KIMIA ANORGANIK II. Drs. Nofrizal, Jhon, M.Si. SENYAWA KOMPLEKS DAN HIBRIDISASI UNSUR TRANSISI (V dan Cr) Di susun oleh : Dosen pengampu :
|
|
|
- Herman Kusnadi
- 6 tahun lalu
- Tontonan:
Transkripsi
1 KIMIA ANORGANIK II SENYAWA KOMPLEKS DAN HIBRIDISASI UNSUR TRANSISI (V dan Cr) Dosen pengampu : Drs. Nofrizal, Jhon, M.Si Di susun oleh : ARDIAN FAZRI DEBBY MUTIARA ANANDA APRIADI WIDYA SULASTRI ZIERNA YESSI LEGENDA OCTA FEBRINA (F1C111005) (F1C111006) (F1C111007) (F1C111008) (F1C111054) (F1C111056) PROGRAM STUDI KIMIA FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS JAMBI 2013/2014
2 BAB I PENDAHULUAN 1.1 LATAR BELAKANG Vanadium pertama kali ditemukan oleh Andres Manuel Del Rio, orang Spanyol yang menjadi ahli pertambangan di Meksiko, pada tahun Del Rio mengesktrak logam tersebut dari sampel bijih timbale berwarna coklat, yang kemudian dinamakan Vanadinite. Dia menemukan bahwa garam tersebut memperlihatkan bermacam-macam warna, dan karena itu dia menamakan unsure tersebut panchromium (Greek: all colors). Del Rio mengganti nama unsure tersebut menjadi erythonium karena garam berwarna merah saat dipanaskan. Pada tahun 1781 Shceele dan juga T.Bergmann mengisolasi oksida baru yang lain dari mineral yang kemudian disebut skelit, CaWO 4. Hasilnya disebut tungsten yang artinya batu berat. Dua tahun kemudian dua bersaudara, J.J. dan F.d Elhuyar dari Spanyol menunjukkan bahwa oksida yang sama merupakan konstituen dari mineral wolframit, dan pemanasan dengan batubara berhasil mereduksi oksida ini menjadi logam yang kemudian diberi nama wolfram dengan symbol W yang direkomendasikan oleh IUPAC, namun komunikasi bahasa Inggris memilih memakai nama tungsten. Akhirnya pada tahun 1797, L.N.Vauquelin dari Perancis menemukan oksida unsure baru dalam suatu mineral dari Siberia yaitu krokoit (crocoite) yang kemudian dikenal sebagai PbCrO 4. Satu tahun kemudian unsur logam baru ini dapat diisolasi melalui reduksi dengan batubara atau charcoal, dan diberi nama dengan bahasa Yunani kroma (chroma) yang artinya warna, karena banyaknya macam warna dalam senyawaannya.
3 BAB II PEMBAHASAN 2.1 SENYAWA KOORDINASI ( SENYAWA KOMPLEKS ) Salah satu keistimewaan logam transisi adalah dapat membentuk senyawa klompeks, yaitu senyawa yang paling sedikit terdiri dari satu ion kompleks (terdiri dari kation logam utama atau logam transisi sebagai atom pusat yang berikatan dengan molekul dan (anion yang disebut sebagai ligan) yang berikatan dengan ion lainnya yang disebut ion counter. Keterangan gambar : bagian dari senyawa koordinasi; model (atas), gambar perspektif (tengah), rumus kimia (bawah). senyawa kompleks mempunyai atom pusat yang dikelilingi oleh ligan. Ketika [Co(NH 3 ) 6 ]CI 3(s) larut dalam air ion kompleks dan ion conter akan terpisah, sedangkan ligan tetap terikat dengan atom pusat. Pada gambar sebelah kiri 6 ligan pada atom pusat ion [Co(NH 3 ) 6 ] 3+ memberikan bentuk oktahedral, sedangkan pada gambar sebelah kanan 4 ligan pada ion [Pt(NH 3 ) 4 ] 2+ memberikan bentuk persegi planar. 2.2 ION KOMPLEKS; BILANGAN KOORDINASI, GEOMETRI DAN LIGAN-LIGAN Ion kompleks terdiri dari atom logam yang merupakan atom pusat yang berikatan dengan ligan-ligan yang berupa ion netral maupun ion yang bermuatan.
4 Bilangan koordinasi : jumlah ligan yang terikat secara langsung pada atom pusat, contohnya pada ion [Co(NH 3 ) 6 ] 3+ bilangan koordinasinya adalah 6. Geometri; bentuk geometri ion kompleks tergantung pada bilangan koordinasinya dan sifat dari ion logam pada ion kompleks itu sendiri. Donor atom per ligan; ligan suatu ion kompleks adalah molekul atau anion yang menyumbangkan satu atau lebih pasangan elektron bebas kepada ion logam yang membentuk ikatan kovalen. Ligan diklasifikasikan berdasarkan jumlah pasanga elektron bebas yang didonorkannya, yaitu monodentat yang mendonorkan satu pasang elektron, bidentat yang mendonorkan dua pasang elektron dan polidentat yang mendonorkan lebih dari dua pasaang elektron.
5 2.3 RUMUS DAN PENAMAAN SENYAWA KOORDINASI Untuk penulisan rumus senyawa koordinasi disusun dengan aturan sebagai berikut: Nama kation ditulis terlebih dahulu sebelum anion. 1. Nama kation ditulis terlebih dahulu sebelum anion. Contoh: K 2 [Co(NH 3 ) 2 CI 4 ] terdiri dari kation K + dan [Co(NH 3 ) 2 CI 4 ] 2- sehingga K + ditulis terlebih dahulu. 2. Muatan kation sama dengan muatan anion. Contoh: pada senyawa K 2 [Co(NH 3 ) 2 CI 4 ], NH 3 merupakan molekul netral Cl - memberi muatan dengan jumlah 4- maka Co harus bermuatan 2+ sehingga mbentuk ion [Co(NH 3 ) 2 CI 4 ] 2- yang berikatan dengan K Dalam ion kompleks, ligan netral ditulis terlebih dahulu baru kemudian ligan anion, dan rumus untuk seluruh ion ditempatkan dalam tanda kurung. Contoh: pada senyawa K 2 [Co(NH 3 ) 2 CI 4 ], NH 3 merupakan molekul netral sehingga ditulis terlebih dahulu baru kemudian Cl - yang bermuatan negatif (anion). Sedangkan aturan untuk penamaan senyawa kompleks adalah: 1. Nama kation ditulis terlebih dahulu, 2. Nama ligan ditulis berdasarkan urutan abjad dan ditulis sebelum nama ion logam, 3. Untuk ligan netral ditulis dengan namanya sendiri kecuali beberapa molekul seperti air yang menjadi aqua, sedangkan untuk anion akhiran ida diganti menjadi o seperti klorida menjadi kloro. 4. Jumlah ligan ditulis sebelum nama ligan tersebut dengan penomoran yunani. 5. Bilangan oksidasi atom pusat ditulis dengan angka romawi di dalam kurung. 6. Jika ion kompleks merupakan anion, maka nama ion logam diakhiri dengan at. Contoh : K 2 [Co(NH 3 ) 2 CI 4 ] = kalium diamina tetra kloro kobaltat (II) [Co(NH 3 ) 6 ]CI 3 = heksaamina kobalt (III) klorida
6 2.4 SEBUAH SEJARAH PERSPEKTIF : ALFRED WERNER DAN TEORI KOORDINASI Senyawa koordinasi telah diketahui sejak 200 tahun yang lalu, pertama kali ditemukan oleh seorang kimiawan muda asal Swiss Alfred Werner. Dia mengusulkan dua macam valensi, yaitu : " valensi primer adalah muatan positif pada ion logam yang harus disetarakan oleh ion negatif sehingga menemukan bilangan koordinasi dari susunan jumlah ligan dan valensi sekunder yang disebut bilangan koordinasi yang menunjukkan jumlah ligan terikat pada atom pusat. " Isomer Dalam Senyawa Kompleks ISOMER rumus kimia sama tetapi sifatnya berbeda Isomer Koordinasi Isomer Stereo Isomer KoordinasiTerjadi ketika adanya pertukaran sebagian atau seluruh ligan. Contoh : [Pt(NH 3 ) 4 Cl 2 ](NO 2 ) 2 dan [Pt(NH 3 ) 4 (NO 2 ) 2 ]Cl Isomer linkage Terbentuk ketika komposisi senyawa kompleks tetap tetapi keterkaitan donor ligan berubah. isomer geometri perbedaan letak atom atau gugus atom dalam ruang. isomer optis perbedaan arah pemutaran bidang polarisasi cahaya 2 ISOMER GEOMETRIK ISOMER OPTIK
7 2.5 DASAR TEORI IKATAN KOMPLEKS a. Dasar Teori Ikatan dan Sifat Kompleks Ligan pada ion kompleks menyumbangkan sepasang elektron untuk membentuk suatu ikatan kovalen dengan atom pusat. Jika suatu atom menyumbangkan sepasang elektron untuk digunakan bersama disebut sebagai ikatan kovalen koordinasi. Jenis dan jumlah orbital hibridisasi ion logam bergantung pada pasangan elektron bebas yang menentukan bentuk geometri ion kompleks. Beberapa contoh bentuk geometri dan hibridisasinya: 1. Oktahedral; biasanya ion kompleks yang memiliki hibridisasi d2sp3 mempunyai bentuk geometri oktahedral. Gamabr hibridisasi dan bentuk geometri [Cr(NH 3 ) 6 ] Segiempat planar; ion kompleks dengan hibridisasi dsp2 akan memiliki bentuk geometri ini.
8 Gambar hibridisasi dan bentuk geometri [Ni (CN) 4 ] 2-3. Tetrahedral; hibridisasi sp3 dari ion kompleks akan memberikan bentuk geometri seperti ini. Gambar hibridisasi dan bentuk geometri [Zn(OH) 4 ] 2- b. Teori Bidang Kristal Teori bidang kristal menyempurnakan teori VB yang menjelaskan tentang bentuk dan ikatan dalam suatu senyawa tetapi tidak dapat memprediksikan warna koordinasi dan juga terkadang saja dapat dipakai untuk memprediksi tentang sifat kemagnetan senyawa, sedangkan teori bidang kristal hanya memberikan sedikit gambaran mengenai ikatan logamligan tetapi mampu menjelaskan tentang warna dan sifat kemagnetan dengan jelas. Warna; cahaya diserap dalam berbagai macam panjang gelombang yang akan menghasilkan berbagai macam spektrum warna, seperti yang tertera dalam tabel berikut: Penjelasan
9 Penjelasan : tentang warna pada logam transisi; warna senyawa koordinsi sangat beragam, hal ini dipengaruhi oleh perbedaan energi (Δ) orbital set t 2g dan e g dalam ion kompleksnya.
10 Dua hal yang dapat mempengaruhi warna senyawa: 1. Untuk ligan tertentu, warna tergantung pada kondisi oksidasi ion logamnya. 2. Dan untuk beberapa ligan lain, warna bergantung pada ligan itu sendiri. Penjelasan tentang sifat kemagnetan pada logam transisi kompleks; sifat kemgnetan logam transisi deipengaruhi oleh jumlah elektron tidak berpasangan pada orbital d. Penempatan orbital dipengaruhi oleh satu dari dua cara berikut: 1. Ligan medan lemah dan kompleks spin tinggi Ligan medan lemah (seperti H 2 O) menyebabkan pemisahan energi kecil, sehingga hanya memakai energi yang lemah dari orbital d untuk berpindah ke set e g dan kemudian untuk berpasangan pada set t 2g. Dengan jumlah elektron tidak berpasangan maksimum ligan medan lemah membentuk komplek spin tinggi. 2. Ligan medan kuar dan kompleks spin rendah Karena ligan medan kuat (seperti CN - ) memerlukan energi yang lebih besar untuk berpindah ke set e g dan kemudian untuk berpasangan pada set t 2g, serta jumlah elektron tidak berpasangan pada ion kompleks lebih sedikit dibanding pada ion bebas sehingga menimbulkan kompleks spin yang rendah. Senyawa kompleks dengan bentuk geometri tetrahedral adalah contoh dari senyawa yang mempunyai kompleks spin yang tinggi, sedangkan untuk senyawa dengan bentuk geometri segiempat planar adalah contoh senyawa dengan kompleks spin yang rendah.
11 2.6 FAKTOR-FKTOR YANG MEMPENGARUHI KESTABILAN KOMPLEKS Adapaun faktor-faktor yang mempengaruhi kestabilan kompleks. Kestabilan suatu kompleks akan berhubungan dengan : 1. Kemampuan mengkompleks logam-logam. Kemampuan mengkompleks relatif (dari) logam-logam digambarkan denganb baik menurut klarifikasi Schwarzenbach, yang dalam garis besarnya didasarkan atas pembagian logam menjadi asam Lewis (penerima pasangan elektron) kelas A dan kelas B. Logam kelas A dicurikan oleh larutran afinitas (dalam larutan air) terhadap halogen F- >Cl- > Br- > I-, dan membentuk kompleks terstabilnya dengan anggota pertama (dari) grup Tabel Berkala (dari) atom penyumbang (yakni, nitrogen, oksigen dan fluor). Logam kelas B jauh lebih mudah berkoordinasi dengan I- daripada dengan F- dalam larutan air, dan membentuk kompleks terstabilnya dengan atom penyumbang kedua (atau yang lebih berat) dari masing-masing grup itu (yakni P, S, Cl). Klasifikasi Scwarzenbach, mendefinisikan ketiga kategori ion logam penerima (pasanag elektron). a. Kation dengan konfigurasi gas mulia. Logam-logam alkali, alkali tanah, dan alumunium termasuk dalam grup ini, yang memperlihatkan sifat-sifat penerima kelas A. Gaya elektrostatik dominan dalam pembentukan kompleks itu, sehingga interaksi antara ion-ion kecil yang bermuatan tinggi, istimewa kuatnya, dan menimbulkan kompleks-kompleks yang stabil. Kompleks-kompleks fluoro istimewa stabil, air diikat lebih kuat daripada amonia yang mempunyai momen dipol kecil dan ion sianida hanya memiliki kecenderungan kecil untuk membentuk kompleks karena mereka hanya berada dalam larutan basa,dimana mereka tak dapat bersaing denganb ion-ion hidroksil. b. Kation dengan sub-kulit d yang terisi lengkap. Yang khas dari grup ini adalah tembaga(i), perak(i), dan emas(i) yang memperlihatkan sifat-sifat penerima kelas B. Ion-ion ini mempunyai daya polarisasi yang tinggi, dan ikatan-ikatan yang terbentuk dalam komplekskompleks merah memiliki watak kovalen yang cukup berarti. c. Ion-ion logam transisi dengan sub-kulit dyang tak lengkap. Dalam grup ini baik kecenderungan kelas A maupun kelas B dapat dikenali. Unsur dengan cirri-ciri kelas B membentuk suatu kelompok yang kira-kira berbentuk segitiga dalam Tabel Berkala, dengan puncaknya pada tembaga dan alasnya memebentang dari renium sampai bismut. Disebelah
12 kiri kelompok ini, unsure-unsur dalam keadaan oksidasi yang tinggi, cenderung memeprlihatkan sifat-sifat kelas A, sementara di sebelah kanan kelompok ini, keadaan oksidasi yang lebih tinggi (dari) suatu unsure lebih memiliki watak kelas B. 2. Ciri-ciri khas ligan. Di antara cirri-ciri khas ligan yang umum diakui sebagai mempengaruhi kestabilan kompleks dalam mana ligan itu terlibat, adalah : a. kekuatan basa dari ligan itu, b. sifat-sifat penyepitan (jika ada), dan c. efek-efek sterik (ruang). Dari sudut pandangan aplikasi kompleks secara analisis, efek penyepitan mempunyai arti yang teramat penting, maka hendaklah diperhatikan secara khusus. Istilah efek sepit mengacu pada fakta bahwa suatu kompleks bersepit, yaitu kompleks yang dibentuk oleh suatu ligan bedentat atua multidentat, adalah lebiih stabil disbanding kompleks padanannya denga ligan-ligan monodentat: semakin banyak titik lekat ligan itu kepada ion logam,semakin besar kestabilan kompleks. Efek sepit ini sering dapat disebabkan oleh kenaikan entropi yang menyertai penyempitan; dalam hubungan ini, penggantian molekul-molekul air dari ion terhidrasi haruslah diingat-ingat. Efek sterik yang paling umum adalah efek yang menghambat pembentukan kompleks yang disebabkan oleh adanya suatu gugusan besar yang melekat pada atau berada berdekatan dengan atom penyumbang. Suatu faktor lanjut yang juga harus dipertimbngkan dari sudut pandangan aplikasi secara analitis dari kompleks-kompleks dan reaksi-reaksi pembentukkan kompleks adalah laju reaksi: agar berguna secara analitis, biasanya reaksi diperlukan cepat. Keinertan atau kelabilan kinetik dipengaruhi oleh banyak faktor, tetapi pengamatan umum berikut ini merupakan pedoman yang baik akan perilaku kompleks-kompleks dari berbagai unsur. a. Unsur grup utama, biasanya membentuk kompleks-kompleks labil.
13 b. Dengan kekecualian Cr(III) dan Co(III), kebanyakan unsur transisi baris-pertama, membentuk kompleks-kompleks labil. c. Unsur transisi baris kedua dan baris ketiga, cenderung membentuk kompleks-kompleks inert. 2.7 KESTABILAN SENYAWA KOMPLEKS Dikenal 2 macam kestabilan senyawa kompleks, yaitu kestabilan termodinamika dan kestabilan kinetika. Kestabilan termodinamika menunjuk pada perubahan energi bebas Gibs ( G) yang terjadi dalam perubahan dari reaktan menjadi produk, sedang kestabilan kinetika menunjuk pada enetgi aktivasi ( G # ) pada substitusi reaksi pertukaran ligan. 1. Kestabilan Termodinamika Kestabilan termodinamika senyawa kompleks lebih sering dinyatakan dengan konstanta kesetimbangan (ingat G = -RT ln K) dalam reaksi ion logam terhidrasi dengan ligan yang sesuai selain air. Harga K memberikan gambaran tentang konsentrasi relatif masing-masing spesies dalam kesetimbangan. Jika harga K besar berarti konsentrasi kompleks jauh lebih besar dibanding konsentrasi komponen-komponen pembentuknya. Suatu kompleks stabil bilamana harga K dalam reaksi pembentukan kompleks tersebut besar. Kompleks logam terbentuk dalam larutan melalui tahap-tahap reaksi, dan konstanta kesetimbangan dapat ditulis untuk masing-masing tahap. Misalnya untuk reaksi pembentukan Cu(NH 3 ) 4 2+ : [Cu(H 2 O) 4 ] 2+ + NH 3 [Cu(H 2 O) 3 (NH 3 )] 2+ K 1 = ( [Cu(H 2 O) 3 (NH 3 )] 2+ )/([Cu(H 2 O) 4 ] 2+ ) ( NH 3 ) [Cu(H 2 O) 3 (NH 3 )] 2+ + NH 3 [Cu(H 2 O) 2 (NH 3 ) 2 ] 2+ K 2 = ( [Cu(H 2 O) 2 (NH 3 ) 2 ] 2+ ) / [Cu(H 2 O) 3 (NH 3 )] 2+ (NH 3 ) [Cu(H 2 O) 2 (NH 3 ) 2 ] 2+ + NH 3 [Cu(H 2 O)(NH 3 ) 3 ] 2+ K 3 = ( [Cu(H 2 O)(NH 3 ) 3 ] 2+ ) / [Cu(H 2 O) 2 (NH 3 ) 2 ] 2+ ( NH 3 ) [Cu(H 2 O)(NH 3 ) 3 ] 2+ + NH 3 [Cu(NH 3 ) 4 ] 2+ K 4 = ([Cu(NH 3 ) 4 ] 2+ )/[Cu(H 2 O)(NH 3 ) 3 ] 2+ ( NH 3 )
14 Konstanta kesetimbangan juga dapat ditulis secara keseluruhan (over-all stability consant) denga notasi β. Untuk reaksi tersebut di atas : [Cu(H 2 O) 4 ] 2+ + NH 3 [Cu(H 2 O) 3 (NH 3 )] 2+ β 1 = ( [Cu(H 2 O) 3 (NH 3 )] 2+ ) / ([Cu(H 2 O) 4 ] 2+ ) ( NH 3 ). [Cu(H 2 O) 4 ] NH 3 [Cu(H 2 O) 2 (NH 3 ) 2 ] 2+ β 2 = ([Cu(H 2 O) 2 (NH 3 ) 2 ] 2+ )/([Cu(H 2 O) 4 ] 2+ ) ( NH 3 ) 2 [Cu(H 2 O) 4 ] NH 3 [Cu(H 2 O)(NH 3 ) 3 ] 2+ β 3 = ([Cu(H 2 O)(NH 3 ) 3 ] 2+ )/([Cu(H 2 O) 4 ] 2+ ) ( NH 3 ) 3 [Cu(H 2 O) 4 ] NH 3 [Cu(NH 3 ) 4 ] 2+ β 4 = ([Cu(NH 3 ) 4 ] 2+ )/([Cu(H 2 O) 4 ] 2+ ) ( NH 3 ) 4 Dengan sedikit penjabaran matematis akan diperoleh hubungan : β 1 = K 1 β 2 = K 1. K 2 β 3 = K 1. K 2.K 3 β 4 = K 1. K 2.K 3.K 4 Dalam reaksi pembentukan kompleks tersebut seringkali ligan H 2 O tidak ditulis karena jumlah molekul H 2 O yang menghidrasi masing-masing ion pada umumnya belum diketahui secara pasti, molekul-molekul air tidak mempengaruhi konstanta kesetimbangan (walaupun terlibat dalam reaksi), dan dalam larutan encer aktivitas air dapat dianggap Faktor-faktor yang Mempengaruhi Stabilitas Ion Kompleks 1. Aspek ion pusat a. Rapat muatan (perbandingan muatan dengan jari-jari atom) Stabilitas ion kompleks bertambah jika rapat muatan ion pusat bertambah b. CFSE (energi psntabilan medan ligan) Stabilitas ion kompleks bertambah dengan adanya CFSE, karena CFSE pada dasarnya merupakan energi penstabilan tambahan yang diakibatkan oleh terjadinya splitting orbital d. Pengaruh CFSE terhadap K dapat dilihat pada diagram berikut. Bulatan-bulatan pada gambar tersebut adalah harga log K relatif masing-masing logam bedasarkan eksperimen, sedang garis putus-putus merupakan kecenderungan harga log K secara teoritis dengan tanpa memperhitungkan CFSE.
15 c. Polarisabilitas Ion-ion logam klas a (asam keras) yaitu yang memiliki muatan tinggi dan ukuran kecil akan membentuk kompleks ysng stabil jika ligannya berasal dari basa keras, yaitu yang elektronegatifitasya besar dan berukuran kecil 2. Aspek ligan a. Efek khelat Kompleks khelat lebih stabil dibanding kompleks nonkhelat analog (yang atom donornya sama). [Ni(en) 3 ] 3+ dengan β 3 sebesar adalah lebih stabil dibanding [Ni(NH 3 ) 6 ] 3+ β 6 sebesar 10 8 b. Ukuran cincin Jika ligan tidak memiliki ikatan angkap, ikatan cincin 5 adalah yang paling stabil, tetapi jka ligan memiliki ikatan rangkap, maka yang paling stabil adalah ikatan cincin 6. c. Hambatan ruang (steric effect) Ligan-ligan bercabang pada umumnya kurang stabi dibanding ligan-ligan tak yang analog. bercabang d. Polarisabilitas Ion-ion logam klas a (asam keras) yaitu yang memiliki muatan tinggi dan ukuran kecil akan membentuk kompleks ysng stabil jika ligannya berasal dari basa keras, yaitu yang elektronegatifitasya besar dan berukuran kecil. 3. Kestabilan Kinetika. Kestabilan kinetika menunjuk pada enetgi aktivasi ( G # ) pada substitusi reaksi pertukaran ligan. Kestabilan kinetika bertambah jika G # semakin besar. Kompleks yang ligannya dapat digantikan oleh ligan lain dengan cepat (kurang dari 1 menit pada suhu 25 o C dan konsentrasi larutan 0,1 M) disebut kompleks labil, sebaliknya jika reaksi pertukarannya berlangsung lambat disebut kompleks inert (lembam). Seringkali kompleks stabil bersifat inert dan kompleks tidak stabil bersifat labil, namun hal itu tidak berhubungan. Bisa saja suatu kompleks stabil namun labil. Sebagai contoh, CN - membentuk kompleks yang sangat stabil dengan Ni 2+, hal ini tercermin dari harga K yang besar untuk reaksi berikut :
16 [Ni(H 2 O) 6 ] CN - [Ni(CN - ) 4 ] H 2 O Namun jika ke dalam larutan ditambahkan ion berlabel 13 CN -, ternyata terjadi reaksi pertukaran ligan yang sangat cepat antara CN - dengan 13 CN - seperti ditunjukkan pada persamaan reaksi berikut : [Ni(CN - ) 4 ] CN - [Ni( 13 CN - ) 4 ] CN - Kasus sebaliknya, kompoleks [Co(NH 3 ) 6 ] 3+ tidak stabil dalam larutan asam, sehingga reaksi berikut hampir sempurna berjalan ke kanan. 4[Co(NH 3 ) 6 ] H H 2 O 4[Co(H 2 O) 6 ] NH 4 + O 2 Akan tetapi [Co(NH 3 ) 6 ] 3+ dapat tinggal dalam larutan asam pada suhu kamar selama beberapa hari dengan tanpa terjadi perubahan. Ini berarti bahwa kestabilan suatu kompleks tidak menjamin keinertannya, sebaliknya kompleks yang tidak stabil dapat saja inert.. Kestabilan kinetika kompleks oktahedral dapat diprediksi berdasarkan Aturan Taube, yaitu : Kompleks oktahedral labil bilamana pada atom pusatnya - mengandung elektron pada orbital e g atau - mengandung elektron pada orbital d kurang dari 3. Kompleks oktahedral inert bilamana pada atom pusatnya - tidak mengandung elektron pada orbital e g dan - mengandung elektron pada orbital d minimal 3. Aturan Taube tersebut logis dan dapat dinalar. Kompleks yang mengandung elektron pada orbital e g labil, karena elektron tersebut posisinya dekat (behadapan langsung) dengan ligan sehingga memberikan tolakan yang signifikan terhadap ligan dan dengan demikian ligan tersebut relatif mudah lepas dan digantikan oleh ligan lain. Kompleks yang mengandung elektron pada orbital d kurang dari 3 labil, karena pada kompleks tersebut masih terdapat minimal 1 orbital t 2g yang kosong dimana ligan pengganti dapat mendekati ion pusat dengan tolakan yang relatif kecil.
17 2.8 UNSUR-UNSUR TRANSISI (V DAN Cr) Unsur-unsur transisi adalah : a. Terletak antara unsur golongan alkali tanah dan golongan boron. b. Merupakan unsur logam c. Merupakan unsur-unsur blok d dalam sistem periodik Sifat-sifat yang khas dari unsur transisi : a. Mempunyai berbagai bilangan oksidasi b. Kebanyakan senyawaannya bersifat paramagnetik c. Kebanyakan senyawaannya berwarna d. Unsur transisi dapat membentuk senyawa kompleks Dalam bentuk logamnya umumnya bersifat : a. Keras, tahan panas b. Penghantar panas dan listrik yang baik c. Bersifat inert Beberapa kekecualian : a. Tembaga (Cu) bersifat lunak dan mudah ditarik b. Mangan (Mn) dan besi (Fe) : bersifat sangat reaktip, terutama dengan oksigen, halogen, sulfur, dan non logam lain (seperti dengan karbon dan boron).
18 2.8.1 VANADIUM SEJARAH VANADIUM Vanadium berasal dari kata vanadis,yaitu nama dewi kecantikan di Skandinavia, pada mulanya ditemukan oleh N. G. Selfstrom di Swedia pada tahun 1830, bersama sama dalam bijih besi. Disebut demikian karena senyawaannya kaya akan warna. Sesungguhnya, unsure ini telah dikenali oleh A.M.del Rio pada tahun 1801 yang ditemukan dalam bijih timbel yang disebut eritronium. Namun sayangnya beliau sendiri yang membatalkan penemuan ini.logam ini tampak bersinar cemerlang, cukup lunak sehingga mudah dibentuk seperti pembuluh, mempunyai titik leleh C titik didih C, serta tahan terhadap korosi. Vanadium adalah unsur kimia dengan lambang V dan nomor atom 23. Ini adalah lembut, abu-abu keperakan, ulet logam transisi. Pembentukan sebuah menstabilkan lapisan oksida logam terhadap oksidasi. Andrés Manuel del Río vanadium menemukannya pada tahun 1801 dengan menganalisis mineral vanadinite, dan menamainya erythronium. Empat tahun kemudian, ia diyakinkan oleh Nils Gabriel Sefström pada tahun Pada 1831, ahli kimia Swedia, Nils Gabriel Sefström, menemukan kembali unsur oksida yang baru ditemukan saat ia bekerja dengan bijih besi. Kemudian pada tahun yang sama, Friedrich Wöhler dikonfirmasi sebelumnya del Río bekerja. Sefström memilih nama yang diawali dengan V, yang tidak ditugaskan untuk setiap elemen. Dia memanggil unsur vanadium setelah Vanadis (nama lain untuk Freya, yang Norse dewi keindahan dan kesuburan), karena banyaknya berwarna indah senyawa kimia yang dihasilkan. Pada 1831, para ahli geologi George William Featherstonhaugh menyarankan agar vanadium harus diganti "rionium" setelah del Río, namunsaraninitidakdiikuti. Isolasi logam vanadium ternyata sulit. Pada 1831,
19 Berzelius melaporkan produksi logam, tapi Henry Enfield Roscoe Berzelius telah menunjukkan bahwa sebenarnya menghasilkan nitrida, vanadium nitrida (VN). Roscoe akhirnya menghasilkan logam pada tahun 1867 oleh pengurangan vanadium (III) klorida, VCL 3, dengan hidrogen. Pada tahun 1927, vanadium murni diproduksi dengan mengurangi vanadium pentoxide dengan kalsium. Yang pertama industri skala besar penggunaan vanadium dalam baja ditemukan di chassis dari Ford Model T, terinspirasi oleh mobil balap Perancis. Baja diperbolehkanuntuk mengurangi beratbadansekaligusvanadium meningkatkankekuatantarik. ( Vanadium juga merupakan suatu logam lembut dan silver-gray unsur metalik. Nomor-Atom nya adalah 23 dan lambang V. Henry Roscoe mengasingkan vanadium metalik tahun Ia mengambil klorid vanadium (VCL3) dan menguranginya dengan hidrogen untuk membentuk vanadium yang metal dan zatair-khlor (HCL).Vanadium merupakan sumber daya di Amerika Serikat, dimana pada umumnya dengan bijih uranium di (dalam) batu pasir yang cukup besar untuk menyediakan U.S. kebutuhan vanadium. Mengimport produk vanadium dan ferrovanadium itu ternyata lebih murah dan sering dilakukan di Amerika. Ferrovanadium yang diimport dibeli dari Canada, Negeri China, Cekoslovakia Republik, Selatan Afrika, dan negara-negara lain. Mayoritas vanadium pentoxide digunakan di (dalam) pabrikasi gelas diimport dari Selatan Afrika. Ilmuwan sudah menemukan bahwa suatu campuran yang menyangkut galium dan vanadium unsur-unsur adalah bermanfaat di dalam membuat superconductive magnit. ( Vanadium boleh diperolehi secara komersil dan penghasilan sampel di dalam makmal biasanya tidak diperlukan. Dari segi penghasilan komersil pula, kaedah penghasilan logam vanadium sebagai hasil utama biasanya tidak diperlukan kerana jumlah yang mencukupi boleh didapati dalam bentuk hasil sampingan proses-proses lain. Dalam bidang industri, pemanasan bijih vanadium atau baki daripada proses-proses lain bersama garam, NaCl, atau natrium karbonat, Na 2 CO 3, pada kira-kira 850 C memberikan natrium vanadat NaVO 3. Ia dilarutkan dalam air dan diasidkan untuk menghasilkan pepejal merah yang kemudiannya dileburkan menjadi bentuk mentah
20 vanadium pentoksida, "V 2 O 5 ". Penurunan vanadium pentoksida dengan kalsium, Ca, menghasilkan vanadium tulen. Satu cara alternatif sesuai bagi penghasilan skala kecil adalah penurunan vanadium pentaklorida, VCl 5, dengan hidrogen, H 2, atau magnesium, Mg. Terdapat bermacam lagi kaedah yang boleh digunakan. Secara industrinya, kebanyakan vanadium digunakan sebagai penambah untuk memperbaiki ciri keluli. Biasanya tindak balas besi mentah dengan vanadium pentoksida mentah "V 2 O 5 " sudah mencukupi, dan tidak perlu menggunakan logam vanadium tulen. Ini menghasilkan ferovanadium yang sesuai untuk kerja-kerja seterusnya SIFAT KIMIA VANADIUM Sifat-sifat : Dipanaskan dalam H 2 (tanpa gas lain) pada C membentuk vanadium hibrida yang stabil. Logam ini reaktif dalam keadaan dingin, bila dipanaskan terbentukv 2 O (coklat), dipanaskan terus terbentuk V 2 O 3 (hitam), V 2 O 4 (biru), akhirnya V 2 O 5 (orange). Logam ini terbakar dengan nyala terang dengan oksigen. Bila dipanaskan dengan C1 2 kering terbentuk VC1 4. Logam ini tidak bereaksi dengan air brom, HCl / dingin,melepaskan H 2 dengan HF dan membentuk larutan hijau. Vanadium(V)oksida sebagai katalis Proses Contact 2.3. KROMIUM SEJARAH KROMIUM Ditemukan pada tahun 1797 oleh Vauquelin, yang membuat logam khrom pada tahun berikutnya.. Kromium adalah sebuah unsur kimia dalam tabel periodik yang memiliki lambang Cr dan nomor atom 24. Khrom juga berwarna abu-abu, berkilau, keras sehingga memerlukan proses pemolesan yang cukup tinggi. Pada 1781 ia berhasil mengisolasi logam. Vanquelin kemudian memperoleh oksida oleh penguapan dan akhirnya terisolasi kromium oksida dengan memanaskan dalam oven arang. Vanquelin juga mengidentifikasi sejumlah kecil krom di ruby dan batu zamrud. Vauquelin melanjutkan untuk menemukan Berilium pada tahun 1798.
21 Kromium berasal dari kata Yunani 'kroma', yang berarti warna karena membentuk berbagai senyawa berwarna-warni. ( Kromium adalah sebuah unsur kimia dalam tabel periodik yang memiliki lambang Cr dan nomor atom 24. Kromium trivalen (Cr(III), atau Cr 3+ ) diperlukan dalam jumlah kecil dalam metabolismegula pada manusia. Kekurangan kromium trivalen dapat menyebabkan penyakit yang disebut penyakit kekurangan kromium (CHROMIUM DEFICIENCY). Kromium merupakan logam tahan korosi (tahan karat) dan dapat dipoles menjadi mengkilat. Dengan sifat ini, kromium (krom) banyak digunakan sebagai pelapis pada ornamen-ornamen bangunan maupun pada komponen kendaraan seperti knalpot pada sepeda motor. Perpaduan Kromium dengan besi dan nikel menghasilkan baja tahan karat. Logam kromium murni tidak pernah ditemukan di alam, umumnya berada dalam bentuk persenyawaan padat atau mineral dengan unsur lain. Kromium adalah logam yang tahan korosi oleh karena itu banyak digunakan sebagai pelapis elektrolit dan inhibitor korosi dalam campuran baja (ALLOY). Senyawa kromium dalam bentuk kromat dan dikromat sangat banyak digunakan oleh industri tekstil, fotografi, pembuatan tinta dan industri zat warna. Tingkat bilangan oksidasi kromium yang sering dijumpai adalah III dan VI. Cr(III) dalam larutan asam berupa ion Cr(H 2 O) 3+ 6, sedangkan dalam larutan yang basa berupa ion Cr{(OH) 5 (H 2 O)} 2- dan CR(OH) 3-6 Cr(VI) dalam larutan - 2- asam (ph lebih kecil dari 6) berupa ion HCrO 4 dan Cr 2 OH 4 yang berwarna jingga, 2- sedangkan dalam larutan basa berupa ion CrO 4 uang berwarna kuning. Pada ph yang rendah (sangat asam) hanya ion Cr 2 O 2-7 yang ada di dalam larutan. Kromium yang telah ditemukan di alam kemudian masuk ke lingkungan melalui limbah industri dari lumpur elektroplating seperti limbah penyamakan dan pabrik inhibitor korosi. ( KARAKTERISTIK KROMIUM Kromium adalah unsure dengan nomor atom 21 yang paling banyak dalam kerak bumi dengan konsentrasi rata-rata 100 ppm. Senyawa Kromium terdapat di dalam lingkungan, karena erosi dari batuan yang mengandung kromium dan dapat didistribusikan oleh letusan gunung berapi. Rentang konsentrasi dalam tanah adalah antara 1 dan 3000 mg /
22 kg, dalam air laut μg / liter, dan di sungai dan danau 26 μg / liter dengan 5,2 mg / liter. Hubungan antara Cr (III) dan Cr (VI) sangat tergantung pada ph dan oksidatif sifat lokasi, tetapi dalam banyak kasus, Cr (III) adalah spesies dominan, meskipun di beberapa daerah di tanah air dapat mengandung sampai 39 μg dari total kromium dari 30 μg yang hadir sebagai Cr (VI). Kromium merupakan logam perak, berkilau, sangat keras yang dapat mengambil cermin semir tinggi. Hal ini juga tidak berbau, tawar, dan lunak. Logam membentuk lapisan tipis oksida pelindung di udara, dan luka bakar ketika dipanaskan untuk membentuk oksida kromium hijau (Cr 2 O 3). ( ) SIFAT SIFAT KIMIA KROMIUM Nomor Atom 24 Massa Atom 51,9961 g/mol Golongan, periode, blok VI B, 4, d Konfigurasi elektron [Ar] 3d 5 4s 1 Jumlah elektron tiap kulit 2, 8,13, 1 Afinitas electron 64,3 kj / mol -1 Ikatan energi dalam gas 142,9 ± 5,4 kj / mol -1. Panjang Ikatan Cr-Cr 249 pm Senyawa beracun dan mudah terbakar
23 TUGAS LOGAM TRANSISI VANADIUM DAN KROMIUM DENGAN LIGANNYA (V DAN CR) UNSUR TRANSISI PEMBENTUK IKATAN VALENSI SENYAWA KOMPLEKS Menurut teori asam basa lewis, ion logam transisi menyediakan orbital d yang kosong sehingga berperan sebagai asam lewis (akseptor pasangan elektron bebas) dan ion atau molekul netral yang memiliki pasangan elektron bebas untuk didonorkan berperan sebagai basa lewis. Senyawa kompleks dengan atom pusat vanadium (V) dan kromium (Cr) 1. VANADIUM Vanadium berasal dari kata vanadis,yaitu nama dewi kecantikan di Skandinavia, pada mulanya ditemukan oleh N. G. Selfstrom di Swedia pada tahun 1830, bersama sama dalam bijih besi. Disebut demikian karena senyawaannya kaya akan warna. Sesungguhnya, unsure ini telah dikenali oleh A.M.del Rio pada tahun 1801 yang ditemukan dalam bijih timbel yang disebut eritronium. Namun sayangnya beliau sendiri yang membatalkan penemuan ini.logam ini tampak bersinar cemerlang, cukup lunak sehingga mudah dibentuk seperti pembuluh, mempunyai titik leleh C titik didih C, serta tahan terhadap korosi. DENGAN ATOM PUSAT V DAN LIGAN KUAT [V(CN) 6 ] : Atom V dengan konfigurasi ektron [Ar] 3d 3 4s 2 Oleh karena itu atom V dapat mengikat enam molekul CN - Atau Atom V harus menyediakan enam buah orbital kosong. Proses hibridisasinya adalah sebagai berikut :
24 23V = 1s 2 2s 2 2p 6 3s 2 3p 6 3d 3 4s 2 23V= [Ar] 3d 3 4s 2 3s 4s [V(CN) 6 ] Hibridisasi ion 23 V dengan ligan kuat (CN - ) membentuk senyawa kompleks 23V= [Ar] 4s 0 3d 5 3d 4s 23V tereksitasi= 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 0 4p 0 23V dalam [V(CN) 6 ] = CN CN CN CN CN CN 3d 2 4s 4p Hibridisasi d 2 sp 3 (kompleks oktahedral) atau ion kompleks spin rendah / inner orbital komplex karena orbital d yang dipakai dalam hibridisasi energinya lebih rendah dari orbital s dan p Karena orbital d yang digunakan dalam hibridisasi ini berasal dari orbital d yang berada disebelah dalam orbital s dan p, maka kompleks dengan orbital hibrida semacam ini disebut sebagai kompleks orbital dalam (inner orbital complex) DENGAN ATOM PUSAT V DAN LIGAN LEMAH [V(H 2 O) 6 ] 2+ : Atom V bermuatan 2+ dengan konfigurasi ektron [Ar] 3d 3 4s 2 Oleh karena itu atom V dapat mengikat enam molekul H 2 O Atau Atom V harus menyediakan enam buah orbital kosong. Proses hibridisasinya adalah sebagai berikut : 23V = 1s 2 2s 2 2p 6 3s 2 3p 6 3d 3 4s 2
25 23V= [Ar] 3d 3 4s 2 3s 4s [V(H 2 O) 6 ] 2+ Hibridisasi ion 23 V +2 dengan ligan kuat (H 2 O) membentuk senyawa kompleks 23V +2 = [Ar] 4s 0 3d 3 3d 4s 23V +2 tereksitasi= 1s 2 2s 2 2p 6 3s 2 3p 6 3d 3 4s 0 4p 0 23V +2 dalam [V(H 2 O) 6 ] 2+ = H 2 O H 2 O H 2 O H 2 O H 2 O H 2 O 3d 2 4s 4p Hibridisasi d 2 sp 3 (kompleks oktahedral) atau ion kompleks spin rendah / inner orbital komplex karena orbital d yang dipakai dalam hibridisasi energinya lebih rendah dari orbital s dan p Karena orbital d yang digunakan dalam hibridisasi ini berasal dari orbital d yang berada disebelah dalam orbital s dan p, maka kompleks dengan orbital hibrida semacam ini disebut sebagai kompleks orbital dalam (inner orbital complex) 2. KROMIUM Kromium adalah sebuah unsur kimia dalam tabel periodik yang memiliki lambang Cr dan nomor atom 24. Kromium trivalen (Cr(III), atau Cr 3+ ) diperlukan dalam jumlah kecil dalam metabolismegula pada manusia. Kekurangan kromium trivalen dapat menyebabkan penyakit yang disebut penyakit kekurangan kromium (CHROMIUM DEFICIENCY). Kromium merupakan logam tahan korosi (tahan karat) dan dapat dipoles menjadi mengkilat.
26 DENGAN ATOM PUSAT Cr DAN LIGAN KUAT 1. ([Cr(NH3) 6 ] + ) Atom Cr dengan konfigurasi ektron [Ar] 3d 4 4s 2 Oleh karena itu atom Cr dapat mengikat enam molekul en Atau Atom Cr harus menyediakan enam buah orbital kosong. Proses hibridisasinya adalah sebagai berikut : 24Cr = 1s 2 2s 2 2p 6 3s 2 3p 6 3d 4 4s 2 24Cr = [Ar] 3d 4 4s 2 3s 4s Hibridisasi ion 24 Cr + dengan ligan kuat (NH 3 ) membentuk senyawa kompleks ([Cr(NH3) 6 ] + ) 24Cr +1 = [Ar] 4s 0 3d 5 3d 4s 24Cr +1 tereksitasi= 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 0 4p 0 24Cr +1 dalam ([Cr(NH3) 6 ] + ) = NH 3 NH 3 NH 3 NH 3 NH 3 NH 3 3d 5 4s 4p Hibridisasi d 2 sp 3 (kompleks oktahedral) atau ion kompleks spin rendah / inner orbital komplex karena orbital d yang dipakai dalam hibridisasi energinya lebih rendah dari orbital s dan p
27 DENGAN ATOM PUSAT Cr DAN LIGAN LEMAH 1. ([Cr(H 2 O) 6 ] 3+) Atom Cr dengan konfigurasi ektron [Ar] 3d 4 4s 2 Oleh karena itu atom Cr dapat mengikat enam molekul en Atau Atom Cr harus menyediakan tiga buah orbital kosong. Proses hibridisasinya adalah sebagai berikut : 24Cr = 1s 2 2s 2 2p 6 3s 2 3p 6 3d 4 4s 2 24Cr = [Ar] 3d 4 4s 2 3s 4s Hibridisasi ion 24Cr 3+ dengan ligan kuat (H 2 O) membentuk senyawa kompleks ([Cr(H 2 O) 6 ] 3+) 24Cr +3 = [Ar] 4s 0 3d 3 3d 4s 24Cr +3 tereksitasi= 1s 2 2s 2 2p 6 3s 2 3p 6 3d 3 4s 0 4p 0 24Cr +3 dalam ([Cr(H 2 O) 6 ] 3+ ) = H 2 O H 2 O H 2 O H 2 O H 2 O H 2 O 3d 2 4s 4p 3 Hibridisasi d 2 sp 3 (kompleks oktahedral) atau ion kompleks spin rendah / inner orbital komplex karena orbital d yang dipakai dalam hibridisasi energinya lebih rendah dari orbital s dan p
28 BAB III PENUTUP 3.1 Kesimpulan a. Senyawa koordinasi adalah senyawa yang mengandung satu atau lebih ion kompleks dengan sejumlah kecil molekul atau ion di seputar atom atau ion logam pusat, biasanya dari logam golongna transisi. b. Vanadium adalah logam berwarna putih kelabu yang lembut dan mulur. Ia mempunyai daya tahan kakisan yang baik terhadap al-kali, asid sulfurik dan asid hiroklorik. Ia bersedia untuk teroksida pada kira-kira 933 K. vanadium mempunyai kekuatan struktur yang baik dan keratin rentas belahan neutron yang rendah, menyebabkannya berguna dalam aplikasi nuclear. Walupun ia sejenis logam, vanadium bersama dengan kromium dan mangan mempunyai cirri-ciri oksida valensi yang bersifat asid. c. Kromium logam masif, berwarna putih perak, dan jika murni dengan titik leleh kirakira 1900 o C dan titik didih kira-kira 2690 o C. Logam ini sangat tahan terhadap korosi, karena reaksi dengan udara menghasilkan lapisan Cr 2 O 3 yang bersifat nonpori sehingga mampu melindungi logam yang terlapisi dari reaksi lebih lanjut. Dengan sifat logam yang tahan korosi, manfaat utama kromium yaitu sebagai pelapis logam atau baja.
29 DAFTAR PUSTAKA kompleks/ Maulana Irfan Pembentukan Senyawa Kompleks dari Logam Gadolinium Dengan Ligan Asam Dietilenrriaminpentaasetat (DTPA). Jurnal Universitas Padjajaran, Bandung. Mudasir Memahami Interaksi Senyawa Kompleks Dengan DNA: Langkah maju Mencari Senyawa Kandidat Antikanker. Jurnal Universitas Gajah Mada, Yogyakarta.
Senyawa Koordinasi (senyawa kompleks)
 Senyawa Koordinasi (senyawa kompleks) Salah satu keistimewaan logam transisi adalah dapat membentuk senyawa klompeks, yaitu senyawa yang paling sedikit terdiri dari satu ion kompleks (terdiri dari kation
Senyawa Koordinasi (senyawa kompleks) Salah satu keistimewaan logam transisi adalah dapat membentuk senyawa klompeks, yaitu senyawa yang paling sedikit terdiri dari satu ion kompleks (terdiri dari kation
1.1 Senyawa Koordinasi (Coordination Coumpond)
 1.1 Senyawa Koordinasi (Coordination Coumpond) Sifat yang paling khas pada logam transisi adalah tentang persenyawaan dan ikatannya. Yang biasa disebut dengan ion kompleks. Ion kompleks sendiri terdiri
1.1 Senyawa Koordinasi (Coordination Coumpond) Sifat yang paling khas pada logam transisi adalah tentang persenyawaan dan ikatannya. Yang biasa disebut dengan ion kompleks. Ion kompleks sendiri terdiri
KIMIA. Sesi KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA. a. Sifat Umum
 KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 12 Sesi NGAN KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA Keteraturan sifat keperiodikan unsur dalam satu periode dapat diamati pada unsur-unsur periode
KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 12 Sesi NGAN KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA Keteraturan sifat keperiodikan unsur dalam satu periode dapat diamati pada unsur-unsur periode
Senyawa Koordinasi. Ion kompleks memiliki ciri khas yaitu bilangan koordinasi, geometri, dan donor atom:
 Senyawa Koordinasi Terdiri dari atom pusat (kation logam transisi), ligan(molekul yang terikat pada ion kompleks) dan di netralkan dengan bilangan koordinasi. Dari gambar [Co(NH 3 )6]CI 3, 6 molekul NH3
Senyawa Koordinasi Terdiri dari atom pusat (kation logam transisi), ligan(molekul yang terikat pada ion kompleks) dan di netralkan dengan bilangan koordinasi. Dari gambar [Co(NH 3 )6]CI 3, 6 molekul NH3
Senyawa Koordinasi. Kompleks ion dengan pusat d B memiliki empat ligan dengan dengan bentuk persegi planar (B)
 Senyawa Koordinasi Aspek umum dari logam transisi adalah pembentukan dari senyawa koordinasi (kompleks). Senyawa koordinasi ini setidaknya memiliki satu ion kompleks yang terdiri dari logam kation yang
Senyawa Koordinasi Aspek umum dari logam transisi adalah pembentukan dari senyawa koordinasi (kompleks). Senyawa koordinasi ini setidaknya memiliki satu ion kompleks yang terdiri dari logam kation yang
KIMIA DASAR TEKNIK INDUSTRI UPNVYK C H R I S N A O C V A T I K A ( ) R I N I T H E R E S I A ( )
 KIMIA DASAR TEKNIK INDUSTRI UPNVYK C H R I S N A O C V A T I K A ( 1 2 2 1 5 0 1 1 3 ) R I N I T H E R E S I A ( 1 2 2 1 5 0 1 1 2 ) Menetukan Sistem Periodik Sifat-Sifat Periodik Unsur Sifat periodik
KIMIA DASAR TEKNIK INDUSTRI UPNVYK C H R I S N A O C V A T I K A ( 1 2 2 1 5 0 1 1 3 ) R I N I T H E R E S I A ( 1 2 2 1 5 0 1 1 2 ) Menetukan Sistem Periodik Sifat-Sifat Periodik Unsur Sifat periodik
KIMIA. Sesi POLIMER. A. LOGAM ALKALI a. Keberadaan dan Kelimpahan Logam Alkali. b. Sifat-Sifat Umum Logam Alkali. c. Sifat Keperiodikan Logam Alkali
 KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 11 Sesi NGAN POLIMER A. LOGAM ALKALI a. Keberadaan dan Kelimpahan Logam Alkali Logam alkali adalah kelompok unsur yang sangat reaktif dengan bilangan oksidasi +1,
KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 11 Sesi NGAN POLIMER A. LOGAM ALKALI a. Keberadaan dan Kelimpahan Logam Alkali Logam alkali adalah kelompok unsur yang sangat reaktif dengan bilangan oksidasi +1,
SENYAWA KOMPLEKS. Definisi. Ion Kompleks. Bilangan koordinasi, geometri, dan ligan RINGKASAN MATERI
 KIMIA ANORGANIK 14 OKTOBER 2012 RINGKASAN MATERI SENYAWA KOMPLEKS Definisi Senyawa kompleks itu: Ada ion logam sebagai atom pusat Ada ligan yang berupa anion atau molekul netral Memiliki counter ion supaya
KIMIA ANORGANIK 14 OKTOBER 2012 RINGKASAN MATERI SENYAWA KOMPLEKS Definisi Senyawa kompleks itu: Ada ion logam sebagai atom pusat Ada ligan yang berupa anion atau molekul netral Memiliki counter ion supaya
Soal dan jawaban tentang Kimia Unsur
 Soal dan jawaban tentang Kimia Unsur 1. Identifikasi suatu unsur dapat dilakukan melalui pengamatan fisis maupun kimia. Berikut yang bukan merupakan pengamatan kimia adalah. A. perubahan warna B. perubahan
Soal dan jawaban tentang Kimia Unsur 1. Identifikasi suatu unsur dapat dilakukan melalui pengamatan fisis maupun kimia. Berikut yang bukan merupakan pengamatan kimia adalah. A. perubahan warna B. perubahan
Kimia Koordinasi SOAL LATIHAN. Jawab soal sudah tersedia. Selesaikan soalnya, dan pelajari mengapa dipilih jawaban tersebut
 Kimia Koordinasi SOAL LATIHAN Jawab soal sudah tersedia. Selesaikan soalnya, dan pelajari mengapa dipilih jawaban tersebut 1. Suatu logam nickel dapat ditulis sebagai [Ar] 4s 2 3d 8, manakah representasi
Kimia Koordinasi SOAL LATIHAN Jawab soal sudah tersedia. Selesaikan soalnya, dan pelajari mengapa dipilih jawaban tersebut 1. Suatu logam nickel dapat ditulis sebagai [Ar] 4s 2 3d 8, manakah representasi
Ikatan Kimia. 2 Klasifikasi Ikatan Kimia :
 Ikatan Kimia Ikatan Kimia : Gaya tarik yang menyebabkan atom-atom yang terikat satu sama lain dalam suatu kombinasi untuk membentuk senyawa yang lebih kompleks. 2 Klasifikasi Ikatan Kimia : 1. Ikatan ion
Ikatan Kimia Ikatan Kimia : Gaya tarik yang menyebabkan atom-atom yang terikat satu sama lain dalam suatu kombinasi untuk membentuk senyawa yang lebih kompleks. 2 Klasifikasi Ikatan Kimia : 1. Ikatan ion
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya.
 30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
LAMPIRAN C CCT pada Materi Ikatan Ion
 LAMPIRAN C CCT pada Materi Ikatan Ion 1 IKATAN ION A. KECENDERUNGAN ATOM UNTUK STABIL Gas mulia merupakan sebutan untuk unsur golongan VIIIA. Unsur unsur ini bersifat inert (stabil). Hal ini dikarenakan
LAMPIRAN C CCT pada Materi Ikatan Ion 1 IKATAN ION A. KECENDERUNGAN ATOM UNTUK STABIL Gas mulia merupakan sebutan untuk unsur golongan VIIIA. Unsur unsur ini bersifat inert (stabil). Hal ini dikarenakan
8.4 Senyawa Kompleks
 8.4 Senyawa Kompleks Alfred Werner (1866-1919): kelompok baru senyawa logam transisi yang terdiri dari ion logam transisi (LT) yang dikelilingi oleh ion atau molekul yang lain. Ion atau molekul yang terikat
8.4 Senyawa Kompleks Alfred Werner (1866-1919): kelompok baru senyawa logam transisi yang terdiri dari ion logam transisi (LT) yang dikelilingi oleh ion atau molekul yang lain. Ion atau molekul yang terikat
Kegiatan Belajar 4 Kimia Unsur. Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada materi Kimia Unsur.
 1 Kegiatan Belajar 4 Kimia Unsur Capaian Pembelajaran Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada materi Kimia Unsur. Subcapaian pembelajaran: 1. Menjelaskan sifat unsur golongan
1 Kegiatan Belajar 4 Kimia Unsur Capaian Pembelajaran Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada materi Kimia Unsur. Subcapaian pembelajaran: 1. Menjelaskan sifat unsur golongan
Ikatan kimia. 1. Peranan Elektron dalam Pembentukan Ikatan Kimia. Ikatan kimia
 Ikatan kimia 1. Peranan Elektron dalam Pembentukan Ikatan Kimia Ikatan kimia Gaya tarik menarik antara atom sehingga atom tersebut tetap berada bersama-sama dan terkombinasi dalam senyawaan. gol 8 A sangat
Ikatan kimia 1. Peranan Elektron dalam Pembentukan Ikatan Kimia Ikatan kimia Gaya tarik menarik antara atom sehingga atom tersebut tetap berada bersama-sama dan terkombinasi dalam senyawaan. gol 8 A sangat
Bilangankoordinasi, bentukgeometri, danligandarisenyawakompleks
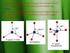 Senyawakoordinasi Senyawa koordinasi (coordination coumpounds) yang disebut juga kompleks adalah senyawa yang memiliki paling sedikit satu ion kompleks dengan kation sebagai pusat kompleks dan anion sebagailigan
Senyawakoordinasi Senyawa koordinasi (coordination coumpounds) yang disebut juga kompleks adalah senyawa yang memiliki paling sedikit satu ion kompleks dengan kation sebagai pusat kompleks dan anion sebagailigan
! " "! # $ % & ' % &
 Valensi ! " "! # $ % & ' %& # % ( ) # *+## )$,) & -#.. Semua unsur memiliki bilangan oksidasi +1 Semua unsur memiliki bilangan oksidasi +2 Semua unsur memiliki bilangan oksidasi +3. Tl juga memiliki bilangan
Valensi ! " "! # $ % & ' %& # % ( ) # *+## )$,) & -#.. Semua unsur memiliki bilangan oksidasi +1 Semua unsur memiliki bilangan oksidasi +2 Semua unsur memiliki bilangan oksidasi +3. Tl juga memiliki bilangan
I. PENDAHULUAN. Pencemaran udara adalah masuknya, atau tercampurnya unsur-unsur berbahaya ke dalam
 I. PENDAHULUAN 1.1 Latar Belakang Masalah Pencemaran udara adalah masuknya, atau tercampurnya unsur-unsur berbahaya ke dalam atmosfir yang dapat mengakibatkan terjadinya kerusakan lingkungan, gangguan
I. PENDAHULUAN 1.1 Latar Belakang Masalah Pencemaran udara adalah masuknya, atau tercampurnya unsur-unsur berbahaya ke dalam atmosfir yang dapat mengakibatkan terjadinya kerusakan lingkungan, gangguan
Bab V Ikatan Kimia. B. Struktur Lewis Antar unsur saling berinteraksi dengan menerima dan melepaskan elektron di kulit terluarnya. Gambaran terjadinya
 Bab V Ikatan Kimia Sebagian besar unsur yang ada di alam mempunyai kecenderungan untuk berinteraksi (berikatan) dengan unsur lain. Hal itu dilakukan karena unsur tersebut ingin mencapai kestabilan. Cara
Bab V Ikatan Kimia Sebagian besar unsur yang ada di alam mempunyai kecenderungan untuk berinteraksi (berikatan) dengan unsur lain. Hal itu dilakukan karena unsur tersebut ingin mencapai kestabilan. Cara
I. PENDAHULUAN. Kualitas udara yang dipergunakan untuk kehidupan tergantung dari lingkungannya. Udara
 I. PENDAHULUAN 1.1 Latar Belakang Masalah Kualitas udara yang dipergunakan untuk kehidupan tergantung dari lingkungannya. Udara mengandung sejumlah oksigen, yang merupakan komponen esensial bagi kehidupan,
I. PENDAHULUAN 1.1 Latar Belakang Masalah Kualitas udara yang dipergunakan untuk kehidupan tergantung dari lingkungannya. Udara mengandung sejumlah oksigen, yang merupakan komponen esensial bagi kehidupan,
D. 4,50 x 10-8 E. 1,35 x 10-8
 1. Pada suatu suhu tertentu, kelarutan PbI 2 dalam air adalah 1,5 x 10-3 mol/liter. Berdasarkan itu maka Kp PbI 2 adalah... A. 4,50 x 10-9 B. 3,37 x 10-9 C. 6,75 x 10-8 S : PbI 2 = 1,5. 10-3 mol/liter
1. Pada suatu suhu tertentu, kelarutan PbI 2 dalam air adalah 1,5 x 10-3 mol/liter. Berdasarkan itu maka Kp PbI 2 adalah... A. 4,50 x 10-9 B. 3,37 x 10-9 C. 6,75 x 10-8 S : PbI 2 = 1,5. 10-3 mol/liter
Bahasan. Senyawa Koordinasi. Bahasan. 1. Teori Werner tentang Senyawa Koordinasi : Tinjauan Ulang. Irwansyah, M.Si
 Bahasan Ion Kompleks dan 1 Teori Werner tentang Senyawa koordinasi : Tinjauan Ulang 2 Ligan 3 Tatanama 4 Isomerisasi 5 Ikatan dalam Ion Kompleks : Teori Medan Kristal 6 Sifat Magnet dan Teori Medan Kristal
Bahasan Ion Kompleks dan 1 Teori Werner tentang Senyawa koordinasi : Tinjauan Ulang 2 Ligan 3 Tatanama 4 Isomerisasi 5 Ikatan dalam Ion Kompleks : Teori Medan Kristal 6 Sifat Magnet dan Teori Medan Kristal
SENYAWA KOORDINASI Putri Anjarsari, S.Si., M.Pd
 SENYAWA KOORDINASI Putri Anjarsari, S.Si., M.Pd putri_anjarsari@uny.ac.id Pengertian Senyawa Koordinasi Senyawa koordinasi adalah senyawa yang mengandung satu atau lebih ion kompleks dengan sejumlah kecil
SENYAWA KOORDINASI Putri Anjarsari, S.Si., M.Pd putri_anjarsari@uny.ac.id Pengertian Senyawa Koordinasi Senyawa koordinasi adalah senyawa yang mengandung satu atau lebih ion kompleks dengan sejumlah kecil
TITRASI PEMBENTUKAN KOMPLEKS. Drs. DJADJAT TISNADJAJA, M.Tech.
 TITRASI PEMBENTUKAN KOMPLEKS Drs. DJADJAT TISNADJAJA, M.Tech. 1 Pendahuluan Salah satu tipe reaksi kimia yang berlaku sebagai dasar penentuan titrimetrik melibatkan pembentukan kompleks atau ion kompleks
TITRASI PEMBENTUKAN KOMPLEKS Drs. DJADJAT TISNADJAJA, M.Tech. 1 Pendahuluan Salah satu tipe reaksi kimia yang berlaku sebagai dasar penentuan titrimetrik melibatkan pembentukan kompleks atau ion kompleks
FAKULTAS TEKNIK UNIVERSITAS NEGERI YOGYAKARTA BAHAN AJAR KIMIA DASAR BAB VI IKATAN KIMIA
 No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 7 BAB VI IKATAN KIMIA Sebagian besar partikel materi adalah berupa molekul atau ion. Hanya beberapa partikel materi saja yang berupa atom. 1)
No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 7 BAB VI IKATAN KIMIA Sebagian besar partikel materi adalah berupa molekul atau ion. Hanya beberapa partikel materi saja yang berupa atom. 1)
LOGO ANALISIS KUALITATIF KATION DAN ANION
 LOGO ANALISIS KUALITATIF KATION DAN ANION By Djadjat Tisnadjaja 1 Jenis analisis Analisis makro Kuantitas zat 0,5 1 g Volume yang dipakai sekitar 20 ml Analisis semimikro Kuatitas zat sekitar 0,05 g Volume
LOGO ANALISIS KUALITATIF KATION DAN ANION By Djadjat Tisnadjaja 1 Jenis analisis Analisis makro Kuantitas zat 0,5 1 g Volume yang dipakai sekitar 20 ml Analisis semimikro Kuatitas zat sekitar 0,05 g Volume
TRY OUT UJIAN NASIONAL SMA PROGRAM IPA AKSES PRIVATE. Mata pelajaran : KIMIA Hari/Tanggal : / 2013
 TRY OUT UJIAN NASIONAL SMA PROGRAM IPA AKSES PRIVATE Mata pelajaran : KIMIA Hari/Tanggal : / 2013 Waktu : 120 Menit PETUNJUK UMUM: 1. Isikan nomor ujian, nama peserta, dan data pada Lembar Jawaban yang
TRY OUT UJIAN NASIONAL SMA PROGRAM IPA AKSES PRIVATE Mata pelajaran : KIMIA Hari/Tanggal : / 2013 Waktu : 120 Menit PETUNJUK UMUM: 1. Isikan nomor ujian, nama peserta, dan data pada Lembar Jawaban yang
LEMBARAN SOAL 5. Pilih satu jawaban yang benar!
 LEMBARAN SOAL 5 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
LEMBARAN SOAL 5 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
D. 2 dan 3 E. 2 dan 5
 1. Pada suhu dan tekanan sama, 40 ml P 2 tepat habis bereaksi dengan 100 ml, Q 2 menghasilkan 40 ml gas PxOy. Harga x dan y adalah... A. 1 dan 2 B. 1 dan 3 C. 1 dan 5 Kunci : E D. 2 dan 3 E. 2 dan 5 Persamaan
1. Pada suhu dan tekanan sama, 40 ml P 2 tepat habis bereaksi dengan 100 ml, Q 2 menghasilkan 40 ml gas PxOy. Harga x dan y adalah... A. 1 dan 2 B. 1 dan 3 C. 1 dan 5 Kunci : E D. 2 dan 3 E. 2 dan 5 Persamaan
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL. UjianTeori. Waktu: 100 menit
 OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
LAPORAN LENGKAP PRAKTIKUM KIMIA ANORGANIK PERCOBAAN 3 PENENTUAN BILANGAN KOORDINAI KOMPLEKS TEMBAGA (II)
 LAPORAN LENGKAP PRAKTIKUM KIMIA ANORGANIK PERCOBAAN 3 PENENTUAN BILANGAN KOORDINAI KOMPLEKS TEMBAGA (II) OLEH : NAMA : IMENG NIM: ACC 109 011 KELOMPOK : 2 ( DUA ) HARI, TANGGAL : RABU, 8 JUNI 2011 ASISTEN
LAPORAN LENGKAP PRAKTIKUM KIMIA ANORGANIK PERCOBAAN 3 PENENTUAN BILANGAN KOORDINAI KOMPLEKS TEMBAGA (II) OLEH : NAMA : IMENG NIM: ACC 109 011 KELOMPOK : 2 ( DUA ) HARI, TANGGAL : RABU, 8 JUNI 2011 ASISTEN
SIFAT FISIS DAN SIFAT KIMIA UNSUR-UNSUR
 SIFAT FISIS DAN SIFAT KIMIA UNSUR-UNSUR ALKALI Sifat Fisika Unsur Golongan Alkali Jari-jari atom dan massa jenis bertambah sedangkan titik Lebur dan titik didih. Sementara energi ionisasi dan keelektronegatifan
SIFAT FISIS DAN SIFAT KIMIA UNSUR-UNSUR ALKALI Sifat Fisika Unsur Golongan Alkali Jari-jari atom dan massa jenis bertambah sedangkan titik Lebur dan titik didih. Sementara energi ionisasi dan keelektronegatifan
LOGO ANALISIS KUALITATIF KATION DAN ANION
 LOGO ANALISIS KUALITATIF KATION DAN ANION BY : Djadjat Tisnadjaja Golongan ketiga Besi (II) dan (III), Alumunium, Kromium (III) dan (VI), nikel, kobalt, Mangan (II) dan (VII) serta Zink Djadjat Tisnadjaja,
LOGO ANALISIS KUALITATIF KATION DAN ANION BY : Djadjat Tisnadjaja Golongan ketiga Besi (II) dan (III), Alumunium, Kromium (III) dan (VI), nikel, kobalt, Mangan (II) dan (VII) serta Zink Djadjat Tisnadjaja,
REAKSI REDUKSI DAN OKSIDASI
 REAKSI REDUKSI DAN OKSIDASI Definisi Reduksi Oksidasi menerima elektron melepas elektron Contoh : Mg Mg 2+ + 2e - (Oksidasi ) O 2 + 4e - 2O 2- (Reduksi) Senyawa pengoksidasi adalah zat yang mengambil elektron
REAKSI REDUKSI DAN OKSIDASI Definisi Reduksi Oksidasi menerima elektron melepas elektron Contoh : Mg Mg 2+ + 2e - (Oksidasi ) O 2 + 4e - 2O 2- (Reduksi) Senyawa pengoksidasi adalah zat yang mengambil elektron
K13 Revisi Antiremed Kelas 10 KIMIA
 K13 Revisi Antiremed Kelas 10 KIMIA Persiapan Penilaian Akhir Semester (PAS) Ganjil Doc Name: RK13AR10KIM01PAS Version : 2016-11 halaman 1 01. Pernyataaan berikut yang tidak benar (A) elektron ditemukan
K13 Revisi Antiremed Kelas 10 KIMIA Persiapan Penilaian Akhir Semester (PAS) Ganjil Doc Name: RK13AR10KIM01PAS Version : 2016-11 halaman 1 01. Pernyataaan berikut yang tidak benar (A) elektron ditemukan
Aris Arianto. Guru Kimia di SMAN Madani Palu. STUDENT S BOOk
 STUDENT S BOOk Aris Arianto Guru Kimia di SMAN Madani Palu Website/blog penulis : Website : http://blendedlearningkimia.com Weblog : 1. http://www.arisarianto.web.id 2. http://arisarianto.wordpress.com
STUDENT S BOOk Aris Arianto Guru Kimia di SMAN Madani Palu Website/blog penulis : Website : http://blendedlearningkimia.com Weblog : 1. http://www.arisarianto.web.id 2. http://arisarianto.wordpress.com
BAB II TINJAUAN PUSTAKA
 BAB II TINJAUAN PUSTAKA 2.1 Perak Nitrat Perak nitrat merupakan senyawa anorganik tidak berwarna, tidak berbau, kristal transparan dengan rumus kimia AgNO 3 dan mudah larut dalam alkohol, aseton dan air.
BAB II TINJAUAN PUSTAKA 2.1 Perak Nitrat Perak nitrat merupakan senyawa anorganik tidak berwarna, tidak berbau, kristal transparan dengan rumus kimia AgNO 3 dan mudah larut dalam alkohol, aseton dan air.
SISTEM PERIODIK UNSUR
 SISTEM PERIODIK UNSUR Abad 18, baru 51 unsur diketahui (gas mulia belum ditemukan) John Newland (1864) : Penyusunan unsur-unsur berdasarkan kenaikan massa atom. Di alam ada 109 unsur, bagaimana penyusunan
SISTEM PERIODIK UNSUR Abad 18, baru 51 unsur diketahui (gas mulia belum ditemukan) John Newland (1864) : Penyusunan unsur-unsur berdasarkan kenaikan massa atom. Di alam ada 109 unsur, bagaimana penyusunan
Ikatan Kimia. Ikatan kimia adalah gaya tarik antar atom yang pemutusan atau pembentukannya menyebabkan terjadinya perubahan kimia.
 Ikatan Kimia 1. Ikatan Kimia 1.1 Pengertian Ikatan kimia adalah gaya tarik antar atom yang pemutusan atau pembentukannya menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam Ikatan Kimia Ikatan Ion:
Ikatan Kimia 1. Ikatan Kimia 1.1 Pengertian Ikatan kimia adalah gaya tarik antar atom yang pemutusan atau pembentukannya menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam Ikatan Kimia Ikatan Ion:
Review II. 1. Pada elektrolisis larutan NaCl dengan elektroda karbon, reaksi yang terjadi pada katoda adalah... A. 2H 2
 KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 14 Sesi NGAN Review II A. ELEKTROLISIS 1. Pada elektrolisis larutan NaCl dengan elektroda karbon, reaksi yang terjadi pada katoda adalah... A. 2H 2 O 4H + + O 2
KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 14 Sesi NGAN Review II A. ELEKTROLISIS 1. Pada elektrolisis larutan NaCl dengan elektroda karbon, reaksi yang terjadi pada katoda adalah... A. 2H 2 O 4H + + O 2
~ gaya tarik antar atom yang pemutusan atau pembentukannya dapat menyebabkan terjadinya perubahan kimia.
 1. Ikatan Kimia Struktur Molekul 1.1 Pengertian ~ gaya tarik antar atom yang pemutusan atau pembentukannya dapat menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang
1. Ikatan Kimia Struktur Molekul 1.1 Pengertian ~ gaya tarik antar atom yang pemutusan atau pembentukannya dapat menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang
Pembuatan Garam Kompleks dan Garam Rangkap.
 A. JUDUL PERCOBAAN Pembuatan Garam Kompleks dan Garam Rangkap. B. TUJUAN PERCOBAAN Mahasiswa diharapkan mampu mempelajari pembuatan dan sifat-sifat garam rangkap kupri ammonium sulfat dan garam kompleks
A. JUDUL PERCOBAAN Pembuatan Garam Kompleks dan Garam Rangkap. B. TUJUAN PERCOBAAN Mahasiswa diharapkan mampu mempelajari pembuatan dan sifat-sifat garam rangkap kupri ammonium sulfat dan garam kompleks
Kimia Koordinasi Teori Ikatan Valensi
 Kimia Koordinasi Teori Ikatan Valensi Beberapa teori telah dirumuskan untuk menjelaskan ikatan dalam senyawaan koordinasi dan untuk merasionalisasi serta meramalkan sifat-sifatnya: teori ikatan valensi,
Kimia Koordinasi Teori Ikatan Valensi Beberapa teori telah dirumuskan untuk menjelaskan ikatan dalam senyawaan koordinasi dan untuk merasionalisasi serta meramalkan sifat-sifatnya: teori ikatan valensi,
BAB I STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR
 BAB I STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR A. STANDAR KOMPOTENSI 1 : Mendeskripsikan struktur atom,sifat-sifat periodik unsur, dan ikatan kimia serta struktur molekul dan sifat-sifatnya. B. KOMPETENSI
BAB I STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR A. STANDAR KOMPOTENSI 1 : Mendeskripsikan struktur atom,sifat-sifat periodik unsur, dan ikatan kimia serta struktur molekul dan sifat-sifatnya. B. KOMPETENSI
No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 8 Semester I BAB I Prodi PT Boga BAB I MATERI
 No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 8 BAB I MATERI Materi adalah sesuatu yang menempati ruang dan mempunyai massa. Materi dapat berupa benda padat, cair, maupun gas. A. Penggolongan
No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 8 BAB I MATERI Materi adalah sesuatu yang menempati ruang dan mempunyai massa. Materi dapat berupa benda padat, cair, maupun gas. A. Penggolongan
1. Ikatan Kimia. Struktur Molekul. 1.1 Pengertian. 1.2 Macam-Macam. ~ gaya tarik antar atom
 1. Ikatan Kimia 1.1 Pengertian ~ gaya tarik antar atom Struktur Molekul 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang terbentuk akibat tarik-menarik elektrostatik antara ion positif (kation) dan ion
1. Ikatan Kimia 1.1 Pengertian ~ gaya tarik antar atom Struktur Molekul 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang terbentuk akibat tarik-menarik elektrostatik antara ion positif (kation) dan ion
BENTUK-BENTUK MOLEKUL
 BENTUK-BENTUK MOLEKUL 10. 1. Menggambarkan Molekul dan Ion dengan Struktur Lewis Berikut adalah langkah-langkah dalam menggambarkan molekul dengan ikatan tunggal menggunakan struktur Lewis: 1) Letakkan
BENTUK-BENTUK MOLEKUL 10. 1. Menggambarkan Molekul dan Ion dengan Struktur Lewis Berikut adalah langkah-langkah dalam menggambarkan molekul dengan ikatan tunggal menggunakan struktur Lewis: 1) Letakkan
SIMULASI UJIAN NASIONAL 2
 SIMULASI UJIAN NASIONAL 2. Diketahui nomor atom dan nomor massa dari atom X adalah 29 dan 63. Jumlah proton, elektron, dan neutron dalam ion X 2+ (A) 29, 27, dan 63 (B) 29, 29, dan 34 (C) 29, 27, dan 34
SIMULASI UJIAN NASIONAL 2. Diketahui nomor atom dan nomor massa dari atom X adalah 29 dan 63. Jumlah proton, elektron, dan neutron dalam ion X 2+ (A) 29, 27, dan 63 (B) 29, 29, dan 34 (C) 29, 27, dan 34
Mengubah energi kimia menjadi energi listrik Mengubah energi listrik menjadi energi kimia Katoda sebagi kutub positif, anoda sebagai kutub negatif
 TUGAS 1 ELEKTROKIMIA Di kelas X, anda telah mempelajari bilangan oksidasi dan reaksi redoks. Reaksi redoks adalah reaksi reduksi dan oksidasi. Reaksi reduksi adalah reaksi penangkapan elektron atau reaksi
TUGAS 1 ELEKTROKIMIA Di kelas X, anda telah mempelajari bilangan oksidasi dan reaksi redoks. Reaksi redoks adalah reaksi reduksi dan oksidasi. Reaksi reduksi adalah reaksi penangkapan elektron atau reaksi
PREDIKSI UJIAN NASIONAL 2011 KIMIA
 Soal PREDIKSI Latihan UJIAN NASIONAL 2011 2013 KIMIA 1 LATIHAN UJIAN AKHIR NASIONAL TAHUN AJARAN 2012/2013 KIMIA 1. Jika unsur 19 X berikatan dengan unsur 35 Z maka, rumus senyawa dan jenis ikatan yang
Soal PREDIKSI Latihan UJIAN NASIONAL 2011 2013 KIMIA 1 LATIHAN UJIAN AKHIR NASIONAL TAHUN AJARAN 2012/2013 KIMIA 1. Jika unsur 19 X berikatan dengan unsur 35 Z maka, rumus senyawa dan jenis ikatan yang
IKATAN KIMIA MAKALAH KIMIA DASAR
 IKATAN KIMIA MAKALAH KIMIA DASAR dibuat sebagai salah satu syarat untuk memperoleh nilai mata kuliah kimia dasar Oleh : AZKA WAFI EL HAKIM ( NPM : 301014000 ) HELGA RACHEL F ( NPM : 3010140014 ) MUHAMMAD
IKATAN KIMIA MAKALAH KIMIA DASAR dibuat sebagai salah satu syarat untuk memperoleh nilai mata kuliah kimia dasar Oleh : AZKA WAFI EL HAKIM ( NPM : 301014000 ) HELGA RACHEL F ( NPM : 3010140014 ) MUHAMMAD
kimia Kelas X TABEL PERIODIK K-13
 K-13 Kelas X kimia TABEL PERIODIK Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami perkembangan sistem periodik unsur dan kelemahannya. 2. Menentukan
K-13 Kelas X kimia TABEL PERIODIK Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami perkembangan sistem periodik unsur dan kelemahannya. 2. Menentukan
Redoks dan Elektrokimia Tim Kimia FTP
 Redoks dan Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis
Redoks dan Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis
OLIMPIADE NASIONAL MATEMATIKA DAN ILMU PENGETAHUAN ALAM TINGKAT PERGURUAN TINGGI (ONMIPA-PT) Bidang Kimia Sub bidang Kimia Anorganik
 OLIMPIADE NASIONAL MATEMATIKA DAN ILMU PENGETAHUAN ALAM TINGKAT PERGURUAN TINGGI (ONMIPA-PT) 2017 Bidang Kimia Sub bidang Kimia Anorganik 16 Mei 2017 Waktu : 120 menit Petunjuk Pengerjaan 1. Tes ini berlangsung
OLIMPIADE NASIONAL MATEMATIKA DAN ILMU PENGETAHUAN ALAM TINGKAT PERGURUAN TINGGI (ONMIPA-PT) 2017 Bidang Kimia Sub bidang Kimia Anorganik 16 Mei 2017 Waktu : 120 menit Petunjuk Pengerjaan 1. Tes ini berlangsung
kimia Kelas X REVIEW I K-13 A. Hakikat Ilmu Kimia
 K-13 Kelas X kimia REVIEW I Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami hakikat ilmu kimia dan metode ilmiah. 2. Memahami teori atom dan
K-13 Kelas X kimia REVIEW I Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami hakikat ilmu kimia dan metode ilmiah. 2. Memahami teori atom dan
Elektrokimia. Tim Kimia FTP
 Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis ini merupakan
Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis ini merupakan
Sulistyani, M.Si.
 Sulistyani, M.Si. sulistyani@uny.ac.id Reaksi oksidasi: perubahan kimia suatu spesies (atom, unsur, molekul) melepaskan elektron. Cu Cu 2+ + 2e Reaksi reduksi: perubahan kimia suatu spesies (atom, unsur,
Sulistyani, M.Si. sulistyani@uny.ac.id Reaksi oksidasi: perubahan kimia suatu spesies (atom, unsur, molekul) melepaskan elektron. Cu Cu 2+ + 2e Reaksi reduksi: perubahan kimia suatu spesies (atom, unsur,
IKATAN KIMIA DAN GEOMETRI MOLEKUL
 IKATAN KIMIA DAN GEOMETRI MOLEKUL Sebagian besar unsur di alam tidak pernah dijumpai dalam atom bebas (kecuali gas mulia), namun dalam bentuk berikatan dengan atom yang sejenis maupun atom-atom yang lain.
IKATAN KIMIA DAN GEOMETRI MOLEKUL Sebagian besar unsur di alam tidak pernah dijumpai dalam atom bebas (kecuali gas mulia), namun dalam bentuk berikatan dengan atom yang sejenis maupun atom-atom yang lain.
TEORI ATOM. Ramadoni Syahputra
 TEORI ATOM Ramadoni Syahputra STRUKTUR ATOM Teori tentang atom pertama kali dikemukakan oleh filsafat Yunani yaitu Leoclipus dan Democritus, pada abad ke-5 sebelum Masehi. Atom berasal dari kata Yunani:
TEORI ATOM Ramadoni Syahputra STRUKTUR ATOM Teori tentang atom pertama kali dikemukakan oleh filsafat Yunani yaitu Leoclipus dan Democritus, pada abad ke-5 sebelum Masehi. Atom berasal dari kata Yunani:
Persiapan UN 2018 KIMIA
 Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI
 BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI A. STANDAR KOMPETENSI Mendiskripsikan hukumhukum dasar kimia dan penerapannya dalam perhitungan kimia. B. Kompetensi Dasar : Menuliskan nama senyawa anorganik
BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI A. STANDAR KOMPETENSI Mendiskripsikan hukumhukum dasar kimia dan penerapannya dalam perhitungan kimia. B. Kompetensi Dasar : Menuliskan nama senyawa anorganik
Bab 1 Pendahuluan. I. Landasan Teori
 I. Landasan Teori Bab 1 Pendahuluan Logam alkali dan alkali tanah memberikan warna nyala yang khas, warna nyala dari logam alkali tanah dapat digunakan sebagai salah satu cara mengidentifikasi adanya unsur
I. Landasan Teori Bab 1 Pendahuluan Logam alkali dan alkali tanah memberikan warna nyala yang khas, warna nyala dari logam alkali tanah dapat digunakan sebagai salah satu cara mengidentifikasi adanya unsur
LAPORAN PRAKTIKUM KIMIA ANORGANIK I PERCOBAAN V
 LAPORAN PRAKTIKUM KIMIA ANORGANIK I PERCOBAAN V PEMBUATAN GARAM KOMPLEKS TETRA AMIN TEMBAGA (II) SULFAT MONOHIDRAT Cu(NH 3 ) H O DAN GARAM RANGKAP AMONIUM TEMBAGA (II) SULFAT HEKSAHIDRAT Cu(SO ).6HO OLEH:
LAPORAN PRAKTIKUM KIMIA ANORGANIK I PERCOBAAN V PEMBUATAN GARAM KOMPLEKS TETRA AMIN TEMBAGA (II) SULFAT MONOHIDRAT Cu(NH 3 ) H O DAN GARAM RANGKAP AMONIUM TEMBAGA (II) SULFAT HEKSAHIDRAT Cu(SO ).6HO OLEH:
IKATAN KIMIA. Tim Dosen Kimia Dasar FTP
 IKATAN KIMIA Tim Dosen Kimia Dasar FTP Sub pokok bahasan: Konsep Ikatan Kimia Macam-macam ikatan kimia KONSEP IKATAN KIMIA Untuk mencapai kestabilan, atom-atom saling berikatan. Ikatan kimia merupakan
IKATAN KIMIA Tim Dosen Kimia Dasar FTP Sub pokok bahasan: Konsep Ikatan Kimia Macam-macam ikatan kimia KONSEP IKATAN KIMIA Untuk mencapai kestabilan, atom-atom saling berikatan. Ikatan kimia merupakan
Hubungan koefisien dalam persamaan reaksi dengan hitungan
 STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
BAB 3 IKATAN DAN STRUKTUR MOLEKUL
 BAB 3 IKATAN DAN STRUKTUR MOLEKUL Atom-atom pada umumnya tidak ditemukan dalam keadaan bebas (kecuali pada temperatur tinggi), melainkan sebagai suatu kelompok atom atau sebagai molekul. Hal ini berarti
BAB 3 IKATAN DAN STRUKTUR MOLEKUL Atom-atom pada umumnya tidak ditemukan dalam keadaan bebas (kecuali pada temperatur tinggi), melainkan sebagai suatu kelompok atom atau sebagai molekul. Hal ini berarti
Ikatan yang terjadi antara atom O dengan O membentuk molekul O 2
 Ikatan Kovalen adalah ikatan yang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan. Ikatan kovalen terjadi akibat ketidakmampuan salah 1 atom yang akan berikatan untuk
Ikatan Kovalen adalah ikatan yang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan. Ikatan kovalen terjadi akibat ketidakmampuan salah 1 atom yang akan berikatan untuk
I. PENDAHULUAN. senyawa kompleks bersifat sebgai asam Lewis sedangkan ligan dalam senyawa
 I. PENDAHULUAN A. Latar Belakang Senyawa kompleks merupakan senyawa yang memiliki warna yang khas yang diakibatkan oleh adanya unsur yang dari golongan transisi yang biasanya berperperan sebagai atom pusat
I. PENDAHULUAN A. Latar Belakang Senyawa kompleks merupakan senyawa yang memiliki warna yang khas yang diakibatkan oleh adanya unsur yang dari golongan transisi yang biasanya berperperan sebagai atom pusat
PAKET UJIAN NASIONAL 17 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 17 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
PAKET UJIAN NASIONAL 17 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
Tabel Periodik. Bab 3a. Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr.
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Bab 3a Tabel Periodik Kapan unsur-unsur ditemukan? 8.1 1 ns 1 Konfigurasi elektron
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Bab 3a Tabel Periodik Kapan unsur-unsur ditemukan? 8.1 1 ns 1 Konfigurasi elektron
SENYAWA KOORDINASI Ion kompleks: Angka koordinasi, Geometri, dan Ligan
 SENYAWA KOORDINASI Keistimewaan dari ilmu kimia peralihan logam adalah rumus dari senyawa koordinasi (kompleks). Ada unsur yang berisi paling sedikit satu ion kompleks, yang terdiri dari satu atom pusat
SENYAWA KOORDINASI Keistimewaan dari ilmu kimia peralihan logam adalah rumus dari senyawa koordinasi (kompleks). Ada unsur yang berisi paling sedikit satu ion kompleks, yang terdiri dari satu atom pusat
Peranan elektron dalam pembentukan ikatan kimia
 IKATAN KIMIA IKATAN KIMIA Gaya yang memegangi atom atau ion membentuk molekul atau kristal disebut Ikatan Kimia. Elektron memegang peran penting dalam pembentukan ikatan kimia. Peranan elektron dalam pembentukan
IKATAN KIMIA IKATAN KIMIA Gaya yang memegangi atom atau ion membentuk molekul atau kristal disebut Ikatan Kimia. Elektron memegang peran penting dalam pembentukan ikatan kimia. Peranan elektron dalam pembentukan
2. Analisis Kualitatif, Sintesis, Karakterisasi dan Uji Katalitik
 2. Analisis Kualitatif, Sintesis, Karakterisasi dan Uji Katalitik Modul 1: Reaksi-Reaksi Logam Transisi & Senyawanya TUJUAN (a) Mempelajari reaksi-reaksi logam transisi dan senyawanya, meliputi reaksi
2. Analisis Kualitatif, Sintesis, Karakterisasi dan Uji Katalitik Modul 1: Reaksi-Reaksi Logam Transisi & Senyawanya TUJUAN (a) Mempelajari reaksi-reaksi logam transisi dan senyawanya, meliputi reaksi
BAB II TINJAUAN PUSTAKA. sehingga dapat menghasilkan data yang akurat.
 9 BAB II TINJAUAN PUSTAKA Proses pengujian panas yang dihasilkan dari pembakaran gas HHO diperlukan perencanaan yang cermat dalam perhitungan dan ukuran. Teori-teori yang berhubungan dengan pengujian yang
9 BAB II TINJAUAN PUSTAKA Proses pengujian panas yang dihasilkan dari pembakaran gas HHO diperlukan perencanaan yang cermat dalam perhitungan dan ukuran. Teori-teori yang berhubungan dengan pengujian yang
BENDA WUJUD, SIFAT DAN KEGUNAANNYA
 BENDA WUJUD, SIFAT DAN KEGUNAANNYA Benda = Materi = bahan Wujud benda : 1) Padat 2) Cair 3) Gas Benda Padat 1. Mekanis kuat (tegar), sukar berubah bentuk, keras 2. Titik leleh tinggi 3. Sebagian konduktor
BENDA WUJUD, SIFAT DAN KEGUNAANNYA Benda = Materi = bahan Wujud benda : 1) Padat 2) Cair 3) Gas Benda Padat 1. Mekanis kuat (tegar), sukar berubah bentuk, keras 2. Titik leleh tinggi 3. Sebagian konduktor
LARUTAN ELEKTROLIT DAN NON ELEKTROLIT. Perbandingan sifat-sifat larutan elektrolit dan larutan non elektrolit.
 KIMIA DASAR I PERTEMUAN 1 Tujuan Perkuliahan: Setelah proses pembelajaran ini selesai, diharapkan mahasiswa dapat: 1. Menjelaskan pengertian dari larutan beserta contohnya. 2. Menjelaskan perbedaan larutan
KIMIA DASAR I PERTEMUAN 1 Tujuan Perkuliahan: Setelah proses pembelajaran ini selesai, diharapkan mahasiswa dapat: 1. Menjelaskan pengertian dari larutan beserta contohnya. 2. Menjelaskan perbedaan larutan
Ringkasan BAB 10. Langkah-langkah penulisan struktur lewis untuk molekul dengan ikatan tunggal.
 Ringkasan BAB 10 1. Struktur lewis untuk molekul ikatan tunggal Langkah-langkah penulisan struktur lewis untuk molekul dengan ikatan tunggal. Langkah 1, tempatkan atom dari golongan yang lebih kecil ditengah
Ringkasan BAB 10 1. Struktur lewis untuk molekul ikatan tunggal Langkah-langkah penulisan struktur lewis untuk molekul dengan ikatan tunggal. Langkah 1, tempatkan atom dari golongan yang lebih kecil ditengah
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB I STRUKTUR ATOM
 BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB I 1. Suatu partikel X memiliki 16 proton, 16 neutron, dan 18 elektron. Partikel tersebut dapat dikategorikan sebagai A. Anion X bermuatan -1
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB I 1. Suatu partikel X memiliki 16 proton, 16 neutron, dan 18 elektron. Partikel tersebut dapat dikategorikan sebagai A. Anion X bermuatan -1
Struktur atom, dan Tabel periodik unsur,
 KISI-KISI PENULISAN USBN Jenis Sekolah : SMA/MA Mata Pelajaran : KIMIA Kurikulum : 2006 Alokasi Waktu : 120 menit Jumlah : Pilihan Ganda : 35 Essay : 5 1 2 3 1.1. Memahami struktur atom berdasarkan teori
KISI-KISI PENULISAN USBN Jenis Sekolah : SMA/MA Mata Pelajaran : KIMIA Kurikulum : 2006 Alokasi Waktu : 120 menit Jumlah : Pilihan Ganda : 35 Essay : 5 1 2 3 1.1. Memahami struktur atom berdasarkan teori
BAB IV HASIL DAN PEMBAHASAN. terhadap pergeseran cermin untuk menentukan faktor konversi, dan grafik
 BAB IV HASIL DAN PEMBAHASAN Bab yang keempat ini mengulas tentang hasil penelitian yang telah dilakukan beserta analisa pembahasannya. Hasil penelitian ini nantinya akan dipaparkan olahan data berupa grafik
BAB IV HASIL DAN PEMBAHASAN Bab yang keempat ini mengulas tentang hasil penelitian yang telah dilakukan beserta analisa pembahasannya. Hasil penelitian ini nantinya akan dipaparkan olahan data berupa grafik
KIMIA UNSUR. (4) energi ionisasi kripton lebih tinggi daripada energi ioniasasi neon
 KIMIA UNSUR GAS MULIA 1. Pernyataan di bawah ini yang merupakan sifat gas mulia a. terletak dalam sistem periodik pada periode kedelapan b. nomor atom terkecil adalah 8 c. sangat reaktif d. elektron pada
KIMIA UNSUR GAS MULIA 1. Pernyataan di bawah ini yang merupakan sifat gas mulia a. terletak dalam sistem periodik pada periode kedelapan b. nomor atom terkecil adalah 8 c. sangat reaktif d. elektron pada
Bab 11 Senyawa Koordinasi
 Bab 11 http://chem.fmipa.ipb.ac.id Cisplatin (cis-pt(nh 3 ) 2 Cl 2 ) Cisplatin menghancurkan sel kanker untuk bereproduksi dengan mengubah konfigurasi DNAnya 1 Ikthisar Sumber: Chang Bab 20 1 Kimia Logam
Bab 11 http://chem.fmipa.ipb.ac.id Cisplatin (cis-pt(nh 3 ) 2 Cl 2 ) Cisplatin menghancurkan sel kanker untuk bereproduksi dengan mengubah konfigurasi DNAnya 1 Ikthisar Sumber: Chang Bab 20 1 Kimia Logam
OLIMPIADE KIMIA INDONESIA
 OLIMPIADE KIMIA INDONESIA OLIMPIADE SAINS NASIONAL SELEKSI KABUPATEN / KOTA UjianTeori Waktu 2 Jam Departemen Pendidikan Nasional Direktorat Jenderal Managemen Pendidikan Dasar dan Menengah Direktorat
OLIMPIADE KIMIA INDONESIA OLIMPIADE SAINS NASIONAL SELEKSI KABUPATEN / KOTA UjianTeori Waktu 2 Jam Departemen Pendidikan Nasional Direktorat Jenderal Managemen Pendidikan Dasar dan Menengah Direktorat
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: HUKUM-HUKUM DASAR KIMIA Di soal diketahui dan ditanya: m (NH 2 ) 2 CO = 12.000 ton/tahun (pabrik) m N 2 = ton/tahun?
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: HUKUM-HUKUM DASAR KIMIA Di soal diketahui dan ditanya: m (NH 2 ) 2 CO = 12.000 ton/tahun (pabrik) m N 2 = ton/tahun?
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: TERMOKIMIA Pada soal diketahui dan ditanya: ΔH c C 2 H 5 OH = -1380 kj/mol ΔH d C 6 H 12 O 6 = -60 kj/mol ΔH c C
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: TERMOKIMIA Pada soal diketahui dan ditanya: ΔH c C 2 H 5 OH = -1380 kj/mol ΔH d C 6 H 12 O 6 = -60 kj/mol ΔH c C
MODUL KIMIA SMA IPA Kelas 10
 SMA IPA Kelas Atom Bagian terkecil dari materi yang sudah tidak dapat dibagi lagi disebut atom (berasal dari bahasa Yunani atomos yang berarti tidak dapat dibagi lagi). Namun, berakhir pendapat tersebut
SMA IPA Kelas Atom Bagian terkecil dari materi yang sudah tidak dapat dibagi lagi disebut atom (berasal dari bahasa Yunani atomos yang berarti tidak dapat dibagi lagi). Namun, berakhir pendapat tersebut
Elektrokimia. Sel Volta
 TI222 Kimia lanjut 09 / 01 47 Sel Volta Elektrokimia Sel Volta adalah sel elektrokimia yang menghasilkan arus listrik sebagai akibat terjadinya reaksi pada kedua elektroda secara spontan Misalnya : sebatang
TI222 Kimia lanjut 09 / 01 47 Sel Volta Elektrokimia Sel Volta adalah sel elektrokimia yang menghasilkan arus listrik sebagai akibat terjadinya reaksi pada kedua elektroda secara spontan Misalnya : sebatang
SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016)
 SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016) Bagian I: Pilihan Ganda 1) Suatu atom yang mempunyai energi ionisasi pertama bernilai besar, memiliki sifat/kecenderungan : A. Afinitas elektron rendah
SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016) Bagian I: Pilihan Ganda 1) Suatu atom yang mempunyai energi ionisasi pertama bernilai besar, memiliki sifat/kecenderungan : A. Afinitas elektron rendah
OAL TES SEMESTER I. I. Pilihlah jawaban yang paling tepat!
 KIMIA X SMA 103 S AL TES SEMESTER I I. Pilihlah jawaban yang paling tepat! 1. Partikel penyusun inti atom terdiri dari... a. proton dan elektron b. proton dan netron c. elektron dan netron d. elektron
KIMIA X SMA 103 S AL TES SEMESTER I I. Pilihlah jawaban yang paling tepat! 1. Partikel penyusun inti atom terdiri dari... a. proton dan elektron b. proton dan netron c. elektron dan netron d. elektron
IKATAN KIMIA DALAM BAHAN
 IKATAN KIMIA DALAM BAHAN Sifat Atom dan Ikatan Kimia Suatu partikel baik berupa ion bermuatan, inti atom dan elektron, dimana diantara mereka, akan membentuk ikatan kimia yang akan menurunkan energi potensial
IKATAN KIMIA DALAM BAHAN Sifat Atom dan Ikatan Kimia Suatu partikel baik berupa ion bermuatan, inti atom dan elektron, dimana diantara mereka, akan membentuk ikatan kimia yang akan menurunkan energi potensial
Siswa diingatkan tentang struktur atom, bilangan kuantum, bentuk-bentuk orbital, dan konfigurasi elektron
 RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
LOGO. Stoikiometri. Tim Dosen Pengampu MK. Kimia Dasar
 LOGO Stoikiometri Tim Dosen Pengampu MK. Kimia Dasar Konsep Mol Satuan jumlah zat dalam ilmu kimia disebut mol. 1 mol zat mengandung jumlah partikel yang sama dengan jumlah partikel dalam 12 gram C 12,
LOGO Stoikiometri Tim Dosen Pengampu MK. Kimia Dasar Konsep Mol Satuan jumlah zat dalam ilmu kimia disebut mol. 1 mol zat mengandung jumlah partikel yang sama dengan jumlah partikel dalam 12 gram C 12,
SOAL SELEKSI OLIMPIADE SAINS TINGKAT KABUPATEN/KOTA 2004 CALON TIM OLIMPIADE KIMIA INDONESIA
 SOAL SELEKSI OLIMPIADE SAINS TINGKAT KABUPATEN/KOTA 2004 CALON TIM OLIMPIADE KIMIA INDONESIA 2005 Bidang Kimia KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN DIREKTORAT JENDERAL PENDIDIKAN MENENGAH DIREKTORAT PEMBINAAN
SOAL SELEKSI OLIMPIADE SAINS TINGKAT KABUPATEN/KOTA 2004 CALON TIM OLIMPIADE KIMIA INDONESIA 2005 Bidang Kimia KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN DIREKTORAT JENDERAL PENDIDIKAN MENENGAH DIREKTORAT PEMBINAAN
DAFTAR PUSTAKA. 1. Dra. Sukmriah M & Dra. Kamianti A, Kimia Kedokteran, edisi 2, Penerbit Binarupa Aksara, 1990
 DAFTAR PUSTAKA 1. Dra. Sukmriah M & Dra. Kamianti A, Kimia Kedokteran, edisi 2, Penerbit Binarupa Aksara, 1990 2. Drs. Hiskia Achmad, Kimia Unsur dan Radiokimia, Penerbit PT. Citra Aditya Bakti, 2001 3.
DAFTAR PUSTAKA 1. Dra. Sukmriah M & Dra. Kamianti A, Kimia Kedokteran, edisi 2, Penerbit Binarupa Aksara, 1990 2. Drs. Hiskia Achmad, Kimia Unsur dan Radiokimia, Penerbit PT. Citra Aditya Bakti, 2001 3.
2. Konfigurasi elektron dua buah unsur tidak sebenarnya:
 . Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
. Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA JAWABAN (DOKUMEN NEGARA) UjianTeori. Waktu: 100 menit
 OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA JAWABAN (DOKUMEN NEGARA) UjianTeori Waktu: 100 menit Kementerian Pendidikan Nasional Dan Kebudayaan Direktorat Jenderal Managemen Pendidikan Dasar
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA JAWABAN (DOKUMEN NEGARA) UjianTeori Waktu: 100 menit Kementerian Pendidikan Nasional Dan Kebudayaan Direktorat Jenderal Managemen Pendidikan Dasar
OAL TES SEMESTER I. I. Pilihlah jawaban yang paling tepat! a. 2d d. 3p b. 2p e. 3s c. 3d 6. Unsur X dengan nomor atom
 KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat!
 Petunjuk : 1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat! 2. Soal Teori ini terdiri dari dua bagian: A. 30 soal pilihan Ganda : 60 poin B. 5 Nomor
Petunjuk : 1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat! 2. Soal Teori ini terdiri dari dua bagian: A. 30 soal pilihan Ganda : 60 poin B. 5 Nomor
PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53
PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53
