Senyawa Koordinasi (senyawa kompleks)
|
|
|
- Susanto Budiono
- 7 tahun lalu
- Tontonan:
Transkripsi
1 Senyawa Koordinasi (senyawa kompleks) Salah satu keistimewaan logam transisi adalah dapat membentuk senyawa klompeks, yaitu senyawa yang paling sedikit terdiri dari satu ion kompleks (terdiri dari kation logam utama atau logam transisi sebagai atom pusat yang berikatan dengan molekul dan/atau anion yang disebut sebagai ligan) yang berikatan dengan ion lainnya yang disebut ion counter. Keterangan gambar: bagian dari senyawa koordinasi; model (atas), gambar perspektif (tengah), rumus kimia (bawah) senyawa kompleks mempunyai atom pusat yang dikelilingi oleh ligan. Ketika [Co(NH 3 ) 6 ]CI 3(S) larut dalam air ion kompleks dan ion conter akan terpisah, sedangkan ligan tetap terikat dengan atom pusat. Pada gambar sebelah kiri 6 ligan pada atom pusat ion [Co(NH 3 ) 6 ] 3+ memberikan bentuk oktahedral, sedangkan pada gambar sebelah kanan 4 ligan pada ion [Pt(NH3)4] 2+ memberikan bentuk persegi planar. Ion kompleks; bilangan koordinasi, geometri dan ligan-ligan Ion kompleks terdiri dari atom logam yang merupakan atom pusat yang berikatan dengan ligan-ligan yang berupa ion netral maupun ion yang bermuatan. Bilangan koordinasi : jumlah ligan yang terikat secara langsung pada atom pusat, contohnya pada ion [Co(NH 3 ) 6 ] 3+ bilangan koordinasinya adalah 6
2 Geometri; bentuk geometri ion kompleks tergantung pada bilangan koordinasinya dan sifat dari ion logam pada ion kompleks itu sendiri. Donor atom per ligan; ligan suatu ion kompleks adalah molekul atau anion yang menyumbangkan satu atau lebih pasangan elektron bebas kepada ion logam yang membentuk ikatan kovalen. Ligan diklasifikasikan berdasarkan jumlah pasanga elektron bebas yang didonorkannya, yaitu monodentat yang mendonorkan satu pasang elektron, bidentat yang mendonorkan dua pasang elektron dan polidentat yang mendonorkan lebih dari dua pasaang elektron.
3 Rumus dan Penamaan Senyawa Koordinasi Untuk penulisan rumus senyawa koordinasi disusun dengan aturan sebagai berikut: 1. Nama kation ditulis terlebih dahulu sebelum anion. Contoh: K 2 [Co(NH 3 ) 2 CI 4 ] terdiri dari kation K + dan [Co(NH 3 ) 2 CI 4 ] 2- sehingga K + ditulis terlebih dahulu. 2. Muatan kation sama dengan muatan anion. Contoh: pada senyawa K 2 [Co(NH 3 ) 2 CI 4 ], NH 3 merupakan molekul netral Cl - memberi muatan dengan jumlah -4 maka Co harus bermuatan 2+ sehingga membentuk ion [Co(NH 3 ) 2 CI 4 ] 2- yang berikatan dengan K + 3. Dalam ion kompleks, ligan netral ditulis terlebih dahulu baru kemudian ligan anion, dan rumus untuk seluruh ion ditempatkan dalam tanda kurung. Contoh: pada senyawa K 2 [Co(NH 3 ) 2 CI 4 ], NH 3 merupakan molekul netral sehingga ditulis terlebih dahulu baru kemudian Cl - yang bermuatan negatif (anion) Sedangkan aturan untuk penamaan senyawa kompleks adalah: 1. Nama kation ditulis terlebih dahulu 2. Nama ligan ditulis berdasarkan urutan abjad dan ditulis sebelum nama ion logam 3. Untuk ligan netral ditulis dengan namanya sendiri kecuali beberapa molekul seperti air yang menjadi aqua, sedangkan untuk anion akhiran ida diganti menjadi o seperti klorida menjadi kloro. 4. Jumlah ligan ditulis sebelum nama ligan tersebut dengan penomoran yunani. 5. Bilangan oksidasi atom pusat ditulis dengan angka romawi di dalam kurung. 6. Jika ion kompleks merupakan anion, maka nama ion logam diakhiri dengan at. Contoh: K 2 [Co(NH 3 ) 2 CI 4 ] = kalium diamina tetra kloro kobaltat (II) [Co(NH3) 6 ]CI 3 = heksaamina kobalt (III) klorida Sebuah Sejarah Perspektif : Alfred Werner dan Teori Koordinasi Senyawa koordinasi telah diketahui sejak 200 tahun yang lalu, pertama kali ditemukan oleh seorang kimiawan muda asal Swiss Alfred Werner. Dia mengusulkan dua macam valensi, yaitu valensi primer adalah muatan positif pada ion logam yang harus disetarakan oleh ion negatif sehingga menemukan bilangan koordinasi dari susunan jumlah ligan dan valensi sekunder yang disebut bilangan koordinasi yang menunjukkan jumlah ligan terikat pada atom pusat.
4 Isomer dalam Senyawa Kompleks Isomer rumus kimia sama tetapi sifatnya berbeda Isomer struktur Isomer stereo isomer koordinasi Isomer linkage isomer geometri isomer optis terjadi ketika adanya pertukaran sebagian atau seluruh ligan ex: [Pt(NH 3 ) 4 Cl 2 ](NO 2 ) 2 da n [Pt(NH 3 ) 4 (NO 2 ) 2 ]Cl 2 Terbentuk ketika komposisi senyawa kompleks tetap tetapi keterkaitan donor ligan berubah. perbedaan letak atom atau gugus atom dalam ruang perbedaan arah pemutaran bidang polarisasi cahaya
5 Dasar Teori Ikatan dan Sifat Kompleks Aplikasi Ikatan Valensi pada Ion Kompleks Ligan pada ion kompleks menyumbangkan sepasang elektron untuk membentuk suatu ikatan kovalen dengan atom pusat. Jika suatu atom menyumbangkan sepasang elektron untuk digunakan bersama disebut sebagai ikatan kovalen koordinasi. Jenis dan jumlah orbital hibridisasi ion logam bergantung pada pasangan elektron bebas yang menentukan bentuk geometri ion kompleks. Beberapa contoh bentuk geometri dan hibridisasinya: 1. Oktahedral; biasanya ion kompleks yang memiliki hibridisasi d 2 sp 3 mempunyai bentuk geometri oktahedral. Keterangan gambar: hibridisasi dan bentuk geometri [Cr (NH 3 ) 6 ] Segiempat planar; ion kompleks dengan hibridisasi dsp 2 akan memiliki bentuk geometri ini. Keterangan gambar: hibridisasi dan bentuk geometri [Ni (CN) 4 ] 2-3. Tetrahedral; hibridisasi sp 3 dari ion kompleks akan memberikan bentuk geometri seperti ini.
6 Keterangan gambar: hibridisasi dan bentuk geometri [Zn (OH) 4 ] 2- Teori Bidang Kristal Teori bidang kristal menyempurnakan teori VB yang menjelaskan tentang bentuk dan ikatan dalam suatu senyawa tetapi tidak dapat memprediksikan warna koordinasi dan juga terkadang saja dapat dipakai untuk memprediksi tentang sifat kemagnetan senyawa, sedangkan teori bidang kristal hanya memberikan sedikit gambaran mengenai ikatan logam-ligan tetapi mampu menjelaskan tentang warna dan sifat kemagnetan dengan jelas. Warna; cahaya diserap dalam berbagai macam panjang gelombang yang akan menghasilkan berbagai macam spektrum warna, seperti yang tertera dalam tabel berikut: Penjelasan tentang warna pada logam transisi; warna senyawa koordinsi sangat beragam, hal ini dipengaruhi oleh perbedaan energi ( orbital set t 2g dan e g dalam ion kompleksnya. Dua hal yang dapat mempengaruhi warna senyawa: 1. Untuk ligan tertentu, warna tergantung pada kondisi oksidasi ion logamnya. 2. Dan untuk beberapa ligan lain, warna bergantung pada ligan itu sendiri.
7 Penjelasan tentang sifat kemagnetan pada logam transisi kompleks; sifat kemgnetan logam transisi deipengaruhi oleh jumlah elektron tidak berpasangan pada orbital d. Penempatan orbital dipengaruhi oleh satu dari dua cara berikut: 1. Ligan medan lemah dan kompleks spin tinggi Ligan medan lemah (seperti H 2 O) menyebabkan pemisahan energi kecil, sehingga hanya memakai energi yang lemah dari orbital d untuk berpindah ke set e g dan kemudian untuk berpasangan pada set t 2g. Dengan jumlah elektron tidak berpasangan maksimum ligan medan lemah membentuk komplek spin tinggi. 2. Ligan medan kuar dan kompleks spin rendah Karena ligan medan kuat (seperti CN - ) memerlukan energi yang lebih besar untuk berpindah ke set e g dan kemudian untuk berpasangan pada set t 2g, serta jumlah elektron tidak berpasangan pada ion kompleks lebih sedikit dibanding pada ion bebas sehingga menimbulkan kompleks spin yang rendah. Senyawa kompleks dengan bentuk geometri tetrahedral adalah contoh dari senyawa yang mempunyai kompleks spin yang tinggi, sedangkan untuk senyawa dengan bentuk geometri segiempat planar adalah contoh senyawa dengan kompleks spin yang rendah.
1.1 Senyawa Koordinasi (Coordination Coumpond)
 1.1 Senyawa Koordinasi (Coordination Coumpond) Sifat yang paling khas pada logam transisi adalah tentang persenyawaan dan ikatannya. Yang biasa disebut dengan ion kompleks. Ion kompleks sendiri terdiri
1.1 Senyawa Koordinasi (Coordination Coumpond) Sifat yang paling khas pada logam transisi adalah tentang persenyawaan dan ikatannya. Yang biasa disebut dengan ion kompleks. Ion kompleks sendiri terdiri
Senyawa Koordinasi. Ion kompleks memiliki ciri khas yaitu bilangan koordinasi, geometri, dan donor atom:
 Senyawa Koordinasi Terdiri dari atom pusat (kation logam transisi), ligan(molekul yang terikat pada ion kompleks) dan di netralkan dengan bilangan koordinasi. Dari gambar [Co(NH 3 )6]CI 3, 6 molekul NH3
Senyawa Koordinasi Terdiri dari atom pusat (kation logam transisi), ligan(molekul yang terikat pada ion kompleks) dan di netralkan dengan bilangan koordinasi. Dari gambar [Co(NH 3 )6]CI 3, 6 molekul NH3
8.4 Senyawa Kompleks
 8.4 Senyawa Kompleks Alfred Werner (1866-1919): kelompok baru senyawa logam transisi yang terdiri dari ion logam transisi (LT) yang dikelilingi oleh ion atau molekul yang lain. Ion atau molekul yang terikat
8.4 Senyawa Kompleks Alfred Werner (1866-1919): kelompok baru senyawa logam transisi yang terdiri dari ion logam transisi (LT) yang dikelilingi oleh ion atau molekul yang lain. Ion atau molekul yang terikat
SENYAWA KOMPLEKS. Definisi. Ion Kompleks. Bilangan koordinasi, geometri, dan ligan RINGKASAN MATERI
 KIMIA ANORGANIK 14 OKTOBER 2012 RINGKASAN MATERI SENYAWA KOMPLEKS Definisi Senyawa kompleks itu: Ada ion logam sebagai atom pusat Ada ligan yang berupa anion atau molekul netral Memiliki counter ion supaya
KIMIA ANORGANIK 14 OKTOBER 2012 RINGKASAN MATERI SENYAWA KOMPLEKS Definisi Senyawa kompleks itu: Ada ion logam sebagai atom pusat Ada ligan yang berupa anion atau molekul netral Memiliki counter ion supaya
Senyawa Koordinasi. Kompleks ion dengan pusat d B memiliki empat ligan dengan dengan bentuk persegi planar (B)
 Senyawa Koordinasi Aspek umum dari logam transisi adalah pembentukan dari senyawa koordinasi (kompleks). Senyawa koordinasi ini setidaknya memiliki satu ion kompleks yang terdiri dari logam kation yang
Senyawa Koordinasi Aspek umum dari logam transisi adalah pembentukan dari senyawa koordinasi (kompleks). Senyawa koordinasi ini setidaknya memiliki satu ion kompleks yang terdiri dari logam kation yang
COORDINATION COMPOUND. Disusun oleh : Bintang Ayu Kalimantini NIM : KELAS D 10.30
 COORDINATION COMPOUND Disusun oleh : Bintang Ayu Kalimantini NIM : 21030112120019 KELAS D 10.30 S enyawa kompleks ditemukan sekitar tahun 1890an oleh Alfred Werner. Senyawa kompleks terdiri dari setidaknya
COORDINATION COMPOUND Disusun oleh : Bintang Ayu Kalimantini NIM : 21030112120019 KELAS D 10.30 S enyawa kompleks ditemukan sekitar tahun 1890an oleh Alfred Werner. Senyawa kompleks terdiri dari setidaknya
SENYAWA KOORDINASI Putri Anjarsari, S.Si., M.Pd
 SENYAWA KOORDINASI Putri Anjarsari, S.Si., M.Pd putri_anjarsari@uny.ac.id Pengertian Senyawa Koordinasi Senyawa koordinasi adalah senyawa yang mengandung satu atau lebih ion kompleks dengan sejumlah kecil
SENYAWA KOORDINASI Putri Anjarsari, S.Si., M.Pd putri_anjarsari@uny.ac.id Pengertian Senyawa Koordinasi Senyawa koordinasi adalah senyawa yang mengandung satu atau lebih ion kompleks dengan sejumlah kecil
Bilangankoordinasi, bentukgeometri, danligandarisenyawakompleks
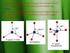 Senyawakoordinasi Senyawa koordinasi (coordination coumpounds) yang disebut juga kompleks adalah senyawa yang memiliki paling sedikit satu ion kompleks dengan kation sebagai pusat kompleks dan anion sebagailigan
Senyawakoordinasi Senyawa koordinasi (coordination coumpounds) yang disebut juga kompleks adalah senyawa yang memiliki paling sedikit satu ion kompleks dengan kation sebagai pusat kompleks dan anion sebagailigan
Bahasan. Senyawa Koordinasi. Bahasan. 1. Teori Werner tentang Senyawa Koordinasi : Tinjauan Ulang. Irwansyah, M.Si
 Bahasan Ion Kompleks dan 1 Teori Werner tentang Senyawa koordinasi : Tinjauan Ulang 2 Ligan 3 Tatanama 4 Isomerisasi 5 Ikatan dalam Ion Kompleks : Teori Medan Kristal 6 Sifat Magnet dan Teori Medan Kristal
Bahasan Ion Kompleks dan 1 Teori Werner tentang Senyawa koordinasi : Tinjauan Ulang 2 Ligan 3 Tatanama 4 Isomerisasi 5 Ikatan dalam Ion Kompleks : Teori Medan Kristal 6 Sifat Magnet dan Teori Medan Kristal
SENYAWA KOORDINASI Ion kompleks: Angka koordinasi, Geometri, dan Ligan
 SENYAWA KOORDINASI Keistimewaan dari ilmu kimia peralihan logam adalah rumus dari senyawa koordinasi (kompleks). Ada unsur yang berisi paling sedikit satu ion kompleks, yang terdiri dari satu atom pusat
SENYAWA KOORDINASI Keistimewaan dari ilmu kimia peralihan logam adalah rumus dari senyawa koordinasi (kompleks). Ada unsur yang berisi paling sedikit satu ion kompleks, yang terdiri dari satu atom pusat
Kimia Koordinasi Teori Ikatan Valensi
 Kimia Koordinasi Teori Ikatan Valensi Beberapa teori telah dirumuskan untuk menjelaskan ikatan dalam senyawaan koordinasi dan untuk merasionalisasi serta meramalkan sifat-sifatnya: teori ikatan valensi,
Kimia Koordinasi Teori Ikatan Valensi Beberapa teori telah dirumuskan untuk menjelaskan ikatan dalam senyawaan koordinasi dan untuk merasionalisasi serta meramalkan sifat-sifatnya: teori ikatan valensi,
Kegiatan Belajar 4 Kimia Unsur. Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada materi Kimia Unsur.
 1 Kegiatan Belajar 4 Kimia Unsur Capaian Pembelajaran Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada materi Kimia Unsur. Subcapaian pembelajaran: 1. Menjelaskan sifat unsur golongan
1 Kegiatan Belajar 4 Kimia Unsur Capaian Pembelajaran Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada materi Kimia Unsur. Subcapaian pembelajaran: 1. Menjelaskan sifat unsur golongan
Teori medan kristal adalah model yang hampir secara menyeluruh menggantikan teori ikatan valensi, pertama kali dimunculkan oleh Hans Bethe pada 1929.
 Teori Medan Kristal Teori medan kristal adalah model yang hampir secara menyeluruh menggantikan teori ikatan valensi, pertama kali dimunculkan oleh Hans Bethe pada 1929. Pada mulanya merupakan model yang
Teori Medan Kristal Teori medan kristal adalah model yang hampir secara menyeluruh menggantikan teori ikatan valensi, pertama kali dimunculkan oleh Hans Bethe pada 1929. Pada mulanya merupakan model yang
MODUL VI KIMIA KOORDINASI
 MODUL VI KIMIA KOORDINASI I. Petunjuk Umum 1. Kompetensi Dasar 1) Mahasiswa memahami definisi senyawa komplek 2) Mahasiswa memahami Teori Koordinasi Werner 3) Mahasiswa memahami jenis-jenis ligan 4) Mahasiswa
MODUL VI KIMIA KOORDINASI I. Petunjuk Umum 1. Kompetensi Dasar 1) Mahasiswa memahami definisi senyawa komplek 2) Mahasiswa memahami Teori Koordinasi Werner 3) Mahasiswa memahami jenis-jenis ligan 4) Mahasiswa
Bab 11 Senyawa Koordinasi
 Bab 11 http://chem.fmipa.ipb.ac.id Cisplatin (cis-pt(nh 3 ) 2 Cl 2 ) Cisplatin menghancurkan sel kanker untuk bereproduksi dengan mengubah konfigurasi DNAnya 1 Ikthisar Sumber: Chang Bab 20 1 Kimia Logam
Bab 11 http://chem.fmipa.ipb.ac.id Cisplatin (cis-pt(nh 3 ) 2 Cl 2 ) Cisplatin menghancurkan sel kanker untuk bereproduksi dengan mengubah konfigurasi DNAnya 1 Ikthisar Sumber: Chang Bab 20 1 Kimia Logam
I. PENDAHULUAN. Kualitas udara yang dipergunakan untuk kehidupan tergantung dari lingkungannya. Udara
 I. PENDAHULUAN 1.1 Latar Belakang Masalah Kualitas udara yang dipergunakan untuk kehidupan tergantung dari lingkungannya. Udara mengandung sejumlah oksigen, yang merupakan komponen esensial bagi kehidupan,
I. PENDAHULUAN 1.1 Latar Belakang Masalah Kualitas udara yang dipergunakan untuk kehidupan tergantung dari lingkungannya. Udara mengandung sejumlah oksigen, yang merupakan komponen esensial bagi kehidupan,
Ikatan Kimia. 2 Klasifikasi Ikatan Kimia :
 Ikatan Kimia Ikatan Kimia : Gaya tarik yang menyebabkan atom-atom yang terikat satu sama lain dalam suatu kombinasi untuk membentuk senyawa yang lebih kompleks. 2 Klasifikasi Ikatan Kimia : 1. Ikatan ion
Ikatan Kimia Ikatan Kimia : Gaya tarik yang menyebabkan atom-atom yang terikat satu sama lain dalam suatu kombinasi untuk membentuk senyawa yang lebih kompleks. 2 Klasifikasi Ikatan Kimia : 1. Ikatan ion
Kimia Koordinasi SOAL LATIHAN. Jawab soal sudah tersedia. Selesaikan soalnya, dan pelajari mengapa dipilih jawaban tersebut
 Kimia Koordinasi SOAL LATIHAN Jawab soal sudah tersedia. Selesaikan soalnya, dan pelajari mengapa dipilih jawaban tersebut 1. Suatu logam nickel dapat ditulis sebagai [Ar] 4s 2 3d 8, manakah representasi
Kimia Koordinasi SOAL LATIHAN Jawab soal sudah tersedia. Selesaikan soalnya, dan pelajari mengapa dipilih jawaban tersebut 1. Suatu logam nickel dapat ditulis sebagai [Ar] 4s 2 3d 8, manakah representasi
KIMIA. Sesi KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA. a. Sifat Umum
 KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 12 Sesi NGAN KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA Keteraturan sifat keperiodikan unsur dalam satu periode dapat diamati pada unsur-unsur periode
KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 12 Sesi NGAN KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA Keteraturan sifat keperiodikan unsur dalam satu periode dapat diamati pada unsur-unsur periode
! " "! # $ % & ' % &
 Valensi ! " "! # $ % & ' %& # % ( ) # *+## )$,) & -#.. Semua unsur memiliki bilangan oksidasi +1 Semua unsur memiliki bilangan oksidasi +2 Semua unsur memiliki bilangan oksidasi +3. Tl juga memiliki bilangan
Valensi ! " "! # $ % & ' %& # % ( ) # *+## )$,) & -#.. Semua unsur memiliki bilangan oksidasi +1 Semua unsur memiliki bilangan oksidasi +2 Semua unsur memiliki bilangan oksidasi +3. Tl juga memiliki bilangan
I. PENDAHULUAN. Pencemaran udara adalah masuknya, atau tercampurnya unsur-unsur berbahaya ke dalam
 I. PENDAHULUAN 1.1 Latar Belakang Masalah Pencemaran udara adalah masuknya, atau tercampurnya unsur-unsur berbahaya ke dalam atmosfir yang dapat mengakibatkan terjadinya kerusakan lingkungan, gangguan
I. PENDAHULUAN 1.1 Latar Belakang Masalah Pencemaran udara adalah masuknya, atau tercampurnya unsur-unsur berbahaya ke dalam atmosfir yang dapat mengakibatkan terjadinya kerusakan lingkungan, gangguan
kimia REVIEW I TUJUAN PEMBELAJARAN
 KTSP kimia K e l a s XI REVIEW I TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami teori atom mekanika kuantum dan hubungannya dengan bilangan
KTSP kimia K e l a s XI REVIEW I TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami teori atom mekanika kuantum dan hubungannya dengan bilangan
Ikatan kovalen koordinat adalah ikatan dimana elektronelektron yang dipakai bersama-sama hanya berasal dari satu atom.
 IKATAN KIMIA 1. Pada molekul CH 4 terdapat ikatan kovalen SEBAB paa tiap molekul CH 4 terdapat 4 atom hidrogen SMU/Ebtanas/Kimia/Tahun 1988 Ikatan Kovalen adalah ikatan kimia yang terjadi karena penggunaan
IKATAN KIMIA 1. Pada molekul CH 4 terdapat ikatan kovalen SEBAB paa tiap molekul CH 4 terdapat 4 atom hidrogen SMU/Ebtanas/Kimia/Tahun 1988 Ikatan Kovalen adalah ikatan kimia yang terjadi karena penggunaan
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB I STRUKTUR ATOM
 BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB I 1. Suatu partikel X memiliki 16 proton, 16 neutron, dan 18 elektron. Partikel tersebut dapat dikategorikan sebagai A. Anion X bermuatan -1
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB I 1. Suatu partikel X memiliki 16 proton, 16 neutron, dan 18 elektron. Partikel tersebut dapat dikategorikan sebagai A. Anion X bermuatan -1
Peranan elektron dalam pembentukan ikatan kimia
 IKATAN KIMIA IKATAN KIMIA Gaya yang memegangi atom atau ion membentuk molekul atau kristal disebut Ikatan Kimia. Elektron memegang peran penting dalam pembentukan ikatan kimia. Peranan elektron dalam pembentukan
IKATAN KIMIA IKATAN KIMIA Gaya yang memegangi atom atau ion membentuk molekul atau kristal disebut Ikatan Kimia. Elektron memegang peran penting dalam pembentukan ikatan kimia. Peranan elektron dalam pembentukan
Ikatan Kimia. Ikatan kimia adalah gaya tarik antar atom yang pemutusan atau pembentukannya menyebabkan terjadinya perubahan kimia.
 Ikatan Kimia 1. Ikatan Kimia 1.1 Pengertian Ikatan kimia adalah gaya tarik antar atom yang pemutusan atau pembentukannya menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam Ikatan Kimia Ikatan Ion:
Ikatan Kimia 1. Ikatan Kimia 1.1 Pengertian Ikatan kimia adalah gaya tarik antar atom yang pemutusan atau pembentukannya menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam Ikatan Kimia Ikatan Ion:
STRUKTUR MOLEKUL SEDERHANA
 STRUKTUR MOLEKUL SEDERHANA Oleh : Dr. Suyanta Ikatan ionik dibentuk oleh tarikan elekrostatik antara kation dan anion. Karena medan listrik suatu ion bersimetri bola, ikatan ion tidak memiliki karakter
STRUKTUR MOLEKUL SEDERHANA Oleh : Dr. Suyanta Ikatan ionik dibentuk oleh tarikan elekrostatik antara kation dan anion. Karena medan listrik suatu ion bersimetri bola, ikatan ion tidak memiliki karakter
TUGAS KIMIA ANORGANIK TEORI IKATAN VALENSI DAN HIBRIDISASI ORBITAL
 TUGAS KIMIA ANORGANIK TEORI IKATAN VALENSI DAN HIBRIDISASI ORBITAL ESTER ALNINTA BASA SIAGIAN (21030116140082) JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK SEMARANG 2016 A. DASAR TEORI IKATAN VALENSI Ikatan valensi
TUGAS KIMIA ANORGANIK TEORI IKATAN VALENSI DAN HIBRIDISASI ORBITAL ESTER ALNINTA BASA SIAGIAN (21030116140082) JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK SEMARANG 2016 A. DASAR TEORI IKATAN VALENSI Ikatan valensi
Ikatan yang terjadi antara atom O dengan O membentuk molekul O 2
 Ikatan Kovalen adalah ikatan yang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan. Ikatan kovalen terjadi akibat ketidakmampuan salah 1 atom yang akan berikatan untuk
Ikatan Kovalen adalah ikatan yang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan. Ikatan kovalen terjadi akibat ketidakmampuan salah 1 atom yang akan berikatan untuk
Aris Arianto. Guru Kimia di SMAN Madani Palu. STUDENT S BOOk
 STUDENT S BOOk Aris Arianto Guru Kimia di SMAN Madani Palu Website/blog penulis : Website : http://blendedlearningkimia.com Weblog : 1. http://www.arisarianto.web.id 2. http://arisarianto.wordpress.com
STUDENT S BOOk Aris Arianto Guru Kimia di SMAN Madani Palu Website/blog penulis : Website : http://blendedlearningkimia.com Weblog : 1. http://www.arisarianto.web.id 2. http://arisarianto.wordpress.com
kimia KONFIGURASI ELEKTRON
 K-13 Kelas X kimia KONFIGURASI ELEKTRON Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konfigurasi elektron kulit dan subkulit. 2. Menyelesaikan
K-13 Kelas X kimia KONFIGURASI ELEKTRON Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konfigurasi elektron kulit dan subkulit. 2. Menyelesaikan
COORDINATION COMPOUNDS
 COORDINATION COMPOUNDS Coordination Compounds (senyawa koordinasi) adalah senyawa yang mengandung paling tidak satu ion komplek, yang merupakan jenis kation logam pusat(baik pada logam transisi ataupun
COORDINATION COMPOUNDS Coordination Compounds (senyawa koordinasi) adalah senyawa yang mengandung paling tidak satu ion komplek, yang merupakan jenis kation logam pusat(baik pada logam transisi ataupun
LAPORAN PRAKTIKUM KIMIA ANORGANIK
 LAPORAN PRAKTIKUM KIMIA ANORGANIK Nama : Idatul Fitriyah NIM : 4301412036 Jurusan : Kimia Prodi : Pendidikan Kimia Dosen : Ella Kusumastuti Kelompok : 7 Tgl Praktikum : 21 Maret 2014 Kawan Kerja : 1. Izza
LAPORAN PRAKTIKUM KIMIA ANORGANIK Nama : Idatul Fitriyah NIM : 4301412036 Jurusan : Kimia Prodi : Pendidikan Kimia Dosen : Ella Kusumastuti Kelompok : 7 Tgl Praktikum : 21 Maret 2014 Kawan Kerja : 1. Izza
BAB I PENDAHULUAN. A. Latar Belakang
 BAB I PEDAHULUA A. Latar Belakang Senyawa kovalen koordinasi terbentuk antara ion logam yang memiliki orbital d yang belum terisi penuh (umumnya ion logam transisi) dengan ligan yang memiliki pasangan
BAB I PEDAHULUA A. Latar Belakang Senyawa kovalen koordinasi terbentuk antara ion logam yang memiliki orbital d yang belum terisi penuh (umumnya ion logam transisi) dengan ligan yang memiliki pasangan
LAPORAN LENGKAP PRAKTIKUM KIMIA ANORGANIK PERCOBAAN 3 PENENTUAN BILANGAN KOORDINAI KOMPLEKS TEMBAGA (II)
 LAPORAN LENGKAP PRAKTIKUM KIMIA ANORGANIK PERCOBAAN 3 PENENTUAN BILANGAN KOORDINAI KOMPLEKS TEMBAGA (II) OLEH : NAMA : IMENG NIM: ACC 109 011 KELOMPOK : 2 ( DUA ) HARI, TANGGAL : RABU, 8 JUNI 2011 ASISTEN
LAPORAN LENGKAP PRAKTIKUM KIMIA ANORGANIK PERCOBAAN 3 PENENTUAN BILANGAN KOORDINAI KOMPLEKS TEMBAGA (II) OLEH : NAMA : IMENG NIM: ACC 109 011 KELOMPOK : 2 ( DUA ) HARI, TANGGAL : RABU, 8 JUNI 2011 ASISTEN
I. PENDAHULUAN. senyawa kompleks bersifat sebgai asam Lewis sedangkan ligan dalam senyawa
 I. PENDAHULUAN A. Latar Belakang Senyawa kompleks merupakan senyawa yang memiliki warna yang khas yang diakibatkan oleh adanya unsur yang dari golongan transisi yang biasanya berperperan sebagai atom pusat
I. PENDAHULUAN A. Latar Belakang Senyawa kompleks merupakan senyawa yang memiliki warna yang khas yang diakibatkan oleh adanya unsur yang dari golongan transisi yang biasanya berperperan sebagai atom pusat
BAB 3 GEOMETRI DAN KEPOLARAN MOLEKUL
 GEOMETRI DAN KEPOLARAN MOLEKUL 3.1 PENGANTAR MENGENAI BENTUK MOLEKUL Bentuk molekul mengontrol sifat-sifat fisik maupun kimia molekul. Geometri elektron dan bentuk molekul ditentukan oleh orientasi semua
GEOMETRI DAN KEPOLARAN MOLEKUL 3.1 PENGANTAR MENGENAI BENTUK MOLEKUL Bentuk molekul mengontrol sifat-sifat fisik maupun kimia molekul. Geometri elektron dan bentuk molekul ditentukan oleh orientasi semua
kimia Kelas X REVIEW I K-13 A. Hakikat Ilmu Kimia
 K-13 Kelas X kimia REVIEW I Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami hakikat ilmu kimia dan metode ilmiah. 2. Memahami teori atom dan
K-13 Kelas X kimia REVIEW I Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami hakikat ilmu kimia dan metode ilmiah. 2. Memahami teori atom dan
~ gaya tarik antar atom yang pemutusan atau pembentukannya dapat menyebabkan terjadinya perubahan kimia.
 1. Ikatan Kimia Struktur Molekul 1.1 Pengertian ~ gaya tarik antar atom yang pemutusan atau pembentukannya dapat menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang
1. Ikatan Kimia Struktur Molekul 1.1 Pengertian ~ gaya tarik antar atom yang pemutusan atau pembentukannya dapat menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang
1. Ikatan Kimia. Struktur Molekul. 1.1 Pengertian. 1.2 Macam-Macam. ~ gaya tarik antar atom
 1. Ikatan Kimia 1.1 Pengertian ~ gaya tarik antar atom Struktur Molekul 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang terbentuk akibat tarik-menarik elektrostatik antara ion positif (kation) dan ion
1. Ikatan Kimia 1.1 Pengertian ~ gaya tarik antar atom Struktur Molekul 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang terbentuk akibat tarik-menarik elektrostatik antara ion positif (kation) dan ion
LATIHAN SOAL IKATAN KIMIA
 LATIHAN SOAL IKATAN KIMIA 1. Cara untuk mendapatkan ke stabilan atom unsur yang bernomor atom 10 adalah dengan a. Melepaskan dua elektron valensinya membentuk ion dengan muatan +2 b. Mengikat enam elektron
LATIHAN SOAL IKATAN KIMIA 1. Cara untuk mendapatkan ke stabilan atom unsur yang bernomor atom 10 adalah dengan a. Melepaskan dua elektron valensinya membentuk ion dengan muatan +2 b. Mengikat enam elektron
Bentuk Molekul. Langkah pertama menggambarkan molekulnya adalah dengan mengubah rumus molekul menjadi stuktur lewis molekulnya.
 Bentuk Molekul Langkah pertama menggambarkan molekulnya adalah dengan mengubah rumus molekul menjadi stuktur lewis molekulnya. 1. Menggunakan aturan oktet untuk menggambarkan struktur lewis a. Struktur
Bentuk Molekul Langkah pertama menggambarkan molekulnya adalah dengan mengubah rumus molekul menjadi stuktur lewis molekulnya. 1. Menggunakan aturan oktet untuk menggambarkan struktur lewis a. Struktur
Elektron maksimal: 2(3 2 ) = Elektron maksimal: 2(4 2 ) = 32 elektron = elektron terakhir: 2 golongan II A 10 sisa 10
 Struktur Atom Isotop: atom/ion yang memiliki jumlah proton (no atom) yang sama. Contoh: 17 Cl dan 17 Cl Isoton: atom/ion yang memiliki jumlah neutron (no massa-no atom) yang sama. Contoh: 14 6C dan 16
Struktur Atom Isotop: atom/ion yang memiliki jumlah proton (no atom) yang sama. Contoh: 17 Cl dan 17 Cl Isoton: atom/ion yang memiliki jumlah neutron (no massa-no atom) yang sama. Contoh: 14 6C dan 16
IKATAN KIMIA DAN GEOMETRI MOLEKUL
 IKATAN KIMIA DAN GEOMETRI MOLEKUL Sebagian besar unsur di alam tidak pernah dijumpai dalam atom bebas (kecuali gas mulia), namun dalam bentuk berikatan dengan atom yang sejenis maupun atom-atom yang lain.
IKATAN KIMIA DAN GEOMETRI MOLEKUL Sebagian besar unsur di alam tidak pernah dijumpai dalam atom bebas (kecuali gas mulia), namun dalam bentuk berikatan dengan atom yang sejenis maupun atom-atom yang lain.
TITRASI PEMBENTUKAN KOMPLEKS. Drs. DJADJAT TISNADJAJA, M.Tech.
 TITRASI PEMBENTUKAN KOMPLEKS Drs. DJADJAT TISNADJAJA, M.Tech. 1 Pendahuluan Salah satu tipe reaksi kimia yang berlaku sebagai dasar penentuan titrimetrik melibatkan pembentukan kompleks atau ion kompleks
TITRASI PEMBENTUKAN KOMPLEKS Drs. DJADJAT TISNADJAJA, M.Tech. 1 Pendahuluan Salah satu tipe reaksi kimia yang berlaku sebagai dasar penentuan titrimetrik melibatkan pembentukan kompleks atau ion kompleks
kimia Kelas X TABEL PERIODIK K-13
 K-13 Kelas X kimia TABEL PERIODIK Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami perkembangan sistem periodik unsur dan kelemahannya. 2. Menentukan
K-13 Kelas X kimia TABEL PERIODIK Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami perkembangan sistem periodik unsur dan kelemahannya. 2. Menentukan
SISTEM PERIODIK UNSUR
 SISTEM PERIODIK UNSUR Abad 18, baru 51 unsur diketahui (gas mulia belum ditemukan) John Newland (1864) : Penyusunan unsur-unsur berdasarkan kenaikan massa atom. Di alam ada 109 unsur, bagaimana penyusunan
SISTEM PERIODIK UNSUR Abad 18, baru 51 unsur diketahui (gas mulia belum ditemukan) John Newland (1864) : Penyusunan unsur-unsur berdasarkan kenaikan massa atom. Di alam ada 109 unsur, bagaimana penyusunan
KIMIA ANORGANIK II. Drs. Nofrizal, Jhon, M.Si. SENYAWA KOMPLEKS DAN HIBRIDISASI UNSUR TRANSISI (V dan Cr) Di susun oleh : Dosen pengampu :
 KIMIA ANORGANIK II SENYAWA KOMPLEKS DAN HIBRIDISASI UNSUR TRANSISI (V dan Cr) Dosen pengampu : Drs. Nofrizal, Jhon, M.Si Di susun oleh : ARDIAN FAZRI DEBBY MUTIARA ANANDA APRIADI WIDYA SULASTRI ZIERNA
KIMIA ANORGANIK II SENYAWA KOMPLEKS DAN HIBRIDISASI UNSUR TRANSISI (V dan Cr) Dosen pengampu : Drs. Nofrizal, Jhon, M.Si Di susun oleh : ARDIAN FAZRI DEBBY MUTIARA ANANDA APRIADI WIDYA SULASTRI ZIERNA
BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI
 BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI A. STANDAR KOMPETENSI Mendiskripsikan hukumhukum dasar kimia dan penerapannya dalam perhitungan kimia. B. Kompetensi Dasar : Menuliskan nama senyawa anorganik
BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI A. STANDAR KOMPETENSI Mendiskripsikan hukumhukum dasar kimia dan penerapannya dalam perhitungan kimia. B. Kompetensi Dasar : Menuliskan nama senyawa anorganik
LATIHAN SOAL IKATAN KIMIA
 LATIHAN SAL IKATAN KIMIA 1. Cara untuk mendapatkan kestabilan atom unsur yang bernomor atom 8 adalah dengan a. Melepaskan enam elektron muatan +6 b. Mengikat dua elektron dari atom lain menjadi ion dengan
LATIHAN SAL IKATAN KIMIA 1. Cara untuk mendapatkan kestabilan atom unsur yang bernomor atom 8 adalah dengan a. Melepaskan enam elektron muatan +6 b. Mengikat dua elektron dari atom lain menjadi ion dengan
C. Reaksi oksidasi reduksi berdasarkan peningkatan dan penurunan bilangan oksidasi. Bilangan Oksidasi (biloks)
 97 Nama : Kelompok : Mata Pelajaran : Kimia Kelas/Semester : X 5 /2 Alokasi Waktu : 2 x 45 menit. Materi pokok : Konsep Redoks Standar Kompetensi : 3. Memahami sifat-sifat larutan elektrolit dan non elektrolit
97 Nama : Kelompok : Mata Pelajaran : Kimia Kelas/Semester : X 5 /2 Alokasi Waktu : 2 x 45 menit. Materi pokok : Konsep Redoks Standar Kompetensi : 3. Memahami sifat-sifat larutan elektrolit dan non elektrolit
DAFTAR PUSTAKA. 1. Dra. Sukmriah M & Dra. Kamianti A, Kimia Kedokteran, edisi 2, Penerbit Binarupa Aksara, 1990
 DAFTAR PUSTAKA 1. Dra. Sukmriah M & Dra. Kamianti A, Kimia Kedokteran, edisi 2, Penerbit Binarupa Aksara, 1990 2. Drs. Hiskia Achmad, Kimia Unsur dan Radiokimia, Penerbit PT. Citra Aditya Bakti, 2001 3.
DAFTAR PUSTAKA 1. Dra. Sukmriah M & Dra. Kamianti A, Kimia Kedokteran, edisi 2, Penerbit Binarupa Aksara, 1990 2. Drs. Hiskia Achmad, Kimia Unsur dan Radiokimia, Penerbit PT. Citra Aditya Bakti, 2001 3.
BAB 2 STRUKTUR ATOM PERKEMBANGAN TEORI ATOM
 BAB 2 STRUKTUR ATOM PARTIKEL MATERI Bagian terkecil dari materi disebut partikel. Beberapa pendapat tentang partikel materi :. Menurut Democritus, pembagian materi bersifat diskontinyu ( jika suatu materi
BAB 2 STRUKTUR ATOM PARTIKEL MATERI Bagian terkecil dari materi disebut partikel. Beberapa pendapat tentang partikel materi :. Menurut Democritus, pembagian materi bersifat diskontinyu ( jika suatu materi
Bab V Ikatan Kimia. B. Struktur Lewis Antar unsur saling berinteraksi dengan menerima dan melepaskan elektron di kulit terluarnya. Gambaran terjadinya
 Bab V Ikatan Kimia Sebagian besar unsur yang ada di alam mempunyai kecenderungan untuk berinteraksi (berikatan) dengan unsur lain. Hal itu dilakukan karena unsur tersebut ingin mencapai kestabilan. Cara
Bab V Ikatan Kimia Sebagian besar unsur yang ada di alam mempunyai kecenderungan untuk berinteraksi (berikatan) dengan unsur lain. Hal itu dilakukan karena unsur tersebut ingin mencapai kestabilan. Cara
Persiapan UN 2018 KIMIA
 Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
Bab 10 Bentuk Bentuk Molekul
 Bab 10 Bentuk Bentuk Molekul 10.1 Menjelaskan Bentuk-Bentuk Molekul dan Ion Menurut Struktur Lewis Hal pertama yang dilakukan untuk mengetahui bentuk dari suatu molekul ialah dengan mengubah rumus suatu
Bab 10 Bentuk Bentuk Molekul 10.1 Menjelaskan Bentuk-Bentuk Molekul dan Ion Menurut Struktur Lewis Hal pertama yang dilakukan untuk mengetahui bentuk dari suatu molekul ialah dengan mengubah rumus suatu
BAB II A. KONSEP ATOM
 BAB II STRUKTURR DAN IKATAN ATOM BAB II STRUKTURR DAN IKATAN ATOM A. KONSEP ATOM Semua material tersusun oleh atom atom. Setiap atom terdiri dari inti atom(nukleus) dan elektron seperti ditunjukkann pada
BAB II STRUKTURR DAN IKATAN ATOM BAB II STRUKTURR DAN IKATAN ATOM A. KONSEP ATOM Semua material tersusun oleh atom atom. Setiap atom terdiri dari inti atom(nukleus) dan elektron seperti ditunjukkann pada
FAKULTAS TEKNIK UNIVERSITAS NEGERI YOGYAKARTA BAHAN AJAR KIMIA DASAR BAB II RUMUS KIMIA DAN TATANAMA
 No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 6 BAB II RUMUS KIMIA DAN TATANAMA A. Rumus Kimia Rumus kimia merupakan kumpulan lambang atom dengan komposisi tertentu. Rumus kimia terdiri dari
No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 6 BAB II RUMUS KIMIA DAN TATANAMA A. Rumus Kimia Rumus kimia merupakan kumpulan lambang atom dengan komposisi tertentu. Rumus kimia terdiri dari
Jurnal Kimia Indonesia
 Jurnal Kimia Indonesia Vol. 1 (1), 2006, h. 7-12 Sintesis Senyawa Kompleks K[Cr(C 2 O 4 ) 2 (H 2 O) 2 ].2H 2 O dan [N(n-C 4 H 9 ) 4 ][CrFe(C 2 O 4 ) 3 ].H 2 O Kiki Adi Kurnia, 1 Djulia Onggo, 1 Dave Patrick,
Jurnal Kimia Indonesia Vol. 1 (1), 2006, h. 7-12 Sintesis Senyawa Kompleks K[Cr(C 2 O 4 ) 2 (H 2 O) 2 ].2H 2 O dan [N(n-C 4 H 9 ) 4 ][CrFe(C 2 O 4 ) 3 ].H 2 O Kiki Adi Kurnia, 1 Djulia Onggo, 1 Dave Patrick,
CONTOH SOAL DAN PEMBAHASAN OLIMPIADE KIMIA UNIVERSITAS UDAYANA PETUNJUK PENGERJAAN SOAL OLIMPIADE KIMIA UNUVERSITAS UDAYANA XXII
 CONTOH SOAL DAN PEMBAHASAN OLIMPIADE KIMIA UNIVERSITAS UDAYANA PETUNJUK PENGERJAAN SOAL OLIMPIADE KIMIA UNUVERSITAS UDAYANA XXII Contoh soal dan pembahasan Olimpiade Kimia Universitas Udayana PETUNJUK
CONTOH SOAL DAN PEMBAHASAN OLIMPIADE KIMIA UNIVERSITAS UDAYANA PETUNJUK PENGERJAAN SOAL OLIMPIADE KIMIA UNUVERSITAS UDAYANA XXII Contoh soal dan pembahasan Olimpiade Kimia Universitas Udayana PETUNJUK
MODUL KIMIA SMA IPA Kelas 10
 SMA IPA Kelas Atom Bagian terkecil dari materi yang sudah tidak dapat dibagi lagi disebut atom (berasal dari bahasa Yunani atomos yang berarti tidak dapat dibagi lagi). Namun, berakhir pendapat tersebut
SMA IPA Kelas Atom Bagian terkecil dari materi yang sudah tidak dapat dibagi lagi disebut atom (berasal dari bahasa Yunani atomos yang berarti tidak dapat dibagi lagi). Namun, berakhir pendapat tersebut
(2) kekuatan ikatan yang dibentuk untuk karbon;
 Reaksi Subsitusi Nukleofilik Alifatik Reaksi yang berlangsung karena penggantian satu atau lebih atom atau gugus dari suatu senyawa oleh atom atau gugus lain disebut reaksi substitusi. Bila reaksi substitusi
Reaksi Subsitusi Nukleofilik Alifatik Reaksi yang berlangsung karena penggantian satu atau lebih atom atau gugus dari suatu senyawa oleh atom atau gugus lain disebut reaksi substitusi. Bila reaksi substitusi
Bilangan Kuantum Utama (n)
 Bilangan Kuantum Utama (n) Menyatakan nomer kulit tempat elektron berada atau bilangan ini juga menyatakan ukuran orbital/ jarak/ jari-jari atom. Dinyatakan dengan bilangan bulat positif. Mempunyai dua
Bilangan Kuantum Utama (n) Menyatakan nomer kulit tempat elektron berada atau bilangan ini juga menyatakan ukuran orbital/ jarak/ jari-jari atom. Dinyatakan dengan bilangan bulat positif. Mempunyai dua
Menggambarkan Molekul dan Ion dengan struktur Lewis Menggunakan Aturan Oktet untuk Menuliskan Struktur Lewis
 2012 Menggambarkan Molekul dan Ion dengan struktur Lewis Untuk menggambarkan suatu molekul bisa dengan cara merubah rumus molekul menjadi struktur lewis dengan aturan oktet. Menggunakan Aturan Oktet untuk
2012 Menggambarkan Molekul dan Ion dengan struktur Lewis Untuk menggambarkan suatu molekul bisa dengan cara merubah rumus molekul menjadi struktur lewis dengan aturan oktet. Menggunakan Aturan Oktet untuk
7) Diketahui 20 X dan 35 Y. Jika keduanya berikatan, tentukan: a. Jenis ikatannya? ikatan ion b. rumus senyawa yang terbentuk. c.
 Ikatan Kimia 1. Di antara spesi berikut yang memiliki konfigurasi stabil adalah : 1) 11 Na + (stabil) 2) 18 X (stabil) 3) 17 Y (stabil) 4) 20 Ca (tidak stabil) 5) 35 Br stabil) Tulis formula elektron masing-masing
Ikatan Kimia 1. Di antara spesi berikut yang memiliki konfigurasi stabil adalah : 1) 11 Na + (stabil) 2) 18 X (stabil) 3) 17 Y (stabil) 4) 20 Ca (tidak stabil) 5) 35 Br stabil) Tulis formula elektron masing-masing
Tabel Periodik. Bab 3a. Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr.
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Bab 3a Tabel Periodik Kapan unsur-unsur ditemukan? 8.1 1 ns 1 Konfigurasi elektron
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Bab 3a Tabel Periodik Kapan unsur-unsur ditemukan? 8.1 1 ns 1 Konfigurasi elektron
Ikatan kimia. 1. Peranan Elektron dalam Pembentukan Ikatan Kimia. Ikatan kimia
 Ikatan kimia 1. Peranan Elektron dalam Pembentukan Ikatan Kimia Ikatan kimia Gaya tarik menarik antara atom sehingga atom tersebut tetap berada bersama-sama dan terkombinasi dalam senyawaan. gol 8 A sangat
Ikatan kimia 1. Peranan Elektron dalam Pembentukan Ikatan Kimia Ikatan kimia Gaya tarik menarik antara atom sehingga atom tersebut tetap berada bersama-sama dan terkombinasi dalam senyawaan. gol 8 A sangat
BAB 10. Strukturr Lewis dan Bentuk Molekul
 BAB 10 Strukturr Lewis dan Bentuk Molekul Disusun Oleh : DHANY MIRNASARI (21030112120012) Dosen Pengampu : DR. ISTADI JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO SEMARANG 2012-2013 10.1
BAB 10 Strukturr Lewis dan Bentuk Molekul Disusun Oleh : DHANY MIRNASARI (21030112120012) Dosen Pengampu : DR. ISTADI JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO SEMARANG 2012-2013 10.1
Pembuatan Garam Kompleks dan Garam Rangkap.
 A. JUDUL PERCOBAAN Pembuatan Garam Kompleks dan Garam Rangkap. B. TUJUAN PERCOBAAN Mahasiswa diharapkan mampu mempelajari pembuatan dan sifat-sifat garam rangkap kupri ammonium sulfat dan garam kompleks
A. JUDUL PERCOBAAN Pembuatan Garam Kompleks dan Garam Rangkap. B. TUJUAN PERCOBAAN Mahasiswa diharapkan mampu mempelajari pembuatan dan sifat-sifat garam rangkap kupri ammonium sulfat dan garam kompleks
SINTESIS DAN KARAKTERISASI SENYAWA KOMPLEKS KOBALT(II) DENGAN BENZOKAIN
 SINTESIS DAN KARAKTERISASI SENYAWA KOMPLEKS KOBALT(II) DENGAN BENZOKAIN Disusun Oleh : MUHAMMAD RIZQON ARIFIANTO M0308045 SKRIPSI Diajukan untuk memenuhi sebagian persyaratan mendapatkan gelar Sarjana
SINTESIS DAN KARAKTERISASI SENYAWA KOMPLEKS KOBALT(II) DENGAN BENZOKAIN Disusun Oleh : MUHAMMAD RIZQON ARIFIANTO M0308045 SKRIPSI Diajukan untuk memenuhi sebagian persyaratan mendapatkan gelar Sarjana
ANALISIS SOAL ULANGAN HARIAN I. Total. Dimensi Proses Pengetahuan Kognitif Menerapkan Menganalisa (C4) 15 3,6,9,11,21 4,12,18,26 5,19,20,25
 ANALISIS SOAL ULANGAN HARIAN I Mata pelajaran Kimia Kelas/Semester XI IPA 1/1 Kisi Butir Soal ClassXI Mudah Sedang Susah C1 C2 and C3 C 4,5,6 Total Presentase 12% 56% 32% 100% Jumlah soal 3 14 8 25 Dimensi
ANALISIS SOAL ULANGAN HARIAN I Mata pelajaran Kimia Kelas/Semester XI IPA 1/1 Kisi Butir Soal ClassXI Mudah Sedang Susah C1 C2 and C3 C 4,5,6 Total Presentase 12% 56% 32% 100% Jumlah soal 3 14 8 25 Dimensi
D. 2 dan 3 E. 2 dan 5
 1. Pada suhu dan tekanan sama, 40 ml P 2 tepat habis bereaksi dengan 100 ml, Q 2 menghasilkan 40 ml gas PxOy. Harga x dan y adalah... A. 1 dan 2 B. 1 dan 3 C. 1 dan 5 Kunci : E D. 2 dan 3 E. 2 dan 5 Persamaan
1. Pada suhu dan tekanan sama, 40 ml P 2 tepat habis bereaksi dengan 100 ml, Q 2 menghasilkan 40 ml gas PxOy. Harga x dan y adalah... A. 1 dan 2 B. 1 dan 3 C. 1 dan 5 Kunci : E D. 2 dan 3 E. 2 dan 5 Persamaan
Contoh soal dan pembahasan Olimpiade Kimia Universitas Udayana PETUNJUK PENGERJAAN SOAL OLIMPIADE KIMIA UNUVERSITAS UDAYANA XXII
 Contoh soal dan pembahasan limpiade Kimia Universitas Udayana PETUNJUK PENGERJAAN SAL LIMPIADE KIMIA UNUVERSITAS UDAYANA XXII PETUNJUK A Jika tersedia lima pilihan A, B, C, D dan E, maka pilihlah salah
Contoh soal dan pembahasan limpiade Kimia Universitas Udayana PETUNJUK PENGERJAAN SAL LIMPIADE KIMIA UNUVERSITAS UDAYANA XXII PETUNJUK A Jika tersedia lima pilihan A, B, C, D dan E, maka pilihlah salah
Ringkasan BAB 10. Langkah-langkah penulisan struktur lewis untuk molekul dengan ikatan tunggal.
 Ringkasan BAB 10 1. Struktur lewis untuk molekul ikatan tunggal Langkah-langkah penulisan struktur lewis untuk molekul dengan ikatan tunggal. Langkah 1, tempatkan atom dari golongan yang lebih kecil ditengah
Ringkasan BAB 10 1. Struktur lewis untuk molekul ikatan tunggal Langkah-langkah penulisan struktur lewis untuk molekul dengan ikatan tunggal. Langkah 1, tempatkan atom dari golongan yang lebih kecil ditengah
ANALISIS SOAL UJIAN HARIAN KELAS XI BAB: TEORI ATOM MEKANIKA KUANTUM, BENTUK MOLEKUL, DAN GAYA ANTARMOLEKUL
 ANALISIS SOAL UJIAN HARIAN KELAS XI BAB: TEORI ATOM MEKANIKA KUANTUM, BENTUK MOLEKUL, DAN Petunjuk Umum : GAYA ANTARMOLEKUL Telitilah soal terlebih dahulu, perangkat soal terdiri dari 20 soal pilihan ganda
ANALISIS SOAL UJIAN HARIAN KELAS XI BAB: TEORI ATOM MEKANIKA KUANTUM, BENTUK MOLEKUL, DAN Petunjuk Umum : GAYA ANTARMOLEKUL Telitilah soal terlebih dahulu, perangkat soal terdiri dari 20 soal pilihan ganda
LAPORAN PRAKTIKUM KIMIA ANORGANIK II PERCOBAAN IV PENENTUAN KOMPOSISI ION KOMPLEKS
 LAPORAN PRAKTIKUM KIMIA ANORGANIK II PERCOBAAN IV PENENTUAN KOMPOSISI ION KOMPLEKS DISUSUN OLEH : NAMA : FEBRINA SULISTYORINI NIM : 09/281447/PA/12402 KELOMPOK : 3 (TIGA) JURUSAN : KIMIA FAKULTAS/PRODI
LAPORAN PRAKTIKUM KIMIA ANORGANIK II PERCOBAAN IV PENENTUAN KOMPOSISI ION KOMPLEKS DISUSUN OLEH : NAMA : FEBRINA SULISTYORINI NIM : 09/281447/PA/12402 KELOMPOK : 3 (TIGA) JURUSAN : KIMIA FAKULTAS/PRODI
BAB I PENDAHULUAN Latar Belakang
 BAB I PENDAHULUAN 1.1. Latar Belakang Logam-logam yang bernilai ekonomi sangat tinggi, diantaranya emas, perak, platina, dan paladium, dikenal sebagai logam-logam yang berharga. Platina sangat berguna
BAB I PENDAHULUAN 1.1. Latar Belakang Logam-logam yang bernilai ekonomi sangat tinggi, diantaranya emas, perak, platina, dan paladium, dikenal sebagai logam-logam yang berharga. Platina sangat berguna
1. Pendahuluan 2. Intermediate reaktif 3. Nukleofil and elektrofil 4. Tipe reaksi 5. Ions versus radicals
 1. Pendahuluan 2. Intermediate reaktif 3. Nukleofil and elektrofil 4. Tipe reaksi 5. Ions versus radicals TUJUAN INSTRUKSIONAL KHUSUS Setelah mengikuti kuliah pokok bahasan Reaktivitas dan Mekanisme, mahasiswa
1. Pendahuluan 2. Intermediate reaktif 3. Nukleofil and elektrofil 4. Tipe reaksi 5. Ions versus radicals TUJUAN INSTRUKSIONAL KHUSUS Setelah mengikuti kuliah pokok bahasan Reaktivitas dan Mekanisme, mahasiswa
BENTUK MOLEKUL CITRAWATI NUGRAHENI MINASTI Struktur Lewis dan Teori VSEPR. disusun oleh :
 BENTUK MOLEKUL Struktur Lewis dan Teori VSEPR disusun oleh : CITRAWATI NUGRAHENI MINASTI 21030112130045 TEKNIK KIMIA UNIVERSITAS DIPONEGORO 2012/2013 STRUKTUR LEWIS dan BENTUK MOLEKUL 10.1 Menggambarkan
BENTUK MOLEKUL Struktur Lewis dan Teori VSEPR disusun oleh : CITRAWATI NUGRAHENI MINASTI 21030112130045 TEKNIK KIMIA UNIVERSITAS DIPONEGORO 2012/2013 STRUKTUR LEWIS dan BENTUK MOLEKUL 10.1 Menggambarkan
PEMBUATAN PARTIKEL NIKEL DIMETILGLIOKSIM YANG HALUS DAN HOMOGEN
 PEMBUATAN PARTIKEL NIKEL DIMETILGLIOKSIM YANG HALUS DAN HOMOGEN I. TUJUAN Mempelajari cara mesintesis senyawa nikel dimetilglioksim yang halus dan homogen. II. TEORI Suatu ion atau molekul kompleks terdiri
PEMBUATAN PARTIKEL NIKEL DIMETILGLIOKSIM YANG HALUS DAN HOMOGEN I. TUJUAN Mempelajari cara mesintesis senyawa nikel dimetilglioksim yang halus dan homogen. II. TEORI Suatu ion atau molekul kompleks terdiri
Kimia Organik 1. Pertemuan ke 3 Indah Solihah
 Kimia Organik 1 Pertemuan ke 3 Indah Solihah Pembentukan Ikatan pada atom Fosfor Nomor atom fosfor (P) adalah 15 Tahap pembentukan ikatan : 1. Sebagian energi digunakan untuk hibridisasi, elektron pada
Kimia Organik 1 Pertemuan ke 3 Indah Solihah Pembentukan Ikatan pada atom Fosfor Nomor atom fosfor (P) adalah 15 Tahap pembentukan ikatan : 1. Sebagian energi digunakan untuk hibridisasi, elektron pada
TEORI IKATAN VALENSI
 TEORI IKATAN VALENSI Pembentukan ikatan kovalen dapat dijelaskan menggunakan dua teori yaitu teori ikatan valensi dan teori orbital molekul. Berdasarkan teori ikatan valensi, ikatan kovalen dapat terbentuk
TEORI IKATAN VALENSI Pembentukan ikatan kovalen dapat dijelaskan menggunakan dua teori yaitu teori ikatan valensi dan teori orbital molekul. Berdasarkan teori ikatan valensi, ikatan kovalen dapat terbentuk
Bab IV Hasil Penelitian dan Pembahasan. IV.1 Sintesis dan karaktrisasi garam rangkap CaCu(CH 3 COO) 4.6H 2 O
 Bab IV Hasil Penelitian dan Pembahasan IV.1 Sintesis dan karaktrisasi garam rangkap CaCu(CH 3 COO) 4.6H 2 O Garam rangkap CaCu(CH 3 COO) 4.6H 2 O telah diperoleh dari reaksi larutan kalsium asetat dengan
Bab IV Hasil Penelitian dan Pembahasan IV.1 Sintesis dan karaktrisasi garam rangkap CaCu(CH 3 COO) 4.6H 2 O Garam rangkap CaCu(CH 3 COO) 4.6H 2 O telah diperoleh dari reaksi larutan kalsium asetat dengan
Struktur Kristal Logam dan Keramik
 Struktur Kristal Logam dan Keramik 1. Selayang Pandang Muhammad Fauzi Mustamin [*] Jurusan Fisika, Universitas Hasanuddin Maret 2015 Material padat dapat diklasifikasi berdasarkan karakteristik atom atau
Struktur Kristal Logam dan Keramik 1. Selayang Pandang Muhammad Fauzi Mustamin [*] Jurusan Fisika, Universitas Hasanuddin Maret 2015 Material padat dapat diklasifikasi berdasarkan karakteristik atom atau
BENTUK-BENTUK MOLEKUL
 BENTUK-BENTUK MOLEKUL 10. 1. Menggambarkan Molekul dan Ion dengan Struktur Lewis Berikut adalah langkah-langkah dalam menggambarkan molekul dengan ikatan tunggal menggunakan struktur Lewis: 1) Letakkan
BENTUK-BENTUK MOLEKUL 10. 1. Menggambarkan Molekul dan Ion dengan Struktur Lewis Berikut adalah langkah-langkah dalam menggambarkan molekul dengan ikatan tunggal menggunakan struktur Lewis: 1) Letakkan
LOGO ANALISIS KUALITATIF KATION DAN ANION
 LOGO ANALISIS KUALITATIF KATION DAN ANION By Djadjat Tisnadjaja 1 Jenis analisis Analisis makro Kuantitas zat 0,5 1 g Volume yang dipakai sekitar 20 ml Analisis semimikro Kuatitas zat sekitar 0,05 g Volume
LOGO ANALISIS KUALITATIF KATION DAN ANION By Djadjat Tisnadjaja 1 Jenis analisis Analisis makro Kuantitas zat 0,5 1 g Volume yang dipakai sekitar 20 ml Analisis semimikro Kuatitas zat sekitar 0,05 g Volume
UNSUR-UNSUR TRANSISI PERIODE KE EMPAT : TEMBAGA
 Nama : Laurensius E. Seran NIM : 607332411998 UNSUR-UNSUR TRANSISI PERIODE KE EMPAT : TEMBAGA lah soal-soal berikut dengan cara menjodohkan dengan jawaban-jawaban yang telah disiapkan dikolom pilihan.
Nama : Laurensius E. Seran NIM : 607332411998 UNSUR-UNSUR TRANSISI PERIODE KE EMPAT : TEMBAGA lah soal-soal berikut dengan cara menjodohkan dengan jawaban-jawaban yang telah disiapkan dikolom pilihan.
STRUKTUR ATOM A. PENGERTIAN DASAR
 STRUKTUR ATOM A. PENGERTIAN DASAR 1. Partikel dasar : partikel-partikel pembentuk atom yang terdiri dari elektron, proton den neutron. 1. Proton : partikel pembentuk atom yang mempunyai massa sama dengan
STRUKTUR ATOM A. PENGERTIAN DASAR 1. Partikel dasar : partikel-partikel pembentuk atom yang terdiri dari elektron, proton den neutron. 1. Proton : partikel pembentuk atom yang mempunyai massa sama dengan
IKATAN KIMIA. RATNAWATI, S.Pd
 IKATAN KIMIA RATNAWATI, S.Pd Tujuan Pembelajaran Setelah mempelajari materi ini, diharapkan siswa dapat: Menjelaskan kecenderungan suatu unsur untuk mencapai kestabilannya Menggambarkan susunan elektron
IKATAN KIMIA RATNAWATI, S.Pd Tujuan Pembelajaran Setelah mempelajari materi ini, diharapkan siswa dapat: Menjelaskan kecenderungan suatu unsur untuk mencapai kestabilannya Menggambarkan susunan elektron
BAB I P ENDAHULUAN A. Latar Belakang Masalah
 BAB I P ENDAHULUAN A. Latar Belakang Masalah Tembaga dalam tubuh manusia mempunyai peranan yang sangat penting, walaupun dalam jumlah yang sedikit (Caret, R.L.; Denniston,K.J.; Topping, J.J., 1993 : 61).
BAB I P ENDAHULUAN A. Latar Belakang Masalah Tembaga dalam tubuh manusia mempunyai peranan yang sangat penting, walaupun dalam jumlah yang sedikit (Caret, R.L.; Denniston,K.J.; Topping, J.J., 1993 : 61).
Komponen Materi. Kimia Dasar 1 Sukisman Purtadi
 Komponen Materi Kimia Dasar 1 Sukisman Purtadi Pengamatan ke Arah Pandangan Atomik Materi Konservasi Massa Komposisi Tetap Perbandingan Berganda Teori Atom Dalton Bagaimana Teori Dalton Menjelaskan Hukum
Komponen Materi Kimia Dasar 1 Sukisman Purtadi Pengamatan ke Arah Pandangan Atomik Materi Konservasi Massa Komposisi Tetap Perbandingan Berganda Teori Atom Dalton Bagaimana Teori Dalton Menjelaskan Hukum
Ikatan Kimia II: VSEPR dan prediksi geometri Molekular, teori ikatan valensi dan Hibridisasi Orbital Atom; teori orbital atom
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Chapter 3c Ikatan Kimia II: VSEPR dan prediksi geometri Molekular, teori ikatan
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Chapter 3c Ikatan Kimia II: VSEPR dan prediksi geometri Molekular, teori ikatan
Kimia Koordinasi Pendahuluan
 Kimia Koordinasi Pendahuluan Senyawaan Koordinasi umumnya terdiri dari satu atom logam atau ion dan setidaknya satu ligand (atom, ion atau molekul) yang dapat dilihat sebagai donor elektron bagi logam
Kimia Koordinasi Pendahuluan Senyawaan Koordinasi umumnya terdiri dari satu atom logam atau ion dan setidaknya satu ligand (atom, ion atau molekul) yang dapat dilihat sebagai donor elektron bagi logam
TITRASI KOMPLEKSOMETRI
 TITRASI KOMPLEKSOMETRI I. TUJUAN a. Menstandarisasi EDTA dengan larutan ZnSO 4 b. Menentukan konsentrasi larutan Ni 2+ c. Memahami prinsip titrasi kompleksometri II. TEORI Titrasi kompleksometri adalah
TITRASI KOMPLEKSOMETRI I. TUJUAN a. Menstandarisasi EDTA dengan larutan ZnSO 4 b. Menentukan konsentrasi larutan Ni 2+ c. Memahami prinsip titrasi kompleksometri II. TEORI Titrasi kompleksometri adalah
wanibesak.wordpress.com 1 TEORI VSEPR DAN GEOMETRI MOLEKUL
 TEORI VSEPR DAN GEOMETRI MOLEKUL Geometri molekul atau sering disebut struktur molekul atau bentuk molekul yaitu gambaran tiga dimensi dari suatu molekul yang ditentukan oleh jumlah ikatan dan besarnya
TEORI VSEPR DAN GEOMETRI MOLEKUL Geometri molekul atau sering disebut struktur molekul atau bentuk molekul yaitu gambaran tiga dimensi dari suatu molekul yang ditentukan oleh jumlah ikatan dan besarnya
STRUKTUR LEWIS DAN BENTUK MOLEKUL (BAB 10)
 TUGAS RESUME STRUKTUR LEWIS DAN BENTUK MOLEKUL (BAB 10) Di susun oleh : Usya Rahmatika (21030112120015) Kelas B FAKULTAS TEKNIK JURUSAN TEKNIK KIMIA UNIVERSITAS DIPONEGORO SEMARANG 10.1 MENGGAMBARKAN BENTUK
TUGAS RESUME STRUKTUR LEWIS DAN BENTUK MOLEKUL (BAB 10) Di susun oleh : Usya Rahmatika (21030112120015) Kelas B FAKULTAS TEKNIK JURUSAN TEKNIK KIMIA UNIVERSITAS DIPONEGORO SEMARANG 10.1 MENGGAMBARKAN BENTUK
IKATAN KIMIA MAKALAH KIMIA DASAR
 IKATAN KIMIA MAKALAH KIMIA DASAR dibuat sebagai salah satu syarat untuk memperoleh nilai mata kuliah kimia dasar Oleh : AZKA WAFI EL HAKIM ( NPM : 301014000 ) HELGA RACHEL F ( NPM : 3010140014 ) MUHAMMAD
IKATAN KIMIA MAKALAH KIMIA DASAR dibuat sebagai salah satu syarat untuk memperoleh nilai mata kuliah kimia dasar Oleh : AZKA WAFI EL HAKIM ( NPM : 301014000 ) HELGA RACHEL F ( NPM : 3010140014 ) MUHAMMAD
LEMBARAN SOAL 6. Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA )
 LEMBARAN SOAL 6 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
LEMBARAN SOAL 6 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
KROMATOGRAFI PENUKAR ION Ion-exchange chromatography
 KROMATOGRAFI PENUKAR ION Ion-exchange chromatography Merupakan pemisahan senyawa senyawa polar dan ion berdasarkan muatan Dapat digunakan untk hampir semua molekul bermuatan termasuk proteins, nucleotides
KROMATOGRAFI PENUKAR ION Ion-exchange chromatography Merupakan pemisahan senyawa senyawa polar dan ion berdasarkan muatan Dapat digunakan untk hampir semua molekul bermuatan termasuk proteins, nucleotides
LEMBAR KEGIATAN SISWA (LKS) IKATAN KOVALEN. 1. Menjelaskan proses terbentuknya ikatan kovalen tunggal, rangkap dua, dan rangkap tiga.
 LEMBAR KEGIATAN SISWA (LKS) IKATAN KOVALEN Kelompok :... Nama Siswa :... Indikator : 1. Menjelaskan proses terbentuknya ikatan kovalen tunggal, rangkap dua, dan rangkap tiga. 2. Menjelaskan proses terbentuknya
LEMBAR KEGIATAN SISWA (LKS) IKATAN KOVALEN Kelompok :... Nama Siswa :... Indikator : 1. Menjelaskan proses terbentuknya ikatan kovalen tunggal, rangkap dua, dan rangkap tiga. 2. Menjelaskan proses terbentuknya
