SENYAWA KOMPLEKS. Definisi. Ion Kompleks. Bilangan koordinasi, geometri, dan ligan RINGKASAN MATERI
|
|
|
- Ida Kusnadi
- 7 tahun lalu
- Tontonan:
Transkripsi
1 KIMIA ANORGANIK 14 OKTOBER 2012 RINGKASAN MATERI SENYAWA KOMPLEKS Definisi Senyawa kompleks itu: Ada ion logam sebagai atom pusat Ada ligan yang berupa anion atau molekul netral Memiliki counter ion supaya senyawa dapat dinetralkan Senyawa kompleks adalah senyawa yang mengandung paling tidak satu ion kompleks. Ion kompleks terdiri dari satu atom pusat(central metal cation) berupa logam transisi ataupun logam pada golongan utama, yang mengikat anion atau molekul netral yang disebut ligan (ligands). Agar senyawa kompleks dapat bermuatan netral, maka ion kompleks dari senyawa tersebut, akan bergabung dengan ion lain yang disebut counter ion. Jika ion kompleks bermuatan positif, maka counter ion pasti akan bermuatan negative dan sebaliknya. Gambar 23.9 susunan dari senyawa kompleks Ion Kompleks Bilangan koordinasi, geometri, dan ligan Ion kompleks dideskripsikan sebagai ion logam dan beberapa jenis ligan yang terikat olehnya. Struktur dari ion kompleks tergantung dari 3 karakteristik, yaitu bilangan koordinasi, geometri dan banyaknya atom penyumbang setiap ligan: PAGE 1 OF 10
2 Bilangan koordinasi Bilangan koordinasi adalah jumlah dari ligan-ligan yang terikat langsung oleh atom pusat. Bilangan koordinasi dari Co 3+ dalam senyawa [Co(NH 3 ) 6 ] 3+ adalah 6, karena enam atom ligan (N dari NH 3 ) terikat oleh atom pusat yaitu Co 3+. Umumnya, bilangan koordinasi yang paling sering muncul adalah 6, tetapi terkadang bilangan koordinasi 2 dan 4 juga dapat muncul dan tidak menutup kemungkinan bilangan yang lebih besar pun bisa muncul. Geometri Bentuk (geometri) dari ion kompleks tergantung pada bilangan koordinasi dan ion logam itu sendiri. Tabel 23.6 memperlihatkan bahwa geometri ion kompleks tergantung pada bilangan koordinasinya 2, 4, dan 6, dengan beberapa contohnya. Sebuah ion kompleks yang mana ion logamnya memiliki bilangan koordinasi 2, seperti [Ag (NH 3 ) 2 ] +, memiliki bentuk yang linier. Tabel 23.6 Bilangan Koordinasi dan Bentuk dari beberapa ion kompleks Atom penyumbang(donor atom) Ligan-ligan dari ion kompleks merupakan anion ataupun molekul netral yang menyumbang satu atau lebih atomnya untuk berikatan dengan ion logam sebagai atom pusat dengan ikatan kovalen. Ligan dikelompokkan berdasarkan jumlah dari atom penyumbangnya (donor atoms). Monodentat, bidentat dan polidentat. Ligan monodentat seperti Cl - dan NH 3 dapat menyumbang satu atomnya untuk berikatan. Ligan bidentat dapat menyumbang dua atomnya dan ligan polidentat dapat menyumbang lebih dari dua atomnya. Tabel 23.7 Beberapa ligan dalam senyawa kompleks PAGE 2 OF 10
3 Menentukan Rumus dan Nama dari Senyawa Kompleks Hal yang penting diingat dalam menuliskan rumus dari senyawa kompleks adalah: 1 Kation ditulis terlebih dahulu baru anion Contohnya, dalam penamaan [Co(NH 3 ) 4 Cl 2 ]Cl, kita menamakan kation [Co(NH 3 ) 4 Cl 2 ] + dahulu sebelum anion Cl -, sehingga namanya tetraamindiklorokobalt(iii) klorida 2 Dalam ion kompleks, ligan harus diberi nama terlebih dahulu menurut urutan abjad, sebelum ion logamnya. Contohnya dalam ion [Co(NH 3 ) 4 Cl 2 ] +, 4 ligan NH 3 dan 2 ligan Cl - diberi nama dahulu sebelum ion logamnya, seperti penamaan pada contoh pertama 3 Penamaan dari ligan. Jika ligan tersebut merupakan anion, maka pada akhir kata diberi imbuhan o. contohnya jika ligannya F - maka diberi nama fluoro. Jika ligan berupa molekul netral, maka ada penamaan khusus yang harus diingat Jumlah dari ligan dapat ditulis dengan imbuhan di-, tri-,tetra-,penta- dll Biloks dari atom pusat ditunjukkan dengan bilangan romawi, jika atom pusat tersebut memiliki bi loks lebih dari satu. Seperti pada contoh pertama Jika ion kompleks berupa anion, maka ion logam sebagai atom pusat, diberi imbuhan at pada akhir kata. Sedangkan jika ion kompleks berupa kation, maka ion logam ditulis dalam bahasa Indonesia CONTOH Tentukan nama dari senyawa Na 3 [AlF 6 ]! Dalam senyawa tersebut mengandung Na + sebagai counter ion, dan [AlF 6 ] 3- sebagai anion kompleks. Anion kompleks tsb memiliki enam(hexa-) ion F - (fluoro) sebagai ligan, jadi kita menamakannya heksafluoro. Ion kompleks berupa anion, jadi ion logam harus diberi imbuhan at menjadi aluminat, sehingga menjadi heksafluoroaluminat. Aluminium hanya memiliki 1 biloks sehingga tidak memerlukan romawi. Counter ion positif diberi nama dahulu baru ion kompleksnya, sehingga nama senyawa dari Na 3 [AlF 6 ] adalah natrium heksafluoroaluminat. PAGE 3 OF 10
4 Sejarah: Alfred Werner dan Teori Koordinasi Zat yang sekarang kita sebut senyawa koordinasi telah dikenal selama hampir 200 tahun ketika kimiawan muda Swiss Alfred Werner mulai mempelajarinya pada tahun 1980-an. Dia menyelidiki serangkaian senyawa seperti kobalt, ditunjukkan pada Tabel di dalam tabel semua mengandung satu ion kobalt(iii), tiga ion kloridadan sejumlah molekul ammonia. Pada saat itu tidak ada teori yang dapat menjelaskan bagaimana senyawa dengan rumus kimia yang mirip bahkan sama persis, dapat memiliki sifat yang berbeda-beda. Setelah dilakukan eksperimen oleh werner ternyata mucul gagasan baru dari werner. Werner mengusulkan suatu ide kompleks koordinasi. Kompleks koordinasi memiliki atom pusat dikelilingi oleh molekul atau anion yang berikatan secara kovalen dengan jumlah yang tetap. Kompleks koordinasi bisa dalam keadaan netral atau bermuatan. Untuk membentuk netral maka kompleks harus bergabung dengan counter ion. Dalam gagasannya werner juga mengusulkan dua jenis valensi, valensi primer dan valensi sekunder. Valensi primer dikenal dengan biloks atom pusat sedangkan valensi sekunder dikenal dengan bilangan koordinasi. Padahal werner adalah seorang ahli kimia organik, namun dia sangat berjasa dibidang anorganik terutama senyawa kompleks. Maka, atas jasanya itulah werner mendapat penghargaan nobel pada tahun 1913 PAGE 4 OF 10
5 Isomerisasi dalam Senyawa Kompleks Isomer struktur Dua senyawa yang memiliki rumus kimia yang sama, tetapi dihubungkan dengan atom yang berbeda disebut isomer struktur. Senyawa kompleks memiliki dua jenis isomer struktur yakni isomer koordinasi (posisi) dan isomer rantai Isomer koordinasi, terjadi pada saat susunan dari ion kompleks berubah tetapi senyawanya tetap. Isomer ini terjadi ketika ligan dan counter ion saling bertukar posisi, seperti pada [Pt(NH 3 ) 4 Cl 2 ](NO 2 ) 2 dan [Pt(NH 3 ) 4 (NO 2 ) 2 ]Cl 2 Isomer rantai, terjadi ketika susunan dari ion kompleks tetap sama namun terikat pada ligan dengan atom penyumbang (donor atom) yang berbeda. Beberapa ligan dapat berikatan dengan ion logam dengan 2 atom penyumbang (donor atom). Contohnya ion nitrit dapat berikatan dengan pasangan atom N tunggal ( nitro, O 2 N: ) atau dengan atom O ( nitrito, ONO: ) sehingga membentuk isomer rantai. [Co(NH 3 ) 5 (NO 2 )]Cl 2 dan [Co (NH 3 ) 5 (ONO)]Cl 2 Isomer ruang (stereoisomers) Isomer ruang (stereoisomers) adalah senyawa yang memiliki ikatan antar atom yang sama tetapi letaknya berbeda dalam dimensi ruang. Isomer ruang terbagi dari 2 jenis yaitu isomer geometri dan isomer optic PAGE 5 OF 10
6 1 Isomer geometri (cis-trans isomers), terjadi jika atom atau sekelompok atom disusun berbeda dalam ruang relatif terhadap ion logamnya. Contohnya [Pt (NH 3 ) 2 Cl 2 ] dapat mempunya 2 isomer geometri, isomer yang pertama, ligan yang sama saling berhadapan dalam satu sisi dinamakan cis-diaminadikloroplatina (II), sedangkan isomer kedua, ligan yang sama saling bersebrangan dinamakan trans- diaminadikloroplatina(ii) 2 Isomer optic, terjadi ketika sebuah molekul dan bayangannya tidak dapat saling tumpang tindih. Ion kompleks yang berbentuk octahedral memiliki banyak isomer optic, ini bisa ditunjukkan dengan merotasikan satu isomernya dan melihat apakah dapat saling tumpang tindih dengan isomer yang lainnya (bayangannya). PAGE 6 OF 10
7 Dasar Teori untuk Pembentukan Ikatan dan Sifat dari Kompleks Penerapan Teori Ikatan Valensi Pada Ion Kompleks Teori ikatan valensi, sangat membantu dalam menjelaskan pembentukan ikatan dan struktur dalam golongan utama. Ikatan valensi ini juga berguna untuk menjelaskan pembentukan ikatan pada ion kompleks. Pada pembentukan ion kompleks, orbital dari ligan yang telah terisi, elektronnya berhibridisasi (overlap) ke orbital ion logam yang masih kosong. Ligan menyumbang pasangan electron bebasnya(basa lewis) untuk diterima oleh ion logam(asam lewis) untuk membentuk satu ikatan kovalen dari ion kompleks. Pada umumnya, untuk senyawa kompleks, jenis hibridisasi pada ion logam(atom pusat) akan menentukan bentuk(geometri) dari ion kompleks tersebut. OKTAHEDRAL Ion heksaaminkrom(iii), [Cr(NH 3 ) 6 ] 3+, menggambarkan penerapan dari teori ikatan valensi untuk kompleks berbentuk octahedral. Enam orbital Cr 3+ yang belum terisi (2 orbital 3d, 1 orbital 4s, 3 orbital 4p) akan bergabung membentuk orbital d 2 sp 3 dengan tingat energy yang sama, kemudian 6 molekul NH 3 memberikan masing-masing satu elektronnya untuk mengisi orbital yang masih kosong. Electron dari orbital 3d yang tidak berpasangan akan membuat ion kompleks menjadi paramagnetic SEGI EMPAT DATAR Ion logam dengan orbital d 8 biasanya akan membentuk ion kompleks berbentuk segi empat datar. Contohnya dalam ion [Ni(CN) 4 ] orbital 3d, 1 orbital 4s, dan 2 orbital 4p dalam Ni 2+ akan bergabung membentuk empat orbital dsp 2. Di dalam orbital d 8 dari Ni 2+, terdapat dua orbital yang setengah penuh, untuk membentuk hibridisasi dsp 2, maka electron dari salah satu orbital akan mengisi orbital lainnya dan membiarkan satu orbital kosong. Orbital kosong ini akan bergabung dengan orbital 4s dan 4p membentuk dsp 2. Sifat dari ion kompleks ini adalah diamagnetic karena semua TETRAHEDRAL Ion logam yang mempunyai subkulit d yang terisi penuh, seperti Zn 2+, biasanya akan membentuk kompleks tetrahedral. Contohnya ion [Zn(OH) 4 ] orbital 4s dan 3 orbital 4p dalam Zn 2+ berhibridisasi membentuk empat orbital sp 3. PAGE 7 OF 10
8 Teori Medan Kristal Teori medan kristal (Bahasa Inggris: Crystal Field Theory), disingkat CFT, adalah sebuah model yang menjelaskan struktur elektronik dari senyawa logam transisi yang semuanya dikategorikan sebagai kompleks koordinasi. CFT berhasil menjelaskan beberapa sifat-sifat magnetik, warna, entalpi hidrasi, dan struktur spinel senyawa kompleks dari logam transisi, namun ia tidak ditujukan untuk menjelaskan ikatan kimia Pemisahan Orbital d (splitting) Diagram energy dari orbital menunjukkan bahwa semua orbital d memiliki energy yang lebih tinggi dalam bentuk kompleks dibandingkan dalam bentuk keadaan bebas. Ini disebabkan gaya tolak menolak dari ligan yang saling berdekatan. Tetapi, akan terjadi pemisahan energy orbital, antara 2 orbital d yang memiliki energy yang lebih tinggi dengan dengan 3 orbital lainnya. Orbital yang lebih tinggi dinamakan orbital e g, dan orbital yang lebih rendah dinamakan orbital t 2g Pemisahan energy dalam orbital ini disebut efek medan Kristal, dan perbedaan energy antara e g dan t 2g disebut energy pemisahan. Energy pemisahan ini dipengaruhi oleh ligan. Semakin kuat ligan, maka energy pemisahan semakin besar dan sebaliknya. Besarnya energy pemisahan ini yang nantinya akan mempengaruhi warna dan sifat magnetic dari kompleks PAGE 8 OF 10
9 Warna kompleks logam transisi Warna-warna cerah yang terlihat pada kebanyakan senyawa koordinasi dapat dijelaskan dengan teori medan kristal ini. Jika orbital-d dari sebuah kompleks berpisah menjadi dua kelompok seperti yang dijelaskan di atas, maka ketika molekul tersebut menyerap foton dari cahaya tampak, satu atau lebih elektron yang berada dalam orbital tersebut akan meloncat dari orbital-d yang berenergi lebih rendah ke orbital-d yang berenergi lebih tinggi, menghasilkan keadaam atom yang tereksitasi. Perbedaan energi antara atom yang berada dalam keadaan dasar dengan yang berada dalam keadaan tereksitasi sama dengan energi foton yang diserap dan berbanding terbalik dengan gelombang cahaya. Karena hanya gelombang-gelombang cahaya (λ) tertentu saja yang dapat diserap (gelombang yang memiliki energi sama dengan energi eksitasi), senyawa-senyawa tersebut akan memperlihatkan warna komplementer (gelombang cahaya yang tidak terserap) Sifat magnetic dari ion kompleks Ion kompleks memiliki sifat magnetik. Sifat magnetik ini disebabkan adanya subkulit d yang tidak terisi penuh pada ion pusatnya. Ion kompleks yang memiliki elektron yang tidak berpasangan pada diagram pemisahannya bersifat paramagnetik dan dapat ditarik oleh medan magnet. Sedangkan ion kompleks yang memiliki elektron berpasangan pada diagram pemisahannya bersifat diamagnetik dan dapat ditolak oleh medan magnet. PAGE 9 OF 10
10 KESIMPULAN Senyawa kompleks terdiri dari ion kompleks dan counter ion pembuat netral. Ion kompleks mempunyai atom pusat yang mengikat ligan berupa molekul netral atau anion dimana memiliki satu atau lebih atom penyumbang untuk berpasangan. Bentuk senyawa kompleks yang paling sering dijumpai adalah octahedral. Rumus kimia dan penamaan dari senyawa kompleks mengikuti aturan yang ditetapkan. Alfred Werner adalah orang yang pertama kali menemukan struktur dari senyawa kompleks. Senyawa kompleks dapat memperlihatkan fenomena isomerisasi, bisa berupa stereoisomer ataupun constitutional isomers. Teori medan Kristal menjelaskan warna dan sifat kemagnetan dari kompleks. Karena dipengaruhi oleh ligan-ligan disekitarnya, energy pada orbital d terpisah. Besarnya energy pemisahan tergantung dari ion logam dan kekuatan dari ligannya. Semakin kuat ligannya maka semakin besar energy pemisahannya dan sebaliknya AHMAD ANDIKA HIMAWAN Teknik Kimia UNDIP rici.blackmoore@gmail.com PAGE 10 OF 10
1.1 Senyawa Koordinasi (Coordination Coumpond)
 1.1 Senyawa Koordinasi (Coordination Coumpond) Sifat yang paling khas pada logam transisi adalah tentang persenyawaan dan ikatannya. Yang biasa disebut dengan ion kompleks. Ion kompleks sendiri terdiri
1.1 Senyawa Koordinasi (Coordination Coumpond) Sifat yang paling khas pada logam transisi adalah tentang persenyawaan dan ikatannya. Yang biasa disebut dengan ion kompleks. Ion kompleks sendiri terdiri
Senyawa Koordinasi (senyawa kompleks)
 Senyawa Koordinasi (senyawa kompleks) Salah satu keistimewaan logam transisi adalah dapat membentuk senyawa klompeks, yaitu senyawa yang paling sedikit terdiri dari satu ion kompleks (terdiri dari kation
Senyawa Koordinasi (senyawa kompleks) Salah satu keistimewaan logam transisi adalah dapat membentuk senyawa klompeks, yaitu senyawa yang paling sedikit terdiri dari satu ion kompleks (terdiri dari kation
Senyawa Koordinasi. Ion kompleks memiliki ciri khas yaitu bilangan koordinasi, geometri, dan donor atom:
 Senyawa Koordinasi Terdiri dari atom pusat (kation logam transisi), ligan(molekul yang terikat pada ion kompleks) dan di netralkan dengan bilangan koordinasi. Dari gambar [Co(NH 3 )6]CI 3, 6 molekul NH3
Senyawa Koordinasi Terdiri dari atom pusat (kation logam transisi), ligan(molekul yang terikat pada ion kompleks) dan di netralkan dengan bilangan koordinasi. Dari gambar [Co(NH 3 )6]CI 3, 6 molekul NH3
Senyawa Koordinasi. Kompleks ion dengan pusat d B memiliki empat ligan dengan dengan bentuk persegi planar (B)
 Senyawa Koordinasi Aspek umum dari logam transisi adalah pembentukan dari senyawa koordinasi (kompleks). Senyawa koordinasi ini setidaknya memiliki satu ion kompleks yang terdiri dari logam kation yang
Senyawa Koordinasi Aspek umum dari logam transisi adalah pembentukan dari senyawa koordinasi (kompleks). Senyawa koordinasi ini setidaknya memiliki satu ion kompleks yang terdiri dari logam kation yang
COORDINATION COMPOUND. Disusun oleh : Bintang Ayu Kalimantini NIM : KELAS D 10.30
 COORDINATION COMPOUND Disusun oleh : Bintang Ayu Kalimantini NIM : 21030112120019 KELAS D 10.30 S enyawa kompleks ditemukan sekitar tahun 1890an oleh Alfred Werner. Senyawa kompleks terdiri dari setidaknya
COORDINATION COMPOUND Disusun oleh : Bintang Ayu Kalimantini NIM : 21030112120019 KELAS D 10.30 S enyawa kompleks ditemukan sekitar tahun 1890an oleh Alfred Werner. Senyawa kompleks terdiri dari setidaknya
Bilangankoordinasi, bentukgeometri, danligandarisenyawakompleks
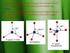 Senyawakoordinasi Senyawa koordinasi (coordination coumpounds) yang disebut juga kompleks adalah senyawa yang memiliki paling sedikit satu ion kompleks dengan kation sebagai pusat kompleks dan anion sebagailigan
Senyawakoordinasi Senyawa koordinasi (coordination coumpounds) yang disebut juga kompleks adalah senyawa yang memiliki paling sedikit satu ion kompleks dengan kation sebagai pusat kompleks dan anion sebagailigan
8.4 Senyawa Kompleks
 8.4 Senyawa Kompleks Alfred Werner (1866-1919): kelompok baru senyawa logam transisi yang terdiri dari ion logam transisi (LT) yang dikelilingi oleh ion atau molekul yang lain. Ion atau molekul yang terikat
8.4 Senyawa Kompleks Alfred Werner (1866-1919): kelompok baru senyawa logam transisi yang terdiri dari ion logam transisi (LT) yang dikelilingi oleh ion atau molekul yang lain. Ion atau molekul yang terikat
SENYAWA KOORDINASI Ion kompleks: Angka koordinasi, Geometri, dan Ligan
 SENYAWA KOORDINASI Keistimewaan dari ilmu kimia peralihan logam adalah rumus dari senyawa koordinasi (kompleks). Ada unsur yang berisi paling sedikit satu ion kompleks, yang terdiri dari satu atom pusat
SENYAWA KOORDINASI Keistimewaan dari ilmu kimia peralihan logam adalah rumus dari senyawa koordinasi (kompleks). Ada unsur yang berisi paling sedikit satu ion kompleks, yang terdiri dari satu atom pusat
Kimia Koordinasi Teori Ikatan Valensi
 Kimia Koordinasi Teori Ikatan Valensi Beberapa teori telah dirumuskan untuk menjelaskan ikatan dalam senyawaan koordinasi dan untuk merasionalisasi serta meramalkan sifat-sifatnya: teori ikatan valensi,
Kimia Koordinasi Teori Ikatan Valensi Beberapa teori telah dirumuskan untuk menjelaskan ikatan dalam senyawaan koordinasi dan untuk merasionalisasi serta meramalkan sifat-sifatnya: teori ikatan valensi,
Kimia Koordinasi SOAL LATIHAN. Jawab soal sudah tersedia. Selesaikan soalnya, dan pelajari mengapa dipilih jawaban tersebut
 Kimia Koordinasi SOAL LATIHAN Jawab soal sudah tersedia. Selesaikan soalnya, dan pelajari mengapa dipilih jawaban tersebut 1. Suatu logam nickel dapat ditulis sebagai [Ar] 4s 2 3d 8, manakah representasi
Kimia Koordinasi SOAL LATIHAN Jawab soal sudah tersedia. Selesaikan soalnya, dan pelajari mengapa dipilih jawaban tersebut 1. Suatu logam nickel dapat ditulis sebagai [Ar] 4s 2 3d 8, manakah representasi
SENYAWA KOORDINASI Putri Anjarsari, S.Si., M.Pd
 SENYAWA KOORDINASI Putri Anjarsari, S.Si., M.Pd putri_anjarsari@uny.ac.id Pengertian Senyawa Koordinasi Senyawa koordinasi adalah senyawa yang mengandung satu atau lebih ion kompleks dengan sejumlah kecil
SENYAWA KOORDINASI Putri Anjarsari, S.Si., M.Pd putri_anjarsari@uny.ac.id Pengertian Senyawa Koordinasi Senyawa koordinasi adalah senyawa yang mengandung satu atau lebih ion kompleks dengan sejumlah kecil
Bahasan. Senyawa Koordinasi. Bahasan. 1. Teori Werner tentang Senyawa Koordinasi : Tinjauan Ulang. Irwansyah, M.Si
 Bahasan Ion Kompleks dan 1 Teori Werner tentang Senyawa koordinasi : Tinjauan Ulang 2 Ligan 3 Tatanama 4 Isomerisasi 5 Ikatan dalam Ion Kompleks : Teori Medan Kristal 6 Sifat Magnet dan Teori Medan Kristal
Bahasan Ion Kompleks dan 1 Teori Werner tentang Senyawa koordinasi : Tinjauan Ulang 2 Ligan 3 Tatanama 4 Isomerisasi 5 Ikatan dalam Ion Kompleks : Teori Medan Kristal 6 Sifat Magnet dan Teori Medan Kristal
Kegiatan Belajar 4 Kimia Unsur. Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada materi Kimia Unsur.
 1 Kegiatan Belajar 4 Kimia Unsur Capaian Pembelajaran Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada materi Kimia Unsur. Subcapaian pembelajaran: 1. Menjelaskan sifat unsur golongan
1 Kegiatan Belajar 4 Kimia Unsur Capaian Pembelajaran Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada materi Kimia Unsur. Subcapaian pembelajaran: 1. Menjelaskan sifat unsur golongan
KIMIA. Sesi KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA. a. Sifat Umum
 KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 12 Sesi NGAN KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA Keteraturan sifat keperiodikan unsur dalam satu periode dapat diamati pada unsur-unsur periode
KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 12 Sesi NGAN KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA Keteraturan sifat keperiodikan unsur dalam satu periode dapat diamati pada unsur-unsur periode
Ikatan Kimia. Ikatan kimia adalah gaya tarik antar atom yang pemutusan atau pembentukannya menyebabkan terjadinya perubahan kimia.
 Ikatan Kimia 1. Ikatan Kimia 1.1 Pengertian Ikatan kimia adalah gaya tarik antar atom yang pemutusan atau pembentukannya menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam Ikatan Kimia Ikatan Ion:
Ikatan Kimia 1. Ikatan Kimia 1.1 Pengertian Ikatan kimia adalah gaya tarik antar atom yang pemutusan atau pembentukannya menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam Ikatan Kimia Ikatan Ion:
Bab 11 Senyawa Koordinasi
 Bab 11 http://chem.fmipa.ipb.ac.id Cisplatin (cis-pt(nh 3 ) 2 Cl 2 ) Cisplatin menghancurkan sel kanker untuk bereproduksi dengan mengubah konfigurasi DNAnya 1 Ikthisar Sumber: Chang Bab 20 1 Kimia Logam
Bab 11 http://chem.fmipa.ipb.ac.id Cisplatin (cis-pt(nh 3 ) 2 Cl 2 ) Cisplatin menghancurkan sel kanker untuk bereproduksi dengan mengubah konfigurasi DNAnya 1 Ikthisar Sumber: Chang Bab 20 1 Kimia Logam
! " "! # $ % & ' % &
 Valensi ! " "! # $ % & ' %& # % ( ) # *+## )$,) & -#.. Semua unsur memiliki bilangan oksidasi +1 Semua unsur memiliki bilangan oksidasi +2 Semua unsur memiliki bilangan oksidasi +3. Tl juga memiliki bilangan
Valensi ! " "! # $ % & ' %& # % ( ) # *+## )$,) & -#.. Semua unsur memiliki bilangan oksidasi +1 Semua unsur memiliki bilangan oksidasi +2 Semua unsur memiliki bilangan oksidasi +3. Tl juga memiliki bilangan
kimia KONFIGURASI ELEKTRON
 K-13 Kelas X kimia KONFIGURASI ELEKTRON Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konfigurasi elektron kulit dan subkulit. 2. Menyelesaikan
K-13 Kelas X kimia KONFIGURASI ELEKTRON Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konfigurasi elektron kulit dan subkulit. 2. Menyelesaikan
Teori medan kristal adalah model yang hampir secara menyeluruh menggantikan teori ikatan valensi, pertama kali dimunculkan oleh Hans Bethe pada 1929.
 Teori Medan Kristal Teori medan kristal adalah model yang hampir secara menyeluruh menggantikan teori ikatan valensi, pertama kali dimunculkan oleh Hans Bethe pada 1929. Pada mulanya merupakan model yang
Teori Medan Kristal Teori medan kristal adalah model yang hampir secara menyeluruh menggantikan teori ikatan valensi, pertama kali dimunculkan oleh Hans Bethe pada 1929. Pada mulanya merupakan model yang
1. Ikatan Kimia. Struktur Molekul. 1.1 Pengertian. 1.2 Macam-Macam. ~ gaya tarik antar atom
 1. Ikatan Kimia 1.1 Pengertian ~ gaya tarik antar atom Struktur Molekul 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang terbentuk akibat tarik-menarik elektrostatik antara ion positif (kation) dan ion
1. Ikatan Kimia 1.1 Pengertian ~ gaya tarik antar atom Struktur Molekul 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang terbentuk akibat tarik-menarik elektrostatik antara ion positif (kation) dan ion
~ gaya tarik antar atom yang pemutusan atau pembentukannya dapat menyebabkan terjadinya perubahan kimia.
 1. Ikatan Kimia Struktur Molekul 1.1 Pengertian ~ gaya tarik antar atom yang pemutusan atau pembentukannya dapat menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang
1. Ikatan Kimia Struktur Molekul 1.1 Pengertian ~ gaya tarik antar atom yang pemutusan atau pembentukannya dapat menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang
Ikatan Kimia. 2 Klasifikasi Ikatan Kimia :
 Ikatan Kimia Ikatan Kimia : Gaya tarik yang menyebabkan atom-atom yang terikat satu sama lain dalam suatu kombinasi untuk membentuk senyawa yang lebih kompleks. 2 Klasifikasi Ikatan Kimia : 1. Ikatan ion
Ikatan Kimia Ikatan Kimia : Gaya tarik yang menyebabkan atom-atom yang terikat satu sama lain dalam suatu kombinasi untuk membentuk senyawa yang lebih kompleks. 2 Klasifikasi Ikatan Kimia : 1. Ikatan ion
BAB 3 GEOMETRI DAN KEPOLARAN MOLEKUL
 GEOMETRI DAN KEPOLARAN MOLEKUL 3.1 PENGANTAR MENGENAI BENTUK MOLEKUL Bentuk molekul mengontrol sifat-sifat fisik maupun kimia molekul. Geometri elektron dan bentuk molekul ditentukan oleh orientasi semua
GEOMETRI DAN KEPOLARAN MOLEKUL 3.1 PENGANTAR MENGENAI BENTUK MOLEKUL Bentuk molekul mengontrol sifat-sifat fisik maupun kimia molekul. Geometri elektron dan bentuk molekul ditentukan oleh orientasi semua
MODUL VI KIMIA KOORDINASI
 MODUL VI KIMIA KOORDINASI I. Petunjuk Umum 1. Kompetensi Dasar 1) Mahasiswa memahami definisi senyawa komplek 2) Mahasiswa memahami Teori Koordinasi Werner 3) Mahasiswa memahami jenis-jenis ligan 4) Mahasiswa
MODUL VI KIMIA KOORDINASI I. Petunjuk Umum 1. Kompetensi Dasar 1) Mahasiswa memahami definisi senyawa komplek 2) Mahasiswa memahami Teori Koordinasi Werner 3) Mahasiswa memahami jenis-jenis ligan 4) Mahasiswa
COORDINATION COMPOUNDS
 COORDINATION COMPOUNDS Coordination Compounds (senyawa koordinasi) adalah senyawa yang mengandung paling tidak satu ion komplek, yang merupakan jenis kation logam pusat(baik pada logam transisi ataupun
COORDINATION COMPOUNDS Coordination Compounds (senyawa koordinasi) adalah senyawa yang mengandung paling tidak satu ion komplek, yang merupakan jenis kation logam pusat(baik pada logam transisi ataupun
TEORI IKATAN VALENSI
 TEORI IKATAN VALENSI Pembentukan ikatan kovalen dapat dijelaskan menggunakan dua teori yaitu teori ikatan valensi dan teori orbital molekul. Berdasarkan teori ikatan valensi, ikatan kovalen dapat terbentuk
TEORI IKATAN VALENSI Pembentukan ikatan kovalen dapat dijelaskan menggunakan dua teori yaitu teori ikatan valensi dan teori orbital molekul. Berdasarkan teori ikatan valensi, ikatan kovalen dapat terbentuk
Peranan elektron dalam pembentukan ikatan kimia
 IKATAN KIMIA IKATAN KIMIA Gaya yang memegangi atom atau ion membentuk molekul atau kristal disebut Ikatan Kimia. Elektron memegang peran penting dalam pembentukan ikatan kimia. Peranan elektron dalam pembentukan
IKATAN KIMIA IKATAN KIMIA Gaya yang memegangi atom atau ion membentuk molekul atau kristal disebut Ikatan Kimia. Elektron memegang peran penting dalam pembentukan ikatan kimia. Peranan elektron dalam pembentukan
STRUKTUR LEWIS DAN TEORI IKATAN VALENSI
 Ikatan Kimia STRUKTUR LEWIS DAN TEORI IKATAN VALENSI Disusun oleh : Kelompok 11 Penty Cahyani 4301411038 Diyah Ayu Lestari 4301411040 Ifan Shovi 4301411041 Rombel 2 UNIVERSITAS NEGERI SEMARANG 2013 A.
Ikatan Kimia STRUKTUR LEWIS DAN TEORI IKATAN VALENSI Disusun oleh : Kelompok 11 Penty Cahyani 4301411038 Diyah Ayu Lestari 4301411040 Ifan Shovi 4301411041 Rombel 2 UNIVERSITAS NEGERI SEMARANG 2013 A.
Aris Arianto. Guru Kimia di SMAN Madani Palu. STUDENT S BOOk
 STUDENT S BOOk Aris Arianto Guru Kimia di SMAN Madani Palu Website/blog penulis : Website : http://blendedlearningkimia.com Weblog : 1. http://www.arisarianto.web.id 2. http://arisarianto.wordpress.com
STUDENT S BOOk Aris Arianto Guru Kimia di SMAN Madani Palu Website/blog penulis : Website : http://blendedlearningkimia.com Weblog : 1. http://www.arisarianto.web.id 2. http://arisarianto.wordpress.com
LAPORAN LENGKAP PRAKTIKUM KIMIA ANORGANIK PERCOBAAN 3 PENENTUAN BILANGAN KOORDINAI KOMPLEKS TEMBAGA (II)
 LAPORAN LENGKAP PRAKTIKUM KIMIA ANORGANIK PERCOBAAN 3 PENENTUAN BILANGAN KOORDINAI KOMPLEKS TEMBAGA (II) OLEH : NAMA : IMENG NIM: ACC 109 011 KELOMPOK : 2 ( DUA ) HARI, TANGGAL : RABU, 8 JUNI 2011 ASISTEN
LAPORAN LENGKAP PRAKTIKUM KIMIA ANORGANIK PERCOBAAN 3 PENENTUAN BILANGAN KOORDINAI KOMPLEKS TEMBAGA (II) OLEH : NAMA : IMENG NIM: ACC 109 011 KELOMPOK : 2 ( DUA ) HARI, TANGGAL : RABU, 8 JUNI 2011 ASISTEN
STRUKTUR MOLEKUL SEDERHANA
 STRUKTUR MOLEKUL SEDERHANA Oleh : Dr. Suyanta Ikatan ionik dibentuk oleh tarikan elekrostatik antara kation dan anion. Karena medan listrik suatu ion bersimetri bola, ikatan ion tidak memiliki karakter
STRUKTUR MOLEKUL SEDERHANA Oleh : Dr. Suyanta Ikatan ionik dibentuk oleh tarikan elekrostatik antara kation dan anion. Karena medan listrik suatu ion bersimetri bola, ikatan ion tidak memiliki karakter
I. PENDAHULUAN. Kualitas udara yang dipergunakan untuk kehidupan tergantung dari lingkungannya. Udara
 I. PENDAHULUAN 1.1 Latar Belakang Masalah Kualitas udara yang dipergunakan untuk kehidupan tergantung dari lingkungannya. Udara mengandung sejumlah oksigen, yang merupakan komponen esensial bagi kehidupan,
I. PENDAHULUAN 1.1 Latar Belakang Masalah Kualitas udara yang dipergunakan untuk kehidupan tergantung dari lingkungannya. Udara mengandung sejumlah oksigen, yang merupakan komponen esensial bagi kehidupan,
Bilangan Kuantum Utama (n)
 Bilangan Kuantum Utama (n) Menyatakan nomer kulit tempat elektron berada atau bilangan ini juga menyatakan ukuran orbital/ jarak/ jari-jari atom. Dinyatakan dengan bilangan bulat positif. Mempunyai dua
Bilangan Kuantum Utama (n) Menyatakan nomer kulit tempat elektron berada atau bilangan ini juga menyatakan ukuran orbital/ jarak/ jari-jari atom. Dinyatakan dengan bilangan bulat positif. Mempunyai dua
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB I STRUKTUR ATOM
 BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB I 1. Suatu partikel X memiliki 16 proton, 16 neutron, dan 18 elektron. Partikel tersebut dapat dikategorikan sebagai A. Anion X bermuatan -1
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB I 1. Suatu partikel X memiliki 16 proton, 16 neutron, dan 18 elektron. Partikel tersebut dapat dikategorikan sebagai A. Anion X bermuatan -1
Ikatan dan Isomeri. Prof. Dr. Jumina Robby Noor Cahyono, S.Si., M.Sc.
 Ikatan dan Isomeri Prof. Dr. Jumina Robby Noor Cahyono, S.Si., M.Sc. Susunan Elektron dalam Atom Mulai dikenalkan oleh Rutherford: Atom terdiri atas inti yg kecil & padat dan dikelilingi oleh elektron-elektron
Ikatan dan Isomeri Prof. Dr. Jumina Robby Noor Cahyono, S.Si., M.Sc. Susunan Elektron dalam Atom Mulai dikenalkan oleh Rutherford: Atom terdiri atas inti yg kecil & padat dan dikelilingi oleh elektron-elektron
PB = Psgan elektron bebas Dari BK dan PB atom pusat dpt diramalkan struktur molekul dng teori VSEPR
 Pasangan elektron valensi mempunyai gaya tolak menolak Pasangan elektron bebas menempati ruang sesuai jenisnya BK = Bilangan Koordinasi = Jumlah atom / substituen yang terikat pada atom pusat PB = Psgan
Pasangan elektron valensi mempunyai gaya tolak menolak Pasangan elektron bebas menempati ruang sesuai jenisnya BK = Bilangan Koordinasi = Jumlah atom / substituen yang terikat pada atom pusat PB = Psgan
kimia REVIEW I TUJUAN PEMBELAJARAN
 KTSP kimia K e l a s XI REVIEW I TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami teori atom mekanika kuantum dan hubungannya dengan bilangan
KTSP kimia K e l a s XI REVIEW I TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami teori atom mekanika kuantum dan hubungannya dengan bilangan
BAHAN AJAR KIMIA KONFIGURASI ELEKTRON DAN BILANGAN KUANTUM
 BAHAN AJAR KIMIA KONFIGURASI ELEKTRON DAN BILANGAN KUANTUM CHEMISTRY IS FUN Oleh : Hana Nazelia AfrianI 1 Konfigurasi Elektron dan Bilangan KONFIGURASI ELEKTRON Konfigurasi elektron adalah susunan elektron
BAHAN AJAR KIMIA KONFIGURASI ELEKTRON DAN BILANGAN KUANTUM CHEMISTRY IS FUN Oleh : Hana Nazelia AfrianI 1 Konfigurasi Elektron dan Bilangan KONFIGURASI ELEKTRON Konfigurasi elektron adalah susunan elektron
JAWABAN. 8. Untuk obligasi tunggal antara sejenis atom, bagaimana kekuatan ikatan yang berhubungan dengan ukuran dari atom?jelaskan secara ilmiah.
 SOAL 1. Thomson mampu menentukan massa / rasio muatan elektron tetapi tidak massa. Bagaimana Percobaan Millikan memungkinkan penentuan massa elektron? 2. Bagaimana senyawa ion netral jika mereka terdiri
SOAL 1. Thomson mampu menentukan massa / rasio muatan elektron tetapi tidak massa. Bagaimana Percobaan Millikan memungkinkan penentuan massa elektron? 2. Bagaimana senyawa ion netral jika mereka terdiri
IKATAN KIMIA MAKALAH KIMIA DASAR
 IKATAN KIMIA MAKALAH KIMIA DASAR dibuat sebagai salah satu syarat untuk memperoleh nilai mata kuliah kimia dasar Oleh : AZKA WAFI EL HAKIM ( NPM : 301014000 ) HELGA RACHEL F ( NPM : 3010140014 ) MUHAMMAD
IKATAN KIMIA MAKALAH KIMIA DASAR dibuat sebagai salah satu syarat untuk memperoleh nilai mata kuliah kimia dasar Oleh : AZKA WAFI EL HAKIM ( NPM : 301014000 ) HELGA RACHEL F ( NPM : 3010140014 ) MUHAMMAD
BAB II A. KONSEP ATOM
 BAB II STRUKTURR DAN IKATAN ATOM BAB II STRUKTURR DAN IKATAN ATOM A. KONSEP ATOM Semua material tersusun oleh atom atom. Setiap atom terdiri dari inti atom(nukleus) dan elektron seperti ditunjukkann pada
BAB II STRUKTURR DAN IKATAN ATOM BAB II STRUKTURR DAN IKATAN ATOM A. KONSEP ATOM Semua material tersusun oleh atom atom. Setiap atom terdiri dari inti atom(nukleus) dan elektron seperti ditunjukkann pada
I. PENDAHULUAN. Pencemaran udara adalah masuknya, atau tercampurnya unsur-unsur berbahaya ke dalam
 I. PENDAHULUAN 1.1 Latar Belakang Masalah Pencemaran udara adalah masuknya, atau tercampurnya unsur-unsur berbahaya ke dalam atmosfir yang dapat mengakibatkan terjadinya kerusakan lingkungan, gangguan
I. PENDAHULUAN 1.1 Latar Belakang Masalah Pencemaran udara adalah masuknya, atau tercampurnya unsur-unsur berbahaya ke dalam atmosfir yang dapat mengakibatkan terjadinya kerusakan lingkungan, gangguan
LATIHAN SOAL IKATAN KIMIA
 LATIHAN SAL IKATAN KIMIA 1. Cara untuk mendapatkan kestabilan atom unsur yang bernomor atom 8 adalah dengan a. Melepaskan enam elektron muatan +6 b. Mengikat dua elektron dari atom lain menjadi ion dengan
LATIHAN SAL IKATAN KIMIA 1. Cara untuk mendapatkan kestabilan atom unsur yang bernomor atom 8 adalah dengan a. Melepaskan enam elektron muatan +6 b. Mengikat dua elektron dari atom lain menjadi ion dengan
Kimia Organik 1. Pertemuan ke 3 Indah Solihah
 Kimia Organik 1 Pertemuan ke 3 Indah Solihah Pembentukan Ikatan pada atom Fosfor Nomor atom fosfor (P) adalah 15 Tahap pembentukan ikatan : 1. Sebagian energi digunakan untuk hibridisasi, elektron pada
Kimia Organik 1 Pertemuan ke 3 Indah Solihah Pembentukan Ikatan pada atom Fosfor Nomor atom fosfor (P) adalah 15 Tahap pembentukan ikatan : 1. Sebagian energi digunakan untuk hibridisasi, elektron pada
I. PENDAHULUAN. senyawa kompleks bersifat sebgai asam Lewis sedangkan ligan dalam senyawa
 I. PENDAHULUAN A. Latar Belakang Senyawa kompleks merupakan senyawa yang memiliki warna yang khas yang diakibatkan oleh adanya unsur yang dari golongan transisi yang biasanya berperperan sebagai atom pusat
I. PENDAHULUAN A. Latar Belakang Senyawa kompleks merupakan senyawa yang memiliki warna yang khas yang diakibatkan oleh adanya unsur yang dari golongan transisi yang biasanya berperperan sebagai atom pusat
kimia Kelas X TABEL PERIODIK K-13
 K-13 Kelas X kimia TABEL PERIODIK Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami perkembangan sistem periodik unsur dan kelemahannya. 2. Menentukan
K-13 Kelas X kimia TABEL PERIODIK Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami perkembangan sistem periodik unsur dan kelemahannya. 2. Menentukan
LAPORAN PRAKTIKUM KIMIA ANORGANIK
 LAPORAN PRAKTIKUM KIMIA ANORGANIK Nama : Idatul Fitriyah NIM : 4301412036 Jurusan : Kimia Prodi : Pendidikan Kimia Dosen : Ella Kusumastuti Kelompok : 7 Tgl Praktikum : 21 Maret 2014 Kawan Kerja : 1. Izza
LAPORAN PRAKTIKUM KIMIA ANORGANIK Nama : Idatul Fitriyah NIM : 4301412036 Jurusan : Kimia Prodi : Pendidikan Kimia Dosen : Ella Kusumastuti Kelompok : 7 Tgl Praktikum : 21 Maret 2014 Kawan Kerja : 1. Izza
kimia Kelas X REVIEW I K-13 A. Hakikat Ilmu Kimia
 K-13 Kelas X kimia REVIEW I Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami hakikat ilmu kimia dan metode ilmiah. 2. Memahami teori atom dan
K-13 Kelas X kimia REVIEW I Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami hakikat ilmu kimia dan metode ilmiah. 2. Memahami teori atom dan
BAB 3 IKATAN DAN STRUKTUR MOLEKUL
 BAB 3 IKATAN DAN STRUKTUR MOLEKUL Atom-atom pada umumnya tidak ditemukan dalam keadaan bebas (kecuali pada temperatur tinggi), melainkan sebagai suatu kelompok atom atau sebagai molekul. Hal ini berarti
BAB 3 IKATAN DAN STRUKTUR MOLEKUL Atom-atom pada umumnya tidak ditemukan dalam keadaan bebas (kecuali pada temperatur tinggi), melainkan sebagai suatu kelompok atom atau sebagai molekul. Hal ini berarti
Bab V Ikatan Kimia. B. Struktur Lewis Antar unsur saling berinteraksi dengan menerima dan melepaskan elektron di kulit terluarnya. Gambaran terjadinya
 Bab V Ikatan Kimia Sebagian besar unsur yang ada di alam mempunyai kecenderungan untuk berinteraksi (berikatan) dengan unsur lain. Hal itu dilakukan karena unsur tersebut ingin mencapai kestabilan. Cara
Bab V Ikatan Kimia Sebagian besar unsur yang ada di alam mempunyai kecenderungan untuk berinteraksi (berikatan) dengan unsur lain. Hal itu dilakukan karena unsur tersebut ingin mencapai kestabilan. Cara
TUGAS KIMIA ANORGANIK TEORI IKATAN VALENSI DAN HIBRIDISASI ORBITAL
 TUGAS KIMIA ANORGANIK TEORI IKATAN VALENSI DAN HIBRIDISASI ORBITAL ESTER ALNINTA BASA SIAGIAN (21030116140082) JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK SEMARANG 2016 A. DASAR TEORI IKATAN VALENSI Ikatan valensi
TUGAS KIMIA ANORGANIK TEORI IKATAN VALENSI DAN HIBRIDISASI ORBITAL ESTER ALNINTA BASA SIAGIAN (21030116140082) JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK SEMARANG 2016 A. DASAR TEORI IKATAN VALENSI Ikatan valensi
LATIHAN SOAL IKATAN KIMIA
 LATIHAN SOAL IKATAN KIMIA 1. Cara untuk mendapatkan ke stabilan atom unsur yang bernomor atom 10 adalah dengan a. Melepaskan dua elektron valensinya membentuk ion dengan muatan +2 b. Mengikat enam elektron
LATIHAN SOAL IKATAN KIMIA 1. Cara untuk mendapatkan ke stabilan atom unsur yang bernomor atom 10 adalah dengan a. Melepaskan dua elektron valensinya membentuk ion dengan muatan +2 b. Mengikat enam elektron
GEOMETRI MOLEKUL (BENTUK MOLEKUL)
 GEOMETRI MOLEKUL (BENTUK MOLEKUL) Untuk menentukan gemetri molekul dapat ditentukan dengan teori: 1. VSEPR 2. Hibridisasi 3. Orbital molekul Hubungan VSEPR dengan domain electron pada atom pusat (jumlah
GEOMETRI MOLEKUL (BENTUK MOLEKUL) Untuk menentukan gemetri molekul dapat ditentukan dengan teori: 1. VSEPR 2. Hibridisasi 3. Orbital molekul Hubungan VSEPR dengan domain electron pada atom pusat (jumlah
Ikatan kovalen koordinat adalah ikatan dimana elektronelektron yang dipakai bersama-sama hanya berasal dari satu atom.
 IKATAN KIMIA 1. Pada molekul CH 4 terdapat ikatan kovalen SEBAB paa tiap molekul CH 4 terdapat 4 atom hidrogen SMU/Ebtanas/Kimia/Tahun 1988 Ikatan Kovalen adalah ikatan kimia yang terjadi karena penggunaan
IKATAN KIMIA 1. Pada molekul CH 4 terdapat ikatan kovalen SEBAB paa tiap molekul CH 4 terdapat 4 atom hidrogen SMU/Ebtanas/Kimia/Tahun 1988 Ikatan Kovalen adalah ikatan kimia yang terjadi karena penggunaan
Bentuk-bentuk molekul
 Bentuk-bentuk molekul Menggambarkan molekul dengan struktur lewis Biasanya elektron disimbolkan dengan titik yang menggambarkan setiap atomnya, dan pasangan yang berikatan digambar menjadi satu, biasanya
Bentuk-bentuk molekul Menggambarkan molekul dengan struktur lewis Biasanya elektron disimbolkan dengan titik yang menggambarkan setiap atomnya, dan pasangan yang berikatan digambar menjadi satu, biasanya
BENTUK MOLEKUL STRUKTUR LEWIS UNTUK MOLEKUL DENGAN IKATAN TUNGGAL
 BENTUK MOLEKUL MELUKISKAN MOLEKUL DAN ION DENGAN STRUKTUR LEWIS Untuk menyusun struktur Lewis dari suatu atom atau unsur, dapat dilakukan dengan cara menuliskan simbol titik pada sekeliling atom yang menggambarkan
BENTUK MOLEKUL MELUKISKAN MOLEKUL DAN ION DENGAN STRUKTUR LEWIS Untuk menyusun struktur Lewis dari suatu atom atau unsur, dapat dilakukan dengan cara menuliskan simbol titik pada sekeliling atom yang menggambarkan
IKATAN KIMIA. RATNAWATI, S.Pd
 IKATAN KIMIA RATNAWATI, S.Pd Tujuan Pembelajaran Setelah mempelajari materi ini, diharapkan siswa dapat: Menjelaskan kecenderungan suatu unsur untuk mencapai kestabilannya Menggambarkan susunan elektron
IKATAN KIMIA RATNAWATI, S.Pd Tujuan Pembelajaran Setelah mempelajari materi ini, diharapkan siswa dapat: Menjelaskan kecenderungan suatu unsur untuk mencapai kestabilannya Menggambarkan susunan elektron
Mekanika Kuantum. Orbital dan Bilangan Kuantum
 Standar Kompetensi Kompetensi Dasar Mendeskripsikan struktur atom dan sifat-sifat periodik serta struktur molekul dan sifat-sifatnya. Menerapkan teori atom mekanika kuantum untuk menuliskan konfigurasi
Standar Kompetensi Kompetensi Dasar Mendeskripsikan struktur atom dan sifat-sifat periodik serta struktur molekul dan sifat-sifatnya. Menerapkan teori atom mekanika kuantum untuk menuliskan konfigurasi
BENTUK MOLEKUL CITRAWATI NUGRAHENI MINASTI Struktur Lewis dan Teori VSEPR. disusun oleh :
 BENTUK MOLEKUL Struktur Lewis dan Teori VSEPR disusun oleh : CITRAWATI NUGRAHENI MINASTI 21030112130045 TEKNIK KIMIA UNIVERSITAS DIPONEGORO 2012/2013 STRUKTUR LEWIS dan BENTUK MOLEKUL 10.1 Menggambarkan
BENTUK MOLEKUL Struktur Lewis dan Teori VSEPR disusun oleh : CITRAWATI NUGRAHENI MINASTI 21030112130045 TEKNIK KIMIA UNIVERSITAS DIPONEGORO 2012/2013 STRUKTUR LEWIS dan BENTUK MOLEKUL 10.1 Menggambarkan
IKATAN KIMIA DAN GEOMETRI MOLEKUL
 IKATAN KIMIA DAN GEOMETRI MOLEKUL Sebagian besar unsur di alam tidak pernah dijumpai dalam atom bebas (kecuali gas mulia), namun dalam bentuk berikatan dengan atom yang sejenis maupun atom-atom yang lain.
IKATAN KIMIA DAN GEOMETRI MOLEKUL Sebagian besar unsur di alam tidak pernah dijumpai dalam atom bebas (kecuali gas mulia), namun dalam bentuk berikatan dengan atom yang sejenis maupun atom-atom yang lain.
Kimia Koordinasi Pendahuluan
 Kimia Koordinasi Pendahuluan Senyawaan Koordinasi umumnya terdiri dari satu atom logam atau ion dan setidaknya satu ligand (atom, ion atau molekul) yang dapat dilihat sebagai donor elektron bagi logam
Kimia Koordinasi Pendahuluan Senyawaan Koordinasi umumnya terdiri dari satu atom logam atau ion dan setidaknya satu ligand (atom, ion atau molekul) yang dapat dilihat sebagai donor elektron bagi logam
KIMIA ANORGANIK BAB 10. STRUKTUR LEWIS dan BENTUK-BENTUK MOLEKUL. Disusun Oleh : Faizal Romadhon NIM : TEKNIK KIMIA
 KIMIA ANORGANIK BAB 10 STRUKTUR LEWIS dan BENTUK-BENTUK MOLEKUL Disusun Oleh : Nama : Faizal Romadhon NIM : 2103012130072 Kelas : Kelas C TEKNIK KIMIA UNIVERSITAS DIPONEGORO SEMARANG 2012 STRUKTUR LEWIS
KIMIA ANORGANIK BAB 10 STRUKTUR LEWIS dan BENTUK-BENTUK MOLEKUL Disusun Oleh : Nama : Faizal Romadhon NIM : 2103012130072 Kelas : Kelas C TEKNIK KIMIA UNIVERSITAS DIPONEGORO SEMARANG 2012 STRUKTUR LEWIS
ANALISIS SOAL UJIAN HARIAN KELAS XI BAB: TEORI ATOM MEKANIKA KUANTUM, BENTUK MOLEKUL, DAN GAYA ANTARMOLEKUL
 ANALISIS SOAL UJIAN HARIAN KELAS XI BAB: TEORI ATOM MEKANIKA KUANTUM, BENTUK MOLEKUL, DAN Petunjuk Umum : GAYA ANTARMOLEKUL Telitilah soal terlebih dahulu, perangkat soal terdiri dari 20 soal pilihan ganda
ANALISIS SOAL UJIAN HARIAN KELAS XI BAB: TEORI ATOM MEKANIKA KUANTUM, BENTUK MOLEKUL, DAN Petunjuk Umum : GAYA ANTARMOLEKUL Telitilah soal terlebih dahulu, perangkat soal terdiri dari 20 soal pilihan ganda
Menggambarkan Molekul dan Ion dengan Struktur Lewis
 Menggambarkan Molekul dan Ion dengan Struktur Lewis Menggunakan Kaidah Oktet untuk Menggambar Struktur Lewis Untuk mencapai kestabilan seperti gas mulia, setiap atom berusaha memenuhi kaidah octet dengan
Menggambarkan Molekul dan Ion dengan Struktur Lewis Menggunakan Kaidah Oktet untuk Menggambar Struktur Lewis Untuk mencapai kestabilan seperti gas mulia, setiap atom berusaha memenuhi kaidah octet dengan
BAB X -Bentuk Molekul-
 BAB X -Bentuk Molekul- Bagaimana Menggambarkan Molekul dan Ion dengan struktur Lewis? Hal pertama yang harus kita perhatikan dalam menggambarkan molekul dari struktur Lewis adalah kita harus mengikuti
BAB X -Bentuk Molekul- Bagaimana Menggambarkan Molekul dan Ion dengan struktur Lewis? Hal pertama yang harus kita perhatikan dalam menggambarkan molekul dari struktur Lewis adalah kita harus mengikuti
IKATAN KIMIA BAB 3. Pada pelajaran bab tiga ini akan dipelajari tentang ikatan ion, ikatan kovalen, dan ikatan logam.
 BAB 3 IKATAN KIMIA Gambar 3.1 Kisi Kristal Senyawa NaCl. Sumber: amparan Dunia Ilmu Time life Pada pelajaran bab tiga ini akan dipelajari tentang ikatan ion, ikatan kovalen, dan ikatan logam. Ikatan Kimia
BAB 3 IKATAN KIMIA Gambar 3.1 Kisi Kristal Senyawa NaCl. Sumber: amparan Dunia Ilmu Time life Pada pelajaran bab tiga ini akan dipelajari tentang ikatan ion, ikatan kovalen, dan ikatan logam. Ikatan Kimia
SKL 1. Ringkasan Materi
 SKL 1 Menganalisis struktur atom, sistem periodik unsur dan ikatan kimia untuk menentukan sifat-sifat unsur dan senyawa. o o o Mendeskripsikan notasi unsur dan kaitannya dengan konfigurasi elektron serta
SKL 1 Menganalisis struktur atom, sistem periodik unsur dan ikatan kimia untuk menentukan sifat-sifat unsur dan senyawa. o o o Mendeskripsikan notasi unsur dan kaitannya dengan konfigurasi elektron serta
UNSUR-UNSUR TRANSISI PERIODE KE EMPAT : TEMBAGA
 Nama : Laurensius E. Seran NIM : 607332411998 UNSUR-UNSUR TRANSISI PERIODE KE EMPAT : TEMBAGA lah soal-soal berikut dengan cara menjodohkan dengan jawaban-jawaban yang telah disiapkan dikolom pilihan.
Nama : Laurensius E. Seran NIM : 607332411998 UNSUR-UNSUR TRANSISI PERIODE KE EMPAT : TEMBAGA lah soal-soal berikut dengan cara menjodohkan dengan jawaban-jawaban yang telah disiapkan dikolom pilihan.
OLIMPIADE NASIONAL MATEMATIKA DAN ILMU PENGETAHUAN ALAM TINGKAT PERGURUAN TINGGI (ONMIPA-PT) Bidang Kimia Sub bidang Kimia Anorganik
 OLIMPIADE NASIONAL MATEMATIKA DAN ILMU PENGETAHUAN ALAM TINGKAT PERGURUAN TINGGI (ONMIPA-PT) 2017 Bidang Kimia Sub bidang Kimia Anorganik 16 Mei 2017 Waktu : 120 menit Petunjuk Pengerjaan 1. Tes ini berlangsung
OLIMPIADE NASIONAL MATEMATIKA DAN ILMU PENGETAHUAN ALAM TINGKAT PERGURUAN TINGGI (ONMIPA-PT) 2017 Bidang Kimia Sub bidang Kimia Anorganik 16 Mei 2017 Waktu : 120 menit Petunjuk Pengerjaan 1. Tes ini berlangsung
BAB 10. Strukturr Lewis dan Bentuk Molekul
 BAB 10 Strukturr Lewis dan Bentuk Molekul Disusun Oleh : DHANY MIRNASARI (21030112120012) Dosen Pengampu : DR. ISTADI JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO SEMARANG 2012-2013 10.1
BAB 10 Strukturr Lewis dan Bentuk Molekul Disusun Oleh : DHANY MIRNASARI (21030112120012) Dosen Pengampu : DR. ISTADI JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO SEMARANG 2012-2013 10.1
Jilid 1. Penulis : Citra Deliana D.S, M.Si. Copyright 2013 pelatihan-osn.com. Cetakan I : Oktober Diterbitkan oleh : Pelatihan-osn.
 Jilid 1 Penulis : Citra Deliana D.S, M.Si. Copyright 2013 pelatihan-osn.com Cetakan I : Oktober 2012 Diterbitkan oleh : Pelatihan-osn.com Kompleks Sawangan Permai Blok A5 No.12 A Sawangan, Depok, Jawa
Jilid 1 Penulis : Citra Deliana D.S, M.Si. Copyright 2013 pelatihan-osn.com Cetakan I : Oktober 2012 Diterbitkan oleh : Pelatihan-osn.com Kompleks Sawangan Permai Blok A5 No.12 A Sawangan, Depok, Jawa
STRUKTUR LEWIS DAN BENTUK MOLEKUL (BAB 10)
 TUGAS RESUME STRUKTUR LEWIS DAN BENTUK MOLEKUL (BAB 10) Di susun oleh : Usya Rahmatika (21030112120015) Kelas B FAKULTAS TEKNIK JURUSAN TEKNIK KIMIA UNIVERSITAS DIPONEGORO SEMARANG 10.1 MENGGAMBARKAN BENTUK
TUGAS RESUME STRUKTUR LEWIS DAN BENTUK MOLEKUL (BAB 10) Di susun oleh : Usya Rahmatika (21030112120015) Kelas B FAKULTAS TEKNIK JURUSAN TEKNIK KIMIA UNIVERSITAS DIPONEGORO SEMARANG 10.1 MENGGAMBARKAN BENTUK
1. Aturan Aufbau. Konfigurasi Elektron. 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p,
 Ingattt.. Tabel SPU Konfigurasi Elektron Struktur Lewis t 1. Aturan Aufbau Konfigurasi Elektron 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, Lanjutan 2. Aturan Hund orbital
Ingattt.. Tabel SPU Konfigurasi Elektron Struktur Lewis t 1. Aturan Aufbau Konfigurasi Elektron 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, Lanjutan 2. Aturan Hund orbital
Ikatan Kimia II: VSEPR dan prediksi geometri Molekular, teori ikatan valensi dan Hibridisasi Orbital Atom; teori orbital atom
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Chapter 3c Ikatan Kimia II: VSEPR dan prediksi geometri Molekular, teori ikatan
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Chapter 3c Ikatan Kimia II: VSEPR dan prediksi geometri Molekular, teori ikatan
Ruko Jambusari No. 7A Yogyakarta Telp. : ; Fax. :
 DASAR-DASAR KIMIA ANORGANIK TRANSISI Oleh : Kristian H. Sugiyarto Edisi Pertama Cetakan Pertama, 2012 Hak Cipta 2012 pada penulis, Hak Cipta dilindungi undang-undang. Dilarang memperbanyak atau memindahkan
DASAR-DASAR KIMIA ANORGANIK TRANSISI Oleh : Kristian H. Sugiyarto Edisi Pertama Cetakan Pertama, 2012 Hak Cipta 2012 pada penulis, Hak Cipta dilindungi undang-undang. Dilarang memperbanyak atau memindahkan
KIMIA ANORGANIK TRANSISI
 KIMIA ANORGANIK TRANSISI cermin cermin Prof. Drs. Kristian H. Sugiyarto, M.Sc., Ph.D. Jurusan Pendidikan Kimia FMIPA, Universitas Negeri Yogyakarta 2009 i PRAKATA Materi Kimia Anorganik Transisi merupakan
KIMIA ANORGANIK TRANSISI cermin cermin Prof. Drs. Kristian H. Sugiyarto, M.Sc., Ph.D. Jurusan Pendidikan Kimia FMIPA, Universitas Negeri Yogyakarta 2009 i PRAKATA Materi Kimia Anorganik Transisi merupakan
ANALISIS SOAL ULANGAN HARIAN I. Total. Dimensi Proses Pengetahuan Kognitif Menerapkan Menganalisa (C4) 15 3,6,9,11,21 4,12,18,26 5,19,20,25
 ANALISIS SOAL ULANGAN HARIAN I Mata pelajaran Kimia Kelas/Semester XI IPA 1/1 Kisi Butir Soal ClassXI Mudah Sedang Susah C1 C2 and C3 C 4,5,6 Total Presentase 12% 56% 32% 100% Jumlah soal 3 14 8 25 Dimensi
ANALISIS SOAL ULANGAN HARIAN I Mata pelajaran Kimia Kelas/Semester XI IPA 1/1 Kisi Butir Soal ClassXI Mudah Sedang Susah C1 C2 and C3 C 4,5,6 Total Presentase 12% 56% 32% 100% Jumlah soal 3 14 8 25 Dimensi
PENENTUAN RUMUS ION KOMPLEKS BESI DENGAN ASAM SALISILAT
 PENENTUAN RUMUS ION KOMPLEKS BESI DENGAN ASAM SALISILAT Desi Eka Martuti, Suci Amalsari, Siti Nurul Handini., Nurul Aini Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Jenderal
PENENTUAN RUMUS ION KOMPLEKS BESI DENGAN ASAM SALISILAT Desi Eka Martuti, Suci Amalsari, Siti Nurul Handini., Nurul Aini Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Jenderal
Penyelesaian Tugas Kuliah Kimia Umum C (Soal bagi kelompok jadwal kuliah Kamis pagi pukul 08.00)
 Penyelesaian Tugas Kuliah Kimia Umum C (Soal bagi kelompok jadwal kuliah Kamis pagi pukul 08.00) Nama : Archemi Puspita Wijaya NIM : L2C007010 Alamat blog : archemipuspita.wordpress.com 1. Jari-jari ion
Penyelesaian Tugas Kuliah Kimia Umum C (Soal bagi kelompok jadwal kuliah Kamis pagi pukul 08.00) Nama : Archemi Puspita Wijaya NIM : L2C007010 Alamat blog : archemipuspita.wordpress.com 1. Jari-jari ion
C. Reaksi oksidasi reduksi berdasarkan peningkatan dan penurunan bilangan oksidasi. Bilangan Oksidasi (biloks)
 97 Nama : Kelompok : Mata Pelajaran : Kimia Kelas/Semester : X 5 /2 Alokasi Waktu : 2 x 45 menit. Materi pokok : Konsep Redoks Standar Kompetensi : 3. Memahami sifat-sifat larutan elektrolit dan non elektrolit
97 Nama : Kelompok : Mata Pelajaran : Kimia Kelas/Semester : X 5 /2 Alokasi Waktu : 2 x 45 menit. Materi pokok : Konsep Redoks Standar Kompetensi : 3. Memahami sifat-sifat larutan elektrolit dan non elektrolit
IKATAN KIMIA Isana SYL
 IKATAN KIMIA Isana SYL IKATAN KIMIA Kebahagiaan atom Konfigurasi i elektronik stabil Konfigurasi elektronik gas mulia / gas lamban (Energi ionisasi relatif besar dan afinitas elektron relatif kecil) Ada
IKATAN KIMIA Isana SYL IKATAN KIMIA Kebahagiaan atom Konfigurasi i elektronik stabil Konfigurasi elektronik gas mulia / gas lamban (Energi ionisasi relatif besar dan afinitas elektron relatif kecil) Ada
Rangkuman bentuk Molekul
 Rangkuman bentuk Molekul Menggambarkan Molekul dan Ion Dengan Struktur Lewis Langkah pertama dalam menggambarkan rumus struktur molekul dengan metode Lewis, dilakukan dengan cara menggambarkan atom-atom
Rangkuman bentuk Molekul Menggambarkan Molekul dan Ion Dengan Struktur Lewis Langkah pertama dalam menggambarkan rumus struktur molekul dengan metode Lewis, dilakukan dengan cara menggambarkan atom-atom
BAB 2 STRUKTUR ATOM PERKEMBANGAN TEORI ATOM
 BAB 2 STRUKTUR ATOM PARTIKEL MATERI Bagian terkecil dari materi disebut partikel. Beberapa pendapat tentang partikel materi :. Menurut Democritus, pembagian materi bersifat diskontinyu ( jika suatu materi
BAB 2 STRUKTUR ATOM PARTIKEL MATERI Bagian terkecil dari materi disebut partikel. Beberapa pendapat tentang partikel materi :. Menurut Democritus, pembagian materi bersifat diskontinyu ( jika suatu materi
Ikatan Kimia II: VSEPR dan prediksi geometri Molekular, teori ikatan valensi dan Hibridisasi Orbital Atom; teori orbital atom
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Chapter 3c Ikatan Kimia II: dan prediksi geometri ar, teori ikatan valensi dan
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Chapter 3c Ikatan Kimia II: dan prediksi geometri ar, teori ikatan valensi dan
Kimia Organik I. Pertemuan ke 1 Indah Solihah
 Kimia Organik I Pertemuan ke 1 Indah Solihah Some organic chemicals DNA Medicines Active Pharmaceutical Ingredients Excipients Fuels Materials Essential oils Pigments Farmakodinamik Farmakokinetik Kimia
Kimia Organik I Pertemuan ke 1 Indah Solihah Some organic chemicals DNA Medicines Active Pharmaceutical Ingredients Excipients Fuels Materials Essential oils Pigments Farmakodinamik Farmakokinetik Kimia
LOGO ANALISIS KUALITATIF KATION DAN ANION
 LOGO ANALISIS KUALITATIF KATION DAN ANION By Djadjat Tisnadjaja 1 Jenis analisis Analisis makro Kuantitas zat 0,5 1 g Volume yang dipakai sekitar 20 ml Analisis semimikro Kuatitas zat sekitar 0,05 g Volume
LOGO ANALISIS KUALITATIF KATION DAN ANION By Djadjat Tisnadjaja 1 Jenis analisis Analisis makro Kuantitas zat 0,5 1 g Volume yang dipakai sekitar 20 ml Analisis semimikro Kuatitas zat sekitar 0,05 g Volume
(2) kekuatan ikatan yang dibentuk untuk karbon;
 Reaksi Subsitusi Nukleofilik Alifatik Reaksi yang berlangsung karena penggantian satu atau lebih atom atau gugus dari suatu senyawa oleh atom atau gugus lain disebut reaksi substitusi. Bila reaksi substitusi
Reaksi Subsitusi Nukleofilik Alifatik Reaksi yang berlangsung karena penggantian satu atau lebih atom atau gugus dari suatu senyawa oleh atom atau gugus lain disebut reaksi substitusi. Bila reaksi substitusi
LEMBARAN SOAL 6. Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA )
 LEMBARAN SOAL 6 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
LEMBARAN SOAL 6 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
BAB FISIKA ATOM. Model ini gagal karena tidak sesuai dengan hasil percobaan hamburan patikel oleh Rutherford.
 1 BAB FISIKA ATOM Perkembangan teori atom Model Atom Dalton 1. Atom adalah bagian terkecil dari suatu unsur yang tidak dapat dibagi-bagi 2. Atom-atom suatu unsur semuanya serupa dan tidak dapat berubah
1 BAB FISIKA ATOM Perkembangan teori atom Model Atom Dalton 1. Atom adalah bagian terkecil dari suatu unsur yang tidak dapat dibagi-bagi 2. Atom-atom suatu unsur semuanya serupa dan tidak dapat berubah
Menggambarkan Molekul dan Ion dengan struktur Lewis Menggunakan Aturan Oktet untuk Menuliskan Struktur Lewis
 2012 Menggambarkan Molekul dan Ion dengan struktur Lewis Untuk menggambarkan suatu molekul bisa dengan cara merubah rumus molekul menjadi struktur lewis dengan aturan oktet. Menggunakan Aturan Oktet untuk
2012 Menggambarkan Molekul dan Ion dengan struktur Lewis Untuk menggambarkan suatu molekul bisa dengan cara merubah rumus molekul menjadi struktur lewis dengan aturan oktet. Menggunakan Aturan Oktet untuk
BAB I PENDAHULUAN Latar Belakang
 BAB I PENDAHULUAN 1.1. Latar Belakang Logam-logam yang bernilai ekonomi sangat tinggi, diantaranya emas, perak, platina, dan paladium, dikenal sebagai logam-logam yang berharga. Platina sangat berguna
BAB I PENDAHULUAN 1.1. Latar Belakang Logam-logam yang bernilai ekonomi sangat tinggi, diantaranya emas, perak, platina, dan paladium, dikenal sebagai logam-logam yang berharga. Platina sangat berguna
Bentuk-Bentuk Molekul
 Bentuk-Bentuk Molekul Di bab ini, kita akan mempelajari bagaimana cara mengubah rumus molekul dari suatu senyawa menjadi sebuah rumus struktur senyawa dalam bentuk dua dimensi yang memperlihatkan hubungan
Bentuk-Bentuk Molekul Di bab ini, kita akan mempelajari bagaimana cara mengubah rumus molekul dari suatu senyawa menjadi sebuah rumus struktur senyawa dalam bentuk dua dimensi yang memperlihatkan hubungan
IKATAN KIMIA BY. V_CVA MAN RETA 2010/2011
 IKATAN KIMIA BY. V_CVA MAN RETA 2010/2011 ATOM STABIL Suatu atom dikatakan stabil jika: 1. Sukar bereaksi dengan atom/unsur lain (golongan VIII A ) 2. Elektron valensinya berisi penuh elektron yaitu berisi
IKATAN KIMIA BY. V_CVA MAN RETA 2010/2011 ATOM STABIL Suatu atom dikatakan stabil jika: 1. Sukar bereaksi dengan atom/unsur lain (golongan VIII A ) 2. Elektron valensinya berisi penuh elektron yaitu berisi
LAPORAN PRAKTIKUM KIMIA ANORGANIK I PERCOBAAN V
 LAPORAN PRAKTIKUM KIMIA ANORGANIK I PERCOBAAN V PEMBUATAN GARAM KOMPLEKS TETRA AMIN TEMBAGA (II) SULFAT MONOHIDRAT Cu(NH 3 ) H O DAN GARAM RANGKAP AMONIUM TEMBAGA (II) SULFAT HEKSAHIDRAT Cu(SO ).6HO OLEH:
LAPORAN PRAKTIKUM KIMIA ANORGANIK I PERCOBAAN V PEMBUATAN GARAM KOMPLEKS TETRA AMIN TEMBAGA (II) SULFAT MONOHIDRAT Cu(NH 3 ) H O DAN GARAM RANGKAP AMONIUM TEMBAGA (II) SULFAT HEKSAHIDRAT Cu(SO ).6HO OLEH:
Ringkasan BAB 10. Langkah-langkah penulisan struktur lewis untuk molekul dengan ikatan tunggal.
 Ringkasan BAB 10 1. Struktur lewis untuk molekul ikatan tunggal Langkah-langkah penulisan struktur lewis untuk molekul dengan ikatan tunggal. Langkah 1, tempatkan atom dari golongan yang lebih kecil ditengah
Ringkasan BAB 10 1. Struktur lewis untuk molekul ikatan tunggal Langkah-langkah penulisan struktur lewis untuk molekul dengan ikatan tunggal. Langkah 1, tempatkan atom dari golongan yang lebih kecil ditengah
ORBITAL DAN IKATAN KIMIA ORGANIK
 ORBITAL DAN IKATAN KIMIA ORGANIK Objektif: Pada Bab ini, mahasiswa diharapkan untuk dapat memahami, Teori dasar orbital atom dan ikatan kimia organik, Orbital molekul orbital atom dan Hibridisasi orbital
ORBITAL DAN IKATAN KIMIA ORGANIK Objektif: Pada Bab ini, mahasiswa diharapkan untuk dapat memahami, Teori dasar orbital atom dan ikatan kimia organik, Orbital molekul orbital atom dan Hibridisasi orbital
Tabel Periodik Unsur. Keperiodikan=keteraturan Kemiripan di antara sifat unsur secara teratur & periodik jika unsur diatur menurut bobot atom (ba).
 Tabel Periodik Unsur Keperiodikan=keteraturan Kemiripan di antara sifat unsur secara teratur & periodik jika unsur diatur menurut bobot atom (ba). Perkembangan Tabel Periodik Lavosier (1769) Unsur: logam
Tabel Periodik Unsur Keperiodikan=keteraturan Kemiripan di antara sifat unsur secara teratur & periodik jika unsur diatur menurut bobot atom (ba). Perkembangan Tabel Periodik Lavosier (1769) Unsur: logam
Disusun Oeh: Fanji Satria JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO SEMARANG
 Disusun Oeh: Fanji Satria 21030112140051 JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO SEMARANG Menggambarkan Molekul dan Ion dengan Struktur Lewis Penyusunan struktur Lewis dari suatu atom
Disusun Oeh: Fanji Satria 21030112140051 JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO SEMARANG Menggambarkan Molekul dan Ion dengan Struktur Lewis Penyusunan struktur Lewis dari suatu atom
Pembuatan Garam Kompleks dan Garam Rangkap.
 A. JUDUL PERCOBAAN Pembuatan Garam Kompleks dan Garam Rangkap. B. TUJUAN PERCOBAAN Mahasiswa diharapkan mampu mempelajari pembuatan dan sifat-sifat garam rangkap kupri ammonium sulfat dan garam kompleks
A. JUDUL PERCOBAAN Pembuatan Garam Kompleks dan Garam Rangkap. B. TUJUAN PERCOBAAN Mahasiswa diharapkan mampu mempelajari pembuatan dan sifat-sifat garam rangkap kupri ammonium sulfat dan garam kompleks
TUGAS KIMIA UMUM C (kelompok jadual kuliah Kamis Pagi jam 08.00) 1. The radii of the sodium and potassium ions are 102 pm and 138 pm, respectively.
 TUGAS KIMIA UMUM C (kelompok jadual kuliah Kamis Pagi jam 08.00) 1. The radii of the sodium and potassium ions are 102 pm and 138 pm, respectively. Which compound has stronger ionic attractions, sodium
TUGAS KIMIA UMUM C (kelompok jadual kuliah Kamis Pagi jam 08.00) 1. The radii of the sodium and potassium ions are 102 pm and 138 pm, respectively. Which compound has stronger ionic attractions, sodium
