MODUL VI KIMIA KOORDINASI
|
|
|
- Shinta Kurniawan
- 7 tahun lalu
- Tontonan:
Transkripsi
1 MODUL VI KIMIA KOORDINASI I. Petunjuk Umum 1. Kompetensi Dasar 1) Mahasiswa memahami definisi senyawa komplek 2) Mahasiswa memahami Teori Koordinasi Werner 3) Mahasiswa memahami jenis-jenis ligan 4) Mahasiswa memahami konsep penamaan senyawa komplek 2. Materi Perkuliahan 1) Definisi Senyawa Komplek 2) Interaksi Ion Logam Pusat dengan Ligan 3) Jenis-jenis Ligan 4) Penamaan Senyawa Komplek 3. Indikator Pencapaian 1) Mahasiswa mampu menjelaskan komposisi dari senyawa komplek 2) Mahasiswa mampu menjelaslaskan Teori Koordinasi Werner dan postulatnya 3) Mahasiswa mampu menyebutkan jenis-jenis ligan dan contohnya 4) Mahasiswa mempu menyebutkan nama senyawa komplek dari strukturnya dan sebaliknya 4. Referensi Chang, R., 2005, Kimia Dasar : Konsep-Konsep Inti, Jilid 2, Penerbit Erlangga, Jakarta Saputro, A.N.C., _, Coordination Chemistry, Lecture Presentation, 5. Strategi Pembelajaran Pembelajaran dilakukan dengan penyampaian materi perkuliahan secara interaktif yang melibatkan partisipasi dosen dan mahasiswa selama satu kali tatap muka setiap 1 pekan dengan bobot 2 SKS. 6. Lembar Kegiatan Pembelajaran 1) Berusaha mempelajari materi sebelum perkuliahan dimulai 2) Memahami materi setelah mengikuti perkuliahan 3) Melakukan kegiatan belajar mandiri melalui tugas yang diberikan 4) Melakukan latihan dalam memecahkan permasalahan dan mendiskusikannya 7. Evaluasi 1) Post test 2) UTS Versi : 1 Revisi : 0 Halaman : 1 dari 5
2 II. Materi Kuliah Sejarah dan Definisi Senyawa Komplek Logam-logam transisi, seperti telah dijelaskan dalam modul V, memiliki sifat salah satunya dapat membentuk senyawa berwarna, dimana senyawa berwarna ini tidak lain adalah senyawa koordinasi atau senyawa komplek. Jadi dalam lingkup kimia koordinasi dipelajari sifat-sifat dari senyawa komplek tersebut. Teori Koordinasi Werner Kimiawan pertama yang mempelajari berbagai sifat dan karakteristik dari senyawa komplek adalah Alfred Werner (kimiawan dari Swiss). Ia pada tahun 1893 mengajukan suatu teori yang disebut Teori Koordinasi. Dalam teorinya Werner mengusulkan tiga postulat yaitu : 1. Kebanyakan unsur memiliki dua jenis valensi, yaitu valensi primer dan valensi sekunder. Valensi primer (yang sekarang disebut bilangan oksidasi) dapat terionisasi sedangkan valensi sekunder (yang sekarang disebut bilangan koordinasi) tidak dapat terionisasi. 2. Valensi sekunder harus dipenuhi oleh anion atau molekul dengan pasangan elektron bebas 3. Valensi sekunder memiliki ruang dan struktur geometri tertentu Sebagai contoh adalah senyawa CoCl 3.6NH 3, valensi primer adalah 3 (bilangan oksidasi Co : 3+) dan valensi sekunder adalah 6 (6 molekul NH 3 diikat secara kovalen koordinasi). Ion Cl - bukan bagian dari ion komplek, tetapi terikat ke ion komplek oleh gaya ionik. Sekarang kita menuliskan senyawa tersebut, yang merupakan senyawa komplek, sebagai Co(NH 3 ) 6 Cl 3. Senyawa komplek adalah senyawa yang mengandung logam pusat dan ligan dimana keduanya terikat secara kovalen koordinasi. Logam pusat umumnya merupakan logam transisi sedangkan ligan dapat berupa kation (NH 4 + ), anion (Cl -, C 2 O 4 2-, molekul kecil (H 2 O, NH 3 ) atau makro molekul (protein). Senyawa komplek dapat berupa senyawa ionik maupun netral. Interaksi Ion Logam Pusat dengan Ligan Interaksi antara ion logam pusat dengan ligan adalah seperti interaksi asam dengan basa Lewis. Teori asam-basa Lewis menyebutkan bahwa asam adalah spesies yang menerima pasangan elektron sedangkan basa adalah spesies yang mendonorkan pasangan elektron. Dalam ion komplek, ligan bertindak sebagai basa Lewis (donor pasangan elektron) dengan menyumbangkan pasangan elektronnya pada ion logam pusat (yang menyediakan orbital kosong), sehingga ion logam pusat merupakan asam Lewis (aseptor pasangan elektron). Oleh karena itu syarat suatu spesies dapat bertindak sebagai ligan adalah memiliki pasangan elektron bebas. Asam Lewis + Basa Lewis Ion Komplek Fe 3+ (aq) + 6 CN - (aq) Fe(CN) 6 3- (aq) Ni 2+ (aq) + 6 NH 3(aq) Ni(NH 3 ) 6 4- (aq) Jumlah ikatan koordinasi yang terbentuk antara ligan dan logam pusat disebut bilangan koordinasi. Baik Fe(CN) 6 3- maupun Ni(NH 3 ) 6 4- memiliki bilangan koordinasi 6. Versi : 1 Revisi : 0 Halaman : 2 dari 5
3 Ligan Muatan ion komplek Counter Ion K 3 Fe(CN) 6 3- Ion logam pusat Bilangan koordinasi Jenis-jenis Ligan Syarat suatu spesies untuk dapat menjadi ligan adalah memiliki pasangan elektron bebas. Ligan dibedakan menjadi : a. Monodentat (unidentat) Ligan monodentat adalah ligan yang hanya mampu menyumbangkan satu pasang elektron bebas saja atau dengan kata lain hanya dapat membentuk satu ikatan kovalen koordinasi dengan ion logam pusat. Kebanyakan ligan adalah monodentat, misalnya Cl -, Br -, H 2 O, NH 3, dan OH -. Walaupun ion atau molekul ini memiliki lebih dari satu pasang elektron bebas tetapi yang dapat disumbangkan ke ion logam pusat hanya satu pasang (mono : satu, dent : gigi). b. Bidentat Ligan bidentat dapat menyumbangkan dua pasang elektron bebasnya pada ion logam pusat (memiliki dua gigi ) sehingga membentuk dua ikatan kovalen koordinasi. Contoh ligan bidentat adalah sebagai berikut : Dimana bipy en dppe acac ox : 2,2'-bipyridine, : ethylenediamine, : diphenylphosphinoethane, : acetylacetonate : oxalate c. Tridentat Dien atau dietilentriamin adalah salah satu contoh ligan tridentat, yaitu ligan yang dapat menyumbangkan 3 pasang elektron pada ion logam pusat. Versi : 1 Revisi : 0 Halaman : 3 dari 5
4 d. Polidentat (multidentat) Suatu molekul yang dapat menyumbangkan lebih dari tiga pasang elektron bebas disebut polidentat, misalnya etilendiamintetraasetat (EDTA) e. Chelating Ligan Ligan yang mampu menyumbangkan lebih dari satu pasang elektron bebas akan berikatan dengan ion logam pusat dengan membentuk cincin, senyawa seperti ini disebut senyawa chelat sedangkan ligannya disebut chelating ligan. Versi : 1 Revisi : 0 Halaman : 4 dari 5
5 Etilendiamin (en) ion oksalat Tata Nama/Nomenclature Senyawa Komplek Tata tulis rumus kimia (formula) senyawa komplek. Senyawa komplek ionik tersusun dari ion komplek dan ion penyeimbang (counter ion). Tata tulis ion komplek didasarkan aturan yang direkomendasikan oleh International Union of Pure and Applied Chemistry (IUPAC) yaitu sebagai berikut : 1. Urutan penulisan lambang atom Ion logam pusat ditulis paling depan, diikuti oleh ligan-ligan negatif yang disusun secara alfabetik, kemudian ligan-ligan netral yang juga disusun secara alfabetik. atom pusat-ligan negatif-ligan netral 2. Pemakaian tanda kurung Rumus kimia seluruh anggota ion kompleks, baik bermuatan atau netral ditulis dalam tanda kurung siku, [ ]. Rumus kimia ligan poliatomik maupun singkatan ligan ditulis dalam tanda kurung kecil ( ). Tidak ada spasi yang memisahkan antar ligan dalam formula kompleks. [atom pusat(ligan negatif)(ligan netral)] 3. Muatan ionik dan bilangan oksidasi Muatan ion kompleks ditulis di luar kurung siku [ ] sebelah kanan sebagai supercript dengan tanda plus atau minus mengikuti nomor muatannya. Bilangan oksidasi atom pusat mungkin dituliskan dengan angka Romawi di sebelah kanan simbol atom sebagai supercript. Contoh : PtCl 6 3- Cr III (NCS) 4 (NH 3 ) 2 - Co(en) 3 2+ Tata nama senyawa komplek Pada awal dipelajarinya (sebelum tahun 1930) senyawa komplek, nama senyawa komplek diberikan berdasarkan penemunya atau warnanya. Versi : 1 Revisi : 0 Halaman : 5 dari 5
6 Kompleks Nama Rumus sekarang Cr(SCN) 3.NH 4 SCN.2NH 3 PtCl 2.2NH 3 Co(NO 2 ) 3.KNO 2.2NH 3 PtCl 2.KCl.C 2 H 4 Garam Reinecke Garam Magnus Garam Erdmann Garam Zeise NH 4 [Cr(NH 3 ) 2 (NCS) 4 ] [Pt(NH 3 ) 4 ][PrCl 4 ] K[Co(NH 3 ) 2 (NO 2 ) 4 ] K[Pt(C 2 H 4 )Cl 3 ] Kompleks Warna Nama Rumus sekarang CoCl 3.6NH 3 Yellow Luteo complex [Co(NH 3 ) 6 ]Cl 3 CoCl 3.5NH 3 Purple Purpureo complex [Co(NH 3 ) 5 Cl]Cl 2 CoCl 3.4NH 3 Green Praseo complex Trans-[Co(NH 3 ) 4 Cl 2 ]Cl CoCl 3.3NH 3 Violet Violeo complex Cis-[Co(NH 3 ) 4 Cl 2 ]Cl Sekarang tata nama senyawa komplek didasarkan aturan yang dikeluarkan oleh Inorganic Nomenclature Committee of International Union of Pure and Applaied Chemistry. 1. Nama Ligan Berikut adalah tabel nama-nama ligan dan rumus kimianya, Rumus Kimia Nama Ligan Rumus Kimia Nama Ligan H 2 O akua I - iodo NH 3 amin CN - siano CO karbonil SCN - tiosianato NO nitrosil CO 3 2- H 2 NC 2 H 4 NH 2 (en) etilendiamin O 2 2- karbonato perokso OH - hidrokso H - hidrido O 2- okso CH 3 metal F - fluoro C 2 H 5 etil Cl - kloro C 2 O 4 2- oksalato Br - bromo NO 2 nitrito Bila di dalam senyawa kompleks terdapat lebih dari satu macam ligan, urutan penyebutan nama ligan adalah secara alfabetik terlepas dari jumlah dan muatan ligan yang ada. Versi : 1 Revisi : 0 Halaman : 6 dari 5
7 2. Jumlah ligan yang ada dinyatakan dengan awalan di, tri, tetra dan seterusnya. 3. Apabila awalan-awalan tersebut telah digunakan untuk menyebut jumlah substituen yang ada pada ligan, maka jumlah ligan yang ada dinyatakan dengan awalan bis, tris, tetrakis dan seterusnya. Ligan yang terdiri dari dua atau lebih atom ditulis di dalam tanda kurung. 4. Nama senyawa kompleks netral dinyatakan dengan satu kata, sedangkan nama senyawa kompleks ionik dinyatakan dengan dua kata dimana nama kation disebut lebih dahulu, baru anionnya. 5. Kompleks anion, nama logamnya berakhiran at, sedangkan kompleks kation atau netral, nama logamnya tetap. kompleks anion : kromium kromat kobalt kobaltat mangan manganat rhodium rhodat Nama khusus : besi ferat tembaga kuprat perak argentat emas aurat kompleks kation dan netral : kromium kromium kobalt kobalt Contoh : KOMPLEKS NETRAL [BaI 2 (py) 6 ] [Ni(CO) 4 ] [Co(NH 3 ) 3 (NO 2 ) 3 ] [AgCl(PPh 3 ) 3 ] KOMPLEKS IONIK K 3 [Fe(CN) 6 ] K 4 [Fe(CN) 6 ] [V(CO) 5 ] 3- [Fe(CO) 4 ] 2- [Co(en) 2 Cl(NO 2 )]Cl : diiodoheksapiridinbarium(ii) : tetrakarbonilnikel : triamintrinitrokobalt(iii) : klorotris(trifenilfosfina)perak(i) : Kalium heksasianoferat(iii) : Kalium heksasianoferat(ii) : Ion pentakarbonilvanadat(iii) : Ion tetrakarbonilferat(ii) : bisetilendiaminkloronitritokobalt(ii) klorida III. Lembar Kerja Untuk masing ion komplek berikut, tentukan : Atom pusat Ligan Bilangan koordinasi Nama Versi : 1 Revisi : 0 Halaman : 7 dari 5
8 a. [Cu(NH 3 ) 4 (H 2 O) 2 ] 2+ b. [Al(H 2 O) 2 (OH) 4 ] - c. [Ni(en) 3 ] 2+ d. Cu(EDTA) 2- e. Al(NH 2 CH 2 CH 2 NH 2 ) 3 3+ f. [Cr(NH 3 ) 4 Cl 2 ]Br g. K 3 [Cr (C 2 O 4 ) 3 ] Versi : 1 Revisi : 0 Halaman : 8 dari 5
SENYAWA KOORDINASI Putri Anjarsari, S.Si., M.Pd
 SENYAWA KOORDINASI Putri Anjarsari, S.Si., M.Pd putri_anjarsari@uny.ac.id Pengertian Senyawa Koordinasi Senyawa koordinasi adalah senyawa yang mengandung satu atau lebih ion kompleks dengan sejumlah kecil
SENYAWA KOORDINASI Putri Anjarsari, S.Si., M.Pd putri_anjarsari@uny.ac.id Pengertian Senyawa Koordinasi Senyawa koordinasi adalah senyawa yang mengandung satu atau lebih ion kompleks dengan sejumlah kecil
Coordination Chemistry
 Lecture Presentation Coordination Chemistry By : Agung Nugroho Catur Saputro, S.Pd., M.Sc NIP. 19770723 200501 1 001 JENIS-JENIS LIGAN DAN TATA NAMA SENYAWA KOMPLEKS o o o o o Menentukan atom pusat, bilangan
Lecture Presentation Coordination Chemistry By : Agung Nugroho Catur Saputro, S.Pd., M.Sc NIP. 19770723 200501 1 001 JENIS-JENIS LIGAN DAN TATA NAMA SENYAWA KOMPLEKS o o o o o Menentukan atom pusat, bilangan
Bab 11 Senyawa Koordinasi
 Bab 11 http://chem.fmipa.ipb.ac.id Cisplatin (cis-pt(nh 3 ) 2 Cl 2 ) Cisplatin menghancurkan sel kanker untuk bereproduksi dengan mengubah konfigurasi DNAnya 1 Ikthisar Sumber: Chang Bab 20 1 Kimia Logam
Bab 11 http://chem.fmipa.ipb.ac.id Cisplatin (cis-pt(nh 3 ) 2 Cl 2 ) Cisplatin menghancurkan sel kanker untuk bereproduksi dengan mengubah konfigurasi DNAnya 1 Ikthisar Sumber: Chang Bab 20 1 Kimia Logam
Senyawa Koordinasi (senyawa kompleks)
 Senyawa Koordinasi (senyawa kompleks) Salah satu keistimewaan logam transisi adalah dapat membentuk senyawa klompeks, yaitu senyawa yang paling sedikit terdiri dari satu ion kompleks (terdiri dari kation
Senyawa Koordinasi (senyawa kompleks) Salah satu keistimewaan logam transisi adalah dapat membentuk senyawa klompeks, yaitu senyawa yang paling sedikit terdiri dari satu ion kompleks (terdiri dari kation
1.1 Senyawa Koordinasi (Coordination Coumpond)
 1.1 Senyawa Koordinasi (Coordination Coumpond) Sifat yang paling khas pada logam transisi adalah tentang persenyawaan dan ikatannya. Yang biasa disebut dengan ion kompleks. Ion kompleks sendiri terdiri
1.1 Senyawa Koordinasi (Coordination Coumpond) Sifat yang paling khas pada logam transisi adalah tentang persenyawaan dan ikatannya. Yang biasa disebut dengan ion kompleks. Ion kompleks sendiri terdiri
8.4 Senyawa Kompleks
 8.4 Senyawa Kompleks Alfred Werner (1866-1919): kelompok baru senyawa logam transisi yang terdiri dari ion logam transisi (LT) yang dikelilingi oleh ion atau molekul yang lain. Ion atau molekul yang terikat
8.4 Senyawa Kompleks Alfred Werner (1866-1919): kelompok baru senyawa logam transisi yang terdiri dari ion logam transisi (LT) yang dikelilingi oleh ion atau molekul yang lain. Ion atau molekul yang terikat
Bahasan. Senyawa Koordinasi. Bahasan. 1. Teori Werner tentang Senyawa Koordinasi : Tinjauan Ulang. Irwansyah, M.Si
 Bahasan Ion Kompleks dan 1 Teori Werner tentang Senyawa koordinasi : Tinjauan Ulang 2 Ligan 3 Tatanama 4 Isomerisasi 5 Ikatan dalam Ion Kompleks : Teori Medan Kristal 6 Sifat Magnet dan Teori Medan Kristal
Bahasan Ion Kompleks dan 1 Teori Werner tentang Senyawa koordinasi : Tinjauan Ulang 2 Ligan 3 Tatanama 4 Isomerisasi 5 Ikatan dalam Ion Kompleks : Teori Medan Kristal 6 Sifat Magnet dan Teori Medan Kristal
SENYAWA KOMPLEKS. Definisi. Ion Kompleks. Bilangan koordinasi, geometri, dan ligan RINGKASAN MATERI
 KIMIA ANORGANIK 14 OKTOBER 2012 RINGKASAN MATERI SENYAWA KOMPLEKS Definisi Senyawa kompleks itu: Ada ion logam sebagai atom pusat Ada ligan yang berupa anion atau molekul netral Memiliki counter ion supaya
KIMIA ANORGANIK 14 OKTOBER 2012 RINGKASAN MATERI SENYAWA KOMPLEKS Definisi Senyawa kompleks itu: Ada ion logam sebagai atom pusat Ada ligan yang berupa anion atau molekul netral Memiliki counter ion supaya
Senyawa Koordinasi. Kompleks ion dengan pusat d B memiliki empat ligan dengan dengan bentuk persegi planar (B)
 Senyawa Koordinasi Aspek umum dari logam transisi adalah pembentukan dari senyawa koordinasi (kompleks). Senyawa koordinasi ini setidaknya memiliki satu ion kompleks yang terdiri dari logam kation yang
Senyawa Koordinasi Aspek umum dari logam transisi adalah pembentukan dari senyawa koordinasi (kompleks). Senyawa koordinasi ini setidaknya memiliki satu ion kompleks yang terdiri dari logam kation yang
Senyawa Koordinasi. Ion kompleks memiliki ciri khas yaitu bilangan koordinasi, geometri, dan donor atom:
 Senyawa Koordinasi Terdiri dari atom pusat (kation logam transisi), ligan(molekul yang terikat pada ion kompleks) dan di netralkan dengan bilangan koordinasi. Dari gambar [Co(NH 3 )6]CI 3, 6 molekul NH3
Senyawa Koordinasi Terdiri dari atom pusat (kation logam transisi), ligan(molekul yang terikat pada ion kompleks) dan di netralkan dengan bilangan koordinasi. Dari gambar [Co(NH 3 )6]CI 3, 6 molekul NH3
Kegiatan Belajar 4 Kimia Unsur. Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada materi Kimia Unsur.
 1 Kegiatan Belajar 4 Kimia Unsur Capaian Pembelajaran Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada materi Kimia Unsur. Subcapaian pembelajaran: 1. Menjelaskan sifat unsur golongan
1 Kegiatan Belajar 4 Kimia Unsur Capaian Pembelajaran Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada materi Kimia Unsur. Subcapaian pembelajaran: 1. Menjelaskan sifat unsur golongan
BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI
 BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI A. STANDAR KOMPETENSI Mendiskripsikan hukumhukum dasar kimia dan penerapannya dalam perhitungan kimia. B. Kompetensi Dasar : Menuliskan nama senyawa anorganik
BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI A. STANDAR KOMPETENSI Mendiskripsikan hukumhukum dasar kimia dan penerapannya dalam perhitungan kimia. B. Kompetensi Dasar : Menuliskan nama senyawa anorganik
I. PENDAHULUAN. Kualitas udara yang dipergunakan untuk kehidupan tergantung dari lingkungannya. Udara
 I. PENDAHULUAN 1.1 Latar Belakang Masalah Kualitas udara yang dipergunakan untuk kehidupan tergantung dari lingkungannya. Udara mengandung sejumlah oksigen, yang merupakan komponen esensial bagi kehidupan,
I. PENDAHULUAN 1.1 Latar Belakang Masalah Kualitas udara yang dipergunakan untuk kehidupan tergantung dari lingkungannya. Udara mengandung sejumlah oksigen, yang merupakan komponen esensial bagi kehidupan,
COORDINATION COMPOUND. Disusun oleh : Bintang Ayu Kalimantini NIM : KELAS D 10.30
 COORDINATION COMPOUND Disusun oleh : Bintang Ayu Kalimantini NIM : 21030112120019 KELAS D 10.30 S enyawa kompleks ditemukan sekitar tahun 1890an oleh Alfred Werner. Senyawa kompleks terdiri dari setidaknya
COORDINATION COMPOUND Disusun oleh : Bintang Ayu Kalimantini NIM : 21030112120019 KELAS D 10.30 S enyawa kompleks ditemukan sekitar tahun 1890an oleh Alfred Werner. Senyawa kompleks terdiri dari setidaknya
Tabel Periodik Unsur. Keperiodikan=keteraturan Kemiripan di antara sifat unsur secara teratur & periodik jika unsur diatur menurut bobot atom (ba).
 Tabel Periodik Unsur Keperiodikan=keteraturan Kemiripan di antara sifat unsur secara teratur & periodik jika unsur diatur menurut bobot atom (ba). Perkembangan Tabel Periodik Lavosier (1769) Unsur: logam
Tabel Periodik Unsur Keperiodikan=keteraturan Kemiripan di antara sifat unsur secara teratur & periodik jika unsur diatur menurut bobot atom (ba). Perkembangan Tabel Periodik Lavosier (1769) Unsur: logam
FAKULTAS TEKNIK UNIVERSITAS NEGERI YOGYAKARTA BAHAN AJAR KIMIA DASAR BAB II RUMUS KIMIA DAN TATANAMA
 No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 6 BAB II RUMUS KIMIA DAN TATANAMA A. Rumus Kimia Rumus kimia merupakan kumpulan lambang atom dengan komposisi tertentu. Rumus kimia terdiri dari
No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 6 BAB II RUMUS KIMIA DAN TATANAMA A. Rumus Kimia Rumus kimia merupakan kumpulan lambang atom dengan komposisi tertentu. Rumus kimia terdiri dari
Kimia Koordinasi SOAL LATIHAN. Jawab soal sudah tersedia. Selesaikan soalnya, dan pelajari mengapa dipilih jawaban tersebut
 Kimia Koordinasi SOAL LATIHAN Jawab soal sudah tersedia. Selesaikan soalnya, dan pelajari mengapa dipilih jawaban tersebut 1. Suatu logam nickel dapat ditulis sebagai [Ar] 4s 2 3d 8, manakah representasi
Kimia Koordinasi SOAL LATIHAN Jawab soal sudah tersedia. Selesaikan soalnya, dan pelajari mengapa dipilih jawaban tersebut 1. Suatu logam nickel dapat ditulis sebagai [Ar] 4s 2 3d 8, manakah representasi
BAB I PENDAHULUAN Latar Belakang
 BAB I PENDAHULUAN 1.1. Latar Belakang Logam-logam yang bernilai ekonomi sangat tinggi, diantaranya emas, perak, platina, dan paladium, dikenal sebagai logam-logam yang berharga. Platina sangat berguna
BAB I PENDAHULUAN 1.1. Latar Belakang Logam-logam yang bernilai ekonomi sangat tinggi, diantaranya emas, perak, platina, dan paladium, dikenal sebagai logam-logam yang berharga. Platina sangat berguna
Tata Nama Senyawa Kimia
 ~CO2 = KARBONDIOKSIDA ~NaCl = NATRIUM KLORIDA ~CH3COOH = CUKA / ASAM ASETAT ~H2SO4 = ASAM SULFAT ~Na2CO3 = NATRIUM KARBONAT ~MgCO3 = MAGNESIUM KARBONAT ~NaOH = NATRIUM KARBONAT ~(NH4)2SO4 = AMONIUM SULFAT
~CO2 = KARBONDIOKSIDA ~NaCl = NATRIUM KLORIDA ~CH3COOH = CUKA / ASAM ASETAT ~H2SO4 = ASAM SULFAT ~Na2CO3 = NATRIUM KARBONAT ~MgCO3 = MAGNESIUM KARBONAT ~NaOH = NATRIUM KARBONAT ~(NH4)2SO4 = AMONIUM SULFAT
TITRASI PEMBENTUKAN KOMPLEKS. Drs. DJADJAT TISNADJAJA, M.Tech.
 TITRASI PEMBENTUKAN KOMPLEKS Drs. DJADJAT TISNADJAJA, M.Tech. 1 Pendahuluan Salah satu tipe reaksi kimia yang berlaku sebagai dasar penentuan titrimetrik melibatkan pembentukan kompleks atau ion kompleks
TITRASI PEMBENTUKAN KOMPLEKS Drs. DJADJAT TISNADJAJA, M.Tech. 1 Pendahuluan Salah satu tipe reaksi kimia yang berlaku sebagai dasar penentuan titrimetrik melibatkan pembentukan kompleks atau ion kompleks
7) Diketahui 20 X dan 35 Y. Jika keduanya berikatan, tentukan: a. Jenis ikatannya? ikatan ion b. rumus senyawa yang terbentuk. c.
 Ikatan Kimia 1. Di antara spesi berikut yang memiliki konfigurasi stabil adalah : 1) 11 Na + (stabil) 2) 18 X (stabil) 3) 17 Y (stabil) 4) 20 Ca (tidak stabil) 5) 35 Br stabil) Tulis formula elektron masing-masing
Ikatan Kimia 1. Di antara spesi berikut yang memiliki konfigurasi stabil adalah : 1) 11 Na + (stabil) 2) 18 X (stabil) 3) 17 Y (stabil) 4) 20 Ca (tidak stabil) 5) 35 Br stabil) Tulis formula elektron masing-masing
Bilangankoordinasi, bentukgeometri, danligandarisenyawakompleks
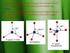 Senyawakoordinasi Senyawa koordinasi (coordination coumpounds) yang disebut juga kompleks adalah senyawa yang memiliki paling sedikit satu ion kompleks dengan kation sebagai pusat kompleks dan anion sebagailigan
Senyawakoordinasi Senyawa koordinasi (coordination coumpounds) yang disebut juga kompleks adalah senyawa yang memiliki paling sedikit satu ion kompleks dengan kation sebagai pusat kompleks dan anion sebagailigan
I. PENDAHULUAN. senyawa kompleks bersifat sebgai asam Lewis sedangkan ligan dalam senyawa
 I. PENDAHULUAN A. Latar Belakang Senyawa kompleks merupakan senyawa yang memiliki warna yang khas yang diakibatkan oleh adanya unsur yang dari golongan transisi yang biasanya berperperan sebagai atom pusat
I. PENDAHULUAN A. Latar Belakang Senyawa kompleks merupakan senyawa yang memiliki warna yang khas yang diakibatkan oleh adanya unsur yang dari golongan transisi yang biasanya berperperan sebagai atom pusat
Untuk penamaan senyawa biner ionik yang dibentuk dari satu unsur logam dan satu
 Tata Nama Senyawa Kimia Bagaimana menyebutkan nama senyawa berdasrkan komponen penyusunnya? Apakah semua senyawa yang telah ditemukan memiliki nama khusus?dulu,senyawa dinamakan sesuai asal ditemukannya,misalnya,asam
Tata Nama Senyawa Kimia Bagaimana menyebutkan nama senyawa berdasrkan komponen penyusunnya? Apakah semua senyawa yang telah ditemukan memiliki nama khusus?dulu,senyawa dinamakan sesuai asal ditemukannya,misalnya,asam
BAB IV BILANGAN OKSIDASI DAN TATA NAMA SENYAWA
 BAB IV BILANGAN OKSIDASI DAN TATA NAMA SENYAWA 1. BILANGAN OKSIDASI Bilangan oksidasi suatu unsur menggambarkan kemampuan unsur tersebut berikatan dengan unsur lain dan menunjukkan bagaimana peranan elektron
BAB IV BILANGAN OKSIDASI DAN TATA NAMA SENYAWA 1. BILANGAN OKSIDASI Bilangan oksidasi suatu unsur menggambarkan kemampuan unsur tersebut berikatan dengan unsur lain dan menunjukkan bagaimana peranan elektron
SENYAWA KOORDINASI Ion kompleks: Angka koordinasi, Geometri, dan Ligan
 SENYAWA KOORDINASI Keistimewaan dari ilmu kimia peralihan logam adalah rumus dari senyawa koordinasi (kompleks). Ada unsur yang berisi paling sedikit satu ion kompleks, yang terdiri dari satu atom pusat
SENYAWA KOORDINASI Keistimewaan dari ilmu kimia peralihan logam adalah rumus dari senyawa koordinasi (kompleks). Ada unsur yang berisi paling sedikit satu ion kompleks, yang terdiri dari satu atom pusat
Tabel Periodik. Bab 3a. Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr.
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Bab 3a Tabel Periodik Kapan unsur-unsur ditemukan? 8.1 1 ns 1 Konfigurasi elektron
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Bab 3a Tabel Periodik Kapan unsur-unsur ditemukan? 8.1 1 ns 1 Konfigurasi elektron
I. PENDAHULUAN. Pencemaran udara adalah masuknya, atau tercampurnya unsur-unsur berbahaya ke dalam
 I. PENDAHULUAN 1.1 Latar Belakang Masalah Pencemaran udara adalah masuknya, atau tercampurnya unsur-unsur berbahaya ke dalam atmosfir yang dapat mengakibatkan terjadinya kerusakan lingkungan, gangguan
I. PENDAHULUAN 1.1 Latar Belakang Masalah Pencemaran udara adalah masuknya, atau tercampurnya unsur-unsur berbahaya ke dalam atmosfir yang dapat mengakibatkan terjadinya kerusakan lingkungan, gangguan
Kimia Koordinasi Teori Ikatan Valensi
 Kimia Koordinasi Teori Ikatan Valensi Beberapa teori telah dirumuskan untuk menjelaskan ikatan dalam senyawaan koordinasi dan untuk merasionalisasi serta meramalkan sifat-sifatnya: teori ikatan valensi,
Kimia Koordinasi Teori Ikatan Valensi Beberapa teori telah dirumuskan untuk menjelaskan ikatan dalam senyawaan koordinasi dan untuk merasionalisasi serta meramalkan sifat-sifatnya: teori ikatan valensi,
Pembuatan Garam Kompleks dan Garam Rangkap.
 A. JUDUL PERCOBAAN Pembuatan Garam Kompleks dan Garam Rangkap. B. TUJUAN PERCOBAAN Mahasiswa diharapkan mampu mempelajari pembuatan dan sifat-sifat garam rangkap kupri ammonium sulfat dan garam kompleks
A. JUDUL PERCOBAAN Pembuatan Garam Kompleks dan Garam Rangkap. B. TUJUAN PERCOBAAN Mahasiswa diharapkan mampu mempelajari pembuatan dan sifat-sifat garam rangkap kupri ammonium sulfat dan garam kompleks
LAPORAN LENGKAP PRAKTIKUM KIMIA ANORGANIK PERCOBAAN 3 PENENTUAN BILANGAN KOORDINAI KOMPLEKS TEMBAGA (II)
 LAPORAN LENGKAP PRAKTIKUM KIMIA ANORGANIK PERCOBAAN 3 PENENTUAN BILANGAN KOORDINAI KOMPLEKS TEMBAGA (II) OLEH : NAMA : IMENG NIM: ACC 109 011 KELOMPOK : 2 ( DUA ) HARI, TANGGAL : RABU, 8 JUNI 2011 ASISTEN
LAPORAN LENGKAP PRAKTIKUM KIMIA ANORGANIK PERCOBAAN 3 PENENTUAN BILANGAN KOORDINAI KOMPLEKS TEMBAGA (II) OLEH : NAMA : IMENG NIM: ACC 109 011 KELOMPOK : 2 ( DUA ) HARI, TANGGAL : RABU, 8 JUNI 2011 ASISTEN
MAKALAH KIMIA. Tata Nama Senyawa Kimia
 MAKALAH KIMIA Tata Nama Senyawa Kimia DI S U S U N OLEH X.1 2015/2016 SMA NEGERI 2 BANTAENG KATA PENGANTAR Segala puji hanya milik Allah SWT. Shalawat dan salam selalu tercurahkan kepada Rasulullah SAW.
MAKALAH KIMIA Tata Nama Senyawa Kimia DI S U S U N OLEH X.1 2015/2016 SMA NEGERI 2 BANTAENG KATA PENGANTAR Segala puji hanya milik Allah SWT. Shalawat dan salam selalu tercurahkan kepada Rasulullah SAW.
LOGO ANALISIS KUALITATIF KATION DAN ANION
 LOGO ANALISIS KUALITATIF KATION DAN ANION BY : Djadjat Tisnadjaja Golongan ketiga Besi (II) dan (III), Alumunium, Kromium (III) dan (VI), nikel, kobalt, Mangan (II) dan (VII) serta Zink Djadjat Tisnadjaja,
LOGO ANALISIS KUALITATIF KATION DAN ANION BY : Djadjat Tisnadjaja Golongan ketiga Besi (II) dan (III), Alumunium, Kromium (III) dan (VI), nikel, kobalt, Mangan (II) dan (VII) serta Zink Djadjat Tisnadjaja,
Ikatan Kimia. 2 Klasifikasi Ikatan Kimia :
 Ikatan Kimia Ikatan Kimia : Gaya tarik yang menyebabkan atom-atom yang terikat satu sama lain dalam suatu kombinasi untuk membentuk senyawa yang lebih kompleks. 2 Klasifikasi Ikatan Kimia : 1. Ikatan ion
Ikatan Kimia Ikatan Kimia : Gaya tarik yang menyebabkan atom-atom yang terikat satu sama lain dalam suatu kombinasi untuk membentuk senyawa yang lebih kompleks. 2 Klasifikasi Ikatan Kimia : 1. Ikatan ion
Peranan elektron dalam pembentukan ikatan kimia
 IKATAN KIMIA IKATAN KIMIA Gaya yang memegangi atom atau ion membentuk molekul atau kristal disebut Ikatan Kimia. Elektron memegang peran penting dalam pembentukan ikatan kimia. Peranan elektron dalam pembentukan
IKATAN KIMIA IKATAN KIMIA Gaya yang memegangi atom atau ion membentuk molekul atau kristal disebut Ikatan Kimia. Elektron memegang peran penting dalam pembentukan ikatan kimia. Peranan elektron dalam pembentukan
Terminologi-Karakteristik-Metode Pendeteksian-Aplikasi, Klasifikasi, Tatanama dan Isomerisasi Senyawa Koordinasi
 Modul 1 Terminologi-Karakteristik-Metode Pendeteksian-Aplikasi, Klasifikasi, Tatanama dan Isomerisasi Senyawa Koordinasi Drs. Momo Rosbiono, M.Pd., M.Si. M PENDAHULUAN odul ini merupakan modul pertama
Modul 1 Terminologi-Karakteristik-Metode Pendeteksian-Aplikasi, Klasifikasi, Tatanama dan Isomerisasi Senyawa Koordinasi Drs. Momo Rosbiono, M.Pd., M.Si. M PENDAHULUAN odul ini merupakan modul pertama
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi. Bab17. Kesetimbangan Asam-Basa dan Kesetimbangan Kelarutan
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Bab17 Kesetimbangan Asam-Basa dan Kesetimbangan Kelarutan Larutan buffer adalah larutan yg terdiri dari: 1. asam lemah/basa
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Bab17 Kesetimbangan Asam-Basa dan Kesetimbangan Kelarutan Larutan buffer adalah larutan yg terdiri dari: 1. asam lemah/basa
LAPORAN PRAKTIKUM KIMIA ANORGANIK I PERCOBAAN V
 LAPORAN PRAKTIKUM KIMIA ANORGANIK I PERCOBAAN V PEMBUATAN GARAM KOMPLEKS TETRA AMIN TEMBAGA (II) SULFAT MONOHIDRAT Cu(NH 3 ) H O DAN GARAM RANGKAP AMONIUM TEMBAGA (II) SULFAT HEKSAHIDRAT Cu(SO ).6HO OLEH:
LAPORAN PRAKTIKUM KIMIA ANORGANIK I PERCOBAAN V PEMBUATAN GARAM KOMPLEKS TETRA AMIN TEMBAGA (II) SULFAT MONOHIDRAT Cu(NH 3 ) H O DAN GARAM RANGKAP AMONIUM TEMBAGA (II) SULFAT HEKSAHIDRAT Cu(SO ).6HO OLEH:
IKATAN KIMIA. RATNAWATI, S.Pd
 IKATAN KIMIA RATNAWATI, S.Pd Tujuan Pembelajaran Setelah mempelajari materi ini, diharapkan siswa dapat: Menjelaskan kecenderungan suatu unsur untuk mencapai kestabilannya Menggambarkan susunan elektron
IKATAN KIMIA RATNAWATI, S.Pd Tujuan Pembelajaran Setelah mempelajari materi ini, diharapkan siswa dapat: Menjelaskan kecenderungan suatu unsur untuk mencapai kestabilannya Menggambarkan susunan elektron
kimia TATA NAMA SENYAWA I
 K-13 Kelas X kimia TATA NAMA ENYAWA I Tujuan Pembelajaran etelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami perbedaan antara senyawa biner dan poliatomik. 2. Memahami
K-13 Kelas X kimia TATA NAMA ENYAWA I Tujuan Pembelajaran etelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami perbedaan antara senyawa biner dan poliatomik. 2. Memahami
LATIHAN SOAL IKATAN KIMIA
 LATIHAN SOAL IKATAN KIMIA 1. Cara untuk mendapatkan ke stabilan atom unsur yang bernomor atom 10 adalah dengan a. Melepaskan dua elektron valensinya membentuk ion dengan muatan +2 b. Mengikat enam elektron
LATIHAN SOAL IKATAN KIMIA 1. Cara untuk mendapatkan ke stabilan atom unsur yang bernomor atom 10 adalah dengan a. Melepaskan dua elektron valensinya membentuk ion dengan muatan +2 b. Mengikat enam elektron
MODUL III KESETIMBANGAN KIMIA
 MODUL III KESETIMBANGAN KIMIA I. Petunjuk Umum 1. Kompetensi Dasar 1) Mahasiswa memahami Asas Le Chatelier 2) Mahasiswa mampu menjelaskan aplikasi reaksi kesetimbangan dalam dunia industry 3) Mahasiswa
MODUL III KESETIMBANGAN KIMIA I. Petunjuk Umum 1. Kompetensi Dasar 1) Mahasiswa memahami Asas Le Chatelier 2) Mahasiswa mampu menjelaskan aplikasi reaksi kesetimbangan dalam dunia industry 3) Mahasiswa
SAP-GARIS-GARIS BESAR PROGRAM PENGAJARAN
 SAP-GARIS-GARIS BESAR PROGRAM PENGAJARAN Mata kuliah : Kimia Kode : Kim 101/3(2-3) Deskripsi : Mata kuliah ini membahas konsep-konsep dasar kimia yang disampaikan secara sederhana, meliputi pengertian
SAP-GARIS-GARIS BESAR PROGRAM PENGAJARAN Mata kuliah : Kimia Kode : Kim 101/3(2-3) Deskripsi : Mata kuliah ini membahas konsep-konsep dasar kimia yang disampaikan secara sederhana, meliputi pengertian
Molekul, Ion dan Senyawa Kimia
 Molekul, Ion dan Senyawa Kimia Drs. Iqmal Tahir, M.Si. iqmal@gadjahmada.edu Molekul - Bentuk satuan terkecil yang dapat diidentifikasikan menjadi unsur-unsur melalui suatu reaksi peruraian dan memiliki
Molekul, Ion dan Senyawa Kimia Drs. Iqmal Tahir, M.Si. iqmal@gadjahmada.edu Molekul - Bentuk satuan terkecil yang dapat diidentifikasikan menjadi unsur-unsur melalui suatu reaksi peruraian dan memiliki
C. Reaksi oksidasi reduksi berdasarkan peningkatan dan penurunan bilangan oksidasi. Bilangan Oksidasi (biloks)
 97 Nama : Kelompok : Mata Pelajaran : Kimia Kelas/Semester : X 5 /2 Alokasi Waktu : 2 x 45 menit. Materi pokok : Konsep Redoks Standar Kompetensi : 3. Memahami sifat-sifat larutan elektrolit dan non elektrolit
97 Nama : Kelompok : Mata Pelajaran : Kimia Kelas/Semester : X 5 /2 Alokasi Waktu : 2 x 45 menit. Materi pokok : Konsep Redoks Standar Kompetensi : 3. Memahami sifat-sifat larutan elektrolit dan non elektrolit
LATIHAN SOAL IKATAN KIMIA
 LATIHAN SAL IKATAN KIMIA 1. Cara untuk mendapatkan kestabilan atom unsur yang bernomor atom 8 adalah dengan a. Melepaskan enam elektron muatan +6 b. Mengikat dua elektron dari atom lain menjadi ion dengan
LATIHAN SAL IKATAN KIMIA 1. Cara untuk mendapatkan kestabilan atom unsur yang bernomor atom 8 adalah dengan a. Melepaskan enam elektron muatan +6 b. Mengikat dua elektron dari atom lain menjadi ion dengan
LAPORAN PRAKTIKUM KIMIA ANORGANIK PERCOBAAN V (STOIKIOMETRI KOMPLEKS AMMIN-TEMBAGA (II))
 LAPORAN PRAKTIKUM KIMIA ANORGANIK PERCOBAAN V (STOIKIOMETRI KOMPLEKS AMMIN-TEMBAGA (II)) OLEH : NAMA : HANIFA NUR HIKMAH STAMBUK : A1C4 09001 KELOMPOK ASISTEN : II (DUA) : ANDI AHMADI LABORATORIUM PENGEMBANGAN
LAPORAN PRAKTIKUM KIMIA ANORGANIK PERCOBAAN V (STOIKIOMETRI KOMPLEKS AMMIN-TEMBAGA (II)) OLEH : NAMA : HANIFA NUR HIKMAH STAMBUK : A1C4 09001 KELOMPOK ASISTEN : II (DUA) : ANDI AHMADI LABORATORIUM PENGEMBANGAN
MAKALAH PENGABDIAN PADA MASYARAKAT TEORI ASAM - BASA. Oleh : M. PRANJOTO UTOMO
 MAKALA PENGABDIAN PADA MASYARAKAT TEORI ASAM - BASA Oleh : M. PRANJOTO UTOMO Makalah ini disampaikan pada kegiatan: Pelatihan Olimpiade SMAN 7 Purworejo Di SMAN 7 Purworejo Pada tanggal 26 28 Februari
MAKALA PENGABDIAN PADA MASYARAKAT TEORI ASAM - BASA Oleh : M. PRANJOTO UTOMO Makalah ini disampaikan pada kegiatan: Pelatihan Olimpiade SMAN 7 Purworejo Di SMAN 7 Purworejo Pada tanggal 26 28 Februari
KIMIA. Sesi KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA. a. Sifat Umum
 KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 12 Sesi NGAN KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA Keteraturan sifat keperiodikan unsur dalam satu periode dapat diamati pada unsur-unsur periode
KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 12 Sesi NGAN KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA Keteraturan sifat keperiodikan unsur dalam satu periode dapat diamati pada unsur-unsur periode
Ikatan yang terjadi antara atom O dengan O membentuk molekul O 2
 Ikatan Kovalen adalah ikatan yang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan. Ikatan kovalen terjadi akibat ketidakmampuan salah 1 atom yang akan berikatan untuk
Ikatan Kovalen adalah ikatan yang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan. Ikatan kovalen terjadi akibat ketidakmampuan salah 1 atom yang akan berikatan untuk
D. 2 dan 3 E. 2 dan 5
 1. Pada suhu dan tekanan sama, 40 ml P 2 tepat habis bereaksi dengan 100 ml, Q 2 menghasilkan 40 ml gas PxOy. Harga x dan y adalah... A. 1 dan 2 B. 1 dan 3 C. 1 dan 5 Kunci : E D. 2 dan 3 E. 2 dan 5 Persamaan
1. Pada suhu dan tekanan sama, 40 ml P 2 tepat habis bereaksi dengan 100 ml, Q 2 menghasilkan 40 ml gas PxOy. Harga x dan y adalah... A. 1 dan 2 B. 1 dan 3 C. 1 dan 5 Kunci : E D. 2 dan 3 E. 2 dan 5 Persamaan
COORDINATION COMPOUNDS
 COORDINATION COMPOUNDS Coordination Compounds (senyawa koordinasi) adalah senyawa yang mengandung paling tidak satu ion komplek, yang merupakan jenis kation logam pusat(baik pada logam transisi ataupun
COORDINATION COMPOUNDS Coordination Compounds (senyawa koordinasi) adalah senyawa yang mengandung paling tidak satu ion komplek, yang merupakan jenis kation logam pusat(baik pada logam transisi ataupun
kimia Kelas X TABEL PERIODIK K-13
 K-13 Kelas X kimia TABEL PERIODIK Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami perkembangan sistem periodik unsur dan kelemahannya. 2. Menentukan
K-13 Kelas X kimia TABEL PERIODIK Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami perkembangan sistem periodik unsur dan kelemahannya. 2. Menentukan
MODUL IV KESETIMBANGAN KELARUTAN
 MODUL IV KESETIMBANGAN KELARUTAN I. Petunjuk Umum 1. Kompetensi Dasar 1) Mahasiswa memahami konsep hubungan kelarutan dengan Ksp 2) Mahasiswa mampu memprediksi terjadinya reaksi pengendapan 3) Mahasiswa
MODUL IV KESETIMBANGAN KELARUTAN I. Petunjuk Umum 1. Kompetensi Dasar 1) Mahasiswa memahami konsep hubungan kelarutan dengan Ksp 2) Mahasiswa mampu memprediksi terjadinya reaksi pengendapan 3) Mahasiswa
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya.
 30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
Pengendapan. Sophi Damayanti
 Titrasi Pengendapan 1 Sophi Damayanti 1. Proses Pelarutan Senyawa ionik dan ionik Dalam keadaan padat: kristal Struktur kristal: Gaya tarik menarik, gaya elektrostatik, ikatan hidrogen dan antaraksi dipol-dipol
Titrasi Pengendapan 1 Sophi Damayanti 1. Proses Pelarutan Senyawa ionik dan ionik Dalam keadaan padat: kristal Struktur kristal: Gaya tarik menarik, gaya elektrostatik, ikatan hidrogen dan antaraksi dipol-dipol
MODUL 9. Satuan Pendidikan : SMA SEDES SAPIENTIAE JAMBU Mata Pelajaran : Kimia Kelas/Semester : X/2
 MODUL 9 Satuan Pendidikan : SMA SEDES SAPIENTIAE JAMBU Mata Pelajaran : Kimia Kelas/Semester : X/2 I. Standar Kompetensi Memahami sifat-sifat larutan nonelektrolit dan elektrolit, serta oksidasi-reduksi.
MODUL 9 Satuan Pendidikan : SMA SEDES SAPIENTIAE JAMBU Mata Pelajaran : Kimia Kelas/Semester : X/2 I. Standar Kompetensi Memahami sifat-sifat larutan nonelektrolit dan elektrolit, serta oksidasi-reduksi.
Analisis Kemampuan Memori Mahasiswa Prodi Pendidikan Sains Pada Materi Tata Nama Senyawa Kompleks
 JEMS Jurnal Edukasi Matematika dan Sains Avaliable online at: http://e-journal.unipma.ac.id/index.php/jems Analisis Kemampuan Memori Mahasiswa Prodi Pendidikan Sains Pada Materi Tata Nama Senyawa Kompleks
JEMS Jurnal Edukasi Matematika dan Sains Avaliable online at: http://e-journal.unipma.ac.id/index.php/jems Analisis Kemampuan Memori Mahasiswa Prodi Pendidikan Sains Pada Materi Tata Nama Senyawa Kompleks
FAKULTAS TEKNIK UNIVERSITAS NEGERI YOGYAKARTA BAHAN AJAR KIMIA DASAR BAB VI IKATAN KIMIA
 No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 7 BAB VI IKATAN KIMIA Sebagian besar partikel materi adalah berupa molekul atau ion. Hanya beberapa partikel materi saja yang berupa atom. 1)
No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 7 BAB VI IKATAN KIMIA Sebagian besar partikel materi adalah berupa molekul atau ion. Hanya beberapa partikel materi saja yang berupa atom. 1)
RENCANA PELAKSANAAN PEMBELAJARAN TATANAMA SENYAWA BINER DAN POLIATOM
 RENCANA PELAKSANAAN PEMBELAJARAN TATANAMA SENYAWA BINER DAN POLIATOM Sekolah : SMAN 16 SURABAYA Mata pelajaran : KIMIA Kelas/Semester : X/1 Alokasi Waktu : 2 x 45 menit ******************************************************************************
RENCANA PELAKSANAAN PEMBELAJARAN TATANAMA SENYAWA BINER DAN POLIATOM Sekolah : SMAN 16 SURABAYA Mata pelajaran : KIMIA Kelas/Semester : X/1 Alokasi Waktu : 2 x 45 menit ******************************************************************************
(2) kekuatan ikatan yang dibentuk untuk karbon;
 Reaksi Subsitusi Nukleofilik Alifatik Reaksi yang berlangsung karena penggantian satu atau lebih atom atau gugus dari suatu senyawa oleh atom atau gugus lain disebut reaksi substitusi. Bila reaksi substitusi
Reaksi Subsitusi Nukleofilik Alifatik Reaksi yang berlangsung karena penggantian satu atau lebih atom atau gugus dari suatu senyawa oleh atom atau gugus lain disebut reaksi substitusi. Bila reaksi substitusi
~ gaya tarik antar atom yang pemutusan atau pembentukannya dapat menyebabkan terjadinya perubahan kimia.
 1. Ikatan Kimia Struktur Molekul 1.1 Pengertian ~ gaya tarik antar atom yang pemutusan atau pembentukannya dapat menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang
1. Ikatan Kimia Struktur Molekul 1.1 Pengertian ~ gaya tarik antar atom yang pemutusan atau pembentukannya dapat menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang
Ikatan Kimia. Ikatan kimia adalah gaya tarik antar atom yang pemutusan atau pembentukannya menyebabkan terjadinya perubahan kimia.
 Ikatan Kimia 1. Ikatan Kimia 1.1 Pengertian Ikatan kimia adalah gaya tarik antar atom yang pemutusan atau pembentukannya menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam Ikatan Kimia Ikatan Ion:
Ikatan Kimia 1. Ikatan Kimia 1.1 Pengertian Ikatan kimia adalah gaya tarik antar atom yang pemutusan atau pembentukannya menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam Ikatan Kimia Ikatan Ion:
LAMPIRAN C CCT pada Materi Ikatan Ion
 LAMPIRAN C CCT pada Materi Ikatan Ion 1 IKATAN ION A. KECENDERUNGAN ATOM UNTUK STABIL Gas mulia merupakan sebutan untuk unsur golongan VIIIA. Unsur unsur ini bersifat inert (stabil). Hal ini dikarenakan
LAMPIRAN C CCT pada Materi Ikatan Ion 1 IKATAN ION A. KECENDERUNGAN ATOM UNTUK STABIL Gas mulia merupakan sebutan untuk unsur golongan VIIIA. Unsur unsur ini bersifat inert (stabil). Hal ini dikarenakan
UNSUR-UNSUR TRANSISI PERIODE KE EMPAT : TEMBAGA
 Nama : Laurensius E. Seran NIM : 607332411998 UNSUR-UNSUR TRANSISI PERIODE KE EMPAT : TEMBAGA lah soal-soal berikut dengan cara menjodohkan dengan jawaban-jawaban yang telah disiapkan dikolom pilihan.
Nama : Laurensius E. Seran NIM : 607332411998 UNSUR-UNSUR TRANSISI PERIODE KE EMPAT : TEMBAGA lah soal-soal berikut dengan cara menjodohkan dengan jawaban-jawaban yang telah disiapkan dikolom pilihan.
1. Ikatan Kimia. Struktur Molekul. 1.1 Pengertian. 1.2 Macam-Macam. ~ gaya tarik antar atom
 1. Ikatan Kimia 1.1 Pengertian ~ gaya tarik antar atom Struktur Molekul 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang terbentuk akibat tarik-menarik elektrostatik antara ion positif (kation) dan ion
1. Ikatan Kimia 1.1 Pengertian ~ gaya tarik antar atom Struktur Molekul 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang terbentuk akibat tarik-menarik elektrostatik antara ion positif (kation) dan ion
Laporan Praktikum Analisis Kualitatif Anion
 Laporan Praktikum Analisis Kualitatif Anion I. Tujuan Tujuan dari praktikum ini adalah untuk memahami prinsip-prinsip dasar yang melatarbelakangi prosedur pemisahan anion serta mengidentifikasi jenis anion
Laporan Praktikum Analisis Kualitatif Anion I. Tujuan Tujuan dari praktikum ini adalah untuk memahami prinsip-prinsip dasar yang melatarbelakangi prosedur pemisahan anion serta mengidentifikasi jenis anion
Mengubah energi kimia menjadi energi listrik Mengubah energi listrik menjadi energi kimia Katoda sebagi kutub positif, anoda sebagai kutub negatif
 TUGAS 1 ELEKTROKIMIA Di kelas X, anda telah mempelajari bilangan oksidasi dan reaksi redoks. Reaksi redoks adalah reaksi reduksi dan oksidasi. Reaksi reduksi adalah reaksi penangkapan elektron atau reaksi
TUGAS 1 ELEKTROKIMIA Di kelas X, anda telah mempelajari bilangan oksidasi dan reaksi redoks. Reaksi redoks adalah reaksi reduksi dan oksidasi. Reaksi reduksi adalah reaksi penangkapan elektron atau reaksi
Bab V Ikatan Kimia. B. Struktur Lewis Antar unsur saling berinteraksi dengan menerima dan melepaskan elektron di kulit terluarnya. Gambaran terjadinya
 Bab V Ikatan Kimia Sebagian besar unsur yang ada di alam mempunyai kecenderungan untuk berinteraksi (berikatan) dengan unsur lain. Hal itu dilakukan karena unsur tersebut ingin mencapai kestabilan. Cara
Bab V Ikatan Kimia Sebagian besar unsur yang ada di alam mempunyai kecenderungan untuk berinteraksi (berikatan) dengan unsur lain. Hal itu dilakukan karena unsur tersebut ingin mencapai kestabilan. Cara
Asam-Basa. Kimia. Kelas XI. B usiness Name. Indikator: A. Teori Asam-Basa
 Asam-Basa Kimia Kelas XI B usiness Name Indikator: 3.1.1 Menjelaskan teori asam basa berdasarkan konsep Arrhenius, Brosnted Lowry dan Lewis 3.1.2 Menjelaskan pengertian indikator asam-basa 3.1.3 Menyebutkan
Asam-Basa Kimia Kelas XI B usiness Name Indikator: 3.1.1 Menjelaskan teori asam basa berdasarkan konsep Arrhenius, Brosnted Lowry dan Lewis 3.1.2 Menjelaskan pengertian indikator asam-basa 3.1.3 Menyebutkan
Teori Ikatan. Ikatan Kimia I: Ikatan Kovalen
 Teori Ikatan Elektron valensi adalah terluar dr suatu atom. Elektron valensi adalah yang berpartisipasi pada ikatan kimia. Ikatan Kimia I: Ikatan Kovalen Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA
Teori Ikatan Elektron valensi adalah terluar dr suatu atom. Elektron valensi adalah yang berpartisipasi pada ikatan kimia. Ikatan Kimia I: Ikatan Kovalen Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA
Reaksi Oksidasi-Reduksi
 Reaksi ksidasireduksi Reaksi yang melibatkan transfer Elektron disebut ksidasireduksi atau Reaksi Redoks ksidasi adalah hilangnya Elektron suatu reaktan Reduksi adalah penangkapan Elektron oleh reaktan
Reaksi ksidasireduksi Reaksi yang melibatkan transfer Elektron disebut ksidasireduksi atau Reaksi Redoks ksidasi adalah hilangnya Elektron suatu reaktan Reduksi adalah penangkapan Elektron oleh reaktan
Kimia Unsur Logam KIM 4 A. LOGAM ALKALI KIMIA UNSUR. materi78.co.nr. Reaksi-reaksi pada logam alkali: 1) Reaksi dengan air.
 Kimia Unsur Logam A. LOGAM ALKALI Golongan IA Unsur 3Li, 11Na, 19K, 37Rb, 55Cs, 87Fr E. valensi 1 Konf. e. ns 2 Sifat Li Na K Rb Cs nama litium natrium kalium rubidium sesium no. a. 3 11 19 37 55 Ar 7
Kimia Unsur Logam A. LOGAM ALKALI Golongan IA Unsur 3Li, 11Na, 19K, 37Rb, 55Cs, 87Fr E. valensi 1 Konf. e. ns 2 Sifat Li Na K Rb Cs nama litium natrium kalium rubidium sesium no. a. 3 11 19 37 55 Ar 7
ELEKTROKIMIA Reaksi Reduksi - Oksidasi
 Jurusan Kimia - FMIPA Universitas Gadjah Mada (UGM) ELEKTROKIMIA Reaksi Reduksi - Oksidasi Drs. Iqmal Tahir, M.Si. Laboratorium Kimia Fisika,, Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam
Jurusan Kimia - FMIPA Universitas Gadjah Mada (UGM) ELEKTROKIMIA Reaksi Reduksi - Oksidasi Drs. Iqmal Tahir, M.Si. Laboratorium Kimia Fisika,, Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam
RINGKASAN Kimia Anorganik
 RINGKASAN Kimia Anorganik Materi: BAB 10 - BENTUK-BENTUK MOLEKUL Pengampu: Dr. Istadi, ST., MT. Disusun oleh: Nama : Bramantya Brian Suwignjo NIM : 21030112140169 Jurusan : S-1 Teknik Kimia (Kelas B) Hari
RINGKASAN Kimia Anorganik Materi: BAB 10 - BENTUK-BENTUK MOLEKUL Pengampu: Dr. Istadi, ST., MT. Disusun oleh: Nama : Bramantya Brian Suwignjo NIM : 21030112140169 Jurusan : S-1 Teknik Kimia (Kelas B) Hari
LOGO TEORI ASAM BASA
 LOGO TEORI ASAM BASA TIM DOSEN KIMIA DASAR FTP 2012 Beberapa ilmuan telah memberikan definisi tentang konsep asam basa Meskipun beberapa definisi terlihat kurang jelas dan berbeda satu sama lain, tetapi
LOGO TEORI ASAM BASA TIM DOSEN KIMIA DASAR FTP 2012 Beberapa ilmuan telah memberikan definisi tentang konsep asam basa Meskipun beberapa definisi terlihat kurang jelas dan berbeda satu sama lain, tetapi
Chapter 7 Larutan tirtawi (aqueous solution)
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi modif oleh Dr I Kartini Chapter 7 Larutan tirtawi (aqueous solution) Larutan adalah campuran yang homogen dari dua atau lebih
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi modif oleh Dr I Kartini Chapter 7 Larutan tirtawi (aqueous solution) Larutan adalah campuran yang homogen dari dua atau lebih
IKATAN KIMIA BAB 3. Pada pelajaran bab tiga ini akan dipelajari tentang ikatan ion, ikatan kovalen, dan ikatan logam.
 BAB 3 IKATAN KIMIA Gambar 3.1 Kisi Kristal Senyawa NaCl. Sumber: amparan Dunia Ilmu Time life Pada pelajaran bab tiga ini akan dipelajari tentang ikatan ion, ikatan kovalen, dan ikatan logam. Ikatan Kimia
BAB 3 IKATAN KIMIA Gambar 3.1 Kisi Kristal Senyawa NaCl. Sumber: amparan Dunia Ilmu Time life Pada pelajaran bab tiga ini akan dipelajari tentang ikatan ion, ikatan kovalen, dan ikatan logam. Ikatan Kimia
LOGO ANALISIS KUALITATIF KATION DAN ANION
 LOGO ANALISIS KUALITATIF KATION DAN ANION By Djadjat Tisnadjaja 1 Jenis analisis Analisis makro Kuantitas zat 0,5 1 g Volume yang dipakai sekitar 20 ml Analisis semimikro Kuatitas zat sekitar 0,05 g Volume
LOGO ANALISIS KUALITATIF KATION DAN ANION By Djadjat Tisnadjaja 1 Jenis analisis Analisis makro Kuantitas zat 0,5 1 g Volume yang dipakai sekitar 20 ml Analisis semimikro Kuatitas zat sekitar 0,05 g Volume
KROMATOGRAFI PENUKAR ION Ion-exchange chromatography
 KROMATOGRAFI PENUKAR ION Ion-exchange chromatography Merupakan pemisahan senyawa senyawa polar dan ion berdasarkan muatan Dapat digunakan untk hampir semua molekul bermuatan termasuk proteins, nucleotides
KROMATOGRAFI PENUKAR ION Ion-exchange chromatography Merupakan pemisahan senyawa senyawa polar dan ion berdasarkan muatan Dapat digunakan untk hampir semua molekul bermuatan termasuk proteins, nucleotides
D. 4,50 x 10-8 E. 1,35 x 10-8
 1. Pada suatu suhu tertentu, kelarutan PbI 2 dalam air adalah 1,5 x 10-3 mol/liter. Berdasarkan itu maka Kp PbI 2 adalah... A. 4,50 x 10-9 B. 3,37 x 10-9 C. 6,75 x 10-8 S : PbI 2 = 1,5. 10-3 mol/liter
1. Pada suatu suhu tertentu, kelarutan PbI 2 dalam air adalah 1,5 x 10-3 mol/liter. Berdasarkan itu maka Kp PbI 2 adalah... A. 4,50 x 10-9 B. 3,37 x 10-9 C. 6,75 x 10-8 S : PbI 2 = 1,5. 10-3 mol/liter
TITRASI KOMPLEKSOMETRI
 TITRASI KOMPLEKSOMETRI I. TUJUAN a. Menstandarisasi EDTA dengan larutan ZnSO 4 b. Menentukan konsentrasi larutan Ni 2+ c. Memahami prinsip titrasi kompleksometri II. TEORI Titrasi kompleksometri adalah
TITRASI KOMPLEKSOMETRI I. TUJUAN a. Menstandarisasi EDTA dengan larutan ZnSO 4 b. Menentukan konsentrasi larutan Ni 2+ c. Memahami prinsip titrasi kompleksometri II. TEORI Titrasi kompleksometri adalah
Ikatan Kimia dan Struktur Molekul. Sulistyani, M.Si.
 Ikatan Kimia dan Struktur Molekul Sulistyani, M.Si. Email: sulistyani@uny.ac.id Pendahuluan Adalah ikatan yang terjadi antar atom atau antar molekul dengan cara sebagai berikut : - atom yang 1 melepaskan
Ikatan Kimia dan Struktur Molekul Sulistyani, M.Si. Email: sulistyani@uny.ac.id Pendahuluan Adalah ikatan yang terjadi antar atom atau antar molekul dengan cara sebagai berikut : - atom yang 1 melepaskan
! " "! # $ % & ' % &
 Valensi ! " "! # $ % & ' %& # % ( ) # *+## )$,) & -#.. Semua unsur memiliki bilangan oksidasi +1 Semua unsur memiliki bilangan oksidasi +2 Semua unsur memiliki bilangan oksidasi +3. Tl juga memiliki bilangan
Valensi ! " "! # $ % & ' %& # % ( ) # *+## )$,) & -#.. Semua unsur memiliki bilangan oksidasi +1 Semua unsur memiliki bilangan oksidasi +2 Semua unsur memiliki bilangan oksidasi +3. Tl juga memiliki bilangan
BAB 1 PENDAHULUAN. 1.1 Latar Belakang
 BAB 1 PENDAHULUAN 1.1 Latar Belakang Asam karboksilat adalah salah satu grup senyawa organik oleh grup karboksil yang berasal dari dua kata yaitu karbonil dan hidroksil. Pada umumnya formula dari asam
BAB 1 PENDAHULUAN 1.1 Latar Belakang Asam karboksilat adalah salah satu grup senyawa organik oleh grup karboksil yang berasal dari dua kata yaitu karbonil dan hidroksil. Pada umumnya formula dari asam
Menjelaskan kecenderungan suatu unsur untuk mencapai kestabilannya dengan cara berikatan dengan unsur lain. Menggambarkan susunan elektron
 Lampiran 1 SILABUS 1 Nama Sekolah : SMA Tri Sukses Natar Mata Pelajaran : KIMIA Kelas/Semester : X/1 Standar Kompetensi : 1. Mendeskripsikan struktur atom, sifat-sifat periodik unsur, dan ikatan kimia
Lampiran 1 SILABUS 1 Nama Sekolah : SMA Tri Sukses Natar Mata Pelajaran : KIMIA Kelas/Semester : X/1 Standar Kompetensi : 1. Mendeskripsikan struktur atom, sifat-sifat periodik unsur, dan ikatan kimia
LARUTAN ELEKTROLIT DAN NON ELEKTROLIT. Perbandingan sifat-sifat larutan elektrolit dan larutan non elektrolit.
 KIMIA DASAR I PERTEMUAN 1 Tujuan Perkuliahan: Setelah proses pembelajaran ini selesai, diharapkan mahasiswa dapat: 1. Menjelaskan pengertian dari larutan beserta contohnya. 2. Menjelaskan perbedaan larutan
KIMIA DASAR I PERTEMUAN 1 Tujuan Perkuliahan: Setelah proses pembelajaran ini selesai, diharapkan mahasiswa dapat: 1. Menjelaskan pengertian dari larutan beserta contohnya. 2. Menjelaskan perbedaan larutan
Persamaan Redoks. Cu(s) + 2Ag + (aq) -> Cu 2+ (aq) + 2Ag(s)
 Persamaan Redoks Dalam reaksi redoks, satu zat akan teroksidasi dan yang lainnya tereduksi. Proses ini terkadang mudah untuk dilihat; untuk contoh ketika balok logam tembaga ditempatkan dalam larutan perak
Persamaan Redoks Dalam reaksi redoks, satu zat akan teroksidasi dan yang lainnya tereduksi. Proses ini terkadang mudah untuk dilihat; untuk contoh ketika balok logam tembaga ditempatkan dalam larutan perak
kimia REVIEW I TUJUAN PEMBELAJARAN
 KTSP kimia K e l a s XI REVIEW I TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami teori atom mekanika kuantum dan hubungannya dengan bilangan
KTSP kimia K e l a s XI REVIEW I TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami teori atom mekanika kuantum dan hubungannya dengan bilangan
Atom, Molekul dan Ion. Abdul Wahid Surhim
 2014 Atom, Molekul dan Ion Abdul Wahid Surhim Materi Pembelajaran Atom Struktur Tabel Periodik Logam- Nonlogam- Metalloid Ion Molekul Teori Atom Dalton Materi terdiri atas atom-atom Secara ringkas, teorinya
2014 Atom, Molekul dan Ion Abdul Wahid Surhim Materi Pembelajaran Atom Struktur Tabel Periodik Logam- Nonlogam- Metalloid Ion Molekul Teori Atom Dalton Materi terdiri atas atom-atom Secara ringkas, teorinya
kimia ASAM-BASA III Tujuan Pembelajaran
 KTSP K-13 kimia K e l a s XI ASAM-BASA III Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami mekanisme reaksi asam-basa. 2. Memahami stoikiometri
KTSP K-13 kimia K e l a s XI ASAM-BASA III Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami mekanisme reaksi asam-basa. 2. Memahami stoikiometri
Sophie Damayanti / SF ITB
 Prinsip dasar Titrasi Kompleksometri reaksi pembentukan senyawa kompleks Dalam bidang FA reaksi pembentukan senyawa kompleks digunakan untuk ANALISIS LOGAM Uji batas CEMARAN LOGAM ZAT AKTIF Kualitatif
Prinsip dasar Titrasi Kompleksometri reaksi pembentukan senyawa kompleks Dalam bidang FA reaksi pembentukan senyawa kompleks digunakan untuk ANALISIS LOGAM Uji batas CEMARAN LOGAM ZAT AKTIF Kualitatif
Sulistyani, M.Si.
 Sulistyani, M.Si. sulistyani@uny.ac.id Reaksi oksidasi: perubahan kimia suatu spesies (atom, unsur, molekul) melepaskan elektron. Cu Cu 2+ + 2e Reaksi reduksi: perubahan kimia suatu spesies (atom, unsur,
Sulistyani, M.Si. sulistyani@uny.ac.id Reaksi oksidasi: perubahan kimia suatu spesies (atom, unsur, molekul) melepaskan elektron. Cu Cu 2+ + 2e Reaksi reduksi: perubahan kimia suatu spesies (atom, unsur,
LARUTAN ELEKTROLIT DAN NON ELEKTROLIT
 BAB 6 LARUTAN ELEKTROLIT DAN NON ELEKTROLIT Standar Kompetensi Memahami sifat-sifat larutan non elektrolit dan elektrolit, serta reaksi oksidasi-reduksi Kompetensi Dasar Mengidentifikasi sifat larutan
BAB 6 LARUTAN ELEKTROLIT DAN NON ELEKTROLIT Standar Kompetensi Memahami sifat-sifat larutan non elektrolit dan elektrolit, serta reaksi oksidasi-reduksi Kompetensi Dasar Mengidentifikasi sifat larutan
LAPORAN PRAKTIKUM KIMIA ANORGANIK II
 LAPORAN PRAKTIKUM KIMIA ANORGANIK II REAKSI KUALITATIF LOGAMLOGAM TRANSISI KELOMPOK : 3 NAMA NIM AMALIAH AGUSTINA 06111010021 FERI SETIAWAN 06111010018 ZULKANDRI 06111010019 APRIANSYAH 06111010020 BERLY
LAPORAN PRAKTIKUM KIMIA ANORGANIK II REAKSI KUALITATIF LOGAMLOGAM TRANSISI KELOMPOK : 3 NAMA NIM AMALIAH AGUSTINA 06111010021 FERI SETIAWAN 06111010018 ZULKANDRI 06111010019 APRIANSYAH 06111010020 BERLY
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi. Bab 16. Asam dan Basa
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Bab 16 Asam dan Basa Asam Memiliki rasa masam; misalnya cuka mempunyai rasa dari asam asetat, dan lemon serta buah-buahan sitrun
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Bab 16 Asam dan Basa Asam Memiliki rasa masam; misalnya cuka mempunyai rasa dari asam asetat, dan lemon serta buah-buahan sitrun
IKATAN KIMIA. Tim Dosen Kimia Dasar FTP
 IKATAN KIMIA Tim Dosen Kimia Dasar FTP Sub pokok bahasan: Konsep Ikatan Kimia Macam-macam ikatan kimia KONSEP IKATAN KIMIA Untuk mencapai kestabilan, atom-atom saling berikatan. Ikatan kimia merupakan
IKATAN KIMIA Tim Dosen Kimia Dasar FTP Sub pokok bahasan: Konsep Ikatan Kimia Macam-macam ikatan kimia KONSEP IKATAN KIMIA Untuk mencapai kestabilan, atom-atom saling berikatan. Ikatan kimia merupakan
BAB IV HASIL PENGAMATAN DAN PERHITUNGAN. Kelompok Vol. EDTA 0.01 M Vol. Magnesium ml 11.3 ml 14.1 ml 12 ml 11.3 ml 11.3 ml
 BAB IV HASIL PENGAMATAN DAN PERHITUNGAN A. HASIL PENGAMATAN 1. Penetapan Kadar Magnesium Kelompok Vol. EDTA 0.1 M Vol. Magnesium 7 8 9 10 11 12 10.7 ml 14.1 ml 12 ml 2. Penetapan Kadar Kalsium Kelompok
BAB IV HASIL PENGAMATAN DAN PERHITUNGAN A. HASIL PENGAMATAN 1. Penetapan Kadar Magnesium Kelompok Vol. EDTA 0.1 M Vol. Magnesium 7 8 9 10 11 12 10.7 ml 14.1 ml 12 ml 2. Penetapan Kadar Kalsium Kelompok
SOAL SELEKSI OLIMPIADE SAINS TINGKAT KABUPATEN/KOTA 2004 CALON TIM OLIMPIADE KIMIA INDONESIA
 SOAL SELEKSI OLIMPIADE SAINS TINGKAT KABUPATEN/KOTA 2004 CALON TIM OLIMPIADE KIMIA INDONESIA 2005 Bidang Kimia KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN DIREKTORAT JENDERAL PENDIDIKAN MENENGAH DIREKTORAT PEMBINAAN
SOAL SELEKSI OLIMPIADE SAINS TINGKAT KABUPATEN/KOTA 2004 CALON TIM OLIMPIADE KIMIA INDONESIA 2005 Bidang Kimia KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN DIREKTORAT JENDERAL PENDIDIKAN MENENGAH DIREKTORAT PEMBINAAN
OLIMPIADE KIMIA INDONESIA
 OLIMPIADE KIMIA INDONESIA OLIMPIADE SAINS NASIONAL SELEKSI KABUPATEN / KOTA UjianTeori Waktu 2 Jam Departemen Pendidikan Nasional Direktorat Jenderal Managemen Pendidikan Dasar dan Menengah Direktorat
OLIMPIADE KIMIA INDONESIA OLIMPIADE SAINS NASIONAL SELEKSI KABUPATEN / KOTA UjianTeori Waktu 2 Jam Departemen Pendidikan Nasional Direktorat Jenderal Managemen Pendidikan Dasar dan Menengah Direktorat
