COORDINATION COMPOUND. Disusun oleh : Bintang Ayu Kalimantini NIM : KELAS D 10.30
|
|
|
- Widyawati Sugiarto
- 7 tahun lalu
- Tontonan:
Transkripsi
1 COORDINATION COMPOUND Disusun oleh : Bintang Ayu Kalimantini NIM : KELAS D 10.30
2 S enyawa kompleks ditemukan sekitar tahun 1890an oleh Alfred Werner. Senyawa kompleks terdiri dari setidaknya satu ion pusat berupa kation(biasanya logam transisi dan logam lainnya) serta ligan yaitu berupa unsur atau senyawa bisa netral ataupun anion. Untuk menjaga kenetralannya, senyawa kompleks berikatan lagi dengan ion-ion lain yang disebut dengan counter ions. Pada larutan, senyawa kompleks yang berikatan dengan counter ions akan berubah seperti larutan elektrolit akibat pemisahan keduanya. Dalam gambar terlihat ada 6 ligan NH3 yang dimiliki, jumlah ligan yang dimiliki ion pusat disebut dengan bilangan koordinasi. Ligan berikatan dengan atom pusat dengan menyumbangkan atom atau sepasang elektron miliknya. Berdasarkan jumlah atom yang diberikan, ligan diklasifikasikan dalam 3 jenis yaitu : Monodentat adalah ligan yang menyumbang satu atom, Bidentate adalah ligan yang menyumbang dua atom serta Polydentate adalah ligan yang menyumbang lebih dari dua atom. Akhirnya, senyawa kompleks akan memiliki bentuk dari gabungan antara atom pusat dan jumlah ligannya, bisa berupa tetrahedral, planar tergantung hibridisasinya. Rumus dan Penamaan - Beberapa aturan dalam menulis rumus senyawa kompleks 1. Kation ditulis terlebih dahulu sebelum anion 2. Muatan kation = Muatan anion 3. Ligan netral ditulis sebelum ligan anion dan semua rumus diletakkan dalam tanda kurung. Semua ion kompleks, boleh jadi kation atau anion. Kompleks kation memiliki counter ions berupa anion dan sebaliknya. - Beberapa aturan penamaan 1. Nama kation ditulis terlebih dahulu sebelum nama anion 2. Ligan diurutkan penamaannya berdasarkan abjad 3. Ligan netral hanya memiliki nama molekul, tapi ada beberapa pengecualian (tabel.1). Sedangkan pada ligan anion penamaannya ditambahkan ide dan o setelah nama (tabel.2) 4. Numerical prefix menerangkan jumlah ligan misal tetraammine. Pengecualian untuk beberapa ligan yang sudah memiliki numerical prefix, kita gunakan bis(2), tris(3) atau tetrakis(4) contoh bis(ethylendiamine) 5. Bilangan oksidasi atom pusat ditulis dalam angka romawi
3 6. Jika ion kompleks adalah anion, kita gunakan akhiran nama logam ditambah ate. Contoh potassium amminepentachloroplatinate (IV) Tabel.1 Tabel.2 Contoh Penerapan soal : Na3[AlF6] : 1. bilangan koordinasi = 6 maka heksa 2. ligan = F-, anion maka flour + o jadi flouro 3. Karnaion kompleks adalah anion maka Al = Alumumunium + ate jadi Alumminate 4.Kation lebih dahulu dinamakan sodium heksaflouroaluminate Isomer Senyawa Kompleks : nama sama, sifat beda Constitutional (structural) isomers : hubungan antar atomnya berbeda Stereoisomers : susunan bangun atau bentuk berbeda Coordination isomers : komposisi sama tetapi terjadi pertukaran ligan dan counter ions misal [Pt(NH 3 ) 4 Cl 2 ](NO 2 ) 2 dengan [Pt(NH 3 ) 4 (NO 2 ) 2 ]Cl 2 Geometric isomers(cistrans isomer/diastereomers) : komposisi sama, tapi penyusunan atom-atom disekeliling atom pusat berbeda Linkage Isomers : komposisi sama tetapi ada perbedaan pada jumlah atom yang diberikan ligan. misa pada [Co(NH 3 ) 4 (NO 2 ) 2 ]Cl 2 dengan [Co(NH 3 ) 4 (ONO)]Cl 2 Optical Isomers(erantiomers) : komposisi sama dan strukturnya sama dengan bayangan dalam beberapa sudut rotasi pada bidang yang terpolarisasi cahaya
4 Teori Dasar Ikatan dan Struktur Kompleks 1. Vallence Bond Theory : ligan menyumbangkan sepasang elektron untuk atom pusat membentuk ikatan kovalen koordinasi. - Octahedral Complex Terdapat elektron yang tidak berpasangan membuat ion kompleks bersifat paramagnetik - Square Planar Complex Terdapat elektron yang tidak terhibridisasi membuat ion kompleks bersifat diamagnetik - - Tetrahedral Complex - Sublevel d telah terisi penuh 2. Crysta Field Theory : menerangkan warna dan sifat magetik ion kompleks berdasarkan pada energi orbital d. - Warna. Setiap benda bisa memancarkan warna karna menyerap beberapa warna sesuai panjang gelombangnya dan memantulkan sisanya. Dalam senyawa kompleks, ion mengadsorpsi cahaya dalam panjang gelombang tertentu kemudian elektron tereksitasi dari energi rendah ke energi tinggi. - Sifat magnetik. Setiap kenaikan energi level menyebabkan sifat magnetik yang diakibatkan jumlah elektron tak berpasangan dalam ion pusat orbita d. dipengaruhi oleh ligan dengan dua cara yaitu : Weak field ligands : memiliki sedikit kenaikan energi Strong-field ligands : karna lintasan diperluas maka butuh kenaikan energi yang besar Pada akhirnya, antara dua teori ini belum ada yang memuaskan. VB menawarkan gambaran sederhana dari senyawa kompleks, tapi tidak menerangkan warnanya seperti Crystal field. Sementara Crysta field mencoba menggambarkan ion logam dan ligan sebagai dua muatan yang berlawanan dan tidak membahas ikatan kovalen. Saat ini, sedang diteliti sebuah teori baru yang menggabungkan keduanya yaitu ligand field-molecular orbita theory.
5
Senyawa Koordinasi (senyawa kompleks)
 Senyawa Koordinasi (senyawa kompleks) Salah satu keistimewaan logam transisi adalah dapat membentuk senyawa klompeks, yaitu senyawa yang paling sedikit terdiri dari satu ion kompleks (terdiri dari kation
Senyawa Koordinasi (senyawa kompleks) Salah satu keistimewaan logam transisi adalah dapat membentuk senyawa klompeks, yaitu senyawa yang paling sedikit terdiri dari satu ion kompleks (terdiri dari kation
8.4 Senyawa Kompleks
 8.4 Senyawa Kompleks Alfred Werner (1866-1919): kelompok baru senyawa logam transisi yang terdiri dari ion logam transisi (LT) yang dikelilingi oleh ion atau molekul yang lain. Ion atau molekul yang terikat
8.4 Senyawa Kompleks Alfred Werner (1866-1919): kelompok baru senyawa logam transisi yang terdiri dari ion logam transisi (LT) yang dikelilingi oleh ion atau molekul yang lain. Ion atau molekul yang terikat
SENYAWA KOMPLEKS. Definisi. Ion Kompleks. Bilangan koordinasi, geometri, dan ligan RINGKASAN MATERI
 KIMIA ANORGANIK 14 OKTOBER 2012 RINGKASAN MATERI SENYAWA KOMPLEKS Definisi Senyawa kompleks itu: Ada ion logam sebagai atom pusat Ada ligan yang berupa anion atau molekul netral Memiliki counter ion supaya
KIMIA ANORGANIK 14 OKTOBER 2012 RINGKASAN MATERI SENYAWA KOMPLEKS Definisi Senyawa kompleks itu: Ada ion logam sebagai atom pusat Ada ligan yang berupa anion atau molekul netral Memiliki counter ion supaya
Bilangankoordinasi, bentukgeometri, danligandarisenyawakompleks
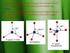 Senyawakoordinasi Senyawa koordinasi (coordination coumpounds) yang disebut juga kompleks adalah senyawa yang memiliki paling sedikit satu ion kompleks dengan kation sebagai pusat kompleks dan anion sebagailigan
Senyawakoordinasi Senyawa koordinasi (coordination coumpounds) yang disebut juga kompleks adalah senyawa yang memiliki paling sedikit satu ion kompleks dengan kation sebagai pusat kompleks dan anion sebagailigan
Senyawa Koordinasi. Ion kompleks memiliki ciri khas yaitu bilangan koordinasi, geometri, dan donor atom:
 Senyawa Koordinasi Terdiri dari atom pusat (kation logam transisi), ligan(molekul yang terikat pada ion kompleks) dan di netralkan dengan bilangan koordinasi. Dari gambar [Co(NH 3 )6]CI 3, 6 molekul NH3
Senyawa Koordinasi Terdiri dari atom pusat (kation logam transisi), ligan(molekul yang terikat pada ion kompleks) dan di netralkan dengan bilangan koordinasi. Dari gambar [Co(NH 3 )6]CI 3, 6 molekul NH3
Senyawa Koordinasi. Kompleks ion dengan pusat d B memiliki empat ligan dengan dengan bentuk persegi planar (B)
 Senyawa Koordinasi Aspek umum dari logam transisi adalah pembentukan dari senyawa koordinasi (kompleks). Senyawa koordinasi ini setidaknya memiliki satu ion kompleks yang terdiri dari logam kation yang
Senyawa Koordinasi Aspek umum dari logam transisi adalah pembentukan dari senyawa koordinasi (kompleks). Senyawa koordinasi ini setidaknya memiliki satu ion kompleks yang terdiri dari logam kation yang
1.1 Senyawa Koordinasi (Coordination Coumpond)
 1.1 Senyawa Koordinasi (Coordination Coumpond) Sifat yang paling khas pada logam transisi adalah tentang persenyawaan dan ikatannya. Yang biasa disebut dengan ion kompleks. Ion kompleks sendiri terdiri
1.1 Senyawa Koordinasi (Coordination Coumpond) Sifat yang paling khas pada logam transisi adalah tentang persenyawaan dan ikatannya. Yang biasa disebut dengan ion kompleks. Ion kompleks sendiri terdiri
SENYAWA KOORDINASI Putri Anjarsari, S.Si., M.Pd
 SENYAWA KOORDINASI Putri Anjarsari, S.Si., M.Pd putri_anjarsari@uny.ac.id Pengertian Senyawa Koordinasi Senyawa koordinasi adalah senyawa yang mengandung satu atau lebih ion kompleks dengan sejumlah kecil
SENYAWA KOORDINASI Putri Anjarsari, S.Si., M.Pd putri_anjarsari@uny.ac.id Pengertian Senyawa Koordinasi Senyawa koordinasi adalah senyawa yang mengandung satu atau lebih ion kompleks dengan sejumlah kecil
Kimia Koordinasi SOAL LATIHAN. Jawab soal sudah tersedia. Selesaikan soalnya, dan pelajari mengapa dipilih jawaban tersebut
 Kimia Koordinasi SOAL LATIHAN Jawab soal sudah tersedia. Selesaikan soalnya, dan pelajari mengapa dipilih jawaban tersebut 1. Suatu logam nickel dapat ditulis sebagai [Ar] 4s 2 3d 8, manakah representasi
Kimia Koordinasi SOAL LATIHAN Jawab soal sudah tersedia. Selesaikan soalnya, dan pelajari mengapa dipilih jawaban tersebut 1. Suatu logam nickel dapat ditulis sebagai [Ar] 4s 2 3d 8, manakah representasi
Kimia Koordinasi Teori Ikatan Valensi
 Kimia Koordinasi Teori Ikatan Valensi Beberapa teori telah dirumuskan untuk menjelaskan ikatan dalam senyawaan koordinasi dan untuk merasionalisasi serta meramalkan sifat-sifatnya: teori ikatan valensi,
Kimia Koordinasi Teori Ikatan Valensi Beberapa teori telah dirumuskan untuk menjelaskan ikatan dalam senyawaan koordinasi dan untuk merasionalisasi serta meramalkan sifat-sifatnya: teori ikatan valensi,
Kegiatan Belajar 4 Kimia Unsur. Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada materi Kimia Unsur.
 1 Kegiatan Belajar 4 Kimia Unsur Capaian Pembelajaran Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada materi Kimia Unsur. Subcapaian pembelajaran: 1. Menjelaskan sifat unsur golongan
1 Kegiatan Belajar 4 Kimia Unsur Capaian Pembelajaran Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada materi Kimia Unsur. Subcapaian pembelajaran: 1. Menjelaskan sifat unsur golongan
SENYAWA KOORDINASI Ion kompleks: Angka koordinasi, Geometri, dan Ligan
 SENYAWA KOORDINASI Keistimewaan dari ilmu kimia peralihan logam adalah rumus dari senyawa koordinasi (kompleks). Ada unsur yang berisi paling sedikit satu ion kompleks, yang terdiri dari satu atom pusat
SENYAWA KOORDINASI Keistimewaan dari ilmu kimia peralihan logam adalah rumus dari senyawa koordinasi (kompleks). Ada unsur yang berisi paling sedikit satu ion kompleks, yang terdiri dari satu atom pusat
Bahasan. Senyawa Koordinasi. Bahasan. 1. Teori Werner tentang Senyawa Koordinasi : Tinjauan Ulang. Irwansyah, M.Si
 Bahasan Ion Kompleks dan 1 Teori Werner tentang Senyawa koordinasi : Tinjauan Ulang 2 Ligan 3 Tatanama 4 Isomerisasi 5 Ikatan dalam Ion Kompleks : Teori Medan Kristal 6 Sifat Magnet dan Teori Medan Kristal
Bahasan Ion Kompleks dan 1 Teori Werner tentang Senyawa koordinasi : Tinjauan Ulang 2 Ligan 3 Tatanama 4 Isomerisasi 5 Ikatan dalam Ion Kompleks : Teori Medan Kristal 6 Sifat Magnet dan Teori Medan Kristal
COORDINATION COMPOUNDS
 COORDINATION COMPOUNDS Coordination Compounds (senyawa koordinasi) adalah senyawa yang mengandung paling tidak satu ion komplek, yang merupakan jenis kation logam pusat(baik pada logam transisi ataupun
COORDINATION COMPOUNDS Coordination Compounds (senyawa koordinasi) adalah senyawa yang mengandung paling tidak satu ion komplek, yang merupakan jenis kation logam pusat(baik pada logam transisi ataupun
KIMIA. Sesi KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA. a. Sifat Umum
 KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 12 Sesi NGAN KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA Keteraturan sifat keperiodikan unsur dalam satu periode dapat diamati pada unsur-unsur periode
KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 12 Sesi NGAN KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA Keteraturan sifat keperiodikan unsur dalam satu periode dapat diamati pada unsur-unsur periode
Teori medan kristal adalah model yang hampir secara menyeluruh menggantikan teori ikatan valensi, pertama kali dimunculkan oleh Hans Bethe pada 1929.
 Teori Medan Kristal Teori medan kristal adalah model yang hampir secara menyeluruh menggantikan teori ikatan valensi, pertama kali dimunculkan oleh Hans Bethe pada 1929. Pada mulanya merupakan model yang
Teori Medan Kristal Teori medan kristal adalah model yang hampir secara menyeluruh menggantikan teori ikatan valensi, pertama kali dimunculkan oleh Hans Bethe pada 1929. Pada mulanya merupakan model yang
Bab 11 Senyawa Koordinasi
 Bab 11 http://chem.fmipa.ipb.ac.id Cisplatin (cis-pt(nh 3 ) 2 Cl 2 ) Cisplatin menghancurkan sel kanker untuk bereproduksi dengan mengubah konfigurasi DNAnya 1 Ikthisar Sumber: Chang Bab 20 1 Kimia Logam
Bab 11 http://chem.fmipa.ipb.ac.id Cisplatin (cis-pt(nh 3 ) 2 Cl 2 ) Cisplatin menghancurkan sel kanker untuk bereproduksi dengan mengubah konfigurasi DNAnya 1 Ikthisar Sumber: Chang Bab 20 1 Kimia Logam
! " "! # $ % & ' % &
 Valensi ! " "! # $ % & ' %& # % ( ) # *+## )$,) & -#.. Semua unsur memiliki bilangan oksidasi +1 Semua unsur memiliki bilangan oksidasi +2 Semua unsur memiliki bilangan oksidasi +3. Tl juga memiliki bilangan
Valensi ! " "! # $ % & ' %& # % ( ) # *+## )$,) & -#.. Semua unsur memiliki bilangan oksidasi +1 Semua unsur memiliki bilangan oksidasi +2 Semua unsur memiliki bilangan oksidasi +3. Tl juga memiliki bilangan
Ikatan Kimia. Ikatan kimia adalah gaya tarik antar atom yang pemutusan atau pembentukannya menyebabkan terjadinya perubahan kimia.
 Ikatan Kimia 1. Ikatan Kimia 1.1 Pengertian Ikatan kimia adalah gaya tarik antar atom yang pemutusan atau pembentukannya menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam Ikatan Kimia Ikatan Ion:
Ikatan Kimia 1. Ikatan Kimia 1.1 Pengertian Ikatan kimia adalah gaya tarik antar atom yang pemutusan atau pembentukannya menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam Ikatan Kimia Ikatan Ion:
MODUL VI KIMIA KOORDINASI
 MODUL VI KIMIA KOORDINASI I. Petunjuk Umum 1. Kompetensi Dasar 1) Mahasiswa memahami definisi senyawa komplek 2) Mahasiswa memahami Teori Koordinasi Werner 3) Mahasiswa memahami jenis-jenis ligan 4) Mahasiswa
MODUL VI KIMIA KOORDINASI I. Petunjuk Umum 1. Kompetensi Dasar 1) Mahasiswa memahami definisi senyawa komplek 2) Mahasiswa memahami Teori Koordinasi Werner 3) Mahasiswa memahami jenis-jenis ligan 4) Mahasiswa
Ikatan Kimia. 2 Klasifikasi Ikatan Kimia :
 Ikatan Kimia Ikatan Kimia : Gaya tarik yang menyebabkan atom-atom yang terikat satu sama lain dalam suatu kombinasi untuk membentuk senyawa yang lebih kompleks. 2 Klasifikasi Ikatan Kimia : 1. Ikatan ion
Ikatan Kimia Ikatan Kimia : Gaya tarik yang menyebabkan atom-atom yang terikat satu sama lain dalam suatu kombinasi untuk membentuk senyawa yang lebih kompleks. 2 Klasifikasi Ikatan Kimia : 1. Ikatan ion
TUGAS KIMIA ANORGANIK TEORI IKATAN VALENSI DAN HIBRIDISASI ORBITAL
 TUGAS KIMIA ANORGANIK TEORI IKATAN VALENSI DAN HIBRIDISASI ORBITAL ESTER ALNINTA BASA SIAGIAN (21030116140082) JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK SEMARANG 2016 A. DASAR TEORI IKATAN VALENSI Ikatan valensi
TUGAS KIMIA ANORGANIK TEORI IKATAN VALENSI DAN HIBRIDISASI ORBITAL ESTER ALNINTA BASA SIAGIAN (21030116140082) JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK SEMARANG 2016 A. DASAR TEORI IKATAN VALENSI Ikatan valensi
JAWABAN. 8. Untuk obligasi tunggal antara sejenis atom, bagaimana kekuatan ikatan yang berhubungan dengan ukuran dari atom?jelaskan secara ilmiah.
 SOAL 1. Thomson mampu menentukan massa / rasio muatan elektron tetapi tidak massa. Bagaimana Percobaan Millikan memungkinkan penentuan massa elektron? 2. Bagaimana senyawa ion netral jika mereka terdiri
SOAL 1. Thomson mampu menentukan massa / rasio muatan elektron tetapi tidak massa. Bagaimana Percobaan Millikan memungkinkan penentuan massa elektron? 2. Bagaimana senyawa ion netral jika mereka terdiri
BENTUK MOLEKUL CITRAWATI NUGRAHENI MINASTI Struktur Lewis dan Teori VSEPR. disusun oleh :
 BENTUK MOLEKUL Struktur Lewis dan Teori VSEPR disusun oleh : CITRAWATI NUGRAHENI MINASTI 21030112130045 TEKNIK KIMIA UNIVERSITAS DIPONEGORO 2012/2013 STRUKTUR LEWIS dan BENTUK MOLEKUL 10.1 Menggambarkan
BENTUK MOLEKUL Struktur Lewis dan Teori VSEPR disusun oleh : CITRAWATI NUGRAHENI MINASTI 21030112130045 TEKNIK KIMIA UNIVERSITAS DIPONEGORO 2012/2013 STRUKTUR LEWIS dan BENTUK MOLEKUL 10.1 Menggambarkan
STRUKTUR LEWIS DAN TEORI IKATAN VALENSI
 Ikatan Kimia STRUKTUR LEWIS DAN TEORI IKATAN VALENSI Disusun oleh : Kelompok 11 Penty Cahyani 4301411038 Diyah Ayu Lestari 4301411040 Ifan Shovi 4301411041 Rombel 2 UNIVERSITAS NEGERI SEMARANG 2013 A.
Ikatan Kimia STRUKTUR LEWIS DAN TEORI IKATAN VALENSI Disusun oleh : Kelompok 11 Penty Cahyani 4301411038 Diyah Ayu Lestari 4301411040 Ifan Shovi 4301411041 Rombel 2 UNIVERSITAS NEGERI SEMARANG 2013 A.
Peranan elektron dalam pembentukan ikatan kimia
 IKATAN KIMIA IKATAN KIMIA Gaya yang memegangi atom atau ion membentuk molekul atau kristal disebut Ikatan Kimia. Elektron memegang peran penting dalam pembentukan ikatan kimia. Peranan elektron dalam pembentukan
IKATAN KIMIA IKATAN KIMIA Gaya yang memegangi atom atau ion membentuk molekul atau kristal disebut Ikatan Kimia. Elektron memegang peran penting dalam pembentukan ikatan kimia. Peranan elektron dalam pembentukan
PB = Psgan elektron bebas Dari BK dan PB atom pusat dpt diramalkan struktur molekul dng teori VSEPR
 Pasangan elektron valensi mempunyai gaya tolak menolak Pasangan elektron bebas menempati ruang sesuai jenisnya BK = Bilangan Koordinasi = Jumlah atom / substituen yang terikat pada atom pusat PB = Psgan
Pasangan elektron valensi mempunyai gaya tolak menolak Pasangan elektron bebas menempati ruang sesuai jenisnya BK = Bilangan Koordinasi = Jumlah atom / substituen yang terikat pada atom pusat PB = Psgan
1. Ikatan Kimia. Struktur Molekul. 1.1 Pengertian. 1.2 Macam-Macam. ~ gaya tarik antar atom
 1. Ikatan Kimia 1.1 Pengertian ~ gaya tarik antar atom Struktur Molekul 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang terbentuk akibat tarik-menarik elektrostatik antara ion positif (kation) dan ion
1. Ikatan Kimia 1.1 Pengertian ~ gaya tarik antar atom Struktur Molekul 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang terbentuk akibat tarik-menarik elektrostatik antara ion positif (kation) dan ion
~ gaya tarik antar atom yang pemutusan atau pembentukannya dapat menyebabkan terjadinya perubahan kimia.
 1. Ikatan Kimia Struktur Molekul 1.1 Pengertian ~ gaya tarik antar atom yang pemutusan atau pembentukannya dapat menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang
1. Ikatan Kimia Struktur Molekul 1.1 Pengertian ~ gaya tarik antar atom yang pemutusan atau pembentukannya dapat menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang
C. Reaksi oksidasi reduksi berdasarkan peningkatan dan penurunan bilangan oksidasi. Bilangan Oksidasi (biloks)
 97 Nama : Kelompok : Mata Pelajaran : Kimia Kelas/Semester : X 5 /2 Alokasi Waktu : 2 x 45 menit. Materi pokok : Konsep Redoks Standar Kompetensi : 3. Memahami sifat-sifat larutan elektrolit dan non elektrolit
97 Nama : Kelompok : Mata Pelajaran : Kimia Kelas/Semester : X 5 /2 Alokasi Waktu : 2 x 45 menit. Materi pokok : Konsep Redoks Standar Kompetensi : 3. Memahami sifat-sifat larutan elektrolit dan non elektrolit
LAPORAN PRAKTIKUM KIMIA ANORGANIK
 LAPORAN PRAKTIKUM KIMIA ANORGANIK Nama : Idatul Fitriyah NIM : 4301412036 Jurusan : Kimia Prodi : Pendidikan Kimia Dosen : Ella Kusumastuti Kelompok : 7 Tgl Praktikum : 21 Maret 2014 Kawan Kerja : 1. Izza
LAPORAN PRAKTIKUM KIMIA ANORGANIK Nama : Idatul Fitriyah NIM : 4301412036 Jurusan : Kimia Prodi : Pendidikan Kimia Dosen : Ella Kusumastuti Kelompok : 7 Tgl Praktikum : 21 Maret 2014 Kawan Kerja : 1. Izza
Bentuk-bentuk molekul
 Bentuk-bentuk molekul Menggambarkan molekul dengan struktur lewis Biasanya elektron disimbolkan dengan titik yang menggambarkan setiap atomnya, dan pasangan yang berikatan digambar menjadi satu, biasanya
Bentuk-bentuk molekul Menggambarkan molekul dengan struktur lewis Biasanya elektron disimbolkan dengan titik yang menggambarkan setiap atomnya, dan pasangan yang berikatan digambar menjadi satu, biasanya
IKATAN KIMIA MAKALAH KIMIA DASAR
 IKATAN KIMIA MAKALAH KIMIA DASAR dibuat sebagai salah satu syarat untuk memperoleh nilai mata kuliah kimia dasar Oleh : AZKA WAFI EL HAKIM ( NPM : 301014000 ) HELGA RACHEL F ( NPM : 3010140014 ) MUHAMMAD
IKATAN KIMIA MAKALAH KIMIA DASAR dibuat sebagai salah satu syarat untuk memperoleh nilai mata kuliah kimia dasar Oleh : AZKA WAFI EL HAKIM ( NPM : 301014000 ) HELGA RACHEL F ( NPM : 3010140014 ) MUHAMMAD
Rangkuman Kimia Anorganik Materi Struktur Lewis dan Bentuk Molekul
 Rangkuman Kimia Anorganik Materi Struktur Lewis dan Bentuk Molekul BAB 10 Nama :Rizky Ardias D NIM :21030112140170 Kelas :B Struktur Lewis dan Bentuk Molekul Pertama-tama kita melihat bagaimana untuk mengubah
Rangkuman Kimia Anorganik Materi Struktur Lewis dan Bentuk Molekul BAB 10 Nama :Rizky Ardias D NIM :21030112140170 Kelas :B Struktur Lewis dan Bentuk Molekul Pertama-tama kita melihat bagaimana untuk mengubah
TUGAS KIMIA UMUM C (kelompok jadual kuliah Kamis Pagi jam 08.00) 1. The radii of the sodium and potassium ions are 102 pm and 138 pm, respectively.
 TUGAS KIMIA UMUM C (kelompok jadual kuliah Kamis Pagi jam 08.00) 1. The radii of the sodium and potassium ions are 102 pm and 138 pm, respectively. Which compound has stronger ionic attractions, sodium
TUGAS KIMIA UMUM C (kelompok jadual kuliah Kamis Pagi jam 08.00) 1. The radii of the sodium and potassium ions are 102 pm and 138 pm, respectively. Which compound has stronger ionic attractions, sodium
TUGAS KIMIA UMUM C (kelompok jadual kuliah Kamis Pagi jam 08.00)
 TUGAS KIMIA UMUM C (kelompok jadual kuliah Kamis Pagi jam 08.00) 1. The radii of the sodium and potassium ions are 102 pm and 138 pm, respectively. Which compound has stronger ionic attractions, sodium
TUGAS KIMIA UMUM C (kelompok jadual kuliah Kamis Pagi jam 08.00) 1. The radii of the sodium and potassium ions are 102 pm and 138 pm, respectively. Which compound has stronger ionic attractions, sodium
LATIHAN SOAL IKATAN KIMIA
 LATIHAN SAL IKATAN KIMIA 1. Cara untuk mendapatkan kestabilan atom unsur yang bernomor atom 8 adalah dengan a. Melepaskan enam elektron muatan +6 b. Mengikat dua elektron dari atom lain menjadi ion dengan
LATIHAN SAL IKATAN KIMIA 1. Cara untuk mendapatkan kestabilan atom unsur yang bernomor atom 8 adalah dengan a. Melepaskan enam elektron muatan +6 b. Mengikat dua elektron dari atom lain menjadi ion dengan
Bentuk Molekul. Membuat struktur lewis menggunakan aturan octet, yaitu setiap atom mengisi kulit terluarnya dengan 8 elektron dan 2 untuk hydrogen.
 Bentuk Molekul Pada molekul, setiap atom, bonding pair, dan lone pair memiliki posisi masing masing yang ditentukan oleh gaya tarik menarik dan tolak menolak. Langkah pertama dalam memvisualisasikan bentuk
Bentuk Molekul Pada molekul, setiap atom, bonding pair, dan lone pair memiliki posisi masing masing yang ditentukan oleh gaya tarik menarik dan tolak menolak. Langkah pertama dalam memvisualisasikan bentuk
Bentuk-Bentuk Molekul
 Bentuk-Bentuk Molekul Di bab ini, kita akan mempelajari bagaimana cara mengubah rumus molekul dari suatu senyawa menjadi sebuah rumus struktur senyawa dalam bentuk dua dimensi yang memperlihatkan hubungan
Bentuk-Bentuk Molekul Di bab ini, kita akan mempelajari bagaimana cara mengubah rumus molekul dari suatu senyawa menjadi sebuah rumus struktur senyawa dalam bentuk dua dimensi yang memperlihatkan hubungan
BENTUK-BENTUK MOLEKUL
 BENTUK-BENTUK MOLEKUL 10.1 Menggambar Molekul dan Ion dengan Struktur Lewis Dalam menggambarkan molekul dan ion, kita dapat menggunakan struktur lewis sebagai panduannya. Dalam permasalahan ini, ada beberapa
BENTUK-BENTUK MOLEKUL 10.1 Menggambar Molekul dan Ion dengan Struktur Lewis Dalam menggambarkan molekul dan ion, kita dapat menggunakan struktur lewis sebagai panduannya. Dalam permasalahan ini, ada beberapa
kimia REVIEW I TUJUAN PEMBELAJARAN
 KTSP kimia K e l a s XI REVIEW I TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami teori atom mekanika kuantum dan hubungannya dengan bilangan
KTSP kimia K e l a s XI REVIEW I TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami teori atom mekanika kuantum dan hubungannya dengan bilangan
LATIHAN SOAL IKATAN KIMIA
 LATIHAN SOAL IKATAN KIMIA 1. Cara untuk mendapatkan ke stabilan atom unsur yang bernomor atom 10 adalah dengan a. Melepaskan dua elektron valensinya membentuk ion dengan muatan +2 b. Mengikat enam elektron
LATIHAN SOAL IKATAN KIMIA 1. Cara untuk mendapatkan ke stabilan atom unsur yang bernomor atom 10 adalah dengan a. Melepaskan dua elektron valensinya membentuk ion dengan muatan +2 b. Mengikat enam elektron
STRUKTUR ATOM A. PENGERTIAN DASAR
 STRUKTUR ATOM A. PENGERTIAN DASAR 1. Partikel dasar : partikel-partikel pembentuk atom yang terdiri dari elektron, proton den neutron. 1. Proton : partikel pembentuk atom yang mempunyai massa sama dengan
STRUKTUR ATOM A. PENGERTIAN DASAR 1. Partikel dasar : partikel-partikel pembentuk atom yang terdiri dari elektron, proton den neutron. 1. Proton : partikel pembentuk atom yang mempunyai massa sama dengan
RINGKASAN Kimia Anorganik
 RINGKASAN Kimia Anorganik Materi: BAB 10 - BENTUK-BENTUK MOLEKUL Pengampu: Dr. Istadi, ST., MT. Disusun oleh: Nama : Bramantya Brian Suwignjo NIM : 21030112140169 Jurusan : S-1 Teknik Kimia (Kelas B) Hari
RINGKASAN Kimia Anorganik Materi: BAB 10 - BENTUK-BENTUK MOLEKUL Pengampu: Dr. Istadi, ST., MT. Disusun oleh: Nama : Bramantya Brian Suwignjo NIM : 21030112140169 Jurusan : S-1 Teknik Kimia (Kelas B) Hari
ANALISIS SOAL ULANGAN HARIAN I. Total. Dimensi Proses Pengetahuan Kognitif Menerapkan Menganalisa (C4) 15 3,6,9,11,21 4,12,18,26 5,19,20,25
 ANALISIS SOAL ULANGAN HARIAN I Mata pelajaran Kimia Kelas/Semester XI IPA 1/1 Kisi Butir Soal ClassXI Mudah Sedang Susah C1 C2 and C3 C 4,5,6 Total Presentase 12% 56% 32% 100% Jumlah soal 3 14 8 25 Dimensi
ANALISIS SOAL ULANGAN HARIAN I Mata pelajaran Kimia Kelas/Semester XI IPA 1/1 Kisi Butir Soal ClassXI Mudah Sedang Susah C1 C2 and C3 C 4,5,6 Total Presentase 12% 56% 32% 100% Jumlah soal 3 14 8 25 Dimensi
Bab V Ikatan Kimia. B. Struktur Lewis Antar unsur saling berinteraksi dengan menerima dan melepaskan elektron di kulit terluarnya. Gambaran terjadinya
 Bab V Ikatan Kimia Sebagian besar unsur yang ada di alam mempunyai kecenderungan untuk berinteraksi (berikatan) dengan unsur lain. Hal itu dilakukan karena unsur tersebut ingin mencapai kestabilan. Cara
Bab V Ikatan Kimia Sebagian besar unsur yang ada di alam mempunyai kecenderungan untuk berinteraksi (berikatan) dengan unsur lain. Hal itu dilakukan karena unsur tersebut ingin mencapai kestabilan. Cara
Menggambarkan Molekul dan Ion dengan struktur Lewis Menggunakan Aturan Oktet untuk Menuliskan Struktur Lewis
 2012 Menggambarkan Molekul dan Ion dengan struktur Lewis Untuk menggambarkan suatu molekul bisa dengan cara merubah rumus molekul menjadi struktur lewis dengan aturan oktet. Menggunakan Aturan Oktet untuk
2012 Menggambarkan Molekul dan Ion dengan struktur Lewis Untuk menggambarkan suatu molekul bisa dengan cara merubah rumus molekul menjadi struktur lewis dengan aturan oktet. Menggunakan Aturan Oktet untuk
BAB I PENDAHULUAN Latar Belakang
 BAB I PENDAHULUAN 1.1. Latar Belakang Logam-logam yang bernilai ekonomi sangat tinggi, diantaranya emas, perak, platina, dan paladium, dikenal sebagai logam-logam yang berharga. Platina sangat berguna
BAB I PENDAHULUAN 1.1. Latar Belakang Logam-logam yang bernilai ekonomi sangat tinggi, diantaranya emas, perak, platina, dan paladium, dikenal sebagai logam-logam yang berharga. Platina sangat berguna
Penyelesaian Tugas Kuliah Kimia Umum C (Soal bagi kelompok jadwal kuliah Kamis pagi pukul 08.00)
 Penyelesaian Tugas Kuliah Kimia Umum C (Soal bagi kelompok jadwal kuliah Kamis pagi pukul 08.00) Nama : Archemi Puspita Wijaya NIM : L2C007010 Alamat blog : archemipuspita.wordpress.com 1. Jari-jari ion
Penyelesaian Tugas Kuliah Kimia Umum C (Soal bagi kelompok jadwal kuliah Kamis pagi pukul 08.00) Nama : Archemi Puspita Wijaya NIM : L2C007010 Alamat blog : archemipuspita.wordpress.com 1. Jari-jari ion
I. PENDAHULUAN. Kualitas udara yang dipergunakan untuk kehidupan tergantung dari lingkungannya. Udara
 I. PENDAHULUAN 1.1 Latar Belakang Masalah Kualitas udara yang dipergunakan untuk kehidupan tergantung dari lingkungannya. Udara mengandung sejumlah oksigen, yang merupakan komponen esensial bagi kehidupan,
I. PENDAHULUAN 1.1 Latar Belakang Masalah Kualitas udara yang dipergunakan untuk kehidupan tergantung dari lingkungannya. Udara mengandung sejumlah oksigen, yang merupakan komponen esensial bagi kehidupan,
MENGGAMBARKAN MOLEKUL DAN ION BERDASARKAN STRUKTUR LEWIS
 MENGGAMBARKAN MOLEKUL DAN ION BERDASARKAN STRUKTUR LEWIS Langkah awal untuk menggambarkan molekul adalah dengan cara mengkonversikan rumus molekul ke dalam struktur lewis. Ini ditunjukan dengan simbol
MENGGAMBARKAN MOLEKUL DAN ION BERDASARKAN STRUKTUR LEWIS Langkah awal untuk menggambarkan molekul adalah dengan cara mengkonversikan rumus molekul ke dalam struktur lewis. Ini ditunjukan dengan simbol
kimia KONFIGURASI ELEKTRON
 K-13 Kelas X kimia KONFIGURASI ELEKTRON Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konfigurasi elektron kulit dan subkulit. 2. Menyelesaikan
K-13 Kelas X kimia KONFIGURASI ELEKTRON Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konfigurasi elektron kulit dan subkulit. 2. Menyelesaikan
Komponen Materi. Kimia Dasar 1 Sukisman Purtadi
 Komponen Materi Kimia Dasar 1 Sukisman Purtadi Pengamatan ke Arah Pandangan Atomik Materi Konservasi Massa Komposisi Tetap Perbandingan Berganda Teori Atom Dalton Bagaimana Teori Dalton Menjelaskan Hukum
Komponen Materi Kimia Dasar 1 Sukisman Purtadi Pengamatan ke Arah Pandangan Atomik Materi Konservasi Massa Komposisi Tetap Perbandingan Berganda Teori Atom Dalton Bagaimana Teori Dalton Menjelaskan Hukum
I. PENDAHULUAN. Pencemaran udara adalah masuknya, atau tercampurnya unsur-unsur berbahaya ke dalam
 I. PENDAHULUAN 1.1 Latar Belakang Masalah Pencemaran udara adalah masuknya, atau tercampurnya unsur-unsur berbahaya ke dalam atmosfir yang dapat mengakibatkan terjadinya kerusakan lingkungan, gangguan
I. PENDAHULUAN 1.1 Latar Belakang Masalah Pencemaran udara adalah masuknya, atau tercampurnya unsur-unsur berbahaya ke dalam atmosfir yang dapat mengakibatkan terjadinya kerusakan lingkungan, gangguan
BAB II A. KONSEP ATOM
 BAB II STRUKTURR DAN IKATAN ATOM BAB II STRUKTURR DAN IKATAN ATOM A. KONSEP ATOM Semua material tersusun oleh atom atom. Setiap atom terdiri dari inti atom(nukleus) dan elektron seperti ditunjukkann pada
BAB II STRUKTURR DAN IKATAN ATOM BAB II STRUKTURR DAN IKATAN ATOM A. KONSEP ATOM Semua material tersusun oleh atom atom. Setiap atom terdiri dari inti atom(nukleus) dan elektron seperti ditunjukkann pada
LAPORAN PRAKTIKUM KIMIA ANORGANIK II PERCOBAAN IV PENENTUAN KOMPOSISI ION KOMPLEKS
 LAPORAN PRAKTIKUM KIMIA ANORGANIK II PERCOBAAN IV PENENTUAN KOMPOSISI ION KOMPLEKS DISUSUN OLEH : NAMA : FEBRINA SULISTYORINI NIM : 09/281447/PA/12402 KELOMPOK : 3 (TIGA) JURUSAN : KIMIA FAKULTAS/PRODI
LAPORAN PRAKTIKUM KIMIA ANORGANIK II PERCOBAAN IV PENENTUAN KOMPOSISI ION KOMPLEKS DISUSUN OLEH : NAMA : FEBRINA SULISTYORINI NIM : 09/281447/PA/12402 KELOMPOK : 3 (TIGA) JURUSAN : KIMIA FAKULTAS/PRODI
BAB 10. Strukturr Lewis dan Bentuk Molekul
 BAB 10 Strukturr Lewis dan Bentuk Molekul Disusun Oleh : DHANY MIRNASARI (21030112120012) Dosen Pengampu : DR. ISTADI JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO SEMARANG 2012-2013 10.1
BAB 10 Strukturr Lewis dan Bentuk Molekul Disusun Oleh : DHANY MIRNASARI (21030112120012) Dosen Pengampu : DR. ISTADI JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO SEMARANG 2012-2013 10.1
Contoh untuk NF 3 F berasal dari golongan VII A, dengan EN 4.0. Maka N sebagai atom pusat
 STRUKTUR LEWIS UNTUK MOLEKUL DAN ION Struktur Lewis merupakan langkah awal untuk menentukan bentuk molekul. Struktur Lewis terdiri dari titiktitik yang menggambarkan valensi electron tiap atom yang saling
STRUKTUR LEWIS UNTUK MOLEKUL DAN ION Struktur Lewis merupakan langkah awal untuk menentukan bentuk molekul. Struktur Lewis terdiri dari titiktitik yang menggambarkan valensi electron tiap atom yang saling
BAB 2 STRUKTUR ATOM PERKEMBANGAN TEORI ATOM
 BAB 2 STRUKTUR ATOM PARTIKEL MATERI Bagian terkecil dari materi disebut partikel. Beberapa pendapat tentang partikel materi :. Menurut Democritus, pembagian materi bersifat diskontinyu ( jika suatu materi
BAB 2 STRUKTUR ATOM PARTIKEL MATERI Bagian terkecil dari materi disebut partikel. Beberapa pendapat tentang partikel materi :. Menurut Democritus, pembagian materi bersifat diskontinyu ( jika suatu materi
Ruko Jambusari No. 7A Yogyakarta Telp. : ; Fax. :
 DASAR-DASAR KIMIA ANORGANIK TRANSISI Oleh : Kristian H. Sugiyarto Edisi Pertama Cetakan Pertama, 2012 Hak Cipta 2012 pada penulis, Hak Cipta dilindungi undang-undang. Dilarang memperbanyak atau memindahkan
DASAR-DASAR KIMIA ANORGANIK TRANSISI Oleh : Kristian H. Sugiyarto Edisi Pertama Cetakan Pertama, 2012 Hak Cipta 2012 pada penulis, Hak Cipta dilindungi undang-undang. Dilarang memperbanyak atau memindahkan
Bab 10 Bentuk Bentuk Molekul
 Bab 10 Bentuk Bentuk Molekul 10.1 Menjelaskan Bentuk-Bentuk Molekul dan Ion Menurut Struktur Lewis Hal pertama yang dilakukan untuk mengetahui bentuk dari suatu molekul ialah dengan mengubah rumus suatu
Bab 10 Bentuk Bentuk Molekul 10.1 Menjelaskan Bentuk-Bentuk Molekul dan Ion Menurut Struktur Lewis Hal pertama yang dilakukan untuk mengetahui bentuk dari suatu molekul ialah dengan mengubah rumus suatu
TEORI IKATAN VALENSI
 TEORI IKATAN VALENSI Pembentukan ikatan kovalen dapat dijelaskan menggunakan dua teori yaitu teori ikatan valensi dan teori orbital molekul. Berdasarkan teori ikatan valensi, ikatan kovalen dapat terbentuk
TEORI IKATAN VALENSI Pembentukan ikatan kovalen dapat dijelaskan menggunakan dua teori yaitu teori ikatan valensi dan teori orbital molekul. Berdasarkan teori ikatan valensi, ikatan kovalen dapat terbentuk
(2) kekuatan ikatan yang dibentuk untuk karbon;
 Reaksi Subsitusi Nukleofilik Alifatik Reaksi yang berlangsung karena penggantian satu atau lebih atom atau gugus dari suatu senyawa oleh atom atau gugus lain disebut reaksi substitusi. Bila reaksi substitusi
Reaksi Subsitusi Nukleofilik Alifatik Reaksi yang berlangsung karena penggantian satu atau lebih atom atau gugus dari suatu senyawa oleh atom atau gugus lain disebut reaksi substitusi. Bila reaksi substitusi
BENTUK MOLEKUL MELUKISKAN MOLEKUL DAN ION DENGAN STRUKTUR LEWIS
 BENTUK MOLEKUL MELUKISKAN MOLEKUL DAN ION DENGAN STRUKTUR LEWIS Penyusunan struktur lewis dilakukan dengan menuliskan titik di sekeliling atom secara 2 dimensi. Titik-titik tersebut mewakili elektron pada
BENTUK MOLEKUL MELUKISKAN MOLEKUL DAN ION DENGAN STRUKTUR LEWIS Penyusunan struktur lewis dilakukan dengan menuliskan titik di sekeliling atom secara 2 dimensi. Titik-titik tersebut mewakili elektron pada
kimia Kelas X REVIEW I K-13 A. Hakikat Ilmu Kimia
 K-13 Kelas X kimia REVIEW I Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami hakikat ilmu kimia dan metode ilmiah. 2. Memahami teori atom dan
K-13 Kelas X kimia REVIEW I Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami hakikat ilmu kimia dan metode ilmiah. 2. Memahami teori atom dan
BAB I PENDAHULUAN. A. Latar Belakang
 BAB I PEDAHULUA A. Latar Belakang Senyawa kovalen koordinasi terbentuk antara ion logam yang memiliki orbital d yang belum terisi penuh (umumnya ion logam transisi) dengan ligan yang memiliki pasangan
BAB I PEDAHULUA A. Latar Belakang Senyawa kovalen koordinasi terbentuk antara ion logam yang memiliki orbital d yang belum terisi penuh (umumnya ion logam transisi) dengan ligan yang memiliki pasangan
STRUKTUR ATOM. 3. Perhatikan gambar berikut :
 STRUKTUR ATOM. Elektron - elektron dalam atom beredar mengelilingi inti dan berada pada lintasan (tingkat energi) tertentu. Elektron dapat berpindah dari satu tingkat energi ke tingkat energi lainnya di
STRUKTUR ATOM. Elektron - elektron dalam atom beredar mengelilingi inti dan berada pada lintasan (tingkat energi) tertentu. Elektron dapat berpindah dari satu tingkat energi ke tingkat energi lainnya di
Coordination Chemistry
 Lecture Presentation Coordination Chemistry By : Agung Nugroho Catur Saputro, S.Pd., M.Sc NIP. 19770723 200501 1 001 JENIS-JENIS LIGAN DAN TATA NAMA SENYAWA KOMPLEKS o o o o o Menentukan atom pusat, bilangan
Lecture Presentation Coordination Chemistry By : Agung Nugroho Catur Saputro, S.Pd., M.Sc NIP. 19770723 200501 1 001 JENIS-JENIS LIGAN DAN TATA NAMA SENYAWA KOMPLEKS o o o o o Menentukan atom pusat, bilangan
PENENTUAN RUMUS ION KOMPLEKS BESI DENGAN ASAM SALISILAT
 PENENTUAN RUMUS ION KOMPLEKS BESI DENGAN ASAM SALISILAT Desi Eka Martuti, Suci Amalsari, Siti Nurul Handini., Nurul Aini Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Jenderal
PENENTUAN RUMUS ION KOMPLEKS BESI DENGAN ASAM SALISILAT Desi Eka Martuti, Suci Amalsari, Siti Nurul Handini., Nurul Aini Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Jenderal
Analisis Kemampuan Memori Mahasiswa Prodi Pendidikan Sains Pada Materi Tata Nama Senyawa Kompleks
 JEMS Jurnal Edukasi Matematika dan Sains Avaliable online at: http://e-journal.unipma.ac.id/index.php/jems Analisis Kemampuan Memori Mahasiswa Prodi Pendidikan Sains Pada Materi Tata Nama Senyawa Kompleks
JEMS Jurnal Edukasi Matematika dan Sains Avaliable online at: http://e-journal.unipma.ac.id/index.php/jems Analisis Kemampuan Memori Mahasiswa Prodi Pendidikan Sains Pada Materi Tata Nama Senyawa Kompleks
RANGKUMAN BENTUK-BENTUK MOLEKUL Oleh Arina Tsusayya Ryandi Kelas selasa siang (kelas b)
 RANGKUMAN BENTUK-BENTUK MOLEKUL Oleh Arina Tsusayya Ryandi 21030112140057 Kelas selasa siang (kelas b) A. Penggambaran Molekul-Molekul dan Ion-Ion dengan Struktur Lewis Untuk menggambar molekul/ion dengan
RANGKUMAN BENTUK-BENTUK MOLEKUL Oleh Arina Tsusayya Ryandi 21030112140057 Kelas selasa siang (kelas b) A. Penggambaran Molekul-Molekul dan Ion-Ion dengan Struktur Lewis Untuk menggambar molekul/ion dengan
Bentuk Molekul. Langkah pertama menggambarkan molekulnya adalah dengan mengubah rumus molekul menjadi stuktur lewis molekulnya.
 Bentuk Molekul Langkah pertama menggambarkan molekulnya adalah dengan mengubah rumus molekul menjadi stuktur lewis molekulnya. 1. Menggunakan aturan oktet untuk menggambarkan struktur lewis a. Struktur
Bentuk Molekul Langkah pertama menggambarkan molekulnya adalah dengan mengubah rumus molekul menjadi stuktur lewis molekulnya. 1. Menggunakan aturan oktet untuk menggambarkan struktur lewis a. Struktur
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB I STRUKTUR ATOM
 BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB I 1. Suatu partikel X memiliki 16 proton, 16 neutron, dan 18 elektron. Partikel tersebut dapat dikategorikan sebagai A. Anion X bermuatan -1
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB I 1. Suatu partikel X memiliki 16 proton, 16 neutron, dan 18 elektron. Partikel tersebut dapat dikategorikan sebagai A. Anion X bermuatan -1
1. Pendahuluan 2. Intermediate reaktif 3. Nukleofil and elektrofil 4. Tipe reaksi 5. Ions versus radicals
 1. Pendahuluan 2. Intermediate reaktif 3. Nukleofil and elektrofil 4. Tipe reaksi 5. Ions versus radicals TUJUAN INSTRUKSIONAL KHUSUS Setelah mengikuti kuliah pokok bahasan Reaktivitas dan Mekanisme, mahasiswa
1. Pendahuluan 2. Intermediate reaktif 3. Nukleofil and elektrofil 4. Tipe reaksi 5. Ions versus radicals TUJUAN INSTRUKSIONAL KHUSUS Setelah mengikuti kuliah pokok bahasan Reaktivitas dan Mekanisme, mahasiswa
Chemical Chemic al Bonding Bonding
 Chemical Bonding Di alam banyak ditemukan zat baik berupa unsur atau senyawa. Keberadaan zat tersebut sangat ditentukan oleh kestabilan zat itu sendiri. Jika suatu zat stabil maka kita akan menemukannya
Chemical Bonding Di alam banyak ditemukan zat baik berupa unsur atau senyawa. Keberadaan zat tersebut sangat ditentukan oleh kestabilan zat itu sendiri. Jika suatu zat stabil maka kita akan menemukannya
Kimia Koordinasi Pendahuluan
 Kimia Koordinasi Pendahuluan Senyawaan Koordinasi umumnya terdiri dari satu atom logam atau ion dan setidaknya satu ligand (atom, ion atau molekul) yang dapat dilihat sebagai donor elektron bagi logam
Kimia Koordinasi Pendahuluan Senyawaan Koordinasi umumnya terdiri dari satu atom logam atau ion dan setidaknya satu ligand (atom, ion atau molekul) yang dapat dilihat sebagai donor elektron bagi logam
Bentuk Molekul. Menggambarkan Molekul dan Ion dengan Struktur Lewis
 Menggambarkan Molekul dan Ion dengan Struktur Lewis Struktur Lewis lebih tepat disebut dengan rumus Lewis ( Lewis formula ) sebab menggambarkan pendistribusian elektron valensi serta ikatan-ikatan antar
Menggambarkan Molekul dan Ion dengan Struktur Lewis Struktur Lewis lebih tepat disebut dengan rumus Lewis ( Lewis formula ) sebab menggambarkan pendistribusian elektron valensi serta ikatan-ikatan antar
ANALISIS SOAL UJIAN HARIAN KELAS XI BAB: TEORI ATOM MEKANIKA KUANTUM, BENTUK MOLEKUL, DAN GAYA ANTARMOLEKUL
 ANALISIS SOAL UJIAN HARIAN KELAS XI BAB: TEORI ATOM MEKANIKA KUANTUM, BENTUK MOLEKUL, DAN Petunjuk Umum : GAYA ANTARMOLEKUL Telitilah soal terlebih dahulu, perangkat soal terdiri dari 20 soal pilihan ganda
ANALISIS SOAL UJIAN HARIAN KELAS XI BAB: TEORI ATOM MEKANIKA KUANTUM, BENTUK MOLEKUL, DAN Petunjuk Umum : GAYA ANTARMOLEKUL Telitilah soal terlebih dahulu, perangkat soal terdiri dari 20 soal pilihan ganda
LAPORAN LENGKAP PRAKTIKUM KIMIA ANORGANIK PERCOBAAN 3 PENENTUAN BILANGAN KOORDINAI KOMPLEKS TEMBAGA (II)
 LAPORAN LENGKAP PRAKTIKUM KIMIA ANORGANIK PERCOBAAN 3 PENENTUAN BILANGAN KOORDINAI KOMPLEKS TEMBAGA (II) OLEH : NAMA : IMENG NIM: ACC 109 011 KELOMPOK : 2 ( DUA ) HARI, TANGGAL : RABU, 8 JUNI 2011 ASISTEN
LAPORAN LENGKAP PRAKTIKUM KIMIA ANORGANIK PERCOBAAN 3 PENENTUAN BILANGAN KOORDINAI KOMPLEKS TEMBAGA (II) OLEH : NAMA : IMENG NIM: ACC 109 011 KELOMPOK : 2 ( DUA ) HARI, TANGGAL : RABU, 8 JUNI 2011 ASISTEN
Ikatan yang terjadi antara atom O dengan O membentuk molekul O 2
 Ikatan Kovalen adalah ikatan yang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan. Ikatan kovalen terjadi akibat ketidakmampuan salah 1 atom yang akan berikatan untuk
Ikatan Kovalen adalah ikatan yang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan. Ikatan kovalen terjadi akibat ketidakmampuan salah 1 atom yang akan berikatan untuk
KIMIA ANORGANIK BAB 10. STRUKTUR LEWIS dan BENTUK-BENTUK MOLEKUL. Disusun Oleh : Faizal Romadhon NIM : TEKNIK KIMIA
 KIMIA ANORGANIK BAB 10 STRUKTUR LEWIS dan BENTUK-BENTUK MOLEKUL Disusun Oleh : Nama : Faizal Romadhon NIM : 2103012130072 Kelas : Kelas C TEKNIK KIMIA UNIVERSITAS DIPONEGORO SEMARANG 2012 STRUKTUR LEWIS
KIMIA ANORGANIK BAB 10 STRUKTUR LEWIS dan BENTUK-BENTUK MOLEKUL Disusun Oleh : Nama : Faizal Romadhon NIM : 2103012130072 Kelas : Kelas C TEKNIK KIMIA UNIVERSITAS DIPONEGORO SEMARANG 2012 STRUKTUR LEWIS
Aris Arianto. Guru Kimia di SMAN Madani Palu. STUDENT S BOOk
 STUDENT S BOOk Aris Arianto Guru Kimia di SMAN Madani Palu Website/blog penulis : Website : http://blendedlearningkimia.com Weblog : 1. http://www.arisarianto.web.id 2. http://arisarianto.wordpress.com
STUDENT S BOOk Aris Arianto Guru Kimia di SMAN Madani Palu Website/blog penulis : Website : http://blendedlearningkimia.com Weblog : 1. http://www.arisarianto.web.id 2. http://arisarianto.wordpress.com
larutan yang lebih pekat, hukum konservasi massa, hukum perbandingan tetap, hukum perbandingan berganda, hukum perbandingan volume dan teori
 i M Tinjauan Mata Kuliah ata kuliah Kimia Dasar 1 yang diberi kode PEKI 4101 mempunyai bobot 3 SKS yang terdiri dari 9 modul. Dalam mata kuliah ini dibahas tentang dasar-dasar ilmu kimia, atom, molekul
i M Tinjauan Mata Kuliah ata kuliah Kimia Dasar 1 yang diberi kode PEKI 4101 mempunyai bobot 3 SKS yang terdiri dari 9 modul. Dalam mata kuliah ini dibahas tentang dasar-dasar ilmu kimia, atom, molekul
KIMIA ANORGANIK ( Dr. Istadi )
 KIMIA ANORGANIK ( Dr. Istadi ) BENTUK MOLEKUL DAN STRUKTUR LEWIS O l e h : Muqsit Bramantiya NIM. 21030112140142 JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO SEMARANG 2012 I. Menggambarkan
KIMIA ANORGANIK ( Dr. Istadi ) BENTUK MOLEKUL DAN STRUKTUR LEWIS O l e h : Muqsit Bramantiya NIM. 21030112140142 JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO SEMARANG 2012 I. Menggambarkan
ORBITAL DAN IKATAN KIMIA ORGANIK
 ORBITAL DAN IKATAN KIMIA ORGANIK Objektif: Pada Bab ini, mahasiswa diharapkan untuk dapat memahami, Teori dasar orbital atom dan ikatan kimia organik, Orbital molekul orbital atom dan Hibridisasi orbital
ORBITAL DAN IKATAN KIMIA ORGANIK Objektif: Pada Bab ini, mahasiswa diharapkan untuk dapat memahami, Teori dasar orbital atom dan ikatan kimia organik, Orbital molekul orbital atom dan Hibridisasi orbital
I. PENDAHULUAN. senyawa kompleks bersifat sebgai asam Lewis sedangkan ligan dalam senyawa
 I. PENDAHULUAN A. Latar Belakang Senyawa kompleks merupakan senyawa yang memiliki warna yang khas yang diakibatkan oleh adanya unsur yang dari golongan transisi yang biasanya berperperan sebagai atom pusat
I. PENDAHULUAN A. Latar Belakang Senyawa kompleks merupakan senyawa yang memiliki warna yang khas yang diakibatkan oleh adanya unsur yang dari golongan transisi yang biasanya berperperan sebagai atom pusat
Persiapan UN 2018 KIMIA
 Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
Ringkasan BAB 10. Langkah-langkah penulisan struktur lewis untuk molekul dengan ikatan tunggal.
 Ringkasan BAB 10 1. Struktur lewis untuk molekul ikatan tunggal Langkah-langkah penulisan struktur lewis untuk molekul dengan ikatan tunggal. Langkah 1, tempatkan atom dari golongan yang lebih kecil ditengah
Ringkasan BAB 10 1. Struktur lewis untuk molekul ikatan tunggal Langkah-langkah penulisan struktur lewis untuk molekul dengan ikatan tunggal. Langkah 1, tempatkan atom dari golongan yang lebih kecil ditengah
STRUKTUR MOLEKUL SEDERHANA
 STRUKTUR MOLEKUL SEDERHANA Oleh : Dr. Suyanta Ikatan ionik dibentuk oleh tarikan elekrostatik antara kation dan anion. Karena medan listrik suatu ion bersimetri bola, ikatan ion tidak memiliki karakter
STRUKTUR MOLEKUL SEDERHANA Oleh : Dr. Suyanta Ikatan ionik dibentuk oleh tarikan elekrostatik antara kation dan anion. Karena medan listrik suatu ion bersimetri bola, ikatan ion tidak memiliki karakter
Tabel Periodik Unsur. Keperiodikan=keteraturan Kemiripan di antara sifat unsur secara teratur & periodik jika unsur diatur menurut bobot atom (ba).
 Tabel Periodik Unsur Keperiodikan=keteraturan Kemiripan di antara sifat unsur secara teratur & periodik jika unsur diatur menurut bobot atom (ba). Perkembangan Tabel Periodik Lavosier (1769) Unsur: logam
Tabel Periodik Unsur Keperiodikan=keteraturan Kemiripan di antara sifat unsur secara teratur & periodik jika unsur diatur menurut bobot atom (ba). Perkembangan Tabel Periodik Lavosier (1769) Unsur: logam
GEOMETRI MOLEKUL (BENTUK MOLEKUL)
 GEOMETRI MOLEKUL (BENTUK MOLEKUL) Untuk menentukan gemetri molekul dapat ditentukan dengan teori: 1. VSEPR 2. Hibridisasi 3. Orbital molekul Hubungan VSEPR dengan domain electron pada atom pusat (jumlah
GEOMETRI MOLEKUL (BENTUK MOLEKUL) Untuk menentukan gemetri molekul dapat ditentukan dengan teori: 1. VSEPR 2. Hibridisasi 3. Orbital molekul Hubungan VSEPR dengan domain electron pada atom pusat (jumlah
BAB 3 IKATAN DAN STRUKTUR MOLEKUL
 BAB 3 IKATAN DAN STRUKTUR MOLEKUL Atom-atom pada umumnya tidak ditemukan dalam keadaan bebas (kecuali pada temperatur tinggi), melainkan sebagai suatu kelompok atom atau sebagai molekul. Hal ini berarti
BAB 3 IKATAN DAN STRUKTUR MOLEKUL Atom-atom pada umumnya tidak ditemukan dalam keadaan bebas (kecuali pada temperatur tinggi), melainkan sebagai suatu kelompok atom atau sebagai molekul. Hal ini berarti
Bilangan Kuantum Utama (n)
 Bilangan Kuantum Utama (n) Menyatakan nomer kulit tempat elektron berada atau bilangan ini juga menyatakan ukuran orbital/ jarak/ jari-jari atom. Dinyatakan dengan bilangan bulat positif. Mempunyai dua
Bilangan Kuantum Utama (n) Menyatakan nomer kulit tempat elektron berada atau bilangan ini juga menyatakan ukuran orbital/ jarak/ jari-jari atom. Dinyatakan dengan bilangan bulat positif. Mempunyai dua
Bab I Pendahuluan. I.1 Latar Belakang dan Masalah Penelitian
 Bab I Pendahuluan I.1 Latar Belakang dan Masalah Penelitian Senyawa kompleks oktahedral yang mengandung ion logam pusat transisi seri pertama dengan konfigurasi d 4 d 7 dapat berada dalam dua keadaan elektronik
Bab I Pendahuluan I.1 Latar Belakang dan Masalah Penelitian Senyawa kompleks oktahedral yang mengandung ion logam pusat transisi seri pertama dengan konfigurasi d 4 d 7 dapat berada dalam dua keadaan elektronik
Perkembangan Model Atom. Semester 1
 Perkembangan Model Atom Semester 1 Model atom adalah suatu gambar rekaan atom berdasarkan eksperimen ataupun kajian teoritis, karena para ahli tidak tahu pasti seperti apakah bentuk atom itu sebenarnya.
Perkembangan Model Atom Semester 1 Model atom adalah suatu gambar rekaan atom berdasarkan eksperimen ataupun kajian teoritis, karena para ahli tidak tahu pasti seperti apakah bentuk atom itu sebenarnya.
Bab 10. Struktur lewis dan BENTUK-BENTUK MOLEKUL
 Bab 10 Struktur lewis dan BENTUK-BENTUK MOLEKUL Oleh : Putri Pratiwi (21030112120010) Dosen Pengampu : Dr. Istadi JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO SEMARANG 2012 10.1 Menggambarkan
Bab 10 Struktur lewis dan BENTUK-BENTUK MOLEKUL Oleh : Putri Pratiwi (21030112120010) Dosen Pengampu : Dr. Istadi JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO SEMARANG 2012 10.1 Menggambarkan
Ikatan Kimia II: VSEPR dan prediksi geometri Molekular, teori ikatan valensi dan Hibridisasi Orbital Atom; teori orbital atom
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Chapter 3c Ikatan Kimia II: VSEPR dan prediksi geometri Molekular, teori ikatan
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Chapter 3c Ikatan Kimia II: VSEPR dan prediksi geometri Molekular, teori ikatan
BENTUK-BENTUK MOLEKUL
 BENTUK-BENTUK MOLEKUL 10. 1. Menggambarkan Molekul dan Ion dengan Struktur Lewis Berikut adalah langkah-langkah dalam menggambarkan molekul dengan ikatan tunggal menggunakan struktur Lewis: 1) Letakkan
BENTUK-BENTUK MOLEKUL 10. 1. Menggambarkan Molekul dan Ion dengan Struktur Lewis Berikut adalah langkah-langkah dalam menggambarkan molekul dengan ikatan tunggal menggunakan struktur Lewis: 1) Letakkan
Tabel Periodik. Bab 3a. Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr.
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Bab 3a Tabel Periodik Kapan unsur-unsur ditemukan? 8.1 1 ns 1 Konfigurasi elektron
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Bab 3a Tabel Periodik Kapan unsur-unsur ditemukan? 8.1 1 ns 1 Konfigurasi elektron
FAKULTAS TEKNIK UNIVERSITAS NEGERI YOGYAKARTA BAHAN AJAR KIMIA DASAR BAB VI IKATAN KIMIA
 No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 7 BAB VI IKATAN KIMIA Sebagian besar partikel materi adalah berupa molekul atau ion. Hanya beberapa partikel materi saja yang berupa atom. 1)
No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 7 BAB VI IKATAN KIMIA Sebagian besar partikel materi adalah berupa molekul atau ion. Hanya beberapa partikel materi saja yang berupa atom. 1)
