COORDINATION COMPOUNDS
|
|
|
- Ade Kusumo
- 7 tahun lalu
- Tontonan:
Transkripsi
1 COORDINATION COMPOUNDS Coordination Compounds (senyawa koordinasi) adalah senyawa yang mengandung paling tidak satu ion komplek, yang merupakan jenis kation logam pusat(baik pada logam transisi ataupun golongan logam utama) yang terikat dengan molekul dan atau anion yang disebut ligan. Untuk mencapai netral dalam ikatan koordinasi,ion komplek biasanya bergabung dengan ion lainnya,yang disebut Counter Ions(ion yang berlawanan jenis). Gambar 23.9 Bagian dari Coordination Compound. Terdiri dari model (atas), gambar komplek (tengah), dan rumus kimia (bawah), biasanya mengandung ion kompleks dan counter ions untuk menetralkan. Ion kompleks punya logam pusat yang dikelilingi oleh ligand. Ketika [Co(NH 3 ) 6 ]Cl 3 dilarutkan, ion kompleks dan counter ion akan berpisah,tetapi ligan tetap berikatan dengan ion logam. Enam ligan disekitar ion logam memberikan ion kompleks bentuk geometri octahedral. Ion kompleks dengan pusat db sebagai ion logam punya empat ligan dan bentuk geometri square planar. Beberapa coordination compound ada di gambar 23.9A Senyawa koordinasinya adalah [Co(NH 3 ) 6 ]CI 3, ion komplek (selalu di dalam kurung siku) adalah [Co(NH 3 ) 6 ] 3+,enam molekul NH 3 yang berikatan dengan atom pusat Co 3+ adalah ligan, dan 3 Cl - adalah counter ion. Coordination compound memiliki sifat seperti elektrolit dalam air. Ion komplek dan counter ion saling berpisah satu sama lain. Dalam gambar 23.9A ditunjukkan 1 mol dari [Co(NH 3 ) 6 ]CI 3 menghasilkan 1 mol ion [Co(NH 3 ) 6 ] 3+ dan 3 mol ion Cl -.
2 Ion Kompleks, Bilangan Koordinasi, Bentuk Geometri, dan Ligan Ion komplek yaitu hubungan ion logam dengan jumlah dan jenis dari ligan yang berikatan dengannya. Strukturnya memiliki 3 karakteristik,yaitu bilangan koordinasi, bentuk geometri, dan jumlah atom yang diberikan oleh setiap ligan. Bilangan koordinasi : jumlah atom ligan yang berikatan langsung dengan ion atom pusat. Bilangan koordinasi dari ion Co 3+ di [Co(NH 3 ) 6 ] 3+ adalah 6 karena enam atom ligan (N dari NH3) berikatan dengannya. Bilangan koordinasi dari ion Pt 2+ di berbagai kompleksnya adalah 4, dan ion Pt 4+ di kompleksnya adalah 6. Tembaga (II) punya banyak bilangan koordinasi,yaitu 2,4, atau 6 di ion komplek yang berbeda. Secara umum,bilangan koordinasi yang paling sering ditemui di ion kompleks adalah 6. Geometri : bentuk ion komplek yang bergantung pada bilangan koordinasi dan sifat alami dari ion logam itu sendiri. Tabel 23.6 menunjukkan bentuk geometri dengan bilangan koordinasi 2,4,dan 6. Ion komplek dengan ion logam yang bilangan koordinasinya 2, seperti [Ag(NH 3 ) 2 ] +, adalah linear. Bilangan koordinasi 4 menghasilkan 2 bentuk seperti square planar atau tetrahedral. Kebanyakan ion logam d 8 membentuk ion kompleks square planar, seperti pada gambar 23.9B. ion d 10 membentuk ion kompleks tetrahedral. Bilangan koordinasi 6 menghasilkan bentuk octahedral seperti pada contoh [Co(NH 3 ) 6 ] 3+ di gambar 23.9A. Atom yang diberikan oleh setiap ligan. Ligan dari ion komplek adalah molekul atau anion dengan 1 atau lebih atom yang setiap pemberian memberikan pasangan elektron ke ion logam dan membentuk ikatan kovalen. Mereka mempunyai setidaknya satu pasangan, donor atom yang lebih sering datang dari golongan 5A(15),6A(16), atau 7A(17).
3 Ligan dibagi berdasarkan jumlah atom yang diberi dan dipakai berikatan dengan ion logam pusat. Monodentat,seperti Cl - dan NH 3 yaitu ligan yang memberikan satu atom. Bidentat,yaitu ligan yang memberikan 2 atom, yang masing-masing berikatan dengan ion logam. Polidentat memberikan lebih dari 2 atom. Seperti pada table 23.7,menunjukkan beberapa ligan yang umum dijumpai di coordination compounds. Rumus dan Cara Penamaan Coordination Compound Ada 3 aturan penting untuk menuliskan rumus dari coordination compound. 1. Kation dituliskan sebelum anion. 2. Muatan dari kation diseimbangkan dengan muatan dari anion. 3. Dalam ion kompleks, ligan netral dituliskan sebelum ligan anion dan rumus dari semua ion di tempatkan di dalam kurung siku. Seluruh ion kompleks mungkin saja kation atau anion. Kompleks kation punya anion sebagai counter ionnya. Dan kompleks anion punya kation sebagai counter ionnya. Untuk menemukan muatan dari ion logam sebagai contoh dalam K 2 [Co(NH 3 ) 2 CI 4 ], 2K + sebagai counter ion menyeimbangkan muatan kompleks anion [Co(NH 3 ) 2 CI 4 ] 2- yang punya 2 molekul NH 3 dan 4 ion Cl - sebagai ligannya. 2 NH 3 netral, dan 4 Clmempunyai muatan total 4-,dan dari seluruh ion kompleks punya muatan 2-. Jadi ion logam pusat seharusnya Co 2+.
4 Muatan ion kompleks = muatan ion logam + jumlah muatan semua ligan 2- = muatan ion logam + [(2x0) + (4x1-)] Jadi, muatan ion logam = (2-) - (4-) = 2+ Kebanyakan coordination compound dinamakan berdasarkan sistem yang menggunakan beberapa peraturan seperti di bawah ini: 1. kation dinamakan sebelum anion. Dalam penamaan [Co(NH 3 ) 4 Cl 2 ]Cl sebagai contohnya, kita namakan ion [Co(NH 3 ) 4 Cl 2 ] + sebelum ion Cl -. Sehingga namanya adalah tetraamindiklorocobalt(iii) klorida. Spasi yang memisahkan kation dan anion. 2. Didalam ion kompleks, ligan dinamakan dari urutan alphabet sebelum ion logam. Catatan bahwa ion [Co(NH 3 ) 4 Cl 2 ] + dinamakan dalam peraturan ke 1, 4 NH 3 dan 2 CL - dinamakan sebelum Co 3+. Karena dia mempunyai 6 donor atom,maka ion etilendiamintetraasetat (EDTA 4- ) mempunyai kompleks yang sangat stabil dengan berbagai ion logam. Sifat ini membuat EDTA sangat berguna untuk logam berat yang beracun. Setelah dimasukkan ke tubuh pasien, ion akan berperan menghilangkan timbale dan logam berat lainnya dari darah dan cairan tubuh lainnya 3. ligan netral mempunyai nama molekul, tetapi ada beberapa pengecualian (tabel 23.8). ligan anion berakhiran ida dan ditambahkan o pada akhir nama. Sebagai contoh nama flourida dari ion F yang menjadi ligan bernama flouro.2 ligan di [Co(NH 3 ) 4 Cl 2 ] + adalah ammina (NH 3 ) dan kloro (Cl - ) dengan ammina dinamakan terlebih dahulu sebelum kloro secara alphabet. 4. numerical prefix menunjukkan jumlah dari ligan. Tetraammina menyumbangkan 4 NH 3,dikloro menyumbangkan 2 Cl -. Aturan ini tidak mempengaruhi urutan alphabet, sehingga tetraammine tetap dinamakan sebelum dikloro. Beberapa nama ligan sudah mempunyai numerical prefix,seperti etilendiamin, kita gunakan bis(2),tris(3),atau tetrakis(4) untuk menunjukkan jumlah ligan.
5 5. bilangan oksidasi dari ion logam pusat ditulis dalam bilangan romawi hanya saat ion logam punya lebih dari 1bilangan. 6. jika ion kompleksnya anion, diberi tambahan nama pada akhir logam ate. Seperti K[Pt(NH 3 )Cl 5 ] adalah potassium amminapentakloroplatinate (IV). Untuk beberapa logam,digunakan akhiran Latin dengan ate pada akhirnya,ditunjukkan pada tabel CONTOH MASALAH 23.3 MENULISKAN NAMA DAN RUMUS COORDINATION COMPOUND Masalah : (a) Apa nama dari Na 3 [AlF 6 ]? (b) Apa nama dari [Co(en) 2 Cl 2 ]NO 3? (c) Apa rumus dari tetraamminbromokloroplatinum(iv) klorida? (d) Apa rumus dari hexaammincobalt(iii) tetrakloroferrat(iii)? Rencana permasalahan: Gunakan peraturan yng terdapat di tabel 23.8 dan 23.9 Penyelesaian : (a) Ion kompleksnya adalah [AlF6] -. terdapat 6 F - sebagai ligan sehingga menjadi hexaflouro. Ion kompleksnya adalah anion,sehingga akhiran logam dirubah menjadi ate,hexaflouroaluminate. Alumunium hanya punya 1 bilangan oksidasi,yaitu +3 sehingga tidak digunakan aturan Roman Numerical. Ion counter positif dinamakan pertama dan diberi spasi,sehingga namanya menjadi sodium hexaflouroaluminate. (b) disusun secara alfabetis, ada 2 ion Cl - dan 2 en [dikloro dan bis(etilendiammine)] sebagai ligan. Ion kompleksnya positif,sehingga nama logam tetap. Tetapi kita harus menentukan bilangan oksidasinya karena Co punya beberapa. Ada 1 NO 3 - menyeimbangkan muatan +1. Dengan 2- dari 2 Cl - dan 0 dari 2 en, logam nya menjadi Co(III). Sehingga namanya menjadi diklorobis(etilendiamin)cobalt(iii) nitrate. (c) Ion logam pusat ditulis pertama. Diikuti oleh ligan netral lalu ligan negatif yang telah diurutkan sesuai alphabet. tetraammin menunjukkan 4NH 3, bromo menunjukkan 1 Br -,kloro menunjukkan 1 Cl -, dan platinum(iv) adalah Pt 4+. Jadi ion kompleksnya adalah [Pt(NH 3 ) 4 BrCl] 2+. muatan +2 berasal dari penjumlahan 4+ dari Pt 4+,0 dari 4 NH 3, 1- dari Br -, 1- dari Cl -, untuk menyeimbangkan muatan jadi ditambahkan 2 counter ion Cl -. > [Pt(NH 3 ) 4 BrCl]Cl 2. (d) Ikatan ini terdiri dari 2 ion kompleks yang berbeda. Di kation, hexaammine=6nh 3,cobalt(III)=Co 3+, jadi kationnya adalah [Co(NH 3 ) 6 ] 3+. Muatan 3+ berasal dari jumlah 3+ dari Co 3+ dan 0 dari 6 NH 3. Di anion, tetrakloro=4cl -,dan ferrat(iii)=fe 3+. Jadi anionnya adalah [Fe(Cl) 4 ] berasal dari jumlah 3+ dari Fe 3+ dan 4- dari 4Cl -. Untuk membentuk ikatan netral, satu kation 3+ diseimbangkan dengan 3 anion 1-. >[Co(NH 3 ) 6 ][Fe(Cl) 4 ] 3. Alfred Werner dan Teori Koordinasi Coordination Compound ditemukan 200 tahun yang lalu oleh seorang ahli kimia muda asal Swiss bernama Alfred Werner yang dimulai pada 1980an. Dia meneliti berbagai jenis ikatan seperti jenis cobalt seperti pada tabel
6 Seperti yang bisa dilihat, data percobaan Werner menunjukkan jika total ligan yang ada tetap sama dalam setiap ikatannya, walaupun jumlah ion Cl - dan molekul NH 3 berbeda di setiap ion kompleksnya. Sebagai contoh pada ikatan pertama[co(nh 3 ) 6 ]Cl 3,secara total mempunyai 4 ion, 1 pada [Co(NH 3 ) 6 ] 3+ dan 3 pada Cl -. Semua ion Cl - bebas membentuk AgCl. pada ikatan terakhir, [Co(NH 3 )Cl 3 ] tidak punya ion yang terpisah. Alfred Werner mendapatkan Nobel pada 1913 di bidang kimia. Isomer dalam Coordination Compounds Isomer adalah ikatan antara rumus kimia yang sama namun berbeda propertinya. Figur menunjukkan secara singkat jenis isomer di Coordination Compounds yang paling umum. Constitusional (struktur) isomers: Atom yang sama tersambung secara berbeda Dua buah ikatan dengan rumus yang sama, tetapi dengan atom yang tersambung berbeda, disebut dengan constitusional (struktur) isomer. 1. Coordination isomer, terjadi saat komposisi suatu ion kompleks berubah bukan pada ikatannya. Salah satu cara isomer ini bisa terjadi ketika ligan dan counter ion bertukar tempat. Seperti pada [Pt(NH 3 ) 4 Cl 2 ](NO 2 ) 2 dan [Pt(NH 3 ) 4 (NO 2 ) 2 ]Cl 2. Pada ikatan pertama, ion Cl - adalah ligan, dan ion NO 2 - adalah counter ion. Pada ikatan kedua,terjadi perpindahan tempat. Cara
7 lain isomer ini bisa terjadi yaitu pada ikatan 2 ion kompleks dimana 2 set ligan di 1 ikatan saling bertukar. 2. Linkage isomer, terjadi ketika komposisi dari ion kompleks tetapi penempatan ligan dari donor atom berubah. Contoh, ion nitrit bisa mengikat pasangan N atom manapun. (nitro,o 2 N:) atau 1dari atom O,(nitrito,ONO:), untuk memberikan linkage isomer. Seperti pada ikatan pentaamminnitrocobalt(iii) klorida [Co(NH 3 ) 5 (NO 2 )]Cl 2 (kiri) yang berwarna orange dan linkage isomer pentaamminnitritocobalt(iii) klorida [Co(NH 3 ) 5 (ONO)]CI 2 (kanan)yang berwarna merah. Stereoisomer : Pengurutan Spatial atom yang berbeda Stereoisomer adalah ikatan yang punya koneksi atomic yang sama tetapi pengurutan spatial atom yang berbeda.terdiri dari,isomer geometri dan isomer optik. 1. Isomer geometri (juga disebut isomer cis-trans dan kadang diastereomers) terjadi ketika atom atau kumpulan atom diurutkan Figur Geometrik (cis-trans) Isomer. secara berbeda ke ion logam pusat. A. cis dan trans isomer pada square planar coordination compound [Pt(NH 3 ) 2 Cl 2 ] Sebagai contoh, square planar B. cis dan trans isomers pada ion kompleks [Pt(NH 3 ) 2 Cl 2 ] punya dua pengurutan, octahedral [Co(NH 3 ) 4 Cl 2 ]+. Warna pada bentuk yang menjadikan 2 ikatan berbeda. menunjukkan warna asli pada jenis tersebut. I Isomer dengan ligan yang saling bersebelahan adalah cis-diammindikloroplatinum(ii) (gambar A). dan isomer dengan ligan yang saling berseberangan adalah transdiammindikloroplatinum(ii). Sifat dari keduanya akan berbeda. Octahedral kompleks juga terdiri dari cis-trans isomer. Cis isomer dari ion [Co(NH 3 ) 4 Cl 2 ]+ punya 2 ligan Cl-
8 yang saling bersebelahan dan berwarna violet. Sedangkan trans isomer mempunyai dua ligan yang saling bersebrangan dan menghasilkan warna hijau. Antikanker geometri isomer Pada pertengahan 1960,Barnett Rosenberg dan temannya menemukan bahwa cis-[pt(nh 3 ) 2 Cl 2 ] anti tumor agen yang sangat efektif. isomer geometri, trans- [Pt(NH 3 ) 2 Cl 2 ], tidak punya efek antitumor. Cisplastin mungkin bekerja dengan diselipkan dengan DNA sel kanker double helix, yang menyebabkan donor atom menggantikan ligan Cl- dan mengikat platinum(ii) dengan kuat,mencegah replikasi DNA 2. Isomer optic (disebut juga enantiomers) terjadi ketika molekul dan bayangan gambarnya tidak bisa superimposed. isomer optic diidentifikasi secara fisik dalam segala cara,kecuali satu, arah dimana mereka berotasi. Ion Octahedral kompleks menunjukkan banyak contoh dari isomer optic. Seperti contoh pada figur 23.12A, dua struktur (I dan II) dari [Co(en) 2 Cl 2 ] +, cis-diklorobis(etilendiamin)cobalt(iii),merupakan bayangan dari yang lainnya. Putar struktur I 180 o vertical axis dan akan ditemukan III. Ligan Cl- pada III cocok dengan II, tetapi ligan en tidak. II dan III (rotasi I) bukan superimposable, mereka masih isomer optic. Salah satu isomer ditunjukkan sebagai d- [Co(en) 2 Cl 2 ] + dan yang lainnya adalah l-[co(en) 2 Cl 2 ] + tergantung dari mana berotasi ke kanan (d- untuk dekstro ) atau ke kiri (l- untuk levo ). Pada figur 23.12B, dua struktur dari transdiklorobis(etilendiammin)cobalt(iii) ion bukanlah isomer optic. Putar I 90 o sekitar vertikal axis dan akan ditemukan III, yang merupakan superimposable dari II. Figur A. Struktur I dan bayangannya,struktur II,adalah isomer optic dari cis-[co(en) 2 Cl 2 ] +. rotasi struktur I menghasilkan struktur III,yang tidak sama dengan struktur II B. trans isomer tidak punya isomer optic. Rotasi dari struktur I menghasilkan struktur III, yang merupakan sama dengan struktur II,bayangan dari struktur I
9 Aplikasi Teori Ikatan Valensi ke Ion Kompleks Figure hybrid orbital dan ikatan di octahedral [Cr(NH 3 ) 6 ]3 + a. ikatan valensi pada ion [Cr(NH 3 ) 6 ] + b. diagram orbital parsial menunjukkan pencampuran dari dua 3d,satu 4s, dan tiga 4p orbital di Cr3+ untuk membentuk enam d2sp3 orbital hybrid, yang terisi dengan enam pasang NH3 (merah) Teori Ikatan valensi, yang membantu menjelaskan ikatan dan struktur dari ikatan golongan utama, juga digunakan untuk menjelaskan ikatan pada ion kompleks. Dalam pembentukan ion kompleks, ligan mengisi orbital mendahului orbital ion logam yang kosong. Ligan (basa lewis) memberikan pasangan electron dan ion logam (asam lewis) menerimanya untuk membentuk suatu ikatan kovalen dalam ion kompleks. (lewis adduct). Ikatan seperti itu, dimana satu atom dalam suatu ikatan memberikan semua elektronnya disebut coordinate covalent bond, meskipun setelah terbentuk mereka mirip seperti ikatan kovalen yang lainnya. CONTOH MASALAH 23.4 MENENTUKAN JENIS DARI STEREOISOMER Masalah: Gambar semua stereoisomer untuk setiap jenis isomer dibawah ini: (a) [Pt(NH 3 ) 2 Br 2 ](square planar) (b)[cr(en) 3 ] 3+ (en=h 2 NCH 2 CH 2 NH 2 ) Rencana penyelesaian: Pertama tentukan geometri dari setiap ion logam dan sifat dari ligan. Jika terdapat 2 ligan yang berbeda yang bisa ditempatkan di posisi yang berbeda,maka isomer geometri (cis-trans) bisa terjadi. Lalu kita liat apaah bayangan dari isomer itu superimposable terhadap yang asli. Jika tidak, isomer optic yang terjadi. Penyelesaian: (a) kompleks Pt(II) adalah square planar dan terdapat 2 monodentat ligan. Setiap pasangan ligan bisa berpindah bersebelahan ataupun berseberangan,sehingga isomer geometri terjadi dan setiap isomer superimposable terhadap bayangannya,sehingga tidak ada isomer optic. (b) etilendiamin (en) adalah ligan bidentat. Cr 3+ punya bilangan koordinasi 6 dan octahedral geometri. Tiga bidentat ligan adalah identik sehingga tidak ada isomer geometri. ion kompleksnya tidak mempunyai bayangan superimposable, sehingga isomer optic terjadi.
10 Kompleks octahedral,ion hexaamminchromium(iii) [Cr(NH 3 ) 6 ] 3+ menggambarkan aplikasi dari valence bond (VB) teori untuk octahedral kompleks (figure 23.13). enam orbital dengan energy terendah dari ion Cr 3+ -dua 3d,satu 4s, dan tiga 4p- bersatu dan membentuk eqivalen d 2 sp 3 hybrid orbital. Enam molekul NH 3 memberikan pasangan electron yang berasal dari nitrogen untuk membentuk enam ikatan logam-ligan. Tiga 3d yang tidak berpasangan dari ion Cr 3+ pusat ([Ar]3d 3 ), yang akan membentuk ion kompleks bersifat paramagnetic, tetap pada unhybridized orbital. Kompleks square planar, ion logam dengan konfigurasi d8 biasanya akan membentuk kompleks square planar(figur 23.14). pada ion [Ni(CN) 4 ] 2- sebagai contoh, model terdiri dari satu 3d,satu 4s, dan dua 4p orbital dari Ni 2+ bergabung dan membentuk empat dsp 2 hybrid orbital yang menerima satu pasangan electron dari setiap ligan CN -. Figur Hybrid orbital dan ikatan pada square planar ion [Ni(CN) 4 ] 2- A. ikatan valensi pada [Ni(CN) 4 ] 2- B. dua pasang 3d electron berpasangan dan membebaskan satu 3d orbital untuk hybridisasi dengan 4s dan dua 4p orbital untuk membentuk empat dsp 2 orbital yang menjadi pasangan dari Kompleks tetrahedral, ion logam yang sudah mengisi d sublevel, seperti Zn 2+ ([Ar]3d 10 ), sering membentuk kompleks tetrahedral (figure 23.15). Figur hybrid orbital dan ikatan pada tetrahedral ion [Zn(OH) 4 ] 2- A. ikatan valensi pada [Zn(OH) 4 ] 2- B.gabungan satu 4s dan tiga 4p orbital memberikan empat sp 3 hybrid orbital yang tersedia untuk menerima pasangan dari ligan OH - (merah)
11 Mengapa setiap substansi memiliki warna? Cahaya putih adalah radiasi elektromagnetik yang mengandung semua panjang gelombang (lamda). Cahaya putih bisa terdispersi menjadi spectrum warna, yang masing-masing mempunyai jarak panjang gelombang. Suatu objek terlihat berwarna pada cahaya putih karena mereka menyerap berbagai panjang gelombang dan memantulkannya. Jika suatu objek menyerap semua panjang gelombang yang terlihat, maka warnanya menjadi hitam, sebaliknya jika memantulkan semua maka warna yang terlihat adalah putih. Setiap warna mempunyai warna komplemen. Sebagai contoh hijau dan merah adalah warna komplemen. Gabungan dari warna komplemen menyerap semua panjang gelombang terlihat dan terlihat hitam. Seperti yang tertera pada figur yang menunjukkan hubungan artist color wheel. Suatu objek memiliki particular color untuk alasan: 1. memantulkan cahaya dari warnanya sendiri,sehingga jika suatu objek menyerap semua panjang gelombang kecuali hijau, pantulan cahaya yang memasuki mata kita adalah warna hijau. 2. menyerap cahaya dari warna komplemen. Sehingga jika objek hanya menyerap merah, komplemen dari hijau, maka sisa panjang gelombang yang dipantulkan dan memasuki mata kita akan hijau juga. Tabel menunjukkan daftar warna yang diserap dan hasil warnanya.
12 Pemisahan d Orbital pada octahedral field pada ligan Contoh sederhana yang sering dijumpai yaitu pergantian warna daun di musim tertentu. Pada musim semi dan panas, daun mengandung banyak sekali klorofil dan hanya mengandung sedikit pigmen warna yang lain yang disebut xantofil. Klorofil menyerap warna merah dan biru dengan sangat kuat, dan memantulkan banyak sekali panjang gelombang warna hijau ke mata kita. Pada musim gugur, dimana fotosintesis jarang terjadi, daun tidak lagi mengandung klorofil, sehingga warna hijau menghilang bersamaan dengan terdekomposisinya klorofil. Xantofil yang tertutup oleh klorofil keluar dan menyerap warna hijau dan biru dengan kuat. Sehingga menampilkan warna kuning dan merah pada musim gugur. Figure 23.17A menunjukkan enam ligan bergerak menuju ion logam untuk membentuk komplek. Karena ligan bergerak pada sumbu x,y,dan z mereka muncul langsung menuju lobes dari d x 2 -y 2 dan d z 2 orbital (figure 23.17B dan C) tetapi diantara lobes pada d xy,d xz, dan dyz orbital (figur 23.17D sampai F). Lalu, electron pada d x 2 -y 2 dan d z 2 orbital memiliki repulse lebih kuat daripada di d xy,d xz,d yz. Energi diagram dari orbital menunjukkan kelima d orbital lebih tinggi di energi saat membentuk kompleks daripada di ion logam yang bebas karena repulsi dari munculnya ligan, tetapi
13 energi orbital terbagi dengan dua orbital yang lebih tinggi di energy dibandingkan tiga yang lainnya. (figur 23.18). dua energy orbital yang lebih tinggi disebut e g dan tiga yang lainnya t 2g orbital. Pemisahan energy orbital disebut crystal field effect dan perbedaan energy antara e g dan t 2g adalah crystal field splitting energy ( ). berdasarkan figure 23.19, H 2 0 termasuk weak-field ligan, dan CN - adalah strong-field ligan. Penjelasan warna pada logam transisi Warna dari coordination compound ditentukan oleh perbedaan energy ( ) antara t 2g dan e g orbital di ion kompleksnya. Perbedaan antara dua energy level electron pada ion sama dengan energy dari photon yang terserap. E elektron = E photon = hv substansi punya warna karena hanya beberapa panjang gelombang dari cahaya putih yang diserap. Spektra absorbsi menunjukkan bahwa panjang gelombang yang terserap oleh ion logam dengan ligan yang berbeda dengan ion logam yang ligannya sama. Dari data tersebut, dapat dihubungkan energy dari cahaya yang diserap ke nilai. Observasi pertama :
14 1. untuk ligan yang diberi, warna tergantung pada bilangan oksidasi dari ion logam. Larutan ion [V(H 2 O) 6 ] 2+ adalah violet dan larutan ion [V(H 2 O) 6 ] 3+ adalah kuning. Seperti yang tercantum pada figure 23.21A. 2. untuk ion logam yang diberi, warna tergantung pada ligan. Bahkan pergantian satu ligan bisa membuat dampak yang besar pada panjang gelombang yang diserap dan warna seperti yang bisa dilihat dua ion kompleks Cr 3+ pada figure 23.21B. Observasi yang kedua yaitu memperbolehkan kita membuat rank ligan ke spectrochemical series berdasarkan kemampuan mereka untuk memisah d-orbital energy. Beberapa jenis bergerak dari weak-field ligan (kecil spiltting,kecil ) ke strong-field ligan.(besar splitting, besar ). Seperti yang ditunjukkan pada figure dengan menggunakan cara ini,kita bisa memprediksikan ukuran relatif dari untuk octahedral kompleks yang sama ion logamnya Sifat Magnet dari Kompleks logam Transisi Pemisahan energy level menyebabkan sifat magnetic dengan mempengaruhi jumlah dari electron yang tidak berpasangan pada ion logam di d orbital. Jika semua energy orbital lemah sudah setengah terisi, maka electron selanjutnya bisa : mengisi orbital setengah penuh, atau mengisi orbital yang kosong dengan energy tertinggi
15 sebagai contoh, ion Mn2+ ([Ar]3d 5 ) punya lima electron tidak berpasangan di orbital 3d (figure 23.23A) Orbital terpengaruh dengan ligan dengan cara:. weak-field ligan dan high-spin kompleks. Seperti pada figure 23.23B strong-field ligan dan low-spin kompleks. Seperti pada figure 23.23C diagram orbital untuk d1 sampai d9 di octahedral kompleks menunjukkan kedua high-spin dan low-spin hanya tersedia untuk d4,d5,d6,dan d7. Seperti pada figure
16 Crystal Field Splitting pada Tetrahedral dan square planar kompleks. Tetrahedral kompleks, dengan ligan yang muncul dari ujung tetrahedron, tidak ada dari kelima d orbital yang menuju langsung mengikuti jalannya. (figure 23.25). Energy untuk memisahkan d orbital lebih kurang dari kompleks tetrahedral daripada di kompleks octahedral yang memiliki ligan yang sama. tetrahedral < oktahedral Hanya high-spin kompleks tetrahedral yang diketahui karena magnitude dari sangat kecil. CONTOH MASALAH 23.5 MENGURUTKAN CRYSTAL FIELD SPLITTING ENERGI UNTUK ION KOMPLEKS DARI LOGAM YANG DIBERI Masalah : Urutkan ion [Ti(H 2 O) 6 ] 3+, [Ti(NH 3 ) 6 ] 3+, dan [Ti(CN) 6 ] 3- dalam urutan nilai relatif dari dan energi dari cahaya tampak yang diserap. Rencana penyelesaian: Rumus menunjukkan bilangan oksidasi titanium adalah +3 pada tiga ion. Dari figure 23.22,kita urutkan ligan berdasarkan kekuatan crystal field, ligan yang paling kuat, splitting terbesar, dan energy cahaya terserap yang paling tinggi. Penyelesaian: Kekuatan ligan field diurutkan CN->NH 3 >H 2 O. jadi nilai relatif dari dan energy cahaya yang terserap adalah Ti(CN) 6 3- >Ti(NH 3 ) 6 3+ >Ti(H 2 O) 6 3+
17 kompleks square planar, pengaruh dari ligan field di square planar mudah digambarkan. Yaitu dengan membayangkan octahedral geometri lalu menghilangkan dua ligan di sepanjang sumbu z. seperti pada figure tanpa sumbu z, energy orbital pada d z 2 berkurang begitu juga pada orbital yang lainnya. Sehingga bisa disimpulkan bahwa kompleks square planar adalah low spin. Tidak ada satupun model yang bisa memuaskan secara keseluruhan. Teori VB muncul menawarkan penggambaran mudah tentang informasi ikatan tetapi belum sampai menjelaskan terbentuknya warna. Crystal field model memprediksikan warna dan sifat magnetic secara bagus tapi belum mejelaskan tentang sifat kovalen alami ikatan logam-ligan. Saat ini, kimia menggunakan model lainnya, yaitu ligan field-molecular orbital theory. Yang merupakan gabungan dari dua model sebelumnya dengan teori MO. Sebagai tambahan tentang pentingnya aplikasi kimia, kompleks dari transisi punya peran penting dalam sistem kehidupan.
1.1 Senyawa Koordinasi (Coordination Coumpond)
 1.1 Senyawa Koordinasi (Coordination Coumpond) Sifat yang paling khas pada logam transisi adalah tentang persenyawaan dan ikatannya. Yang biasa disebut dengan ion kompleks. Ion kompleks sendiri terdiri
1.1 Senyawa Koordinasi (Coordination Coumpond) Sifat yang paling khas pada logam transisi adalah tentang persenyawaan dan ikatannya. Yang biasa disebut dengan ion kompleks. Ion kompleks sendiri terdiri
Senyawa Koordinasi. Ion kompleks memiliki ciri khas yaitu bilangan koordinasi, geometri, dan donor atom:
 Senyawa Koordinasi Terdiri dari atom pusat (kation logam transisi), ligan(molekul yang terikat pada ion kompleks) dan di netralkan dengan bilangan koordinasi. Dari gambar [Co(NH 3 )6]CI 3, 6 molekul NH3
Senyawa Koordinasi Terdiri dari atom pusat (kation logam transisi), ligan(molekul yang terikat pada ion kompleks) dan di netralkan dengan bilangan koordinasi. Dari gambar [Co(NH 3 )6]CI 3, 6 molekul NH3
Senyawa Koordinasi (senyawa kompleks)
 Senyawa Koordinasi (senyawa kompleks) Salah satu keistimewaan logam transisi adalah dapat membentuk senyawa klompeks, yaitu senyawa yang paling sedikit terdiri dari satu ion kompleks (terdiri dari kation
Senyawa Koordinasi (senyawa kompleks) Salah satu keistimewaan logam transisi adalah dapat membentuk senyawa klompeks, yaitu senyawa yang paling sedikit terdiri dari satu ion kompleks (terdiri dari kation
Senyawa Koordinasi. Kompleks ion dengan pusat d B memiliki empat ligan dengan dengan bentuk persegi planar (B)
 Senyawa Koordinasi Aspek umum dari logam transisi adalah pembentukan dari senyawa koordinasi (kompleks). Senyawa koordinasi ini setidaknya memiliki satu ion kompleks yang terdiri dari logam kation yang
Senyawa Koordinasi Aspek umum dari logam transisi adalah pembentukan dari senyawa koordinasi (kompleks). Senyawa koordinasi ini setidaknya memiliki satu ion kompleks yang terdiri dari logam kation yang
COORDINATION COMPOUND. Disusun oleh : Bintang Ayu Kalimantini NIM : KELAS D 10.30
 COORDINATION COMPOUND Disusun oleh : Bintang Ayu Kalimantini NIM : 21030112120019 KELAS D 10.30 S enyawa kompleks ditemukan sekitar tahun 1890an oleh Alfred Werner. Senyawa kompleks terdiri dari setidaknya
COORDINATION COMPOUND Disusun oleh : Bintang Ayu Kalimantini NIM : 21030112120019 KELAS D 10.30 S enyawa kompleks ditemukan sekitar tahun 1890an oleh Alfred Werner. Senyawa kompleks terdiri dari setidaknya
SENYAWA KOMPLEKS. Definisi. Ion Kompleks. Bilangan koordinasi, geometri, dan ligan RINGKASAN MATERI
 KIMIA ANORGANIK 14 OKTOBER 2012 RINGKASAN MATERI SENYAWA KOMPLEKS Definisi Senyawa kompleks itu: Ada ion logam sebagai atom pusat Ada ligan yang berupa anion atau molekul netral Memiliki counter ion supaya
KIMIA ANORGANIK 14 OKTOBER 2012 RINGKASAN MATERI SENYAWA KOMPLEKS Definisi Senyawa kompleks itu: Ada ion logam sebagai atom pusat Ada ligan yang berupa anion atau molekul netral Memiliki counter ion supaya
Bilangankoordinasi, bentukgeometri, danligandarisenyawakompleks
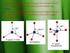 Senyawakoordinasi Senyawa koordinasi (coordination coumpounds) yang disebut juga kompleks adalah senyawa yang memiliki paling sedikit satu ion kompleks dengan kation sebagai pusat kompleks dan anion sebagailigan
Senyawakoordinasi Senyawa koordinasi (coordination coumpounds) yang disebut juga kompleks adalah senyawa yang memiliki paling sedikit satu ion kompleks dengan kation sebagai pusat kompleks dan anion sebagailigan
SENYAWA KOORDINASI Ion kompleks: Angka koordinasi, Geometri, dan Ligan
 SENYAWA KOORDINASI Keistimewaan dari ilmu kimia peralihan logam adalah rumus dari senyawa koordinasi (kompleks). Ada unsur yang berisi paling sedikit satu ion kompleks, yang terdiri dari satu atom pusat
SENYAWA KOORDINASI Keistimewaan dari ilmu kimia peralihan logam adalah rumus dari senyawa koordinasi (kompleks). Ada unsur yang berisi paling sedikit satu ion kompleks, yang terdiri dari satu atom pusat
Kimia Koordinasi SOAL LATIHAN. Jawab soal sudah tersedia. Selesaikan soalnya, dan pelajari mengapa dipilih jawaban tersebut
 Kimia Koordinasi SOAL LATIHAN Jawab soal sudah tersedia. Selesaikan soalnya, dan pelajari mengapa dipilih jawaban tersebut 1. Suatu logam nickel dapat ditulis sebagai [Ar] 4s 2 3d 8, manakah representasi
Kimia Koordinasi SOAL LATIHAN Jawab soal sudah tersedia. Selesaikan soalnya, dan pelajari mengapa dipilih jawaban tersebut 1. Suatu logam nickel dapat ditulis sebagai [Ar] 4s 2 3d 8, manakah representasi
8.4 Senyawa Kompleks
 8.4 Senyawa Kompleks Alfred Werner (1866-1919): kelompok baru senyawa logam transisi yang terdiri dari ion logam transisi (LT) yang dikelilingi oleh ion atau molekul yang lain. Ion atau molekul yang terikat
8.4 Senyawa Kompleks Alfred Werner (1866-1919): kelompok baru senyawa logam transisi yang terdiri dari ion logam transisi (LT) yang dikelilingi oleh ion atau molekul yang lain. Ion atau molekul yang terikat
SENYAWA KOORDINASI Putri Anjarsari, S.Si., M.Pd
 SENYAWA KOORDINASI Putri Anjarsari, S.Si., M.Pd putri_anjarsari@uny.ac.id Pengertian Senyawa Koordinasi Senyawa koordinasi adalah senyawa yang mengandung satu atau lebih ion kompleks dengan sejumlah kecil
SENYAWA KOORDINASI Putri Anjarsari, S.Si., M.Pd putri_anjarsari@uny.ac.id Pengertian Senyawa Koordinasi Senyawa koordinasi adalah senyawa yang mengandung satu atau lebih ion kompleks dengan sejumlah kecil
Bahasan. Senyawa Koordinasi. Bahasan. 1. Teori Werner tentang Senyawa Koordinasi : Tinjauan Ulang. Irwansyah, M.Si
 Bahasan Ion Kompleks dan 1 Teori Werner tentang Senyawa koordinasi : Tinjauan Ulang 2 Ligan 3 Tatanama 4 Isomerisasi 5 Ikatan dalam Ion Kompleks : Teori Medan Kristal 6 Sifat Magnet dan Teori Medan Kristal
Bahasan Ion Kompleks dan 1 Teori Werner tentang Senyawa koordinasi : Tinjauan Ulang 2 Ligan 3 Tatanama 4 Isomerisasi 5 Ikatan dalam Ion Kompleks : Teori Medan Kristal 6 Sifat Magnet dan Teori Medan Kristal
Kegiatan Belajar 4 Kimia Unsur. Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada materi Kimia Unsur.
 1 Kegiatan Belajar 4 Kimia Unsur Capaian Pembelajaran Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada materi Kimia Unsur. Subcapaian pembelajaran: 1. Menjelaskan sifat unsur golongan
1 Kegiatan Belajar 4 Kimia Unsur Capaian Pembelajaran Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada materi Kimia Unsur. Subcapaian pembelajaran: 1. Menjelaskan sifat unsur golongan
Bab 11 Senyawa Koordinasi
 Bab 11 http://chem.fmipa.ipb.ac.id Cisplatin (cis-pt(nh 3 ) 2 Cl 2 ) Cisplatin menghancurkan sel kanker untuk bereproduksi dengan mengubah konfigurasi DNAnya 1 Ikthisar Sumber: Chang Bab 20 1 Kimia Logam
Bab 11 http://chem.fmipa.ipb.ac.id Cisplatin (cis-pt(nh 3 ) 2 Cl 2 ) Cisplatin menghancurkan sel kanker untuk bereproduksi dengan mengubah konfigurasi DNAnya 1 Ikthisar Sumber: Chang Bab 20 1 Kimia Logam
Teori medan kristal adalah model yang hampir secara menyeluruh menggantikan teori ikatan valensi, pertama kali dimunculkan oleh Hans Bethe pada 1929.
 Teori Medan Kristal Teori medan kristal adalah model yang hampir secara menyeluruh menggantikan teori ikatan valensi, pertama kali dimunculkan oleh Hans Bethe pada 1929. Pada mulanya merupakan model yang
Teori Medan Kristal Teori medan kristal adalah model yang hampir secara menyeluruh menggantikan teori ikatan valensi, pertama kali dimunculkan oleh Hans Bethe pada 1929. Pada mulanya merupakan model yang
MODUL VI KIMIA KOORDINASI
 MODUL VI KIMIA KOORDINASI I. Petunjuk Umum 1. Kompetensi Dasar 1) Mahasiswa memahami definisi senyawa komplek 2) Mahasiswa memahami Teori Koordinasi Werner 3) Mahasiswa memahami jenis-jenis ligan 4) Mahasiswa
MODUL VI KIMIA KOORDINASI I. Petunjuk Umum 1. Kompetensi Dasar 1) Mahasiswa memahami definisi senyawa komplek 2) Mahasiswa memahami Teori Koordinasi Werner 3) Mahasiswa memahami jenis-jenis ligan 4) Mahasiswa
! " "! # $ % & ' % &
 Valensi ! " "! # $ % & ' %& # % ( ) # *+## )$,) & -#.. Semua unsur memiliki bilangan oksidasi +1 Semua unsur memiliki bilangan oksidasi +2 Semua unsur memiliki bilangan oksidasi +3. Tl juga memiliki bilangan
Valensi ! " "! # $ % & ' %& # % ( ) # *+## )$,) & -#.. Semua unsur memiliki bilangan oksidasi +1 Semua unsur memiliki bilangan oksidasi +2 Semua unsur memiliki bilangan oksidasi +3. Tl juga memiliki bilangan
Kimia Koordinasi Teori Ikatan Valensi
 Kimia Koordinasi Teori Ikatan Valensi Beberapa teori telah dirumuskan untuk menjelaskan ikatan dalam senyawaan koordinasi dan untuk merasionalisasi serta meramalkan sifat-sifatnya: teori ikatan valensi,
Kimia Koordinasi Teori Ikatan Valensi Beberapa teori telah dirumuskan untuk menjelaskan ikatan dalam senyawaan koordinasi dan untuk merasionalisasi serta meramalkan sifat-sifatnya: teori ikatan valensi,
I. PENDAHULUAN. Kualitas udara yang dipergunakan untuk kehidupan tergantung dari lingkungannya. Udara
 I. PENDAHULUAN 1.1 Latar Belakang Masalah Kualitas udara yang dipergunakan untuk kehidupan tergantung dari lingkungannya. Udara mengandung sejumlah oksigen, yang merupakan komponen esensial bagi kehidupan,
I. PENDAHULUAN 1.1 Latar Belakang Masalah Kualitas udara yang dipergunakan untuk kehidupan tergantung dari lingkungannya. Udara mengandung sejumlah oksigen, yang merupakan komponen esensial bagi kehidupan,
Ikatan Kimia. 2 Klasifikasi Ikatan Kimia :
 Ikatan Kimia Ikatan Kimia : Gaya tarik yang menyebabkan atom-atom yang terikat satu sama lain dalam suatu kombinasi untuk membentuk senyawa yang lebih kompleks. 2 Klasifikasi Ikatan Kimia : 1. Ikatan ion
Ikatan Kimia Ikatan Kimia : Gaya tarik yang menyebabkan atom-atom yang terikat satu sama lain dalam suatu kombinasi untuk membentuk senyawa yang lebih kompleks. 2 Klasifikasi Ikatan Kimia : 1. Ikatan ion
I. PENDAHULUAN. Pencemaran udara adalah masuknya, atau tercampurnya unsur-unsur berbahaya ke dalam
 I. PENDAHULUAN 1.1 Latar Belakang Masalah Pencemaran udara adalah masuknya, atau tercampurnya unsur-unsur berbahaya ke dalam atmosfir yang dapat mengakibatkan terjadinya kerusakan lingkungan, gangguan
I. PENDAHULUAN 1.1 Latar Belakang Masalah Pencemaran udara adalah masuknya, atau tercampurnya unsur-unsur berbahaya ke dalam atmosfir yang dapat mengakibatkan terjadinya kerusakan lingkungan, gangguan
kimia KONFIGURASI ELEKTRON
 K-13 Kelas X kimia KONFIGURASI ELEKTRON Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konfigurasi elektron kulit dan subkulit. 2. Menyelesaikan
K-13 Kelas X kimia KONFIGURASI ELEKTRON Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konfigurasi elektron kulit dan subkulit. 2. Menyelesaikan
Bentuk-Bentuk Molekul
 Bentuk-Bentuk Molekul Di bab ini, kita akan mempelajari bagaimana cara mengubah rumus molekul dari suatu senyawa menjadi sebuah rumus struktur senyawa dalam bentuk dua dimensi yang memperlihatkan hubungan
Bentuk-Bentuk Molekul Di bab ini, kita akan mempelajari bagaimana cara mengubah rumus molekul dari suatu senyawa menjadi sebuah rumus struktur senyawa dalam bentuk dua dimensi yang memperlihatkan hubungan
Persiapan UN 2018 KIMIA
 Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
Tabel Periodik. Bab 3a. Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr.
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Bab 3a Tabel Periodik Kapan unsur-unsur ditemukan? 8.1 1 ns 1 Konfigurasi elektron
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Bab 3a Tabel Periodik Kapan unsur-unsur ditemukan? 8.1 1 ns 1 Konfigurasi elektron
Ikatan Kimia. Ikatan kimia adalah gaya tarik antar atom yang pemutusan atau pembentukannya menyebabkan terjadinya perubahan kimia.
 Ikatan Kimia 1. Ikatan Kimia 1.1 Pengertian Ikatan kimia adalah gaya tarik antar atom yang pemutusan atau pembentukannya menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam Ikatan Kimia Ikatan Ion:
Ikatan Kimia 1. Ikatan Kimia 1.1 Pengertian Ikatan kimia adalah gaya tarik antar atom yang pemutusan atau pembentukannya menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam Ikatan Kimia Ikatan Ion:
LAPORAN LENGKAP PRAKTIKUM KIMIA ANORGANIK PERCOBAAN 3 PENENTUAN BILANGAN KOORDINAI KOMPLEKS TEMBAGA (II)
 LAPORAN LENGKAP PRAKTIKUM KIMIA ANORGANIK PERCOBAAN 3 PENENTUAN BILANGAN KOORDINAI KOMPLEKS TEMBAGA (II) OLEH : NAMA : IMENG NIM: ACC 109 011 KELOMPOK : 2 ( DUA ) HARI, TANGGAL : RABU, 8 JUNI 2011 ASISTEN
LAPORAN LENGKAP PRAKTIKUM KIMIA ANORGANIK PERCOBAAN 3 PENENTUAN BILANGAN KOORDINAI KOMPLEKS TEMBAGA (II) OLEH : NAMA : IMENG NIM: ACC 109 011 KELOMPOK : 2 ( DUA ) HARI, TANGGAL : RABU, 8 JUNI 2011 ASISTEN
BENTUK MOLEKUL STRUKTUR LEWIS UNTUK MOLEKUL DENGAN IKATAN TUNGGAL
 BENTUK MOLEKUL MELUKISKAN MOLEKUL DAN ION DENGAN STRUKTUR LEWIS Untuk menyusun struktur Lewis dari suatu atom atau unsur, dapat dilakukan dengan cara menuliskan simbol titik pada sekeliling atom yang menggambarkan
BENTUK MOLEKUL MELUKISKAN MOLEKUL DAN ION DENGAN STRUKTUR LEWIS Untuk menyusun struktur Lewis dari suatu atom atau unsur, dapat dilakukan dengan cara menuliskan simbol titik pada sekeliling atom yang menggambarkan
Bilangan Kuantum Utama (n)
 Bilangan Kuantum Utama (n) Menyatakan nomer kulit tempat elektron berada atau bilangan ini juga menyatakan ukuran orbital/ jarak/ jari-jari atom. Dinyatakan dengan bilangan bulat positif. Mempunyai dua
Bilangan Kuantum Utama (n) Menyatakan nomer kulit tempat elektron berada atau bilangan ini juga menyatakan ukuran orbital/ jarak/ jari-jari atom. Dinyatakan dengan bilangan bulat positif. Mempunyai dua
Aris Arianto. Guru Kimia di SMAN Madani Palu. STUDENT S BOOk
 STUDENT S BOOk Aris Arianto Guru Kimia di SMAN Madani Palu Website/blog penulis : Website : http://blendedlearningkimia.com Weblog : 1. http://www.arisarianto.web.id 2. http://arisarianto.wordpress.com
STUDENT S BOOk Aris Arianto Guru Kimia di SMAN Madani Palu Website/blog penulis : Website : http://blendedlearningkimia.com Weblog : 1. http://www.arisarianto.web.id 2. http://arisarianto.wordpress.com
Menggambarkan Molekul dan Ion dengan Struktur Lewis
 Menggambarkan Molekul dan Ion dengan Struktur Lewis Menggunakan Kaidah Oktet untuk Menggambar Struktur Lewis Untuk mencapai kestabilan seperti gas mulia, setiap atom berusaha memenuhi kaidah octet dengan
Menggambarkan Molekul dan Ion dengan Struktur Lewis Menggunakan Kaidah Oktet untuk Menggambar Struktur Lewis Untuk mencapai kestabilan seperti gas mulia, setiap atom berusaha memenuhi kaidah octet dengan
kimia REVIEW I TUJUAN PEMBELAJARAN
 KTSP kimia K e l a s XI REVIEW I TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami teori atom mekanika kuantum dan hubungannya dengan bilangan
KTSP kimia K e l a s XI REVIEW I TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami teori atom mekanika kuantum dan hubungannya dengan bilangan
LAPORAN PRAKTIKUM KIMIA ANORGANIK
 LAPORAN PRAKTIKUM KIMIA ANORGANIK Nama : Idatul Fitriyah NIM : 4301412036 Jurusan : Kimia Prodi : Pendidikan Kimia Dosen : Ella Kusumastuti Kelompok : 7 Tgl Praktikum : 21 Maret 2014 Kawan Kerja : 1. Izza
LAPORAN PRAKTIKUM KIMIA ANORGANIK Nama : Idatul Fitriyah NIM : 4301412036 Jurusan : Kimia Prodi : Pendidikan Kimia Dosen : Ella Kusumastuti Kelompok : 7 Tgl Praktikum : 21 Maret 2014 Kawan Kerja : 1. Izza
KIMIA. Sesi KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA. a. Sifat Umum
 KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 12 Sesi NGAN KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA Keteraturan sifat keperiodikan unsur dalam satu periode dapat diamati pada unsur-unsur periode
KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 12 Sesi NGAN KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA Keteraturan sifat keperiodikan unsur dalam satu periode dapat diamati pada unsur-unsur periode
Bentuk Molekul MELUKISKAN MOLEKUL DAN ION DENGAN STRUKTUR LEWIS
 Bentuk Molekul MELUKISKAN MOLEKUL DAN ION DENGAN STRUKTUR LEWIS Struktur Lewis adalah diagram yang menunjukkan ikatan-ikatan antar atom dalam suatu molekul. Struktur Lewis digunakan untuk menggambarkan
Bentuk Molekul MELUKISKAN MOLEKUL DAN ION DENGAN STRUKTUR LEWIS Struktur Lewis adalah diagram yang menunjukkan ikatan-ikatan antar atom dalam suatu molekul. Struktur Lewis digunakan untuk menggambarkan
~ gaya tarik antar atom yang pemutusan atau pembentukannya dapat menyebabkan terjadinya perubahan kimia.
 1. Ikatan Kimia Struktur Molekul 1.1 Pengertian ~ gaya tarik antar atom yang pemutusan atau pembentukannya dapat menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang
1. Ikatan Kimia Struktur Molekul 1.1 Pengertian ~ gaya tarik antar atom yang pemutusan atau pembentukannya dapat menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang
Peranan elektron dalam pembentukan ikatan kimia
 IKATAN KIMIA IKATAN KIMIA Gaya yang memegangi atom atau ion membentuk molekul atau kristal disebut Ikatan Kimia. Elektron memegang peran penting dalam pembentukan ikatan kimia. Peranan elektron dalam pembentukan
IKATAN KIMIA IKATAN KIMIA Gaya yang memegangi atom atau ion membentuk molekul atau kristal disebut Ikatan Kimia. Elektron memegang peran penting dalam pembentukan ikatan kimia. Peranan elektron dalam pembentukan
1. Ikatan Kimia. Struktur Molekul. 1.1 Pengertian. 1.2 Macam-Macam. ~ gaya tarik antar atom
 1. Ikatan Kimia 1.1 Pengertian ~ gaya tarik antar atom Struktur Molekul 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang terbentuk akibat tarik-menarik elektrostatik antara ion positif (kation) dan ion
1. Ikatan Kimia 1.1 Pengertian ~ gaya tarik antar atom Struktur Molekul 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang terbentuk akibat tarik-menarik elektrostatik antara ion positif (kation) dan ion
Menggambarkan Molekul dan Ion dengan struktur Lewis Menggunakan Aturan Oktet untuk Menuliskan Struktur Lewis
 2012 Menggambarkan Molekul dan Ion dengan struktur Lewis Untuk menggambarkan suatu molekul bisa dengan cara merubah rumus molekul menjadi struktur lewis dengan aturan oktet. Menggunakan Aturan Oktet untuk
2012 Menggambarkan Molekul dan Ion dengan struktur Lewis Untuk menggambarkan suatu molekul bisa dengan cara merubah rumus molekul menjadi struktur lewis dengan aturan oktet. Menggunakan Aturan Oktet untuk
Ringkasan BAB 10. Langkah-langkah penulisan struktur lewis untuk molekul dengan ikatan tunggal.
 Ringkasan BAB 10 1. Struktur lewis untuk molekul ikatan tunggal Langkah-langkah penulisan struktur lewis untuk molekul dengan ikatan tunggal. Langkah 1, tempatkan atom dari golongan yang lebih kecil ditengah
Ringkasan BAB 10 1. Struktur lewis untuk molekul ikatan tunggal Langkah-langkah penulisan struktur lewis untuk molekul dengan ikatan tunggal. Langkah 1, tempatkan atom dari golongan yang lebih kecil ditengah
LOGO ANALISIS KUALITATIF KATION DAN ANION
 LOGO ANALISIS KUALITATIF KATION DAN ANION By Djadjat Tisnadjaja 1 Jenis analisis Analisis makro Kuantitas zat 0,5 1 g Volume yang dipakai sekitar 20 ml Analisis semimikro Kuatitas zat sekitar 0,05 g Volume
LOGO ANALISIS KUALITATIF KATION DAN ANION By Djadjat Tisnadjaja 1 Jenis analisis Analisis makro Kuantitas zat 0,5 1 g Volume yang dipakai sekitar 20 ml Analisis semimikro Kuatitas zat sekitar 0,05 g Volume
Ikatan yang terjadi antara atom O dengan O membentuk molekul O 2
 Ikatan Kovalen adalah ikatan yang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan. Ikatan kovalen terjadi akibat ketidakmampuan salah 1 atom yang akan berikatan untuk
Ikatan Kovalen adalah ikatan yang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan. Ikatan kovalen terjadi akibat ketidakmampuan salah 1 atom yang akan berikatan untuk
BAB I PENDAHULUAN. A. Latar Belakang
 BAB I PEDAHULUA A. Latar Belakang Senyawa kovalen koordinasi terbentuk antara ion logam yang memiliki orbital d yang belum terisi penuh (umumnya ion logam transisi) dengan ligan yang memiliki pasangan
BAB I PEDAHULUA A. Latar Belakang Senyawa kovalen koordinasi terbentuk antara ion logam yang memiliki orbital d yang belum terisi penuh (umumnya ion logam transisi) dengan ligan yang memiliki pasangan
MODUL KIMIA SMA IPA Kelas 10
 SMA IPA Kelas Atom Bagian terkecil dari materi yang sudah tidak dapat dibagi lagi disebut atom (berasal dari bahasa Yunani atomos yang berarti tidak dapat dibagi lagi). Namun, berakhir pendapat tersebut
SMA IPA Kelas Atom Bagian terkecil dari materi yang sudah tidak dapat dibagi lagi disebut atom (berasal dari bahasa Yunani atomos yang berarti tidak dapat dibagi lagi). Namun, berakhir pendapat tersebut
Bab 10 Bentuk Bentuk Molekul
 Bab 10 Bentuk Bentuk Molekul 10.1 Menjelaskan Bentuk-Bentuk Molekul dan Ion Menurut Struktur Lewis Hal pertama yang dilakukan untuk mengetahui bentuk dari suatu molekul ialah dengan mengubah rumus suatu
Bab 10 Bentuk Bentuk Molekul 10.1 Menjelaskan Bentuk-Bentuk Molekul dan Ion Menurut Struktur Lewis Hal pertama yang dilakukan untuk mengetahui bentuk dari suatu molekul ialah dengan mengubah rumus suatu
Bentuk Molekul. Membuat struktur lewis menggunakan aturan octet, yaitu setiap atom mengisi kulit terluarnya dengan 8 elektron dan 2 untuk hydrogen.
 Bentuk Molekul Pada molekul, setiap atom, bonding pair, dan lone pair memiliki posisi masing masing yang ditentukan oleh gaya tarik menarik dan tolak menolak. Langkah pertama dalam memvisualisasikan bentuk
Bentuk Molekul Pada molekul, setiap atom, bonding pair, dan lone pair memiliki posisi masing masing yang ditentukan oleh gaya tarik menarik dan tolak menolak. Langkah pertama dalam memvisualisasikan bentuk
Bentuk-bentuk Molekul
 Bentuk-bentuk Molekul 10.1 Menggambar Ion dan Molekul Menggunakan Struktur Lewis Kita dapat menggunakan struktur lewis untuk melihat bagaimana bentuk molekul dari suatu senyawa kimia. Struktur ini disimbolkan
Bentuk-bentuk Molekul 10.1 Menggambar Ion dan Molekul Menggunakan Struktur Lewis Kita dapat menggunakan struktur lewis untuk melihat bagaimana bentuk molekul dari suatu senyawa kimia. Struktur ini disimbolkan
Kimia Koordinasi Pendahuluan
 Kimia Koordinasi Pendahuluan Senyawaan Koordinasi umumnya terdiri dari satu atom logam atau ion dan setidaknya satu ligand (atom, ion atau molekul) yang dapat dilihat sebagai donor elektron bagi logam
Kimia Koordinasi Pendahuluan Senyawaan Koordinasi umumnya terdiri dari satu atom logam atau ion dan setidaknya satu ligand (atom, ion atau molekul) yang dapat dilihat sebagai donor elektron bagi logam
JAWABAN. 8. Untuk obligasi tunggal antara sejenis atom, bagaimana kekuatan ikatan yang berhubungan dengan ukuran dari atom?jelaskan secara ilmiah.
 SOAL 1. Thomson mampu menentukan massa / rasio muatan elektron tetapi tidak massa. Bagaimana Percobaan Millikan memungkinkan penentuan massa elektron? 2. Bagaimana senyawa ion netral jika mereka terdiri
SOAL 1. Thomson mampu menentukan massa / rasio muatan elektron tetapi tidak massa. Bagaimana Percobaan Millikan memungkinkan penentuan massa elektron? 2. Bagaimana senyawa ion netral jika mereka terdiri
STRUKTUR MOLEKUL SEDERHANA
 STRUKTUR MOLEKUL SEDERHANA Oleh : Dr. Suyanta Ikatan ionik dibentuk oleh tarikan elekrostatik antara kation dan anion. Karena medan listrik suatu ion bersimetri bola, ikatan ion tidak memiliki karakter
STRUKTUR MOLEKUL SEDERHANA Oleh : Dr. Suyanta Ikatan ionik dibentuk oleh tarikan elekrostatik antara kation dan anion. Karena medan listrik suatu ion bersimetri bola, ikatan ion tidak memiliki karakter
BENTUK-BENTUK MOLEKUL
 BENTUK-BENTUK MOLEKUL 10. 1. Menggambarkan Molekul dan Ion dengan Struktur Lewis Berikut adalah langkah-langkah dalam menggambarkan molekul dengan ikatan tunggal menggunakan struktur Lewis: 1) Letakkan
BENTUK-BENTUK MOLEKUL 10. 1. Menggambarkan Molekul dan Ion dengan Struktur Lewis Berikut adalah langkah-langkah dalam menggambarkan molekul dengan ikatan tunggal menggunakan struktur Lewis: 1) Letakkan
kimia Kelas X REVIEW I K-13 A. Hakikat Ilmu Kimia
 K-13 Kelas X kimia REVIEW I Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami hakikat ilmu kimia dan metode ilmiah. 2. Memahami teori atom dan
K-13 Kelas X kimia REVIEW I Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami hakikat ilmu kimia dan metode ilmiah. 2. Memahami teori atom dan
Bentuk Molekul. Langkah pertama menggambarkan molekulnya adalah dengan mengubah rumus molekul menjadi stuktur lewis molekulnya.
 Bentuk Molekul Langkah pertama menggambarkan molekulnya adalah dengan mengubah rumus molekul menjadi stuktur lewis molekulnya. 1. Menggunakan aturan oktet untuk menggambarkan struktur lewis a. Struktur
Bentuk Molekul Langkah pertama menggambarkan molekulnya adalah dengan mengubah rumus molekul menjadi stuktur lewis molekulnya. 1. Menggunakan aturan oktet untuk menggambarkan struktur lewis a. Struktur
Rangkuman Kimia Anorganik Materi Struktur Lewis dan Bentuk Molekul
 Rangkuman Kimia Anorganik Materi Struktur Lewis dan Bentuk Molekul BAB 10 Nama :Rizky Ardias D NIM :21030112140170 Kelas :B Struktur Lewis dan Bentuk Molekul Pertama-tama kita melihat bagaimana untuk mengubah
Rangkuman Kimia Anorganik Materi Struktur Lewis dan Bentuk Molekul BAB 10 Nama :Rizky Ardias D NIM :21030112140170 Kelas :B Struktur Lewis dan Bentuk Molekul Pertama-tama kita melihat bagaimana untuk mengubah
BENTUK MOLEKUL CITRAWATI NUGRAHENI MINASTI Struktur Lewis dan Teori VSEPR. disusun oleh :
 BENTUK MOLEKUL Struktur Lewis dan Teori VSEPR disusun oleh : CITRAWATI NUGRAHENI MINASTI 21030112130045 TEKNIK KIMIA UNIVERSITAS DIPONEGORO 2012/2013 STRUKTUR LEWIS dan BENTUK MOLEKUL 10.1 Menggambarkan
BENTUK MOLEKUL Struktur Lewis dan Teori VSEPR disusun oleh : CITRAWATI NUGRAHENI MINASTI 21030112130045 TEKNIK KIMIA UNIVERSITAS DIPONEGORO 2012/2013 STRUKTUR LEWIS dan BENTUK MOLEKUL 10.1 Menggambarkan
TUJUAN INSTRUKSIONAL KHUSUS
 ISI BAB I 1. Pendahuluan 2. Struktur Atom 3. Elektronegativitas 4. Ikatan Ionik 5. Ikatan Kovalen 6. Struktur Lewis 7. Polaritas Ikatan 8. Sifat-Sifat Senyawa Kovalen TUJUAN INSTRUKSIONAL KHUSUS Setelah
ISI BAB I 1. Pendahuluan 2. Struktur Atom 3. Elektronegativitas 4. Ikatan Ionik 5. Ikatan Kovalen 6. Struktur Lewis 7. Polaritas Ikatan 8. Sifat-Sifat Senyawa Kovalen TUJUAN INSTRUKSIONAL KHUSUS Setelah
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB I STRUKTUR ATOM
 BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB I 1. Suatu partikel X memiliki 16 proton, 16 neutron, dan 18 elektron. Partikel tersebut dapat dikategorikan sebagai A. Anion X bermuatan -1
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB I 1. Suatu partikel X memiliki 16 proton, 16 neutron, dan 18 elektron. Partikel tersebut dapat dikategorikan sebagai A. Anion X bermuatan -1
Mekanika Kuantum. Orbital dan Bilangan Kuantum
 Standar Kompetensi Kompetensi Dasar Mendeskripsikan struktur atom dan sifat-sifat periodik serta struktur molekul dan sifat-sifatnya. Menerapkan teori atom mekanika kuantum untuk menuliskan konfigurasi
Standar Kompetensi Kompetensi Dasar Mendeskripsikan struktur atom dan sifat-sifat periodik serta struktur molekul dan sifat-sifatnya. Menerapkan teori atom mekanika kuantum untuk menuliskan konfigurasi
π, maka pengertian stereoisomer Stereoisomer konfigurasi.
 BAB III STEREOKIMIA Pendahuluan Struktur cis dan trans butena Perbedaan cis dan trans dalam struktur butena disebabkan karena perbedaan letak gugus metil dalam ruang kenyataan ini diajukan konsep stereoisomer.
BAB III STEREOKIMIA Pendahuluan Struktur cis dan trans butena Perbedaan cis dan trans dalam struktur butena disebabkan karena perbedaan letak gugus metil dalam ruang kenyataan ini diajukan konsep stereoisomer.
BAB 3 GEOMETRI DAN KEPOLARAN MOLEKUL
 GEOMETRI DAN KEPOLARAN MOLEKUL 3.1 PENGANTAR MENGENAI BENTUK MOLEKUL Bentuk molekul mengontrol sifat-sifat fisik maupun kimia molekul. Geometri elektron dan bentuk molekul ditentukan oleh orientasi semua
GEOMETRI DAN KEPOLARAN MOLEKUL 3.1 PENGANTAR MENGENAI BENTUK MOLEKUL Bentuk molekul mengontrol sifat-sifat fisik maupun kimia molekul. Geometri elektron dan bentuk molekul ditentukan oleh orientasi semua
Ikatan kovalen koordinat adalah ikatan dimana elektronelektron yang dipakai bersama-sama hanya berasal dari satu atom.
 IKATAN KIMIA 1. Pada molekul CH 4 terdapat ikatan kovalen SEBAB paa tiap molekul CH 4 terdapat 4 atom hidrogen SMU/Ebtanas/Kimia/Tahun 1988 Ikatan Kovalen adalah ikatan kimia yang terjadi karena penggunaan
IKATAN KIMIA 1. Pada molekul CH 4 terdapat ikatan kovalen SEBAB paa tiap molekul CH 4 terdapat 4 atom hidrogen SMU/Ebtanas/Kimia/Tahun 1988 Ikatan Kovalen adalah ikatan kimia yang terjadi karena penggunaan
Contoh untuk NF 3 F berasal dari golongan VII A, dengan EN 4.0. Maka N sebagai atom pusat
 STRUKTUR LEWIS UNTUK MOLEKUL DAN ION Struktur Lewis merupakan langkah awal untuk menentukan bentuk molekul. Struktur Lewis terdiri dari titiktitik yang menggambarkan valensi electron tiap atom yang saling
STRUKTUR LEWIS UNTUK MOLEKUL DAN ION Struktur Lewis merupakan langkah awal untuk menentukan bentuk molekul. Struktur Lewis terdiri dari titiktitik yang menggambarkan valensi electron tiap atom yang saling
TUGAS KIMIA UMUM C (kelompok jadual kuliah Kamis Pagi jam 08.00) 1. The radii of the sodium and potassium ions are 102 pm and 138 pm, respectively.
 TUGAS KIMIA UMUM C (kelompok jadual kuliah Kamis Pagi jam 08.00) 1. The radii of the sodium and potassium ions are 102 pm and 138 pm, respectively. Which compound has stronger ionic attractions, sodium
TUGAS KIMIA UMUM C (kelompok jadual kuliah Kamis Pagi jam 08.00) 1. The radii of the sodium and potassium ions are 102 pm and 138 pm, respectively. Which compound has stronger ionic attractions, sodium
Bentuk Molekul. Menggambarkan molekul dan ion dengan struktu lewis
 Bentuk Molekul Menggambarkan molekul dan ion dengan struktu lewis Langkah pertama menggambarkan seperti apa molekul kelihatannya adalah dengan mengonversi rumus molekul menjadi struktur lewis (atau rumus
Bentuk Molekul Menggambarkan molekul dan ion dengan struktu lewis Langkah pertama menggambarkan seperti apa molekul kelihatannya adalah dengan mengonversi rumus molekul menjadi struktur lewis (atau rumus
KIMIA ANORGANIK BAB 10. STRUKTUR LEWIS dan BENTUK-BENTUK MOLEKUL. Disusun Oleh : Faizal Romadhon NIM : TEKNIK KIMIA
 KIMIA ANORGANIK BAB 10 STRUKTUR LEWIS dan BENTUK-BENTUK MOLEKUL Disusun Oleh : Nama : Faizal Romadhon NIM : 2103012130072 Kelas : Kelas C TEKNIK KIMIA UNIVERSITAS DIPONEGORO SEMARANG 2012 STRUKTUR LEWIS
KIMIA ANORGANIK BAB 10 STRUKTUR LEWIS dan BENTUK-BENTUK MOLEKUL Disusun Oleh : Nama : Faizal Romadhon NIM : 2103012130072 Kelas : Kelas C TEKNIK KIMIA UNIVERSITAS DIPONEGORO SEMARANG 2012 STRUKTUR LEWIS
OLIMPIADE NASIONAL MATEMATIKA DAN ILMU PENGETAHUAN ALAM TINGKAT PERGURUAN TINGGI (ONMIPA-PT) Bidang Kimia Sub bidang Kimia Anorganik
 OLIMPIADE NASIONAL MATEMATIKA DAN ILMU PENGETAHUAN ALAM TINGKAT PERGURUAN TINGGI (ONMIPA-PT) 2017 Bidang Kimia Sub bidang Kimia Anorganik 16 Mei 2017 Waktu : 120 menit Petunjuk Pengerjaan 1. Tes ini berlangsung
OLIMPIADE NASIONAL MATEMATIKA DAN ILMU PENGETAHUAN ALAM TINGKAT PERGURUAN TINGGI (ONMIPA-PT) 2017 Bidang Kimia Sub bidang Kimia Anorganik 16 Mei 2017 Waktu : 120 menit Petunjuk Pengerjaan 1. Tes ini berlangsung
BAHAN AJAR KIMIA KONFIGURASI ELEKTRON DAN BILANGAN KUANTUM
 BAHAN AJAR KIMIA KONFIGURASI ELEKTRON DAN BILANGAN KUANTUM CHEMISTRY IS FUN Oleh : Hana Nazelia AfrianI 1 Konfigurasi Elektron dan Bilangan KONFIGURASI ELEKTRON Konfigurasi elektron adalah susunan elektron
BAHAN AJAR KIMIA KONFIGURASI ELEKTRON DAN BILANGAN KUANTUM CHEMISTRY IS FUN Oleh : Hana Nazelia AfrianI 1 Konfigurasi Elektron dan Bilangan KONFIGURASI ELEKTRON Konfigurasi elektron adalah susunan elektron
KIMIA ANORGANIK ( Dr. Istadi )
 KIMIA ANORGANIK ( Dr. Istadi ) BENTUK MOLEKUL DAN STRUKTUR LEWIS O l e h : Muqsit Bramantiya NIM. 21030112140142 JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO SEMARANG 2012 I. Menggambarkan
KIMIA ANORGANIK ( Dr. Istadi ) BENTUK MOLEKUL DAN STRUKTUR LEWIS O l e h : Muqsit Bramantiya NIM. 21030112140142 JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO SEMARANG 2012 I. Menggambarkan
Ikatan kimia. 1. Peranan Elektron dalam Pembentukan Ikatan Kimia. Ikatan kimia
 Ikatan kimia 1. Peranan Elektron dalam Pembentukan Ikatan Kimia Ikatan kimia Gaya tarik menarik antara atom sehingga atom tersebut tetap berada bersama-sama dan terkombinasi dalam senyawaan. gol 8 A sangat
Ikatan kimia 1. Peranan Elektron dalam Pembentukan Ikatan Kimia Ikatan kimia Gaya tarik menarik antara atom sehingga atom tersebut tetap berada bersama-sama dan terkombinasi dalam senyawaan. gol 8 A sangat
kimia Kelas X TABEL PERIODIK K-13
 K-13 Kelas X kimia TABEL PERIODIK Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami perkembangan sistem periodik unsur dan kelemahannya. 2. Menentukan
K-13 Kelas X kimia TABEL PERIODIK Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami perkembangan sistem periodik unsur dan kelemahannya. 2. Menentukan
SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016)
 SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016) Bagian I: Pilihan Ganda 1) Suatu atom yang mempunyai energi ionisasi pertama bernilai besar, memiliki sifat/kecenderungan : A. Afinitas elektron rendah
SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016) Bagian I: Pilihan Ganda 1) Suatu atom yang mempunyai energi ionisasi pertama bernilai besar, memiliki sifat/kecenderungan : A. Afinitas elektron rendah
Penyelesaian Tugas Kuliah Kimia Umum C (Soal bagi kelompok jadwal kuliah Kamis pagi pukul 08.00)
 Penyelesaian Tugas Kuliah Kimia Umum C (Soal bagi kelompok jadwal kuliah Kamis pagi pukul 08.00) Nama : Archemi Puspita Wijaya NIM : L2C007010 Alamat blog : archemipuspita.wordpress.com 1. Jari-jari ion
Penyelesaian Tugas Kuliah Kimia Umum C (Soal bagi kelompok jadwal kuliah Kamis pagi pukul 08.00) Nama : Archemi Puspita Wijaya NIM : L2C007010 Alamat blog : archemipuspita.wordpress.com 1. Jari-jari ion
IKATAN KIMIA. RATNAWATI, S.Pd
 IKATAN KIMIA RATNAWATI, S.Pd Tujuan Pembelajaran Setelah mempelajari materi ini, diharapkan siswa dapat: Menjelaskan kecenderungan suatu unsur untuk mencapai kestabilannya Menggambarkan susunan elektron
IKATAN KIMIA RATNAWATI, S.Pd Tujuan Pembelajaran Setelah mempelajari materi ini, diharapkan siswa dapat: Menjelaskan kecenderungan suatu unsur untuk mencapai kestabilannya Menggambarkan susunan elektron
RANGKUMAN BAB 10: BENTUK-BENTUK MOLEKUL
 14 Oktober 2012 TUGAS KIMIA ANORGANIK RANGKUMAN BAB 10: BENTUK-BENTUK MOLEKUL Dosen Pengampu: Dr. Istadi Teknik Kimia Universitas Diponegoro 2012 Intan Medinah (21030112130081) BAB 10 BENTUK-BENTUK MOLEKUL
14 Oktober 2012 TUGAS KIMIA ANORGANIK RANGKUMAN BAB 10: BENTUK-BENTUK MOLEKUL Dosen Pengampu: Dr. Istadi Teknik Kimia Universitas Diponegoro 2012 Intan Medinah (21030112130081) BAB 10 BENTUK-BENTUK MOLEKUL
TITRASI PEMBENTUKAN KOMPLEKS. Drs. DJADJAT TISNADJAJA, M.Tech.
 TITRASI PEMBENTUKAN KOMPLEKS Drs. DJADJAT TISNADJAJA, M.Tech. 1 Pendahuluan Salah satu tipe reaksi kimia yang berlaku sebagai dasar penentuan titrimetrik melibatkan pembentukan kompleks atau ion kompleks
TITRASI PEMBENTUKAN KOMPLEKS Drs. DJADJAT TISNADJAJA, M.Tech. 1 Pendahuluan Salah satu tipe reaksi kimia yang berlaku sebagai dasar penentuan titrimetrik melibatkan pembentukan kompleks atau ion kompleks
STRUKTUR LEWIS DAN BENTUK MOLEKUL (BAB 10)
 TUGAS RESUME STRUKTUR LEWIS DAN BENTUK MOLEKUL (BAB 10) Di susun oleh : Usya Rahmatika (21030112120015) Kelas B FAKULTAS TEKNIK JURUSAN TEKNIK KIMIA UNIVERSITAS DIPONEGORO SEMARANG 10.1 MENGGAMBARKAN BENTUK
TUGAS RESUME STRUKTUR LEWIS DAN BENTUK MOLEKUL (BAB 10) Di susun oleh : Usya Rahmatika (21030112120015) Kelas B FAKULTAS TEKNIK JURUSAN TEKNIK KIMIA UNIVERSITAS DIPONEGORO SEMARANG 10.1 MENGGAMBARKAN BENTUK
TEKNIK KIMIA UNIVERSITAS DIPONEGORO BENTUK MOLEKUL KIMIA UMUM EKO NOVIARIYONO
 TEKNIK KIMIA UNIVERSITAS DIPONEGORO BENTUK MOLEKUL KIMIA UMUM EKO NOVIARIYONO 21030112120 BENTUK MOLEKUL 10.1 Menggambarkan Molekul dan Ion Dengan Struktur Lewis Untuk menggambarkan bentuk molekul, pertama
TEKNIK KIMIA UNIVERSITAS DIPONEGORO BENTUK MOLEKUL KIMIA UMUM EKO NOVIARIYONO 21030112120 BENTUK MOLEKUL 10.1 Menggambarkan Molekul dan Ion Dengan Struktur Lewis Untuk menggambarkan bentuk molekul, pertama
1) Menggambarkan Molekul dan Ion Menggunakan Struktur Lewis
 1) Menggambarkan Molekul dan Ion Menggunakan Struktur Lewis Langkah pertama yang dilakukan untuk menggambarkan struktur suatu molekul adalah dengan mengkonversikan rumus molekulnya ke dalam struktur Lewis
1) Menggambarkan Molekul dan Ion Menggunakan Struktur Lewis Langkah pertama yang dilakukan untuk menggambarkan struktur suatu molekul adalah dengan mengkonversikan rumus molekulnya ke dalam struktur Lewis
KONSEP IKATAN KIMIA 1. ELEKTRONEGATIVITAS 2. IKATAN IONIK 3. STRUKTUR MOLEKUL TERISOLASI: SIFAT IKATAN KIMIA KOVALEN 4.
 Sumber: http://ebookbrowse.com KONSEP IKATAN KIMIA 1. ELEKTRONEGATIVITAS 2. IKATAN IONIK 3. STRUKTUR MOLEKUL TERISOLASI: SIFAT IKATAN KIMIA KOVALEN 4. IKATAN KOVALEN 5. IKATAN KOVALEN POLAR 6. MUATAN FORMAL
Sumber: http://ebookbrowse.com KONSEP IKATAN KIMIA 1. ELEKTRONEGATIVITAS 2. IKATAN IONIK 3. STRUKTUR MOLEKUL TERISOLASI: SIFAT IKATAN KIMIA KOVALEN 4. IKATAN KOVALEN 5. IKATAN KOVALEN POLAR 6. MUATAN FORMAL
RINGKASAN Kimia Anorganik
 RINGKASAN Kimia Anorganik Materi: BAB 10 - BENTUK-BENTUK MOLEKUL Pengampu: Dr. Istadi, ST., MT. Disusun oleh: Nama : Bramantya Brian Suwignjo NIM : 21030112140169 Jurusan : S-1 Teknik Kimia (Kelas B) Hari
RINGKASAN Kimia Anorganik Materi: BAB 10 - BENTUK-BENTUK MOLEKUL Pengampu: Dr. Istadi, ST., MT. Disusun oleh: Nama : Bramantya Brian Suwignjo NIM : 21030112140169 Jurusan : S-1 Teknik Kimia (Kelas B) Hari
Bentuk-bentuk molekul
 Bentuk-bentuk molekul Menggambarkan molekul dengan struktur lewis Biasanya elektron disimbolkan dengan titik yang menggambarkan setiap atomnya, dan pasangan yang berikatan digambar menjadi satu, biasanya
Bentuk-bentuk molekul Menggambarkan molekul dengan struktur lewis Biasanya elektron disimbolkan dengan titik yang menggambarkan setiap atomnya, dan pasangan yang berikatan digambar menjadi satu, biasanya
(2) kekuatan ikatan yang dibentuk untuk karbon;
 Reaksi Subsitusi Nukleofilik Alifatik Reaksi yang berlangsung karena penggantian satu atau lebih atom atau gugus dari suatu senyawa oleh atom atau gugus lain disebut reaksi substitusi. Bila reaksi substitusi
Reaksi Subsitusi Nukleofilik Alifatik Reaksi yang berlangsung karena penggantian satu atau lebih atom atau gugus dari suatu senyawa oleh atom atau gugus lain disebut reaksi substitusi. Bila reaksi substitusi
TITRASI KOMPLEKSOMETRI
 TITRASI KOMPLEKSOMETRI I. TUJUAN a. Menstandarisasi EDTA dengan larutan ZnSO 4 b. Menentukan konsentrasi larutan Ni 2+ c. Memahami prinsip titrasi kompleksometri II. TEORI Titrasi kompleksometri adalah
TITRASI KOMPLEKSOMETRI I. TUJUAN a. Menstandarisasi EDTA dengan larutan ZnSO 4 b. Menentukan konsentrasi larutan Ni 2+ c. Memahami prinsip titrasi kompleksometri II. TEORI Titrasi kompleksometri adalah
2. Konfigurasi elektron dua buah unsur tidak sebenarnya:
 . Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
. Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
Disusun Oeh: Fanji Satria JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO SEMARANG
 Disusun Oeh: Fanji Satria 21030112140051 JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO SEMARANG Menggambarkan Molekul dan Ion dengan Struktur Lewis Penyusunan struktur Lewis dari suatu atom
Disusun Oeh: Fanji Satria 21030112140051 JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO SEMARANG Menggambarkan Molekul dan Ion dengan Struktur Lewis Penyusunan struktur Lewis dari suatu atom
BAB 10. Strukturr Lewis dan Bentuk Molekul
 BAB 10 Strukturr Lewis dan Bentuk Molekul Disusun Oleh : DHANY MIRNASARI (21030112120012) Dosen Pengampu : DR. ISTADI JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO SEMARANG 2012-2013 10.1
BAB 10 Strukturr Lewis dan Bentuk Molekul Disusun Oleh : DHANY MIRNASARI (21030112120012) Dosen Pengampu : DR. ISTADI JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO SEMARANG 2012-2013 10.1
Pembuatan Garam Kompleks dan Garam Rangkap.
 A. JUDUL PERCOBAAN Pembuatan Garam Kompleks dan Garam Rangkap. B. TUJUAN PERCOBAAN Mahasiswa diharapkan mampu mempelajari pembuatan dan sifat-sifat garam rangkap kupri ammonium sulfat dan garam kompleks
A. JUDUL PERCOBAAN Pembuatan Garam Kompleks dan Garam Rangkap. B. TUJUAN PERCOBAAN Mahasiswa diharapkan mampu mempelajari pembuatan dan sifat-sifat garam rangkap kupri ammonium sulfat dan garam kompleks
Bab V Ikatan Kimia. B. Struktur Lewis Antar unsur saling berinteraksi dengan menerima dan melepaskan elektron di kulit terluarnya. Gambaran terjadinya
 Bab V Ikatan Kimia Sebagian besar unsur yang ada di alam mempunyai kecenderungan untuk berinteraksi (berikatan) dengan unsur lain. Hal itu dilakukan karena unsur tersebut ingin mencapai kestabilan. Cara
Bab V Ikatan Kimia Sebagian besar unsur yang ada di alam mempunyai kecenderungan untuk berinteraksi (berikatan) dengan unsur lain. Hal itu dilakukan karena unsur tersebut ingin mencapai kestabilan. Cara
C. Reaksi oksidasi reduksi berdasarkan peningkatan dan penurunan bilangan oksidasi. Bilangan Oksidasi (biloks)
 97 Nama : Kelompok : Mata Pelajaran : Kimia Kelas/Semester : X 5 /2 Alokasi Waktu : 2 x 45 menit. Materi pokok : Konsep Redoks Standar Kompetensi : 3. Memahami sifat-sifat larutan elektrolit dan non elektrolit
97 Nama : Kelompok : Mata Pelajaran : Kimia Kelas/Semester : X 5 /2 Alokasi Waktu : 2 x 45 menit. Materi pokok : Konsep Redoks Standar Kompetensi : 3. Memahami sifat-sifat larutan elektrolit dan non elektrolit
Berikut adalah beberapa langkah dalam menggambarkan struktur Lewis untuk molekul dengan ikatan tunggal. Kita ambil contoh NF 3.
 Dalam BAB ini kita akan mengubah susunan suatu zat ke bentuk dua dimensi untuk melihat ikatan yang terjadi di suatu molekul, kita dapat merubah suatu bentuk molekul dua dimensi menjadi tiga dimensi. Kita
Dalam BAB ini kita akan mengubah susunan suatu zat ke bentuk dua dimensi untuk melihat ikatan yang terjadi di suatu molekul, kita dapat merubah suatu bentuk molekul dua dimensi menjadi tiga dimensi. Kita
LATIHAN SOAL IKATAN KIMIA
 LATIHAN SAL IKATAN KIMIA 1. Cara untuk mendapatkan kestabilan atom unsur yang bernomor atom 8 adalah dengan a. Melepaskan enam elektron muatan +6 b. Mengikat dua elektron dari atom lain menjadi ion dengan
LATIHAN SAL IKATAN KIMIA 1. Cara untuk mendapatkan kestabilan atom unsur yang bernomor atom 8 adalah dengan a. Melepaskan enam elektron muatan +6 b. Mengikat dua elektron dari atom lain menjadi ion dengan
Laporan Praktikum Analisis Kualitatif Anion
 Laporan Praktikum Analisis Kualitatif Anion I. Tujuan Tujuan dari praktikum ini adalah untuk memahami prinsip-prinsip dasar yang melatarbelakangi prosedur pemisahan anion serta mengidentifikasi jenis anion
Laporan Praktikum Analisis Kualitatif Anion I. Tujuan Tujuan dari praktikum ini adalah untuk memahami prinsip-prinsip dasar yang melatarbelakangi prosedur pemisahan anion serta mengidentifikasi jenis anion
Ikatan Kimia II: VSEPR dan prediksi geometri Molekular, teori ikatan valensi dan Hibridisasi Orbital Atom; teori orbital atom
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Chapter 3c Ikatan Kimia II: VSEPR dan prediksi geometri Molekular, teori ikatan
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Chapter 3c Ikatan Kimia II: VSEPR dan prediksi geometri Molekular, teori ikatan
Elektron maksimal: 2(3 2 ) = Elektron maksimal: 2(4 2 ) = 32 elektron = elektron terakhir: 2 golongan II A 10 sisa 10
 Struktur Atom Isotop: atom/ion yang memiliki jumlah proton (no atom) yang sama. Contoh: 17 Cl dan 17 Cl Isoton: atom/ion yang memiliki jumlah neutron (no massa-no atom) yang sama. Contoh: 14 6C dan 16
Struktur Atom Isotop: atom/ion yang memiliki jumlah proton (no atom) yang sama. Contoh: 17 Cl dan 17 Cl Isoton: atom/ion yang memiliki jumlah neutron (no massa-no atom) yang sama. Contoh: 14 6C dan 16
I. PENDAHULUAN. senyawa kompleks bersifat sebgai asam Lewis sedangkan ligan dalam senyawa
 I. PENDAHULUAN A. Latar Belakang Senyawa kompleks merupakan senyawa yang memiliki warna yang khas yang diakibatkan oleh adanya unsur yang dari golongan transisi yang biasanya berperperan sebagai atom pusat
I. PENDAHULUAN A. Latar Belakang Senyawa kompleks merupakan senyawa yang memiliki warna yang khas yang diakibatkan oleh adanya unsur yang dari golongan transisi yang biasanya berperperan sebagai atom pusat
LOGO ANALISIS KUALITATIF KATION DAN ANION
 LOGO ANALISIS KUALITATIF KATION DAN ANION BY : Djadjat Tisnadjaja Golongan ketiga Besi (II) dan (III), Alumunium, Kromium (III) dan (VI), nikel, kobalt, Mangan (II) dan (VII) serta Zink Djadjat Tisnadjaja,
LOGO ANALISIS KUALITATIF KATION DAN ANION BY : Djadjat Tisnadjaja Golongan ketiga Besi (II) dan (III), Alumunium, Kromium (III) dan (VI), nikel, kobalt, Mangan (II) dan (VII) serta Zink Djadjat Tisnadjaja,
KEGIATAN BELAJAR 3 IKATAN KIMIA. 1. Menguasai tentang jenis-jenis ikatan kimia dan proses pembentukannya
 KEGIATAN BELAJAR 3 IKATAN KIMIA A. APAIAN PEMBELAJARAN 1. Menguasai tentang jenis-jenis ikatan kimia dan proses pembentukannya. Menggambarkan struktur Lewis 3. Menguasai teori ikatan kimia dan aplikasinya
KEGIATAN BELAJAR 3 IKATAN KIMIA A. APAIAN PEMBELAJARAN 1. Menguasai tentang jenis-jenis ikatan kimia dan proses pembentukannya. Menggambarkan struktur Lewis 3. Menguasai teori ikatan kimia dan aplikasinya
ELEKTROKIMIA Reaksi Reduksi - Oksidasi
 Jurusan Kimia - FMIPA Universitas Gadjah Mada (UGM) ELEKTROKIMIA Reaksi Reduksi - Oksidasi Drs. Iqmal Tahir, M.Si. Laboratorium Kimia Fisika,, Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam
Jurusan Kimia - FMIPA Universitas Gadjah Mada (UGM) ELEKTROKIMIA Reaksi Reduksi - Oksidasi Drs. Iqmal Tahir, M.Si. Laboratorium Kimia Fisika,, Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam
TUGAS KIMIA ANORGANIK TEORI IKATAN VALENSI DAN HIBRIDISASI ORBITAL
 TUGAS KIMIA ANORGANIK TEORI IKATAN VALENSI DAN HIBRIDISASI ORBITAL ESTER ALNINTA BASA SIAGIAN (21030116140082) JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK SEMARANG 2016 A. DASAR TEORI IKATAN VALENSI Ikatan valensi
TUGAS KIMIA ANORGANIK TEORI IKATAN VALENSI DAN HIBRIDISASI ORBITAL ESTER ALNINTA BASA SIAGIAN (21030116140082) JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK SEMARANG 2016 A. DASAR TEORI IKATAN VALENSI Ikatan valensi
Elektrokimia. Tim Kimia FTP
 Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis ini merupakan
Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis ini merupakan
