LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI. PT. Mutiara Mukti Farma (MUTIFA) Medan
|
|
|
- Sucianty Hermanto
- 6 tahun lalu
- Tontonan:
Transkripsi
1 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Mutiara Mukti Farma (MUTIFA) Medan Disusun oleh: Sri Mady Astuti, S. Farm FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2009
2 KATA PENGANTAR Puji syukur kehadirat Tuhan yang Maha Esa Atas limpahan rahmat dan karunia-nya sehingga penulis dapat menyelesaikan Praktek Kerja Profesi (PKP) di Industri Farmasi PT. Mutiara Mukti Farma (MUTIFA) Medan dan penyusunan laporan ini. Pada kesempatan ini, penulis menyampaikan terimakasih yang sebesarbesarnya kepada: 1. Bapak Jacob selaku Direktur Utama PT. MUTIFA Medan yang telah berkenan memberikan fasilitas kepada penulis untuk melaksanakan Praktek Kerja Profesi (PKP). 2. Bapak Drs. D.R. Nainggolan, Apt., selaku manager Research dan Development (R & D) PT. MUTIFA Medan yang telah memberikan fasilitas, membimbing dan mengarahkan penulis selama melaksanakan Praktek Kerja Profesi (PKP) ini. 3. Ibu Betty, S.Si, Apt., selaku manager Quality Assurance (QA) yang telah membimbing dan mengarahkan penulis selama melaksanakan Praktek Kerja Profesi (PKP) ini. 4. Bapak Donald Situmorang, S.Si, Apt., selaku manager produksi Beta Laktam, dan Bapak Drs. Budiono, Apt., selaku manager produksi non Beta Laktam yang telah membimbing dan mengarahkan penulis selama melaksanakan Praktek Kerja Profesi (PKP) ini.
3 5. Ibu Dra. Rita Puspita, Apt., selaku manager Quality Control (QC) yang telah membimbing dan mengarahkan penulis selama melaksanakan Praktek Kerja Profesi (PKP) ini. 6. Bapak Arif Nasution, ST., selaku manager teknik yang telah membimbing dan mengarahkan penulis selama melaksanakan Praktek Kerja Profesi (PKP) ini 7. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi Universitas Sumatera Utara. 8. Bapak Drs. Wiryanto, M. S, Apt., selaku ketua program studi Program Pendidikan Profesi Apoteker Fakultas Farmasi Universitas Sumatera Utara. 9. Seluruh staf dan karyawan PT. MUTIFA Medan atas perhatian dan bantuan yang diberikan kepada penulis selama melaksanakan Praktek Kerja Profesi (PKP) ini. Penulis menyadari atas kekurangan dalam penulisan laporan ini, untuk itu diharapkan kritik dan saran yang membangun demi kesempurnaan laporan ini. Penulis berharap semoga laporan ini dapat memberi manfaat bagi ilmu pengetahuan khususnya di bidang farmasi.
4 DAFTAR ISI Halaman HALAMAN JUDUL.... LEMBAR PENGESAHAN... KATA PENGANTAR... DAFTAR ISI... DAFTAR GAMBAR... DAFTAR TABEL... DAFTAR LAMPIRAN... RINGKASAN... i ii iii v viii ix x xi BAB I PENDAHULUAN Latar Belakang Tujuan... 2 BAB II TINJAUAN UMUM PT. MUTIARA MUKTI FARMA (MUTIFA) MEDAN Sejarah Visi dan Misi Lokasi dan Sarana Produksi Lokasi Sarana Produksi Penerapan CPOB di PT. Mutiara Mukti Farma (MUTIFA)... 11
5 BAB III KEGIATAN DI PT. MUTIARA MUKTI FARMA (MUTIFA) MEDAN Keterlibatan dalam Produksi Tinjauan ke bagian-bagian lain Research and Development Quality Control (QC) Quality Assurance (QA) Gudang Limbah Limbah Non Beta Laktam Limbah Beta Laktam BAB IV PEMBAHASAN Personalia Bangunan dan Fasilitas Peralatan Sanitasi dan Higiene Produksi Pengawasan Mutu Inspeksi Diri Penanganan Keluhan dan Penarikan Obat Kembalian Dokumentasi Pengamatan Pengolahan Limbah... 44
6 BAB V KESIMPULAN DAN SARAN Kesimpulan Saran DAFTAR PUSTAKA LAMPIRAN... 48
7 DAFTAR GAMBAR Halaman Gambar 1. Denah lokasi PT. MUTIFA... 5 Gambar 2. Struktur Organisasi R & D di PT. MUTIFA Gambar 3. Struktur Pemastian Mutu di PT. MUTIFA Gambar 4. Diagram Sistem Pengolahan Limbah Cair di PT. MUTIFA Gambar 5. Diagram Sistem Pengolahan Limbah Padat di PT. MUTIFA... 35
8 DAFTAR TABEL Halaman Tabel 1. Ukuran Ruangan masing-masing Bagian di PT. MUTIFA Tabel 2. Status dan Jumlah Personil pada PT. MUTIFA... 9 Tabel 3. Personalia PT. MUTIFA Medan Berdasarkan Jenjang Pendidikan 10 Tabel 4. Tolak Ukur Pemantauan Limbah Cair di PT. MUTIFA Tabel 5. Sistem Penanggulangan Limbah Udara... 36
9 DAFTAR LAMPIRAN Halaman Lampiran 1. Struktur Organisasi PT. MUTIFA Lampiran 2. Bagan Proses Pembuatan Tablet/Kaplet Lampiran 3. Bagan Proses Pembuatan Kapsul Lampiran 4. Bagan Proses Pembuatan Serbuk Oral Lampiran 5. Bagan Proses Pembuatan Liquida Lampiran 6. Bagan Proses Pembuatan Salep Lampiran 7. Bagan Proses Pembuatan Tablet Salut Gula Lampiran 8. Daftar Data Produk PT. Mutifa... 55
10 RINGKASAN Telah dilakukan Praktek Kerja Profesi (PKP) di Industri Farmasi PT. Mutiara Mukti Farma (MUTIFA) Medan yang merupakan salah satu program dalam pendidikan profesi apoteker, yang bertujuan agar mahasiswa/mahasisiwi mengetahui dan memahami tugas dan fungsi apoteker dalam industri farmasi, yang diharapkan dapat sebagai bekal untuk menghadapi dunia kerja yang sesungguhnya. Mahasiswa juga diharapkan dapat memperoleh wawasan dan pengetahuan yang lebih luas, memahami penerapan CPOB di PT. Mutiara Mukti Farma (MUTIFA), serta mengetahui gambaran tentang situasi dan kondisi kerja di PT. Mutiara Mukti Farma (MUTIFA). Praktek Kerja Profesi di Industri Farmasi PT. Mutiara Mukti Farma (MUTIFA) Medan dilaksanakan pada tanggal 4 September 2008 sampai dengan 22 September 2008 dengan jumlah jam efektif 300 jam. Kegiatan yang dilakukan selama Praktek Kerja Profesi (PKP) di Industri antara lain membuat catatan kegiatan harian yang berisi absensi, dan materi kegiatan yang ditandatangani oleh pembimbing, melihat kegiatan di Ruang Produksi Beta Laktam dan Non Beta laktam, Laboratorium Quality Control (QC), Gudang Bahan Baku dan Bahan Kemasan, sistem pengolahan air untuk produksi, sistem pengaturan udara (AHS), sistem pengolahan limbah, dan Laboratorium R and D. Tugas khusus yang diberikan berupa metoda analisa penetapan kadar untuk tablet dan sirup dari beberapa produk obat PT. MUTIFA.
11 BAB I PENDAHULUAN 1.1 Latar Belakang Obat adalah suatu zat yang dimaksudkan untuk dipakai dalam diagnosis, mengurangi rasa sakit, serta mengobati atau mencegah penyakit. Salah satu upaya yang dilakukan pemerintah untuk menjamin tersedianya obat yang bermutu, aman, dan berkhasiat yaitu dengan mengharuskan setiap industri farmasi untuk menerapkan Cara Pembuatan Obat yang Baik (CPOB) sesuai keputusan Menteri Kesehatan RI Nomor 43/MENKES/SK/II/1988 pada tanggal 2 Februari CPOB adalah pedoman pembuatan obat bagi industri farmasi di Indonesia yang bertujuan untuk memastikan agar sifat maupun mutu obat yang dihasilkan senantiasa memenuhi persyaratan mutu yang telah ditentukan, dan sesuai dengan tujuan penggunaannya. Mutu suatu obat tidak dapat ditentukan berdasarkan pemeriksaan produk akhir saja, melainkan harus dibentuk ke dalam produk selama keseluruhan proses pembuatan. Apoteker merupakan salah satu tenaga inti dalam industri farmasi karena turut berperan dalam menghasilkan obat yang bermutu, aman dan berkhasiat. Kedudukan apoteker juga diatur dalam CPOB, yaitu sebagai penanggung jawab produksi, pengawasan mutu, dan pemastian mutu. Oleh karena itu, dibutuhkan apoteker yang memiliki wawasan, pengetahuan, keterampilan, dan kemampuan dalam mengaplikasikan dan mengembangkan ilmunya secara profesional, terutama dalam menghadapi kenyataan di lapangan industri. Dengan demikian,
12 Praktek Kerja Profesi di industri farmasi menjadi salah satu kebutuhan mahasiswa calon apoteker. Program Pendidikan Profesi Apoteker Fakultas Farmasi Universitas Sumatera Utara (USU) telah bekerja sama dengan PT. Mutiara Mukti Farma (MUTIFA) untuk menyelenggarakan Praktek Kerja Profesi. Praktek Kerja Profesi ini dilaksanakan pada tanggal 4 September 2008 hingga 22 September Praktek Kerja Profesi di industri farmasi ini diharapkan dapat memberikan pengetahuan praktis kepada mahasiswa calon apoteker tentang pekerjaan kefarmasian di industri melalui penerapan CPOB. 1.2 Tujuan Adapun tujuan Praktek Kerja Profesi Apoteker Fakultas Farmasi USU di industri PT. Mutiara Mukti Farma (MUTIFA) adalah : 1. Mengetahui dan memahami tugas dan fungsi apoteker dalam industri farmasi, yang diharapkan dapat sebagai bekal untuk menghadapi dunia kerja yang sesungguhnya. 2. Memperoleh wawasan dan pengetahuan yang lebih luas, serta memahami penerapan CPOB di PT. Mutiara Mukti Farma (MUTIFA). 3. Mengetahui gambaran tentang situasi dan kondisi kerja di PT. Mutiara Mukti Farma (MUTIFA).
13 BAB II TINJAUAN UMUM PT. MUTIARA MUKTI FARMA (MUTIFA) MEDAN 2.1 Sejarah Pada tahun 1975 didirikan Industri Farmasi di kota Medan dengan nama Sejati Pharmaceutical Industries, yang memproduksi obar merek SIAGOGO. Setelah beberapa tahun berproduksi, perusahaan ini kemudian dialihkan pemiliknya kepada Bapak Drs. W. H. Siahaan dan memindahnamakan perusahaan tersebut dalam suatu akte notaris tertanggal 31 Januari 1980 dengan nama PT. Mutiara Mukti Farma (MUTIFA) yang berlokasi di Jl. Brigjen Katamso No. 220 Medan. Berdasarkan Surat Keputusan Menteri Kesehatan RI tahun 1981 No. 0098/SK/PAB/81 memutuskan memberikan izin untuk mendirikan pabrik Farmasi kepada PT. Mutiara Mukti Farma (MUTIFA) dengan nama MUTIFA INDUSTRI FARMASI untuk memproduksi obat-obatan. Dengan dikeluarkannya surat izin produksi oleh Departemen Kesehatan RI c/q Badan Pengawasan Obat dan Makanan No. 213/AA/III/81, mulailah PT Mutiara Mukti Farma memproduksi obat-obatan. Pada tahun 1983, perusahaan ini menjalankan dan melaksanakan operasinya dalam menghasilkan berbagai jenis maupun bentuk sediaan obat untuk memenuhi kebutuhan masyarakat Indonesia wilayah barat umumnya dan daerah Sumatera Utara pada khususnya. Pada tanggal 29 November 1988, dengan akte notaris No. 35 diadakanlah perubahan akte atas pemegang saham serta manajemen perusahaan, yang
14 ditetapkan melalui keputusan Menteri Kehakiman RI No. C HT th 89 tanggal 31 Januari Dalam akte tersebut, berdasarkan keputusan rapat Dewan Komisaris serta pemegang saham, ditetapkan bahwa yang menjadi penanggung jawab dengan jabatan Direktur Utama adalah Bapak Jacob. Sesuai dengan Keputusan Menteri Kesehatan RI No. 43/Menkes/SK/II/1988 tentang Pedoman Cara Pembuatan Obat yang Baik (CPOB), bahwa setiap industri farmasi harus mengacu pada pedoman tersebut, maka untuk memenuhi ketentuan tersebut PT. MUTIFA telah membangun pabrik yang baru di Jl. Karya Jaya No. 68 Km 8,5 Namorambe. Pada bulan Mei 1994 produksi telah dilaksanakan di pabrik yang baru dan pada saat ini kegiatan administrasi juga telah dilakukan dilokasi tersebut. Pada tanggal 27 Juli 1994 PT. MUTIFA diberikan sertifikat sebagai industri farmasi yang telah memenuhi CPOB. Bentuk sediaan yang telah diproduksi sampai saat ini terdiri dari 7 jenis sediaan yaitu : tablet, sirup, salep, serbuk oral, serbuk obat luar, bedak, sediaan produk kecil rumah tangga, dan kapsul sebanyak 114 item. Pendistribusian sediaan yang diproduksi PT. MUTIFA Medan meliputi wilayah : Provinsi Sumatera Utara, Riau, Sumatera Selatan, Daerah Khusus Ibukota (DKI) Jakarta, Jawa Barat, Jawa Tengah, Jawa Timur, Sulawesi Utara, dan Sulawesi Selatan. Untuk wilayah Sumatera obat didistribusikan melalui Pedagang Besar Farmasi (PBF) Mekada Abadi.
15 Obat-obatan diproduksi berdasarkan sistem skala prioritas, yang mengutamakan obat yang lebih cepat laku di pasaran. Hal ini tidak berlaku untuk obat Inpres dan Askes. 2.2 Visi dan Misi Visi dan Misi PT. MUTIFA adalah Anda sehat kami bangga. 2.3 Lokasi dan Sarana Produksi Lokasi PT. MUTIFA Medan berada di Jl. Karya Jaya No. 68 Km 8,5 Namorambe Medan. Denah lokasi PT. MUTIFA ditunjukkan pada Gambar 1 berikut ini : Jl. Letjen Jamin Ginting Lokasi PT. MUTIFA Jl. Karya Yasa Jl. Karya Jaya Ke Bandara Polonia Jl. M. Basyir Titi Kuning Ke Deli Tua Jl. Brigjen Katamso Gambar 1. Denah Lokasi PT. MUTIFA Luas areal PT. MUTIFA Medan mempunyai luas areal 9600 m 2 dan luas bangunan 6259 m 2.
16 Luas masing-masing ruangan adalah sebagai berikut : Tabel 1. Ukuran Ruangan Masing-Masing Bagian di PT. MUTIFA No. Ruang/Gudang Ukuran (m 2 ) 1. Ruang Perkantoran Ruang Produksi β laktam Ruang Laboratorium dan Pengawasan Mutu Ruang Teknik dan Bengkel Ruang Produksi Tablet Ruang Produksi Sirup Ruang Produksi Bedak Ruang Produksi Kapsul Ruang Produksi Salep Ruang Produksi Produk Kecil Rumah Tangga Gudang Bahan Baku Gudang Bahan Kemasan Gudang Hasil Jadi Janitor Kantin Ruang Pengemasan Gudang Alat 25 Sumber arus listrik berasal dari Perusahaan Listrik Negara (PLN), dan apabila arus listrik dari PLN terputus digunakan generator. Sumber air berasal dari sumur pompa, dan air PAM. Untuk keperluan produksi digunakan air sumur yang telah mengalami proses pengolahan. Air PAM
17 digunakan untuk pencucian alat, mandi, dan bila aliran PAM mengalami masalah, untuk menggantikan air PAM digunakan air sumur yang telah mengalami tiga kali penyaringan. Bangunan penunjang lainnya terdiri dari musholla, kamar mandi, dan pos jaga Sarana Produksi Ruangan produksi, gudang bahan baku, gudang bahan kemasan, dan obat jadi dibuat sedemikian rupa sehingga waktu yang dibutuhkan untuk mengangkut bahan baku ke ruang produksi, bahan kemasan ke ruang pengemasan, obat jadi dari ruang karantina ke gudang obat jadi relatif singkat, dan tidak melalui ruang produksi lainnya sehingga kemungkinan terjadinya pencemaran silang dapat dihindari. Keadaan ruang produksi adalah sebagai berikut : a. Lantai Lantai ruang produksi beta laktam, kapsul, puyer, salep, dan sirup, terbuat dari beton yang dilapisi granit diantaranya diisi dengan semen putih. Lantai mempunyai permukaan yang rata, mudah dibersihkan, tidak menahan partikel, tahan terhadap deterjen, desinfektan, dan tahan terhadap bahan kimia. b. Dinding Dinding ruang terbuat dari beton, yang dilapisi dengan sebagian epoksi dan sebagian akrilit, sehingga permukaan dinding menjadi licin, rata, kedap air, mudah dibersihkan, tahan terhadap bahan kimia, deterjen, desinfektan, tidak menahan partikel, serta tidak menjadi tempat bersarangnya binatang kecil.
18 c. Langit-langit Langit-langit ruang terbuat dari beton, yang dilapisi epoksi sehingga permukaan langit-langit menjadi licin dan rata, kedap air, mudah dibersihkan, tahan terhadap bahan kimia, deterjen, desinfektan, tidak menahan partikel. d. Pengaturan Udara Aliran udara yang digunakan dalam ruangan produksi beta laktam dan non beta laktam adalah Air Handling System (AHS). Supply udara yang akan disalurkan ke dalam ruang produksi berasal dari 2 sumber, yaitu berasal dari udara yang disirkulasi kembali (sebanyak 80%), dan berasal dari udara bebas (sebanyak 20%). Supply udara tersebut kemudian melewati filter yang terdapat di dalam filter house yang terdiri dari prefilter yang memiliki efisiensi penyaringan sebesar 35% dan medium filter yang memiliki efisiensi penyaringan sebesar 95%. Selanjutnya, supply udara ini melewati cooling coil (evaporator) yang akan menurunkan suhu (T) dan kelembaban relatif (RH) udara. Kemudian udara dipompa dengan menggunakan static pressure fan (blower) ke dalam ruang produksi melalui ducting (saluran udara). Jumlah udara yang masuk ke dalam ruang produksi diatur dengan menggunakan volume dumper. Selanjutnya udara disirkulasi kembali ke AHS. Kecepatan pertukaran udara dalam ruangan produksi beta laktam maupun non beta laktam 20 kali per jam, dan untuk koridor 25 kali per jam.
19 e. Personalia Untuk mendukung kegiatan operasionalnya, PT. MUTIFA memerlukan personil yang terampil dan terlatih. Status dan jumlah personil dilihat pada tabel 2 berikut ini : Tabel 2. Status dan Jumlah Personil pada PT. MUTIFA No. Bagian Unit Jumlah 1. Direktur Utama 1 2. Manajer Administrasi dan Keuangan 7 4. Research & Development 3 5. Unit Sirup Unit Kapsul 5 7. Unit Tablet Unit Puyer 4 9. Unit Bedak Gudang Kemasan Gudang Bahan Baku Gudang Obat Jadi Teknisi Laboratorium Kolektor Akuntansi Penjualan/Pemasaran Supir Pembelian Cleaning Service Satpam 5 Jumlah seluruhnya 137 Dalam rangka memenuhi persyaratan CPOB, langkah-langkah yang diambil PT. MUTIFA Medan dibidang personalia adalah dengan cara mengirim pimpinan atau staf untuk mengikuti pelatihan mengenai CPOB. Selanjutnya diharapkan pimpinan atau staf tersebut dapat memberikan bimbingan dan pelatihan tentang CPOB kepada karyawan sehingga kegiatan perusahaan akan
20 memenuhi ketentuan CPOB. Berdasarkan jenjang pendidikan, maka personil PT. MUTIFA Medan dapat diuraikan sebagai berikut: Tabel 3. Personalia PT. MUTIFA Medan Berdasarkan Jenjang Pendidikan No. Jenjang Pendidikan Jumlah (Orang) 1. Apoteker 8 2. Sarjana Sarjana Muda 5 4. SLTA/sederajat SLTP SD 2 e. Struktur Organisasi Struktur organisasi pada PT. MUTIFA merupakan struktur organisasi yang vertikal, dimana masing-masing bawahan dipimpin oleh manajer yang langsung bertanggungjawab penuh kepada Direktur Utama. Kekuasaan tertinggi berada pada rapat umum pemegang saham yang pelaksanaannya harus dipertanggungjawabkan oleh Direktur Utama. Direktur Utama membawahi 11 bagian, dan masing-masing bawahan dipimpin oleh manajer yang langsung bertanggungjawab penuh kepada Direktur Utama. Masing-masing bagian membawahi sub bagian yang bertanggungjawab penuh kepada Kepala bagiannya (Manajernya) dalam melaksanakan tugas yang telah dibebankan kepadanya. Struktur organisasi PT. MUTIFA Medan dapat dilihat pada lampiran 1 halaman 49.
21 2.4 Penerapan CPOB di PT. Mutiara Mukti Farma (MUTIFA) CPOB adalah bagian dari Pemastian Mutu yang memastikan bahwa obat dibuat dan dikendalikan secara konsisten untuk mencapai standar mutu yang sesuai dengan tujuan penggunaan, serta dipersyaratkan dalam izin edar, maupun spesifikasi produk. CPOB mencakup seluruh aspek produksi dan pengendalian mutu. Pada pembuatan obat, pengendalian menyeluruh adalah sangat esensial untuk menjamin bahwa konsumen menerima obat yang bermutu tinggi. Pembuatan secara sembarangan tidak dibenarkan bagi produk yang digunakan untuk menyelamatkan jiwa, memulihkan, atau memelihara kesehatan. Tidaklah cukup bila produk jadi hanya sekedar lulus dari serangkaian pengujian, tetapi yang lebih penting adalah bahwa mutu harus dibentuk ke dalam produk tersebut. Mutu obat tergantung pada bahan awal, bahan pengemas, proses produksi dan pengendalian mutu, bangunan, peralatan yang dipakai dan personil yang terlibat. Persyaratan dasar dari CPOB adalah: a. Semua proses pembuatan obat dijabarkan dengan jelas, dikaji secara sistematis berdasarkan pengalaman, serta terbukti mampu secara konsisten menghasilkan obat yang memenuhi persyaratan mutu dan spesifikasi yang telah ditetapkan. b. Tahap proses yang kritis dalam pembuatan, pengawasan proses, dan sarana penunjang serta perubahannya yang signifikan divalidasi.
22 c. Tersedia semua sarana yang diperlukan dalam CPOB termasuk : personil yang terkualifikasi dan terlatih. bangunan dan sarana dengan luas yang memadai. peralatan dan sarana penunjang yang sesuai. bahan, wadah, dan label yang benar. prosedur, dan instruksi yang disetujui. tempat penyimpanan, dan transportasi yang memadai. d. Prosedur dan instruksi ditulis dalam bentuk instruksi dengan bahasa yang jelas, tidak bermakna ganda, dapat diterapkan secara spesifik pada sarana yang tersedia. e. Operator memperoleh pelatihan untuk menjalankan prosedur secara benar. f. Pencatatan dilakukan secara manual atau dengan alat pencatat selama pembuatan yang menunjukkan bahwa semua langkah yang dipersyaratkan dalam prosedur, dan instruksi yang ditetapkan benar-benar dilaksanakan lalu jumlah serta mutu produk yang dihasilkan sesuai dengan yang diharapkan. Tiap penyimpangan dicatat secara lengkap dan diinvestigasi. g. Catatan pembuatan termasuk distribusi yang memungkinkan penelusuran riwayat bets secara lengkap, disimpan secara komprehensif, dan dalam bentuk yang mudah diakses. h. Penyimpanan dan distribusi obat yang dapat memperkecil risiko terhadap mutu obat. i. Tersedia sistem penarikan kembali batch obat manapun dari peredaran.
23 j. Keluhan terhadap produk yang beredar dikaji, penyebab cacat mutu diinvestigasi, serta dilakukan tindakan perbaikan yang tepat, dan pencegahan pengulangan kembali keluhan. Sumber daya manusia sangat penting dalam pembentukan, maupun penerapan sistem pemastian mutu yang memuaskan, dan pembuatan obat secara benar. Oleh sebab itu industri farmasi bertanggung jawab untuk menyediakan personil yang terkualifikasi dalam jumlah yang memadai untuk melaksanakan semua tugas. Tiap personil hendaklah memahami tanggung jawab masing-masing dan dicatat. Seluruh personil hendaklah memahami prinsip CPOB, serta memperoleh pelatihan awal dan berkesinambungan, termasuk instruksi mengenai higiene yang berkaitan dengan pekerjaan. Bangunan dan fasilitas untuk pembuatan obat hendaklah memiliki desain, konstruksi dan letak yang memadai, serta disesuaikan kondisinya, dan dirawat dengan baik untuk memudahkan pelaksanaan operasi yang benar. Tata letak maupun desain ruangan harus dibuat sedemikian rupa untuk memperkecil risiko terjadinya kekeliruan, pencemaran silang dan kesalahan lain, memudahkan pembersihan, sanitasi dan perawatan yang efektif untuk menghindari pencemaransilang, penumpukan debu atau kotoran, serta dampak lain yang dapat menurunkan mutu obat. Peralatan untuk pembuatan obat hendaklah memiliki desain dan konstruksi yang tepat, ukuran yang memadai, serta ditempatkan dan dikualifikasi dengan tepat, agar mutu obat terjamin sesuai desain serta seragam dari bets ke bets, dan untuk memudahkan pembersihan serta perawatan.
24 Tingkat sanitasi dan higiene yang tinggi hendaklah diterapkan pada setiap aspek pembuatan obat. Ruang lingkup sanitasi dan higiene meliputi personil, bangunan, peralatan dan perlengkapan, bahan produksi serta wadahnya, dan segala sesuatu yang dapat merupakan sumber pencemaran produk. Sumber pencemaran potensial hendaklah dihilangkan melalui suatu program sanitasi maupun higiene yang menyeluruh dan terpadu. Tujuan inspeksi diri adalah untuk mengevaluasi apakah semua aspek produksi, dan pengawasan mutu industri farmasi memenuhi ketentuan CPOB. Program inspeksi diri hendaklah dirancang untuk mendeteksi kelemahan dalam pelaksanaan CPOB, dan untuk menetapkan tindakan perbaikan yang diperlukan. Inspeksi diri hendaklah dilakukan secara independen dan rinci oleh petugas yang kompeten dari perusahaan. Ada manfaatnya bila juga menggunakan auditor luar yang independen. Inspeksi diri hendaklah dilakukan secara rutin, maupun pada situasi khusus, misalnya dalam hal terjadi penarikan kembali obat jadi, atau terjadi penolakan yang berulang. Semua saran untuk tindakan perbaikan supaya dilaksanakan. Prosedur dan catatan inspeksi diri hendaklah didokumentasikan, serta dibuat program tindak lanjut yang efektif. Semua keluhan dan informasi lain yang berkaitan dengan kemungkinan terjadi kerusakan obat hendaklah dikaji dengan teliti sesuai dengan prosedur tertulis. Untuk menangani semua kasus yang mendesak, hendaklah disusun suatu sistem, bila perlu mencakup penarikan kembali produk yang diketahui atau diduga cacat dari peredaran secara cepat dan efektif. Penarikan kembali produk adalah
25 suatu proses penarikan kembali dari satu, beberapa, atau seluruh batch produk tertentu dari peredaran. Penarikan kembali produk dilakukan apabila ditemukan produk yang cacat mutu, atau bila ada laporan mengenai reaksi yang merugikan yang serius serta berisiko terhadap kesehatan. Penarikan kembali produk dari peredaran dapat mengakibatkan penundaan, atau penghentian pembuatan obat tersebut. Produk kembalian adalah obat jadi yang telah beredar, yang kemudian dikembalikan ke industri farmasi karena keluhan mengenai kerusakan, daluwarsa, atau alasan lain, misalnya kondisi wadah atau kemasan yang dapat menimbulkan keraguan akan identitas, mutu, jumlah, dan keamanan obat yang bersangkutan. Dokumentasi adalah bagian dari sistem informasi manajemen, dan dokumentasi yang baik merupakan bagian yang esensial dari pemastian mutu. Dokumentasi yang jelas adalah fundamental untuk memastikan bahwa tiap personil menerima uraian tugas yang relevan secara jelas dan rinci, sehingga memperkecil resiko terjadi salah tafsir dan kekeliruan yang biasanya timbul karena hanya mengandalkan komunikasi lisan. Spesifikasi, Dokumen Produksi Induk/Formula Pembuatan, prosedur, metode dan instruksi, laporan, dan catatan harus bebas dari kekeliruan, dan tersedia secara tertulis.
26 BAB III KEGIATAN DI PT. MUTIARA MUKTI FARMA (MUTIFA) MEDAN 3.1 Keterlibatan dalam Produksi Yang dimaksud dengan produksi adalah semua kegiatan mulai dari penerimaan bahan awal, pengolahan, sampai dengan pengemasan untuk menghasilkan obat jadi. Tugas dan fungsi bagian produksi PT. MUTIFA antara lain : 1. Melaksanakan pembuatan obat mulai dari permintaan bahan baku ke gudang, pengolahan, pengemasan, sampai pengiriman obat ke gudang obat jadi. 2. Melaksanakan secara teknis dan administrasi semua tugas selama pengolahan maupun pengemasan dengan berpedoman kepada prosedur tetap (protap) yang telah ditetapkan. Sasaran utama yang harus dicapai oleh bagian produksi antara lain adalah sebagai berikut : 1. Memenuhi dan menyerahkan permintaan sesuai dengan jumlah yang diharapkan, dan waktu penyerahan yang diminta. 2. Menghasilkan produk yang diminta sesuai dengan jumlah yang ditetapkan secara efektif dan efisien. Sebelum proses berlangsung, ada beberapa hal yang perlu dipersiapkan agar produksi dapat berjalan lancar dan menghasilkan suatu produk sesuai dengan yang diharapkan.
27 Tahapan yang perlu diperhatikan sebelum produksi adalah sebagai berikut : 1. Ruang produksi harus tetap dijaga kebersihannya, dengan menggunakan desinfektan untuk memperkecil terjadinya kontaminasi oleh mikroorganisme. 2. Temperatur, dan kelembaban ruangan harus diatur sedemikian rupa sesuai dengan sifat bahan yang akan digunakan. Bila perlu dapat digunakan Air Conditioner (AC) sebagai alat pendingin ruangan, dan dehumidifier sebagai alat pengatur kelembaban. 3. Ruangan produksi harus mendapat penerangan dan pertukaran udara yang cukup, karena dapat memperlancar kegiatan. 4. Alat-alat yang digunakan harus selalu dalam keadaan bersih, dan dalam kondisi yang baik. Sebelum proses produksi berlangsung, dibuat laporan proses produksi yang bertujuan untuk dokumentasi, sehingga jika terjadi kekeliruan atau kesalahan pada proses produksi, maka segera diketahui pada proses mana kesalahan tersebut terjadi, dan dilakukan langkah-langkah untuk mengatasi permasalahan tersebut. Laporan proses produksi, berguna untuk menghitung jam kerja yang diperlukan dalam mengerjakan suatu batch sediaan. Laporan ini dibuat dan ditandatangani oleh petugas yang melaksanakan tahapan proses produksi. Selama proses produksi berlangsung dilakukan pengawasan dalam proses (In Process Control/IPC) baik terhadap produk antara maupun terhadap produk ruahan dari tiap tahapan proses produksi. Bagian pengawasan mutu akan melaksanakan IPC setelah seksi bagian produksi membuat permohonan pemeriksaan. Produk antara maupun produk ruahan yang sedang diperiksa
28 (berstatus karantina) diberi label kuning, dan jika lulus pemeriksaan diberi label hijau, sehingga dapat diteruskan ke proses selanjutnya. Produk yang tidak memenuhi persyaratan akan diberi label merah, dan tidak boleh diteruskan sebelum persyaratan yang telah ditentukan dipenuhi, atau bahan tersebut akan dimusnahkan jika tidak memungkinkan untuk proses ulang. Setelah tahap pengemasan selesai, obat jadi dikarantina, kemudian dibuat permohonan pemeriksaan ke bagian pengawasan mutu untuk dilakukan Finished Pack Analysis. Obat jadi yang lulus pemeriksaan selanjutnya diserahkan ke gudang obat jadi. Bagian-bagian produksi pada PT. MUTIFA terdiri atas: 1. Unit tablet Unit ini dilengkapi dengan timbangan, mesin pencampuran bahan, granulator, mesin pencetak tablet, oven, lubrikator, FBD (Fluid Bed Dryer), mesin penyalut, mesin strip, dan mesin blister. Hal-hal yang diperiksa selama produksi adalah keseragaman bobot, waktu hancur, ketebalan, kekerasan, kadar zat berkhasiat, friabilitas, LOD (Lost Of Drying), dan disolusi. Bagan proses pembuatan tablet dapat dilihat pada lampiran 2 halaman Unit kapsul Mesin-mesin yang digunakan pada produksi kapsul adalah mesin pencampuran bahan, mesin pengisi kapsul, dan oven. Pada produksi kapsul perlu diperhatikan kondisi ruangan yaitu temperatur, dan kelembaban. Pengaturan temperatur dengan memakai alat pendingin (AC) untuk mendapatkan temperatur 25 C. Hal-hal yang diperiksa selama produksi adalah keseragaman bobot, kadar
29 zat berkhasiat, waktu hancur, disolusi, dan LOD. Bagan proses pembuatan kapsul dapat dilihat pada lampiran 3 halaman Unit serbuk oral Alat-alat yang digunakan pada produksi ini antara lain mesin pencampuran bahan, alat pengisi serbuk, dan oven. Hal-hal yang diperiksa selama produksi adalah keseragaman bobot, LOD (Lost Of Drying). dan kadar zat berkhasiat. Bagan proses pembuatan serbuk oral dapat dilihat pada lampiran 4 halaman Unit Liquida Unit liquida memproduksi sediaan bentuk cair seperti suspensi, sirup. Unit ini dilengkapi dengan mesin pencampuran, dan mesin pengisi obat ke dalam wadah. Hal-hal yang diperiksa selama produksi adalah ph larutan, Berat Jenis (BJ) larutan, keseragaman volume, viskositas larutan, kadar zat berkhasiat, dan kebocoran wadah. Bagan proses pembuatan liquida dapat dilihat pada lampiran 5 halaman Unit salep Mesin-mesin yang digunakan pada produksi salep antara lain mesin pencampur bahan (mixer), dan mesin pengisi salep ke dalam wadah. Hal-hal yang diperiksa selama produksi adalah keseragaman bobot, kadar zat berkhasiat, dan homogenitas. Bagan proses pembuatan salep dapat dilihat pada lampiran 6 halaman 54.
30 3.2 Tinjauan Ke Bagian-Bagian Lain Research and Development (R&D) Research and Development (R&D) di PT. MUTIFA baru dibentuk pada tahun R & D bertanggung jawab dalam menghasilkan produk-produk baru di PT. MUTIFA. Kegiatan-kegiatan yang terlibat dalam menghasilkan produkproduk baru tersebut adalah formulasi. menyusun semua protokol validasi maupun laporan validasi proses yang diperlukan di PT. MUTIFA. Struktur Organisasi R & D di PT. MUTIFA dapat dilihat pada gambar 2 berikut ini: Manager R & D Supervisor R & D FORMULASI LAPORAN VALIDASI PROSES Gambar 2. Struktur Organisasi R & D di PT. MUTIFA Quality Control (QC) Bagian pengawasan mutu bertanggung jawab dalam melaksanakan mutu suatu produk yang dihasilkan oleh industri farmasi, agar senantiasa memiliki persyaratan mutu yang telah ditetapkan sesuai dengan tujuan penggunaannya. Sistem pengawasan mutu harus dirancang dengan tepat untuk menjamin bahwa tiap obat mengandung bahan dengan mutu yang benar, dan jumlah yang tepat
31 sesuai dengan prosedur, sehingga obat tersebut senantiasa memenuhi spesefikasi yang telah ditetapkan. Manajer pengawasan mutu PT. MUTIFA adalah seorang apoteker yang cakap, terlatih, yang dapat bekerja secara professional. Ruang lingkup tugas, wewenang, dan tanggung jawab dari manajer pengawasan mutu adalah : 1. Manajer pengawasan mutu diberi wewenang dan tanggung jawab penuh atas penyusunan, verifikasi, dan pelaksanaan seluruh proses pengawasan mutu. 2. Manajer pengawasan mutu sebagai satu-satunya yang memiliki wewenang untuk meluluskan bahan awal, produk antara, produk ruahan, dan obat jadi. Bila produk tersebut tidak sesuai dengan spesifikasinya, atau bahan yang dibuat tidak sesuai dengan prosedur yang disetujui dan kondisi yang ditentukan, maka manajer produksi langsung menolaknya. 3. Memberikan pengarahan dalam melaksanakan tugas di laboratorium kimia, mikrobiologi, pelaksanaan pengawasan dalam proses (In Process Control/IPC), maupun pelaksanaan CPOB. 4. Bertanggung jawab untuk menjamin bahwa semua pengujian dilaksanakan dengan metode yang benar, dan telah disetujui. 5. Bertanggung jawab atas pelaksanaan inspeksi bahan baku, bahan pengemas, maupun proses produksi. 6. Bertanggung jawab untuk meninjau sebuah catatan pengolahan batch dan catatan pengemasan batch sebelum meluluskan obat jadi. 7. Jika ada kegagalan dalam produksi, mendiskusikan hal tersebut dengan manajer produksi, dan ikut serta mencari penyebab maupun jalan keluarnya.
32 8. Bertanggung jawab atas pengadaan, pemakaian, dan pembuatan pereaksi. 9. Bertanggung jawab agar alat-alat untuk analisa dipakai serta dijaga dengan benar, dikalibrasi, dan senantiasa tersedia suku cadangnya. 10. Bertanggung jawab moral yang tinggi, kemampuan, pengembangan, dan pelatihan, serta melakukan evaluasi tahunan atas semua karyawan yang dibawahinya. 11. Bertanggung jawab atas pelaksanaan inspeksi CPOB, dan menjamin pelaksanaan CPOB secara ketat. 12. Membuat laporan bulanan, dan anggaran tahunan bagian pengawasan mutu. 13. Memastikan bahwa semua prosedur analisa disimpan secara baik dan benar. 14. Mengusahakan perbaikan biaya pengawasan mutu. Laboratorium pengawasan mutu di PT. MUTIFA dibagi atas laboratorium kimia, dan mikrobiologi. Kedua laboratorium tersebut dalam ruangan yang terpisah, dan memiliki alat pengujian masing-masing. Selain itu, ruang penimbangan, ruang penyimpanan bahan, dan ruangan instrumen dipisahkan secara tersendiri. Terdapat ruangan khusus untuk instrumen spektrofotometer, dan ruang instrumen High Performance Liquid Chromatography (HPLC) dan terdapat juga lemari asam yang memiliki sistem penghisap udara tersendiri. Sampah dan sisa bahan laboratorium QC dibuang pada tempat yang telah disediakan. Bahan beracun dan bahan yang mudah terbakar disimpan pada tempat khusus dan terpisah. Limbah yang dihasilkan dari bagian QC dibuang ke Instalasi Pengolahan Air Limbah di PT. MUTIFA.
33 Personil bagian QC terdiri dari apoteker, dan analis yang terdidik, terlatih serta berpengalaman dibidangnya. Tugas dan wewenang personil diterangkan dalam protap yang disimpan oleh personil yang bersangkutan. Tiap personil menggunakan pakaian jas laboratorium, masker, dan sarung tangan yang diperlukan untuk tugasnya. Peralatan laboratorium uji disesuaikan dengan prosedur pengujian. Dibuat protap-protap untuk pengoperasian dan peralatan, serta dilekatkan pada dinding yang berdekatan dengan peralatan yang bersangkutan. Perawatan dan kalibrasi peralatan dilakukan secara rutin dan didokumentasikan. Terdapat penandaan yang jelas tentang keadaan peralatan, apakah berfungsi baik atau tidak. Tanggal dan waktu kalibrasi selanjutnya tertera pada instrumen dengan jelas. Penerimaan dan pembuatan pereaksi serta media biakan dicatat dalam buku khusus. Pembuatan pereaksi dilakukan di laboratorium berdasarkan petunjuk pembuatan yang tertulis dan setiap pereaksi diberi label yang sesuai seperti konsentrasi, faktor standarisasi, batas waktu penggunaan, tanggal standarisasi ulang, kondisi penyimpanan, tanggal pembuatan, dan tanda tangan petugas pembuat. Prosedur pengujian yang akan digunakan terlebih dahulu divalidasi dengan memperhatikan fasilitas dan peralatan yang ada. Spesifikasi dan prosedur pengujian untuk setiap bahan awal, produk antara, produk ruahan, dan obat jadi memuat ketentuan dan cara pemeriksaan serta pengujian identitas, kemurnian, kualitas, dan kadar (potensi).
34 Prosedur pengujian memuat: 1. Jumlah contoh yang diperlukan. 2. Banyaknya pereaksi yang digunakan untuk pengujian. 3. Alat atau instrumen yang digunakan. 4. Rumus perhitungan yang digunakan. 5. Range yang diperbolehkan. 6. Referensi yang digunakan sebagai acuan. Pengujian dilakukan mengikuti instruksi pada prosedur pengujian untuk masing-masing bahan atau produk dan diperiksa oleh supervisor. Catatan analisa meliputi : 1. Nama dan nomor batch. 2. Nama petugas yang mengambil contoh. 3. Metoda analisa yang digunakan. 4. Perhitungan dalam unit ukuran, rumus yang digunakan, dan range yang diperbolehkan. 5. Kesimpulan (diterima atau ditolak). 6. Tanggal dan tanda tangan petugas yang melakukan pengujian. 7. Nama pemasok, jumlah keseluruhan, dan jumlah bahan awal yang diterima. 8. Jumlah keseluruhan, wadah, bahan baku, bahan pengemas, produk antara, produk ruahan, dan obat jadi dari batch yang dianalisa. 9. Rujukan pustaka dari mana prosedur pengujian diambil.
35 Contoh pertinggal diberi identitas yang jelas, mewakili tiap batch bahan baku yang diterima, dan obat jadi dalam kemasan lengkap, disimpan dalam jangka waktu tertentu (sampai batas waktu kadaluarsa) dengan kondisi yang sesuai dengan label penandaan. Jumlah sampel pertinggal adalah minimal 2 kali dari jumlah sampel yang dibutuhkan untuk pengujian lengkap. Validasi yang dilakukan oleh PT. MUTIFA antara lain: 1. Validasi metode analisa, dilakukan untuk mengetahui bahwa metode analisis sesuai tujuan penggunaanya. 2. Validasi proses. Isi dari validasi proses terdiri dari komposisi/formula, spesifikasi bahan baku, bagan alur proses, perlengkapan dan peralatan terkait, sistem penunjang, kondisi ruangan, proses pembuatan dan parameter kritis, dokumentasi, stabilitas dan pengemasan. 3. Validasi pembersihan. Validasi pembersihan dilakukan hanya untuk permukaan alat yang bersentuhan langsung dengan produk. Spesifikasi ditetapkan sendiri oleh pabrik yang telah memenuhi persyaratan yang ada dalam farmakope dan senantiasa direvisi secara rutin. Spesifikasi dibuat dalam bentuk dokumen dan disimpan tersendiri, yang meliputi : 1. Spesifikasi bahan baku. 2. Spesifikasi bahan pengemas. 3. Spesifikasi produk antara. 4. Spesifikasi produk ruahan. 5. Spesifikasi produk jadi.
36 Pengambilan sampel dilakukan terhadap sebagian kecil dari batch yang ada. Sampel yang diambil hendaklah mewakili batch yang ada, dan berdasarkan prosedur tetap yang telah dibuat. Jumlah sampel yang diambil mengikuti rumus n + 1. Sampel bahan awal, produk antara, diambil secara acak mewakili tiap wadah menggunakan peralatan yang sesuai yang diambil pada proses awal, tengah, dan akhir. Pengambilan sampel dilakukan dengan tepat untuk mencegah kontaminasi silang. Wadah untuk bahan sampel diberi label yang menunjukkan isi wadah, nomor batch, tanggal pengambilan, dan tanda bahwa sampel telah diambil dari wadah tersebut. Pengambilan sampel bahan baku dilakukan pada tempat yang bersih, dan dilakukan pemeriksaan awal terlebih dahulu sebelum pengambilan sampel. Bahan baku yang akan diuji telah dilengkapi dengan sertifikat analisis dari produsen atau supplier, bahan pengemas dilihat dari segi fisiknya. Pengawasan pada kemasan diperiksa oleh IPC sebelum kegiatan pengemasan berjalan, selama proses berlangsung, dan pada produk akhir yang sudah dikemas. Untuk menjamin keseragaman batch, sampel diambil mewakili setiap batch produk antara dan produk ruahan untuk diuji identitas, kekuatan, kemurnian dan kualitasnya. Produk antara dan produk ruahan yang ditolak diberi penandaan dan diawasi dengan sistem karantina. Setiap batch obat jadi dilakukan pengujian terhadap spesifikasi yang ditetapkan. Batch yang tidak memenuhi syarat, diselidiki kesalahannya dan dilakukan pengujian ulang bersama bagian penelitian dan pengembangan. Bila
37 dilakukan pengolahan ulang, maka prosedur tersebut harus diperiksa, dan disetujui oleh bagian QC. Setiap bahan awal, produk antara, produk ruahan dan produk jadi yang telah diuji dan memenuhi persyaratan yang ditetapkan diberi label DILULUSKAN. Setiap bahan awal, produk antara, produk ruahan, dan obat jadi telah ditetapkan batas waktu penyimpanannya. Jika obat telah melewati batas waktu penyimpanan, maka bagian QC akan melakukan pengujian ulang berdasarkan tanggal pengujian ulang. Jika masih memenuhi syarat maka bahan diberi label DILULUSKAN. Bagian QC memeriksa semua catatan produksi tiap batch obat untuk menentukan apakah proses pengolahan telah memenuhi semua persyaratan yang telah ditetapkan, kemudian dilaporkan ke bagian QA untuk diluluskan. QC menyusun protap untuk mengetahui stabilitas obat jadi, kondisi penyimpanan yang cocok, dan tanggal kadaluarsa. Pengujian stabilitas obat meliputi: 1. Jumlah contoh dan jadwal pengujian berdasarkan sifat zat yang diuji. 2. Kondisi penyimpanan. 3. Metode pengujian yang spesifik, bermakna, dan handal. 4. Pengujian produk dalam kemasan yang sama dengan kemasan produk yang dipasarkan. 5. Pada obat jadi untuk rekonstitusi, pengujian stabilitas dilakukan sebelum dan sesudah rekonstitusi.
38 3.2.3 Quality Assurance (QA) Pemastian Mutu adalah suatu konsep luas yang mencakup semua hal baik secara tersendiri maupun secara kolektif, yang akan mempengaruhi mutu dari obat yang dihasilkan. Pemastian mutu adalah totalitas semua pengaturan yang dibuat dengan tujuan untuk memastikan bahwa obat yang dihasilkan dengan mutu yang sesuai dengan tujuan pemakaiannya. Tugas-tugas bagian pemastian mutu mencakup: 1. Desain dan pengembangan obat dilakukan dengan cara yang memperhatikan persyaratan CPOB. 2. Semua langkah produksi dan pengendalian diuraikan secara jelas dan CPOB diterapkan. 3. Tanggung jawab manajerial diuraikan dengan jelas dalam uraian jabatan. 4. Pengaturan disiapkan untuk pembuatan pasokan dan penggunaan bahan awal dan pengemas yang benar. 5. Semua pengawasan terhadap produk antara dan pengawasan selama proses (in- process controls), serta validasi yang perlu dilakukan. 6. Pengkajian terhadap semua dokumen yang terkait dengan proses pengemasan dan pengujian bets, dilakukan sebelum memberikan pengesahan pelulusan untuk distribusi. Penilaian hendaklah meliputi semua faktor yang relevan termasuk kondisi pembuatan, hasil pengujian atau pengawasan selama proses, pengkajian dokumen produksi termasuk pengemasan, pengkajian penyimpangan dari prosedur yang telah
39 ditetapkan, pemenuhan persyaratan dari Spesifikasi Produk Jadi, dan pemeriksaan produk dalam kemasan akhir. 7. Obat tidak dijual atau dipasok sebelum kepala bagian Manajemen Mutu (Pemastian Mutu) menyatakan bahwa tiap bets produksi dibuat dan dikendalikan sesuai dengan persyaratan yang tercantum dalam izin edar, serta peraturan lain yang berkaitan dengan aspek produksi, pengawasan mutu, dan pelulusan produk 8. Tersedia pengaturan yang memadai untuk memastikan bahwa, sedapat mungkin, produk disimpan, didistribusikan, dan selanjutnya ditangani sedemikian rupa agar mutu tetap dijaga selama masa edar /simpan obat. 9. Tersedia prosedur inspeksi diri atau audit mutu yang secara berkala mengevaluasi efektivitas dan penerapan Sistem Pemastian Mutu. 10. Pemasok bahan awal dan pengemas dievaluasi dan disetujui untuk memenuhi spesifikasi mutu yang telah ditentukan oleh perusahaan 11. Penyimpangan dilaporkan, diselidiki. dan dicatat. 12. Tersedia sistem persetujuan terhadap perubahan yang berdampak pada mutu produksi. 13. Prosedur pengolahan ulang dievaluasi dan disetujui, dan. 14. Evaluasi mutu produk berkala dilakukan untuk verifikasi konsistensi proses. dan memastikan perbaikan proses yang berkesinambungan.
40 bawah ini: Struktur pemastian mutu di PT. MUTIFA dapat dilihat pada gambar 3 di QA Manager QA Pharmacist Supervisor QA QA Staffs Gambar 3. Struktur Pemastian Mutu di PT. MUTIFA Gudang Gudang bertugas melaksanakan penerimaan, penyimpanan, pemeliharaan bahan baku, kemasan, dan sediaan jadi. Gudang melaksanakan penyimpanan dan pengeluaran bahan baku, sediaan jadi dan kemasan dengan memakai prinsip FIFO (First In First Out) maupun FEFO (First Expire First Out). Gudang terbagi 3 yaitu gudang bahan baku, gudang sediaan jadi, dan gudang kemasan yang dibuat dengan sistem satu pintu. Pelaksanaan kegiatan di gudang adalah menerima, menyimpan, memelihara, menyalurkan bahan baku, bahan sediaan dan kemasan serta melaksanakan administrasi penerimaan, penyimpanan, penyaluran sesuai peraturan dan ketentuan yang berlaku.
41 Proses masuknya bahan baku ke gudang adalah sebagai berikut: 1. Bahan dipesan menggunakan Surat Pesanan (SP). 2. Selanjutnya bahan baku yang masuk ke gudang harus disertai dengan sertifikat analisis (CA) dan disesuaikan dengan SP. 3. Lalu diperiksa kondisi fisik dari bahan tersebut. 4. Bon faktur ditandatangani oleh kepala gudang, lalu diserahkan ke kasir industri. 5. Bahan baku yang masuk tersebut langsung dibuat Bukti Barang Masuk (BBM). Selanjutnya bahan dikarantina untuk dianalisis lebih lanjut. Barang yang belum diperiksa atau dalam tahap pemeriksaan diberi label karantina. Label karantina ini berwarna kuning berisi nama barang, jumlah, nomor batch, tanggal diterima, unit penerimaan, dan tanda tangan. Barang yang diluluskan diberi label diluluskan berwarna hijau, serta berisi nama barang, tanggal diterima, jumlah, pembuat/penyalur, nomor batch asal, dan data yang diisi oleh Unit Quality Control (QC) (tanggal tes, nomor lot, tanda tangan, dan tanggal kadaluarsa), sedangkan barang yang ditolak diberi label ditolak yang berwarna merah dan berisi nama barang, jumlah, nomor batch, tanggal diterima, dan tanda tangan bagian QC. Bahan baku atau kemasan dianalisis oleh Unit Quality Control (QC) setelah menerima Surat Pengiriman contoh bahan baku atau kemasan. Unit ini bertugas memberikan persetujuan atau penolakan terhadap bahan baku dan kemasan berdasarkan hasil analisis. Bahan baku atau kemasan yang diluluskan
42 oleh Unit Quality Control (QC) akan merobek label karantina, menempelkan label diluluskan yang berwarna hijau, dan ditempatkan di daerah yang diluluskan. Bahan baku atau kemasan yang ditolak oleh Unit Quality Control (QC) akan dirobek label karantina dan ditempelkan label ditolak yang berwarna merah serta menempatkannya di daerah ditolak. Khusus bahan baku dan kemasan yang ditolak, Unit Quality Control (QC) harus membuat surat penolakan kepada pemasok dengan menyebutkan alasan penolakan. Barang yang sesuai dengan spesifikasi atau persyaratan selanjutnya disimpan di gudang obat jadi atau bahan baku, dan dibuat berita acara penerimaan barang. Bahan baku, sediaan jadi, maupun kemasan yang disimpan di gudang memiliki kartu stok yang berfungsi sebagai kontrol, dan memudahkan pemeriksaan jika ada kekeliruan. Penyimpanan bahan baku disusun berdasarkan jenis bahan baku, sedangkan untuk bahan baku cair dan beta laktam disimpan terpisah. Untuk penyimpanan kemasan disusun berdasarkan jenis dan bentuknya, sehingga mudah dalam pengambilan maupun penyusunannya. Bahan baku dan kemasan yang tidak tahan pada suhu kamar, disimpan pada ruangan khusus yang dilengkapi dengan AC. Masuknya obat jadi/sediaan jadi di gudang obat jadi diserahkan oleh kepala unit produksi kepada kepala gudang obat jadi. Kemudian kepala gudang obat jadi membuat surat Bukti Penyerahan Hasil Produksi (BPHP) yang menerangkan nama obat jadi, kemasan, jumlah, nomor batch yang ditandatangani oleh kepala gudang obat jadi. Penyimpanan sediaan jadi berdasarkan bentuk sediaan guna memudahkan dalam pencarian. Jadi untuk proses administrasi,
43 masing-masing kepala gudang tersebut membuat laporan masuk atau keluarnya bahan baku, obat jadi, dan kemasan secara komputerisasi maupun manual Limbah Limbah Non Beta Laktam Jenis limbah non beta laktam di PT. MUTIFA ada 3 jenis yaitu: 1. Limbah cair. Limbah cair ini berasal dari limbah produksi, limbah laboratorium, limbah domestik, dan limbah bengkel. Diagram sistem pengolahan limbah cair dapat dilihat pada gambar 4 berikut ini: Limbah. domestik Limbah cair produksi termasuk pembersihan daerah produksi Limbah cair laboratorium Bak Penampungan Bak Sedimentasi Bak Aerasi Bak Biokontrol Badan Air buangan Limbah bengkel cair kecuali oli Oli bekas dari bengkel Dijual Gambar 4. Diagram Sistem Pengolahan Limbah Cair di PT. MUTIFA
44 Tolak ukur yang dipakai untuk pemantauan limbah cair adalah berdasarkan baku mutu air limbah yang diisyaratkan dalam Surat Keputusan Menteri Negara Kependudukan dan Lingkungan Hidup No. 03/Men KLH/II/1991 seperti yang terdapat dalam tabel berikut: Tabel 4. Tolak Ukur Pemantauan Limbah Cair di PT. MUTIFA Parameter BOD (Biological Oxygen Demand) COD (Chemical Oxygen Demand) TSS (Total Suspended Solid) Proses Pembuatan Bahan Formula (mg/l) Formulasi (Pencampuran) (mg/l) Total-N 30 - Fenol 1,0 - ph 6,0-9,0 6,0-9,0 2. Limbah Padat. Limbah padat ini berasal dari: a. Bekas kemasan bahan awal (bahan baku/bahan kemasan) seperti kertas, kotak karton, wadah kayu/plastik/kaca, drum, kaleng. b. Buangan proses produksi seperti tepung sisa proses, produk antara/ruahan yang rusak atau kotor, kemasan (aluminium foil, botol, dus, dll). c. Buangan bahan hasil pengujian laboratorium seperti tablet bekas pengujian kekerasan, waktu hancur, dll. d. Bahan awal yang rusak. e. Produk obat jadi yang rusak. f. Wadah bekas bahan produksi (plastik, tong rusak, dll).
45 g. Limbah padat domestik. Tolak ukur yang dipakai untuk pemantauan limbah padat adalah kualitas lingkungan atau kebersihan di dalam area industri, dimana tidak terdapat lagi limbah padat yang berserakan di pabrik. Diagram sistem pengolahan limbah padat di PT. MUTIFA adalah sebagai berikut: Debu Produksi Dust Collector Debu Lantai Vacum Cleaner Limbah Domestik Bahan baku, Produk antara, Produk ruahan, dan Produk jadi yang rusak Incenerator Tong/Karton Aluminum foil, Botol, Pot plastik yang rusak atau sisa cetakan lama Pembuangan terakhir milik PEMDA Kertas karton & plastik tanpa label pabrik, Botol rusak Kemasan bahan awal yang rusak Dijual Gambar 5. Diagram Sistem Pengolahan Limbah Padat di PT. MUTIFA 3. Limbah Udara. Limbah udara ini berasal dari a. gas, uap dan asap. - bahan kimia / reagensia. - bahan baku seperti ammonia liquida, alkohol, dll.
46 - proses produksi seperti metilen klorida dari proses coating - pembakaran zat padat. - asap pembakaran sampah b. debu produksi. Tolak ukur yang dipakai untuk pamantauan limbah udara adalah kualitas udara di dalam dan di luar lingkungan pabrik, meliputi kadar H 2 S, NH 2, SO 2, CO, NO 2, TSP. Sistem penanggulangan limbah udara antara lain tertera pada tabel berikut: Tabel 5. Sistem Penanggulangan Limbah Udara Jenis 1.Bahan kimia/reagensia laboratorium 2. Asap pembakaran sampah 3. Uap solven 4. Debu Produksi Cara Pengendalian 1. Lemari Asam 2. Incenerator cerobong tinggi 3. Exhaust fan 4. Pemasangan dust collector 4. Limbah Suara. Limbah suara ini berasal dari mesin produksi, genset, mesin sistem penunjang (AHU, mesin boiler). Cara pengendalian limbah suara ini dapat diatasi dengan menggunakan ear insert oleh pekerja. Tolak ukur yang digunakan untuk pemantaun limbah suara adalah angka kebisingan dan getaran di dalam dan di luar area pabrik yang diukur sesuai dengan angka kebisingan maksimum 65 db dan getaran maksimum 7,5 Hz Limbah Beta Laktam Jenis limbah beta laktam dapat berupa limbah cair, padat,udara, dan suara. Limbah cair berasal dari gedung produksi beta laktam berupa pencucian
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI PT. MUTIFA MEDAN
 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. MUTIFA MEDAN Disusun Oleh : Miss Naimah Abdunroni, S. Farm. 083202053 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2010 Lembar Pengesahan LAPORAN
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. MUTIFA MEDAN Disusun Oleh : Miss Naimah Abdunroni, S. Farm. 083202053 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2010 Lembar Pengesahan LAPORAN
BAB II TINJAUAN PUSTAKA. (CPOB). Hal ini didasarkan oleh Keputusan Menteri Kesehatan RI.
 BAB II TINJAUAN PUSTAKA Industri farmasi diwajibkan menerapkan Cara Pembuatan Obat yang Baik (CPOB). Hal ini didasarkan oleh Keputusan Menteri Kesehatan RI. No.43/MENKES/SK/II/1988 tentang CPOB dan Keputusan
BAB II TINJAUAN PUSTAKA Industri farmasi diwajibkan menerapkan Cara Pembuatan Obat yang Baik (CPOB). Hal ini didasarkan oleh Keputusan Menteri Kesehatan RI. No.43/MENKES/SK/II/1988 tentang CPOB dan Keputusan
GAMBARAN UMUM PERUSAHAAN
 BAB II GAMBARAN UMUM PERUSAHAAN 2.1. Sejarah Pada tahun 1975, didirikan Industri Farmasi di Kota Medan dengan nama Sejati Pharmaceutical Industries, yang memproduksi obat merek SIAGOGO. Setelah beberapa
BAB II GAMBARAN UMUM PERUSAHAAN 2.1. Sejarah Pada tahun 1975, didirikan Industri Farmasi di Kota Medan dengan nama Sejati Pharmaceutical Industries, yang memproduksi obat merek SIAGOGO. Setelah beberapa
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Mutiara Mukti Farma (MUTIFA) Medan
 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Mutiara Mukti Farma (MUTIFA) Medan Disusun oleh : Janti Kosman, S. Farm NIM 073202044 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2008 KATA PENGANTAR
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Mutiara Mukti Farma (MUTIFA) Medan Disusun oleh : Janti Kosman, S. Farm NIM 073202044 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2008 KATA PENGANTAR
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Mutiara Mukti Farma (MUTIFA) Medan. Dewi Lumban Batu, S. Farm NIM
 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Mutiara Mukti Farma (MUTIFA) Medan Disusun oleh : Dewi Lumban Batu, S. Farm NIM 073202015 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2008 Lembar
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Mutiara Mukti Farma (MUTIFA) Medan Disusun oleh : Dewi Lumban Batu, S. Farm NIM 073202015 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2008 Lembar
BAB II TINJAUAN PUSTAKA
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 tentang Ketentuan dan Tata cara Pelaksanaan Pemberian Izin Usaha
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 tentang Ketentuan dan Tata cara Pelaksanaan Pemberian Izin Usaha
BAB II TINJAUAN UMUM INDUSTRI FARMASI. (BUMN) dibentuk sebagai Perusahaan Perseroan pada tanggal 16 Agustus
 BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Tinjauan PT. Kimia Farma (Persero) Tbk. 2.1.1 Sejarah Perusahaan. PT. Kimia Farma (Persero) Tbk. sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan
BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Tinjauan PT. Kimia Farma (Persero) Tbk. 2.1.1 Sejarah Perusahaan. PT. Kimia Farma (Persero) Tbk. sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI PT. MUTIARA MUKTI FARMA (MUTIFA) MEDAN
 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. MUTIARA MUKTI FARMA (MUTIFA) MEDAN Disusun Oleh: Nelli Purba, S.Farm. NIM 083202142 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. MUTIARA MUKTI FARMA (MUTIFA) MEDAN Disusun Oleh: Nelli Purba, S.Farm. NIM 083202142 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS
BAB II TINJAUAN PUSTAKA. Obat Jadi dan Industri Bahan Baku Obat. Definisi dari obat jadi yaitu
 BAB II TINJAUAN PUSTAKA A. Industri Farmasi 1. Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan No. 245/MenKes/SK/V/1990 tentang Ketentuan dan Tata Cara Pelaksanaan Pemberian Izin
BAB II TINJAUAN PUSTAKA A. Industri Farmasi 1. Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan No. 245/MenKes/SK/V/1990 tentang Ketentuan dan Tata Cara Pelaksanaan Pemberian Izin
BAB II TINJAUAN PUSTAKA. menurut Peraturan Menteri Kesehatan RI No. 1799/Menkes/Per/XII/2010 tentang Industri Farmasi adalah badan usaha yang
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Peraturan Menteri Kesehatan RI No. 1799/Menkes/Per/XII/2010 tentang Industri Farmasi adalah badan
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Peraturan Menteri Kesehatan RI No. 1799/Menkes/Per/XII/2010 tentang Industri Farmasi adalah badan
BAB II TINJAUAN UMUM. Universitas Sumatera Utara
 BAB II TINJAUAN UMUM 2.1 Industri Farmasi Industri farmasi adalah industri obat jadi dan industri bahan baku obat. Industri farmasi sebagai industri penghasil obat, dituntut untuk dapat menghasilkan obat
BAB II TINJAUAN UMUM 2.1 Industri Farmasi Industri farmasi adalah industri obat jadi dan industri bahan baku obat. Industri farmasi sebagai industri penghasil obat, dituntut untuk dapat menghasilkan obat
BAB II TINJAUAN PUSTAKA. Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri obat jadi dan
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri
LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI PT. KIMIA FARMA PLANT MEDAN
 LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI DI PT. KIMIA FARMA PLANT MEDAN DISUSUN OLEH : ERNITA, S. Farm 093202016 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN
LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI DI PT. KIMIA FARMA PLANT MEDAN DISUSUN OLEH : ERNITA, S. Farm 093202016 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN
BAB II TINJAUAN PUSTAKA. Industri farmasi menurut SK Menkes No. 245/Menkes/SK/V/1990 adalah
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi Industri farmasi menurut SK Menkes No. 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri obat jadi adalah industri yang
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi Industri farmasi menurut SK Menkes No. 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri obat jadi adalah industri yang
BAB II TINJAUAN PUSTAKA. Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri obat jadi dan
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri
BAB II TINJAUAN PUSTAKA. Industri farmasi menurut Peraturan Menteri Kesehatan RI No.
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Peraturan Menteri Kesehatan RI No. 1799/Menkes/Per/XII/2010 tentang Industri Farmasi adalah badan
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Peraturan Menteri Kesehatan RI No. 1799/Menkes/Per/XII/2010 tentang Industri Farmasi adalah badan
BAB II TINJAUAN PUSTAKA
 BAB II TINJAUAN PUSTAKA 2.1 Pengertian Industri Farmasi. Industri farmasi menurut Surat Keputusan Menteri Kesehatan Nomor. 245/Menkes/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri
BAB II TINJAUAN PUSTAKA 2.1 Pengertian Industri Farmasi. Industri farmasi menurut Surat Keputusan Menteri Kesehatan Nomor. 245/Menkes/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri
BAB II TINJAUAN PUSTAKA. Industri farmasi menurut SK Menkes No. 245/Menkes/SK/V/1990
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut SK Menkes No. 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut SK Menkes No. 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI. PT. Kimia Farma (Persero) Tbk Plant Medan
 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Kimia Farma (Persero) Tbk Plant Medan Disusun Oleh : Astrie Rezky, S. Farm. 093202004 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2010 Lembar
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Kimia Farma (Persero) Tbk Plant Medan Disusun Oleh : Astrie Rezky, S. Farm. 093202004 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2010 Lembar
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI DI PT. KIMIA FARMA (PERSERO) Tbk PLANT MEDAN
 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI DI PT. KIMIA FARMA (PERSERO) Tbk PLANT MEDAN DISUSUN OLEH : SRI ROMAITO HASIBUAN, S.Farm 093202065 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI DI PT. KIMIA FARMA (PERSERO) Tbk PLANT MEDAN DISUSUN OLEH : SRI ROMAITO HASIBUAN, S.Farm 093202065 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS
BAB II TINJAUAN UMUM INDUSTRI FARMASI. Lembaga Farmasi Direktorat Kesehatan Angkatan Darat (Lafi Ditkesad)
 BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Perkembangan Lafi Ditkesad Lembaga Farmasi Direktorat Kesehatan Angkatan Darat (Lafi Ditkesad) merupakan lembaga yang telah ada sejak zaman penjajahan Belanda.
BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Perkembangan Lafi Ditkesad Lembaga Farmasi Direktorat Kesehatan Angkatan Darat (Lafi Ditkesad) merupakan lembaga yang telah ada sejak zaman penjajahan Belanda.
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI. PT. Mutiara Mukti Farma (MUTIFA) Medan
 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Mutiara Mukti Farma (MUTIFA) Medan Disusun oleh : Teuku Mirza, S. Farm NIM 083202086 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2009 LEMBAR
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Mutiara Mukti Farma (MUTIFA) Medan Disusun oleh : Teuku Mirza, S. Farm NIM 083202086 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2009 LEMBAR
BAB II TINJAUAN PUSTAKA
 BAB II TINJAUAN PUSTAKA 2.1. Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia No.245 /Menkes/VI/1990, industri farmasi adalah industri obat jadi dan industri
BAB II TINJAUAN PUSTAKA 2.1. Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia No.245 /Menkes/VI/1990, industri farmasi adalah industri obat jadi dan industri
BAB II TINJAUAN PUSTAKA. Industri Farmasi menurut Peraturan Menteri Kesehatan RI Nomor
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri Farmasi menurut Peraturan Menteri Kesehatan RI Nomor 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki izin
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri Farmasi menurut Peraturan Menteri Kesehatan RI Nomor 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki izin
BAB II TINJAUAN PUSTAKA. Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri obat jadi dan
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri
BAB II TINJAUAN UMUM INDUSTRI FARMASI. Belanda, pada tahun 1958 pemerintah melebur sejumlah perusahaan farmasi
 BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Sejarah PT. Kimia Farma (Persero) Tbk. Sejalan dengan kebijakan nasionalisasi bekas perusahaan-perusahaan Belanda, pada tahun 1958 pemerintah melebur sejumlah
BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Sejarah PT. Kimia Farma (Persero) Tbk. Sejalan dengan kebijakan nasionalisasi bekas perusahaan-perusahaan Belanda, pada tahun 1958 pemerintah melebur sejumlah
BAB III KEGIATAN DI INDUSTRI FARMASI P.T. KIMIA FARMA (PERSERO) TBK. PLANT MEDAN
 BAB III KEGIATAN DI INDUSTRI FARMASI P.T. KIMIA FARMA (PERSERO) TBK. PLANT MEDAN 3.1 Keterlibatan Dalam Produksi Praktek Kerja Profesi Apoteker di P.T. Kimia Farma (Persero) Tbk. Plant Medan, dilaksanakan
BAB III KEGIATAN DI INDUSTRI FARMASI P.T. KIMIA FARMA (PERSERO) TBK. PLANT MEDAN 3.1 Keterlibatan Dalam Produksi Praktek Kerja Profesi Apoteker di P.T. Kimia Farma (Persero) Tbk. Plant Medan, dilaksanakan
BAB II TINJAUAN PUSTAKA. Gudang merupakan sarana pendukung kegiatan produksi industri farmasi
 BAB II TINJAUAN PUSTAKA 2.1 Definisi Gudang merupakan sarana pendukung kegiatan produksi industri farmasi yang berfungsi untuk menyimpan bahan baku, bahan kemas dan obat jadi yang belum didistribusikan.
BAB II TINJAUAN PUSTAKA 2.1 Definisi Gudang merupakan sarana pendukung kegiatan produksi industri farmasi yang berfungsi untuk menyimpan bahan baku, bahan kemas dan obat jadi yang belum didistribusikan.
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI PT. UNIVERSAL PHARMACEUTICAL INDUSTRIES MEDAN
 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. UNIVERSAL PHARMACEUTICAL INDUSTRIES MEDAN Disusun oleh: KATARIN SITOMPUL, S.Farm NIM 093202039 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. UNIVERSAL PHARMACEUTICAL INDUSTRIES MEDAN Disusun oleh: KATARIN SITOMPUL, S.Farm NIM 093202039 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI
BAB II TINJAUAN PUSTAKA. Indonesia Nomor 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat.
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat.
Industri farmasi menurut Surat Keputusan Menteri Kesehatan Nomor. 245/Menkes/V/1990 adalah industri obat jadi dan industri bahan baku obat.
 BAB II TINJAUAN PUSTAKA 2.1. Pengertian Industri Farmasi. Industri farmasi menurut Surat Keputusan Menteri Kesehatan Nomor. 245/Menkes/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri
BAB II TINJAUAN PUSTAKA 2.1. Pengertian Industri Farmasi. Industri farmasi menurut Surat Keputusan Menteri Kesehatan Nomor. 245/Menkes/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri
BAB II TINJAUAN UMUM. Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik
 BAB II TINJAUAN UMUM 2.1 Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat.
BAB II TINJAUAN UMUM 2.1 Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat.
B. Tujuan Tujuan Qualiy Assurance adalah untuk memastikan bahwa obat dihasilkan dengan mutu yang sesuai dengan tujuan pemakaiannya.
 PEMASTIAN MUTU (QUALITY ASSURANCE/QA) A. Pendahuluan Industri farmasi bertujuan untuk menghasilkan obat yang harus memenuhi persyaratan khasiat (efficacy), keamanan (safety) dan mutu (quality). Berdasarkan
PEMASTIAN MUTU (QUALITY ASSURANCE/QA) A. Pendahuluan Industri farmasi bertujuan untuk menghasilkan obat yang harus memenuhi persyaratan khasiat (efficacy), keamanan (safety) dan mutu (quality). Berdasarkan
BAB II TINJAUAN PUSTAKA. Industri farmasi adalah industri obat jadi dan industri bahan baku obat.
 BAB II TINJAUAN PUSTAKA A. Industri Farmasi Industri farmasi adalah industri obat jadi dan industri bahan baku obat. Industri farmasi sebagai industri penghasil obat, dituntut untuk dapat menghasilkan
BAB II TINJAUAN PUSTAKA A. Industri Farmasi Industri farmasi adalah industri obat jadi dan industri bahan baku obat. Industri farmasi sebagai industri penghasil obat, dituntut untuk dapat menghasilkan
BAB II TINJAUAN UMUM INDUSTRI. 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki izin dari menteri
 BAB II TINJAUAN UMUM INDUSTRI 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri Farmasi menurut Peraturan Menteri Kesehatan RI Nomor 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki
BAB II TINJAUAN UMUM INDUSTRI 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri Farmasi menurut Peraturan Menteri Kesehatan RI Nomor 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki
KATA PENGANTAR QUALITY CONTROL
 KATA PENGANTAR Assalamu alaikum, wr, wb, Segala Puji senantiasa kami panjatkan kehadirat Allah SWT beserta junjungan kita Nabi Besar Muhammad Rasulullah S.A.W yang telah melimpahkan rahmat, berkah, dan
KATA PENGANTAR Assalamu alaikum, wr, wb, Segala Puji senantiasa kami panjatkan kehadirat Allah SWT beserta junjungan kita Nabi Besar Muhammad Rasulullah S.A.W yang telah melimpahkan rahmat, berkah, dan
BAB II TINJAUAN PUSTAKA. Obat Jadi dan Industri Bahan Baku Obat. Definisi dari obat jadi yaitu
 BAB II TINJAUAN PUSTAKA A. Industri Farmasi 1. Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan No. 245/MenKes/SK/V/1990 tentang Ketentuan dan Tata Cara Pelaksanaan Pemberian Izin
BAB II TINJAUAN PUSTAKA A. Industri Farmasi 1. Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan No. 245/MenKes/SK/V/1990 tentang Ketentuan dan Tata Cara Pelaksanaan Pemberian Izin
KEPUTUSAN MENTERI KESEHATAN REPUBLIK INDONESIA NOMOR : 965/MENKES/SK/XI/1992 TENTANG
 KEPUTUSAN MENTERI KESEHATAN NOMOR : 965/MENKES/SK/XI/1992 TENTANG CARA PRODUKSI KOSMETIKA YANG BAIK MENTERI KESEHATAN, Menimbang : a. bahwa langkah utama untuk menjamin keamanan kosmetika adalah penerapan
KEPUTUSAN MENTERI KESEHATAN NOMOR : 965/MENKES/SK/XI/1992 TENTANG CARA PRODUKSI KOSMETIKA YANG BAIK MENTERI KESEHATAN, Menimbang : a. bahwa langkah utama untuk menjamin keamanan kosmetika adalah penerapan
Tugas Individu Farmasi Industri. Uraian Tugas Kepala Bagian Produksi, Pengawasan Mutu dan Pemastian Mutu
 Tugas Individu Farmasi Industri Uraian Tugas Kepala Bagian Produksi, Pengawasan Mutu dan Pemastian Mutu Disusun Oleh : Eka Wahyu Lestari 14340004 Dosen : Drs. Kosasih, M.Sc., Apt. Program Profesi Apoteker
Tugas Individu Farmasi Industri Uraian Tugas Kepala Bagian Produksi, Pengawasan Mutu dan Pemastian Mutu Disusun Oleh : Eka Wahyu Lestari 14340004 Dosen : Drs. Kosasih, M.Sc., Apt. Program Profesi Apoteker
BAB II TINJAUAN UMUM INDUSTRI. 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki izin dari menteri
 BAB II TINJAUAN UMUM INDUSTRI 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri Farmasi menurut Peraturan Menteri Kesehatan RI Nomor 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki
BAB II TINJAUAN UMUM INDUSTRI 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri Farmasi menurut Peraturan Menteri Kesehatan RI Nomor 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki
LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI PT. SANBE FARMA UNIT II CIMAHI
 LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI di PT. SANBE FARMA UNIT II CIMAHI Disusun Oleh : Syabrina Naulita Pane, S.Farm. NIM 093202066 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS
LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI di PT. SANBE FARMA UNIT II CIMAHI Disusun Oleh : Syabrina Naulita Pane, S.Farm. NIM 093202066 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS
BAB II TINJAUAN UMUM INDUSTRI FARMASI. mendapatkan sertifikat Cara Pembuatan Obat yang Baik pada tahun Saat ini
 BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1. Sejarah PT. Universal Pharmaceutical Industries didirikan pada tahun 1975 dan mendapatkan sertifikat Cara Pembuatan Obat yang Baik pada tahun 1995. Saat ini dalam
BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1. Sejarah PT. Universal Pharmaceutical Industries didirikan pada tahun 1975 dan mendapatkan sertifikat Cara Pembuatan Obat yang Baik pada tahun 1995. Saat ini dalam
BAB II TINJAUAN UMUM PT. COMBIPHAR. bawah pengelolaan Drs. Handoko Prayogo, Apt. Berawal dari industri rumah
 BAB II TINJAUAN UMUM PT. COMBIPHAR 2.1 Sejarah Perkembangan PT. Combiphar PT. Combiphar didirikan pada tahun 1971 di Jl. Sukabumi 61 Bandung, di bawah pengelolaan Drs. Handoko Prayogo, Apt. Berawal dari
BAB II TINJAUAN UMUM PT. COMBIPHAR 2.1 Sejarah Perkembangan PT. Combiphar PT. Combiphar didirikan pada tahun 1971 di Jl. Sukabumi 61 Bandung, di bawah pengelolaan Drs. Handoko Prayogo, Apt. Berawal dari
Tugas dan tanggungjawab Quality Assurance (QA) / Jaminan Mutu
 Tugas dan tanggungjawab Quality Assurance (QA) / Jaminan Mutu Departemen QA merupakan departemen yang bertanggung jawab antara lain : a) Audit internal QA melakukan evaluasi kerja kesemua bagian/departemen
Tugas dan tanggungjawab Quality Assurance (QA) / Jaminan Mutu Departemen QA merupakan departemen yang bertanggung jawab antara lain : a) Audit internal QA melakukan evaluasi kerja kesemua bagian/departemen
BAB 2 GAMBARAN UMUM OBJEK
 BAB 2 GAMBARAN UMUM OBJEK 2.1 Sejarah Singkat Berdirinya PT. Metiska Farma PT. Metiska Farma didirikan pada tahun 1970, atas prakarsa Bapak Memet Tanuwijaya, Bapak Ismail dan Bapak Karim Johan, yang pada
BAB 2 GAMBARAN UMUM OBJEK 2.1 Sejarah Singkat Berdirinya PT. Metiska Farma PT. Metiska Farma didirikan pada tahun 1970, atas prakarsa Bapak Memet Tanuwijaya, Bapak Ismail dan Bapak Karim Johan, yang pada
CPOB. (Cara Pembuatan Obat yang Baik)
 CPOB { (Cara Pembuatan Obat yang Baik) CPOB (Cara Pembuatan Obat Yang Baik) 2006 atau GMP (Good Manufacturing Practices) 2006 adalah suatu pedoman pembuatan obat berdasarkan berbagai ketentuan dalam CPOB
CPOB { (Cara Pembuatan Obat yang Baik) CPOB (Cara Pembuatan Obat Yang Baik) 2006 atau GMP (Good Manufacturing Practices) 2006 adalah suatu pedoman pembuatan obat berdasarkan berbagai ketentuan dalam CPOB
Produksi di Industri Farmasi
 Produksi di Industri Farmasi PRODUKSI istilah terkait Pembuatan Seluruh rangkaian kegiatan dalam menghasilkan suatu obat, meliputi produksi dan pengawasan mutu, mulai dari pengadaan bahan awal dan bahan
Produksi di Industri Farmasi PRODUKSI istilah terkait Pembuatan Seluruh rangkaian kegiatan dalam menghasilkan suatu obat, meliputi produksi dan pengawasan mutu, mulai dari pengadaan bahan awal dan bahan
PT. Universal Pharmaceutical Industries Medan
 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Universal Pharmaceutical Industries Medan Disusun oleh: Chairunnisya Arief, S. Farm. 073202011 Ratna Aurora, S. Farm. 073202075 Sumantri S, S. Farm.
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Universal Pharmaceutical Industries Medan Disusun oleh: Chairunnisya Arief, S. Farm. 073202011 Ratna Aurora, S. Farm. 073202075 Sumantri S, S. Farm.
Lampiran 1. Bagan proses Pembuatan Krim
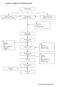 Lampiran 1. Bagan proses Pembuatan Krim Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph -Stabilitas krim Pencampuran Dengan
Lampiran 1. Bagan proses Pembuatan Krim Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph -Stabilitas krim Pencampuran Dengan
BAB II TINJAUAN PUSTAKA. yang berfungsi untuk menyimpan bahan baku, bahan kemas, dan obat jadi yang
 BAB II TINJAUAN PUSTAKA 2.1 Definisi Gudang merupakan sarana pendukung kegiatan produksi industri farmasi yang berfungsi untuk menyimpan bahan baku, bahan kemas, dan obat jadi yang belum didistribusikan.
BAB II TINJAUAN PUSTAKA 2.1 Definisi Gudang merupakan sarana pendukung kegiatan produksi industri farmasi yang berfungsi untuk menyimpan bahan baku, bahan kemas, dan obat jadi yang belum didistribusikan.
Lampiran 1. Bagan proses Pembuatan Krim
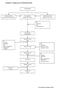 Lampiran 1. Bagan proses Pembuatan Krim Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph -Stabilitas krim Pencampuran Dengan
Lampiran 1. Bagan proses Pembuatan Krim Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph -Stabilitas krim Pencampuran Dengan
UNIVERSITAS INDONESIA
 UNIVERSITAS INDONESIA LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. SYDNA FARMA JL. RC. VETERAN NO. 89 BINTARO, JAKARTA SELATAN PERIODE 1 APRIL 3 JUNI 2013 LAPORAN PRAKTEK KERJA PROFESI APOTEKER KARTIKA
UNIVERSITAS INDONESIA LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. SYDNA FARMA JL. RC. VETERAN NO. 89 BINTARO, JAKARTA SELATAN PERIODE 1 APRIL 3 JUNI 2013 LAPORAN PRAKTEK KERJA PROFESI APOTEKER KARTIKA
(BUMN) dibentuk sebagai Perusahaan Perseroan pada tanggal 16 Agustus Sejak berdirinya hingga sekarang ini PT. Kimia Farma (Persero) Tbk.
 BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Tinjauan PT. Kimia Farma (Persero) Tbk. 2.1.1 Sejarah Perusahaan. PT. Kimia Farma (Persero) Tbk. sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan
BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Tinjauan PT. Kimia Farma (Persero) Tbk. 2.1.1 Sejarah Perusahaan. PT. Kimia Farma (Persero) Tbk. sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan
Lampiran 1. Bagan proses Pembuatan Krim
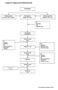 Lampiran 1. Bagan proses Pembuatan Krim Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph -Stabilitas krim Pencampuran Dengan
Lampiran 1. Bagan proses Pembuatan Krim Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph -Stabilitas krim Pencampuran Dengan
BAB II TINJAUAN UMUM PT. COMBIPHAR. PT. Combiphar didirikan pada tahun 1971 di Jl. Sukabumi no. 61,
 BAB II TINJAUAN UMUM PT. COMBIPHAR 2.1 Sejarah Perkembangan PT. Combiphar PT. Combiphar didirikan pada tahun 1971 di Jl. Sukabumi no. 61, Bandung di bawah pengelolaan Drs. Handoko Prayogo, Apt. Berawal
BAB II TINJAUAN UMUM PT. COMBIPHAR 2.1 Sejarah Perkembangan PT. Combiphar PT. Combiphar didirikan pada tahun 1971 di Jl. Sukabumi no. 61, Bandung di bawah pengelolaan Drs. Handoko Prayogo, Apt. Berawal
UNIVERSITAS INDONESIA
 UNIVERSITAS INDONESIA LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. COMBIPHAR JL. RAYA SIMPANG NO. 383 PADALARANG BANDUNG PERIODE 07 MARET 01 APRIL 2011 LAPORAN PRAKTEK KERJA PROFESI APOTEKER MOCHAMAD
UNIVERSITAS INDONESIA LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. COMBIPHAR JL. RAYA SIMPANG NO. 383 PADALARANG BANDUNG PERIODE 07 MARET 01 APRIL 2011 LAPORAN PRAKTEK KERJA PROFESI APOTEKER MOCHAMAD
Oleh : Bambang Priyambodo
 Oleh : Bambang Priyambodo SISTEMATIKA CPOB: 2012 merupakan penyempurnaan dari CPOB: 2006, mencakup revisi terhadap : Pedoman CPOB: 2006 Suplemen I Pedoman CPOB: 2006 tahun 2009 Aneks 8 : Cara Pembuatan
Oleh : Bambang Priyambodo SISTEMATIKA CPOB: 2012 merupakan penyempurnaan dari CPOB: 2006, mencakup revisi terhadap : Pedoman CPOB: 2006 Suplemen I Pedoman CPOB: 2006 tahun 2009 Aneks 8 : Cara Pembuatan
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT BANDUNG
 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT BANDUNG Disusun Oleh : Eka Saputra, S. Farm. 073202020 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT BANDUNG Disusun Oleh : Eka Saputra, S. Farm. 073202020 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA
BAB I PENDAHULUAN. Kesehatan merupakan kebutuhan terpenting bagi manusia sehingga
 BAB I PENDAHULUAN A. Latar Belakang Kesehatan merupakan kebutuhan terpenting bagi manusia sehingga berbagai usaha dilakukan untuk memperoleh tubuh yang sehat. Mulai dari melakukan olah raga, hidup secara
BAB I PENDAHULUAN A. Latar Belakang Kesehatan merupakan kebutuhan terpenting bagi manusia sehingga berbagai usaha dilakukan untuk memperoleh tubuh yang sehat. Mulai dari melakukan olah raga, hidup secara
LAPORAN PRAKTEK KERJA PROFESI APOTEKER FARMASI INDUSTRI
 LAPORAN PRAKTEK KERJA PROFESI APOTEKER FARMASI INDUSTRI LAPORAN PRAKTEK KERJA PROFESI APOTEKER FARMASI INDUSTRI di LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT (LAFI DITKESAD) PERIODE 01 30 NOVEMBER
LAPORAN PRAKTEK KERJA PROFESI APOTEKER FARMASI INDUSTRI LAPORAN PRAKTEK KERJA PROFESI APOTEKER FARMASI INDUSTRI di LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT (LAFI DITKESAD) PERIODE 01 30 NOVEMBER
LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. CORONET CROWN JL. RAYA TAMAN Km 15 SEPANJANG - SIDOARJO (12 16 DESEMBER 2011) PERIODE XXXVII
 LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. CORONET CROWN JL. RAYA TAMAN Km 15 SEPANJANG - SIDOARJO (12 16 DESEMBER 2011) PERIODE XXXVII PROGRAM PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS KATOLIK
LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. CORONET CROWN JL. RAYA TAMAN Km 15 SEPANJANG - SIDOARJO (12 16 DESEMBER 2011) PERIODE XXXVII PROGRAM PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS KATOLIK
2016, No Mengingat : 1. Undang-Undang Nomor 8 Tahun 1999 tentang Perlindungan Konsumen (Lembaran Negara Republik Indonesia Tahun 1999 Nomor 42,
 BERITA NEGARA REPUBLIK INDONESIA No.880, 2016 BPOM. Industri Kosmetika Gol. B. Higiene Sanitasi. Dokumen. Penerapan. Pedoman. PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR 11
BERITA NEGARA REPUBLIK INDONESIA No.880, 2016 BPOM. Industri Kosmetika Gol. B. Higiene Sanitasi. Dokumen. Penerapan. Pedoman. PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR 11
ABSTRAK. Keywords: pemastian mutu, CPOB produksi, in-process control
 ABSTRAK Pemastian Mutu adalah totalitas semua pengaturan yang dibuat dengan tujuan untuk memastikan bahwa obat dihasilkan dengan mutu yang sesuai dengan tujuan pemakaiannya. Pemastian Mutu mencakup Cara
ABSTRAK Pemastian Mutu adalah totalitas semua pengaturan yang dibuat dengan tujuan untuk memastikan bahwa obat dihasilkan dengan mutu yang sesuai dengan tujuan pemakaiannya. Pemastian Mutu mencakup Cara
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI PT. COMBIPHAR. Jl. RAYA SIMPANG NO. 383 PADALARANG, BANDUNG PERIODE AGUSTUS 2009
 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. COMBIPHAR Jl. RAYA SIMPANG NO. 383 PADALARANG, BANDUNG PERIODE 04-28 AGUSTUS 2009 Disusun Oleh: Nina Octaviana, S.Farm 083202134 PROGRAM PENDIDIKAN
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. COMBIPHAR Jl. RAYA SIMPANG NO. 383 PADALARANG, BANDUNG PERIODE 04-28 AGUSTUS 2009 Disusun Oleh: Nina Octaviana, S.Farm 083202134 PROGRAM PENDIDIKAN
BAB II TINJAUAN UMUM INDUSTRI FARMASI PT. KIMIA FARMA (PERSERO) TBK. PLANT MEDAN
 BAB II TINJAUAN UMUM INDUSTRI FARMASI PT. KIMIA FARMA (PERSERO) TBK. PLANT MEDAN 2.1 Sejarah Perusahaan Kimia Farma adalah perusahaan industri farmasi pertama di Indonesia yang didirikan oleh Pemerintah
BAB II TINJAUAN UMUM INDUSTRI FARMASI PT. KIMIA FARMA (PERSERO) TBK. PLANT MEDAN 2.1 Sejarah Perusahaan Kimia Farma adalah perusahaan industri farmasi pertama di Indonesia yang didirikan oleh Pemerintah
UNIVERSITAS INDONESIA
 UNIVERSITAS INDONESIA LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT ASTRAZENECA INDONESIA CIKARANG SITE JALAN TEKNO RAYA BLOK B1A B1B, CIKARANG, BEKASI JAWA BARAT PERIODE 6 JANUARI 21 FEBRUARI 2014 LAPORAN
UNIVERSITAS INDONESIA LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT ASTRAZENECA INDONESIA CIKARANG SITE JALAN TEKNO RAYA BLOK B1A B1B, CIKARANG, BEKASI JAWA BARAT PERIODE 6 JANUARI 21 FEBRUARI 2014 LAPORAN
BAB II TINJAUAN PUSTAKA. Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia No.
 BAB II TINJAUAN PUSTAKA 2.1 Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia No. 245/Menkes/SK/V/1990, yang dimaksud dengan industri farmasi adalah industri
BAB II TINJAUAN PUSTAKA 2.1 Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia No. 245/Menkes/SK/V/1990, yang dimaksud dengan industri farmasi adalah industri
BAB 1 PENDAHULUAN. Dalam industri manufaktur saat ini sebagian besar proses produksi
 BAB 1 PENDAHULUAN 1.1 Latar Belakang Dalam industri manufaktur saat ini sebagian besar proses produksi dilakukan dengan menggunakan mesin sebagai pengganti tenaga manusia. Dimana dengan menggunakan mesin
BAB 1 PENDAHULUAN 1.1 Latar Belakang Dalam industri manufaktur saat ini sebagian besar proses produksi dilakukan dengan menggunakan mesin sebagai pengganti tenaga manusia. Dimana dengan menggunakan mesin
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI. PT. Universal Pharmaceutical Industri Medan. Disusun oleh: Ratna Aurora, S.
 1 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Universal Pharmaceutical Industri Medan Disusun oleh: Ratna Aurora, S.Farm 073202075 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS
1 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Universal Pharmaceutical Industri Medan Disusun oleh: Ratna Aurora, S.Farm 073202075 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS
LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI. Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung. Disusun Oleh:
 LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung Disusun Oleh: Debora R. Hutagaol, S.Farm. NIM 133202215 Dinda Ayyu Hanjaya, S.Farm. NIM 133202126
LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung Disusun Oleh: Debora R. Hutagaol, S.Farm. NIM 133202215 Dinda Ayyu Hanjaya, S.Farm. NIM 133202126
Lampiran 1. Bagan proses Pembuatan Krim / Salep
 Lampiran 1. Bagan proses Pembuatan Krim / Salep Penimbangan Peleburan bahan D ki (F i k) Pencampuran D lt t Pelarutan zat aktif, P t(f i) ph Pencampuran Identifikasi ph Kadar zat berkhasiat Homogenitas
Lampiran 1. Bagan proses Pembuatan Krim / Salep Penimbangan Peleburan bahan D ki (F i k) Pencampuran D lt t Pelarutan zat aktif, P t(f i) ph Pencampuran Identifikasi ph Kadar zat berkhasiat Homogenitas
MENTERI KESEHATAN REPUBLIK INDONESIA
 KEPUTUSAN MENTERI KESEHATAN NOMOR: 659/MENKES/SK/X/1991 TENTANG CARA PEMBUATAN OBAT TRADISIONAL YANG BAIK MENTERI KESEHATAN Menimbang : a. bahwa untuk membuat obat tradisional yang memenuhi persyaratan
KEPUTUSAN MENTERI KESEHATAN NOMOR: 659/MENKES/SK/X/1991 TENTANG CARA PEMBUATAN OBAT TRADISIONAL YANG BAIK MENTERI KESEHATAN Menimbang : a. bahwa untuk membuat obat tradisional yang memenuhi persyaratan
DOKUMENTASI
 DOKUMENTASI PENDAHULUAN Dokumentasi adalah suatu bukti yang dapat dipercaya pada penerapan/pemenuhan CPOTB. Mutu yang direncanakan adalah satu-satunya solusi untuk mengatasi keluhan yang terkait dengan
DOKUMENTASI PENDAHULUAN Dokumentasi adalah suatu bukti yang dapat dipercaya pada penerapan/pemenuhan CPOTB. Mutu yang direncanakan adalah satu-satunya solusi untuk mengatasi keluhan yang terkait dengan
BAB II TINJAUAN UMUM INDUSTRI FARMASI. (BUMN) dibentuk sebagai Perusahaan Perseroan pada tanggal 16 Agustus 1971.
 BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1. Tinjauan PT. Kimia Farma (Persero) Tbk. 2.1.1. Sejarah Perusahaan. PT.Kimia Farma (Persero) Tbk sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan
BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1. Tinjauan PT. Kimia Farma (Persero) Tbk. 2.1.1. Sejarah Perusahaan. PT.Kimia Farma (Persero) Tbk sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan
LAPORAN PRAKTEK KERJA PROFESI APOTEKER FARMASI INDUSTRI
 LAPORAN PRAKTEK KERJA PROFESI APOTEKER FARMASI INDUSTRI di LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT (LAFI DITKESAD) PERIODE 01 30 NOVEMBER 2010 Disusun oleh: RANI MELINTAN, S.Farm. NIM 093202145
LAPORAN PRAKTEK KERJA PROFESI APOTEKER FARMASI INDUSTRI di LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT (LAFI DITKESAD) PERIODE 01 30 NOVEMBER 2010 Disusun oleh: RANI MELINTAN, S.Farm. NIM 093202145
BAB II TINJAUAN PUSTAKA. Industri Farmasi adalah badan usaha yang memiliki izin dari Menteri
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian industri farmasi Industri Farmasi adalah badan usaha yang memiliki izin dari Menteri Kesehatan untuk melakukan kegiatan pembuatan obat atau
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian industri farmasi Industri Farmasi adalah badan usaha yang memiliki izin dari Menteri Kesehatan untuk melakukan kegiatan pembuatan obat atau
Lampiran 1. Bagan proses Pembuatan Krim
 Lampiran 1. Bagan proses Pembuatan Krim Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph -Stabilitas krim Pencampuran Dengan
Lampiran 1. Bagan proses Pembuatan Krim Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph -Stabilitas krim Pencampuran Dengan
2. KETENTUAN UMUM Obat tradisional Bahan awal Bahan baku Simplisia
 1. PNGERTIAN CPOTB Cara Pembuatan Obat Tradisional yang Baik (CPOTB) meliputi seluruh aspek yang menyangkut pembuatan obat tradisional, Tujuan untuk menjamin agar produk yang dihasilkan senantiasa memenuhi
1. PNGERTIAN CPOTB Cara Pembuatan Obat Tradisional yang Baik (CPOTB) meliputi seluruh aspek yang menyangkut pembuatan obat tradisional, Tujuan untuk menjamin agar produk yang dihasilkan senantiasa memenuhi
(BUMN) dibentuk sebagai Perusahaan Perseroan pada tanggal 16 Agustus Sejak berdirinya hingga sekarang ini PT. Kimia Farma (Persero) Tbk telah
 BAB II TINJAUAN UMUM INDUSTRI FARMASI PT. KIMIA FARMA 2.1 Sejarah Perusahaan. PT.Kimia Farma (Persero) Tbk sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan Perseroan pada tanggal 16
BAB II TINJAUAN UMUM INDUSTRI FARMASI PT. KIMIA FARMA 2.1 Sejarah Perusahaan. PT.Kimia Farma (Persero) Tbk sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan Perseroan pada tanggal 16
BAB II PT. KIMIA FARMA. (BUMN) dibentuk sebagai Perusahaan Perseroan pada tanggal 16 Agustus
 BAB II PT. KIMIA FARMA 2.1 Tinjauan PT. Kimia Farma(Persero) Tbk. 2.1.1 Sejarah Perusahaan. PT.Kimia Farma (Persero) Tbk sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan Perseroan pada
BAB II PT. KIMIA FARMA 2.1 Tinjauan PT. Kimia Farma(Persero) Tbk. 2.1.1 Sejarah Perusahaan. PT.Kimia Farma (Persero) Tbk sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan Perseroan pada
1 dari1717 I. PENDAHULUAN. I. Latar Belakang
 I. PENDAHULUAN I. Latar Belakang Pembinaan terhadap sarana produksi Perbekalan Kesehatan Rumah Tangga dalam rangka pengamanan alat kesehatan dan PKRT seperti yang disebutkan dalam Permenkes 1184/MENKES/PER/IX/2004
I. PENDAHULUAN I. Latar Belakang Pembinaan terhadap sarana produksi Perbekalan Kesehatan Rumah Tangga dalam rangka pengamanan alat kesehatan dan PKRT seperti yang disebutkan dalam Permenkes 1184/MENKES/PER/IX/2004
Quality Control (QC) dan Quality Assurance (QA) Mata Kuliah : Rancangan Produk Industri (2 SKS) Dosen : Kuni Zu aimah B.,S.Farm., M.Farm., Apt.
 Quality Control (QC) dan Quality Assurance (QA) Mata Kuliah : Rancangan Produk Industri (2 SKS) Dosen : Kuni Zu aimah B.,S.Farm., M.Farm., Apt. Industri farmasi harus membuat obat sedemikian rupa agar
Quality Control (QC) dan Quality Assurance (QA) Mata Kuliah : Rancangan Produk Industri (2 SKS) Dosen : Kuni Zu aimah B.,S.Farm., M.Farm., Apt. Industri farmasi harus membuat obat sedemikian rupa agar
2 Presiden Nomor 55 Tahun 2013 (Lembaran Negara Republik Indonesia Tahun 2013 Nomor 125); 3. Peraturan Presiden Nomor 24 Tahun 2010 tentang Kedudukan,
 BERITA NEGARA REPUBLIK INDONESIA No.794, 2014 KEMEN KP. Obat Ikan. Cara Pembuatan. PERATURAN MENTERI KELAUTAN DAN PERIKANAN REPUBLIK INDONESIA NOMOR 24/PERMEN-KP/2014 TENTANG CARA PEMBUATAN OBAT IKAN YANG
BERITA NEGARA REPUBLIK INDONESIA No.794, 2014 KEMEN KP. Obat Ikan. Cara Pembuatan. PERATURAN MENTERI KELAUTAN DAN PERIKANAN REPUBLIK INDONESIA NOMOR 24/PERMEN-KP/2014 TENTANG CARA PEMBUATAN OBAT IKAN YANG
PERSONALIA
 PERSONALIA 1. Persyaratan Umum Jumlah dan Pengetahuan: Memiliki pengetahuan, keterampilan dan kemampuan sesuai dengan tugasnya. Mempunyai sikap dan kesadaran yang tinggi untuk melaksanakan Cara Pembuatan
PERSONALIA 1. Persyaratan Umum Jumlah dan Pengetahuan: Memiliki pengetahuan, keterampilan dan kemampuan sesuai dengan tugasnya. Mempunyai sikap dan kesadaran yang tinggi untuk melaksanakan Cara Pembuatan
Lampiran 1. Bagan proses Pembuatan Krim
 Lampiran 1. Bagan proses Pembuatan Krim Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph -Stabilitas krim Pencampuran Dengan
Lampiran 1. Bagan proses Pembuatan Krim Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph -Stabilitas krim Pencampuran Dengan
BAB III TINJAUAN PT. KIMIA FARMA (PERSERO) TBK. PLANT MEDAN. PT. Kimia Farma (Persero) Tbk. Plant Medan memiliki personalia
 BAB III TINJAUAN PT. KIMIA FARMA (PERSERO) TBK. PLANT MEDAN 3.1 Aspek Personalia PT. Kimia Farma (Persero) Tbk. Plant Medan memiliki personalia sebanyak 64 orang dengan berbagai pendidikan, ketrampilan,
BAB III TINJAUAN PT. KIMIA FARMA (PERSERO) TBK. PLANT MEDAN 3.1 Aspek Personalia PT. Kimia Farma (Persero) Tbk. Plant Medan memiliki personalia sebanyak 64 orang dengan berbagai pendidikan, ketrampilan,
BAB II TINJAUAN UMUM PT. PRADJA PHARIN (PRAFA) mengalami perkembangan pesat. PT. Prafa didirikan pada tahun 1960 oleh Tjipto
 BAB II TINJAUAN UMUM PT. PRADJA PHARIN (PRAFA) 2.1 Sejarah dan Perkembangan Perusahaan PT. Prafa merupakan salah satu perusahaan farmasi Indonesia yang mengalami perkembangan pesat. PT. Prafa didirikan
BAB II TINJAUAN UMUM PT. PRADJA PHARIN (PRAFA) 2.1 Sejarah dan Perkembangan Perusahaan PT. Prafa merupakan salah satu perusahaan farmasi Indonesia yang mengalami perkembangan pesat. PT. Prafa didirikan
Lampiran 1. Bagan proses Pembuatan Krim / Salep
 Lampiran 1. Bagan proses Pembuatan Krim / Salep Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph -Stabilitas krim Pencampuran
Lampiran 1. Bagan proses Pembuatan Krim / Salep Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph -Stabilitas krim Pencampuran
BAB 1 PENDAHULUAN. yang terdepan, suatu industri harus mampu mengoptimalkan produksinya dalam
 1 BAB 1 PENDAHULUAN 1.1 Latar Belakang Masalah Pada zaman sekarang ini, dengan semakin banyaknya industri baru yang muncul menjadikan persaingan antar industri semakin ketat. Sehingga, untuk menjadi yang
1 BAB 1 PENDAHULUAN 1.1 Latar Belakang Masalah Pada zaman sekarang ini, dengan semakin banyaknya industri baru yang muncul menjadikan persaingan antar industri semakin ketat. Sehingga, untuk menjadi yang
BAB 1 MANAJEMEN MUTU
 Lampiran Peraturan Kepala Badan Pengawas Obat dan Makanan Nomor HK.03.1.23.06.11.5629 Tahun 2011 BAB 1 MANAJEMEN MUTU PRINSIP Industri obat tradisional harus membuat obat tradisional sedemikian rupa agar
Lampiran Peraturan Kepala Badan Pengawas Obat dan Makanan Nomor HK.03.1.23.06.11.5629 Tahun 2011 BAB 1 MANAJEMEN MUTU PRINSIP Industri obat tradisional harus membuat obat tradisional sedemikian rupa agar
LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI
 LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI di LEMBAGA FARMASI ANGKATAN UDARA (LAFIAU) Drs. ROOSTYAN EFFENDIE, Apt Disusun Oleh : Ratna susanti,s.fram 083202066 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS
LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI di LEMBAGA FARMASI ANGKATAN UDARA (LAFIAU) Drs. ROOSTYAN EFFENDIE, Apt Disusun Oleh : Ratna susanti,s.fram 083202066 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS
LAMPIRAN 1 DENAH PT. OTTO PHARMACEUTICAL INDUSTRIES
 LAMPIRAN 1 DENAH PT. OTTO PHARMACEUTICAL INDUSTRIES 78 Direktur Utama Divisi Pemasaran Produksi Direktur Pemasaran Divisi Pengembangan Bisnis Logistik Divisi Pabrik Ass. Pabrik Umum Divisi Manajemen Mutu
LAMPIRAN 1 DENAH PT. OTTO PHARMACEUTICAL INDUSTRIES 78 Direktur Utama Divisi Pemasaran Produksi Direktur Pemasaran Divisi Pengembangan Bisnis Logistik Divisi Pabrik Ass. Pabrik Umum Divisi Manajemen Mutu
BAB III CARA PEMBUATAN OBAT YANG BAIK (CPOB) dibuat secara konsisten, memenuhi persyaratan yang ditetapkan dan sesuai dengan
 BAB III CARA PEMBUATAN OBAT YANG BAIK (CPOB) Cara Pembuatan Obat yang Baik (CPOB) bertujuan untuk menjamin obat dibuat secara konsisten, memenuhi persyaratan yang ditetapkan dan sesuai dengan tujuan penggunaannya.
BAB III CARA PEMBUATAN OBAT YANG BAIK (CPOB) Cara Pembuatan Obat yang Baik (CPOB) bertujuan untuk menjamin obat dibuat secara konsisten, memenuhi persyaratan yang ditetapkan dan sesuai dengan tujuan penggunaannya.
Lampiran 1. Bagan proses Pembuatan Krim
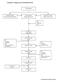 Lampiran 1. Bagan proses Pembuatan Krim Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph Pencampuran Dengan mikser -Identifikasi
Lampiran 1. Bagan proses Pembuatan Krim Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph Pencampuran Dengan mikser -Identifikasi
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI. PT. COMBIPHAR Jl. RAYA SIMPANG NO. 383 PADALARANG, BANDUNG PERIODE AGUSTUS 2009
 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. COMBIPHAR Jl. RAYA SIMPANG NO. 383 PADALARANG, BANDUNG PERIODE 04-28 AGUSTUS 2009 Disusun Oleh: FANNY FERLIANY SIMANJUNTAK, S.Farm. 083202117 FAKULTAS
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. COMBIPHAR Jl. RAYA SIMPANG NO. 383 PADALARANG, BANDUNG PERIODE 04-28 AGUSTUS 2009 Disusun Oleh: FANNY FERLIANY SIMANJUNTAK, S.Farm. 083202117 FAKULTAS
SESLA BAG. PROD GUPUSFI BAG. UJIBANG BAG. JANG UNIT GUTRANS UNIT GULUR UNIT GUPALKES UNIT GUHANJABAKU
 Lampiran 1. Struktur Organisasi Lafiau KALAFIAU ESELON SESLA ESELON PEMBANTU PIMPINAN/STAF ESELON BAG. PROD GUPUSFI BAG. UJIBANG BAG. JANG TABLET GUTRANS UJI COBA JANGMAT KAPSUL GULUR LITBANG HARFASMAT
Lampiran 1. Struktur Organisasi Lafiau KALAFIAU ESELON SESLA ESELON PEMBANTU PIMPINAN/STAF ESELON BAG. PROD GUPUSFI BAG. UJIBANG BAG. JANG TABLET GUTRANS UJI COBA JANGMAT KAPSUL GULUR LITBANG HARFASMAT
BAB II TINJAUAN UMUM INDUSTRI. 2.1 Tinjauan Lembaga Farmasi Angkatan Udara (LAFIAU) Sejarah dan Perkembangan Lembaga Farmasi Angkatan Udara
 BAB II TINJAUAN UMUM INDUSTRI 2.1 Tinjauan Lembaga Farmasi Angkatan Udara (LAFIAU) 2.1.1 Sejarah dan Perkembangan Lembaga Farmasi Angkatan Udara Perjalanan sejarah dimulai ketika di pangkalan udara belum
BAB II TINJAUAN UMUM INDUSTRI 2.1 Tinjauan Lembaga Farmasi Angkatan Udara (LAFIAU) 2.1.1 Sejarah dan Perkembangan Lembaga Farmasi Angkatan Udara Perjalanan sejarah dimulai ketika di pangkalan udara belum
KISI-KISI MATERI PLPG MATA PELAJARAN FARMASI INDUSTRI
 KISI-KISI MATERI PLPG MATA PELAJARAN FARMASI INDUSTRI Standar Guru (SKG) Inti Guru (KI) Guru Mata Pelajaran 1 Menguasai karakteristik Mengidentifikasi karakteristik peserta didik yang berkaitan dengan
KISI-KISI MATERI PLPG MATA PELAJARAN FARMASI INDUSTRI Standar Guru (SKG) Inti Guru (KI) Guru Mata Pelajaran 1 Menguasai karakteristik Mengidentifikasi karakteristik peserta didik yang berkaitan dengan
PERSYARATAN TEKNIS CARA PEMBUATAN OBAT TRADISIONAL YANG BAIK BAB 1
 Lampiran Peraturan Kepala Badan Pengawas Obat dan Makanan Nomor HK.03.1.23.06.11.5629 Tahun 2011 Tentang Persyaratan Teknis Cara Pembuatan Obat Tradisioanl Yang Baik (CPOTB) PERSYARATAN TEKNIS CARA PEMBUATAN
Lampiran Peraturan Kepala Badan Pengawas Obat dan Makanan Nomor HK.03.1.23.06.11.5629 Tahun 2011 Tentang Persyaratan Teknis Cara Pembuatan Obat Tradisioanl Yang Baik (CPOTB) PERSYARATAN TEKNIS CARA PEMBUATAN
PEDOMAN CARA PEMBUATAN OBAT YANG BAIK
 7 2013, No.122 LAMPIRAN PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR HK.03.1.33.12.12.8195 TAHUN 2012 TENTANG PENERAPAN PEDOMAN CARA PEMBUATAN OBAT YANG BAIK PENDAHULUAN PRINSIP
7 2013, No.122 LAMPIRAN PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR HK.03.1.33.12.12.8195 TAHUN 2012 TENTANG PENERAPAN PEDOMAN CARA PEMBUATAN OBAT YANG BAIK PENDAHULUAN PRINSIP
