KINETIKA KIMIA. SHINTA ROSALIA DEWI
|
|
|
- Glenna Hardja
- 6 tahun lalu
- Tontonan:
Transkripsi
1 KINETIKA KIMIA. SHINTA ROSALIA DEWI
2 Kinetika kimia Shinta Rosalia Dewi Pendahuluan Kinetika Reaksi Mekanika fluida mendesain reaktor kimia Pindah panas neraca massa ekonomi Termodinamika Pendahuluan (cont ) Kinetika reaksi adalah studi tentang laju reaksi, perubahan konsentrasi reaktan (atau produk) sebagai fungsi dari waktu Reaksi dapat berlangsung dengan laju yang bervariasi, ada yang serta merta, perlu cukup waktu (pembakaran) atau waktu yang sangat lama seperti penuaan, pembentukan batubara dan beberapa reaksi peluruhan radioaktif Pendahuluan (cont ) Laju reaksi dinyatakan sebagai laju berkurangnya konsentrasi pereaksi atau bertambahnya konsentrasi produk per satuan waktu. Laju reaksi mempunyai satuan mol per liter per detik (mol. L-1. s-1 atau M.s-1). Laju pengurangan reaktan dinyatakan sebagai -r, sedangkan laju pembentukan produk dinyatakan sebagai +r. Mengekspresikan Laju Reaksi A B R dna r k[a][b] dt Laju reaksi Perubahan konsentrasi A Perubahan waktu Konst A 2 Konst A1 (Konst A) t 2 t1 t A B Laju t t Ekspresi Laju dalam Konsentrasi Reaktan dan Produk C2H4 O3 C2H4 O O2 Laju C2H4 O3 C2H4 O O2 t t t t Untuk reaksi hidrogen dan iodine membentuk HI H2 (g) I2 (g) 2HI(g) H2 I2 1 HI Laju t t 2 t HI H2 I2 Laju 2 2 t t t atau Soal latihan Laju pembentukan NO(g) pada reaksi 2NOBr(g) 2NO(g) + Br2(g) adalah sebesar 1,6 x 10-4 M/s. berapa laju konsumsi NOBr? d[no] 1,6x10 4 M / s dt 1 d[no] 1 d[nobr] r 2 dt 2 dt sehingga r = 0,5x1,6x10-4 M/s = 8x10-5 M/s d[nobr] 4 4 dan 2 x r=2 x (8x10 M / s) 1,6x10 M / s dt
3 Soal Latihan Karena menghasilkan produk gas non polusi, hidrogen digunakan sebagai bahan bakar roket dan sumber energi masa depan: 2H2(g) + O2(g) 2H2O(g) 1. Tuliskan laju reaksi ini dalam bentuk perubahan [H2], [O2] dan [H2O] terhadap waktu 2. Saat O2 turun pada 0,23 mol/l.s berapa kenaikan terbentuknya H2O? d[o2 ] 0,23mol / L dt d[o2 ] 1 d[h2 ] 1 d[h2 O] laju 2 dt dt 2 dt d[o2 ] 1 d[h2 O] 0,23mol / L dt 2 dt d[h2 O] d[o2 ] 2 2x0,23mol / L 0, 46mol / L dt dt Laju reaksi Apabila diberikan satu komponen reaksi, i, dan laju perubahan jumlah mol komponen i adalah dni/dt, maka laju reaksi dalam berbagai bentuk dapat ditulis dengan : Didasarkan pada unit volume reaksi fluida : mol i 1 dni ri V dt (volume fluida) (waktu) Didasarkan pada unit masa padatan dalam system padat-fluida : mol i 1 dni ' ri W dt (massa zat padat )(waktu) Laju reaksi Didasarkan pada unit volume padatan dalam system gas-padat : mol i 1 dni ri Vs dt (volume zat padat) (waktu) ''' Didasarkan pada unit volume reaktor : mol i 1 dni ri Vr dt (volume reaktor ) (waktu) '''' Latihan Seorang perempuan dengan berat 60 kg mengkonsumsi sekitar 6000 kj energi dari makanan. Dan asumsikan bahwa seluruh makanannya adalah glukosa dan reaksi keseluruhannya adalah sebagai berikut : C6H12O6 + 6O2 6CO2 + 6H2O HR = kj Tentukan laju metabolik perempuan tersebut dalam mol oksigen per m3 tubuh per detik! (densitas = 1000 kg/m3) 1 dno2 mol O2 yang digunakan ro2 V dt (m3 tubuh). s Jawaban kg densitas perempuan p 1000 x 3 m 60 kg 3 Vp 0,06 m 1000 kg /m3 Untuk setiap mol glukosa yang dikonsumsi, digunakan 6 mol O2 dan melepas 2816 kj energi. dno2 6 mol O kj / hari 12,78 mol O2 / hari dt 2816 kj / mol glukosa 1 mol glukosa 1 dno2 ro2 V dt 12,78 mol O2 yang digunakan 1hari 1 ro2 x 3 0,06 m hari 24 x 3600 s ro2 2,47 x 10-3 mol O2 yang digunakan/m3s Jenis reaksi Berdasarkan banyaknya fase yang terlibat dalam sistem reaksi Reaksi homogen : sistem reaksi dengan fase tunggal (fasa yang sama). Berupa reaksi homogen fase gas atau reaksi homogen fase cair. Reaksi terjadi di seluruh bagian fase Reaksi heterogen : sistem reaksi yang mengandung lebih dari 1 (satu) fase sedikitnya dua fasa pereaksi supaya reaksi dapat berlangsung. Reaksi terjadi di permukaan antar fase Jenis reaksi (cont ) Berdasarkan keberadaan atau penggunaan katalis Reaksi katalitik : sistem reaksi yang menggunakan peran katalis atau katalisator. Ada 2 macam : 1. reaksi katalitik homogen (jika fase katalis = fase reaksi) 2. reaksi katalitik heterogen (jika fase katalis fase reaksi). Reaksi non-katalitik : sistem reaksi yang tidak menggunakan peran katalis.
4 Jenis reaksi (cont ) Berdasarkan mekanisme atau kompleksitasnya Reaksi tunggal (single reaction) : reaksi yang mempunyai satu persamaan stoikiometri dan satu persamaan laju yang bertanggung jawab pada jalannya reaksi. Reaksi kompleks (multiple reaction) : reaksi yang mempunyai lebih dari satu persamaan stoikiometri dan kinetika reaksi yang bertanggung jawab pada jalannya reaksi. Multiple reaction Reaksi seri Reaksi seri atau reaksi konsekutif adalah reaksi dari reaktan yang terbentuk zat antara yang reaktif sebelum berubah menjadi produk yang stabil. A B P k1 k2 Contoh : k1 C2H4O + NH3 etilen amoniak oksida HOCH2CH2NH2 EO mono-etanol amin (HOCH2CH2NH)2NH di-etanol amin EO (HOCH2CH2)3N tri-etanol amin Multiple reaction Reaksi paralel Reaksi paralel atau reaksi samping (competitive reaction) yaitu dari reaktan yang sama dihasilkan produk yang berbeda melalui jalur reaksi yang berbeda pula. P k1 A k2 R Reaksi paralel Contoh : reaksi oksidasi etilen menghasilkan produk etilen oksida, akan tetapi selama proses oksidasi, sebagian etilen terbakar sempurna sehingga terbentuk produk yang tidak diinginkan yaitu uap air dan karbon dioksida. k C2H4 + 1/2 O2 etilen oksigen C2H4 + 3 O2 etilen 1 oksigen C2H4O etilen oksida k2 2CO2
5 + karbondioksida 2H2O air Multiple reaction Reaksi kompleks : melibatkan reaksi seri dan paralel C2H5OH k1 etanol C2H5OH k2 etanol C2H4 etana + CH3CHO etanal C2H4 + H2O air etana CH3CHO + H2 etanal k3 C4H6 hidrogen + H2O air butadiena Jenis reaksi (cont ) Berdasarkan arah reaksinya Reaksi reversibel (bolak-balik) : reaksi reversibel merupakan reaksi bolak-balik; dalam hal ini terjadi kesetimbangan. Reaksi ireversibel (searah) : reaksi ireversibel merupakan reaksi satu arah atau tak dapat balik; tidak ada keadaan setimbang. Sistem kinetik Sistem tertutup : sistem yang tidak ada hubungan materi dengan lingkungan Ex : reaksi dalam fasa cair dalam tabung reaksi tertutup, maka yg berpengaruh hanya fasa cair dan uap di dalam sistem Sistem terbuka : sistem yg berhubungan dengan lingkungan dalam bentuk materi atau energi Ex : sistem fasa cair yg dipanaskan dalam tabung pemanas sehingga fasa cair dapat berubah menjadi fasa gas yg dapat keluar sistem Variabel yg mempengaruhi laju reaksi Temperatur pd reaksi isotermal, T dijaga konstan sehingga tidak mempengaruhi variabel lain Tekanan dan volume pada reaksi yg melibatkan fasa gs, P dan V penting untuk dijaga konstan Komposisi kimia : konsentrasi reaktan umumnya merupakan parameter yg dikaji Variabel yg mempengaruhi laju reaksi Komposisi kimia : konsentrasi senyawa inert pada beberapa kasus ditemui senyawa yg tidak terlibat dalam reaksi tetapi memberikan efek pada laju reaksi Komposisi kimia : katalis mempercepat reaksi Efek permukaan : rx heterogen / homogen Persamaan laju reaksi Apabila diberikan reaksi : aa + bb cc + dd Maka persamaan laju reaksi dapat ditulis : 1 d[a] 1 d[b] 1 d[c] 1 d[d] r k[a]a [B]b a dt b dt c dt d dt
6 dimana r : laju reaksi k : konstanta laju reaksi a : orde reaksi terhadap [A] b : orde reaksi terhadap {B} Orde reaksi Orde reaksi (tingkat reaksi) adalah jumlah eksponen faktor konsentrasi yang terdapat dalam persamaan laju. Orde reaksi menyatakan besarnya pengaruh konsentrasi pereaksi terhadap laju reaksi. Orde reaksi biasanya berupa bilangan bulat, tetapi dapat bernilai pecahan atau negatif Orde reaksi (cont ) Misalnya reaksi : aa + bb dd P a + b d = n Jadi reaksi tingkat a terhadap A, tingkat b terhadap B dan tingkat n terhadap keseluruhan reaksi. Dimana nilai : a. b,..., d tidak harus selalu sama dengan koefisien stoikiometri. Reaksi yang harga orde reaksi terhadap suatu komponen sama dengan koefisien reaksi komponennya disebut reaksi elementer A B R dna r k[a][b] dt Orde reaksi total = 2 Reaksi yang harga orde reaksinya tidak sama dengan koefisien stoikhiometri komponennya disebut reaksi non elementer. 5 Br- + BrO H+ 3 Br2 + 3 H2O, r dnbro 3 k [BrO3 ][Br ][H2 ] dt orde reaksi total = Latihan Tabel di bawah ini merupakan data dari reaksi P + Q R + S [P]awal (M) a 2a 3a a a [Q]awal (M) b b b 2b 3b Laju reaksi (M/s) V 4v 9v v v Dari data tersebut, tentukan: 1.orde reaksi P 2.orde reaksi Q 3.orde reaksi total 4.persamaan laju reaksi Latihan Salah satu reaksi gas yang terjadi dalam kendaraan adalah: NO2(g) + CO(g) NO(g) + CO2(g) Laju = k[no2]m[co]n Jika diketahui data sebagai berikut, tentukan orde reaksi keseluruhan dan persamaan lajunya Eksperimen Laju awal (mol/l.s) [NO2] awal (mol/l)
7 [CO] awal (mol/l) ,0050 0,080 0,0050 0,10 0,40 0,10 0,10 0,10 0,20 Latihan Rumusan laju reaksi tersebut diperoleh dari percobaan. Misalkan diperoleh data percobaan untuk reaksi : NO(g) + Cl2(g) NOCl2(g) Diperoleh data sebagai berikut : Perc [NO],M [Cl2], M r, M/s ,1 0,1 0,2 0,3 0,1 0,2 0,1 0, ? Rumusan laju reaksi untuk reaksi tersebut adalah : r = k.[no]m.[cl2]n Orde NO = m Percobaan 1 dan 3 [NO]m r m Orde Cl2 = n Percobaan 1 dan 2 [Cl2 ]n r n [NO]3 r3 r1 [NO]1 [Cl2 ]2 r2 [Cl2 ]1 r1 m n 8 0,2 0,1 4 2m 2 m 1 0,2 16 0,1 4 2n 4 n 2 Maka rumusan laju reaksinya adalah : r=k.[no]1.[cl2]2 Harga k diperoleh dengan memasukan salah satu data percobaan r k 2 [NO].[Cl2 ] 4 k 2 0,1.0,1 k M 2s 1
8 Maka laju reaksi pada percobaan 4 adalah : r= k.[no].[cl2]2 r= x 0,3 x 0,32 r= 108 Ms-1 Latihan Nitrogen oksida (NO) direaksikan dengan Cl2 sesuai reaksi : 2NO + Cl2 2NOCl, diperoleh data hasil percobaan penentuan laju : Percobaan [NO] (M) [Cl2] (M) Waktu (detik) 1 0,13 0, ,26 0, ,26 0, ,52 0,32 2 Persamaan laju reaksinya adalah Model kinetika Kinetika orde nol Kinetika orde satu Kinetika orde dua Kinetika orde tinggi Kinetika reaksi orde semu Reaksi orde nol Misalnya diberikan reaksi sederhana : A P Reaksi orde nol adalah reaksi yang laju reaksinya dapat ditulis sebagai : d[a] k [A]0 k dt di mana k adalah konstanta laju reaksi orde nol dan [A] adalah konsentrasi reaktan. Reaksi orde nol (cont ) [A] [A] 0 [A] [A]0 k t atau k t Waktu paro Waktu paro (t1/2) adalahh waktu yang diperlukan untuk mereaksikan separo dari konsentrasi reaktan awal. Pada t1/2, [A] = ½ [Ao] [A]0 [A] [A]0 (1 0, 5) 0, 5[A]0 k t t1/2 t1/2 t1/2 [A]0 2k Latihan Suatu reaksi dengan konsentrasi reaktan 1 mol/l, 50% sempurna dalam 10 menit. Reaksi dibiarkan berlangsung 5 menit lagi. Berapa banyak sisa reaktan jika reaksi mengikuti orde nol? Reaksi orde satu Misalnya diberikan reaksi sederhana : A P d[a] d[a] k [A] atau k dt dt [A] [A]0 ln kt [A] ln [A] ln [A]0 kt Reaksi orde satu (cont ) Apabila dibuat grafik ln [A] versus t akan diperoleh slope = -k. Konstanta laju reaksi juga dapat ditentukan dengan rumus : 1 [A]0 k ln t [A] Waktu paro Pada t1/2, [A] = ½ [Ao] 1 [A]0 k ln t [A] [A]0 ln kt1/2 1 [A] 2 0 ln 2 = kt1/2 t1/2 ln2 0,693 k k contoh Reaksi dekomposisi N2O5 berlangsung mengikuti reaksi orde satu : 2N2O5 4NO2 + O2 Pada temperatur 25oC didapatkan harga k = 3,38 x 10-5 detik-1. berapa waktu paro dari reaksi tersebut? Latihan Reaksi dekomposisi gas azometan : CH3N2CH3 CH3CH3 + N2 dengan variasi waktu, dihasilkan nilai tekanan parsial pada temperatur 600 K adalah sebagai berikut : t / detik 0 p/p0 /10-2 8,
9 ,72 3,99 2,78 1,94 Tentukan orde reaksi, konstanta laju reaksi pada temperatur tersebut! Tentukan waktu paronya! Hubungan konversi dg waktu Reaksi Order 1 Persamaan hubungan konversi atau konsentrasi suatu bahan dalam reactor dengan waktu reaksi dapat dinyatakan berdasarkan neraca massa dalam reactor yang digunakan. Misalkan suatu larutan A dengan konsentrasi CA0 gmol/l dalam reactor batch dengan volume larutan V L bereaksi membentuk B dengan persamaan reaksi A B, reaksi merupakan reaksi order 1 dengan kecepatan reaksi ra= kca, [A] dari persamaan ln kt, dapat ditulis : [A]o [A] kt e [A]o sehingga hubungan konsentrasi A dengan waktu dapat ditulis : [A] =[A]o.e kt dan hubungan konversi dengan waktu : [A]o(1 - x A ) [A]o.e XA 1 e kt kt konsentrasi bahan yang lain dapat ditulis : [P] = [P]o + [A]o.X A Soal Suatu larutan A dengan konsentrasi 0,5 gmol/l dalam reactor batch dengan volume larutan 2,5 L bereaksi membentuk B dengan persamaan reaksi : A B reaksi merupakan reaksi order 1 dengan kecepatan reaksi ra= kca, dengan nilai k=0,01 1/menit. berapa konsentrasi A, konversi A serta konsentrasi B setelah 3 menit? Penyelesaian Dengan penjabaran neraca massa A seperti di atas diperoleh persamaan : C A C A0 e kt (0,01 gmol C A 0,5 e L C A 0,485gmol / L 1 )(3menit) menit X A 1 e kt (0,01 XA 1 e
10 1 )(3menit) menit 0,029 CB CB0 C A 0 X 0 0, 5 0,029 0,0145 gmol / L Soal Suatu larutan A dengan konsentrasi 10 gmol/l dalam reactor batch dengan volume larutan 2,5 L bereaksi membentuk B dengan persamaan reaksi A 3B, reaksi merupakan reaksi order 1 dengan kecepatan reaksi ra= kca, dengan nilai k=0,02 1/menit berapa konsentrasi A, konversi A serta konsentrasi B, setelah 3 menit Reaksi orde dua Pada reaksi orde dua, laju reaksi berbanding langsung dengan kuadrat konsentrasi dari satu reaktan atau dengan hasil kali konsentrasi yang meningkat sampai pangkat satu atau dua dari reaktan. Misalkan pada reaksi orde dua : 2A P, maka persamaan lajunya : d[a] d[a] 2 k [A] atau 2 k dt dt [A] Reaksi orde dua (cont ) d[a] 2 k [A] atau dt d[a] 2 k dt [A] 1 1 kt atau [A] [A]0 1 1 kt [A] [A]0 A + B P, maka persamaan lajunya : d[a] k [A][B] dt d[a] k dt [A][B] [A]0 [A] = [B]0 [B] sehingga [B] = [B]0 [A]0 + [A], dengan [A] dan [B] adalah konsentrasi reaktan dan [A]0 dan [B]0 adalah konsentrasi awal reaktan. Jika [B] disubstitusi ke persamaan, maka : d[a] k dt [A]([B]0 [A]0 [A] [A]0 [B] 1 ln kt [B]0 [A]0 [B]0 [A] [A]0 [B] ln ([B]0 [A]0 )kt ln [A] [B]0 Waktu paro Waktu paro dapat ditentukan hanya jika satu jenis reaktan terlibat. Penentuannya dilakukan terhadap salah satu reaktan saja. Waktu paro berhubungan dengan konsentrasi awal Rumus menghitung waktu paro (kecuali untuk n =1 atau reaksi orde satu) n t 12 (n 1)[A]0n 1 k Reaksi orde semu / pseudo Sukrosa + H2O + H+ fruktosa + glukosa + H+ Laju reaksi : d[s] k[s][h2o][h ] dt d[s] k'[s] --> reaksi pseudo orde satu dt k' k[h2o][h ] H+ merupakan katalis yang konsentrasi total selama reaksi adalah tetap Konsentrasi pelarut air umumnya mendekati tetap / konstan sehingga tidak mempengaruhi Menentukan k dan orde reaksi Menentukan konstanta laju reaksi dan orde reaksi berdasarkan waktu paro : 2n 1 1 log t 12 log (n 1)log[A]0 (n 1)k Plot grafik log t1/2 vs log A0 n : orde reaksi, k : konstanta laju reaksi
11 Faktor yang Mempengaruhi Laju Reaksi Pada kondisi tertentu masing-masing reaksi memiliki karakteristik laju masing-masing yang ditentukan oleh sifat kimia reaktan Pada suhu kamar: H2(g) + F2(g) 2HF(g) sangat cepat 3H2(g) + N2(g) 2NH3(g) sangat lambat Faktor yang Mempengaruhi Laju Reaksi Konsentrasi: molekul-molekul harus bertumbukan agar terjadi reaksi dalam konteks ini laju reaksi proporsional dengan konsentrasi reaktan Luas permukaan : semakin besar luas permukaan, laju reaksi semakin cepat Temperatur: molekul harus bertumbukan dengan energi yang cukup untuk bereaksi Katalis : penggunaan katalis akan mempercepat laju reaksi N2(g) + 3H2(g) 2NH3(g) H = -92,4Kj Pada 25oC : Kp = 6,2 105 Konsentrasi Konsentrasi mempengaruhi laju reaksi, karena banyaknya partikel memungkinkan lebih banyak tumbukan, dan itu membuka peluang semakin banyak tumbukan efektif yang menghasilkan perubahan. Mana yang lebih mungkin terjadi tabrakan, di jalan lengang atau dijalanan padat?? Konsentrasi Hubungan kuantitatif perubahan konsentrasi dengan laju reaksi tidak dapat ditetapkan dari persamaan reaksi, tetapi harus melalui percobaan. Dalam penetapan laju reaksi ditetapkan yang menjadi patokan adalah laju perubahan konsentrasi reaktan. Ada reaktan yang perubahan konsentrasinya tidak mempengaruhi laju reaksi: [reaktan] V [reaktan] x V 1 xn 1 n o Contoh Persamaan kecepatan reaksi H2 + I2 2 HI V = k [H2][I2]. Jika konsentrasi H2 dinaikkan 2x dan I2 dinaikkan 3x, maka laju reaksi menjadi? Konsentrasi Reaksi antara NO(g) dan O2 (g) adalah reaksi berorde dua terhadap NO(g) dan berorde dua untuk O2 (g). Jika konsentrasi kedua pereaksi dijadikan 3 kali konsentrasi semula. Tentukan laju reaksinya dibandingkan dengan laju semula menjadi! Luas Permukaan Mana yang lebih luas permukaannya? Sepotong tahu utuh atau sepotong tahu dipotong 4? Luas Permukaan Luas Permukaan Perhatikan bahwa luas permukaan tahu utuh lebih kecil dari tahu yang dipotong 4 Sekarang! Mana yang lebih luas permukaannya, gula berukuran butir kasar atau gula berukuran butiran halus? Mana yang lebih mudah larut, gula yang berukuran butir kasar atau yang berukuran butiran halus? Luas Permukaan Luas permukaan mempercepat laju reaksi karena semakin luas permukaan zat, semakin banyak bagian zat yang saling bertumbukan dan semakin besar peluang adanya tumbukan efektif menghasilkan perubahan Semakin luas permukaan zat, semakin kecil ukuran partikel zat. Jadi semakin kecil ukuran partikel zat, reaksi pun akan semakin cepat. Luas permukaan Reaksi zat A dan B (zat padat, dengan ukuran 100 mesh) menghasilkan C : A+B C mempunyai persamaan laju reaksi : r = [A] [B]2 Jika ukuran B yang direaksikan adalah 200 mesh, bagaimana perubahan laju reaksinya?
12 Katalis Katalis homogen Katalis heterogen Katalis enzim Katalis : zat yang dapat mempengaruhi laju reaksi (biasanya mempercepat), tanpa dikonsumsi selama reaksi berlangsung Katalis bekerja dengan mengubah mekanisme reaksi dan energi aktivasi sistem Kesetimbangan dalam sistem tetap Katalis homogen : katalis yang fasenya sama dengan fase reaktan Katalis heterogen : katalis yang fasenya berbeda dengan fase reaktan; biasanya melibatkan lebih dari satu fasa Reaksi Katalitik : terjadi pada antar muka (interface) fluida padat luas permukaan antar muka hrs tinggi berpengaruh secara signifikan pada laju reaksi. Temperatur Kenaikan suhu dapat mempercepat laju reaksi karena dengan naiknya suhu energi kinetik partikel zat-zat meningkat sehingga memungkinkan semakin banyaknya tumbukan efektif yang menghasilkan perubahan Temperatur Hubungan Kuntitatif perubahan suhu terhadap laju reaksi: Hubungan ini ditetapkan dari suatu percobaan, misal diperoleh data sebagai berikut: Suhu (oc) Laju reaksi (M/detik) T 0,3 0,6 1,2 2,4 Vt Temperatur Hubungan Kuantitatif perubahan suhu terhadap laju reaksi: Ta - To v a = ( v) T vo 1 ta = ( ) v Dimana : Va = laju reaksi akhir (pada suhu T) Vo = laju reaksi awal (pada suhu awal (To)) v = perubahan laju ta = waktu akhir (pada suhu T) to = waktu awal Ta = suhu akhir To = suhu awal T = perubahan suhu Ta - To T to Pengaruh Temperatur Berapa kenaikan laju reaksi yang terjadi apabila suhu dinaikkan dari 70oC menjadi 100oC, di mana setiap kenaikan suhu 10oC, laju reaksi meningkat 3 kali? Latihan Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 10oC. jika pada suhu 30oC reaksi berlangsung 48 menit, maka berapa lama waktu reaksi jika reaksi berlangsung pada suhu 60oC?
13 Pengaruh Suhu terhadap Energi Aktivasi PERSAMAAN ARRHENIUS k 0 A0. e k e k0 Ea RT0 k A0. e Ea 1 1 R T T0 k k0. e Ea RT k0. e Ea 1 R T Ea RT Keterangan k = konstanta laju reaksi k0 = faktor frekuensi reaksi R = konstanta gas (1,987 kal / g- mole K; 8,314 J/K.mol ) Ea = energi aktivasi, yang nilainya dianggap konstan pada suatu kisaran suhu tertentu Energi aktivasi diartikan sebagai suatu tingkat energi minimum yang diperlukan untuk memulai suatu reaksi. Persamaan Arrhenius juga dapat dinyatakan dalam bentuk : Ea ln k ln k 0 R 1 T Persamaan di atas merupkan persamaan garis lurus (linier), dengan 1/T sebagai sumbu X dan ln k sebagai sumbu Y. Dengan demikian, slope dari kurva tersebut adalah Ea / R. jika terdapat dua data : Ea ln k 1 lna RT1 Ea ln k 2 lna RT2 maka Ea Ea ln k 1 ln k 2 lna lna RT1 RT2 k1 Ea 1 1 r1 t2 Ea 1 1 ln ln ln k2 R T2 T1 r2 t1 R T2 T1 Susu dipasteurisasi pada suhu 63oC selama 30 menit, jika dipasteurisasi pada suhu 74oC hanya membutuhkan waktu 15 detik. Hitunglah energi aktivasi pasteurisasi tsb. Penyedap rasa berbentuk bubuk dalam kemasan sachet akan mengalami penurunan mutu aroma selama penyimpanan. Pengujian aroma selama penyimpanan dilakukan dengan uji sensoris. Data skor sensori penyedap rasa tersebut adalah : Suhu Pengujian (0C) Waktu (hari)
14 Skor Sensori 8 7,93 7,86 7,83 7,79 8 7,86 7,72 7,59 7,41 8 7,69 7,31 7,03 6,66 Pertanyaan : 1. Tentukan persamaan kinetika reaksi penurunan aroma selama penyimpanan! Tentukan juga orde reaksinya! 2. Tentukan nilai k untuk masing-masing suhu pengujian! 3. Tentukan energi aktivasi! Gunakan plot Arrhenius!
15
Kinetika kimia. Shinta Rosalia Dewi
 Kinetika kimia Shinta Rosalia Dewi Pendahuluan Termodinamika Kinetika Reaksi Mekanika fluida Pindah panas neraca massa ekonomi mendesain reaktor kimia Pendahuluan (cont ) Kinetika reaksi adalah studi tentang
Kinetika kimia Shinta Rosalia Dewi Pendahuluan Termodinamika Kinetika Reaksi Mekanika fluida Pindah panas neraca massa ekonomi mendesain reaktor kimia Pendahuluan (cont ) Kinetika reaksi adalah studi tentang
KINETIKA KIMIA LAJU DAN MEKANISME DALAM REAKSI KIMIA
 KINETIKA KIMIA LAJU DAN MEKANISME DALAM REAKSI KIMIA Pendahuluan Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan koefisien seimbang Namun persamaan reaksi tidak dapat menjawab 3
KINETIKA KIMIA LAJU DAN MEKANISME DALAM REAKSI KIMIA Pendahuluan Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan koefisien seimbang Namun persamaan reaksi tidak dapat menjawab 3
Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan
 KINETIKA Pendahuluan Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan Namun persamaan reaksi tidak dapat menjawab :. Seberapa cepat reaksi berlangsung 2. Bagaimana
KINETIKA Pendahuluan Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan Namun persamaan reaksi tidak dapat menjawab :. Seberapa cepat reaksi berlangsung 2. Bagaimana
BAB 9. KINETIKA KIMIA
 BAB 9 BAB 9. KINETIKA KIMIA 9.1 TEORI TUMBUKAN DARI LAJU REAKSI 9.2 TEORI KEADAAN TRANSISI DARI LAJU REAKSI 9.3 HUKUM LAJU REAKSI 9.4 FAKTOR-FAKTOR LAJU REAKSI 9.5 MEKANISME REAKSI 9.6 ENZIM SEBAGAI KATALIS
BAB 9 BAB 9. KINETIKA KIMIA 9.1 TEORI TUMBUKAN DARI LAJU REAKSI 9.2 TEORI KEADAAN TRANSISI DARI LAJU REAKSI 9.3 HUKUM LAJU REAKSI 9.4 FAKTOR-FAKTOR LAJU REAKSI 9.5 MEKANISME REAKSI 9.6 ENZIM SEBAGAI KATALIS
Bab 10 Kinetika Kimia
 D e p a r t e m e n K i m i a F M I P A I P B Bab 0 Kinetika Kimia http://chem.fmipa.ipb.ac.id Ikhtisar 2 3 Laju Reaksi Teori dalam Kinetika Kimia 4 Mekanisme Reaksi 5 46 Faktor Penentu Laju Reaksi Enzim
D e p a r t e m e n K i m i a F M I P A I P B Bab 0 Kinetika Kimia http://chem.fmipa.ipb.ac.id Ikhtisar 2 3 Laju Reaksi Teori dalam Kinetika Kimia 4 Mekanisme Reaksi 5 46 Faktor Penentu Laju Reaksi Enzim
Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Chapter 8 Kinetika Kimia Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Chapter 8 Kinetika Kimia Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
BAB VI KINETIKA REAKSI KIMIA
 BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
Purwanti Widhy H, M.Pd. Laju Reaksi
 Purwanti Widhy H, M.Pd Laju Reaksi SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi, Kompetensi Dasar & Indikator
Purwanti Widhy H, M.Pd Laju Reaksi SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi, Kompetensi Dasar & Indikator
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
Laju Reaksi. Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I
 Laju Reaksi Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi,
Laju Reaksi Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi,
Kinetika Kimia dan Mekanisme Reaksi
 Kinetika Kimia dan Mekanisme Reaksi Kinetika Kimia Kinetika kimia adalah ilmu yang mempelajari laju reaksi, atau seberapa cepat proses reaksi berlangsung dalam waktu tertentu. Kinetika kimia menjelaskan
Kinetika Kimia dan Mekanisme Reaksi Kinetika Kimia Kinetika kimia adalah ilmu yang mempelajari laju reaksi, atau seberapa cepat proses reaksi berlangsung dalam waktu tertentu. Kinetika kimia menjelaskan
Sulistyani, M.Si.
 Sulistyani, M.Si. Email: sulistyani@uny.ac.id Laju reaksi adalah laju pengurangan reaktan tiap satuan waktu atau laju pembentukan produk tiap satuan waktu. Laju reaksi dipengaruhi oleh: sifat dan keadan
Sulistyani, M.Si. Email: sulistyani@uny.ac.id Laju reaksi adalah laju pengurangan reaktan tiap satuan waktu atau laju pembentukan produk tiap satuan waktu. Laju reaksi dipengaruhi oleh: sifat dan keadan
A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI
 3 LAJU REAKSI A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI Materi dapat berubah dari bentuk yang satu ke bentuk yang
3 LAJU REAKSI A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI Materi dapat berubah dari bentuk yang satu ke bentuk yang
Kinetika Kimia. Abdul Wahid Surhim
 Kinetika Kimia bdul Wahid Surhim 2014 Kerangka Pembelajaran Laju Reaksi Hukum Laju dan Orde Reaksi Hukum Laju Terintegrasi untuk Reaksi Orde Pertama Setengah Reaksi Orde Pertama Reaksi Orde Kedua Laju
Kinetika Kimia bdul Wahid Surhim 2014 Kerangka Pembelajaran Laju Reaksi Hukum Laju dan Orde Reaksi Hukum Laju Terintegrasi untuk Reaksi Orde Pertama Setengah Reaksi Orde Pertama Reaksi Orde Kedua Laju
wanibesak.wordpress.com
 1. Diberikan beberapa pernyataan 1) katalis dapat mempercepat laju reaksi dengan cara menaikan energi aktivasi 2) tahap penentu laju reaksi adalah tahap reaksi yang berlangsung paling lambat 3) laju reaksi
1. Diberikan beberapa pernyataan 1) katalis dapat mempercepat laju reaksi dengan cara menaikan energi aktivasi 2) tahap penentu laju reaksi adalah tahap reaksi yang berlangsung paling lambat 3) laju reaksi
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
SOAL LAJU REAKSI. Mol CaCO 3 = = 0.25 mol = 25. m Mr
 SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN
 BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN STANDAR KOMPETENSI 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan
BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN STANDAR KOMPETENSI 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan
H 2 O (L) H 2 O (G) KESETIMBANGAN KIMIA. N 2 O 4 (G) 2NO 2 (G)
 H 2 O (L) H 2 O (G) KESETIMBANGAN KIMIA. N 2 O 4 (G) 2NO 2 (G) Purwanti Widhy H Kesetimbangan adalah suatu keadaan di mana tidak ada perubahan yang terlihat seiring berjalannya waktu. Kesetimbangan kimia
H 2 O (L) H 2 O (G) KESETIMBANGAN KIMIA. N 2 O 4 (G) 2NO 2 (G) Purwanti Widhy H Kesetimbangan adalah suatu keadaan di mana tidak ada perubahan yang terlihat seiring berjalannya waktu. Kesetimbangan kimia
Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka
 Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka waktu reaksi berlangsung pada suhu 90 o C Susu dipasteurisasi
Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka waktu reaksi berlangsung pada suhu 90 o C Susu dipasteurisasi
kimia KTSP & K-13 KESETIMBANGAN KIMIA 1 K e l a s A. Reaksi Kimia Reversible dan Irreversible Tujuan Pembelajaran
 KTSP & K-13 kimia K e l a s XI KESETIMBANGAN KIMIA 1 Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami definisi reaksi kimia reversible dan irreversible..
KTSP & K-13 kimia K e l a s XI KESETIMBANGAN KIMIA 1 Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami definisi reaksi kimia reversible dan irreversible..
Kinetika Reaksi Homogen Sistem Reaktor Alir (Kontinyu)
 KINETIKA DAN KATALISIS / SEMESTER PENDEK 2009-2010 PRODI TEKNIK KIMIA FTI UPN VETERAN YOGYAKARTA Kinetika Reaksi Homogen Sistem Reaktor Alir (Kontinyu) Senin, 19 Juli 2010 / Siti Diyar Kholisoh, ST, MT
KINETIKA DAN KATALISIS / SEMESTER PENDEK 2009-2010 PRODI TEKNIK KIMIA FTI UPN VETERAN YOGYAKARTA Kinetika Reaksi Homogen Sistem Reaktor Alir (Kontinyu) Senin, 19 Juli 2010 / Siti Diyar Kholisoh, ST, MT
PETA KONSEP LAJU REAKSI. Percobaan. Waktu perubahan. Hasil reaksi. Pereaksi. Katalis. Suhu pereaksi. Konsentrasi. Luas. permukaan.
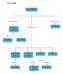 PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka
 Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka waktu reaksi berlangsung pada suhu 90 o C Susu dipasteurisasi
Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka waktu reaksi berlangsung pada suhu 90 o C Susu dipasteurisasi
LAJU REAKSI MEKANISME REAKSI
 KINETIKA KIMIA LAJU REAKSI BAGAIMANA PERUB. KIMIA TSB BERLANGSUNG - BESI MUDAH BERKARAT PD UDARA YANG LEMBAB - MAKANAN LEBIH CEPAT BUSUK BILA TIDAK DIINGINKAN MEKANISME REAKSI - PENJUMLAHAN TAHAP TAHAP
KINETIKA KIMIA LAJU REAKSI BAGAIMANA PERUB. KIMIA TSB BERLANGSUNG - BESI MUDAH BERKARAT PD UDARA YANG LEMBAB - MAKANAN LEBIH CEPAT BUSUK BILA TIDAK DIINGINKAN MEKANISME REAKSI - PENJUMLAHAN TAHAP TAHAP
Waktu (t) Gambar 3.1 Grafik hubungan perubahan konsentrasi terhadap waktu
 3 LAJU REAKSI Setelah mempelajari bab ini, kamu diharapkan mampu: Menghitung konsentrasi larutan (molaritas larutan). Menganalisis faktor-faktor yang mempengaruhi laju reaksi (konsentrasi, luas permukaan,
3 LAJU REAKSI Setelah mempelajari bab ini, kamu diharapkan mampu: Menghitung konsentrasi larutan (molaritas larutan). Menganalisis faktor-faktor yang mempengaruhi laju reaksi (konsentrasi, luas permukaan,
MODUL 1 TERMOKIMIA. A. Hukum Pertama Termodinamika. B. Kalor Reaksi
 MODUL 1 TERMOKIMIA Termokimia adalah ilmu yang mempelajari hubungan antara energi panas dan energi kimia. Sebagai prasyarat untuk mempelajari termokimia, kita harus mengetahui tentang perbedaan kalor (Q)
MODUL 1 TERMOKIMIA Termokimia adalah ilmu yang mempelajari hubungan antara energi panas dan energi kimia. Sebagai prasyarat untuk mempelajari termokimia, kita harus mengetahui tentang perbedaan kalor (Q)
KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN
 KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN 1. Suatu reaksi dikatakan mencapai kesetimbangan apabila. A. laju reaksi ke kiri sama dengan ke kanan B. jumlah koefisien reaksi ruas kiri sama dengan ruas kanan
KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN 1. Suatu reaksi dikatakan mencapai kesetimbangan apabila. A. laju reaksi ke kiri sama dengan ke kanan B. jumlah koefisien reaksi ruas kiri sama dengan ruas kanan
Laju Reaksi KIM 2 A. KEMOLARAN B. LAJU REAKSI C. UNGKAPAN LAJU REAKSI LAJU REAKSI. materi78.co.nr
 Laju eaksi A. KEMOLAAN Dalam laju reaksi, besaran yang digunakan adalah kemolaran benda. Kemolaran menyatakan jumlah mol zat terlarut dari tiap liter larutan atau gas, menunjukkan kekentalan atau kepekatan.
Laju eaksi A. KEMOLAAN Dalam laju reaksi, besaran yang digunakan adalah kemolaran benda. Kemolaran menyatakan jumlah mol zat terlarut dari tiap liter larutan atau gas, menunjukkan kekentalan atau kepekatan.
MODUL LAJU REAKSI. Laju reaksi _ 2013 Page 1
 MODUL LAJU REAKSI Standar Kompetensi ( SK ) : Memahami kinetika reaksi, kesetimbangan kimia dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri. Kompetensi
MODUL LAJU REAKSI Standar Kompetensi ( SK ) : Memahami kinetika reaksi, kesetimbangan kimia dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri. Kompetensi
c. Suhu atau Temperatur
 Pada laju reaksi terdapat faktor-faktor yang dapat mempengaruhi laju reaksi. Selain bergantung pada jenis zat yang beraksi laju reaksi dipengaruhi oleh : a. Konsentrasi Pereaksi Pada umumnya jika konsentrasi
Pada laju reaksi terdapat faktor-faktor yang dapat mempengaruhi laju reaksi. Selain bergantung pada jenis zat yang beraksi laju reaksi dipengaruhi oleh : a. Konsentrasi Pereaksi Pada umumnya jika konsentrasi
SOAL KIMIA 2 KELAS : XI IPA
 SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
LAPORAN PRAKTIKUM KIMIA DASAR
 LAPORAN PRAKTIKUM KIMIA DASAR KECEPATAN REAKSI Disusun Oleh : 1. Achmad Zaimul Khaqqi (132500030) 2. Dinda Kharisma Asmara (132500014) 3. Icha Restu Maulidiah (132500033) 4. Jauharatul Lailiyah (132500053)
LAPORAN PRAKTIKUM KIMIA DASAR KECEPATAN REAKSI Disusun Oleh : 1. Achmad Zaimul Khaqqi (132500030) 2. Dinda Kharisma Asmara (132500014) 3. Icha Restu Maulidiah (132500033) 4. Jauharatul Lailiyah (132500053)
Kunci jawaban dan pembahasan soal laju reaksi
 Kunci jawaban dan pembahasan soal laju reaksi Soal nomor 1 Mencari volume yang dibutuhkan pada proses pengenceran. Rumus pengenceran V 1. M 1 = V 2. M 2 Misal volume yang dibutuhkan sebanyak x ml, maka
Kunci jawaban dan pembahasan soal laju reaksi Soal nomor 1 Mencari volume yang dibutuhkan pada proses pengenceran. Rumus pengenceran V 1. M 1 = V 2. M 2 Misal volume yang dibutuhkan sebanyak x ml, maka
Soal Soal Kesetimbangan Kimia. Proses Haber-Bosch merupakan proses pembentukan atau produksi ammonia berdasarkan reaksi:
 Nama : Fitria Puspita NIM : 1201760 Kelas : Pendidikan Kimia A Soal Soal Kesetimbangan Kimia SBMPTN 2014 Untuk soal no 1-3, bacalah narasi berikut. Proses Haber-Bosch merupakan proses pembentukan atau
Nama : Fitria Puspita NIM : 1201760 Kelas : Pendidikan Kimia A Soal Soal Kesetimbangan Kimia SBMPTN 2014 Untuk soal no 1-3, bacalah narasi berikut. Proses Haber-Bosch merupakan proses pembentukan atau
Bahasan: Mempelajari kecepatan/laju reaksi suatu proses/perubahan kimia. reaksi berlangsung mekanisme reaksi
 Mempelajari kecepatan/laju reaksi suatu proses/perubahan kimia. Kinetika juga mempelajari bagaimana reaksi berlangsung mekanisme reaksi Referensi: Brown et.al; Chemistry, The Central Science, 11th edition
Mempelajari kecepatan/laju reaksi suatu proses/perubahan kimia. Kinetika juga mempelajari bagaimana reaksi berlangsung mekanisme reaksi Referensi: Brown et.al; Chemistry, The Central Science, 11th edition
Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam
 Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam sistem pada kesetimbangan Uap mengembun dengan laju
Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam sistem pada kesetimbangan Uap mengembun dengan laju
H 2 O (l) H 2 O (g) Kesetimbangan kimia. N 2 O 4 (g) 2NO 2 (g)
 Purwanti Widhy H Kesetimbangan adalah suatu keadaan di mana tidak ada perubahan yang terlihat seiring berjalannya waktu. Kesetimbangan kimia tercapai jika: Laju reaksi maju dan laju reaksi balik sama besar
Purwanti Widhy H Kesetimbangan adalah suatu keadaan di mana tidak ada perubahan yang terlihat seiring berjalannya waktu. Kesetimbangan kimia tercapai jika: Laju reaksi maju dan laju reaksi balik sama besar
Kesetimbangan Kimia. Bab 4
 Kesetimbangan Kimia Bab 4 Standar Kompetensi 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang memengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri Kompetensi
Kesetimbangan Kimia Bab 4 Standar Kompetensi 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang memengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri Kompetensi
tanya-tanya.com Soal No.2 Apabila anda diminta untuk mengukur laju reaksi terhadap reaksi : Zn(s) + 2HCI(aq)
 Soal No.1 Apa yang di maksud dengan laju reaksi dan satuan dari laju reaksi? Laju reaksi dinyatakan sebagai berkurangnya jumlah pereaksi untuk setiap satuan waktu atau bertambahnya jumlah hasil reaksi
Soal No.1 Apa yang di maksud dengan laju reaksi dan satuan dari laju reaksi? Laju reaksi dinyatakan sebagai berkurangnya jumlah pereaksi untuk setiap satuan waktu atau bertambahnya jumlah hasil reaksi
KAJIAN KERANGKA BERPIKIR
 KAJIAN Materi kimia merupakan salah satu materi essensial yang sebagian besar konsepnya bersifat invisible. Dimulai dengan reaksi searah dan dua arah, keadaan setimbang dinamis, reaksi homogen dan heterogen,
KAJIAN Materi kimia merupakan salah satu materi essensial yang sebagian besar konsepnya bersifat invisible. Dimulai dengan reaksi searah dan dua arah, keadaan setimbang dinamis, reaksi homogen dan heterogen,
Kinetika Reaksi Homogen Sistem Reaktor Alir (Kontinyu)
 KINETIKA DAN KATALISIS / SEMESTER GENAP 2010-2011 PRODI TEKNIK KIMIA FTI UPN VETERAN YOGYAKARTA Kinetika Reaksi Homogen Sistem Reaktor Alir (Kontinyu) Siti Diyar Kholisoh & I Gusti S. Budiaman / Juni 2011
KINETIKA DAN KATALISIS / SEMESTER GENAP 2010-2011 PRODI TEKNIK KIMIA FTI UPN VETERAN YOGYAKARTA Kinetika Reaksi Homogen Sistem Reaktor Alir (Kontinyu) Siti Diyar Kholisoh & I Gusti S. Budiaman / Juni 2011
KONSEP KESETIMBANGAN KIMIA
 KONSEP KESETIMBANGAN KIMIA 1. 2. 3. HUKUM KEKEKALAN ENERGI PENGERTIAN KERJA DAN KALOR PENGERTIAN SISTEM, LINGKUNGAN, DAN FUNGSI KEADAAN HUKUM PERTAMA TERMODINAMIKA HUKUM KEDUA TERMODINAMIKA 4. 5. 6. ENERGI
KONSEP KESETIMBANGAN KIMIA 1. 2. 3. HUKUM KEKEKALAN ENERGI PENGERTIAN KERJA DAN KALOR PENGERTIAN SISTEM, LINGKUNGAN, DAN FUNGSI KEADAAN HUKUM PERTAMA TERMODINAMIKA HUKUM KEDUA TERMODINAMIKA 4. 5. 6. ENERGI
LEMBAR KERJA SISWA 4
 88 LEMBAR KERJA SISWA 4 Mata Pelajaran Kelas/Semester Materi Pokok Submateri Pokok Alokasi Waktu : Kimia : I/ganjil : Laju Reaksi : Teori Tumbukan : 2 x 45 menit Standar Kompetensi Memahami Kinetika Reaksi,
88 LEMBAR KERJA SISWA 4 Mata Pelajaran Kelas/Semester Materi Pokok Submateri Pokok Alokasi Waktu : Kimia : I/ganjil : Laju Reaksi : Teori Tumbukan : 2 x 45 menit Standar Kompetensi Memahami Kinetika Reaksi,
Kode KIM.10. Laju Reaksi
 Kode KIM.10 Laju Reaksi BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN NASIONAL 2004 BAB I. PENDAHULUAN
Kode KIM.10 Laju Reaksi BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN NASIONAL 2004 BAB I. PENDAHULUAN
BAB II DASAR TEORI. FeO. CO Fe CO 2. Fe 3 O 4. Fe 2 O 3. Gambar 2.1. Skema arah pergerakan gas CO dan reduksi
 BAB II DASAR TEORI Pengujian reduksi langsung ini didasari oleh beberapa teori yang mendukungnya. Berikut ini adalah dasar-dasar teori mengenai reduksi langsung yang mendasari penelitian ini. 2.1. ADSORPSI
BAB II DASAR TEORI Pengujian reduksi langsung ini didasari oleh beberapa teori yang mendukungnya. Berikut ini adalah dasar-dasar teori mengenai reduksi langsung yang mendasari penelitian ini. 2.1. ADSORPSI
PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH
 PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH TAHUN 2016 Soal diketik ulang oleh urip rukim (www.urip.info)
PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH TAHUN 2016 Soal diketik ulang oleh urip rukim (www.urip.info)
kimia LAJU REAKSI 1 TUJUAN PEMBELAJARAN
 KTSP & K-13 kimia K e l a s XI LAJU REAKSI 1 TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konsep molaritas. 2. Memahami definisi dan faktor-faktor
KTSP & K-13 kimia K e l a s XI LAJU REAKSI 1 TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konsep molaritas. 2. Memahami definisi dan faktor-faktor
Pelatihan Online I OSN Bidang Kimia Page 1 PETUNJUK PENGERJAAN SOAL
 PETUNJUK PENGERJAAN SOAL 1. Periksalah terlebih dahulu soal yang Anda terima, apakah dalam keadaan baik, terbaca, lengkap, dan jelas, sebelum Anda mengerjakan. 2. Jawaban dikerjakan pada lembar jawaban
PETUNJUK PENGERJAAN SOAL 1. Periksalah terlebih dahulu soal yang Anda terima, apakah dalam keadaan baik, terbaca, lengkap, dan jelas, sebelum Anda mengerjakan. 2. Jawaban dikerjakan pada lembar jawaban
Kesetimbangan Kimia. A b d u l W a h i d S u r h i m
 Kesetimbangan Kimia A b d u l W a h i d S u r h i m 2 0 1 4 Rujukan Chapter 12 dan 14: Masterton, William L. and Hurley, Cecile N. 2009. Chemistry: Principles and Reactions. Sixth Edition. Books/Cole.
Kesetimbangan Kimia A b d u l W a h i d S u r h i m 2 0 1 4 Rujukan Chapter 12 dan 14: Masterton, William L. and Hurley, Cecile N. 2009. Chemistry: Principles and Reactions. Sixth Edition. Books/Cole.
A. HUKUM PERBANDINGAN VOLUM DAN HIPOTESIS AVOGADRO*
 Di muka kita telah membahas tentang jenis perubahan materi. Bagian dari Kimia yang membahas hubungan kuantitatif (jumlah) antara zat-zat yang terlibat dalam suatu perubahan kimia atau reaksi kimia dikenal
Di muka kita telah membahas tentang jenis perubahan materi. Bagian dari Kimia yang membahas hubungan kuantitatif (jumlah) antara zat-zat yang terlibat dalam suatu perubahan kimia atau reaksi kimia dikenal
BAB II KAJIAN PUSTAKA. kemampuan adalah karakteristik yang menonjol dari seorang individu yang
 BAB II KAJIAN PUSTAKA 2.1 Defenisi Kemampuan Kemampuan sama dengan kata kesanggupan atau kecakapan. Dengan bahasa yang lebih terperinci, kemampuan dapat diartikan sebagai kesanggupan individu untuk melakukan
BAB II KAJIAN PUSTAKA 2.1 Defenisi Kemampuan Kemampuan sama dengan kata kesanggupan atau kecakapan. Dengan bahasa yang lebih terperinci, kemampuan dapat diartikan sebagai kesanggupan individu untuk melakukan
Abdul Wahid Surhim 2014
 Abdul Wahid Surhim 2014 Kerangka Pembelajaran Persamaan Kimia Pola Reaktivitas Kimia Berat Atom dan Molekul Mol Rumus Empirik dari Analisis Informasi Kuantitatif dari Persamaan yang Disetarakan Membatasi
Abdul Wahid Surhim 2014 Kerangka Pembelajaran Persamaan Kimia Pola Reaktivitas Kimia Berat Atom dan Molekul Mol Rumus Empirik dari Analisis Informasi Kuantitatif dari Persamaan yang Disetarakan Membatasi
Gambar 2.1 Reaksi Saponifikasi tripalmitin
 I. JUDUL : Kinetika Reaksi Saponifikasi Etil Asetat II. TANGGAL PERCOBAAN : Rabu, 16 November 2011 III. TUJUAN : 1. Untuk memberikan gambaran bahwa reaksi penyabunan etil asetat oleh ion hidroksida adalah
I. JUDUL : Kinetika Reaksi Saponifikasi Etil Asetat II. TANGGAL PERCOBAAN : Rabu, 16 November 2011 III. TUJUAN : 1. Untuk memberikan gambaran bahwa reaksi penyabunan etil asetat oleh ion hidroksida adalah
Kesetimbangan Kimia. Tim Dosen Kimia Dasar FTP
 Kesetimbangan Kimia Tim Dosen Kimia Dasar FTP Pengertian kesetimbangan kimia Suatu sistem dikatakan setimbang jika dua proses yang berlawanan terjadi dengan laju yang sama atau dengan kata lain tidak terjadi
Kesetimbangan Kimia Tim Dosen Kimia Dasar FTP Pengertian kesetimbangan kimia Suatu sistem dikatakan setimbang jika dua proses yang berlawanan terjadi dengan laju yang sama atau dengan kata lain tidak terjadi
Soal-Soal. Bab 4. Latihan. Laju Reaksi. 1. Madu dengan massa jenis 1,4 gram/ cm 3 mengandung glukosa (M r. 5. Diketahui reaksi:
 Bab Laju Reaksi Soal-Soal Latihan. Madu dengan massa jenis, gram/ cm 3 mengandung glukosa (M r = 80) sebanyak 35 % b/b. Kemolaran glukosa dalam madu adalah... 0,8 M (D),7 M,8 M (E) 3,0 M, M. Untuk membuat
Bab Laju Reaksi Soal-Soal Latihan. Madu dengan massa jenis, gram/ cm 3 mengandung glukosa (M r = 80) sebanyak 35 % b/b. Kemolaran glukosa dalam madu adalah... 0,8 M (D),7 M,8 M (E) 3,0 M, M. Untuk membuat
Siswa diingatkan tentang struktur atom, bilangan kuantum, bentuk-bentuk orbital, dan konfigurasi elektron
 RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
Kesetimbangan Kimia. Chapter 9 P N2 O 4. Kesetimbangan akan. Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Kesetimbangan adalah suatu keadaan di mana tidak ada perubahan yang terlihat seiring berjalannya waktu. Kesetimbangan kimia
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Kesetimbangan adalah suatu keadaan di mana tidak ada perubahan yang terlihat seiring berjalannya waktu. Kesetimbangan kimia
1. Perhatikan struktur senyawa berikut!
 . Perhatikan struktur senyawa berikut! CH CH CH CH CH CH CH Jumlah atom C primer, atom C sekunder, dan atom C tersier dari senyawa di atas adalah...,, dan D.,, dan,, dan E.,, dan,, dan. Di bawah ini merupakan
. Perhatikan struktur senyawa berikut! CH CH CH CH CH CH CH Jumlah atom C primer, atom C sekunder, dan atom C tersier dari senyawa di atas adalah...,, dan D.,, dan,, dan E.,, dan,, dan. Di bawah ini merupakan
BAB II KESETIMBANGAN KIMIA
 BAB II KESETIMBANGAN KIMIA TIU : 1. Memahami definisi kimia dan mengidentifikasi keadaan kimia. Memahami faktor-faktor yang mempengaruhi kimia: Prinsip Le Chatelier. Memahami aplikasi kimia dalam perolehan
BAB II KESETIMBANGAN KIMIA TIU : 1. Memahami definisi kimia dan mengidentifikasi keadaan kimia. Memahami faktor-faktor yang mempengaruhi kimia: Prinsip Le Chatelier. Memahami aplikasi kimia dalam perolehan
OAL TES SEMESTER I. I. Pilihlah jawaban yang paling tepat! a. 2d d. 3p b. 2p e. 3s c. 3d 6. Unsur X dengan nomor atom
 KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
1. Hukum Lavoisier 2. Hukum Proust 3. Hukum Dalton 4. Hukum Gay Lussac & Hipotesis Avogadro
 - - 1. Hukum Lavoisier 2. Hukum Proust 3. Hukum Dalton 4. Hukum Gay Lussac & Hipotesis Avogadro 1. Hukum Lavoisier (Hukum Kekekalan Massa) : Dalam sistem tertutup, massa zat sebelum dan sesudah reaksi
- - 1. Hukum Lavoisier 2. Hukum Proust 3. Hukum Dalton 4. Hukum Gay Lussac & Hipotesis Avogadro 1. Hukum Lavoisier (Hukum Kekekalan Massa) : Dalam sistem tertutup, massa zat sebelum dan sesudah reaksi
BAB 6. (lihat diktat kuliah KIMIA : Bab 6 dan 7)
 BAB 6 (lihat diktat kuliah KIMIA : Bab 6 dan 7) KONSEP KESETIMBANGAN KIMIA 1. HUKUM KEKEKALAN ENERGI 2. PENGERTIAN KERJA DAN KALOR 3. PENGERTIAN SISTEM, LINGKUNGAN, DAN FUNGSI KEADAAN 4. HUKUM PERTAMA
BAB 6 (lihat diktat kuliah KIMIA : Bab 6 dan 7) KONSEP KESETIMBANGAN KIMIA 1. HUKUM KEKEKALAN ENERGI 2. PENGERTIAN KERJA DAN KALOR 3. PENGERTIAN SISTEM, LINGKUNGAN, DAN FUNGSI KEADAAN 4. HUKUM PERTAMA
HASIL DAN PEMBAHASAN
 HASIL DAN PEMBAHASAN Analisis Kebutuhan Daya Static Mixing Reactor Alat penelitian dirancang dan dibangun tanpa perhitungan rancangan struktural yang rinci. Meskipun demikian, perhitungan lebih rinci untuk
HASIL DAN PEMBAHASAN Analisis Kebutuhan Daya Static Mixing Reactor Alat penelitian dirancang dan dibangun tanpa perhitungan rancangan struktural yang rinci. Meskipun demikian, perhitungan lebih rinci untuk
Stoikiometri. Bab 3. Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Secara Mikro atom & molekul.
 Bab 3 Stoikiometri Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional: 1 atom 12 C beratnya 12 sma Jika ditimbang
Bab 3 Stoikiometri Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional: 1 atom 12 C beratnya 12 sma Jika ditimbang
BAB I PENDAHULUAN 1.1 Latar Belakang 1.2 Perumusan Masalah
 BAB I PENDAHULUAN 1.1 Latar Belakang Lemak dan minyak adalah trigliserida yang berarti triester (dari) gliserol. Perbedaan antara suatu lemak adalah pada temperatur kamar, lemak akan berbentuk padat dan
BAB I PENDAHULUAN 1.1 Latar Belakang Lemak dan minyak adalah trigliserida yang berarti triester (dari) gliserol. Perbedaan antara suatu lemak adalah pada temperatur kamar, lemak akan berbentuk padat dan
PENGARUH KATALISIS TERHADAP TETAPAN LAJU
 PENGARUH KATALISIS TERHADAP TETAPAN LAJU Laju reaksi sering dipengaruhi oleh adanya katalis Contoh : Hidrolisis sukrosa dalam air Suhu kamar lama (bisa beberapa bulan) Namun jika hidrolisis dilakukan dalam
PENGARUH KATALISIS TERHADAP TETAPAN LAJU Laju reaksi sering dipengaruhi oleh adanya katalis Contoh : Hidrolisis sukrosa dalam air Suhu kamar lama (bisa beberapa bulan) Namun jika hidrolisis dilakukan dalam
KINETIKA KIMIA LAJU DAN MEKANISME DALAM REAKSI KIMIA. Disampaikan oleh : Dr. Sri Handayani 2013
 KINETIK KIMI LJU DN MEKNISME DLM REKSI KIMI Disampaikan oleh : Dr. Sri Handayani 03 Pendahuluan Perubahan kimia secara sederhana diulis dalam persamaan reaksi dengan koefisien seimbang Namun persamaan
KINETIK KIMI LJU DN MEKNISME DLM REKSI KIMI Disampaikan oleh : Dr. Sri Handayani 03 Pendahuluan Perubahan kimia secara sederhana diulis dalam persamaan reaksi dengan koefisien seimbang Namun persamaan
Wardaya College IKATAN KIMIA STOIKIOMETRI TERMOKIMIA CHEMISTRY. Part III. Summer Olympiad Camp Kimia SMA
 Part I IKATAN KIMIA CHEMISTRY Summer Olympiad Camp 2017 - Kimia SMA 1. Untuk menggambarkan ikatan yang terjadi dalam suatu molekul kita menggunakan struktur Lewis atau 'dot and cross' (a) Tuliskan formula
Part I IKATAN KIMIA CHEMISTRY Summer Olympiad Camp 2017 - Kimia SMA 1. Untuk menggambarkan ikatan yang terjadi dalam suatu molekul kita menggunakan struktur Lewis atau 'dot and cross' (a) Tuliskan formula
HUBUNGAN ENERGI DALAM REAKSI KIMIA
 HUBUNGAN ENERGI DALAM REAKSI KIMIA _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA ENERGI & KERJA Energi adalah kemampuan untuk melakukan kerja.
HUBUNGAN ENERGI DALAM REAKSI KIMIA _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA ENERGI & KERJA Energi adalah kemampuan untuk melakukan kerja.
PERCOBAAN 3 PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI
 LAPORAN PRAKTIKUM KIMIA FISIKA Nama : Any Kurniawati Kelompok : 6 NIM : 4301410009 Prodi/Jurusan : Pend. Kimia/Kimia Dosen : Ir. Sri Wahyuni, M.Si Tanggal Praktikum : 19 September 2012 Teman kerja : Fitriya
LAPORAN PRAKTIKUM KIMIA FISIKA Nama : Any Kurniawati Kelompok : 6 NIM : 4301410009 Prodi/Jurusan : Pend. Kimia/Kimia Dosen : Ir. Sri Wahyuni, M.Si Tanggal Praktikum : 19 September 2012 Teman kerja : Fitriya
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
KIMIA TERAPAN STOIKIOMETRI DAN HUKUM-HUKUM KIMIA Haris Puspito Buwono
 KIMIA TERAPAN STOIKIOMETRI DAN HUKUM-HUKUM KIMIA Haris Puspito Buwono Semester Gasal 2012/2013 STOIKIOMETRI 2 STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi
KIMIA TERAPAN STOIKIOMETRI DAN HUKUM-HUKUM KIMIA Haris Puspito Buwono Semester Gasal 2012/2013 STOIKIOMETRI 2 STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi
Kesetimbangan Kimia KIM 2 A. PENDAHULUAN B. REAKSI KESETIMBANGAN. α = KESETIMBANGAN KIMIA. materi78.co.nr. setimbang
 konsentrasi laju reaksi materi78.co.nr Kesetimbangan Kimia A. PENDAHULUAN Reaksi satu arah (irreversible) atau reaksi tidak dapat balik adalah reaksi yang terjadi pada satu arah, dan produknya tidak dapat
konsentrasi laju reaksi materi78.co.nr Kesetimbangan Kimia A. PENDAHULUAN Reaksi satu arah (irreversible) atau reaksi tidak dapat balik adalah reaksi yang terjadi pada satu arah, dan produknya tidak dapat
Massa atom merupakan massa dari atom dalam satuan massa atom (sma).
 Bab 3 Stoikiometri Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional: 1 atom 12 C beratnya 12 sma Jika ditimbang
Bab 3 Stoikiometri Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional: 1 atom 12 C beratnya 12 sma Jika ditimbang
STOKIOMETRI. Kimia Kelas X
 STOKIOMETRI Kimia Kelas X SEKOLAH MENENGAH ATAS NEGERI 12 SURABAYA 2015 STOKIOMETRI STOKIOMETRI Pada materi stokiometri, kita akan mempelajari beberapa hal seperti persamaan reaksi, hukum-hukum dasar kimia,
STOKIOMETRI Kimia Kelas X SEKOLAH MENENGAH ATAS NEGERI 12 SURABAYA 2015 STOKIOMETRI STOKIOMETRI Pada materi stokiometri, kita akan mempelajari beberapa hal seperti persamaan reaksi, hukum-hukum dasar kimia,
Teknik Reaksi Kimia Lanjut
 UNIVERSITAS INDONESIA Teknik Reaksi Kimia Lanjut Pasca Sarjana Dicka A Rahim [ 110610795 ] Rindang Isnaniar Wisnu Aji [ 1106109043 ] 01 D E P O K P4 5 A Reaksi fase liquid : A + B C Mengikuti persamaan
UNIVERSITAS INDONESIA Teknik Reaksi Kimia Lanjut Pasca Sarjana Dicka A Rahim [ 110610795 ] Rindang Isnaniar Wisnu Aji [ 1106109043 ] 01 D E P O K P4 5 A Reaksi fase liquid : A + B C Mengikuti persamaan
STOIKIOMETRI I. HUKUM DASAR ILMU KIMIA
 STOIKIOMETRI I. HUKUM DASAR ILMU KIMIA a. Hukum Kekekalan Massa (Hukum Lavoisier) Massa zat sebelum dan sesudah reaksi adalah sama. Contoh: S + O 2 SO 2 2 gr 32 gr 64 gr b. Hukum Perbandingan Tetap (Hukum
STOIKIOMETRI I. HUKUM DASAR ILMU KIMIA a. Hukum Kekekalan Massa (Hukum Lavoisier) Massa zat sebelum dan sesudah reaksi adalah sama. Contoh: S + O 2 SO 2 2 gr 32 gr 64 gr b. Hukum Perbandingan Tetap (Hukum
PRAKTIKUM KIMIA DASAR I KECEPATAN REAKSI. Kelompok V : Amir Hamzah Umi Kulsum
 PRAKTIKUM KIMIA DASAR I KECEPATAN REAKSI Kelompok V : Amir Hamzah 1415005 Umi Kulsum 1415018 AKADEMI KIMIA ANALISIS CARAKA NUSANTARA CIMANGGIS, KELAPA DUA DEPOK, 2015 BAB 1 PENDAHULUAN 1.1 Latar Belakang
PRAKTIKUM KIMIA DASAR I KECEPATAN REAKSI Kelompok V : Amir Hamzah 1415005 Umi Kulsum 1415018 AKADEMI KIMIA ANALISIS CARAKA NUSANTARA CIMANGGIS, KELAPA DUA DEPOK, 2015 BAB 1 PENDAHULUAN 1.1 Latar Belakang
Soal Pilihan Ganda Berilah tanda silang pada huruf A, B, C, D atau E di depan jawaban yang benar!
 Soal Pilihan Ganda Berilah tanda silang pada huruf A, B, C, D atau E di depan jawaban yang benar!. Berikut ini adalah ciri-ciri terjadinya reaksi kesetimbangan, kecuali. reaksi reversibel B. terjadi dalam
Soal Pilihan Ganda Berilah tanda silang pada huruf A, B, C, D atau E di depan jawaban yang benar!. Berikut ini adalah ciri-ciri terjadinya reaksi kesetimbangan, kecuali. reaksi reversibel B. terjadi dalam
BAB IV HASIL DAN PEMBAHASAN
 BAB IV HASIL DAN PEMBAHASAN IV.1. KARAKTERISTIK BATUBARA Sampel batubara yang digunakan dalam eksperimen adalah batubara subbituminus. Dengan pengujian proksimasi dan ultimasi yang telah dilakukan oleh
BAB IV HASIL DAN PEMBAHASAN IV.1. KARAKTERISTIK BATUBARA Sampel batubara yang digunakan dalam eksperimen adalah batubara subbituminus. Dengan pengujian proksimasi dan ultimasi yang telah dilakukan oleh
KINETIKA REAKSI PEMBUATAN KALSIUM KARBONAT DARI LIMBAH PUPUK ZA DENGAN PROSES SODA. Suprihatin, Ambarita R.
 KINETIKA REAKSI PEMBUATAN KALSIUM KARBONAT DARI LIMBAH PUPUK ZA DENGAN PROSES SODA Suprihatin, Ambarita R. Jurusan Teknik Kimia, Fakultas Teknologi Industri UPN Veteran Jawa Timur Jl. Raya Rungkut Madya
KINETIKA REAKSI PEMBUATAN KALSIUM KARBONAT DARI LIMBAH PUPUK ZA DENGAN PROSES SODA Suprihatin, Ambarita R. Jurusan Teknik Kimia, Fakultas Teknologi Industri UPN Veteran Jawa Timur Jl. Raya Rungkut Madya
Butadiena, HCN Senyawa Ni/ P Adiponitril Nilon( Serat, plastik) α Olefin, senyawa Rh/ P Aldehid Plasticizer, peluas
 Katalis adalah suatu zat yang ditambahkan pada sistem reaksi untuk meningkatkan laju reaksi tanpa ikut berubah secara kimia pada akhir reaksi. Dan menurut Oswald (1902) mendefinisikan katalis sebagai suatu
Katalis adalah suatu zat yang ditambahkan pada sistem reaksi untuk meningkatkan laju reaksi tanpa ikut berubah secara kimia pada akhir reaksi. Dan menurut Oswald (1902) mendefinisikan katalis sebagai suatu
Rumus Kimia. Mol unsur =
 Rumus Kimia Menentukan Rumus Kimia Zat Rumus kimia zat dapat dibedakan menjadi rumus empiris dan rumus molekul. Rumus empiris dapat ditentukan dengan menghitung mol komponen penyusun zat dengan menggunakan
Rumus Kimia Menentukan Rumus Kimia Zat Rumus kimia zat dapat dibedakan menjadi rumus empiris dan rumus molekul. Rumus empiris dapat ditentukan dengan menghitung mol komponen penyusun zat dengan menggunakan
KONSEP MOL DAN STOIKIOMETRI
 KONSEP MOL DAN STOIKIOMETRI HUKUM-HUKUM DASAR KIMIA 1. Asas Lavoiser atau kekekalan massa jumlah sebelum dan setelah reaksi kimia adalah tetap 2. Hukum Gas Ideal P V = nrt Dengan P adalah tekanan (atm),
KONSEP MOL DAN STOIKIOMETRI HUKUM-HUKUM DASAR KIMIA 1. Asas Lavoiser atau kekekalan massa jumlah sebelum dan setelah reaksi kimia adalah tetap 2. Hukum Gas Ideal P V = nrt Dengan P adalah tekanan (atm),
RENCANA PELAKSANAAN PEMBELAJARAN (RPP) KELAS EKSPERIMEN PERTEMUAN KE-1
 RENCANA PELAKSANAAN PEMBELAJARAN (RPP) KELAS EKSPERIMEN PERTEMUAN KE-1 Sekolah : SMAN 3 Tangerang Selatan Mata Pelajaran : Kimia Kelas/ Semester : XI/ I Tahun Pelajaran : 010/011 Pokok Bahasan : Laju Reaksi
RENCANA PELAKSANAAN PEMBELAJARAN (RPP) KELAS EKSPERIMEN PERTEMUAN KE-1 Sekolah : SMAN 3 Tangerang Selatan Mata Pelajaran : Kimia Kelas/ Semester : XI/ I Tahun Pelajaran : 010/011 Pokok Bahasan : Laju Reaksi
BAB III KESETIMBANGAN KIMIA. AH = 92 kj
 BAB III KESETIMBANGAN KIMIA Amonia (NH 3 ) merupakan salah satu zat kimia yang paling banyak diproduksi. Amonia digunakan terutama untuk membuat pupuk, yaitu urea dan ZA. Penggunaan amonia yang lain, yaitu
BAB III KESETIMBANGAN KIMIA Amonia (NH 3 ) merupakan salah satu zat kimia yang paling banyak diproduksi. Amonia digunakan terutama untuk membuat pupuk, yaitu urea dan ZA. Penggunaan amonia yang lain, yaitu
KINETIKA REAKSI KIMIA TIM DOSEN KIMIA DASAR FTP UB 2012
 KINETIKA REAKSI KIMIA TIM DOSEN KIMIA DASAR FTP UB Konsep Kinetia/ Laju Reasi Laju reasi menyataan laju perubahan onsentrasi zat-zat omponen reasi setiap satuan watu: V [ M ] t Laju pengurangan onsentrasi
KINETIKA REAKSI KIMIA TIM DOSEN KIMIA DASAR FTP UB Konsep Kinetia/ Laju Reasi Laju reasi menyataan laju perubahan onsentrasi zat-zat omponen reasi setiap satuan watu: V [ M ] t Laju pengurangan onsentrasi
H = H hasil reaksi H pereaksi. Larutan HCl
 Standar Kompetensi Kompetensi Dasar Memahami perubahan energi dalam kimia, cara pengukuran dan sifat ketidakteraturan dalam alam semesta. Menjelaskan pengertian tentang entalpi suatu zat dan perubahannya.
Standar Kompetensi Kompetensi Dasar Memahami perubahan energi dalam kimia, cara pengukuran dan sifat ketidakteraturan dalam alam semesta. Menjelaskan pengertian tentang entalpi suatu zat dan perubahannya.
Materi Pokok Bahasan :
 STOIKIOMETRI Kompetensi : Memiliki kemampuan untuk menginterpretasikan serta menerapkan dalam perhitungan kimia. Memiliki kemampuan untuk mengaplikasikan pengetahuan yang dimilikinya dan terbiasa menggunakan
STOIKIOMETRI Kompetensi : Memiliki kemampuan untuk menginterpretasikan serta menerapkan dalam perhitungan kimia. Memiliki kemampuan untuk mengaplikasikan pengetahuan yang dimilikinya dan terbiasa menggunakan
BAB II LANDASAN TEORI
 digilib.uns.ac.id BAB II LANDASAN TEORI A. Tinjauan Pustaka 1. Mekanisme reaksi hidrogen peroksida dengan iodida a. Hidrogen peroksida Hidrogen peroksida merupakan agen pengoksidasi yang kuat. Senyawa
digilib.uns.ac.id BAB II LANDASAN TEORI A. Tinjauan Pustaka 1. Mekanisme reaksi hidrogen peroksida dengan iodida a. Hidrogen peroksida Hidrogen peroksida merupakan agen pengoksidasi yang kuat. Senyawa
Contoh Soal & Pembahasan Reaksi Kesetimbangan
 Soal No.1 Contoh Soal & Pembahasan Reaksi Kesetimbangan Reaksi kimia ada yang berlangsung searah (berkesudahan) dan ada yang dapat balik (bolak-balik). Jelaskan perbedaanya disertai dengan contoh-contohnya.
Soal No.1 Contoh Soal & Pembahasan Reaksi Kesetimbangan Reaksi kimia ada yang berlangsung searah (berkesudahan) dan ada yang dapat balik (bolak-balik). Jelaskan perbedaanya disertai dengan contoh-contohnya.
KESETIMBANGAN. titik setimbang
 KESETIMBANGAN STANDART KOMPETENSI;. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang berpengaruh, serta penerapannya dalam kehidupan sehari-hari. KOMPETENSI DASAR;.. Menjelaskan kestimbangan
KESETIMBANGAN STANDART KOMPETENSI;. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang berpengaruh, serta penerapannya dalam kehidupan sehari-hari. KOMPETENSI DASAR;.. Menjelaskan kestimbangan
TEORI TUMBUKAN PADA LAJU REAKSI KIMIA
 PENGEMBANGAN BAHAN AJAR TEORI TUMBUKAN PADA LAJU REAKSI KIMIA OLEH : Drs. I Wayan Suarsa, M.Si JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS UDAYANA 2017 Kata Pengantar Puji dan
PENGEMBANGAN BAHAN AJAR TEORI TUMBUKAN PADA LAJU REAKSI KIMIA OLEH : Drs. I Wayan Suarsa, M.Si JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS UDAYANA 2017 Kata Pengantar Puji dan
Soal 5 Jumlah mol dari 29,8 gram amonium fosfat ((NH4)3PO4) (Ar N = 14, H = 1, dan P = 31) adalah. A. 0,05 mol
 Bank Soal Stoikiometri Kimia Bagian 2 Soal 1 Satu liter campuran gas terdiri dari 60% volume metana (CH4) dan sisanya gas etana (C2H6) dibakar sempurna sesuai reaksi: CH4 + 3 O2 2 CO2 + 2 H2O 2 C2H6 +
Bank Soal Stoikiometri Kimia Bagian 2 Soal 1 Satu liter campuran gas terdiri dari 60% volume metana (CH4) dan sisanya gas etana (C2H6) dibakar sempurna sesuai reaksi: CH4 + 3 O2 2 CO2 + 2 H2O 2 C2H6 +
BAB IV TERMOKIMIA A. PENGERTIAN KALOR REAKSI
 BAB IV TERMOKIMIA A. Standar Kompetensi: Memahami tentang ilmu kimia dan dasar-dasarnya serta mampu menerapkannya dalam kehidupan se-hari-hari terutama yang berhubungan langsung dengan kehidupan. B. Kompetensi
BAB IV TERMOKIMIA A. Standar Kompetensi: Memahami tentang ilmu kimia dan dasar-dasarnya serta mampu menerapkannya dalam kehidupan se-hari-hari terutama yang berhubungan langsung dengan kehidupan. B. Kompetensi
Chapter 6. Gas. Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Chapter 6 Gas Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Beberapa zat yang berwujud gas pada suhu 25 0 C dan tekanan 1 Atm 5.1 1 5.1 Sifat-sifat fisis yang
Chapter 6 Gas Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Beberapa zat yang berwujud gas pada suhu 25 0 C dan tekanan 1 Atm 5.1 1 5.1 Sifat-sifat fisis yang
MATA PELAJARAN/PAKET KEAHLIAN KIMIA
 SUMBER BELAJAR PENUNJANG PLPG 2016 MATA PELAJARAN/PAKET KEAHLIAN KIMIA BAB III ENERGITIKA, KINETIKA, DAN KESETIMBANGAN KIMIA Prof. Dr. Sudarmin, M.Si Dra. Woro Sumarni, M.Si Cepi Kurniawan, M.Si, Ph.D
SUMBER BELAJAR PENUNJANG PLPG 2016 MATA PELAJARAN/PAKET KEAHLIAN KIMIA BAB III ENERGITIKA, KINETIKA, DAN KESETIMBANGAN KIMIA Prof. Dr. Sudarmin, M.Si Dra. Woro Sumarni, M.Si Cepi Kurniawan, M.Si, Ph.D
KONVERSI KATALITIK GLYCEROL MENJADI ACETOL (HYDROXI-2 PROPANON) Pembimbing : Prof. Dr. Ir. Suprapto, DEA
 KONVERSI KATALITIK GLYCEROL MENJADI ACETOL (HYDROXI-2 PROPANON) Pembimbing : Prof. Dr. Ir. Suprapto, DEA Presentasi Tesis 1 Pebruari 2010 Oleh : Abdul Chalim (NRP. 2307 201 008) Program Magister Jurusan
KONVERSI KATALITIK GLYCEROL MENJADI ACETOL (HYDROXI-2 PROPANON) Pembimbing : Prof. Dr. Ir. Suprapto, DEA Presentasi Tesis 1 Pebruari 2010 Oleh : Abdul Chalim (NRP. 2307 201 008) Program Magister Jurusan
Laporan Kimia Fisik KI-3141
 Laporan Kimia Fisik KI-3141 PERCOBN M-1 KINETIK HLOGENSI SETON DENGN KTLISTOR SM Nama : Kartika Trianita NIM : 1517 Kelompok : 2 Tanggal Percobaan : 22 Oktober 212 Tanggal Laporan : 2 November 212 sisten
Laporan Kimia Fisik KI-3141 PERCOBN M-1 KINETIK HLOGENSI SETON DENGN KTLISTOR SM Nama : Kartika Trianita NIM : 1517 Kelompok : 2 Tanggal Percobaan : 22 Oktober 212 Tanggal Laporan : 2 November 212 sisten
