wanibesak.wordpress.com
|
|
|
- Teguh Atmadja
- 7 tahun lalu
- Tontonan:
Transkripsi
1 1. Diberikan beberapa pernyataan 1) katalis dapat mempercepat laju reaksi dengan cara menaikan energi aktivasi 2) tahap penentu laju reaksi adalah tahap reaksi yang berlangsung paling lambat 3) laju reaksi didefinisikan sebagai berkurangnya molaritas produk tiap satuan waktu 4) makin luas permukaan zat, maka laju reaksi makin cepat Pernyataan yang benar mengenai laju reaksi adalah. (A) (2) dan (3) benar (B) (1) dan (3) benar (C) (2) dan (4) benar (D) jika hanya (4) yang benar (E) jika semua jawaban benar Kunci B 2. Logam seng bereaksi dengan larutan HCl membebaskan gas hidrogen. Eksperimen dilakukan lima kali dan setiap kali digunakan ukuran berat atau jumlah Zn sama. Jumlah HCl yang digunakan volumenya selalu sama, tetapi molaritasnya berbeda. Laju reaksi yang paling besar ditemukan pada eksperimen dengan molaritas HCl sebesar M. (A) (B) 1,5 (C) 0,2 (D) 2,0 (E) 1,0 Kunci D 3. Suatu reaksi berlangsung pada suhu 20 o C. Jika pada setiap kenaikan suhu 10 o C tetapan laju reaksinya meningkat 2 kali, maka laju reaksi pada suhu 60 o C dibandingkan dengan 20 o C akan meningkat sebesar kali. (A) 2
2 (B) 32 (C) 8 (D) 64 (E) 16 Kunci E 4. Adanya katalis (katalis positif) dapat mempercepat terjadinya reaksi kimia karena. (A) menaikan jumlah tumbukan (B) menurunkan jumlah tumbukan (C) menaikan energi aktivasi (D) menurunkan energi aktivasi (E) tidak mengubah laju reaksi Kunci D 5. Data percobaan untuk reaksi A+B AB sebagai berikut. No [A] [B] Laju s ,3 0,05 0,05 0, Orde reaksi terhadap A dan B berturut-turut adalah... (A) 2 dan 4 (B) 2 dan 2 (C) 2 dan 1 (D) 1 dan 2 (E) 1 dan 1 Pembahasan orde reaksi terhadap A (data 1,2) Kunci B 3 x = 9
3 x = 2 orde reaksi terhadap B (data 1,3) 4 y = 16 y = 2 6. Data eksperimen untuk reaksi: 2A(g) + B(g) 2AB(g) Perc. [A] [B] Laju ,2 0,3 0,2 0, Dari data tersebut dapat disimpulkan bahwa persamaan laju reaksinya adalah... (A) v = k [A] 2 (B) v = k [B] (C) v = k [A] [B] (D) v = k [A] [B] 2 (E) v = k [A] 2 [B] Kunci E Pembahasan Orde reaksi terhadap A, percobaan 4 dan 5 Orde reaksi terhadap B, percobaan 1 dan 2 Persamaan laju reaksinya: v = k. [A] 2 [B]
4 8 Suatu reaksi: P + Q Produk memiliki persamaan kecepatan v = k[p] 2 [Q]. Jika konsentrasi masing masing pereaksi diperbesar tiga kali, kecepatan reaksinya menjadi... (A) 3 kali (B) 18 kali (C) 9 kali (D) 6 kali (E) 27 kali Kunci E 9 Pengaruh konsentrasi, luas permukaan sentuhan, dan suhu reaksi terhadap kecepatan reaksi menurut teori tumbukan berturut-turut karena... (A) frekuensi tumbukan, orientasi tumbukan, energi kinetik partikel (B) orientasi tumbukan, frekuensi tumbukan, keadaan transisi (C) orientasi tumbukan, energi pengaktifan, frekuensi tumbukan (D) energi kinetik partikel, orientasi tumbukan, energi pengaktifan (E) orientasi dan frekuensi tumbukan Kunci A 10 Pernyataan yang tidak tepat tentang pengaruh luas permukaan reaksi heterogen adalah... (A) serbuk seng memberikan reaksi lebih cepat daripada butiran seng (B) semakin besar jumlah luas permukaan padatan, semakin tinggi reaksi itu (C) jumlah tumbukan dipengaruhi oleh jumlah ukuran partikel yang makin kecil (D) partikel yang besar mempunyai lebih banyak permukaan untuk bertumbukan (E) semakin besar luas permukaan, semakin cepat reaksi berlangsung Kunci D
5 11. Di antara data kondisi reaksi berikut. No Seng [HCl] Suhu Serbuk Serbuk Lempeng Serbuk Lempeng M M 0,2 M 0,2 M 0,2 M Manakah yang laju reaksinya paling rendah? (A) 1 (B) 4 (C) 2 (D) 5 (E) 3 Kunci E Pembahasan Laju reaksi dipengaruhi oleh faktor: luas permukaan: zat berupa serbuk lajunya semakin besar konsentrasi: konsentrasi semakin tinggi lajunya semakin besar suhu: suhu semakin tinggi lajunya semakin besar Jadi, laju reaksi paling rendah adalah zat yang berupa lempeng dengan suhu yang paling rendah. 12. Cara-cara berikut ini dapat meningkatkan kecepatan reaksi, kecuali... (A) menghancurkan partikel-partikel pereaksi menjadi serbuk kecil (B) meningkatkan suhu reaksi (C) memotong daging menjadi serpihan-serpihan sebelum dimasak (D) menambah air ke dalam larutan pereaksi sampai berlebih (E) menambahkan katalisator yang cocok Kunci D
6 13 Kenaikan suhu akan mempercepat reaksi sebab... (A) kenaikan suhu akan memperbesar energi kinetik molekul pereaksi (B) kenaikan suhu akan memperbesar tekanan molekul pereaksi (C) kenaikan suhu akan menaikkan energi pengaktifan zat yang bereaksi (D) kenaikan suhu akan memperbesar konsentrasi zat yang bereaksi (E) kenaikan suhu akan memperbesar luas permukaan zat pereaksi Kunci A 14 Untuk meningkatkan kinerja katalis dalam konverter kendaraan bermotor maka ditambahkan... (A) inhibitor (B) aktivator (C) promotor (D) radiator (E) logam transisi Kunci C 15 Grafik yang menunjukan Laju reaksi tidak dipengaruhi oleh besarnya konsentrasi pereaksi adalah. (A) (B) (C) (D) (E) Kunci A
7 Pembahasan Laju reaksi tidak dipengaruhi oleh besarnya konsentrasi pereaksi reaksi orde nol. Grafik reaksi orde nol adalah sebagai berikut. SOAL ESSAY 1. Dari reaksi : 2NO(g) + 2H 2 (g) N 2 (g) + 2H 2 O(g) Diperoleh data sebagai berikut : Orde reaksi data di atas adalah. 2. Tabel data laju reaksi 2NO(g) + Br 2 (g) 2NOBr(g) pada berbagai konsentrasi. Tentukan orde reaksinya. 4. Diketahui data percobaan : Tentukan persamaan reaksi laju reaksi untuk percobaan di atas. 5. Pada reaksi : A(g) + B(g) C(g) diperoleh data percobaan : Rumus laju reaksinya adalah. 3. Pada reaksi 2CO(g) + O 2 (g) 2CO 2 (g) diperoleh data: Tentukan persamaan laju reaksi total untuk reaksi di atas.
8 KUNCI JAWABAN 1. Penyelesaian : Reaksi terhadap NO orde = 1 Reaksi terhadap H 2 orde = 1 Orde reaksi = = 2 2. Penyelesaian : Reaksi terhadap [NO] bila [Br 2] tetap : Reaksi terhadap [Br 2] bila [NO] tetap : 3. Penyelesaian :
9 orde reaksi = = 2 4. Penyelesaian : t berbanding terbalik Salah data, jadi tidak ada atau tidak dapat disimpulkan. 5. Penyelesaian : Untuk menuliskan persamaan laju reaksi kita tentukan orde masing-masing zat. Untuk mencari orde A kita ambil [B] yang sama yaitu percobaan 1 dan 2. Orde terhadap A = 2
10 Untuk mencari orde B kita ambil [A] yang sama yaitu untuk percobaan 3 dan 4. Orde terhadap B = 1 Jadi persamaan laju reaksi : V = k [A]²[B]
Faktor-faktor yang Mempengaruhi Laju Reaksi
 Faktor-faktor yang Mempengaruhi Laju Reaksi Faktor yang mempengaruhi laju reaksi adalah sebagai berikut. Konsentrasi Jika konsentrasi suatu larutan makin besar, larutan akan mengandung jumlah partikel
Faktor-faktor yang Mempengaruhi Laju Reaksi Faktor yang mempengaruhi laju reaksi adalah sebagai berikut. Konsentrasi Jika konsentrasi suatu larutan makin besar, larutan akan mengandung jumlah partikel
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
LEMBAR KERJA SISWA 4
 88 LEMBAR KERJA SISWA 4 Mata Pelajaran Kelas/Semester Materi Pokok Submateri Pokok Alokasi Waktu : Kimia : I/ganjil : Laju Reaksi : Teori Tumbukan : 2 x 45 menit Standar Kompetensi Memahami Kinetika Reaksi,
88 LEMBAR KERJA SISWA 4 Mata Pelajaran Kelas/Semester Materi Pokok Submateri Pokok Alokasi Waktu : Kimia : I/ganjil : Laju Reaksi : Teori Tumbukan : 2 x 45 menit Standar Kompetensi Memahami Kinetika Reaksi,
Soal-Soal. Bab 4. Latihan. Laju Reaksi. 1. Madu dengan massa jenis 1,4 gram/ cm 3 mengandung glukosa (M r. 5. Diketahui reaksi:
 Bab Laju Reaksi Soal-Soal Latihan. Madu dengan massa jenis, gram/ cm 3 mengandung glukosa (M r = 80) sebanyak 35 % b/b. Kemolaran glukosa dalam madu adalah... 0,8 M (D),7 M,8 M (E) 3,0 M, M. Untuk membuat
Bab Laju Reaksi Soal-Soal Latihan. Madu dengan massa jenis, gram/ cm 3 mengandung glukosa (M r = 80) sebanyak 35 % b/b. Kemolaran glukosa dalam madu adalah... 0,8 M (D),7 M,8 M (E) 3,0 M, M. Untuk membuat
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN
 BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN STANDAR KOMPETENSI 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan
BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN STANDAR KOMPETENSI 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan
RENCANA PELAKSANAAN PEMBELAJARAN ( R P P )
 PEMERINTAH KOTA YOGYAKARTA DINAS PENDIDIKAN SMA NEGERI 6 YOGYAKARTA The Research School of Jogja Jalan C. Simanjuntak No Yogyakarta 55, Telepon 0 55/ Faximile 0 5660 E-mail : sman6@sman6-yogya.sch.id,
PEMERINTAH KOTA YOGYAKARTA DINAS PENDIDIKAN SMA NEGERI 6 YOGYAKARTA The Research School of Jogja Jalan C. Simanjuntak No Yogyakarta 55, Telepon 0 55/ Faximile 0 5660 E-mail : sman6@sman6-yogya.sch.id,
SOAL LAJU REAKSI. Mol CaCO 3 = = 0.25 mol = 25. m Mr
 SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
kimia LAJU REAKSI 1 TUJUAN PEMBELAJARAN
 KTSP & K-13 kimia K e l a s XI LAJU REAKSI 1 TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konsep molaritas. 2. Memahami definisi dan faktor-faktor
KTSP & K-13 kimia K e l a s XI LAJU REAKSI 1 TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konsep molaritas. 2. Memahami definisi dan faktor-faktor
Waktu (t) Gambar 3.1 Grafik hubungan perubahan konsentrasi terhadap waktu
 3 LAJU REAKSI Setelah mempelajari bab ini, kamu diharapkan mampu: Menghitung konsentrasi larutan (molaritas larutan). Menganalisis faktor-faktor yang mempengaruhi laju reaksi (konsentrasi, luas permukaan,
3 LAJU REAKSI Setelah mempelajari bab ini, kamu diharapkan mampu: Menghitung konsentrasi larutan (molaritas larutan). Menganalisis faktor-faktor yang mempengaruhi laju reaksi (konsentrasi, luas permukaan,
A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI
 3 LAJU REAKSI A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI Materi dapat berubah dari bentuk yang satu ke bentuk yang
3 LAJU REAKSI A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI Materi dapat berubah dari bentuk yang satu ke bentuk yang
yang berkaitan dengan Laju Reaksi, diberikan pada tabel berikut ini.
 BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Hasil Penelitian Berdasarkan hasil pengumpulan data, persentase siswa SMA Negeri 1 Paguyaman, Kabupaten Boalemo yang memberikan jawaban untuk tiap item tes yang
BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Hasil Penelitian Berdasarkan hasil pengumpulan data, persentase siswa SMA Negeri 1 Paguyaman, Kabupaten Boalemo yang memberikan jawaban untuk tiap item tes yang
Kunci jawaban dan pembahasan soal laju reaksi
 Kunci jawaban dan pembahasan soal laju reaksi Soal nomor 1 Mencari volume yang dibutuhkan pada proses pengenceran. Rumus pengenceran V 1. M 1 = V 2. M 2 Misal volume yang dibutuhkan sebanyak x ml, maka
Kunci jawaban dan pembahasan soal laju reaksi Soal nomor 1 Mencari volume yang dibutuhkan pada proses pengenceran. Rumus pengenceran V 1. M 1 = V 2. M 2 Misal volume yang dibutuhkan sebanyak x ml, maka
SOAL KIMIA 2 KELAS : XI IPA
 SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
c. Suhu atau Temperatur
 Pada laju reaksi terdapat faktor-faktor yang dapat mempengaruhi laju reaksi. Selain bergantung pada jenis zat yang beraksi laju reaksi dipengaruhi oleh : a. Konsentrasi Pereaksi Pada umumnya jika konsentrasi
Pada laju reaksi terdapat faktor-faktor yang dapat mempengaruhi laju reaksi. Selain bergantung pada jenis zat yang beraksi laju reaksi dipengaruhi oleh : a. Konsentrasi Pereaksi Pada umumnya jika konsentrasi
PETA KONSEP LAJU REAKSI. Percobaan. Waktu perubahan. Hasil reaksi. Pereaksi. Katalis. Suhu pereaksi. Konsentrasi. Luas. permukaan.
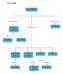 PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
BAB II KAJIAN PUSTAKA. kemampuan adalah karakteristik yang menonjol dari seorang individu yang
 BAB II KAJIAN PUSTAKA 2.1 Defenisi Kemampuan Kemampuan sama dengan kata kesanggupan atau kecakapan. Dengan bahasa yang lebih terperinci, kemampuan dapat diartikan sebagai kesanggupan individu untuk melakukan
BAB II KAJIAN PUSTAKA 2.1 Defenisi Kemampuan Kemampuan sama dengan kata kesanggupan atau kecakapan. Dengan bahasa yang lebih terperinci, kemampuan dapat diartikan sebagai kesanggupan individu untuk melakukan
tanya-tanya.com Soal No.2 Apabila anda diminta untuk mengukur laju reaksi terhadap reaksi : Zn(s) + 2HCI(aq)
 Soal No.1 Apa yang di maksud dengan laju reaksi dan satuan dari laju reaksi? Laju reaksi dinyatakan sebagai berkurangnya jumlah pereaksi untuk setiap satuan waktu atau bertambahnya jumlah hasil reaksi
Soal No.1 Apa yang di maksud dengan laju reaksi dan satuan dari laju reaksi? Laju reaksi dinyatakan sebagai berkurangnya jumlah pereaksi untuk setiap satuan waktu atau bertambahnya jumlah hasil reaksi
MODUL LAJU REAKSI. Laju reaksi _ 2013 Page 1
 MODUL LAJU REAKSI Standar Kompetensi ( SK ) : Memahami kinetika reaksi, kesetimbangan kimia dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri. Kompetensi
MODUL LAJU REAKSI Standar Kompetensi ( SK ) : Memahami kinetika reaksi, kesetimbangan kimia dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri. Kompetensi
Sulistyani, M.Si.
 Sulistyani, M.Si. Email: sulistyani@uny.ac.id Laju reaksi adalah laju pengurangan reaktan tiap satuan waktu atau laju pembentukan produk tiap satuan waktu. Laju reaksi dipengaruhi oleh: sifat dan keadan
Sulistyani, M.Si. Email: sulistyani@uny.ac.id Laju reaksi adalah laju pengurangan reaktan tiap satuan waktu atau laju pembentukan produk tiap satuan waktu. Laju reaksi dipengaruhi oleh: sifat dan keadan
Laju Reaksi. Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I
 Laju Reaksi Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi,
Laju Reaksi Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi,
Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan
 KINETIKA Pendahuluan Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan Namun persamaan reaksi tidak dapat menjawab :. Seberapa cepat reaksi berlangsung 2. Bagaimana
KINETIKA Pendahuluan Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan Namun persamaan reaksi tidak dapat menjawab :. Seberapa cepat reaksi berlangsung 2. Bagaimana
Laporan Praktikum Kimia Laju Reaksi
 Laporan Praktikum Kimia Laju Reaksi Oleh: 1. Kurniawan Eka Yuda (5) 2. Tri Puji Lestari (23) 3. Rina Puspitasari (17) 4. Elva Alvivah Almas (11) 5. Rusti Nur Anggraeni (35) 6. Eki Aisyah (29) Kelas XI
Laporan Praktikum Kimia Laju Reaksi Oleh: 1. Kurniawan Eka Yuda (5) 2. Tri Puji Lestari (23) 3. Rina Puspitasari (17) 4. Elva Alvivah Almas (11) 5. Rusti Nur Anggraeni (35) 6. Eki Aisyah (29) Kelas XI
LAPORAN PRAKTIKUM KIMIA DASAR
 LAPORAN PRAKTIKUM KIMIA DASAR KECEPATAN REAKSI Disusun Oleh : 1. Achmad Zaimul Khaqqi (132500030) 2. Dinda Kharisma Asmara (132500014) 3. Icha Restu Maulidiah (132500033) 4. Jauharatul Lailiyah (132500053)
LAPORAN PRAKTIKUM KIMIA DASAR KECEPATAN REAKSI Disusun Oleh : 1. Achmad Zaimul Khaqqi (132500030) 2. Dinda Kharisma Asmara (132500014) 3. Icha Restu Maulidiah (132500033) 4. Jauharatul Lailiyah (132500053)
RENCANA PELAKSANAAN PEMBELAJARAN (RPP) KELAS EKSPERIMEN PERTEMUAN KE-1
 RENCANA PELAKSANAAN PEMBELAJARAN (RPP) KELAS EKSPERIMEN PERTEMUAN KE-1 Sekolah : SMAN 3 Tangerang Selatan Mata Pelajaran : Kimia Kelas/ Semester : XI/ I Tahun Pelajaran : 010/011 Pokok Bahasan : Laju Reaksi
RENCANA PELAKSANAAN PEMBELAJARAN (RPP) KELAS EKSPERIMEN PERTEMUAN KE-1 Sekolah : SMAN 3 Tangerang Selatan Mata Pelajaran : Kimia Kelas/ Semester : XI/ I Tahun Pelajaran : 010/011 Pokok Bahasan : Laju Reaksi
BAB IV HASIL PENELITIAN DAN PEMBAHASAN. Paguyaman yang berhubungan dengan materi laju reaksi diberikan dalam Tabel 2 berikut.
 BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Hasil Penelitian Dari hasil penelitian diperoleh presentase jawaban siswa kelas XI SMA Negeri 1 Paguyaman yang berhubungan dengan materi laju reaksi diberikan
BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Hasil Penelitian Dari hasil penelitian diperoleh presentase jawaban siswa kelas XI SMA Negeri 1 Paguyaman yang berhubungan dengan materi laju reaksi diberikan
Katalis 1. Pengertian Katalis 2. Jenis Katalis a. Katalis Homogen
 Katalis 1. Pengertian Katalis Katalis merupakan suatu zat yang dapat mempercepat laju reaksi dalam reaksi kimia pada suhu tertentu, tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri. Suatu
Katalis 1. Pengertian Katalis Katalis merupakan suatu zat yang dapat mempercepat laju reaksi dalam reaksi kimia pada suhu tertentu, tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri. Suatu
Materi pelajaran Biologi. Disusun oleh: Dra. Tetty Afianti.
 Materi pelajaran Biologi kelas 11 Disusun oleh: Dra. Tetty Afianti KECEPATAN REAKSI Diriwayatkan dari Umar abi Salamah ra. : Aku seorang anak laki-laki di bawah asuhan Rasulullah Saw dan tanganku biasa
Materi pelajaran Biologi kelas 11 Disusun oleh: Dra. Tetty Afianti KECEPATAN REAKSI Diriwayatkan dari Umar abi Salamah ra. : Aku seorang anak laki-laki di bawah asuhan Rasulullah Saw dan tanganku biasa
KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN
 KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN 1. Suatu reaksi dikatakan mencapai kesetimbangan apabila. A. laju reaksi ke kiri sama dengan ke kanan B. jumlah koefisien reaksi ruas kiri sama dengan ruas kanan
KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN 1. Suatu reaksi dikatakan mencapai kesetimbangan apabila. A. laju reaksi ke kiri sama dengan ke kanan B. jumlah koefisien reaksi ruas kiri sama dengan ruas kanan
PRAKTIKUM KIMIA DASAR I KECEPATAN REAKSI. Kelompok V : Amir Hamzah Umi Kulsum
 PRAKTIKUM KIMIA DASAR I KECEPATAN REAKSI Kelompok V : Amir Hamzah 1415005 Umi Kulsum 1415018 AKADEMI KIMIA ANALISIS CARAKA NUSANTARA CIMANGGIS, KELAPA DUA DEPOK, 2015 BAB 1 PENDAHULUAN 1.1 Latar Belakang
PRAKTIKUM KIMIA DASAR I KECEPATAN REAKSI Kelompok V : Amir Hamzah 1415005 Umi Kulsum 1415018 AKADEMI KIMIA ANALISIS CARAKA NUSANTARA CIMANGGIS, KELAPA DUA DEPOK, 2015 BAB 1 PENDAHULUAN 1.1 Latar Belakang
OAL TES SEMESTER I. I. Pilihlah jawaban yang paling tepat! a. 2d d. 3p b. 2p e. 3s c. 3d 6. Unsur X dengan nomor atom
 KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
Laboratorium Kimia SMA... Praktikum II Kelas XI IPA Semester I Tahun Pelajaran.../...
 Laboratorium Kimia SMA... Praktikum II Kelas XI IPA Semester I Tahun Pelajaran.../... Judul : Faktor-Faktor yang Mempengaruhi Laju Reaksi Praktikan : mor Absen : Kelas : Tanggal : Lembar Kegiatan Siswa
Laboratorium Kimia SMA... Praktikum II Kelas XI IPA Semester I Tahun Pelajaran.../... Judul : Faktor-Faktor yang Mempengaruhi Laju Reaksi Praktikan : mor Absen : Kelas : Tanggal : Lembar Kegiatan Siswa
Laju reaksi menunjukkan perubahan konsentrasi pereaksi atau hasil reaksi persatuan waktu.
 Bab IV Laju Reaksi Sumber: Ebbing, General Chemistry Laju reaksi menunjukkan perubahan konsentrasi pereaksi atau hasil reaksi persatuan waktu. TUJUAN PEMBELAJARAN Setelah mengikuti pembelajaran siswa dapat
Bab IV Laju Reaksi Sumber: Ebbing, General Chemistry Laju reaksi menunjukkan perubahan konsentrasi pereaksi atau hasil reaksi persatuan waktu. TUJUAN PEMBELAJARAN Setelah mengikuti pembelajaran siswa dapat
Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Chapter 8 Kinetika Kimia Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Chapter 8 Kinetika Kimia Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
BAB 9. KINETIKA KIMIA
 BAB 9 BAB 9. KINETIKA KIMIA 9.1 TEORI TUMBUKAN DARI LAJU REAKSI 9.2 TEORI KEADAAN TRANSISI DARI LAJU REAKSI 9.3 HUKUM LAJU REAKSI 9.4 FAKTOR-FAKTOR LAJU REAKSI 9.5 MEKANISME REAKSI 9.6 ENZIM SEBAGAI KATALIS
BAB 9 BAB 9. KINETIKA KIMIA 9.1 TEORI TUMBUKAN DARI LAJU REAKSI 9.2 TEORI KEADAAN TRANSISI DARI LAJU REAKSI 9.3 HUKUM LAJU REAKSI 9.4 FAKTOR-FAKTOR LAJU REAKSI 9.5 MEKANISME REAKSI 9.6 ENZIM SEBAGAI KATALIS
Bab 10 Kinetika Kimia
 D e p a r t e m e n K i m i a F M I P A I P B Bab 0 Kinetika Kimia http://chem.fmipa.ipb.ac.id Ikhtisar 2 3 Laju Reaksi Teori dalam Kinetika Kimia 4 Mekanisme Reaksi 5 46 Faktor Penentu Laju Reaksi Enzim
D e p a r t e m e n K i m i a F M I P A I P B Bab 0 Kinetika Kimia http://chem.fmipa.ipb.ac.id Ikhtisar 2 3 Laju Reaksi Teori dalam Kinetika Kimia 4 Mekanisme Reaksi 5 46 Faktor Penentu Laju Reaksi Enzim
Contoh Soal & Pembahasan Reaksi Kesetimbangan
 Soal No.1 Contoh Soal & Pembahasan Reaksi Kesetimbangan Reaksi kimia ada yang berlangsung searah (berkesudahan) dan ada yang dapat balik (bolak-balik). Jelaskan perbedaanya disertai dengan contoh-contohnya.
Soal No.1 Contoh Soal & Pembahasan Reaksi Kesetimbangan Reaksi kimia ada yang berlangsung searah (berkesudahan) dan ada yang dapat balik (bolak-balik). Jelaskan perbedaanya disertai dengan contoh-contohnya.
RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 2 JP
 RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 2 JP Standar Kompetensi 1. Memahami kinetika reaksi dan kesetimbangan kimia
RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 2 JP Standar Kompetensi 1. Memahami kinetika reaksi dan kesetimbangan kimia
BAB VI KINETIKA REAKSI KIMIA
 BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
KINETIKA KIMIA LAJU DAN MEKANISME DALAM REAKSI KIMIA
 KINETIKA KIMIA LAJU DAN MEKANISME DALAM REAKSI KIMIA Pendahuluan Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan koefisien seimbang Namun persamaan reaksi tidak dapat menjawab 3
KINETIKA KIMIA LAJU DAN MEKANISME DALAM REAKSI KIMIA Pendahuluan Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan koefisien seimbang Namun persamaan reaksi tidak dapat menjawab 3
Purwanti Widhy H, M.Pd. Laju Reaksi
 Purwanti Widhy H, M.Pd Laju Reaksi SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi, Kompetensi Dasar & Indikator
Purwanti Widhy H, M.Pd Laju Reaksi SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi, Kompetensi Dasar & Indikator
Kode KIM.10. Laju Reaksi
 Kode KIM.10 Laju Reaksi BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN NASIONAL 2004 BAB I. PENDAHULUAN
Kode KIM.10 Laju Reaksi BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN NASIONAL 2004 BAB I. PENDAHULUAN
TEORI TUMBUKAN PADA LAJU REAKSI KIMIA
 PENGEMBANGAN BAHAN AJAR TEORI TUMBUKAN PADA LAJU REAKSI KIMIA OLEH : Drs. I Wayan Suarsa, M.Si JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS UDAYANA 2017 Kata Pengantar Puji dan
PENGEMBANGAN BAHAN AJAR TEORI TUMBUKAN PADA LAJU REAKSI KIMIA OLEH : Drs. I Wayan Suarsa, M.Si JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS UDAYANA 2017 Kata Pengantar Puji dan
Kinetika Kimia dan Mekanisme Reaksi
 Kinetika Kimia dan Mekanisme Reaksi Kinetika Kimia Kinetika kimia adalah ilmu yang mempelajari laju reaksi, atau seberapa cepat proses reaksi berlangsung dalam waktu tertentu. Kinetika kimia menjelaskan
Kinetika Kimia dan Mekanisme Reaksi Kinetika Kimia Kinetika kimia adalah ilmu yang mempelajari laju reaksi, atau seberapa cepat proses reaksi berlangsung dalam waktu tertentu. Kinetika kimia menjelaskan
k = A. e -E/RT Secara sistematis hubungan suhu dan laju reaksi dapat ditulis sebagai berikut: v 2 = 2n x v 1 dan t 2 = t 1/ 2 n
 POKOK BAHASAN I. LAJU REAKSI 1.1 Pengertian Laju Reaksi Laju reaksi didefinisikan sebagai laju berkurangnya konsentrasi zat pereaksi (reaktan) atau laju bertambahnya hasil reaksi (produk) tiap satu satuan
POKOK BAHASAN I. LAJU REAKSI 1.1 Pengertian Laju Reaksi Laju reaksi didefinisikan sebagai laju berkurangnya konsentrasi zat pereaksi (reaktan) atau laju bertambahnya hasil reaksi (produk) tiap satu satuan
Termodinamika dan Kesetimbangan Kimia
 Termodinamika dan Kesetimbangan Kimia Dalam kesetimbangan kimia terdapat 2 reaksi yaitu reaksi irreversible dan reaksi reversible. Reaksi irreversible (reaksi searah) adalah reaksi yang berlangsung searah.
Termodinamika dan Kesetimbangan Kimia Dalam kesetimbangan kimia terdapat 2 reaksi yaitu reaksi irreversible dan reaksi reversible. Reaksi irreversible (reaksi searah) adalah reaksi yang berlangsung searah.
SOAL-SOAL KESETIMBANGAN KIMIA
 H=+380 kj/mol SOAL-SOAL KESETIMBANGAN KIMIA 1. Ebtanas 99 Suatu reaksi berada dalam keadaan setimbang apabila A. Reaksi ke kanan dan kiri telah berhenti B. Mol pereaksi selalu sama dengan mol hasil reaksi
H=+380 kj/mol SOAL-SOAL KESETIMBANGAN KIMIA 1. Ebtanas 99 Suatu reaksi berada dalam keadaan setimbang apabila A. Reaksi ke kanan dan kiri telah berhenti B. Mol pereaksi selalu sama dengan mol hasil reaksi
Laju Reaksi KIM 2 A. KEMOLARAN B. LAJU REAKSI C. UNGKAPAN LAJU REAKSI LAJU REAKSI. materi78.co.nr
 Laju eaksi A. KEMOLAAN Dalam laju reaksi, besaran yang digunakan adalah kemolaran benda. Kemolaran menyatakan jumlah mol zat terlarut dari tiap liter larutan atau gas, menunjukkan kekentalan atau kepekatan.
Laju eaksi A. KEMOLAAN Dalam laju reaksi, besaran yang digunakan adalah kemolaran benda. Kemolaran menyatakan jumlah mol zat terlarut dari tiap liter larutan atau gas, menunjukkan kekentalan atau kepekatan.
Soal ini terdiri dari 10 soal Essay (153 poin)
 Bidang Studi Kode Berkas : Kimia : KI-L01 (soal) Soal ini terdiri dari 10 soal Essay (153 poin) Tetapan Avogadro N A = 6,022 10 23 partikel.mol 1 Tetapan Gas Universal R = 8,3145 J.mol -1.K -1 = 0,08206
Bidang Studi Kode Berkas : Kimia : KI-L01 (soal) Soal ini terdiri dari 10 soal Essay (153 poin) Tetapan Avogadro N A = 6,022 10 23 partikel.mol 1 Tetapan Gas Universal R = 8,3145 J.mol -1.K -1 = 0,08206
MENYARING DAN MENDEKANTASI
 MENYARING DAN MENDEKANTASI MENYARING - Menyaring adalah suatu proses dimana partikelpartikel dipisahkan dari cairan dengan melewatkan cairan melalui bahan permeabel (kertas saring,dll). - Endapan : suatu
MENYARING DAN MENDEKANTASI MENYARING - Menyaring adalah suatu proses dimana partikelpartikel dipisahkan dari cairan dengan melewatkan cairan melalui bahan permeabel (kertas saring,dll). - Endapan : suatu
LAPORAN PRAKTIKUM PERCOBAAN PRAKTKUM 1 LAJU REAKSI
 LAPORAN PRAKTIKUM PERCOBAAN PRAKTKUM 1 LAJU REAKSI DOSEN PENGAMPU : ANDI HIMYATUL HIDAYAH, S.Si.,Apt. DISUSUSN OLEH : FILDZAH MAULIDA NIM. 37.2016.7.1.81454 PROGRAM STUDI FARMASI FAKULTAS ILMU KESEHATAN
LAPORAN PRAKTIKUM PERCOBAAN PRAKTKUM 1 LAJU REAKSI DOSEN PENGAMPU : ANDI HIMYATUL HIDAYAH, S.Si.,Apt. DISUSUSN OLEH : FILDZAH MAULIDA NIM. 37.2016.7.1.81454 PROGRAM STUDI FARMASI FAKULTAS ILMU KESEHATAN
Laju Reaksi. Kode KIM.10
 Kode KIM.10 Laju Reaksi BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN NASIONAL 004 Kim. 10. Laju Reaksi
Kode KIM.10 Laju Reaksi BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN NASIONAL 004 Kim. 10. Laju Reaksi
Kesetimbangan Kimia KIM 2 A. PENDAHULUAN B. REAKSI KESETIMBANGAN. α = KESETIMBANGAN KIMIA. materi78.co.nr. setimbang
 konsentrasi laju reaksi materi78.co.nr Kesetimbangan Kimia A. PENDAHULUAN Reaksi satu arah (irreversible) atau reaksi tidak dapat balik adalah reaksi yang terjadi pada satu arah, dan produknya tidak dapat
konsentrasi laju reaksi materi78.co.nr Kesetimbangan Kimia A. PENDAHULUAN Reaksi satu arah (irreversible) atau reaksi tidak dapat balik adalah reaksi yang terjadi pada satu arah, dan produknya tidak dapat
1. Ciri-Ciri Reaksi Kimia
 Apakah yang dimaksud dengan reaksi kimia? Reaksi kimia adalah peristiwa perubahan kimia dari zat-zat yang bereaksi (reaktan) menjadi zat-zat hasil reaksi (produk). Pada reaksi kimia selalu dihasilkan zat-zat
Apakah yang dimaksud dengan reaksi kimia? Reaksi kimia adalah peristiwa perubahan kimia dari zat-zat yang bereaksi (reaktan) menjadi zat-zat hasil reaksi (produk). Pada reaksi kimia selalu dihasilkan zat-zat
KEMOLARAN. M = n/v. M = g/mr x 1000/V
 KEMOLARAN Kemolaran atau molaritas menyatakan konsentrasi dari suatu larutan yang menggambarkan jumlah mol zat terlarut dalam setiap liter larutan.kemolaran berkaitan dengan jumlah mol dan volume larutan.hubungan
KEMOLARAN Kemolaran atau molaritas menyatakan konsentrasi dari suatu larutan yang menggambarkan jumlah mol zat terlarut dalam setiap liter larutan.kemolaran berkaitan dengan jumlah mol dan volume larutan.hubungan
Gambar 2.1 Reaksi Saponifikasi tripalmitin
 I. JUDUL : Kinetika Reaksi Saponifikasi Etil Asetat II. TANGGAL PERCOBAAN : Rabu, 16 November 2011 III. TUJUAN : 1. Untuk memberikan gambaran bahwa reaksi penyabunan etil asetat oleh ion hidroksida adalah
I. JUDUL : Kinetika Reaksi Saponifikasi Etil Asetat II. TANGGAL PERCOBAAN : Rabu, 16 November 2011 III. TUJUAN : 1. Untuk memberikan gambaran bahwa reaksi penyabunan etil asetat oleh ion hidroksida adalah
Soal Soal Kesetimbangan Kimia. Proses Haber-Bosch merupakan proses pembentukan atau produksi ammonia berdasarkan reaksi:
 Nama : Fitria Puspita NIM : 1201760 Kelas : Pendidikan Kimia A Soal Soal Kesetimbangan Kimia SBMPTN 2014 Untuk soal no 1-3, bacalah narasi berikut. Proses Haber-Bosch merupakan proses pembentukan atau
Nama : Fitria Puspita NIM : 1201760 Kelas : Pendidikan Kimia A Soal Soal Kesetimbangan Kimia SBMPTN 2014 Untuk soal no 1-3, bacalah narasi berikut. Proses Haber-Bosch merupakan proses pembentukan atau
HAND OUT KIMIA XI IPA BAB III LAJU REAKSI
 HAND OUT KIMIA XI IPA BAB III LAJU REAKSI 1 BAB III LAJU REAKSI I. Standarkompetensi Memahami Kinetika reaksi, kesetimbangan kimia dan factor-faktor yang mempengaruhinya serta penerapannya dalam kehidupan
HAND OUT KIMIA XI IPA BAB III LAJU REAKSI 1 BAB III LAJU REAKSI I. Standarkompetensi Memahami Kinetika reaksi, kesetimbangan kimia dan factor-faktor yang mempengaruhinya serta penerapannya dalam kehidupan
Laporan Kimia Fisik KI-3141
 Laporan Kimia Fisik KI-3141 PERCOBN M-1 KINETIK HLOGENSI SETON DENGN KTLISTOR SM Nama : Kartika Trianita NIM : 1517 Kelompok : 2 Tanggal Percobaan : 22 Oktober 212 Tanggal Laporan : 2 November 212 sisten
Laporan Kimia Fisik KI-3141 PERCOBN M-1 KINETIK HLOGENSI SETON DENGN KTLISTOR SM Nama : Kartika Trianita NIM : 1517 Kelompok : 2 Tanggal Percobaan : 22 Oktober 212 Tanggal Laporan : 2 November 212 sisten
Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka
 Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka waktu reaksi berlangsung pada suhu 90 o C Susu dipasteurisasi
Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka waktu reaksi berlangsung pada suhu 90 o C Susu dipasteurisasi
LEMBARAN SOAL 7. Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA )
 LEMBARAN SOAL 7 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal
LEMBARAN SOAL 7 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal
BAB 1 1. Atom karbon mempunyai ke khasan. Pernyataan yang tepat mengenai kekhasan atom karbon
 SOAL DAN PEMBAHASAN KIMIA KELAS XI SEMESTER 1 BAB 1 1. Atom karbon mempunyai ke khasan. Pernyataan yang tepat mengenai kekhasan atom karbon adalah A. Karbon mempunyai 4 elektron valensi yang mampu membentuk
SOAL DAN PEMBAHASAN KIMIA KELAS XI SEMESTER 1 BAB 1 1. Atom karbon mempunyai ke khasan. Pernyataan yang tepat mengenai kekhasan atom karbon adalah A. Karbon mempunyai 4 elektron valensi yang mampu membentuk
PENGARUH KATALISIS TERHADAP TETAPAN LAJU
 PENGARUH KATALISIS TERHADAP TETAPAN LAJU Laju reaksi sering dipengaruhi oleh adanya katalis Contoh : Hidrolisis sukrosa dalam air Suhu kamar lama (bisa beberapa bulan) Namun jika hidrolisis dilakukan dalam
PENGARUH KATALISIS TERHADAP TETAPAN LAJU Laju reaksi sering dipengaruhi oleh adanya katalis Contoh : Hidrolisis sukrosa dalam air Suhu kamar lama (bisa beberapa bulan) Namun jika hidrolisis dilakukan dalam
No Indikator Soal Valid
 107 Lampiran 3 Rekapitulasi asi Instrumen TDM-TWO-TIER No Indikator Soal 1 Memahami kesetimbangan Reaksi kesetimbangan antara N 2 O 4 dengan NO 2 mengikuti persamaan kimia berikut ini : ator 1 :- dinamis
107 Lampiran 3 Rekapitulasi asi Instrumen TDM-TWO-TIER No Indikator Soal 1 Memahami kesetimbangan Reaksi kesetimbangan antara N 2 O 4 dengan NO 2 mengikuti persamaan kimia berikut ini : ator 1 :- dinamis
BAB II KAJIAN PUSTAKA. Model PBL merupakan pembelajaran yang penyampaiannya dilakukan
 BAB II KAJIAN PUSTAKA 2.1 Pengertian Model PBL Model PBL merupakan pembelajaran yang penyampaiannya dilakukan dengan cara menyajikan suatu permasalahan, mengajukan pertanyaan-pertanyaan, memfasilitasi
BAB II KAJIAN PUSTAKA 2.1 Pengertian Model PBL Model PBL merupakan pembelajaran yang penyampaiannya dilakukan dengan cara menyajikan suatu permasalahan, mengajukan pertanyaan-pertanyaan, memfasilitasi
JURNAL PRAKTIKUM KIMIA LAJU REAKSI 24 MARET 2014
 JURNAL PRAKTIKUM KIMIA LAJU REAKSI 24 MARET 204 Oleh MIRRAH AGHNIA NAFILAH F (306200055) FITRIA KUSUMA WARDHANI (306200060) INTAN MUTHIAH AFIFAH (30620006) NUR AZIZAH APRIANI (306200064) PROGRAM STUDI
JURNAL PRAKTIKUM KIMIA LAJU REAKSI 24 MARET 204 Oleh MIRRAH AGHNIA NAFILAH F (306200055) FITRIA KUSUMA WARDHANI (306200060) INTAN MUTHIAH AFIFAH (30620006) NUR AZIZAH APRIANI (306200064) PROGRAM STUDI
Kinetika kimia. Shinta Rosalia Dewi
 Kinetika kimia Shinta Rosalia Dewi Pendahuluan Termodinamika Kinetika Reaksi Mekanika fluida Pindah panas neraca massa ekonomi mendesain reaktor kimia Pendahuluan (cont ) Kinetika reaksi adalah studi tentang
Kinetika kimia Shinta Rosalia Dewi Pendahuluan Termodinamika Kinetika Reaksi Mekanika fluida Pindah panas neraca massa ekonomi mendesain reaktor kimia Pendahuluan (cont ) Kinetika reaksi adalah studi tentang
MODUL KESETIMBANGAN. Perhatikan reaksi berikut
 MODUL KESETIMBANGAN Perhatikan reaksi berikut a.n 2 (g) + 3H 2 (g) 2NH 3 (g), di sebut juga reaksi... b. N 2 (g) + 3H 2 (g) 2NH 3 (g), di sebut juga reaksi... Perhatikan reaksi: Maka persamaan laju reaksi
MODUL KESETIMBANGAN Perhatikan reaksi berikut a.n 2 (g) + 3H 2 (g) 2NH 3 (g), di sebut juga reaksi... b. N 2 (g) + 3H 2 (g) 2NH 3 (g), di sebut juga reaksi... Perhatikan reaksi: Maka persamaan laju reaksi
kecuali . kecuali . kecuali
 1. Berikut ini adalah ciri-ciri terjadinya reaksi kesetimbangan, kecuali. A. reaksi reversibel B. terjadi dalam ruang tertutup C. laju reaksi ke kiri sama dengan laju reaksi ke kanan D. reaksinya tidak
1. Berikut ini adalah ciri-ciri terjadinya reaksi kesetimbangan, kecuali. A. reaksi reversibel B. terjadi dalam ruang tertutup C. laju reaksi ke kiri sama dengan laju reaksi ke kanan D. reaksinya tidak
Tujuh4reaksi - - REAKSI KIMIA - - 2H 2 (g) + O 2(g) 2H 2 O ( l ) Reaksi Kimia 7206 Kimia. Reaksi Kimia
 - - REAKSI KIMIA - - Modul ini singkron dengan Aplikasi Android, Download melalui Play Store di HP Kamu, ketik di pencarian Tujuh4reaksi Jika Kamu kesulitan, Tanyakan ke tentor bagaimana cara downloadnya.
- - REAKSI KIMIA - - Modul ini singkron dengan Aplikasi Android, Download melalui Play Store di HP Kamu, ketik di pencarian Tujuh4reaksi Jika Kamu kesulitan, Tanyakan ke tentor bagaimana cara downloadnya.
MODUL KIMIA SMA IPA Kelas 11
 SMA IPA Kelas Di sekitar kita banyak dijumpai peristiwa reaksi kimia, misalnya reaksi pembakaran kayu, pembakaran bensin, fotosintesis, perkaratan besi dan lain sebagainya. Dalam reaksi kimia, ada reaksi
SMA IPA Kelas Di sekitar kita banyak dijumpai peristiwa reaksi kimia, misalnya reaksi pembakaran kayu, pembakaran bensin, fotosintesis, perkaratan besi dan lain sebagainya. Dalam reaksi kimia, ada reaksi
Kritis Variabel Superordinat Koordinat Subordinat. reaksi. Katalis. Partikelpartikel. Molekul pereaksi dalam wadahnya selalu bergerak
 19 Tabel 2. Analisis konsep materi laju Label Konsep Laju Reaksi Definisi Konsep Menyatakan laju perubahan konsentrasi zatzat yaitu zat pe (reaktan) atau zat hasil (produk), setiap satuan waktu berlangsung
19 Tabel 2. Analisis konsep materi laju Label Konsep Laju Reaksi Definisi Konsep Menyatakan laju perubahan konsentrasi zatzat yaitu zat pe (reaktan) atau zat hasil (produk), setiap satuan waktu berlangsung
H 2 O (l) H 2 O (g) Kesetimbangan kimia. N 2 O 4 (g) 2NO 2 (g)
 Purwanti Widhy H Kesetimbangan adalah suatu keadaan di mana tidak ada perubahan yang terlihat seiring berjalannya waktu. Kesetimbangan kimia tercapai jika: Laju reaksi maju dan laju reaksi balik sama besar
Purwanti Widhy H Kesetimbangan adalah suatu keadaan di mana tidak ada perubahan yang terlihat seiring berjalannya waktu. Kesetimbangan kimia tercapai jika: Laju reaksi maju dan laju reaksi balik sama besar
KINETIKA KIMIA. SHINTA ROSALIA DEWI
 KINETIKA KIMIA. SHINTA ROSALIA DEWI Kinetika kimia Shinta Rosalia Dewi Pendahuluan Kinetika Reaksi Mekanika fluida mendesain reaktor kimia Pindah panas neraca massa ekonomi Termodinamika Pendahuluan (cont
KINETIKA KIMIA. SHINTA ROSALIA DEWI Kinetika kimia Shinta Rosalia Dewi Pendahuluan Kinetika Reaksi Mekanika fluida mendesain reaktor kimia Pindah panas neraca massa ekonomi Termodinamika Pendahuluan (cont
- Melakukan percobaan penentuan laju reaksi. - Mendiskusikan data-data percobaan laju reaksi dalam bentuk grafik untuk menentukan harga laju
 Silabus RPP SMK KLS 12 CONTOH SILABUS Nama Sekolah : SMK SEDC Mata Pelajaran : KIMIA Kelas/Semester : XII Standar Kompetensi : 11. Mengidentifikasi faktor-faktor yang mempengaruhi laju reaksi Alokasi Waktu
Silabus RPP SMK KLS 12 CONTOH SILABUS Nama Sekolah : SMK SEDC Mata Pelajaran : KIMIA Kelas/Semester : XII Standar Kompetensi : 11. Mengidentifikasi faktor-faktor yang mempengaruhi laju reaksi Alokasi Waktu
H 2 O (L) H 2 O (G) KESETIMBANGAN KIMIA. N 2 O 4 (G) 2NO 2 (G)
 H 2 O (L) H 2 O (G) KESETIMBANGAN KIMIA. N 2 O 4 (G) 2NO 2 (G) Purwanti Widhy H Kesetimbangan adalah suatu keadaan di mana tidak ada perubahan yang terlihat seiring berjalannya waktu. Kesetimbangan kimia
H 2 O (L) H 2 O (G) KESETIMBANGAN KIMIA. N 2 O 4 (G) 2NO 2 (G) Purwanti Widhy H Kesetimbangan adalah suatu keadaan di mana tidak ada perubahan yang terlihat seiring berjalannya waktu. Kesetimbangan kimia
SILABUS Sekolah : SMA Negeri 5 Surabaya Mata Pelajaran : Kimia Kelas/semester : XI/1 Referensi : BSNP / CIE Standar Kompetensi
 SILABUS Sekolah : SMA Negeri 5 Surabaya Mata Pelajaran : Kimia Kelas/semester : /1 Referensi : BSNP / CIE Standar Kompetensi : 1.Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur
SILABUS Sekolah : SMA Negeri 5 Surabaya Mata Pelajaran : Kimia Kelas/semester : /1 Referensi : BSNP / CIE Standar Kompetensi : 1.Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur
A. KESEIMBANGAN DINAMIS
 1 Tugas Kimia IV Prakerin KESEIMBANGAN KIMIA Coba kamu perhatikan proses pendidihan air dengan panci tertutup. Pada waktu air menguap, uap air akan tertahan dalam tutup panci. Selanjutnya, uap air akan
1 Tugas Kimia IV Prakerin KESEIMBANGAN KIMIA Coba kamu perhatikan proses pendidihan air dengan panci tertutup. Pada waktu air menguap, uap air akan tertahan dalam tutup panci. Selanjutnya, uap air akan
LAJU REAKSI MEKANISME REAKSI
 KINETIKA KIMIA LAJU REAKSI BAGAIMANA PERUB. KIMIA TSB BERLANGSUNG - BESI MUDAH BERKARAT PD UDARA YANG LEMBAB - MAKANAN LEBIH CEPAT BUSUK BILA TIDAK DIINGINKAN MEKANISME REAKSI - PENJUMLAHAN TAHAP TAHAP
KINETIKA KIMIA LAJU REAKSI BAGAIMANA PERUB. KIMIA TSB BERLANGSUNG - BESI MUDAH BERKARAT PD UDARA YANG LEMBAB - MAKANAN LEBIH CEPAT BUSUK BILA TIDAK DIINGINKAN MEKANISME REAKSI - PENJUMLAHAN TAHAP TAHAP
Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka
 Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka waktu reaksi berlangsung pada suhu 90 o C Susu dipasteurisasi
Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka waktu reaksi berlangsung pada suhu 90 o C Susu dipasteurisasi
Soal Pilihan Ganda Berilah tanda silang pada huruf A, B, C, D atau E di depan jawaban yang benar!
 Soal Pilihan Ganda Berilah tanda silang pada huruf A, B, C, D atau E di depan jawaban yang benar!. Berikut ini adalah ciri-ciri terjadinya reaksi kesetimbangan, kecuali. reaksi reversibel B. terjadi dalam
Soal Pilihan Ganda Berilah tanda silang pada huruf A, B, C, D atau E di depan jawaban yang benar!. Berikut ini adalah ciri-ciri terjadinya reaksi kesetimbangan, kecuali. reaksi reversibel B. terjadi dalam
DAFTAR ISI. KATA PENGANTAR... i. DAFTAR ISI... iv. DAFTAR TABEL... vi. DAFTAR GAMBAR... vii. DAFTAR LAMPIRAN... ix BAB I PENDAHULUAN...
 DAFTAR ISI ABSTRAK KATA PENGANTAR... i DAFTAR ISI... iv DAFTAR TABEL... vi DAFTAR GAMBAR... vii DAFTAR LAMPIRAN... ix BAB I PENDAHULUAN... 1 A. Latar Belakang... 1 B. Rumusan Masalah... 5 C. Tujuan Penelitian...
DAFTAR ISI ABSTRAK KATA PENGANTAR... i DAFTAR ISI... iv DAFTAR TABEL... vi DAFTAR GAMBAR... vii DAFTAR LAMPIRAN... ix BAB I PENDAHULUAN... 1 A. Latar Belakang... 1 B. Rumusan Masalah... 5 C. Tujuan Penelitian...
BAB I PENDAHULUAN. A. Latar Belakang
 BAB I PENDAHULUAN A. Latar Belakang Reaksi kimia berlangsung dengan kecepatan yang berbeda-beda. Meledaknya petasan, adalah contoh reaksi yang berlangsung dalam waktu singkat. Proses perkaratan besi, pematangan
BAB I PENDAHULUAN A. Latar Belakang Reaksi kimia berlangsung dengan kecepatan yang berbeda-beda. Meledaknya petasan, adalah contoh reaksi yang berlangsung dalam waktu singkat. Proses perkaratan besi, pematangan
2. Konfigurasi elektron dua buah unsur tidak sebenarnya:
 . Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
. Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
Siswa diingatkan tentang struktur atom, bilangan kuantum, bentuk-bentuk orbital, dan konfigurasi elektron
 RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
BAB I PENDAHULUAN 1.1. Latar Belakang .
 BAB I PENDAHULUAN 1.1. Latar Belakang Kebutuhan bahan bakar yang meningkat dengan semakin bertambahnya industri dan jumlah kendaraan bermotor baru, 5 juta unit sepeda motor dan 700.000 mobil per tahun.
BAB I PENDAHULUAN 1.1. Latar Belakang Kebutuhan bahan bakar yang meningkat dengan semakin bertambahnya industri dan jumlah kendaraan bermotor baru, 5 juta unit sepeda motor dan 700.000 mobil per tahun.
Kesetimbangan Kimia. Bab 4
 Kesetimbangan Kimia Bab 4 Standar Kompetensi 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang memengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri Kompetensi
Kesetimbangan Kimia Bab 4 Standar Kompetensi 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang memengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri Kompetensi
BAB IV ANALISIS DAN PEMBAHASAN 4.2 DATA HASIL ARANG TEMPURUNG KELAPA SETELAH DILAKUKAN AKTIVASI
 39 BAB IV ANALISIS DAN PEMBAHASAN 4.1 PENDAHULUAN Hasil eksperimen akan ditampilkan pada bab ini. Hasil eksperimen akan didiskusikan untuk mengetahui keoptimalan arang aktif tempurung kelapa lokal pada
39 BAB IV ANALISIS DAN PEMBAHASAN 4.1 PENDAHULUAN Hasil eksperimen akan ditampilkan pada bab ini. Hasil eksperimen akan didiskusikan untuk mengetahui keoptimalan arang aktif tempurung kelapa lokal pada
PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH
 PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH TAHUN 2016 Soal diketik ulang oleh urip rukim (www.urip.info)
PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH TAHUN 2016 Soal diketik ulang oleh urip rukim (www.urip.info)
II. KOMPETENSI DASAR 3.1 Mendeskripsikan pengertian laju reaksi dengan melakukan percobaan tentang faktor-faktor yang mempengaruhi laju reaksi.
 RENCANA PELAKSANAAN PEMBELAJARAN (RPP) LAJU REAKSI SEKOLAH : SMAN 6 SURABAYA MATA PELAJARAN : KIMIA KELAS / SEMESTER : XI / (satu) PERTEMUAN KE : 3 ALOKASI WAKTU : 6 Jam Pelajaran I. STANDAR KOMPETENSI
RENCANA PELAKSANAAN PEMBELAJARAN (RPP) LAJU REAKSI SEKOLAH : SMAN 6 SURABAYA MATA PELAJARAN : KIMIA KELAS / SEMESTER : XI / (satu) PERTEMUAN KE : 3 ALOKASI WAKTU : 6 Jam Pelajaran I. STANDAR KOMPETENSI
Faktor-Faktor yang Mempengaruhi Pergeseran Kesetimbangan
 Standar Kometensi Kometensi Dasar Menjelaskan kinetika dan kesetimbangan reaksi kimia serta faktor-faktor yang memengaruhinya. Menjelaskan engertian reaksi kesetimbangan. Menyelidiki faktor-faktor yang
Standar Kometensi Kometensi Dasar Menjelaskan kinetika dan kesetimbangan reaksi kimia serta faktor-faktor yang memengaruhinya. Menjelaskan engertian reaksi kesetimbangan. Menyelidiki faktor-faktor yang
Reaksi kimia. Lambang-lambang yang digunakan dalam persamaan reaksi, antara lain:
 Reaksi kimia Reaksi kimia A Persamaan Reaksi Persamaan reaksi menggambarkan reaksi kimia yang terdiri atas rumus kimia pereaksi dan hasil reaksi disertai koefisien masing-masing. Pada reaksi kimia, satu
Reaksi kimia Reaksi kimia A Persamaan Reaksi Persamaan reaksi menggambarkan reaksi kimia yang terdiri atas rumus kimia pereaksi dan hasil reaksi disertai koefisien masing-masing. Pada reaksi kimia, satu
KINETIKA KIMIA LAJU DAN MEKANISME DALAM REAKSI KIMIA. Disampaikan oleh : Dr. Sri Handayani 2013
 KINETIK KIMI LJU DN MEKNISME DLM REKSI KIMI Disampaikan oleh : Dr. Sri Handayani 03 Pendahuluan Perubahan kimia secara sederhana diulis dalam persamaan reaksi dengan koefisien seimbang Namun persamaan
KINETIK KIMI LJU DN MEKNISME DLM REKSI KIMI Disampaikan oleh : Dr. Sri Handayani 03 Pendahuluan Perubahan kimia secara sederhana diulis dalam persamaan reaksi dengan koefisien seimbang Namun persamaan
BAB 1 PENDAHULUAN. energi, menyusun bahan makanan, merombak bahan makanan, memasukkan atau
 BAB 1 PENDAHULUAN 1. LATAR BELAKANG Metabolisme merupakan suatau reaksi kimia yang terjadi didalam tubuh makhluk hidup. Reaksi metabolisme tersebut dimaksudkan untuk memperoleh energi, menyimpan energi,
BAB 1 PENDAHULUAN 1. LATAR BELAKANG Metabolisme merupakan suatau reaksi kimia yang terjadi didalam tubuh makhluk hidup. Reaksi metabolisme tersebut dimaksudkan untuk memperoleh energi, menyimpan energi,
BAB II KAJIAN PUSTAKA. salah yang artinya tidak benar, tidak betul atau keliru. Jadi, kesalahan dalam memecahkan
 BAB II KAJIAN PUSTAKA. Kesalahan Pemahaman Siswa Kesalahan menurut kamus besar Bahasa Indonesia (007:98) berasal dari kata dasar salah yang artinya tidak benar, tidak betul atau keliru. Jadi, kesalahan
BAB II KAJIAN PUSTAKA. Kesalahan Pemahaman Siswa Kesalahan menurut kamus besar Bahasa Indonesia (007:98) berasal dari kata dasar salah yang artinya tidak benar, tidak betul atau keliru. Jadi, kesalahan
Komponen Materi. Kimia Dasar 1 Sukisman Purtadi
 Komponen Materi Kimia Dasar 1 Sukisman Purtadi Pengamatan ke Arah Pandangan Atomik Materi Konservasi Massa Komposisi Tetap Perbandingan Berganda Teori Atom Dalton Bagaimana Teori Dalton Menjelaskan Hukum
Komponen Materi Kimia Dasar 1 Sukisman Purtadi Pengamatan ke Arah Pandangan Atomik Materi Konservasi Massa Komposisi Tetap Perbandingan Berganda Teori Atom Dalton Bagaimana Teori Dalton Menjelaskan Hukum
BAB.4 LAJU REAKSI. Suatu reaksi yang diturunkan secara eksperimen dinyatakan dengan rumus kecepatan reaksi :
 BAB.4 LAJU REAKSI laju reaksi adalah banyaknya mol/liter suatu zat yang dapat berubah menjadi zat lain dalam setiap satuan waktu. Pada umumnya kecepatan reaksi akan besar bila konsentrasi pereaksi cukup
BAB.4 LAJU REAKSI laju reaksi adalah banyaknya mol/liter suatu zat yang dapat berubah menjadi zat lain dalam setiap satuan waktu. Pada umumnya kecepatan reaksi akan besar bila konsentrasi pereaksi cukup
LEMBAR AKTIVITAS SISWA ( LAS )_ 1
 LEMBAR AKTIVITAS SISWA ( LAS )_ 1 1. Perhatikan reaksi berikut: CaCO 2 (s) CaO (s) + CO 2 (g) H = 178 KJ/mol. Jelaskan! a. Arah kesetimbangan ditambahkan CaCO 2 (s) b. Tiga kemungkinan yang dapat dilakukan
LEMBAR AKTIVITAS SISWA ( LAS )_ 1 1. Perhatikan reaksi berikut: CaCO 2 (s) CaO (s) + CO 2 (g) H = 178 KJ/mol. Jelaskan! a. Arah kesetimbangan ditambahkan CaCO 2 (s) b. Tiga kemungkinan yang dapat dilakukan
HALAMAN PENGESAHAN LAPORAN RESMI PRAKTIKUM KIMIA DASAR. :4. Pengaruh Konsentrasi dan Suhu Pada Laju Reaksi. 6. John Peterson Serius
 HALAMAN PENGESAHAN LAPORAN RESMI PRAKTIKUM KIMIA DASAR Nama Percobaan :4. Pengaruh Konsentrasi dan Suhu Pada Laju Reaksi Kelompok :12 (Dua Belas) Nama :1 Muhammad Dary Dzaky (1404015185) 2. Ina Subiyanti
HALAMAN PENGESAHAN LAPORAN RESMI PRAKTIKUM KIMIA DASAR Nama Percobaan :4. Pengaruh Konsentrasi dan Suhu Pada Laju Reaksi Kelompok :12 (Dua Belas) Nama :1 Muhammad Dary Dzaky (1404015185) 2. Ina Subiyanti
Analisis Keterkaitan KI - KD dengan IPK dan Materi Pembelajaran. Kompetensi Inti Kompetensi Dasar Indikator Pencapaian Kompetensi
 No. Dokumen : F/751/WKS1/P/6 No. Revisi : 1 Tanggal Berlaku : 1 Juli 2016 Analisis Keterkaitan KI - KD dengan IPK dan Sekolah : SMA NEGERI 1 GODEAN Mata Pelajaran : Kimia Kelas / Program : XI/MIPA Semester
No. Dokumen : F/751/WKS1/P/6 No. Revisi : 1 Tanggal Berlaku : 1 Juli 2016 Analisis Keterkaitan KI - KD dengan IPK dan Sekolah : SMA NEGERI 1 GODEAN Mata Pelajaran : Kimia Kelas / Program : XI/MIPA Semester
