Waktu (t) Gambar 3.1 Grafik hubungan perubahan konsentrasi terhadap waktu
|
|
|
- Yanti Hartanto
- 7 tahun lalu
- Tontonan:
Transkripsi
1 3 LAJU REAKSI Setelah mempelajari bab ini, kamu diharapkan mampu: Menghitung konsentrasi larutan (molaritas larutan). Menganalisis faktor-faktor yang mempengaruhi laju reaksi (konsentrasi, luas permukaan, suhu, dan katalis) melalui percobaan. Menafsirkan grafik dari data percobaan tentang faktor-faktor yang mempengaruhi laju reaksi. Menjelaskan pengaruh konsentrasi, luas permukaan bidang sentuh, dan suhu terhadap laju reaksi berdasarkan teori tumbukan. Membedakan diagram energi potensial dari reaksi kimia yang menggunakan katalisator dan yang tidak menggunakan katalisator. Menjelaskan pengertian, peranan katalisator dan energi pengaktifan dengan menggunakan diagram. Menentukan orde dan waktu reaksi. Menjelaskan peranan katalis dalam makhluk hidup dan industri. 45
2 A. KONSEP LAJU REAKSI Kata Kunci 1. Pengertian laju reaksi konsep, laju reaksi, Reaksi kimia berlangsung dengan kecepatan yang berbeda-beda. Meledaknya petasan, adalah contoh reaksi yang berlangsung dalam waktu singkat. Proses perkaratan besi, pematangan buah di pohon, dan fosilisasi sisa organisme merupakan peristiwaperistiwa kimia yang berlangsung sangat lambat. Reaksi kimia selalu berkaitan dengan perubahan dari suatu pereaksi (reaktan) menjadi hasil reaksi (produk). Pereaksi (reaktan) Hasil reaksi (produk) Laju reaksi dapat dinyatakan sebagai berkurangnya jumlah (konsentrasi) pereaksi per satuan waktu atau bertambahnya jumlah (konsentrasi) hasil reaksi per satuan waktu. Konsentrasi Produk Pereaksi Gambar 3.1 Grafik hubungan perubahan konsentrasi terhadap waktu Berdasarkan grafik diatas, maka: Waktu (t) Laju reaksi + Δ [Produk] Δt v pereaksi v produk Di mana: [Pereaksi] [Produk] Δ t v konsentrasi pereaksi (mol/liter) konsentrasi produk (mol/liter) perubahan waktu (detik) laju reaksi (M/detik) (Tanda negatif menunjukkan bahwa konsentrasi pereaksi berkurang, sedangkan tanda positif menunjukkan bahwa konsentrasi produk bertambah) 46
3 2. Molaritas larutan (M) dan penggunaannya Reaksi zat dalam bentuk larutan sering dipengaruhi oleh perbandingan komponen penyusun larutan. Larutan biasanya disebut encer, bila mengandung sedikit zat terlarut. Encer pekatnya larutan disebut konsentrasi. Satuan laju reaksi umumnya dinyatakan dengan mol/liter.detik. Molaritas (mol/ liter) adalah ukuran yang menyatakan banyaknya mol zat terlarut dalam satu liter larutannya. Molaritas (M) Atau: Molaritas (M) Contoh soal: Berapa molaritas larutan yang dibuat dengan cara melarutkan 49 gram H 2 SO 4 (Mr 98) dalam air sampai volume 200 ml? Jawab: Molaritas (M) 1000 vol 2terlarut tso4 arutan O 4 2,5 mol/ Liter (M) Adakalanya, larutan yang tersedia di laboratorium adalah larutan-larutan yang konsentrasinya sangat tinggi (larutan pekat), sehingga bila kita memerlukan larutan dengan konsentrasi rendah maka kita perlu mengencerkannya terlebih dahulu. Pengenceran adalah penambahan zat pelarut ke dalam suatu larutan yang pekat untuk mendapatkan larutan baru yang konsentrasinya lebih rendah. Jumlah mol sebelum pengenceran harus sama dengan jumlah mol setelah pengenceran, sehingga: n 1 n 2 M 1 V 1 M 2 V 2 Dimana: M 1 konsentrasi molar awal V 1 volume larutan awal M 2 konsentrasi molar setelah pengenceran V 2 volume larutan setelah pengenceran n 2 konsentrasi molar setelah pengenceran n 2 volume larutan setelah pengenceran 47
4 B. PERSAMAAN LAJU REAKSI Hubungan kuantitatif antara perubahan konsentrasi dengan laju reaksi dinyatakan dengan Persamaan Laju Reaksi atau Hukum Laju Reaksi. Untuk reaksi: pa + qb rc maka bentuk umum persamaan lajunya adalah: Kata Kunci persamaan, laju reaksi, orde v k [A] m [B] n dimana: v laju reaksi (mol/ Liter. s) k tetapan laju reaksi m orde/tingkat reaksi terhadap A n orde/tingkat reaksi terhadap B [A] konsentrasi awal A (mol/ Liter) [B] konsentrasi awal B (mol/ Liter) Tingkat reaksi (orde reaksi) tidak sama dengan koefisien reaksi. Orde reaksi hanya dapat ditentukan melalui percobaan. Tingkat reaksi total adalah jumlah tingkat reaksi untuk setiap pereaksi. Orde reaksi total m + n Orde reaksi menunjukkan hubungan antara perubahan konsentrasi pereaksi dengan perubahan laju reaksi. Hubungan antara kedua besaran ini dapat dinyatakan dengan grafik orde reaksi. Pada reaksi orde nol, laju reaksi tidak bergantung pada konsentrasi pereaksi. v v k [pereaksi] Pada reaksi orde satu, laju reaksi berbanding lurus dengan konsentrasi pereaksi. Jika konsentrasi dinaikkan dua kali, maka laju reaksinya pun akan dua kali lebih cepat dari semula, dst. 48
5 v k [pereaksi] 1 v [pereaksi] Pada reaksi orde dua, kenaikan laju reaski akan sebanding dengan kenaikan konsentrasi pereaksi pangkat dua. Bila konsentrasi pereaksi dinaikkan dua kali, maka laju reaksinya akan naik menjadi empat kali lipat dari semula. v v k [pereaksi] 2 [pereaksi] Dengan demikian, jika konsentrasi suatu zat dinaikkan a kali, maka laju reaksinya menjadi b kali; sehingga orde reaksi terhadap zat tersebut adalah : a x b dimana x orde reaksi Persamaan laju reaksi dapat ditentukan melalui eksperimen, yaitu dengan mengukur konsentrasi salah satu produk pada selang waktu tertentu selama reaksi berlangsung. Tabel di bawah ini menunjukkan hasil percobaan penentuan laju reaksi antara gas hidrogen dengan nitrogen monoksida yang dilakukan pada suhu 800 o C, menurut persamaan reaksi: 2H 2 (g) + 2NO (g) 2H 2 O (g) + N 2 (g) Percobaan ke- [NO] awal (mol/dm 3 ) [H 2 ] awal (mol/dm 3 ) Laju awal pembentukan N 2 (mol/dm 3 ) 1 0,006 0,001 0, ,006 0,002 0, ,006 0,003 0, ,001 0,006 0, ,002 0,006 0, ,003 0,006 0,
6 Dengan membandingkan percobaan (4) dan (5), nampak bahwa jika konsentrasi NO dinaikkan dua kali maka laju reaksi menjadi 4 kali lebih cepat; sedangkan dari percobaan (4) dan (6), jika konsentrasi NO dinaikkan 3 kali, maka laju reaksinya menjadi 9 kali lebih cepat. v k [NO] 2 m 2 Dari percobaan (1) dan (2) terlihat bahwa jika konsentrasi gas H 2 dinaikkan 2 kali maka laju reaksinya menjadi 2 kali lebih cepat, dan jika konsesntrasi H 2 dinaikkan 3 kali maka laju reaksinya menjadi 3 kali semula. v k [H 2 ] n 1 Dengan demikian, persamaan laju reaksinya menjadi: v k [NO] 2 [H 2 ] Untuk menetukan harga k, misalnya diambil data dari percobaan (2) : v k [NO] 2 [H 2 ] 0,0060 mol/ dm 3.s k (0,006 mol/ dm 3 ) 2 (0,002 mol/ dm 3 ) k 8, mol 2 dm 6 s 1 50
7 Contoh soal: Pada suhu 273 o C, gas brom dapat bereaksi dengan gas nitrogen monoksida menurut persamaan reaksi: 2NO 2(g) + Br 2(g) 2NOBr (g) Dari reaksi tersebut diperoleh data sebagai berikut: Perc. No [NO 2 ] [Br 2 ] Kecepatan reaksi 1 0,1 0, ,1 0, ,1 0, ,2 0, ,3 0,05 54 Tentukan tingkat reaksi (orde) dari reaksi tersebut! Pembahasan: Persamaan laju reaksi untuk reaksi di atas: v k [NO 2 ] m [Br 2 ] n Untuk menentukan orde reaksi terhadap NO 2, kita ambil yang konsentrasi Br 2 nya sama (tetap) m 2 Untuk menentukan orde reaksi terhadap Br 2, kita ambil yang konsentrasi NO 2 nya sama (tetap) n 1 51
8 Jadi persamaan laju reaksinya dapat diketahui: v k [NO 2 ] 2 [Br 2 ] Orde reaksi m + n C. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI 1. Konsentrasi Kata Kunci Larutan dengan konsentrasi yang besar (pekat) faktor, konsentrasi, luas mengandung partikel yang lebih rapat, jika dibandingkan dengan larutan encer. Semakin tinggi konsentrasi berarti permukaan sentuh, temperatur, katalisator semakin banyak molekul-molekul dalam setiap satuan luas ruangan, akibatnya tumbukan antar molekul makin sering terjadi dan reaksi berlangsung semakin cepat. Semakin tinggi konsentrasi suatu larutan, makin besar laju reaksinya 2. Luas permukaan sentuh Suatu zat akan bereaksi apabila bercampur dan bertumbukan. Pada pencampuran reaktan yang terdiri dari dua fasa atau lebih, tumbukan berlangsung pada bagian permukaan zat. Padatan berbentuk serbuk halus memiliki luas permukaan bidang sentuh yang lebih besar daripada padatan berbentuk lempeng atau butiran. Semakin luas permukaan partikel, maka frekuensi tumbukan kemungkinan akan semakin tinggi sehingga reaksi dapat berlangsung lebih cepat. Laju reaksi berbanding lurus dengan luas permukaan reaktan 3. Temperatur Setiap partikel selalu bergerak. Dengan naiknya suhu, energi gerak (kinetik) partikel ikut meningkat sehingga makin banyak partikel yang memiliki energi kinetik di atas harga energi aktivasi (Ea). Kenaikan suhu akan memperbesar laju reaksi Harga tetapan laju reaksi (k) akan berubah jika suhunya berubah. Berdasarkan hasil percobaan, laju reaksi akan menjadi 2 kali lebih besar untuk setiap kenaikan suhu 10 o C. o laju reaksi awal laju reaksi setelah suhu dinaikkan t kenaikan suhu ( t 2 t 1 ) 52
9 Contoh soal: Setiap kenaikan suhu 20 o C, laju reaksi menjadi 3 kali lebih cepat dari semula. Jika pada suhu 20 o C laju reaksi berlangsung 9 menit, maka tentukan laju reaksi pada suhu 80 o C! Pembahasan: T 1 20 o T 2 80 o T 9 menit. v t 2. v t t 2 menit 4. Katalisator Katalis adalah zat yang dapat memperbesar laju reaksi, tetapi tidak mengalami perubahan kimia secara permanen, sehingga pada akhir reaksi zat tersebut dapat diperoleh kembali. Katalis mempercepat reaksi dengan cara menurunkan harga energi aktivasi (Ea). Katalisis adalah peristiwa peningkatan laju reaksi sebagai akibat penambahan suatu katalis. Meskipun katalis menurunkan energi aktivasi reaksi, tetapi ia tidak mempengaruhi perbedaan energi antara produk dan pereaksi. Dengan kata lain, penggunaan katalis tidak akan mengubah entalpi reaksi. Energi pereaksi Ea tanpa katalis Ea dengan adanya katalis Gambar 3.2 Grafik energi pengaktifan berkurang dengan adanya katalis 53
10 Berdasarkan wujudnya, katalis dapat dibedakan menjadi dua macam, yaitu katalis homogen dan katalis heterogen. a. Katalis homogen Katalis homogen adalah katalis yang berada dalam fasa yang sama dengan molekul pereaksi. Banyak contoh dari katalis jenis ini baik dalam fasa gas maupun dalam fasa cair atau larutan. Contoh: Katalis dan pereaksi berwujud cair 2H 2 O 2 (aq) H 2 O (l) +O 2 (g) Katalis dan pereaksi berwujud gas NO (g) 2SO 2 (g) + O 2 (g) 2SO 3 (g) b. Katalis heterogen Katalis heterogen berada dalam fasa yang berbeda dengan pereaksi; biasanya ada dalam bentuk padatan. Katalis heterogen biasanya melibatkan pereaksi fasa gas yang terserap pada permukaan katalis padat. Terdapat dua jenis proses penyerapan gas pada permukaan padat, yaitu adsorpsi (penyerapan zat pada permukaan benda) dan absorpsi (penyerapan zat ke seluruh bagian benda). Contoh: Katalis berwujud padat, sedangkan pereaksi berwujud gas. vo 2 5(8) 2SO 2 (g) + O 2 2SO 3 (g) Ni C 2 H 4 (g) + H 2 (g) (8) c. Autokatalis C 2 H 6 (g) Autokatalis adalah zat hasil reaksi yang dapat berperan sebagai katalis. Contoh: MnSO 4 yang dihasilkan dari reaksi kalium permanganat dengan asam oksalat dalam suasana asam merupakan autokatalis reaksi tersebut. 2 KMnO 4 (aq) + 5 H 2 C 2 O(aq) + 3 H 2 SO 4 (aq) 2 MnSO 4 (aq) + K 2 SO 4 (aq) + 8H 2 O(l) + 10 CO 2 (g) Disamping itu, ada beberapa zat yang dapat memperlambat suatu reaksi. Zat tersebut dinamakan antikatalis, karena sifatnya berlawanan dengan katalis. Inhibitor Inhibitor adalah zat yang memperlambat atau menghentikan jalannya reaksi. 54
11 Contoh: SnCl 2 bersifat inhibitor pada reaksi : H 2 SO 3 + udara H 2 SO 4 Racun katalis Racun katalis adalah zat yang dalam jumlah sedikit dapat menghambat kerja katalis. Contoh: CO 2,CS 2, atau H 2 S merupakan racun katalis pada reaksi : 2H 2 (g) + O 2 (g) 2H 2 O (l) KEGIATAN 3.1 Faktor-faktor yang mempengaruhi laju reaksi Tujuan Menyelidiki pengaruh luas permukaan, suhu, konsentrasi, dan katalisator terhadap laju reaksi. Alat dan Bahan Alat dan Bahan Ukuran/satuan Jumlah Tabung reaksi - 5 Gelas kimia 250 ml 5 Sumbat tabung - 5 Alat pengukur waktu - 1 Termometer 100 o C 1 Pipet tetes - 5 Lampu spiritus - 1 Kaki tiga - 1 Pualam Keping dan serbuk 5 gram Larutan asam klorida 1 M, 2 M, dan 3 M 10 ml Larutan asam oksalat 0,1 M 10 ml Larutan asam sulfat 1 M 10 ml Larutan kalium permanganat 0,1 M 10 ml 55
12 a. Pengaruh luas permukaan 1. Masukkan 10 ml larutan HCL 3 M ke dalam gelas kimia. 2. Tambahkan keping-keping pualam dan catat waktu sejak penambahan tersebut sampai pualam habis bereaksi. 3. Ulangi kegiatan di atas dengan menggunakan 10 ml HCL 3 M dan pualam yang telah digerus halus. Catat waktunya. 4. Bandingkan kedua percobaan tersebut dan buatlah kesimpulannya. b. Pengaruh suhu 1. Masukkan 10 ml asam oksalat 0,1 M ke dalam gelas kimia. Tambahkan 2 ml asam sulfat 1 M. Ukur suhunya dan letakkan di atas kertas putih. Masukkan 4 ml kalium permanganat 0,1 M ke dalam campuran di atas sambil memijit stopwatch. Aduk campuran tersebut dan amati hilangnya warna kalium permanganat. Matikan stopwatch pada saat warna kalium permanganat tepat hilang. Catat waktu yang digunakan. 2. Masukkan 10 ml asam oksalat 0,1 M ke dalam gelas kimia. Tambahkan 2 ml asam sulfat 1 M. Panaskan campuran tersebut sampai suhunya 20 o C dari suhu yang diamati pada kegiatan 1, atau sampai suhunya 40 o C. Letakkan di atas kertas putih. Segera masukkan 4 ml kalium permanganat 0,1 ml ke dalam campuran di atas sambil memijit stopwatch. Aduk campuran tersebut dan amati hilangnya warna kalium permanganat. Matikan stopwatch pada saat warna kalium permanganat tepat hilang. Catat waktu yang digunakan. 3. Lakukan kegiatan 1 dan 2 di atas di mana suhunya setiap kali naik 20 o C dari percobaan sebelumnya. Pemanasan dilakukan sampai suhu larutan mendidih. 4. Tuliskan seluruh hasil pengamatan pada lembar data pengamatan dan diskusikan hasilnya. c. Pengaruh katalis 1. Masukkan 10 ml asam oksalat 0,1 M dalam gelas kimia. 2. Tambahkan 2 ml asam sulfat 1 M. Kemudian tambahkan 0,5 ml mangan sulfat 0,1 M. Letakkan di atas kertas putih. Masukkan 4 ml kalium permanganat 0,1 M ke dalam campuran di atas sambil memijit stopwatch. 3. Aduk campuran tersebut dan amati hilangnya warna kalium permanganat. Matikan stopwatch pada saat warna kalium permanganat tepat hilang. 4. Catat waktu yang digunakan. 5. Bandingkan hasil pengamatan ini dengan hasil pengamatan pada kegiatan A1, dan tuliskan hasil pengamatan pada lembar data pengamatan, kemudian diskusikan hasilnya. 56
13 D. PERANAN KATALIS DALAM MAHLUK HIDUP DAN INDUSTRI 1. Peranan katalis dalam mahluk hidup Telah diketahui bahwa laju reaksi akan meningkat secara tajam dengan naiknya suhu. Jika reaksi tertentu tidak cukup cepat pada suhu normal, kita dapat mempercepat lajunya dengan meningkatkan suhu reaksi. Namun demikian, terkadang upaya ini tidak layak dilakukan. Misalnya, sel mahluk hidup dirancang untuk beroperasi pada suhu sekitar 37 o C. Akan tetapi, banyak reaksi biokimia dalam tubuh yang akan berlangsung terlalu lambat pada suhu ini bila tidak ada campur tangan zat lain. Dalam tubuh kita, berbagai proses biokimia dipercepat oleh katalis yang disebut enzim (biokatalis). Enzim-enzim ini selalu bekerja secara spesifik; suatu reaksi hanya dapat dipercepat oleh enzim tertentu, ibarat lubang kunci dengan anak kuncinya. Enzim membentuk kompleks dengan substrat (zat yang akan dipercepat reaksinya), lalu kompleks itu terurai menghasilkan zat yang diinginkan, sedangkan enzim dikembalikan lagi ke bentuknya semula. Contoh: Kata Kunci katalis, makhluk hidup, industri Enzim oksidase mempercepat reaksi oksidasi Enzim hidrolase mempercepat pemecahan bahan makanan melalui reaksi hidrolisis. Gambar 3.3 Pembentukan suatu zat dengan menggunakan katalis enzim Sumber: 2. Peranan katalis dalam industri Dalam proses industri, penggunaan suhu yang lebih tinggi untuk mempercepat reaksi seperti proses Haber untuk sintesis ammonia bisa saja dilakukan, akan tetapi biaya operasionalnya akan menjadi sangat mahal. Di dalam indutsri kimia, meningkatkan suhu berarti menambah biaya untuk pasokan energi. Oleh karena itu, diperlukan suatu zat yang mampu mempercepat reaksi tanpa harus meningkatkan suhu atau tekanan sehingga biaya produksi menjadi lebih murah. Zat tersebut adalah katalis. 57
14 a. Proses kontak (pembuatan asam sulfat) Reaksi pembuatan asam sulfat dilakukan melaui beberapa tahap: 1) S + O 2 SO 2 2) 2SO 2 + O 2 2SO 3 3) SO 3 + H 2 O H 2 SO 4 Reaksi tahap (2) berlangsung sangat lambat, sehingga perlu ditambahkan katalis vanadium (V) oksida, V 2 O 5 b. Proses Haber-Bosch (pembuatan amonia) Amonia adalah salah satu senyawa yang sangat dibutuhkan dalam industri pupuk. Senyawa ini dibuat melalui reaksi antara gas nitrogen dan gas hidrogen. N 2 (g) + 3H 2 (g) 2NH 3 (g) Reaksi tersebut berjalan sangat lambat pada suhu rendah, sedangkan pada suhu tinggi gas NH 3 yang dihasilkan cenderung terurai kembali menjadi gas nitrogen dan gas hidrogen. Atas dasar itulah, diperlukan suatu kondisi yang memungkinkan agar reaksi dapat berlangsung cepat pada suhu rendah. Setelah melakukan penelitian yang cukup lama, pada tahun 1905 Fritz Haber berhasil menemukan cara membuat gas NH 3 yang efisien, yaitu dengan menambahkan katalis berupa serbuk besi (besi plus). Katalisator ini dibuat dari besi yang dicampur dengan sedikit kalium oksida dan alumunium. Penambahan katalisator Fe tersebut menyebabkan produksi gas amonia dapat berlangsung efektif pada suhu 500 o C. Proses ini selanjutnya dikenal dengan Proses Haber. Ringkasan Reaksi kimia berlangsung dengan kecepatan yang berbeda-beda. Reaksi kimia selalu berkaitan dengan perubahan dari suatu pereaksi (reaktan) menjadi hasil reaksi (produk). Laju reaksi dapat dinyatakan sebagai berkurangnya jumlah (konsentrasi) pereaksi per satuan waktu atau bertambahnya jumlah (konsentrasi) hasil reaksi per satuan waktu. Hubungan kuantitatif antara perubahan konsentrasi dengan laju reaksi dinyatakan dengan Persamaan Laju Reaksi. Persamaan laju reaksi dapat ditentukan melalui eksperimen, yaitu dengan mengukur konsentrasi salah satu produk pada selang waktu tertentu selama reaksi berlangsung. Cepat lambatnya laju reaksi dipengaruhi oleh beberapa faktor, antara lain : Konsentrasi, dimana semakin tinggi konsentrasi suatu larutan, makin besar laju reaksinya; Luas permukaan sentuh, dimana laju reaksi berbanding lurus dengan luas permukaan reaktan; Temperatur, dimana kenaikan suhu akan memperbesar laju reaksi; dan Katalis. Katalis mempercepat reaksi dengan cara menurunkan harga energi aktivasi (Ea). Berbagai proses biokimia yang terjadi dalam tubuh kita dipercepat oleh katalis yang disebut enzim (biokatalis). 58
15 GLOSARIUM Absorpsi : penyerapan zat pada permukaan benda Adsorpsi : penyerapan zat pada ke seluruh bagian benda Inhibitor : zat yang memperlambat atau menghentikan jalannya reaksi Katalis : zat yang dapat memperbesar laju reaksi, tetapi tidak mengalami perubahan kimia secara permanen, sehingga pada akhir reaksi zat tersebut dapat diperoleh kembali Katalisis : peristiwa peningkatan laju reaksi sebagai akibat penambahan suatu katalis Racun katalis: zat yang dalam jumlah sedikit dapat menghambat kerja katalis SOAL-SOAL LATIHAN BAB 3 I. Pilihan Ganda Pilihlah salah satu jawaban yang paling benar! 1. Larutan NaCl (Mr 58,5) mempunyai konsentrasi 0,2 M; artinya dalam. A. 1 liter larutannya terdapat 2 gram NaCl B. 1 liter pelarutnya terdapat 0,2 mol NaCl C. 2 liter pelarutnya terdapat 0,4 mol NaCl D. 500 ml pelarutnya terdapat 4 gram NaCl E. 500 ml larutannya terdapat 0,2 mol NaCl 2. Ke dalam 250 ml larutan 0,1 M NaOH, dilakukan pengenceran dengan menambahkan 500 ml air. Kemolaran larutan sekarang adalah. A. 0,02 M D. 0,04 M B. 0,3 M E. 0,033 M C. 0,025 M 3. Molaritas larutan Ca(OH) 2 yang dibuat dengan melarutkan 0,10 mol Ca(OH) 2 ke dalam air sampai volumenya 2 liter adalah. A. 2,50 M D. 0,20 M B. 2,00 M E. 0,05 M C. 0,50 M 4. Jika perubahan konsentrasi salah satu pereaksi tidak mempengaruhi laju reaksi, maka orde reaksi terhadap pereaksi tersebut adalah. A. 4 D. 1 B. 3 E. 0 C. 2 59
16 5. Laju reaksi untuk persamaan: P + Q PQ Pada setiap saat dapat dinyatakan bahwa. A. penambahan konsentrasi P tiap satuan waktu B. penambahan konsentrasi P dan Q tiap satuan waktu C. penambahan konsentrasi P, Q dan PQ tiap satuan waktu D. penambahan konsentrasi PQ tiap satuan waktu E. penambahan konsentrasi P dan PQ tiap satuan waktu 6. Pada reaksi: 3A (g) +B (g) + 2C (g) D(g) + 2E (g) Jika kecepatan pembentukan D adalah k [A][B] 2 Maka kecepatan reaksinya tidak dipengaruhi oleh perubahan. A. temperatur D. konsentrasi B B. suhu E. konsentrasi C C. konsentrasi A 7. Laju reaksi dari A (g) + B (g) C (g) adalah v k [A][B] 2. Jika volume yang ditempati gas-gas tersebut diubah menjadi kali volume semula, maka laju reaksinya dibandingkan semula akan menjadi. A. kali D. kali B. 16 kali E. 64 kali C. 32 kali 8. Grafik yang menyatakan reaksi orde satu adalah. A. D. B. E. C. 9. Kenaikan suhu akan mempercepat laju reaksi karena. A. kenaikan suhu akan menyebabkan konsentrasi pereaksi meningkat B. frekuensi tumbukan semakin tinggi C. dalam reaksi kimia suhu berperan sebagai katalisator 60
17 D. kenaikan suhu akan mengakibatkan turunnya energi aktivasi E. energi kinetik partikel-partikel yang bereaksi semakin tinggi 10. Suatu katalis mempercepat reaksi dengan cara meningkatkan. A. jumlah tumbukan molekul B. energi kinetik molekul C. perubahan entalpi D. energi aktivasi E. jumlah molekul yang memiliki energi di atas energi aktivasi 11. Diantara reaksi berikut yang terjadi paling cepat adalah. A. 2 gram batang Zn dengan larutan HCl 0,01 M B. 2 gram batang Zn dengan larutan HCl 0,1 M C. 2 gram serbuk Zn dengan larutan HCl 0,01 M D. 2 gram serbuk Zn dengan larutan HCl 0,001 M E. 2 gram serbuk Zn dengan larutan HCl 0,1 M 12. Dari percobaan pengukuran laju reaksi diperoleh data sebagai berikut: No [A] [B] Waktu reaksi 1 0,1 0, ,2 0, ,4 0, ,4 0, ,4 0,05 36 Dapat disimpulkan bahwa orde reaksi totalnya adalah. A. 1 D. 4 B. 2 E. 5 C Uap bensin lebih mudah terbakar daripada bensin cair. Perbedaan tersebut disebabkan karena faktor. A. entalpi D. luas permukaan B. katalisator E. konsentrasi C. suhu 14. Energi aktivasi suatu reaksi dapat diperkecil dengan cara. A. menaikkan suhu D. memperbesar tekanan B. menambah konsentrasi E. menambahkan katalis C. menghaluskan pereaksi 15. Reaksi antara gas hydrogen dan gas nitrogen monoksida berlangsung menurut persamaan: 2H 2 (g) +2NO (g) 2H 2 O (g) + N 2 (g) Kecepatan reaksinya adalah v k [H 2 ] [NO] 2 61
18 Dengan demikian, reaksi tersebut termasuk reaksi orde ke. A. 0 D. 3 B. 1 E. 4 C Faktor-faktor berikut mempengaruhi laju reaksi, kecuali. A. jumlah zat pereaksi D. suhu B. katalisator E. konsentrasi awal zat pereaksi C. luas permukaaan sentuhan 17. Reaksi akan berlangsung 3 kali lebih cepat dari semula setiap kenaikan 20 o C. Jika pada suhu 30 o C suatu reaksi berlangsung 3 menit, maka pada suhu 70 o C reaksi akan berlangsung selama. A. 1/3 menit D. 4 menit B. 2/3 menit E. 12 menit C. 1 menit 18. Data percobaan laju reaksi untuk: 2 NO (g) + 2H 2(g) N 2(g) + 2H 2 O (g) Percobaan Konsentrasi [NO] [H 2 ] Laju reaksi , , , , , , Berdasarkan data di atas, maka rumus laju reaksi yang benar adalah. A. v k(no)(h 2 ) D. v k(no) 2 B. v k(no)(h 2 ) 2 E. v k(h 2 ) 2 C. v k(no) 2 (H 2 ) 19. Pada reaksi 2A + B +2C D + 2 E, kecepatan reaksinya adalah V k(a).(b) 2. kecepatan reaksi ini tidak dipengaruhi oleh. A. konsentrasi A D. suhu B. konsentrasi B E. tekanan C. konsentrasi C 20. Suatu reaksi berlangsung pada suhu 20 o C. Bila pada setiap kenaikkan 10 o C tetapan laju reaksinya meningkat 2 kali, maka laju reaksi pada 60 o C dibandingkan dengan 20 o C akan meningkat... A. 2 kali D. 32 kali B. 8 kali E. 64 kali C. 16 kali 62
19 II. Uraian 1. Diketahui reaksi: H 2 O 2 + 2I 2H 2 O + I 2 Jika konsentrasi I 2 bertambah dari 0 menjadi 10 5 mol/l dalam 10 sekon, berapa laju reaksi untuk persamaan tersebut? 2. Dari persamaan reaksi: A + B C Diperoleh data sebagai berikut: [A] molar 0,1 0,1 0,2 [A] molar 0,05 0,20 0,20 Laju reaksi molar/jam Tentukan persamaan laju dari data diatas! 3. Untuk reaksi P (g) + Q (g) PQ (g) diperoleh data sebagai berikut: No [P] M [Q] M v (M/s) 1 0,05 0, ,20 0, ,40 0,80 32 Tentukan: a. persamaan lajunya b. orde reaksi total c. harga k 4. Suatu reaksi berlangsung dua kali lebih cepat setiap kenaikan temperatur sebesar 10 o C. Tentukan waktu reaksi pada temperatur 75 o C jika diketahui waktu reaksi pada suhu 45 o C adalah 48 detik! 5. Persamaan laju reaksi untuk P + 2Q R adalah v k [P][Q] 2. Jika konsentrasi P dan Q masing-masing 1 molar, maka pada saat konsentrasi P tinggal molar, tentukan laju reaksinya! 63
20 64
PRAKTIKUM KIMIA DASAR I KECEPATAN REAKSI. Kelompok V : Amir Hamzah Umi Kulsum
 PRAKTIKUM KIMIA DASAR I KECEPATAN REAKSI Kelompok V : Amir Hamzah 1415005 Umi Kulsum 1415018 AKADEMI KIMIA ANALISIS CARAKA NUSANTARA CIMANGGIS, KELAPA DUA DEPOK, 2015 BAB 1 PENDAHULUAN 1.1 Latar Belakang
PRAKTIKUM KIMIA DASAR I KECEPATAN REAKSI Kelompok V : Amir Hamzah 1415005 Umi Kulsum 1415018 AKADEMI KIMIA ANALISIS CARAKA NUSANTARA CIMANGGIS, KELAPA DUA DEPOK, 2015 BAB 1 PENDAHULUAN 1.1 Latar Belakang
PETA KONSEP LAJU REAKSI. Percobaan. Waktu perubahan. Hasil reaksi. Pereaksi. Katalis. Suhu pereaksi. Konsentrasi. Luas. permukaan.
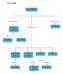 PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
SOAL LAJU REAKSI. Mol CaCO 3 = = 0.25 mol = 25. m Mr
 SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI
 3 LAJU REAKSI A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI Materi dapat berubah dari bentuk yang satu ke bentuk yang
3 LAJU REAKSI A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI Materi dapat berubah dari bentuk yang satu ke bentuk yang
BAB VI KINETIKA REAKSI KIMIA
 BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
Kunci jawaban dan pembahasan soal laju reaksi
 Kunci jawaban dan pembahasan soal laju reaksi Soal nomor 1 Mencari volume yang dibutuhkan pada proses pengenceran. Rumus pengenceran V 1. M 1 = V 2. M 2 Misal volume yang dibutuhkan sebanyak x ml, maka
Kunci jawaban dan pembahasan soal laju reaksi Soal nomor 1 Mencari volume yang dibutuhkan pada proses pengenceran. Rumus pengenceran V 1. M 1 = V 2. M 2 Misal volume yang dibutuhkan sebanyak x ml, maka
Laporan Praktikum Kimia Laju Reaksi
 Laporan Praktikum Kimia Laju Reaksi Oleh: 1. Kurniawan Eka Yuda (5) 2. Tri Puji Lestari (23) 3. Rina Puspitasari (17) 4. Elva Alvivah Almas (11) 5. Rusti Nur Anggraeni (35) 6. Eki Aisyah (29) Kelas XI
Laporan Praktikum Kimia Laju Reaksi Oleh: 1. Kurniawan Eka Yuda (5) 2. Tri Puji Lestari (23) 3. Rina Puspitasari (17) 4. Elva Alvivah Almas (11) 5. Rusti Nur Anggraeni (35) 6. Eki Aisyah (29) Kelas XI
BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN
 BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN STANDAR KOMPETENSI 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan
BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN STANDAR KOMPETENSI 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan
c. Suhu atau Temperatur
 Pada laju reaksi terdapat faktor-faktor yang dapat mempengaruhi laju reaksi. Selain bergantung pada jenis zat yang beraksi laju reaksi dipengaruhi oleh : a. Konsentrasi Pereaksi Pada umumnya jika konsentrasi
Pada laju reaksi terdapat faktor-faktor yang dapat mempengaruhi laju reaksi. Selain bergantung pada jenis zat yang beraksi laju reaksi dipengaruhi oleh : a. Konsentrasi Pereaksi Pada umumnya jika konsentrasi
Faktor-faktor yang Mempengaruhi Laju Reaksi
 Faktor-faktor yang Mempengaruhi Laju Reaksi Faktor yang mempengaruhi laju reaksi adalah sebagai berikut. Konsentrasi Jika konsentrasi suatu larutan makin besar, larutan akan mengandung jumlah partikel
Faktor-faktor yang Mempengaruhi Laju Reaksi Faktor yang mempengaruhi laju reaksi adalah sebagai berikut. Konsentrasi Jika konsentrasi suatu larutan makin besar, larutan akan mengandung jumlah partikel
wanibesak.wordpress.com
 1. Diberikan beberapa pernyataan 1) katalis dapat mempercepat laju reaksi dengan cara menaikan energi aktivasi 2) tahap penentu laju reaksi adalah tahap reaksi yang berlangsung paling lambat 3) laju reaksi
1. Diberikan beberapa pernyataan 1) katalis dapat mempercepat laju reaksi dengan cara menaikan energi aktivasi 2) tahap penentu laju reaksi adalah tahap reaksi yang berlangsung paling lambat 3) laju reaksi
Laju Reaksi KIM 2 A. KEMOLARAN B. LAJU REAKSI C. UNGKAPAN LAJU REAKSI LAJU REAKSI. materi78.co.nr
 Laju eaksi A. KEMOLAAN Dalam laju reaksi, besaran yang digunakan adalah kemolaran benda. Kemolaran menyatakan jumlah mol zat terlarut dari tiap liter larutan atau gas, menunjukkan kekentalan atau kepekatan.
Laju eaksi A. KEMOLAAN Dalam laju reaksi, besaran yang digunakan adalah kemolaran benda. Kemolaran menyatakan jumlah mol zat terlarut dari tiap liter larutan atau gas, menunjukkan kekentalan atau kepekatan.
kimia LAJU REAKSI 1 TUJUAN PEMBELAJARAN
 KTSP & K-13 kimia K e l a s XI LAJU REAKSI 1 TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konsep molaritas. 2. Memahami definisi dan faktor-faktor
KTSP & K-13 kimia K e l a s XI LAJU REAKSI 1 TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konsep molaritas. 2. Memahami definisi dan faktor-faktor
Laboratorium Kimia SMA... Praktikum II Kelas XI IPA Semester I Tahun Pelajaran.../...
 Laboratorium Kimia SMA... Praktikum II Kelas XI IPA Semester I Tahun Pelajaran.../... Judul : Faktor-Faktor yang Mempengaruhi Laju Reaksi Praktikan : mor Absen : Kelas : Tanggal : Lembar Kegiatan Siswa
Laboratorium Kimia SMA... Praktikum II Kelas XI IPA Semester I Tahun Pelajaran.../... Judul : Faktor-Faktor yang Mempengaruhi Laju Reaksi Praktikan : mor Absen : Kelas : Tanggal : Lembar Kegiatan Siswa
tanya-tanya.com Soal No.2 Apabila anda diminta untuk mengukur laju reaksi terhadap reaksi : Zn(s) + 2HCI(aq)
 Soal No.1 Apa yang di maksud dengan laju reaksi dan satuan dari laju reaksi? Laju reaksi dinyatakan sebagai berkurangnya jumlah pereaksi untuk setiap satuan waktu atau bertambahnya jumlah hasil reaksi
Soal No.1 Apa yang di maksud dengan laju reaksi dan satuan dari laju reaksi? Laju reaksi dinyatakan sebagai berkurangnya jumlah pereaksi untuk setiap satuan waktu atau bertambahnya jumlah hasil reaksi
LAPORAN PRAKTIKUM KIMIA DASAR
 LAPORAN PRAKTIKUM KIMIA DASAR KECEPATAN REAKSI Disusun Oleh : 1. Achmad Zaimul Khaqqi (132500030) 2. Dinda Kharisma Asmara (132500014) 3. Icha Restu Maulidiah (132500033) 4. Jauharatul Lailiyah (132500053)
LAPORAN PRAKTIKUM KIMIA DASAR KECEPATAN REAKSI Disusun Oleh : 1. Achmad Zaimul Khaqqi (132500030) 2. Dinda Kharisma Asmara (132500014) 3. Icha Restu Maulidiah (132500033) 4. Jauharatul Lailiyah (132500053)
RENCANA PELAKSANAAN PEMBELAJARAN (RPP) KELAS EKSPERIMEN PERTEMUAN KE-1
 RENCANA PELAKSANAAN PEMBELAJARAN (RPP) KELAS EKSPERIMEN PERTEMUAN KE-1 Sekolah : SMAN 3 Tangerang Selatan Mata Pelajaran : Kimia Kelas/ Semester : XI/ I Tahun Pelajaran : 010/011 Pokok Bahasan : Laju Reaksi
RENCANA PELAKSANAAN PEMBELAJARAN (RPP) KELAS EKSPERIMEN PERTEMUAN KE-1 Sekolah : SMAN 3 Tangerang Selatan Mata Pelajaran : Kimia Kelas/ Semester : XI/ I Tahun Pelajaran : 010/011 Pokok Bahasan : Laju Reaksi
OAL TES SEMESTER I. I. Pilihlah jawaban yang paling tepat! a. 2d d. 3p b. 2p e. 3s c. 3d 6. Unsur X dengan nomor atom
 KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
Laju reaksi menunjukkan perubahan konsentrasi pereaksi atau hasil reaksi persatuan waktu.
 Bab IV Laju Reaksi Sumber: Ebbing, General Chemistry Laju reaksi menunjukkan perubahan konsentrasi pereaksi atau hasil reaksi persatuan waktu. TUJUAN PEMBELAJARAN Setelah mengikuti pembelajaran siswa dapat
Bab IV Laju Reaksi Sumber: Ebbing, General Chemistry Laju reaksi menunjukkan perubahan konsentrasi pereaksi atau hasil reaksi persatuan waktu. TUJUAN PEMBELAJARAN Setelah mengikuti pembelajaran siswa dapat
BAB II KAJIAN PUSTAKA. kemampuan adalah karakteristik yang menonjol dari seorang individu yang
 BAB II KAJIAN PUSTAKA 2.1 Defenisi Kemampuan Kemampuan sama dengan kata kesanggupan atau kecakapan. Dengan bahasa yang lebih terperinci, kemampuan dapat diartikan sebagai kesanggupan individu untuk melakukan
BAB II KAJIAN PUSTAKA 2.1 Defenisi Kemampuan Kemampuan sama dengan kata kesanggupan atau kecakapan. Dengan bahasa yang lebih terperinci, kemampuan dapat diartikan sebagai kesanggupan individu untuk melakukan
yang berkaitan dengan Laju Reaksi, diberikan pada tabel berikut ini.
 BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Hasil Penelitian Berdasarkan hasil pengumpulan data, persentase siswa SMA Negeri 1 Paguyaman, Kabupaten Boalemo yang memberikan jawaban untuk tiap item tes yang
BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Hasil Penelitian Berdasarkan hasil pengumpulan data, persentase siswa SMA Negeri 1 Paguyaman, Kabupaten Boalemo yang memberikan jawaban untuk tiap item tes yang
LEMBAR KERJA SISWA 4
 88 LEMBAR KERJA SISWA 4 Mata Pelajaran Kelas/Semester Materi Pokok Submateri Pokok Alokasi Waktu : Kimia : I/ganjil : Laju Reaksi : Teori Tumbukan : 2 x 45 menit Standar Kompetensi Memahami Kinetika Reaksi,
88 LEMBAR KERJA SISWA 4 Mata Pelajaran Kelas/Semester Materi Pokok Submateri Pokok Alokasi Waktu : Kimia : I/ganjil : Laju Reaksi : Teori Tumbukan : 2 x 45 menit Standar Kompetensi Memahami Kinetika Reaksi,
1. Ciri-Ciri Reaksi Kimia
 Apakah yang dimaksud dengan reaksi kimia? Reaksi kimia adalah peristiwa perubahan kimia dari zat-zat yang bereaksi (reaktan) menjadi zat-zat hasil reaksi (produk). Pada reaksi kimia selalu dihasilkan zat-zat
Apakah yang dimaksud dengan reaksi kimia? Reaksi kimia adalah peristiwa perubahan kimia dari zat-zat yang bereaksi (reaktan) menjadi zat-zat hasil reaksi (produk). Pada reaksi kimia selalu dihasilkan zat-zat
BAB I PENDAHULUAN. A. Latar Belakang
 BAB I PENDAHULUAN A. Latar Belakang Reaksi kimia berlangsung dengan kecepatan yang berbeda-beda. Meledaknya petasan, adalah contoh reaksi yang berlangsung dalam waktu singkat. Proses perkaratan besi, pematangan
BAB I PENDAHULUAN A. Latar Belakang Reaksi kimia berlangsung dengan kecepatan yang berbeda-beda. Meledaknya petasan, adalah contoh reaksi yang berlangsung dalam waktu singkat. Proses perkaratan besi, pematangan
MODUL I Pembuatan Larutan
 MODUL I Pembuatan Larutan I. Tujuan percobaan - Membuat larutan dengan metode pelarutan padatan. - Melakukan pengenceran larutan dengan konsentrasi tinggi untuk mendapatkan larutan yang diperlukan dengan
MODUL I Pembuatan Larutan I. Tujuan percobaan - Membuat larutan dengan metode pelarutan padatan. - Melakukan pengenceran larutan dengan konsentrasi tinggi untuk mendapatkan larutan yang diperlukan dengan
KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN
 KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN 1. Suatu reaksi dikatakan mencapai kesetimbangan apabila. A. laju reaksi ke kiri sama dengan ke kanan B. jumlah koefisien reaksi ruas kiri sama dengan ruas kanan
KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN 1. Suatu reaksi dikatakan mencapai kesetimbangan apabila. A. laju reaksi ke kiri sama dengan ke kanan B. jumlah koefisien reaksi ruas kiri sama dengan ruas kanan
LEMBAR KERJA SISWA 2
 76 LEMBAR KERJA SISWA 2 Mata Pelajaran Kelas / Semester Materi pokok Submateri pokok Alokasi Waktu : Kimia : XI/ganjil : Laju Reaksi : Konsep Laju Reaksi : 2 x 45 menit Standar Kompetensi 3. Memahami Kinetika
76 LEMBAR KERJA SISWA 2 Mata Pelajaran Kelas / Semester Materi pokok Submateri pokok Alokasi Waktu : Kimia : XI/ganjil : Laju Reaksi : Konsep Laju Reaksi : 2 x 45 menit Standar Kompetensi 3. Memahami Kinetika
Soal-Soal. Bab 4. Latihan. Laju Reaksi. 1. Madu dengan massa jenis 1,4 gram/ cm 3 mengandung glukosa (M r. 5. Diketahui reaksi:
 Bab Laju Reaksi Soal-Soal Latihan. Madu dengan massa jenis, gram/ cm 3 mengandung glukosa (M r = 80) sebanyak 35 % b/b. Kemolaran glukosa dalam madu adalah... 0,8 M (D),7 M,8 M (E) 3,0 M, M. Untuk membuat
Bab Laju Reaksi Soal-Soal Latihan. Madu dengan massa jenis, gram/ cm 3 mengandung glukosa (M r = 80) sebanyak 35 % b/b. Kemolaran glukosa dalam madu adalah... 0,8 M (D),7 M,8 M (E) 3,0 M, M. Untuk membuat
RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 2 JP
 RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 2 JP Standar Kompetensi 1. Memahami kinetika reaksi dan kesetimbangan kimia
RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 2 JP Standar Kompetensi 1. Memahami kinetika reaksi dan kesetimbangan kimia
Laju Reaksi. Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I
 Laju Reaksi Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi,
Laju Reaksi Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi,
SOAL KIMIA 2 KELAS : XI IPA
 SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
Bab 10 Kinetika Kimia
 D e p a r t e m e n K i m i a F M I P A I P B Bab 0 Kinetika Kimia http://chem.fmipa.ipb.ac.id Ikhtisar 2 3 Laju Reaksi Teori dalam Kinetika Kimia 4 Mekanisme Reaksi 5 46 Faktor Penentu Laju Reaksi Enzim
D e p a r t e m e n K i m i a F M I P A I P B Bab 0 Kinetika Kimia http://chem.fmipa.ipb.ac.id Ikhtisar 2 3 Laju Reaksi Teori dalam Kinetika Kimia 4 Mekanisme Reaksi 5 46 Faktor Penentu Laju Reaksi Enzim
Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Chapter 8 Kinetika Kimia Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Chapter 8 Kinetika Kimia Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
Kesetimbangan Kimia. Bab 4
 Kesetimbangan Kimia Bab 4 Standar Kompetensi 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang memengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri Kompetensi
Kesetimbangan Kimia Bab 4 Standar Kompetensi 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang memengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri Kompetensi
BAB IV HASIL PENELITIAN DAN PEMBAHASAN. Paguyaman yang berhubungan dengan materi laju reaksi diberikan dalam Tabel 2 berikut.
 BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Hasil Penelitian Dari hasil penelitian diperoleh presentase jawaban siswa kelas XI SMA Negeri 1 Paguyaman yang berhubungan dengan materi laju reaksi diberikan
BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Hasil Penelitian Dari hasil penelitian diperoleh presentase jawaban siswa kelas XI SMA Negeri 1 Paguyaman yang berhubungan dengan materi laju reaksi diberikan
JURNAL PRAKTIKUM KIMIA LAJU REAKSI 24 MARET 2014
 JURNAL PRAKTIKUM KIMIA LAJU REAKSI 24 MARET 204 Oleh MIRRAH AGHNIA NAFILAH F (306200055) FITRIA KUSUMA WARDHANI (306200060) INTAN MUTHIAH AFIFAH (30620006) NUR AZIZAH APRIANI (306200064) PROGRAM STUDI
JURNAL PRAKTIKUM KIMIA LAJU REAKSI 24 MARET 204 Oleh MIRRAH AGHNIA NAFILAH F (306200055) FITRIA KUSUMA WARDHANI (306200060) INTAN MUTHIAH AFIFAH (30620006) NUR AZIZAH APRIANI (306200064) PROGRAM STUDI
Kode KIM.10. Laju Reaksi
 Kode KIM.10 Laju Reaksi BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN NASIONAL 2004 BAB I. PENDAHULUAN
Kode KIM.10 Laju Reaksi BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN NASIONAL 2004 BAB I. PENDAHULUAN
LEMBAR KERJA SISWA 3
 82 LEMBAR KERJA SISWA 3 Mata Pelajaran Kelas/Semester Materi Pokok Sub Materi Pokok Alokasi Waktu : Kimia : XI IPA 3/Ganjil : Laju Reaksi : Faktor-faktor yang mempengaruhi laju reaksi : 2 45 menit Standar
82 LEMBAR KERJA SISWA 3 Mata Pelajaran Kelas/Semester Materi Pokok Sub Materi Pokok Alokasi Waktu : Kimia : XI IPA 3/Ganjil : Laju Reaksi : Faktor-faktor yang mempengaruhi laju reaksi : 2 45 menit Standar
MENYARING DAN MENDEKANTASI
 MENYARING DAN MENDEKANTASI MENYARING - Menyaring adalah suatu proses dimana partikelpartikel dipisahkan dari cairan dengan melewatkan cairan melalui bahan permeabel (kertas saring,dll). - Endapan : suatu
MENYARING DAN MENDEKANTASI MENYARING - Menyaring adalah suatu proses dimana partikelpartikel dipisahkan dari cairan dengan melewatkan cairan melalui bahan permeabel (kertas saring,dll). - Endapan : suatu
Purwanti Widhy H, M.Pd. Laju Reaksi
 Purwanti Widhy H, M.Pd Laju Reaksi SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi, Kompetensi Dasar & Indikator
Purwanti Widhy H, M.Pd Laju Reaksi SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi, Kompetensi Dasar & Indikator
BAB III KESETIMBANGAN KIMIA. AH = 92 kj
 BAB III KESETIMBANGAN KIMIA Amonia (NH 3 ) merupakan salah satu zat kimia yang paling banyak diproduksi. Amonia digunakan terutama untuk membuat pupuk, yaitu urea dan ZA. Penggunaan amonia yang lain, yaitu
BAB III KESETIMBANGAN KIMIA Amonia (NH 3 ) merupakan salah satu zat kimia yang paling banyak diproduksi. Amonia digunakan terutama untuk membuat pupuk, yaitu urea dan ZA. Penggunaan amonia yang lain, yaitu
kimia KESETIMBANGAN KIMIA 2 Tujuan Pembelajaran
 KTSP & K-13 kimia K e l a s XI KESETIMBANGAN KIMIA 2 Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami faktor-faktor yang memengaruhi kesetimbangan.
KTSP & K-13 kimia K e l a s XI KESETIMBANGAN KIMIA 2 Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami faktor-faktor yang memengaruhi kesetimbangan.
LAJU REAKSI MEKANISME REAKSI
 KINETIKA KIMIA LAJU REAKSI BAGAIMANA PERUB. KIMIA TSB BERLANGSUNG - BESI MUDAH BERKARAT PD UDARA YANG LEMBAB - MAKANAN LEBIH CEPAT BUSUK BILA TIDAK DIINGINKAN MEKANISME REAKSI - PENJUMLAHAN TAHAP TAHAP
KINETIKA KIMIA LAJU REAKSI BAGAIMANA PERUB. KIMIA TSB BERLANGSUNG - BESI MUDAH BERKARAT PD UDARA YANG LEMBAB - MAKANAN LEBIH CEPAT BUSUK BILA TIDAK DIINGINKAN MEKANISME REAKSI - PENJUMLAHAN TAHAP TAHAP
LEMBARAN SOAL 5. Pilih satu jawaban yang benar!
 LEMBARAN SOAL 5 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
LEMBARAN SOAL 5 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
KEMOLARAN. M = n/v. M = g/mr x 1000/V
 KEMOLARAN Kemolaran atau molaritas menyatakan konsentrasi dari suatu larutan yang menggambarkan jumlah mol zat terlarut dalam setiap liter larutan.kemolaran berkaitan dengan jumlah mol dan volume larutan.hubungan
KEMOLARAN Kemolaran atau molaritas menyatakan konsentrasi dari suatu larutan yang menggambarkan jumlah mol zat terlarut dalam setiap liter larutan.kemolaran berkaitan dengan jumlah mol dan volume larutan.hubungan
BAB 9. KINETIKA KIMIA
 BAB 9 BAB 9. KINETIKA KIMIA 9.1 TEORI TUMBUKAN DARI LAJU REAKSI 9.2 TEORI KEADAAN TRANSISI DARI LAJU REAKSI 9.3 HUKUM LAJU REAKSI 9.4 FAKTOR-FAKTOR LAJU REAKSI 9.5 MEKANISME REAKSI 9.6 ENZIM SEBAGAI KATALIS
BAB 9 BAB 9. KINETIKA KIMIA 9.1 TEORI TUMBUKAN DARI LAJU REAKSI 9.2 TEORI KEADAAN TRANSISI DARI LAJU REAKSI 9.3 HUKUM LAJU REAKSI 9.4 FAKTOR-FAKTOR LAJU REAKSI 9.5 MEKANISME REAKSI 9.6 ENZIM SEBAGAI KATALIS
MODUL 1 TERMOKIMIA. A. Hukum Pertama Termodinamika. B. Kalor Reaksi
 MODUL 1 TERMOKIMIA Termokimia adalah ilmu yang mempelajari hubungan antara energi panas dan energi kimia. Sebagai prasyarat untuk mempelajari termokimia, kita harus mengetahui tentang perbedaan kalor (Q)
MODUL 1 TERMOKIMIA Termokimia adalah ilmu yang mempelajari hubungan antara energi panas dan energi kimia. Sebagai prasyarat untuk mempelajari termokimia, kita harus mengetahui tentang perbedaan kalor (Q)
Antiremed Kelas 11 Kimia
 Antiremed Kelas 11 Kimia Persiapan UAS 1 Kimia Doc. Name: AR11KIM01UAS Version: 016-08 halaman 1 01. Salah satu teori yang menjadi dasar sehingga tercipta model atom modern (A) Rutherford, Niels Bohr,
Antiremed Kelas 11 Kimia Persiapan UAS 1 Kimia Doc. Name: AR11KIM01UAS Version: 016-08 halaman 1 01. Salah satu teori yang menjadi dasar sehingga tercipta model atom modern (A) Rutherford, Niels Bohr,
Hukum Dasar Kimia Dan Konsep Mol
 A. PENDAHULUAN Hukum Dasar Kimia Dan Konsep Mol Hukum dasar kimia merupakan hukum dasar yang digunakan dalam stoikiometri (perhitungan kimia), antara lain: 1) Hukum Lavoisier atau hukum kekekalan massa.
A. PENDAHULUAN Hukum Dasar Kimia Dan Konsep Mol Hukum dasar kimia merupakan hukum dasar yang digunakan dalam stoikiometri (perhitungan kimia), antara lain: 1) Hukum Lavoisier atau hukum kekekalan massa.
Metodologi Penelitian
 16 Bab III Metodologi Penelitian Penelitian dilakukan dengan menggunakan metode titrasi redoks dengan menggunakan beberapa oksidator (K 2 Cr 2 O 7, KMnO 4 dan KBrO 3 ) dengan konsentrasi masing-masing
16 Bab III Metodologi Penelitian Penelitian dilakukan dengan menggunakan metode titrasi redoks dengan menggunakan beberapa oksidator (K 2 Cr 2 O 7, KMnO 4 dan KBrO 3 ) dengan konsentrasi masing-masing
II. KOMPETENSI DASAR 3.1 Mendeskripsikan pengertian laju reaksi dengan melakukan percobaan tentang faktor-faktor yang mempengaruhi laju reaksi.
 RENCANA PELAKSANAAN PEMBELAJARAN (RPP) LAJU REAKSI SEKOLAH : SMAN 6 SURABAYA MATA PELAJARAN : KIMIA KELAS / SEMESTER : XI / (satu) PERTEMUAN KE : 3 ALOKASI WAKTU : 6 Jam Pelajaran I. STANDAR KOMPETENSI
RENCANA PELAKSANAAN PEMBELAJARAN (RPP) LAJU REAKSI SEKOLAH : SMAN 6 SURABAYA MATA PELAJARAN : KIMIA KELAS / SEMESTER : XI / (satu) PERTEMUAN KE : 3 ALOKASI WAKTU : 6 Jam Pelajaran I. STANDAR KOMPETENSI
Kesetimbangan Kimia KIM 2 A. PENDAHULUAN B. REAKSI KESETIMBANGAN. α = KESETIMBANGAN KIMIA. materi78.co.nr. setimbang
 konsentrasi laju reaksi materi78.co.nr Kesetimbangan Kimia A. PENDAHULUAN Reaksi satu arah (irreversible) atau reaksi tidak dapat balik adalah reaksi yang terjadi pada satu arah, dan produknya tidak dapat
konsentrasi laju reaksi materi78.co.nr Kesetimbangan Kimia A. PENDAHULUAN Reaksi satu arah (irreversible) atau reaksi tidak dapat balik adalah reaksi yang terjadi pada satu arah, dan produknya tidak dapat
K13 Revisi Antiremed Kelas 10 Kimia
 K13 Revisi Antiremed Kelas 10 Kimia Hukum Dasar Perhitungan Kimia - Latihan Soal Doc. Name: RK13AR10KIM0801 Version : 2016-11 halaman 1 01. Pernyataan yang paling sesuai tentang hukum Lavoisier (A) Jumlah
K13 Revisi Antiremed Kelas 10 Kimia Hukum Dasar Perhitungan Kimia - Latihan Soal Doc. Name: RK13AR10KIM0801 Version : 2016-11 halaman 1 01. Pernyataan yang paling sesuai tentang hukum Lavoisier (A) Jumlah
Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan
 KINETIKA Pendahuluan Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan Namun persamaan reaksi tidak dapat menjawab :. Seberapa cepat reaksi berlangsung 2. Bagaimana
KINETIKA Pendahuluan Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan Namun persamaan reaksi tidak dapat menjawab :. Seberapa cepat reaksi berlangsung 2. Bagaimana
Wardaya College IKATAN KIMIA STOIKIOMETRI TERMOKIMIA CHEMISTRY. Part III. Summer Olympiad Camp Kimia SMA
 Part I IKATAN KIMIA CHEMISTRY Summer Olympiad Camp 2017 - Kimia SMA 1. Untuk menggambarkan ikatan yang terjadi dalam suatu molekul kita menggunakan struktur Lewis atau 'dot and cross' (a) Tuliskan formula
Part I IKATAN KIMIA CHEMISTRY Summer Olympiad Camp 2017 - Kimia SMA 1. Untuk menggambarkan ikatan yang terjadi dalam suatu molekul kita menggunakan struktur Lewis atau 'dot and cross' (a) Tuliskan formula
Hubungan koefisien dalam persamaan reaksi dengan hitungan
 STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
Gambar 2.1 Reaksi Saponifikasi tripalmitin
 I. JUDUL : Kinetika Reaksi Saponifikasi Etil Asetat II. TANGGAL PERCOBAAN : Rabu, 16 November 2011 III. TUJUAN : 1. Untuk memberikan gambaran bahwa reaksi penyabunan etil asetat oleh ion hidroksida adalah
I. JUDUL : Kinetika Reaksi Saponifikasi Etil Asetat II. TANGGAL PERCOBAAN : Rabu, 16 November 2011 III. TUJUAN : 1. Untuk memberikan gambaran bahwa reaksi penyabunan etil asetat oleh ion hidroksida adalah
A. ARTI KESETIMBANGAN B. FAKTOR-FAKTOR YANG MEMPENGARUHI PERGESERAN KESETIMBANGAN C. TETAPAN KESETIMBANGAN D. KESETIMBANGAN KIMIA DALAM INDUSTRI
 4 KESETIMBANGAN KIMIA A. ARTI KESETIMBANGAN B. FAKTOR-FAKTOR YANG MEMPENGARUHI PERGESERAN KESETIMBANGAN C. TETAPAN KESETIMBANGAN D. KESETIMBANGAN KIMIA DALAM INDUSTRI Dalam kehidupan sehari-hari, sering
4 KESETIMBANGAN KIMIA A. ARTI KESETIMBANGAN B. FAKTOR-FAKTOR YANG MEMPENGARUHI PERGESERAN KESETIMBANGAN C. TETAPAN KESETIMBANGAN D. KESETIMBANGAN KIMIA DALAM INDUSTRI Dalam kehidupan sehari-hari, sering
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya.
 30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
BAB 1 PENDAHULUAN. energi, menyusun bahan makanan, merombak bahan makanan, memasukkan atau
 BAB 1 PENDAHULUAN 1. LATAR BELAKANG Metabolisme merupakan suatau reaksi kimia yang terjadi didalam tubuh makhluk hidup. Reaksi metabolisme tersebut dimaksudkan untuk memperoleh energi, menyimpan energi,
BAB 1 PENDAHULUAN 1. LATAR BELAKANG Metabolisme merupakan suatau reaksi kimia yang terjadi didalam tubuh makhluk hidup. Reaksi metabolisme tersebut dimaksudkan untuk memperoleh energi, menyimpan energi,
MODUL LAJU REAKSI. Laju reaksi _ 2013 Page 1
 MODUL LAJU REAKSI Standar Kompetensi ( SK ) : Memahami kinetika reaksi, kesetimbangan kimia dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri. Kompetensi
MODUL LAJU REAKSI Standar Kompetensi ( SK ) : Memahami kinetika reaksi, kesetimbangan kimia dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri. Kompetensi
Butadiena, HCN Senyawa Ni/ P Adiponitril Nilon( Serat, plastik) α Olefin, senyawa Rh/ P Aldehid Plasticizer, peluas
 Katalis adalah suatu zat yang ditambahkan pada sistem reaksi untuk meningkatkan laju reaksi tanpa ikut berubah secara kimia pada akhir reaksi. Dan menurut Oswald (1902) mendefinisikan katalis sebagai suatu
Katalis adalah suatu zat yang ditambahkan pada sistem reaksi untuk meningkatkan laju reaksi tanpa ikut berubah secara kimia pada akhir reaksi. Dan menurut Oswald (1902) mendefinisikan katalis sebagai suatu
Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka
 Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka waktu reaksi berlangsung pada suhu 90 o C Susu dipasteurisasi
Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka waktu reaksi berlangsung pada suhu 90 o C Susu dipasteurisasi
STOKIOMETRI BAB. B. Konsep Mol 1. Hubungan Mol dengan Jumlah Partikel. Contoh: Jika Ar Ca = 40, Ar O = 16, Ar H = 1, tentukan Mr Ca(OH) 2!
 BAB 7 STOKIOMETRI A. Massa Molekul Relatif Massa Molekul Relatif (Mr) biasanya dihitung menggunakan data Ar masing-masing atom yang ada dalam molekul tersebut. Mr senyawa = (indeks atom x Ar atom) Contoh:
BAB 7 STOKIOMETRI A. Massa Molekul Relatif Massa Molekul Relatif (Mr) biasanya dihitung menggunakan data Ar masing-masing atom yang ada dalam molekul tersebut. Mr senyawa = (indeks atom x Ar atom) Contoh:
1. Perhatikan struktur senyawa berikut!
 . Perhatikan struktur senyawa berikut! CH CH CH CH CH CH CH Jumlah atom C primer, atom C sekunder, dan atom C tersier dari senyawa di atas adalah...,, dan D.,, dan,, dan E.,, dan,, dan. Di bawah ini merupakan
. Perhatikan struktur senyawa berikut! CH CH CH CH CH CH CH Jumlah atom C primer, atom C sekunder, dan atom C tersier dari senyawa di atas adalah...,, dan D.,, dan,, dan E.,, dan,, dan. Di bawah ini merupakan
A. KESEIMBANGAN DINAMIS
 1 Tugas Kimia IV Prakerin KESEIMBANGAN KIMIA Coba kamu perhatikan proses pendidihan air dengan panci tertutup. Pada waktu air menguap, uap air akan tertahan dalam tutup panci. Selanjutnya, uap air akan
1 Tugas Kimia IV Prakerin KESEIMBANGAN KIMIA Coba kamu perhatikan proses pendidihan air dengan panci tertutup. Pada waktu air menguap, uap air akan tertahan dalam tutup panci. Selanjutnya, uap air akan
LOGO. Stoikiometri. Tim Dosen Pengampu MK. Kimia Dasar
 LOGO Stoikiometri Tim Dosen Pengampu MK. Kimia Dasar Konsep Mol Satuan jumlah zat dalam ilmu kimia disebut mol. 1 mol zat mengandung jumlah partikel yang sama dengan jumlah partikel dalam 12 gram C 12,
LOGO Stoikiometri Tim Dosen Pengampu MK. Kimia Dasar Konsep Mol Satuan jumlah zat dalam ilmu kimia disebut mol. 1 mol zat mengandung jumlah partikel yang sama dengan jumlah partikel dalam 12 gram C 12,
Soal Soal Kesetimbangan Kimia. Proses Haber-Bosch merupakan proses pembentukan atau produksi ammonia berdasarkan reaksi:
 Nama : Fitria Puspita NIM : 1201760 Kelas : Pendidikan Kimia A Soal Soal Kesetimbangan Kimia SBMPTN 2014 Untuk soal no 1-3, bacalah narasi berikut. Proses Haber-Bosch merupakan proses pembentukan atau
Nama : Fitria Puspita NIM : 1201760 Kelas : Pendidikan Kimia A Soal Soal Kesetimbangan Kimia SBMPTN 2014 Untuk soal no 1-3, bacalah narasi berikut. Proses Haber-Bosch merupakan proses pembentukan atau
HALAMAN PENGESAHAN LAPORAN RESMI PRAKTIKUM KIMIA DASAR. :4. Pengaruh Konsentrasi dan Suhu Pada Laju Reaksi. 6. John Peterson Serius
 HALAMAN PENGESAHAN LAPORAN RESMI PRAKTIKUM KIMIA DASAR Nama Percobaan :4. Pengaruh Konsentrasi dan Suhu Pada Laju Reaksi Kelompok :12 (Dua Belas) Nama :1 Muhammad Dary Dzaky (1404015185) 2. Ina Subiyanti
HALAMAN PENGESAHAN LAPORAN RESMI PRAKTIKUM KIMIA DASAR Nama Percobaan :4. Pengaruh Konsentrasi dan Suhu Pada Laju Reaksi Kelompok :12 (Dua Belas) Nama :1 Muhammad Dary Dzaky (1404015185) 2. Ina Subiyanti
10 mlhcl2 M. 10 ml HCl2 M. Na 2 S 2 O 3 0,2 M KIM/ IND- II
 10 mlhcl2 M 10 ml HCl2 M 10 mlhcl2 M Na 2 S 2 O 3 0,2 M Na 2 S 2 O 3 0,2 M Na 2 S 2 O 3 0,2 M KIM/ IND- II BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL
10 mlhcl2 M 10 ml HCl2 M 10 mlhcl2 M Na 2 S 2 O 3 0,2 M Na 2 S 2 O 3 0,2 M Na 2 S 2 O 3 0,2 M KIM/ IND- II BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL
MODUL III KESETIMBANGAN KIMIA
 MODUL III KESETIMBANGAN KIMIA I. Petunjuk Umum 1. Kompetensi Dasar 1) Mahasiswa memahami Asas Le Chatelier 2) Mahasiswa mampu menjelaskan aplikasi reaksi kesetimbangan dalam dunia industry 3) Mahasiswa
MODUL III KESETIMBANGAN KIMIA I. Petunjuk Umum 1. Kompetensi Dasar 1) Mahasiswa memahami Asas Le Chatelier 2) Mahasiswa mampu menjelaskan aplikasi reaksi kesetimbangan dalam dunia industry 3) Mahasiswa
MODUL KIMIA SMA IPA Kelas 10
 SMA IPA Kelas 0 A. Massa Atom. Massa Atom Relatif (Ar) Massa atom relatif (Ar) merupakan perbandingan massa atom dengan massa satu atom yang tetap. Secara matematis dapat dirumuskan sebagai berikut. sma
SMA IPA Kelas 0 A. Massa Atom. Massa Atom Relatif (Ar) Massa atom relatif (Ar) merupakan perbandingan massa atom dengan massa satu atom yang tetap. Secara matematis dapat dirumuskan sebagai berikut. sma
- Melakukan percobaan penentuan laju reaksi. - Mendiskusikan data-data percobaan laju reaksi dalam bentuk grafik untuk menentukan harga laju
 Silabus RPP SMK KLS 12 CONTOH SILABUS Nama Sekolah : SMK SEDC Mata Pelajaran : KIMIA Kelas/Semester : XII Standar Kompetensi : 11. Mengidentifikasi faktor-faktor yang mempengaruhi laju reaksi Alokasi Waktu
Silabus RPP SMK KLS 12 CONTOH SILABUS Nama Sekolah : SMK SEDC Mata Pelajaran : KIMIA Kelas/Semester : XII Standar Kompetensi : 11. Mengidentifikasi faktor-faktor yang mempengaruhi laju reaksi Alokasi Waktu
Stoikiometri. OLEH Lie Miah
 Stoikiometri OLEH Lie Miah 1 STANDAR KOMPETENSI KOMPETENSI DASAR INDIKATOR KARAKTERISTIK MATERI KESULITAN BELAJAR SISWA STANDAR KOMPETENSI Memahami hukum-hukum dasar Kimia dan penerapannya dalam perhitungan
Stoikiometri OLEH Lie Miah 1 STANDAR KOMPETENSI KOMPETENSI DASAR INDIKATOR KARAKTERISTIK MATERI KESULITAN BELAJAR SISWA STANDAR KOMPETENSI Memahami hukum-hukum dasar Kimia dan penerapannya dalam perhitungan
Siswa diingatkan tentang struktur atom, bilangan kuantum, bentuk-bentuk orbital, dan konfigurasi elektron
 RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
PENGARUH KATALISIS TERHADAP TETAPAN LAJU
 PENGARUH KATALISIS TERHADAP TETAPAN LAJU Laju reaksi sering dipengaruhi oleh adanya katalis Contoh : Hidrolisis sukrosa dalam air Suhu kamar lama (bisa beberapa bulan) Namun jika hidrolisis dilakukan dalam
PENGARUH KATALISIS TERHADAP TETAPAN LAJU Laju reaksi sering dipengaruhi oleh adanya katalis Contoh : Hidrolisis sukrosa dalam air Suhu kamar lama (bisa beberapa bulan) Namun jika hidrolisis dilakukan dalam
UJIAN NASIONAL TAHUN PELAJARAN 2007/2008
 UJIAN NASIONAL TAHUN PELAJARAN 2007/2008 PANDUAN MATERI SMA DAN MA K I M I A PROGRAM STUDI IPA PUSAT PENILAIAN PENDIDIKAN BALITBANG DEPDIKNAS KATA PENGANTAR Dalam rangka sosialisasi kebijakan dan persiapan
UJIAN NASIONAL TAHUN PELAJARAN 2007/2008 PANDUAN MATERI SMA DAN MA K I M I A PROGRAM STUDI IPA PUSAT PENILAIAN PENDIDIKAN BALITBANG DEPDIKNAS KATA PENGANTAR Dalam rangka sosialisasi kebijakan dan persiapan
PRAKTIKUM KIMIA DASAR I
 PRAKTIKUM KIMIA DASAR I REAKSI KIMIA PADA SIKLUS LOGAM TEMBAGA Oleh : Luh Putu Arisanti 1308105006 JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS UDAYANA BADUNG TAHUN 2013/2014
PRAKTIKUM KIMIA DASAR I REAKSI KIMIA PADA SIKLUS LOGAM TEMBAGA Oleh : Luh Putu Arisanti 1308105006 JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS UDAYANA BADUNG TAHUN 2013/2014
2. Analisis Kualitatif, Sintesis, Karakterisasi dan Uji Katalitik
 2. Analisis Kualitatif, Sintesis, Karakterisasi dan Uji Katalitik Modul 1: Reaksi-Reaksi Logam Transisi & Senyawanya TUJUAN (a) Mempelajari reaksi-reaksi logam transisi dan senyawanya, meliputi reaksi
2. Analisis Kualitatif, Sintesis, Karakterisasi dan Uji Katalitik Modul 1: Reaksi-Reaksi Logam Transisi & Senyawanya TUJUAN (a) Mempelajari reaksi-reaksi logam transisi dan senyawanya, meliputi reaksi
kecuali . kecuali . kecuali
 1. Berikut ini adalah ciri-ciri terjadinya reaksi kesetimbangan, kecuali. A. reaksi reversibel B. terjadi dalam ruang tertutup C. laju reaksi ke kiri sama dengan laju reaksi ke kanan D. reaksinya tidak
1. Berikut ini adalah ciri-ciri terjadinya reaksi kesetimbangan, kecuali. A. reaksi reversibel B. terjadi dalam ruang tertutup C. laju reaksi ke kiri sama dengan laju reaksi ke kanan D. reaksinya tidak
Sulistyani, M.Si.
 Sulistyani, M.Si. Email: sulistyani@uny.ac.id Laju reaksi adalah laju pengurangan reaktan tiap satuan waktu atau laju pembentukan produk tiap satuan waktu. Laju reaksi dipengaruhi oleh: sifat dan keadan
Sulistyani, M.Si. Email: sulistyani@uny.ac.id Laju reaksi adalah laju pengurangan reaktan tiap satuan waktu atau laju pembentukan produk tiap satuan waktu. Laju reaksi dipengaruhi oleh: sifat dan keadan
LAPORAN LENGKAP PRAKTIKUM ANORGANIK PERCOBAAN 1 TOPIK : SINTESIS DAN KARAKTERISTIK NATRIUM TIOSULFAT
 LAPORAN LENGKAP PRAKTIKUM ANORGANIK PERCOBAAN 1 TOPIK : SINTESIS DAN KARAKTERISTIK NATRIUM TIOSULFAT DI SUSUN OLEH : NAMA : IMENG NIM : ACC 109 011 KELOMPOK : 2 ( DUA ) HARI / TANGGAL : SABTU, 28 MEI 2011
LAPORAN LENGKAP PRAKTIKUM ANORGANIK PERCOBAAN 1 TOPIK : SINTESIS DAN KARAKTERISTIK NATRIUM TIOSULFAT DI SUSUN OLEH : NAMA : IMENG NIM : ACC 109 011 KELOMPOK : 2 ( DUA ) HARI / TANGGAL : SABTU, 28 MEI 2011
Katalis 1. Pengertian Katalis 2. Jenis Katalis a. Katalis Homogen
 Katalis 1. Pengertian Katalis Katalis merupakan suatu zat yang dapat mempercepat laju reaksi dalam reaksi kimia pada suhu tertentu, tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri. Suatu
Katalis 1. Pengertian Katalis Katalis merupakan suatu zat yang dapat mempercepat laju reaksi dalam reaksi kimia pada suhu tertentu, tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri. Suatu
HAND OUT KIMIA XI IPA BAB III LAJU REAKSI
 HAND OUT KIMIA XI IPA BAB III LAJU REAKSI 1 BAB III LAJU REAKSI I. Standarkompetensi Memahami Kinetika reaksi, kesetimbangan kimia dan factor-faktor yang mempengaruhinya serta penerapannya dalam kehidupan
HAND OUT KIMIA XI IPA BAB III LAJU REAKSI 1 BAB III LAJU REAKSI I. Standarkompetensi Memahami Kinetika reaksi, kesetimbangan kimia dan factor-faktor yang mempengaruhinya serta penerapannya dalam kehidupan
LAPORAN MINGGUAN PRAKTIKUM KIMIA DASAR REAKSI KIMIA. Oleh: : Nugraheni Wahyu Permatasari NRP :
 LAPORAN MINGGUAN PRAKTIKUM KIMIA DASAR REAKSI KIMIA Oleh: Nama : Nugraheni Wahyu Permatasari NRP : 133020112 Kelompok : E Meja : 4 (Empat) Tanggal Percobaan : 18 Oktober 2013 Asisten : Aldia Januaresti
LAPORAN MINGGUAN PRAKTIKUM KIMIA DASAR REAKSI KIMIA Oleh: Nama : Nugraheni Wahyu Permatasari NRP : 133020112 Kelompok : E Meja : 4 (Empat) Tanggal Percobaan : 18 Oktober 2013 Asisten : Aldia Januaresti
LAPORAN PRAKTIKUM DINAMIKA KIMIA JUDUL PERCOBAAN : PENENTUAN LAJU REAKSI IODINASI ASETON DALAM SUASANA ASAM. Nama : SantiNurAini NRP :
 LAPORAN PRAKTIKUM DINAMIKA KIMIA JUDUL PERCOBAAN : PENENTUAN LAJU REAKSI IODINASI ASETON DALAM SUASANA ASAM Nama : SantiNurAini NRP : 1413100048 Tanggal Praktikum : 28 April 2015 Nama Asisten : Mas Mattius
LAPORAN PRAKTIKUM DINAMIKA KIMIA JUDUL PERCOBAAN : PENENTUAN LAJU REAKSI IODINASI ASETON DALAM SUASANA ASAM Nama : SantiNurAini NRP : 1413100048 Tanggal Praktikum : 28 April 2015 Nama Asisten : Mas Mattius
I. Judul : Membandingkan Kenaikan Titik Didih Larutan Elektrolit dan Non-Elektrolit.
 I. Judul : Membandingkan Kenaikan Titik Didih Larutan Elektrolit dan Non-Elektrolit. II. Tujuan : Membandingkan Kenaikan Titik Didih Larutan Elektrolit dan Non-Elektrolit pada konsentrasi larutan yang
I. Judul : Membandingkan Kenaikan Titik Didih Larutan Elektrolit dan Non-Elektrolit. II. Tujuan : Membandingkan Kenaikan Titik Didih Larutan Elektrolit dan Non-Elektrolit pada konsentrasi larutan yang
Kekekalan Energi energi tidak dapat diciptakan maupun dimusnahkan
 Termokimia XI IPA CO 2, mineral, panas, cahaya Kekekalan Energi energi tidak dapat diciptakan maupun dimusnahkan Manusia Fotosintesis Sayuran dan Buah Entalpi energi / kalor yang terdapat dalam suatu materi.
Termokimia XI IPA CO 2, mineral, panas, cahaya Kekekalan Energi energi tidak dapat diciptakan maupun dimusnahkan Manusia Fotosintesis Sayuran dan Buah Entalpi energi / kalor yang terdapat dalam suatu materi.
STOIKIOMETRI. STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi zat-zat kimia dan reaksi-reaksinya.
 STOIKIOMETRI STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi zat-zat kimia dan reaksi-reaksinya. 1.HUKUM KEKEKALAN MASSA = HUKUM LAVOISIER "Massa zat-zat sebelum
STOIKIOMETRI STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi zat-zat kimia dan reaksi-reaksinya. 1.HUKUM KEKEKALAN MASSA = HUKUM LAVOISIER "Massa zat-zat sebelum
MODUL STOIKIOMETRI 1
 MODUL STOIKIOMETRI 1 1. Pengertian Mol Mol merupakan suatu satuan jumlah, yang berasal dari kata moles yang artinya sejumlah massa / sejumlah kecil massa, hampir sama dengan lusin. 1 mol = 6,02 X 10 23
MODUL STOIKIOMETRI 1 1. Pengertian Mol Mol merupakan suatu satuan jumlah, yang berasal dari kata moles yang artinya sejumlah massa / sejumlah kecil massa, hampir sama dengan lusin. 1 mol = 6,02 X 10 23
KONSEP MOL DAN STOIKIOMETRI
 BAB V KONSEP MOL DAN STOIKIOMETRI Dalam ilmu fisika, dikenal satuan mol untuk besaran jumlah zat. Dalam bab ini, akan dibahas mengenai konsep mol yang mendasari perhitungan kimia (stoikiometri). A. KONSEP
BAB V KONSEP MOL DAN STOIKIOMETRI Dalam ilmu fisika, dikenal satuan mol untuk besaran jumlah zat. Dalam bab ini, akan dibahas mengenai konsep mol yang mendasari perhitungan kimia (stoikiometri). A. KONSEP
Laju Reaksi. Kode KIM.10
 Kode KIM.10 Laju Reaksi BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN NASIONAL 004 Kim. 10. Laju Reaksi
Kode KIM.10 Laju Reaksi BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN NASIONAL 004 Kim. 10. Laju Reaksi
KONSEP MOL DAN STOIKIOMETRI
 KONSEP MOL DAN STOIKIOMETRI HUKUM-HUKUM DASAR KIMIA 1. Asas Lavoiser atau kekekalan massa jumlah sebelum dan setelah reaksi kimia adalah tetap 2. Hukum Gas Ideal P V = nrt Dengan P adalah tekanan (atm),
KONSEP MOL DAN STOIKIOMETRI HUKUM-HUKUM DASAR KIMIA 1. Asas Lavoiser atau kekekalan massa jumlah sebelum dan setelah reaksi kimia adalah tetap 2. Hukum Gas Ideal P V = nrt Dengan P adalah tekanan (atm),
LEMBARAN SOAL 7. Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA )
 LEMBARAN SOAL 7 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal
LEMBARAN SOAL 7 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal
MODUL I SIFAT KOLIGATIF LARUTAN Penurunan Titik Beku Larutan
 MODUL I SIFAT KOLIGATIF LARUTAN Penurunan Titik Beku Larutan - Siswa mampu membuktikan penurunan titik beku larutan akibat penambahan zat terlarut. - Siswa mampu membedakan titik beku larutan elektrolit
MODUL I SIFAT KOLIGATIF LARUTAN Penurunan Titik Beku Larutan - Siswa mampu membuktikan penurunan titik beku larutan akibat penambahan zat terlarut. - Siswa mampu membedakan titik beku larutan elektrolit
BAB IV HASIL DAN PEMBAHASAN. Pengujian kali ini adalah penetapan kadar air dan protein dengan bahan
 BAB IV HASIL DAN PEMBAHASAN 4.1 Hasil Pengujian kali ini adalah penetapan kadar air dan protein dengan bahan yang digunakan Kerupuk Udang. Pengujian ini adalah bertujuan untuk mengetahui kadar air dan
BAB IV HASIL DAN PEMBAHASAN 4.1 Hasil Pengujian kali ini adalah penetapan kadar air dan protein dengan bahan yang digunakan Kerupuk Udang. Pengujian ini adalah bertujuan untuk mengetahui kadar air dan
BAB 2. PERSAMAAN KIMIA DAN HASIL REAKSI
 BAB 2. PERSAMAAN KIMIA DAN HASIL REAKSI 1. RUMUS KIMIA 2. MENULISKAN PERSAMAAN KIMIA YANG BALANS 3. HUBUNGAN MASSA DALAM REAKSI KIMIA 4. REAKTAN PEMBATAS 5. HASIL PERSENTASE Reaktan (Pereaksi) Produk (Hasil
BAB 2. PERSAMAAN KIMIA DAN HASIL REAKSI 1. RUMUS KIMIA 2. MENULISKAN PERSAMAAN KIMIA YANG BALANS 3. HUBUNGAN MASSA DALAM REAKSI KIMIA 4. REAKTAN PEMBATAS 5. HASIL PERSENTASE Reaktan (Pereaksi) Produk (Hasil
kimia KTSP & K-13 KESETIMBANGAN KIMIA 1 K e l a s A. Reaksi Kimia Reversible dan Irreversible Tujuan Pembelajaran
 KTSP & K-13 kimia K e l a s XI KESETIMBANGAN KIMIA 1 Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami definisi reaksi kimia reversible dan irreversible..
KTSP & K-13 kimia K e l a s XI KESETIMBANGAN KIMIA 1 Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami definisi reaksi kimia reversible dan irreversible..
