Laporan Kimia Fisik KI-3141
|
|
|
- Lanny Lie
- 6 tahun lalu
- Tontonan:
Transkripsi
1 Laporan Kimia Fisik KI-3141 PERCOBN M-1 KINETIK HLOGENSI SETON DENGN KTLISTOR SM Nama : Kartika Trianita NIM : 1517 Kelompok : 2 Tanggal Percobaan : 22 Oktober 212 Tanggal Laporan : 2 November 212 sisten : li Syari ati (251227) Sarah Fauzani (1589) Laboratorium Kimia Fisik Program Studi Kimia Fakultas Matematika dan Ilmu Pengetahuan lam Institut Teknologi Bandung 212
2 Kinetika Halogenasi seton dengan Katalisator sam I. Tujuan Percobaan Menentukan persamaan laju reaksi iodisasi aseton dalam suasana asam. II. Teori Dasar Kinetika kimia adalah salah satu ilmu yang membahas tentang laju atau kecepatan dan mekanisme reaksi.berdasarkan penelitian yang mula-mula dilakukan oleh Wiilhelmy terhadap kecepatan inversi glukosa, ternyata reaksi berbanding lurus dengan konsentrasi atau tekanan dari produk atau reaktan terhadap waktu.secara kuantitatif kecepatan reaksi kimia ditentukan oleh oleh orde reaksi yaitu jumlah dari eksponen konsentrasi pada persamaan laju reaksi. Katalis adalah suatu zat yang dapat mempercepat atau memperlambat reaksi. Katalis yang memperlambat reaksi di sebut inhibitor. Pada umumnya yang di sebut katalis adalah zat yang mempercepat reaksi. Katalis di kelompokkan menjadi katalis homogen, katalis heterogen. Katalis homogen adalah katalis yang wujudnya sama dengan wujud zat-zat pereaksi. Katalis heterogen adalah katalis yang wujudnya berbeda dengan pereaksi. Laju reaksi (Reaction Rate) atau kecepatan reaksi adalah perubahan konsentrasi konsentrasi pereaksi ataupun produk dalam satauan waktu. Laju suatu reaksi dapat di nyataka sebagai laju berkurangnya konsentrasi suatu pereaksi, atau laju bertambahnya konsentrasi suatu produk. Konsentrasi baisanya di nyatakan dalam mol per liter, tetapi untuk reaksi fase gas, suatu tekanan atmosfer, milimeter merkurium, dapat di gunakan sebagai ganti konsentrasi. ( Muchtaridi,26;13-17 ) Orde reaksi adalah banyaknya faktor konsentrasi zat reaktan yang mempengaruhi kecepatan reaksi. Penentuan orde reaksi tidak dapat diturunkan dari persamaan reaksi tetapi hanya dapat ditentukan berdasarkan percobaan. Suatu reaksi yang diturunkan secara eksperimen dinyatakan dengan rumus kecepatan reaksi : v = k [] [B] 2
3 Persamaan tersebut mengandung pengertian reaksi orde 1 terhadap zat dan merupakan reaksi orde 2 terhadap zat B. Secara keselurahan reaksi tersebut adalah reaksi orde 3. III. Data Pengamatan [seton] = 3 M [HCl] = 1 M [I 2 ] =,1 M λ pengukuran = 546 nm Run seton (ml) HCl (ml) I 2 (ml) KI (ml) bsorbansi pada tiap waktu s 6 s 12 s 18 s
4 III. Pengolahan Data 1. Grafik terhadap t Run 1 Run y = -3x R² = y = -.14x R² =.9999 r = -m =,3 r =,14 Run 2 y = -6x R² = 1 Run 5 y = -4x R² =.9997 r =,61 r =,36 Run 3 Run 6 y = -6x R² =.9586 y = -7x R² = 1 r =,6 r =,69
5 bsorban y = -.1x R² =.999 r =,96 Run r =,5 Run 1 y = -5x R² =.7359 Run 8 y = -.16x R² =.9886 Run 11 y = -.12x R² =.9997 r =, r =,1 Run 9 y = -1x R² =.6 Waktu (s) r =,119.6 r =,118 Run 12 y = -.12x R² = Penentuan Orde Reaksi [M] =
6 ln r ln r Run ke- r ln r [seton]' ln [seton]' seton y =.9689x R² =.8543 ln [seton]' -5-1 m = orde reaksi aseton =,968 1 Run ke- r ln r [HCl]' ln [HCl]' HCl y = 1.476x R² =.9822 ln [HCl]' m = orde reaksi HCl = 1,47 1
7 ln r Run ke- r ln r [I 2 ]' ln [I 2 ]' Iodin y = x R² = ln [I2]' -1 m = orde reaksi I 2 = 1, Penentuan nilai k Run ke- r [seton] 1 M [HCl] 1 (M) [I 2 ] 2 (M) k (M -3,s -1 ) 1,3 3 1,1 1 2,61 3 1,1 2, ,6 3 1,1 2 4,14 3 1,1 4, ,36 3 1,1 1,2 6,69 3 1,1 2,3 7,96 3 1,1 3,2 8, ,1 5, ,1 3 1,1, ,5 3 1,1 1, , ,1 3, , ,1 3,933333
8 k rata-rata = 2,63556 r = 2,63556 [seton][hcl][i 2 ] 2 IV. Pembahasan Pada percobaan ini dilakukan penentuan persamaan laju reaksi iodisasi aseton dalam suasana asam. Pereaksi yang digunakan dalam percobaan ini adalah aseton, HCl, KI, dan iodium. Larutan HCl berfungsi sebagai katalis asam, yaitu katalis homogen dikarenakan wujudnya sama dengan pereaksi. Sedangkan KI berfungsi sebagai pelarut dan I 2 yang akan menghalogenisasikan aseton. Oleh karena akan ditentukan pengaruh suatu zat dalam laju reaksi, maka dibuat keadaan dimana volume aseton tetap, volume HCl tetap, dan volume iodium tetap. Ketika volume aseton tetap, maka pada saat itu aseton tidak mempengaruhi laju reaksi, begitupun untuk HCl dan iodium. Ketika suatu zat volumenya tetap atau tidak mempengaruhi laju reaksi, maka yang dilihat adalah pengaruh dari dua zat lainnya dalam laju reaksi. Larutan KI tidak mempengaruhi laju reaksi karena fungsinya hanya sebagai pelarut Laju reaksi pada percobaan ini menggunakan spektrofotometer Spectronic-2 untuk mengukur perubahan absorbansi larutan setiap 6 detik selama 3 menit. Perubahan absorbansi terhadap waktu inilah yang disebut laju reaksi. Metoda pengukuran dengan spektrofotometer didasarkan pada serapan sinar monokromatis oleh larutan berwarna pada panjang gelombang tertentu, yaitu panjang gelombang dimana larutan dapat memberikan penyerapan maksimal. Skema alatnya adalah sebagai berikut. Bagian gambar: 1. tempat kuvet 2. display digital 3. pengatur transmitan/absorbans (1%T / ) 4. tombol pengurangan 5. tombol menaikkan 6. pengatur panjang gelombang Tempat kuvet merupakan tempat larutan yang dianalisis berada. Pertama-tama dilakukan kalibrasi terlebih dahulu dengan memilih panjang gelombang pengukuran yang diinginkan
9 dengan menggunakan tombol untuk menaikkan dan mengurangkan, kemudian memasukkan aqua dm sebagai blanko dan absorban diatur pada angka. Setelah itu dilakukan analisis terhadap sampel dengan memasukkan larutan yang akan dianalisis ke dalam kuvet. Nilai absorban akan ditunjukkan pada display digital. Pada percobaan ini dilakukan pengukuran pada panjang gelombang 546 nm dikarenakan pada panjang gelombang tersebut larutan menyerap warna komplementernya. Hasil pengamatan menunjukkan bahwa absorbansi zat akan berkurang seiring bertambahnya waktu. Hal ini dikarenakan terjadi reaksi antara aseton dengan I2 yang semula berwarna coklat menghasilkan hasil reaksi yang bening. Semakin memudarnya warna akan menunjukkan penurunan absorbansi karena larutan semakin tidak menyerap panjang gelombang. Pada run 1 grafik yang diperoleh kurang linear (nilai R2 tidak mendekati 1) dikarenakan listrik pada saat percobaan sempat padam sehingga percobaan run 1 diulang ketika listrik telah nyala kembali dan hasil yang diperoleh menjadi kurang tepat. Pada run 9 dan 1 diperoleh nilai absorban yang tetap pada waktu yang berbeda. Hal ini terjadi dikarenakan kandungan I2 dalam larutan hanya sedikit sehingga I2 lebih cepat habis bereaksi. Stoikiometri reaksi yang terjadi adalah sebagai berikut. O O acid CH 3 -C-CH 3 + I > CH 3 -C-CH 2 I + HI Hasil percobaan menunjukkan bahwa laju reaksi naik seiring dengan bertambahnya konsentrasi H + (asam). Dalam suasana asam, pada hasil reaksi diperoleh pula H + seperti ditunjukkan pada reaksi di atas, sehingga dalam larutan yang tidak dibuffer, kecepatan awal reaksi akan terus bertambah selama reaksi berlangsung. Berdasarkan fakta di atas, dapat diramalkan mekanisme reaksi halogenisasi aseton yang terjadi, yaitu sebagai berikut.
10 Oleh karena aseton merupakan basa sangat lemah, maka kesetimbangan reaksi (1) akan bergeser ke kiri. Orde reaksi hanya dapat ditentukan melalui percobaan. Dari perhitungan diperoleh bahwa laju reaksi aseton dan HCl sama dengan 1, sedangkan laju reaksi iodin sama dengan 2. da faktor-faktor yang mempengaruhi laju reaksi, diantaranya adalah konsentrasi, katalis, suhu, luas permukaan, dan energi aktivasi. Semakin besar konsentrasi, maka semakin cepat pula laju reaksi. Hal ini bersesuaikan dengan persamaan laju reaksi yang menunjukkan hubungan sebanding antara konsentrasi dan laju reaksi. Katalis berfungsi untuk mempercepat jalannya reaksi dengan cara menurunkan energi aktivasi, karena semakin kecil energi aktivasi, maka semakin sedikit energi yang dibutuhkan untuk terbentuknya produk. Semakin luas permukaan zat, maka semakin banyak atau besar bidang sentuh zat yang dapat bereaksi, sehingga laju reaksi meningkat. V. Kesimpulan Persamaan laju reaksi iodisasi aseton dalam suasana asam adalah r = 2,63556 [seton][hcl][i 2 ] 2. VI. Daftar Pustaka Z Daniels cs. Eksperimental Physical Chemistry International Student Edition, edisi 7. Hal (31 Oktober 212; 19.) (1 November 212; 19.15) ormal_bab%21.pdf (1 November 212; 2.15) (2 November 212; 5:25)
11 VII. LMPIRN
Laporan Kimia Fisik KI-3141
 Laporan Kimia Fisik KI-3141 PERCOBAAN M-2 PENENTUAN LAJU REAKSI DAN TETAPAN LAJU REAKSI Nama : Kartika Trianita NIM : 10510007 Kelompok : 2 Tanggal Percobaan : 2 November 2012 Tanggal Laporan : 9 November
Laporan Kimia Fisik KI-3141 PERCOBAAN M-2 PENENTUAN LAJU REAKSI DAN TETAPAN LAJU REAKSI Nama : Kartika Trianita NIM : 10510007 Kelompok : 2 Tanggal Percobaan : 2 November 2012 Tanggal Laporan : 9 November
LAPORAN PRAKTIKUM DINAMIKA KIMIA JUDUL PERCOBAAN : PENENTUAN LAJU REAKSI IODINASI ASETON DALAM SUASANA ASAM. Nama : SantiNurAini NRP :
 LAPORAN PRAKTIKUM DINAMIKA KIMIA JUDUL PERCOBAAN : PENENTUAN LAJU REAKSI IODINASI ASETON DALAM SUASANA ASAM Nama : SantiNurAini NRP : 1413100048 Tanggal Praktikum : 28 April 2015 Nama Asisten : Mas Mattius
LAPORAN PRAKTIKUM DINAMIKA KIMIA JUDUL PERCOBAAN : PENENTUAN LAJU REAKSI IODINASI ASETON DALAM SUASANA ASAM Nama : SantiNurAini NRP : 1413100048 Tanggal Praktikum : 28 April 2015 Nama Asisten : Mas Mattius
LEMBAR KERJA SISWA 4
 88 LEMBAR KERJA SISWA 4 Mata Pelajaran Kelas/Semester Materi Pokok Submateri Pokok Alokasi Waktu : Kimia : I/ganjil : Laju Reaksi : Teori Tumbukan : 2 x 45 menit Standar Kompetensi Memahami Kinetika Reaksi,
88 LEMBAR KERJA SISWA 4 Mata Pelajaran Kelas/Semester Materi Pokok Submateri Pokok Alokasi Waktu : Kimia : I/ganjil : Laju Reaksi : Teori Tumbukan : 2 x 45 menit Standar Kompetensi Memahami Kinetika Reaksi,
kimia LAJU REAKSI 1 TUJUAN PEMBELAJARAN
 KTSP & K-13 kimia K e l a s XI LAJU REAKSI 1 TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konsep molaritas. 2. Memahami definisi dan faktor-faktor
KTSP & K-13 kimia K e l a s XI LAJU REAKSI 1 TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konsep molaritas. 2. Memahami definisi dan faktor-faktor
PERCOBAAN 03 LAJU INVERSI GULA
 PERCOBAAN 03 LAJU INVERSI GULA Nama : Sonny Caesar Octario NIM : 10509078 Tanggal Praktikum : 6 Oktober 2011 Tanggal Pengumpulan : 13 Oktober 2011 Asisten : Hendra Saputera Sasmaya LABORATORIUM KIMIA FISIK
PERCOBAAN 03 LAJU INVERSI GULA Nama : Sonny Caesar Octario NIM : 10509078 Tanggal Praktikum : 6 Oktober 2011 Tanggal Pengumpulan : 13 Oktober 2011 Asisten : Hendra Saputera Sasmaya LABORATORIUM KIMIA FISIK
Kunci jawaban dan pembahasan soal laju reaksi
 Kunci jawaban dan pembahasan soal laju reaksi Soal nomor 1 Mencari volume yang dibutuhkan pada proses pengenceran. Rumus pengenceran V 1. M 1 = V 2. M 2 Misal volume yang dibutuhkan sebanyak x ml, maka
Kunci jawaban dan pembahasan soal laju reaksi Soal nomor 1 Mencari volume yang dibutuhkan pada proses pengenceran. Rumus pengenceran V 1. M 1 = V 2. M 2 Misal volume yang dibutuhkan sebanyak x ml, maka
PENENTUAN TETAPAN PENGIONAN INDIKATOR METIL MERAH SECARA SPEKTROFOTOMETRI
 PENENTUAN TETAPAN PENGIONAN INDIKATOR METIL MERAH SECARA SPEKTROFOTOMETRI A. Tujuan Percobaan Percobaan. Menentukan tetapan pengionan indikator metil merah secara spektrofotometri. B. Dasar Teori Dalam
PENENTUAN TETAPAN PENGIONAN INDIKATOR METIL MERAH SECARA SPEKTROFOTOMETRI A. Tujuan Percobaan Percobaan. Menentukan tetapan pengionan indikator metil merah secara spektrofotometri. B. Dasar Teori Dalam
Gambar 2.1 Reaksi Saponifikasi tripalmitin
 I. JUDUL : Kinetika Reaksi Saponifikasi Etil Asetat II. TANGGAL PERCOBAAN : Rabu, 16 November 2011 III. TUJUAN : 1. Untuk memberikan gambaran bahwa reaksi penyabunan etil asetat oleh ion hidroksida adalah
I. JUDUL : Kinetika Reaksi Saponifikasi Etil Asetat II. TANGGAL PERCOBAAN : Rabu, 16 November 2011 III. TUJUAN : 1. Untuk memberikan gambaran bahwa reaksi penyabunan etil asetat oleh ion hidroksida adalah
LAPORAN PRAKTIKUM KIMIA DASAR
 LAPORAN PRAKTIKUM KIMIA DASAR KECEPATAN REAKSI Disusun Oleh : 1. Achmad Zaimul Khaqqi (132500030) 2. Dinda Kharisma Asmara (132500014) 3. Icha Restu Maulidiah (132500033) 4. Jauharatul Lailiyah (132500053)
LAPORAN PRAKTIKUM KIMIA DASAR KECEPATAN REAKSI Disusun Oleh : 1. Achmad Zaimul Khaqqi (132500030) 2. Dinda Kharisma Asmara (132500014) 3. Icha Restu Maulidiah (132500033) 4. Jauharatul Lailiyah (132500053)
wanibesak.wordpress.com
 1. Diberikan beberapa pernyataan 1) katalis dapat mempercepat laju reaksi dengan cara menaikan energi aktivasi 2) tahap penentu laju reaksi adalah tahap reaksi yang berlangsung paling lambat 3) laju reaksi
1. Diberikan beberapa pernyataan 1) katalis dapat mempercepat laju reaksi dengan cara menaikan energi aktivasi 2) tahap penentu laju reaksi adalah tahap reaksi yang berlangsung paling lambat 3) laju reaksi
BAB VI KINETIKA REAKSI KIMIA
 BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
ANALISIS DUA KOMPONEN TANPA PEMISAHAN
 LAPORAN PRAKTIKUM KIMIA ANALITIK ANALISIS DUA KOMPONEN TANPA PEMISAHAN Tanggal Praktikum : Jumat, Oktober 010 Tanggal Pengumpulan Laporan : Jumat, 9 Oktober 010 Disusun oleh Nama : Annisa Hijriani Nim
LAPORAN PRAKTIKUM KIMIA ANALITIK ANALISIS DUA KOMPONEN TANPA PEMISAHAN Tanggal Praktikum : Jumat, Oktober 010 Tanggal Pengumpulan Laporan : Jumat, 9 Oktober 010 Disusun oleh Nama : Annisa Hijriani Nim
c. Suhu atau Temperatur
 Pada laju reaksi terdapat faktor-faktor yang dapat mempengaruhi laju reaksi. Selain bergantung pada jenis zat yang beraksi laju reaksi dipengaruhi oleh : a. Konsentrasi Pereaksi Pada umumnya jika konsentrasi
Pada laju reaksi terdapat faktor-faktor yang dapat mempengaruhi laju reaksi. Selain bergantung pada jenis zat yang beraksi laju reaksi dipengaruhi oleh : a. Konsentrasi Pereaksi Pada umumnya jika konsentrasi
BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN
 BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN STANDAR KOMPETENSI 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan
BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN STANDAR KOMPETENSI 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan
Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Chapter 8 Kinetika Kimia Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Chapter 8 Kinetika Kimia Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
Termodinamika dan Kesetimbangan Kimia
 Termodinamika dan Kesetimbangan Kimia Dalam kesetimbangan kimia terdapat 2 reaksi yaitu reaksi irreversible dan reaksi reversible. Reaksi irreversible (reaksi searah) adalah reaksi yang berlangsung searah.
Termodinamika dan Kesetimbangan Kimia Dalam kesetimbangan kimia terdapat 2 reaksi yaitu reaksi irreversible dan reaksi reversible. Reaksi irreversible (reaksi searah) adalah reaksi yang berlangsung searah.
Waktu (t) Gambar 3.1 Grafik hubungan perubahan konsentrasi terhadap waktu
 3 LAJU REAKSI Setelah mempelajari bab ini, kamu diharapkan mampu: Menghitung konsentrasi larutan (molaritas larutan). Menganalisis faktor-faktor yang mempengaruhi laju reaksi (konsentrasi, luas permukaan,
3 LAJU REAKSI Setelah mempelajari bab ini, kamu diharapkan mampu: Menghitung konsentrasi larutan (molaritas larutan). Menganalisis faktor-faktor yang mempengaruhi laju reaksi (konsentrasi, luas permukaan,
LAPORAN PRAKTIKUM KIMIA FISIK KI3141 PERCOBAAN M-2 PENENTUAN ORDE REAKSI DAN TETAPAN LAJU REAKSI. : Ricky Iqbal Syahrudin.
 LAPORAN PRAKTIKUM KIMIA FISIK KI3141 PERCOBAAN M-2 PENENTUAN ORDE REAKSI DAN TETAPAN LAJU REAKSI Nama : Ricky Iqbal Syahrudin Nim : 10513013 Kelompok : 2 Hari/tanggal Praktikum : Kamis, 05 Oktober 2015
LAPORAN PRAKTIKUM KIMIA FISIK KI3141 PERCOBAAN M-2 PENENTUAN ORDE REAKSI DAN TETAPAN LAJU REAKSI Nama : Ricky Iqbal Syahrudin Nim : 10513013 Kelompok : 2 Hari/tanggal Praktikum : Kamis, 05 Oktober 2015
Faktor-faktor yang Mempengaruhi Laju Reaksi
 Faktor-faktor yang Mempengaruhi Laju Reaksi Faktor yang mempengaruhi laju reaksi adalah sebagai berikut. Konsentrasi Jika konsentrasi suatu larutan makin besar, larutan akan mengandung jumlah partikel
Faktor-faktor yang Mempengaruhi Laju Reaksi Faktor yang mempengaruhi laju reaksi adalah sebagai berikut. Konsentrasi Jika konsentrasi suatu larutan makin besar, larutan akan mengandung jumlah partikel
PERCOBAAN 6 KONSTANTA KECEPATAN REAKSI
 PERCOBAAN 6 KONSTANTA KECEPATAN REAKSI A. TUJUAN Mempelajari kecepatan reaksi hidrolisa sukrosa dengan pengaruh H + sebagai katalisator dan menentukan konstanta kecepatan reaksinya dengan menggunakan polarimeter.
PERCOBAAN 6 KONSTANTA KECEPATAN REAKSI A. TUJUAN Mempelajari kecepatan reaksi hidrolisa sukrosa dengan pengaruh H + sebagai katalisator dan menentukan konstanta kecepatan reaksinya dengan menggunakan polarimeter.
Soal-Soal. Bab 4. Latihan. Laju Reaksi. 1. Madu dengan massa jenis 1,4 gram/ cm 3 mengandung glukosa (M r. 5. Diketahui reaksi:
 Bab Laju Reaksi Soal-Soal Latihan. Madu dengan massa jenis, gram/ cm 3 mengandung glukosa (M r = 80) sebanyak 35 % b/b. Kemolaran glukosa dalam madu adalah... 0,8 M (D),7 M,8 M (E) 3,0 M, M. Untuk membuat
Bab Laju Reaksi Soal-Soal Latihan. Madu dengan massa jenis, gram/ cm 3 mengandung glukosa (M r = 80) sebanyak 35 % b/b. Kemolaran glukosa dalam madu adalah... 0,8 M (D),7 M,8 M (E) 3,0 M, M. Untuk membuat
MODUL LAJU REAKSI. Laju reaksi _ 2013 Page 1
 MODUL LAJU REAKSI Standar Kompetensi ( SK ) : Memahami kinetika reaksi, kesetimbangan kimia dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri. Kompetensi
MODUL LAJU REAKSI Standar Kompetensi ( SK ) : Memahami kinetika reaksi, kesetimbangan kimia dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri. Kompetensi
Laporan Kimia Analitik KI-3121
 Laporan Kimia Analitik KI-3121 PERCOBAAN 2 PENETAPAN ANION FOSFAT DALAM AIR Nama : Kartika Trianita NIM : 10510007 Kelompok : 1 Tanggal Percobaan : 28 September 2012 Tanggal Laporan : 5 Oktober 2012 Asisten
Laporan Kimia Analitik KI-3121 PERCOBAAN 2 PENETAPAN ANION FOSFAT DALAM AIR Nama : Kartika Trianita NIM : 10510007 Kelompok : 1 Tanggal Percobaan : 28 September 2012 Tanggal Laporan : 5 Oktober 2012 Asisten
ABSTRAK. Percobaan dengan judul reaksi orde satu yang bertujuan untuk menguji apakah H 2 O 2
 Reaksi Orde Satu Tujuan : Menguji apakah reaksi penguraian H 2 O 2 dalam air merupakan reaksi orde keastu berdasarkan cara grafik Kelompok 3: Hana Aulia, Amelia Desiria, Sarip Hidayat Program Studi Pendidikan
Reaksi Orde Satu Tujuan : Menguji apakah reaksi penguraian H 2 O 2 dalam air merupakan reaksi orde keastu berdasarkan cara grafik Kelompok 3: Hana Aulia, Amelia Desiria, Sarip Hidayat Program Studi Pendidikan
Laporan Kimia Analitik KI-3121
 Laporan Kimia Analitik KI-3121 PERCOBAAN 5 SPEKTROFOTOMETRI SERAPAN ATOM Nama : Kartika Trianita NIM : 10510007 Kelompok : 1 Tanggal Percobaan : 19 Oktober 2012 Tanggal Laporan : 2 November 2012 Asisten
Laporan Kimia Analitik KI-3121 PERCOBAAN 5 SPEKTROFOTOMETRI SERAPAN ATOM Nama : Kartika Trianita NIM : 10510007 Kelompok : 1 Tanggal Percobaan : 19 Oktober 2012 Tanggal Laporan : 2 November 2012 Asisten
PENGARUH KATALISIS TERHADAP TETAPAN LAJU
 PENGARUH KATALISIS TERHADAP TETAPAN LAJU Laju reaksi sering dipengaruhi oleh adanya katalis Contoh : Hidrolisis sukrosa dalam air Suhu kamar lama (bisa beberapa bulan) Namun jika hidrolisis dilakukan dalam
PENGARUH KATALISIS TERHADAP TETAPAN LAJU Laju reaksi sering dipengaruhi oleh adanya katalis Contoh : Hidrolisis sukrosa dalam air Suhu kamar lama (bisa beberapa bulan) Namun jika hidrolisis dilakukan dalam
PETA KONSEP LAJU REAKSI. Percobaan. Waktu perubahan. Hasil reaksi. Pereaksi. Katalis. Suhu pereaksi. Konsentrasi. Luas. permukaan.
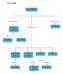 PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
Sulistyani, M.Si.
 Sulistyani, M.Si. Email: sulistyani@uny.ac.id Laju reaksi adalah laju pengurangan reaktan tiap satuan waktu atau laju pembentukan produk tiap satuan waktu. Laju reaksi dipengaruhi oleh: sifat dan keadan
Sulistyani, M.Si. Email: sulistyani@uny.ac.id Laju reaksi adalah laju pengurangan reaktan tiap satuan waktu atau laju pembentukan produk tiap satuan waktu. Laju reaksi dipengaruhi oleh: sifat dan keadan
BAB 9. KINETIKA KIMIA
 BAB 9 BAB 9. KINETIKA KIMIA 9.1 TEORI TUMBUKAN DARI LAJU REAKSI 9.2 TEORI KEADAAN TRANSISI DARI LAJU REAKSI 9.3 HUKUM LAJU REAKSI 9.4 FAKTOR-FAKTOR LAJU REAKSI 9.5 MEKANISME REAKSI 9.6 ENZIM SEBAGAI KATALIS
BAB 9 BAB 9. KINETIKA KIMIA 9.1 TEORI TUMBUKAN DARI LAJU REAKSI 9.2 TEORI KEADAAN TRANSISI DARI LAJU REAKSI 9.3 HUKUM LAJU REAKSI 9.4 FAKTOR-FAKTOR LAJU REAKSI 9.5 MEKANISME REAKSI 9.6 ENZIM SEBAGAI KATALIS
PRAKTIKUM KIMIA DASAR I KECEPATAN REAKSI. Kelompok V : Amir Hamzah Umi Kulsum
 PRAKTIKUM KIMIA DASAR I KECEPATAN REAKSI Kelompok V : Amir Hamzah 1415005 Umi Kulsum 1415018 AKADEMI KIMIA ANALISIS CARAKA NUSANTARA CIMANGGIS, KELAPA DUA DEPOK, 2015 BAB 1 PENDAHULUAN 1.1 Latar Belakang
PRAKTIKUM KIMIA DASAR I KECEPATAN REAKSI Kelompok V : Amir Hamzah 1415005 Umi Kulsum 1415018 AKADEMI KIMIA ANALISIS CARAKA NUSANTARA CIMANGGIS, KELAPA DUA DEPOK, 2015 BAB 1 PENDAHULUAN 1.1 Latar Belakang
A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI
 3 LAJU REAKSI A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI Materi dapat berubah dari bentuk yang satu ke bentuk yang
3 LAJU REAKSI A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI Materi dapat berubah dari bentuk yang satu ke bentuk yang
KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN
 KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN 1. Suatu reaksi dikatakan mencapai kesetimbangan apabila. A. laju reaksi ke kiri sama dengan ke kanan B. jumlah koefisien reaksi ruas kiri sama dengan ruas kanan
KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN 1. Suatu reaksi dikatakan mencapai kesetimbangan apabila. A. laju reaksi ke kiri sama dengan ke kanan B. jumlah koefisien reaksi ruas kiri sama dengan ruas kanan
Purwanti Widhy H, M.Pd. Laju Reaksi
 Purwanti Widhy H, M.Pd Laju Reaksi SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi, Kompetensi Dasar & Indikator
Purwanti Widhy H, M.Pd Laju Reaksi SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi, Kompetensi Dasar & Indikator
Laju Reaksi. Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I
 Laju Reaksi Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi,
Laju Reaksi Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi,
OAL TES SEMESTER I. I. Pilihlah jawaban yang paling tepat! a. 2d d. 3p b. 2p e. 3s c. 3d 6. Unsur X dengan nomor atom
 KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
LAMPIRAN. 2. Tabel penentuan konsentrasi dan kadar pada beda variable pelarut
 3 LMPIRN 1. Tabel penentuan panjang gelombang maksimal Panjang Gelombang (nm) bsorbansi 490 0,895 500 0,776 510 0,74 50 0,646 530 0,61. Tabel penentuan konsentrasi dan kadar pada beda variable pelarut
3 LMPIRN 1. Tabel penentuan panjang gelombang maksimal Panjang Gelombang (nm) bsorbansi 490 0,895 500 0,776 510 0,74 50 0,646 530 0,61. Tabel penentuan konsentrasi dan kadar pada beda variable pelarut
Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan
 KINETIKA Pendahuluan Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan Namun persamaan reaksi tidak dapat menjawab :. Seberapa cepat reaksi berlangsung 2. Bagaimana
KINETIKA Pendahuluan Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan Namun persamaan reaksi tidak dapat menjawab :. Seberapa cepat reaksi berlangsung 2. Bagaimana
TEORI TUMBUKAN PADA LAJU REAKSI KIMIA
 PENGEMBANGAN BAHAN AJAR TEORI TUMBUKAN PADA LAJU REAKSI KIMIA OLEH : Drs. I Wayan Suarsa, M.Si JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS UDAYANA 2017 Kata Pengantar Puji dan
PENGEMBANGAN BAHAN AJAR TEORI TUMBUKAN PADA LAJU REAKSI KIMIA OLEH : Drs. I Wayan Suarsa, M.Si JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS UDAYANA 2017 Kata Pengantar Puji dan
KESETIMBANGAN KIMIA A. Pendahuluan 1. Latar Belakang Keadaan setimbang adalah suatu keadaaan dimana konsentrasi seluruh zat tidak lagi mengalami
 KESETIMBANGAN KIMIA A. Pendahuluan 1. Latar Belakang Keadaan setimbang adalah suatu keadaaan dimana konsentrasi seluruh zat tidak lagi mengalami perubahan, sebab zat-zat diruas kanan terbentuk dan terurai
KESETIMBANGAN KIMIA A. Pendahuluan 1. Latar Belakang Keadaan setimbang adalah suatu keadaaan dimana konsentrasi seluruh zat tidak lagi mengalami perubahan, sebab zat-zat diruas kanan terbentuk dan terurai
LEMBAR KERJA SISWA 3
 82 LEMBAR KERJA SISWA 3 Mata Pelajaran Kelas/Semester Materi Pokok Sub Materi Pokok Alokasi Waktu : Kimia : XI IPA 3/Ganjil : Laju Reaksi : Faktor-faktor yang mempengaruhi laju reaksi : 2 45 menit Standar
82 LEMBAR KERJA SISWA 3 Mata Pelajaran Kelas/Semester Materi Pokok Sub Materi Pokok Alokasi Waktu : Kimia : XI IPA 3/Ganjil : Laju Reaksi : Faktor-faktor yang mempengaruhi laju reaksi : 2 45 menit Standar
Kesetimbangan Kimia. A b d u l W a h i d S u r h i m
 Kesetimbangan Kimia A b d u l W a h i d S u r h i m 2 0 1 4 Rujukan Chapter 12 dan 14: Masterton, William L. and Hurley, Cecile N. 2009. Chemistry: Principles and Reactions. Sixth Edition. Books/Cole.
Kesetimbangan Kimia A b d u l W a h i d S u r h i m 2 0 1 4 Rujukan Chapter 12 dan 14: Masterton, William L. and Hurley, Cecile N. 2009. Chemistry: Principles and Reactions. Sixth Edition. Books/Cole.
JURNAL PRAKTIKUM KIMIA LAJU REAKSI 24 MARET 2014
 JURNAL PRAKTIKUM KIMIA LAJU REAKSI 24 MARET 204 Oleh MIRRAH AGHNIA NAFILAH F (306200055) FITRIA KUSUMA WARDHANI (306200060) INTAN MUTHIAH AFIFAH (30620006) NUR AZIZAH APRIANI (306200064) PROGRAM STUDI
JURNAL PRAKTIKUM KIMIA LAJU REAKSI 24 MARET 204 Oleh MIRRAH AGHNIA NAFILAH F (306200055) FITRIA KUSUMA WARDHANI (306200060) INTAN MUTHIAH AFIFAH (30620006) NUR AZIZAH APRIANI (306200064) PROGRAM STUDI
tanya-tanya.com Soal No.2 Apabila anda diminta untuk mengukur laju reaksi terhadap reaksi : Zn(s) + 2HCI(aq)
 Soal No.1 Apa yang di maksud dengan laju reaksi dan satuan dari laju reaksi? Laju reaksi dinyatakan sebagai berkurangnya jumlah pereaksi untuk setiap satuan waktu atau bertambahnya jumlah hasil reaksi
Soal No.1 Apa yang di maksud dengan laju reaksi dan satuan dari laju reaksi? Laju reaksi dinyatakan sebagai berkurangnya jumlah pereaksi untuk setiap satuan waktu atau bertambahnya jumlah hasil reaksi
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
Materi pelajaran Biologi. Disusun oleh: Dra. Tetty Afianti.
 Materi pelajaran Biologi kelas 11 Disusun oleh: Dra. Tetty Afianti KECEPATAN REAKSI Diriwayatkan dari Umar abi Salamah ra. : Aku seorang anak laki-laki di bawah asuhan Rasulullah Saw dan tanganku biasa
Materi pelajaran Biologi kelas 11 Disusun oleh: Dra. Tetty Afianti KECEPATAN REAKSI Diriwayatkan dari Umar abi Salamah ra. : Aku seorang anak laki-laki di bawah asuhan Rasulullah Saw dan tanganku biasa
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
3 METODOLOGI PENELITIAN
 3 METODOLOGI PENELITIAN 3.1 Alat dan bahan 3.1.1 Alat Peralatan yang digunakan dalam penelitian ini menggunakan alat yang berasal dari Laboratorium Tugas Akhir dan Laboratorium Kimia Analitik di Program
3 METODOLOGI PENELITIAN 3.1 Alat dan bahan 3.1.1 Alat Peralatan yang digunakan dalam penelitian ini menggunakan alat yang berasal dari Laboratorium Tugas Akhir dan Laboratorium Kimia Analitik di Program
SOAL LAJU REAKSI. Mol CaCO 3 = = 0.25 mol = 25. m Mr
 SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
SOAL KIMIA 2 KELAS : XI IPA
 SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
Spektrofotometri Serapan Atom
 Spektrofotometri Serapan Atom I. Tujuan Menentukan kepekaan dan daerah konsentrasi analisis logam Cu pada panjang gelombang 324.7 nm Menentukan pengaruh spesi lain, matriks, dan nyala api pada larutan
Spektrofotometri Serapan Atom I. Tujuan Menentukan kepekaan dan daerah konsentrasi analisis logam Cu pada panjang gelombang 324.7 nm Menentukan pengaruh spesi lain, matriks, dan nyala api pada larutan
STUDI GANGGUAN KROM (III) PADA ANALISA BESI DENGAN PENGOMPLEKS 1,10-FENANTROLIN PADA PH 4,5 SECARA SPEKTROFOTOMETRI UV-TAMPAK
 STUDI GANGGUAN KROM (III) PADA ANALISA BESI DENGAN PENGOMPLEKS 1,10-FENANTROLIN PADA PH 4,5 SECARA SPEKTROFOTOMETRI UV-TAMPAK Oleh: Retno Rahayu Dinararum 1409 100 079 Dosen Pembimbing: Drs. R. Djarot
STUDI GANGGUAN KROM (III) PADA ANALISA BESI DENGAN PENGOMPLEKS 1,10-FENANTROLIN PADA PH 4,5 SECARA SPEKTROFOTOMETRI UV-TAMPAK Oleh: Retno Rahayu Dinararum 1409 100 079 Dosen Pembimbing: Drs. R. Djarot
Siswa diingatkan tentang struktur atom, bilangan kuantum, bentuk-bentuk orbital, dan konfigurasi elektron
 RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
BAB II KAJIAN PUSTAKA. kemampuan adalah karakteristik yang menonjol dari seorang individu yang
 BAB II KAJIAN PUSTAKA 2.1 Defenisi Kemampuan Kemampuan sama dengan kata kesanggupan atau kecakapan. Dengan bahasa yang lebih terperinci, kemampuan dapat diartikan sebagai kesanggupan individu untuk melakukan
BAB II KAJIAN PUSTAKA 2.1 Defenisi Kemampuan Kemampuan sama dengan kata kesanggupan atau kecakapan. Dengan bahasa yang lebih terperinci, kemampuan dapat diartikan sebagai kesanggupan individu untuk melakukan
Bab 10 Kinetika Kimia
 D e p a r t e m e n K i m i a F M I P A I P B Bab 0 Kinetika Kimia http://chem.fmipa.ipb.ac.id Ikhtisar 2 3 Laju Reaksi Teori dalam Kinetika Kimia 4 Mekanisme Reaksi 5 46 Faktor Penentu Laju Reaksi Enzim
D e p a r t e m e n K i m i a F M I P A I P B Bab 0 Kinetika Kimia http://chem.fmipa.ipb.ac.id Ikhtisar 2 3 Laju Reaksi Teori dalam Kinetika Kimia 4 Mekanisme Reaksi 5 46 Faktor Penentu Laju Reaksi Enzim
Kode KIM.10. Laju Reaksi
 Kode KIM.10 Laju Reaksi BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN NASIONAL 2004 BAB I. PENDAHULUAN
Kode KIM.10 Laju Reaksi BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN NASIONAL 2004 BAB I. PENDAHULUAN
yang berkaitan dengan Laju Reaksi, diberikan pada tabel berikut ini.
 BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Hasil Penelitian Berdasarkan hasil pengumpulan data, persentase siswa SMA Negeri 1 Paguyaman, Kabupaten Boalemo yang memberikan jawaban untuk tiap item tes yang
BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Hasil Penelitian Berdasarkan hasil pengumpulan data, persentase siswa SMA Negeri 1 Paguyaman, Kabupaten Boalemo yang memberikan jawaban untuk tiap item tes yang
LAPORAN KIMIA ANALITIK KI 3121 Percobaan modul 2 PENETAPAN ANION FOSFAT DALAM AIR
 LAPORAN KIMIA ANALITIK KI 3121 Percobaan modul 2 PENETAPAN ANION FOSFAT DALAM AIR Nama : Imana Mamizar NIM : 10511066 Kelompok : 5 Nama Asisten : Rizki Tanggal Percobaan : 25 Oktober 2013 Tanggal Pengumpulan
LAPORAN KIMIA ANALITIK KI 3121 Percobaan modul 2 PENETAPAN ANION FOSFAT DALAM AIR Nama : Imana Mamizar NIM : 10511066 Kelompok : 5 Nama Asisten : Rizki Tanggal Percobaan : 25 Oktober 2013 Tanggal Pengumpulan
BAB IV HASIL PENELITIAN DAN PEMBAHASAN. Paguyaman yang berhubungan dengan materi laju reaksi diberikan dalam Tabel 2 berikut.
 BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Hasil Penelitian Dari hasil penelitian diperoleh presentase jawaban siswa kelas XI SMA Negeri 1 Paguyaman yang berhubungan dengan materi laju reaksi diberikan
BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Hasil Penelitian Dari hasil penelitian diperoleh presentase jawaban siswa kelas XI SMA Negeri 1 Paguyaman yang berhubungan dengan materi laju reaksi diberikan
RENCANA PELAKSANAAN PEMBELAJARAN (RPP) KELAS EKSPERIMEN PERTEMUAN KE-1
 RENCANA PELAKSANAAN PEMBELAJARAN (RPP) KELAS EKSPERIMEN PERTEMUAN KE-1 Sekolah : SMAN 3 Tangerang Selatan Mata Pelajaran : Kimia Kelas/ Semester : XI/ I Tahun Pelajaran : 010/011 Pokok Bahasan : Laju Reaksi
RENCANA PELAKSANAAN PEMBELAJARAN (RPP) KELAS EKSPERIMEN PERTEMUAN KE-1 Sekolah : SMAN 3 Tangerang Selatan Mata Pelajaran : Kimia Kelas/ Semester : XI/ I Tahun Pelajaran : 010/011 Pokok Bahasan : Laju Reaksi
LAPORAN KIMIA ANALITIK KI-2221
 LAPORAN KIMIA ANALITIK KI-2221 Percobaan 5 EKSTRAKSI PELARUT Nama : Nisrina Rizkia NIM : 10510002 Kelompok : 1 Tanggal Percobaan : 20 Maret 2012 Tanggal Laporan : 27 Maret 2012 Asisten Praktikum : Ka Elsi
LAPORAN KIMIA ANALITIK KI-2221 Percobaan 5 EKSTRAKSI PELARUT Nama : Nisrina Rizkia NIM : 10510002 Kelompok : 1 Tanggal Percobaan : 20 Maret 2012 Tanggal Laporan : 27 Maret 2012 Asisten Praktikum : Ka Elsi
1. Dapat mengerti prinsip-prinsip dasar mengenai teknik spektrofotometri (yaitu prinsip dasar
 LAPORAN PRAKTIKUM III PRAKTIKUM METABOLISME GLUKOSA, UREA DAN TRIGLISERIDA (TEKNIK SPEKTROFOTOMETRI) NAMA PRODI : IKA WARAZTUTY DAN IRA ASTUTI : MAGISTER ILMU BIOMEDIK TGL PRATIKUM : 17 MARET 2015 TUJUAN
LAPORAN PRAKTIKUM III PRAKTIKUM METABOLISME GLUKOSA, UREA DAN TRIGLISERIDA (TEKNIK SPEKTROFOTOMETRI) NAMA PRODI : IKA WARAZTUTY DAN IRA ASTUTI : MAGISTER ILMU BIOMEDIK TGL PRATIKUM : 17 MARET 2015 TUJUAN
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Jenis Penelitian Penelitian ini melibatkan pengujian secara kualitatif dan kuantitatif. Pelaksanaannya dilakukan melalui beberapa tahapan yaitu tahap penyiapan sampel, tahap
BAB III METODE PENELITIAN A. Jenis Penelitian Penelitian ini melibatkan pengujian secara kualitatif dan kuantitatif. Pelaksanaannya dilakukan melalui beberapa tahapan yaitu tahap penyiapan sampel, tahap
PERCOBAAN 3 PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI
 LAPORAN PRAKTIKUM KIMIA FISIKA Nama : Any Kurniawati Kelompok : 6 NIM : 4301410009 Prodi/Jurusan : Pend. Kimia/Kimia Dosen : Ir. Sri Wahyuni, M.Si Tanggal Praktikum : 19 September 2012 Teman kerja : Fitriya
LAPORAN PRAKTIKUM KIMIA FISIKA Nama : Any Kurniawati Kelompok : 6 NIM : 4301410009 Prodi/Jurusan : Pend. Kimia/Kimia Dosen : Ir. Sri Wahyuni, M.Si Tanggal Praktikum : 19 September 2012 Teman kerja : Fitriya
Laporan Praktikum Kimia Laju Reaksi
 Laporan Praktikum Kimia Laju Reaksi Oleh: 1. Kurniawan Eka Yuda (5) 2. Tri Puji Lestari (23) 3. Rina Puspitasari (17) 4. Elva Alvivah Almas (11) 5. Rusti Nur Anggraeni (35) 6. Eki Aisyah (29) Kelas XI
Laporan Praktikum Kimia Laju Reaksi Oleh: 1. Kurniawan Eka Yuda (5) 2. Tri Puji Lestari (23) 3. Rina Puspitasari (17) 4. Elva Alvivah Almas (11) 5. Rusti Nur Anggraeni (35) 6. Eki Aisyah (29) Kelas XI
PENENTUAN RUMUS ION KOMPLEKS BESI DENGAN ASAM SALISILAT
 PENENTUAN RUMUS ION KOMPLEKS BESI DENGAN ASAM SALISILAT Desi Eka Martuti, Suci Amalsari, Siti Nurul Handini., Nurul Aini Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Jenderal
PENENTUAN RUMUS ION KOMPLEKS BESI DENGAN ASAM SALISILAT Desi Eka Martuti, Suci Amalsari, Siti Nurul Handini., Nurul Aini Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Jenderal
LAPORAN KIMIA ANALITIK KI Percobaan modul 3 TITRASI SPEKTROFOTOMETRI
 LAPORAN KIMIA ANALITIK KI 3121 Percobaan modul 3 TITRASI SPEKTROFOTOMETRI Nama : Imana Mamizar NIM : 10511066 Kelompok : 5 Nama Asisten : Fatni Rifqiyati Tanggal Percobaan : 1 November 2013 Tanggal Pengumpulan
LAPORAN KIMIA ANALITIK KI 3121 Percobaan modul 3 TITRASI SPEKTROFOTOMETRI Nama : Imana Mamizar NIM : 10511066 Kelompok : 5 Nama Asisten : Fatni Rifqiyati Tanggal Percobaan : 1 November 2013 Tanggal Pengumpulan
H 2 O (l) H 2 O (g) Kesetimbangan kimia. N 2 O 4 (g) 2NO 2 (g)
 Purwanti Widhy H Kesetimbangan adalah suatu keadaan di mana tidak ada perubahan yang terlihat seiring berjalannya waktu. Kesetimbangan kimia tercapai jika: Laju reaksi maju dan laju reaksi balik sama besar
Purwanti Widhy H Kesetimbangan adalah suatu keadaan di mana tidak ada perubahan yang terlihat seiring berjalannya waktu. Kesetimbangan kimia tercapai jika: Laju reaksi maju dan laju reaksi balik sama besar
RENCANA PELAKSANAAN PEMBELAJARAN ( R P P )
 PEMERINTAH KOTA YOGYAKARTA DINAS PENDIDIKAN SMA NEGERI 6 YOGYAKARTA The Research School of Jogja Jalan C. Simanjuntak No Yogyakarta 55, Telepon 0 55/ Faximile 0 5660 E-mail : sman6@sman6-yogya.sch.id,
PEMERINTAH KOTA YOGYAKARTA DINAS PENDIDIKAN SMA NEGERI 6 YOGYAKARTA The Research School of Jogja Jalan C. Simanjuntak No Yogyakarta 55, Telepon 0 55/ Faximile 0 5660 E-mail : sman6@sman6-yogya.sch.id,
Laporan Resmi Praktikum Kimia Fisika III Inversi Gula
 I. JUDUL : Inversi Gula II. TANGGAL PERCOBAAN : Rabu, 14 Desember 2011 III. TUJUAN : Menentukan orde reaksi dari reaksi inversi gula menggunakan polarimeter IV. TINJAUAN PUSTAKA : Istilah laju atau kecepatan
I. JUDUL : Inversi Gula II. TANGGAL PERCOBAAN : Rabu, 14 Desember 2011 III. TUJUAN : Menentukan orde reaksi dari reaksi inversi gula menggunakan polarimeter IV. TINJAUAN PUSTAKA : Istilah laju atau kecepatan
Laboratorium Kimia SMA... Praktikum II Kelas XI IPA Semester I Tahun Pelajaran.../...
 Laboratorium Kimia SMA... Praktikum II Kelas XI IPA Semester I Tahun Pelajaran.../... Judul : Faktor-Faktor yang Mempengaruhi Laju Reaksi Praktikan : mor Absen : Kelas : Tanggal : Lembar Kegiatan Siswa
Laboratorium Kimia SMA... Praktikum II Kelas XI IPA Semester I Tahun Pelajaran.../... Judul : Faktor-Faktor yang Mempengaruhi Laju Reaksi Praktikan : mor Absen : Kelas : Tanggal : Lembar Kegiatan Siswa
LAPORAN PRAKTIKUM KIMIA ANORGANIK II PERCOBAAN IV PENENTUAN KOMPOSISI ION KOMPLEKS
 LAPORAN PRAKTIKUM KIMIA ANORGANIK II PERCOBAAN IV PENENTUAN KOMPOSISI ION KOMPLEKS DISUSUN OLEH : NAMA : FEBRINA SULISTYORINI NIM : 09/281447/PA/12402 KELOMPOK : 3 (TIGA) JURUSAN : KIMIA FAKULTAS/PRODI
LAPORAN PRAKTIKUM KIMIA ANORGANIK II PERCOBAAN IV PENENTUAN KOMPOSISI ION KOMPLEKS DISUSUN OLEH : NAMA : FEBRINA SULISTYORINI NIM : 09/281447/PA/12402 KELOMPOK : 3 (TIGA) JURUSAN : KIMIA FAKULTAS/PRODI
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian yang digunakan eksperimental. B. Tempat dan Waktu Tempat penelitian ini dilakukan di Laboratorium Kimia Fakultas Ilmu Keperawatan dan Kesehatan
BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian yang digunakan eksperimental. B. Tempat dan Waktu Tempat penelitian ini dilakukan di Laboratorium Kimia Fakultas Ilmu Keperawatan dan Kesehatan
TUGAS II REGULER C AKADEMI ANALIS KESEHATAN NASIONAL SURAKARTA TAHUN AKADEMIK 2011/2012
 TUGAS II REGULER C AKADEMI ANALIS KESEHATAN NASIONAL SURAKARTA TAHUN AKADEMIK 2011/2012 Mata Kuliah Topik Smt / Kelas Beban Kredit Dosen Pengampu Batas Pengumpulan : Kimia Analitik II : Spektrofotometri
TUGAS II REGULER C AKADEMI ANALIS KESEHATAN NASIONAL SURAKARTA TAHUN AKADEMIK 2011/2012 Mata Kuliah Topik Smt / Kelas Beban Kredit Dosen Pengampu Batas Pengumpulan : Kimia Analitik II : Spektrofotometri
KINETIKA REAKSI HIDROLISA PATI DARI KULIT NANGKA DENGAN KATALISATOR ASAM CHLORIDA MENGGUNAKAN TANGKI BERPENGADUK
 KINETIKA REAKSI HIDROLISA PATI DARI KULIT NANGKA DENGAN KATALISATOR ASAM CHLORIDA MENGGUNAKAN TANGKI BERPENGADUK Indra B.K. 1), Retno D. 2) Program Studi Teknik Kimia, Fakultas Teknologi Industri, UPN
KINETIKA REAKSI HIDROLISA PATI DARI KULIT NANGKA DENGAN KATALISATOR ASAM CHLORIDA MENGGUNAKAN TANGKI BERPENGADUK Indra B.K. 1), Retno D. 2) Program Studi Teknik Kimia, Fakultas Teknologi Industri, UPN
10 mlhcl2 M. 10 ml HCl2 M. Na 2 S 2 O 3 0,2 M KIM/ IND- II
 10 mlhcl2 M 10 ml HCl2 M 10 mlhcl2 M Na 2 S 2 O 3 0,2 M Na 2 S 2 O 3 0,2 M Na 2 S 2 O 3 0,2 M KIM/ IND- II BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL
10 mlhcl2 M 10 ml HCl2 M 10 mlhcl2 M Na 2 S 2 O 3 0,2 M Na 2 S 2 O 3 0,2 M Na 2 S 2 O 3 0,2 M KIM/ IND- II BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL
Bab III Metodologi Penelitian
 Bab III Metodologi Penelitian Penelitian ini dilakukan dalam tiga tahap yaitu, tahap isolasi kitin yang terdiri dari penghilangan protein, penghilangan mineral, tahap dua pembuatan kitosan dengan deasetilasi
Bab III Metodologi Penelitian Penelitian ini dilakukan dalam tiga tahap yaitu, tahap isolasi kitin yang terdiri dari penghilangan protein, penghilangan mineral, tahap dua pembuatan kitosan dengan deasetilasi
HALAMAN PENGESAHAN LAPORAN RESMI PRAKTIKUM KIMIA DASAR. :4. Pengaruh Konsentrasi dan Suhu Pada Laju Reaksi. 6. John Peterson Serius
 HALAMAN PENGESAHAN LAPORAN RESMI PRAKTIKUM KIMIA DASAR Nama Percobaan :4. Pengaruh Konsentrasi dan Suhu Pada Laju Reaksi Kelompok :12 (Dua Belas) Nama :1 Muhammad Dary Dzaky (1404015185) 2. Ina Subiyanti
HALAMAN PENGESAHAN LAPORAN RESMI PRAKTIKUM KIMIA DASAR Nama Percobaan :4. Pengaruh Konsentrasi dan Suhu Pada Laju Reaksi Kelompok :12 (Dua Belas) Nama :1 Muhammad Dary Dzaky (1404015185) 2. Ina Subiyanti
PENENTUAN KADAR PROTEIN SECARA SPEKTROFOTOMETRI
 K E L O M P O K 4 PENENTUAN KADAR PROTEIN SECARA SPEKTROFOTOMETRI L/O/G/O www.themegallery.com Pend. Kimia Rombel 3 1 2 Vepy Iandasari 46 Gustiyani Eka. S 48 3 4 Anggun Dwi Astiningsih 49 Nurul Anggi Ayuningtias
K E L O M P O K 4 PENENTUAN KADAR PROTEIN SECARA SPEKTROFOTOMETRI L/O/G/O www.themegallery.com Pend. Kimia Rombel 3 1 2 Vepy Iandasari 46 Gustiyani Eka. S 48 3 4 Anggun Dwi Astiningsih 49 Nurul Anggi Ayuningtias
I. TUJUAN Menentukan konstanta kecepatan reaksi dengan menggunakan polarimeter.
 I. TUJUAN Menentukan konstanta kecepatan reaksi dengan menggunakan polarimeter. II. DASAR TEORI Menurut Soekardjo (2002), polarisasi dapat dibagi menjadi dua, yaitu : 1. Polarisasi konsentrasi yang disebabkan
I. TUJUAN Menentukan konstanta kecepatan reaksi dengan menggunakan polarimeter. II. DASAR TEORI Menurut Soekardjo (2002), polarisasi dapat dibagi menjadi dua, yaitu : 1. Polarisasi konsentrasi yang disebabkan
Kinetika kimia. Shinta Rosalia Dewi
 Kinetika kimia Shinta Rosalia Dewi Pendahuluan Termodinamika Kinetika Reaksi Mekanika fluida Pindah panas neraca massa ekonomi mendesain reaktor kimia Pendahuluan (cont ) Kinetika reaksi adalah studi tentang
Kinetika kimia Shinta Rosalia Dewi Pendahuluan Termodinamika Kinetika Reaksi Mekanika fluida Pindah panas neraca massa ekonomi mendesain reaktor kimia Pendahuluan (cont ) Kinetika reaksi adalah studi tentang
Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam
 Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam sistem pada kesetimbangan Uap mengembun dengan laju
Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam sistem pada kesetimbangan Uap mengembun dengan laju
Praktikum Kimia Fisika II Hidrolisis Etil Asetat dalam Suasana Asam Lemah & Asam Kuat
 I. Judul Percobaan Hidrolisis Etil Asetat dalam Suasana Asam Lemah & dalam Suasana Asam Kuat II. Tanggal Percobaan Senin, 8 April 2013 pukul 11.00 14.00 WIB III. Tujuan Percobaan Menentukan orde reaksi
I. Judul Percobaan Hidrolisis Etil Asetat dalam Suasana Asam Lemah & dalam Suasana Asam Kuat II. Tanggal Percobaan Senin, 8 April 2013 pukul 11.00 14.00 WIB III. Tujuan Percobaan Menentukan orde reaksi
Tabel 4. Hubungan antara berbagai tingkat kejenuhan ammonium sulfat (0-100%) dengan aktivitas unit enzim selulase. No Fraksi Aktivitas Unit (U/mL)
 62 Lampiran 1. Tabel 4. Hubungan antara berbagai tingkat kejenuhan ammonium sulfat (0-100% dengan aktivitas unit enzim selulase Fraksi Aktivitas Unit (U/mL 1 2 3 4 5 0-20 % 20-40 % 40-60 % 60-80 % 80-100
62 Lampiran 1. Tabel 4. Hubungan antara berbagai tingkat kejenuhan ammonium sulfat (0-100% dengan aktivitas unit enzim selulase Fraksi Aktivitas Unit (U/mL 1 2 3 4 5 0-20 % 20-40 % 40-60 % 60-80 % 80-100
A. Judul B. Tujuan C. Dasar Teori
 PERCOBAAN III A. Judul : Penetapan Besi secara Spektrofotometri B. Tujuan : dapat menetapkan kandungan besi dalam suatu sampel dengan teknik kurva kalibrasi biasa dan teknik standar adisi. C. Dasar Teori
PERCOBAAN III A. Judul : Penetapan Besi secara Spektrofotometri B. Tujuan : dapat menetapkan kandungan besi dalam suatu sampel dengan teknik kurva kalibrasi biasa dan teknik standar adisi. C. Dasar Teori
ACARA IV PERCOBAAN DASAR ALAT SPEKTROFOTOMETER SERAPAN ATOM
 ACARA IV PERCOBAAN DASAR ALAT SPEKTROFOTOMETER SERAPAN ATOM A. PELAKSANAAN PRAKTIKUM 1. Tujuan Praktikum a. Percobaan dasar spektrofotometri serapan atom. b. Penentuan konsentrasi sampel dengan alat spektrofotometri
ACARA IV PERCOBAAN DASAR ALAT SPEKTROFOTOMETER SERAPAN ATOM A. PELAKSANAAN PRAKTIKUM 1. Tujuan Praktikum a. Percobaan dasar spektrofotometri serapan atom. b. Penentuan konsentrasi sampel dengan alat spektrofotometri
kimia ASAM-BASA III Tujuan Pembelajaran
 KTSP K-13 kimia K e l a s XI ASAM-BASA III Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami mekanisme reaksi asam-basa. 2. Memahami stoikiometri
KTSP K-13 kimia K e l a s XI ASAM-BASA III Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami mekanisme reaksi asam-basa. 2. Memahami stoikiometri
A. D. Rosalia, et al., ALCHEMY jurnal penelitian kimia, vol. 11 (2015), no. 1, hal
 KAJIAN EMPIRIS MEKANISME REAKSI HIDROGEN PEROKSIDA DENGAN IODIDA PADA SUASANA ASAM (AN EMPIRICAL STUDY ON THE HYDROGEN PEROXIDE REACTION WITH IODIDE IN ACID CONDITION) Ayuni Dita Rosalia, Patiha, Eddy
KAJIAN EMPIRIS MEKANISME REAKSI HIDROGEN PEROKSIDA DENGAN IODIDA PADA SUASANA ASAM (AN EMPIRICAL STUDY ON THE HYDROGEN PEROXIDE REACTION WITH IODIDE IN ACID CONDITION) Ayuni Dita Rosalia, Patiha, Eddy
MENYARING DAN MENDEKANTASI
 MENYARING DAN MENDEKANTASI MENYARING - Menyaring adalah suatu proses dimana partikelpartikel dipisahkan dari cairan dengan melewatkan cairan melalui bahan permeabel (kertas saring,dll). - Endapan : suatu
MENYARING DAN MENDEKANTASI MENYARING - Menyaring adalah suatu proses dimana partikelpartikel dipisahkan dari cairan dengan melewatkan cairan melalui bahan permeabel (kertas saring,dll). - Endapan : suatu
Jason Mandela's Lab Report
 LAPORAN PRAKTIKUM KIMIA FISIK I PERCOBAAN-4 KINETIKA ADSORPSI Disusun Oleh: Nama : Jason Mandela NIM :2014/365675/PA/16132 Partner : - Dwi Ratih Purwaningsih - Krisfian Tata AP - E Devina S - Fajar Sidiq
LAPORAN PRAKTIKUM KIMIA FISIK I PERCOBAAN-4 KINETIKA ADSORPSI Disusun Oleh: Nama : Jason Mandela NIM :2014/365675/PA/16132 Partner : - Dwi Ratih Purwaningsih - Krisfian Tata AP - E Devina S - Fajar Sidiq
III. BAHAN DAN METODE. Penelitian ini dilaksanakan di Laboratorium Analisis Hasil Pertanian (Ruang
 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Analisis Hasil Pertanian (Ruang Analisis Pati dan Karbohidrat), Laboratorium Pengolahan Hasil Pertanian,
III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Analisis Hasil Pertanian (Ruang Analisis Pati dan Karbohidrat), Laboratorium Pengolahan Hasil Pertanian,
Soal Soal Kesetimbangan Kimia. Proses Haber-Bosch merupakan proses pembentukan atau produksi ammonia berdasarkan reaksi:
 Nama : Fitria Puspita NIM : 1201760 Kelas : Pendidikan Kimia A Soal Soal Kesetimbangan Kimia SBMPTN 2014 Untuk soal no 1-3, bacalah narasi berikut. Proses Haber-Bosch merupakan proses pembentukan atau
Nama : Fitria Puspita NIM : 1201760 Kelas : Pendidikan Kimia A Soal Soal Kesetimbangan Kimia SBMPTN 2014 Untuk soal no 1-3, bacalah narasi berikut. Proses Haber-Bosch merupakan proses pembentukan atau
Kesetimbangan Kimia KIM 2 A. PENDAHULUAN B. REAKSI KESETIMBANGAN. α = KESETIMBANGAN KIMIA. materi78.co.nr. setimbang
 konsentrasi laju reaksi materi78.co.nr Kesetimbangan Kimia A. PENDAHULUAN Reaksi satu arah (irreversible) atau reaksi tidak dapat balik adalah reaksi yang terjadi pada satu arah, dan produknya tidak dapat
konsentrasi laju reaksi materi78.co.nr Kesetimbangan Kimia A. PENDAHULUAN Reaksi satu arah (irreversible) atau reaksi tidak dapat balik adalah reaksi yang terjadi pada satu arah, dan produknya tidak dapat
SILABUS Sekolah : SMA Negeri 5 Surabaya Mata Pelajaran : Kimia Kelas/semester : XI/1 Referensi : BSNP / CIE Standar Kompetensi
 SILABUS Sekolah : SMA Negeri 5 Surabaya Mata Pelajaran : Kimia Kelas/semester : /1 Referensi : BSNP / CIE Standar Kompetensi : 1.Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur
SILABUS Sekolah : SMA Negeri 5 Surabaya Mata Pelajaran : Kimia Kelas/semester : /1 Referensi : BSNP / CIE Standar Kompetensi : 1.Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur
Bahasan: Mempelajari kecepatan/laju reaksi suatu proses/perubahan kimia. reaksi berlangsung mekanisme reaksi
 Mempelajari kecepatan/laju reaksi suatu proses/perubahan kimia. Kinetika juga mempelajari bagaimana reaksi berlangsung mekanisme reaksi Referensi: Brown et.al; Chemistry, The Central Science, 11th edition
Mempelajari kecepatan/laju reaksi suatu proses/perubahan kimia. Kinetika juga mempelajari bagaimana reaksi berlangsung mekanisme reaksi Referensi: Brown et.al; Chemistry, The Central Science, 11th edition
BAB IV HASIL DAN PEMBAHASAN. A. Hasil
 digilib.uns.ac.id BAB IV HASIL DAN PEMBAHASAN A. Hasil 1. Penentuan Panjang Gelombang Maksimum dan Absorbtivitas Molar I 3 Penentuan Panjang Gelombang Maksimum Penentuan dilakukan dengan mereaksikan KI
digilib.uns.ac.id BAB IV HASIL DAN PEMBAHASAN A. Hasil 1. Penentuan Panjang Gelombang Maksimum dan Absorbtivitas Molar I 3 Penentuan Panjang Gelombang Maksimum Penentuan dilakukan dengan mereaksikan KI
SILABUS. : 1. Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur molekul, dan sifat sifat senyawa.
 Nama Sekolah Mata Pelajaran Kelas/Semester Standar Kompetensi Alokasi Waktu SILABUS : SMA : KIMIA : XI/1 : 1. Memahami struktur atom meramalkan sifat-sifat periodik unsur, struktur molekul, dan sifat sifat
Nama Sekolah Mata Pelajaran Kelas/Semester Standar Kompetensi Alokasi Waktu SILABUS : SMA : KIMIA : XI/1 : 1. Memahami struktur atom meramalkan sifat-sifat periodik unsur, struktur molekul, dan sifat sifat
LAPORAN KIMIA ANALITIK KI3121. Percobaan 04 PENENTUAN KEKERUHAN AIR SECARA TURBIDIMETRI
 LAPORAN KIMIA ANALITIK KI3121 Percobaan 04 PENENTUAN KEKERUHAN AIR SECARA TURBIDIMETRI Nama : Agam Muarif Nim : 10510070 Kelompok : 05 Tanggal Percobaan : 09 November 2012 Tanggal Laporan : 19 November
LAPORAN KIMIA ANALITIK KI3121 Percobaan 04 PENENTUAN KEKERUHAN AIR SECARA TURBIDIMETRI Nama : Agam Muarif Nim : 10510070 Kelompok : 05 Tanggal Percobaan : 09 November 2012 Tanggal Laporan : 19 November
HUBUNGAN ANTARA KONSENTRASI DAN TEMPERATUR TERHADAP LAJU REAKSI DAN NILAI ENERGI AKTIFASI
 HUBUNGAN ANTARA KONSENTRASI DAN TEMPERATUR TERHADAP LAJU REAKSI DAN NILAI ENERGI AKTIFASI Fitriyah*, Ikhsannudin, Ninda yerasetyo Lab. Kimi Dasar Jurusan Kimia Universitas Negeri Semarang Gedung D8 Lt
HUBUNGAN ANTARA KONSENTRASI DAN TEMPERATUR TERHADAP LAJU REAKSI DAN NILAI ENERGI AKTIFASI Fitriyah*, Ikhsannudin, Ninda yerasetyo Lab. Kimi Dasar Jurusan Kimia Universitas Negeri Semarang Gedung D8 Lt
LAPORAN PRAKTIKUM PERCOBAAN PRAKTKUM 1 LAJU REAKSI
 LAPORAN PRAKTIKUM PERCOBAAN PRAKTKUM 1 LAJU REAKSI DOSEN PENGAMPU : ANDI HIMYATUL HIDAYAH, S.Si.,Apt. DISUSUSN OLEH : FILDZAH MAULIDA NIM. 37.2016.7.1.81454 PROGRAM STUDI FARMASI FAKULTAS ILMU KESEHATAN
LAPORAN PRAKTIKUM PERCOBAAN PRAKTKUM 1 LAJU REAKSI DOSEN PENGAMPU : ANDI HIMYATUL HIDAYAH, S.Si.,Apt. DISUSUSN OLEH : FILDZAH MAULIDA NIM. 37.2016.7.1.81454 PROGRAM STUDI FARMASI FAKULTAS ILMU KESEHATAN
LAMPIRAN. 2. Tabel penentuan konsentrasi dan kadar pada beda variable pelarut Sampel Panjang Gelombang Absorbansi Konsentrasi Kadar (%)
 LMPIRN 1. Tabel penentuan panjang gelombang maksimal PanjangGelombang (nm) bsorbansi 595 1,300 600 1,6 605 1,156 610 1,136 615 1,06. Tabel penentuan konsentrasi dan kadar pada beda variable pelarut Sampel
LMPIRN 1. Tabel penentuan panjang gelombang maksimal PanjangGelombang (nm) bsorbansi 595 1,300 600 1,6 605 1,156 610 1,136 615 1,06. Tabel penentuan konsentrasi dan kadar pada beda variable pelarut Sampel
