AUTENTIKASI PRODUK TUNA (Thunnus sp.) KALENG DENGAN METODE POLYMERASE CHAIN REACTION FERRY RABITO LUHUR
|
|
|
- Sri Leony Hartono
- 6 tahun lalu
- Tontonan:
Transkripsi
1 AUTENTIKASI PRODUK TUNA (Thunnus sp.) KALENG DENGAN METODE POLYMERASE CHAIN REACTION FERRY RABITO LUHUR DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR BOGOR 2010
2 RINGKASAN FERRY RABITO LUHUR. C Autentikasi Produk Tuna (Thunnus sp) Kaleng dengan Metode Polymerase Chain Reaction. Dibimbing oleh ASADATUN ABDULLAH, NURJANAH dan LAKSMI AMBARSARI. Autentikasi bahan pangan merupakan salah satu tantangan bagi para pelaku bisnis pangan, termasuk pangan perikanan. Autentikasi konvensional berbasis morfologi memiliki kekurangan utama berupa ketergantungan akan kehadiran ahli dan kelengkapan morfologi dari ikan itu sendiri. Kelengkapan morfologi ikan dari pangan olahan tidak lagi utuh karena telah mengalami proses sterilisasi komersial, misalnya pada produk tuna dalam kaleng. Analisis berbasis protein juga memiliki kekurangan karena proses denaturasi protein selama pemasakan dan sterilisasi yang menyebabkan perubahan pada profil protein yang hendak diamati. Salah satu cara untuk dapat mengindentifikasi spesies yang telah mengalami perubahan bentuk dan denaturasi protein yang diakibatkan oleh proses fisika dan kimia adalah PCR-sequencing. Polymerase chain reaction dilakukan untuk mengamplifikasi gen cyt-b DNA mitokondria. Gen cyt-b dari DNA mitokondria digunakan dalam penelitian ini karena beberapa kelebihan yang dimiliki, yaitu bentuknya yang sirkular relatif lebih resisten terhadap suhu tinggi, kelimpahannya dalam sel tinggi, mengikuti garis keturunan ibu, tidak mengalami rekombinasi, tingkat mutasi sangat tinggi sehingga dapat digunakan untuk studi filogenetik. DNA empat spesies tuna segar dan tuna kaleng dapat diekstraksi menggunakan metode CTAB. DNA hasil ekstraksi kemudian diamplifikasi dengan menggunakan primer fishcytb-f dan cytb1-5r. Amplikon dari tuna segar berukuran 750 pb sedangkan pada tuna kaleng ukurannya berkurang menjadi <100 pb. Penurunan yang terjadi membuktikan bahwa DNA pada ikan tuna mengalami kerusakan akibat pengolahan suhu tinggi dan penggunaan bahan-bahan tambahan makanan. Amplikon yang diperoleh tersebut kemudian ditentukan urutan nukleotidanya dan dilakukan penjajaran dengan BLAST yang menyebutkan bahwa spesies yang ada pada empat buah tuna kaleng untuk kode TK1, TK2, TK3 DAN TK6 berturut-turut adalah: Thunnus alalunga, Thunnus obesus, Thunnus albacares dan Thunnus alalunga. Metode berbasis PCR lain yang dapat dicoba diantaranya adalah PCR-RAPD, Real Time PCR, radioactive probes dan masih banyak aplikasi tambahan yang bertujuan untuk meningkatkan efisiensi dan efektifitas dari prosedur autentikasi yang digunakan.
3 AUTENTIKASI PRODUK TUNA (Thunnus sp.) KALENG DENGAN METODE POLYMERASE CHAIN REACTION Oleh: FERRY RABITO LUHUR C Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Departemen Teknologi Hasil Perairan DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR BOGOR 2010
4 Judul Nama NRP Departemen : Autentikasi Produk Tuna (Thunnus sp.) Kaleng dengan Metode Polymerase Chain Reaction : Ferry Rabito Luhur : C : Teknologi Hasil Perairan Menyetujui, Komisi Pembimbing Pembimbing I, Pembimbing II, Asadatun Abdullah S.Pi, M.S.M, M.Si Dr. Ir. Nurjanah MS. NIP NIP Pembimbing III, Dr. Laksmi Ambarsari, MS. NIP Mengetahui, Ketua Departemen Teknologi Hasil Perairan Dr. Ir. Ruddy Suwandi, M.S, M.Phil. NIP Tanggal Pengesahan :...
5 PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI Dengan ini saya menyatakan bahwa skripsi Autentikasi Produk Tuna (Thunnus sp) Kaleng dengan Metode Polymerase Chain Reaction adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi atau kutipan yang berasal dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini. Bogor, Juli 2010 Ferry Rabito Luhur C
6 KATA PENGANTAR Puji syukur ke hadirat Allah yang telah memberikan rahmat-nya sehingga skripsi dengan judul Autentikasi Produk Tuna (Thunnus sp.) Kaleng dengan Metode Polymerase Chain Reaction ini dapat diselesaikan sebagai salah satu syarat untuk mendapatkan Gelar Sarjana di Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu selama penulis melakukan penelitian dan penyusunan skripsi. Pada kesempatan ini, penulis mengucapkan terima kasih kepada: 1. Ibu Asadatun Abdullah S.Pi, M.S.M, M.Si, selaku dosen pembimbing skripsi atas segala bimbingan dalam penyusunan skripsi serta memberikan kesempatan kepada penulis untuk ikut serta dalam program Hibah Kompetitif Sesuai Prioritas Nasional Ibu Dr. Ir. Nurjanah MS. dan Ibu Dr. Laksmi Ambarsari MS. selaku dosen pembimbing skripsi yang memberikan arahan dan masukan serta nasihat kepada penulis. 3. Bapak Dr. Ir. Agoes M. Jacoeb, MS. selaku dosen penguji skripsi yang memberikan arahan dan masukan kepada penulis untuk perbaikan skripsi. 4. Bapak Dr. Ruddy Suwandi MS, M.Phil selaku ketua Departemen Teknologi Hasil Perairan. 5. Ibu Dr. Ir. Sri Purwaningsih, M.Si selaku dosen pembimbing akademik yang telah dengan sabar membimbing dan mendukung penulis. 6. Segenap dosen Departemen Teknologi Hasil Perairan atas ilmu dan nasihat hidup yang telah diberikan kepada penulis. 7. Papa, Mama, Freddy, Frans dan Faldy untuk doa dan dukungannya. 8. Mbak Wiwit, Nanda, Nanang, Fathu, Fadil dan Indah atas kerjasama yang sangat menyenangkan. 9. Teman-teman kost Perwira 51, Bata Merah, dan Wisma Fio udah menemani tinggal seatap. 10. Mkst erz: Daniel, Jus, Adit, Rio, Wendhy, Glen, Gana dan Bayang untuk suka duka dan segala keributannya.
7 11. Teman-teman Kemaki dan Tim Pendamping untuk kekeluargaannya. 12. Febriani, untuk segala suka duka yang dilewati bersama. 13. Teman-teman THP 43 yang saya banggakan dan selalu di hati. 14. Teman-teman THP 40,41,42,44, dan 45 untuk kebersamaannya. 15. Semua orang yang mendukung saya yang tidak dapat disebutkan satu per satu. Adapun tujuan dari peyusunan skripsi ini adalah sebagai syarat kelulusan program sarjana Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Penulis menyadari masih terdapat banyak kekurangan dalam penyusunan skripsi ini, oleh karena itu penulis sangat mengharapkan kritik dan saran dari semua pihak, sehingga penelitian ini dapat dikembangkan dengan baik di kemudian hari dan bermanfaat bagi banyak pihak. Bogor, 25 Juli 2010 Penulis
8 RIWAYAT HIDUP Penulis dilahirkan di Cirebon, Jawa Barat pada tanggal 22 Januari Penulis merupakan anak kesatu dari empat bersaudara dari pasangan Theo Chandra Luhur dan Elisa Chandra Luhur. Penulis memulai jenjang pendidikan formal di SD. Santa Maria Cirebon ( ), selanjutnya penulis melanjutkan pendidikannya di SLTP. Santa Maria Cirebon ( ). Pendidikan menengah atas ditempuh penulis di SMA Pangudi Luhur van Lith Muntilan ( ). Pada tahun 2006, penulis diterima di Institut Pertanian Bogor melalui jalur SPMB (Seleksi Penerimaan Mahasiswa Baru) dan pada tahun 2007 penulis diterima di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Selama masa perkuliahan, penulis aktif dalam berbagai organisasi kemahasiswaan seperti Himpunan Mahasiswa Teknologi Hasil Perikanan (Himasilkan) sebagai anggota divisi kewirausahaan periode Penulis mengambil mata kuliah Genetika Dasar, Biologi Molekuler dan Genetika Pemuliaan Tanaman sebagai supporting course (SC) untuk mendukung penelitian yang dilakukan. Penulis aktif sebagai panitia pada berbagai kegiatan kemahasiswaan di Institut Pertanian Bogor. Selain itu, penulis juga pernah mengikuti Seminar dan pelatihan ISO 22000:2005 yang diadakan di Institut Pertanian Bogor. Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, penulis melakukan penelitian dengan judul Autentikasi Produk Tuna (Thunnus sp) Kaleng dengan Metode Polymerase Chain Reaction dibawah bimbingan Asadatun Abdullah, S.Pi, M.S.M, M.Si, Dr. Ir. Nurjanah, MS. dan Dr. Laksmi Ambarsari, MS.
9 DAFTAR ISI DAFTAR TABEL... DAFTAR GAMBAR... DAFTAR LAMPIRAN... Halaman 1 PENDAHULUAN 1.1 Latar Belakang Tujuan TINJAUAN PUSTAKA 2.1 Deskripsi dan Klasifikasi Ikan Tuna Ikan Tuna dalam Kaleng Autentikasi Bahan Baku DNA Gen Sitokrom-b pada DNA mitokondria METODOLOGI 3.1 Waktu dan Tempat Bahan dan Alat Tahapan Penelitian HASIL DAN PEMBAHASAN 5.1 Karakteristik Bahan Baku Hasil Ekstraksi DNA Amplikon Gen Cyt-b dari DNA Mitokondria Urutan Nukleotida dan Hasil Penjajaran DNA KESIMPULAN DAN SARAN 6.1 Kesimpulan Saran DAFTAR PUSTAKA LAMPIRAN viii ix x
10 DAFTAR TABEL No Teks Halaman 1 Informasi metode autentikasi dan target molekulnya Hasil sekuensing spesies ikan tuna Hasil sekuensing spesies ikan tuna kaleng... 26
11 11 DAFTAR GAMBAR No Teks Halaman 1 Struktur DNA Gen sitokrom-b pada DNA mitokondria Koleksi sampel penelitian Diagram alir tahapan penelitian Siklus PCR Elektroforegram DNA genom tuna segar Elektroforegram DNA genom tuna kaleng Elektroforegram amplikon cyt-b tuna segar Elektroforegram amplikon cyt-b tuna kaleng... 23
12 DAFTAR LAMPIRAN No Halaman 1 Alat yang digunakan saat penelitian Metode pembuatan larutan Diagram alir ekstraksi DNA dengan metode CTAB... 34
13 1 PENDAHULUAN 1.1 Latar Belakang Ikan tuna (Thunnus sp.) merupakan salah satu komoditas ekonomis penting perikanan baik di pasar global maupun di Indonesia. FAO (2005) menyatakan bahwa ikan golongan scombroid sejauh ini menjadi salah satu komoditas paling ekonomis di dunia. Hal ini dibuktikan dengan jumlah total ekspor tuna dunia pada tahun 2008 yang mencapai angka 7,5 miliar US$ (Josupeit 2010). Indonesia sebagai salah satu negara eksportir tuna mengekspor sebesar ton pada tahun 2005, dan pada tahun 2009 mengalami peningkatan menjadi ton (BRKP 2009). Peningkatan jumlah tersebut juga disebabkan meningkatnya permintaan pasar, bukan hanya untuk produk segar, melainkan juga untuk produk olahannya seperti tuna loin, tuna fillet, hingga tuna dalam kaleng. Produk tuna dalam kaleng mengalami peningkatan permintaan terkait dengan gaya hidup serba cepat dan produktif yang membutuhkan makanan yang relatif cepat, mudah disiapkan, mudah disimpan dan tahan lama. Daya tahan produk tuna kaleng sendiri didapat dari proses sterilisasi komersial yang menyebabkan mikroba dalam makanan kaleng tidak dapat hidup dan berkembang biak (Winarno 2004). Sterilisasi yang mengandalkan suhu tinggi tentu saja mengubah bentuk bahan baku tuna yang digunakan baik secara fisik maupun kimia. Perubahan bentuk ini dapat menyebabkan kesulitan dalam autentikasi bahan baku. Autentikasi bahan baku tuna dalam kaleng sangat penting dilakukan terkait dengan pelabelan dan penilaian harga. Tuna merupakan produk yang menjadi salah satu target dari kecurangan dagang (economical fraud), yang disebut juga aliud pro alio, dimana spesies mahal, digantikan dengan yang lebih murah (Colombo et al. 2005). Autentikasi yang umumnya menggunakan identifikasi fisik, melalui pengamatan morfologi dan morfometrik, atau identifikasi protein, dengan elektroforesis protein, tidak dapat lagi digunakan karena ikan sudah dipreparasi sedemikian hingga bentuknya tidak utuh lagi dan proteinnya sudah mengalami
14 denaturasi akibat pengolahan dengan suhu tinggi, begitu juga dengan DNA, namun teknik amplifikasi fragmen-fragmen DNA telah berhasil dikembangkan (Mackie et al. 1999). Hal inilah yang dapat digunakan sebagai solusi untuk melakukan proses autentifikasi tuna dalam kaleng. Autentikasi tuna dalam kaleng dengan menggunakan teknik amplifikasi DNA berkembang sangat pesat di Eropa, Amerika dan beberapa negara Asia. Prinsip utama kebanyakan prosedur autentikasi yang dapat dilakukan ialah reaksi berantai polimerase atau polymerase chain reaction (PCR). PCR merupakan metode yang memanfaatkan oligonukleotida sebagai primer, prinsip thermal dan enzim sebagai perantara untuk mengamplifikasi fragmen DNA tertentu dalam suatu thermocycler (Muladno 2002). Gen yang dijadikan sebagai target pada penelitian ini adalah gen sitokromb (cyt-b) dari DNA mitokondria. Gen cyt-b dijadikan sebagai target karena beberapa kelebihan yang dimilikinya yaitu bentuk yang sirkular relatif lebih resisten terhadap suhu tinggi, kelimpahan dalam sel tinggi, mengikuti garis keturunan ibu, tidak mengalami rekombinasi dan tingkat mutasi sangat tinggi sehingga dapat digunakan untuk studi filogenetik (Baker 2000). DNA yang teramplifikasi (amplikon) akan ditentukan urutan basanya melalui sebuah proses yang disebut sequencing. Manfaat dari penelitian ini adalah mendapatkan kondisi optimal untuk metode autentikasi produk ikan tuna dalam kaleng yang menggunakan gen sitokrom-b sebagai primer dalam metode berbasis PCRsequencing. Penelitian ini diharapkan dapat mengidentifikasi spesies ikan dengan penentuan urutan basa dari amplikon yang diduga berukuran 750 pb pada ikan segar dan <123 pb pada ikan kaleng. 1.2 Tujuan Penelitian Autentikasi Produk Tuna (Thunnus sp.) Kaleng dengan Metode Polymerase Chain Reaction ini bertujuan untuk memperoleh ekstrak DNA ikan tuna segar dari perusahaan eksportir tuna dan tuna kaleng yang diperoleh dari pasar-pasar swalayan, mengamplifikasi gen sitokrom-b mitokondria, dan menentukan urutan basa dari amplikon untuk mengidentifikasi spesies ikan yang terdapat dalam makanan kaleng.
15 2 TINJAUAN PUSTAKA 2.1 Deskripsi dan Klasifikasi Ikan Tuna Tuna adalah ikan laut yang terdiri dari beberapa spesies dari famili scombridae, terutama genus Thunnus. Tuna tidak seperti kebanyakan ikan yang memiliki daging berwarna putih, daging ikan ini berwarna merah muda sampai merah tua. Hal ini karena otot tuna lebih banyak mengandung mioglobin daripada ikan lainnya. Beberapa spesies tuna yang lebih besar, misalnya tuna sirip biru (bluefin tuna), dapat menaikkan suhu darahnya di atas suhu air dengan aktifitas ototnya. Hal ini menyebabkan mereka dapat hidup di air yang lebih dingin dan dapat bertahan dalam kondisi yang beragam. Tuna adalah ikan yang memiliki nilai komersial tinggi (Anonim 2005). Ikan tuna dijual dalam beragam bentuk mulai dari tuna loin, tuna fillet, tuna steak hingga tuna kaleng. Berikut ini klasifikasi ikan tuna mata besar (Thunnus obesus), tuna sirip kuning (Thunnus albacares), tuna albacore (Thunnus alalunga), dan Southern Bluefin (Thunnus maccoyii) menurut FAO Kingdom : Animalia Phylum : Chordata Class : Actinopterygii Order : Perciformes Family : Scombridae Genus : Thunnus Spesies : Thunnus obesus Thunnus albacares Thunnus alalunga Thunnus maccoyii 2.2 Ikan Tuna dalam Kaleng Ikan tuna dalam kaleng menurut SNI adalah produk olahan hasil perikanan dengan bahan baku tuna (Thunnus sp.) segar atau beku yang mengalami perlakuan sebagai berikut: penerimaan, penyiangan,
16 pemotongan, pencucian, pengukusan, pendinginan, pembersihan, pemotongan, seleksi daging, pengisian, penimbangan, pengisian media, penutupan kaleng, sterilisasi, pendinginan, pemeraman, seleksi, pengepakan dan pengemasan. Sterilisasi merupakan titik kritis dalam tahapan produksi tuna dalam kaleng. Winarno (2004) menyatakan bahwa daya tahan produk tuna kaleng sendiri didapat dari proses sterilisasi komersial yang menyebabkan mikroba dalam makanan kaleng tidak dapat hidup dan berkembang biak pada kondisi penyimpanan normal. Sterilisasi yang mengandalkan suhu tinggi o C selama 1-1,5 jam tentu saja mengubah karakterisik fisika-kimia bahan baku tuna yang digunakan. Sifat-sifat organoleptik berupa penampakan, warna, aroma, tekstur dan rasa dari bahan baku mengalami perubahan. Komponen makromolekul didalamnya juga berubah seperti protein yang mengalami denaturasi permanen atau asam nukleat yang terdegradasi sebagian. Kondisi inilah yang menjadi tantangan dalam proses autentikasi produk olahan dalam kaleng. Tuna dalam kaleng menurut standar Codex (CODEX STAN ) terbagi menjadi empat kategori: 1. solid, potongan ikan besar dan kompak memenuhi ukuran kaleng, proporsi dari chunk atau flakes tidak boleh melebihi 18% berat kering. 2. chunk, potongan ikan tidak boleh kurang dari 1,2 cm dan bentuk otot tidak boleh hilang, proporsi potongan daging yang berukuran kurang dari 1,2 cm tidak boleh melebihi 30% berat kering. 3. flake atau flakes, campuran partikel dan potongan ikan yang berukuran kurang dari 1,2 cm tanpa kehilangan bentuk otot, proporsi potongan daging yang kurang dari 1,2 cm dapat lebih dari 30%. 4. grated atau shreded, campuran potongan ikan yang telah dimasak dan memiliki ukuran seragam, tetapi merupakan partikel yang terpisah, bukan pasta. 2.3 Autentikasi Bahan Baku Produk seafood yang beredar di pasar Eropa haruslah memiliki label yang menginformasikan jenis spesies yang digunakan, lokasi daerah penangkapan, dan kondisi perairannya. Identifikasi spesies tidaklah mungkin dilakukan secara visual
17 ketika karakteristik morfologi yang dibutuhkan untuk identifikasi yakni kepala, sirip, kulit dan tulang telah dihilangkan selama proses pengolahan. Beberapa metode dapat digunakan untuk mencegah pemalsuan terhadap konsumen dan metode yang dipilih pada umumnya berdasarkan sifat alamiah dari bahan baku produk tersebut. Pemalsuan spesies yang digunakan sebagai bahan baku merupakan suatu kegiatan penipuan dan dapat merugikan konsumen serta menurunkan tingkat keamanan pangan. Hal ini dapat dicegah melalui autentikasi spesies yang digunakan sebagai bahan baku. Autentikasi spesies merupakan elemen kunci untuk verifikasi keaslian bahan baku dan mencegah terjadinya praktek pemalsuan bahan baku. Autentikasi dilakukan karena banyaknya spesies hasil perairan yang dapat digunakan sebagai bahan baku dalam pembuatan produk perikanan (Martinez et al. 2005). Penggunaan DNA sebagai molecular marker dapat digunakan untuk mengidentifikasi spesies ikan. Kestabilan DNA dan banyaknya informasi mengenai hal tersebut, dapat dijadikan sebagai alasan untuk menggunakan teknik DNA sebagai alat mengidentifikasi spesies ikan. Metodologi analisis DNA berdasarkan pada teknologi polymerase chain reaction (PCR) (Pardo 2009). Selain itu, teknik berbasis DNA memiliki sebuah keuntungan, yaitu tidak memerlukan standar untuk setiap jaringan yang dianalisis, karena sebagian besar sel dari suatu individu memiliki DNA genom yang sama (Martinez et al. 2005). Penggunaan metode berbasis DNA difavoritkan untuk banyak prosedur autentikasi karena beberapa kelebihan yang dimilikinya. Pertama, DNA merupakan molekul stabil dan awet yang dapat diperoleh dari bahan biologis dalam kondisi tertekan, misalnya pemrosesan makanan. Kedua, DNA dapat ditemukan pada semua jaringan atau larutan biologis yang mengandung inti sel atau sel tak berinti misalnya plastida dan/atau mitokondria, dapat juga diperoleh dari substrat-substrat biologis misalnya air liur, kotoran, biji tanaman, susu dan lain-lain. Ketiga, DNA dapat memberikan informasi yang lebih memadai daripada protein setelah mengalami degenerasi materi genetik dan kehadiran dari kehadiran sejumlah besar fragmen non-coding (Pereira et al. 2008). Adapun beberapa
18 metode yang dapat digunakan untuk autentikasi bahan baku disajikan pada Tabel 1. Tabel 1. Informasi Metode Autentikasi dan Target Molekulnya Informasi Identifikasi spesies Sumber: Martinez et al. (2005) Analisis 13 C, 2 H, 1 H NMR Elektroforesis SDS-PAGE IEF 2D-elektroforesis Immunological techniques: Blot hybridization ELISA Immunohistochemistry PCR, elektroforesis, hybridizations Molekul yang Dianalisis Lipid Protein Protein DNA Tipe Analisis Fingerprints Fingerprints Target recognition Fingerprint: RAPD RFLP dan probe hybridization Fingerprint-target recognition (with consensus sequencing) PCR-RFLP PCR-SSCP Sequencing Single nucleotide polymorphisms Target recognition: Species-specific sequences 2.4 DNA Deoxyribose Nucleic Acid (DNA) merupakan komponen yang berperan dalam menentukan sifat-sifat organisme. Pengaturan tersebut dilakukan DNA dengan mengendalikan pembentukan rantai protein, baik protein struktural (untuk pertumbuhan) maupun fungional (misalnya hormon dan enzim). Selain itu, DNA juga berperan dalam pewarisan sifat dari satu generasi ke genersi berikutnya karena mengandung materi-materi genetik (Jusuf 2001). Gambar struktur DNA disajikan pada Gambar 1.
19 Gambar 1 Struktur DNA Sumber: Azrael (2008) DNA disusun oleh banyak nukleotida (polinukleotida), dimana nukleotida itu sendiri terdiri dari gula deoksiribosa, basa nitrogen (Purin: Adenin (A), Guanin (G) dan Pirimidin: Timin (T), Sitosin (C) (Campbell 2002). DNA dari satu makhluk hidup satu dengan makhluk hidup lainnya memiliki susunan basa dan atau panjang yang berbeda satu sama lain, termasuk dalam suatu spesies. Sifat inilah yang mendasari kegiatan autentikasi produk ikan tuna baik yang segar maupun olahan untuk menilik kesesuaian claim pada label dengan keaslian bahan yang digunakan. DNA dapat diekstraksi dari hampir semua bagian tubuh organisme yang diamati, termasuk dari jaringan ototnya. Ekstraksi DNA dari sampel merupakan langkah pertama yang paling penting dalam pengembangan metode analisis DNA. Sebagian besar protokol dan kit komersial dapat digunakan untuk ekstraksi DNA (Pardo 2009). Permasalahan yang kemudian timbul adalah jenis metode yang digunakan untuk menjamin kualitas dan kuantitas DNA yang diekstrak dari tuna kaleng. Hal itu dikarenakan DNA mengalami degradasi selama proses pemasakan dan sterilisasi, ditambah penggunaan beberapa macam larutan yang juga memainkan peranan dalam proses degradasi DNA (Bauer et al. 2003). Prinsip dari ekstraksi DNA secara umum adalah melisiskan sel dan secara halus memisahkan protein dan komponen selular lainnya sehingga DNA dapat diperoleh secara utuh dan dengan kemurnian yang tinggi (Baker 2000).
20 2.5 Gen Cyt-b pada DNA Mitokodria DNA pada organisme eukariot tidak hanya terdapat pada nukleus atau tepatnya kromosom, tetapi juga terdapat pada sitoplasma, yaitu mitokondria atau plastida (pada tumbuhan). DNA yang tidak terdapat di dalam nukleus sering disebut DNA ekstranukleus atau DNA sitoplasmik. Penelitian ini menggunakan gen sitokrom-b (cyt-b) pada DNA mitokondria. Sitokrom ialah protein mengandung besi dengan gugus prostetik (disebut heme) yang mempunyai empat cincin organik yang mengelilingi besi tunggal tersebut dan merupakan salah satu komponen penyusun rantai transpor elektron pada mitokondria (Campbell 2002). DNA mitokondria sering digunakan dalam studi filogenetik karena tidak mengalami proses rekombinasi seperti pada DNA inti. Ilustrasi gen sitokrom-b dalam DNA mitokondria disajikan dalam Gambar 2. Gambar 2 Gen sitokrom-b dalam DNA mitokondria Sumber: University of Leicester (2009)
21 3 METODOLOGI 3.1 Waktu dan Tempat Penelitian Autentikasi Bahan Baku Ikan Tuna (Thunnus sp.) dalam Rangka Peningkatan Keamanan Pangan dengan Metode Berbasis DNA dilaksanakan pada bulan Januari sampai dengan Mei 2010 dan bertempat di Laboratorium Karakteristik Bahan Baku Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Laboratorium Penelitian Biokimia, Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, dan Laboratorium Penyakit Hewan, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. 3.2 Bahan dan Alat Bahan utama yang digunakan pada penelitian ini adalah steak ikan tuna (Thunnus obesus, T. alalunga, T. macoyyi, T. albacares) dalam bentuk steak. Produk tuna dalam kaleng berbagai merek yang diperdagangkan di pasar lokal dan swalayan di Bogor. Gambar tuna secara utuh, tuna steak dan contoh tuna kaleng yang digunakan sebagai bahan baku penelitian disajikan pada Gambar 3. Bahan yang digunakan pada preparasi bahan baku antara lain nitrogen cair sedangkan alat yang digunakan adalah talenan, plastik, aluminium foil, kertas label lalu tempat penyimpanan dingin (freezer). Alat yang digunakan pada ekstraksi DNA menggunakan metode CTAB antara lain mortar dan penggerus steril, wadah es batu, ice maker, tabung mikro 1,5 ml, water bath, pipet mikro, pipette tips, sentrifuse, dan vortex. Bahan yang digunakan pada ekstraksi DNA menggunakan metode CTAB adalah ikan tuna (Thunnus sp), es batu, nitrogen cair, larutan Buffer TE, larutan lisis, kloroform, larutan presipitasi, larutan NaCl 1,2 M, etanol dingin, dan Aquabidestilata. Sedangkan alat yang digunakan antara lain tabung mikro 1,5 ml, vortex, water bath, sentrifuse, colum, dan collection tube.
22 22 a b c d e f Gambar 3 Koleksi sampel penelitian: a. Thunnus albacares, b.thunnus obesus, c. Thunnus maccoyii, d. Thunnus albacares (dalam lingkaran merah), e. Tuna segar dalam bentuk steak yang dikemas dalam wadah vacuum, f. Tuna dalam kaleng Bahan yang digunakan saat PCR adalah es batu, aquabidestilata (ddh 2 O), primer dengan fishcytb-f dengan urutan 5 ACCACCGTTGTTATTCAACTACA AGAAC 3 dan cytb1-5r : 5 GGTCTTTGAAGGAGAAGTATGGGTGGAA 3, DNA hasil ekstraksi, dan larutan mix (PCR kit commercial). Alat yang digunakan pada proses PCR antara lain pipet mikro, wadah es batu, ice maker, pipette tips, marker pen, tabung PCR 50 µl.
23 Bahan yang digunakan saat elektroforesis adalah bubuk Agarosa dan larutan Buffer TBE 1x. Alat yang digunakan pada elektroforesis antara lain casting tray, pisau bedah, seperangkat alat katoda-anoda, alat sinar UV. Bahan yang digunakan adalah gel agarosa, larutan buffer TBE, loading dye, DNA marker, ethidium bromida dan aquades. Alat yang digunakan pada pembuatan gel agarosa antara lain gelas ukur, labu ukur, timbangan digital, microwave, cetakan agar, electrophoresis comb, dan alumunium foil. Gambar alat dan contoh pembuatan larutan yang digunakan pada penelitian ini disajikan pada Lampiran 1 dan Tahapan Penelitian Penelitian ini dilakukan dalam lima tahap yaitu: preparasi dan karakterisasi label sampel produk perikanan, penentuan primer oligonukleotida spesifik gen cyt-b tuna, isolasi/ektraksi total genom (DNA), optimasi metode autentikasi label berbasis DNA dengan PCR simpleks, penentuan urutan nukleotida dan penjajaran produk hasil PCR (amplikon) dengan Gene Bank. Adapun diagram alir tahapantahapan pada penelitian ini dapat dilihat pada Gambar Koleksi Sampel Ikan tuna (Thunnus sp.) yang digunakan pada penelitian ini berasal dari PT. Lautan Bahari Sejahtera, Muara Baru, Jakarta Utara, PT. Perikanan Nusantara, Benoa, Bali dan pasar swalayan daerah Bogor. Produk tuna dalam kaleng diperoleh dari pasar swalayan di Bogor Metode Ekstraksi DNA CTAB Ekstraksi DNA menggunakan CTAB diawali dengan melisis jaringan menggunakan nitrogen cair yang selanjutnya dilakukan penambahan larutan CTAB 500 µl. Sampel yang digunakan sebanyak 0,1-0,5 gram, dan padanya ditambahkan 14 µl proteinase K, diinkubasi pada suhu 55 o C selama dua jam dan disentrifuse selama sepuluh menit pada rpm (rotation per minute). Sampel yang telah disentrifuse diberi 500 µl PCI, dikocok sekitar lima menit agar larutan tercampur, kemudian disentrifuse selama lima menit pada rpm.
24 Larutan PCI kemudian dibuang, ditambah 400 µl kloroform isoamilalkohol dan disentrifuse selama lima menit pada rpm. Bagian yang mengandung kloroform isoamilalkohol dibuang, ditambah 600 µl isopropanol dan dipresipitasi pada suhu 4 o C selama satu malam, disentrifus selama sepuluh menit pada rpm. Bagian yang mengandung isopropanol dibuang, ditambah 500 µl etanol 70% kemudian disentrifuse selama sepuluh menit pada rpm. Bagian yang mengandung etanol dibuang dan selanjutnya dikeringkan kurang lebih selama satu jam, ditambahkan 100 µl Tris EDTA dan disimpan pada suhu 4 o C. Diagram alir proses ekstraksi DNA dengan metode CTAB disajikan pada Lampiran 3. Gambar 4 Diagram alir tahapan penelitian
25 3.3.3 Elektroforesis Elektroforesis agarose digunakan untuk mengetahui/memastikan adanya DNA setelah proses ekstraksi DNA dan untuk mengidentifikasi keberhasilan proses amplifikasi setelah PCR. Gel agorose dibuat dengan cara mensuspensikan agarose kering di dalam larutan buffer TBE 1X, merebusnya hingga larutan tersebut berwarna jernih, kemudian menuangkannya pada casting tray dan membiarkannya hingga dingin. Selama elektroforesis, gel akan terendam di dalam ruangan yang mengandung larutan buffer serta elektroda positif dan negatif. DNA yang terekstraksi akan dicampur dengan loading dye yang berguna untuk memberi warna, memudahkan pemasukan ke dalam sumur dan menambah densitas DNA. DNA yang akan dianalisis akan berjalan melewati pori-pori pada gel dengan adanya arus listrik. DNA akan bergerak ke kutub positif dan menjauhi kutub negatif karena adanya arus listrik. Gel tersebut kemudian diwarnai dengan larutan ethidium bromida, untuk selanjutnya divisualisasikan dibawah gelombang pendek sinar UV (Basit 2009) Polymerase Chain Reaction (PCR) Proses ekstraksi DNA dapat diperjelas/diperkuat dengan menggunakan polymerase chain reaction (PCR). Campuran utama pada reaksi ini terdiri dari air, buffer, dntps, primer dan Taq DNA polymerase yang telah disiapkan dalam suatu tabung, kemudian dialiquoted ke dalam tabung-tabung. Setelah itu MgCl 2 dan larutan DNA template ditambahkan (Basit 2009). Bahan-bahan tersebut telah dicampurkan dalam produk PCR mix komersial dengan merek dagang Vivantis. Sampel DNA yang telah diekstraksi (3.3.2) dipersiapkan untuk PCR sebanyak 2 µl. Bahan untuk PCR adalah 7,5 µl ddh 2 O, primer fishcytb-f dan cytb1-5r masing-masing 1,5 µl, PCR mix yang mengandung Taq polimerase dan dntp dicampur dalam tabung PCR. Aquabidestilata (ddh 2 O) berfungsi untuk melarutkan komponen PCR agar bercampur setelah itu primer baik forward maupun reverse yang berfungsi untuk proses penggandaan pada PCR, primer yang telah dimasukkan dalam tabung PCR kemudian ditambahkan DNA sebanyak 2 µl dan yang terakhir adalah PCR mix, yang terdiri dari dntp yang berfungsi agar pada proses PCR dapat membuat untai baru serta Taq polimerase.
26 Komponen yang berada pada tabung PCR dimasukkan ke thermocycler yang sebelumnya harus diatur suhu dan siklus yang akan digunakan. Siklus PCR secara garis besar dibagi menjadi lima bagian mulai dari pre-denaturation, denaturation, annealing, extension, post-extension dan preservation yang ilustrasinya disajikan pada Gambar 5. Produk PCR kemudian dapat divisualisasikan pada 1% dan 2,5% gel agarose yang telah diberi pewarna berupa larutan ethidium bromide untuk dielektroforesis, kemudian divisualisasikan di bawah gelombang pendek sinar UV. Gambar 5 Siklus PCR Penentuan Urutan Nukleotida dan Penjajaran DNA Penentuan urutan nukleotida dilakukan dengan cara mengirimkan sampel ke Macrogen Inc., Korea Selatan. Data urutan nukleotida yang diperoleh kemudian disejajarkan dengan Gene Bank menggunakan software Basic Local Alignment Search Tool (BLAST) untuk mendapatkan nama spesies tuna sebagai bahan baku produk tuna kaleng.
27 4 HASIL DAN PEMBAHASAN 4.1 Karakteristik Bahan Baku Tuna Kaleng Produk tuna kaleng merupakan salah satu makanan olahan paling penting di dunia. Gaya hidup serba cepat mendorong terjadinya peningkatan permintaan terhadap produk tuna kaleng yang berarti diikuti oleh peningkatan permintaan terhadap bahan baku. Bahan baku tuna kaleng sendiri terdiri dari beberapa spesies ikan tuna. Europe Uni Regulation 1536/92 menggolongkan tuna berikut nama dagang yang boleh dicantumkan pada label yaitu white tuna untuk albakor (Thunnus alalunga), light tuna untuk tuna sirip kuning (Thunnus albacares) dan tuna mata besar (Thunnus obesus), dan label tuna untuk ikan dari genus Thunnus lainnya serta cakalang (Katsuwonus pelamis), sementara genus Euthynnus, Sarda, dan Auxis digolongkan bukan tuna, melainkan bonito. SNI sedikit berbeda tentang persyaratan bahan baku ikan tuna dalam kaleng, menyebutkan ikan yang digunakan bahan baku tuna kaleng meliputi semua spesies dari genus Thunnus ditambah tiga spesies dari genus Euthynnus (E. affinis, E. alettaratus dan E. lincatus). Spesies tuna yang umum digunakan sebagai bahan baku tuna kaleng di Indonesia adalah tuna sirip kuning (T. albacares), albakor (T.alalunga), tuna mata besar (T. obesus) dan tuna sirip biru selatan (T. maccoyii). Pemilihan empat spesies tersebut berdasarkan pada teksur, citarasa dan ketersediaannya di perairan Indonesia. Tuna sirip biru selatan merupakan yang paling jarang digunakan karena harganya yang tinggi karena lebih banyak diekspor sebagai bahan baku alternatif tuna sirip biru (T. thynnus) untuk dibuat sushi dan sashimi. Keempat spesies tuna tersebut memiliki perbedaan tekstur dan citarasa karena komposisi daging merah dan putihnya. Potongan daging tuna mentah yang biasa dijual dalam bentuk segar atau beku biasanya berupa tuna loin atau tuna steak, sulit untuk dibedakan spesies asalnya karena telah kehilangan morfologi awalnya. Pereira et al. (2008) menyatakan bahwa kata morfologi yang digunakan dalam kajian biologi merujuk kepada tampilan dan struktur dari keseluruhan atau bagian tubuh suatu
28 organisme. Penggunaan morfologi untuk berbagai studi identifikasi ataupun taksonomi masih merupakan yang paling favorit digunakan. Kesulitan dalam identifikasi tuna loin atau tuna steak tersebut adalah pada proses preparasi, pendinginan (chilling) atau pembekuan (freezing) misalnya empat tuna steak dari empat spesies tuna yang diambil sebagai sampel, menunjukkan warna yang tidak berbeda signifikan satu sama lain. Yamashita et al. (2008) menyebutkan bahwa kemiripan dan perbedaan harga dari spesies yang berbeda mendorong terjadinya penipuan dagang berupa substitusi spesies mahal dengan yang lebih murah. Proses sterilisasi komersial yang dilakukan pada proses pembuatan produk tuna kaleng membuat bahan baku mengalami perubahan secara fisik maupun kimia. Perubahan fisik meliputi ciri organoleptik berupa warna, penampakan, tekstur, rasa dan aroma seperti terlihat pada Gambar 3e, sedangkan perubahan kimia meliputi denaturasi protein, degradasi sebagian DNA dan lain-lain. Perubahan ini menjadi tantangan tersediri untuk autentikasi bahan baku yang digunakan. Mackie et al. (1999) menyebutkan bahwa karakteristik morfologi tuna kaleng akan hilang selama filleting dan processing bahan baku. Autentikasi yang berdasar pada protein yaitu elektroforesis protein, kromatografi dan imunoassay tidak lagi sesuai untuk produk yang dikalengkan. Ketidaksesuaian tersebut karena proses pengalengan menggunakan proses panas yang menyebabkan perubahan irreversible pada protein. DNA yang diekstrak dari makanan kaleng sifatnya lebih stabil daripada protein. Kesulitan autentikasi tuna kaleng tidak hanya terdapat pada degradasi protein atau sebagian DNA-nya saja tetapi juga karena penggunaan beberapa jenis rempah-rempah dan pasta. Ram et al. (1996) menyebutkan bahwa penggunaan bahan-bahan aditif seperti rempah-rempah dan pasta dalam seafood dapat menghambat proses polymeration chain reaction (PCR) yang merupakan dasar dari beberapa metode autentikasi berbasis DNA. Tuna kaleng yang digunakan dalam penelitian ini sendiri terdiri dari berbagai merek yang menggunakan media berbeda, yaitu air, minyak, minyak kedelai, bawang bombai, saus cabai dan sambal goreng.
29 Autentikasi bahan baku di Indonesia belum menjadi perhatian utama dari instansi pemerintah yang menangani masalah standarisasi pangan. Hal ini ditunjukkan oleh tidak adanya syarat dalam SNI , tentang penanganan dan pengolahan ikan tuna dalam kaleng, untuk mencantumkan nama spesies yang digunakan sebagai bahan baku pada label kemasan tuna kaleng. Negara-negara maju yang peduli akan mutu dan keamanan pangan telah menerapkan peraturan penyebutan nama spesies bahan baku pada label kemasan. Negara Uni Eropa telah memiliki aturan EU Reg.104/2000 yang berbunyi produk perikanan dapat memasuki pasar jika menyebutkan dengan jelas nama dagang, metode produksi dan area penangkapannya. Jepang memiliki peraturan tersendiri mengenai standarisasi label pangan untuk makanan dan minuman yang dibuat oleh instansi bernama The Law Concerning Standardization and Proper Labeling of Agricultural and Forestry Products (JAS Law). Pentingnya autentikasi bahan baku bukan hanya terkait kecurangan dalam dagang (economical fraud), tetapi juga sangat berguna dalam pelestarian spesiesspesies tuna di alam. International Union for the Conservation of Nature and Natural Resources (IUCN) membuat Red List of Threatened Species (IUCN Red List) yang menyebutkan bahwa Thunnus thynnus dan T. maccoyii berstatus critically endangered, T. obesus (considered vulnerable), T. albacares (with lower risk) dan T. alalunga (included with deficient data). Penangkapan yang melebihi total tangkapan yang diperbolehkan (total allowable catches) akan membuat spesies berrstatus critically endangered semakin kritis posisinya di alam dan membuat ikan berstatus dibawahnya naik setingkat lebih kritis. Hal ini terkait dengan Illegal. Unregulated and Unreported fishing (IUU) yang tentu saja tidak mengalami pengecekan, termasuk didalamnya autentikasi. 4.2 Hasil Ekstraksi DNA Penelitian ini menggunakan metode CTAB untuk melakukan ekstraksi DNA dari jaringan ikan tuna segar maupun tuna kaleng. Larutan yang paling membedakan metode ini dari metode lainnya ialah penggunaan larutan CTAB itu sendiri. Chapela (2006) menyebutkan bahwa CTAB merupakan deterjen kationik
30 yang mengikat DNA dan membantu ekstraksi kompleks DNA-CTAB dari protein pada ekstraksi fase lipid (kloroform-air). Kekurangan utama dari metode CTAB ialah memerlukan waktu yang lebih lama dibandingkan dengan penggunaan kit komersial dan harus dilakukannya pre-treatment berupa penambahan nirogen cair dan penggerusan caringan dengan mortar sebagai langkah awal pelisisian sel secara fisik. Jaringan daging yang telah diberi nitrogen cair dan digerus diberi larutan CTAB untuk mengikat DNA. Larutan proteinase-k kemudian ditambahkan untuk mendegradasi protein (Dwiyitno 2008). Penggunaan RNase setelah proteinase-k berfungsi untuk memisahkan RNA dari DNA dan bersifat opsional, bergantung pada untuk kebutuhan apa ekstraksi DNA dilakukan. Fenol dan Kloroform dalam larutan phenol-chloroform-isoamylalkohol (PCI) berfungsi untuk membersihkan kontaminan sedangkan isoamilalkohol penting digunakan untuk mencegah terbentuknya busa pada campuran reaksi. PCI pada perbandingan P:C:I = 25:24:1 berperan sebagai lysis buffer, bekerja dengan cara memisahkan protein-lemak ke dalam fase padatan dan DNA serta gula-garam ke dalam fase cair. Larutan chloroform-isoamylalkohol (CI) ditambahkan kemudian untuk mengikat fenol yang kelak dapat menjadi kontaminan bagi DNA yang dihasilkan (Dwiyitno 2008). Hasil ekstraksi yang bertujuan mendapatkan DNA dapat dilihat menggunakan gel elektroforesis di bawah sinar UV dengan adanya pita. Hal ini bertujuan dimana hasil ekstraksi akan digunakan sebagai DNA cetakan pada proses PCR (Muladno 2002). Penambahan larutan isopropanol maupun etanol untuk mengendapkan DNA sehingga pada proses akhir ekstraksi DNA diperoleh DNA dalam bentuk pelet yang terdapat pada dasar tabung mikro. Proses ekstraksi DNA merupakan suatu langkah awal yang penting untuk mendapatkan DNA dalam kuantitas dan kualitas yang baik dimana jika kuantitas maupun kualitas DNA hasil ekstraksi tidak mencukupi atau tidak terekstraksi maka akan menjadi faktor penghambat pada proses selanjutnya, yaitu polymerase chain reaction (PCR). DNA berhasil diekstraksi dari sampel tuna segar dan tuna keleng menggunakan metode CTAB dan disajikan pada Gambar 6 serta 7. Smear yang ada nampak begitu dominan dikarenakan pada proses ekstraksi DNA tidak
31 digunakan RNAse, sehingga saat dielektroforesis pengotornya bukan hanya berupa protein atau sisa reaktan berupa fenol, tetapi juga RNA pb 1000 pb 500 pb 100 pb Gambar 6 Elektroforegram DNA genom tuna segar Keterangan: 1. Marker 100 pb 7. Thunnus albacares 2. Thunnus albacares (Bali) 8. Thunnus sp. 3. Thunnus alalunga 9. Thunnus sp. 4. Thunnus obesus 10. Marker 100 pb 5. Thunnus maccoyii konsentrasi agarose: 1% 6. Thunnus obesus (MuaraBaru) pb 1000 pb 500 pb 100 pb Gambar 7 Elektroforegram DNA genom Tuna Kaleng Keterangan: 1. Marker 100 pb 6. Tuna sambal goreng (TK5) 2. Tuna dalam air (TK1) 7. Tuna dalam air (TK6) 3. Tuna minyak kedelai (TK2) 8. Marker 100 pb 4. Tuna bawang bombai (TK3) konsentrasi agarose: 2,5% 5. Tuna dalam saus cabai (TK4) Mackie (1997) dan Quinteiro et al. (1998) menemukan fragmen DNA yang tersisa dalam tuna kaleng berukuran kurang dari 100 pasang basa, sedangkan Ram et al. (1996) menemukan bahwa DNA yang diisolasi dari spesies tuna kaleng berukuran kurang dari 123 pasang basa. Hal ini memperkuat dugaan penulis
32 bahwa ukuran DNA yang berhasil diekstraksi dari tuna kaleng berukuran sekitar 100 pasang basa. 4.3 Amplikon Gen Sitokrom-b DNA Mitokondria Amplifikasi DNA merupakan suatu langkah untuk memperbanyak kuantitas DNA dari kondisi yang tadinya berjumlah sedikit. Amplifikasi DNA dilakukan dengan suatu prosedur yang disebut polymerase chain reaction (PCR) atau reaksi berantai polimerase. DNA yang dibutuhkan untuk PCR jumlahnya sangat sedikit. Kelemahan dari teknik PCR adalah DNA yang digunakan haruslah berkualitas, jika tidak metode yang ada tidak dapat diulangi (non-reproducible). Sampel tidak boleh tercampur dengan bahan dari sumber lain atau mengandung kontaminan misalnya bakteri. Reaksi berantai polimerase (PCR) merupakan suatu proses amplifikasi secara enzimatik yang spesifik untuk menggandakan DNA (Chen dan Janes 2000). Reaksi berantai polimerase (PCR) juga dapat diartikan sebagai suatu metode enzimatis untuk melipatgandakan secara eksponensial suatu sekuens nukleotida tertentu dengan cara in vitro (Yuwono 2006). Proses PCR membutuhkan tiga syarat dasar dalam siklus PCR yaitu: denaturasi DNA cetakan, penempelan sepasang primer oligonukeotida pada DNA cetakan utas tunggal dan pemanjangan secara enzimatik untuk menghasilkan salinan (copy) DNA untuk proses siklus berikutnya. Pemilihan DNA polimerase tergantung pada kebutuhan. Beberapa macam enzim yang secara komersial dijual dapat dipilih sesuai dengan ketahanan terhadap panas, prosesivitas dan ketepatan penempelan. DNA polimerase yang umum digunakan adalah Taq DNA polimerase. DNA polimerase membutuhkan ion magnesium sebagai kofaktor dan katalis untuk reaksi pemanjangan pada suhu 72 o C. Komponen dntps terdiri dari datp, dctp, dgtp, dan dttp yang berperan sebagai pasangan basa untuk pemanjangan primer dan menyalin urutan target (Chen dan Janes 2000). Reaksi pelipatgandaan suatu fragmen DNA dimulai dengan melakukan denaturasi DNA template (cetakan) sehingga rantai DNA yang berantai ganda (double stranded) akan terpisah menjadi rantai tunggal (single stranded). Denaturasi DNA dilakukan dengan menggunakan panas pada suhu 94/95 o C
33 selama 1-2 menit, kemudian suhu diturunkan menjadi o C sehingga primer akan menempel (annealing) pada cetakan yang terpisah menjadi rantai tunggal. Proses pemanjangan secara umum terjadi pada suhu 72 o C (Chen dan Janes 2000). Penempelan primer/annealing tergantung pada suhu melting (T m ). Suhu annealing merupakan langkah yang kritis pada proses amplifikasi. Jika suhu annealing terlalu rendah akan menghasilkan amplifikasi yang tidak spesifik sedangkan jika temperatur terlalu tinggi maka tidak terjadi amplifikasi (Karusanagar et al. 1999). Penempelan yang paling baik ditentukan oleh optimasi prosedur PCR karena meskipun suhu T m dapat dihitung secara manual atau menggunakan software tertentu, angka yang didapat hanya dapat dijadikan sebagai patokan dalam memulai optimasi, jarang terjadi angka yang dihasilkan dari hitungan atau software langsung akurat. Penelitian ini menggunakan pasangan primer fishcytb-f dan cytb1-5r sebagai reverse primer yang merupakan fragmen sitokrom-b (cyt-b) yang terdapat dalam genom mitokondria ikan. Genom mitokondria mengandung molekul DNA utas ganda yang menyimpan informasi kunci subunit rantai transport elektron yang ditemukan dalam mitokondria (sumber energi bagi sel eukariot). Hampir keseluruhan spesies eukariot memiliki mitokondria. DNA mitokondria (mt-dna) pada hewan memiliki tingkat mutasi yang tinggi, berdampak pada jumlah variasi urutan yang cukup signifikan antar spesies dengan kekerabatan yang erat, hanya memiliki sedikit intron, diwariskan melalui garis keturunan ibu, menyederhanakan interpretasi dan menghilangkan bias dari pejantan (male biased gene flow), lebih mudah didapat dari DNA yang terdegradasi dan/atau berjumlah sedikit karena dalam tiap sel hanya ada satu DNA inti tetapi ada banyak salinan mt-dna (Pereira et al. 2008). PCR yang dilakukan terhadap sampel tuna segar menggunakan primer fishcytb-f sebagai forward primer dan cytb1-5r sebagai reverse primer menghasilkan amplikon berukuran 750 pasang basa. Gen cyt-b pada tuna segar yang diamplifikasi berasal dari empat spesies tuna: tuna sirip kuning (Thunnus albacares), tuna albakor (Thunnus alalunga), tuna mata besar (Thunnus obesus) dan tuna sirip biru selatan (Thunnus maccoyii). Elektroforegram amplikon cyt-b dari tuna segar disajikan pada Gambar 8.
34 pb 1000 pb 750 pb 500 pb 100 pb Gambar 8 Elektroforegram amplikon cyt-b tuna segar Keterangan: 1. Marker 100 pb 6. Thunnus obesus (MuaraBaru) 2. Thunnus albacares (Bali) 7. Thunnus albacares 3. Thunnus alalunga 8. Kontrol negatif (-) 4. Thunnus obesus 9. Marker 100 pb 5. Thunnus maccoyii konsentrasi agarose: 1% Elektroforegram menunjukan ukuran amplikon yang serupa pada empat spesies tuna segar yang berbeda. Hal ini menunjukkan bahwa DNA target dari primer fishcytb-f dan cytb1-5r pada tuna segar yang belum mengalami pemrosesan suhu tinggi seperti pemasakan dan sterilisasi pada pengalengan berukuran 750 pasang basa. Pita samar yang nampak sedikit di bawah marker 100 pb merupakan excess primer. Excess primer merupakan kelebihan primer yang tidak tepat menempel pada saat proses annealing sehingga terpisah dan terdeteksi di gel agarose. Pengolahan suhu tinggi berupa pemasakan dan sterilisasi yang diterima tuna kaleng telah mendegradasi sejumlah besar DNA ikan tuna dalam kaleng. Degradasi DNA genom yang berhasil diekstraksi tersebut tentu saja akan berimplikasi pada penurunan ukuran fragmen DNA yang akan teramplifikasi pada proses PCR. Hal ini senada dengan yang diutarakan Ram et al. (1996) bahwa implikasi dari ukuran fragmen DNA yang didapat dari proses ekstraksi yang hanya <123 pb adalah ukuran fragmen DNA yang didapat dari proses PCR tuna kaleng seharusnya < 123 pasang basa. Tuna kaleng yang digunakan dalam penelitian ini terdiri dari beberapa merek yang dijual di pasar swalayan di sekitar Bogor dengan media larutan yang
35 bervariasi dari air garam, minyak, pasta hingga sambal goreng. Primer yang digunakan untuk PCR sama dengan yang digunakan untuk mengamplifikasi gen cyt-b pada tuna segar yaitu pasangan primer fishcytb-f dan cytb1-5r. Amplikon cyt-b yang berhasil diamplifikasi dari tuna kaleng berukuran kurang dari 100 pasang basa. Penurunan ukuran target PCR dari primer tersebut sesuai dengan dugaan diatas yaitu disebabkan oleh DNA genom yang sudah terdegradasi selama proses pengalengan yang menggunakan suhu tinggi. Elektroforegram amplikon cyt-b dari tuna kaleng disajikan pada Gambar pb 1000 pb 500 pb 100 pb Gambar 9 Elektroforegram amplikon cyt-b tuna kaleng Keterangan: 1. Marker 100 pb 6. Tuna sambal goreng (TK5) 2. Tuna dalam air (TK1) 7. Tuna dalam air (TK6) 3. Tuna minyak kedelai (TK2) 8. Kontrol negatif (-) 4. Tuna bawang bombai (TK3) 9. Marker 100 pb 5. Tuna dalam saus cabai (TK4) konsentrasi agarose: 2,5% Ukuran amplikon cyt-b < 100 pasang basa sesuai dengan pendapat Mackie (1997) dan Quintero et al. (1998) yang menemukan bahwa fragmen DNA yang tersisa dalam tuna kaleng berukuran kurang dari 100 pasang basa, sedangkan Ram et al. (1996) menemukan bahwa DNA yang diisolasi dari spesies tuna kaleng berukuran kurang dari 123 pasang basa. Lin dan Hwang (2006) berhasil mengamplifikasi ukuran gen terpanjang untuk sitokrom-b mitokondria DNA tuna kaleng yaitu 126 dan 146 pasang basa. Keberhasilan amplifikasi gen cyt-b tuna kaleng ini berdasar pada kelebihan DNA yang disebutkan oleh Borgo et al. (1996) yaitu ketika DNA ditemukan dalam keadaan telah terdegradasi, amplifikasi PCR lebih sering menetapkan mt- DNA sebagai targetnya karena relatif berlimpah jumlahnya dibanding DNA inti.
36 Selain itu, mt-dna berbentuk sirkular yang secara alami memiliki resistensi yang lebih tinggi terhadap perusakan oleh panas. Pita yang dihasilkan pada elektroforegram cyt-b tuna kaleng jauh lebih tipis daripada yang dihasilkan pada tuna segar. Fenomena ini menunjukkan bahwa kualitas produk PCR pada tuna kaleng lebih rendah dibandingkan dengan tuna segar. Akane et al. (1994) dan Goodyear et al. (1993) menyatakan bahwa penggunaan bahan tambahan pangan atau proses pengalengan dapat menghasilkan sejenis inhibitor PCR. Inhibitor PCR tersebut turut serta dalam mendegradasi DNA. Ram et al. (1996) lebih pesimistis dengan menyatakan tidak semua sampel ikan kaleng berhasil diamplifikasi karena proses pengalengan dan penggunaan bahan tambahan menghalangi proses PCR, dan diduga sengaja digunakan untuk mencegah aplikasi autentikasi spesies berbasis PCR. Dugaan tersebut bisa jadi benar apabila mengamati excess primer yang ada pada produk dengan bumbu bawang bombai dan sambal goreng pada sampel tuna kaleng lebih tebal daripada excess primer yang ada pada sampel lainnya. Semakin tebal excess primer berarti penempelan primer ke gen semakin kurang optimal, itu adalah salah satu indikator bahwa ada inhibitor yang menghambat proses PCR. Peningkatan kualitas PCR produk dapat saja dilakukan dengan pemberian perlakuan sebelum dilakukan proses ekstraksi DNA yang bertujuan untuk menghilangkan residu rempah-rempah, pasta hingga minyak atau lemak yang berpotensi menurunkan kualitas DNA yang diekstraksi hingga menjadi inhibitor pada proses PCR. Chapela (2006) menyarankan perlakuan pra-ekstraksi dengan menghilangkan minyak dan lemak dari daging tuna kaleng dengan merendamnya dalam larutan kloroform:methanol:air (1:2:0,8). 4.4 Urutan Nukleotida dan Hasil Penjajaran DNA Proses sequencing merupakan suatu metode untuk memperoleh urutan nukleotida dari suatu spesies. Proses sequencing merupakan modifikasi dari replikasi DNA dimana proses ini menyediakan informasi untuk identifikasi spesies (Dwiyitno 2008).
37 Metode sequencing yang digunakan adalah metode Sanger. Prinsip metode Sanger berdasarkan pendekatan sintesis molekul DNA baru dan pemberhentian sintesis tersebut pada basa tertentu. Proses sequencing diawali dengan proses PCR yang dibagi tiga bagian yaitu denaturasi, annealing, dan elongasi. Komponen lain yang ditambahkan adalah ddntp (dideoxynucleoside triphosphate). Komponen ddntp terdiri dari komponen dideoxyadenosine, dideoxycytidine, dideoxyguanidine, dan dideoxythymidine triphosphate. Komponen ddntp yang bereaksi dengan salah satu komponen dntp maka sintesis DNA tidak dapat terjadi. Sebagai contoh jika komponen ddntp yaitu ddatp bereaksi dengan kompoenn dntp yaitu datp maka sintesis DNA akan berhenti karena tidak memiliki 3-OH yang mengakibatkan tidak terbentuknya DNA baru (Barnum 2005). Proses sintesis DNA akan berhenti dan berlangsung secara acak dimana proses pemberhentian (kodon stop) tidak bisa diatur sehingga akan menghasilkan panjang yang berbeda. Analisis autentikasi produk hasil perikanan menggunakan gen target DNA mitokondria relatif mudah dilakukan di laboratorium dan dibandingkan dengan bank data (Bossier 1999). Hasil sequencing DNA ikan tuna dapat dilihat pada Tabel 2. Tabel 2 Hasil sequencing spesies ikan tuna No Kode sampel Spesies hasil Nomor akses pencocokan BLAST NCBI Homologi 1 BL1 (Thunnus albacares) Thunnus albacares DQ % 2 BL2 (Thunnus alalunga) Thunnus alalunga GU % 3 BL3 (Thunnus obesus) Thunnus obesus DQ % 4 BL4 (Thunnus maccoyii) Thunnus macoyyi EF % 5 MB1 (Thunnus obesus) Thunnus obesus DQ % 6 MB5 (Thunnus albacares) Thunnus albacares DQ % Hasil sequencing berupa urutan nukleotida dibandingkan dengan Gene Bank ( atau disebut penjajaran menggunakan metode Basic Local Alignment Search Tool (BLAST). Hal ini dapat dilihat sampel yang digunakan dengan hasil sequencing menggunakan metode BLAST telah sesuai dengan spesies hasil identifikasi morfologi pasca dipreparasi. Ikan tuna dengan spesies tuna sirip kuning (Thunnus albacares), albakor (Thunnus alalunga), tuna
38 mata besar (Thunnus obesus) dan tuna sirip biru selatan (Thunnus macoyyi) dengan menggunakan gen target cyt-b berhasil diidentifikasi. Hasil sequencing selain berupa urutan nukleotida juga dapat melihat tingkat homologi spesies yang diuji. Tingkat homologi merupakan persentase kesamaan spesies yang diuji dengan data yang tersedia di bank data. Spesies tuna sirip kuning (Thunnus albacares), albakor (Thunnus alalunga), tuna mata besar (Thunnus obesus) dan tuna sirip biru selatan (Thunnus macoyyi) memiliki tingkat homologi berturut-turut adalah 99%, 99%, 99% dan 100%. Perbedaan pada tingkat homologi ini disebabkan adanya ketidaksamaan dengan bank data yaitu sebesar 1%. Ram et al. (1996) menyatakan beberapa urutan basa yang ada pada GenBank seringkali menimbulkan ambiguitas, yang sebagian besar mengakibatkan ketidakakuratan. Hal ini juga dapat disebabkan oleh adanya variasi urutan nukleotida pada spesies yang diuji. Penentuan sekuens untuk tuna kaleng tidak berbeda signifikan tekniknya dengan tuna segar. Data sekuens yang didapat kemudian dianalisis menggunakan BLAST. Perbedaan penjajaran antara tuna segar dan tuna kaleng adalah data sekuens dari tuna segar langsung dimasukkan secara utuh ke dalam BLAST, sedangkan data sekuens dari tuna kaleng harus dipilih terlebih dahulu dalam bentuk fragmen pendek (50 pb), setelah itu baru dimasukkan ke dalam BLAST. Hasil analisis BLAST disajikan pada Tabel 3. Tabel 3 Hasil sequencing spesies ikan tuna kaleng No Kode sampel Spesies hasil Nomor akses pencocokan BLAST NCBI Homologi 1 TK1 Thunnus alalunga GU % 2 TK2 Thunnus obesus GU % 3 TK3 Thunnus albacares GU % 4 TK6 Thunnus alalunga GU % Hasil analisis yang didapat dari empat sampel tuna kaleng menunjukkan bahwa spesies yang digunakan sebagai bahan baku tuna kaeng di Indonesia ialah tuna sirip kuning (Thunnus albacares) dan tuna mata besar (Thunnus obesus) yang dikategorikan sebagai chunk light tuna dan albakor (Thunnus alalunga) yang disebut sebagai white tuna. Tuna sirip biru selatan (Thunnus maccoyii), sesuai dengan teorinya, tidak digunakan sebagai bahan baku produk tuna kaleng karena
39 harganya yang relatif mahal dan jarang ditemukan di perairan Indonesia karena jumlahnya yang sudah sangat sedikit dan masuk kategori critically endangered (CE) dalam IUCN Red List. Metode sequencing yang digunakan selain menghasilkan data berupa urutan nukleotida juga dapat menghasilkan dendogram dengan bantuan beberapa software yaitu suatu diagram yang menunjukkan hubungan kekerabatan.
40 5 KESIMPULAN DAN SARAN 5.1 Kesimpulan Autentikasi merupakan salah satu isu yang menjadi perhatian para pelaku bisnis pangan, termasuk pangan perikanan. Autentikasi menggunakan teknik PCR-sequencing merupakan salah satu cara untuk dapat mengindentifikasi spesies yang telah mengalami perubahan bentuk dan kerusakan DNA yang diakibatkan oleh proses fisika dan kimia. DNA berhasil diekstraksi dari empat spesies tuna segar dan tuna kaleng. DNA yang didapat berhasil diamplifikasi dengan menggunakan primer fishcytb-f dan cytb1-5r. Amplikon dari tuna segar berukuran 750 pb sedangkan pada tuna kaleng ukurannya berkurang menjadi <100 pb. Penurunan yang terjadi membuktikan bahwa DNA pada ikan tuna mengalami kerusakan akibat pengolahan suhu tinggi dan penggunaan bahan-bahan tambahan makanan. Amplikon tersebut kemudian di-sequence dan dilakukan penjajaran dengan BLAST yang menyebutkan bahwa spesies yang ada pada empat buah tuna kaleng untuk kode TK1, TK2, TK3 DAN TK6 berturut-turut adalah: Thunnus alalunga, Thunnus obesus, Thunnus albacares dan Thunnus alalunga. 5.2 Saran Kuantitas dan kualitas DNA hasil ekstraksi dapat ditingkatkan dengan melakukan pre-treatment terhadap sampel yang mengandung pengotor misalnya lemak atau minyak dibersihkan terlebih dahulu dengan pelarut organik yang mengandung chloroform. Pengambilan sampel dari tuna kaleng sebaiknya lebih diperhatikan dengan melakukan homogenisasi terlebih dahulu terhadap daging yang terdapat dalam tuna kaleng untuk menghindari tidak terdeteksinya campuran ikan pada tuna kaleng. Proses ekstraksi DNA dapat saja dievaluasi secara kuantitatif terlebih dahulu menggunakan spektrofotometer untuk menentukan kuantitas dan kualitas secara akurat dari DNA yang didapat. Perkembangan analisis berbasis PCR sudah sangat maju, seperti penggunaan PCR-RAPD, Real Time PCR, radioactive probes, dan masih banyak aplikasi tambahan dari PCR yang dapat dicoba untuk meningkatkan efisiensi dan efektifitas dari prosedur autentikasi yang digunakan.
41 DAFTAR PUSTAKA Akane A, Matsubara K, Nakamura H, Takahashi S & Kimura K Purification of highly DNA by gel filtration for PCR. Biotechniques, 16: Anonim Tuna. [10 September 2009] Azrael DNA Structure. [27 Agustus 2009] Barnum SR Biotechnology an Introduction. USA: Thompson Learning. Baker JA Molecular Methods in Ecology. Blackwell Science: Australia Basit SA Comparison of DNA Extraction Methods for Muscle Tissues of Tuna and Tuna-Like Species: Its Implications for Identification Using Polymerase Chain Reaction. Artikel: hlm 1-8. Bauer T, Weller P, Hammes WP & Hertel C The effects of processing parameters on DNA degradation in food. European Food Research Technology, 217: Borgo R, Souty-Grosset C, Bouchon D & Gomot L PCR-RFLP analysis of mitochondrial DNA for identification of snail meat species. J. Food Sci, 61: 1-4. Bossier P Authentication of seafood products by DNA patterns. J. Food Sci, 64: [BRKP] Badan Riset Kelautan dan Perikanan Potret dan Strategi Pengembangan Perikanan Tuna, Udang dan Rumput Laut. Jakarta: Badan Riset Kelautan dan Perikanan. Campbell NA, Reece JB & Mitchell LG Biologi Edisi Kelima-Jilid 1. Jakarta: Penerbit Erlangga Chapela MJ, Sotelo CG, Perez-Martin RI, Pardo MA, Perez-Villareal B, Gilardi P & Riese J Comparison of DNA extraction methods from muscle of canned tuna for species identification. Food Control, 18: Chen BY & Janes HW PCR Cloning Protocol. New Jersey: Humana Press
42 Collette BB & Nauen CE An annotated and illustrated catalogue of tunas, mackerels, bonitos and related species known to date. FAO species catalogue. Vol. 2. Scombrids of the world.fao Fish. Synop. 125(2). 137p. Colombo F, Mangiagalli G & Renon O Identification of tuna species by computer-assisted and cluster analysis of PCR-SSCP electrophoretic pattern. Food Control. 16: [ Davidson College ] Single Stranded Conformation Polymorphism (SSCP) Parker/method.html [22 Januari 2010] Dwiyitno The optimization and validation of a polymerase chain reaction protocol for fish and seafood authenticity based on the cytochrome b gene. [Tesis]. Belgium: Catholic University of Applied Science (KaHo) Sint Lieven. Goodyear PD, MacLaughlin BS & Mason IJ A reliable method for the removal of co purifying PCR inhibitors from ancient DNA. Biotechniques, 16: [FAO] Food and Agriculture Organization FISHSTAT Plus, Universal Software for Fisheries Statistical Time Series. statistics/ software/fishstat. Josupeit H World Tuna Trade Challanges and Opportunities dalam Seychelles Tuna Conference FAO, 4-6 Februari 2010, Seychelles. Jusuf M Genetika I-Struktur dan Ekspresi Gen. Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Karusanagar I, Karusanagar I & Reilly A Aquaculture and Biotechnology. USA: Science Publisher. Lin WF & Hwang DF Application of PCR-RFLP analysis on species identification of canned tuna. Department of Food Science: Taiwan. Mackie IM Methods of Identifying species of raw and processed fish. Fish processing technology 2ed: Mackie IM, Pryde SE, Gonsalez-Sotelo C, Medina L, Perez-Martin R & Quinteiro J Challenges in the identification of species canned fish. Trend in Food Science and Technology, 10: 9-14.
43 Martinez I, James D & Loreal H Application of Modern Analytical Techniques to Ensure Seafood Safety and Authenticity. Rome: Food and Agricultural Organization (FAO). Muladno Teknologi Rekayasa Genetika. Bogor: Pustaka Wirausaha Muda Mitsutoshi N, Maeta K, Aimi T, Suginaka K & Morinaga T Authentication of Flying-Fish-Meal of Processed Using PCR-RFLP. Journal Food Science and Technology 75: Pardo AM Identification of fish species. [27 Agustus 2009] Pereira F, Carneiro J & Amorim A Identification of species with DNAbased technology: current progress and challenges. Recent Patents on DNA & Gene Sequences, 2: Ram JL, Ram ML & Baidoun FF Authentication of canned tuna and bonito by sequence and restriction site analysis of polymerase chain reaction products of mitochondrial DNA. J Agric Food Chem, 44: [University of Leicester] Mitochondrial DNA. Quinteiro J, Sotelo CG, Rehbein H, Pryde SE, Medina I, Perez-Martin R.I, Rey- Mendez M & Mackie IM Use of mt-dna direct polymerase chain reaction (PCR) sequencing and PCR-restriction fragment length polymorphism methodologies in species identification of canned tuna. J. Agric. Food Chem, 42: Winarno FG Sterilisasi Pangan. M-Brio Press: Bogor. Yuwono T Teori dan Aplikasi Polymerase Chain Reaction. Yogyakarta: CV Andi.
44 LAMPIRAN Lampiran 1 Alat yang digunakan saat penelitian Daging ikan Penanganan ikan menggunakan es Pipette tips Micro tube 1.5 ml Autoklaf Water bath Sentrifuse Thermocycler PCR Power Supply elektroforesis Casting Tray elektroforesis Larutan ethidium bromide Gel agarose
3 METODOLOGI 3.1 Waktu dan Tempat 3.2 Bahan dan Alat
 3 METODOLOGI 3.1 Waktu dan Tempat Penelitian Autentikasi Bahan Baku Ikan Tuna (Thunnus sp.) dalam Rangka Peningkatan Keamanan Pangan dengan Metode Berbasis DNA dilaksanakan pada bulan Januari sampai dengan
3 METODOLOGI 3.1 Waktu dan Tempat Penelitian Autentikasi Bahan Baku Ikan Tuna (Thunnus sp.) dalam Rangka Peningkatan Keamanan Pangan dengan Metode Berbasis DNA dilaksanakan pada bulan Januari sampai dengan
4 HASIL DAN PEMBAHASAN
 4 HASIL DAN PEMBAHASAN 4.1 Karakteristik Bahan Baku Tuna Kaleng Produk tuna kaleng merupakan salah satu makanan olahan paling penting di dunia. Gaya hidup serba cepat mendorong terjadinya peningkatan permintaan
4 HASIL DAN PEMBAHASAN 4.1 Karakteristik Bahan Baku Tuna Kaleng Produk tuna kaleng merupakan salah satu makanan olahan paling penting di dunia. Gaya hidup serba cepat mendorong terjadinya peningkatan permintaan
3 METODOLOGI 3.1 Waktu dan Tempat 3.2 Bahan dan Alat
 3 METODOLOGI 3.1 Waktu dan Tempat Penelitian dilakukan selama bulan Januari hingga April 2010 bertempat di Laboratorium Karakteristik Bahan Baku, Departemen Teknologi Hasil Perairan, Fakultas Perikanan
3 METODOLOGI 3.1 Waktu dan Tempat Penelitian dilakukan selama bulan Januari hingga April 2010 bertempat di Laboratorium Karakteristik Bahan Baku, Departemen Teknologi Hasil Perairan, Fakultas Perikanan
4 HASIL DAN PEMBAHASAN
 4 HASIL DAN PEMBAHASAN 4.1 Preparasi dan Karakteristik Bahan Baku Produk tuna steak dikemas dengan plastik dalam keadaan vakum. Pengemasan dengan bahan pengemas yang cocok sangat bermanfaat untuk mencegah
4 HASIL DAN PEMBAHASAN 4.1 Preparasi dan Karakteristik Bahan Baku Produk tuna steak dikemas dengan plastik dalam keadaan vakum. Pengemasan dengan bahan pengemas yang cocok sangat bermanfaat untuk mencegah
3. METODE PENELITIAN
 19 3. METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian ini dilaksanakan pada bulan Maret sampai Juni 2010 di Laboratorium Mikrobiologi, Biokimia dan Bioteknologi Hasil Perairan Departemen Teknologi Hasil
19 3. METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian ini dilaksanakan pada bulan Maret sampai Juni 2010 di Laboratorium Mikrobiologi, Biokimia dan Bioteknologi Hasil Perairan Departemen Teknologi Hasil
BAB III. METODOLOGI PENELITIAN. Pengambilan sampel. Penyiapan templat mtdna dengan metode lisis sel
 16 BAB III. METODOLOGI PENELITIAN Bab ini menggambarkan tahapan penelitian yang terdiri dari pengambilan sampel, penyiapan templat mtdna dengan metode lisis sel, amplifikasi D-loop mtdna dengan teknik
16 BAB III. METODOLOGI PENELITIAN Bab ini menggambarkan tahapan penelitian yang terdiri dari pengambilan sampel, penyiapan templat mtdna dengan metode lisis sel, amplifikasi D-loop mtdna dengan teknik
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Jenis Penelitian deskriptif. Jenis penelitian yang digunakan adalah penelitian dasar dengan metode B. Objek Penelitian Objek penelitian ini adalah sampel DNA koleksi hasil
BAB III METODE PENELITIAN A. Jenis Penelitian deskriptif. Jenis penelitian yang digunakan adalah penelitian dasar dengan metode B. Objek Penelitian Objek penelitian ini adalah sampel DNA koleksi hasil
4. HASIL DAN PEMBAHASAN
 29 4. HASIL DAN PEMBAHASAN 4.1 Karakteristik isolat bakteri dari ikan tuna dan cakalang 4.1.1 Morfologi isolat bakteri Secara alamiah, mikroba terdapat dalam bentuk campuran dari berbagai jenis. Untuk
29 4. HASIL DAN PEMBAHASAN 4.1 Karakteristik isolat bakteri dari ikan tuna dan cakalang 4.1.1 Morfologi isolat bakteri Secara alamiah, mikroba terdapat dalam bentuk campuran dari berbagai jenis. Untuk
BAB III METODE PENELITIAN. Penelitian ini merupakan penelitian eksperimental dengan 7 sampel dari 7
 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian ini merupakan penelitian eksperimental dengan 7 sampel dari 7 individu udang Jari yang diambil dari Segara Anakan Kabupaten Cilacap Jawa Tengah.
BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian ini merupakan penelitian eksperimental dengan 7 sampel dari 7 individu udang Jari yang diambil dari Segara Anakan Kabupaten Cilacap Jawa Tengah.
BAB III METODE PENELITIAN. Secara garis besar langkah-langkah yang dilakukan dalam penelitian ini
 BAB III METODE PENELITIAN Secara garis besar langkah-langkah yang dilakukan dalam penelitian ini adalah: pengumpulan sampel; lisis terhadap sampel mtdna yang telah diperoleh; amplifikasi daerah D-loop
BAB III METODE PENELITIAN Secara garis besar langkah-langkah yang dilakukan dalam penelitian ini adalah: pengumpulan sampel; lisis terhadap sampel mtdna yang telah diperoleh; amplifikasi daerah D-loop
2 TINJAUAN PUSTAKA 2.1 Deskripsi dan Klasifikasi Ikan Tuna ( Thunnus sp)
 2 TINJAUAN PUSTAKA 2.1 Deskripsi dan Klasifikasi Ikan Tuna (Thunnus sp) Ikan tuna merupakan ikan perenang cepat yang berada di epipelagis ( > 500 m) yang dapat berenang sejauh 55 km setiap hari. Persebaran
2 TINJAUAN PUSTAKA 2.1 Deskripsi dan Klasifikasi Ikan Tuna (Thunnus sp) Ikan tuna merupakan ikan perenang cepat yang berada di epipelagis ( > 500 m) yang dapat berenang sejauh 55 km setiap hari. Persebaran
FAKULTAS BIOLOGI LABORATORIUM GENETIKA & PEMULIAAN INSTRUKSI KERJA UJI
 ISOLASI TOTAL DNA TUMBUHAN DENGAN KIT EKSTRAKSI DNA PHYTOPURE Halaman : 1 dari 5 1. RUANG LINGKUP Metode ini digunakan untuk mengisolasi DNA dari sampel jaringan tumbuhan, dapat dari daun, akar, batang,
ISOLASI TOTAL DNA TUMBUHAN DENGAN KIT EKSTRAKSI DNA PHYTOPURE Halaman : 1 dari 5 1. RUANG LINGKUP Metode ini digunakan untuk mengisolasi DNA dari sampel jaringan tumbuhan, dapat dari daun, akar, batang,
MATERI DAN METODE. Lokasi dan Waktu. Materi. Tabel 1. Jumah Sampel Darah Ternak Sapi Indonesia Ternak n Asal Sapi Bali 2 4
 MATERI DAN METODE Lokasi dan Waktu Penelitian dilaksanakan di Laboratorium Genetika Molekuler Ternak, Bagian Pemuliaan dan Genetika Ternak, Fakultas Peternakan, Institut Pertanian Bogor. penelitian ini
MATERI DAN METODE Lokasi dan Waktu Penelitian dilaksanakan di Laboratorium Genetika Molekuler Ternak, Bagian Pemuliaan dan Genetika Ternak, Fakultas Peternakan, Institut Pertanian Bogor. penelitian ini
BAB III METODE PENELITIAN Bagan Alir Penelitian ini secara umum dapat digambarkan pada skema berikut:
 BAB III METODE PENELITIAN Tahapan-tahapan yang dilakukan dalam penelitian ini adalah: pengumpulan sampel, lisis terhadap sampel mtdna yang telah diperoleh, amplifikasi daerah HVI mtdna sampel dengan menggunakan
BAB III METODE PENELITIAN Tahapan-tahapan yang dilakukan dalam penelitian ini adalah: pengumpulan sampel, lisis terhadap sampel mtdna yang telah diperoleh, amplifikasi daerah HVI mtdna sampel dengan menggunakan
Pengujian DNA, Prinsip Umum
 Pengujian DNA, Prinsip Umum Pengujian berbasis DNA dalam pengujian mutu benih memang saat ini belum diregulasikan sebagai salah satu standar kelulusan benih dalam proses sertifikasi. Dalam ISTA Rules,
Pengujian DNA, Prinsip Umum Pengujian berbasis DNA dalam pengujian mutu benih memang saat ini belum diregulasikan sebagai salah satu standar kelulusan benih dalam proses sertifikasi. Dalam ISTA Rules,
BAB III METODE PENELITIAN. Dalam penelitian ini dilakukan lima tahap utama yang meliputi tahap
 BAB III METODE PENELITIAN Dalam penelitian ini dilakukan lima tahap utama yang meliputi tahap penyiapan templat mtdna, amplifikasi fragmen mtdna pada daerah D-loop mtdna manusia dengan teknik PCR, deteksi
BAB III METODE PENELITIAN Dalam penelitian ini dilakukan lima tahap utama yang meliputi tahap penyiapan templat mtdna, amplifikasi fragmen mtdna pada daerah D-loop mtdna manusia dengan teknik PCR, deteksi
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Jenis penelitian Jenis penelitian ini adalah penelitian deskriptif yang mengangkat fenomena alam sebagai salah satu masalah dalam penelitian, sehingga dapat menerangkan arti
BAB III METODE PENELITIAN A. Jenis penelitian Jenis penelitian ini adalah penelitian deskriptif yang mengangkat fenomena alam sebagai salah satu masalah dalam penelitian, sehingga dapat menerangkan arti
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian ini adalah penelitian deskriptif yang mengangkat fenomena alam sebagai salah satu masalah dalam penelitian. Penelitian ini dapat menerangkan
BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian ini adalah penelitian deskriptif yang mengangkat fenomena alam sebagai salah satu masalah dalam penelitian. Penelitian ini dapat menerangkan
FAKULTAS BIOLOGI LABORATORIUM GENETIKA & PEMULIAAN INSTRUKSI KERJA UJI
 Halaman : 1 dari 5 ISOLASI TOTAL DNA HEWAN DENGAN KIT EKSTRAKSI DNA 1. RUANG LINGKUP Metode ini digunakan untuk mengisolasi DNA dari sampel jaringan hewan, dapat dari insang, otot, darah atau jaringan
Halaman : 1 dari 5 ISOLASI TOTAL DNA HEWAN DENGAN KIT EKSTRAKSI DNA 1. RUANG LINGKUP Metode ini digunakan untuk mengisolasi DNA dari sampel jaringan hewan, dapat dari insang, otot, darah atau jaringan
KATAPENGANTAR. Pekanbaru, Desember2008. Penulis
 KATAPENGANTAR Fuji syukut ke Hadirat Allah SWT. berkat rahmat dan izin-nya penulis dapat menyelesaikan skripsi yang beijudul "Skrining Bakteri Vibrio sp Penyebab Penyakit Udang Berbasis Teknik Sekuens
KATAPENGANTAR Fuji syukut ke Hadirat Allah SWT. berkat rahmat dan izin-nya penulis dapat menyelesaikan skripsi yang beijudul "Skrining Bakteri Vibrio sp Penyebab Penyakit Udang Berbasis Teknik Sekuens
BAB III METODOLOGI PENELITIAN. Penelitian akan diawali dengan preparasi alat dan bahan untuk sampling
 16 BAB III METODOLOGI PENELITIAN Penelitian akan diawali dengan preparasi alat dan bahan untuk sampling sel folikel akar rambut. Sampel kemudian dilisis, diamplifikasi dan disekuensing dengan metode dideoksi
16 BAB III METODOLOGI PENELITIAN Penelitian akan diawali dengan preparasi alat dan bahan untuk sampling sel folikel akar rambut. Sampel kemudian dilisis, diamplifikasi dan disekuensing dengan metode dideoksi
BAB III METODE PENELITIAN. amplifikasi daerah HVI mtdna sampel dengan menggunakan teknik PCR;
 BAB III METODE PENELITIAN Secara garis besar, langkah-langkah yang dilakukan dalam penelitian ini adalah: pengumpulan sampel; lisis terhadap sampel mtdna yang telah diperoleh; amplifikasi daerah HVI mtdna
BAB III METODE PENELITIAN Secara garis besar, langkah-langkah yang dilakukan dalam penelitian ini adalah: pengumpulan sampel; lisis terhadap sampel mtdna yang telah diperoleh; amplifikasi daerah HVI mtdna
3 Metodologi Penelitian
 3 Metodologi Penelitian 3.1 Alat Penelitian ini dilakukan di Laboratorium Penelitian Biokimia, Program Studi Kimia, Institut Teknologi Bandung. Peralatan yang digunakan pada penelitian ini diantaranya
3 Metodologi Penelitian 3.1 Alat Penelitian ini dilakukan di Laboratorium Penelitian Biokimia, Program Studi Kimia, Institut Teknologi Bandung. Peralatan yang digunakan pada penelitian ini diantaranya
4.1. Alat dan Bahan Penelitian a. Alat Penelitian. No. URAIAN ALAT. A. Pengambilan sampel
 7 IV. METODE PENELITIAN Ikan Lais diperoleh dari hasil penangkapan ikan oleh nelayan dari sungaisungai di Propinsi Riau yaitu S. Kampar dan S. Indragiri. Identifikasi jenis sampel dilakukan dengan menggunakan
7 IV. METODE PENELITIAN Ikan Lais diperoleh dari hasil penangkapan ikan oleh nelayan dari sungaisungai di Propinsi Riau yaitu S. Kampar dan S. Indragiri. Identifikasi jenis sampel dilakukan dengan menggunakan
ANALISA HASIL TRANSFORMASI DENGAN MENGGUNAKAN PCR KOLONI DAN RESTRIKSI
 1 ANALISA HASIL TRANSFORMASI DENGAN MENGGUNAKAN PCR KOLONI DAN RESTRIKSI PENDAHULUAN Polimerase Chain Reaction (PCR) PCR adalah suatu reaksi invitro untuk menggandakan jumlah molekul DNA pada target tertentu
1 ANALISA HASIL TRANSFORMASI DENGAN MENGGUNAKAN PCR KOLONI DAN RESTRIKSI PENDAHULUAN Polimerase Chain Reaction (PCR) PCR adalah suatu reaksi invitro untuk menggandakan jumlah molekul DNA pada target tertentu
MATERI DAN METODE. Kota Padang Sumatera Barat pada bulan Oktober Amplifikasi gen Growth
 III. MATERI DAN METODE 3.1 Waktu dan Tempat Pengambilan sampel darah domba dilakukan di Kecamatan Koto Tengah Kota Padang Sumatera Barat pada bulan Oktober 2012. Amplifikasi gen Growth Hormone menggunakan
III. MATERI DAN METODE 3.1 Waktu dan Tempat Pengambilan sampel darah domba dilakukan di Kecamatan Koto Tengah Kota Padang Sumatera Barat pada bulan Oktober 2012. Amplifikasi gen Growth Hormone menggunakan
LAMPIRAN. Lampiran 1. Deskripsi Pembuatan Larutan Stok dan Buffer
 LAMPIRAN Lampiran 1. Deskripsi Pembuatan Larutan Stok dan Buffer 1. Pembuatan Larutan Stok a. CTAB 5 % Larutan dibuat dengan melarutkan : - NaCl : 2.0 gr - CTAB : 5.0 gr - Aquades : 100 ml b. Tris HCl
LAMPIRAN Lampiran 1. Deskripsi Pembuatan Larutan Stok dan Buffer 1. Pembuatan Larutan Stok a. CTAB 5 % Larutan dibuat dengan melarutkan : - NaCl : 2.0 gr - CTAB : 5.0 gr - Aquades : 100 ml b. Tris HCl
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian tentang Pengaruh Suhu Annealing pada Program PCR terhadap Keberhasilan Amplifikasi DNA Udang Jari (Metapenaeus elegans) Laguna Segara Anakan
BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian tentang Pengaruh Suhu Annealing pada Program PCR terhadap Keberhasilan Amplifikasi DNA Udang Jari (Metapenaeus elegans) Laguna Segara Anakan
4 Hasil dan Pembahasan
 4 Hasil dan Pembahasan Dalam bab ini akan dipaparkan hasil dari tahap-tahap penelitian yang telah dilakukan. Melalui tahapan tersebut diperoleh urutan nukleotida sampel yang positif diabetes dan sampel
4 Hasil dan Pembahasan Dalam bab ini akan dipaparkan hasil dari tahap-tahap penelitian yang telah dilakukan. Melalui tahapan tersebut diperoleh urutan nukleotida sampel yang positif diabetes dan sampel
BAHAN DAN METODE Tempat dan Waktu Penelitian Bahan dan Alat
 12 BAHAN DAN METODE Tempat dan Waktu Penelitian Survei penyakit klorosis dan koleksi sampel tanaman tomat sakit dilakukan di sentra produksi tomat di daerah Cianjur, Cipanas, Lembang, dan Garut. Deteksi
12 BAHAN DAN METODE Tempat dan Waktu Penelitian Survei penyakit klorosis dan koleksi sampel tanaman tomat sakit dilakukan di sentra produksi tomat di daerah Cianjur, Cipanas, Lembang, dan Garut. Deteksi
BAB III METODE PENELITIAN. Penelitian ini merupakan penelitian yang dilakukan dengan metode
 16 BAB III METODE PENELITIAN A. Jenis Penelitian Penelitian ini merupakan penelitian yang dilakukan dengan metode deskriptif. Penelitian deskriptif adalah suatu metode penelitian untuk membuat deskripsi,
16 BAB III METODE PENELITIAN A. Jenis Penelitian Penelitian ini merupakan penelitian yang dilakukan dengan metode deskriptif. Penelitian deskriptif adalah suatu metode penelitian untuk membuat deskripsi,
Teknik-teknik Dasar Bioteknologi
 Teknik-teknik Dasar Bioteknologi Oleh: TIM PENGAMPU Program Studi Agroteknologi Fakultas Pertanian Universitas Jember Tujuan Perkuliahan 1. Mahasiswa mengetahui macam-macam teknik dasar yang digunakan
Teknik-teknik Dasar Bioteknologi Oleh: TIM PENGAMPU Program Studi Agroteknologi Fakultas Pertanian Universitas Jember Tujuan Perkuliahan 1. Mahasiswa mengetahui macam-macam teknik dasar yang digunakan
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian tentang Karakterisasi genetik Udang Jari (Metapenaeus elegans De Man, 1907) hasil tangkapan dari Laguna Segara Anakan berdasarkan haplotipe
BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian tentang Karakterisasi genetik Udang Jari (Metapenaeus elegans De Man, 1907) hasil tangkapan dari Laguna Segara Anakan berdasarkan haplotipe
AUTENTIKASI TUNA STEAK KOMERSIAL DENGAN METODE PCR-SEQUENCING
 AUTENTIKASI TUNA STEAK KOMERSIAL DENGAN METODE PCR-SEQUENCING Authentication Of Commercial Tuna Steak With PCR-Sequencing Based Methods Asadatun Abdullah *, Nurjanah, Nanang Kurnia Departemen Teknologi
AUTENTIKASI TUNA STEAK KOMERSIAL DENGAN METODE PCR-SEQUENCING Authentication Of Commercial Tuna Steak With PCR-Sequencing Based Methods Asadatun Abdullah *, Nurjanah, Nanang Kurnia Departemen Teknologi
BAB III METODOLOGI PENELITIAN. Pada penelitian ini terdapat lima tahapan penelitian yang dilakukan yaitu
 BAB III METODOLOGI PENELITIAN Pada penelitian ini terdapat lima tahapan penelitian yang dilakukan yaitu pengumpulan sampel berupa akar rambut, ekstraksi mtdna melalui proses lisis akar rambut, amplifikasi
BAB III METODOLOGI PENELITIAN Pada penelitian ini terdapat lima tahapan penelitian yang dilakukan yaitu pengumpulan sampel berupa akar rambut, ekstraksi mtdna melalui proses lisis akar rambut, amplifikasi
BAB III BAHAN DAN METODE
 9 BAB III BAHAN DAN METODE 3.1 Waktu dan Tempat Penelitian Penelitian dilaksanakan pada bulan September 2011 sampai dengan Juli 2012. Kegiatan ekstraksi DNA sampai PCR-RFLP dilakukan di laboratorium Analisis
9 BAB III BAHAN DAN METODE 3.1 Waktu dan Tempat Penelitian Penelitian dilaksanakan pada bulan September 2011 sampai dengan Juli 2012. Kegiatan ekstraksi DNA sampai PCR-RFLP dilakukan di laboratorium Analisis
AUTENTIKASI IKAN TUNA (Thunnus sp) DENGAN METODE BERBASIS PCR-SEQUENCING. Oleh : NANANG KURNIA C
 AUTENTIKASI IKAN TUNA (Thunnus sp) DENGAN METODE BERBASIS PCR-SEQUENCING Oleh : NANANG KURNIA C34061419 DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR
AUTENTIKASI IKAN TUNA (Thunnus sp) DENGAN METODE BERBASIS PCR-SEQUENCING Oleh : NANANG KURNIA C34061419 DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR
BAB 3 METODOLOGI PENELITIAN
 20 BAB 3 METODOLOGI PENELITIAN 3.1. Desain Penelitian Penelitian ini bersifat deskriptif cross sectional molekuler. Data yang diperoleh berasal dari pemeriksaan langsung yang dilakukan peneliti sebanyak
20 BAB 3 METODOLOGI PENELITIAN 3.1. Desain Penelitian Penelitian ini bersifat deskriptif cross sectional molekuler. Data yang diperoleh berasal dari pemeriksaan langsung yang dilakukan peneliti sebanyak
II. MATERI DAN METODE. Tempat pengambilan sampel daun jati (Tectona grandis Linn. f.) dilakukan di
 II. MATERI DAN METODE 2.1 Waktu dan Tempat Penelitian Tempat pengambilan sampel daun jati (Tectona grandis Linn. f.) dilakukan di enam desa yaitu tiga desa di Kecamatan Grokgak dan tiga desa di Kecamatan
II. MATERI DAN METODE 2.1 Waktu dan Tempat Penelitian Tempat pengambilan sampel daun jati (Tectona grandis Linn. f.) dilakukan di enam desa yaitu tiga desa di Kecamatan Grokgak dan tiga desa di Kecamatan
LAMPIRAN. Lampiran 1. Pembuatan Larutan Stok dan Buffer
 LAMPIRAN Lampiran 1. Pembuatan Larutan Stok dan Buffer A. LARUTAN STOK CTAB 5 % (100 ml) - Ditimbang NaCl sebanyak 2.0 gram - Ditimbang CTAB sebanyak 5.0 gram. - Dimasukkan bahan kimia ke dalam erlenmeyer
LAMPIRAN Lampiran 1. Pembuatan Larutan Stok dan Buffer A. LARUTAN STOK CTAB 5 % (100 ml) - Ditimbang NaCl sebanyak 2.0 gram - Ditimbang CTAB sebanyak 5.0 gram. - Dimasukkan bahan kimia ke dalam erlenmeyer
Kolokium Departemen Biologi FMIPA IPB: Ria Maria
 Kolokium Departemen Biologi FMIPA IPB: Ria Maria Ria Maria (G34090088), Achmad Farajallah, Maria Ulfah. 2012. Karakterisasi Single Nucleotide Polymorphism Gen CAST pada Ras Ayam Lokal. Makalah Kolokium
Kolokium Departemen Biologi FMIPA IPB: Ria Maria Ria Maria (G34090088), Achmad Farajallah, Maria Ulfah. 2012. Karakterisasi Single Nucleotide Polymorphism Gen CAST pada Ras Ayam Lokal. Makalah Kolokium
III. METODOLOGI PENELITIAN. Penelitian ini menggunakan metode eksperimental yang bertujuan untuk
 56 III. METODOLOGI PENELITIAN A. Rancangan Penelitian Penelitian ini menggunakan metode eksperimental yang bertujuan untuk mengamplifikasi Gen FNBP1L. B. Tempat dan Waktu Penelitian 1. Tempat Penelitian
56 III. METODOLOGI PENELITIAN A. Rancangan Penelitian Penelitian ini menggunakan metode eksperimental yang bertujuan untuk mengamplifikasi Gen FNBP1L. B. Tempat dan Waktu Penelitian 1. Tempat Penelitian
1 0,53 0,59 2 0,3 0,2 3 0,02 0,02 4 0,04 0,04 5 0,3 0,3 Ilustrasi rangkaian isolasi DNA tersebut dapat dilihat pada Gambar 1 berikut.
 PERBANDINGAN BEBERAPA METODE ISOLASI DNA UNTUK PENENTUAN KUALITAS LARUTAN DNA TANAMAN SINGKONG (Manihot esculentum L.) Molekul DNA dalam suatu sel dapat diekstraksi atau diisolasi untuk berbagai macam
PERBANDINGAN BEBERAPA METODE ISOLASI DNA UNTUK PENENTUAN KUALITAS LARUTAN DNA TANAMAN SINGKONG (Manihot esculentum L.) Molekul DNA dalam suatu sel dapat diekstraksi atau diisolasi untuk berbagai macam
BAB II TINJAUAN PUSTAKA
 4 BAB II TINJAUAN PUSTAKA A. Babi Babi adalah sejenis hewan ungulata yang bermoncong panjang dan berhidung leper dan merupakan hewan yang aslinya berasal dari Eurasia. Didalam Al-Qur an tertera dengan
4 BAB II TINJAUAN PUSTAKA A. Babi Babi adalah sejenis hewan ungulata yang bermoncong panjang dan berhidung leper dan merupakan hewan yang aslinya berasal dari Eurasia. Didalam Al-Qur an tertera dengan
MATERI DAN METODE. Materi
 MATERI DAN METODE Lokasi dan Waktu Penelitian ini dilakukan di Laboratorium Genetika Molekuler Ternak, Bagian Pemuliaan dan Genetik Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan,
MATERI DAN METODE Lokasi dan Waktu Penelitian ini dilakukan di Laboratorium Genetika Molekuler Ternak, Bagian Pemuliaan dan Genetik Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan,
VISUALISASI HASIL PCR DENGAN METODE PCR LANGSUNG DAN TIDAK LANGSUNG PADA SAMPEL BAKTERI Pseudomonas fluorescens dan Ralstonia solanacearum
 VISUALISASI HASIL PCR DENGAN METODE PCR LANGSUNG DAN TIDAK LANGSUNG PADA SAMPEL BAKTERI Pseudomonas fluorescens dan Ralstonia solanacearum Pendahuluan Polymerase Chain Reaction (PCR) adalah suatu teknik
VISUALISASI HASIL PCR DENGAN METODE PCR LANGSUNG DAN TIDAK LANGSUNG PADA SAMPEL BAKTERI Pseudomonas fluorescens dan Ralstonia solanacearum Pendahuluan Polymerase Chain Reaction (PCR) adalah suatu teknik
HASIL DAN PEMBAHASAN
 HASIL DAN PEMBAHASAN Ekstraksi dan Purifikasi DNA Total DNA total yang diperoleh dalam penelitian bersumber dari darah dan bulu. Ekstraksi DNA yang bersumber dari darah dilakukan dengan metode phenolchloroform,
HASIL DAN PEMBAHASAN Ekstraksi dan Purifikasi DNA Total DNA total yang diperoleh dalam penelitian bersumber dari darah dan bulu. Ekstraksi DNA yang bersumber dari darah dilakukan dengan metode phenolchloroform,
MATERI DAN METODE. Materi. Tabel 1. Sampel Darah Sapi Perah dan Sapi Pedaging yang Digunakan No. Bangsa Sapi Jenis Kelamin
 MATERI DAN METODE Lokasi dan Waktu Penelitian ini dilaksanakan di Laboratorium Genetika Molekuler Ternak, Bagian Pemuliaan dan Genetika, Fakultas Peternakan, Institut Pertanian Bogor. Penelitian ini berlangsung
MATERI DAN METODE Lokasi dan Waktu Penelitian ini dilaksanakan di Laboratorium Genetika Molekuler Ternak, Bagian Pemuliaan dan Genetika, Fakultas Peternakan, Institut Pertanian Bogor. Penelitian ini berlangsung
II. BAHAN DAN METODE. Betina BEST BB NB RB. Nirwana BN NN RN. Red NIFI BR NR RR
 II. BAHAN DAN METODE Ikan Uji Ikan uji yang digunakan adalah ikan nila hibrida hasil persilangan resiprok 3 strain BEST, Nirwana dan Red NIFI koleksi Balai Riset Perikanan Budidaya Air Tawar Sempur, Bogor.
II. BAHAN DAN METODE Ikan Uji Ikan uji yang digunakan adalah ikan nila hibrida hasil persilangan resiprok 3 strain BEST, Nirwana dan Red NIFI koleksi Balai Riset Perikanan Budidaya Air Tawar Sempur, Bogor.
LAPORAN PRAKTIKUM REKAYASA GENETIKA
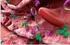 LAPORAN PRAKTIKUM REKAYASA GENETIKA LAPORAN IV (ISOLASI RNA DARI TANAMAN) KHAIRUL ANAM P051090031/BTK BIOTEKNOLOGI SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2010 0 ISOLASI RNA DARI TANAMAN TUJUAN Tujuan
LAPORAN PRAKTIKUM REKAYASA GENETIKA LAPORAN IV (ISOLASI RNA DARI TANAMAN) KHAIRUL ANAM P051090031/BTK BIOTEKNOLOGI SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2010 0 ISOLASI RNA DARI TANAMAN TUJUAN Tujuan
MATERI DAN METODE. Lokasi dan Waktu
 MATERI DAN METODE Lokasi dan Waktu Analisis Polymerase Chain Reaction (PCR) serta analisis penciri Polymerase Chain Reaction-Restriction Fragment Length Polymorphism (PCR-RFLP) dilaksanakan di Laboratorium
MATERI DAN METODE Lokasi dan Waktu Analisis Polymerase Chain Reaction (PCR) serta analisis penciri Polymerase Chain Reaction-Restriction Fragment Length Polymorphism (PCR-RFLP) dilaksanakan di Laboratorium
TINJAUAN PUSTAKA Tikus ( Rattus norvegicus Gen Sitokrom b
 TINJAUAN PUSTAKA Tikus (Rattus norvegicus) Tikus termasuk ke dalam kingdom Animalia, filum Chordata, subfilum Vertebrata, kelas Mamalia, ordo Rodentia, dan famili Muridae. Spesies-spesies utama yang terdapat
TINJAUAN PUSTAKA Tikus (Rattus norvegicus) Tikus termasuk ke dalam kingdom Animalia, filum Chordata, subfilum Vertebrata, kelas Mamalia, ordo Rodentia, dan famili Muridae. Spesies-spesies utama yang terdapat
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian yang dilakukan termasuk penelitian deskriptif. Penelitian deskriptif adalah metode penelitian yang bertujuan membuat gambaran secara sistematis,
BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian yang dilakukan termasuk penelitian deskriptif. Penelitian deskriptif adalah metode penelitian yang bertujuan membuat gambaran secara sistematis,
III. METODOLOGI PENELITIAN. Penelitian ini menggunakan metode eksperimental yang bertujuan untuk
 27 III. METODOLOGI PENELITIAN 3.1 Desain Penelitian Penelitian ini menggunakan metode eksperimental yang bertujuan untuk mengamplifikasi Gen STX1A. 3.2 Tempat dan Waktu Penelitian 1. Tempat Penelitian
27 III. METODOLOGI PENELITIAN 3.1 Desain Penelitian Penelitian ini menggunakan metode eksperimental yang bertujuan untuk mengamplifikasi Gen STX1A. 3.2 Tempat dan Waktu Penelitian 1. Tempat Penelitian
LAPORAN PRAKTIKUM REKAYASA GENETIKA
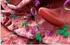 LAPORAN PRAKTIKUM REKAYASA GENETIKA LAPORAN II (ISOLASI DNA GENOM) KHAIRUL ANAM P051090031/BTK BIOTEKNOLOGI SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2010 0 ISOLASI DAN IDENTIFIKASI DNA SEL MUKOSA
LAPORAN PRAKTIKUM REKAYASA GENETIKA LAPORAN II (ISOLASI DNA GENOM) KHAIRUL ANAM P051090031/BTK BIOTEKNOLOGI SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2010 0 ISOLASI DAN IDENTIFIKASI DNA SEL MUKOSA
Asam Asetat Glacial = 5,7 ml EDTA 0,5 M ph 8.0 = 10 ml Aquades ditambahkan hingga volume larutan 100 ml
 36 Lampiran 1. Pembuatan Larutan Stok dan Buffer A. Pembuatan Larutan Stok Tris HCL 1 M ph 8.0 (100 ml) : Timbang Tris sebanyak 12,114 g. Masukkan Tris ke dalam Erlenmeyer dan ditambahkan 80 ml aquades.
36 Lampiran 1. Pembuatan Larutan Stok dan Buffer A. Pembuatan Larutan Stok Tris HCL 1 M ph 8.0 (100 ml) : Timbang Tris sebanyak 12,114 g. Masukkan Tris ke dalam Erlenmeyer dan ditambahkan 80 ml aquades.
Identifikasi Gen Abnormal Oleh : Nella ( )
 Identifikasi Gen Abnormal Oleh : Nella (10.2011.185) Identifikasi gen abnormal Pemeriksaan kromosom DNA rekombinan PCR Kromosom waldeyer Kromonema : pita spiral yang tampak pada kromatid Kromomer : penebalan
Identifikasi Gen Abnormal Oleh : Nella (10.2011.185) Identifikasi gen abnormal Pemeriksaan kromosom DNA rekombinan PCR Kromosom waldeyer Kromonema : pita spiral yang tampak pada kromatid Kromomer : penebalan
III. Bahan dan Metode
 III. Bahan dan Metode A. Waktu dan Tempat Penelitian Penelitian ini dilaksanakan selama 3 bulan dari bulan Mei-Juli 2011 yang dilakukan di LPPT UGM Yogyakarta. B. Bahan Penelitian Sampel yang digunakan
III. Bahan dan Metode A. Waktu dan Tempat Penelitian Penelitian ini dilaksanakan selama 3 bulan dari bulan Mei-Juli 2011 yang dilakukan di LPPT UGM Yogyakarta. B. Bahan Penelitian Sampel yang digunakan
BAB III METODOLOGI PENELITIAN. Jenis penelitian yang digunakan adalah penelitian dasar dengan metode
 22 BAB III METODOLOGI PENELITIAN A. Jenis Penelitian Jenis penelitian yang digunakan adalah penelitian dasar dengan metode penelitian deskriptif. B. Lokasi dan Waktu Penelitian 1. Lokasi Penelitian Penelitian
22 BAB III METODOLOGI PENELITIAN A. Jenis Penelitian Jenis penelitian yang digunakan adalah penelitian dasar dengan metode penelitian deskriptif. B. Lokasi dan Waktu Penelitian 1. Lokasi Penelitian Penelitian
LAPORAN PRAKTIKUM BIOTEKNOLOGI PERTANIAN ISOLASI DNA
 LAPORAN PRAKTIKUM BIOTEKNOLOGI PERTANIAN ISOLASI DNA Disusun Oleh: Nama : Aminatus Sholikah NIM : 115040213111035 Kelompok : kamis, 06.00-07.30 Asisten : Putu Shantiawan Prayoga PROGRAM STUDI AGROEKOTEKNOLOGI
LAPORAN PRAKTIKUM BIOTEKNOLOGI PERTANIAN ISOLASI DNA Disusun Oleh: Nama : Aminatus Sholikah NIM : 115040213111035 Kelompok : kamis, 06.00-07.30 Asisten : Putu Shantiawan Prayoga PROGRAM STUDI AGROEKOTEKNOLOGI
POLYMERASE CHAIN REACTION (PCR)
 POLYMERASE CHAIN REACTION (PCR) Disusun oleh: Hanif Wahyuni (1210411003) Prayoga Wibhawa Nu Tursedhi Dina Putri Salim (1210412032) (1210413031) SEJARAH Teknik ini dirintis oleh Kary Mullis pada tahun 1985
POLYMERASE CHAIN REACTION (PCR) Disusun oleh: Hanif Wahyuni (1210411003) Prayoga Wibhawa Nu Tursedhi Dina Putri Salim (1210412032) (1210413031) SEJARAH Teknik ini dirintis oleh Kary Mullis pada tahun 1985
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian yang digunakan adalah penelitian dasar dengan metode deskriptif (Nazir, 1983). B. Populasi dan Sampel Populasi dalam penelitian ini adalah
BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian yang digunakan adalah penelitian dasar dengan metode deskriptif (Nazir, 1983). B. Populasi dan Sampel Populasi dalam penelitian ini adalah
MATERI DAN METODE. Materi
 MATERI DAN METODE Lokasi dan Waktu Penelitian dilaksanakan di Laboratorium Genetika Molekuler Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan IPB dan Laboratorium Terpadu,
MATERI DAN METODE Lokasi dan Waktu Penelitian dilaksanakan di Laboratorium Genetika Molekuler Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan IPB dan Laboratorium Terpadu,
METODE PENELITIAN. Tabel 1 Sampel yang digunakan dalam penelitian
 12 METODE PEELITIA Waktu dan Tempat Penelitian dilaksanakan pada bulan Mei sampai dengan April 2010, bertempat di Bagian Fungsi Hayati dan Perilaku Hewan, Departemen Biologi, Fakultas Matematika dan Ilmu
12 METODE PEELITIA Waktu dan Tempat Penelitian dilaksanakan pada bulan Mei sampai dengan April 2010, bertempat di Bagian Fungsi Hayati dan Perilaku Hewan, Departemen Biologi, Fakultas Matematika dan Ilmu
Saintek Vol 5, No 6, Tahun 2010 POLYMERASE CHAIN REACTION (PCR) Zuhriana K.Yusuf
 Saintek Vol 5, No 6, Tahun 2010 POLYMERASE CHAIN REACTION (PCR) Zuhriana K.Yusuf Staf Pengajar Jurusan Kesehatan Masyarakat FIKK Universitas Negeri Gorontalo Abstrak (Polymerase Chain Reaction, PCR) adalah
Saintek Vol 5, No 6, Tahun 2010 POLYMERASE CHAIN REACTION (PCR) Zuhriana K.Yusuf Staf Pengajar Jurusan Kesehatan Masyarakat FIKK Universitas Negeri Gorontalo Abstrak (Polymerase Chain Reaction, PCR) adalah
BAB III METODOLOGI PENELITIAN. Jenis penelitian yang digunakan adalah penelitian dasar dengan metode
 24 BAB III METODOLOGI PENELITIAN A. Jenis Penelitian Jenis penelitian yang digunakan adalah penelitian dasar dengan metode penelitian deskriptif. B. Objek Penelitian Empat spesies burung anggota Famili
24 BAB III METODOLOGI PENELITIAN A. Jenis Penelitian Jenis penelitian yang digunakan adalah penelitian dasar dengan metode penelitian deskriptif. B. Objek Penelitian Empat spesies burung anggota Famili
HASIL DAN PEMBAHASAN. DNA Genom
 IV. HASIL DAN PEMBAHASAN A. Isolasi DNA Metode isolasi dilakukan untuk memisahkan DNA dari komponen sel yang lain (Ilhak dan Arslan, 2007). Metode isolasi ini sesuai dengan protokol yang diberikan oleh
IV. HASIL DAN PEMBAHASAN A. Isolasi DNA Metode isolasi dilakukan untuk memisahkan DNA dari komponen sel yang lain (Ilhak dan Arslan, 2007). Metode isolasi ini sesuai dengan protokol yang diberikan oleh
BAB IV HASIL DAN PEMBAHASAN
 BAB IV HASIL DAN PEMBAHASAN 4.1 Uji Kuantitas DNA Udang Jari (Metapenaeus elegans De Man, 1907) Laguna Segara Anakan, Cilacap, Jawa Tengah dengan Spektrofotometer Pengujian kualitas DNA udang jari (Metapenaeus
BAB IV HASIL DAN PEMBAHASAN 4.1 Uji Kuantitas DNA Udang Jari (Metapenaeus elegans De Man, 1907) Laguna Segara Anakan, Cilacap, Jawa Tengah dengan Spektrofotometer Pengujian kualitas DNA udang jari (Metapenaeus
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Jenis Penelitian Penelitian ini merupakan penelitian murni yang dilakukan dengan metode deskriptif, yaitu suatu metode penelitian untuk membuat deskripsi, gambaran atau lukisan
BAB III METODE PENELITIAN A. Jenis Penelitian Penelitian ini merupakan penelitian murni yang dilakukan dengan metode deskriptif, yaitu suatu metode penelitian untuk membuat deskripsi, gambaran atau lukisan
BAB I PENDAHULUAN. di udara, darat, maupun laut. Keanekaragaman hayati juga merujuk pada
 BAB I PENDAHULUAN 1.1 Latar Belakang Keanekaragaman hayati adalah seluruh keragaman bentuk kehidupan di bumi. Keanekaragaman hayati terjadi pada semua lingkungan mahluk hidup, baik di udara, darat, maupun
BAB I PENDAHULUAN 1.1 Latar Belakang Keanekaragaman hayati adalah seluruh keragaman bentuk kehidupan di bumi. Keanekaragaman hayati terjadi pada semua lingkungan mahluk hidup, baik di udara, darat, maupun
PRAKATA. Alhamdulillah syukur senantiasa penulis panjatkan kepada Allah swt., atas
 PRAKATA Alhamdulillah syukur senantiasa penulis panjatkan kepada Allah swt., atas segala nikmat dan karunia-nya, penulisan Tugas Akhir dengan judul Keragaman Genetik Abalon (Haliotis asinina) Selat Lombok
PRAKATA Alhamdulillah syukur senantiasa penulis panjatkan kepada Allah swt., atas segala nikmat dan karunia-nya, penulisan Tugas Akhir dengan judul Keragaman Genetik Abalon (Haliotis asinina) Selat Lombok
LEMBAR PENGESAHAN Laporan lengkap praktikum Genetika dan Biologi Molekuler dengan judul Isolasi DNA Bawang Bombay Dengan Cara Sederhana yang disusun o
 LAPORAN LENGKAP PRAKTIKUM GENETIKA DAN BIOLOGI MOLEKULER (ISOLASI DNA BAWANG BOMBAY DENGAN CARA SEDERHANA) Disusun oleh: NAMA : LASINRANG ADITIA NIM : 60300112034 KELAS : BIOLOGI A KELOMPOK : V (Lima)
LAPORAN LENGKAP PRAKTIKUM GENETIKA DAN BIOLOGI MOLEKULER (ISOLASI DNA BAWANG BOMBAY DENGAN CARA SEDERHANA) Disusun oleh: NAMA : LASINRANG ADITIA NIM : 60300112034 KELAS : BIOLOGI A KELOMPOK : V (Lima)
BAB XII. REAKSI POLIMERISASI BERANTAI
 BAB XII. REAKSI POLIMERISASI BERANTAI Di dalam Bab XII ini akan dibahas pengertian dan kegunaan teknik Reaksi Polimerisasi Berantai atau Polymerase Chain Reaction (PCR) serta komponen-komponen dan tahapan
BAB XII. REAKSI POLIMERISASI BERANTAI Di dalam Bab XII ini akan dibahas pengertian dan kegunaan teknik Reaksi Polimerisasi Berantai atau Polymerase Chain Reaction (PCR) serta komponen-komponen dan tahapan
I. PENDAHULUAN. A. Latar Belakang. Pasar pangan yang semakin global membawa pengaruh baik, namun
 I. PENDAHULUAN A. Latar Belakang Pasar pangan yang semakin global membawa pengaruh baik, namun masyarakat patut berhati-hati dengan bahan makanan dalam bentuk olahan atau mentah yang sangat mudah didapat
I. PENDAHULUAN A. Latar Belakang Pasar pangan yang semakin global membawa pengaruh baik, namun masyarakat patut berhati-hati dengan bahan makanan dalam bentuk olahan atau mentah yang sangat mudah didapat
EKSTRAKSI DNA. 13 Juni 2016
 EKSTRAKSI DNA 13 Juni 2016 Pendahuluan DNA: polimer untai ganda yg tersusun dari deoksiribonukleotida (dari basa purin atau pirimidin, gula pentosa,dan fosfat). Basa purin: A,G Basa pirimidin: C,T DNA
EKSTRAKSI DNA 13 Juni 2016 Pendahuluan DNA: polimer untai ganda yg tersusun dari deoksiribonukleotida (dari basa purin atau pirimidin, gula pentosa,dan fosfat). Basa purin: A,G Basa pirimidin: C,T DNA
BAB 4. METODE PENELITIAN
 BAB 4. METODE PENELITIAN Penelitian penanda genetik spesifik dilakukan terhadap jenis-jenis ikan endemik sungai paparan banjir Riau yaitu dari Genus Kryptopterus dan Ompok. Penelitian ini bertujuan untuk
BAB 4. METODE PENELITIAN Penelitian penanda genetik spesifik dilakukan terhadap jenis-jenis ikan endemik sungai paparan banjir Riau yaitu dari Genus Kryptopterus dan Ompok. Penelitian ini bertujuan untuk
III. BAHAN DAN METODE
 III. BAHAN DAN METODE Tempat dan Waktu Penelitian dilakukan di Laboratorium BIORIN (Biotechnology Research Indonesian - The Netherlands) Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB. Penelitian
III. BAHAN DAN METODE Tempat dan Waktu Penelitian dilakukan di Laboratorium BIORIN (Biotechnology Research Indonesian - The Netherlands) Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB. Penelitian
BAB III METODE PENELITIAN
 39 BAB III METODE PENELITIAN A. Desain Penelitian Penelitian yang dilakukan merupakan penelitian deskriptif. Penelitian membuat deskripsi secara sistematis, faktual dan akurat mengenai fakta-fakta dan
39 BAB III METODE PENELITIAN A. Desain Penelitian Penelitian yang dilakukan merupakan penelitian deskriptif. Penelitian membuat deskripsi secara sistematis, faktual dan akurat mengenai fakta-fakta dan
MATERI DAN METODE Lokasi dan Waktu Materi Sampel Pengambilan Sampel Ekstraksi DNA Primer
 MATERI DAN METODE Lokasi dan Waktu Penelitian ini dilaksanakan pada bulan Juni hingga Nopember 2010. Penelitian dilakukan di Laboratorium Pemuliaan dan Genetik Molekuler, Bagian Pemuliaan dan Genetik Ternak,
MATERI DAN METODE Lokasi dan Waktu Penelitian ini dilaksanakan pada bulan Juni hingga Nopember 2010. Penelitian dilakukan di Laboratorium Pemuliaan dan Genetik Molekuler, Bagian Pemuliaan dan Genetik Ternak,
MATERI DAN METODE. Lokasi dan Waktu. Materi
 MATERI DAN METODE Lokasi dan Waktu Penelitian ini dilaksanakan di Laboratorium Genetika Molekuler, Bagian Pemuliaan dan Genetika Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan,
MATERI DAN METODE Lokasi dan Waktu Penelitian ini dilaksanakan di Laboratorium Genetika Molekuler, Bagian Pemuliaan dan Genetika Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan,
Metode-metode dalam biologi molekuler : isolasi DNA, PCR, kloning, dan ELISA
 Metode-metode dalam biologi molekuler : isolasi DNA, PCR, kloning, dan ELISA Dr. Syazili Mustofa, M.Biomed Lektor mata kuliah ilmu biomedik Departemen Biokimia, Biologi Molekuler, dan Fisiologi Fakultas
Metode-metode dalam biologi molekuler : isolasi DNA, PCR, kloning, dan ELISA Dr. Syazili Mustofa, M.Biomed Lektor mata kuliah ilmu biomedik Departemen Biokimia, Biologi Molekuler, dan Fisiologi Fakultas
4 HASIL DAN PEMBAHASAN
 24 4 HASIL DAN PEMBAHASAN 4.1 Isolasi dan Purifikasi Bakteri Isolasi merupakan proses pemindahan organisme dari habitat asli ke dalam suatu habitat baru untuk dapat dikembangbiakkan. Purifikasi merupakan
24 4 HASIL DAN PEMBAHASAN 4.1 Isolasi dan Purifikasi Bakteri Isolasi merupakan proses pemindahan organisme dari habitat asli ke dalam suatu habitat baru untuk dapat dikembangbiakkan. Purifikasi merupakan
METODOLOGI PENELITIAN. Tempat dan Waktu Penelitian. Bahan dan Alat Penelitian
 14 METODOLOGI PENELITIAN Tempat dan Waktu Penelitian Tempat penelitian dilakukan di Laboratorium Unit Pelayanan Mikrobiologi Terpadu, Bagian Mikrobiologi Kesehatan, Departemen Ilmu Penyakit Hewan dan Kesehatan
14 METODOLOGI PENELITIAN Tempat dan Waktu Penelitian Tempat penelitian dilakukan di Laboratorium Unit Pelayanan Mikrobiologi Terpadu, Bagian Mikrobiologi Kesehatan, Departemen Ilmu Penyakit Hewan dan Kesehatan
Bab III Bahan dan Metode III.1 Bahan III. 2 Alat
 Bab III Bahan dan Metode III.1 Bahan Pada penelitian ini, sampel yang digunakan dalam penelitian, adalah cacing tanah spesies L. rubellus yang berasal dari peternakan cacing tanah lokal di Sekeloa, Bandung.
Bab III Bahan dan Metode III.1 Bahan Pada penelitian ini, sampel yang digunakan dalam penelitian, adalah cacing tanah spesies L. rubellus yang berasal dari peternakan cacing tanah lokal di Sekeloa, Bandung.
BAB III BAHAN DAN CARA KERJA. Penelitian dilakukan di Laboratorium Institute of Human Virology and
 23 BAB III BAHAN DAN CARA KERJA A. LOKASI DAN WAKTU PENELITIAN Penelitian dilakukan di Laboratorium Institute of Human Virology and Cancer Biology of the University of Indonesia (IHVCB-UI), Jl. Salemba
23 BAB III BAHAN DAN CARA KERJA A. LOKASI DAN WAKTU PENELITIAN Penelitian dilakukan di Laboratorium Institute of Human Virology and Cancer Biology of the University of Indonesia (IHVCB-UI), Jl. Salemba
JADWAL PRAKTIKUM BIOKIMIA
 JADWAL PRAKTIKUM BIOKIMIA Waktu Kegiatan dan Judul Percobaan 2 Februari 2018 Penjelasan Awal Praktikum di Lab. Biokimia Dasar 9 Februari 2018 23 Februari 2018 2 Maret 2018 9 Maret 2018 16 Maret 2018 23
JADWAL PRAKTIKUM BIOKIMIA Waktu Kegiatan dan Judul Percobaan 2 Februari 2018 Penjelasan Awal Praktikum di Lab. Biokimia Dasar 9 Februari 2018 23 Februari 2018 2 Maret 2018 9 Maret 2018 16 Maret 2018 23
LAPORAN II (ISOLASI DNA GENOM)
 LAPORAN PRAKTIKUM REKAYASA GENETIKA LAPORAN II (ISOLASI DNA GENOM) KHAIRUL ANAM P051090031/BTK BIOTEKNOLOGI SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2010 0 ISOLASI DNA GENOM TUJUAN 16s rrna. Praktikum
LAPORAN PRAKTIKUM REKAYASA GENETIKA LAPORAN II (ISOLASI DNA GENOM) KHAIRUL ANAM P051090031/BTK BIOTEKNOLOGI SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2010 0 ISOLASI DNA GENOM TUJUAN 16s rrna. Praktikum
Penelitian akan dilaksanakan pada bulan Februari-Agustus 2010 di Laboratorium Zoologi Departemen Biologi, FMIPA, IPB.
 Kolokium Ajeng Ajeng Siti Fatimah, Achmad Farajallah dan Arif Wibowo. 2009. Karakterisasi Genom Mitokondria Gen 12SrRNA - COIII pada Ikan Belida Batik Anggota Famili Notopteridae. Kolokium disampaikan
Kolokium Ajeng Ajeng Siti Fatimah, Achmad Farajallah dan Arif Wibowo. 2009. Karakterisasi Genom Mitokondria Gen 12SrRNA - COIII pada Ikan Belida Batik Anggota Famili Notopteridae. Kolokium disampaikan
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian yang dilakukan adalah penelitian deskriptif. Penelitian deskriptif adalah penelitian yang mendeskripsikan suatu gambaran yang sistematis dengan
BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian yang dilakukan adalah penelitian deskriptif. Penelitian deskriptif adalah penelitian yang mendeskripsikan suatu gambaran yang sistematis dengan
BAB III METODE PENELITIAN. mengekstraksi DNA dari dari beberapa spesimen herbarium Rafflesia arnoldii
 21 BAB III METODE PENELITIAN 3.1 Jenis Penelitian Penelitian ini merupakan penelitian deskriptif kuantitatif untuk mengekstraksi DNA dari dari beberapa spesimen herbarium Rafflesia arnoldii R.Br dan Rafflesia
21 BAB III METODE PENELITIAN 3.1 Jenis Penelitian Penelitian ini merupakan penelitian deskriptif kuantitatif untuk mengekstraksi DNA dari dari beberapa spesimen herbarium Rafflesia arnoldii R.Br dan Rafflesia
1. PENDAHULUAN 1.1 Latar Belakang
 1 1. PENDAHULUAN 1.1 Latar Belakang Asam deoksiribonukleat atau deoxyribonucleic acid (DNA) merupakan salah satu jenis asam nukleat yang membawa ribuan gen yang menentukan sifat tertentu dari satu generasi
1 1. PENDAHULUAN 1.1 Latar Belakang Asam deoksiribonukleat atau deoxyribonucleic acid (DNA) merupakan salah satu jenis asam nukleat yang membawa ribuan gen yang menentukan sifat tertentu dari satu generasi
BAB II KAJIAN PUSTAKA. sel pada tubuh memiliki DNA yang sama dan sebagian besar terdapat pada
 BAB II KAJIAN PUSTAKA 2.1. DNA (Deoxyribonuleic Acid) Deoxyribonucleic acid (DNA) adalah suatu materi yang terdapat pada tubuh manusia dan semua makhluk hidup yang diwarisi secara turun menurun. Semua
BAB II KAJIAN PUSTAKA 2.1. DNA (Deoxyribonuleic Acid) Deoxyribonucleic acid (DNA) adalah suatu materi yang terdapat pada tubuh manusia dan semua makhluk hidup yang diwarisi secara turun menurun. Semua
TINJAUAN PUSTAKA. Ikan Lele Dumbo (Clarias gariepinus) Menurut Kottelat dkk., (1993), klasifikasi dari ikan lele dumbo adalah.
 TINJAUAN PUSTAKA Ikan Lele Dumbo (Clarias gariepinus) Menurut Kottelat dkk., (1993), klasifikasi dari ikan lele dumbo adalah sebagai berikut: Kingdom Filum Kelas Ordo Family Genus : Animalia : Chordata
TINJAUAN PUSTAKA Ikan Lele Dumbo (Clarias gariepinus) Menurut Kottelat dkk., (1993), klasifikasi dari ikan lele dumbo adalah sebagai berikut: Kingdom Filum Kelas Ordo Family Genus : Animalia : Chordata
3. METODE PENELITIAN
 29 3. METODE PENELITIAN 3.1. Lokasi dan Waktu Penelitian Lokasi penelitian meliputi Laut Sulawesi, Selat Makassar, Teluk Bone, Laut Flores, Laut Banda, Teluk Tolo, Laut Maluku dan Teluk Tomini (Gambar
29 3. METODE PENELITIAN 3.1. Lokasi dan Waktu Penelitian Lokasi penelitian meliputi Laut Sulawesi, Selat Makassar, Teluk Bone, Laut Flores, Laut Banda, Teluk Tolo, Laut Maluku dan Teluk Tomini (Gambar
BAB II TINJAUAN PUSTAKA. Tubuh manusia tersusun atas sel yang membentuk jaringan, organ, hingga
 6 BAB II TINJAUAN PUSTAKA 2.1 DNA Mitokondria Tubuh manusia tersusun atas sel yang membentuk jaringan, organ, hingga sistem organ. Dalam sel mengandung materi genetik yang terdiri dari DNA dan RNA. Molekul
6 BAB II TINJAUAN PUSTAKA 2.1 DNA Mitokondria Tubuh manusia tersusun atas sel yang membentuk jaringan, organ, hingga sistem organ. Dalam sel mengandung materi genetik yang terdiri dari DNA dan RNA. Molekul
HASIL DAN PEMBAHASAN. Uji Kualitatif dan Kuantitatif Hasil Isolasi RNA
 6 konsentrasinya. Untuk isolasi kulit buah kakao (outer pod wall dan inner pod wall) metode sama seperti isolasi RNA dari biji kakao. Uji Kualitatif dan Kuantitatif Hasil Isolasi RNA Larutan RNA hasil
6 konsentrasinya. Untuk isolasi kulit buah kakao (outer pod wall dan inner pod wall) metode sama seperti isolasi RNA dari biji kakao. Uji Kualitatif dan Kuantitatif Hasil Isolasi RNA Larutan RNA hasil
III. MATERI DAN METODE. Fakultas Pertanian dan Peternakan Universitas Islam Negeri Sultan Syarif Kasim
 III. MATERI DAN METODE 3.1 Waktu dan Tempat Penelitian ini akan dilaksanakan di Laboratorium Genetika dan Pemuliaan Fakultas Pertanian dan Peternakan Universitas Islam Negeri Sultan Syarif Kasim Riau Pekanbaru
III. MATERI DAN METODE 3.1 Waktu dan Tempat Penelitian ini akan dilaksanakan di Laboratorium Genetika dan Pemuliaan Fakultas Pertanian dan Peternakan Universitas Islam Negeri Sultan Syarif Kasim Riau Pekanbaru
DAFTAR ISI DAFTAR TABEL... DAFTAR GAMBAR... DAFTAR LAMPIRAN...
 DAFTAR ISI Bab Halaman DAFTAR TABEL... DAFTAR GAMBAR... DAFTAR LAMPIRAN... ix x xii I II III PENDAHULUAN 1.1 Latar Belakang... 1 1.2 Identifikasi Masalah... 2 1.3 Tujuan Penelitian... 2 1.4 Kegunaan Penelitian...
DAFTAR ISI Bab Halaman DAFTAR TABEL... DAFTAR GAMBAR... DAFTAR LAMPIRAN... ix x xii I II III PENDAHULUAN 1.1 Latar Belakang... 1 1.2 Identifikasi Masalah... 2 1.3 Tujuan Penelitian... 2 1.4 Kegunaan Penelitian...
Metodologi Penelitian. Metode, bahan dan alat yang digunakan dalam penelitian ini akan dipaparkan pada bab ini.
 Bab III Metodologi Penelitian Metode, bahan dan alat yang digunakan dalam penelitian ini akan dipaparkan pada bab ini. III.1 Rancangan Penelitian Secara garis besar tahapan penelitian dijelaskan pada diagram
Bab III Metodologi Penelitian Metode, bahan dan alat yang digunakan dalam penelitian ini akan dipaparkan pada bab ini. III.1 Rancangan Penelitian Secara garis besar tahapan penelitian dijelaskan pada diagram
METODE. Materi. Tabel 1. Jumlah Sampel DNA yang Digunakan dan Asal Pengambilan Sampel Darah.
 METODE Lokasi dan Waktu Penelitian ini dilaksanakan di Laboratorium Pemuliaan dan Genetika Molekuler, Bagian Pemuliaan dan Genetik Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan,
METODE Lokasi dan Waktu Penelitian ini dilaksanakan di Laboratorium Pemuliaan dan Genetika Molekuler, Bagian Pemuliaan dan Genetik Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan,
