STOIKIOMETRI A. HUKUM-HUKUM DASAR KIMIA B. PERHITUNGAN KIMIA
|
|
|
- Yohanes Yuwono
- 7 tahun lalu
- Tontonan:
Transkripsi
1 4 STOIKIOMETRI A. HUKUM-HUKUM DASAR KIMIA B. PERHITUNGAN KIMIA Kata Stoikiometri berasal dari bahasa Yunani, stoicheion yang berarti unsur (partikel) dan metron yang berarti pengukuran. Stoikiometri menggambarkan hubungan kuantitatif antara zat-zat yang terlibat dalam reaksi kimia. Dasardasar stoikiometri, kita dapat menghitung massa atau volume pereaksi yang diperlukan untuk memperoleh massa atau volume hasil reaksi yang dikehendaki. Pengetahuan ini sangat diperlukan untuk menghitung bahan baku yang dibutuhkan guna menghasilkan sejumlah produk yang dikehendaki dalam industri. Setelah Anda mempelajari stokiometri Anda diharapkan dapat membuktikan dan mengkomunikasikan berlakunya hukum dasar kimia. Hubungan antara konsep satu dengan yang lain dalam perhitungan kimia dapat Anda perhatikan pada peta konsep berikut.
2 66 KIMIA X SMA STOIKIOMETRI meliputi terdiri dari Ar Mr M O L perhitungan kimia penentuan rumus kimia perhitungan massa perhitungan volume massa molar persamaan reaksi untuk persamaan pembatas volume molar jumlah partikel dapat RE RM diukur hukum dasar kimia hukum kekekalan massa hukum perbandingan tetap hukum kelipatan perbandingan hukum perbandingan volume hukum Avogadro keadaan gas lain diketahui keadaan standart keadaan suhu tekanan tertentu terdiri menghitung berkaitan tetapan Avogadro Peta Konsep Stoikiometri A. HUKUM-HUKUM DASAR KIMIA Pada awal abad ke-18 para ilmuwan mempelajari secara kuantitatif susunan zat-zat melalui percobaan-percobaan dari berbagai reaksi kimia. Hasil percobaan yang diperoleh para ilmuwan tersebut terangkum dalam Hukum-hukum Dasar Kimia.
3 KIMIA X SMA Hukum Kekekalan Massa Perhatikan hal-hal berikut ini: Bagaimanakah massa rokok sebelum dibakar dan sesudah dibakar? Bagaimanakah massa buah mangga sebelum masak (matang) dan sesudah masak? Bagaimanakah massa besi sebelum dan sesudah berkarat? Dalam serangkaian percobaan pembakaran dan proses-proses yang berhubungan dengan pembakaran, Antoine Laurent Lavoisier ( ) menyatakan bahwa dalam semua proses pembakaran suatu materi dengan oksigen dari udara maka materi tersebut akan mengalami perubahan. Lavoisier melakukan percobaan, di mana cairan merkuri bereaksi dengan oksigen membentuk merkuri oksida yang berwarna merah (mercury calx). Bila merkuri oksida dipanaskan lagi, maka akan terurai menghasilkan cairan merkuri dan gas oksigen, yang jumlahnya sama dengan yang dibutuhkan pada waktu pembentukan merkuri oksida. Berdasarkan serangkaian percobaannya, Lavoisier mengemukakan suatu hukum dalam bukunya yang berjudul "Treaite Elementaire de Chemie" yang dikenal dengan Hukum Kekekalan Massa. Hukum Kekekalan Massa berbunyi: Jumlah massa zat sebelum reaksi dan sesudah reaksi sama. Percobaan: Membuktikan Hukum Kekekalan Massa tutup gabus larutan HCl 1M butiran Al Rangkailah alat seperti gambar (Pipa Y yang ujung-ujungnya secara terpisah diisi dengan larutan HCl 1 M pada salah satu ujung dan butiran logam Al pada ujung yang lain, kemudian timbanglah) Catat massa (berat) sebelum kedua zat tersebut direaksikan. Miringkan pipa tersebut sehingga larutan HCl bercampur dengan logam Al. Apakah yang menunjukkan terjadinya reaksi kimia? Timbang kembali semua alat beserta isinya - Catat massa (beratnya) - Bagaimana massa sebelum dan sesudah reaksi?
4 68 KIMIA X SMA Latihan 1 1. Lengkapilah data pada tabel berikut, reaksi antara besi dengan belerang menghasilkan besi (II) sulfida No. Massa sebelum reaksi Massa sesudah reaksi Besi (gr) Belerang (gr) Besi(II) sulfida (gr) Sejumlah 12,7 gram tembaga dipijarkan dengan belerang menghasilkan 19,1 gram tembaga (II) sulfida. Berapa gram-kah belerang yang telah bereaksi? 2. Hukum Perbandingan Tetap (Hukum Proust) Pada proses pembentukan senyawa dari unsur-unsurnya, menunjukkan adanya hubungan massa yang bereaksi secara kuantitatif. Karena itu para ilmuwan kimia mendapatkan dorongan kuat untuk mencari hubungan massa antara zat yang menyusun senyawa. Joseph Louis Proust ( ) melakukan percobaan dengan memanaskan kalsium karbonat, (CaCO 3 ) sehingga menghasilkan gas CO 2. Ternyata, persentase unsur-unsur penyusun gas CO 2 dari hasil pemanasan kalsium karbonat sama dengan persentase CO 2 yang ada di alam. Proust mengembangkan hasil temuannya dan mendapatkan suatu hukum yang disebut Hukum Perbandingan Tetap. Hukum Perbandingan Tetap berbunyi: Perbandingan massa unsur-unsur penyusun senyawa selalu tetap Contoh: Data berikut diperoleh dengan cara membakar logam magnesium (mereaksikan magnesium dengan gas oksigen) menghasilkan magnesium oksida. Tabel 4.1 Massa Massa Massa Perbandingan massa No. magnesium oksigen magnesium oksida magnesium dan oksigen (gr) (gr) (gr) dalam magnesium oksida 1. 0,60 0,40 1,00 0,60 : 0,40 3 : ,48 0,32 0,80 0,48 : 0,32 3 : ,36 0,24 0,60 0,36 : 0,24 3 : 2
5 KIMIA X SMA 69 Berdasarkan data di atas membuktikan bahwa perbandingan massa magnesium dan massa oksigen dalam magnesium oksida memiliki nilai tetap yaitu 3: 2, walaupun massa magnesium dan oksigen yang disediakan berbeda-beda. Latihan 2 1. Hasil percobaan reaksi antara logam tembaga dengan belerang diperoleh data sebagai berikut. No. Massa tembaga Massa belerang Massa tembaga belerang (gr) (gr) (gr) 1. 4,23 2,13 6, ,17 1,60 4, ,54 1,28 3, ,12 1,06 3,18 a. Berapakah perbandingan massa tembaga dan belerang dalam senyawa tembaga belerang? Apakah data tersebut menunjukkan berlakunya hukum Proust? b. Buatlah grafik antara massa tembaga dengan massa belerang! 2. Dalam senyawa air, perbandingan massa hidrogen dan massa oksigen adalah 1 : 8. Jika 40 gram hidrogen direaksikan dengan oksigen, ternyata diperoleh 270 gram air, berapa gram oksigen yang telah bereaksi? 3. Hukum Kelipatan Perbandingan (Hukum Dalton) John Dalton ( ) mengamati bahwa karbon dan oksigen dapat membentuk dua macam senyawa. Pada senyawa pertama perbandingan massa karbon dan oksigen adalah 3 : 4, sedangkan pada senyawa kedua perbandingan karbon dan oksigen adalah 3 : 8. Pada massa karbon yang sama, perbandingan massa oksigen dalam kedua senyawa itu merupakan bilangan bulat dan sederhana, yaitu 1 : 2. Massa atom karbon dan oksigen dalam kedua senyawa di atas, digambarkan oleh Dalton sebagai berikut. Senyawa I Senyawa II massa oksigen massa karbon Gambar 4.1 Hukum Kelipatan Perbandingan.
6 70 KIMIA X SMA Beberapa penelitian terhadap unsur-unsur yang membentuk lebih dari satu senyawa, Dalton menyatakan pendapatnya, bahwa: "Bila dua unsur membentuk dua senyawa atau lebih dan salah satu unsurnya mempunyai massa yang sama maka massa unsur yang lainnya berbanding sebagai bilangan bulat dan sederhana." Pernyataan Dalton tersebut disebut Hukum Kelipatan Perbandingan Contoh: Belerang dan oksigen dapat membentuk dua senyawa yaitu SO 2 dan SO 3. Perhatikan tabel berikut ini. Tabel 4.2 Massa Massa unsur pembentuk Senyawa senyawa senyawa (g) Belerang (g) Oksigen (g) Perbandingan massa belerang dan oksigen SO 2 6,4 3,2 3,2 3,2 : 3,2 1 : 1 2 : 2 SO 3 8,0 3,2 4,8 3,2 : 4,8 1 : 1,5 2 : 3 Dari data di atas ternyata, untuk massa S yang sama, perbandingan massa O yaitu 2 : 3, yang merupakan bilangan bulat dan sederhana. Latihan 3 1. Unsur A dan B bergabung membentuk dua senyawa. Pada senyawa I mengandung 42,9% A dan senyawa II mengandung 27,3% A. Buktikan bahwa kedua senyawa itu sesuai Hukum Kelipatan Perbandingan! 2. Unsur N dan O dapat membentuk tiga senyawa oksida nitrogen. Persentase N dalam ketiga oksida nitrogen tersebut berturut-turut adalah 46,7%, 36,8% dan 25,9%. Apakah dalam senyawa itu berlaku Hukum Kelipatan Perbandingan? Jelaskan! 4. Hukum Perbandingan Volum (Hukum Gay-Lussac) Percobaan tentang beberapa reaksi yang berwujud gas pada suhu dan tekanan tertentu telah dilakukan oleh Gay-Lussac ( ). Berdasarkan serangkaian percobaannya diperoleh data sebagai berikut: a. satu liter gas hidrogen bereaksi dengan satu liter gas klorin, menghasilkan dua liter gas hidrogen klorida; b. dua liter gas hidrogen bereaksi dengan satu liter gas oksigen, menghasilkan dua liter uap air; c. tiga liter gas hidrogen beraksi dengan satu liter gas nitrogen, menghasilkan 2 liter gas ammonia.
7 KIMIA X SMA 71 Reaksi di atas selanjutnya dapat dituliskan persamaan reaksinya sebagai berikut. 1) H 2(g) + Cl 2(g) 2HCl (g) Perbandingan volumnya: 1: 1: 2 1 liter 1 liter 2 liter 2) 2H 2(g) + O 2(g) 2H 2 O (g) Perbandingan volumnya: 2: 1: 2 2 liter 1 liter 2 liter 3) 3H 2(g) + N 2(g) 2NH 3(g) Perbandingan volumnya: 3: 1: 2 3 liter 1 liter 2 liter Berdasarkan hasil percobaan tersebut Gay Lussac mengemukakan hukum yang disebut Hukum Perbandingan Volum, berbunyi: "Volum gas-gas yang bereaksi dan volum gas-gas hasil reaksi, jika diukur pada suhu dan tekanan yang sama, akan berbanding sebagai bilangan bulat dan sederhana". Berdasarkan hukum tersebut, untuk reaksi zat yang berwujud gas, perbandingan koefisien reaksi ekivalen dengan perbandingan volumnya, sehingga berlaku hubungan sebagai berikut: Volum gas X Volum gas Y Koefisien gas X Koefisien gas Y Contoh Soal: Sebanyak 4 liter gas etana dibakar sempurna menghasilkan gas karbon dioksida dan uap air, menurut reaksi: C 2 H 6(g) + O 2(g) CO 2(g) + H 2 O (g) Hitunglah: a. volum gas oksigen yang diperlukan. b. volum gas CO 2 yang terbentuk. c. volum uap air yang terbentuk. Persamaan reaksi setara: 2C 2 H 6(g) + 7O 2(g) 4CO 2(g) + 6H 2 O (g) a. Volum O 2 yang diperlukan b. Volum CO 2 yang terbentuk x 4 liter 14 liter x 4 liter 8 liter c. Volum uap air 6 2 x 4 liter 12 liter
8 72 KIMIA X SMA Latihan 4 Pembakaran sempurna 4 liter gas amonia NH 3 menghasilkan gas nitrogen dioksida NO 2 dan uap air, menurut reaksi: NH 3(g) + O 2(g) NO 2(g) + H 2 O (g) (reaksi belum setara) Hitunglah: a. Volum gas oksigen yang diperlukan. b. Volum gas NO 2 yang dihasilkan. c. Volum uap air yang dihasilkan. d. Jika udara mengandung 20% gas oksigen, berapa liter volum udara yang diperlukan? 5. Hipotesis Avogadro Pada saat Gay Lussac mengemukakan hasil percobaannya, para ilmuwan saat itu belum menerima, karena tidak sesuai dengan teori atom Dalton. Menurut teori atom Dalton, partikel terkecil dari semua unsur adalah atom-atom tunggal dan partikel senyawa adalah gabungan dari atom yang berbeda dan disebut atom senyawa. Amedeo Avogadro ( ) mengemukakan pendapatnya, bahwa hukum Gay Lussac dan teori Dalton dapat sejalan, apabila ada dua anggapan sebagai berikut. a. Volum yang sama dari gas-gas yang berbeda, pada suhu dan tekanan yang sama mempunyai jumlah partikel yang sama. b. Pada dasarnya yang dimaksud partikel gas adalah molekul-molekul yang merupakan gabungan terdiri atas sejumlah atom yang bergabung. Avogadro mengusulkan bahwa gas hidrogen dan oksigen keduanya berada sebagai molekul-molekul diatomik yang merupakan gabungan dari atom-atom yang sama, yaitu sebagai H 2 dan O liter gas hidrogen 2 molekul gas hidrogen 1 liter gas oksigen 1 molekul gas oksigen Gambar liter uap air 2 molekul uap air
9 KIMIA X SMA 73 Apa yang diusulkan oleh Avogadro tersebut pada kurun waktu berikutnya diperkuat oleh ilmuwan dari Jerman, Stanisalao Cannizaro ( ). Dia mengemukakan daftar massa atom yang diperolehnya dari pendapat Avogadro. Pendapat Avogadro ini dikenal dengan Hipotesa Avogadro. Dari berbagai percobaan membuktikan kebenaran dari hipotesa Avogadro maka hipotesa Avogadro dapat disebut Hukum Avogadro, berbunyi: "Pada suhu dan tekanan yang sama gas-gas yang volumnya sama akan mempunyai jumlah partikel yang sama". Contoh soal: Pada suhu dan tekanan tertentu, 2 liter gas nitrogen tepat bereaksi dengan 4 liter gas oksigen menghasilkan 4 liter oksida nitogen, N x O y. Bagaimana rumus oksida tersebut? Perbandingan volum sama dengan perbandingan koefisien reaksi, sehingga reaksinya dapat ditulis sebagai berikut: 2N 2(g) + 4O 2(g) 4N x O y(g) Dalam persamaan reaksi jumlah atom kiri harus sama dengan jumlah atom kanan, sehingga harga x dan y dapat ditentukan sebagai berikut. Jumlah atom N kiri jumlah atom N kanan 2 x 2 4x x 1 Jumlah atom O kiri jumlah atom O kanan 4 x 2 4y y 2 Jadi rumus oksida tersebut adalah NO 2 Latihan 5 1. Sebanyak 200 ml gas klor, Cl 2 (P, T) tepat bereaksi dengan 500 ml gas oksigen, O 2 (P, T) menghasilkan 200 ml oksida klor, Cl x O y (P, T). Tentukan rumus oksida tersebut! 2. Pada suhu dan tekanan tertentu, 6 liter gas NH 3 mempunyai 2 x molekul. Pada P dan T yang sama, berapa jumlah molekul 4 liter gas SO 3?
10 74 KIMIA X SMA B. PERHITUNGAN KIMIA Pembahasan perhitungan kimia dimulai dari pengertian massa molekul relatif (Mr), konsep mol, penerapan hukum Gay Lussac serta hukum Avogadro dalam persamaan reaksi, penentuan rumus empiris rumus molekul, air kristal dan kadar zat dalam senyawa, serta pereaksi pembatas. 1. Massa Molekul Relatif (Mr) Partikel dasar suatu senyawa adalah molekul yang merupakan gabungan dari atom-atom suatu unsur. Oleh karena itu penentuan massa molekul relatif (Mr) juga menggunakan pembanding atom karbon-12. Jadi, massa molekul relatif adalah perbandingan massa rata-rata satu molekul terhadap 1 12 kali massa satu atom karbon-12. Untuk senyawa yang terdiri atas ion-ion digunakan istilah massa rumus relatif, dengan lambang yang sama, yaitu Mr. Massa molekul relatif (Mr) suatu senyawa X 2 Y 3 dapat dirumuskan sebagai berikut: Massa rata - rata 1 molekul X Y Mr senyawa X Y x massa 1 atom C 12 Untuk memperoleh harga Mr dijabarkan sebagai berikut: (2 massa rata - rata atom X)+(3 massa rata - rata atom Y) Mr X2Y x massa 1 atom C 12 2 massa rata - rata atom X 3 massa rata - rata atom Y + 1 x massa 1 atom C x massa 1 atom C Ar X + 3. Ar Y Jadi massa molekul relatif (Mr) merupakan penjumlahan dari massa atom relatif (Ar) atom-atom penyusun molekul atau senyawa. Contoh soal: Hitunglah massa molekul relatif asam sulfat, H 2 SO 4 jika diketahui Ar H 1, S 32 dan O 16. Mr H 2 SO 4 (2 x Ar H) + (1 x Ar S) + (4 x Ar O) (2 x 1) + (1 x 32) + (4 x 16)
11 KIMIA X SMA 75 Latihan 6 Hitunglah Mr senyawa berikut ini! 1. NH 3 6. KMnO 4 2. HNO 3 7. H 3 PO 4 3. Mg(OH) 2 8. Na 2 CO 3 4. Al(OH) 3 9. Ca 3 (PO 4 ) 2 5. FeSO Al 2 (SO 4 ) 3 Diketahui Ar H 1, C 12, N 14, O 16, Na 23, Mg 24, Al 27, P 31, S 32, Ca 40, Mn 55, Fe 56 dan K Mol Dalam perhitungan kimia para ahli kimia sepakat mencari satuan yang digunakan untuk menyatakan jumlah zat yaitu mol. Telah kita ketahui bahwa partikel dasar penyusun suatu unsur adalah atom, sedangkan partikel penyusun senyawa berupa molekul atau ion. Karena ukuran partikel dasar tersebut sangat kecil maka untuk keperluan perhitungan digunakan satuan jumlah seperti halnya yang telah kita kenal dalam kehidupan sehari-hari yaitu lusin, kodi, rim, dan sebagainya. IUPAC menetapkan satuan mol tersebut didasarkan pada atom C-12, yang dinyatakan sebagai berikut. Satu mol suatu zat adalah banyaknya partikel dalam suatu zat di mana jumlahnya sama dengan banyaknya atom yang terdapat dalam 12 gram C-12. Ilmuwan dari Jerman Johann Loschmidt pada tahun 1865 melalui percobaannya berhasil menghitung banyaknya atom yang terdapat dalam 12 gram C-12, yaitu sebanyak 6,02 x Bilangan ini selanjutnya disebut Tetapan Avogadro, sebab yang pertama menyatakan perlunya satuan jumlah bagi atom atau molekul adalah Amedeo Avogadro, dilambangkan L (Loschmidt) untuk menghargai jasa Loschmidt. 1 mol 6,02 x tetapan Avogadro (L) a. Hubungan Mol Dengan Jumlah Partikel Satu mol zat adalah banyaknya zat tersebut yang mengandung 6,02 x partikel. Partikel ini dalam zat dapat berupa atom, molekul atau ion.
12 76 KIMIA X SMA Contoh: 1 mol unsur tembaga (Cu) mengandung 6,02 x atom Cu 1 mol gas nitrogen (N 2 ) mengandung 6,02 x molekul N 2 1 mol gas karbon dioksida (CO 2 ) mengandung 6,02 x molekul CO 2 1 mol ion nitrat (NO - 3 ) mengandung 6,02 x ion NO - 3 Hubungan mol dengan jumlah partikel dapat dirumuskan: Jumlah partikel zat mol x L 1 mol 6,02 x partikel L Mol Jumlah partikel L Contoh soal: 1. Hitunglah jumlah partikel zat berikut: a. 2 mol aluminium (Al) b. 0,04 mol gas belerang dioksida (SO 2 ) c. 0,2 mol ion sulfat SO 2-4 a. Jumlah atom Al mol x L 2 mol x 6,02 x atom/mol 12,04 x atom Al b. Jumlah molekul SO 2 0,04 mol x 6,02 x molekul/mol 24,08 x molekul SO 2 c. Jumlah ion SO 2-4 0,2 mol x 6,02 x ion/mol 12,04 x ion SO Hitung mol zat berikut: a. 3,01 x atom besi (Fe) b. 6,02 x molekul asam nitrat (HNO 3 ) c. 15,05 x ion natrium (Na + ) Jumlah atom Fe a. Mol Fe L 22 3,10 x ,02 x , mol Fe
13 KIMIA X SMA 77 b. c. 20 6,02 x 10 molekul Mol HNO3 23 6,02 x 10 molekul/mol 0, 001 mol HNO ,05 x 10 ion Mol Na 23 6,02 x 10 ion/mol + 0, 025 mol Na 3. Hitunglah jumlah atom C dan atom O dalam 0,1 mol CO 2. Dalam 1 molekul CO 2 terdapat 1 atom C dan 2 atom O Jumlah atom C 1 x 0,1 x 6,02 x ,02 x atom Jumlah atom O 2 x 0,1 x 6,02 x ,04 x atom Latihan 7 Hitunglah: 1. Jumlah atom dalam 2 mol belerang! 2. Jumlah molekul CO 2 dalam 0,01 mol gas CO 2! 3. Jumlah mol dari 6,02 x molekul N 2! 4. Jumlah mol dari 24,8 x atom besi! 5. Jumlah atom S dan atom O dalam 1 mol SO 3! b. Hubungan Mol dengan Massa (gram) Pada penetapan satuan mol dijelaskan, bahwa dalam 12 gram karbon -12 (Ar C-12) terdapat 6,02 X atom karbon, dinyatakan sebagai satu mol. Massa atom karbon-12 dalam 1mol ini disebut massa molar karbon. Karena atom karbon-12 sebagai standar, maka massa molar zat secara umum dapat ditentukan berdasarkan atom karbon-12. Satuan massa molar adalah gram/mol atau gram mol -1.
14 78 KIMIA X SMA Perhatikan contoh pada tabel di bawah ini. Tabel 4.3 Hubungan Rumus Zat, Mr, dan Massa Molar Nama Rumus zat Massa 1 mol Ar atau Mr Massa molar zat (gr) (gr/mol) air H 2 O aluminium Al karbondioksida CO asam sulfat H 2 SO Dari tabel tersebut dapat disimpulkan sebagai berikut. Massa molar adalah massa 1 mol zat yang besarnya sama dengan massa atom relatif (Ar) atau massa molekul relatif (Mr) zat tersebut dan dinyatakan dalam gram. Pernyataan tersebut dapat dirumuskan: Massa molar (g/mol) Ar atau Mr gram Mol Ar atau Mr dan Gram Mol x Ar atau Mr Contoh soal: 1. Berapa gramkah massa 2 mol gas amonia, NH 3 (Ar H1, N14)? Mr NH (3 x 1) 17 massa NH 3 Mol x Mr 2 x gram NH 3 2. Hitunglah Ar unsur A jika 0,02 mol A massanya 1,12 gram. gram mol Ar 1,12 002, Ar 112, Ar ,
15 KIMIA X SMA Berapakah jumlah molekul yang terdapat dalam 8,8 gram gas CO 2 (Ar C 12, O 16)? Mr CO (2 x 16) 44 gram CO Mol CO2 2 Mr CO2 8, , mol Jumlah molekul CO 2 mol x L 0,2 x 6,02 x ,04 x 10 2 Latihan 8 1. Hitunglah massa zat berikut! a. 0,002 mol logam timbal (Ar Pb 207) b. 2 x 10-2 mol H 2 SO 4 (Ar H 1, O 16, S 32) c. 3,01 x atom besi (Ar Fe 56) d. 1,204 x molekul metana, CH 4 (Ar H 1, C 12) 2. Sebanyak 6,4 gram suatu unsur X mengandung 12,04 x atom X. Tentukanlah Ar unsur X! c. Hubungan Mol Dengan Volum 1) Volum Gas Pada Suhu dan Tekanan yang Sama Hukum Avogadro menyatakan bahwa: "Pada suhu dan tekanan yang sama semua gas yang volumnya sama mengandung jumlah partikel yang sama pula." Karena jumlah partikel sama, berarti gas-gas yang bervolum sama akan mempunyai jumlah mol yang sama. atau mol gas I mol gas II Sedangkan untuk gas-gas yang volumnya berbeda berlaku hubungan: Volume gas I Mol gas I V n atau 1 1 Volume gas II Mol gas II V2 n2
16 80 KIMIA X SMA Contoh Soal: 1. Pada suhu dan tekanan tertentu, 2 liter gas O 2 (Mr 32) massanya 3,2 gram. Berapa volum 7,5 gram gas NO (Mr 30 ) pada keadaan tersebut? Volume O2 Mol O 2 Volum NO Mol NO 2 gr O2/ Mr O 2 Volum NO gr NO/ Mr NO 2 3, 2/ 32 Volum NO 75, / 30 Volum NO 5 liter 2. Dalam suatu tabung yang bervolum 1 liter diisi 8 gram gas oksigen (O 2 ). Jika pada keadaan yang sama tabung tersebut diisi gas nitrogen, (N 2 ) berapa massa gas nitrogen tersebut? Ar N 14, O 16 Karena volume sama, maka molnya sama mol gas O 2 mol gas N2 gr O2 gr N 2 Mr O2 Mr N2 8 gr N x 28 gr N gram Latihan 9 1. Dalam ruang 2 liter diisi gas CO 2 ternyata mengandung 6,02 x molekul CO 2. Jika pada suhu dan tekanan yang sama diisi gas A ternyata massanya 8 gram. Berapa Mr gas A tersebut? 2. Pada suhu dan tekanan tertentu 4 liter gas SO 2 (Mr 64) massanya 19,2 gram. Berapa massa gas NO 2 (Mr 46) yang volumnya 2 liter? 3. Sebuah botol hampa mempunyai berat 30,50 gram. Jika diisi gas nitrogen, N 2 (Ar N 14) beratnya menjadi 31,9 gram. Akan tetapi jika botol tersebut diisi gas X beratnya menjadi 34,05 gram. Hitunglah Mr gas X!
17 KIMIA X SMA 81 2) Volum Gas Pada Keadaan Standar ( 0 o C, 1 atm) Volum molar gas menyatakan volum 1 mol gas pada suhu dan tekanan tertentu. Stanislao Cannizzaro ( ) dari Italia mengemukakan hasil percobaannya sebagai berikut. Setiap 1 mol gas apa saja pada suhu 0 o C dan tekanan 1 atmosfer mempunyai volum 22,4 liter. Sesuai dengan rumus gas ideal: P. V n. R. T P : tekanan gas (atm) V : volume gas (liter) n : mol gas R : tetapan gas ideal ( 0,082 liter atm/mol o K) T : suhu mutlak ( o C + 273) o K n. R. T V P 1 x 0,082 x , 386 liter ~ 22, 4 liter Suhu 0 o C (273 K) dan tekanan 1 atmosfer dikenal sebagai keadaan standar atau STP (Standard Temperature and Pressure). Jadi volum 1 mol gas pada keadaan standar disebut Volum Molar Standar. Pada keadaan standar, volum (liter) dari sejumlah mol (n) suatu gas, berlaku hubungan sebagai berikut. Volum gas (STP) n x 22,4 liter/mol atau mol liter 22, 4
18 82 KIMIA X SMA Contoh: 1. Hitunglah volum 2 mol gas oksigen pada keadaan standar. Volum O 2 2 mol x 22,4 liter/mol 44,8 liter 2. Berapakah mol gas nitrogen, jika pada suhu 0 o C dan tekanan 1 atm mempunyai 4,48 liter? 448, liter Mol N2 22, 4 liter/mol 02, mol 3. Berapakah gram gas CO 2 terdapat dalam 2240 ml pada STP? Ar C 12, O 16 Mr CO 2 44, volum CO ml 2,24 liter gram mol x Mr 224, liter gram 22, 4 liter/mol x 44 44, gram 4. Berapakah jumlah molekul yang terdapat dalam 6,72 liter gas hidrogen pada STP? jumlah partikel mol x L 672, liter 23 Molekul H2 x 6,02 x 10 molekul/mol 22, 4 liter/mol 22 18, 06 x 10 molekul
19 KIMIA X SMA 83 Hubungan antara mol, gram, volum (STP) dan jumlah partikel dapat digambarkan skema sebagai berikut. Gram : massa molar x massa molar Mol x 6,02 x : 6,02 x Jumlah partikel : 22,4 L x 22,4 L Volume (STP) 0 o C, 1 atm Gambar 4.3 Konversi satuan mol dengan massa, jumlah partikel dan volum Latihan Hitunglah volum gas berikut ini, jika diukur pada suhu 0 o C, 1 atm: a. 2 x 10-2 mol gas NO b. 12,8 gram gas SO 3 (Ar O 16, S 32) c. 2,408 x molekul gas Cl ,2 gram gas X 2 pada keadaan standar mempunyai volum 2240 ml (kondisi STP), berapa Ar X? 3. Sebanyak 4480 ml gas SO 3 diukur pada 0 o C, 76 cmhg, berapa gramkah massa gas SO 3 tersebut? (Ar O 16, S 32) 3) Volum Gas pada Suhu dan Tekanan Tertentu Volum gas sangat dipengaruhi oleh suhu dan tekanan, sehingga menurut Boyle Gay Lussac dirumuskan sebagai berikut. PV T PV PV C atau T1 T2
20 84 KIMIA X SMA Pada keadaan standar suhu 0 o C (273 o K) dan tekanan 1 atm, satu mol semua gas mempunyai volum 22,4 liter, sehingga harga C dapat ditentukan sebagai berikut: P 1 atm V 22,4 liter/mol T 273 o K 1 atm x 22, 4 liter/mol C 273 K 0,082 atm liter K -1 mol -1 Angka 0,082 dinamakan tetapan gas ideal (R). Jika banyaknya mol gas n, maka rumus Boyle Gay Lussac tersebut diturunkan menjadi: PV nrt Rumus ini dikenal dengan Persamaan Umum Gas Ideal. Contoh: 1. Berapakah volum 11 gram gas CO 2 (Mr 44) pada suhu 27 o C dan tekanan 1 atm? (R 0,082 atm.lt.k -1.mol -1 ) PV nrt 11 n 44 V nrt P 025, mol 025, x 0,082 x , liter 2. Suatu gas mempunyai volum 250 ml pada keadaan standar. Berapakah volum gas tersebut jika diukur pada suhu 25 o C dan tekanan 760 mmhg? P 1 1 atm 760 mmhg, V ml 0,25 lt, T 1 0 o C 273 K P mmhg 1 atm, T 2 25 o C 298 K PV 1 1 PV 2 2 T1 T2 PVT V PT atm x 0, 25 L x 298 K 1 atm x 273 K 027, liter
21 KIMIA X SMA 85 Latihan Hitunglah volum 6,4 gram gas SO 2 (Mr 64) diukur pada suhu 27 o C dan tekanan 700 mmhg! 2. Gas karbon dioksida, CO 2 pada suhu 27 o C dan tekanan 2 atm mempunyai volum 24,6 liter. Berapakah gram massa gas CO 2? (Ar C 12, O 16) 3. Sebanyak 2,4 gram gas A pada suhu 127 o C, tekanan 152 cmhg mempunyai volum 492 ml. Hitunglah Mr gas A! 3. Komposisi Senyawa Salah satu manfaat penting dari ilmu kimia adalah kemampuannya dalam mengidentifikasi suatu zat. Ada 2 tahap dalam melakukan identifikasi ini, yaitu analisa kualitatif dan analisis kuantitatif. Analisa kualitatif digunakan untuk menentukan jenis komponen penyusun zat tersebut, sedangkan analisa kuantitatif digunkaan untuk mengetahui massa dari setiap komponen penyusun zat tersebut. Di dalam mengetahui jenis dan massa setiap komponen penyusun zat kita dapat mengetahui komposisi zat tersebut. Kompossi zat ini biasanya dinyatakan dalam satuan persen massa (% massa). a. Persentase Unsur Dalam Senyawa Sesuai Hukum Perbandingan Tetap dari Proust, bahwa massa unsur-unsur penyusun suatu senyawa mempunyai perbandingan tertentu dan tetap, maka persentase unsur dan massa unsur dalam suatu senyawa A x B y dapat dirumuskan sebagai berikut. Rumus persentase unsur dalam senyawa: x. ArA % Adalam senyawa AxBy Mr AxBy y. ArB % Bdalam senyawa AxBy Mr AxBy Contoh: Berapakah persentase massa unsur Ca, C dan O dalam senyawa CaCO 3? (Ar C 12, O 16 dan Ca 40) 1 Ar Ca % Ca dalam CaCO3 aco x 1 Mr C 00% x 1 00% % x 100% x 100%
22 86 KIMIA X SMA % Cdalam CaCO3 x 1 00% % % Odalam CaCO3 x 1 00% x 100% 48% 100 Rumus massa unsur dalam senyawa: x. ArA Massa A dalam AxBy Mr AxBy y. Ar B Massa B dalam AxBy Mr AxBy x massa AxBy x massa AxBy Contoh: a. Berapa gramkah massa unsur nitrogen yang terdapat dalam 120 gram urea, CO(NH 2 ) 2? (Ar H 1, C 12, N 14 dan O 16) 2Ar N Massa N dalam CO(NH2) 2 x massa CO(NH2) 2 Mr CO(NH2) x 10 2 gram gram b. Dalam senyawa Al 2 O 3 mengandung 540 gram aluminium. Berapa gramkah massa Al 2 O 3 tersebut? (Ar O 16 dan Al 27) Mr Al O Massa Al2O3 2 3 x massa Al 2 Ar Al 102 x 50 4 gram gram Latihan Hitunglah persentase unsur kalium, nitrogen dan oksigen dalam senyawa KNO 3! (Ar K 39, O 16 dan N 14) 2. Berapa gramkah massa unsur nitrogen dalam 1 kuintal pupuk ZA, (NH 4 ) 2 SO 4? (Ar H 1, N 14, O 16 dan S 32)
23 KIMIA X SMA Bijih bauksit mengandung 60% massa Al 2 O 3. Berapa gramkah massa aluminium yang terkandung dalam 100 gram bijih bauksit tersebut? (Ar O 16 dan Al 27) b. Rumus Empiris dan Rumus Molekul Konsep mol dapat digunakan untuk menentukan rumus kimia suatu senyawa, baik rumus empiris (RE) maupun rumus molekul (RM). Bagaimanakah hubungan rumus empiris dan rumus molekul suatu zat? Di dalam memahami hubungan RE dan RM, perhatikan contoh RE dan RM pada tabel di bawah ini. Tabel 4.4 Hubungan Antara RE dan RM Nama Senyawa Rumus Empiris Rumus Molekul asam klorida HCl HCl amoniak NH 3 NH 3 hidrogen peroksida HO H 2 O 2 asam oksalat HCO 2 H 2 C 2 O 4 etana CH 3 C 2 H 6 glukosa CH 2 O C 6 H 12 O 6 Berdasarkan tabel tersebut dapat disimpulkan, bahwa rumus molekul merupakan kelipatan bilangan bulat n (n 1,2,3 dan seterusnya) dari rumus empiris. Hubungan ini secara matematis dapat dirumuskan sebagai berikut. RM (RE) n Rumus molekul mempunyai Mr yang merupakan penjumlahan Ar atom penyusun suatu molekul, maka rumus di atas dapat di tuliskan menjadi Mr (ΣAr RE) n Langkah-langkah menentukan rumus empiris. Menghitung perbandingan % atau gram unsur-unsur penyusun senyawa. Menghitung perbandingan mol unsur-unsur tersebut dengan cara, % atau gram dibagi Ar masing-masing unsur.
24 88 KIMIA X SMA Menuliskan perbandingan mol unsur-unsur penyusun dengan angka bulat dan sederhana. Menuliskan rumus empiris. Jika diketahui Mr senyawa, rumus molekul dapat ditentukan dengan rumus Mr (ΣAr RE) n. Contoh: 1. Suatu senyawa hidrokarbon terdiri atas 80 % massa karbon dan 20% massa hidrogen. Tentukanlah rumus empiris hidrokarbon tersebut! (Ar H 1 dan C 12). Perbandingan % atau perbandingan massa massa C : massa H 80 : 20 Perbandingan mol Mol C : Mol H : ,67 : 20 1 : 3 Jadi, umus empiris senyawa hidrokarbon tersebut adalah CH Sebanyak 14,2 gram suatu senyawa ternyata mengandung 4,6 gram natrium, 3,2 gram belerang dan sisanya oksigen. Tentukanlah rumus empiris senyawa tersebut! (Ar S 32, Na 23 dan O 16) Massa Na 4,6 gram S 3,2 gram O 14,2 (4,6 + 3,2) 6,4 gram Perbandingan massa massa Na : massa S : massa O 4,6 : 3,2 : 6,4 Perbandingan mol 46 Mol Na : Mol S : Mol O, 32 :, 64 :, , 2 : 0,1 : 0, 4 2 : 1 : 4 Jadi, rumus empiris senyawa tersebut adalah Na 2 SO 4.
25 KIMIA X SMA Suatu oksida N x O y mengandung 30,43 % nitrogen dan 69,56 % oksigen. Jika oksida tersebut mempunyai Mr 92, tentukan rumus molekulnya! (Ar N 14 dan O 16). N 30,43%; O 69,56% Perbandingan mol 30 Mol N : Mol O, :, ,17 : 4, 34 1 : 2 Rumus empiris oksida adalah NO 2 Mr (ΣAr RE) n 92 ( ) n 92 (46) n n 2 Rumus molekul oksida adalah (NO 2 ) 2 N 2 O 4 Latihan Suatu oksida besi, Fe x O y mengandung 70% besi (Ar Fe 56, O 16). Tentukan rumus oksida tersebut! 2. Sebanyak 50 gram suatu oksida logam MO mengandung 30 gram logam M. Jika Ar O 16, berapa Ar logam M? 3. Suatu senyawa hidrokarbon mengandung 80% karbon (Ar C 12, H 1) dan sisanya hidrogen. Jika 3,01 x molekul senyawa tersebut massanya 1,5 gram, tentukan rumus molekul hidrokarbon tersebut! 4. Sebanyak 22 gram senyawa organik terdiri atas C, H, dan O dibakar sempurna, menghasilkan 44 gram CO 2 dan 18 gram H 2 O ( Ar H 1, C 12 dan O 16). Jika Mr senyawa 88, tentukan rumus molekulnya! 5. Vitamin C terdiri atas unsur C, H, dan O mempunyai Mr 176. Pembakaran 88 gram vitamin C tersebut menghasilkan 132 gram CO 2 dan 36 gram H 2 O (Ar H 1, C 12 dan O 16). Tentukan rumus molekul vitamin C tersebut!
26 90 KIMIA X SMA 4. Air Kristal Kristal merupakan zat padat yang memiliki bentuk teratur. Beberapa senyawa yang berwujud kristal padat mempunyai kemampuan untuk menyerap uap air dari udara, sehingga kristal senyawa itu mengandung air kristal. Senyawa yang mengandung air kristal dikenal sebagai senyawa hidrat. Molekul- molekul air tersebut terkurung rapat dalam susunan kristal senyawa, sehingga senyawa hidrat tetap kering. Air kristal akan terlepas bila dipanaskan/dilarutkan, sehingga dalam proses reaksinya air kristal tidak terjadi reaksi kimia. Contoh: CaSO 4. 2H 2 O, menunjukkan tiap satuan kristal CaSO 4 terkandung 2 molekul air. CuSO 4. 5H 2 O, menunjukkan tiap satuan kristal CuSO 4 terkandung 5 molekul air. Contoh di atas terlihat bahwa setiap 1 mol CaSO 4 terkandung 2 mol air dan setiap 1 mol CuSO 4 terkandung 5 mol air. Penentuan jumlah air kristal didasarkan pada perbandingan mol zat murni dengan mol air dalam kristal tersebut. Contoh soal: 1. Kristal BaCl 2.XH 2 O mengandung 15,4% massa air kristal. Tentukan rumus kristal tersebut. (Ar H 1, O 16, Cl 35,5 dan Ba 137) % BaCl % 15,4 % 84,6 % % BaCl H O Perbandingan Mol BaCl 2 : Mol H2O 2 % : 2 Mr BaCl2 Mr H2O 84, 6 15, 4 : , : 0,8 Perbandingan mol BaCl 2 : Mol H 2 O 1: 2 Jadi rumus kristal tersebut adalah BaCl 2. 2H 2 O 2. Jika 38 gram MgSO 4.XH 2 O dipanaskan, ternyata diperoleh 20 gram MgSO 4. (Ar H 1, O 16, Mg 24 dan S 32). Tentukan harga X! Massa MgSO 4.XH 2 O 38 gram Massa MgSO 20 gram Massa H 2 O 38 gram 20 gram 18 gram
27 Perbandingan Mol MgSO 4 : Mol H 2 O 1 : X 20 : : 1 1 : 6 Jadi, harga X adalah 6, dan rumus kristal adalah MgSO 4.6H 2 O KIMIA X SMA 91 Latihan Sebanyak 43 gram gips (CaSO 4.XH 2 O) dipanaskan sehingga diperoleh 34 gram CaSO 4 murni. Tentukan rumus kristal gips tersebut! (Ar H 1,O 16, S 32 dan Ca 40). 2. Kristal terusi (CuSO 4. XH 2 O) sebanyak 62,37 gram dipanaskan sehingga diperoleh kristal anhidrat yang massanya 39,87 gram. Tentukan harga X! (Ar H 1,O 16, S 32 dan Cu 63,5) 6. Kemurnian (Kadar Zat Dalam Senyawa) Sering kita jumpai barang-barang perdagangan yang mencantumkan kemurniannya (kadar), terutama paling banyak bahan-bahan kimia yang memerlukan ketelitian untuk keperluan analisa kuantitatif. Cara menentukan kemurnian dapat digunakan rumus sebagai berikut. % zat dari hasil eksperimen Kemurnian (kadar) % zat secara teoretis massa zat hasil eksperimen Kemurnian (kadar) massa sampel x 100% x 100% Contoh: 1) Dalam pupuk perdagangan tertulis "Pupuk Urea CO(NH 2 ) 2 dengan kandungan nitrogen 20%. Tentukan berapa persenkah kemurnian pupuk urea tersebut? (diketahui Ar H 1, C 12, N 14, O 16) Mr CO(NH 2 )
28 92 KIMIA X SMA - Persentase N dalam CO(NH 2 ) 2 murni: Jumlah atom N x Ar N Mr CO(NH2) 2 1 x 14 x 100% 60 23, 33% - Persentase N dalam sampel 20% - Jadi, kemurnian CO(NH 2 ) 2 dalam sampel adalah: 20 23, 33 x 100% 85,72% x 100% 2) Dalam menentukan kadar belerang (S) dalam suatu batuan, ditimbang sebanyak 10 gram batuan tersebut kemudian dibakar. Massa zat setelah pembakaran ditimbang ternyata tinggal 6,8 gram. Dari data tersebut tentukan kadar belerang (S) dalam batuan tersebut! - Massa batuan (sampel) 10 gr - Massa batuan etelah dibakar 6,8 gr Massa zat yang hilang adalah massa belerang karena pada pembakaran belerang diubah menjadi gas belerang dioksida (SO 2 ) S (s) + O 2(g) SO 2(g) - Jadi, massa belerang (S) dalam batuan (sampel) (10-6,8) 3,2 gr - Maka kadar belerang (S): Massa hasil eksperiman x 100% Massa sampel Massa S Massa batuan sebelum dibakar x 100% 3, 2 10 x 100% 32% Latihan Dalam 60 gram terdapat 32 gram oksigen, tentukan berapa % kemurnian Al 2 (SO 4 ) 3 tersebut (Ar Al 27, S 32, O 16)! 2. Berapa gram asam fosfat yang dapat dibuat dari 248 gram fosfor?
29 6. Hitungan Kimia Dalam Persamaan Reaksi KIMIA X SMA 93 Reaksi kimia berlaku hukum kekekalan massa, yang ditunjukkan oleh persamaan reaksi setara. Contoh: C 3 H 8(g) + 5O 2(g) 3CO 2(g) + 4H 2 O (g) Menurut persamaan reaksi setara ini kita bisa melihat adanya hubungan kuantitatif antara zat satu dengan zat yang lain melalui koefisien masing-masing zat. Menurut hukum Gay Lussac, perbandingan volume menunjukkan perbandingan koefisien. Menurut hukum Avogadro, perbandingan volum menunjukkan perbandingan jumlah partikel. Sedangkan menurut konsep mol perbandingan jumlah partikel sama dengan perbandingan mol. Bisa kita tarik suatu kesimpulan, bahwa: Perbandingan koefisien perbandingan volum perbandingan jumlah partikel perbandingan mol Tetapi ingat, ini hanya berlaku bila zatnya berwujud gas. Mengapa demikian? Bagaimanakah untuk zat yang tidak berwujud gas apakah ketentuan itu tidak berlaku? Ya tetap berlaku sama, kecuali untuk perbandingan volume. Sehingga ketentuan itu menjadi: Perbandingan koefisien perbandingan mol perbandingan jumlah partikel Menurut persaman reaksi setara ini jika mol salah satu zat diketahui (misal B) maka mol-mol zat yang lain dapat dicari dengan membandingkan koefisien. mol A koefisien A k atau mol A oefisien A mol koefisien B x B mol B koefisien B Contoh: 1. Sebanyak 3 gram gas etana, C 2 H 6 (Mr 30) dibakar sempurna menghasilkan gas karbon dioksida dan uap air, menurut persamaan reaksi: 2C 2 H 6(g) + 7O 2(g) 4CO 2(g) + 6H 2 O (g) a. Berapakah mol O 2 yang diperlukan untuk membakar etana? b. Berapakah gram CO 2 yang dihasilkan? (Ar C 12, O 16) c. Jika diukur pada suhu 0 o C, 1 atm, berapkah liter volum gas CO 2 yang dihasilkan?
30 94 KIMIA X SMA 2C 2 H 6(g) (Diketahui) gram mol Mr ,1 + 7O 2(g) (dicari) 7 mol 2 x 0,1 035, 4CO 2(g) (dicari) 4 mol 2 x 0,1 02, + 3H 2 O a. jadi O 2 yang diper- b. gram mol x Mr CO 2 lukan 0,35 mol 0,2 x 44 8,8 gram c. liter mol x 22,4 0,2 x 22,4 4,48 2. Pemanasan kalium klorat, KClO 3 terurai menurut reaksi: KClO 3(S) KCl (s) + O 2(g) (reaksi belum setara) Jika volum O 2 yang dihasilkan 6 liter, diukur pada kondisi di mana 6 gram gas NO (Mr 30) volumnya 4 liter. Berapa gram KClO 3 yang terurai? (Ar K 39, Cl 35,5 dan O 16) Persamaan reaksi setara: 2KClO 3(S) 2KCl (s) + 3O 2(g) 6 Mol NO 30 0, 2 mol mol O2 v mol NO olum O 2 volum NO 6 mol O liter 2 x 0, 2 mol 4 liter 0, 3 mol 2 x 0, 3 mol 3 02, mol 0, 3 mol Massa KClO 3 mol x Mr 0,2 x 122,5 24,5 gram
31 KIMIA X SMA 95 Latihan Sejumlah 12,8 gram belerang dibakar menghasilkan gas belerang dioksida, menurut reaksi: S (s) + O 2(g) SO 2(g) (reaksi belum setara) Hitunglah! a. Massa gas oksigen yang diperlukan untuk pembakaran. b. Volum gas SO 2 jika diukur pada suhu 0 o C, 1 atm. (Ar O 16, S 32) 2. Pada peruraian perak oksida, Ag 2 O dihasilkan logam perak dan gas oksigen. Jika volum gas oksigen diukur pada keadaan standar sebanyak 672 ml, hitunglah! a. Massa perak oksida yang terurai. b. Massa perak yang terjadi. (Ar Ag 108, O 16) 3. Pembakaran sempurna 13,8 gram etanol, C 2 H 5 OH dihasilkan gas CO 2 dan uap air. a. Berapakah gramkah gas oksigen yang diperlukan untuk membakar? b. Berapakah gramkah uap air yang terbentuk? c. Berapakah volum gas karbon dioksida, bila diukur pada suhu dan tekanan di mana 7 gram gas nitrogen (Mr N 2 28) volumnya 0,5 liter? (Ar H 1, C 12, O 16) 7. Pereaksi Pembatas Dalam suatu persamaan reaksi, koefisien reaksi menyatakan perbandingan mol zat-zat yang terlibat reaksi. Apabila mol yang tersedia tidak sesuai dengan perbandingan koefisien reaksinya, maka salah satu zat akan habis bereaksi dan zat yang lain tidak habis bereaksi. Zat yang habis bereaksi disebut sebagai pereaksi pembatas, sedangkan yang tidak habis bereaksi disebut pereaksi sisa atau berlebih. Perhatikan contoh reaksi berikut ini. 2 mol gas etena, C 2 H 4 direaksikan dengan 3 mol gas oksigen, menghasilkan gas karbon dioksida dan uap air, menurut persamaan reaksi: C 2 H 4(g) + 3O 2(g) 2CO 2(g) + 2H 2 O (g) Apakah gas C 2 H 4 dan O 2 dapat bereaksi semua?
32 96 KIMIA X SMA Perhatikan penyelesaian berikut: Perbandingan koefisien C 2 H 4 : O 2 adalah 1: 3 ) Jika C 2 H 4 habis bereaksi (2 mol), maka diperlukan O x 2 mol 6 mol O 2. Karena O 2 yang tersedia hanya 3 mol maka mol O 2 tidak memadai (tidak mungkin). ) Jika O 2 habis bereaksi (3 mol), maka diperlukan C 2 H x 3 mol 1 mol, sehingga C 2 H 4 masih tersisa 1 mol. Jadi O 2 habis bereaksi (pereaksi pembatas), sedangkan C 2 H 4 sebagai pereaksi sisa. Contoh soal: 12 gram logam magnesium, Mg (Ar 24) direaksikan dengan 2 mol asam klorida, HCl menurut reaksi: Mg (s) + 2HCl (aq) MgCl 2(aq) + H 2(g) a. Tentukan pereaksi pembatas. b. Berapa gram zat yang tersisa? c. Berapa gram MgCl 2 yang terbentuk? (Ar H 1, Mg 24, Cl 35,5) d. Berapa volum gas hidrogen diukur pada keadaan standar? gram Jumlah mol Ar 12 05, mol 24 Mg (s) + 2HCl (aq) MgCl 2(aq) + H 2(g) ) mula-mula 0,5 mol 2 mol - - ) reaksi 0,5 mol 1 mol 0,5 mol 0,5 mol ) akhir reaksi 0 1 mol 0,5 mol 0,5 mol Catatan: ) Pada bagian "reaksi" berlaku "Perbandingan koefisien perbandingan mol" ) Pada bagian akhir reaksi, berlaku: - sebelah kiri anak panah mula-mula bereaksi - sebelah kanan anak panah mula-mula + hasil reaksi Menurut skema di atas kita dapat melihat dengan jelas, berapakah banyak masing-masing zat pada keadaan mula-mula (sebelum reaksi)? Berapakah banyak yang bereaksi (kiri anak panah), zat hasil reaksi (sebelah kanan anak panah), dan bagaimanakah komposisi zat setelah reaksinya selesai (akhir reaksi)?
33 KIMIA X SMA 97 Berdasarkan skema tersebut, kita gunakan untuk menjawab pertanyaan-pertanyaan. a. Pereaksi pembatas (yang habis bereaksi) adalah Mg. b. Zat yang tersisa HCl sebanyak 1 x 36,5 36,5 gam. c. Massa MgCl 2 yang terbentuk 0,5 x 59,5 29,75 gram d. Volum H 2 (STP) 0,5 mol x 22,4 liter/mol 11,2 liter. Latihan Sebanyak 30 gram besi direaksikan dengan 16 gram belerang menurut reaksi: Fe (s) + S (s) FeS (s) (Ar Fe 56,S 32) a. Zat manakah yang sebagai pereaksi pembatas? b. Berapa gram FeS yang terbentuk? c. Berapa gram zat yang tersisa? 2. Pada pemanasan 25 gram cuplikan batu pualam, CaCO 3 (Mr 100), menurut reaksi: CaCO 3(s) CaO (s) + CO 2(g) Gas CO 2 yang terbentuk dialirkan ke dalam Mg(OH) 2 terjadi reaksi: CO 2(g) + Mg(OH) 2(aq) MgCO 3(s) + H 2 O (l) Apabila Mg CO 3 yang terbentuk 0,072 gram, berapa persen kadar CaCO 3 dalam cuplikan batu pualam tersebut? 3. Sebanyak 1,2 gram cuplikan yang mengandung belerang, dibakar sempurna menghasilkan gas SO 2. Jika volum gas SO 2 diukur pada 0 o C, 1 atm sebanyak 672 ml, berapa % kadar belerang dalam cuplikan? (Ar S 32) 4. Pemanasan 61,25 gram KClO 3 terurai sempurna menurut reaksi: KClO 3(s) KCl (s) + O 2(g) (belum setara) Hitunglah: a. massa KCl yang dihasilkan b. volum O 2 pada suhu 0 o C, 1atm c. volum O 2 diukur pada suhu 27 o C, tekanan 1 atm. (R 0,082) (Ar O 16, Cl 35,5, K 39)
34 98 KIMIA X SMA 5. Sebanyak 25,4 gram tembaga direaksikan dengan 15 gram belerang menghasilkan tembaga sulfida, CuS. (Ar S 32, Cu 63,5) Tentukan: a. pereaksi pembatasnya b. berapa gram zat yang tersisa c. berapa gram CuS yang terbentuk Kata Kunci stoikiometri hukum kekekalan massa Antoine Laurent Lavoiser hukum perbandingan tetap Joseph Louis Proust hukum kelipatan perbandingan John Dalton hukum perbandingan volume Gay Lussac hipotesa Avogadro Amedeo Avogadro Stanisalad Cannizaro konsep mo massa atom relatif (Ar) massa molekul relatif (Mr) mol Loschmidt massa molar volum molar STP volum molar standar RANGKUMAN Hukum-hukum dasar kimia 1) Hukum kekekalan massa: jumlah massa zat sebelum reaksi dan sesudah reaksi sama 2) Hukum perbandingan tetap: perbandingan massa unsur-unsur penyusun senyawa selalu tetap 3) Hukum kelipatan perbandingan (Hukum Dalton): bila dua unsur membentuk dua senyawa atau lebih, perbandingan massa dari unsur pertama dengan unsur kedua merupakan bilangan bulat dan sederhana 4) Hukum perbandingan volume (Hukum Gay - Lussac): volume gasgas yang bereaksi dan volum gas-gas hasil reaksi jika diukur pada suhu dan tekanan yang sama akan berbanding sebagai bilangan bulat dan sederhana 5) Hukum Avogadro: pada suhu dan tekanan yang sama gas-gas yang volumnya sama akan mempunyai jumlah partikel yang sama Stoikiometri: menggambarkan hubungan kuantitatif antar atom unsur-unsur zat dan hubungan kuantitatif antar zat-zat pereaksi dan hasil reaksi dalam suatu reaksi kimia.
35 KIMIA X SMA 99 Boyle Gay Lussac persamaan umum gas ideal analisa kualitatif analisa kuantitatif rumus empiris rumus moleku air kristal, 92 pereaksi pembatas koefisien reaksi pereaksi sisa Massa atom relatif (Ar) : Perbandingan massa rata-rata 1 atom suatu unsur terhadap 1 12 kali massa 1 atom C 12 Massa molekul relatif (Mr): penjumlahan dari massa atom relatif (Ar) atom-atom penyusun molekul suatu unsur/senyawa Satu mol zat (n) menyatakan banyaknya partikel yang terkandung dalam suatu zat yang jumlahnya sama dengan banyaknya atom yang terdapat dalam 12 gram C 12 Massa molar (Mm) adalah massa dari satu mol zat yang sama dengan Ar atau Mr zat tersebut yang dinyatakan dalam gram Volume molar gas adalah volum dari 1 mol gas pada suhu (T) dan tekanan (P) tertentu. Kondisi STP (0 o C, 1 atm) setiap 1 mol gas volumnya 22,4 liter. Hubungan antara mol, massa molar dan volume molar gram : massa molar x MOL x L : jumlah partikel : x 22,4 liter (STP) Persentase unsur x dalam senyawa Σunsur x. Ar x % x Mr senyawa. 100% Hubungan antara rumus molekul dan rumus empiris Rumus molekul (rumus empiris) n Mr rumus molekul n. (Mr rumus empiris)
36 100 KIMIA X SMA - Senyawa hidrat adalah senyawa yang mengadung air kristal - Pereaksi pembatas: pereaksi yang habis lebih dahulu (pereaksi yang tidak habis disebut pereaksi sisa) P ELATIHAN SOAL I. Pilihlah salah satu jawaban yang paling benar! 1. Sebanyak 9 gram magnesium tepat habis bereaksi dengan serbuk belerang menghasilkan magnesium sulfida yang massanya 21 gram maka massa belerang yang telah bereaksi sebanyak... a. 17 gram b. 12 gram c. 9 gram d. 7 gram e. 4 gram 2. Pada senyawa SO 3 perbandingan massa S: O 2: 3. Jika 8 gram belerang dibakar dengan 16 gram oksigen maka massa gas SO 3 yang dihasilkan sebanyak... a. 24 gam b. 22 gram c. 20 gram d. 18 gram e. 16 gram 3. Data dari hasil percobaan pembentukan FeS dari reaksi antara Fe dan S adalah sebagai berikut. Massa Massa Massa Massa sisa Fe (gr) S (gr) FeS (gr) Fe S Dari data tersebut, perbandingan massa Fe: S pada senyawa FeS adalah... a. 7: 6 d. 7: 3 b. 6: 7 e. 4: 2 c. 7: 4 4. Sebanyak 100 cm 3 gas NO tepat bereaksi dengan 25 cm 3 gas oksigen menghasilkan 50 cm 3 suatu oksida nitrogen, N x O y. Rumus oksida nitrogen tersebut adalah... a. N 2 O d. N 2 O 4 b. NO 2 e. N 2 O 5 c. N 2 O 3
37 KIMIA X SMA Perbandingan massa rata-rata 1 atom suatu unsur dengan 1 12 massa 1 atom C-12 disebut... a. satuan massa atom (sma) b. massa 1 atom c. massa atom relatif d. massa 1 molekul e. massa molekul relatif. 6. Jika massa 1 atom C-12 adalah 2,04 x kg dan massa ratarata 1 atom B adalah 6,8 X kg maka Ar unsur B adalah... a. b. c. d. e , x 10 x , x , x 10 x , x , x , x 10 x , x , x , x , x Diketahui Mr (MH 4 ) 3 PO Jika Ar H 1, O 16 dan P 31 maka Ar M adalah... a. 18 d. 14 b. 17 e. 12 c Sejumlah 1,6 gram suatu senyawa mengandung 2,4 X molekul. Mr senyawa tersebut adalah... a. 16 d. 36 b. 24 e. 40 c Pada suhu dan tekanan yang sama, 3 liter gas NO dan 2 liter gas X mempunyai massa yang sama. Jika Mr NO 30 maka Mr gas X adalah... a. 20 d. 45 b. 24 e. 48 c Pada suhu dan tekanan tertentu 2 liter gas CH 4 ( Mr 16) massanya 4 gram. Jika diukur pada keadaan yang sama maka massa 4 liter gas O 2 (Mr 32) adalah... a. 32 gram d. 8 gram b. 24 gram e. 4 gram c. 16 gram 11. Sebanyak 32 gram oksida besi, Fe x O y mengandung 22,4 gram besi. Jika Ar Fe 56 dan O 16 maka rumus oksida besi itu adalah... a. FeO d. Fe 2 O 3 b. Fe 2 O e. Fe 3 O 4 c. FeO Sebanyak 30 gram senyawa organik jika dibakar sempurna menghasilkan 44 gram CO 2 dan 18 gram H 2 O (ArH 1, C 12, O 16). Jika senyawa tersebut mengandung 3,01 x molekul maka rumus molekul senyawa organik tersebut adalah... a. CH 2 O d. C 3 H 6 O 2 b. CH 2 O 2 e. C 4 H 8 O 2 c. C 2 H 4 O 2
38 102 KIMIA X SMA 13. Pemanasan 49,2 gram senyawa hidrat MgSO 4.xH 2 O dihasilkan 24 gam MgSO 4 anhidrat (Mr MgSO 4 120, H 2 O 18). Harga x adalah... a. 3 d. 6 b. 4 e. 7 c Sebanyak 7,2 gram logam M direaksikan dengan larutan HCl berlebihan, menurut reaksi: M (s) + 2HCl (aq) MCl 2(aq) + H 2(g) Jika dihasilkan 6,72 liter gas hidrogen pada 0 o C,1 atm maka Ar logam M adalah... a. 23 d. 29 b. 24 e. 30 c Pemanasan 49 gram KClO 3 (Mr 122,5), menurut reaksi: KClO 3(s) KCl (s) + O 2(g) (reaksi belum setara) Volum O 2 diukur pada suhu dan tekanan di mana 5 liter gas N 2 (Mr 28) massanya 1,4 gram maka volum O 2 yang terjadi sebanyak... a. 20 liter d. 50 liter b. 30 liter e. 60 liter c. 40 liter II. Kerjakan soal-soal di bawah ini dengan benar! 1. Dalam senyawa besi sulfida perbandingan massa Fe: S 7: 4. Jika massa besi dan belerang masing-masing disediakan 14 gram, berapa gram massa besi sulfida yang dihasilkan? 2. Pembakaran sempurna 4 liter gas C x H y menghasilkan 8 liter gas CO 2 dan 12 liter uap air. Tentukan rumus molekul C x H y tersebut! 3. Dalam 100 kg pupuk urea, mengandung 85% CO(NH 2 ). Jika pupuk urea tersebut digunakan untuk memupuk tanaman padi seluas 1 Ha, berapa gram tiap m 2 tanaman padi tersebut mendapatkan unsur nitrogen? (Ar H 1, C 12, N 14) 4. Sebanyak 13,8 gram senyawa C x H y O z dibakar sempurna ternyata menghasilkan 26,4 gram CO 2 dan 16,2 gram H 2 O. Jika senyawa tersebut mempunyai 1,8 x molekul ( L 6 x ), tentukan rumus molekul C x H y O z tersebut! (Ar H 1, C 12, O 16) 5. Sebanyak 22,4 gram unsur X direaksikan dengan asam klorida berlebihan, menurut reaksi: 2X + 6HCl 2XCl 3 + 3H 2 gas hidrogen yang terjadi sebanyak 6 liter diukur pada P dan T di mana 6 gram gas NO (Mr 30) volumnya 2 liter. Hitunglah Ar X!
KONSEP MOL DAN STOIKIOMETRI
 BAB V KONSEP MOL DAN STOIKIOMETRI Dalam ilmu fisika, dikenal satuan mol untuk besaran jumlah zat. Dalam bab ini, akan dibahas mengenai konsep mol yang mendasari perhitungan kimia (stoikiometri). A. KONSEP
BAB V KONSEP MOL DAN STOIKIOMETRI Dalam ilmu fisika, dikenal satuan mol untuk besaran jumlah zat. Dalam bab ini, akan dibahas mengenai konsep mol yang mendasari perhitungan kimia (stoikiometri). A. KONSEP
STOKIOMETRI BAB. B. Konsep Mol 1. Hubungan Mol dengan Jumlah Partikel. Contoh: Jika Ar Ca = 40, Ar O = 16, Ar H = 1, tentukan Mr Ca(OH) 2!
 BAB 7 STOKIOMETRI A. Massa Molekul Relatif Massa Molekul Relatif (Mr) biasanya dihitung menggunakan data Ar masing-masing atom yang ada dalam molekul tersebut. Mr senyawa = (indeks atom x Ar atom) Contoh:
BAB 7 STOKIOMETRI A. Massa Molekul Relatif Massa Molekul Relatif (Mr) biasanya dihitung menggunakan data Ar masing-masing atom yang ada dalam molekul tersebut. Mr senyawa = (indeks atom x Ar atom) Contoh:
HUKUM DASAR KIMIA. 2CUO. 28GRAM NITROGEN 52 GRAM MAGNESIUM NITRIDA 3 MG + N 2 MG 3 N 2
 HUKUM DASAR KIMIA. 2CUO. 28GRAM NITROGEN 52 GRAM MAGNESIUM NITRIDA 3 MG + N 2 MG 3 N 2 HUKUM DASAR KIMIA 1) Hukum Kekekalan Massa ( Hukum Lavoisier ). Yaitu : Dalam sistem tertutup, massa zat sebelum
HUKUM DASAR KIMIA. 2CUO. 28GRAM NITROGEN 52 GRAM MAGNESIUM NITRIDA 3 MG + N 2 MG 3 N 2 HUKUM DASAR KIMIA 1) Hukum Kekekalan Massa ( Hukum Lavoisier ). Yaitu : Dalam sistem tertutup, massa zat sebelum
STOIKIOMETRI STOIKIOMETRI
 BAB V STOIKIOMETRI Standar Kompetensi Memahami hukum-hukum dasar kimia dan penerapannya dalam perhitungan kimia (stoikiometri) Kompetensi Dasar Mendeskripsikan tata nama senyawa anorganik dan organik sederhana
BAB V STOIKIOMETRI Standar Kompetensi Memahami hukum-hukum dasar kimia dan penerapannya dalam perhitungan kimia (stoikiometri) Kompetensi Dasar Mendeskripsikan tata nama senyawa anorganik dan organik sederhana
LATIHAN ULANGAN TENGAH SEMESTER 2
 Pilihlah jawaban yang paling benar LATIHAN ULANGAN TENGAH SEMESTER 2 TATANAMA 1. Nama senyawa berikut ini sesuai dengan rumus kimianya, kecuali. A. NO = nitrogen oksida B. CO 2 = karbon dioksida C. PCl
Pilihlah jawaban yang paling benar LATIHAN ULANGAN TENGAH SEMESTER 2 TATANAMA 1. Nama senyawa berikut ini sesuai dengan rumus kimianya, kecuali. A. NO = nitrogen oksida B. CO 2 = karbon dioksida C. PCl
Stoikiometri. OLEH Lie Miah
 Stoikiometri OLEH Lie Miah 1 STANDAR KOMPETENSI KOMPETENSI DASAR INDIKATOR KARAKTERISTIK MATERI KESULITAN BELAJAR SISWA STANDAR KOMPETENSI Memahami hukum-hukum dasar Kimia dan penerapannya dalam perhitungan
Stoikiometri OLEH Lie Miah 1 STANDAR KOMPETENSI KOMPETENSI DASAR INDIKATOR KARAKTERISTIK MATERI KESULITAN BELAJAR SISWA STANDAR KOMPETENSI Memahami hukum-hukum dasar Kimia dan penerapannya dalam perhitungan
Hukum Dasar Kimia Dan Konsep Mol
 A. PENDAHULUAN Hukum Dasar Kimia Dan Konsep Mol Hukum dasar kimia merupakan hukum dasar yang digunakan dalam stoikiometri (perhitungan kimia), antara lain: 1) Hukum Lavoisier atau hukum kekekalan massa.
A. PENDAHULUAN Hukum Dasar Kimia Dan Konsep Mol Hukum dasar kimia merupakan hukum dasar yang digunakan dalam stoikiometri (perhitungan kimia), antara lain: 1) Hukum Lavoisier atau hukum kekekalan massa.
STOIKIOMETRI. STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi zat-zat kimia dan reaksi-reaksinya.
 STOIKIOMETRI STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi zat-zat kimia dan reaksi-reaksinya. 1.HUKUM KEKEKALAN MASSA = HUKUM LAVOISIER "Massa zat-zat sebelum
STOIKIOMETRI STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi zat-zat kimia dan reaksi-reaksinya. 1.HUKUM KEKEKALAN MASSA = HUKUM LAVOISIER "Massa zat-zat sebelum
BAB V PERHITUNGAN KIMIA
 BAB V PERHITUNGAN KIMIA KOMPETENSI DASAR 2.3 : Menerapkan hukum Gay Lussac dan hukum Avogadro serta konsep mol dalam menyelesaikan perhitungan kimia (stoikiometri ) Indikator : 1. Siswa dapat menghitung
BAB V PERHITUNGAN KIMIA KOMPETENSI DASAR 2.3 : Menerapkan hukum Gay Lussac dan hukum Avogadro serta konsep mol dalam menyelesaikan perhitungan kimia (stoikiometri ) Indikator : 1. Siswa dapat menghitung
LOGO STOIKIOMETRI. Marselinus Laga Nur
 LOGO STOIKIOMETRI Marselinus Laga Nur Materi Pokok Bahasan : A. Konsep Mol B. Penentuan Rumus Kimia C. Koefisien Reaksi D. Hukum-hukum Gas A. Konsep Mol Pengertian konsep mol Hubungan mol dengan jumlah
LOGO STOIKIOMETRI Marselinus Laga Nur Materi Pokok Bahasan : A. Konsep Mol B. Penentuan Rumus Kimia C. Koefisien Reaksi D. Hukum-hukum Gas A. Konsep Mol Pengertian konsep mol Hubungan mol dengan jumlah
Materi Pokok Bahasan :
 STOIKIOMETRI Kompetensi : Memiliki kemampuan untuk menginterpretasikan serta menerapkan dalam perhitungan kimia. Memiliki kemampuan untuk mengaplikasikan pengetahuan yang dimilikinya dan terbiasa menggunakan
STOIKIOMETRI Kompetensi : Memiliki kemampuan untuk menginterpretasikan serta menerapkan dalam perhitungan kimia. Memiliki kemampuan untuk mengaplikasikan pengetahuan yang dimilikinya dan terbiasa menggunakan
Sumber: Silberberg, Chemistry: The Molecular Nature of Matter and Change
 Bab V Perhitungan Kimia Sumber: Silberberg, Chemistry: The Molecular Nature of Matter and Change Jumlah permen dalam stoples dapat diketahui jika berat dari satu permen dan seluruh permen diketahui. Cara
Bab V Perhitungan Kimia Sumber: Silberberg, Chemistry: The Molecular Nature of Matter and Change Jumlah permen dalam stoples dapat diketahui jika berat dari satu permen dan seluruh permen diketahui. Cara
MODUL KIMIA SMA IPA Kelas 10
 SMA IPA Kelas 0 A. Massa Atom. Massa Atom Relatif (Ar) Massa atom relatif (Ar) merupakan perbandingan massa atom dengan massa satu atom yang tetap. Secara matematis dapat dirumuskan sebagai berikut. sma
SMA IPA Kelas 0 A. Massa Atom. Massa Atom Relatif (Ar) Massa atom relatif (Ar) merupakan perbandingan massa atom dengan massa satu atom yang tetap. Secara matematis dapat dirumuskan sebagai berikut. sma
BAB 5 HUKUM DASAR KIMIA
 BAB 5 HUKUM DASAR KIMIA Dalam ilmu kimia perlu dipelajari massa dan volume zat-zat yang bereaksi dan zat yang dihasilkan dalam suatu reaksi kimia. Studi tentang hubungan-hubungan kuantitatif dalam suatu
BAB 5 HUKUM DASAR KIMIA Dalam ilmu kimia perlu dipelajari massa dan volume zat-zat yang bereaksi dan zat yang dihasilkan dalam suatu reaksi kimia. Studi tentang hubungan-hubungan kuantitatif dalam suatu
Bab IV Hukum Dasar Kimia
 Bab IV Hukum Dasar Kimia Sumber: Silberberg, Chemistry :The Molecular Nature of Matter and Change Kalsium karbonat ditemukan pada beberapa bentuk seperti pualam, batu koral, dan kapur. Persen massa unsur-unsur
Bab IV Hukum Dasar Kimia Sumber: Silberberg, Chemistry :The Molecular Nature of Matter and Change Kalsium karbonat ditemukan pada beberapa bentuk seperti pualam, batu koral, dan kapur. Persen massa unsur-unsur
STOKIOMETRI. Kimia Kelas X
 STOKIOMETRI Kimia Kelas X SEKOLAH MENENGAH ATAS NEGERI 12 SURABAYA 2015 STOKIOMETRI STOKIOMETRI Pada materi stokiometri, kita akan mempelajari beberapa hal seperti persamaan reaksi, hukum-hukum dasar kimia,
STOKIOMETRI Kimia Kelas X SEKOLAH MENENGAH ATAS NEGERI 12 SURABAYA 2015 STOKIOMETRI STOKIOMETRI Pada materi stokiometri, kita akan mempelajari beberapa hal seperti persamaan reaksi, hukum-hukum dasar kimia,
KIMIA TERAPAN STOIKIOMETRI DAN HUKUM-HUKUM KIMIA Haris Puspito Buwono
 KIMIA TERAPAN STOIKIOMETRI DAN HUKUM-HUKUM KIMIA Haris Puspito Buwono Semester Gasal 2012/2013 STOIKIOMETRI 2 STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi
KIMIA TERAPAN STOIKIOMETRI DAN HUKUM-HUKUM KIMIA Haris Puspito Buwono Semester Gasal 2012/2013 STOIKIOMETRI 2 STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi
STOIKIOMETRI. Oleh. Sitti Rahmawati S.Pd.
 STOIKIOMETRI Oleh Sitti Rahmawati S.Pd Copyright oke.or.id Artikel ini boleh dicopy,diubah, dikutip, di cetak dalam media kertas atau yang lain, dipublikasikan kembali dalam berbagai bentuk dengan tetap
STOIKIOMETRI Oleh Sitti Rahmawati S.Pd Copyright oke.or.id Artikel ini boleh dicopy,diubah, dikutip, di cetak dalam media kertas atau yang lain, dipublikasikan kembali dalam berbagai bentuk dengan tetap
Hubungan koefisien dalam persamaan reaksi dengan hitungan
 STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
LOGO. Stoikiometri. Tim Dosen Pengampu MK. Kimia Dasar
 LOGO Stoikiometri Tim Dosen Pengampu MK. Kimia Dasar Konsep Mol Satuan jumlah zat dalam ilmu kimia disebut mol. 1 mol zat mengandung jumlah partikel yang sama dengan jumlah partikel dalam 12 gram C 12,
LOGO Stoikiometri Tim Dosen Pengampu MK. Kimia Dasar Konsep Mol Satuan jumlah zat dalam ilmu kimia disebut mol. 1 mol zat mengandung jumlah partikel yang sama dengan jumlah partikel dalam 12 gram C 12,
A. HUKUM PERBANDINGAN VOLUM DAN HIPOTESIS AVOGADRO*
 Di muka kita telah membahas tentang jenis perubahan materi. Bagian dari Kimia yang membahas hubungan kuantitatif (jumlah) antara zat-zat yang terlibat dalam suatu perubahan kimia atau reaksi kimia dikenal
Di muka kita telah membahas tentang jenis perubahan materi. Bagian dari Kimia yang membahas hubungan kuantitatif (jumlah) antara zat-zat yang terlibat dalam suatu perubahan kimia atau reaksi kimia dikenal
SKL 2 RINGKASAN MATERI. 1. Konsep mol dan Bagan Stoikiometri ( kelas X )
 SKL 2 Menerapkan hukum-hukum dasar kimia untuk memecahkan masalah dalam perhitungan kimia. o Menganalisis persamaan reaksi kimia o Menyelesaikan perhitungan kimia yang berkaitan dengan hukum dasar kimia
SKL 2 Menerapkan hukum-hukum dasar kimia untuk memecahkan masalah dalam perhitungan kimia. o Menganalisis persamaan reaksi kimia o Menyelesaikan perhitungan kimia yang berkaitan dengan hukum dasar kimia
Ujian Akhir Semester Mata Pelajaran Kimia Kelas X Wacana berikut digunakan untuk menjawab soal no 1 dan 2. Ditentukan 5 unsur dengan konfigurasi
 Ujian Akhir Semester Mata Pelajaran Kimia Kelas X Wacana berikut digunakan untuk menjawab soal no 1 dan 2. Ditentukan 5 unsur dengan konfigurasi elektron sebagai berikut: P : 2 8 7 S : 2 8 8 Q : 2 8 8
Ujian Akhir Semester Mata Pelajaran Kimia Kelas X Wacana berikut digunakan untuk menjawab soal no 1 dan 2. Ditentukan 5 unsur dengan konfigurasi elektron sebagai berikut: P : 2 8 7 S : 2 8 8 Q : 2 8 8
BAB IV HUKUM DASAR KIMIA
 BAB IV HUKUM DASAR KIMIA KOMPETENSI DASAR : 2.1 Membuktikan dan mengkomunikasikan berlakunya hukum-hukum dasar kimia melalui percobaan Indikator : 1. Membuktikan berdasarkan percobaan bahwa massa zat sebelum
BAB IV HUKUM DASAR KIMIA KOMPETENSI DASAR : 2.1 Membuktikan dan mengkomunikasikan berlakunya hukum-hukum dasar kimia melalui percobaan Indikator : 1. Membuktikan berdasarkan percobaan bahwa massa zat sebelum
Tugas Kimia STOIKIOMETRI
 Tugas Kimia STOIKIOMETRI NAMA ANGGOTA : 1. Nyoman Dharma Triyasa (10) 2. Komang Jnana Shindu Putra (17) 3. I.G.A Dharsasasmitha Yani (19) 4. Ni Putu Riska Valentini (25) 5. Putu Ayu Rosita Octaviani (26)
Tugas Kimia STOIKIOMETRI NAMA ANGGOTA : 1. Nyoman Dharma Triyasa (10) 2. Komang Jnana Shindu Putra (17) 3. I.G.A Dharsasasmitha Yani (19) 4. Ni Putu Riska Valentini (25) 5. Putu Ayu Rosita Octaviani (26)
Soal 5 Jumlah mol dari 29,8 gram amonium fosfat ((NH4)3PO4) (Ar N = 14, H = 1, dan P = 31) adalah. A. 0,05 mol
 Bank Soal Stoikiometri Kimia Bagian 2 Soal 1 Satu liter campuran gas terdiri dari 60% volume metana (CH4) dan sisanya gas etana (C2H6) dibakar sempurna sesuai reaksi: CH4 + 3 O2 2 CO2 + 2 H2O 2 C2H6 +
Bank Soal Stoikiometri Kimia Bagian 2 Soal 1 Satu liter campuran gas terdiri dari 60% volume metana (CH4) dan sisanya gas etana (C2H6) dibakar sempurna sesuai reaksi: CH4 + 3 O2 2 CO2 + 2 H2O 2 C2H6 +
FAKULTAS TEKNIK UNIVERSITAS NEGERI YOGYAKARTA BAHAN AJAR KIMIA DASAR BAB IV STOIKIOMETRI
 No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 6 BAB IV STOIKIOMETRI A. HUKUM GAY LUSSAC Bila diukur pada suhu dan tekanan yang sama, volum gas yang bereaksi dan volum gas hasil reaksi berbanding
No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 6 BAB IV STOIKIOMETRI A. HUKUM GAY LUSSAC Bila diukur pada suhu dan tekanan yang sama, volum gas yang bereaksi dan volum gas hasil reaksi berbanding
STOIKIOMETRI. Massa molekul relatif suatu zat sama dengan jumlah massa atom relatif atomatom penyusun molekul zat tersebut.
 STOIKIOMETRI Istilah STOIKIOMETRI berasal dari kata-kata Yunani yaitu Stoicheion (partikel) dan metron (pengukuran). STOIKIOMETRI akhirnya mengacu kepada cara perhitungan dan pengukuran zat serta campuran
STOIKIOMETRI Istilah STOIKIOMETRI berasal dari kata-kata Yunani yaitu Stoicheion (partikel) dan metron (pengukuran). STOIKIOMETRI akhirnya mengacu kepada cara perhitungan dan pengukuran zat serta campuran
KONSEP MOL DAN STOIKIOMETRI
 KONSEP MOL DAN STOIKIOMETRI HUKUM-HUKUM DASAR KIMIA 1. Asas Lavoiser atau kekekalan massa jumlah sebelum dan setelah reaksi kimia adalah tetap 2. Hukum Gas Ideal P V = nrt Dengan P adalah tekanan (atm),
KONSEP MOL DAN STOIKIOMETRI HUKUM-HUKUM DASAR KIMIA 1. Asas Lavoiser atau kekekalan massa jumlah sebelum dan setelah reaksi kimia adalah tetap 2. Hukum Gas Ideal P V = nrt Dengan P adalah tekanan (atm),
MATA PELAJARAN/PAKET KEAHLIAN ILMU KIMIA
 SUMBER BELAJAR PENUNJANG PLPG 2016 MATA PELAJARAN/PAKET KEAHLIAN ILMU KIMIA BAB II HUKUM-HUKUM DASAR KIMIA, STOIKIOMETRI Prof. Dr. Sudarmin, M.Si Dra. Woro Sumarni, M.Si Cepi Kurniawan, M.Si, Ph.D KEMENTERIAN
SUMBER BELAJAR PENUNJANG PLPG 2016 MATA PELAJARAN/PAKET KEAHLIAN ILMU KIMIA BAB II HUKUM-HUKUM DASAR KIMIA, STOIKIOMETRI Prof. Dr. Sudarmin, M.Si Dra. Woro Sumarni, M.Si Cepi Kurniawan, M.Si, Ph.D KEMENTERIAN
K13 Revisi Antiremed Kelas 10 Kimia
 K1 Revisi Antiremed Kelas 10 Kimia Stoikiometri - Soal Doc. Name:RK1AR10KIM0901 Version : 2016-10 halaman 1 1. Jika diketahui massa atom C-12= p gram dan massa 1 atom unsur X adalah a gram. Massa atom
K1 Revisi Antiremed Kelas 10 Kimia Stoikiometri - Soal Doc. Name:RK1AR10KIM0901 Version : 2016-10 halaman 1 1. Jika diketahui massa atom C-12= p gram dan massa 1 atom unsur X adalah a gram. Massa atom
Stoikhiometri : dan metron = mengukur. Membahas tentang : senyawa) senyawa (stoikhiometri. (stoikhiometri. reaksi)
 STOIKHIOMETRI Stoikhiometri : Dari kata Stoicheion = unsur dan metron = mengukur Membahas tentang : hub massa antar unsur dalam suatu senyawa (stoikhiometri senyawa) dan antar zat dalam suatu reaksi (stoikhiometri
STOIKHIOMETRI Stoikhiometri : Dari kata Stoicheion = unsur dan metron = mengukur Membahas tentang : hub massa antar unsur dalam suatu senyawa (stoikhiometri senyawa) dan antar zat dalam suatu reaksi (stoikhiometri
STOIKIOMETRI Konsep mol
 STOIKIOMETRI Konsep mol Dalam hukum-hukum dasar materi ditegaskan bahwa senyawa terbentuk dari unsur bukan dengan perbandingan sembarang tetapi dalam jumlah yang spesifik, demikian juga reaksi kimia antara
STOIKIOMETRI Konsep mol Dalam hukum-hukum dasar materi ditegaskan bahwa senyawa terbentuk dari unsur bukan dengan perbandingan sembarang tetapi dalam jumlah yang spesifik, demikian juga reaksi kimia antara
Emas yang terbentuk sebanyak 20 gram, jika ArAu = 198, maka tentukan Ar M!
 1. Suatu senyawa mengandung kadar unsur (% berat) sebagai berikut : S = 35,97%; O = 62,9%; dan H = 1,13%. Rumus molekul senyawa tersebut adalah. 2. Gas hidrogen dapat dibuat dari reaksi antara logam magnesium
1. Suatu senyawa mengandung kadar unsur (% berat) sebagai berikut : S = 35,97%; O = 62,9%; dan H = 1,13%. Rumus molekul senyawa tersebut adalah. 2. Gas hidrogen dapat dibuat dari reaksi antara logam magnesium
BAB 2. PERSAMAAN KIMIA DAN HASIL REAKSI
 BAB 2. PERSAMAAN KIMIA DAN HASIL REAKSI 1. RUMUS KIMIA 2. MENULISKAN PERSAMAAN KIMIA YANG BALANS 3. HUBUNGAN MASSA DALAM REAKSI KIMIA 4. REAKTAN PEMBATAS 5. HASIL PERSENTASE Reaktan (Pereaksi) Produk (Hasil
BAB 2. PERSAMAAN KIMIA DAN HASIL REAKSI 1. RUMUS KIMIA 2. MENULISKAN PERSAMAAN KIMIA YANG BALANS 3. HUBUNGAN MASSA DALAM REAKSI KIMIA 4. REAKTAN PEMBATAS 5. HASIL PERSENTASE Reaktan (Pereaksi) Produk (Hasil
K13 Revisi Antiremed Kelas 10 Kimia
 K13 Revisi Antiremed Kelas 10 Kimia Hukum Dasar Perhitungan Kimia - Latihan Soal Doc. Name: RK13AR10KIM0801 Version : 2016-11 halaman 1 01. Pernyataan yang paling sesuai tentang hukum Lavoisier (A) Jumlah
K13 Revisi Antiremed Kelas 10 Kimia Hukum Dasar Perhitungan Kimia - Latihan Soal Doc. Name: RK13AR10KIM0801 Version : 2016-11 halaman 1 01. Pernyataan yang paling sesuai tentang hukum Lavoisier (A) Jumlah
LARUTAN ELEKTROLIT DAN KONSEP REDOKS
 LARUTAN ELEKTROLIT DAN KONSEP REDOKS LARUTAN ELEKTROLIT DAN KONSEP REDOKS \usepackage{chemmacros} \ch{n2 \gas{} + 3 H2 \gas{} ->2 NH3 \gas{} } Stoikimiometri Membahas tentang hubungan massa antar unsur
LARUTAN ELEKTROLIT DAN KONSEP REDOKS LARUTAN ELEKTROLIT DAN KONSEP REDOKS \usepackage{chemmacros} \ch{n2 \gas{} + 3 H2 \gas{} ->2 NH3 \gas{} } Stoikimiometri Membahas tentang hubungan massa antar unsur
MODUL STOIKIOMETRI 1
 MODUL STOIKIOMETRI 1 1. Pengertian Mol Mol merupakan suatu satuan jumlah, yang berasal dari kata moles yang artinya sejumlah massa / sejumlah kecil massa, hampir sama dengan lusin. 1 mol = 6,02 X 10 23
MODUL STOIKIOMETRI 1 1. Pengertian Mol Mol merupakan suatu satuan jumlah, yang berasal dari kata moles yang artinya sejumlah massa / sejumlah kecil massa, hampir sama dengan lusin. 1 mol = 6,02 X 10 23
HUKUM DASAR KIMIA DAN PERHITUNGAN KIMIA
 HUKUM DASAR KIMIA DAN PERHITUNGAN KIMIA Mata Pelajaran : Kimia Kelas : X (Sepuluh) Nomor Modul : Kim.X.06 Penulis : Dorthy Hariandja, S.Pd. Penyunting Materi : Drs. Darsef, M.Si Penyunting Media : Drs.
HUKUM DASAR KIMIA DAN PERHITUNGAN KIMIA Mata Pelajaran : Kimia Kelas : X (Sepuluh) Nomor Modul : Kim.X.06 Penulis : Dorthy Hariandja, S.Pd. Penyunting Materi : Drs. Darsef, M.Si Penyunting Media : Drs.
Antiremed Kelas 10 Kimia
 Antiremed Kelas 10 Kimia Stokiometri - Latihan Soal Doc. Name:K1 AR10KIM0901 Version : 201-09 halaman 1 1. Jika diketahui massa atom C-12= p gram dan massa 1 atom unsur X adalah a gram. Massa atom relatif
Antiremed Kelas 10 Kimia Stokiometri - Latihan Soal Doc. Name:K1 AR10KIM0901 Version : 201-09 halaman 1 1. Jika diketahui massa atom C-12= p gram dan massa 1 atom unsur X adalah a gram. Massa atom relatif
Antiremed Kelas 10 KIMIA
 Antiremed Kelas 10 KIMIA Persiapan UAS 1 Kimia Doc Name: AR10KIM01UAS Version : 2016-07 halaman 1 01. Partikel berikut yang muatannya sebesar 19 1,6 10 C dan bermassa 1 sma (A) elektron (B) proton (C)
Antiremed Kelas 10 KIMIA Persiapan UAS 1 Kimia Doc Name: AR10KIM01UAS Version : 2016-07 halaman 1 01. Partikel berikut yang muatannya sebesar 19 1,6 10 C dan bermassa 1 sma (A) elektron (B) proton (C)
1. Hukum Lavoisier 2. Hukum Proust 3. Hukum Dalton 4. Hukum Gay Lussac & Hipotesis Avogadro
 - - 1. Hukum Lavoisier 2. Hukum Proust 3. Hukum Dalton 4. Hukum Gay Lussac & Hipotesis Avogadro 1. Hukum Lavoisier (Hukum Kekekalan Massa) : Dalam sistem tertutup, massa zat sebelum dan sesudah reaksi
- - 1. Hukum Lavoisier 2. Hukum Proust 3. Hukum Dalton 4. Hukum Gay Lussac & Hipotesis Avogadro 1. Hukum Lavoisier (Hukum Kekekalan Massa) : Dalam sistem tertutup, massa zat sebelum dan sesudah reaksi
soal stoikiometri larutan I. KEGIATAN: 1. Logam aluminium sebanyak 2,7 gram direaksikan dengan larutan asam sulfat. Hitunglah: (a) Volume gas yang
 soal stoikiometri larutan I. KEGIATAN: 1. Logam aluminium sebanyak 2,7 gram direaksikan dengan larutan asam sulfat. Hitunglah: (a) Volume gas yang dihasilkan pada t,p tertentu bila 8 gram gas oksigen volumenya
soal stoikiometri larutan I. KEGIATAN: 1. Logam aluminium sebanyak 2,7 gram direaksikan dengan larutan asam sulfat. Hitunglah: (a) Volume gas yang dihasilkan pada t,p tertentu bila 8 gram gas oksigen volumenya
Tabel Hasil Analisis Kebenaran Konsep pada Objek Penelitian
 202 Lampiran B Label Pengertian stoikiometri Pengertian massa atom Perhitungan massa atom Tabel Hasil Analisis pada Objek Penelitian Penjelasan pada Stoikiometri berasal dari bahasa Yunani (stoicheion,
202 Lampiran B Label Pengertian stoikiometri Pengertian massa atom Perhitungan massa atom Tabel Hasil Analisis pada Objek Penelitian Penjelasan pada Stoikiometri berasal dari bahasa Yunani (stoicheion,
Hukum Dasar Ilmu Kimia Sumber :
 A Hukum Kekekalan Massa (Hukum Lavoisier) Hukum Dasar Ilmu Kimia Sumber : wwwe-dukasinet Pernahkah Anda memperhatikan sepotong besi yang dibiarkan di udara terbuka, dan pada suatu waktu kita akan menemukan,
A Hukum Kekekalan Massa (Hukum Lavoisier) Hukum Dasar Ilmu Kimia Sumber : wwwe-dukasinet Pernahkah Anda memperhatikan sepotong besi yang dibiarkan di udara terbuka, dan pada suatu waktu kita akan menemukan,
6.1 HUKUM-HUKUM DASAR KIMIA
 6.1 HUKUM-HUKUM DASAR KIMIA 1. Hukum kekekalan massa oleh Antoine Laurent Lavoiser (1789). Lavoiser mengemukakan pernyataan yang disebut hukum kekekalan massa, yang berbunyi : Pada reaksi kimia, massa
6.1 HUKUM-HUKUM DASAR KIMIA 1. Hukum kekekalan massa oleh Antoine Laurent Lavoiser (1789). Lavoiser mengemukakan pernyataan yang disebut hukum kekekalan massa, yang berbunyi : Pada reaksi kimia, massa
kimia Kelas X KONSEP MOL I K-13 A. Persamaan Reaksi
 K-13 Kelas X kimia KNSEP ML I Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami persamaan reaksi kimia dan komponen-komponennya. 2. Memahami cara
K-13 Kelas X kimia KNSEP ML I Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami persamaan reaksi kimia dan komponen-komponennya. 2. Memahami cara
STOIKIOMETRI _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA
 STOIKIOMETRI _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA 1. Hukum-Hukum Dasar 2. Persamaan Gas Ideal 3. Persamaan Kimia 4. Yield STOIKIOMETRI
STOIKIOMETRI _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA 1. Hukum-Hukum Dasar 2. Persamaan Gas Ideal 3. Persamaan Kimia 4. Yield STOIKIOMETRI
SATUAN ACARA PERKULIAHAN (SAP)
 Mata Kuliah : Kimia Teknik Kode Mata Kuliah : MKT 1105 SKS : 2(2-0) Waktu Pertemuan : 100 Menit SATUAN ACARA PERKULIAHAN (SAP) A. Tujuan Pembelajaran 1. Tujuan pembelajaran umum mata kuliah Setelah menyelesaikan
Mata Kuliah : Kimia Teknik Kode Mata Kuliah : MKT 1105 SKS : 2(2-0) Waktu Pertemuan : 100 Menit SATUAN ACARA PERKULIAHAN (SAP) A. Tujuan Pembelajaran 1. Tujuan pembelajaran umum mata kuliah Setelah menyelesaikan
Reaksi Dan Stoikiometri Larutan
 A. PERSAMAAN REAKSI ION Reaksi Dan Stoikiometri Larutan Persamaan reaksi ion adalah persamaan reaksi yang menjelaskan bagaimana reaksi antar-ion terjadi pada elektrolit. Persamaan reaksi ion terdiri dari:
A. PERSAMAAN REAKSI ION Reaksi Dan Stoikiometri Larutan Persamaan reaksi ion adalah persamaan reaksi yang menjelaskan bagaimana reaksi antar-ion terjadi pada elektrolit. Persamaan reaksi ion terdiri dari:
Reaksi dan Stoikiometri Larutan
 Reaksi dan Stoikiometri Larutan A. PERSAMAAN REAKSI ION Persamaan reaksi ion adalah persamaan reaksi yang menjelaskan bagaimana reaksi antar-ion terjadi pada larutan elektrolit. Persamaan reaksi ion terdiri
Reaksi dan Stoikiometri Larutan A. PERSAMAAN REAKSI ION Persamaan reaksi ion adalah persamaan reaksi yang menjelaskan bagaimana reaksi antar-ion terjadi pada larutan elektrolit. Persamaan reaksi ion terdiri
Stoikiometri. Bab 3. Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Secara Mikro atom & molekul.
 Bab 3 Stoikiometri Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional: 1 atom 12 C beratnya 12 sma Jika ditimbang
Bab 3 Stoikiometri Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional: 1 atom 12 C beratnya 12 sma Jika ditimbang
Soal Hukum Dasar Kimia Kelas X
 Author : Sri Utami Publish : 23-09-2011 11:34:08 Soal Hukum Dasar Kimia Kelas X Hukum Dasar Kimia 1. Ilmuwan yang menyatakan bahwa perbandingan massa unsur unsur dalam suatu senyawa tertentu selalu tetap
Author : Sri Utami Publish : 23-09-2011 11:34:08 Soal Hukum Dasar Kimia Kelas X Hukum Dasar Kimia 1. Ilmuwan yang menyatakan bahwa perbandingan massa unsur unsur dalam suatu senyawa tertentu selalu tetap
K13 Revisi Antiremed Kelas 11 Kimia
 K13 Revisi Antiremed Kelas 11 Kimia Stoikiometri Larutan - Soal Doc. Name: RK13AR11KIM0601 Doc. Version : 2016-12 01. Zat-zat berikut ini dapat bereaksi dengan larutan asam sulfat, kecuali... (A) kalsium
K13 Revisi Antiremed Kelas 11 Kimia Stoikiometri Larutan - Soal Doc. Name: RK13AR11KIM0601 Doc. Version : 2016-12 01. Zat-zat berikut ini dapat bereaksi dengan larutan asam sulfat, kecuali... (A) kalsium
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya.
 30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
Stoikiometri. Berasal dari kata Stoicheion (partikel) dan metron (pengukuran). Cara perhitungan dan pengukuran zat serta campuran kimia.
 Stoikiometri Berasal dari kata Stoicheion (partikel) dan metron (pengukuran). Cara perhitungan dan pengukuran zat serta campuran kimia. Bilangan Avogadro Stoikometri: pengukuran kuantitatif sehingga perlu
Stoikiometri Berasal dari kata Stoicheion (partikel) dan metron (pengukuran). Cara perhitungan dan pengukuran zat serta campuran kimia. Bilangan Avogadro Stoikometri: pengukuran kuantitatif sehingga perlu
Massa atom merupakan massa dari atom dalam satuan massa atom (sma).
 Bab 3 Stoikiometri Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional: 1 atom 12 C beratnya 12 sma Jika ditimbang
Bab 3 Stoikiometri Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional: 1 atom 12 C beratnya 12 sma Jika ditimbang
KIMIA DASAR. Ashfar Kurnia, M.Farm., Apt.
 KIMIA DASAR Ashfar Kurnia, M.Farm., Apt. ILMU KIMIA Kimia Ilmu pengetahuan alam yang mempelajari tentang MATERIyang meliputi: Struktur materi Susunan materi Sifat materi Perubahan materi Energi yang menyertai
KIMIA DASAR Ashfar Kurnia, M.Farm., Apt. ILMU KIMIA Kimia Ilmu pengetahuan alam yang mempelajari tentang MATERIyang meliputi: Struktur materi Susunan materi Sifat materi Perubahan materi Energi yang menyertai
Antiremed Kelas 11 Kimia
 Antiremed Kelas 11 Kimia Stoikiometri Larutan - Latihan Soal Doc. Name: AR11KIM0699 Doc. Version : 2012-07 01. Zat-zat berikut ini dapat bereaksi dengan larutan asam sulfat, kecuali... (A) kalsium oksida
Antiremed Kelas 11 Kimia Stoikiometri Larutan - Latihan Soal Doc. Name: AR11KIM0699 Doc. Version : 2012-07 01. Zat-zat berikut ini dapat bereaksi dengan larutan asam sulfat, kecuali... (A) kalsium oksida
BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI
 BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI A. STANDAR KOMPETENSI Mendiskripsikan hukumhukum dasar kimia dan penerapannya dalam perhitungan kimia. B. Kompetensi Dasar : Menuliskan nama senyawa anorganik
BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI A. STANDAR KOMPETENSI Mendiskripsikan hukumhukum dasar kimia dan penerapannya dalam perhitungan kimia. B. Kompetensi Dasar : Menuliskan nama senyawa anorganik
OAL TES SEMESTER I. I. Pilihlah jawaban yang paling tepat!
 KIMIA X SMA 103 S AL TES SEMESTER I I. Pilihlah jawaban yang paling tepat! 1. Partikel penyusun inti atom terdiri dari... a. proton dan elektron b. proton dan netron c. elektron dan netron d. elektron
KIMIA X SMA 103 S AL TES SEMESTER I I. Pilihlah jawaban yang paling tepat! 1. Partikel penyusun inti atom terdiri dari... a. proton dan elektron b. proton dan netron c. elektron dan netron d. elektron
Menuliskan nama senyawa kimia
 81 Bab 6. Stoikiometri Standar Kompetensi Memahami terjadinya ikatan kimia Memahami konsep mol Kompetensi Dasar Menuliskan nama senyawa kimia Menjelaskan konsep mol Menerapkan hukum Gay Lussac dan hukum
81 Bab 6. Stoikiometri Standar Kompetensi Memahami terjadinya ikatan kimia Memahami konsep mol Kompetensi Dasar Menuliskan nama senyawa kimia Menjelaskan konsep mol Menerapkan hukum Gay Lussac dan hukum
BAB 1V HASIL DAN PEMBAHASAN
 4.1.1 HASIL PENELITIAN BAB 1V HASIL DAN PEMBAHASAN Berdasarkan data hasil penelitian, persentase kemampuan siswa kelas dalam menyelesaikan soal-soal persamaan reaksi kimia dapat dilihat pada tabel dibawah
4.1.1 HASIL PENELITIAN BAB 1V HASIL DAN PEMBAHASAN Berdasarkan data hasil penelitian, persentase kemampuan siswa kelas dalam menyelesaikan soal-soal persamaan reaksi kimia dapat dilihat pada tabel dibawah
BAB III STOIKIOMETRI
 BAB III STOIKIOMETRI A. Standar Kompetensi: Memahami tentang ilmu kimia dan dasar-dasarnya serta mampu menerapkannya dalam kehidupan se-hari-hari terutama yang berhubungan langsung dengan kehidupan. B.
BAB III STOIKIOMETRI A. Standar Kompetensi: Memahami tentang ilmu kimia dan dasar-dasarnya serta mampu menerapkannya dalam kehidupan se-hari-hari terutama yang berhubungan langsung dengan kehidupan. B.
BAB III METODOLOGI PENELITIAN
 BAB III METODOLOGI PENELITIAN A. Lokasi dan Subjek Penelitian Penelitian ini dilaksanakan di SMA Negeri 2 Bandung. Subyek penelitian dalam penelitian ini adalah siswa SMA kelas X dan XI yang telah mempelajari
BAB III METODOLOGI PENELITIAN A. Lokasi dan Subjek Penelitian Penelitian ini dilaksanakan di SMA Negeri 2 Bandung. Subyek penelitian dalam penelitian ini adalah siswa SMA kelas X dan XI yang telah mempelajari
HUKUM DASAR KIMIA DAN PERHITUNGAN KIMIA
 Modul Hukum Dasar Kimia dan Perhitungan Kimia EV Page of 8 HUKUM DASAR KIMIA DAN PERHITUNGAN KIMIA Mata Pelajaran K e l a s Nomor Modul Penulis : Kimia : X : Kim.X.04 : Ernavita M.Pd Sekolah Menengah Atas
Modul Hukum Dasar Kimia dan Perhitungan Kimia EV Page of 8 HUKUM DASAR KIMIA DAN PERHITUNGAN KIMIA Mata Pelajaran K e l a s Nomor Modul Penulis : Kimia : X : Kim.X.04 : Ernavita M.Pd Sekolah Menengah Atas
LEMBARAN SOAL 11. Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : X ( SEPULUH )
 LEMBARAN SOAL 11 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : X ( SEPULUH ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan
LEMBARAN SOAL 11 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : X ( SEPULUH ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan
BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN
 BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN NASIONAL JAKARTA 4 00 43 KATA PENGANTAR Pendidikan Menengah
BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN NASIONAL JAKARTA 4 00 43 KATA PENGANTAR Pendidikan Menengah
MATERI adalah segala sesuatu yang mempunyai massa dan menempati ruang ( punya volume )
 MATERI adalah segala sesuatu yang mempunyai massa dan menempati ruang ( punya volume ) Perubahan materi 1. perubahan fisis a) perubahan yang tidak menghasilkan zat baru b) perubahan bentuk dan wujud tanpa
MATERI adalah segala sesuatu yang mempunyai massa dan menempati ruang ( punya volume ) Perubahan materi 1. perubahan fisis a) perubahan yang tidak menghasilkan zat baru b) perubahan bentuk dan wujud tanpa
WEEK 3, 4 & 5 Bag 3:STOIKIOMETRI. Joko Sedyono Benyamin
 WEEK 3, 4 & 5 Bag 3:STOIKIOMETRI Joko Sedyono Benyamin 1 Diskripsi Stoikiometri adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif/jumlah zat yang terlibat dalam reaksi kimia. Kata ini berasal
WEEK 3, 4 & 5 Bag 3:STOIKIOMETRI Joko Sedyono Benyamin 1 Diskripsi Stoikiometri adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif/jumlah zat yang terlibat dalam reaksi kimia. Kata ini berasal
Rumus Kimia. Mol unsur =
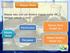 Rumus Kimia Menentukan Rumus Kimia Zat Rumus kimia zat dapat dibedakan menjadi rumus empiris dan rumus molekul. Rumus empiris dapat ditentukan dengan menghitung mol komponen penyusun zat dengan menggunakan
Rumus Kimia Menentukan Rumus Kimia Zat Rumus kimia zat dapat dibedakan menjadi rumus empiris dan rumus molekul. Rumus empiris dapat ditentukan dengan menghitung mol komponen penyusun zat dengan menggunakan
Abdul Wahid Surhim 2014
 Abdul Wahid Surhim 2014 Kerangka Pembelajaran Persamaan Kimia Pola Reaktivitas Kimia Berat Atom dan Molekul Mol Rumus Empirik dari Analisis Informasi Kuantitatif dari Persamaan yang Disetarakan Membatasi
Abdul Wahid Surhim 2014 Kerangka Pembelajaran Persamaan Kimia Pola Reaktivitas Kimia Berat Atom dan Molekul Mol Rumus Empirik dari Analisis Informasi Kuantitatif dari Persamaan yang Disetarakan Membatasi
Soal ini terdiri dari 25 soal PG (50 poin) dan 6 soal essay (88 poin)
 Bidang Studi Kode Berkas : Kimia : KI-T01 (soal) Soal ini terdiri dari 25 soal PG (50 poin) dan 6 soal essay (88 poin) Tetapan Avogadro N A = 6,022 10 23 partikel.mol 1 Tetapan Gas Universal R = 8,3145
Bidang Studi Kode Berkas : Kimia : KI-T01 (soal) Soal ini terdiri dari 25 soal PG (50 poin) dan 6 soal essay (88 poin) Tetapan Avogadro N A = 6,022 10 23 partikel.mol 1 Tetapan Gas Universal R = 8,3145
BAB I STOIKHIOMETRI I - 1
 BAB I STOIKHIOMETRI 1.1 PENDAHULUAN Setiap zat, unsur, senyawa dalam kimia mempunyai nama dan rumus uniknya sendiri. Cara tersingkat untuk memerikan suatu reaksi kimia adalah dengan menuliskan rumus untuk
BAB I STOIKHIOMETRI 1.1 PENDAHULUAN Setiap zat, unsur, senyawa dalam kimia mempunyai nama dan rumus uniknya sendiri. Cara tersingkat untuk memerikan suatu reaksi kimia adalah dengan menuliskan rumus untuk
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI
 3 LAJU REAKSI A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI Materi dapat berubah dari bentuk yang satu ke bentuk yang
3 LAJU REAKSI A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI Materi dapat berubah dari bentuk yang satu ke bentuk yang
No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 8 Semester I BAB I Prodi PT Boga BAB I MATERI
 No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 8 BAB I MATERI Materi adalah sesuatu yang menempati ruang dan mempunyai massa. Materi dapat berupa benda padat, cair, maupun gas. A. Penggolongan
No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 8 BAB I MATERI Materi adalah sesuatu yang menempati ruang dan mempunyai massa. Materi dapat berupa benda padat, cair, maupun gas. A. Penggolongan
PENGANTAR. Konsep Dasar Kimia untuk PGSD 73
 PENGANTAR Saudara tentu masih ingat tentang perubahan kimia dari materi. Perubahan kimia atau reaksi kimia dapat dinyatakan ke dalam suatu persamaan yang disebut persamaan reaksi. Bagian lain dari Ilmu
PENGANTAR Saudara tentu masih ingat tentang perubahan kimia dari materi. Perubahan kimia atau reaksi kimia dapat dinyatakan ke dalam suatu persamaan yang disebut persamaan reaksi. Bagian lain dari Ilmu
LEMBARAN SOAL 4. Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA )
 LEMBARAN SOAL 4 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
LEMBARAN SOAL 4 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN
 KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN 1. Suatu reaksi dikatakan mencapai kesetimbangan apabila. A. laju reaksi ke kiri sama dengan ke kanan B. jumlah koefisien reaksi ruas kiri sama dengan ruas kanan
KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN 1. Suatu reaksi dikatakan mencapai kesetimbangan apabila. A. laju reaksi ke kiri sama dengan ke kanan B. jumlah koefisien reaksi ruas kiri sama dengan ruas kanan
Konsep Mol : Menghubungkan Dunia Makroskopik dan Dunia Molekular
 Konsep Mol : Menghubungkan Dunia Makroskopik dan Dunia Molekular 1 Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional:
Konsep Mol : Menghubungkan Dunia Makroskopik dan Dunia Molekular 1 Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional:
Konsep Mol. 1. Jumlah Partikel Dalam 1 Mol Zat
 Konsep Mol Setiap zat yang ada di alam tersusun atas partikel-partikel bentuk atom, molekul, dan ion. Ukuran dan massa partikel-partikel zat tersebut sangat kecil sehingga kita kesulitan untuk mengukurnya.
Konsep Mol Setiap zat yang ada di alam tersusun atas partikel-partikel bentuk atom, molekul, dan ion. Ukuran dan massa partikel-partikel zat tersebut sangat kecil sehingga kita kesulitan untuk mengukurnya.
STOIKIOMETRI. Purwanti Widhy H, M.Pd
 STOIKIOMETRI Purwanti Widhy H, M.Pd widhy_ipauny@yahoo.com Menentukan jumlah partikel dan jumlah mol Jumlah molx(n) = jumlah partikelx L 1 mol = L partikel L= bilangan avogadro (6.02 x 10 23 /mol)
STOIKIOMETRI Purwanti Widhy H, M.Pd widhy_ipauny@yahoo.com Menentukan jumlah partikel dan jumlah mol Jumlah molx(n) = jumlah partikelx L 1 mol = L partikel L= bilangan avogadro (6.02 x 10 23 /mol)
Ikatan kimia. 1. Peranan Elektron dalam Pembentukan Ikatan Kimia. Ikatan kimia
 Ikatan kimia 1. Peranan Elektron dalam Pembentukan Ikatan Kimia Ikatan kimia Gaya tarik menarik antara atom sehingga atom tersebut tetap berada bersama-sama dan terkombinasi dalam senyawaan. gol 8 A sangat
Ikatan kimia 1. Peranan Elektron dalam Pembentukan Ikatan Kimia Ikatan kimia Gaya tarik menarik antara atom sehingga atom tersebut tetap berada bersama-sama dan terkombinasi dalam senyawaan. gol 8 A sangat
SOAL KIMIA 2 KELAS : XI IPA
 SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A. D. Cu E. Zn
 1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
FAKULTAS TEKNIK UNIVERSITAS NEGERI YOGYAKARTA BAHAN AJAR KIMIA DASAR BAB II RUMUS KIMIA DAN TATANAMA
 No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 6 BAB II RUMUS KIMIA DAN TATANAMA A. Rumus Kimia Rumus kimia merupakan kumpulan lambang atom dengan komposisi tertentu. Rumus kimia terdiri dari
No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 6 BAB II RUMUS KIMIA DAN TATANAMA A. Rumus Kimia Rumus kimia merupakan kumpulan lambang atom dengan komposisi tertentu. Rumus kimia terdiri dari
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
7. Diantara spesi berikut ini yang memiliki jari-jari paling besar adalah A. Al 3+ D.Mg 2+ B.F - E. Na + C. O 2-
 Pililah salah satu jawaban yang paling tepat! 1. 23 X 11 +,jumlah proton,elektron dan neutron berturut-turut adalah A. 11 proton,11elektron dan 12 neutron D. 11 proton, 10 elektron dan 12 neutron B. 10
Pililah salah satu jawaban yang paling tepat! 1. 23 X 11 +,jumlah proton,elektron dan neutron berturut-turut adalah A. 11 proton,11elektron dan 12 neutron D. 11 proton, 10 elektron dan 12 neutron B. 10
Perhatikan gambar diagram P-T berikut:
 SIFAT KOLIGATIF LARUTAN 1. Yang bukan merupakan sifat koligatif larutan adalah. A. Penurunan tekanan uap B. Penurunan titik beku C. Penurunan titik didih D. Kenaikan titik didih E. Tekanan osmosis 2. Adanya
SIFAT KOLIGATIF LARUTAN 1. Yang bukan merupakan sifat koligatif larutan adalah. A. Penurunan tekanan uap B. Penurunan titik beku C. Penurunan titik didih D. Kenaikan titik didih E. Tekanan osmosis 2. Adanya
TATA NAMA SENYAWA DAN PER- SAMAAN REAKSI
 TATA NAMA SENYAWA DAN PER- SAMAAN REAKSI A. RUMUS KIMIA B. TATA NAMA SENYAWA ANRGANIK C. PERSAMAAN REAKSI Materi tersusun oleh atom-atom, misalnya tembaga, jika tembaga kita potong menjadi dua bagian masing-masing
TATA NAMA SENYAWA DAN PER- SAMAAN REAKSI A. RUMUS KIMIA B. TATA NAMA SENYAWA ANRGANIK C. PERSAMAAN REAKSI Materi tersusun oleh atom-atom, misalnya tembaga, jika tembaga kita potong menjadi dua bagian masing-masing
HUKUM DASAR KIMIA DAN STOIKIOMETRI
 HUKUM DASAR KIMIA DAN STOIKIOMETRI Bagaimana cara untuk mengukur jumlah suatu senyawa yang terkandung dalam suatu material? Ini merupakan pertanyaan dasar yang telah dijawab oleh para kimiawan terdahulu.
HUKUM DASAR KIMIA DAN STOIKIOMETRI Bagaimana cara untuk mengukur jumlah suatu senyawa yang terkandung dalam suatu material? Ini merupakan pertanyaan dasar yang telah dijawab oleh para kimiawan terdahulu.
TATA NAMA SENYAWA, PERSAMAAN REAKSI SEDERHANA, & HUKUM-HUKUM DASAR KIMIA
 Bidang: KIMIA DASAR Materi ini dapat diunduh di https://arisarianto.wordpress.com Materi tambahan lainnya, kunjungi portal https://school.quipper.com/id/index.html buka kelas khusus SMAN MODEL TERPADU
Bidang: KIMIA DASAR Materi ini dapat diunduh di https://arisarianto.wordpress.com Materi tambahan lainnya, kunjungi portal https://school.quipper.com/id/index.html buka kelas khusus SMAN MODEL TERPADU
III. REAKSI KIMIA. Jenis kelima adalah reaksi penetralan, merupakan reaksi asam dengan basa membentuk garam dan air.
 III. REAKSI KIMIA Tujuan 1. Mengamati bukti terjadinya suatu reaksi kimia. 2. Menuliskan persamaan reaksi kimia. 3. Mempelajari secara sistematis lima jenis reaksi utama. 4. Membuat logam tembaga dari
III. REAKSI KIMIA Tujuan 1. Mengamati bukti terjadinya suatu reaksi kimia. 2. Menuliskan persamaan reaksi kimia. 3. Mempelajari secara sistematis lima jenis reaksi utama. 4. Membuat logam tembaga dari
BAB 1 SIFAT KOLIGATIF LARUTAN. STANDART KOMPETENSI Mendeskripsikan sifat-sifat larutan, metode pengukuran serta terapannya.
 BAB 1 SIFAT KOLIGATIF LARUTAN STANDART KOMPETENSI Mendeskripsikan sifat-sifat larutan, metode pengukuran serta terapannya. KOMPETENSI DASAR Mendeskripsikan penurunan tekanan uap, kenaikan titik didih,
BAB 1 SIFAT KOLIGATIF LARUTAN STANDART KOMPETENSI Mendeskripsikan sifat-sifat larutan, metode pengukuran serta terapannya. KOMPETENSI DASAR Mendeskripsikan penurunan tekanan uap, kenaikan titik didih,
SIFAT KOLIGATIF LARUTAN
 BAB 1 SIFAT KOLIGATIF LARUTAN Gambar 1.1 Proses kenaikan titik didih Sumber: Jendela Iptek Materi Pada pelajaran bab pertama ini, akan dipelajari tentang penurunan tekanan uap larutan ( P), kenaikan titik
BAB 1 SIFAT KOLIGATIF LARUTAN Gambar 1.1 Proses kenaikan titik didih Sumber: Jendela Iptek Materi Pada pelajaran bab pertama ini, akan dipelajari tentang penurunan tekanan uap larutan ( P), kenaikan titik
STOIKIOMETRI LARUTAN. Andian Ari Anggraeni, M.Sc
 STOIKIOMETRI LARUTAN Andian Ari Anggraeni, M.Sc A.1. MASSA ATOM RELATIF (A r ) DAN MASSA MOLEKUL RELATIF (M r ) Dari percobaan diketahui bahwa perbandingan massa hidrogen dan oksigen dalam air adalah 1
STOIKIOMETRI LARUTAN Andian Ari Anggraeni, M.Sc A.1. MASSA ATOM RELATIF (A r ) DAN MASSA MOLEKUL RELATIF (M r ) Dari percobaan diketahui bahwa perbandingan massa hidrogen dan oksigen dalam air adalah 1
BAB IV BILANGAN OKSIDASI DAN TATA NAMA SENYAWA
 BAB IV BILANGAN OKSIDASI DAN TATA NAMA SENYAWA 1. BILANGAN OKSIDASI Bilangan oksidasi suatu unsur menggambarkan kemampuan unsur tersebut berikatan dengan unsur lain dan menunjukkan bagaimana peranan elektron
BAB IV BILANGAN OKSIDASI DAN TATA NAMA SENYAWA 1. BILANGAN OKSIDASI Bilangan oksidasi suatu unsur menggambarkan kemampuan unsur tersebut berikatan dengan unsur lain dan menunjukkan bagaimana peranan elektron
MODUL 5. Kiat Menghitung Zat Kimia
 MDUL 5 MDUL 5 Kiat Menghitung Zat Kimia i Kata Pengantar Daftar Isi Pendidikan kesetaraan sebagai pendidikan alternatif memberikan layanan kepada mayarakat yang karena kondisi geografis, sosial budaya,
MDUL 5 MDUL 5 Kiat Menghitung Zat Kimia i Kata Pengantar Daftar Isi Pendidikan kesetaraan sebagai pendidikan alternatif memberikan layanan kepada mayarakat yang karena kondisi geografis, sosial budaya,
BAB III KESETIMBANGAN KIMIA. AH = 92 kj
 BAB III KESETIMBANGAN KIMIA Amonia (NH 3 ) merupakan salah satu zat kimia yang paling banyak diproduksi. Amonia digunakan terutama untuk membuat pupuk, yaitu urea dan ZA. Penggunaan amonia yang lain, yaitu
BAB III KESETIMBANGAN KIMIA Amonia (NH 3 ) merupakan salah satu zat kimia yang paling banyak diproduksi. Amonia digunakan terutama untuk membuat pupuk, yaitu urea dan ZA. Penggunaan amonia yang lain, yaitu
