BAB III METODOLOGI PENELITIAN
|
|
|
- Utami Lesmono
- 9 tahun lalu
- Tontonan:
Transkripsi
1 BAB III METODOLOGI PENELITIAN A. Lokasi dan Subjek Penelitian Penelitian ini dilaksanakan di SMA Negeri 2 Bandung. Subyek penelitian dalam penelitian ini adalah siswa SMA kelas X dan XI yang telah mempelajari materi stoikiometri. Profil siswa SMA kelas X dan XI yang menjadi subjek penelitian adalah profil yang sama, dimana kategori subjeknya adalah siswa-siswi kelas X dan XI IPA dalam kategori taraf kecerdasan yang tinggi berdasarkan urutan pembagian kelasnya, yaitu di X-MIA 1 dan XI-MIA I. Pemilihan kelas untuk penelitian ini berdasarkan rekomendasi dari guru kimia di SMA Negeri 2 Bandung. Miskonsepsi ini diungkap melalui tes diagnostik pilihan ganda dua tingkat. Siswa yang diteliti dikondisikan dalam keadaan siap untuk menjalani proses pengambilan data. Pengkondisian tersebut dilakukan dengan cara diberitahu bahwa akan dilakukan tes stoikiometri melalui guru kimia. Tujuan dari proses ini adalah agar saat dilakukan pengambilan data siswa berada dalam keadaan siap untuk dilakukan pengujian terhadap materi stoikiometri, sehingga jawaban pada instrumen penelitian benar-benar berdasarkan pengetahuan dan pemahaman yang dimiliki siswa. Perbandingan Miskonsepsi Siswa Kelas X Dan Xi Pada Materi Stoikiometri Melalui Tes Diagnostik Pilihan Ganda Dua Tingkat
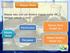
2 27 B. Metode dan Desain Penelitian Penelitian ini ditujukan untuk membandingkan miskonsepsi siswa kelas X dan XI pada materi stoikiometri melalui tes diagnostik pilihan ganda dua tingkat. Merujuk pada tujuan penelitian di atas, maka metode penelitian yang digunakan adalah penelitian komparatif. Penelitian komparatif adalah penelitian yang bersifat membandingkan. Penelitian ini dilakukan untuk membandingkan persamaan dan perbedaan dua atau lebih dari satu atau dalam waktu yang berbeda. Menurut Nazir (2005: 58) penelitian komparatif adalah sejenis penelitian deskriptif yang ingin mencari jawaban secara mendasar tentang sebab-akibat, dengan menganalisis faktor-faktor penyebab terjadinya ataupun munculnya suatu fenomena tertentu. Desain penelitian disusun untuk memberikan gambaran mengenai alur penelitian yang dilakukan peneliti dari awal hingga akhir, sehingga penelitian yang dilakukan sesuai dengan sistematika yang seharusnya. Desain penelitian dilakukan dengan tujuan untuk dapat menjawab pertanyaan penelitian. Desain penelitian yang dilakukan pada penelitian ini ditunjukkan pada gambar 3.1. Perbandingan Miskonsepsi Siswa Kelas X Dan Xi Pada Materi Stoikiometri Melalui Tes Diagnostik Pilihan Ganda Dua Tingkat
3 28 Secara garis besar alur dari penelitian ini digambarkan sebagai berikut: Soal pilihan ganda dua tingkat stoikiometri yang telah diuji reliabilitasnya Validasi oleh para ahli Ditolak CVR < 0,99 Perhitungan CVR Revisi CVR 0,99 Diterima Soal pilihan ganda dua tingkat materi stoikiometri Uji coba soal stoikiometri kelas X dan XI di SMA Negeri 2 Bandung Pengolahan dan analisis data menggunakan kunci determinasi Miskonsepsi siswa kelas X Miskonsepsi siswa kelas materi stoikiometri XI materi stoikiometri Perbandingan Miskonsepsi Siswa Kelas X Dan Xi Pada Materi Stoikiometri Melalui Tes Diagnostik Pilihan Ganda Dua Tingkat
4 29 Hasil analisis perbandingan miskonsepsi siswa kelas X dan XI pada materi stoikiometri Gambar 3.1. Alur Penelitian C. Definisi Operasional Definisi operasional yang terkait dengan penelitian ini adalah: 1. Miskonsepsi merupakan konsepsi anak sebagai hasil konstruksi tentang pengalaman sehari-hari di alam sekitarnya, yang berbeda dengan konsepsi ilmiah (Dahar, 2011). Menurut Fowler dalam Suparno (2005) miskonsepsi adalah suatu pengertian yang tidak akurat terhadap konsep, penggunaan konsep yang salah, klasifikasi contoh-contoh yang salah, kekacauan konsepkonsep yang berbeda, dan hubungan konsep-konsep yang tidak benar. Dalam Tan et al. (2005) mendefinisikan miskonsepsi sebagai konsepsi siswa yang berbeda dengan konsepsi yang diterima secara ilmiah 2. Tes diagnostik adalah tes yang digunakan untuk mengetahui kelemahankelemahan siswa, sehingga dari kelemahan-kelemahan tersebut dapat diberikan perlakuan yang tepat (Arikunto, 2009). Menurut Depdiknas (2007), tes diagnostik adalah tes yang digunakan untuk mengetahui kelemahankelemahan siswa, sehingga hasil tersebut dapat digunakan sebagai dasar untuk memberikan tindak lanjut, berupa perlakuan yang tepat dan sesuai dengan kelemahan yang dimiliki siswa. 3. Tes diagnostik pilihan ganda dua tingkat (two-tier multiple choice) merupakan bentuk tes pilihan ganda yang terdiri dari dua tingkat. Menurut Treagust (1995), tes pilihan ganda dua tingkat merupakan instrumen diagnostik yang dapat mengidentifikasi dan mengevaluasi konsepsi siswa pada bidang tertentu, yaitu melalui pilihan pada tingkat pertama untuk Perbandingan Miskonsepsi Siswa Kelas X Dan Xi Pada Materi Stoikiometri Melalui Tes Diagnostik Pilihan Ganda Dua Tingkat
5 30 menentukan pengetahuan faktual atau konseptual sedangkan pilihan pada tingkat kedua digunakan untuk mengetahui alasan dibalik pilihan pada pertama. D. Instrumen Penelitian Instrumen yang digunakan dalam penelitian ini adalah instrumen soal pilihan ganda dua tingkat materi stoikiometri. Instrumen ini berupa set soal stoikiometri yang telah disusun oleh peneliti lain (Rizki, 2013) sehingga pada penelitian ini peneliti melakukan aplikasi terhadap soal yang telah dibuat untuk mengetahui perbandingan miskonsepsi siswa kelas X dan XI terhadap materi stoikiometri. E. Prosedur Penelitian Pada penelitian sebelumnya dihasilkan 15 butir soal tes diagnostik pilihan ganda dua tingkat dengan kriteria nilai reliabilitas cukup tinggi, sehingga peneliti menggunakan instrumen tersebut sebagai instrumen penelitian tanpa melakukan uji kelayakan instrumen kembali. 15 butir soal hasil penelitian sebelumnya dilakukan validasi kembali sebelum di ujikan kepada 7 validator, yang terdiri dari 2 orang dosen dan 5 orang guru kimia. Dua orang dosen yang dijadikan validator berasal dari dosen pendidikan kimia, sementara 5 orang guru berasal dari perwakilan sekolah tempat penelitian, yaitu guru kimia SMA Negeri 2 Bandung. Soal hasil validasi dari para validator kemudian dihitung validitasnya untuk setiap butir soal dengan menggunakan CVR, selain itu dihitung juga nilai CVI untuk mengetahui rata-rata nilai CVR soal. Butir soal yang dinyatakan tidak valid secara CVR dihilangkan, sedangkan butir soal yang memenuhi kriteria minimal Perbandingan Miskonsepsi Siswa Kelas X Dan Xi Pada Materi Stoikiometri Melalui Tes Diagnostik Pilihan Ganda Dua Tingkat
6 31 CVR dilakukan perbaikan ulang sesuai dengan saran yang diberikan oleh validator. Soal yang valid dan baik secara nilai reliabilitas diujikan pada siswa kelas X dan kelas XI. Waktu yang diberikan untuk mengerjakan soal adalah sama, yaitu 60 menit. F. Teknik Pengumpulan dan Analisis Data 1. Teknik Pengumpulan Data Data yang digunakan dalam penelitian ini adalah data hasil jawaban siswa kelas X dan kelas XI sekolah menengah atas negeri 2 kota Bandung dengan menggunakan soal tes tulis berupa tes pilihan ganda dua tingkat materi stoikiometri. Sebelum dilakukan pengambilan data, peneliti memberi tahu siswa yang akan dijadikan subjek penelitian melalui guru mata pelajaran kimia yang mengajar di kelas yang bersangkutan bahwa akan diadakan tes soal stoikiometri, sehingga siswa membaca materi yang akan diujikan, yaitu stoikiometri. Tujuan dari kegiatan ini adalah agar data yang diujikan benar-benar berdasarkan kemampuan siswa dalam menjawab soal, sehingga miskonsepsi siswa dari dua kelas yang berbeda, yaitu kelas X dan kelas XI menjadi terlihat. 2. Analisis Data Berikut ini analisis data yang digunakan. a. Data Revalidasi Pengolahan data hasil revalidasi digunakan untuk mengetahui kevalidan untuk setiap butir soal. Adapun langkah-langkah yang dilakukan untuk memperoleh data hasil validasi adalah sebagai berikut: Perbandingan Miskonsepsi Siswa Kelas X Dan Xi Pada Materi Stoikiometri Melalui Tes Diagnostik Pilihan Ganda Dua Tingkat
7 32 1) 15 butir soal tes diagnostik pilihan ganda dua tingkat hasil penelitian sebelumnya pada materi stoikiometri dilakukan validasi oleh 7 validator, yang terdiri dari dua orang dosen dan lima orang guru pelajaran kimia SMAN di kota Bandung. 2) Hasil dari validasi dihitung nilai CVR dan CVI dengan menggunakan rumus: Keterangan : Ne : Jumlah validator yang menyatakan Ya N : Jumlah validator 3) Menentukan kevalidan dari setiap butir soal berdasarkan skor minimal CVR. Pada penelitian ini jumlah validator yang terlibat sebanyak 7 orang, sehingga seperti uraian bab II, skor minimal untuk 7 validator adalah 0,99. Tabel 3.1. Skor Minimum CVR pada Jumlah Validator Tertentu Jumlah Validator Skor CVR 5 0,99 6 0,99 7 0,99 8 0,78 9 0, , , , , , ,49 Perbandingan Miskonsepsi Siswa Kelas X Dan Xi Pada Materi Stoikiometri Melalui Tes Diagnostik Pilihan Ganda Dua Tingkat
8 , , , , ,29 (Lawshe, C.H., 1975: ). Tabel 3.2. Nilai CVR Hasil revalidasi soal pilihan ganda dua tingkat pada 7 orang validator untuk Setiap Butir Soal yang pada Materi Stoikiometri Perbandingan Miskonsepsi Siswa Kelas X Dan Xi Pada Materi Stoikiometri Melalui Tes Diagnostik Pilihan Ganda Dua Tingkat
9 34 No Konsep Target Soal Nilai CVR Kesesuaian Butir Soal dengan Miskonsepsi Nilai CVR Kesesuaian Stem dengan Option Keputusan 1 Hukum Kekekalan Massa Diterima yang berbunyi Dalam sistem tertutup, massa zat sebelum dan sesudah reaksi adalah sama 2 Hukum Perbandingan Tetap Diterima yang berbunyi perbandingan massa unsur-unsur dalam satu senyawa adalah tertentu dan tetap 3 Hukum Kelipatan Diterima perbandingan (Hukum Dalton 4 Hukum Perbandingan Volume Diterima 5 Hipotesis Avogadro Diterima 6 Hubungan antara jumlah mol (n) dengan jumlah partikel (X) 7 Hubungan jumlah mol (n) dengan massa zat (m) Diterima Diterima 8 Hubungan jumlah mol dengan Diterima volume 9 Rumus Empirik Diterima 10 Rumus molekul Diterima 11 Menentukan rumus air kristal Diterima 12 Kadar zat dalam suatu Diterima senyawa 13 Kadar zat dalam suatu Diterima senyawa 14. Pereaksi pembatas dalam suatu Diterima reaksi 15. Banyak zat pereaksi atau hasil reaksi Diterima Perbandingan Miskonsepsi Siswa Kelas X Dan Xi Pada Materi Stoikiometri Melalui Tes Diagnostik Pilihan Ganda Dua Tingkat
10 35 Berdasarkan Tabel 3.2. butir soal yang mempunyai nilai CVR sama dengan 1 adalah sebanyak 15 soal, yakni soal nomor 1, 2, 3, 4, 6, 7, 8, 9, 10, 11, 12, 13 14, 15. Nilai CVR sama dengan 1 didapat karena tujuh validator menilai sesuai., Dengan demikian, berdasarkan nilai minimum CVR untuk validator berjumlah lima (0,99) sebanyak 15 soal dikatakan memenuhi kriteria baik (layak) dari segi validitasnya. Tabel 3.3. Rekapitulasi Hasil Uji Validitas Butir soal yang tidak memenuhi Butir soal yang memenuhi kriteria dari segi kriteria dari segi validitas (CVR validitas (CVR 1, 2, 3, 4, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, - Adapun saran dari validator menjadi perbaikan di dalam soal diagnostik pilihan berganda dua tingkat yang tervalidasi. Nilai reliabilitas dari instrumen yang digunakan adalah sebesar 0,51. Nilai ini diperoleh berdasarkan hasil uji instrumen yang dilakukan peneliti sebelumnya Rizki (2013), sehingga pada penelitian ini peneliti tidak melakukan uji pendahuluan instrumen karena nilai reliabilitas sudah memenuhi kriteria sebagai alat ukur instrumen yang baik, dan langsung pada tahap aplikasi soal tes diagnostik pilihan ganda dua tingkat b. Data Jawaban Siswa Pengolahan data jawaban siswa dilakukan untuk mengetahui jenis dan perbedaan miskonsepsi siswa kelas X dan kelas XI. Adapun langkah-langkah yang dilakukan untuk memperoleh data tersebut adalah sebagai berikut: 1) Soal yang dinyatakan valid diujikan kepada 62 siswa yang berasal dari kelas yang berbeda, yaitu 31 siswa kelas X dan 31 siswa kelas XI. Data yang mungkin diperoleh dari hasil jawaban siswa adalah dalam menjawab soal tes diagnostik pilihan ganda dua tingkat adalah seperti pada tabel 3.4 Tabel 3.4 Beberapa pola respon siswa pada soal yang diujikan Soal (%) jawaban siswa a.1 a.2 a.3 Perbandingan Miskonsepsi Siswa Kelas X Dan Xi Pada Materi Stoikiometri Melalui Tes Diagnostik Pilihan Ganda Dua Tingkat
11 36 untuk setiap pola respon b.1 b.2 b.3 c.1 c.2 c.3 1) Pengkatagorian pemahaman dan miskonsespsi siswa. Pengkatagorian dilakukan berdasarkan pada acuan seperti pada tabel 3.5. Tabel 3.5. Kategori Pemahaman Siswa Kombinasi Jawaban Klasifikasi Jawaban Siswa Jawaban benar-alasan benar Pemahaman utuh Jawaban benar-alasan salah Pemahaman parsial dengan miskonsepsi Jawaban salah-alasan benar Pemahaman parsial dengan miskonsepsi Jawaban salah-alasan salah Tidak paham (Tekkaya, et al., 1999) 2) Data yang didapat dari hasil uji aplikasi skala kecil instrumen tes diagnostik pilihan ganda dua tingkat dianalisis dan diinterpretasikan miskonsepsi yang terkandung dalam setiap jawaban siswa dengan menggunakan kunci determinasi miskonsepsi (tabel 3.5). Miskonsepsi siswa yang terungkap di hitung presentasenya dengan menggunakan persamaan berikut: Keterangan: NP = Persentase siswa yang mengalami miskonsepsi PR = Jumlah siswa yang memilih pola respon tertentu n = Total jumlah siswa pada aplikasi produk skala kecil Perbandingan Miskonsepsi Siswa Kelas X Dan Xi Pada Materi Stoikiometri Melalui Tes Diagnostik Pilihan Ganda Dua Tingkat
12 37 Untuk menafsirkan persentase siswa yang mengalami miskonsepsi pada setiap konsep stoikiometri dapat digunakan kriteria sebagai berikut: Tabel 3.6 Kriteria Persentase Siswa yang Mengalami Miskonsepsi pada Setiap Konsep Stoikiometri No. Persentase (%) Kriteria 1. 0 Tidak satupun Sedikit dari jumlah respon Hampir setengahnya Setengahnya Lebih dari setengahnya Hampir seluruhnya Seluruhnya (Sudjana, 2005) Untuk siswa yang mengalami miskonsepsi, maka penentuan miskonsepsi yang dialami oleh siswa tersebut menggunakan kunci determinasi miskonsepsi. Kunci determinasi miskonsepsi untuk materi stoikimetri ditunjukan pada tabel 3.7. Perbandingan Miskonsepsi Siswa Kelas X Dan Xi Pada Materi Stoikiometri Melalui Tes Diagnostik Pilihan Ganda Dua Tingkat
13 Perbandingan Miskonsepsi Siswa Kelas X Dan Xi Pada Materi Stoikiometri Melalui Tes Diagnostik Pilihan Ganda Dua Tingkat 38
14 37 Tabel 3.7 Kunci Determinasi Miskonsepsi pada Materi Stoikiometri No Konsep Soal 1 Hukum Kekekalan Massa yang berbunyi Dalam sistem tertutup, massa zat sebelum dan sesudah reaksi adalah sama 1. Seorang siswa melakukan tiga kali percobaan memanaskan logam merkuri dalam tabung tertutup dan dihasilkan merkuri oksida. Data percobaannya adalah sebagai berikut: Percobaan Massa Merkuri (gram) Massa Oksigen (gram) Massa Merkuri Oksida (gram) I ? II 400? 442 III 600? 645 Menurut hukum Lavoisier, pernyataan di bawah ini yang benar adalah. (Ar Hg=200, O=16) a. Massa merkuri oksida pada percobaan I adalah 219 gram b. Oksigen yang bereaksi pada percobaan II adalah 38 gram c. Massa merkuri oksida pada percobaan I adalah 215 gram d. Jika merkuri yang digunakan 100 gram maka hasil reaksinya 119 gram e. Oksigen yang bereaksi seharusnya kelipatan dari 16 gram Alasan: 1. Karena massa merkuri pada percobaan II 2 kali lipat dari percobaan I, maka oksigen yang yang Pola Respon a.3 a.5;b.1 e.1 a.1;a.2; b.4 Miskonsepsi Siswa Siswa berfikir pada Hukum Kekekalan Massa (Hukum Lavoisier) massa suatu pereaksi dan hasil reaksi ditentukan dari perbandingan. Siswa beranggapan bahwa massa suatu unsur saat beraksi harus mempunyai nilai kelipatan dari Ar unsur tersebut, terlebih karena data unsur lain (merkuri) yang diberikan adalah kelipatan dari nilai Ar nya Tidak paham Siswa berfikir pada Hukum Kekekalan Massa (Hukum Lavoisier) massa suatu hasil reaksi mengalami penambahan massa karena proses pembakaran
15 38 dibutuhkan adalah dua kali lipat 2. Jumlah oksigen yang dibutuhkan adalah kelipatan dari 21 gram 3. Jumlah massa hasil reaksi adalah penjumlahan massa zat-zat sebelum bereaksi 4. Jumlah massa hasil reaksi mengalami penambahan 5. Perbandingan massa merkuri dan oksigen adalah 25:2
16 39 No Konsep Soal Pola Respon 2. Hukum 2. Perbandingan massa kalsium dan massa oksigen Perbandingan membentuk kalsium oksida ialah 5:2. a.2 Tetap yang Jika 40 gram kalsium direaksikan dengan 10 gram berbunyi oksigen, maka massa kalsium oksida yang terbentuk perbandingan ialah... gram. (Ar O=16, Ca=40) massa unsurunsur dalam satu c.1 senyawa adalah tertentu dan tetap a. 70 d. 35 b. 56 e. 25 c. 50 Alasan: 1. Sesuai hukum Lavoisier, maka kalsium oksida yang dihasilkan adalah 50 gram 2. Perbandingan massanya 5:2, sehingga hasil reaksinya 7. Karena massa yang paling kecil oksigen maka hasil reaksinya adalah 10 x 7 gram= 70 gram d.3 e.5;d.5; e.3;b.4 Miskonsepsi Siswa Siswa mengganggap pereaksi yang massanya paling sedikit adalah penentu perhitungan, tanpa membandingkan dengan perbandingan massa yang diberikan Siswa tidak menganggap perbandingan masssa yang diberikan berpengaruh pada hasil reaksi, sehingga siswa menggunakan hukum Kekekalan Massa dengan menjumlahkan secara langsung massa pereaksi dan massa hasil reaksi tanpa menggunakan perbandingan massa masingmasing unsur yang telah diberikan datanya Kesalahan atau kekurangtelitian yang dilakukan oleh responden dalam mengisi jawaban (tidak paham)
17 40 3. Kalsium yang bereaksi hanya 25 gram sehingga massa kalsium oksida 35 gram 4. Ar C=40 dan Ar O=16 sehingga hasilnya adalah 56 gram 5. Massa kalsium yang bereaksi hanya 15 gram sehingga hasilnya 25 gram No Konsep Soal 3 Hukum Kelipatan perbandingan (Hukum Dalton) yang berbunyi jika dua jenis unsur bergabung membentuk lebih dari satu 3. Dua buah unsur A dan B dapat membentuk dua macam senyawa. Senyawa I mengandung A 50% dan senyawa II mengandung A 25%. Untuk A yang sama, maka perbandingan B pada senyawa I dan II ialah. a. 1 : 2 d. 3 : 2 b. 1 : 3 e. 2 : 3 c. 2 : 1 Alasan: 1. 50:25 = 2: :50 = 1:2 Pola Respon b.5 c.1:a.2 e.3;d.4 Miskonsepsi Siswa Siswa dalam aplikasi hukum kelipatan perbandingan menghitung perbandingan suatu unsur dalam senyawa langsung menggunakan perbandingan persentasenya dengan mengabaikan kelipatan perbandingan unsur pembentuk lainnya Siswa dalam aplikasi hukum kelipatan perbandingan membandingkan unsur B tanpa menyamakan terlebih dahulu dengan perbandingan unsur A nya. Ini tidak sesuai dengan bunyi hukum perbandingan tetap
18 41 senyawa, dan jika massamassa salah satu unsur dalam senyawasenyawa tersebut sama, sedangkan massa-massa unsur lainnya berbeda, maka perbandingan massa unsur lainnya dalam senyawasenyawa tersebut merupakan bilangan bulat dan sederhana 3. 50:75 = 2: :50 = 3: :150 = 1:3 Tidak paham No Konsep Soal Pola Respon 4 Hukum a.1;a.4 perbandingan volume yang 4. Suatu senyawa hidrokarbon tepat bereaksi dengan 10 L O 2 dan menghasilkan 6 L CO 2 berdasarkan persamaan berikut: Miskonsepsi Siswa Siswa menganggap kekekalan massa direpresentasikan dengan koefisien, sehingga jumlah koefisien sebelum dan setelah reaksi harus sama
19 42 berbunyi Pada suhu dan tekanan yang sama, volume gas-gas yang bereaksi dan volume gas-gas hasil reaksi berbanding sebagai bilangan bulat sederhana. Hukum perbandingan volume dinyatakan sebagai perbandingan volume gas-gas sesuai dengan koefisien masing-masing gas.. x C n H 2n+2 (g) + 5 O 2 (g) 3 CO 2 (g) + 4 H 2 O (l) Pernyataan berikut yang benar adalah. a. Nilai x adalah 2 b. Volume gas hasil reaksi adalah 14 L c. Volume senyawa hidrokarbon adalah 4 L d. Volume senyawa hidrokarbon adalah 2 L e. Volume senyawa hidrokarbon adalah 8 L Alasan: 1. Jumlah koefisien sebelum reaksi dan setelah reaksi sama 2. Jumlah volume sebelum reaksi dan setelah reaksi sama 3. Perbandingan koefisien sama dengan perbandingan volume 4. Perbandingan volume reaksi di atas adalah 2:5:3:4 5. Perbandingan volume sama dengan perbandingan massa c.1;c.2 Siswa beranggapan bahwa volume merepresentasikan massa sehingga volume sebelum reaksi harus sama dengan setelah bereaksi d.3 d.4 Siswa beranggapan bahwa nilai koefisien menunjukkan nilai volume secara mutlak, artinya nilai koefisien harus sama dengan nilai volume a.2;a.3;d.2 Tidak paham
20 43 No Konsep Soal Pola Respon Miskonsepsi Siswa 5 Hipotesis a.3 Perbandingan koefisien antara dua senyawa tidak dapat Avogadro yang 5. Terdapat persamaan reaksi sebagai berikut: menunjukkan perbandingan molnya berbunyi 2 H 2 S(g) + 3 O 2 (g) 2 H 2 O(g) + 2 SO 2 (g). Jika suhu b.5;c.3;c. Tidak paham Pada suhu dan dan tekanan sebelum dan setelah reaksi sama, maka 4;d.2;d.5 tekanan yang pernyataan berikut yang tidak benar adalah... sama, semua gas c.4 a. Jika O 2 yang direaksikan 6 mol, maka H 2 O yang dengan volume terbentuk adalah 4 mol e.3 Siswa menggunakan hukum perbandingan volume yang sama akan b. Jika jumlah molekul H 2 S adalah 6,02 x dalam menyelesaikan soal ini hipotesis Avogadro, mengandung maka jumlah molekul SO 2 adalah 6,02 x dimana pada suatu persamaan reaksi gas, perbandingan jumlah molekul c. Jika H 2 S yang bereaksi 20 gram, maka H 2 O koefisien dapat pula menunjukkan perbandingan yang sama pula yang dihasilkan adalah 20 gram volume. Konsep ini benar sehingga seharusnya tidak Perbandingan d. Jika H 2 S yang bereaksi 3 L, maka H 2 O yang dipilih oleh responden. volume gas-gas dihasilkan adalah 3 L
21 44 itu juga merupakan perbandingan jumlah molekul yang terlibat dalam reaksi. Dengan kata lain perbandingan volume gas-gas yang bereaksi sama dengan koefisien reaksinya. e. Jika H 2 S yang bereaksi 1 L, maka volume gas hasil reaksi adalah 2L Alasan: 1. Jumlah molekul H 2 S yang bereaksi sama dengan molekul SO 2 yang dihasilkan 2. Jumlah volume SO 2 dan H 2 O yang dihasilkan adaalah sama 3. Perbandingan mol O 2 dan H 2 O adalah 3:2 4. Massa H 2 S yang bereaksi dan H 2 O yang dihasilkan bereaksi sama 5. Perbandingan volume H 2 S dan SO 2 =1:1 No Konsep Soal Pola Respon Miskonsepsi Siswa
22 45 6 Konversi jumlah mol zat dengan jumlah partikel Hubungan antara jumlah mol (n) dengan jumlah (X) dapat dinyatakan partikel dalam zat sebagai berikut. X = n 6, atau 6. Dalam 10 mol senyawa ion K 2 Cr 2 O 7, banyaknya ion K + adalah. (Ar K=39, O=16, Cr=52) a. 6,02 x d. 9,03 x b. 1,2 x10 24 e. 1,2 x10 25 c. 6,02 x Alasan: 1. Mol ion K + adalah 10, maka jumlah ionnya 10 x 6,02 x Mol ion K + adalah 2, maka jumlah ionnya 2 x 6,02 x Mol ion K + adalah 20, maka jumlah ionnya 20 x 6,02 x Mol ion K + adalah 1, maka jumlah ionnya 1 x 6,02 x Mol ion K + adalah 15, maka jumlah ionnya 15 x 6,02 x a.4 Siswa beranggapan bahwa jumlah mol ion sama dengan jumlah muatannya b.2 Siswa beranggapan bahwa jumlah atom atau ion merepresentasikan jumlah mol c.2;d.1;d.2 e.3 Tidak paham n = No Konsep Soal Pola Respon 7 Konversi 7. Sebanyak 5 mol gas X 2 mempunyai massa 799 gram. c.1 Miskonsepsi Siswa
23 46 jumlah mol dengan massa Hubungan jumlah mol (n) dengan massa zat (m) adalah: n = 1. Unsur X adalah. a. F d. I b. Cl e. At c. Br Alasan: 1. Ar X adalah 79,9 2. Ar X adalah 159,8 3. Ar X adalah 126,9 4. Ar X adalah 35,5 5. Ar X adalah 63,5 b.2;c.2;c. 3 Siswa menganggap indeks unsur suatu senyawa tidak perlu diikutsertakan saat menghitung Ar dari massa dan mol yang diketahui b.1 Siswa tidak mengetahui nomor massa suatu unsur d.3; Tidak paham No Konsep Soal 8. Konversi jumlah mol 8. Diketahui persamaan reaksi sebagai berikut: NaBrO 3 (s) NaBr(s) + O 2 (g) Pola Respon Miskonsepsi Siswa a.5 d.4 Siswa mengabaikan koefisien dalam perhitungan mol
24 47 dengan volume Volume per mol gas disebut volume molar dan dilambangkan. V = n Volume molar gas bergantung pada suhu dan tekanan dengan rumus sebagai berikut: P = nrt dengan: P = tekanan (atm) = volume gas (liter) n = jumlah mol (mol) R = tetapan gas = 0,082 L atm/mol K T = suhu (Kelvin) dilambangkan. Volume gas yang dihasilkan pada reaksi pemanasan 75,45 gram natrium bromat pada suhu 25 C dan tekanan 1 atm adalah... (Ar C=12, O=16, Na=23 dan Br=79,9) a. 18 b. 16,8 c. 13,44 d. 12 e. 11,2 Alasan : 1. Volume NaBr = 0,5 x 22,4 L 2. Volume O 2 = 0,5 x 22,4 L 3. Volume O 2 = 0,75 x 22,4 L 4. Volume O 2 = nrt/p =12 L 5. Volume O 2 = nrt/p =18 L e.2;b.3;d.5 Tidak dapat membedakan penggunaan rumus P = nrt dan V = n Mengabaikan koefisien dalam perhitungan mol e.1 Siswa tidak mengerti simbol fasa (g) pada sebuah persamaan reaksi c.1;c.2;c.4; Tidak paham c.5
25 48 No Konsep Soal 9. Rumus Empirik 9. Suatu senyawa nitrogen oksida dihasilkan dari reaksi 28 gram nitrogen dan 64 gram oksigen (Ar N = 14 dan O = 16). Tentukan rumus empiris nitrogen oksida tersebut! a. N 2 O 3 b. N 2 O 4 c. NO d. NO 2 e. NO 4 Alasan: :16 = 2:3 2. : = 1:4 3. : = 2:4 4. : = 1:2 5. : = 1:1 Pola Respon a.1;d.3; e.2 b.3; Miskonsepsi Siswa Siswa tidak melibatkan massa dan Ar masing-masing unsur. Siswa menganggap bahwa menyelesaikan soal rumus empirik dengan membagi massa gas dengan Ar unsur bukan Mr molekul gas c.4 Tidak paham d.4.
26 49 No Konsep Soal 10. Rumus molekul 10. Suatu gas seberat 51 gram mempunyai volume 18,327 liter pada T=25 C dan P= 1 atm. Jika rumus empiris gas tersebut ialah C n H 2n-2 maka rumus molekul gas tersebut ialah... (Ar H=1, C=12) a. C 2 H 2 b. C 3 H 4 c. C 4 H 6 d. C 5 H 8 e. C 6 H 10 Alasan: 1. Mol adalah data yang paling penting untuk menentukan rumus molekul 2. Nilai n didapat dari membagi volume dengan massa 3. Rumus molekul didapat dengan menghitung Mr 4. Mr C n H 2n-2 adalah 12, jadi nilai n didapat dengan membagi Mr dengan Nilai n dihitung dengan membagi massa dengan Ar C Pola Respon Miskonsepsi Siswa a.2 Siswa mencari rumus molekul dengan mengabaikan Mr molekulnya b.3;e.3 Tidak paham e.3 d.3 d.4 d.5 Siswa berfikir bahwa suatu senyawa memiliki massa atom relatif bukan massa molekul relatif
27 50 No Konsep Soal 11. Menentukan rumus air kristal 11. Sebanyak 2 gram kalsium klorida (CaCl 2 ) menyerap uap air dari udara dan membentuk hidrat dengan massa 3,94 gram. Tentukan rumus air kristal tersebut! (Ar Ca = 40, Cl = 35,5, H = 1, dan O = 16) a. CaCl 2.H 2 O d. CaCl 2.6H 2 O b. CaCl 2.2H 2 O e. CaCl 2. 10H 2 O c. CaCl 2.4H 2 O Alasan: 1. Perbandingan massa 3,94 : 2 = 2 2. Massa hidrat 3,94 2 = 1,94 3. Jadi perban-dingannya 2 : 1,94 = 1 4. Perbandingan mol = : = 6 Pola Respon a.2; c.3 e.5; a.3 c.4:d.2; d.5; e.4 d.3 Miskonsepsi Siswa Siswa mencari rumus air kristal dengan cara membandingkan massa senyawa anhidrat dengan massa air, bukan molnya. Seharusnya membandingkan molnya, bukan massanya. Siswa mengkonversi massa suatu zat ke dalam volume dengan membaginya dengan 22,4 L. Siswa mengadopsi rumus yang terdapat pada hukum Avogadro, dimana volume suatu gas dapat diketahui dengan membagi molnya dengan 22,4 L dengan catatan dalam keadaan standar, yaitu T= 0 0 C dan P = 1 atm Tidak paham
28 51 5. Perbandingan mol = : = 4 Volume = 3,94/22,4 = 0,089
29 52 No Konsep Soal 12. Kadar zat dalam suatu senyawa 12. Cuplikan bubuk besi sebanyak 50 gram dipanaskan dengan gas klor menghasilkan 100 gram besi (II) klorida. Kadar unsur besi dalam cuplikan tersebut ialah (Ar Fe=56, Cl=35,5) a. 50% d. 87,4% b. 89% e. 88,20% c. 78,7% Alasan: a. x 100% = 50% b. Mol besi= =0,89 %=0,89 x 100% = 89% c. Mol FeCl= = 0,787 %=0,78 x 100% = 78,7% d. Massa Fe= 0,787 mol x 56 g/mol= 44,1 g %= x 100% = 88,2% e. Mol Fe= = 0,89 Mol FeCl 2 = = 0,78 Pola Respon Miskonsepsi Siswa a.1 Mencari persentase Fe dengan cara membandingkan mol Fe dalam FeCl 2 dengan mol Fe mula (yang sebenarnya adalah mol cuplikan bubuk besi) b.5 Menentukan muatan suatu atom dalam suatu senyawa dimana muatan atom A nilainya akan dengan angka indeks atom B begitupun sebaliknya c.3 Siswa menentukan kadar unsur dalam suatu senyawa dilihat dari jumlah atom yang menyusun senyawa tersebut, bukan massanya. d.3 Siswa menganggap bahwa menghitung kadar suatu unsur dalam senyawa dengan membagi Ar unsur tersebut dengan Mr senyawa tanpa melibatkan indeks yang menunjukkan jumlah atom unsur tersebut. d.4 d.5 e.4 %= x 100%= 87,4%
30 53 No Konsep Soal Pola Respon Miskonsepsi Siswa 13. Kadar zat dalam suatu senyawa. 13. Kadar unsur vanadium dalam senyawa V 2 O 3 adalah. (Ar V=50,95 dan O=16) a. 34,0% b. 40,0% c. 60,0% d. 66,7% e. 68,0% Alasan: 1. x 100% = 66,7% 2. x 100% = 40% 3. x 100% = 34% 4. x 100 % = 68% 5. x 100% = 60% d.1; b.2;c;5 Siswa menghitung kadar unsur dalam suatu senyawa dilihat dari jumlah atom yang menyusun senyawa tersebut, bukan massanya a.3 Siswa tidak menggunakan indeks sebagai acuan bahwa indeks sebagai jumlah atom dalam senyawa e.4 d.3;d.4;e.2 Tidak paham
31 54 No Konsep Soal 14. Pereaksi pembatas dalam suatu reaksi 14. Sebanyak 8,1 gram logam aluminium direaksikan dengan 38 gram Cr 2 O 3 sesuai persamaan reaksi: 2 Al(s) + Cr 2 O 3 (aq) Al 2 O 3 (aq) + 2 Cr(s) Berapa gram logam kromium yang dihasilkan? (Ar Al = 27, Cr = 52, dan O = 16) a. 15,6 gram b. 26 gram c. 52 gram d. 78 gram e. 156 gram Alasan: 1. Pereaksi pembatas adalah Al karena massa Al lebih kecil 2. Pereaksi pembatas adalah Cr 2 O 3 karena mol Cr 2 O 3 lebih kecil Pola Respon a.3 e.5 Miskonsepsi Siswa Siswa menganggap bahwa pereaksi pembatas adalah pereaksi yang massanya paling kecil e.1 Siswa menganggap bahwa pereaksi pembatas ditentukan dari massanya, bukan dari jumlah mol b.4;c.4 a.5;e.5;c.2 Setaranya jumlah atom Cr pada molekul Cr dan senyawa Cr 2 O 3, maka jumlah molnya pun sama Siswa mengabaikan koefisien pada persamaan reaksi ketika akan menetapkan pereaksi pembatas, sehingga siswa salah menetapkan pereaksi yang bertindak sebagai pereaksi pembatas
32 55 3. Mol Cr sama dengan mol Al 4. Mol Cr sama dengan mol Cr 2 O 3 5. Mol Cr dua kali lebih besar dari mol Cr 2 O 3 a.1;d.5 Tidak paham No Konsep Soal 15. Banyak zat pereaksi atau hasil reaksi 15. Pada pemanasan 24,5 gram KClO 3 menurut reaksi: KClO 3 (s) KCl(s) + O 2 (g) tentukan volume gas oksigen yang dihasilkan jika pada suhu dan tekanan yang sama, 8,4 gram gas nitrogen mempunyai volume 7,2 liter! (Ar K = 39, Cl = 35,5, N=14 dan O = 16) a. 0,12 L Pola Respon Miskonsepsi Siswa a.3 Siswa menggeneralisasikan rumus rumus ke dalam semua senyawa dalam fasa apapun, termasuk fasa padat. b.2;b.3;c.4 Siswa menggunakan rumus bukan pada senyawa gas c.2 yang ditanyakan, yaitu oksigen, melainkan pada pereaksi.
33 56 b. 9 L c. 7,2 L d. 3,6 L e. 4,8 L c.3;c.5 Siswa menganggap bahwa data tambahan yang berisi senyawa lain yang kondisi suhu dan temperaturnya sama dengan data utama, nilai variabel yang diberikan akan selalu sama dengan pereaksi pada data utama, bukan dengan senyawa yang ditanyakan. d.5;e.3 Menggeneralisasikan rumus rumus ke dalam semua senyawa dalam fasa apapun, termasuk fasa padat. b.2 Menganggap bahwa data tambahan yang berisi senyawa lain yang kondisi suhu dan temperaturnya sama dengan data utama, nilai variabel yang diberikan akan selalu sama dengan pereaksi pada data utama, bukan dengan senyawa yang ditanyakan.
34 55 3) Kunci Determinasi Miskonsepsi Butir soal pilihan ganda dua tingkat yang digunakan pada penelitian ini terdiri dari lima pilihan pada pilihan pertama dan lima pilihan pada pilihan kedua. Dengan demikian akan ada beberapa kemungkinan pola jawaban. Berdasarkan pola jawaban siswa tersebut dapat dilihat siswa yang mengalami miskonsepsi dan siswa yang tidak mengalami miskonsepsi. Untuk siswa yang mengalami miskonsepsi, diperlukan identifikasi miskonsepsi yang dialami siswa tersebut. Dengan demikian, untuk memudahkan pengidentifikasian, disusun suatu kunci determinasi miskonsepsi untuk menentukan miskonsepsi yang dialami masingmasing siswa pada setiap butir soal. Kunci determinasi miskonsepsi untuk tes pilihan ganda dua tingkat pada materi stoikiometri ditunjukan pada tabel 3.5. Pada masing-masing butir soal terdapat kotak abu yang menunjukan bahwa siswa yang memilih pola jawaban tersebut memiliki pemahaman penuh atau tidak mengalami miskonsepsi dan kotak putih yang menunjukan siswa mengalami tidak paham penuh. Seperti pada soal nomor 1, siswa yang memilih pola jawaban a.3 menunjukan bahwa siswa tersebut tidak mengalami miskonsepsi. Perbandingan Miskonsepsi Siswa Kelas X Dan Xi Pada Materi Stoikiometri Melalui Tes Diagnostik Pilihan Ganda Dua Tingkat
35 Perbandingan Miskonsepsi Siswa Kelas X Dan Xi Pada Materi Stoikiometri Melalui Tes Diagnostik Pilihan Ganda Dua Tingkat 56
KONSEP MOL DAN STOIKIOMETRI
 BAB V KONSEP MOL DAN STOIKIOMETRI Dalam ilmu fisika, dikenal satuan mol untuk besaran jumlah zat. Dalam bab ini, akan dibahas mengenai konsep mol yang mendasari perhitungan kimia (stoikiometri). A. KONSEP
BAB V KONSEP MOL DAN STOIKIOMETRI Dalam ilmu fisika, dikenal satuan mol untuk besaran jumlah zat. Dalam bab ini, akan dibahas mengenai konsep mol yang mendasari perhitungan kimia (stoikiometri). A. KONSEP
Hukum Dasar Kimia Dan Konsep Mol
 A. PENDAHULUAN Hukum Dasar Kimia Dan Konsep Mol Hukum dasar kimia merupakan hukum dasar yang digunakan dalam stoikiometri (perhitungan kimia), antara lain: 1) Hukum Lavoisier atau hukum kekekalan massa.
A. PENDAHULUAN Hukum Dasar Kimia Dan Konsep Mol Hukum dasar kimia merupakan hukum dasar yang digunakan dalam stoikiometri (perhitungan kimia), antara lain: 1) Hukum Lavoisier atau hukum kekekalan massa.
STOIKIOMETRI. STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi zat-zat kimia dan reaksi-reaksinya.
 STOIKIOMETRI STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi zat-zat kimia dan reaksi-reaksinya. 1.HUKUM KEKEKALAN MASSA = HUKUM LAVOISIER "Massa zat-zat sebelum
STOIKIOMETRI STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi zat-zat kimia dan reaksi-reaksinya. 1.HUKUM KEKEKALAN MASSA = HUKUM LAVOISIER "Massa zat-zat sebelum
KIMIA TERAPAN STOIKIOMETRI DAN HUKUM-HUKUM KIMIA Haris Puspito Buwono
 KIMIA TERAPAN STOIKIOMETRI DAN HUKUM-HUKUM KIMIA Haris Puspito Buwono Semester Gasal 2012/2013 STOIKIOMETRI 2 STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi
KIMIA TERAPAN STOIKIOMETRI DAN HUKUM-HUKUM KIMIA Haris Puspito Buwono Semester Gasal 2012/2013 STOIKIOMETRI 2 STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi
STOKIOMETRI BAB. B. Konsep Mol 1. Hubungan Mol dengan Jumlah Partikel. Contoh: Jika Ar Ca = 40, Ar O = 16, Ar H = 1, tentukan Mr Ca(OH) 2!
 BAB 7 STOKIOMETRI A. Massa Molekul Relatif Massa Molekul Relatif (Mr) biasanya dihitung menggunakan data Ar masing-masing atom yang ada dalam molekul tersebut. Mr senyawa = (indeks atom x Ar atom) Contoh:
BAB 7 STOKIOMETRI A. Massa Molekul Relatif Massa Molekul Relatif (Mr) biasanya dihitung menggunakan data Ar masing-masing atom yang ada dalam molekul tersebut. Mr senyawa = (indeks atom x Ar atom) Contoh:
Materi Pokok Bahasan :
 STOIKIOMETRI Kompetensi : Memiliki kemampuan untuk menginterpretasikan serta menerapkan dalam perhitungan kimia. Memiliki kemampuan untuk mengaplikasikan pengetahuan yang dimilikinya dan terbiasa menggunakan
STOIKIOMETRI Kompetensi : Memiliki kemampuan untuk menginterpretasikan serta menerapkan dalam perhitungan kimia. Memiliki kemampuan untuk mengaplikasikan pengetahuan yang dimilikinya dan terbiasa menggunakan
LOGO STOIKIOMETRI. Marselinus Laga Nur
 LOGO STOIKIOMETRI Marselinus Laga Nur Materi Pokok Bahasan : A. Konsep Mol B. Penentuan Rumus Kimia C. Koefisien Reaksi D. Hukum-hukum Gas A. Konsep Mol Pengertian konsep mol Hubungan mol dengan jumlah
LOGO STOIKIOMETRI Marselinus Laga Nur Materi Pokok Bahasan : A. Konsep Mol B. Penentuan Rumus Kimia C. Koefisien Reaksi D. Hukum-hukum Gas A. Konsep Mol Pengertian konsep mol Hubungan mol dengan jumlah
HUKUM DASAR KIMIA. 2CUO. 28GRAM NITROGEN 52 GRAM MAGNESIUM NITRIDA 3 MG + N 2 MG 3 N 2
 HUKUM DASAR KIMIA. 2CUO. 28GRAM NITROGEN 52 GRAM MAGNESIUM NITRIDA 3 MG + N 2 MG 3 N 2 HUKUM DASAR KIMIA 1) Hukum Kekekalan Massa ( Hukum Lavoisier ). Yaitu : Dalam sistem tertutup, massa zat sebelum
HUKUM DASAR KIMIA. 2CUO. 28GRAM NITROGEN 52 GRAM MAGNESIUM NITRIDA 3 MG + N 2 MG 3 N 2 HUKUM DASAR KIMIA 1) Hukum Kekekalan Massa ( Hukum Lavoisier ). Yaitu : Dalam sistem tertutup, massa zat sebelum
Stoikiometri. OLEH Lie Miah
 Stoikiometri OLEH Lie Miah 1 STANDAR KOMPETENSI KOMPETENSI DASAR INDIKATOR KARAKTERISTIK MATERI KESULITAN BELAJAR SISWA STANDAR KOMPETENSI Memahami hukum-hukum dasar Kimia dan penerapannya dalam perhitungan
Stoikiometri OLEH Lie Miah 1 STANDAR KOMPETENSI KOMPETENSI DASAR INDIKATOR KARAKTERISTIK MATERI KESULITAN BELAJAR SISWA STANDAR KOMPETENSI Memahami hukum-hukum dasar Kimia dan penerapannya dalam perhitungan
BAB V PERHITUNGAN KIMIA
 BAB V PERHITUNGAN KIMIA KOMPETENSI DASAR 2.3 : Menerapkan hukum Gay Lussac dan hukum Avogadro serta konsep mol dalam menyelesaikan perhitungan kimia (stoikiometri ) Indikator : 1. Siswa dapat menghitung
BAB V PERHITUNGAN KIMIA KOMPETENSI DASAR 2.3 : Menerapkan hukum Gay Lussac dan hukum Avogadro serta konsep mol dalam menyelesaikan perhitungan kimia (stoikiometri ) Indikator : 1. Siswa dapat menghitung
LOGO. Stoikiometri. Tim Dosen Pengampu MK. Kimia Dasar
 LOGO Stoikiometri Tim Dosen Pengampu MK. Kimia Dasar Konsep Mol Satuan jumlah zat dalam ilmu kimia disebut mol. 1 mol zat mengandung jumlah partikel yang sama dengan jumlah partikel dalam 12 gram C 12,
LOGO Stoikiometri Tim Dosen Pengampu MK. Kimia Dasar Konsep Mol Satuan jumlah zat dalam ilmu kimia disebut mol. 1 mol zat mengandung jumlah partikel yang sama dengan jumlah partikel dalam 12 gram C 12,
LATIHAN ULANGAN TENGAH SEMESTER 2
 Pilihlah jawaban yang paling benar LATIHAN ULANGAN TENGAH SEMESTER 2 TATANAMA 1. Nama senyawa berikut ini sesuai dengan rumus kimianya, kecuali. A. NO = nitrogen oksida B. CO 2 = karbon dioksida C. PCl
Pilihlah jawaban yang paling benar LATIHAN ULANGAN TENGAH SEMESTER 2 TATANAMA 1. Nama senyawa berikut ini sesuai dengan rumus kimianya, kecuali. A. NO = nitrogen oksida B. CO 2 = karbon dioksida C. PCl
Sumber: Silberberg, Chemistry: The Molecular Nature of Matter and Change
 Bab V Perhitungan Kimia Sumber: Silberberg, Chemistry: The Molecular Nature of Matter and Change Jumlah permen dalam stoples dapat diketahui jika berat dari satu permen dan seluruh permen diketahui. Cara
Bab V Perhitungan Kimia Sumber: Silberberg, Chemistry: The Molecular Nature of Matter and Change Jumlah permen dalam stoples dapat diketahui jika berat dari satu permen dan seluruh permen diketahui. Cara
Tugas Kimia STOIKIOMETRI
 Tugas Kimia STOIKIOMETRI NAMA ANGGOTA : 1. Nyoman Dharma Triyasa (10) 2. Komang Jnana Shindu Putra (17) 3. I.G.A Dharsasasmitha Yani (19) 4. Ni Putu Riska Valentini (25) 5. Putu Ayu Rosita Octaviani (26)
Tugas Kimia STOIKIOMETRI NAMA ANGGOTA : 1. Nyoman Dharma Triyasa (10) 2. Komang Jnana Shindu Putra (17) 3. I.G.A Dharsasasmitha Yani (19) 4. Ni Putu Riska Valentini (25) 5. Putu Ayu Rosita Octaviani (26)
MATA PELAJARAN/PAKET KEAHLIAN ILMU KIMIA
 SUMBER BELAJAR PENUNJANG PLPG 2016 MATA PELAJARAN/PAKET KEAHLIAN ILMU KIMIA BAB II HUKUM-HUKUM DASAR KIMIA, STOIKIOMETRI Prof. Dr. Sudarmin, M.Si Dra. Woro Sumarni, M.Si Cepi Kurniawan, M.Si, Ph.D KEMENTERIAN
SUMBER BELAJAR PENUNJANG PLPG 2016 MATA PELAJARAN/PAKET KEAHLIAN ILMU KIMIA BAB II HUKUM-HUKUM DASAR KIMIA, STOIKIOMETRI Prof. Dr. Sudarmin, M.Si Dra. Woro Sumarni, M.Si Cepi Kurniawan, M.Si, Ph.D KEMENTERIAN
BAB I PENDAHULUAN A. Latar Belakang Penelitian
 BAB I PENDAHULUAN A. Latar Belakang Penelitian Kimia merupakan cabang ilmu yang paling penting dan dianggap sebagai pelajaran yang sulit untuk siswa oleh guru kimia, peneliti, dan pendidik pada umumnya.
BAB I PENDAHULUAN A. Latar Belakang Penelitian Kimia merupakan cabang ilmu yang paling penting dan dianggap sebagai pelajaran yang sulit untuk siswa oleh guru kimia, peneliti, dan pendidik pada umumnya.
FAKULTAS TEKNIK UNIVERSITAS NEGERI YOGYAKARTA BAHAN AJAR KIMIA DASAR BAB IV STOIKIOMETRI
 No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 6 BAB IV STOIKIOMETRI A. HUKUM GAY LUSSAC Bila diukur pada suhu dan tekanan yang sama, volum gas yang bereaksi dan volum gas hasil reaksi berbanding
No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 6 BAB IV STOIKIOMETRI A. HUKUM GAY LUSSAC Bila diukur pada suhu dan tekanan yang sama, volum gas yang bereaksi dan volum gas hasil reaksi berbanding
MODUL KIMIA SMA IPA Kelas 10
 SMA IPA Kelas 0 A. Massa Atom. Massa Atom Relatif (Ar) Massa atom relatif (Ar) merupakan perbandingan massa atom dengan massa satu atom yang tetap. Secara matematis dapat dirumuskan sebagai berikut. sma
SMA IPA Kelas 0 A. Massa Atom. Massa Atom Relatif (Ar) Massa atom relatif (Ar) merupakan perbandingan massa atom dengan massa satu atom yang tetap. Secara matematis dapat dirumuskan sebagai berikut. sma
BAB III METODOLOGI PENELITIAN
 BAB III METODOLOGI PENELITIAN A. Lokasi dan Subjek Penelitian Pelaksanaan penelitian berlokasi di salah satu SMA Negeri di Kota Cimahi. Pertimbangan pemilihan SMA Negeri adalah berdasarkan kesesuaian kurikulum
BAB III METODOLOGI PENELITIAN A. Lokasi dan Subjek Penelitian Pelaksanaan penelitian berlokasi di salah satu SMA Negeri di Kota Cimahi. Pertimbangan pemilihan SMA Negeri adalah berdasarkan kesesuaian kurikulum
A. HUKUM PERBANDINGAN VOLUM DAN HIPOTESIS AVOGADRO*
 Di muka kita telah membahas tentang jenis perubahan materi. Bagian dari Kimia yang membahas hubungan kuantitatif (jumlah) antara zat-zat yang terlibat dalam suatu perubahan kimia atau reaksi kimia dikenal
Di muka kita telah membahas tentang jenis perubahan materi. Bagian dari Kimia yang membahas hubungan kuantitatif (jumlah) antara zat-zat yang terlibat dalam suatu perubahan kimia atau reaksi kimia dikenal
STOIKIOMETRI STOIKIOMETRI
 BAB V STOIKIOMETRI Standar Kompetensi Memahami hukum-hukum dasar kimia dan penerapannya dalam perhitungan kimia (stoikiometri) Kompetensi Dasar Mendeskripsikan tata nama senyawa anorganik dan organik sederhana
BAB V STOIKIOMETRI Standar Kompetensi Memahami hukum-hukum dasar kimia dan penerapannya dalam perhitungan kimia (stoikiometri) Kompetensi Dasar Mendeskripsikan tata nama senyawa anorganik dan organik sederhana
Bab IV Hukum Dasar Kimia
 Bab IV Hukum Dasar Kimia Sumber: Silberberg, Chemistry :The Molecular Nature of Matter and Change Kalsium karbonat ditemukan pada beberapa bentuk seperti pualam, batu koral, dan kapur. Persen massa unsur-unsur
Bab IV Hukum Dasar Kimia Sumber: Silberberg, Chemistry :The Molecular Nature of Matter and Change Kalsium karbonat ditemukan pada beberapa bentuk seperti pualam, batu koral, dan kapur. Persen massa unsur-unsur
Ujian Akhir Semester Mata Pelajaran Kimia Kelas X Wacana berikut digunakan untuk menjawab soal no 1 dan 2. Ditentukan 5 unsur dengan konfigurasi
 Ujian Akhir Semester Mata Pelajaran Kimia Kelas X Wacana berikut digunakan untuk menjawab soal no 1 dan 2. Ditentukan 5 unsur dengan konfigurasi elektron sebagai berikut: P : 2 8 7 S : 2 8 8 Q : 2 8 8
Ujian Akhir Semester Mata Pelajaran Kimia Kelas X Wacana berikut digunakan untuk menjawab soal no 1 dan 2. Ditentukan 5 unsur dengan konfigurasi elektron sebagai berikut: P : 2 8 7 S : 2 8 8 Q : 2 8 8
BAB 5 HUKUM DASAR KIMIA
 BAB 5 HUKUM DASAR KIMIA Dalam ilmu kimia perlu dipelajari massa dan volume zat-zat yang bereaksi dan zat yang dihasilkan dalam suatu reaksi kimia. Studi tentang hubungan-hubungan kuantitatif dalam suatu
BAB 5 HUKUM DASAR KIMIA Dalam ilmu kimia perlu dipelajari massa dan volume zat-zat yang bereaksi dan zat yang dihasilkan dalam suatu reaksi kimia. Studi tentang hubungan-hubungan kuantitatif dalam suatu
Soal 5 Jumlah mol dari 29,8 gram amonium fosfat ((NH4)3PO4) (Ar N = 14, H = 1, dan P = 31) adalah. A. 0,05 mol
 Bank Soal Stoikiometri Kimia Bagian 2 Soal 1 Satu liter campuran gas terdiri dari 60% volume metana (CH4) dan sisanya gas etana (C2H6) dibakar sempurna sesuai reaksi: CH4 + 3 O2 2 CO2 + 2 H2O 2 C2H6 +
Bank Soal Stoikiometri Kimia Bagian 2 Soal 1 Satu liter campuran gas terdiri dari 60% volume metana (CH4) dan sisanya gas etana (C2H6) dibakar sempurna sesuai reaksi: CH4 + 3 O2 2 CO2 + 2 H2O 2 C2H6 +
Hubungan koefisien dalam persamaan reaksi dengan hitungan
 STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
KONSEP MOL DAN STOIKIOMETRI
 KONSEP MOL DAN STOIKIOMETRI HUKUM-HUKUM DASAR KIMIA 1. Asas Lavoiser atau kekekalan massa jumlah sebelum dan setelah reaksi kimia adalah tetap 2. Hukum Gas Ideal P V = nrt Dengan P adalah tekanan (atm),
KONSEP MOL DAN STOIKIOMETRI HUKUM-HUKUM DASAR KIMIA 1. Asas Lavoiser atau kekekalan massa jumlah sebelum dan setelah reaksi kimia adalah tetap 2. Hukum Gas Ideal P V = nrt Dengan P adalah tekanan (atm),
STOKIOMETRI. Kimia Kelas X
 STOKIOMETRI Kimia Kelas X SEKOLAH MENENGAH ATAS NEGERI 12 SURABAYA 2015 STOKIOMETRI STOKIOMETRI Pada materi stokiometri, kita akan mempelajari beberapa hal seperti persamaan reaksi, hukum-hukum dasar kimia,
STOKIOMETRI Kimia Kelas X SEKOLAH MENENGAH ATAS NEGERI 12 SURABAYA 2015 STOKIOMETRI STOKIOMETRI Pada materi stokiometri, kita akan mempelajari beberapa hal seperti persamaan reaksi, hukum-hukum dasar kimia,
K13 Revisi Antiremed Kelas 10 Kimia
 K1 Revisi Antiremed Kelas 10 Kimia Stoikiometri - Soal Doc. Name:RK1AR10KIM0901 Version : 2016-10 halaman 1 1. Jika diketahui massa atom C-12= p gram dan massa 1 atom unsur X adalah a gram. Massa atom
K1 Revisi Antiremed Kelas 10 Kimia Stoikiometri - Soal Doc. Name:RK1AR10KIM0901 Version : 2016-10 halaman 1 1. Jika diketahui massa atom C-12= p gram dan massa 1 atom unsur X adalah a gram. Massa atom
Stoikhiometri : dan metron = mengukur. Membahas tentang : senyawa) senyawa (stoikhiometri. (stoikhiometri. reaksi)
 STOIKHIOMETRI Stoikhiometri : Dari kata Stoicheion = unsur dan metron = mengukur Membahas tentang : hub massa antar unsur dalam suatu senyawa (stoikhiometri senyawa) dan antar zat dalam suatu reaksi (stoikhiometri
STOIKHIOMETRI Stoikhiometri : Dari kata Stoicheion = unsur dan metron = mengukur Membahas tentang : hub massa antar unsur dalam suatu senyawa (stoikhiometri senyawa) dan antar zat dalam suatu reaksi (stoikhiometri
STOIKIOMETRI Konsep mol
 STOIKIOMETRI Konsep mol Dalam hukum-hukum dasar materi ditegaskan bahwa senyawa terbentuk dari unsur bukan dengan perbandingan sembarang tetapi dalam jumlah yang spesifik, demikian juga reaksi kimia antara
STOIKIOMETRI Konsep mol Dalam hukum-hukum dasar materi ditegaskan bahwa senyawa terbentuk dari unsur bukan dengan perbandingan sembarang tetapi dalam jumlah yang spesifik, demikian juga reaksi kimia antara
Hukum Dasar Ilmu Kimia Sumber :
 A Hukum Kekekalan Massa (Hukum Lavoisier) Hukum Dasar Ilmu Kimia Sumber : wwwe-dukasinet Pernahkah Anda memperhatikan sepotong besi yang dibiarkan di udara terbuka, dan pada suatu waktu kita akan menemukan,
A Hukum Kekekalan Massa (Hukum Lavoisier) Hukum Dasar Ilmu Kimia Sumber : wwwe-dukasinet Pernahkah Anda memperhatikan sepotong besi yang dibiarkan di udara terbuka, dan pada suatu waktu kita akan menemukan,
STOIKIOMETRI A. HUKUM-HUKUM DASAR KIMIA B. PERHITUNGAN KIMIA
 4 STOIKIOMETRI A. HUKUM-HUKUM DASAR KIMIA B. PERHITUNGAN KIMIA Kata Stoikiometri berasal dari bahasa Yunani, stoicheion yang berarti unsur (partikel) dan metron yang berarti pengukuran. Stoikiometri menggambarkan
4 STOIKIOMETRI A. HUKUM-HUKUM DASAR KIMIA B. PERHITUNGAN KIMIA Kata Stoikiometri berasal dari bahasa Yunani, stoicheion yang berarti unsur (partikel) dan metron yang berarti pengukuran. Stoikiometri menggambarkan
K13 Revisi Antiremed Kelas 10 Kimia
 K13 Revisi Antiremed Kelas 10 Kimia Hukum Dasar Perhitungan Kimia - Latihan Soal Doc. Name: RK13AR10KIM0801 Version : 2016-11 halaman 1 01. Pernyataan yang paling sesuai tentang hukum Lavoisier (A) Jumlah
K13 Revisi Antiremed Kelas 10 Kimia Hukum Dasar Perhitungan Kimia - Latihan Soal Doc. Name: RK13AR10KIM0801 Version : 2016-11 halaman 1 01. Pernyataan yang paling sesuai tentang hukum Lavoisier (A) Jumlah
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya.
 30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
HUKUM DASAR KIMIA DAN PERHITUNGAN KIMIA
 HUKUM DASAR KIMIA DAN PERHITUNGAN KIMIA Mata Pelajaran : Kimia Kelas : X (Sepuluh) Nomor Modul : Kim.X.06 Penulis : Dorthy Hariandja, S.Pd. Penyunting Materi : Drs. Darsef, M.Si Penyunting Media : Drs.
HUKUM DASAR KIMIA DAN PERHITUNGAN KIMIA Mata Pelajaran : Kimia Kelas : X (Sepuluh) Nomor Modul : Kim.X.06 Penulis : Dorthy Hariandja, S.Pd. Penyunting Materi : Drs. Darsef, M.Si Penyunting Media : Drs.
1. Hukum Lavoisier 2. Hukum Proust 3. Hukum Dalton 4. Hukum Gay Lussac & Hipotesis Avogadro
 - - 1. Hukum Lavoisier 2. Hukum Proust 3. Hukum Dalton 4. Hukum Gay Lussac & Hipotesis Avogadro 1. Hukum Lavoisier (Hukum Kekekalan Massa) : Dalam sistem tertutup, massa zat sebelum dan sesudah reaksi
- - 1. Hukum Lavoisier 2. Hukum Proust 3. Hukum Dalton 4. Hukum Gay Lussac & Hipotesis Avogadro 1. Hukum Lavoisier (Hukum Kekekalan Massa) : Dalam sistem tertutup, massa zat sebelum dan sesudah reaksi
6.1 HUKUM-HUKUM DASAR KIMIA
 6.1 HUKUM-HUKUM DASAR KIMIA 1. Hukum kekekalan massa oleh Antoine Laurent Lavoiser (1789). Lavoiser mengemukakan pernyataan yang disebut hukum kekekalan massa, yang berbunyi : Pada reaksi kimia, massa
6.1 HUKUM-HUKUM DASAR KIMIA 1. Hukum kekekalan massa oleh Antoine Laurent Lavoiser (1789). Lavoiser mengemukakan pernyataan yang disebut hukum kekekalan massa, yang berbunyi : Pada reaksi kimia, massa
STOIKIOMETRI. Oleh. Sitti Rahmawati S.Pd.
 STOIKIOMETRI Oleh Sitti Rahmawati S.Pd Copyright oke.or.id Artikel ini boleh dicopy,diubah, dikutip, di cetak dalam media kertas atau yang lain, dipublikasikan kembali dalam berbagai bentuk dengan tetap
STOIKIOMETRI Oleh Sitti Rahmawati S.Pd Copyright oke.or.id Artikel ini boleh dicopy,diubah, dikutip, di cetak dalam media kertas atau yang lain, dipublikasikan kembali dalam berbagai bentuk dengan tetap
SKL 2 RINGKASAN MATERI. 1. Konsep mol dan Bagan Stoikiometri ( kelas X )
 SKL 2 Menerapkan hukum-hukum dasar kimia untuk memecahkan masalah dalam perhitungan kimia. o Menganalisis persamaan reaksi kimia o Menyelesaikan perhitungan kimia yang berkaitan dengan hukum dasar kimia
SKL 2 Menerapkan hukum-hukum dasar kimia untuk memecahkan masalah dalam perhitungan kimia. o Menganalisis persamaan reaksi kimia o Menyelesaikan perhitungan kimia yang berkaitan dengan hukum dasar kimia
BAB III METODOLOGI PENELITIAN
 34 BAB III METODOLOGI PENELITIAN A. Lokasi dan Subjek Penelitian Penelitian ini dilaksanakan di salah satu SMA Swasta di Kota Bandung, yaitu di SMA Laboratorium Percontohan UPI Bandung. Pemilihan lokasi
34 BAB III METODOLOGI PENELITIAN A. Lokasi dan Subjek Penelitian Penelitian ini dilaksanakan di salah satu SMA Swasta di Kota Bandung, yaitu di SMA Laboratorium Percontohan UPI Bandung. Pemilihan lokasi
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Lokasi dan Subjek Penelitian Penelitian dilaksanakan di salah satu SMA Negeri di Kota Bandung. Subjek penelitian berupa instrumen tes diagnostik yang dikembangkan. Subjek ini
BAB III METODE PENELITIAN A. Lokasi dan Subjek Penelitian Penelitian dilaksanakan di salah satu SMA Negeri di Kota Bandung. Subjek penelitian berupa instrumen tes diagnostik yang dikembangkan. Subjek ini
C. Prosedur Penelitian Secara garis besar, alur penelitian yang dilakukan dapat dilihat sebagaimana ditunjukkan pada gambar 3.
 BAB III METODOLOGI PENELITIAN A. Lokasi dan Objek Penelitian Penelitian dilaksanakan di salah satu SMA Negeri di kota Bandung. Objek yang dijadikan sebagai bahan dalam penelitian ini adalah tes diagnostik
BAB III METODOLOGI PENELITIAN A. Lokasi dan Objek Penelitian Penelitian dilaksanakan di salah satu SMA Negeri di kota Bandung. Objek yang dijadikan sebagai bahan dalam penelitian ini adalah tes diagnostik
Stoikiometri. Bab 3. Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Secara Mikro atom & molekul.
 Bab 3 Stoikiometri Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional: 1 atom 12 C beratnya 12 sma Jika ditimbang
Bab 3 Stoikiometri Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional: 1 atom 12 C beratnya 12 sma Jika ditimbang
kimia Kelas X KONSEP MOL I K-13 A. Persamaan Reaksi
 K-13 Kelas X kimia KNSEP ML I Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami persamaan reaksi kimia dan komponen-komponennya. 2. Memahami cara
K-13 Kelas X kimia KNSEP ML I Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami persamaan reaksi kimia dan komponen-komponennya. 2. Memahami cara
BAB III METODE PENELITIAN
 21 BAB III METODE PENELITIAN A. Lokasi dan Subyek Penelitian Penelitian ini dilaksanakan di SMA Negeri di Bandung, yaitu SMA Negeri 14 Bandung yang melibatkan 36 orang siswa untuk enam soal tes esai, 36
21 BAB III METODE PENELITIAN A. Lokasi dan Subyek Penelitian Penelitian ini dilaksanakan di SMA Negeri di Bandung, yaitu SMA Negeri 14 Bandung yang melibatkan 36 orang siswa untuk enam soal tes esai, 36
STOIKIOMETRI. Massa molekul relatif suatu zat sama dengan jumlah massa atom relatif atomatom penyusun molekul zat tersebut.
 STOIKIOMETRI Istilah STOIKIOMETRI berasal dari kata-kata Yunani yaitu Stoicheion (partikel) dan metron (pengukuran). STOIKIOMETRI akhirnya mengacu kepada cara perhitungan dan pengukuran zat serta campuran
STOIKIOMETRI Istilah STOIKIOMETRI berasal dari kata-kata Yunani yaitu Stoicheion (partikel) dan metron (pengukuran). STOIKIOMETRI akhirnya mengacu kepada cara perhitungan dan pengukuran zat serta campuran
BAB IV HUKUM DASAR KIMIA
 BAB IV HUKUM DASAR KIMIA KOMPETENSI DASAR : 2.1 Membuktikan dan mengkomunikasikan berlakunya hukum-hukum dasar kimia melalui percobaan Indikator : 1. Membuktikan berdasarkan percobaan bahwa massa zat sebelum
BAB IV HUKUM DASAR KIMIA KOMPETENSI DASAR : 2.1 Membuktikan dan mengkomunikasikan berlakunya hukum-hukum dasar kimia melalui percobaan Indikator : 1. Membuktikan berdasarkan percobaan bahwa massa zat sebelum
BAB II KAJIAN PUSTAKA...
 DAFTAR ISI LEMBAR PERNYATAAN... i KATA PENGANTAR... ii UCAPAN TERIMA KASIH... iii ABSTRAK... iv DAFTAR ISI... vi DAFTAR TABEL... ix DAFTAR GAMBAR... x DAFTAR LAMPIRAN... xi BAB I PENDAHULUAN... 1 Latar
DAFTAR ISI LEMBAR PERNYATAAN... i KATA PENGANTAR... ii UCAPAN TERIMA KASIH... iii ABSTRAK... iv DAFTAR ISI... vi DAFTAR TABEL... ix DAFTAR GAMBAR... x DAFTAR LAMPIRAN... xi BAB I PENDAHULUAN... 1 Latar
Rumus Kimia. Mol unsur =
 Rumus Kimia Menentukan Rumus Kimia Zat Rumus kimia zat dapat dibedakan menjadi rumus empiris dan rumus molekul. Rumus empiris dapat ditentukan dengan menghitung mol komponen penyusun zat dengan menggunakan
Rumus Kimia Menentukan Rumus Kimia Zat Rumus kimia zat dapat dibedakan menjadi rumus empiris dan rumus molekul. Rumus empiris dapat ditentukan dengan menghitung mol komponen penyusun zat dengan menggunakan
LARUTAN ELEKTROLIT DAN KONSEP REDOKS
 LARUTAN ELEKTROLIT DAN KONSEP REDOKS LARUTAN ELEKTROLIT DAN KONSEP REDOKS \usepackage{chemmacros} \ch{n2 \gas{} + 3 H2 \gas{} ->2 NH3 \gas{} } Stoikimiometri Membahas tentang hubungan massa antar unsur
LARUTAN ELEKTROLIT DAN KONSEP REDOKS LARUTAN ELEKTROLIT DAN KONSEP REDOKS \usepackage{chemmacros} \ch{n2 \gas{} + 3 H2 \gas{} ->2 NH3 \gas{} } Stoikimiometri Membahas tentang hubungan massa antar unsur
Massa atom merupakan massa dari atom dalam satuan massa atom (sma).
 Bab 3 Stoikiometri Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional: 1 atom 12 C beratnya 12 sma Jika ditimbang
Bab 3 Stoikiometri Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional: 1 atom 12 C beratnya 12 sma Jika ditimbang
MODUL STOIKIOMETRI 1
 MODUL STOIKIOMETRI 1 1. Pengertian Mol Mol merupakan suatu satuan jumlah, yang berasal dari kata moles yang artinya sejumlah massa / sejumlah kecil massa, hampir sama dengan lusin. 1 mol = 6,02 X 10 23
MODUL STOIKIOMETRI 1 1. Pengertian Mol Mol merupakan suatu satuan jumlah, yang berasal dari kata moles yang artinya sejumlah massa / sejumlah kecil massa, hampir sama dengan lusin. 1 mol = 6,02 X 10 23
BAB III METODOLOGI PENELITIAN
 BAB III METODOLOGI PENELITIAN A. Lokasi dan Subjek Penelitian Pelaksanaan penelitian ini dilakukan di salah satu SMA swasta di Bandung. Pemilihan lokasi ini dilakukan berdasarkan kesesuaian antara kurikulum
BAB III METODOLOGI PENELITIAN A. Lokasi dan Subjek Penelitian Pelaksanaan penelitian ini dilakukan di salah satu SMA swasta di Bandung. Pemilihan lokasi ini dilakukan berdasarkan kesesuaian antara kurikulum
BAB III HASIL PENELITIAN
 BAB III HASIL PENELITIAN A. Gambaran Umum Buku Teks Kimia SMA Kelas X 1. Identitas Buku Teks Kimia SMA Kelas X Buku yang menjadi obyek penelitian peneliti adalah buku teks kimia SMA kelas X jilid 1 materi
BAB III HASIL PENELITIAN A. Gambaran Umum Buku Teks Kimia SMA Kelas X 1. Identitas Buku Teks Kimia SMA Kelas X Buku yang menjadi obyek penelitian peneliti adalah buku teks kimia SMA kelas X jilid 1 materi
OAL TES SEMESTER I. I. Pilihlah jawaban yang paling tepat!
 KIMIA X SMA 103 S AL TES SEMESTER I I. Pilihlah jawaban yang paling tepat! 1. Partikel penyusun inti atom terdiri dari... a. proton dan elektron b. proton dan netron c. elektron dan netron d. elektron
KIMIA X SMA 103 S AL TES SEMESTER I I. Pilihlah jawaban yang paling tepat! 1. Partikel penyusun inti atom terdiri dari... a. proton dan elektron b. proton dan netron c. elektron dan netron d. elektron
Stoikiometri. Berasal dari kata Stoicheion (partikel) dan metron (pengukuran). Cara perhitungan dan pengukuran zat serta campuran kimia.
 Stoikiometri Berasal dari kata Stoicheion (partikel) dan metron (pengukuran). Cara perhitungan dan pengukuran zat serta campuran kimia. Bilangan Avogadro Stoikometri: pengukuran kuantitatif sehingga perlu
Stoikiometri Berasal dari kata Stoicheion (partikel) dan metron (pengukuran). Cara perhitungan dan pengukuran zat serta campuran kimia. Bilangan Avogadro Stoikometri: pengukuran kuantitatif sehingga perlu
Antiremed Kelas 10 Kimia
 Antiremed Kelas 10 Kimia Stokiometri - Latihan Soal Doc. Name:K1 AR10KIM0901 Version : 201-09 halaman 1 1. Jika diketahui massa atom C-12= p gram dan massa 1 atom unsur X adalah a gram. Massa atom relatif
Antiremed Kelas 10 Kimia Stokiometri - Latihan Soal Doc. Name:K1 AR10KIM0901 Version : 201-09 halaman 1 1. Jika diketahui massa atom C-12= p gram dan massa 1 atom unsur X adalah a gram. Massa atom relatif
BAB III METODOLOGI PENELITIAN
 BAB III METODOLOGI PENELITIAN A. Lokasi dan Subjek Penelitian Penelitian ini dilaksanakan di Sekolah Menengah Atas (SMA) Negeri 5 Karawang tahun ajaran 2014-2015. Lokasi penelitian dipilih berdasarkan
BAB III METODOLOGI PENELITIAN A. Lokasi dan Subjek Penelitian Penelitian ini dilaksanakan di Sekolah Menengah Atas (SMA) Negeri 5 Karawang tahun ajaran 2014-2015. Lokasi penelitian dipilih berdasarkan
BAB I STOIKHIOMETRI I - 1
 BAB I STOIKHIOMETRI 1.1 PENDAHULUAN Setiap zat, unsur, senyawa dalam kimia mempunyai nama dan rumus uniknya sendiri. Cara tersingkat untuk memerikan suatu reaksi kimia adalah dengan menuliskan rumus untuk
BAB I STOIKHIOMETRI 1.1 PENDAHULUAN Setiap zat, unsur, senyawa dalam kimia mempunyai nama dan rumus uniknya sendiri. Cara tersingkat untuk memerikan suatu reaksi kimia adalah dengan menuliskan rumus untuk
Emas yang terbentuk sebanyak 20 gram, jika ArAu = 198, maka tentukan Ar M!
 1. Suatu senyawa mengandung kadar unsur (% berat) sebagai berikut : S = 35,97%; O = 62,9%; dan H = 1,13%. Rumus molekul senyawa tersebut adalah. 2. Gas hidrogen dapat dibuat dari reaksi antara logam magnesium
1. Suatu senyawa mengandung kadar unsur (% berat) sebagai berikut : S = 35,97%; O = 62,9%; dan H = 1,13%. Rumus molekul senyawa tersebut adalah. 2. Gas hidrogen dapat dibuat dari reaksi antara logam magnesium
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
Konsep Mol : Menghubungkan Dunia Makroskopik dan Dunia Molekular
 Konsep Mol : Menghubungkan Dunia Makroskopik dan Dunia Molekular 1 Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional:
Konsep Mol : Menghubungkan Dunia Makroskopik dan Dunia Molekular 1 Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional:
Tabel Hasil Analisis Kebenaran Konsep pada Objek Penelitian
 202 Lampiran B Label Pengertian stoikiometri Pengertian massa atom Perhitungan massa atom Tabel Hasil Analisis pada Objek Penelitian Penjelasan pada Stoikiometri berasal dari bahasa Yunani (stoicheion,
202 Lampiran B Label Pengertian stoikiometri Pengertian massa atom Perhitungan massa atom Tabel Hasil Analisis pada Objek Penelitian Penjelasan pada Stoikiometri berasal dari bahasa Yunani (stoicheion,
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
Konsep Mol. 1. Jumlah Partikel Dalam 1 Mol Zat
 Konsep Mol Setiap zat yang ada di alam tersusun atas partikel-partikel bentuk atom, molekul, dan ion. Ukuran dan massa partikel-partikel zat tersebut sangat kecil sehingga kita kesulitan untuk mengukurnya.
Konsep Mol Setiap zat yang ada di alam tersusun atas partikel-partikel bentuk atom, molekul, dan ion. Ukuran dan massa partikel-partikel zat tersebut sangat kecil sehingga kita kesulitan untuk mengukurnya.
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Lokasi dan Objek Penelitian Penelitian dilaksanakan pada salah satu SMA Negeri di kota Cimahi. Objek penelitian berupa instrumen tes diagnostik yang dikembangkan. Objek ini
BAB III METODE PENELITIAN A. Lokasi dan Objek Penelitian Penelitian dilaksanakan pada salah satu SMA Negeri di kota Cimahi. Objek penelitian berupa instrumen tes diagnostik yang dikembangkan. Objek ini
BAB 2. PERSAMAAN KIMIA DAN HASIL REAKSI
 BAB 2. PERSAMAAN KIMIA DAN HASIL REAKSI 1. RUMUS KIMIA 2. MENULISKAN PERSAMAAN KIMIA YANG BALANS 3. HUBUNGAN MASSA DALAM REAKSI KIMIA 4. REAKTAN PEMBATAS 5. HASIL PERSENTASE Reaktan (Pereaksi) Produk (Hasil
BAB 2. PERSAMAAN KIMIA DAN HASIL REAKSI 1. RUMUS KIMIA 2. MENULISKAN PERSAMAAN KIMIA YANG BALANS 3. HUBUNGAN MASSA DALAM REAKSI KIMIA 4. REAKTAN PEMBATAS 5. HASIL PERSENTASE Reaktan (Pereaksi) Produk (Hasil
DAFTAR ISI PERNYATAAN... KATA PENGANTAR... UCAPAN TERIMA KASIH... ABSTRAK... DAFTAR ISI... DAFTAR TABEL... DAFTAR GAMBAR... DAFTAR LAMPIRAN...
 DAFTAR ISI PERNYATAAN... KATA PENGANTAR... UCAPAN TERIMA KASIH... ABSTRAK... DAFTAR ISI... DAFTAR TABEL... DAFTAR GAMBAR... DAFTAR LAMPIRAN... BAB I PENDAHULUAN A. Latar Belakang Penelitian... 1 B. Identifikasi
DAFTAR ISI PERNYATAAN... KATA PENGANTAR... UCAPAN TERIMA KASIH... ABSTRAK... DAFTAR ISI... DAFTAR TABEL... DAFTAR GAMBAR... DAFTAR LAMPIRAN... BAB I PENDAHULUAN A. Latar Belakang Penelitian... 1 B. Identifikasi
STOIKIOMETRI _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA
 STOIKIOMETRI _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA 1. Hukum-Hukum Dasar 2. Persamaan Gas Ideal 3. Persamaan Kimia 4. Yield STOIKIOMETRI
STOIKIOMETRI _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA 1. Hukum-Hukum Dasar 2. Persamaan Gas Ideal 3. Persamaan Kimia 4. Yield STOIKIOMETRI
BAB IV HASIL PENELITIAN DAN PEMBAHASAN. kelompok mahasiswa dalam menyelesaikan soal-soal stoikiometri.
 4.1 Deskripsi Hasil Penelitian BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1.1 Cara Mahasiswa Menyelesaikan Soal-Soal Stoikiometri Cara mahasiswa menyelesaikan soal stoikiometri dianalisis berdasarkan respon
4.1 Deskripsi Hasil Penelitian BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1.1 Cara Mahasiswa Menyelesaikan Soal-Soal Stoikiometri Cara mahasiswa menyelesaikan soal stoikiometri dianalisis berdasarkan respon
Antiremed Kelas 10 KIMIA
 Antiremed Kelas 10 KIMIA Persiapan UAS 1 Kimia Doc Name: AR10KIM01UAS Version : 2016-07 halaman 1 01. Partikel berikut yang muatannya sebesar 19 1,6 10 C dan bermassa 1 sma (A) elektron (B) proton (C)
Antiremed Kelas 10 KIMIA Persiapan UAS 1 Kimia Doc Name: AR10KIM01UAS Version : 2016-07 halaman 1 01. Partikel berikut yang muatannya sebesar 19 1,6 10 C dan bermassa 1 sma (A) elektron (B) proton (C)
KIMIA DASAR. Ashfar Kurnia, M.Farm., Apt.
 KIMIA DASAR Ashfar Kurnia, M.Farm., Apt. ILMU KIMIA Kimia Ilmu pengetahuan alam yang mempelajari tentang MATERIyang meliputi: Struktur materi Susunan materi Sifat materi Perubahan materi Energi yang menyertai
KIMIA DASAR Ashfar Kurnia, M.Farm., Apt. ILMU KIMIA Kimia Ilmu pengetahuan alam yang mempelajari tentang MATERIyang meliputi: Struktur materi Susunan materi Sifat materi Perubahan materi Energi yang menyertai
WEEK 3, 4 & 5 Bag 3:STOIKIOMETRI. Joko Sedyono Benyamin
 WEEK 3, 4 & 5 Bag 3:STOIKIOMETRI Joko Sedyono Benyamin 1 Diskripsi Stoikiometri adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif/jumlah zat yang terlibat dalam reaksi kimia. Kata ini berasal
WEEK 3, 4 & 5 Bag 3:STOIKIOMETRI Joko Sedyono Benyamin 1 Diskripsi Stoikiometri adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif/jumlah zat yang terlibat dalam reaksi kimia. Kata ini berasal
BAB III METODE PENELITIAN
 31 BAB III METODE PENELITIAN A. Lokasi dan Subjek Penelitian Penelitian dilaksanakan di tiga SMA Negeri dan satu SMA Swasta di Kota Bandung. Subjek pada penelitian ini adalah instrumen tes diagnostik yang
31 BAB III METODE PENELITIAN A. Lokasi dan Subjek Penelitian Penelitian dilaksanakan di tiga SMA Negeri dan satu SMA Swasta di Kota Bandung. Subjek pada penelitian ini adalah instrumen tes diagnostik yang
Abdul Wahid Surhim 2014
 Abdul Wahid Surhim 2014 Kerangka Pembelajaran Persamaan Kimia Pola Reaktivitas Kimia Berat Atom dan Molekul Mol Rumus Empirik dari Analisis Informasi Kuantitatif dari Persamaan yang Disetarakan Membatasi
Abdul Wahid Surhim 2014 Kerangka Pembelajaran Persamaan Kimia Pola Reaktivitas Kimia Berat Atom dan Molekul Mol Rumus Empirik dari Analisis Informasi Kuantitatif dari Persamaan yang Disetarakan Membatasi
Lembar Kegiatan Siswa
 Lembar Kegiatan Siswa LEMBAR KEGIATAN PERTEMUAN I I. Lembar Kegiatan Siswa (LKS)-01 : Kelompok Nama Kelompok : Nama Anggota : 1. 4. 2. 5. 3. 6. A. Petunjuk: 1. Bacalah dulu infornasi singkat pada LKS ini,
Lembar Kegiatan Siswa LEMBAR KEGIATAN PERTEMUAN I I. Lembar Kegiatan Siswa (LKS)-01 : Kelompok Nama Kelompok : Nama Anggota : 1. 4. 2. 5. 3. 6. A. Petunjuk: 1. Bacalah dulu infornasi singkat pada LKS ini,
SATUAN ACARA PERKULIAHAN (SAP)
 Mata Kuliah : Kimia Teknik Kode Mata Kuliah : MKT 1105 SKS : 2(2-0) Waktu Pertemuan : 100 Menit SATUAN ACARA PERKULIAHAN (SAP) A. Tujuan Pembelajaran 1. Tujuan pembelajaran umum mata kuliah Setelah menyelesaikan
Mata Kuliah : Kimia Teknik Kode Mata Kuliah : MKT 1105 SKS : 2(2-0) Waktu Pertemuan : 100 Menit SATUAN ACARA PERKULIAHAN (SAP) A. Tujuan Pembelajaran 1. Tujuan pembelajaran umum mata kuliah Setelah menyelesaikan
SOAL LAJU REAKSI. Mol CaCO 3 = = 0.25 mol = 25. m Mr
 SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Definisi Operasional Berikut ini diuraikan beberapa definisi operasional dari istilah yang terkait dalam permasalahan penelitian ini, di antaranya: 1. Pengembangan tes tertulis
BAB III METODE PENELITIAN A. Definisi Operasional Berikut ini diuraikan beberapa definisi operasional dari istilah yang terkait dalam permasalahan penelitian ini, di antaranya: 1. Pengembangan tes tertulis
LEMBAR PERSETUJUAN PEMBIMBING
 LEMBAR PERSETUJUAN PEMBIMBING Jurnal yang berjudul : Identifikasi Kemampuan Siswa Menyelesaikan Soal Persamaan Reaksi dan Perhitungan Kimia Menggunakan Three-Tier Multiple Choice Diagnostic Instrument
LEMBAR PERSETUJUAN PEMBIMBING Jurnal yang berjudul : Identifikasi Kemampuan Siswa Menyelesaikan Soal Persamaan Reaksi dan Perhitungan Kimia Menggunakan Three-Tier Multiple Choice Diagnostic Instrument
MATERI adalah segala sesuatu yang mempunyai massa dan menempati ruang ( punya volume )
 MATERI adalah segala sesuatu yang mempunyai massa dan menempati ruang ( punya volume ) Perubahan materi 1. perubahan fisis a) perubahan yang tidak menghasilkan zat baru b) perubahan bentuk dan wujud tanpa
MATERI adalah segala sesuatu yang mempunyai massa dan menempati ruang ( punya volume ) Perubahan materi 1. perubahan fisis a) perubahan yang tidak menghasilkan zat baru b) perubahan bentuk dan wujud tanpa
BAB III METODOLOGI PENELITIAN
 BAB III METODOLOGI PENELITIAN A. Metode Penelitian Penelitian ini menggunakan metode Pengembangan dan Validasi (Development and Validation Methods) yang dikembangkan oleh Adams dan Wieman (2010). Metode
BAB III METODOLOGI PENELITIAN A. Metode Penelitian Penelitian ini menggunakan metode Pengembangan dan Validasi (Development and Validation Methods) yang dikembangkan oleh Adams dan Wieman (2010). Metode
Ikatan kimia. 1. Peranan Elektron dalam Pembentukan Ikatan Kimia. Ikatan kimia
 Ikatan kimia 1. Peranan Elektron dalam Pembentukan Ikatan Kimia Ikatan kimia Gaya tarik menarik antara atom sehingga atom tersebut tetap berada bersama-sama dan terkombinasi dalam senyawaan. gol 8 A sangat
Ikatan kimia 1. Peranan Elektron dalam Pembentukan Ikatan Kimia Ikatan kimia Gaya tarik menarik antara atom sehingga atom tersebut tetap berada bersama-sama dan terkombinasi dalam senyawaan. gol 8 A sangat
No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 8 Semester I BAB I Prodi PT Boga BAB I MATERI
 No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 8 BAB I MATERI Materi adalah sesuatu yang menempati ruang dan mempunyai massa. Materi dapat berupa benda padat, cair, maupun gas. A. Penggolongan
No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 8 BAB I MATERI Materi adalah sesuatu yang menempati ruang dan mempunyai massa. Materi dapat berupa benda padat, cair, maupun gas. A. Penggolongan
BAB VI KINETIKA REAKSI KIMIA
 BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI
 BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI A. STANDAR KOMPETENSI Mendiskripsikan hukumhukum dasar kimia dan penerapannya dalam perhitungan kimia. B. Kompetensi Dasar : Menuliskan nama senyawa anorganik
BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI A. STANDAR KOMPETENSI Mendiskripsikan hukumhukum dasar kimia dan penerapannya dalam perhitungan kimia. B. Kompetensi Dasar : Menuliskan nama senyawa anorganik
HUKUM DASAR KIMIA DAN STOIKIOMETRI
 HUKUM DASAR KIMIA DAN STOIKIOMETRI Bagaimana cara untuk mengukur jumlah suatu senyawa yang terkandung dalam suatu material? Ini merupakan pertanyaan dasar yang telah dijawab oleh para kimiawan terdahulu.
HUKUM DASAR KIMIA DAN STOIKIOMETRI Bagaimana cara untuk mengukur jumlah suatu senyawa yang terkandung dalam suatu material? Ini merupakan pertanyaan dasar yang telah dijawab oleh para kimiawan terdahulu.
Menuliskan nama senyawa kimia
 81 Bab 6. Stoikiometri Standar Kompetensi Memahami terjadinya ikatan kimia Memahami konsep mol Kompetensi Dasar Menuliskan nama senyawa kimia Menjelaskan konsep mol Menerapkan hukum Gay Lussac dan hukum
81 Bab 6. Stoikiometri Standar Kompetensi Memahami terjadinya ikatan kimia Memahami konsep mol Kompetensi Dasar Menuliskan nama senyawa kimia Menjelaskan konsep mol Menerapkan hukum Gay Lussac dan hukum
IDENTIFIKASI TINGKAT PEMAHAMAN KONSEP HUKUM- HUKUM DASAR KIMIA DAN PENERAPANNYA DALAM STOIKIOMETRI PADA SISWA KELAS X IPA DI MAN 3 MALANG
 IDENTIFIKASI TINGKAT PEMAHAMAN KONSEP HUKUM- HUKUM DASAR KIMIA DAN PENERAPANNYA DALAM STOIKIOMETRI PADA SISWA KELAS X IPA DI MAN 3 MALANG Riski Norjana, Santosa, Ridwan Joharmawan Jurusan Kimia, FMIPA
IDENTIFIKASI TINGKAT PEMAHAMAN KONSEP HUKUM- HUKUM DASAR KIMIA DAN PENERAPANNYA DALAM STOIKIOMETRI PADA SISWA KELAS X IPA DI MAN 3 MALANG Riski Norjana, Santosa, Ridwan Joharmawan Jurusan Kimia, FMIPA
K13 Revisi Antiremed Kelas 11 Kimia
 K13 Revisi Antiremed Kelas 11 Kimia Stoikiometri Larutan - Soal Doc. Name: RK13AR11KIM0601 Doc. Version : 2016-12 01. Zat-zat berikut ini dapat bereaksi dengan larutan asam sulfat, kecuali... (A) kalsium
K13 Revisi Antiremed Kelas 11 Kimia Stoikiometri Larutan - Soal Doc. Name: RK13AR11KIM0601 Doc. Version : 2016-12 01. Zat-zat berikut ini dapat bereaksi dengan larutan asam sulfat, kecuali... (A) kalsium
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Lokasi dan Objek Penelitian Penelitian ini dilaksanakan di salah satu SMA Negeri di Bandung, dimana peserta yang dilibatkan merupakan siswa yang telah mengikuti pembelajaran
BAB III METODE PENELITIAN A. Lokasi dan Objek Penelitian Penelitian ini dilaksanakan di salah satu SMA Negeri di Bandung, dimana peserta yang dilibatkan merupakan siswa yang telah mengikuti pembelajaran
STOIKIOMETRI I. HUKUM DASAR ILMU KIMIA
 STOIKIOMETRI I. HUKUM DASAR ILMU KIMIA a. Hukum Kekekalan Massa (Hukum Lavoisier) Massa zat sebelum dan sesudah reaksi adalah sama. Contoh: S + O 2 SO 2 2 gr 32 gr 64 gr b. Hukum Perbandingan Tetap (Hukum
STOIKIOMETRI I. HUKUM DASAR ILMU KIMIA a. Hukum Kekekalan Massa (Hukum Lavoisier) Massa zat sebelum dan sesudah reaksi adalah sama. Contoh: S + O 2 SO 2 2 gr 32 gr 64 gr b. Hukum Perbandingan Tetap (Hukum
HUKUM DASAR KIMIA DAN PERHITUNGAN KIMIA
 Modul Hukum Dasar Kimia dan Perhitungan Kimia EV Page of 8 HUKUM DASAR KIMIA DAN PERHITUNGAN KIMIA Mata Pelajaran K e l a s Nomor Modul Penulis : Kimia : X : Kim.X.04 : Ernavita M.Pd Sekolah Menengah Atas
Modul Hukum Dasar Kimia dan Perhitungan Kimia EV Page of 8 HUKUM DASAR KIMIA DAN PERHITUNGAN KIMIA Mata Pelajaran K e l a s Nomor Modul Penulis : Kimia : X : Kim.X.04 : Ernavita M.Pd Sekolah Menengah Atas
D. Ag 2 S, Ksp = 1,6 x E. Ag 2 CrO 4, Ksp = 3,2 x 10-11
 1. Garam dengan kelarutan paling besar adalah... A. AgCl, Ksp = 10-10 B. AgI, Ksp = 10-16 C. Ag 2 CrO 4, Ksp = 3,2 x 10-12 D. Ag 2 S, Ksp = 1,6 x 10-49 E. Ag 2 CrO 4, Ksp = 3,2 x 10-11 Jadi garam dengan
1. Garam dengan kelarutan paling besar adalah... A. AgCl, Ksp = 10-10 B. AgI, Ksp = 10-16 C. Ag 2 CrO 4, Ksp = 3,2 x 10-12 D. Ag 2 S, Ksp = 1,6 x 10-49 E. Ag 2 CrO 4, Ksp = 3,2 x 10-11 Jadi garam dengan
BAB III METODOLOGI PENELITIAN
 37 BAB III METODOLOGI PENELITIAN A. Lokasi dan Subyek Penelitian Pelaksanaan penelitian berlokasi di salah satu SMA swasta di kota Bandung, yaitu SMA Pasundan 2 Bandung. Pertimbangan pemilihan SMA swasta
37 BAB III METODOLOGI PENELITIAN A. Lokasi dan Subyek Penelitian Pelaksanaan penelitian berlokasi di salah satu SMA swasta di kota Bandung, yaitu SMA Pasundan 2 Bandung. Pertimbangan pemilihan SMA swasta
