PENGEMBANGAN METODE KLONING GEN KETAHANAN TERHADAP HAMA PADA SENGON (Paraserianthes falcataria) ANA TAMPANG
|
|
|
- Hendri Tanudjaja
- 6 tahun lalu
- Tontonan:
Transkripsi
1 PENGEMBANGAN METODE KLONING GEN KETAHANAN TERHADAP HAMA PADA SENGON (Paraserianthes falcataria) ANA TAMPANG SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR BOGOR 2012
2 PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI Dengan ini saya menyatakan bahwa tesis Pengembangan Metode Kloning Gen Ketahanan terhadap Hama pada Sengon (Paraserianthes falcataria) adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini. Bogor, Januari 2012 Ana Tampang NRP E
3 ABSTRACT ANA TAMPANG. Cloning Method of Pest Resistance Gene from Sengon (Paraserianthes falcataria). Under Direction of ULFAH J SIREGAR and ARUM SEKAR WULANDARI. Sengon is one of fast growing trees species, which is widely cultivated in plantations forest in Indonesia due to its multipurpose nature, and easy to grow. The plantation, however, faces serious problem of stem borer (Xystrocera festiva) attack, which was reported could destroyed sengon plantation. Meanwhile, several studies have reported the role of trypsin inhibitors (TI) and alpha-amylase inhibitor (AAI) in resistance in trees to insects. This research aimed at cloning a possible pest resistance gene from sengon. Sengon genomic DNA was isolated using CTAB buffer combined with binding columnn of GenElute plant Genomic DNA Miniprep Kit. Designed primer pairs did not generate amplicon. PCR products were obtained from published degenerate primers as two amplicons, with predicted size of 350 bp and 550 bp for AAI gene, and 600 bp and 800 bp for TI gene. Cloning with pgem-t Easy vector resulted in several white colonies. Sequencing from selective colonies with long and short amplicon of AAI and TI sequences with 693 nucleotide, 278 nucleotide and 832 nucleotide, 278 nucleotide, respectively. BLASTN and BLASTX the sequences did not confirm that the inserts were AAI and TI genes. Further research is still needed to identify pest resistance gene in sengon tree. Keywords: Sengon (Paraserianthes falcataria), alpha-amylase inhibitor gene, trypsin inhibitor gene, cloning
4 RINGKASAN ANA TAMPANG. Pengembangan Metode Kloning Gen Ketahanan terhadap Hama pada Sengon (Paraserianthes falcataria). Dibimbing oleh ULFAH J SIREGAR dan ARUM SEKAR WULANDARI. Pengembangan tanaman sengon (Paraseritanthes falcataria) memiliki beberapa kendala, salah satunya adalah serangan hama boktor (Xystrocera festiva). Serangan hama ini ditandai dengan banyaknya lubang gerek pada batang sehingga menyebabkan penurunan kualitas kayu bahkan dapat menyebabkan kematian pohon. Pengembangan tanaman sengon yang tahan terhadap serangan hama dengan bantuan penanda molekuler merupakan salah satu upaya dalam pengendalian hama. Salah satu penanda molekuler yang dapat digunakan adalah penanda molekuler atas dasar sekuen gen yang mempengaruhi ketahanan terhadap hama, seperti gen tripsin inhibitor (TI) dan alfa amilase inhibitor (AAI). Deteksi gen-gen yang berperan dalam ketahanan hama ini dapat terbantu dengan penggunaan PCR (Polymerase Chain Reaction). Beberapa primer spesifik telah didesain dan digunakan dengan tujuan mendapatkan hasil amplifikasi yang lebih jelas untuk mendeteksi suatu gen target. Pengembangan metode molekuler melalui kloning hasil PCR dengan menggunakan primer spesifik gen AAI dan TI penting dilakukan untuk menghasilkan informasi genetik yang dapat digunakan sebagai acuan untuk mengontrol dan melindungi tanaman dari serangan hama, khususnya terhadap pohon sengon yang rentan terhadap serangan hama boktor melalui program pemuliaan pohon. Penelitian ini bertujuan untuk mengembangkan metode kloning gen pada sengon untuk mendeteksi gen TI dan AAI sebagai gen yang berperan terhadap ketahanan serangan hama pada sengon. Penelitian dilaksanakan di Laboratorium Bioteknologi SEAMEO-BIOTROP Bogor. Waktu penelitian dilaksanakan bulan September 2010 sampai Oktober Pelaksanaan penelitian yang dilakukan meliputi isolasi DNA genomik sengon dengan 3 (tiga) macam metode isolasi, perancangan primer menggunakan program primer3, amplifikasi DNA genomik dengan PCR menggunakan primer spesifik terhadap gen AAI dan TI hasil desain program maupun primer yang sudah dipublikasikan, ekstraksi DNA hasil PCR dari gel agarose menggunakan Kit Qiaquick R Spin (Qiagen) dengan metode mikrosentrifuse, ligasi fragmen DNA pada vektor kloning pgem-t Easy, pembuatan sel kompeten Escherichia coli dengan metode CaCl 2, transformasi dengan menggunakan metode kejut panas (heat shock) dan seleksi plasmid rekombinan berdasarkan hasil PCR menggunakan pasangan primer M13, isolasi DNA plasmid rekombinan Purelink TM Quick Plasmid Miniprep Kit (Invitrogen), sekuensing dan analisis homologi sekuen menggunakan program blastx dan blastn. Hasil penelitian menunjukkan bahwa metode isolasi DNA genomik sengon menggunakan buffer CTAB yang dikombinasikan dengan penggunaan binding column dari GenElute plant Genomic DNA Miniprep Kit menghasilkan kualitas DNA terbaik, namun dalam kuantitas yang lebih kecil. Primer hasil desain menggunakan program primer3 terhadap sekuen dengan nomor aksesi U dan EU pada data base NCBI tidak menghasilkan amplikon
5 pada DNA sengon dalam proses PCR dengan suhu annealing 45 o C - 62 o C. Hasil PCR menggunakan primer spesifik gen alfa amilase inhibitor (α-ai1) yang telah dipublikasikan menghasilkan dua ukuran amplikon yang diperkirakan berukuran 350 pb dan 550 pb. Hasil PCR menggunakan primer spesifik gen tripsin inhibitor (A start /A stop ) yang telah dipublikasikan menghasilkan dua ukuran amplikon yang diperkirakan berukuran 600 pb dan 800 pb. Fragmen-fragmen DNA berhasil diklon menggunakan vektor pgem-t Easy yang ditandai dengan tumbuhnya koloni transforman berwarna putih pada media seleksi. Seleksi plasmid rekombinan dilakukan dengan PCR terhadap koloni transforman menggunakan primer M13. Isolasi DNA plasmid rekombinan dilakukan terhadap koloni transforman terpilih yaitu koloni yang diperkirakan mempunyai amplikon sesuai dengan ukuran insert hasil amplifikasi PCR. Hasil sekuensing memperlihatkan bahwa DNA plasmid rekombinan terpilih mempunyai ukuran gen insert yang berhasil diamplifikasi menggunakan primer α-ai1 adalah 278 pb dan 693 pb sedangkan yang diamplifikasi dengan menggunakan primer A start /A stop masingmasing berukuran 278 pb dan 832 pb. Analisis homologi menggunakan program BLASTN dan BLASTX terhadap sekuen-sekuen tersebut tidak homolog dengan gen AAI dan TI yang ada pada bank gen. Kata kunci: Sengon (Paraserianthes falcataria), gen alfa amilase inhibitor, gen tripsin inhibitor, kloning.
6 Hak Cipta Milik IPB, tahun 2012 Hak Cipta dilindungi Undang-Undang 1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kririk, atau tinjauan suatu masalah b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB 2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB
7 Penguji Luar Komisi Pembimbing : Dr.Ir. Tetty Chaidamsari, M.Si
8 HALAMAN PENGESAHAN Judul Tesis Nama NRP : Pengembangan Metode Kloning Gen Ketahanan terhadap Hama pada Sengon (Paraserianthes falcataria) : Ana Tampang : E Disetujui Komisi Pembimbing Dr.Ir. Ulfah J. Siregar, M.Agr Ketua Dr.Ir. Arum Sekar Wulandari, MS Anggota Diketahui Ketua Program Studi Silvikultur Tropika Dekan Sekolah Pascasarjana Dr.Ir. Basuki Wasis, MS Dr.Ir. Dahrul Syah, M.Sc.Agr Tanggal Ujian: 23 Desember 2011 Tanggal Lulus :
9 PRAKATA Puji dan syukur penulis panjatkan kepada Tuhan, karena atas berkat-nya penulis dapat menyelesaikan tesis yang berjudul Pengembangan Metode Kloning Gen Ketahanan terhadap Hama pada Sengon (Paraserianthes falcataria). Terima kasih dan penghargaan yang tulus penulis ucapkan kepada : 1. Dr.Ir. Ulfah J.Siregar,M.Agr selaku Ketua Komisi Pembimbing dan Dr.Ir. Arum Sekar Wulandari,MS selaku Anggota Komisi Pembimbing yang telah memberi bimbingan dan saran dalam berbagai kesempatan diskusi yang berkaitan dengan penelitian ini. 2. Dr.Ir. Basuki Wasis, MS selaku Ketua Program Studi Silvikultur Tropika dan Dr.Ir. Tetty Chaidamsari,M.Si selaku Penguji Luar Komisi pada Ujian Tesis yang telah memberi banyak masukan dan saran. 3. Direktorat Jenderal Pendidikan Tinggi atas beasiswa BPPS sehingga penulis dapat mengikuti pendidikan di Program Studi Silvikultur Tropika, Sekolah Pascasarjana IPB. 4. Bapak, Mama, Kak Ida, Kak Yani, Kak Eta dan semua keponakan atas segala doa dan kasih sayangnya. 5. Anidah dan Nina yang telah banyak membantu dalam pelaksanaan di laboratorium. 6. Rekan-rekan Pascasarjana Program Studi Silvikultur Tropika secara khusus angkatan 2008 atas bantuan dan kebersamaan selama ini. 7. Rekan-rekan Ikatan Mahasiswa Papua di Bogor dan berbagai pihak yang tidak bisa disebutkan satu persatu, untuk semua dorongan dan bantuan yang diberikan. Penulis menyadari masih banyak kekurangan dalam penulisan ini. Semoga karya ilmiah ini bermanfaat bagi kita semua. Bogor, Januari 2012 Ana Tampang
10 RIWAYAT HIDUP Penulis dilahirkan di Jayapura pada tanggal 12 Februari 1982 dari ayah Junus Sulle dan ibu Helce Kombong. Penulis merupakan anak keempat dari empat bersaudara. Pada tahun 1999 penulis diterima pada Program Studi Budidaya Hutan, Fakultas Pertanian, Universitas Cenderawasih (sekarang Universitas Negeri Papua). Penulis menyelesaikan pendidikan sarjana pada tahun Tahun 2005 penulis lulus seleksi CPNS di lingkungan Universitas Negeri Papua dan bekerja sebagai staf pengajar di Jurusan Budidaya Hutan, Fakultas Kehutanan. Penulis mendapat kesempatan melanjutkan pendidikan pascasarjana pada tahun 2008 melalui beasiswa BPPS. Pendidikan pascasarjana ditempuh pada Program Studi Silvikultur Tropika, Sekolah Pascasarjana Institut Pertanian Bogor.
11 DAFTAR ISI Halaman DAFTAR TABEL xi DAFTAR GAMBAR xii DAFTAR LAMPIRAN xiii PENDAHULUAN Latar Belakang Tujuan dan Manfaat TINJAUAN PUSTAKA Risalah Sengon (Paraserianthes falcataria) Hama Boktor (Xystrocera festiva) Gen Tripsin Inhibitor dan Alfa Amilase Inhibitor Perancangan Primer Polymerase Chain Reaction (PCR) Kloning Gen Sekuensing dan Analisis Homologi METODE PENELITIAN Tempat dan Waktu Bahan dan Alat Prosedur Pelaksanaan Penelitian Sekuensing dan Analisis Homologi HASIL DAN PEMBAHASAN Isolasi DNA Genomik Sengon Perancangan Primer PCR DNA Sengon dengan Primer Spesifik Kloning Fragmen DNA Hasil PCR Sekuensing DNA dan Analisis Homologi KESIMPULAN DAN SARAN Kesimpulan Saran DAFTAR PUSTAKA LAMPIRAN
12 DAFTAR TABEL Halaman 1 Sekuen primer gen AAI dan TI hasil desain menggunakan program primer Sekuen primer gen AAI dan TI yang sudah dipublikasikan Hasil perhitungan kemurnian dan konsentrasi DNA template Primer gen AAI dan TI hasil desain menggunakan program primer
13 DAFTAR GAMBAR Halaman 1 Kumbang Xystrocera festiva Pohon sengon yang terserang hama boktor Peta retriksi vektor pgem-t Easy Hasil elektroforesis DNA genomik daun sengon yang diperoleh dengan metoda 1 (A), metoda 2 (B) dan metoda 3 (C) Profil elektroforesis produk PCR dengan menggunakan primer hasil desain pada beberapa suhu annealing Profil elektroforesis amplifikasi DNA genomik sengon menggunakan pasangan primer α-ai Profil elektroforesis amplifikasi DNA genomik sengon menggunakan pasangan primer A start /A stop Profil elektroforesis pita DNA hasil ektraksi dari gel agarose Koloni bakteri transforman yang berhasil tumbuh pada media seleksi Profil elektroforesis PCR koloni hasil transformasi menggunakan pasangan primer M DNA plasmid rekombinan hasil transformasi Hasil BLASTN dengan entri sekuen fragmen 693 pb yang diamplifikasi dengan primer α-ai Hasil BLASTN dengan entri sekuen fragmen 832 pb yang diamplifikasi dengan primer A start /A stop Hasil BLASTX dengan entri sekuen fragmen 832 pb yang diamplifikasi dengan primer A start /A stop
14 DAFTAR LAMPIRAN Halaman 1 Sekuen nukleotida gen alfa amilase inhibitor untuk desain primer Hasil perancangan primer gen alfa amilase inhibitor menggunakan program primer3 terhadap sekuen dengan nomor aksesi U Sekuen nukleotida gen tripsin inhibitor untuk desain primer Hasil perancangan primer gen tripsin inhibitor menggunakan program primer3 terhadap sekuen dengan nomor aksesi EU Hasil sekuensing fragmen DNA yang diamplifikasi menggunakan primer α-ai1 ukuran 693 (A) dan 278 (B) Hasil sekuensing fragmen DNA yang diamplifikasi menggunakan primer A start /A stop ukuran 832 (A) dan 278 (B) Sekuen vektor pgem-t Easy
15 1 PENDAHULUAN Latar Belakang Kebutuhan kayu terus meningkat sedangkan pasokan bahan baku kayu terutama yang berasal dari hutan alam yang tersedia semakin berkurang. Pengembangan hutan tanaman dilakukan dalam upaya pemenuhan akan kebutuhan kayu tersebut. Umumnya jenis-jenis yang dikembangkan adalah jenisjenis yang tergolong cepat tumbuh (fast growing species). Beberapa jenis pohon hutan telah dikembangkan pada hutan tanaman, salah satunya adalah sengon (Paraserianthes falcataria). Sengon merupakan jenis pohon yang temasuk dalam famili Leguminosae (Atmosuseno 1998). Sengon banyak diminati dalam pengembangan hutan tanaman. Jenis ini memiliki keunggulan yaitu cepat tumbuh dan mudah tumbuh karena tidak terlalu membutuhkan kondisi tempat tumbuh yang rumit sehingga jenis ini sesuai digunakan untuk penghijauan lahan-lahan kritis. Riap pertumbuhan sengon rakyat rata-rata mencapai 20 m 3 /ha/tahun, bahkan pada kebun benih sengon di Candiroto Temanggung riap volume sebesar 27,26 m 3 /ha/tahun (Rimbawanto 2008). Kegunaan pohon sengon cukup banyak. Kayunya dapat digunakan sebagai bahan baku pulp maupun untuk kayu pertukangan, akar pohon dapat bersimbiosis dengan rhizobium yang membantu menyuburkan tanah bahkan daunnya dapat digunakan sebagai pakan ternak. Pemanfaatan kayu sengon juga semakin meningkat seiring teknologi pengawetan kayu yang makin berkembang. Kebutuhan kayu sengon tiap tahunnya mencapai 500 ribu m 3 dengan harga jualnya mencapai Rp ,-/m 3 (Siregar et al. 2010). Kebutuhan kayu yang masih tinggi dengan harga jual yang cukup baik dapat dijadikan peluang untuk mengembangkan jenis ini. Pengembangan sengon mempunyai beberapa kendala. Salah satu kendala utama pengembangan tanaman sengon adalah serangan hama boktor (Xystrocera festiva). X. festiva merupakan hama yang serangannya cukup serius pada hutan tanaman (Nair 2007). Serangan hama ini ditandai dengan banyaknya lubang gerek pada batang sehingga menyebabkan penurunan kualitas kayu bahkan dapat menyebabkan kematian pohon.
16 2 Salah satu upaya pengendalian hama secara hayati, yaitu dengan mengembangkan tanaman sengon yang tahan terhadap serangan hama. Tanaman yang di lapangan terlihat tahan terhadap serangan hama masih perlu diuji untuk memastikan bahwa sifat ketahanan tersebut disebabkan oleh faktor genetik sehingga diharapkan sifat ketahanan tersebut dapat diwariskan kepada generasi selanjutnya. Ada beberapa cara yang dapat dilakukan untuk menguji kembali ketahanan klon-klon harapan tersebut. Jaya et al. (2004) menyatakan bahwa penanaman kembali di daerah serangan dapat memberikan indikasi langsung mengenai ketahanan tanaman terhadap hama tersebut. Namun cara tersebut memerlukan waktu yang relatif lama karena memerlukan proses perbanyakan tanaman dan waktu hingga tanaman dapat berbuah. Selain itu juga memerlukan lahan yang luas. Cara yang lebih efisien dapat ditempuh dengan menggunakan metoda molekuler di antaranya adalah penggunaan penanda molekuler. Salah satu penanda molekuler yang dapat digunakan adalah penanda molekuler atas dasar sekuen gen tanaman yang berperan dalam ketahanan hama, seperti gen tripsin inhibitor (TI) dan alfa amilase inhibitor (AAI). Beberapa peneliti telah melaporkan peranan TI dan AAI dalam ketahanan tanaman terhadap hama. Tanaman padi transgenik yang mengekspresikan gen CpTI (Cowpea Trypsin Inhibitor) secara signifikan meningkat daya resistennya terhadap dua spesies penggerek batang padi (Xu et al. 1996). Penelitian lain yang dilakukan oleh Shukla et al. (2005) juga menunjukkan bahwa Soybean Trypsin Inhibitor mampu meningkatkan jumlah kematian dan menekan jumlah pupa Helicoverpa armigora dibandingkan kontrol (tanpa tripsin inhibitor). Selain TI, gen AAI juga diketahui berperan dalam ketahanan terhadap serangan hama. Pisum sativum transgenik yang mengekspresikan gen AAI kacang (Bean α- amylase inhibitor) dapat memberikan perlindungan terhadap Bruchus pisorum (Morton et al. 2000). Lebih lanjut Barbosa et al. (2010) menyatakan bahwa α- amylase inhibitor-1 dari benih kopi arabika (Coffea arabica) transgenik mampu menghambat aktivitas enzim alfa amilase hama Hypotheneumus hampei (coffe berry borer) sehingga berpotensi dalam pengendalian hama tersebut. Deteksi gen-gen ketahanan hama ini dapat terbantu dengan penggunaan PCR (Polymerase Chain Reaction). PCR sangat berguna dalam perbanyakan
17 3 DNA secara in vitro sehingga memudahkan dalam mempelajari aspek-aspek genetik. Spesifisitas dan efisiensi PCR sangat ditentukan oleh primer yang digunakan. Primer merupakan komponen PCR yang sangat menentukan ketepatan sekuen DNA yang ingin diamplifikasi. Urutan nukleotida primer akan menjadi penentu pada bagian mana primer akan menempel pada DNA. Desain primer yang tepat merupakan salah satu langkah penting untuk keberhasilan mengsekuen DNA (Abd-Elsalam 2003). Beberapa primer spesifik telah didesain dan digunakan dengan tujuan mendapatkan hasil amplifikasi yang lebih jelas untuk mendeteksi suatu gen target, seperti dalam mendeteksi Phytopthora palmivora penyebab penyakit busuk buah pada tanaman kakao (Darmono et al. 2006) dan untuk mendeteksi bakteri Xanthomonas axonopodis pv. glycines penyebab penyakit bisul bakteri pada kedelai (Pratiwi 2004). Desain primer dapat dilakukan dengan memanfaatkan teknologi bioinformatika yaitu dengan mengakses internet untuk mendapat sekuen nukleotida yang tersimpan dalam database bank gen dan menyusunnya sehingga menjadi susunan nukleotida suatu primer. Bioinformatika selain untuk mendesain primer dapat juga digunakan untuk membandingkan suatu sekuen dengan sekuen yang tersimpan dalam bank data menggunakan program Basic Local Alignment Search Tool (BLAST) (Altschul et al. 1997) untuk mendeteksi suatu gen. Jaya et al. (2004) melakukan pendeteksian gen inhibitor proteinase (PIN) dengan menggunakan primer spesifik terhadap PIN pada tanaman kakao yang diduga berperan dalam sistem ketahanan tanaman kakao terhadap hama Penggerek Buah Kakao (BPK). Pengembangan metoda molekuler melalui kloning hasil PCR dengan menggunakan primer spesifik gen AAI dan TI penting dilakukan untuk menghasilkan informasi genetik yang dapat digunakan sebagai acuan untuk mengontrol dan melindungi tanaman dari serangan hama, khususnya terhadap pohon sengon yang rentan terhadap serangan hama boktor melalui program pemuliaan pohon.
18 4 Tujuan dan Manfaat Tujuan dari penelitian ini adalah mengembangkan metoda kloning gen pada sengon untuk mendeteksi gen tripsin inhibitor (TI) dan alfa amilase inhibitor (AAI) sebagai gen yang berperan terhadap ketahanan serangan hama pada sengon, dari hasil PCR dengan menggunakan primer spesifik. Pengembangan metoda kloning ini bermanfaat untuk mempelajari lebih lanjut gen-gen ketahanan terhadap hama pada sengon dalam rangka menunjang program pemuliaan pohon hutan.
19 5 TINJAUAN PUSTAKA Risalah Sengon (Paraserianthes falcataria) Sengon tergolong famili Leguminosae (Mimosaceae) dan dikenal dengan berbagai nama lokal seperti Jeungjing (Sunda), Sengon laut (Jawa), Tedehu pute (Sulawesi), Sika (Maluku), Bae (Papua) sedangkan di Malaysia dikenal dengan nama Batai (Hidayat 2002). Jenis ini merupakan jenis asli dari kepulauan sebelah timur Indonesia yakni di sekitar Maluku dan Papua. Penyebarannya secara alami selain di Indonesia yaitu Haiti, Papua New Guinea, dan Kepulauan Solomon (Orwa et al. 2009). Jenis ini menghendaki iklim basah sampai agak kering, pada dataran rendah hingga ke pegunungan sampai ketinggian 1500 m dari permukaan laut (Martawijaya et al. 1989), dengan ketinggian optimum m dari permukaan laut (Siregar et al. 2010). Sengon termasuk spesies yang memerlukan cahaya (Hidayat 2002). Sengon tumbuh pada suhu sekitar 20 o C 33 o C dan kelembaban sekitar 50 75% (Atmosuseno 1998). Sengon termasuk dalam jenis yang cepat tumbuh. Hidayat (2002) mengemukakan bahwa pohon sengon mulai berbunga sejak umur 3 tahun dengan musim berbunga pada bulan Maret Juni dan Oktober Desember. Sengon dapat dipanen pada umur yang relatif singkat, yaitu 5 7 tahun setelah tanam. Tinggi pohon dapat mencapai 40 m dan diameter bisa mencapai 100 cm. Peningkatan pertumbuhan tinggi tanaman sengon dapat dilakukan dengan aplikasi mikoriza dan cuka kayu (Siarudin dan Suhaendah 2007). Beberapa jenis hama dan penyakit sengon yang menyerang tanaman sengon adalah hama penggerek batang, hama ulat kantong dan penyakit karat puru. Anakan sengon di persemaian sering terkena lodoh yang disebabkan oleh Rhizoctonia, Sclerotium, Fusarium, Pythium dan Phytopthora (Hidayat 2002). Pohon sengon tidak berbanir dan kulit berwarna kelabu muda. Daun majemuk menyirip ganda, berwarna hijau dan berbentuk elips sampai memanjang. Jumlah sirip dalam tiap daun 6 20 pasang dengan anak daun 6 26 pasang persirip (Hidayat 2002). Bunga tersusun dalam bentuk malai. Benang sari menonjol lebih panjang dari daun mahkota. Warna bunga putih kekuningan. Kuntum bunga yang mekar berisi bunga jantan dan bunga betina. Cara penyerbukan bunga
20 6 dibantu oleh serangga dan angin. Buah berbentuk polong, pipih dan tipis serta berwarna hijau sampai coklat jika sudah masak, setiap polong buah berisi biji. Biji berbentuk elips, berwarna hijau ketika masih muda dan berwarna coklat kehitaman dan agak keras serta licin jika sudah masak (Atmosuseno 1998). Kayu gubal dan kayu teras sengon berwarna coklat muda yang disertai warna merah muda dan tidak dapat dibedakan dengan jelas. Kayunya lunak, sangat ringan dan mudah menyerap bahan pengawet. Berat jenis dan tergolong dalam kelas kuat III IV dan kelas awet IV (sedang). Kayu sengon mengandung selulosa tinggi, lignin rendah, pentosan rendah dan ekstraktif tinggi. Persentase lignin rendah menunjukkan kayu tidak terlalu kuat dan tidak terlalu kaku. Persentase pentosan yang rendah akan mengurangi kekuatan kayu karena selain sebagai cadangan makanan bagi sel, pentosan juga berfungsi sebagai penguat dinding sel kayu (Atmosuseno 1998). Beberapa kegunaan kayu sengon antara lain adalah untuk konstruksi ringan, bahan pulp, kerajinan tangan, veneer. Daun sengon dapat digunakan sebagai pakan ternak (ayam dan kambing) sedangkan kulit batang oleh masyarakat Ambon digunakan untuk penyamak jaring, kadang-kadang sebagai pengganti sabun (Hidayat 2002). Ekstrak daun sengon yang ditambahkan garam tawas dapat digunakan sebagai pewarna kain sutera sebagai pengganti bahan pewarna sintetik (Kusriniati 2007). Tegakan sengon dapat membantu menyuburkan tanah di sekitarnya. Daun sengon yang luruh cepat membusuk. Perakarannya dapat bersimbiosis dengan bakteri Rhizobium membentuk bintil akar yang dapat mengikat nitrogen bebas dari udara dan mengubahnya menjadi amonia (NH 3 ). Hama Boktor (Xystrocera festiva) Permasalahan yang paling umum dihadapi dalam pengembangan sengon adalah serangan hama penggerek batang atau yang disebut juga hama boktor (Xystrocera festiva). X. festiva tergolong dalam kelas Coleoptera: Famili Cerambycidae dan subfamili Cerambycinae. Jarak terbang X. festiva tidak jauh sehingga untuk mencapai tempat yang jauh, kumbang ini harus terbang beberapa kali dan dapat dibantu oleh angin (Husaeni 2010).
21 7 Serangga ini merupakan serangga nokturnal. Husaeni (2010) menjelaskan bahwa kumbang X. festiva memiliki panjang tubuh sekitar cm, berwarna coklat kemerahan dengan sisi-sisi sebelah luar elitranya berwarna hijau kebirubiruan (Gambar 1). Telur berwarna hijau kekuningan dan membentuk kelompok telur karena ada semacam zat perekat yang dihasilkan oleh kumbang betina. Larva yang baru ditetaskan berukuran 2x1 mm dan berwarna kuning gading sedangkan larva dewasa panjangnya dapat mencapai 5 cm. Pupa (kepompong) berukuran 4 cm dan berwarna kuning gading namun dengan bertambahnya umur warna ini berangsur-angsur berubah menjadi coklat. Gambar 1 Kumbang Xystrocera festiva (Sumber : Nair (2007) mengemukakan bahwa kumbang meletakkan telur pada celah luka kulit kayu pohon dan larva mengebor batang. Larva berada di bawah kulit dan akhirnya melubangi hingga ke bagian dalam kayu (Matsumoto dan Irianto 1995). Pertumbuhan sejumlah besar larva pada suatu pohon menyebabkan terbentuknya terowongan dan kulit kayu mengering serta pecah. Pada umumnya serangan hama ini terjadi pada pohon yang telah berumur 3 tahun (Husaeni 2010). Persentase serangan hama cenderung meningkat dengan semakin bertambahnya umur dan diameter pohon (Husaeni dan Haneda 2010). Sengon yang sehat memiliki kambium dengan kandungan air yang tinggi dan berwarna putih sedangkan yang terserang hama boktor memiliki kambium dengan kandungan air yang sedikit atau mengering dan berwarna coklat serta seratnya ada yang kehitaman (Hartati 2002). Serangan awal hama boktor terlihat dengan berubahnya warna kulit batang sengon yang terserang. Batang sengon berubah warna menjadi merah kecoklatan berbeda dengan batang sengon sehat yang berwarna putih. Kerusakan awal ditandai dari kulit pohon yang mengalami nekrosis dan menunjukkan adanya lubang yang berbentuk oval sebagai aktivitas pengeboran dari larva hama ini.
22 8 Jalan masuk hama pada batang akan tampak berwarna hitam dan kering (Gambar 2). Larva biasanya hidup secara berkelompok dan memakan kulit kayu, lapisan kambium, xylem dan berdiam di bawah kulit kayu (Matsumoto dan Irianto 1995). Serangan pada kayu gubal dapat berlanjut ke sekeliling batang yang menyebabkan tajuk di bagian atas menguning dan daun berguguran hingga akhirnya menyebabkan kematian pohon tersebut. Lubang gerek berbentuk lonjong dengan panjang berkisar antara 6 18 cm dan garis tengah antara mm. Gambar 2 Pohon sengon yang terserang hama boktor (Sumber : dokumentasi pribadi 2010). Pengendalian hama boktor dapat dilakukan secara mekanik (penangkapan kumbang dengan lampu perangkap, pemusnahan kelompok telur boktor, penyesetan kulit batang sengon yang terserang), secara silvikultur (penanaman pohon sengon resisten, pengaturan jarak tanam, pembuatan tanaman campuran, penjarangan tegakan), secara hayati (pelepasan parasit telur, penyemprotan dengan cendawan patogen) dan secara kimiawi. Ketahanan tanaman terhadap serangan hama dan penyakit dipengaruhi oleh faktor genetik ataupun lingkungan. Iklim secara tidak langsung dapat mempengaruhi vigor dan fisiologi tanaman inang akan ketahanan tanaman inang terhadap hama (Wiyono 2007). Pengendalian X. festiva secara hayati dapat menggunakan cendawan Beauveria bassiana dan Metarhizium anisopliae dengan mengaplikasikannya
23 9 langsung ke serangga (Wahyono dan Tarigan 2007). Penjarangan terhadap pohon yang terkena serangan merupakan tindakan yang cukup baik untuk mengurangi serangan hama. Tanaman mempunyai mekanisme pertahanan diri berupa reaksireaksi kimia yang terjadi di dalam sel dan jaringan tanaman (Rimbawanto 2008). Serangga hama biasanya mempunyai enzim-enzim khusus dalam sistem pencernaannya untuk mencerna makanan. Aktivitas tripsin inhibitor pada tanaman diketahui dapat mengontrol perkembangan hama. Hasil penelitian menunjukkan bahwa pada tanaman famili Leguminosae atau Fabaceae terdapat zat kimia berupa inhibitor tripsin dan kimotripsin yang dapat menghambat aktivitas kerja enzim pencernaan tersebut. Zat inhibitor ini merupakan daya tahan alami suatu tanaman untuk melawan serangan hama. Gen Tripsin Inhibitor (TI) dan Alfa Amilase Inhibitor (AAI) Tanaman secara alami memiliki kemampuan untuk melindungi dirinya dari serangan hama dengan mensintesis makromolekul tertentu seperti protease inhibitor dan alfa amilase inhibitor (Ismail et al. 2010). Tripsin inhibitor adalah senyawa yang mempunyai kemampuan untuk menghambat aktivitas proteolitik enzim tripsin sehingga menyebabkan terganggunya pencernaan protein. Tripsin inhibitor menghalangi pelepasan asam-asam amino dari ikatan proteinnya sehingga tidak dapat diserap. Mekanisme penghambatan aktivitas enzim proteolitik (tripsin dan kimotripsin) oleh inhibitor protease terjadi karena terbentuknya ikatan kompleks antara kedua senyawa tersebut (interaksi proteinprotein). Alfa amilase inhibitor adalah senyawa yang menghambat kerja enzim alfa amilase. Enzim alfa amilase (α-1,4-glucanohydrolase) termasuk dalam famili 13 glycosyl hydrolases (Henrissat dan Bairoch 1996 dalam Polaina dan MacCabe 2007). Alfa amilase mengkatalisis pemutusan ikatan α-1,4-glikosidik pada molekul karbohidrat. Amilase menghidrolisis karbohidrat menjadi maltosa, maltotriosa dan oligosakarida ataupun hingga menjadi glukosa (Polaina dan MacCabe 2007). Gen-gen yang berperan menghasilkan senyawa-senyawa inhibitor ini masing-masing adalah gen AAI dan gen TI. Kedua gen ini banyak dipelajari dalam upaya peningkatan resistensi tanaman terhadap hama. Gen-gen ini seperti
24 10 sarana untuk memindahkan sifat resisten suatu hama dari suatu tanaman ke tanaman lainnya melalui rekayasa genetik. Winarni (2003) melaporkan bahwa berdasarkan marka isozim pada sengon terlihat pola-pola pita yang khas yang menunjukkan nilai aktivitas tripisin yang rendah atau tinggi pada lokus-lokus tertentu walaupun korelasi aktivitas tripsin inhibitor dengan marka isozim memperlihatkan nilai korelasi yang rendah. Tanaman padi transgenik yang mengekspresikan gen CpTI secara signifikan meningkat daya resistennya terhadap dua spesies penggerek batang padi (Xu et al. 1996). Begitu pula pada benih kopi arabika (Coffea arabica) transgenik yang mengekspresikan gen AAI dari Phaseolus vulgaris menghasilkan alfa amilase inhibitor dan mampu menghambat aktivitas enzim alfa amilase hama Hypotheneumus hampei (coffe berry borer) sehingga berpotensi dalam pengendalian hama tersebut (Barbosa et al. 2010). Suatu alfa amilase inhibitor dapat menghambat alfa amilase suatu hama namun tidak menghambat hama lainnya (Ishimoto dan Kitamura 1989). Hasil penemuan Mirkov et al mengindikasikan bahwa genom buncis mengandung lebih dari satu gen AAI. Perancangan Primer Primer adalah seutas tunggal DNA pendek atau oligonukleotida, yang panjangnya antara basa (Chawla 2002). Primer berfungsi sebagai penginisiasi reaksi polimerisasi DNA secara in vitro. Primer merupakan komponen PCR yang sangat menentukan ketepatan sekuen DNA yang ingin diamplifikasi. Urutan nukleotida primer akan menjadi penentu pada bagian mana primer akan menempel (anneal) pada genom. Dieffenbach et al. (1993) mengemukakan bahwa desain primer ditujukan untuk memperoleh keseimbangan antara spesifisitas (ketegasan) dan efisiensi amplifikasi. Spesifisitas diartikan sebagai frekuensi terjadi mispriming. Efisiensi didefinisikan sebagai kemampuan pasangan primer untuk mengamplifikasi produk pada tiap siklus PCR. Sekuensekuen primer perlu dipilih untuk memilih daerah DNA, menghindari kemungkinan mishibridisasi untuk sekuen yang sama yang berdekatan. Pengulangan mononukleotida harus dihindari. Primer harus tidak mudah menempel dengan primer lainnya ketika dicampur.
25 11 Beberapa parameter yang diperhatikan dalam mendesain primer yaitu : a. Panjang Primer Panjang primer berperan dalam mengontrol spesifisitas. Primer yang baik biasanya terdiri dari nukleotida (Abd-Elsalam 2003). Panjang ini cukup bagi primer untuk terikat dengan mudah pada DNA template pada suhu annealingnya. Ukuran primer yang paling banyak dipilih sekitar 20 basa karena nilai temperature melting (T m )nya dapat mencapai lebih dari 55 o C (Jamil 2005). b. Temperatur Melting (T m ) Temperatur melting atau suhu leleh adalah temperature dimana setengah dari duplex DNA akan terpisah menjadi strand tunggal. Kedua primer dalam reaksi PCR harus mempunyai Tm yang sama untuk menyakinkan bahwa keduanya akan mempunyai kinetik hibridisasi yang sama selama fase temperatur annealing (Chawla 2002). Tm primer yang optimal adalah 52 o C 58 o C. Umumnya Tm primer ini menghasilkan hasil yang lebih baik dibandingkan Tm yang lebih rendah. Primer dengan Tm di atas 65 o C harus dihindari karena berpotensi untuk secondary annealing (Abd-Elsalam 2003). Nilai Tm biasa diindikasikan dari kandungan basa GC. Dieffenbach et al. (1993) menyatakan bahwa untuk primer yang lebih pendek dari 20 basa, pendugaan T m dapat dihitung dengan formula T m = 4(G+C) + 2(A+T). c. Komposisi Primer Kandungan GC adalah persentase jumlah G dan C terhadap jumlah basa total pada primer. Guevara-Garcia (1997) dalam Jamil (2005) menyatakan bahwa kandungan G dan C ditentukan untuk menjamin stabilitas primer yang tinggi. Persentase atau kandungan GC merupakan ciri penting DNA dan memberikan informasi tentang kekuatan annealing (Abd-Elsalam 2003). Primer harus memiliki kandungan GC antara 45 % hingga 60 % (Dieffenbach et al dalam Abd-Elsalam 2003 ). Kandungan GC, suhu leleh dan suhu annealing saling berpengaruh satu dengan yang lainnya.
26 12 Polymerase Chain Reaction (PCR) Reaksi polimerase berantai atau PCR adalah suatu proses perbanyakan DNA secara in vitro enzimatik dengan pengontrolan suhu (Weising et al. 2005). Campuran reaksi PCR mengandung bufer, DNA-polimerase termostabil, empat dioksiribonukleotida (dntps), primer oligonukleotida, DNA template. PCR dapat menghasilkan perbanyakan DNA dalam jumlah banyak dengan waktu yang relatif singkat. Reaksi PCR merupakan proses berulang antara kali siklus. Setiap siklus terdiri atas tiga tahap yaitu denaturasi, annealing dan elongasi. Pada tahap denaturasi, DNA template yang merupakan utas ganda dibuat menjadi utas tunggal melalui peningkatan suhu (94 o C 96 C). Tahap berikutnya adalah tahap penempelan atau annealing primer, yaitu dengan suhu yang lebih rendah tergantung pada primer yang digunakan. Primer menempel pada bagian DNA templat yang komplementer urutan basanya. Penempelan ini bersifat spesifik pada sekuen target. Urutan nukleotida primer akan menjadi penentu pada bagian mana primer akan menempel (anneal) pada genom. Suhu yang tidak tepat menyebabkan tidak terjadinya penempelan atau primer menempel di sembarang tempat. Tahap berikutnya adalah tahap pemanjangan atau elongasi. Suhu yang digunakan adalah sesuai dengan suhu optimal aktivitas DNA polimerase. Umumnya suhu yang digunakan antara 65 o C 72 o C. Kloning Gen Kloning gen adalah upaya perbanyakan suatu gen melalui proses perkembangbiakan sel inang. Fragmen DNA diletakkan di vektor untuk memastikan fragmen yang diklon tersebut terduplikasi (Lodge et al. 2007). Fragmen DNA yang mengandung gen yang hendak diklon dimasukkan ke molekul vektor berupa DNA sirkular untuk menghasilkan molekul DNA rekombinan (Brown 2006). Fragmen DNA dan vektor dipotong dengan enzim retriksi yang sama agar ujung untaian DNA mempunyai segmen yang sama sehingga memudahkan proses ligasi. Penggabungan fragmen DNA dengan DNA vektor dikatalis oleh enzim ligase sehingga terbentuk DNA rekombinan (Brown 1991). Umumnya vektor yang digunakan adalah plasmid. Plasmid adalah molekul kecil DNA sirkular yang ditemukan pada banyak tipe bakteri. Plasmid
27 13 mempunyai ORI (Origin of Replication) yang berfungsi untuk replikasi. Gen yang terinsert akan tercopy sejalan dengan perbanyakan plasmid. Plasmid yang digunakan dalam kloning mengandung selectable marker, biasanya gen resisten antibiotik. Selectable marker berperan dalam membedakan bakteri yang mengandung plasmid dengan menebarkannya pada media agar yang mengandung antibiotik (Lodge et al. 2007). Salah satu plasmid yang digunakan dalam kloning adalah pgem-t Easy yang petanya dapat dilihat pada Gambar 3. Gambar 3 Peta retriksi vektor pgem-t Easy (Promega 2010). Vektor mentransport gen ke sel inang. Sel inang yang umumnya digunakan adalah bakteri (Brown 2006). Vektor dimasukkan ke sel inang melalui proses yang disebut transformasi sehingga menghasilkan plasmid rekombinan ke bakteri. Pembelahan sel bakteri menyebabkan terduplikatnya fragmen DNA (Lodge et al. 2007). Dalam sel inang, vektor bermultiplikasi menghasilkan jumlah kopian yang identik bukan hanya vektor tetapi juga gen yang terinsert. (Brown 2006).
28 14 Sekuensing dan Analisis Homologi Sekuensing DNA adalah penentuan seluruh atau sebagian sekuen nukleotida dari molekul DNA. Alasan mendasar untuk mengetahui sekuen molekul DNA adalah untuk membuat prediksi tentang fungsinya dan memfasilitasi untuk manipulasi molekul (Alphey 1997). Sekuensing DNA juga dipergunakan dalam studi populasi genetik (Weising et al. 2005). Informasi sekuen nukleotida sangat penting dalam bidang kloning molekuler sebab dengan mengetahui sekuen DNA maka dapat ditentukan situs enzim retriksi spesifik atau dapat memprediksi ORF sekuen DNA yang bersangkutan (Glick dan Paternak 1994). Sekuensing dapat dilakukan langsung terhadap daerah target amplifiksi PCR ataupun disekuensing setelah diklon (Weising et al. 2005). Sekuensing DNA Metode Sanger disebut juga metode chain terminator yaitu prosesnya berdasar pada sintesis enzimatik dari template DNA untai tunggal menggunakan ddntps (dideoksinukleotida). Metode Maxam Gilbert disebut juga metode chemical degradation yaitu prosesnya didasarkan meliputi degradasi secara kimia fragmen DNA yang diberi radiolabel pada ujungnya. Pelabelan biasanya menggunakan fosfat radioaktif (Alphey 1997; Graham 2001). Fungsi-fungsi gen sering dapat diturunkan dari sekuen nukleotidanya, sebagai contoh dalam membandingkan sekuen sampel dengan sekuen gen yang telah diketahui fungsinya (Glick dan Paternak 1994). Perbandingan sekuen didasarkan pada asumsi bahwa protein disusun dari suatu tetua akan mempunyai sekuen yang sama yang disebut homologi. Jika suatu sekuen dikategorikan homolog dengan suatu kelompok sekuen maka dapat disimpulkan bahwa sekuen tersebut tersusun dari sekuen tetua yang sama sehingga mempunyai fungsi yang sama pula degan kelompok sekuen tersebut (Lodge et al. 2007). Analisis homologi dapat dilakukan melalui pendekatan bioinformatika. Bioinformatika adalah ilmu yang menggunakan teknologi informasi untuk mengatur, menganalisis, dan mendistribusikan informasi biologis untuk menjawab pertanyaan biologi kompleks (Abd-Elsalam 2003). Komputasional biologi meliputi penemuan gen pada sekuen DNA dari berbagai organisme, mengembangkan metode untuk menduga struktur dan/atau fungsi protein yang
29 15 baru ditemukan dan sekuen RNA struktural, mengelompokkan sekuen protein ke famili-famili bersesuaian dan pengembangan model protein (Chawla 2002). Pengembangan teknologi menjadikan bioinformatika semakin mudah dilakukan karena dapat diakses secara gratis dari internet. European Bioinformatics Institute (EBI), National Center for Biotechnology Information (NCBI) dan DNA Data Bank of Japan (DDBJ) mempunyai situs dimana ketiga situs saling berintegrasi untuk memberikan informasi sekuen DNA atau protein suatu organisme. Program yang umum digunakan yaitu BLAST (Basic Local Alignment Search Tool). Program ini digunakan untuk mencari kesamaan sekuen DNA atau protein query dengan sekuen pada database. BLAST membandingkan sekuen yang tidak diketahui fungsinya dengan sekuen pada database. Fungsi dari sekuen baru kemudian disimpulkan dari fungsi sekuen yang diketahui. Program BLASTN membandingkan sekuen nukleotida query dengan sekuen nukleotida pada database. BLASTX membandingkan sekuen nukleotida query yang ditranslate dalam keenam frames reading dengan sekuen protein database (Hindley 1983). E- value (expect value) adalah ukuran seberapa mirip kecocokan suatu sekuen dengan yang ada di database (Lodge et al. 2007).
30 16 METODE PENELITIAN Tempat dan Waktu Penelitian dilakukan di Laboratorium Bioteknologi SEAMEO-BIOTROP, Bogor. Waktu pelaksanaan mulai bulan September 2010 hingga Oktober Bahan dan Alat Bahan tanaman yang digunakan adalah daun pohon sengon (Paraserianthes falcataria). Selain itu digunakan juga bahan-bahan untuk isolasi DNA, pereaksi PCR, elektroforesis, ekstraksi gel, ligasi dan transformasi. Alat yang digunakan adalah pipet mikro, gelas ukur, mortar dan pestel, timbangan analitik, waterbath, Maxi Mix Vortex Thermolyne, mikrosentrifuse (microfuge 200R Hettich), vacum dryer, Gene Amp PCR System 9700, alat elektroforesis (Owl Separation System ), hotplate, DU 530 UV-VIS spektrofotometer, laminar air flow, shaker inkubator, kodak geldoc. Prosedur Pelaksanaan Penelitian Pengambilan Sampel Sampel berasal dari hutan tanaman Perum Perhutani BKPH Pare, KPH Kediri. Sampel berupa daun pohon sengon provenan Kediri. Sampel dimasukkan ke dalam plastik klips yang berisi silika gel. Isolasi DNA Genomik Sengon Metode 1 Isolasi DNA genomik sengon dilakukan dengan metode Orozco-Castillo et al. (1994). Sampel daun sengon sebanyak g digerus dalam nitrogen cair hingga sampel berbentuk bubuk. Bubuk sampel langsung dimasukkan dalam tube yang berisi 1 ml bufer ekstrak CTAB dan 10 µl merkaptoetanol. Larutan berisi bubuk sampel divortex dan diinkubasi pada suhu 65 o C dalam waterbath selama 45 menit. Campuran ditambahkan 750 µl fenol:kloroform:isoamilalkohol (25:24:1) dan kemudian disentrifugasi pada rpm selama 10 menit. Supernatan diambil dan ditambahkan 1x volume kloroform isoamilalkohol lalu disentrifugasi pada rpm selama 10 menit. Tahapan ini dilakukan sebanyak
31 17 2 kali. Supernatan diambil dan ditambahkan 1x volume isopropanol dingin. Larutan dihomogenkan perlahan hingga berbentuk benang putih kemudian diinkubasi pada suhu -20 o C selama semalam. Larutan kemudian disentrifugasi pada rpm selama 10 menit. Hasil sentrifugasi berupa pelet DNA, pelet DNA kemudian dibilas dengan alkohol 70%. Pelet divakum hingga tidak tercium aroma alkohol dan kemudian dilarutkan dengan 200 µl bufer TE. Metode 2 Isolasi DNA genomik dilakukan menggunakan GenElute plant Genomic DNA Miniprep Kit. Berat sampel yang digunakan adalah 100 mg bubuk daun sengon yang telah digerus dengan penambahan nitrogen cair. Prosedur isolasi DNA mengikuti prosedur kit. DNA dilarutkan dengan larutan elusi sebanyak 100 µl. Metode 3 Isolasi DNA genomik dilakukan dengan menggunakan bufer CTAB (metoda 1) yang dimodifikasi dengan penggunaan GenElute plant Genomic DNA Miniprep Kit. Isolasi DNA sengon dilakukan dengan menggerus daun pohon sengon sebanyak g. Daun digerus dengan menambahkan nitrogen cair hingga berbentuk bubuk halus. Bubuk hasil gerusan dimasukan ke dalam tube 2 ml yang berisi buffer ekstrak (1 ml bufer CTAB dan 10 µl mercaptaetanol). Campuran dalam tube tersebut divortex dan kemudian diinkubasi dalam waterbath selama 45 menit pada suhu 65 o C. Setiap 15 menit sekali tabungtabung tersebut diangkat dari waterbath dan dikocok. Setelah inkubasi, tube diangkat dan didinginkan pada suhu ruang selama 15 menit untuk selanjutnya dilakukan pemurnian DNA. Pemurnian DNA dilakukan dengan menambahkan fenol kloroform isoamilalkohol (25:24:1) sebanyak 750 µl, kemudian disentrifugasi pada kecepatan rpm selama 10 menit. Tahapan ini dilakukan sebanyak dua kali. Supernatan hasil sentrifugasi dipindahkan ke tube baru dan ditambahkan kloroform isoamilalkohol (24:1) dan disentrifugasi. Tahapan selanjutnya adalah binding dengan menggunakan GenElute plant Genomic DNA Miniprep Kit. Sebanyak 500 µl supernatan ditambahkan 700 µl larutan binding kemudian dihomogenkan dengan membolak-balik tube. Campuran dipipet ke tube berisi gen elute miniprep binding coloum yang sebelumnya telah diaktifkan membrannya dengan larutan preparation coloum. Campuran didiamkan dalam
32 18 colom selama 5 menit kemudian disentrifugasi pada rpm selama 1 menit. Binding coloum ditempatkan pada tube baru kemudian dicuci dengan menambahkan 500 µl larutan pencuci (wash solution) yang telah diencerkan lalu disentrifugasi pada rpm selama 5 menit untuk mengeringkan etanol. Setelah pencucian, binding coloum ditempatkan pada tube baru, kemudian dilakukan pelarutan DNA yang terbinding dengan menambahkan dalam keadaan hangat 100 µl larutan elution ke dalam coloum. Larutan elusi dalam coloum didiamkan selama 5 menit dan disentrifugasi pada rpm selama 1 menit. Pelarutan dilakukan dua kali dengan cara yang sama sehingga diperoleh 200 µl larutan stok DNA. Hasil isolasi DNA dilakukan uji kualitas dan kuantitasnya. Kualitas DNA diketahui dari hasil elektroforesis menggunakan agarose 1%. DNA sebanyak 5 µl dicampur dengan 1 µl loading buffer, kemudian dimasukkan dalam sumur elektroforesis. Kemurnian DNA diukur dengan nilai perbandingan serapan pada panjang gelombang 260 nm dan 280 nm. Nilai panjang gelombang 260 nm digunakan untuk pengukuran kuantitas DNA dengan rumus (Muladno 2010), yaitu Konsentrasi DNA = A 260 nm x faktor pengenceran x 50µg/µL. Perancangan Primer Primer untuk gen TI dan AAI dirancang dengan menggunakan program komputer. Tahap awal dilakukan dengan mencari sekuen gen TI dan AAI rujukan dari situs NCBI: Sekuen yang dipilih adalah sekuen gen dari tanaman leguminoceae. Sekuen tersebut kemudian dimasukkan dalam program primer3 ( untuk menghasilkan sekuen primer yang hendak digunakan dalam pengujian. Primer yang dipilih adalah primer yang memiliki kandungan GC 50% (Dieffenbach et al.1993). Amplifikasi DNA Genomik dengan PCR Reaksi PCR dilakukan dengan menggunakan 2 macam primer, yaitu primer hasil desain menggunakan program primer3 (Tabel 1) maupun primer spesifik terhadap gen AAI dan TI yang sudah dipublikasikan (Tabel 2).
33 19 Tabel 1 Sekuen primer gen AAI dan TI hasil desain menggunakan program primer3 Primer Sekuen Nukleotida AAI (forward) AAI (reverse) CTTCTCTCCCACGCAAACTC TGAAGTTGGTGTCGAAGCTG TI (forward) TI (reverse) CCATGGATCTGAACCACCTC CCTGGACTTGCAAGGTTTGT Tabel 2 Sekuen primer gen AAI dan TI yang sudah dipublikasikan Primer Sekuen Primer Sumber α-ai1 Tripsin Inhibitor Forward : 5 -GCCTTGGGATGTACACGACT-3 Reverse : 5 -CTCCATTGATAAGCCCCTGA-3 A start : 5 -TCNGAYGCNGARAARGTNTAYGA YATHGA-3 A stop : 5 -NGAYTCNGTYTCNGANCCNGANCG NGGYTT-3 Barbosa et al Hung et al Volume reaksi PCR yang digunakan adalah 25 µl yang mengandung 250 ng DNA, pasangan primer (forward dan reverse) masing-masing 0.8 µm, 1X bufer KOD Hot Start DNA Polymerase, MgSO mm, dntps 0.2 mm (masing-masing), enzim KOD Hot Start DNA Polymerase 1 U serta water nuclease. Program PCR yang digunakan adalah Pre-denaturasi 95 o C selama 2 menit, dilanjutkan dengan 35 siklus denaturasi pada suhu 95 o C selama 20 detik, annealing pada suhu tertentu selama 10 detik, dan ekstensi selama 10 detik pada suhu 70 o C. Produk PCR selanjutnya dielektroforesis. Gel yang digunakan adalah gel agarose 1.5%. Pembuatan gel agarose dilakukan dengan cara melarutkan 0.6 g agarose dalam 40 ml bufer TAE 1X. Elektroforesis dilakukan dengan mengambil 5 µl PCR produk yang dicampur dengan 1 µl loading buffer. Gel hasil elektroforesis kemudian divisualisasikan di dalam geldoc untuk melihat fragmen DNA yang terbentuk, kemudian difoto untuk dokumentasi. Kegiatan PCR dan elektroforesis ini dilakukan dengan cara yang sama, baik menggunakan primer spesifik terhadap tripsin inhibitor maupun alfa amilase inhibitor.
34 20 Ektraksi DNA Hasil PCR dari Gel Agarose Hasil amplifikasi gen dengan PCR dimurnikan dengan mengekstraksi pitapita yang terbentuk pada gel hasil elektroforesis. Gel yang mengandung gen target dipotong menggunakan scalpel steril. Ekstraksi gel dilakukan dengan menggunakan prosedur Kit Qiaquick R Spin (Qiagen) dengan metode mikrosentrifuse. Gel dipotong pada daerah yang ada band dengan berat < 400 mg. DNA dielusi dengan penambahan 30 µl bufer EB (10 mm Tris-Cl). Kloning Fragmen DNA Produk PCR 1. Ligasi Fragmen DNA pada vektor kloning. Vektor kloning yang digunakan adalah pgem-t Easy. Volume reaksi ligasi sebanyak 10 µl yang terdiri dari 2x buffer ligasi 5 µl, vektor pgem-t Easy 0.5 µl, DNA hasil elusi produk PCR 3.5 µl, dan T4 DNA ligase 1 µl. Campuran reaksi diinkubasi pada suhu 4 o C selama semalam. 2. Pembuatan Sel Kompeten Escherichia coli Bakteri E.coli XL1-blue dibuat sel kompeten. E.coli dikulturkan dalam media agar LB yang mengandung tetrasiklin 100 ppm dan diinkubasi semalam pada suhu 37 o C sehingga terbentuk koloni. Koloni bakteri dikulturkan ke dalam media cair LB yang mengandung tetrasiklin 100 ppm pada suhu 37 o C selama semalam. Larutan kultur diambil sebanyak 1 ml dan ditambahkan 100 ppm tetrasiklin dan 3 ml media LB. Larutan diinkubasi dalam shaker 200 rpm pada suhu 37 o C selama 3 jam. Hasil inokulasi dimasukkan ke dalam tabung mikro steril. Hasil kultur diambil sebanyak 1.5 ml dan didiamkan dalam es selama 5 10 menit. Larutan disentrifugasi pada 6000 rpm dan suhu 4 o C selama 2 menit. Supernatan dibuang dan pelet disuspensi dengan 1 ml CaCl 2 0.1M dingin. Larutan diinkubasi dalam es selama 15 menit kemudian disentrifugasi pada 6000 rpm dan suhu 4 o C selama 2 menit. Supernatan hasil sentrifugasi dibuang sedangkan pelet disuspensi dengan 200 µl CaCl M dingin. Tabung mikro yang berisi sel kompeten dimasukkan ke dalam nitrogen cair kemudian disimpan pada suhu -80 o C.
35 21 3. Transformasi dan Seleksi Plasmid Rekombinan Plasmid hasil ligasi fragmen DNA sebanyak 5 µl ditambahkan ke dalam sel kompeten E.coli sebanyak 200 µl. Campuran didiamkan dalam es selama 30 menit kemudian diberi kejut panas (heat shock) pada suhu 42 o C dalam waterbath selama 50 detik dan segera didinginkan dalam es selama 10 menit. Media LB dan glukosa 20 mm sebanyak 800 µl ditambahkan ke dalam campuran kemudian diinkubasi dalam shaker inkubator pada suhu 37 o C dan 200 rpm selama 1 jam 30 menit. Campuran larutan tersebut kemudian disentrifugasi pada 3500 rpm selama 5 menit. Pelet yang terbentuk dilarutkan dengan 100 µl supernatan hingga pelet larut sempurna. Larutan tersebut kemudian disebarkan di atas permukaan media seleksi berupa media LA yang mengandung ampisilin 100 ppm, X-Gal 40 ppm, IPTG 0.1 mm dan diinkubasi pada suhu 37 o C selama semalam. Koloni bakteri transforman yang berwarna putih kemudian di PCR untuk seleksi plasmid rekombinan. PCR koloni dilakukan dengan menggunakan pasangan primer M13 forward dan reverse. Volume reaksi PCR yang digunakan adalah 15 µl yang mengandung 10 µl larutan bakteri (koloni bakteri dilarutkan dalam 10 µl water nuclease), pasangan primer M13 (forward dan reverse) 10 µm masingmasing 0.15 µl, 10x bufer komplete (Fermentas) 1.5 µl, 10 mm dntps 0.3 µl, enzim tag DNA Polymerase 0.15 µl serta water nuclease 2.75 µl. Program PCR yang digunakan adalah program PCR koloni. Tahap pertama terdiri dari 1 siklus program lisis bakteri (96 o C selama 5 menit dilanjutkan dengan 50 o C selama 90 detik, 96 o C selama 90 detik, 45 o C selama 90 detik, 96 o C selama 1 menit dan 40 o C selama 1 menit. Tahap kedua adalah PCR, dimana larutan bakteri dicampurkan dengan campuran reaksi PCR. Reaksi PCR terdiri dari 30 siklus (94 o C selama 30 detik, 55 o C selama 1 menit dan 72 o C selama 2 menit) dilanjutkan dengan 1 siklus 72 o C selama 5 menit. Seleksi plasmid rekombinan dilakukan berdasarkan elektroforesis hasil PCR pada agarosa 1%. Koloni bakteri rekombinan dipilih yaitu yang menghasilkan amplikon dengan kualitas yang bagus dan ukuran spesifik yang sesuai dengan hasil ekstraksi gel.
36 22 Isolasi DNA Plasmid Rekombinan Isolasi DNA plasmid rekombinan diambil dari koloni hasil transformasi yang telah diseleksi berdasarkan PCR koloni. Koloni bakteri diambil dengan menggunakan tusuk gigi steril dan dicelupkan dalam 10 ml media LB yang mengandung ampisilin 100 ppm. Larutan diinkubasi selama semalam dalam shaker inkubator pada suhu 37 o C. Larutan hasil kultur sebanyak 8 ml digunakan untuk isolasi plasmid sedangkan 2 ml disimpan dalam gliserol sebagai stok. Penyimpanan dilakukan pada suhu -70 o C. Isolasi plasmid dilakukan menggunakan prosedur Purelink TM Quick Plasmid Miniprep Kit (Invitrogen). Hasil isolasi dielusi dengan 50 µl bufer TE. Sekuensing dan Analisis Homologi Sekuensing fragmen DNA genomik sengon terklon dilakukan oleh PT.Gentika Science di Singapura. Materi yang disekuen adalah DNA plasmid rekombinan. Sekuen DNA hasil sekuensing dianalisis homologi dengan menggunakan program BLAST pada situs NCBI Program BLASTN membandingkan sekuen nukleotida hasil sekuensing dengan sekuen nukleotida yang ada pada database. BLASTX membandingkan sekuen nukleotida dengan sekuen protein database. Analisis homologi menggunakan program ini untuk memastikan sekuen tersebut merupakan sekuen gen target.
37 HASIL DAN PEMBAHASAN Isolasi DNA Genomik Sengon DNA genomik sengon diisolasi dari daun muda pohon sengon. Hasil uji integritas DNA metode 1, metode 2 dan metode 3 pada gel agarose dapat dilihat pada Gambar 4. Hasil penghitungan kemurnian dan konsentrasi DNA berdasarkan pengukuran serapan pada panjang gelombang 260 nm dan 280 nm menggunakan spektrofotometer ultraviolet dapat dilihat pada Tabel 3. Kualitas DNA yang baik ditunjukkan dengan kemurnian dan integritas yang baik ketika dielektroferesis dalam gel agarose. A B C Gambar 4 Hasil elektroforesis DNA genomik sengon yang diperoleh dengan metode 1 (A), metode 2 (B) dan metode 3 (C). 5 µl larutan DNA dielektroforesis pada gel agarose 1%. Gambar 4A menunjukkan bahwa hasil isolasi DNA dengan menggunakan metode 1 mempunyai integritas yang kurang bagus. Hasil elektroforesis larutan DNA pada gel agarose terlihat bahwa larutan DNA masih banyak mengandung kontaminan. Hal ini terlihat juga berdasarkan hasil perhitungan kemurnian DNA yaitu berkisar antara 1.32 hingga 2.89 (Tabel 3).
38 24 Tabel 3 Hasil perhitungan kemurnian dan konsentrasi DNA template No Kemurnian DNA Konsentrasi DNA (ng/µl) Metode 1 Metode Sambrook dan Maniatis (1989) menyatakan bahwa DNA dikatakan murni jika rasio serapan pada panjang gelombang 260 nm dan 280 nm adalah 1.8. Kemurnian DNA mempengaruhi keberhasilan pada tahap PCR. Perbandingan nilai serapan 260/280 nm yang lebih kecil dari 1.8 dapat terjadi karena adanya kontaminan protein (Weising et al. 2005). DNA yang tidak murni berarti masih mengandung komponen kontaminan seperti protein, polisakarida ataupun senyawa-senyawa fenol. DNA yang diisolasi dengan metode 1 terlihat kental dan agak susah untuk dipipet. Porebski et al. (1997) menyatakan bahwa polisakarida dapat terlihat dengan kentalnya DNA yang dihasilkan dan susah dalam pemipetannya sehingga tidak dapat diamplifikasi pada PCR karena menghambat aktivitas enzim polimerase. Hasil isolasi DNA dengan menggunakan metode 1 dapat ditingkatkan kuantitas dan kualitasnya dengan menambahkan tahapan pemurniannya. Pemurnian dapat dilakukan dengan penambahan fenol dan kloroform maupun dengan peningkatan konsentrasi CTAB di dalam bufer
39 25 ekstraksi (Weising et al. 2005). DNA daun sengon tidak berhasil diisolasi dengan menggunakan metode 2 (Gambar 4B) sedangkan metode 3 (Gambar 4C) menghasilkan DNA dengan integritas yang lebih bagus, yaitu berupa pita tunggal dengan jarak migrasi relatif sama. Tabel 3 menunjukkan bahwa larutan DNA hasil isolasi berdasarkan metode 3 mempunyai kemurnian yang lebih bagus yaitu berkisar antara 1.45 hingga 1.96 namun konsentrasi DNA yang dihasilkan lebih rendah. Perancangan Primer Perancangan primer spesifik terhadap gen AAI dan TI didasarkan pada sekuen yang terdapat pada database yang diakses melalui internet pada situs NCBI (National Centre for Biotechnological Information, Sekuen yang digunakan adalah sekuen gen AAI dari Phaseolus maculatus dengan nomor akses U dengan jumlah nukleotida 795 (Lampiran 1) yang berasal dari DNA genomik. Sekuen gen TI yang digunakan adalah sekuen dengan nomor akses EU yang mempunyai 324 nukleotida (Lampiran 3), berasal dari genomik DNA Vigna unguiculata. Hasil perancangan primer terhadap kedua sekuen tersebut dengan menggunakan program primer3 dapat dilihat pada Lampiran 2 dan Lampiran 4 sedangkan primer terpilih disajikan pada Tabel 4. Tabel 4 Primer gen AAI dan TI hasil desain menggunakan program primer3 Primer Sekuen Nukleotida Keterangan AAI (forward) AAI (reverse) TI (forward) TI (reverse) CTTCTCTCCCACGCAAACTC TGAAGTTGGTGTCGAAGCTG CCATGGATCTGAACCACCTC CCTGGACTTGCAAGGTTTGT * Tm: temperatur melting, G: guanin, C: sitosin. 20 nukleotida, Tm 60 o C, 55% GC 20 nukleotida, Tm 60 o C, 50% GC 20 nukleotida, Tm 60 o C, 55% GC 20 nukleotida, Tm 60 o C, 50% GC Jumlah sekuen nukleotida, Tm maupun kandungan GC pada primer masih tergolong dalam jumlah optimal untuk suatu primer. Abd-Elsalam (2003) menyatakan bahwa jumlah optimal nukleotida suatu primer adalah nukleotida, sedangkan Tm di bawah 65 o C dan kandungan GC antara 45% hingga 60%. Setiap pasang primer (forward dan reverse) untuk kedua gen juga memiliki
40 26 Tm yang sama yaitu 60 o C. Chawla (2002) menyatakan bahwa pasangan primer dalam reaksi PCR sebaiknya mempunyai Tm yang sama. PCR DNA Sengon dengan Primer Spesifik Deteksi gen AAI dan gen TI pada sengon dilakukan menggunakan primer spesifik terhadap kedua gen tersebut. Amplifikasi fragmen DNA sengon diawali dengan melakukan optimasi kondisi PCR. Optimasi kondisi PCR dilakukan dengan menguji beberapa parameter yaitu konsentrasi DNA template, jumlah enzim, konsentrasi primer dan terutama suhu annealing (suhu penempelan primer). Optimasi perlu dilakukan untuk mendapatkan hasil amplifikasi yang diinginkan. Menurut Weising et al. (2005) beberapa parameter yang mempengaruhi PCR adalah primer, aktivitas dan jumlah enzim polimerase, suhu, konsentrasi primer, DNA template dan MgCl 2, dan kualitas DNA template. Amplifikasi fragmen DNA sengon menggunakan primer hasil desain dilakukan dengan optimasi beberapa suhu annealing, yaitu 45 o C hingga 62 o C. Hasil elektroforesis terhadap hasil PCR menunjukkan bahwa tidak ada amplikon yang terbentuk (Gambar 5). Hal ini diduga karena primer yang didesain masih belum tepat untuk mengamplifikasi gen TI maupun AAI pada DNA genomik sengon. Abd-Elsalam (2003) menyatakan bahwa pendesainan primer yang kurang baik menyebabkan reaksi PCR tidak bekerja dengan baik. Hal ini menyebabkan tidak terjadinya amplikon M Gambar 5 Profil elektroforesis produk PCR dengan menggunakan primer hasil desain pada beberapa suhu annealing. Baris 1-12 berturut-turut adalah produk PCR dengan suhu annealing 62 o C, 61.3 o C, 60.4 o C, 58.8 o C, 56.7 o C, 54.8 o C, 53 o C, 50.8 o C, 48.7 o C, 47 o C, 45.8 o C, 45 o C. M adalah ladder. 5 µl hasil PCR dielektroforesis pada gel agarose 1.5%.
41 27 Primer spesifik terhadap gen AAI dan TI yang telah dipublikasi (Tabel 2) juga dicobakan untuk mengamplifikasi DNA genomik sengon. Primer untuk gen AAI adalah primer yang sudah pernah dicobakan untuk mendeteksi gen AAI Phaseolus vulgaris yang diekspresikan pada kopi arabika (Coffea arabica) sedangkan primer TI adalah primer yang pernah dicobakan untuk mengamplifikasi gen TI pada Delonix regia. Beberapa suhu annealing yang dicobakan terhadap primer AAI (primer α-ai1) bervariasi antara 45 o C hingga 62 o C. Berdasarkan hasil optimasi maka suhu annealing yang terbaik adalah 54 o C. Amplifikasi fragmen DNA sengon dengan PCR menggunakan pasangan primer α-ai1 menghasilkan dua amplikon yaitu amplikon pendek yang diperkirakan berukuran 350 pb dan amplikon panjang yang diperkirakan berukuran 550 pb (Gambar 6) M 550 pb 350 pb 500 pb 250 pb Gambar 6 Profil elektroforesis amplifikasi DNA genomik sengon menggunakan pasangan primer α-ai1. Baris 1 adalah kontrol (-), Baris 2-4 adalah hasil PCR menggunakan pasangan primer α-ai1, baris M adalah ladder. Ukuran marker pada sebelah kanan dalam satuan pb (pasang basa) sedangkan prediksi ukuran amplikon pada sebelah kiri dalam satuan pb. 5 µl hasil PCR dielektroforesis pada gel agarose 1.5%. Suhu annealing yang dicobakan terhadap primer TI (Primer A start /A stop ) dari suhu 43 o C hingga 57 o C. Berdasarkan hasil optimasi maka suhu annealing yang digunakan adalah 45 o C. Amplifikasi fragmen DNA sengon dengan PCR menggunakan pasangan primer A start /A stop menghasilkan dua amplikon yaitu amplikon pendek yang diperkirakan berukuran 600 pb dan amplikon panjang yang diperkirakan berukuran 800 pb (Gambar 7).
42 M 800 pb 600 pb 750 pb 500 pb Gambar 7 Profil elektroforesis amplifikasi DNA genomik sengon menggunakan pasangan primer A start /A stop. Baris 1 adalah kontrol (-), Baris 2-3 adalah hasil PCR menggunakan pasangan primer A start /A stop, baris M adalah ladder. Ukuran marker pada sebelah kanan dalam satuan pb sedangkan prediksi ukuran amplikon pada sebelah kiri dalam satuan pb. 5 µl hasil PCR dielektroforesis pada gel agarose 1.5%. Suhu annealing sangat mempengaruhi penyatuan DNA dan primer. Jika suhu annealing yang digunakan terlalu tinggi maka tidak terjadi hibridisasi namun jika suhu annealing terlalu rendah maka bisa terjadi mishibridisasi (Brown 2006). Park (2011) menyatakan bahwa suhu annealing merupakan faktor paling kritis untuk keberhasilan amplifikasi selain kemurnian dan konsentrasi DNA. Variasi kecil dalam salah satu variabel suatu reaksi PCR dapat mempengaruhi hasil amplikon. Semua amplikon yang dihasilkan kemudian dimurnikan dari gel agarose dengan menggunakan Kit Qiaquick R Spin (Qiagen). Hal ini dimaksudkan untuk mendapatkan DNA gen hasil amplifikasi tanpa kontaminan dari pereaksi PCR lainnya. Hasil ektraksi gel kemudian diperiksa dengan elektroforesis pada gel agarose 1% seperti yang terlihat pada Gambar M pb 500 pb Gambar 8 Profil elektroforesis pita DNA hasil ektraksi dari gel agarose. Baris 1-6 adalah fragmen DNA hasil PCR dengan primer α-ai1, baris 7-9 adalah fragmen DNA hasil PCR dengan primer A start /A stop, M adalah ladder 1 Kb plus. Tanda ( ) menunjukkan posisi amplikon. 2 µl hasil elusi dielektroforesis pada gel agarose 1%.
43 29 Hasil elusi memperlihatkan bahwa fragmen DNA yang dihasilkan mempunyai ukuran yang sama dengan hasil elektroforesis hasil PCR sebelumnya. DNA hasil ekstraksi gel yang dihasilkan untuk gen TI baik untuk ukuran 600 pb maupun 800 pb terlihat sangat tipis. Hasil elusi ini digunakan sebagai gen insert dalam proses ligasi. Kloning Fragmen DNA Hasil PCR Kloning fragmen DNA dilakukan dengan menggunakan Escherichia coli sebagai sel kompeten dan pgem-t Easy sebagai vektor kloning. Fragmen DNA disisipkan pada DNA plasmid (vektor kloning) membentuk plasmid rekombinan yang disebut proses ligasi. Ligasi dimaksudkan agar fragmen DNA dapat dengan aman tereplikasi bersamaan dengan replikasi plasmid. Brown (2006) menyatakan bahwa fragmen DNA yang tidak diligasi umumnya akan terdegradasi oleh enzim dalam inang bakteri. Hasil ligasi berupa plasmid rekombinan kemudian ditransformasi ke dalam sel bakteri E.coli kompeten sebagai sel inang. E.coli digunakan sebagai sel inang karena E.coli cepat dalam bereplikasi dan juga sensitif untuk tumbuh pada antibiotik (Brown 2006). Transformasi membentuk sel bakteri transforman yang membawa plasmid rekombinan. Koloni bakteri transforman terlihat berupa koloni-koloni putih yang tumbuh pada media seleksi yang mengandung antibiotik ampisilin, X-Gal, dan IPTG (Gambar 9). Koloni bakteri dapat tumbuh pada media seleksi karena enzim β-lactamase yang terkandung pada plasmid mampu mengubah ampisilin menjadi tidak beracun sedangkan bakteri non transforman tidak menghasilkan koloni (Brown 2006). Gambar 9 Koloni bakteri transforman yang berhasil tumbuh pada media seleksi. Koloni mengandung plasmid rekombinan berwarna putih ( ), sedangkan koloni mengandung plasmid non rekombinan berwarna biru ( )
44 30 Koloni putih merupakan ciri dari koloni rekombinan yaitu sel bakteri E.coli yang mengandung plasmid rekombinan. Gambar 9 memperlihatkan bahwa koloni putih mendominasi jumlah koloni yang terbentuk pada media seleksi. Selain koloni putih juga terdapat koloni berwarna biru, dengan jumlah sangat sedikit. Koloni biru merupakan ciri dari koloni yang tidak mengandung plasmid rekombinan. Plasmid secara normal dapat mensintesis β-galactosidase oleh gen lacz. β-galactosidase akan mengubah X-gal yang ada pada media sehingga menjadi molekul berwarna biru. Plasmid rekombinan memecah gen lacz sehingga tidak dapat mensintesis β-galactosidase menyebabkan koloni berwarna putih. Sistem ini disebut seleksi lac (Brown 2006). Plasmid rekombinan yang dihasilkan dari koloni putih diperiksa keberadaannya dengan PCR menggunakan primer universal M13 forward dan reverse. Hasil elektroforesis PCR koloni pada agarose menghasilkan beberapa variasi ukuran amplikon (Gambar 10) M M 850 pb 500 pb A B M M 1000 pb 500 pb C D Gambar 10 Profil elektroforesis PCR koloni hasil transformasi menggunakan pasangan primer M13 (baris 1-19). M adalah Ladder. Koloni transforman AAI amplikon panjang (A) dan pendek (B). Koloni transforman TI amplikon panjang (C) dan pendek (D). Baris 2, 7, 11 dan 14 merupakan koloni yang dipilih (tanda ) untuk isolasi DNA plasmid. 5 µl hasil PCR dielektroforesis pada gel agarose 1%.
45 31 Beberapa koloni kemudian dipilih untuk diisolasi plasmidnya yaitu koloni yang diperkirakan menghasilkan amplikon yang sesuai dengan ukuran insert hasil amplifikasi PCR. Amplikon hasil PCR koloni mempunyai ukuran yang lebih besar sekitar 200 pb dari ukuran amplikon hasil PCR DNA genomik sengon menggunakan primer spesifik. Hal ini karena PCR koloni menggunakan primer universal M13 yang komplemen pada daerah vektor pgem-t Easy (Isda et al. 2008). Satu koloni dipilih untuk setiap gen (AAI dan TI) yaitu satu untuk mewakili amplikon panjang dan satu untuk amplikon pendek. Plasmid yang terkandung dalam koloni terseleksi tersebut kemudian diisolasi DNAnya, selanjutnya dilakukan sekuensing (Gambar 11) M 2000 pb Gambar 11 DNA plasmid rekombinan hasil transformasi. Baris 1 dan 3 adalah plasmid yang mengandung fragmen hasil PCR gen AAI amplikon panjang sedangkan baris 2 dan 4 amplikon pendek. Baris 5 dan 6 adalah plasmid yang mengandung fragmen hasil PCR gen TI amplikon panjang sedangkan baris 7 amplikon pendek. M adalah ladder. 2 µl DNA plasmid dielektroforesis pada gel agarose 1%. DNA plasmid rekombinan mempunyai ukuran yang bervariasi. Variasi ini disebabkan oleh perbedaan ukuran DNA insert, karena plasmid yang digunakan sama yaitu pgem-t Easy. Ukuran DNA plasmid rekombinan merupakan gabungan antara DNA plasmid dan DNA insert dan seharusnya lebih besar dari ukuran plasmid pgem-t Easy, yang berukuran 3015 pb (Promega 2010). Sekuensing DNA dan Analisis Homologi Materi yang digunakan untuk sekuensing adalah DNA plasmid rekombinan terseleksi yang mempunyai ukuran sesuai gen target. Sekuensing dilakukan terhadap plasmid rekombinan yang mengandung fragmen DNA sengon
46 32 berukuran pendek maupun panjang. Hasil sekuensing nukleotida DNA plasmid dari koloni terpilih untuk kedua DNA gen terklon dapat dilihat pada Lampiran 5 dan Lampiran 6. Hasil sekuensing terhadap fragmen DNA terklon yang diamplifikasi dengan primer α-ai1 pada koloni terpilih masing-masing berukuran 693 pb untuk amplikon panjang dan 278 pb untuk amplikon pendek. Hasil sekuensing terhadap fragmen DNA terklon yang diamplifikasi dengan primer A start /A stop pada koloni terpilih masing-masing berukuran 832 pb untuk amplikon panjang dan 278 pb untuk amplikon pendek. Sekuen-sekuen ini kemudian dilakukan analisis homologi menggunakan program BLASTN dan BLASTX pada situs ncbi; Program BLASTN membandingkan sekuen nukleotida entri dengan sekuen nukleotida yang ada pada bank gen sedangkan BLASTX membandingkan sekuen nukleotida entri dengan sekuen protein yang ada pada bank gen. Hasil analisis BLAST tergambar dengan adanya garis-garis berwarna. Garis-garis ini menggambarkan posisi pensejajaran (alignment). Kode warna pada BLAST mengindikasikan kekerabatan berdasarkan skor pensejajaran dan panjang tiap garis berhubungan dengan daerah mana sekuen sejajar dengan sekuen target. Garis warna merah menggambarkan tingkat homologi paling bagus sedangkan garis warna hitam menunjukkan paling buruk. Tingkat homologi juga dapat terlihat dari nilai skor bit dan E-value (expectation value). Tingkat homologi yang paling bersesuaian dengan suatu sekuen adalah pada daftar paling atas dan memiliki skor bits paling tinggi namun E-value rendah (Hindley 1983; Claveri dan Notredame 2007). Hasil BLASTN dengan entri sekuen fragmen DNA terklon yang diamplifikasi dengan primer α-ai1 pada koloni terpilih yang berukuran 278 pb tidak ditemukan sekuen yang homolog sedangkan hasil BLASTN untuk fragmen 693 pb seperti terlihat pada Gambar 12. Hasil BLASTN menunjukkan bahwa fragmen DNA berukuran 693 pb tersebut homologi dengan gen resisten tahan penyakit pada Arabidopsis thaliana. Tingkat homologi paling tinggi yaitu dengan nomor aksesi CP (Arabidopsis thaliana chromosome 5) dengan nilai skor maks 56.5 dan E-value 2e-04. Analisis homologi menggunakan BLASTX untuk kedua ukuran fragmen ini tidak menghasilkan daerah homolog dengan sekuen protein yang ada pada bank gen.
47 33 Gambar 12 Hasil BLASTN dengan entri sekuen nukleotida fragmen 693 pb yang diamplifikasi dengan primer α-ai1. Sekuen nukleotida fragmen DNA yang diamplifikasi dengan primer A start /A stop pada koloni terpilih masing-masing berukuran 832 pb dan 278 pb. Hasil BLASTN dengan entri sekuen fragmen 278 pb tidak ditemukan sekuen yang homolog pada bank gen sedangkan hasil BLASTN untuk fragmen 832 pb seperti terlihat pada Gambar 13. Gambar 13 Hasil BLASTN dengan entri sekuen nukleotida fragmen 832 pb yang diamplifikasi dengan primer A start /A stop.
48 34 Analisis homologi dengan BLASTN terhadap fragmen DNA berukuran 832 pb yang diamplifikasi dengan primer A start /A stop lebih homolog dengan gen Ganoderma sp dengan tingkat homologi paling tinggi terhadap nomor aksesi HM sedangkan jika dianalisis dengan BLASTX, sekuen tersebut lebih homolog dengan hypothetical protein dengan nomor aksesi XP (Gambar 14). Lubec et al. (2005) menjelaskan bahwa hypothetical protein diperkirakan merupakan suatu protein yang didefinisikan sebagai fraksi besar gen dalam sekuen genom suatu organisme namun belum dikarakteristikan fungsinya. Gambar 14 Hasil BLASTX dengan entri sekuen nukleotida fragmen 832 pb yang diamplifikasi dengan primer A start /A stop. Berdasarkan hasil analisis homologi diketahui bahwa sekuen fragmen DNA sengon yang teramplifikasi menggunakan pasangan primer α-ai1 pada koloni terpilih bukan gen AAI. Begitupula yang terjadi dengan DNA sengon yang teramplifikasi menggunakan pasangan primer A start /A stop pada koloni terpilih bukan gen TI. Hasil ini diperoleh mungkin karena tidak semua koloni
49 35 transforman yang terbentuk dilakukan sekuensing sehingga masih memungkinkan bahwa gen target berada pada koloni yang lain. Kemungkinan yang lain adalah primer yang digunakan belum cocok untuk mengamplifikasi gen AAI maupun TI dari sengon. Kedua primer yang digunakan merupakan primer yang digunakan untuk amplifikasi gen AAI pada kopi transgenik dan gen TI pada Delonix regia. Aminingsih (2005) melaporkan bahwa amplifikasi DNA kakao (Theobroma cacao) dengan primer gen LEAFY dari Arabidopsis thaliana tidak menghasilkan fragmen gen LEAFY namun memberikan hasil positif jika menggunakan primer gen LEAFY dari Citrus sinensis. Hal ini menggambarkan bahwa gen LEAFY kakao mempunyai homologi yang rendah dengan arabidopsis sedangkan dengan Citrus sinensis mempunyai homologi yang tinggi, sehingga kalau menggunakan primer yang templatenya dari Citrus sinensis kemungkinan mendapatkan gen LEAFY dari kakao lebih besar. Demikian pula pada tanaman sengon membutuhkan primer yang berasal dari template yang sesuai, yaitu memiliki homologi yang tinggi dengan gen AAI dan TI pada sengon. Kajian lebih lanjut untuk kesesuaian primer dalam mengamplifikasi gen AAI dan gen TI pada sengon perlu dilakukan.
50 KESIMPULAN 1. Metode isolasi DNA genomik sengon menggunakan bufer CTAB yang dikombinasikan dengan penggunaan binding column dari GenElute plant Genomic DNA Miniprep Kit menghasilkan kualitas DNA terbaik, namun dalam kuantitas yang lebih kecil. 2. Primer hasil desain menggunakan program primer3 terhadap sekuen dengan nomor aksesi U dan EU tidak menghasilkan amplikon pada DNA sengon dalam proses PCR dengan suhu annealing 45 o C 62 o C 3. Hasil PCR menggunakan primer spesifik gen alfa amilase inhibitor (α-ai1) dan gen tripsin inhibitor (A start /A stop ) masing-masing menghasilkan dua ukuran amplikon yang berhasil diklon pada vektor pgem-t Easy. 4. Sekuen fragmen DNA yang diklon tidak homolog dengan gen alfa amilase inhibitor dan tripsin inhibitor yang ada pada bank gen. SARAN Upaya perbaikan dalam mendesain suatu primer spesifik perlu dilakukan untuk menghasilkan suatu primer spesifik yang tepat sehingga dapat digunakan dalam program PCR untuk mendeteksi secara tepat suatu gen. Sekuensing terhadap semua ukuran koloni transforman perlu dilakukan untuk memastikan ada atau tidaknya gen target hasil kloning.
51 37 DAFTAR PUSTAKA Abd-Elsalam KA Bioinformatic tools and guideline for PCR primer design. J African Journal of Biotech 2(5): Alphey L DNA Sequencing from Experimental, Methods to Bioinformatics. UK: Bios Scientific Publisher. Altschul SF, Madden TL, Schaffer AA, Zhang J, Zhang Z, Miller W, Lipman DJ Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. J Nuc Ac Res 25(17): Aminingsih T Identifikasi dan karakteristik fragmen DNA genomic kakao (Theobroma cacao L.) hasil PCR menggunakan primer heterologous LEAFY [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor. Atmosuseno BS Budidaya, Kegunaan, dan Prospek Sengon. Jakarta: Penebar Swadaya. Barbosa A, Albuquerque EVS, Silva MCM, Souza DSL, Oliveira OB, Valencia A, Rocha TL, Grossi-de-Sa MF α-amylase inhibitor-1 gen from Phaseolus vulgaris expressed in Coffea arabica plants inhibits α-amylases from the coffee berry borer pest. BMC Biotechnology 10:44. Brown TA An Introduction Gene Cloning and DNA Analysis. Ed ke-5. UK: Blackwell. Chawla HS Introduction to Plant Biotechnology. Ed ke-2. USA: Science Publishers,Inc. Claverie JM, Notredame C Bioinformatics for Dummies. Ed ke-2. Canada:. Wiley Publising. Dieffenbach CW, TMJ Lowe, GS Dveksler General concepts for PCR primer design; manual Supplement. Cold Spring Harbor Laboratory Press. [3 Mei 2010]. Graham CA, Hill AJM DNA Sequencing Protocols. Ed ke-2.vol:167. New Jersey: Humana Press. Hartati NS Konstruksi pustaka cdna sengon (Paraserianthes falcataria L.Nielsen) yang terinduksi oleh serangan hama boktor (Xystrosera festiva) [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor. Hidayat J Informasi singkat benih; Paraserianthes falcataria (L.) Nielsen. Direktorat Perbenihan Tanaman Hutan. Bandung.
52 38 Hindley J Laboratory Techniques in Biochemistry and Molecular Biology. Vol:10. Amsterdam: Elsevier Biomedical Press. Hung CH, Peng PH, Huang CC, Wang HL, Chen YJ, Chen YL, Chi LM Genomic and cdna Cloning, Characterization of Delonix regia Trypsin Inhibitor (DrTI) Gene,and Expression of DrTI in Escherichia coli. J Biosci Biotechnol Biochem 71(1): Husaeni EA, Haneda NF Infestation of Xystrocera festiva in Paraserianthes falcataria plantation in East Java,Indonesia. J of Tropical Forest Sci 22(4): Husaeni EA Xystrocera festiva Thoms (Cerambycidae,Coleoptera): Biologi dan Pengendaliannya Pada Hutan Tanaman Sengon. Bogor: IPB Press. Isda MN, Kasim M, Masyurdin, Chaidamsari T, Santoso J Kloning dan karakterisasi gen penyandi inhibitor proteinase dari kulit buah kakao. J Menara Perkebunan 76(2): Ismail I, Fong SL, Abdullah R, Chan KF, Zainal Z, Sidik NM, Zain CRCM Molecular and expression analysis of Cowpea trypsin inhibitor (CpTI) gene in transgenic Elaeis guineensis Jacq leaves. AJCS 4(1): Jaya AMS, Aswidinnoor H, Santoso D Deteksi dan analisis sekuen gen inhibitor proteinase pada beberapa klon kakao harapan tahan penggerek buah kakao dari Sulawesi Selatan. Menara Perkebunan 72(1):1-10. Kusriniati D. Setyowati E, Achmad U Pemanfaatan daun sengon (Albizia falcataria) sebagai pewarna kain sutera menggunakan mordan tawas dengan konsentrasi yang berbeda. J Teknobuga 1(1):7-14. Lodge J, Lund P, Minchin S Gene Cloning: Principles and Application. New York: Taylor and Francis. Lubec G, Sadat LA, Yang JW, John JPP Searching for hypothetical proteins: Theory and practice based upon original data and literature. J Progress in Neurobiology 77: Matsumoto, Irianto Ecology and control of albizzia borer, Xystocera festiva. [5 Mei 2010]. Mirkov TE, Wahlstrom JM, Hagiwara K, Finardi-Filho F, Kjemtrup S, Chrispeels MJ Evolutionary relationships among protein in the phytohemagglutinin-arcelin-α-amylase inhibitor family of the common bean and its relatives. J Plant Molecular Biol 26:
53 39 Morton RL, Schroeder HE, Bateman KS, Chrispeels MJ, Armnstrong E Bean α-amylase inhibitor-1 in transgenic peas (Pisum sativum) provides complete protection from pea weevil (Bruchus pisorum) under field conditions. Proc Natl Acad Sci USA 97(8): Muladno Teknologi Rekayasa Genetika. Ed ke-2. Bogor: IPB Press. Nair KSS Tropical Forest Insect Pests; Ecology, Impact, and Management. New York: Cambridge University Press. Orozco-Castillo C, Chalmers KJ, Waugh R, Powell W Diversity and selective gene introgression in coffee using RAPD markers. J Theor Appl Genet 87: Orwa C, Mutua A, Kindt R, Jamnadass R, Anthony S Paraserianthes falcataria. [5 Mei 2010]. Park DJ PCR Protocol. Ed ke-3. New York: Humana Press. Polaina J, MacCabe AP Industrial Enzymes; Structure, Function and Applications. Netherlands: Spinger. Promega Technical Manual; pgem-t and pgem-t Easy Vector System. USA: Promega. Rimbawanto A Pemuliaan tanaman dan ketahanan penyakit pada sengon. Makalah workshop penanggulangan serangan karat puru pada tanaman sengon 19 Nop Balai Besar Penelitian Bioteknologi dan Pemuliaan Tanaman Hutan Yogyakarta. Sambrook J, Maniatis T Molecular Cloning: A Laboratory Manual. New York: Cold Spring Harbour Laboratory Press. Shukla S, Arora R, Sharma HC Biological activity of soybean trypsin inhibitor and plant lectins against cotton bollworm/legume pod borer, Helicoverpa armigera. Plant Biotech 22(1): 1-6. Siarudin M, Suhaendah E Uji pengaruh mikoriza dan cuka kayu terhadap pertumbuhan lima provenan sengon di persemaian. J Pemuliaan Tanaman Hutan 1(1). Siregar IZ, Yunanto T, Ratnasari J Kayu Sengon: Prospek Bisnis, Budidaya,Panen dan Pascapanen. Jakarta: Penebar Swadaya. Thompson JD, Higgins DG, Gibson TJ ClustalW: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice. J Nuc AC Res 22:
54 40 Wahyono TE, Tarigan N Uji patogenisitas agen hayati Beauveria bassiana dan Metarhizium anisopliae terhadap ulat serendang (Xystrocera festiva). Buletin Teknik Pertanian 12(1): Weising K, Nybom H, Wolff K, Kahl G DNA Fingerprinting in Plants; Principles, Methods, and Apllications. Ed ke-2. Boca Raton: CRC Press. Winarni I Studi keragaman tripsin inhibitor dan keragaman genetic isoenzim pohon plus sengon (Paraserianthes falcataria (L) Nielsen) pada hutan rakyat di Jawa Barat [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor. Wiyono S Perubahan iklim dan ledakan hama dan penyakit tanaman. Makalah seminar sehari tentang keanekaragaman hayati ditengah perubhaan iklim. Jakarta Xu D, Xue Q, McElroy D, Mawal Y, Hilder VA, Wu R Constitutive expression of a cowpea trypsin inhibitor gene, CpTi, in transgenic rice plants confers resistance to two major rice insect pests. J Molecular Breeding 2:
55 Lampiran 1 Sekuen nukleotida gen alfa amilase inhibitor untuk desain primer 41
TINJAUAN PUSTAKA Risalah Sengon ( Paraserianthes falcataria
 5 TINJAUAN PUSTAKA Risalah Sengon (Paraserianthes falcataria) Sengon tergolong famili Leguminosae (Mimosaceae) dan dikenal dengan berbagai nama lokal seperti Jeungjing (Sunda), Sengon laut (Jawa), Tedehu
5 TINJAUAN PUSTAKA Risalah Sengon (Paraserianthes falcataria) Sengon tergolong famili Leguminosae (Mimosaceae) dan dikenal dengan berbagai nama lokal seperti Jeungjing (Sunda), Sengon laut (Jawa), Tedehu
HASIL DAN PEMBAHASAN Isolasi DNA Genomik Sengon
 HASIL DAN PEMBAHASAN Isolasi DNA Genomik Sengon DNA genomik sengon diisolasi dari daun muda pohon sengon. Hasil uji integritas DNA metode 1, metode 2 dan metode 3 pada gel agarose dapat dilihat pada Gambar
HASIL DAN PEMBAHASAN Isolasi DNA Genomik Sengon DNA genomik sengon diisolasi dari daun muda pohon sengon. Hasil uji integritas DNA metode 1, metode 2 dan metode 3 pada gel agarose dapat dilihat pada Gambar
Pembuatan Media Kultur Bakteri Pemanenan sel bakteri. Isolasi DNA kromosom bakteri. Kloning DNA
 LAMPIRAN 15 15 Lampiran 1 Tahapan penelitian Pembuatan Media Kultur Bakteri Pemanenan sel bakteri Isolasi DNA kromosom bakteri Pemotongan DNA dengan enzim restriksi Kloning DNA Isolasi DNA plasmid hasil
LAMPIRAN 15 15 Lampiran 1 Tahapan penelitian Pembuatan Media Kultur Bakteri Pemanenan sel bakteri Isolasi DNA kromosom bakteri Pemotongan DNA dengan enzim restriksi Kloning DNA Isolasi DNA plasmid hasil
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian yang digunakan adalah penelitian dasar dengan metode deskriptif (Nazir, 1983). B. Populasi dan Sampel Populasi dalam penelitian ini adalah
BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian yang digunakan adalah penelitian dasar dengan metode deskriptif (Nazir, 1983). B. Populasi dan Sampel Populasi dalam penelitian ini adalah
ANALISA HASIL TRANSFORMASI DENGAN MENGGUNAKAN PCR KOLONI DAN RESTRIKSI
 1 ANALISA HASIL TRANSFORMASI DENGAN MENGGUNAKAN PCR KOLONI DAN RESTRIKSI PENDAHULUAN Polimerase Chain Reaction (PCR) PCR adalah suatu reaksi invitro untuk menggandakan jumlah molekul DNA pada target tertentu
1 ANALISA HASIL TRANSFORMASI DENGAN MENGGUNAKAN PCR KOLONI DAN RESTRIKSI PENDAHULUAN Polimerase Chain Reaction (PCR) PCR adalah suatu reaksi invitro untuk menggandakan jumlah molekul DNA pada target tertentu
BAB III METODE PENELITIAN Bagan Alir Penelitian ini secara umum dapat digambarkan pada skema berikut:
 BAB III METODE PENELITIAN Tahapan-tahapan yang dilakukan dalam penelitian ini adalah: pengumpulan sampel, lisis terhadap sampel mtdna yang telah diperoleh, amplifikasi daerah HVI mtdna sampel dengan menggunakan
BAB III METODE PENELITIAN Tahapan-tahapan yang dilakukan dalam penelitian ini adalah: pengumpulan sampel, lisis terhadap sampel mtdna yang telah diperoleh, amplifikasi daerah HVI mtdna sampel dengan menggunakan
BAB 4 HASIL PERCOBAAN DAN BAHASAN. Oligonukleotida sintetis daerah pengkode IFNα2b sintetis dirancang menggunakan
 BAB 4 HASIL PERCOBAAN DAN BAHASAN Oligonukleotida sintetis daerah pengkode IFNα2b sintetis dirancang menggunakan program komputer berdasarkan metode sintesis dua arah TBIO, dimana proses sintesis daerah
BAB 4 HASIL PERCOBAAN DAN BAHASAN Oligonukleotida sintetis daerah pengkode IFNα2b sintetis dirancang menggunakan program komputer berdasarkan metode sintesis dua arah TBIO, dimana proses sintesis daerah
BAB III METODE PENELITIAN
 39 BAB III METODE PENELITIAN A. Desain Penelitian Penelitian yang dilakukan merupakan penelitian deskriptif. Penelitian membuat deskripsi secara sistematis, faktual dan akurat mengenai fakta-fakta dan
39 BAB III METODE PENELITIAN A. Desain Penelitian Penelitian yang dilakukan merupakan penelitian deskriptif. Penelitian membuat deskripsi secara sistematis, faktual dan akurat mengenai fakta-fakta dan
BAB III METODE PENELITIAN. Jenis penelitian yang dilakukan termasuk dalam penelitian dasar yang. dilakukan dengan metode deskriptif (Nazir, 1998).
 BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian yang dilakukan termasuk dalam penelitian dasar yang dilakukan dengan metode deskriptif (Nazir, 1998). B. Populasi dan Sampel 1. Populasi yang
BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian yang dilakukan termasuk dalam penelitian dasar yang dilakukan dengan metode deskriptif (Nazir, 1998). B. Populasi dan Sampel 1. Populasi yang
FAKULTAS BIOLOGI LABORATORIUM GENETIKA & PEMULIAAN INSTRUKSI KERJA UJI
 ISOLASI TOTAL DNA TUMBUHAN DENGAN KIT EKSTRAKSI DNA PHYTOPURE Halaman : 1 dari 5 1. RUANG LINGKUP Metode ini digunakan untuk mengisolasi DNA dari sampel jaringan tumbuhan, dapat dari daun, akar, batang,
ISOLASI TOTAL DNA TUMBUHAN DENGAN KIT EKSTRAKSI DNA PHYTOPURE Halaman : 1 dari 5 1. RUANG LINGKUP Metode ini digunakan untuk mengisolasi DNA dari sampel jaringan tumbuhan, dapat dari daun, akar, batang,
3 METODOLOGI 3.1 Waktu dan Tempat 3.2 Bahan dan Alat
 3 METODOLOGI 3.1 Waktu dan Tempat Penelitian Autentikasi Bahan Baku Ikan Tuna (Thunnus sp.) dalam Rangka Peningkatan Keamanan Pangan dengan Metode Berbasis DNA dilaksanakan pada bulan Januari sampai dengan
3 METODOLOGI 3.1 Waktu dan Tempat Penelitian Autentikasi Bahan Baku Ikan Tuna (Thunnus sp.) dalam Rangka Peningkatan Keamanan Pangan dengan Metode Berbasis DNA dilaksanakan pada bulan Januari sampai dengan
BAB 4 HASIL PERCOBAAN DAN PEMBAHASAN
 BAB 4 HASIL PERCOBAAN DAN PEMBAHASAN Sebelum melakukan PCR, terlebih dahulu dilakukan perancangan primer menggunakan program DNA Star. Pemilihan primer dilakukan dengan mempertimbangkan parameter spesifisitas,
BAB 4 HASIL PERCOBAAN DAN PEMBAHASAN Sebelum melakukan PCR, terlebih dahulu dilakukan perancangan primer menggunakan program DNA Star. Pemilihan primer dilakukan dengan mempertimbangkan parameter spesifisitas,
III. BAHAN DAN METODE
 III. BAHAN DAN METODE Tempat dan Waktu Penelitian dilakukan di Laboratorium BIORIN (Biotechnology Research Indonesian - The Netherlands) Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB. Penelitian
III. BAHAN DAN METODE Tempat dan Waktu Penelitian dilakukan di Laboratorium BIORIN (Biotechnology Research Indonesian - The Netherlands) Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB. Penelitian
KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN DIREKTORAT JENDERAL PENDIDIKAN MENENGAH DIREKTORAT PEMBINAAN SEKOLAH MENENGAH ATAS
 KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN DIREKTORAT JENDERAL PENDIDIKAN MENENGAH DIREKTORAT PEMBINAAN SEKOLAH MENENGAH ATAS Test Seleksi Calon Peserta International Biology Olympiad (IBO) 2014 2 8 September
KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN DIREKTORAT JENDERAL PENDIDIKAN MENENGAH DIREKTORAT PEMBINAAN SEKOLAH MENENGAH ATAS Test Seleksi Calon Peserta International Biology Olympiad (IBO) 2014 2 8 September
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Jenis Penelitian deskriptif. Jenis penelitian yang digunakan adalah penelitian dasar dengan metode B. Objek Penelitian Objek penelitian ini adalah sampel DNA koleksi hasil
BAB III METODE PENELITIAN A. Jenis Penelitian deskriptif. Jenis penelitian yang digunakan adalah penelitian dasar dengan metode B. Objek Penelitian Objek penelitian ini adalah sampel DNA koleksi hasil
TUGAS TERSTRUKTUR BIOTEKNOLOGI PERTANIAN VEKTOR DNA
 TUGAS TERSTRUKTUR BIOTEKNOLOGI PERTANIAN VEKTOR DNA Oleh: Gregorius Widodo Adhi Prasetyo A2A015009 KEMENTERIAN RISET TEKNOLOGI DAN PENDIDIKAN TINGGI UNIVERSITAS JENDERAL SOEDIRMAN FAKULTAS PERTANIAN PROGRAM
TUGAS TERSTRUKTUR BIOTEKNOLOGI PERTANIAN VEKTOR DNA Oleh: Gregorius Widodo Adhi Prasetyo A2A015009 KEMENTERIAN RISET TEKNOLOGI DAN PENDIDIKAN TINGGI UNIVERSITAS JENDERAL SOEDIRMAN FAKULTAS PERTANIAN PROGRAM
FAKULTAS BIOLOGI LABORATORIUM GENETIKA & PEMULIAAN INSTRUKSI KERJA UJI
 Halaman : 1 dari 5 ISOLASI TOTAL DNA HEWAN DENGAN KIT EKSTRAKSI DNA 1. RUANG LINGKUP Metode ini digunakan untuk mengisolasi DNA dari sampel jaringan hewan, dapat dari insang, otot, darah atau jaringan
Halaman : 1 dari 5 ISOLASI TOTAL DNA HEWAN DENGAN KIT EKSTRAKSI DNA 1. RUANG LINGKUP Metode ini digunakan untuk mengisolasi DNA dari sampel jaringan hewan, dapat dari insang, otot, darah atau jaringan
Pengujian DNA, Prinsip Umum
 Pengujian DNA, Prinsip Umum Pengujian berbasis DNA dalam pengujian mutu benih memang saat ini belum diregulasikan sebagai salah satu standar kelulusan benih dalam proses sertifikasi. Dalam ISTA Rules,
Pengujian DNA, Prinsip Umum Pengujian berbasis DNA dalam pengujian mutu benih memang saat ini belum diregulasikan sebagai salah satu standar kelulusan benih dalam proses sertifikasi. Dalam ISTA Rules,
LAPORAN PRAKTIKUM REKAYASA GENETIKA
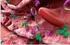 LAPORAN PRAKTIKUM REKAYASA GENETIKA LAPORAN IV (ISOLASI RNA DARI TANAMAN) KHAIRUL ANAM P051090031/BTK BIOTEKNOLOGI SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2010 0 ISOLASI RNA DARI TANAMAN TUJUAN Tujuan
LAPORAN PRAKTIKUM REKAYASA GENETIKA LAPORAN IV (ISOLASI RNA DARI TANAMAN) KHAIRUL ANAM P051090031/BTK BIOTEKNOLOGI SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2010 0 ISOLASI RNA DARI TANAMAN TUJUAN Tujuan
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Jenis penelitian Jenis penelitian ini adalah penelitian deskriptif yang mengangkat fenomena alam sebagai salah satu masalah dalam penelitian, sehingga dapat menerangkan arti
BAB III METODE PENELITIAN A. Jenis penelitian Jenis penelitian ini adalah penelitian deskriptif yang mengangkat fenomena alam sebagai salah satu masalah dalam penelitian, sehingga dapat menerangkan arti
BAB III METODE PENELITIAN. Secara garis besar langkah-langkah yang dilakukan dalam penelitian ini
 BAB III METODE PENELITIAN Secara garis besar langkah-langkah yang dilakukan dalam penelitian ini adalah: pengumpulan sampel; lisis terhadap sampel mtdna yang telah diperoleh; amplifikasi daerah D-loop
BAB III METODE PENELITIAN Secara garis besar langkah-langkah yang dilakukan dalam penelitian ini adalah: pengumpulan sampel; lisis terhadap sampel mtdna yang telah diperoleh; amplifikasi daerah D-loop
BAHAN DAN METODE Tempat dan Waktu Penelitian Bahan dan Alat
 12 BAHAN DAN METODE Tempat dan Waktu Penelitian Survei penyakit klorosis dan koleksi sampel tanaman tomat sakit dilakukan di sentra produksi tomat di daerah Cianjur, Cipanas, Lembang, dan Garut. Deteksi
12 BAHAN DAN METODE Tempat dan Waktu Penelitian Survei penyakit klorosis dan koleksi sampel tanaman tomat sakit dilakukan di sentra produksi tomat di daerah Cianjur, Cipanas, Lembang, dan Garut. Deteksi
BAB III METODE PENELITIAN. Penelitian ini merupakan penelitian eksperimental dengan 7 sampel dari 7
 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian ini merupakan penelitian eksperimental dengan 7 sampel dari 7 individu udang Jari yang diambil dari Segara Anakan Kabupaten Cilacap Jawa Tengah.
BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian ini merupakan penelitian eksperimental dengan 7 sampel dari 7 individu udang Jari yang diambil dari Segara Anakan Kabupaten Cilacap Jawa Tengah.
4. HASIL DAN PEMBAHASAN
 29 4. HASIL DAN PEMBAHASAN 4.1 Karakteristik isolat bakteri dari ikan tuna dan cakalang 4.1.1 Morfologi isolat bakteri Secara alamiah, mikroba terdapat dalam bentuk campuran dari berbagai jenis. Untuk
29 4. HASIL DAN PEMBAHASAN 4.1 Karakteristik isolat bakteri dari ikan tuna dan cakalang 4.1.1 Morfologi isolat bakteri Secara alamiah, mikroba terdapat dalam bentuk campuran dari berbagai jenis. Untuk
BAHAN DAN METODE Waktu dan Tempat Bahan Metode Isolasi C. gloeosporioides dari Buah Avokad
 15 BAHAN DAN METODE Waktu dan Tempat Penelitian dilaksanakan di Laboratorium Balai Besar Karantina Pertanian (BBKP) Tanjung Priok Wilayah Kerja Bogor, mulai bulan Oktober 2011 sampai Februari 2012. Bahan
15 BAHAN DAN METODE Waktu dan Tempat Penelitian dilaksanakan di Laboratorium Balai Besar Karantina Pertanian (BBKP) Tanjung Priok Wilayah Kerja Bogor, mulai bulan Oktober 2011 sampai Februari 2012. Bahan
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Jenis Penelitian Penelitian ini merupakan penelitian murni yang dilakukan dengan metode deskriptif, yaitu suatu metode penelitian untuk membuat deskripsi, gambaran atau lukisan
BAB III METODE PENELITIAN A. Jenis Penelitian Penelitian ini merupakan penelitian murni yang dilakukan dengan metode deskriptif, yaitu suatu metode penelitian untuk membuat deskripsi, gambaran atau lukisan
HASIL DAN PEMBAHASAN
 HASIL DAN PEMBAHASAN Amplifikasi ini membutuhkan primer spesifik (sekuen oligonukelotida khusus) untuk daerah tersebut. Primer biasanya terdiri dari 10-20 nukleotida dan dirancang berdasarkan daerah konservatif
HASIL DAN PEMBAHASAN Amplifikasi ini membutuhkan primer spesifik (sekuen oligonukelotida khusus) untuk daerah tersebut. Primer biasanya terdiri dari 10-20 nukleotida dan dirancang berdasarkan daerah konservatif
BAHAN DAN METODE. ditranskipsi dan produk translasi yang dikode oleh gen (Nasution 1999).
 4 ditranskipsi dan produk translasi yang dikode oleh gen (Nasution 1999). Polymerase Chain Reaction (PCR) PCR merupakan suatu reaksi in vitro untuk menggandakan jumlah molekul DNA pada target tertentu
4 ditranskipsi dan produk translasi yang dikode oleh gen (Nasution 1999). Polymerase Chain Reaction (PCR) PCR merupakan suatu reaksi in vitro untuk menggandakan jumlah molekul DNA pada target tertentu
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian ini adalah penelitian deskriptif yang mengangkat fenomena alam sebagai salah satu masalah dalam penelitian. Penelitian ini dapat menerangkan
BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian ini adalah penelitian deskriptif yang mengangkat fenomena alam sebagai salah satu masalah dalam penelitian. Penelitian ini dapat menerangkan
LAMPIRAN. Lampiran 1. Pembuatan Larutan Stok dan Buffer
 LAMPIRAN Lampiran 1. Pembuatan Larutan Stok dan Buffer A. LARUTAN STOK CTAB 5 % (100 ml) - Ditimbang NaCl sebanyak 2.0 gram - Ditimbang CTAB sebanyak 5.0 gram. - Dimasukkan bahan kimia ke dalam erlenmeyer
LAMPIRAN Lampiran 1. Pembuatan Larutan Stok dan Buffer A. LARUTAN STOK CTAB 5 % (100 ml) - Ditimbang NaCl sebanyak 2.0 gram - Ditimbang CTAB sebanyak 5.0 gram. - Dimasukkan bahan kimia ke dalam erlenmeyer
HASIL DAN PEMBAHASAN bp bp bp
 HASIL DAN PEBAHASAN Purifikasi dan Pengujian Produk PCR (Stilbena Sintase) Purifikasi ini menggunakan high pure plasmid isolation kit dari Invitrogen. Percobaan dilakukan sesuai dengan prosedur yang terdapat
HASIL DAN PEBAHASAN Purifikasi dan Pengujian Produk PCR (Stilbena Sintase) Purifikasi ini menggunakan high pure plasmid isolation kit dari Invitrogen. Percobaan dilakukan sesuai dengan prosedur yang terdapat
BAB III METODOLOGI PENELITIAN. Penelitian akan diawali dengan preparasi alat dan bahan untuk sampling
 16 BAB III METODOLOGI PENELITIAN Penelitian akan diawali dengan preparasi alat dan bahan untuk sampling sel folikel akar rambut. Sampel kemudian dilisis, diamplifikasi dan disekuensing dengan metode dideoksi
16 BAB III METODOLOGI PENELITIAN Penelitian akan diawali dengan preparasi alat dan bahan untuk sampling sel folikel akar rambut. Sampel kemudian dilisis, diamplifikasi dan disekuensing dengan metode dideoksi
BAB 4 HASIL PERCOBAAN DAN BAHASAN
 14 BAB 4 HASIL PERCOBAAN DAN BAHASAN Konfirmasi bakteri C. violaceum dan B. cereus dilakukan dengan pewarnaan Gram, identifikasi morfologi sel bakteri, sekuensing PCR 16s rdna dan uji kualitatif aktivitas
14 BAB 4 HASIL PERCOBAAN DAN BAHASAN Konfirmasi bakteri C. violaceum dan B. cereus dilakukan dengan pewarnaan Gram, identifikasi morfologi sel bakteri, sekuensing PCR 16s rdna dan uji kualitatif aktivitas
Pengertian TEKNOLOGI DNA REKOMBINAN. Cloning DNA. Proses rekayasa genetik pada prokariot. Pemuliaan tanaman konvensional: TeknologiDNA rekombinan:
 Materi Kuliah Bioteknologi Pertanian Prodi Agroteknologi Pertemuan Ke 9-10 TEKNOLOGI DNA REKOMBINAN Ir. Sri Sumarsih, MP. Email: Sumarsih_03@yahoo.com Weblog: Sumarsih07.wordpress.com Website: agriculture.upnyk.ac.id
Materi Kuliah Bioteknologi Pertanian Prodi Agroteknologi Pertemuan Ke 9-10 TEKNOLOGI DNA REKOMBINAN Ir. Sri Sumarsih, MP. Email: Sumarsih_03@yahoo.com Weblog: Sumarsih07.wordpress.com Website: agriculture.upnyk.ac.id
METODOLOGI PENELITIAN. Tempat dan Waktu Penelitian. Bahan dan Alat Penelitian
 14 METODOLOGI PENELITIAN Tempat dan Waktu Penelitian Tempat penelitian dilakukan di Laboratorium Unit Pelayanan Mikrobiologi Terpadu, Bagian Mikrobiologi Kesehatan, Departemen Ilmu Penyakit Hewan dan Kesehatan
14 METODOLOGI PENELITIAN Tempat dan Waktu Penelitian Tempat penelitian dilakukan di Laboratorium Unit Pelayanan Mikrobiologi Terpadu, Bagian Mikrobiologi Kesehatan, Departemen Ilmu Penyakit Hewan dan Kesehatan
BAB in. METODE PENELITIAN
 BAB in. METODE PENELITIAN Waktu Dan Tempat Penelitian Penelitian ini telah dilakukan dari April sampai November 2009 di laboratorium Biologi Molekular dan Rekayasa Genetika, Balai Penelitian Bioteknologi
BAB in. METODE PENELITIAN Waktu Dan Tempat Penelitian Penelitian ini telah dilakukan dari April sampai November 2009 di laboratorium Biologi Molekular dan Rekayasa Genetika, Balai Penelitian Bioteknologi
METODE PENELITIAN. Tabel 2. Rincian pengambilan contoh uji baik daun maupun kayu jati
 METODE PENELITIAN Waktu dan Tempat Dalam penelitian ini contoh uji yang digunakan dibedakan atas contoh uji daun dan kayu. Penelitian terhadap daun dan kayu dilakukan di Ruang Analisis Genetika, Laboratorium
METODE PENELITIAN Waktu dan Tempat Dalam penelitian ini contoh uji yang digunakan dibedakan atas contoh uji daun dan kayu. Penelitian terhadap daun dan kayu dilakukan di Ruang Analisis Genetika, Laboratorium
Teknik-teknik Dasar Bioteknologi
 Teknik-teknik Dasar Bioteknologi Oleh: TIM PENGAMPU Program Studi Agroteknologi Fakultas Pertanian Universitas Jember Tujuan Perkuliahan 1. Mahasiswa mengetahui macam-macam teknik dasar yang digunakan
Teknik-teknik Dasar Bioteknologi Oleh: TIM PENGAMPU Program Studi Agroteknologi Fakultas Pertanian Universitas Jember Tujuan Perkuliahan 1. Mahasiswa mengetahui macam-macam teknik dasar yang digunakan
BAB III METODE PENELITIAN. Penelitian ini merupakan penelitian yang dilakukan dengan metode
 16 BAB III METODE PENELITIAN A. Jenis Penelitian Penelitian ini merupakan penelitian yang dilakukan dengan metode deskriptif. Penelitian deskriptif adalah suatu metode penelitian untuk membuat deskripsi,
16 BAB III METODE PENELITIAN A. Jenis Penelitian Penelitian ini merupakan penelitian yang dilakukan dengan metode deskriptif. Penelitian deskriptif adalah suatu metode penelitian untuk membuat deskripsi,
BAB III BAHAN DAN METODE
 9 BAB III BAHAN DAN METODE 3.1 Waktu dan Tempat Penelitian Penelitian dilaksanakan pada bulan September 2011 sampai dengan Juli 2012. Kegiatan ekstraksi DNA sampai PCR-RFLP dilakukan di laboratorium Analisis
9 BAB III BAHAN DAN METODE 3.1 Waktu dan Tempat Penelitian Penelitian dilaksanakan pada bulan September 2011 sampai dengan Juli 2012. Kegiatan ekstraksi DNA sampai PCR-RFLP dilakukan di laboratorium Analisis
BAB III METODOLOGI PENELITIAN. Pada penelitian ini terdapat lima tahapan penelitian yang dilakukan yaitu
 BAB III METODOLOGI PENELITIAN Pada penelitian ini terdapat lima tahapan penelitian yang dilakukan yaitu pengumpulan sampel berupa akar rambut, ekstraksi mtdna melalui proses lisis akar rambut, amplifikasi
BAB III METODOLOGI PENELITIAN Pada penelitian ini terdapat lima tahapan penelitian yang dilakukan yaitu pengumpulan sampel berupa akar rambut, ekstraksi mtdna melalui proses lisis akar rambut, amplifikasi
BAB III METODE PENELITIAN. Dalam penelitian ini dilakukan lima tahap utama yang meliputi tahap
 BAB III METODE PENELITIAN Dalam penelitian ini dilakukan lima tahap utama yang meliputi tahap penyiapan templat mtdna, amplifikasi fragmen mtdna pada daerah D-loop mtdna manusia dengan teknik PCR, deteksi
BAB III METODE PENELITIAN Dalam penelitian ini dilakukan lima tahap utama yang meliputi tahap penyiapan templat mtdna, amplifikasi fragmen mtdna pada daerah D-loop mtdna manusia dengan teknik PCR, deteksi
BAHAN DAN METODE Waktu dan Tempat Bahan dan Alat
 12 BAHAN DAN METODE Waktu dan Tempat Penelitian ini dilakukan dari bulan April 2006 sampai dengan bulan April 2007. Penelitian dilakukan di rumah kaca, laboratorium Biologi Molekuler Seluler Tanaman, dan
12 BAHAN DAN METODE Waktu dan Tempat Penelitian ini dilakukan dari bulan April 2006 sampai dengan bulan April 2007. Penelitian dilakukan di rumah kaca, laboratorium Biologi Molekuler Seluler Tanaman, dan
HASIL DAN PEMBAHASAN. Uji Kualitatif dan Kuantitatif Hasil Isolasi RNA
 6 konsentrasinya. Untuk isolasi kulit buah kakao (outer pod wall dan inner pod wall) metode sama seperti isolasi RNA dari biji kakao. Uji Kualitatif dan Kuantitatif Hasil Isolasi RNA Larutan RNA hasil
6 konsentrasinya. Untuk isolasi kulit buah kakao (outer pod wall dan inner pod wall) metode sama seperti isolasi RNA dari biji kakao. Uji Kualitatif dan Kuantitatif Hasil Isolasi RNA Larutan RNA hasil
BAB III. METODOLOGI PENELITIAN. Pengambilan sampel. Penyiapan templat mtdna dengan metode lisis sel
 16 BAB III. METODOLOGI PENELITIAN Bab ini menggambarkan tahapan penelitian yang terdiri dari pengambilan sampel, penyiapan templat mtdna dengan metode lisis sel, amplifikasi D-loop mtdna dengan teknik
16 BAB III. METODOLOGI PENELITIAN Bab ini menggambarkan tahapan penelitian yang terdiri dari pengambilan sampel, penyiapan templat mtdna dengan metode lisis sel, amplifikasi D-loop mtdna dengan teknik
URAIAN MATERI 1. Pengertian dan prinsip kloning DNA Dalam genom sel eukariotik, gen hanya menempati sebagian kecil DNA kromosom, selain itu merupakan
 URAIAN MATERI 1. Pengertian dan prinsip kloning DNA Dalam genom sel eukariotik, gen hanya menempati sebagian kecil DNA kromosom, selain itu merupakan sekuen non kode (sekuen yang tidak mengalami sintesis
URAIAN MATERI 1. Pengertian dan prinsip kloning DNA Dalam genom sel eukariotik, gen hanya menempati sebagian kecil DNA kromosom, selain itu merupakan sekuen non kode (sekuen yang tidak mengalami sintesis
MATERI DAN METODE. Kota Padang Sumatera Barat pada bulan Oktober Amplifikasi gen Growth
 III. MATERI DAN METODE 3.1 Waktu dan Tempat Pengambilan sampel darah domba dilakukan di Kecamatan Koto Tengah Kota Padang Sumatera Barat pada bulan Oktober 2012. Amplifikasi gen Growth Hormone menggunakan
III. MATERI DAN METODE 3.1 Waktu dan Tempat Pengambilan sampel darah domba dilakukan di Kecamatan Koto Tengah Kota Padang Sumatera Barat pada bulan Oktober 2012. Amplifikasi gen Growth Hormone menggunakan
BAB III METODE PENELITIAN. amplifikasi daerah HVI mtdna sampel dengan menggunakan teknik PCR;
 BAB III METODE PENELITIAN Secara garis besar, langkah-langkah yang dilakukan dalam penelitian ini adalah: pengumpulan sampel; lisis terhadap sampel mtdna yang telah diperoleh; amplifikasi daerah HVI mtdna
BAB III METODE PENELITIAN Secara garis besar, langkah-langkah yang dilakukan dalam penelitian ini adalah: pengumpulan sampel; lisis terhadap sampel mtdna yang telah diperoleh; amplifikasi daerah HVI mtdna
BAB 3 PERCOBAAN. Alat elektroforesis agarosa (Biorad), autoklaf, cawan Petri, GeneAid High Speed Plasmid
 BAB 3 PERCOBAAN 3.1 Alat Alat elektroforesis agarosa (Biorad), autoklaf, cawan Petri, GeneAid High Speed Plasmid Mini kit, inkubator goyang (GSL), jarum Ose bundar, kit GFX (GE Healthcare), kompor listrik
BAB 3 PERCOBAAN 3.1 Alat Alat elektroforesis agarosa (Biorad), autoklaf, cawan Petri, GeneAid High Speed Plasmid Mini kit, inkubator goyang (GSL), jarum Ose bundar, kit GFX (GE Healthcare), kompor listrik
Kloning Domain KS dan Domain A ke dalam Sel E. coli DH5α. Analisis Bioinformatika. HASIL Penapisan Bakteri Penghasil Senyawa Antibakteri
 3 selama 1 menit, dan elongasi pada suhu 72 0 C selama 1 menit. Tahap terakhir dilakukan pada suhu 72 0 C selama 10 menit. Produk PCR dielektroforesis pada gel agarosa 1 % (b/v) menggunakan tegangan 70
3 selama 1 menit, dan elongasi pada suhu 72 0 C selama 1 menit. Tahap terakhir dilakukan pada suhu 72 0 C selama 10 menit. Produk PCR dielektroforesis pada gel agarosa 1 % (b/v) menggunakan tegangan 70
3. METODE PENELITIAN
 29 3. METODE PENELITIAN 3.1. Lokasi dan Waktu Penelitian Lokasi penelitian meliputi Laut Sulawesi, Selat Makassar, Teluk Bone, Laut Flores, Laut Banda, Teluk Tolo, Laut Maluku dan Teluk Tomini (Gambar
29 3. METODE PENELITIAN 3.1. Lokasi dan Waktu Penelitian Lokasi penelitian meliputi Laut Sulawesi, Selat Makassar, Teluk Bone, Laut Flores, Laut Banda, Teluk Tolo, Laut Maluku dan Teluk Tomini (Gambar
BAB XII. REAKSI POLIMERISASI BERANTAI
 BAB XII. REAKSI POLIMERISASI BERANTAI Di dalam Bab XII ini akan dibahas pengertian dan kegunaan teknik Reaksi Polimerisasi Berantai atau Polymerase Chain Reaction (PCR) serta komponen-komponen dan tahapan
BAB XII. REAKSI POLIMERISASI BERANTAI Di dalam Bab XII ini akan dibahas pengertian dan kegunaan teknik Reaksi Polimerisasi Berantai atau Polymerase Chain Reaction (PCR) serta komponen-komponen dan tahapan
MATERI DAN METODE. Lokasi dan Waktu. Materi. Tabel 1. Jumah Sampel Darah Ternak Sapi Indonesia Ternak n Asal Sapi Bali 2 4
 MATERI DAN METODE Lokasi dan Waktu Penelitian dilaksanakan di Laboratorium Genetika Molekuler Ternak, Bagian Pemuliaan dan Genetika Ternak, Fakultas Peternakan, Institut Pertanian Bogor. penelitian ini
MATERI DAN METODE Lokasi dan Waktu Penelitian dilaksanakan di Laboratorium Genetika Molekuler Ternak, Bagian Pemuliaan dan Genetika Ternak, Fakultas Peternakan, Institut Pertanian Bogor. penelitian ini
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian tentang Pengaruh Suhu Annealing pada Program PCR terhadap Keberhasilan Amplifikasi DNA Udang Jari (Metapenaeus elegans) Laguna Segara Anakan
BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian tentang Pengaruh Suhu Annealing pada Program PCR terhadap Keberhasilan Amplifikasi DNA Udang Jari (Metapenaeus elegans) Laguna Segara Anakan
HASIL DAN PEMBAHASAN
 HASIL DAN PEMBAHASAN Pemotongan Parsial dan Penyisipan Nukleotida pada Ujung Fragmen DNA Konstruksi pustaka genom membutuhkan potongan DNA yang besar. Untuk mendapatkan fragmen-fragmen dengan ukuran relatif
HASIL DAN PEMBAHASAN Pemotongan Parsial dan Penyisipan Nukleotida pada Ujung Fragmen DNA Konstruksi pustaka genom membutuhkan potongan DNA yang besar. Untuk mendapatkan fragmen-fragmen dengan ukuran relatif
LAMPIRAN. Lampiran 1. Deskripsi Pembuatan Larutan Stok dan Buffer
 LAMPIRAN Lampiran 1. Deskripsi Pembuatan Larutan Stok dan Buffer 1. Pembuatan Larutan Stok a. CTAB 5 % Larutan dibuat dengan melarutkan : - NaCl : 2.0 gr - CTAB : 5.0 gr - Aquades : 100 ml b. Tris HCl
LAMPIRAN Lampiran 1. Deskripsi Pembuatan Larutan Stok dan Buffer 1. Pembuatan Larutan Stok a. CTAB 5 % Larutan dibuat dengan melarutkan : - NaCl : 2.0 gr - CTAB : 5.0 gr - Aquades : 100 ml b. Tris HCl
BAB 3 PERCOBAAN 3.1 Bahan 3.2 Alat
 BAB 3 PERCOBAAN 3.1 Bahan Bahan yang digunakan memiliki kualitas pro analisis atau pro biologi molekular, yaitu : primer M. tuberculosis forward: 5 GGATCCGATGAGCAAGCTGATCGAA3 (Proligo) dan primer M. tuberculosis
BAB 3 PERCOBAAN 3.1 Bahan Bahan yang digunakan memiliki kualitas pro analisis atau pro biologi molekular, yaitu : primer M. tuberculosis forward: 5 GGATCCGATGAGCAAGCTGATCGAA3 (Proligo) dan primer M. tuberculosis
VISUALISASI HASIL PCR DENGAN METODE PCR LANGSUNG DAN TIDAK LANGSUNG PADA SAMPEL BAKTERI Pseudomonas fluorescens dan Ralstonia solanacearum
 VISUALISASI HASIL PCR DENGAN METODE PCR LANGSUNG DAN TIDAK LANGSUNG PADA SAMPEL BAKTERI Pseudomonas fluorescens dan Ralstonia solanacearum Pendahuluan Polymerase Chain Reaction (PCR) adalah suatu teknik
VISUALISASI HASIL PCR DENGAN METODE PCR LANGSUNG DAN TIDAK LANGSUNG PADA SAMPEL BAKTERI Pseudomonas fluorescens dan Ralstonia solanacearum Pendahuluan Polymerase Chain Reaction (PCR) adalah suatu teknik
Metode-metode dalam biologi molekuler : isolasi DNA, PCR, kloning, dan ELISA
 Metode-metode dalam biologi molekuler : isolasi DNA, PCR, kloning, dan ELISA Dr. Syazili Mustofa, M.Biomed Lektor mata kuliah ilmu biomedik Departemen Biokimia, Biologi Molekuler, dan Fisiologi Fakultas
Metode-metode dalam biologi molekuler : isolasi DNA, PCR, kloning, dan ELISA Dr. Syazili Mustofa, M.Biomed Lektor mata kuliah ilmu biomedik Departemen Biokimia, Biologi Molekuler, dan Fisiologi Fakultas
IV. HASIL DAN PEMBAHASAN
 IV. HASIL DAN PEMBAHASAN 4.1 Isolasi Fragmen DNA Penyandi CcGH Mature Plasmid pgem-t Easy yang mengandung cdna GH ikan mas telah berhasil diisolasi. Hal ini ditunjukkan dengan adanya pita DNA pada ukuran
IV. HASIL DAN PEMBAHASAN 4.1 Isolasi Fragmen DNA Penyandi CcGH Mature Plasmid pgem-t Easy yang mengandung cdna GH ikan mas telah berhasil diisolasi. Hal ini ditunjukkan dengan adanya pita DNA pada ukuran
HASIL DAN PEMBAHASAN
 HASIL DAN PEMBAHASAN Ekstraksi dan Purifikasi DNA Total DNA total yang diperoleh dalam penelitian bersumber dari darah dan bulu. Ekstraksi DNA yang bersumber dari darah dilakukan dengan metode phenolchloroform,
HASIL DAN PEMBAHASAN Ekstraksi dan Purifikasi DNA Total DNA total yang diperoleh dalam penelitian bersumber dari darah dan bulu. Ekstraksi DNA yang bersumber dari darah dilakukan dengan metode phenolchloroform,
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Jenis penelitian Jenis penelitian yang dilakukan adalah penelitian dasar dengan metode deskriptif (Nazir, 1988). B. Populasi dan sampel Populasi pada penelitian ini adalah
BAB III METODE PENELITIAN A. Jenis penelitian Jenis penelitian yang dilakukan adalah penelitian dasar dengan metode deskriptif (Nazir, 1988). B. Populasi dan sampel Populasi pada penelitian ini adalah
Identifikasi Gen Abnormal Oleh : Nella ( )
 Identifikasi Gen Abnormal Oleh : Nella (10.2011.185) Identifikasi gen abnormal Pemeriksaan kromosom DNA rekombinan PCR Kromosom waldeyer Kromonema : pita spiral yang tampak pada kromatid Kromomer : penebalan
Identifikasi Gen Abnormal Oleh : Nella (10.2011.185) Identifikasi gen abnormal Pemeriksaan kromosom DNA rekombinan PCR Kromosom waldeyer Kromonema : pita spiral yang tampak pada kromatid Kromomer : penebalan
VII. UJI EKSPRESI GEN TcAP1 (APETALA1 KAKAO) PADA TANAMAN MODEL. Abstrak
 VII. UJI EKSPRESI GEN TcAP1 (APETALA1 KAKAO) PADA TANAMAN MODEL Abstrak Pada berbagai spesies termasuk kakao, gen AP1 (APETALA1) diketahui sebagai gen penanda pembungaan yang mengendalikan terbentuknya
VII. UJI EKSPRESI GEN TcAP1 (APETALA1 KAKAO) PADA TANAMAN MODEL Abstrak Pada berbagai spesies termasuk kakao, gen AP1 (APETALA1) diketahui sebagai gen penanda pembungaan yang mengendalikan terbentuknya
4 Hasil dan Pembahasan
 4 Hasil dan Pembahasan Dalam bab ini akan dipaparkan hasil dari tahap-tahap penelitian yang telah dilakukan. Melalui tahapan tersebut diperoleh urutan nukleotida sampel yang positif diabetes dan sampel
4 Hasil dan Pembahasan Dalam bab ini akan dipaparkan hasil dari tahap-tahap penelitian yang telah dilakukan. Melalui tahapan tersebut diperoleh urutan nukleotida sampel yang positif diabetes dan sampel
ABSTRAK. ISOLASI, OPTIMASI AMPLIFIKASI DAN KLONING GEN phoq PADA Salmonella typhi
 ABSTRAK ISOLASI, OPTIMASI AMPLIFIKASI DAN KLONING GEN phoq PADA Salmonella typhi Patrisia Puspapriyanti, 2008. Pembimbing I : Ernawati A.Girirachman, Ph.D. Pembimbing II : Johan Lucianus, dr., M.Si. Salmonella
ABSTRAK ISOLASI, OPTIMASI AMPLIFIKASI DAN KLONING GEN phoq PADA Salmonella typhi Patrisia Puspapriyanti, 2008. Pembimbing I : Ernawati A.Girirachman, Ph.D. Pembimbing II : Johan Lucianus, dr., M.Si. Salmonella
3. METODE PENELITIAN
 19 3. METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian ini dilaksanakan pada bulan Maret sampai Juni 2010 di Laboratorium Mikrobiologi, Biokimia dan Bioteknologi Hasil Perairan Departemen Teknologi Hasil
19 3. METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian ini dilaksanakan pada bulan Maret sampai Juni 2010 di Laboratorium Mikrobiologi, Biokimia dan Bioteknologi Hasil Perairan Departemen Teknologi Hasil
II. MATERI DAN METODE. Tempat pengambilan sampel daun jati (Tectona grandis Linn. f.) dilakukan di
 II. MATERI DAN METODE 2.1 Waktu dan Tempat Penelitian Tempat pengambilan sampel daun jati (Tectona grandis Linn. f.) dilakukan di enam desa yaitu tiga desa di Kecamatan Grokgak dan tiga desa di Kecamatan
II. MATERI DAN METODE 2.1 Waktu dan Tempat Penelitian Tempat pengambilan sampel daun jati (Tectona grandis Linn. f.) dilakukan di enam desa yaitu tiga desa di Kecamatan Grokgak dan tiga desa di Kecamatan
Asam Asetat Glacial = 5,7 ml EDTA 0,5 M ph 8.0 = 10 ml Aquades ditambahkan hingga volume larutan 100 ml
 36 Lampiran 1. Pembuatan Larutan Stok dan Buffer A. Pembuatan Larutan Stok Tris HCL 1 M ph 8.0 (100 ml) : Timbang Tris sebanyak 12,114 g. Masukkan Tris ke dalam Erlenmeyer dan ditambahkan 80 ml aquades.
36 Lampiran 1. Pembuatan Larutan Stok dan Buffer A. Pembuatan Larutan Stok Tris HCL 1 M ph 8.0 (100 ml) : Timbang Tris sebanyak 12,114 g. Masukkan Tris ke dalam Erlenmeyer dan ditambahkan 80 ml aquades.
Gambar 1. Struktur organisasi promoter pada organisme prokariot [Sumber: University of Miami 2008: 1.]
![Gambar 1. Struktur organisasi promoter pada organisme prokariot [Sumber: University of Miami 2008: 1.] Gambar 1. Struktur organisasi promoter pada organisme prokariot [Sumber: University of Miami 2008: 1.]](/thumbs/63/49770631.jpg) Gambar 1. Struktur organisasi promoter pada organisme prokariot [Sumber: University of Miami 2008: 1.] Gambar 2. Struktur organisasi promoter pada organisme eukariot [Sumber: Gilbert 1997: 1.] Gambar 3.
Gambar 1. Struktur organisasi promoter pada organisme prokariot [Sumber: University of Miami 2008: 1.] Gambar 2. Struktur organisasi promoter pada organisme eukariot [Sumber: Gilbert 1997: 1.] Gambar 3.
3 Metodologi Penelitian
 3 Metodologi Penelitian 3.1 Alat Penelitian ini dilakukan di Laboratorium Penelitian Biokimia, Program Studi Kimia, Institut Teknologi Bandung. Peralatan yang digunakan pada penelitian ini diantaranya
3 Metodologi Penelitian 3.1 Alat Penelitian ini dilakukan di Laboratorium Penelitian Biokimia, Program Studi Kimia, Institut Teknologi Bandung. Peralatan yang digunakan pada penelitian ini diantaranya
BAB III BAHAN DAN METODE
 BAB III BAHAN DAN METODE 3.1. Tempat dan Waktu Penelitian 3.1.1. Tempat Penelitian Penelitian dilaksanakan di Laboratorium Bioteknologi Perikanan dan Kelautan Fakultas Perikanan dan Ilmu Kelautan Universitas
BAB III BAHAN DAN METODE 3.1. Tempat dan Waktu Penelitian 3.1.1. Tempat Penelitian Penelitian dilaksanakan di Laboratorium Bioteknologi Perikanan dan Kelautan Fakultas Perikanan dan Ilmu Kelautan Universitas
BAB III METODE PENELITIAN. mengekstraksi DNA dari dari beberapa spesimen herbarium Rafflesia arnoldii
 21 BAB III METODE PENELITIAN 3.1 Jenis Penelitian Penelitian ini merupakan penelitian deskriptif kuantitatif untuk mengekstraksi DNA dari dari beberapa spesimen herbarium Rafflesia arnoldii R.Br dan Rafflesia
21 BAB III METODE PENELITIAN 3.1 Jenis Penelitian Penelitian ini merupakan penelitian deskriptif kuantitatif untuk mengekstraksi DNA dari dari beberapa spesimen herbarium Rafflesia arnoldii R.Br dan Rafflesia
BAHAN DAN METODE. Tempat dan Waktu Penelitian
 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilakukan di Laboratorium Kerjasama Bioteknologi Indonesia- Belanda (BIORIN) dan Laboratorium Biologi Molekuler dan Seluler Tanaman (BMST), Pusat
BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilakukan di Laboratorium Kerjasama Bioteknologi Indonesia- Belanda (BIORIN) dan Laboratorium Biologi Molekuler dan Seluler Tanaman (BMST), Pusat
III. METODE PENELITIAN
 III. METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian Penelitian ini dilaksanakan mulai bulan November 2007 hingga Juli 2009, bertempat di Laboratorium Reproduksi dan Genetika Organisme Akuatik Departemen
III. METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian Penelitian ini dilaksanakan mulai bulan November 2007 hingga Juli 2009, bertempat di Laboratorium Reproduksi dan Genetika Organisme Akuatik Departemen
LAPORAN II (ISOLASI DNA GENOM)
 LAPORAN PRAKTIKUM REKAYASA GENETIKA LAPORAN II (ISOLASI DNA GENOM) KHAIRUL ANAM P051090031/BTK BIOTEKNOLOGI SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2010 0 ISOLASI DNA GENOM TUJUAN 16s rrna. Praktikum
LAPORAN PRAKTIKUM REKAYASA GENETIKA LAPORAN II (ISOLASI DNA GENOM) KHAIRUL ANAM P051090031/BTK BIOTEKNOLOGI SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2010 0 ISOLASI DNA GENOM TUJUAN 16s rrna. Praktikum
BAHAN DAN METODE Tempat dan Waktu Bahan dan Alat Metode Penelitian Isolasi Aktinomiset
 BAHAN DAN METODE Tempat dan Waktu Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, dari bulan Februari sampai dengan
BAHAN DAN METODE Tempat dan Waktu Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, dari bulan Februari sampai dengan
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian tentang Karakterisasi genetik Udang Jari (Metapenaeus elegans De Man, 1907) hasil tangkapan dari Laguna Segara Anakan berdasarkan haplotipe
BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian tentang Karakterisasi genetik Udang Jari (Metapenaeus elegans De Man, 1907) hasil tangkapan dari Laguna Segara Anakan berdasarkan haplotipe
KATAPENGANTAR. Pekanbaru, Desember2008. Penulis
 KATAPENGANTAR Fuji syukut ke Hadirat Allah SWT. berkat rahmat dan izin-nya penulis dapat menyelesaikan skripsi yang beijudul "Skrining Bakteri Vibrio sp Penyebab Penyakit Udang Berbasis Teknik Sekuens
KATAPENGANTAR Fuji syukut ke Hadirat Allah SWT. berkat rahmat dan izin-nya penulis dapat menyelesaikan skripsi yang beijudul "Skrining Bakteri Vibrio sp Penyebab Penyakit Udang Berbasis Teknik Sekuens
Bab III Bahan dan Metode III.1 Bahan III. 2 Alat
 Bab III Bahan dan Metode III.1 Bahan Pada penelitian ini, sampel yang digunakan dalam penelitian, adalah cacing tanah spesies L. rubellus yang berasal dari peternakan cacing tanah lokal di Sekeloa, Bandung.
Bab III Bahan dan Metode III.1 Bahan Pada penelitian ini, sampel yang digunakan dalam penelitian, adalah cacing tanah spesies L. rubellus yang berasal dari peternakan cacing tanah lokal di Sekeloa, Bandung.
LAPORAN PRAKTIKUM REKAYASA GENETIKA
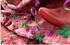 LAPORAN PRAKTIKUM REKAYASA GENETIKA LAPORAN V (HIBRIDISASI) KHAIRUL ANAM P051090031/BTK BIOTEKNOLOGI SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2010 0 HIBRIDISASI DOT BLOT TUJUAN blot) Praktikum ini
LAPORAN PRAKTIKUM REKAYASA GENETIKA LAPORAN V (HIBRIDISASI) KHAIRUL ANAM P051090031/BTK BIOTEKNOLOGI SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2010 0 HIBRIDISASI DOT BLOT TUJUAN blot) Praktikum ini
TINJAUAN PUSTAKA. Elaeidobius kamerunicus Faust. (Coleoptera : Curculionidae) Kumbang ini mengalami metamorfosis sempurna (holometabola), yakni
 TINJAUAN PUSTAKA Elaeidobius kamerunicus Faust. (Coleoptera : Curculionidae) Kumbang ini mengalami metamorfosis sempurna (holometabola), yakni siklus hidupnya terdiri dari telur larva pupa imago. E. kamerunicus
TINJAUAN PUSTAKA Elaeidobius kamerunicus Faust. (Coleoptera : Curculionidae) Kumbang ini mengalami metamorfosis sempurna (holometabola), yakni siklus hidupnya terdiri dari telur larva pupa imago. E. kamerunicus
REKAYASA GENETIKA. By: Ace Baehaki, S.Pi, M.Si
 REKAYASA GENETIKA By: Ace Baehaki, S.Pi, M.Si Dalam rekayasa genetika DNA dan RNA DNA (deoxyribonucleic Acid) : penyimpan informasi genetika Informasi melambangkan suatu keteraturan kebalikan dari entropi
REKAYASA GENETIKA By: Ace Baehaki, S.Pi, M.Si Dalam rekayasa genetika DNA dan RNA DNA (deoxyribonucleic Acid) : penyimpan informasi genetika Informasi melambangkan suatu keteraturan kebalikan dari entropi
YOHANES NOVI KURNIAWAN KONSTRUKSI DAERAH PENGKODE INTERFERON ALFA-2B (IFNα2B) DAN KLONINGNYA PADA Escherichia coli JM109
 YOHANES NOVI KURNIAWAN 10702026 KONSTRUKSI DAERAH PENGKODE INTERFERON ALFA-2B (IFNα2B) DAN KLONINGNYA PADA Escherichia coli JM109 Program Studi Sains dan Teknologi Farmasi INSTITUT TEKNOLOGI BANDUNG 2007
YOHANES NOVI KURNIAWAN 10702026 KONSTRUKSI DAERAH PENGKODE INTERFERON ALFA-2B (IFNα2B) DAN KLONINGNYA PADA Escherichia coli JM109 Program Studi Sains dan Teknologi Farmasi INSTITUT TEKNOLOGI BANDUNG 2007
ABSTRAK. OPTIMASI AMPLIFIKASI DAN KLONING GEN Chaperonin 60.1 PADA Mycobacterium tuberculosis
 ABSTRAK OPTIMASI AMPLIFIKASI DAN KLONING GEN Chaperonin 60.1 PADA Mycobacterium tuberculosis Nia Oktriviany, 2009 Pembimbing I : Ernawati Arifin Giri Rachman, Ph.D Pembimbing serta I : Debbie Sofie Retnoningrum,
ABSTRAK OPTIMASI AMPLIFIKASI DAN KLONING GEN Chaperonin 60.1 PADA Mycobacterium tuberculosis Nia Oktriviany, 2009 Pembimbing I : Ernawati Arifin Giri Rachman, Ph.D Pembimbing serta I : Debbie Sofie Retnoningrum,
BAB III METODE PENELITIAN. Jenis penelitian yang digunakan dalam penelitian ini adalah deskriptif.
 BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian yang digunakan dalam penelitian ini adalah deskriptif. Penelitian deskriptif adalah metode penelitian yang bertujuan untuk membuat gambaran
BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian yang digunakan dalam penelitian ini adalah deskriptif. Penelitian deskriptif adalah metode penelitian yang bertujuan untuk membuat gambaran
Bab IV Hasil dan Pembahasan
 32 Bab IV Hasil dan Pembahasan Penggunaan α-amilase dalam beberapa sektor industri mengalami peningkatan dan sekarang ini banyak diperlukan α-amilase dengan sifat yang khas dan mempunyai kemampuan untuk
32 Bab IV Hasil dan Pembahasan Penggunaan α-amilase dalam beberapa sektor industri mengalami peningkatan dan sekarang ini banyak diperlukan α-amilase dengan sifat yang khas dan mempunyai kemampuan untuk
METODE PENELITIAN. Tabel 1 Sampel yang digunakan dalam penelitian
 12 METODE PEELITIA Waktu dan Tempat Penelitian dilaksanakan pada bulan Mei sampai dengan April 2010, bertempat di Bagian Fungsi Hayati dan Perilaku Hewan, Departemen Biologi, Fakultas Matematika dan Ilmu
12 METODE PEELITIA Waktu dan Tempat Penelitian dilaksanakan pada bulan Mei sampai dengan April 2010, bertempat di Bagian Fungsi Hayati dan Perilaku Hewan, Departemen Biologi, Fakultas Matematika dan Ilmu
III. Bahan dan Metode
 III. Bahan dan Metode A. Waktu dan Tempat Penelitian Penelitian ini dilaksanakan selama 3 bulan dari bulan Mei-Juli 2011 yang dilakukan di LPPT UGM Yogyakarta. B. Bahan Penelitian Sampel yang digunakan
III. Bahan dan Metode A. Waktu dan Tempat Penelitian Penelitian ini dilaksanakan selama 3 bulan dari bulan Mei-Juli 2011 yang dilakukan di LPPT UGM Yogyakarta. B. Bahan Penelitian Sampel yang digunakan
METODOLOGI. Gambar 1 Bahan tanaman : (a) Tetua IR64; (b) tetua Hawarabunar, dan (c) F 1 (IRxHawarabunar) c a b
 METODOLOGI Waktu dan Tempat Penelitian ini dilakukan dua tahap yaitu penanaman padi dan analisis fisiologi dan marka molekuler. Penanaman padi secara gogo pada tanah masam dilakukan di rumah kaca Cikabayan
METODOLOGI Waktu dan Tempat Penelitian ini dilakukan dua tahap yaitu penanaman padi dan analisis fisiologi dan marka molekuler. Penanaman padi secara gogo pada tanah masam dilakukan di rumah kaca Cikabayan
MATERI DAN METODE. Materi
 MATERI DAN METODE Lokasi dan Waktu Penelitian dilaksanakan di Laboratorium Genetika Molekuler Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan IPB dan Laboratorium Terpadu,
MATERI DAN METODE Lokasi dan Waktu Penelitian dilaksanakan di Laboratorium Genetika Molekuler Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan IPB dan Laboratorium Terpadu,
BAB IV. HASIL DAN PEMBAHASAN
 BAB IV. HASIL DAN PEMBAHASAN Amplifikasi PCR Pada penelitian konstruksi gen harus mempertimbangkan dua hal yaitu urutan nukleotida gen yang akan dikonstruksi dan vektor ekspresi yang akan digunakan. Pada
BAB IV. HASIL DAN PEMBAHASAN Amplifikasi PCR Pada penelitian konstruksi gen harus mempertimbangkan dua hal yaitu urutan nukleotida gen yang akan dikonstruksi dan vektor ekspresi yang akan digunakan. Pada
BAB IV HASIL DAN PEMBAHASAN. A. ISOLASI DNA GENOM PADI (Oryza sativa L.) KULTIVAR ROJOLELE,
 BAB IV HASIL DAN PEMBAHASAN A. ISOLASI DNA GENOM PADI (Oryza sativa L.) KULTIVAR ROJOLELE, NIPPONBARE, DAN BATUTEGI Isolasi DNA genom padi dari organ daun padi (Oryza sativa L.) kultivar Rojolele, Nipponbare,
BAB IV HASIL DAN PEMBAHASAN A. ISOLASI DNA GENOM PADI (Oryza sativa L.) KULTIVAR ROJOLELE, NIPPONBARE, DAN BATUTEGI Isolasi DNA genom padi dari organ daun padi (Oryza sativa L.) kultivar Rojolele, Nipponbare,
BAB 3 METODOLOGI PENELITIAN
 20 BAB 3 METODOLOGI PENELITIAN 3.1. Desain Penelitian Penelitian ini bersifat deskriptif cross sectional molekuler. Data yang diperoleh berasal dari pemeriksaan langsung yang dilakukan peneliti sebanyak
20 BAB 3 METODOLOGI PENELITIAN 3.1. Desain Penelitian Penelitian ini bersifat deskriptif cross sectional molekuler. Data yang diperoleh berasal dari pemeriksaan langsung yang dilakukan peneliti sebanyak
MATERI DAN METODE. Lokasi dan Waktu. Materi
 MATERI DAN METODE Lokasi dan Waktu Penelitian ini dilaksanakan di Laboratorium Genetika Molekuler, Bagian Pemuliaan dan Genetika Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan,
MATERI DAN METODE Lokasi dan Waktu Penelitian ini dilaksanakan di Laboratorium Genetika Molekuler, Bagian Pemuliaan dan Genetika Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan,
HASIL DAN PEMBAHASAN. Hasil konfirmasi dicek dengan elektroforesis gel agarosa 1%.
 reaction mix pada tabung mikro, kemudian program PCR dilanjutkan kembali dengan program PCR biasa: 94 o C selama 30 detik, 55 o C selama 1 menit, dan 72 o C selama 2 menit. Hasil konfirmasi dicek dengan
reaction mix pada tabung mikro, kemudian program PCR dilanjutkan kembali dengan program PCR biasa: 94 o C selama 30 detik, 55 o C selama 1 menit, dan 72 o C selama 2 menit. Hasil konfirmasi dicek dengan
BAHAN DAN METODE. Produksi Protein Rekombinan Hormon Pertumbuhan (rgh)
 11 BAHAN DAN METODE Penelitian ini terdiri atas 2 tahapan utama, yaitu produksi protein rekombinan hormon pertumbuhan (rgh) dari ikan kerapu kertang, ikan gurame, dan ikan mas, dan uji bioaktivitas protein
11 BAHAN DAN METODE Penelitian ini terdiri atas 2 tahapan utama, yaitu produksi protein rekombinan hormon pertumbuhan (rgh) dari ikan kerapu kertang, ikan gurame, dan ikan mas, dan uji bioaktivitas protein
BAB III METODOLOGI PENELITIAN. Jenis penelitian yang digunakan adalah penelitian dasar dengan metode
 24 BAB III METODOLOGI PENELITIAN A. Jenis Penelitian Jenis penelitian yang digunakan adalah penelitian dasar dengan metode penelitian deskriptif. B. Objek Penelitian Empat spesies burung anggota Famili
24 BAB III METODOLOGI PENELITIAN A. Jenis Penelitian Jenis penelitian yang digunakan adalah penelitian dasar dengan metode penelitian deskriptif. B. Objek Penelitian Empat spesies burung anggota Famili
POLYMERASE CHAIN REACTION (PCR)
 POLYMERASE CHAIN REACTION (PCR) Disusun oleh: Hanif Wahyuni (1210411003) Prayoga Wibhawa Nu Tursedhi Dina Putri Salim (1210412032) (1210413031) SEJARAH Teknik ini dirintis oleh Kary Mullis pada tahun 1985
POLYMERASE CHAIN REACTION (PCR) Disusun oleh: Hanif Wahyuni (1210411003) Prayoga Wibhawa Nu Tursedhi Dina Putri Salim (1210412032) (1210413031) SEJARAH Teknik ini dirintis oleh Kary Mullis pada tahun 1985
BAB III BAHAN DAN METODE
 BAB III BAHAN DAN METODE 3.. Tempat dan Waktu Tempat penelitian analisis DNA dilakukan di Common Laboratory SEAMEO BIOTROP dan laboratorium Silvikultur Fakultas Kehutanan Institut Pertanian Bogor. Penelitian
BAB III BAHAN DAN METODE 3.. Tempat dan Waktu Tempat penelitian analisis DNA dilakukan di Common Laboratory SEAMEO BIOTROP dan laboratorium Silvikultur Fakultas Kehutanan Institut Pertanian Bogor. Penelitian
