Laporan Kimia Fisik KI-3141
|
|
|
- Irwan Kartawijaya
- 6 tahun lalu
- Tontonan:
Transkripsi
1 Laporan Kimia Fisik KI-3141 PERCOBAAN M-2 PENENTUAN LAJU REAKSI DAN TETAPAN LAJU REAKSI Nama : Kartika Trianita NIM : Kelompok : 2 Tanggal Percobaan : 2 November 2012 Tanggal Laporan : 9 November 2012 Asisten : Liany Bella Laboratorium Kimia Fisik Program Studi Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Teknologi Bandung 2012
2 Penentuan Laju Reaksi dan Tetapan Laju Reaksi I. Tujuan Percobaan 1. Membuktikan bahwa orde reaksi penyabunan etil asetat oleh ion hidroksida adalah Menentukan tetapan laju reaksi penyabunan etil asetat oleh ion hidroksida. II. Teori Dasar Kinetika kimia adalah salah satu ilmu yang membahas tentang laju atau kecepatan dan mekanisme reaksi. Secara kuantitatif kecepatan reaksi kimia ditentukan oleh orde reaksi, yaitu jumlah dari eksponen konsentrasi pada persamaan laju reaksi. Laju reaksi (Reaction Rate) atau kecepatan reaksi adalah perubahan konsentrasi konsentrasi pereaksi ataupun produk dalam satauan waktu. Laju suatu reaksi dapat dinyatakan sebagai laju berkurangnya konsentrasi suatu pereaksi, atau laju bertambahnya konsentrasi suatu produk. Konsentrasi baisanya di nyatakan dalam mol per liter, tetapi untuk reaksi fase gas, suatu tekanan atmosfer, milimeter merkurium, dapat di gunakan sebagai ganti konsentrasi. Orde reaksi adalah banyaknya faktor konsentrasi zat reaktan yang mempengaruhi kecepatan reaksi. Penentuan orde reaksi tidak dapat diturunkan dari persamaan reaksi tetapi hanya dapat ditentukan berdasarkan percobaan. Suatu reaksi yang diturunkan secara eksperimen dinyatakan dengan rumus kecepatan reaksi: v = k [A] [B] 2 Persamaan tersebut mengandung pengertian reaksi orde 1 terhadap zat A dan merupakan reaksi orde 2 terhadap zat B. Secara keselurahan reaksi tersebut adalah reaksi orde 3. Tetapan k yang muncul disebut juga sebagai tetapan laju atau koefisien laju. Satuan tetapan atau koefisien laju bergantung pada orde reaksi. Ada beberapa cara untuk mengukur laju dari suatu reaksi. Sebagai contoh, jika gas dilepaskan dalam suatu reaksi. Kita dapat mengukurnya dengan menghitung volume gas yang dilepaskan permenit pada waktu tertentu selama reaksi berlangsung. Definisi laju ini dapat
3 diukur dengan satuan cm 3 s -1. Laju biasanya diukur dengan melihat beberapa cepat konsentrasi suatu reaktan berkurang pada waktu tertentu. Dalam percobaan ini, pada metode titrasi, laju reaksi ditentukan dari perubahan banyaknya jumlah basa yang bereaksi dengan etil asetat untuk menghasilkan produk. Konduktometri merupakan metode analisis kimia berdasarkan daya hantar listrik suatu larutan. Daya hantar listrik (L) suatu larutan bergantung pada jenis dan konsentrasi ion di dalam larutan. Daya hantar listrik berhubungan dengan pergerakan suatu ion di dalam larutan ion yang mudah bergerak mempunyai daya hantar listrik yang besar. Daya hantar listrik (L) merupakan kebalikan dari tahanan (R), sehingga daya hantar listrik mempunyai satuan ohm -1. Bila arus listrik dialirkan dalam suatu larutan mempunyai dua elektroda, maka daya hantar listrik (L) berbanding lurus dengan luas permukaan elektroda (A) dan berbanding terbalik dengan jarak kedua elektroda (l). L= l/r = k (A/ l) dengan k adalah daya hantar jenis dalam satuan ohm -1 cm - 1. Kuat lemahnya larutan elektrolit sangat ditentukan oleh partikel- partikel bermuatan di dalam larutan elektrolit. Larutan elektrolit akanmengalami ionisasi, dimana zat terlarutnya terurai menjadi ion positif dan negatif. Adanya muatan listrik inilah yang menyebabkan larutan memiliki daya hantar listrik. Proses ionisasi sangat penting untuk menunjukkan kemampuan daya hantarnya, semakin banyak zat yang terionisasi semakin kuat daya hantarnya. Demikian pula sebaliknya semakin sulit terionisasi semakin lemah daya hantar listriknya III. Data Pengamatan 1.Metode Titrasi [NaOH] = 0,0169 M [HCl] = 0,0205 M [etil asetat] = 0,02 M [KCl] = 0,1 M
4 Untuk vol. NaOH = vol. etil asetat = 50 ml t (menit) V titran (ml) 5 18, , , , ,5 Untuk vol. NaOH = 40 ml dan vol. etil asetat = 50 ml t (menit) V titran (ml) 5 18, , , , ,7 2.Metode Konduktometri Truang = 27 o C Nilai hantaran pada 40 o C L air L NaOH L KCl = 175 s/cm = 1753 s/cm = 12,22 ms/cm t (menit) Hantaran ( s/cm) Dipanaskan 70 o C lalu didinginkan 1308
5 c III. Pengolahan Data 1. Metode Titrasi Etilasetat : NaOH (50 ml : 50 ml) ( [ ] [ ] ) Vx = 0,05 ( ) = -0,1924 L x = [ ] x = = -0,0325 M a = [ ] = = 0,01 M b = [ ] = = 0,00845 M t (menit) V titran (L) V x (L) x (M) a (M) b (M) c = x/(a(a-x)) 10 0,184-0,1924-0,0325 0,01 0, , ,185-0,1924-0,0325 0,01 0, , ,198-0,1924-0,0325 0,01 0, , ,201-0,1924-0,0325 0,01 0, , ,215-0,1924-0,0325 0,01 0, ,4706 Titrasi 50 ml Etilasetat : 50 ml NaOH y = 2E-06x R² = t
6 c Dari kurva di atas, diperoleh persamaan garis y = x - 76,47 Maka, k = slope = Etilasetat : NaOH (60 ml : 40 ml) Dengan menggunakan cara yang sama, diperoleh hasil sebagai berikut. t (menit) V titran (ml) V x (L) x (M) a (M) b (M) c = [1/(a-b)]. ln[b(a-x)/a(b-x)] 5 18,7-0,2024-0, ,012 0, , ,5-0,2024-0, ,012 0, , ,6-0,2024-0, ,012 0, , ,5-0,2024-0, ,012 0, , ,7-0,2024-0, ,012 0, , Titrasi 60 ml Etilasetat : 40 ml NaOH y = 4E-05x R² = t Dari kurva di atas, diperoleh persamaan garis y = x - 86,55 Maka, k = slope = Metode Konduktometri L sel = + L KCl L sel = 0,175 ms/cm + 12,22 ms/cm = 12,395 ms/cm K sel = = = 12,7866
7 (1/a)(Lo-Lt/Lt-Lc) t (menit) L o (ms/cm) L t (ms/cm) L c (ms/cm) a (1/a)(L o -L t /L t -L c ) 5 1,753 1,531 1,308 0,01 99, ,753 1,522 1,308 0,01 107, ,753 1,485 1,308 0,01 151, ,753 1,438 1,308 0,01 242, ,753 1,402 1,308 0,01 373, y = x R² = Konduktometri t Dari kurva di atas diperoleh persamaan garis y = 5,610x + 54,65 k = slope = 5,610
8 IV. Pembahasan Pada percobaan ini dibuktikan bahwa orde reaksi penyabunan etil asetat oleh ion hidroksida adalah 2, serta ditentukan nilai tetapan laju reaksi tersebut (k). Parameter yang terukur adalah pengurangan konsentrasi ester yang diukur dengan cara titrasi dengan basa kuat terhadap asam asetat yang dihasilkan serta waktu reaksi. Pada metode titrasi, larutan NaOH yang diberikan sudah distandardisasi sehingga dapat langsung digunakan. Larutan NaOH merupakan larutan baku sekunder yang tidak stabil dalam penyimpanannya sehingga perlu dilakukan standardisasi terlebih dahulu sebelum digunakan. Pada percobaan ini digunakan labu erlenmeyer tertutup yang bertujuan agar tidak terdapat kontaminasi terhadap larutan yang dianalisis. Selain itu juga agar suhu dalam labu dapat konstan lebih lama. Larutan NaOH dan etil asetat yang akan dicampurkan, sebelumnya perlu dilakukan penyamaan suhu terlebih dahulu. Pada percobaan ini digunakan suhu 40 o C. Hal ini dilakukan agar laju reaksi yang dihasilkan tidak mengalami perubahan yang besar. Laju reaksi dipengaruhi oleh suhu. Kenaikan suhu akan menyebabkan tumbukan antarpartikel berlangsung lebih cepat dikarenakan energi kinetiknya meningkat. Pengocokan dilakukan agar campuran kedua larutan homogen. Reaksi yang terjadi adalah sebagai berikut. CH 3 COOC 2 H 5 (aq) + NaOH (aq) CH 3 COONa (aq) + C 2 H 5 OH (aq) Campuran reaksi dimasukkan ke dalam 20 ml HCl sebelum dititrasi dengan NaOH. Pencampuran dengan HCl dimaksudkan untuk menetralkan campuran reaksi yang bersifat basa seperti ditunjukkan oleh reaksi di atas. Maka, yang dititrasi adalah kelebihan HCl yang tidak digunakan untuk menetralkan basa. Digunakan phenoftalein sebagai indikator. Oleh karena mulanya larutan yang dititrasi bersifat asam, maka perubahan warna yang diamati adalah dari tidak berwarna menjadi pink. Reaksi yang terjadi saat titrasi adalah sebagai berikut. NaOH (aq) + HCl (aq) NaCl (aq) + H 2 O (l) Hasil percobaan menunjukkan bahwa semakin lama, volume titran semakin besar. Hal ini berarti banyaknya HCl yang tidak digunakan untuk menetralkan larutan basa semakin banyak, artinya jumlah OH - yang digunakan untuk membentuk produk larutan basa semakin sedikit. Selain metode titrasi, dilakukan pula penentuan orde reaksi dan tetapan laju reaksi dengan metode konduktometri. Metode ini digunakan untuk mempelajari reaksi
9 yang melibatkan ion-ion yang memiliki daya hantar listrik cukup tinggi, seperti ion H + dan OH -. Daya hantar listrik suatu larutan bergantung pada jenis dan konsentrasi ion dalam larutan tersebut. Daya hantar listrik berhubungan dengan pergerakan suatu ion dalam larutan yang mudah bergerak. Daya hantar listrik merupakan kebalikan dari tahanan. Oleh karenanya daya hantar listrik memiliki satuan ohm -1. Hasil percobaan menunjukkan bahwa daya hantar listrik larutan menurun seiring dengan bertambahnya waktu. Hal ini terjadi dikarenakan selama percobaan terjadi penggantian ion OH - dari larutan dengan ion CH3COO - seperti ditunjukkan pada reaksi sebelumnya. Semakin bertambahnya waktu, maka semakin banyak penggantian ion OH - dari larutan dengan ion CH 3 COO -. Ion OH yang awalnya memiliki nilai hantaran yang besar jumlahnya menjadi lebih sedikit, sedangkan jumlah CH3COO- menjadi lebih banyak sehingga nilai hantaran larutan menjadi lebih kecil karena ch3coo- memiliki nilai hantaran yang lebih kecil. Nilai tetapan laju reaksi yang diperoleh dari metode titrasi dengan metode konduktometri memberikan hasil yang berbeda. Hal ini bisa terjadi karena prinsip keduanya berbeda. Metode konduktometri lebih baik dibandingkan metode titrasi. Metoda konduktometri didasarkan pada adanya ion-ion dalam larutan yang dapat menghantarkan listrik sehingga hanya dilakukan pengukuran nilai hantaran, tidak menggunakan indikator. Sedangkan metode titrasi berdasarkan pada titik akhir titrasi yang ditunjukkan oleh perubahan warna larutan. Metode titrasi ini kurang akurat dikarenakan penentuan titik akhir titrasi yang tidak jelas. Kesalahan pada hasil percobaan dapat terjadi disebabkan suhu larutan tidak benar2 konstan pada 40oC. Jika tidak dilakukan pada suhu konstan, maka hasil yang diperoleh tidak hanya dipengaruhi konsentrasi, namun juga pada suhu larutan saat percobaan. Bila arus listrik dialirkan ke dalam suatu larutan melalui dua electrode, maka daya hantar listrik (G) berbanding lurus dengan luas bidang luas bidang electrode, maka daya hantar listrik (G) berbanding lurus dengan luas bidang electrode (A) dan berbanding terbalik dengan jarak kedua electrode (l). jadi, G= 1/R=k A/l Dimana k adalah daya hantar jenis dalam satuan ohm-1cm-1
10 V. Kesimpulan Orde reaksi penyabunan etil asetat oleh ion hidroksida terbukti merupakan reaksi orde 2 karena diperoleh kurva linier dengan nilai R 2 >0,9 atau mendekati 1. Sedangkan dengan metode titrasi tidak terbukti dikarenakan kurva yang diperoleh tidak linier (R 2 <0,9). Dengan metode titrasi, tetapan laju reaksi penyabunan etil asetat oleh ion hidroksida pada saat volume etil asetat sama dengan volume NaOH adalah , sedangkan pada saat volume etil asetat:naoh = 3:2 tetapan laju reaksi adalah Dengan metode konduktometri, tetapan laju reaksi saat volume etil asetat sama dengan NaOH sebesar 5,610. VI. Daftar Pustaka Daniels, et al Eksperimental Physical Chemistry, ed.7. Hal Findlay Practical Physical Chemistry, ed. 8. Hal 307 Shoemaker, et al Eksperiments in Physical Chemistry, ed. 3. Hal 3 (8 November 2012; 20.45) Saponifikasi-Etil-Asetat (8 November 2012; 20.55)
11 VII. LAMPIRAN Jawaban Pertanyaan 1. Kenyataan yang membuktikan bahwa reaksi penyabunan etil asetat ini adalah orde 2 dapat dilihat pada kurva yang diperoleh. Liniernya kurva yang memiliki nilai R 2 >0,9 atau mendekati 1 menunjukkan bahwa reaksi tersebut merupakan reaksi orde Turunan satuan-satuan SI untuk hantaran jenis dan hantaran molar. Hantaran jenis larutan ialah hantaran sebatang larutan yang panjangnya 1 meter dan luas penampang lintang 1 m 2. Maka untuk dua permukaan sejajar seluas A m 2 dan berjarah 1 m satu sama lain berlaku hubungan : L = к A/1 atau к = L 1/A К = [siemens][m] / [m 2 ] sehingga satuan к adalah siemens.m -1. Hantaran molar didefinisikan jika terdapat dua buah elektroda yang cukup luas dan sejajar dan berjarak 1 m, ditempatkan sejumlah larutan yang mengandung 1 mol elektrolit, dinyatakan dengan Λ. Λ= к / C dengan C adalah konsentrasi larutan dalam mol m-3 sehingga Λ = [siemens][m -1 ] / [mol][m -3 ] sehingga Λ memiliki satuan siemens.m 2.mol Akibat bila titrasi HCl tidak segera dilakukan, berarti titrasi dilakukan ketika suhunya sudah menurun. Hal ini akan mempengaruhi laju reaksi yang diperoleh menjadi lebih lambat karena pada suhu rendah energi kinetik kecil sehingga laju reaksi pun akan kecil. Seandainya titrasi harus ditunda sampai semua percobaan selesai, maka harus dilakukan pemanasan agar laju reaksi yang diperoleh lebih besar dan sesuai dengan harapan. 4. Tiga cara untuk menentukan orde reaksi adalah sebagai berikut. 1. Metode Integrasi Pada metode ini dc/dt ditentukan langsung dengan memplot konsentrasi terhadap waktu. Nilai tangen menunjukkan kecepatan pada daat t. Orde reaksi dan tetapan laju reaksi ditentukan dari kurva log v terhadap log C.
12 Masalah yang timbul dalam metode ini adalah adanya reaksi samping dan reaksi kebalikan yang dapat mempengaruhi hasil percobaan. Namun cara ini merupakan cara penentuan orde reaksi yang paling tetap. 2. Metode laju reaksi Awal (Initial Rates Method) Pada metode ini, masalah reaksi samping dan reaksi kebalikan dapat ditiadakan. Cara yang dilakukan adalah mengukur laju reaksi awal dengan konsentrasi awal reaktan yang berbeda-beda. 3. Metode waktu paruh Secara umum, untuk reaksi yang berorde n, waktu paruh sebanding dengan 1/Co n-1, dimana Co adalah konsentrasi awal reaktan. Data hasil percobaan dimasukkan ke dalam persamaan di atas, kemudian dibuat kurva yang berbentuk garis lurus dengan cara yang sama seperti pada metode integrasi. Seperti halnya pada metode integrasi, adanya reaksi samping mempengaruhi ketepatan metode ini. 5. Prinsip penentuan energi pengaktifan secara percobaan dan persamaanpersamaan yang digunakan. Energi pengaktifan dapat ditentukan secara ekperimen dengan menentukan nilai tetapan laju reaksi (k) pada berbagai suhu. Dengan mengalurkan ln k terhadap 1/T akan diperoleh kurva. Dari hasil regresi akan diperoleh persamaan garis linear dimana nilai dari kemiringan garis (gradien) sebanding dengan Ea/R sedangkan intersep sebanding dengan 1/A. Digunakan persamaan empiris Arhenius yaitu k = A e -Ea/RT sehingga ln k = -
LAPORAN PRAKTIKUM KIMIA FISIK KI3141 PERCOBAAN M-2 PENENTUAN ORDE REAKSI DAN TETAPAN LAJU REAKSI. : Ricky Iqbal Syahrudin.
 LAPORAN PRAKTIKUM KIMIA FISIK KI3141 PERCOBAAN M-2 PENENTUAN ORDE REAKSI DAN TETAPAN LAJU REAKSI Nama : Ricky Iqbal Syahrudin Nim : 10513013 Kelompok : 2 Hari/tanggal Praktikum : Kamis, 05 Oktober 2015
LAPORAN PRAKTIKUM KIMIA FISIK KI3141 PERCOBAAN M-2 PENENTUAN ORDE REAKSI DAN TETAPAN LAJU REAKSI Nama : Ricky Iqbal Syahrudin Nim : 10513013 Kelompok : 2 Hari/tanggal Praktikum : Kamis, 05 Oktober 2015
Laporan Kimia Fisik KI-3141
 Laporan Kimia Fisik KI-3141 PERCOBN M-1 KINETIK HLOGENSI SETON DENGN KTLISTOR SM Nama : Kartika Trianita NIM : 1517 Kelompok : 2 Tanggal Percobaan : 22 Oktober 212 Tanggal Laporan : 2 November 212 sisten
Laporan Kimia Fisik KI-3141 PERCOBN M-1 KINETIK HLOGENSI SETON DENGN KTLISTOR SM Nama : Kartika Trianita NIM : 1517 Kelompok : 2 Tanggal Percobaan : 22 Oktober 212 Tanggal Laporan : 2 November 212 sisten
Gambar 2.1 Reaksi Saponifikasi tripalmitin
 I. JUDUL : Kinetika Reaksi Saponifikasi Etil Asetat II. TANGGAL PERCOBAAN : Rabu, 16 November 2011 III. TUJUAN : 1. Untuk memberikan gambaran bahwa reaksi penyabunan etil asetat oleh ion hidroksida adalah
I. JUDUL : Kinetika Reaksi Saponifikasi Etil Asetat II. TANGGAL PERCOBAAN : Rabu, 16 November 2011 III. TUJUAN : 1. Untuk memberikan gambaran bahwa reaksi penyabunan etil asetat oleh ion hidroksida adalah
Praktikum Kimia Fisika II Hidrolisis Etil Asetat dalam Suasana Asam Lemah & Asam Kuat
 I. Judul Percobaan Hidrolisis Etil Asetat dalam Suasana Asam Lemah & dalam Suasana Asam Kuat II. Tanggal Percobaan Senin, 8 April 2013 pukul 11.00 14.00 WIB III. Tujuan Percobaan Menentukan orde reaksi
I. Judul Percobaan Hidrolisis Etil Asetat dalam Suasana Asam Lemah & dalam Suasana Asam Kuat II. Tanggal Percobaan Senin, 8 April 2013 pukul 11.00 14.00 WIB III. Tujuan Percobaan Menentukan orde reaksi
Jason Mandela's Lab Report
 LAPORAN PRAKTIKUM KIMIA FISIK I PERCOBAAN-6 PENENTUAN KINETIKA ESTER SAPONIFIKASI DENGAN METODE KONDUKTOMETRI Disusun Oleh: Nama : Jason Mandela NIM :2014/365675/PA/16132 Partner Fakultas/Prodi Hari/Tanggal/Jam
LAPORAN PRAKTIKUM KIMIA FISIK I PERCOBAAN-6 PENENTUAN KINETIKA ESTER SAPONIFIKASI DENGAN METODE KONDUKTOMETRI Disusun Oleh: Nama : Jason Mandela NIM :2014/365675/PA/16132 Partner Fakultas/Prodi Hari/Tanggal/Jam
LAPORAN PRAKTIKUM KIMIA FISIKA II PENENTUAN LAJU REAKSI DAN TETAPAN LAJU
 LAPORAN PRAKTIKUM KIMIA FISIKA II PENENTUAN LAJU REAKSI DAN TETAPAN LAJU Nama NIM Prodi Anggota kelompok Disusun oleh: : Edi Siswanto : H13112071 : Kimia : 1. Alpius Suriadi 2. Gloria Sindora 3. Indri
LAPORAN PRAKTIKUM KIMIA FISIKA II PENENTUAN LAJU REAKSI DAN TETAPAN LAJU Nama NIM Prodi Anggota kelompok Disusun oleh: : Edi Siswanto : H13112071 : Kimia : 1. Alpius Suriadi 2. Gloria Sindora 3. Indri
LABORATORIUM ANALITIK INSTRUMEN
 LABORATORIUM ANALITIK INSTRUMEN SEMESTER GENAP TAHUN AJARAN 2012/2013 MODUL PEMBIMBING : Titrasi Konduktometri : Riniati S.Pd., M.Si. Tanggal Praktikum : 25 April 2013 Tanggal Penyerahan : 2 Mei Oleh :
LABORATORIUM ANALITIK INSTRUMEN SEMESTER GENAP TAHUN AJARAN 2012/2013 MODUL PEMBIMBING : Titrasi Konduktometri : Riniati S.Pd., M.Si. Tanggal Praktikum : 25 April 2013 Tanggal Penyerahan : 2 Mei Oleh :
LARUTAN PENYANGGA (BUFFER)
 LARUTAN PENYANGGA (BUFFER) Larutan penyangga Larutan penyangga atau larutan buffer adalah larutan yang ph-nya praktis tidak berubah walaupun kepadanya ditambahkan sedikit asam, sedikit basa, atau bila
LARUTAN PENYANGGA (BUFFER) Larutan penyangga Larutan penyangga atau larutan buffer adalah larutan yang ph-nya praktis tidak berubah walaupun kepadanya ditambahkan sedikit asam, sedikit basa, atau bila
KONDUKTOMETRI OLEH : AMANAH FIRDAUSA NOFITASARI KIMIA A
 KONDUKTOMETRI OLEH : AMANAH FIRDAUSA NOFITASARI KIMIA A 2011 11030234016 Pengertia n Konduktometri Metode analisis yang memanfaatkan pengukuran daya hantar listrik, yang dihasilkan dari sepasang elektroda
KONDUKTOMETRI OLEH : AMANAH FIRDAUSA NOFITASARI KIMIA A 2011 11030234016 Pengertia n Konduktometri Metode analisis yang memanfaatkan pengukuran daya hantar listrik, yang dihasilkan dari sepasang elektroda
PERCOBAAN POTENSIOMETRI (PENGUKURAN ph)
 PERCOBAAN POTENSIOMETRI (PENGUKURAN ph) I. Tujuan. Membuat kurva hubungan ph - volume pentiter 2. Menentukan titik akhir titrasi 3. Menghitung kadar zat II. Prinsip Prinsip potensiometri didasarkan pada
PERCOBAAN POTENSIOMETRI (PENGUKURAN ph) I. Tujuan. Membuat kurva hubungan ph - volume pentiter 2. Menentukan titik akhir titrasi 3. Menghitung kadar zat II. Prinsip Prinsip potensiometri didasarkan pada
kimia ASAM-BASA III Tujuan Pembelajaran
 KTSP K-13 kimia K e l a s XI ASAM-BASA III Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami mekanisme reaksi asam-basa. 2. Memahami stoikiometri
KTSP K-13 kimia K e l a s XI ASAM-BASA III Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami mekanisme reaksi asam-basa. 2. Memahami stoikiometri
Konduktimeter dan Analisis Konduktometri
 Konduktimeter dan Analisis Konduktometri Pemicu : 1. Jelaskan bagian bagian yang dibutuhkan dari alat konduktometri secara umum! 2. Jelaskan pengertian dari analisis konduktometri, konduktivitas, konduktansi,
Konduktimeter dan Analisis Konduktometri Pemicu : 1. Jelaskan bagian bagian yang dibutuhkan dari alat konduktometri secara umum! 2. Jelaskan pengertian dari analisis konduktometri, konduktivitas, konduktansi,
BAB 6. Jika ke dalam air murni ditambahkan asam atau basa meskipun dalam jumlah. Larutan Penyangga. Kata Kunci. Pengantar
 Kimia XI SMA 179 BAB 6 Larutan Penyangga Tujuan Pembelajaran: Setelah mempelajari bab ini, Anda diharapkan mampu: 1. Menjelaskan pengertian larutan penyangga dan komponen penyusunnya. 2. Merumuskan persamaan
Kimia XI SMA 179 BAB 6 Larutan Penyangga Tujuan Pembelajaran: Setelah mempelajari bab ini, Anda diharapkan mampu: 1. Menjelaskan pengertian larutan penyangga dan komponen penyusunnya. 2. Merumuskan persamaan
LARUTAN PENYANGGA (BUFFER)
 LARUTAN PENYANGGA (BUFFER) Larutan penyangga Larutan penyangga atau larutan buffer adalah larutan yang ph-nya praktis tidak berubah walaupun kepadanya ditambahkan sedikit asam, sedikit basa, atau bila
LARUTAN PENYANGGA (BUFFER) Larutan penyangga Larutan penyangga atau larutan buffer adalah larutan yang ph-nya praktis tidak berubah walaupun kepadanya ditambahkan sedikit asam, sedikit basa, atau bila
Bab IV Hasil dan Diskusi
 Bab IV Hasil dan Diskusi IV.1 Hasil Eksperimen Eksperimen dikerjakan di laboratorium penelitian Kimia Analitik. Suhu ruang saat bekerja berkisar 24-25 C. Data yang diperoleh mencakup data hasil kalibrasi
Bab IV Hasil dan Diskusi IV.1 Hasil Eksperimen Eksperimen dikerjakan di laboratorium penelitian Kimia Analitik. Suhu ruang saat bekerja berkisar 24-25 C. Data yang diperoleh mencakup data hasil kalibrasi
PENENTUAN KADAR KARBONAT DAN HIDROGEN KARBONAT MELALUI TITRASI ASAM BASA
 PENENTUAN KADAR KARBONAT DAN HIDROGEN KARBONAT MELALUI TITRASI ASAM BASA 1 Tujuan Percobaan Tujuan dari percobaan ini adalah menentukan kadar natrium karbonat dan natrium hidrogen karbonat dengan titrasi
PENENTUAN KADAR KARBONAT DAN HIDROGEN KARBONAT MELALUI TITRASI ASAM BASA 1 Tujuan Percobaan Tujuan dari percobaan ini adalah menentukan kadar natrium karbonat dan natrium hidrogen karbonat dengan titrasi
BAB VI KINETIKA REAKSI KIMIA
 BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
SOAL SELEKSI NASIONAL TAHUN 2006
 SOAL SELEKSI NASIONAL TAHUN 2006 Soal 1 ( 13 poin ) KOEFISIEN REAKSI DAN LARUTAN ELEKTROLIT Koefisien reaksi merupakan langkah penting untuk mengamati proses berlangsungnya reaksi. Lengkapi koefisien reaksi-reaksi
SOAL SELEKSI NASIONAL TAHUN 2006 Soal 1 ( 13 poin ) KOEFISIEN REAKSI DAN LARUTAN ELEKTROLIT Koefisien reaksi merupakan langkah penting untuk mengamati proses berlangsungnya reaksi. Lengkapi koefisien reaksi-reaksi
FAKTOR YANG MEMPENGARUHI DAYA HANTAR LISTRIK
 Nama : Ririn Vidiastuti NIM : 06111010015 Shift : A Kelompok : 5 (Lima) FAKTOR YANG MEMPENGARUHI DAYA HANTAR LISTRIK A. Jumlah Ion yang Ada Daya hantar listrik larutan elektrolit dipengaruhi oleh banyaknya
Nama : Ririn Vidiastuti NIM : 06111010015 Shift : A Kelompok : 5 (Lima) FAKTOR YANG MEMPENGARUHI DAYA HANTAR LISTRIK A. Jumlah Ion yang Ada Daya hantar listrik larutan elektrolit dipengaruhi oleh banyaknya
LAPORAN PRAKTIKUM ELEKTROANALISIS
 LAPORAN PRAKTIKUM ELEKTROANALISIS PENGUKURAN KONDUKTIVITAS DAN TDS Dosen Pembimbing : Ibu Endang W, MT Kelompok 6 Nevy Puspitasari NIM 111431020 Nurul Latipah NIM 111431022 Rizky Permatawati NIM 111431025
LAPORAN PRAKTIKUM ELEKTROANALISIS PENGUKURAN KONDUKTIVITAS DAN TDS Dosen Pembimbing : Ibu Endang W, MT Kelompok 6 Nevy Puspitasari NIM 111431020 Nurul Latipah NIM 111431022 Rizky Permatawati NIM 111431025
kimia LAJU REAKSI 1 TUJUAN PEMBELAJARAN
 KTSP & K-13 kimia K e l a s XI LAJU REAKSI 1 TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konsep molaritas. 2. Memahami definisi dan faktor-faktor
KTSP & K-13 kimia K e l a s XI LAJU REAKSI 1 TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konsep molaritas. 2. Memahami definisi dan faktor-faktor
SOAL DAN KUNCI JAWABAN LARUTAN ELEKTROLIT DAN NON ELEKTROLIT
 SOAL DAN KUNCI JAWABAN LARUTAN ELEKTROLIT DAN NON ELEKTROLIT SOAL DAN KUNCI JAWABAN LARUTAN ELEKTROLIT DAN NON ELEKTROLIT 1. Pernyataan yang benar tentang elektrolit adalah. A. Elektrolit adalah zat yang
SOAL DAN KUNCI JAWABAN LARUTAN ELEKTROLIT DAN NON ELEKTROLIT SOAL DAN KUNCI JAWABAN LARUTAN ELEKTROLIT DAN NON ELEKTROLIT 1. Pernyataan yang benar tentang elektrolit adalah. A. Elektrolit adalah zat yang
LARUTAN PENYANGGA (BUFFER)
 LARUTAN PENYANGGA (BUFFER) Larutan penyangga Larutan penyangga atau larutan buffer adalah larutan yang ph-nya praktis tidak berubah walaupun kepadanya ditambahkan sedikit asam, sedikit basa, atau bila
LARUTAN PENYANGGA (BUFFER) Larutan penyangga Larutan penyangga atau larutan buffer adalah larutan yang ph-nya praktis tidak berubah walaupun kepadanya ditambahkan sedikit asam, sedikit basa, atau bila
PERCOBAAN 3 PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI
 LAPORAN PRAKTIKUM KIMIA FISIKA Nama : Any Kurniawati Kelompok : 6 NIM : 4301410009 Prodi/Jurusan : Pend. Kimia/Kimia Dosen : Ir. Sri Wahyuni, M.Si Tanggal Praktikum : 19 September 2012 Teman kerja : Fitriya
LAPORAN PRAKTIKUM KIMIA FISIKA Nama : Any Kurniawati Kelompok : 6 NIM : 4301410009 Prodi/Jurusan : Pend. Kimia/Kimia Dosen : Ir. Sri Wahyuni, M.Si Tanggal Praktikum : 19 September 2012 Teman kerja : Fitriya
DERAJAT KEASAMAN (ph)
 LAPORAN PRAKTIKUM KIMIA DASAR DERAJAT KEASAMAN (ph) DISUSUN OLEH FAISAL ARSYAD (13513128) NURUL FIKRI (13513136) JURUSAN TEKNIK LINGKUNGAN FAKULTAS TEKNIK SIPIL DAN PERENCANAAN UNIVERSITAS ISLAM INDONESIA
LAPORAN PRAKTIKUM KIMIA DASAR DERAJAT KEASAMAN (ph) DISUSUN OLEH FAISAL ARSYAD (13513128) NURUL FIKRI (13513136) JURUSAN TEKNIK LINGKUNGAN FAKULTAS TEKNIK SIPIL DAN PERENCANAAN UNIVERSITAS ISLAM INDONESIA
I. LARUTAN BUFFER. 1. Membuat Larutan Buffer 2. Mempelajari Daya Sanggah Larutan Buffer TINJAUAN PUSTAKA
 I. LARUTAN BUFFER II. TUJUAN 1. Membuat Larutan Buffer 2. Mempelajari Daya Sanggah Larutan Buffer III. TINJAUAN PUSTAKA Larutan penyangga atau larutan buffer atau larutan dapar merupakan suatu larutan
I. LARUTAN BUFFER II. TUJUAN 1. Membuat Larutan Buffer 2. Mempelajari Daya Sanggah Larutan Buffer III. TINJAUAN PUSTAKA Larutan penyangga atau larutan buffer atau larutan dapar merupakan suatu larutan
Kelas : XI IPA Guru : Tim Guru HSPG Tanggal : Senin, 23 Mei 2016 Mata pelajaran : Kimia Waktu : WIB
 Kelas : XI IPA Guru : Tim Guru HSPG Tanggal : Senin, 23 Mei 2016 Mata pelajaran : Kimia Waktu : 10.15 11.45 WIB Petunjuk Pengerjaan Soal Berdoa terlebih dahulu sebelum mengerjakan! Isikan identitas Anda
Kelas : XI IPA Guru : Tim Guru HSPG Tanggal : Senin, 23 Mei 2016 Mata pelajaran : Kimia Waktu : 10.15 11.45 WIB Petunjuk Pengerjaan Soal Berdoa terlebih dahulu sebelum mengerjakan! Isikan identitas Anda
MODUL PRAKTIKUM LABORATORIUM INSTRUKSIONAL TEKNIK PANGAN
 MODUL PRAKTIKUM LABORATORIUM KINETIKA ESTERIFIKASI (KIS) Disusun oleh: Dr. Megawati Zunita, S.Si., M.Si. Joanna Nadia, S.T., M.Sc. PROGRAM STUDI FAKULTAS TEKNOLOGI INDUSTRI INSTITUT TEKNOLOGI BANDUNG 2018
MODUL PRAKTIKUM LABORATORIUM KINETIKA ESTERIFIKASI (KIS) Disusun oleh: Dr. Megawati Zunita, S.Si., M.Si. Joanna Nadia, S.T., M.Sc. PROGRAM STUDI FAKULTAS TEKNOLOGI INDUSTRI INSTITUT TEKNOLOGI BANDUNG 2018
Bab VIII Reaksi Penetralan dan Titrasi Asam-Basa
 Bab VIII Reaksi Penetralan dan Titrasi Asam-Basa Sumber: James Mapple, Chemistry an Enquiry-Based Approach Pengukuran ph selama titrasi akan lebih akurat dengan menggunakan alat ph-meter. TUJUAN PEMBELAJARAN
Bab VIII Reaksi Penetralan dan Titrasi Asam-Basa Sumber: James Mapple, Chemistry an Enquiry-Based Approach Pengukuran ph selama titrasi akan lebih akurat dengan menggunakan alat ph-meter. TUJUAN PEMBELAJARAN
Tetapan Ionisasi Asam 03 Desember 2014 Wiji Dwi Utami Abstrak
 Tetapan Ionisasi Asam 03 Desember 2014 Wiji Dwi Utami 1113016200014 Abstrak Telah dilakukan percobaan mengenai tetapan ionisasi asam yang bertujuan untuk menentukan derajat ionisasi dan harga tetapan kesetimbangan
Tetapan Ionisasi Asam 03 Desember 2014 Wiji Dwi Utami 1113016200014 Abstrak Telah dilakukan percobaan mengenai tetapan ionisasi asam yang bertujuan untuk menentukan derajat ionisasi dan harga tetapan kesetimbangan
LARUTAN ELEKTROLIT DAN NON ELEKTROLIT
 BAB 6 LARUTAN ELEKTROLIT DAN NON ELEKTROLIT Standar Kompetensi Memahami sifat-sifat larutan non elektrolit dan elektrolit, serta reaksi oksidasi-reduksi Kompetensi Dasar Mengidentifikasi sifat larutan
BAB 6 LARUTAN ELEKTROLIT DAN NON ELEKTROLIT Standar Kompetensi Memahami sifat-sifat larutan non elektrolit dan elektrolit, serta reaksi oksidasi-reduksi Kompetensi Dasar Mengidentifikasi sifat larutan
LEMBAR SOAL. Mata pelajaran : Kimia. Kelas/Program : XI/IPA Hari, tanggal : Selasa, 8 April 2008 Alokasi waktu : 90 Menit
 DEPARTEMEN PENDIDIKAN NASIONAL UNIVERSITAS NEGERI SEMARANG FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM JURUSAN KIMIA Gedung D6. Kampus Sekaran Gunungpati Semarang 50229 Telp. 8508035 LEMBAR SOAL Mata
DEPARTEMEN PENDIDIKAN NASIONAL UNIVERSITAS NEGERI SEMARANG FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM JURUSAN KIMIA Gedung D6. Kampus Sekaran Gunungpati Semarang 50229 Telp. 8508035 LEMBAR SOAL Mata
kimia TITRASI ASAM BASA
 Kurikulum 2006/2013 2013 kimia K e l a s XI TITRASI ASAM BASA Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami definisi dan macam-macam titrasi.
Kurikulum 2006/2013 2013 kimia K e l a s XI TITRASI ASAM BASA Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami definisi dan macam-macam titrasi.
LEMBARAN SOAL 4. Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA )
 LEMBARAN SOAL 4 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
LEMBARAN SOAL 4 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
Kunci jawaban dan pembahasan soal laju reaksi
 Kunci jawaban dan pembahasan soal laju reaksi Soal nomor 1 Mencari volume yang dibutuhkan pada proses pengenceran. Rumus pengenceran V 1. M 1 = V 2. M 2 Misal volume yang dibutuhkan sebanyak x ml, maka
Kunci jawaban dan pembahasan soal laju reaksi Soal nomor 1 Mencari volume yang dibutuhkan pada proses pengenceran. Rumus pengenceran V 1. M 1 = V 2. M 2 Misal volume yang dibutuhkan sebanyak x ml, maka
PERCOBAAN I PENENTUAN KADAR KARBONAT DAN HIDROGEN KARBONAT MELALUI TITRASI ASAM BASA
 LAPORAN PRAKTIKUM KIMIA ANALITIK KI-2122 PERCOBAAN I PENENTUAN KADAR KARBONAT DAN HIDROGEN KARBONAT MELALUI TITRASI ASAM BASA Nama Praktikan : Anggi Febrina NIM : 13010107 Kelompok : 5 (Shift Pagi) Tanggal
LAPORAN PRAKTIKUM KIMIA ANALITIK KI-2122 PERCOBAAN I PENENTUAN KADAR KARBONAT DAN HIDROGEN KARBONAT MELALUI TITRASI ASAM BASA Nama Praktikan : Anggi Febrina NIM : 13010107 Kelompok : 5 (Shift Pagi) Tanggal
Nama : Kelompok : Mata Pelajaran : Kimia Kelas/Semester : X 5 /2 Alokasi Waktu : 2 x 45 menit.
 Nama : Kelompok : 78 Mata Pelajaran : Kimia Kelas/Semester : X 5 /2 Alokasi Waktu : 2 x 45 menit. Materi Pokok : Sifat dan jenis larutan elektrolit dan non elektrolit. Standar Kompetensi : Memahami sifat-sifat
Nama : Kelompok : 78 Mata Pelajaran : Kimia Kelas/Semester : X 5 /2 Alokasi Waktu : 2 x 45 menit. Materi Pokok : Sifat dan jenis larutan elektrolit dan non elektrolit. Standar Kompetensi : Memahami sifat-sifat
CH 3 COONa 0,1 M K a CH 3 COOH = 10 5
 Soal No. 1 Dari beberapa larutan berikut ini yang tidak mengalami hidrolisis adalah... A. NH 4 Cl C. K 2 SO 4 D. CH 3 COONa E. CH 3 COOK Yang tidak mengalami peristiwa hidrolisis adalah garam yang berasal
Soal No. 1 Dari beberapa larutan berikut ini yang tidak mengalami hidrolisis adalah... A. NH 4 Cl C. K 2 SO 4 D. CH 3 COONa E. CH 3 COOK Yang tidak mengalami peristiwa hidrolisis adalah garam yang berasal
Larutan Penyangga XI MIA
 Larutan Penyangga XI MIA Komponen Larutan Penyangga Larutan Penyangga Asam Terdiri dari Asam lemah dan basa konjugasinya (Contoh : CH 3 COOH dan CH 3 COO -, HF dan F - ) Cara membuatnya : 1. Mencampurkan
Larutan Penyangga XI MIA Komponen Larutan Penyangga Larutan Penyangga Asam Terdiri dari Asam lemah dan basa konjugasinya (Contoh : CH 3 COOH dan CH 3 COO -, HF dan F - ) Cara membuatnya : 1. Mencampurkan
MATERI HIDROLISIS GARAM KIMIA KELAS XI SEMESTER GENAP
 MATERI HIDROLISIS GARAM KIMIA KELAS XI SEMESTER GENAP PENDAHULUAN Kalian pasti mendengar penyedap makanan. Penyedap makanan yang sering digunakan adalah vitsin. Penyedap ini mengandung monosodium glutamat
MATERI HIDROLISIS GARAM KIMIA KELAS XI SEMESTER GENAP PENDAHULUAN Kalian pasti mendengar penyedap makanan. Penyedap makanan yang sering digunakan adalah vitsin. Penyedap ini mengandung monosodium glutamat
Laporan Praktikum Kimia ~Titrasi asam basa~
 Laporan Praktikum Kimia ~Titrasi asam basa~ -Menentukan konsentrasi NaOH dengan HCl 0,1 M- Latifa Dinna Prayudipta XI IPA 1 SMAN 3 TANGERANG SELATAN TAHUN AJARAN 2009/2010 Laporan praktikum kimia -titrasi
Laporan Praktikum Kimia ~Titrasi asam basa~ -Menentukan konsentrasi NaOH dengan HCl 0,1 M- Latifa Dinna Prayudipta XI IPA 1 SMAN 3 TANGERANG SELATAN TAHUN AJARAN 2009/2010 Laporan praktikum kimia -titrasi
LAPORAN PRAKTIKUM DINAMIKA KIMIA JUDUL PERCOBAAN : PENENTUAN LAJU REAKSI IODINASI ASETON DALAM SUASANA ASAM. Nama : SantiNurAini NRP :
 LAPORAN PRAKTIKUM DINAMIKA KIMIA JUDUL PERCOBAAN : PENENTUAN LAJU REAKSI IODINASI ASETON DALAM SUASANA ASAM Nama : SantiNurAini NRP : 1413100048 Tanggal Praktikum : 28 April 2015 Nama Asisten : Mas Mattius
LAPORAN PRAKTIKUM DINAMIKA KIMIA JUDUL PERCOBAAN : PENENTUAN LAJU REAKSI IODINASI ASETON DALAM SUASANA ASAM Nama : SantiNurAini NRP : 1413100048 Tanggal Praktikum : 28 April 2015 Nama Asisten : Mas Mattius
LAPORAN KIMIA ANALITIK KI Percobaan modul 3 TITRASI SPEKTROFOTOMETRI
 LAPORAN KIMIA ANALITIK KI 3121 Percobaan modul 3 TITRASI SPEKTROFOTOMETRI Nama : Imana Mamizar NIM : 10511066 Kelompok : 5 Nama Asisten : Fatni Rifqiyati Tanggal Percobaan : 1 November 2013 Tanggal Pengumpulan
LAPORAN KIMIA ANALITIK KI 3121 Percobaan modul 3 TITRASI SPEKTROFOTOMETRI Nama : Imana Mamizar NIM : 10511066 Kelompok : 5 Nama Asisten : Fatni Rifqiyati Tanggal Percobaan : 1 November 2013 Tanggal Pengumpulan
wanibesak.wordpress.com 1
 Ringkasan, contoh soal dan pembahasan mengenai asam, basa dan larutan penyangga atau larutan buffer Persamaan ionisasi air H 2O H + + OH Dari reaksi di atas sesuai hukum kesetimbangan, tetapan kesetimbangan
Ringkasan, contoh soal dan pembahasan mengenai asam, basa dan larutan penyangga atau larutan buffer Persamaan ionisasi air H 2O H + + OH Dari reaksi di atas sesuai hukum kesetimbangan, tetapan kesetimbangan
PENGARUH KATALISIS TERHADAP TETAPAN LAJU
 PENGARUH KATALISIS TERHADAP TETAPAN LAJU Laju reaksi sering dipengaruhi oleh adanya katalis Contoh : Hidrolisis sukrosa dalam air Suhu kamar lama (bisa beberapa bulan) Namun jika hidrolisis dilakukan dalam
PENGARUH KATALISIS TERHADAP TETAPAN LAJU Laju reaksi sering dipengaruhi oleh adanya katalis Contoh : Hidrolisis sukrosa dalam air Suhu kamar lama (bisa beberapa bulan) Namun jika hidrolisis dilakukan dalam
HASIL KALI KELARUTAN (Ksp)
 LAPORAN PRAKTIKUM KIMIA FISIKA HASIL KALI KELARUTAN (Ksp) NAMA : YUSI ANDA RIZKY NIM : H311 08 003 KELOMPOK : II (DUA) HARI/TGL PERC. : SENIN/08 MARET 2010 ASISTEN : FITRI JUNIANTI LABORATORIUM KIMIA FISIKA
LAPORAN PRAKTIKUM KIMIA FISIKA HASIL KALI KELARUTAN (Ksp) NAMA : YUSI ANDA RIZKY NIM : H311 08 003 KELOMPOK : II (DUA) HARI/TGL PERC. : SENIN/08 MARET 2010 ASISTEN : FITRI JUNIANTI LABORATORIUM KIMIA FISIKA
BAB 9. KINETIKA KIMIA
 BAB 9 BAB 9. KINETIKA KIMIA 9.1 TEORI TUMBUKAN DARI LAJU REAKSI 9.2 TEORI KEADAAN TRANSISI DARI LAJU REAKSI 9.3 HUKUM LAJU REAKSI 9.4 FAKTOR-FAKTOR LAJU REAKSI 9.5 MEKANISME REAKSI 9.6 ENZIM SEBAGAI KATALIS
BAB 9 BAB 9. KINETIKA KIMIA 9.1 TEORI TUMBUKAN DARI LAJU REAKSI 9.2 TEORI KEADAAN TRANSISI DARI LAJU REAKSI 9.3 HUKUM LAJU REAKSI 9.4 FAKTOR-FAKTOR LAJU REAKSI 9.5 MEKANISME REAKSI 9.6 ENZIM SEBAGAI KATALIS
LAPORAN PRAKTIKUM KIMIA DASAR
 LAPORAN PRAKTIKUM KIMIA DASAR KECEPATAN REAKSI Disusun Oleh : 1. Achmad Zaimul Khaqqi (132500030) 2. Dinda Kharisma Asmara (132500014) 3. Icha Restu Maulidiah (132500033) 4. Jauharatul Lailiyah (132500053)
LAPORAN PRAKTIKUM KIMIA DASAR KECEPATAN REAKSI Disusun Oleh : 1. Achmad Zaimul Khaqqi (132500030) 2. Dinda Kharisma Asmara (132500014) 3. Icha Restu Maulidiah (132500033) 4. Jauharatul Lailiyah (132500053)
Bab IV Hasil dan Pembahasan
 Bab IV Hasil dan Pembahasan IV.1 Pembuatan Larutan Buffer Semua zat yang digunakan untuk membuat larutan buffer dapat larut dengan sempurna. Larutan yang diperoleh jernih, homogen, dan tidak berbau. Data
Bab IV Hasil dan Pembahasan IV.1 Pembuatan Larutan Buffer Semua zat yang digunakan untuk membuat larutan buffer dapat larut dengan sempurna. Larutan yang diperoleh jernih, homogen, dan tidak berbau. Data
Derajat Keasaman dan kebasaan (ph dan poh)
 Derajat Keasaman dan kebasaan (ph dan poh) Berdasarkan teori asam basa Arhenius, suatu larutan dapat bersifat asam, basa atau netral tergantung pada konsentrasi ion H+ atau ion OH dalam larutan tersebut.
Derajat Keasaman dan kebasaan (ph dan poh) Berdasarkan teori asam basa Arhenius, suatu larutan dapat bersifat asam, basa atau netral tergantung pada konsentrasi ion H+ atau ion OH dalam larutan tersebut.
Penambahan oleh sedikit asam-kuat (H + ) menyebabkan kesetimbangan. CH 3 COOH(aq) CH 3 COO - (aq) + H + (aq) (9.1) asam lemah
 Larutan bufer* merupakan sistem larutan yang dapat mempertahankan lingkungannya dari pengaruh seperti oleh penambahan sedikit asam/basa kuat, atau oleh pengenceran. Sistem bufer terdiri atas dua komponen,
Larutan bufer* merupakan sistem larutan yang dapat mempertahankan lingkungannya dari pengaruh seperti oleh penambahan sedikit asam/basa kuat, atau oleh pengenceran. Sistem bufer terdiri atas dua komponen,
C. Tujuan Percobaan : Menentukan titik akhir titrasi asam-basa secara konduktometri D. Kajian Pustaka 1. Konduktometri
 A. Judul Percobaan : Titrasi Konduktometri B. Waktu Percobaan Sebelum : 10 April 2014, pkl 07.00 wib Sesudah : 10 April 2014, pkl 10.00 wib C. Tujuan Percobaan : Menentukan titik akhir titrasi asam-basa
A. Judul Percobaan : Titrasi Konduktometri B. Waktu Percobaan Sebelum : 10 April 2014, pkl 07.00 wib Sesudah : 10 April 2014, pkl 10.00 wib C. Tujuan Percobaan : Menentukan titik akhir titrasi asam-basa
kimia KTSP & K-13 KESETIMBANGAN KIMIA 1 K e l a s A. Reaksi Kimia Reversible dan Irreversible Tujuan Pembelajaran
 KTSP & K-13 kimia K e l a s XI KESETIMBANGAN KIMIA 1 Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami definisi reaksi kimia reversible dan irreversible..
KTSP & K-13 kimia K e l a s XI KESETIMBANGAN KIMIA 1 Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami definisi reaksi kimia reversible dan irreversible..
Gambar Rangkaian Alat pengujian larutan
 LARUTAN ELEKTROLIT DAN BUKAN ELEKTROLIT Selain dari ikatannya, terdapat cara lain untuk mengelompokan senyawa yakni didasarkan pada daya hantar listrik. Jika suatu senyawa dilarutkan dalam air dapat menghantarkan
LARUTAN ELEKTROLIT DAN BUKAN ELEKTROLIT Selain dari ikatannya, terdapat cara lain untuk mengelompokan senyawa yakni didasarkan pada daya hantar listrik. Jika suatu senyawa dilarutkan dalam air dapat menghantarkan
SOAL KIMIA 1 KELAS : XI IPA
 SOAL KIIA 1 KELAS : XI IPA PETUNJUK UU 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja 3. Kerjakanlah soal anda pada lembar
SOAL KIIA 1 KELAS : XI IPA PETUNJUK UU 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja 3. Kerjakanlah soal anda pada lembar
ABSTRAK. Percobaan dengan judul reaksi orde satu yang bertujuan untuk menguji apakah H 2 O 2
 Reaksi Orde Satu Tujuan : Menguji apakah reaksi penguraian H 2 O 2 dalam air merupakan reaksi orde keastu berdasarkan cara grafik Kelompok 3: Hana Aulia, Amelia Desiria, Sarip Hidayat Program Studi Pendidikan
Reaksi Orde Satu Tujuan : Menguji apakah reaksi penguraian H 2 O 2 dalam air merupakan reaksi orde keastu berdasarkan cara grafik Kelompok 3: Hana Aulia, Amelia Desiria, Sarip Hidayat Program Studi Pendidikan
Laporan Praktikum Kimia Dasar II. Daya Hantar Listrik Larutan Elektrolit
 Laporan Praktikum Kimia Dasar II Daya Hantar Listrik Larutan Elektrolit Oleh: Kelompok : I (satu) Nama Nim Prodi : Ardinal : F1D113002 : Teknik Pertambangan FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS JAMBI
Laporan Praktikum Kimia Dasar II Daya Hantar Listrik Larutan Elektrolit Oleh: Kelompok : I (satu) Nama Nim Prodi : Ardinal : F1D113002 : Teknik Pertambangan FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS JAMBI
LAPORAN PRAKTIKUM KIMIA FISIKA II TETAPAN IONISASI ASAM. Selasa, 20-Mei Disusun Oleh : Yasa Esa Yasinta. Kelompok : 5. Gilang Yudha Pratama
 LAPORAN PRAKTIKUM KIMIA FISIKA II TETAPAN IONISASI ASAM Selasa, 20-Mei-2014 Disusun Oleh : Yasa Esa Yasinta 1112016200062 Kelompok : 5 Gilang Yudha Pratama Risky Hari Setiawan Savira Aulia PROGRAM STUDI
LAPORAN PRAKTIKUM KIMIA FISIKA II TETAPAN IONISASI ASAM Selasa, 20-Mei-2014 Disusun Oleh : Yasa Esa Yasinta 1112016200062 Kelompok : 5 Gilang Yudha Pratama Risky Hari Setiawan Savira Aulia PROGRAM STUDI
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
I. Judul : Membandingkan Kenaikan Titik Didih Larutan Elektrolit dan Non-Elektrolit.
 I. Judul : Membandingkan Kenaikan Titik Didih Larutan Elektrolit dan Non-Elektrolit. II. Tujuan : Membandingkan Kenaikan Titik Didih Larutan Elektrolit dan Non-Elektrolit pada konsentrasi larutan yang
I. Judul : Membandingkan Kenaikan Titik Didih Larutan Elektrolit dan Non-Elektrolit. II. Tujuan : Membandingkan Kenaikan Titik Didih Larutan Elektrolit dan Non-Elektrolit pada konsentrasi larutan yang
LAPORAN PRAKTIKUM 3 ph METER, BUFFER, dan PENGENCERAN DISUSUN OLEH : MARIA LESTARI DAN YULIA FITRI GHAZALI Kamis 04 Oktober s/d 16.
 LAPORAN PRAKTIKUM 3 ph METER, BUFFER, dan PENGENCERAN DISUSUN OLEH : MARIA LESTARI DAN YULIA FITRI GHAZALI Kamis 04 Oktober 2012 14.00 s/d 16.00 wib TUJUAN : 1. Agar mahasiswa dapat memahami prinsip-prinsip
LAPORAN PRAKTIKUM 3 ph METER, BUFFER, dan PENGENCERAN DISUSUN OLEH : MARIA LESTARI DAN YULIA FITRI GHAZALI Kamis 04 Oktober 2012 14.00 s/d 16.00 wib TUJUAN : 1. Agar mahasiswa dapat memahami prinsip-prinsip
Kesetimbangan Kimia. A b d u l W a h i d S u r h i m
 Kesetimbangan Kimia A b d u l W a h i d S u r h i m 2 0 1 4 Rujukan Chapter 12 dan 14: Masterton, William L. and Hurley, Cecile N. 2009. Chemistry: Principles and Reactions. Sixth Edition. Books/Cole.
Kesetimbangan Kimia A b d u l W a h i d S u r h i m 2 0 1 4 Rujukan Chapter 12 dan 14: Masterton, William L. and Hurley, Cecile N. 2009. Chemistry: Principles and Reactions. Sixth Edition. Books/Cole.
Larutan penyangga dapat terbentuk dari campuran asam lemah dan basa
 Larutan penyangga dapat terbentuk dari campuran asam lemah dan basa konjugasinya atau campuran basa lemah dan asam konjugasinya. Larutan penyangga disebut juga larutan penahan atau larutan dapar atau buffer.
Larutan penyangga dapat terbentuk dari campuran asam lemah dan basa konjugasinya atau campuran basa lemah dan asam konjugasinya. Larutan penyangga disebut juga larutan penahan atau larutan dapar atau buffer.
Stoikiometri. Berasal dari kata Stoicheion (partikel) dan metron (pengukuran). Cara perhitungan dan pengukuran zat serta campuran kimia.
 Stoikiometri Berasal dari kata Stoicheion (partikel) dan metron (pengukuran). Cara perhitungan dan pengukuran zat serta campuran kimia. Bilangan Avogadro Stoikometri: pengukuran kuantitatif sehingga perlu
Stoikiometri Berasal dari kata Stoicheion (partikel) dan metron (pengukuran). Cara perhitungan dan pengukuran zat serta campuran kimia. Bilangan Avogadro Stoikometri: pengukuran kuantitatif sehingga perlu
Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Chapter 8 Kinetika Kimia Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Chapter 8 Kinetika Kimia Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
UJIAN PRAKTIK KIMIA SMA NEGERI 4 MATARAM TAHUN 2013
 UJIAN PRAKTIK KIMIA SMA NEGERI 4 MATARAM TAHUN 2013 Standar Kompetensi Lulusan : Mendeskripsikan sifat-sifat larutan, metode pengukuran dan terapannya. Indikator : Siswa dapat meramalkan harga ph suatu
UJIAN PRAKTIK KIMIA SMA NEGERI 4 MATARAM TAHUN 2013 Standar Kompetensi Lulusan : Mendeskripsikan sifat-sifat larutan, metode pengukuran dan terapannya. Indikator : Siswa dapat meramalkan harga ph suatu
LAPORAN PRAKTIKUM KIMIA DASAR I
 LAPORAN PRAKTIKUM KIMIA DASAR I NAMA KELOMPOK : MELVIA PERMATASARI (08121006013) MELANY AMDIRA (08121006027) ANIS ALAFIFAH (08121006029) PUTRI WULANDARI (08121006071) MUTIARA BELLA (08121006073) JURUSAN
LAPORAN PRAKTIKUM KIMIA DASAR I NAMA KELOMPOK : MELVIA PERMATASARI (08121006013) MELANY AMDIRA (08121006027) ANIS ALAFIFAH (08121006029) PUTRI WULANDARI (08121006071) MUTIARA BELLA (08121006073) JURUSAN
KIMIA FISIKA I. Disusun oleh : Dr. Isana SYL, M.Si
 PETUNJUK PRAKTIKUM KIMIA FISIKA I Disusun oleh : Dr. Isana SYL, M.Si Isana_supiah@uny.ac.id LABORATORIUM KIMIA FISIKA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI YOGYAKARTA 2002 TERMODINAMIKA
PETUNJUK PRAKTIKUM KIMIA FISIKA I Disusun oleh : Dr. Isana SYL, M.Si Isana_supiah@uny.ac.id LABORATORIUM KIMIA FISIKA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI YOGYAKARTA 2002 TERMODINAMIKA
Sifat Dasar Larutan Kelarutan Pengaruh Jenis Zat pada Kelarutan
 2. LARUTAN 1. Sifat Dasar Larutan Larutan adalah campuran yang bersifat homogen antara molekul, atom ataupun ion dari dua zat atau lebih. Disebut campuran karena susunannya atau komposisinya dapat berubah.
2. LARUTAN 1. Sifat Dasar Larutan Larutan adalah campuran yang bersifat homogen antara molekul, atom ataupun ion dari dua zat atau lebih. Disebut campuran karena susunannya atau komposisinya dapat berubah.
TUGAS KIMIA SMA NEGERI 1 BAJAWA TITRASI ASAM BASA. Nama : Kelas. Disusun oleh:
 TUGAS KIMIA TITRASI ASAM BASA Disusun oleh: Nama : Kelas : SMA NEGERI 1 BAJAWA 2015 TITRASI ASAM BASA 1. Prinsip Dasar Titrasi netralisasi adalah titrasi yang didasarkan pada reaksi antara suatu asam dengan
TUGAS KIMIA TITRASI ASAM BASA Disusun oleh: Nama : Kelas : SMA NEGERI 1 BAJAWA 2015 TITRASI ASAM BASA 1. Prinsip Dasar Titrasi netralisasi adalah titrasi yang didasarkan pada reaksi antara suatu asam dengan
Kimia Study Center - Contoh soal dan pembahasan tentang hidrolisis larutan garam dan menentukan ph atau poh larutan garam, kimia SMA kelas 11 IPA.
 Kimia Study Center - Contoh soal dan pembahasan tentang hidrolisis larutan garam dan menentukan ph atau poh larutan garam, kimia SMA kelas 11 IPA. Soal No. 1 Dari beberapa larutan berikut ini yang tidak
Kimia Study Center - Contoh soal dan pembahasan tentang hidrolisis larutan garam dan menentukan ph atau poh larutan garam, kimia SMA kelas 11 IPA. Soal No. 1 Dari beberapa larutan berikut ini yang tidak
PETA KONSEP LAJU REAKSI. Percobaan. Waktu perubahan. Hasil reaksi. Pereaksi. Katalis. Suhu pereaksi. Konsentrasi. Luas. permukaan.
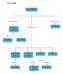 PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
Soal-Soal. Bab 4. Latihan. Laju Reaksi. 1. Madu dengan massa jenis 1,4 gram/ cm 3 mengandung glukosa (M r. 5. Diketahui reaksi:
 Bab Laju Reaksi Soal-Soal Latihan. Madu dengan massa jenis, gram/ cm 3 mengandung glukosa (M r = 80) sebanyak 35 % b/b. Kemolaran glukosa dalam madu adalah... 0,8 M (D),7 M,8 M (E) 3,0 M, M. Untuk membuat
Bab Laju Reaksi Soal-Soal Latihan. Madu dengan massa jenis, gram/ cm 3 mengandung glukosa (M r = 80) sebanyak 35 % b/b. Kemolaran glukosa dalam madu adalah... 0,8 M (D),7 M,8 M (E) 3,0 M, M. Untuk membuat
Metode titrimetri dikenal juga sebagai metode volumetri
 Metode titrimetri dikenal juga sebagai metode volumetri? yaitu, merupakan metode analisis kuantitatif yang didasarkan pada prinsip pengukuran volume. 1 Macam Analisa Volumetri 1. Gasometri adalah volumetri
Metode titrimetri dikenal juga sebagai metode volumetri? yaitu, merupakan metode analisis kuantitatif yang didasarkan pada prinsip pengukuran volume. 1 Macam Analisa Volumetri 1. Gasometri adalah volumetri
ASAM -BASA, STOIKIOMETRI LARUTAN DAN TITRASI ASAM-BASA
 ASAM -BASA, STOIKIOMETRI LARUTAN DAN TITRASI ASAM-BASA Asam merupakan zat yang yang mengion dalam air menghasilkan ion H + dan basa merupakan zat yang mengion dalam air menghasilkan ion OH -. ASAM Asam
ASAM -BASA, STOIKIOMETRI LARUTAN DAN TITRASI ASAM-BASA Asam merupakan zat yang yang mengion dalam air menghasilkan ion H + dan basa merupakan zat yang mengion dalam air menghasilkan ion OH -. ASAM Asam
10 mlhcl2 M. 10 ml HCl2 M. Na 2 S 2 O 3 0,2 M KIM/ IND- II
 10 mlhcl2 M 10 ml HCl2 M 10 mlhcl2 M Na 2 S 2 O 3 0,2 M Na 2 S 2 O 3 0,2 M Na 2 S 2 O 3 0,2 M KIM/ IND- II BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL
10 mlhcl2 M 10 ml HCl2 M 10 mlhcl2 M Na 2 S 2 O 3 0,2 M Na 2 S 2 O 3 0,2 M Na 2 S 2 O 3 0,2 M KIM/ IND- II BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL
Jason Mandela's Lab Report
 LAPORAN PRAKTIKUM KIMIA FISIK I PERCOBAAN-4 KINETIKA ADSORPSI Disusun Oleh: Nama : Jason Mandela NIM :2014/365675/PA/16132 Partner : - Dwi Ratih Purwaningsih - Krisfian Tata AP - E Devina S - Fajar Sidiq
LAPORAN PRAKTIKUM KIMIA FISIK I PERCOBAAN-4 KINETIKA ADSORPSI Disusun Oleh: Nama : Jason Mandela NIM :2014/365675/PA/16132 Partner : - Dwi Ratih Purwaningsih - Krisfian Tata AP - E Devina S - Fajar Sidiq
2. Konfigurasi elektron dua buah unsur tidak sebenarnya:
 . Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
. Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi. Bab17. Kesetimbangan Asam-Basa dan Kesetimbangan Kelarutan
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Bab17 Kesetimbangan Asam-Basa dan Kesetimbangan Kelarutan Larutan buffer adalah larutan yg terdiri dari: 1. asam lemah/basa
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Bab17 Kesetimbangan Asam-Basa dan Kesetimbangan Kelarutan Larutan buffer adalah larutan yg terdiri dari: 1. asam lemah/basa
BAB I PENDAHULUAN 1.1. Latar Belakang 1.2. Tujuan Percobaan 1.3. Manfaat Percobaan
 BAB I PENDAHULUAN 1.1. Latar Belakang Seiring sedang berkembangnya kemajuan ilmu pengetahuan dan teknologi pada bidang perindustrian di Indonesia, beragam industri terus melakukan inovasi dan perkembangan
BAB I PENDAHULUAN 1.1. Latar Belakang Seiring sedang berkembangnya kemajuan ilmu pengetahuan dan teknologi pada bidang perindustrian di Indonesia, beragam industri terus melakukan inovasi dan perkembangan
Laporan Kimia Analitik KI-3121
 Laporan Kimia Analitik KI-3121 PERCOBAAN 5 SPEKTROFOTOMETRI SERAPAN ATOM Nama : Kartika Trianita NIM : 10510007 Kelompok : 1 Tanggal Percobaan : 19 Oktober 2012 Tanggal Laporan : 2 November 2012 Asisten
Laporan Kimia Analitik KI-3121 PERCOBAAN 5 SPEKTROFOTOMETRI SERAPAN ATOM Nama : Kartika Trianita NIM : 10510007 Kelompok : 1 Tanggal Percobaan : 19 Oktober 2012 Tanggal Laporan : 2 November 2012 Asisten
Rangkuman Materi Larutan Elektrolit dan Non elektrolit
 Rangkuman Materi Larutan Elektrolit dan Non elektrolit LARUTAN ELEKTROLIT DAN LARUTAN NON ELEKTROLIT LARUTAN ELEKTROLIT 1. Pengertian Larutan Elektrolit Larutan elektrolit adalah larutan yang dapat menghantarkan
Rangkuman Materi Larutan Elektrolit dan Non elektrolit LARUTAN ELEKTROLIT DAN LARUTAN NON ELEKTROLIT LARUTAN ELEKTROLIT 1. Pengertian Larutan Elektrolit Larutan elektrolit adalah larutan yang dapat menghantarkan
OAL TES SEMESTER II. I. Pilihlah jawaban yang paling tepat!
 KIMIA XI SMA 217 S OAL TES SEMESTER II I. Pilihlah jawaban yang paling tepat! 1. Basa menurut Arhenius adalah senyawa yang bila dilarutkan dalam air akan menghasilkan a. proton d. ion H b. elektron e.
KIMIA XI SMA 217 S OAL TES SEMESTER II I. Pilihlah jawaban yang paling tepat! 1. Basa menurut Arhenius adalah senyawa yang bila dilarutkan dalam air akan menghasilkan a. proton d. ion H b. elektron e.
BAB I PENDAHULUAN I.1.
 BAB I PENDAHULUAN I.1. Tujuan Percobaan Tujuan dari percobaan ini adalah untuk mengetahui nilai konstanta dalam peristiwa adsorbsi dari larutan asam asetat oleh karbon aktif pada suhu konstan. I.2. Dasar
BAB I PENDAHULUAN I.1. Tujuan Percobaan Tujuan dari percobaan ini adalah untuk mengetahui nilai konstanta dalam peristiwa adsorbsi dari larutan asam asetat oleh karbon aktif pada suhu konstan. I.2. Dasar
LAPORAN PRAKTIKUM KIMIA DASAR I STOIKIOMETRI REAKSI
 LAPORAN PRAKTIKUM KIMIA DASAR I STOIKIOMETRI REAKSI Nama Anggota: Isrenna Ratu Rezky Suci 1157040029 Helmi Fauzi 1157040025 Fajar Gunawan 1157040022 Fresa Agustini 1157040024 JURUSAN KIMIA 1A FAKULTAS
LAPORAN PRAKTIKUM KIMIA DASAR I STOIKIOMETRI REAKSI Nama Anggota: Isrenna Ratu Rezky Suci 1157040029 Helmi Fauzi 1157040025 Fajar Gunawan 1157040022 Fresa Agustini 1157040024 JURUSAN KIMIA 1A FAKULTAS
PENUNTUN PRAKTIKUM KIMIA DASAR II KI1201
 PENUNTUN PRAKTIKUM KIMIA DASAR II KI1201 Disusun Ulang Oleh: Dr. Deana Wahyuningrum Dr. Ihsanawati Dr. Irma Mulyani Dr. Mia Ledyastuti Dr. Rusnadi LABORATORIUM KIMIA DASAR PROGRAM TAHAP PERSIAPAN BERSAMA
PENUNTUN PRAKTIKUM KIMIA DASAR II KI1201 Disusun Ulang Oleh: Dr. Deana Wahyuningrum Dr. Ihsanawati Dr. Irma Mulyani Dr. Mia Ledyastuti Dr. Rusnadi LABORATORIUM KIMIA DASAR PROGRAM TAHAP PERSIAPAN BERSAMA
Hubungan koefisien dalam persamaan reaksi dengan hitungan
 STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
Materi yang terdapat di alam jika ditinjau dari ukuran konduktivitasnya dapat dibagi menjadi tiga kelompok:
 BAB III KONDUKTOMETRI Bab ini akan membicarakan sifatsifat larutan yang keraitan dan kelistrikan yang tidak dipengaruhi oleh reaksi elektrodanya. Pembicaraan mengenai masalah tersebut pada bab ini, yaitu:
BAB III KONDUKTOMETRI Bab ini akan membicarakan sifatsifat larutan yang keraitan dan kelistrikan yang tidak dipengaruhi oleh reaksi elektrodanya. Pembicaraan mengenai masalah tersebut pada bab ini, yaitu:
c. Suhu atau Temperatur
 Pada laju reaksi terdapat faktor-faktor yang dapat mempengaruhi laju reaksi. Selain bergantung pada jenis zat yang beraksi laju reaksi dipengaruhi oleh : a. Konsentrasi Pereaksi Pada umumnya jika konsentrasi
Pada laju reaksi terdapat faktor-faktor yang dapat mempengaruhi laju reaksi. Selain bergantung pada jenis zat yang beraksi laju reaksi dipengaruhi oleh : a. Konsentrasi Pereaksi Pada umumnya jika konsentrasi
kimia Kelas X LARUTAN ELEKTROLIT DAN NONELEKTROLIT K-13 A. Pengertian Larutan dan Daya Hantar Listrik
 K-13 Kelas X kimia LARUTAN ELEKTROLIT DAN NONELEKTROLIT Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami perbedaan antara larutan elektrolit dan
K-13 Kelas X kimia LARUTAN ELEKTROLIT DAN NONELEKTROLIT Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami perbedaan antara larutan elektrolit dan
Reaksi dalam larutan berair
 Reaksi dalam larutan berair Drs. Iqmal Tahir, M.Si. iqmal@gadjahmada.edu Larutan - Suatu campuran homogen dua atau lebih senyawa. Pelarut (solven) - komponen dalam larutan yang membuat penuh larutan (ditandai
Reaksi dalam larutan berair Drs. Iqmal Tahir, M.Si. iqmal@gadjahmada.edu Larutan - Suatu campuran homogen dua atau lebih senyawa. Pelarut (solven) - komponen dalam larutan yang membuat penuh larutan (ditandai
1. Dari pengujian larutan dengan kertas lakmus diperoleh data berikut:
 SOAL-SOAL BAB 5 LARUTAN ASAM BASA/ Kimia Erlangga 2B 1. Dari pengujian larutan dengan kertas lakmus diperoleh data berikut: No Larutan yang diuji Warna lakmus Merah Biru 1 X Merah Biru 2 Y Merah Merah
SOAL-SOAL BAB 5 LARUTAN ASAM BASA/ Kimia Erlangga 2B 1. Dari pengujian larutan dengan kertas lakmus diperoleh data berikut: No Larutan yang diuji Warna lakmus Merah Biru 1 X Merah Biru 2 Y Merah Merah
PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP FAX KODE POS 60299
 PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP. 031-8415492 FAX 031-8430673 KODE POS 60299 ULANGAN AKHIR SEMESTER 2 (DUA) TAHUN PELAJARAN 2011 2012 Hari/Tanggal :
PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP. 031-8415492 FAX 031-8430673 KODE POS 60299 ULANGAN AKHIR SEMESTER 2 (DUA) TAHUN PELAJARAN 2011 2012 Hari/Tanggal :
HASIL DAN PEMBAHASAN. Gambar 12. Hubungan Tegangan Membran terhadap Variasi Suhu pada Konsentrasi 100 mm Larutan NaCl, MgCl 2 dan AlCl 3
 9 HASIL DAN PEMBAHASAN 1. Hasil Perlakuan Pasif untuk Tegangan Membran 1.1 Tinjauan Perlakuan Variasi Konsentrasi Gambar 11 memperlihatkan grafik tegangan membran telur terhadap variasi konsentrasi larutan
9 HASIL DAN PEMBAHASAN 1. Hasil Perlakuan Pasif untuk Tegangan Membran 1.1 Tinjauan Perlakuan Variasi Konsentrasi Gambar 11 memperlihatkan grafik tegangan membran telur terhadap variasi konsentrasi larutan
SOAL LAJU REAKSI. Mol CaCO 3 = = 0.25 mol = 25. m Mr
 SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
BAB II ISI. Sumber gambar: (salirawati, 2008)
 BAB I PENDAHULUAN 1.1 Latar Belakang Daya hantar listrik adalah parameter yang dipengaruhi oleh salinitas tinggi rendahnya berkaitan erat dengan nilai salinitas. Konduktivitas (Daya Hantar Listrik / DHL)
BAB I PENDAHULUAN 1.1 Latar Belakang Daya hantar listrik adalah parameter yang dipengaruhi oleh salinitas tinggi rendahnya berkaitan erat dengan nilai salinitas. Konduktivitas (Daya Hantar Listrik / DHL)
Larutan Dapar Dapar adalah senyawa-senyawa atau campuran senyawa yang dapat meniadakan perubahan ph terhadap penambahan sedikit asam atau basa.
 Larutan Dapar Dapar adalah senyawa-senyawa atau campuran senyawa yang dapat meniadakan perubahan ph terhadap penambahan sedikit asam atau basa. Peniadaan perubahan ph tersebut dikenal sebagai aksi dapar.
Larutan Dapar Dapar adalah senyawa-senyawa atau campuran senyawa yang dapat meniadakan perubahan ph terhadap penambahan sedikit asam atau basa. Peniadaan perubahan ph tersebut dikenal sebagai aksi dapar.
LAPORAN PRAKTIKUM KIMIA FISIKA PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI
 LAPORAN PRAKTIKUM KIMIA FISIKA PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI OLEH : KELOMPOK III Nama : Rifqi Munip (061330401022) Riska (061330401023) Sarah Swasti Putri (061330401024) Siti Nurjanah (061330401025)
LAPORAN PRAKTIKUM KIMIA FISIKA PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI OLEH : KELOMPOK III Nama : Rifqi Munip (061330401022) Riska (061330401023) Sarah Swasti Putri (061330401024) Siti Nurjanah (061330401025)
Chapter 7 Larutan tirtawi (aqueous solution)
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi modif oleh Dr I Kartini Chapter 7 Larutan tirtawi (aqueous solution) Larutan adalah campuran yang homogen dari dua atau lebih
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi modif oleh Dr I Kartini Chapter 7 Larutan tirtawi (aqueous solution) Larutan adalah campuran yang homogen dari dua atau lebih
