KUMPULAN PERTANYAAN DAN JAWABAN CPOB
|
|
|
- Susanto Tedja
- 7 tahun lalu
- Tontonan:
Transkripsi
1 Page 1 of 8 KUMPULAN PERTANYAAN DAN JAWABAN CPOB I MANAJEMEN MUTU 1. Apakah Annual Product Review (APR) merupakan validasi proses retrospektif? 2. Bagaimana cara memantau suhu pada proses distribusi produk yang menggunakan jasa ekspedisi? APR tidak sama dengan Validasi Proses Retrospektif, tapi data APR dapat digunakan untuk validasi retrospektif, dengan ketentuan dapat menjawab semua parameter yang ditentukan dalam protokol validasi retrospektif. (Pedoman CPOB Edisi 2012 menggunakan istilah Product Quality Review (PQR)/ Pengkajian Mutu Produk (PMP) untuk APR). a. Cara memantau suhu pada proses distribusi produk yang menggunakan jasa ekspedisi, antara lain dengan: melakukan pemetaan suhu selama transportasi di dalam container pengiriman oleh jasa ekspedisi untuk menentukan posisi terburuk; melakukan pemantauan suhu selama perjalanan di posisi terburuk; dengan memasang termometer pemantau/pencatat (data logger) atau termometer maxmin. b. Penggunaan jasa ekspedisi dapat dikategorikan dalam Kegiatan Kontrak (Pedoman CPOB Edisi 2012 Aneks 12) menyebutkan bahwa: Kontrak tersebut hendaklah menegaskan tanggaung jawab masing-masing pihak, termasuk ketaatan tehadap prinsip-prinsip CDOB. Tiap penerima kontrak hendaklah memenuhi ketentuan yang tercantum dalam Pedoman CDOB tersebut. Penerima kontrak hendaklah diaudit secara berkala. II PERSONALIA 1. Apakah Penanggung Jawab Pengawasan Mutu harus seorang apoteker? 2. Apa yang dimaksud dengan kompetensi para Apoteker Penanggung Jawab di produksi sediaan farmasi? a. Menurut PP No. 51 Tahun 2009 Tentang Pekerjaan Kefarmasian Pasal 9 Ayat 1 Penanggung Jawab Pengawasan Mutu harus seorang apoteker. b. Pedoman CPOB Edisi 2012 menyebutkan bahwa: Kepala bagian Pengawasan Mutu hendaklah seorang apoteker terkualifikasi dan memperoleh pelatihan yang sesuai, memiliki pengalaman praktis yang memadai dan keterampilan manajerial sehingga memungkinkan untuk melaksanakan tugasnya secara profesional. Menurut PP No. 51 Tahun 2009 Tentang Pekerjaan Kefarmasian Pasal 37, apoteker harus memiliki sertifikat kompetensi profesi yang akan diatur dalam peraturan menteri. Namun, sementara belum ada peraturan yang dimaksud, industri farmasi dapat mengukur kompetensi dengan mengacu pada Pedoman CPOB Edisi 2012 Butir 2.5; 2.6 dan 2.7. Apoteker Penanggung Jawab hendaklah memperoleh pelatihan yang sesuai, memiliki pengalaman praktis yang memadai dan keterampilan manajerial sehingga memungkinkan untuk melaksanakan tugas secara profesional.
2 Page 2 of 8 III BANGUNAN DAN FASILITAS 1. Berapa nilai minimum standard jumlah mikroba udara di ruangan yang boleh ditetapkan sendiri yakni Kelas E? Nilai minimum standar tidak ditetapkan karena tergantung jenis produk dan spesifikasi mikroba yang ditetapkan dalam masing-masing produk/ sediaan oleh industri sendiri. (Catatan: Di Amerika Serikat dan Eropa, persyaratan mikrobiologis untuk sediaan krim dan cairan sudah ditetapkan dalam farmakope). Bagaimana jika industri farmasi menetapkan jumlah angka yang tinggi? 2. Sistem tata udara dengan aliran udara manakah yang sesuai Pedoman CPOB 2012; apakah HVAC dengan sistem koridor bertekanan udara positif atau negatif? 3. Bila industri farmasi yang sudah memiliki sistem HVAC namun inlet dan outlet-nya tidak sesuai Pedoman CPOB, apakah industri harus melakukan renovasi HVAC? 4. Filter jenis apa yang harus digunakan pada sistem HVAC di fasilitas nonsteril, di mana terpasang 1 (satu) AHU yang digunakan untuk beberapa ruang produksi dengan multi produk? 5. Bagaimanakah desain pintu darurat (emergency door) pada ruang aseptis? 6. Apakah udara yang dipasok ke laboratorium mikrobiologi yang digunakan hanya untuk uji identifikasi (bukan uji sterilitas) harus melewati filter HEPA? 7. Apakah sediaan yang mengandung kortikosteroida sintetis berpotensi tinggi (misal metilprednisolon) boleh diproduksi di fasilitas nonhormon? Di Indonesia ketetapan diserahkan kepada masing-masing industri dengan ketentuan memenuhi spesifikasi mikrobiologis yang ditetapkan dalam masing-masing produk/ sediaan. Pedoman CPOB Edisi 2012 merekomendasikan sistem koridor bersih (untuk sediaan padat, nonsteril), di mana tekanan udara di koridor lebih tinggi daripada tekanan udara di ruang proses produksi, sehingga aliran udara terjadi dari koridor ke ruang produksi. Semua barang yang dibawa melalui koridor tetap dalam keadaan bersih / tidak terkontaminasi oleh (partikel) bahan/ produk dari ruang-ruang produksi. Untuk sediaan steril direkomendasikan koridor bertekanan udara negatif relatif terhadap ruang produksi demi perlindungan pada proses kritis yang sensitif terhadap kontaminan mikroorganisme. Apabila sistem HVAC tidak dapat memenuhi persyaratan parameter kualifikasi (perbedaan tekanan udara; frekuensi pertukaran udara; pola aliran udara, bila perlu; waktu recovery; uji integritas filter HEPA), industri harus mempertimbangkan perubahan pada desain. Sistem HVAC yang menggunakan 1 AHU melayani beberapa ruang produksi: dengan udara yang diresirkulasi harus memasang HEPA filter H13 (efisiensi 99,95%) sebagai filter akhir; dengan udara yang dibuang 100 % (single pass) memasang F8 (EN % ASHRAE 52/76) sampai dengan F9 (85 %EN 1822 atau 95 % ASHRAE 52/76). Sama dengan pintu darurat lain, desain harus memastikan kerapatan pintu namun mudah terbuka apabila didorong dari dalam dan hanya dapat dibuka dari dalam. Direkomendasikan laboratorium mikrobiologi yang digunakan hanya untuk uji identifikasi dilengkapi unit LAF berlatar belakang ruang dengan minimal Kelas D. Dalam produksi sediaan yang mengandung kortikosteroida, fasilitas yang perlu dipisah dari fasilitas produksi nonhormon adalah unit untuk produksi hormon seks (hormon kelamin) seperti estrogen, progesteron dan turunannya. Namun perlu diberi perhatian pada pelaksanaan validasi pembersihan alat/mesin yang digunakan memproses kortikosteroid; pelaksanaan produksi secara campaign; personil menggunakan APD yang sesuai.
3 Page 3 of 8 8. Apakah ruang sampling harus dilengkapi dengan unit LAF? 9. Apa yang disebut recovery time? 10. Bagaimanakah cara menghitung jumlah partikel udara? Ruang sampling untuk pengambilan sampel bahan yang digunakan untuk produksi nonsteril harus memenuhi persyaratan kebersihan kelas E (seperti untuk fasilitas produksi); dan direkomendasikan Ruang Sampling dilengkapi dengan sampling booth (contoh desain lihat POP CPOB 2006, Lampiran 3.22 dan 3.32). Unit LAF atau uni directional air flow (UDAF) dari sampling booth berfungsi untuk menjamin perlindungan bahan terhadap risiko kontaminasi dan keamanan operator. Pengambilan sampel produk steril yang diproses secara aseptis hendaklah dilakukan di ruang kelas A/B. Pengambilan sampel bahan nonsteril untuk produksi produk steril yang diproses dengan sterilisasi akhir dapat dilakukan di ruang kelas D; pengambilan sampel bahan steril dilakukan di ruang Kelas C. Recovery time adalah waktu yang diperlukan oleh suatu sistem HVAC untuk mencapai kembali kondisi at rest kelas kebersihan ruangan yang dilayaninya setelah ruangan terkait digunakan untuk proses produksi. Ruangan-ruangan yang memerlukan ketentuan recovery time adalah Ruang Sampling, Ruang Timbang, Ruang Pembuatan Produk Steril (A, B, C dan D). Lihat Pedoman CPOB 2012 Aneks 1 Butir 6 dan 7 Untuk pengukuran rutin volume sampel total yang diambil tidak kurang dari 1 m 3 untuk kelas A dan B dan dianjurkan juga untuk kelas C. Partikel udara diukur dengan alat khusus yang disebut (airborne) particle counter. Jumlah partikel in-operation pasti meningkat. Yang harus dilakukan adalah menghitung partikel pada periode set up, proses pengisian, dan recovery time sesudah operation (harus kembali pada posisi semula). 11. Pelaksanaan kualifikasi sistem pengolahan air (SPA) terdiri dari 3 fase. Jika modifikasi dilakukan terhadap sistem (yang sudah dikualifikasi), apakah harus dilaksanakan kembali kualifikasi 3 fase tersebut? Pertanyaan tidak menjelaskan bagian apa saja dari sistem SPA yang dimodifikasi. Apabila keseluruhan sistem (unit pengolahan dan sistem distribusi air) yang dimodifikasi, maka kualifikasi 3 fase dilakukan. Apabila hanya sebagian sistem yang dimodifikasi, pelaksanaan kualifikasi dilakukan berdasarkan kajian risiko terhadap sistem. Rekualifikasi dapat terdiri dari 3 fase (untuk modifikasi unit pengolahan saja) atau 1 fase (untuk modifikasi sistem distribusi saja), namun penetapannya didasarkan pada hasil pengkajian risiko. IV PERALATAN 1. Bagaimanakah kualifikasi air shower? Penggunaan / tujuan pemasangan air shower harus dipertimbangkan dan tidak dianjurkan untuk digunakan pada saat masuk ruangan tetapi bila mau keluar ruangan berisiko. Dalam rangka kualifikasi harus ditetapkan kriteria penerimaan (acceptance criteria) kebersihan pakaian setelah melewati proses air showering. Parameter kritis ( yakni jumlah dan posisi nozzle penyembur serta kecepatan semburan/ tiupan dan tarikan/ hisapan udara) diukur dan ditetapkan untuk mencapai acceptance kriteria tsb.
4 Page 4 of 8 V SANITASI DAN HIGIENE 1. Bagaimana cara sterilisasi larutan desinfektan? Sterilisasi larutan desinfektan dilakukan biasanya dengan filtrasi melalui filter steril (sterilising filter) berpori 0,22 µ atau bila memungkinkan sterilisasi cara panas basah (sterilisation by moist heat) menggunakan otoklaf, tergantung sifat/ jenis desinfektan. 2. Bagaimanakah metode pengujian residu deterjen yang digunakan dalam proses pembersihan? Residu deterjen diuji melalui antara lain: 1. analisis kimia yang spesifik terhadap zat kimia deterjen dalam jumlah yang sangat kecil atau; 2. metode Total Organic Carbon (TOC); 3. Uji Busa (Foam Test); 4. spektrofotometri. VII PENGAWASAN MUTU 1. Apakah pola sampling (pengambilan sampel) bahan awal hanya berlaku untuk produk nonsteril dan supplier baru? Bagaimana pola sampling bahan awal untuk produk steril? 2. Metode apa saja yang boleh digunakan untuk pengujian? 3. Apakah alat yang digunakan untuk pelaksanaan uji endotoksin harus didepirogenisasi? Pola sampling yang sama berlaku untuk semua bahan awal nonsteril dan steril. Metode yang diaplikasikan minimal ekuivalen dengan metode resmi yakni metode dari Farmakope Indonesia, USP, BP, EP, JP terbaru atau bila bukan dari kompendial resmi harus divalidasi secara komprehensif. Ya. Karena bila alat berkaitan tidak didepirogenisasi tentu ada risiko bahwa hasil pengujian menunjukkan false endotoxine-positive akibat zat endotoxin yang berasal dari alat tersebut, bukan dari larutan uji. VIII INSPEKSI DIRI, AUDIT MUTU DAN AUDIT & PERSETUJUAN PEMASOK 1. Pada audit eksternal terhadap vendor, apakah pemasok perlu diberi sosialisasi sehingga tidak menolak untuk diinspeksi? 2. Beberapa industri penerima tol tidak bersedia untuk diaudit. Bagaimana menyikapi hal ini? Biasanya pemasok bahan (yang berniat baik) sudah mengerti dan tidak menolak untuk diaudit. Adalah tugas dan tanggung jawab calon pembeli bukan Pemerintah /BPOM - untuk memberi penerangan ( sosialisasi ), bila perlu, agar vendor audit/ inspeksi tidak ditolak. Penerima Kontrak harus bersedia diaudit oleh Pemberi Kontrak baik dalam rangka penunjukan maupun secara rutin pasca penunjukan (yang harus tercakup dalam Surat Kontrak) yang antara lain untuk menentukan apakah (calon) Penerima Kontrak memiliki kapasitas (penyimpanan, produksi dll.) dan kompeten melakukan proses pembuatan produk sesuai CPOB dan standar Pemberi Kontrak. Ingat bahwa yang bertanggung jawab terhadap mutu produk adalah tetap
5 Page 5 of 8 Pemberi Kontrak. Jadi apabila calon Penerima Kontrak tidak bersedia diaudit, Pemberi Kontrak seharusnya tidak menunjuk/mengikat perjanjian kontrak dengan perusahaan tersebut. XI PEMBUATAN DAN ANALISIS KONTRAK 1. Apa ada persyaratan bagi penerima analisis berdasarkan kontrak (contract analysis)? Penerima Kontrak harus memiliki Sertifikat CPOB atau akreditasi dari lembaga akreditasi nasional yang mencakup ruang lingkup pengujian dan bersedia diaudit oleh Pemberi Kontrak baik dalam rangka penunjukan maupun secara rutin pasca penunjukan (tercakup dalam Surat Kontrak) yang antara lain untuk menentukan apakah kompeten melakukan analisis/pengujian terkait. Yang bertanggung jawab terhadap mutu produk (yang diuji berdasarkan kontrak) tetap Pemberi Kontrak. XII KUALIFIKASI DAN VALIDASI 1. Apa prasyarat untuk melakukan validasi proses? Semua bahan (bahan awal, bahan pengemas), alat (mesinmesin produksi, alat-alat ukur), sistem-sistem (HVAC, pengolahan air dan uap bersih serta udara bertekanan, bila bersentuhan dengan produk) dan metode pengujian yang digunakan dalam proses pembuatan yang akan divalidasi harus dikualifikasi dan/ atau divalidasi lebih dahulu; bila tidak, langkah validasi proses tidak valid. 2. Berapa bets sebaiknya yang digunakan untuk melakukan validasi retrospektif? 3. Apakah setelah dilakukan media fill untuk produk aseptis, tidak perlu lagi dilakukan validasi proses? 4. Apakah validasi uji sterilitas perlu dilakukan untuk tiap produk steril atau hanya untuk yang dianggap worst case saja? 5. Bagaimanakah ketentuan validasi pembersihan bag filter untuk fluid bed drier? Validasi proses retrospektif: bets berurutan. Kita harus memisahkan arti media fill dari validasi proses: Media fill adalah validasi proses aseptis untuk membuktikan bahwa prosedur dan semua langkah proses yang dilakukan memberikan sterility assurance ; sedangkan validasi proses adalah untuk membuktikan kehandalan proses dan kinerja mesin untuk masing-masing produk terkait. Validasi uji sterilitas harus dilakukan untuk tiap produk steril dan masing-masing kekuatan dengan pertimbangan bahwa penetapan worst case sulit. Ketentuan validasi pembersihan bag filter sama dengan ketentuan validasi pembersihan mesin/peralatan yang lain. Namun pengambilan sampel tidak bisa dengan cara apus tetapi dengan cara bilas.
6 Page 6 of 8 Pembersihan filter bag yang digunakan untuk lebih dari satu produk (multy purpose) harus divalidasi. Bag filter yang product dedicated tidak memerlukan validasi pembersihan (yang memastikan pengeliminasian cross-contamination). Sedangkan produk toksis harus menggunakan dedicated bag filter. XIII PEMBUATAN PRODUK STERIL 1. Bagaimana persyaratan pakaian dan personil pada validasi proses aseptik / media fill? 2. Apakah personil harus mandi setelah keluar dari area produksi? 3. Apakah ruang kelas A dan B harus kedap udara? 4. Bagaimana persyaratan pertukaran udara untuk kelas B? Karena pada saat pemasangan HVAC, kontrakor mengusulkan 100 kali/ jam (mengingat semakin besar frekuensi pertukaran udara, semakin banyak partikel terlepas dari dinding, lantai) 5. Berapa batas jumlah partikel udara dalam area untuk pembuatan/ pengisian dry injections? 6. Dalam pembuatan injeksi cair nonbetalaktam secara aseptis apakah pencampuran/pemrosesan bahan tambahan (eksipien) dan zat aktif dilakukan di kelas A atau C? 7. Pada saat validasi media fill, hasil menunjukkan memenuhi syarat tapi setelah 6 bulan (revalidasi), Karena validasi dengan media fill adalah menyimulasi proses aseptik yang reguler, semua kondisi operasional termasuk persyaratan pakaian dan personil - harus identis dengan kondisi proses aseptik reguler. Lihat Pedoman CPOB Edisi 2012 dan Petunjuk Operasional Penerapan CPOB Edisi 2006 Aneks 1 Butir Tidak diharuskan personil mandi setelah keluar dari area produksi, kecuali bila meninggalkan area pembuatan produk yang mengandung antibotika tertentu (misal betalaktam), hormon seks dan zat berpotensi sangat tinggi yang lain. Tidak. Kita harus menjaga agar personil termasuk yang bekerja di ruang-ruang kelas A dan B tetap bisa bernafas / mendapat cukup oksigen, jadi perlu udara masuk dan keluar. Kedap udara berarti tidak ada udara masuk dan tidak ada udara keluar. Kelas B direkomendasikan minimal kali/jam. Perlu dikaji dasar yang dirujuk kontraktor tersebut untuk menetapkan persyaratan 100 kali/jam. Nilai pertukaran udara 20 kali/jam adalah acuan minimal, dan tidak mungkin dapat dicapai kebersihan kelas B apabila hanya 20 kali/jam. Pada revisi Pedoman dan POP CPOB 2006, lampiran 3.5a angka 20 kali akan diganti. Sudah ditetapkan di Pedoman CPOB. Pengisian pada pembuatan dry injection dilakukan di area kelas kebersihan A dengan latar belakang kelas B. Pengujian dilakukan pada saat at rest dan saat operasional yaitu pada saat mesin set up (belum menggunakan produk). Waktu proses removal dari partikel (recovery/clean-up time), sehingga setelah penghentian operasi dalam waktu tertentu jumlah partikel segera kembali ke kondisi at rest, harus ditentukan. Preparasi (penambahan/pencampuran dan pelarutan dilakukan di klas C. Pengisian ke dalam wadah akhir (filling) di kelas A berlatar belakang kelas B. Pada simulasi yg tidak memenuhi syarat harus dilakukan investigasi untuk menemukan akar penyebab masalah TMS. Hasil investigasi akan menentukan tindak lanjut yang diambil termasuk pengulangan simulasi bila perlu atau penanganan
7 Page 7 of 8 diperoleh hasil tidak memenuhi syarat. Bagaimana penanganan produk yang ada? 8. Pada saat penimbangan bahan baku steril apakah diperlukan dust collector? 9. Apakah di dalam ruang kelas kebersihan A boleh ada interkom? 10. Untuk produksi hanya satu jenis produk, bagaimana cara / frekuensi pembersihan peralatan / mesin? 11. Apakah alat dan mesin mixing harus disterilkan untuk produk dengan sterilisasi akhir? 12. Pada proses sterilisasi infus, apakah harus menggunakan suhu 121 o C selama 15 menit? 13. Bagaimana memastikan bahwa bioindikator yang digunakan tidak memberikan hasil false positive? terhadap bets/produk yang dihasilkan sebelum pelaksanaan media fill yang gagal. Bila semua hasil pemantauan mikroba terhadap udara ruang produksi (air sampler dan cawan papar), personil yang bekerja, pemantauan proses sterilisasi dan uji sterilitas menunjukkan hasil yang bagus, produk dapat diluluskan apabila: hasil investigasi di atas menyatakan penyebab kegagalan media fill tidak berkaitan dengan proses (non-process related) dan hasil pengulangan media fill dinyatakan lulus; dan hasil pengujian ulang (dua kali pengujian normal) terhadap produk yang diproduksi pada kurun waktu tersebut dinyatakan lulus. Selama belum ada pembuktian tersebut, produk yang diproduksi sejak validasi terakhir yang memenuhi syarat sampai dengan validasi yang tidak memenuhi syarat termasuk yang di pasar dikarantina. Tergantung desain unit LAF yang dipasang. Apabila unit LAF telah didesain sedemikian rupa sehingga debu yang tercipta diarahkan ke bagian unit LAF yang berfungsi menghisap/ mengumpulkan debu, maka dust collector tidak diperlukan. Tidak boleh ada interkom karena konstruksinya mengandung risiko menampung / menyimpan debu dan kuman; dan belum ada cara pembersihan dan sanitasi yang tepat untuk interkom. Namun suatu voice of comunicator yang dilengkapi selaput tembus suara tapi tidak tembus partikel dapat dipasang sebagai alternatif. Harus ditentukan batas sampai setelah berapa bets peralatan tersebut harus dibersihkan; penentuan ini harus ditunjang dengan bukti/validasi. Alat mixing untuk pembuatan produk dengan sterilisasi akhir tidak perlu disterilkan, namun harus dicuci kemudian dibilas akhir dengan WFI. Prosedur pembersihan harus divalidasi dan dibuktikan bahwa kandungan mikroba yang terdeteksi pada permukaan alat tidak melebihi jumlah tertentu (mis. 25 CFU/25cm 2 ); namun demikian disarankan bahwa semua peralatan yang akan digunakan untuk memproses produk, meskipun disterilisasi akhir, disterilkan sebelum digunakan untuk menekan bioburden; dengan demikian proses sterilisasi akhir produk (yang telah divalidasi) tidak akan dibebani oleh bioburden peralatan yang dapat bervariasi. Sesuai monografi farmakope, produk (termasuk bahan pengemasnya) yang stabil-panas (heat stable) harus disterilisasi pada suhu 121 O C selama 15 menit Produk (termasuk bahan pengemasnya) yang panas-labil (heat labil) dapat disterilkan pada suhu lebih rendah yang setara untuk memberikan minimal F O =8 menit dan SAL (Sterility Assurance Level) Jumlah mikroba yang terkandung dalam bioindikator yang digunakan harus diketahui.
8 Page 8 of Sediaan tetes mata tidak memerlukan pemeriksaan endotoksin; apakah pada air yang digunakan untuk proses produksi harus diperiksa endotoksin? 15. Bagaimana cara penyaringan produk yang akan diisikan secara aseptis? 16. Untuk produk steril antibiotika, jika validasi media fill sudah memenuhi syarat, apakah tetap harus dilakukan uji sterilitas? Untuk sediaan tetes mata air murni yang digunakan minimal adalah Purified Water - PW (Air Murni) yang disaring melalui 0,2µm filter, dan persyaratan endotoksin tidak relevan untuk obat tetes mata. Tapi, jika air yang digunakan untuk sediaan tetes mata tersebut diklaim sebagai WFI maka pemeriksaan yang dilakukan pada air harus sesuai dengan spesifikasinya; jadi termasuk pemeriksaan endotoksin. Direkomendasikan melakukan filtrasi serial (seri, bukan paralel) melalui filter 0,2µm kemudian lakukan uji keutuhan (integrity test) terhadap filter. Ya, keduanya harus dilakukan sebagai bagian dari CPOB. XVIII PEMBUATAN OBAT INVESTIGASI UNTUK UJI KLINIS 1. Apakah ada fasilitas untuk produk obat investigasi Produksi obat/sediaan jenis apapun yang akan dikonsumsi harus dilakukan dalam fasilitas sesuai Sertifikat CPOB; dalam hal ini fasilitas untuk produksi obat investigasi harus yang sudah disertifikasi untuk sediaan terkait.
Oleh : Bambang Priyambodo
 Oleh : Bambang Priyambodo SISTEMATIKA CPOB: 2012 merupakan penyempurnaan dari CPOB: 2006, mencakup revisi terhadap : Pedoman CPOB: 2006 Suplemen I Pedoman CPOB: 2006 tahun 2009 Aneks 8 : Cara Pembuatan
Oleh : Bambang Priyambodo SISTEMATIKA CPOB: 2012 merupakan penyempurnaan dari CPOB: 2006, mencakup revisi terhadap : Pedoman CPOB: 2006 Suplemen I Pedoman CPOB: 2006 tahun 2009 Aneks 8 : Cara Pembuatan
BAB II TINJAUAN PUSTAKA. menurut Peraturan Menteri Kesehatan RI No. 1799/Menkes/Per/XII/2010 tentang Industri Farmasi adalah badan usaha yang
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Peraturan Menteri Kesehatan RI No. 1799/Menkes/Per/XII/2010 tentang Industri Farmasi adalah badan
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Peraturan Menteri Kesehatan RI No. 1799/Menkes/Per/XII/2010 tentang Industri Farmasi adalah badan
BAB II TINJAUAN PUSTAKA. Indonesia Nomor 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat.
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat.
BAB II TINJAUAN PUSTAKA. Industri farmasi menurut SK Menkes No. 245/Menkes/SK/V/1990 adalah
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi Industri farmasi menurut SK Menkes No. 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri obat jadi adalah industri yang
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi Industri farmasi menurut SK Menkes No. 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri obat jadi adalah industri yang
BAB II TINJAUAN UMUM. Universitas Sumatera Utara
 BAB II TINJAUAN UMUM 2.1 Industri Farmasi Industri farmasi adalah industri obat jadi dan industri bahan baku obat. Industri farmasi sebagai industri penghasil obat, dituntut untuk dapat menghasilkan obat
BAB II TINJAUAN UMUM 2.1 Industri Farmasi Industri farmasi adalah industri obat jadi dan industri bahan baku obat. Industri farmasi sebagai industri penghasil obat, dituntut untuk dapat menghasilkan obat
BAB II TINJAUAN PUSTAKA. Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri obat jadi dan
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri
BAB II TINJAUAN PUSTAKA. Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri obat jadi dan
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri
BAB II TINJAUAN PUSTAKA. (CPOB). Hal ini didasarkan oleh Keputusan Menteri Kesehatan RI.
 BAB II TINJAUAN PUSTAKA Industri farmasi diwajibkan menerapkan Cara Pembuatan Obat yang Baik (CPOB). Hal ini didasarkan oleh Keputusan Menteri Kesehatan RI. No.43/MENKES/SK/II/1988 tentang CPOB dan Keputusan
BAB II TINJAUAN PUSTAKA Industri farmasi diwajibkan menerapkan Cara Pembuatan Obat yang Baik (CPOB). Hal ini didasarkan oleh Keputusan Menteri Kesehatan RI. No.43/MENKES/SK/II/1988 tentang CPOB dan Keputusan
BAB II TINJAUAN PUSTAKA. Obat Jadi dan Industri Bahan Baku Obat. Definisi dari obat jadi yaitu
 BAB II TINJAUAN PUSTAKA A. Industri Farmasi 1. Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan No. 245/MenKes/SK/V/1990 tentang Ketentuan dan Tata Cara Pelaksanaan Pemberian Izin
BAB II TINJAUAN PUSTAKA A. Industri Farmasi 1. Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan No. 245/MenKes/SK/V/1990 tentang Ketentuan dan Tata Cara Pelaksanaan Pemberian Izin
BAB II TINJAUAN PUSTAKA
 BAB II TINJAUAN PUSTAKA 2.1 Pengertian Industri Farmasi. Industri farmasi menurut Surat Keputusan Menteri Kesehatan Nomor. 245/Menkes/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri
BAB II TINJAUAN PUSTAKA 2.1 Pengertian Industri Farmasi. Industri farmasi menurut Surat Keputusan Menteri Kesehatan Nomor. 245/Menkes/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri
Tugas Individu Farmasi Industri. Uraian Tugas Kepala Bagian Produksi, Pengawasan Mutu dan Pemastian Mutu
 Tugas Individu Farmasi Industri Uraian Tugas Kepala Bagian Produksi, Pengawasan Mutu dan Pemastian Mutu Disusun Oleh : Eka Wahyu Lestari 14340004 Dosen : Drs. Kosasih, M.Sc., Apt. Program Profesi Apoteker
Tugas Individu Farmasi Industri Uraian Tugas Kepala Bagian Produksi, Pengawasan Mutu dan Pemastian Mutu Disusun Oleh : Eka Wahyu Lestari 14340004 Dosen : Drs. Kosasih, M.Sc., Apt. Program Profesi Apoteker
BAB II TINJAUAN PUSTAKA. Industri Farmasi menurut Peraturan Menteri Kesehatan RI Nomor
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri Farmasi menurut Peraturan Menteri Kesehatan RI Nomor 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki izin
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri Farmasi menurut Peraturan Menteri Kesehatan RI Nomor 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki izin
BAB II TINJAUAN PUSTAKA. Industri farmasi menurut SK Menkes No. 245/Menkes/SK/V/1990
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut SK Menkes No. 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut SK Menkes No. 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri
BAB II TINJAUAN PUSTAKA. Industri farmasi menurut Peraturan Menteri Kesehatan RI No.
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Peraturan Menteri Kesehatan RI No. 1799/Menkes/Per/XII/2010 tentang Industri Farmasi adalah badan
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Peraturan Menteri Kesehatan RI No. 1799/Menkes/Per/XII/2010 tentang Industri Farmasi adalah badan
BAB II TINJAUAN UMUM INDUSTRI FARMASI. Lembaga Farmasi Direktorat Kesehatan Angkatan Darat (Lafi Ditkesad)
 BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Perkembangan Lafi Ditkesad Lembaga Farmasi Direktorat Kesehatan Angkatan Darat (Lafi Ditkesad) merupakan lembaga yang telah ada sejak zaman penjajahan Belanda.
BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Perkembangan Lafi Ditkesad Lembaga Farmasi Direktorat Kesehatan Angkatan Darat (Lafi Ditkesad) merupakan lembaga yang telah ada sejak zaman penjajahan Belanda.
BAB II TINJAUAN UMUM. Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik
 BAB II TINJAUAN UMUM 2.1 Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat.
BAB II TINJAUAN UMUM 2.1 Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat.
BAB II TINJAUAN UMUM INDUSTRI. 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki izin dari menteri
 BAB II TINJAUAN UMUM INDUSTRI 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri Farmasi menurut Peraturan Menteri Kesehatan RI Nomor 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki
BAB II TINJAUAN UMUM INDUSTRI 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri Farmasi menurut Peraturan Menteri Kesehatan RI Nomor 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki
BAB II TINJAUAN PUSTAKA. Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri obat jadi dan
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri
Viddy A R. II Selasa, 5 September 2017
 INDUSTRI No. Tanggal Topik/Pokok Bahasan Substansi materi Dosen I Selasa, 29 Agustus 2017 Pendahuluan -Ruang lingkup industri farmasi -Pemenuhan CPOB -Jenis-jenis industri farmasi -Ciri-ciri industri farmasi
INDUSTRI No. Tanggal Topik/Pokok Bahasan Substansi materi Dosen I Selasa, 29 Agustus 2017 Pendahuluan -Ruang lingkup industri farmasi -Pemenuhan CPOB -Jenis-jenis industri farmasi -Ciri-ciri industri farmasi
PEDOMAN CARA PEMBUATAN OBAT YANG BAIK
 7 2013, No.122 LAMPIRAN PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR HK.03.1.33.12.12.8195 TAHUN 2012 TENTANG PENERAPAN PEDOMAN CARA PEMBUATAN OBAT YANG BAIK PENDAHULUAN PRINSIP
7 2013, No.122 LAMPIRAN PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR HK.03.1.33.12.12.8195 TAHUN 2012 TENTANG PENERAPAN PEDOMAN CARA PEMBUATAN OBAT YANG BAIK PENDAHULUAN PRINSIP
B. Tujuan Tujuan Qualiy Assurance adalah untuk memastikan bahwa obat dihasilkan dengan mutu yang sesuai dengan tujuan pemakaiannya.
 PEMASTIAN MUTU (QUALITY ASSURANCE/QA) A. Pendahuluan Industri farmasi bertujuan untuk menghasilkan obat yang harus memenuhi persyaratan khasiat (efficacy), keamanan (safety) dan mutu (quality). Berdasarkan
PEMASTIAN MUTU (QUALITY ASSURANCE/QA) A. Pendahuluan Industri farmasi bertujuan untuk menghasilkan obat yang harus memenuhi persyaratan khasiat (efficacy), keamanan (safety) dan mutu (quality). Berdasarkan
BAB II TINJAUAN PUSTAKA. Obat Jadi dan Industri Bahan Baku Obat. Definisi dari obat jadi yaitu
 BAB II TINJAUAN PUSTAKA A. Industri Farmasi 1. Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan No. 245/MenKes/SK/V/1990 tentang Ketentuan dan Tata Cara Pelaksanaan Pemberian Izin
BAB II TINJAUAN PUSTAKA A. Industri Farmasi 1. Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan No. 245/MenKes/SK/V/1990 tentang Ketentuan dan Tata Cara Pelaksanaan Pemberian Izin
BAB II TINJAUAN PUSTAKA
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 tentang Ketentuan dan Tata cara Pelaksanaan Pemberian Izin Usaha
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 tentang Ketentuan dan Tata cara Pelaksanaan Pemberian Izin Usaha
Quality Control (QC) dan Quality Assurance (QA) Mata Kuliah : Rancangan Produk Industri (2 SKS) Dosen : Kuni Zu aimah B.,S.Farm., M.Farm., Apt.
 Quality Control (QC) dan Quality Assurance (QA) Mata Kuliah : Rancangan Produk Industri (2 SKS) Dosen : Kuni Zu aimah B.,S.Farm., M.Farm., Apt. Industri farmasi harus membuat obat sedemikian rupa agar
Quality Control (QC) dan Quality Assurance (QA) Mata Kuliah : Rancangan Produk Industri (2 SKS) Dosen : Kuni Zu aimah B.,S.Farm., M.Farm., Apt. Industri farmasi harus membuat obat sedemikian rupa agar
BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA
 BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR HK.03.1.33.12.12.8195 TAHUN 2012 TENTANG PENERAPAN PEDOMAN CARA PEMBUATAN OBAT
BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR HK.03.1.33.12.12.8195 TAHUN 2012 TENTANG PENERAPAN PEDOMAN CARA PEMBUATAN OBAT
Aspek-aspek CPOB. Manajemen Mutu Personalia Bangunan dan Fasilitas Peralatan Sanitasi dan Higiene Produksi
 Personalia Aspek-aspek CPOB Manajemen Mutu Personalia Bangunan dan Fasilitas Peralatan Sanitasi dan Higiene Produksi Pengawasan mutu Inspeksi diri dan audit mutu Penanganan keluhan terhadap produk, penarikan
Personalia Aspek-aspek CPOB Manajemen Mutu Personalia Bangunan dan Fasilitas Peralatan Sanitasi dan Higiene Produksi Pengawasan mutu Inspeksi diri dan audit mutu Penanganan keluhan terhadap produk, penarikan
CPOB. (Cara Pembuatan Obat yang Baik)
 CPOB { (Cara Pembuatan Obat yang Baik) CPOB (Cara Pembuatan Obat Yang Baik) 2006 atau GMP (Good Manufacturing Practices) 2006 adalah suatu pedoman pembuatan obat berdasarkan berbagai ketentuan dalam CPOB
CPOB { (Cara Pembuatan Obat yang Baik) CPOB (Cara Pembuatan Obat Yang Baik) 2006 atau GMP (Good Manufacturing Practices) 2006 adalah suatu pedoman pembuatan obat berdasarkan berbagai ketentuan dalam CPOB
BAB II TINJAUAN PUSTAKA. Industri farmasi adalah industri obat jadi dan industri bahan baku obat.
 BAB II TINJAUAN PUSTAKA A. Industri Farmasi Industri farmasi adalah industri obat jadi dan industri bahan baku obat. Industri farmasi sebagai industri penghasil obat, dituntut untuk dapat menghasilkan
BAB II TINJAUAN PUSTAKA A. Industri Farmasi Industri farmasi adalah industri obat jadi dan industri bahan baku obat. Industri farmasi sebagai industri penghasil obat, dituntut untuk dapat menghasilkan
BAB II TINJAUAN UMUM INDUSTRI. 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki izin dari menteri
 BAB II TINJAUAN UMUM INDUSTRI 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri Farmasi menurut Peraturan Menteri Kesehatan RI Nomor 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki
BAB II TINJAUAN UMUM INDUSTRI 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri Farmasi menurut Peraturan Menteri Kesehatan RI Nomor 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki
PEDOMAN PENYIAPAN DOKUMEN INDUK INDUSTRI FARMASI DAN INDUSTRI OBAT TRADISIONAL PENDAHULUAN
 7 2012, No.294 LAMPIRAN PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR HK.04.1.33.02.12.0883 TAHUN 2012 TENTANG DOKUMEN INDUK INDUSTRI FARMASI DAN INDUSTRI OBAT TRADISIONAL PEDOMAN
7 2012, No.294 LAMPIRAN PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR HK.04.1.33.02.12.0883 TAHUN 2012 TENTANG DOKUMEN INDUK INDUSTRI FARMASI DAN INDUSTRI OBAT TRADISIONAL PEDOMAN
BAB II TINJAUAN PUSTAKA
 BAB II TINJAUAN PUSTAKA 2.1. Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia No.245 /Menkes/VI/1990, industri farmasi adalah industri obat jadi dan industri
BAB II TINJAUAN PUSTAKA 2.1. Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia No.245 /Menkes/VI/1990, industri farmasi adalah industri obat jadi dan industri
BAB II TINJAUAN UMUM INDUSTRI FARMASI. (BUMN) dibentuk sebagai Perusahaan Perseroan pada tanggal 16 Agustus
 BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Tinjauan PT. Kimia Farma (Persero) Tbk. 2.1.1 Sejarah Perusahaan. PT. Kimia Farma (Persero) Tbk. sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan
BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Tinjauan PT. Kimia Farma (Persero) Tbk. 2.1.1 Sejarah Perusahaan. PT. Kimia Farma (Persero) Tbk. sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan
TUGAS FARMASI INDUSTRI ELIMINASI DAN VALIDASI 12 ASPEK CPOB
 TUGAS FARMASI INDUSTRI ELIMINASI DAN VALIDASI 12 ASPEK CPOB Nama : SITTI MUNAWARAH NIM : 3351161343 Kelas : D PROGRAM STUDI PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS JENDRAL ACHMAD YANI CIMAHI-JAWA
TUGAS FARMASI INDUSTRI ELIMINASI DAN VALIDASI 12 ASPEK CPOB Nama : SITTI MUNAWARAH NIM : 3351161343 Kelas : D PROGRAM STUDI PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS JENDRAL ACHMAD YANI CIMAHI-JAWA
Industri farmasi menurut Surat Keputusan Menteri Kesehatan Nomor. 245/Menkes/V/1990 adalah industri obat jadi dan industri bahan baku obat.
 BAB II TINJAUAN PUSTAKA 2.1. Pengertian Industri Farmasi. Industri farmasi menurut Surat Keputusan Menteri Kesehatan Nomor. 245/Menkes/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri
BAB II TINJAUAN PUSTAKA 2.1. Pengertian Industri Farmasi. Industri farmasi menurut Surat Keputusan Menteri Kesehatan Nomor. 245/Menkes/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri
KATA PENGANTAR QUALITY CONTROL
 KATA PENGANTAR Assalamu alaikum, wr, wb, Segala Puji senantiasa kami panjatkan kehadirat Allah SWT beserta junjungan kita Nabi Besar Muhammad Rasulullah S.A.W yang telah melimpahkan rahmat, berkah, dan
KATA PENGANTAR Assalamu alaikum, wr, wb, Segala Puji senantiasa kami panjatkan kehadirat Allah SWT beserta junjungan kita Nabi Besar Muhammad Rasulullah S.A.W yang telah melimpahkan rahmat, berkah, dan
BAB III KEGIATAN DI INDUSTRI FARMASI P.T. KIMIA FARMA (PERSERO) TBK. PLANT MEDAN
 BAB III KEGIATAN DI INDUSTRI FARMASI P.T. KIMIA FARMA (PERSERO) TBK. PLANT MEDAN 3.1 Keterlibatan Dalam Produksi Praktek Kerja Profesi Apoteker di P.T. Kimia Farma (Persero) Tbk. Plant Medan, dilaksanakan
BAB III KEGIATAN DI INDUSTRI FARMASI P.T. KIMIA FARMA (PERSERO) TBK. PLANT MEDAN 3.1 Keterlibatan Dalam Produksi Praktek Kerja Profesi Apoteker di P.T. Kimia Farma (Persero) Tbk. Plant Medan, dilaksanakan
BAB 1 MANAJEMEN MUTU
 Lampiran Peraturan Kepala Badan Pengawas Obat dan Makanan Nomor HK.03.1.23.06.11.5629 Tahun 2011 BAB 1 MANAJEMEN MUTU PRINSIP Industri obat tradisional harus membuat obat tradisional sedemikian rupa agar
Lampiran Peraturan Kepala Badan Pengawas Obat dan Makanan Nomor HK.03.1.23.06.11.5629 Tahun 2011 BAB 1 MANAJEMEN MUTU PRINSIP Industri obat tradisional harus membuat obat tradisional sedemikian rupa agar
2 Presiden Nomor 55 Tahun 2013 (Lembaran Negara Republik Indonesia Tahun 2013 Nomor 125); 3. Peraturan Presiden Nomor 24 Tahun 2010 tentang Kedudukan,
 BERITA NEGARA REPUBLIK INDONESIA No.794, 2014 KEMEN KP. Obat Ikan. Cara Pembuatan. PERATURAN MENTERI KELAUTAN DAN PERIKANAN REPUBLIK INDONESIA NOMOR 24/PERMEN-KP/2014 TENTANG CARA PEMBUATAN OBAT IKAN YANG
BERITA NEGARA REPUBLIK INDONESIA No.794, 2014 KEMEN KP. Obat Ikan. Cara Pembuatan. PERATURAN MENTERI KELAUTAN DAN PERIKANAN REPUBLIK INDONESIA NOMOR 24/PERMEN-KP/2014 TENTANG CARA PEMBUATAN OBAT IKAN YANG
BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA
 BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA KEPUTUSAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR HK.04.1.23.09.10.9269 TAHUN 2010 TENTANG PEDOMAN TINDAK LANJUT HASIL PENGAWASAN
BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA KEPUTUSAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR HK.04.1.23.09.10.9269 TAHUN 2010 TENTANG PEDOMAN TINDAK LANJUT HASIL PENGAWASAN
PERSYARATAN TEKNIS CARA PEMBUATAN OBAT TRADISIONAL YANG BAIK BAB 1
 Lampiran Peraturan Kepala Badan Pengawas Obat dan Makanan Nomor HK.03.1.23.06.11.5629 Tahun 2011 Tentang Persyaratan Teknis Cara Pembuatan Obat Tradisioanl Yang Baik (CPOTB) PERSYARATAN TEKNIS CARA PEMBUATAN
Lampiran Peraturan Kepala Badan Pengawas Obat dan Makanan Nomor HK.03.1.23.06.11.5629 Tahun 2011 Tentang Persyaratan Teknis Cara Pembuatan Obat Tradisioanl Yang Baik (CPOTB) PERSYARATAN TEKNIS CARA PEMBUATAN
PRINSIP DAN PELAKSANAAN PENGAMBILAN SAMPEL (SAMPLING) Marlia Singgih Wibowo School of Pharmacy ITB
 PRINSIP DAN PELAKSANAAN PENGAMBILAN SAMPEL (SAMPLING) Marlia Singgih Wibowo School of Pharmacy ITB Prinsip Umum Pengambilan Sampel (Sampling) adalah tahap awal dalam proses dimana data hasil karakterisasi
PRINSIP DAN PELAKSANAAN PENGAMBILAN SAMPEL (SAMPLING) Marlia Singgih Wibowo School of Pharmacy ITB Prinsip Umum Pengambilan Sampel (Sampling) adalah tahap awal dalam proses dimana data hasil karakterisasi
2011, No Mengingat : 1. Undang-Undang Nomor 8 Tahun 1999 tentang Perlindungan Konsumen (Lembaran Negara Republik Indonesia Tahun 1999 Nomor 42,
 BERITA NEGARA REPUBLIK INDONESIA No.393, 2011 BADAN POM. Obat Tradisional. Pembuatan. Persyaratan Teknis. PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR HK.03.1.23.06.11.5629
BERITA NEGARA REPUBLIK INDONESIA No.393, 2011 BADAN POM. Obat Tradisional. Pembuatan. Persyaratan Teknis. PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR HK.03.1.23.06.11.5629
PERANCANGAN PENGAWASAN MUTU - BAHAN BAKU OBAT - SEDIAAN JADI
 PERANCANGAN PENGAWASAN MUTU - BAHAN BAKU OBAT - SEDIAAN JADI STATUS FI IV 1. Buku kumpulan standar dalam bidang farmasi terutama untuk bahan baku obat serta sediaan jadinya, sediaan produk biologi, alat
PERANCANGAN PENGAWASAN MUTU - BAHAN BAKU OBAT - SEDIAAN JADI STATUS FI IV 1. Buku kumpulan standar dalam bidang farmasi terutama untuk bahan baku obat serta sediaan jadinya, sediaan produk biologi, alat
Produksi di Industri Farmasi
 Produksi di Industri Farmasi PRODUKSI istilah terkait Pembuatan Seluruh rangkaian kegiatan dalam menghasilkan suatu obat, meliputi produksi dan pengawasan mutu, mulai dari pengadaan bahan awal dan bahan
Produksi di Industri Farmasi PRODUKSI istilah terkait Pembuatan Seluruh rangkaian kegiatan dalam menghasilkan suatu obat, meliputi produksi dan pengawasan mutu, mulai dari pengadaan bahan awal dan bahan
FORMULIR PEMANTAUAN SELAMA RENOVASI / KONSTRUKSI BANGUNAN
 FORMULIR PEMANTAUAN SELAMA RENOVASI / KONSTRUKSI BANGUNAN Area Renovasi : Tanggal pemantauan : KELAS III N O KEGIATAN YA TIDAK NA KETERANGAN 1 Mengisolasi sistem HVAC di area kerja untuk mencegah kontaminasi
FORMULIR PEMANTAUAN SELAMA RENOVASI / KONSTRUKSI BANGUNAN Area Renovasi : Tanggal pemantauan : KELAS III N O KEGIATAN YA TIDAK NA KETERANGAN 1 Mengisolasi sistem HVAC di area kerja untuk mencegah kontaminasi
Tugas dan tanggungjawab Quality Assurance (QA) / Jaminan Mutu
 Tugas dan tanggungjawab Quality Assurance (QA) / Jaminan Mutu Departemen QA merupakan departemen yang bertanggung jawab antara lain : a) Audit internal QA melakukan evaluasi kerja kesemua bagian/departemen
Tugas dan tanggungjawab Quality Assurance (QA) / Jaminan Mutu Departemen QA merupakan departemen yang bertanggung jawab antara lain : a) Audit internal QA melakukan evaluasi kerja kesemua bagian/departemen
GOOD LABORATORY PRACTICE (PRAKTEK LABORATORIUM YANG BENAR) Hasil pemeriksaan laboratorium digunakan untuk :
 GOOD LABORATORY PRACTICE (PRAKTEK LABORATORIUM YANG BENAR) Pelayanan laboratorium merupakan bagian integral dari pelayanan kesehatan yang diperlukan untuk menunjang upaya peningkatan kesehatan, pencegahan
GOOD LABORATORY PRACTICE (PRAKTEK LABORATORIUM YANG BENAR) Pelayanan laboratorium merupakan bagian integral dari pelayanan kesehatan yang diperlukan untuk menunjang upaya peningkatan kesehatan, pencegahan
BAB II TINJAUAN PUSTAKA. Gudang merupakan sarana pendukung kegiatan produksi industri farmasi
 BAB II TINJAUAN PUSTAKA 2.1 Definisi Gudang merupakan sarana pendukung kegiatan produksi industri farmasi yang berfungsi untuk menyimpan bahan baku, bahan kemas dan obat jadi yang belum didistribusikan.
BAB II TINJAUAN PUSTAKA 2.1 Definisi Gudang merupakan sarana pendukung kegiatan produksi industri farmasi yang berfungsi untuk menyimpan bahan baku, bahan kemas dan obat jadi yang belum didistribusikan.
LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI PT. SANBE FARMA UNIT II CIMAHI
 LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI di PT. SANBE FARMA UNIT II CIMAHI Disusun Oleh : Syabrina Naulita Pane, S.Farm. NIM 093202066 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS
LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI di PT. SANBE FARMA UNIT II CIMAHI Disusun Oleh : Syabrina Naulita Pane, S.Farm. NIM 093202066 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS
PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA
 BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR HK.03.1.23.06.11.5629 TAHUN 2011 TENTANG PERSYARATAN TEKNIS CARA PEMBUATAN OBAT
BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR HK.03.1.23.06.11.5629 TAHUN 2011 TENTANG PERSYARATAN TEKNIS CARA PEMBUATAN OBAT
PETUNJUK OPERASIONAL PENERAPAN PEDOMAN CARA PEMBUATAN OBAT YANG BAIK ANEKS 1 PEMBUATAN PRODUK STERIL EDISI 2013. POPP-Aneks 1-Ped-04/CPOB/2013
 PETUNJUK OPERASIONAL PENERAPAN PEDOMAN CARA PEMBUATAN OBAT YANG BAIK ANEKS 1 PEMBUATAN PRODUK STERIL EDISI 2013 POPP-Aneks 1-Ped-04/CPOB/2013 Badan Pengawas Obat dan Makanan Republik Indonesia 2013 PENGANTAR
PETUNJUK OPERASIONAL PENERAPAN PEDOMAN CARA PEMBUATAN OBAT YANG BAIK ANEKS 1 PEMBUATAN PRODUK STERIL EDISI 2013 POPP-Aneks 1-Ped-04/CPOB/2013 Badan Pengawas Obat dan Makanan Republik Indonesia 2013 PENGANTAR
BAB II TINJAUAN UMUM INDUSTRI FARMASI. Belanda, pada tahun 1958 pemerintah melebur sejumlah perusahaan farmasi
 BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Sejarah PT. Kimia Farma (Persero) Tbk. Sejalan dengan kebijakan nasionalisasi bekas perusahaan-perusahaan Belanda, pada tahun 1958 pemerintah melebur sejumlah
BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Sejarah PT. Kimia Farma (Persero) Tbk. Sejalan dengan kebijakan nasionalisasi bekas perusahaan-perusahaan Belanda, pada tahun 1958 pemerintah melebur sejumlah
BERITA NEGARA REPUBLIK INDONESIA
 BERITA NEGARA REPUBLIK INDONESIA No.382, 2014 KEMENHAN. Peralatan Kesehatan. Lembaga Farmasi TNI. Standardisasi. PERATURAN MENTERI PERTAHANAN REPUBLIK INDONESIA NOMOR 10 TAHUN 2014 TENTANG STANDARDISASI
BERITA NEGARA REPUBLIK INDONESIA No.382, 2014 KEMENHAN. Peralatan Kesehatan. Lembaga Farmasi TNI. Standardisasi. PERATURAN MENTERI PERTAHANAN REPUBLIK INDONESIA NOMOR 10 TAHUN 2014 TENTANG STANDARDISASI
PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA
 PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN NOMOR HK.04.1.33.02.12.0883 TAHUN 2012 TENTANG DOKUMEN INDUK INDUSTRI FARMASI DAN INDUSTRI OBAT TRADISIONAL DENGAN RAHMAT TUHAN YANG MAHA ESA KEPALA BADAN
PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN NOMOR HK.04.1.33.02.12.0883 TAHUN 2012 TENTANG DOKUMEN INDUK INDUSTRI FARMASI DAN INDUSTRI OBAT TRADISIONAL DENGAN RAHMAT TUHAN YANG MAHA ESA KEPALA BADAN
Lampiran 1. Bagan proses Pembuatan Krim
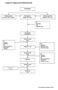 Lampiran 1. Bagan proses Pembuatan Krim Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph -Stabilitas krim Pencampuran Dengan
Lampiran 1. Bagan proses Pembuatan Krim Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph -Stabilitas krim Pencampuran Dengan
KAJIAN RESIKO PENGENDALIAN INFEKSI MATRIX PENCEGAHAN UNTUK PEMBANGUNAN DAN RENOVASI
 KAJIAN RESIKO PENGENDALIAN INFEKSI MATRIX PENCEGAHAN UNTUK PEMBANGUNAN DAN RENOVASI Langkah Pertama : Identifikasi Tipe Aktifitas Proyek Konstruksi (Tipe A-D) Tipe Aktifitas inspeksi dan non-invasif. A
KAJIAN RESIKO PENGENDALIAN INFEKSI MATRIX PENCEGAHAN UNTUK PEMBANGUNAN DAN RENOVASI Langkah Pertama : Identifikasi Tipe Aktifitas Proyek Konstruksi (Tipe A-D) Tipe Aktifitas inspeksi dan non-invasif. A
BAB II TINJAUAN PUSTAKA. Industri Farmasi adalah badan usaha yang memiliki izin dari Menteri
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian industri farmasi Industri Farmasi adalah badan usaha yang memiliki izin dari Menteri Kesehatan untuk melakukan kegiatan pembuatan obat atau
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian industri farmasi Industri Farmasi adalah badan usaha yang memiliki izin dari Menteri Kesehatan untuk melakukan kegiatan pembuatan obat atau
PERSONALIA
 PERSONALIA 1. Persyaratan Umum Jumlah dan Pengetahuan: Memiliki pengetahuan, keterampilan dan kemampuan sesuai dengan tugasnya. Mempunyai sikap dan kesadaran yang tinggi untuk melaksanakan Cara Pembuatan
PERSONALIA 1. Persyaratan Umum Jumlah dan Pengetahuan: Memiliki pengetahuan, keterampilan dan kemampuan sesuai dengan tugasnya. Mempunyai sikap dan kesadaran yang tinggi untuk melaksanakan Cara Pembuatan
LAMPIRAN 1 DENAH PT. OTTO PHARMACEUTICAL INDUSTRIES
 LAMPIRAN 1 DENAH PT. OTTO PHARMACEUTICAL INDUSTRIES 78 Direktur Utama Divisi Pemasaran Produksi Direktur Pemasaran Divisi Pengembangan Bisnis Logistik Divisi Pabrik Ass. Pabrik Umum Divisi Manajemen Mutu
LAMPIRAN 1 DENAH PT. OTTO PHARMACEUTICAL INDUSTRIES 78 Direktur Utama Divisi Pemasaran Produksi Direktur Pemasaran Divisi Pengembangan Bisnis Logistik Divisi Pabrik Ass. Pabrik Umum Divisi Manajemen Mutu
LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT BANDUNG
 LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT BANDUNG Disusun Oleh : YURAIDAH, S.Farm 083202097 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2009 LEMBAR
LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT BANDUNG Disusun Oleh : YURAIDAH, S.Farm 083202097 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2009 LEMBAR
No Kode DAR2/Profesional/582/010/2018 PENDALAMAN MATERI FARMASI MODUL 010: CARA DISTRIBUSI OBAT YANG BAIK. Dr. NURKHASANAH, M.Si., Apt.
 No Kode DAR2/Profesional/582/010/2018 PENDALAMAN MATERI FARMASI MODUL 010: CARA DISTRIBUSI OBAT YANG BAIK Dr. NURKHASANAH, M.Si., Apt. Kementerian Pendidikan dan Kebudayaan Kementerian Riset, Teknologi
No Kode DAR2/Profesional/582/010/2018 PENDALAMAN MATERI FARMASI MODUL 010: CARA DISTRIBUSI OBAT YANG BAIK Dr. NURKHASANAH, M.Si., Apt. Kementerian Pendidikan dan Kebudayaan Kementerian Riset, Teknologi
TUGAS INDIVIDU PENGANTAR MIKROBIOLOGI. Penerapan HACCP pada Proses Produksi Yoghurt
 TUGAS INDIVIDU PENGANTAR MIKROBIOLOGI Penerapan HACCP pada Proses Produksi Yoghurt Disusun Oleh : Yatin Dwi Rahayu 1006578 JURUSAN PENDIDIKAN TEKNOLOGI AGROINDUSTRI FAKULTAS PENDIDIKAN TEKNOLOGI KEJURUAN
TUGAS INDIVIDU PENGANTAR MIKROBIOLOGI Penerapan HACCP pada Proses Produksi Yoghurt Disusun Oleh : Yatin Dwi Rahayu 1006578 JURUSAN PENDIDIKAN TEKNOLOGI AGROINDUSTRI FAKULTAS PENDIDIKAN TEKNOLOGI KEJURUAN
MODUL MATERI UJIAN PERPINDAHAN JABATAN FUNGSIONAL PENGAWAS FARMASI DAN MAKANAN TERAMPIL KE AHLI PEGAWAI NEGERI SIPIL (PNS) BADAN POM RI
 MODUL MATERI UJIAN PERPINDAHAN JABATAN FUNGSIONAL PENGAWAS FARMASI DAN MAKANAN TERAMPIL KE AHLI PEGAWAI NEGERI SIPIL (PNS) BADAN POM RI MATA PELAJARAN : KONSEP DASAR PENGAWASAN BADAN PENGAWAS OBAT DAN
MODUL MATERI UJIAN PERPINDAHAN JABATAN FUNGSIONAL PENGAWAS FARMASI DAN MAKANAN TERAMPIL KE AHLI PEGAWAI NEGERI SIPIL (PNS) BADAN POM RI MATA PELAJARAN : KONSEP DASAR PENGAWASAN BADAN PENGAWAS OBAT DAN
PANDUAN INFECTION CONTROL RISK ASESSMENT (ICRA) KONSTRUKSI RS. BAPTIS BATU TAHUN 2014 RS BAPTIS BATU JL RAYA TLEKUNG NO 1 JUNREJO BATU
 PANDUAN INFECTION CONTROL RISK ASESSMENT (ICRA) KONSTRUKSI RS. BAPTIS BATU TAHUN 2014 RS BAPTIS BATU JL RAYA TLEKUNG NO 1 JUNREJO BATU DAFTAR ISI Halaman Judul... Daftar Isi... Lembar Pengesahan... i ii
PANDUAN INFECTION CONTROL RISK ASESSMENT (ICRA) KONSTRUKSI RS. BAPTIS BATU TAHUN 2014 RS BAPTIS BATU JL RAYA TLEKUNG NO 1 JUNREJO BATU DAFTAR ISI Halaman Judul... Daftar Isi... Lembar Pengesahan... i ii
UNIVERSITAS INDONESIA
 UNIVERSITAS INDONESIA LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. SYDNA FARMA JL. RC. VETERAN NO. 89 BINTARO, JAKARTA SELATAN PERIODE 1 APRIL 3 JUNI 2013 LAPORAN PRAKTEK KERJA PROFESI APOTEKER KARTIKA
UNIVERSITAS INDONESIA LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. SYDNA FARMA JL. RC. VETERAN NO. 89 BINTARO, JAKARTA SELATAN PERIODE 1 APRIL 3 JUNI 2013 LAPORAN PRAKTEK KERJA PROFESI APOTEKER KARTIKA
Pendahuluan. Proteksi Produk Proteksi Personil Proteksi Lingkungan
 Sistem AHU/HVAC Pendahuluan Sistem pengkondisian udara (tata udara) yg dipergunakan di industri farmasi yg mendukung proses produksi sesuai dg syarat yg ditetapkan Tujuan : Proteksi Produk Proteksi Personil
Sistem AHU/HVAC Pendahuluan Sistem pengkondisian udara (tata udara) yg dipergunakan di industri farmasi yg mendukung proses produksi sesuai dg syarat yg ditetapkan Tujuan : Proteksi Produk Proteksi Personil
INVESTIGASI POLA ALIRAN UDARA PADA SISTEM RUANG BERSIH FARMASI SKRIPSI DIMAS ADRIANTO
 INVESTIGASI POLA ALIRAN UDARA PADA SISTEM RUANG BERSIH FARMASI SKRIPSI Oleh DIMAS ADRIANTO 0404020215 DEPARTEMEN TEKNIK MESIN FAKULTAS TEKNIK UNIVERSITAS INDONESIA GENAP 2007/2008 1 INVESTIGASI POLA ALIRAN
INVESTIGASI POLA ALIRAN UDARA PADA SISTEM RUANG BERSIH FARMASI SKRIPSI Oleh DIMAS ADRIANTO 0404020215 DEPARTEMEN TEKNIK MESIN FAKULTAS TEKNIK UNIVERSITAS INDONESIA GENAP 2007/2008 1 INVESTIGASI POLA ALIRAN
BAB II TINJAUAN PUSTAKA. Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia No.
 BAB II TINJAUAN PUSTAKA 2.1 Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia No. 245/Menkes/SK/V/1990, yang dimaksud dengan industri farmasi adalah industri
BAB II TINJAUAN PUSTAKA 2.1 Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia No. 245/Menkes/SK/V/1990, yang dimaksud dengan industri farmasi adalah industri
UNIVERSITAS INDONESIA
 UNIVERSITAS INDONESIA LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT ASTRAZENECA INDONESIA CIKARANG SITE JALAN TEKNO RAYA BLOK B1A B1B, CIKARANG, BEKASI JAWA BARAT PERIODE 6 JANUARI 21 FEBRUARI 2014 LAPORAN
UNIVERSITAS INDONESIA LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT ASTRAZENECA INDONESIA CIKARANG SITE JALAN TEKNO RAYA BLOK B1A B1B, CIKARANG, BEKASI JAWA BARAT PERIODE 6 JANUARI 21 FEBRUARI 2014 LAPORAN
5.1.1 Kesimpulan Tugas Khusus Pengawasan Mutu - Kualitas air dan menjaga air dari kontaminasi mikrobiologi merupakan bagian penting untuk memastikan
 BAB V KESIMPULAN 5.1. Kesimpulan Kesimpulan yang dapat diambil dari hasil kegiatan Praktek Kerja Profesi Apoteker (PKPA) pada tanggal 03 April 2017 sampai 19 Mei 2017 di PT. OTTO Pharmaceutical Industries
BAB V KESIMPULAN 5.1. Kesimpulan Kesimpulan yang dapat diambil dari hasil kegiatan Praktek Kerja Profesi Apoteker (PKPA) pada tanggal 03 April 2017 sampai 19 Mei 2017 di PT. OTTO Pharmaceutical Industries
BAB II TINJAUAN UMUM PT. COMBIPHAR. PT. Combiphar didirikan pada tahun 1971 di Jl. Sukabumi no. 61,
 BAB II TINJAUAN UMUM PT. COMBIPHAR 2.1 Sejarah Perkembangan PT. Combiphar PT. Combiphar didirikan pada tahun 1971 di Jl. Sukabumi no. 61, Bandung di bawah pengelolaan Drs. Handoko Prayogo, Apt. Berawal
BAB II TINJAUAN UMUM PT. COMBIPHAR 2.1 Sejarah Perkembangan PT. Combiphar PT. Combiphar didirikan pada tahun 1971 di Jl. Sukabumi no. 61, Bandung di bawah pengelolaan Drs. Handoko Prayogo, Apt. Berawal
BAB II TINJAUAN UMUM INDUSTRI FARMASI. mendapatkan sertifikat Cara Pembuatan Obat yang Baik pada tahun Saat ini
 BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1. Sejarah PT. Universal Pharmaceutical Industries didirikan pada tahun 1975 dan mendapatkan sertifikat Cara Pembuatan Obat yang Baik pada tahun 1995. Saat ini dalam
BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1. Sejarah PT. Universal Pharmaceutical Industries didirikan pada tahun 1975 dan mendapatkan sertifikat Cara Pembuatan Obat yang Baik pada tahun 1995. Saat ini dalam
Cara Distribusi Obat yang Baik (CDOB)
 Cara Distribusi Obat yang Baik (CDOB) BPOM dalam mengawal obat Visi : Obat dan makanan terjamin aman,bermutu dan berkhasiat. Misi: Melindungi masyarakat dari obat dan makanan yang beresiko terhadap kesehatan.
Cara Distribusi Obat yang Baik (CDOB) BPOM dalam mengawal obat Visi : Obat dan makanan terjamin aman,bermutu dan berkhasiat. Misi: Melindungi masyarakat dari obat dan makanan yang beresiko terhadap kesehatan.
LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI PT. KIMIA FARMA PLANT MEDAN
 LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI DI PT. KIMIA FARMA PLANT MEDAN DISUSUN OLEH : ERNITA, S. Farm 093202016 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN
LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI DI PT. KIMIA FARMA PLANT MEDAN DISUSUN OLEH : ERNITA, S. Farm 093202016 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN
UNIVERSITAS INDONESIA
 UNIVERSITAS INDONESIA LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. COMBIPHAR JL. RAYA SIMPANG NO. 383 PADALARANG BANDUNG PERIODE 07 MARET 01 APRIL 2011 LAPORAN PRAKTEK KERJA PROFESI APOTEKER MOCHAMAD
UNIVERSITAS INDONESIA LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. COMBIPHAR JL. RAYA SIMPANG NO. 383 PADALARANG BANDUNG PERIODE 07 MARET 01 APRIL 2011 LAPORAN PRAKTEK KERJA PROFESI APOTEKER MOCHAMAD
BAB II TINJAUAN UMUM PT. COMBIPHAR. bawah pengelolaan Drs. Handoko Prayogo, Apt. Berawal dari industri rumah
 BAB II TINJAUAN UMUM PT. COMBIPHAR 2.1 Sejarah Perkembangan PT. Combiphar PT. Combiphar didirikan pada tahun 1971 di Jl. Sukabumi 61 Bandung, di bawah pengelolaan Drs. Handoko Prayogo, Apt. Berawal dari
BAB II TINJAUAN UMUM PT. COMBIPHAR 2.1 Sejarah Perkembangan PT. Combiphar PT. Combiphar didirikan pada tahun 1971 di Jl. Sukabumi 61 Bandung, di bawah pengelolaan Drs. Handoko Prayogo, Apt. Berawal dari
PENERAPAN CARA BUDIDAYA IKAN YANG BAIK (CBIB) PADA UNIT USAHA BUDIDAYA
 PENERAPAN CARA BUDIDAYA IKAN YANG BAIK (CBIB) PADA UNIT USAHA BUDIDAYA Direktorat Jenderal Perikanan Budidaya Direktorat Produksi 2010 Pendahuluan Dalam rangka menghadapi era globalisasi, maka produk perikanan
PENERAPAN CARA BUDIDAYA IKAN YANG BAIK (CBIB) PADA UNIT USAHA BUDIDAYA Direktorat Jenderal Perikanan Budidaya Direktorat Produksi 2010 Pendahuluan Dalam rangka menghadapi era globalisasi, maka produk perikanan
BAB I PENDAHULUAN 1.1. Latar Belakang
 BAB I PENDAHULUAN 1.1. Latar Belakang Seiring dengan berkembangnya jaman masyarakat semakin sadar bahwa akan pentingnya kesehatan dalam kehidupan. Kesehatan merupakan salah satu aspek terpenting untuk
BAB I PENDAHULUAN 1.1. Latar Belakang Seiring dengan berkembangnya jaman masyarakat semakin sadar bahwa akan pentingnya kesehatan dalam kehidupan. Kesehatan merupakan salah satu aspek terpenting untuk
BAB IV ANALISA DAN PEMBAHASAN
 55 BAB IV ANALISA DAN PEMBAHASAN 4.1 Proses Penanganan Contoh Sample merupakan bahan-bahan yang akan digunakan dalam baik dalam proeses pembuatan obat secara langsung maupun baha-bahan penunjang lain yang
55 BAB IV ANALISA DAN PEMBAHASAN 4.1 Proses Penanganan Contoh Sample merupakan bahan-bahan yang akan digunakan dalam baik dalam proeses pembuatan obat secara langsung maupun baha-bahan penunjang lain yang
UNIVERSITAS INDONESIA
 UNIVERSITAS INDONESIA LAPORAN PRAKTIK KERJA PROFESI APOTEKER DI PT. KALBE FARMA, Tbk. KAWASAN INDUSTRI DELTA SILICON JL. M.H. THAMRIN BLOK A3-1, LIPPO CIKARANG BEKASI PERIODE 01 APRIL - 30 MEI 2014 LAPORAN
UNIVERSITAS INDONESIA LAPORAN PRAKTIK KERJA PROFESI APOTEKER DI PT. KALBE FARMA, Tbk. KAWASAN INDUSTRI DELTA SILICON JL. M.H. THAMRIN BLOK A3-1, LIPPO CIKARANG BEKASI PERIODE 01 APRIL - 30 MEI 2014 LAPORAN
BLUEPRINT UJI KOMPETENSI APOTEKER INDONESIA METODE OSCE
 BLUEPRINT UJI KOMPETENSI APOTEKER INDONESIA METODE OSCE 2017 I. PENGANTAR Uji Kompetensi Apoteker Indonesia (UKAI) merupakan penerapan sistem uji kompetensi secara nasional pada tahap akhir pendidikan
BLUEPRINT UJI KOMPETENSI APOTEKER INDONESIA METODE OSCE 2017 I. PENGANTAR Uji Kompetensi Apoteker Indonesia (UKAI) merupakan penerapan sistem uji kompetensi secara nasional pada tahap akhir pendidikan
KEPUTUSAN MENTERI KESEHATAN REPUBLIK INDONESIA NOMOR : 965/MENKES/SK/XI/1992 TENTANG
 KEPUTUSAN MENTERI KESEHATAN NOMOR : 965/MENKES/SK/XI/1992 TENTANG CARA PRODUKSI KOSMETIKA YANG BAIK MENTERI KESEHATAN, Menimbang : a. bahwa langkah utama untuk menjamin keamanan kosmetika adalah penerapan
KEPUTUSAN MENTERI KESEHATAN NOMOR : 965/MENKES/SK/XI/1992 TENTANG CARA PRODUKSI KOSMETIKA YANG BAIK MENTERI KESEHATAN, Menimbang : a. bahwa langkah utama untuk menjamin keamanan kosmetika adalah penerapan
PEDOMAN TEKNIS CARA DISTRIBUSI OBAT YANG BAIK
 7 LAMPIRAN PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR HK.03.1.34.11.12.7542 TAHUN 2012 TENTANG PEDOMAN TEKNIS CARA DISTRIBUSI OBAT YANG BAIK PEDOMAN TEKNIS CARA DISTRIBUSI
7 LAMPIRAN PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR HK.03.1.34.11.12.7542 TAHUN 2012 TENTANG PEDOMAN TEKNIS CARA DISTRIBUSI OBAT YANG BAIK PEDOMAN TEKNIS CARA DISTRIBUSI
Penggunaan terbesar herbal. Fitofarmaka. supplement. kosmetik
 Penggunaan terbesar herbal Fitofarmaka supplement kosmetik Pasar herbal Pasar dunia 10 M USD Nilai export indonesia 100 Triliun Kualitas Produksi herbal GAP GMP GDP GAP ON FARM Iklim Tanah Ketinggian bibit
Penggunaan terbesar herbal Fitofarmaka supplement kosmetik Pasar herbal Pasar dunia 10 M USD Nilai export indonesia 100 Triliun Kualitas Produksi herbal GAP GMP GDP GAP ON FARM Iklim Tanah Ketinggian bibit
ENVIRONMENTAL MONITORING RISK ASSESSMENT. By Tim Sandle
 ENVIRONMENTAL MONITORING RISK ASSESSMENT By Tim Sandle PENDAHULUAN Pemantauan lingkungan atau Environmental Monitoring menggambarkan pengujian mikrobiologi yang dilakukan dengan tujuan untuk mendeteksi
ENVIRONMENTAL MONITORING RISK ASSESSMENT By Tim Sandle PENDAHULUAN Pemantauan lingkungan atau Environmental Monitoring menggambarkan pengujian mikrobiologi yang dilakukan dengan tujuan untuk mendeteksi
PETUNJUK OPERASIONAL PENERAPAN JILID II
 PETUNJUK OPERASIONAL PENERAPAN PEDOMAN CARA PEMBUATAN OBAT YANG BAIK 2012 JILID II POPP-04/CPOB/2014 Badan Pengawas Obat dan Makanan Republik Indonesia 2014 HAK CIPTA DILINDUNGI UNDANG-UNDANG Dilarang
PETUNJUK OPERASIONAL PENERAPAN PEDOMAN CARA PEMBUATAN OBAT YANG BAIK 2012 JILID II POPP-04/CPOB/2014 Badan Pengawas Obat dan Makanan Republik Indonesia 2014 HAK CIPTA DILINDUNGI UNDANG-UNDANG Dilarang
BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA
 BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR 10 TAHUN 2017 TENTANG PENERAPAN PEDOMAN CARA PEMBUATAN OBAT YANG BAIK DI UNIT
BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR 10 TAHUN 2017 TENTANG PENERAPAN PEDOMAN CARA PEMBUATAN OBAT YANG BAIK DI UNIT
PERATURAN KEPALA BADAN PENGAWAS TENAGA NUKLIR NOMOR 2 TAHUN 2011 TENTANG KETENTUAN KESELAMATAN OPERASI REAKTOR NONDAYA
 PERATURAN KEPALA BADAN PENGAWAS TENAGA NUKLIR NOMOR 2 TAHUN 2011 TENTANG KETENTUAN KESELAMATAN OPERASI REAKTOR NONDAYA DENGAN RAHMAT TUHAN YANG MAHA ESA KEPALA BADAN PENGAWAS TENAGA NUKLIR, Menimbang :
PERATURAN KEPALA BADAN PENGAWAS TENAGA NUKLIR NOMOR 2 TAHUN 2011 TENTANG KETENTUAN KESELAMATAN OPERASI REAKTOR NONDAYA DENGAN RAHMAT TUHAN YANG MAHA ESA KEPALA BADAN PENGAWAS TENAGA NUKLIR, Menimbang :
Standar Mikrobiologi dan Uji Mikrobiologi untuk Bahan dan Produk Farmasi. Marlia Singgih Wibowo
 Standar Mikrobiologi dan Uji Mikrobiologi untuk Bahan dan Produk Farmasi Marlia Singgih Wibowo Bahan Farmasi Bahan baku Air murni (Purified Water) Produk Farmasi Steril (Sterile Pharmaceuticals) Produk
Standar Mikrobiologi dan Uji Mikrobiologi untuk Bahan dan Produk Farmasi Marlia Singgih Wibowo Bahan Farmasi Bahan baku Air murni (Purified Water) Produk Farmasi Steril (Sterile Pharmaceuticals) Produk
PRODUKSI FARMASI di RUMAH SAKIT
 PRODUKSI FARMASI di RUMAH SAKIT Kuliah : FARMASI RUMAH SAKIT Heru Sasongko, M.Sc,.,Apt. Pustaka : IFRS RSUP DR SARDJITO YOGYAKARTA PRODUKSI FARMASI : Merupakan kegiatan membuat, merubah bentuk dan me-ngemas
PRODUKSI FARMASI di RUMAH SAKIT Kuliah : FARMASI RUMAH SAKIT Heru Sasongko, M.Sc,.,Apt. Pustaka : IFRS RSUP DR SARDJITO YOGYAKARTA PRODUKSI FARMASI : Merupakan kegiatan membuat, merubah bentuk dan me-ngemas
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI DI PT. KIMIA FARMA (PERSERO) Tbk PLANT MEDAN
 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI DI PT. KIMIA FARMA (PERSERO) Tbk PLANT MEDAN DISUSUN OLEH : SRI ROMAITO HASIBUAN, S.Farm 093202065 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI DI PT. KIMIA FARMA (PERSERO) Tbk PLANT MEDAN DISUSUN OLEH : SRI ROMAITO HASIBUAN, S.Farm 093202065 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS
PERSYARATAN TAMBAHAN LABORATORIUM LINGKUNGAN
 PERSYARATAN TAMBAHAN LABORATORIUM LINGKUNGAN Lampiran I Peraturan Menteri Negara Lingkungan Hidup Nomor : 06 Tahun 2009 Tanggal : 6 April 2009 PERSYARATAN TAMBAHAN LABORATORIUM LINGKUNGAN Persyaratan
PERSYARATAN TAMBAHAN LABORATORIUM LINGKUNGAN Lampiran I Peraturan Menteri Negara Lingkungan Hidup Nomor : 06 Tahun 2009 Tanggal : 6 April 2009 PERSYARATAN TAMBAHAN LABORATORIUM LINGKUNGAN Persyaratan
LAPORAN PRAKTIKUM MIKROBIOLOGI DASAR STERILISASI
 LAPORAN PRAKTIKUM MIKROBIOLOGI DASAR STERILISASI Disusun Oleh: Rifki Muhammad Iqbal (1211702067) Biologi 3 B Kelompok 6 JURUSAN BIOLOGI FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS ISLAM NEGERI (UIN) SUNAN
LAPORAN PRAKTIKUM MIKROBIOLOGI DASAR STERILISASI Disusun Oleh: Rifki Muhammad Iqbal (1211702067) Biologi 3 B Kelompok 6 JURUSAN BIOLOGI FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS ISLAM NEGERI (UIN) SUNAN
CHECKLIST DOKUMEN REGISTRASI OBAT COPY
 CHECKLIST DOKUMEN REGISTRASI OBAT COPY I. INFORMASI PRODUK Nama Obat : Bentuk sediaan & Kekuatan : Zat aktif : Kemasan : Pendaftar : Produsen : Kategori registrasi : II. DOKUMEN YANG DISERAHKAN No. Parameter
CHECKLIST DOKUMEN REGISTRASI OBAT COPY I. INFORMASI PRODUK Nama Obat : Bentuk sediaan & Kekuatan : Zat aktif : Kemasan : Pendaftar : Produsen : Kategori registrasi : II. DOKUMEN YANG DISERAHKAN No. Parameter
MENTERI KESEHATAN REPUBLIK INDONESIA
 KEPUTUSAN MENTERI KESEHATAN NOMOR: 659/MENKES/SK/X/1991 TENTANG CARA PEMBUATAN OBAT TRADISIONAL YANG BAIK MENTERI KESEHATAN Menimbang : a. bahwa untuk membuat obat tradisional yang memenuhi persyaratan
KEPUTUSAN MENTERI KESEHATAN NOMOR: 659/MENKES/SK/X/1991 TENTANG CARA PEMBUATAN OBAT TRADISIONAL YANG BAIK MENTERI KESEHATAN Menimbang : a. bahwa untuk membuat obat tradisional yang memenuhi persyaratan
REGULATORY COMPLIANCE DI INDUSTRI FARMASI
 REGULATORY COMPLIANCE DI INDUSTRI FARMASI What? HOW? Why? When? A. Retno Tyas Utami. 4 Januari 2014 POKOK BAHASAN Pendahuluan (sistem pengawasan ) Inspeksi CPOB Regulatori BADAN POM RI Maturity Industri
REGULATORY COMPLIANCE DI INDUSTRI FARMASI What? HOW? Why? When? A. Retno Tyas Utami. 4 Januari 2014 POKOK BAHASAN Pendahuluan (sistem pengawasan ) Inspeksi CPOB Regulatori BADAN POM RI Maturity Industri
Air dan air limbah- Bagian 3: Cara uji padatan tersuspensi total (Total Suspended Solid, TSS) secara gravimetri
 Standar Nasional Indonesia Air dan air limbah- Bagian 3: Cara uji padatan tersuspensi total (Total Suspended Solid, TSS) secara gravimetri ICS 13.060.50 Badan Standardisasi Nasional Daftar isi Daftar
Standar Nasional Indonesia Air dan air limbah- Bagian 3: Cara uji padatan tersuspensi total (Total Suspended Solid, TSS) secara gravimetri ICS 13.060.50 Badan Standardisasi Nasional Daftar isi Daftar
KEPUTUSAN KEPALA BADAN PENGAWAS TENAGA NUKLIR NOMOR : 14/Ka-BAPETEN/VI-99 TENTANG KETENTUAN KESELAMATAN PABRIK KAOS LAMPU
 KEPUTUSAN KEPALA BADAN PENGAWAS TENAGA NUKLIR NOMOR : 14/Ka-BAPETEN/VI-99 TENTANG KETENTUAN KESELAMATAN PABRIK KAOS LAMPU KEPALA BADAN PENGAWAS TENAGA NUKLIR, Menimbang : a. bahwa proses pembuatan kaos
KEPUTUSAN KEPALA BADAN PENGAWAS TENAGA NUKLIR NOMOR : 14/Ka-BAPETEN/VI-99 TENTANG KETENTUAN KESELAMATAN PABRIK KAOS LAMPU KEPALA BADAN PENGAWAS TENAGA NUKLIR, Menimbang : a. bahwa proses pembuatan kaos
(BUMN) dibentuk sebagai Perusahaan Perseroan pada tanggal 16 Agustus Sejak berdirinya hingga sekarang ini PT. Kimia Farma (Persero) Tbk.
 BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Tinjauan PT. Kimia Farma (Persero) Tbk. 2.1.1 Sejarah Perusahaan. PT. Kimia Farma (Persero) Tbk. sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan
BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Tinjauan PT. Kimia Farma (Persero) Tbk. 2.1.1 Sejarah Perusahaan. PT. Kimia Farma (Persero) Tbk. sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan
BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA
 PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN NOMOR HK.04.1.33.12.11.09938 TAHUN 2011 TENTANG KRITERIA DAN TATA CARA PENARIKAN OBAT YANG TIDAK MEMENUHI STANDAR DAN/ATAU PERSYARATAN DENGAN RAHMAT TUHAN
PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN NOMOR HK.04.1.33.12.11.09938 TAHUN 2011 TENTANG KRITERIA DAN TATA CARA PENARIKAN OBAT YANG TIDAK MEMENUHI STANDAR DAN/ATAU PERSYARATAN DENGAN RAHMAT TUHAN
