KESTABILAN OBAT. Dr. Joshita.D, MS Program S2 Ilmu Kefarmasian Departemen Farmasi FMIPA Universitas Indonesia 2008
|
|
|
- Johan Lesmono
- 7 tahun lalu
- Tontonan:
Transkripsi
1 KESTABILAN OBAT Dr. Joshita.D, MS Program S2 Ilmu Kefarmasian Departemen Farmasi FMIPA Universitas Indonesia 2008
2 ACUAN YANG DIGUNAKAN FDA Guideline 1984, 1987 Drug Stability, Carstensen JT, 3 rd ed,2000 Chemical Kinetics, Laidler KJ, 1980 Chemical Stability of Pharmaceuticals, Connors KA, Amidon GL, Stella VJ, 1986 IFSCC Monograph number 2, The Fundamentals of Stability testing, 1992 Physical Pharmacy, Martin, 2006
3 Satuan Acara Perkuliahan Pendahuluan, Pengertian Stabilitas Obat : expiration date - shelf-life, Potential Adverse Effects of Instability in Pharmaceutical Products, The Gamut of Stability Concerns, Reasons for Stability Testing, Modes of Degradation, Stability Test Stabilitas kimia:kinetika Reaksi: Pengertian Laju Reaksi, Orde Reaksi, Molekularita, Orde 0 1 2, Reaksi Kompleks,Cara Menentukan Orde Reaksi, Kondisi penyimpanan : pengaruh suhu dan faktor lain terhadap laju reaksi, Penguraian dan penstabilan obat, Analisis kestabilan dipercepat Stabilitas Fisika Uji Stabilitas sediaan farmasi/kosmetik
4 PENDAHULUAN STABILITAS ADALAH SIMBOL KUALITAS YANG PENTING UNTUK PRODUK OBAT/KOSMETIK Stabilitas Obat : Kemampuan suatu produk untuk mempertahankan sifat dan karakteristiknya agar sama dengan yang dimilikinya pada saat dibuat (identitas, kekuatan, kualitas, kemurnian) dalam batasan yang ditetapkan sepanjang periode penyimpanan dan penggunaan (shelf-life) Expiration date : waktu yang tertera pada kemasan yang menunjukkan batas waktu diperbolehkannya obat tersebut dikonsumsi karena diharapkan masih memenuhi spesifikasi yang ditetapkan Shelf-life (waktu simpan): adalah periode penggunaan dan penyimpanan yaitu waktu dimana suatu produk tetap memenuhi spesifikasinya jika disimpan dalam wadahnya yang sesuai dengan kondisi penjualan di pasar
5 Jenis spesifikasi Spesifikasi release adalah spesifikasi yang harus dipenuhi pada waktu pembuatan, misalnya %. Spesifikasi periksa atau spesifikasi waktu simpan atau spesifikasi umur produk, adalah spesifikasi yang harus dipenuhi sepanjang waktu simpannya, misalnya %.
6 Spesifikasi release dan spesifikasi waktu simpan Waktu simpan minimum : Periode waktu yang dibutuhkan suatu produk yang berada pada batas spesifikasi release saat pembuatan untuk mencapai batas spesifikasi periksa Spesifikasi release Spesifikasi waktu simpan
7 Stabilitas didefinisikan sebagai kemampuan suatu produk obat atau kosmetik untuk bertahan dalam batas spesifikasi yang ditetapkan sepanjang periode penyimpanan dan penggunaan untuk menjamin identitas, kekuatan, kualitas dan kemurnian produk tersebut Sediaan obat/kosmetika yang stabil adalah suatu sediaan yang masih berada dalam batas yang dapat diterima selama periode penyimpanan dan penggunaan, dimana sifat dan karakteristiknya sama dengan yang dimilikinya pada saat dibuat.
8 Efek tidak diinginkan yang potensial dari ketidakstabilan produk farmasi hilangnya zat aktif, naiknya konsentrasi zat aktif, BA berubah, hilangnya keseragaman kandungan, menurunnya status mikrobiologis, hilangnya elegansi produk dan patient acceptability, pembentukan hasil urai yang toksik, hilangnya kekedapan kemasan, menurunnya kualitas label dan modifikasi faktor hubungan fungsional.
9 RUANG LINGKUP DAN ALASAN UJI STABILITAS Ruang lingkup: Bahan baku obat dan eksipien R&D Formulasi Bahan uji klinik Obat untuk dipasarkan Reformulasi, perubahan tempat pembuatan, mengatasi kesulitan, keluhan pasien Produk dlm distribusi Penyimpanan produk oleh pasien Stabilitas in vivo Alasan uji stabilitas: 1. Kepentingan pasien 2. Reputasi produsen 3. Mengikuti peraturan 4. Membuat data base yang penting untuk formulasi produk lain
10 JENIS PENGURAIAN: 1. Kimia 2. Fisika 3. Biologi 4. Kombinasi Therapeutic Toxicological Drug product stability ELEMEN PENTING UNTUK PROGRAM UJI STABILITAS YANG BERKUALITAS TINGGI DAN COST EFFECTIVE 1.Komitmen pada kualitas 2.Dasar teori Scientific 3.Pengetahuan ttg Peraturan dan Standar Farmakope 4.Komunikasi efektif R&D, Produksi, QC/QA, Bagian Keluhan dan Regulasi 5.Metode Analitik yang digunakan 6.Monitoring cermat untuk anggaran stabilitas 7.Kemampuan managerial untuk mengkoordinasi dan mengoptimasi program
11 LANJUTAN 1. Periode kesesuaian : simbol Strategi untuk meningkatkan kualitas untuk produk yang shelf life: paling cepat rusak karena bergantung pada waktu misalnya hilangnya potensi zat aktif 1. Mengurangi kesalahan Sampling dan Analisis : ketepatan waktu sampling, 2. Shelf Life: 7 hari, 1 bulan, 1 improve precision dan tahun, 18 bulan, tahun reproducibility 3. Expiration Date: waktu yang 2. Statistik tertera pada kemasan setiap batch yang menunjukkan masa 3. Proses:mengaliri ampul berisi larutan dengan N2 berakhirnya produk tsb boleh 4. Formulasi:stability dikonsumsi. overages, mengurangi Singkat : May 06 hidrolisis-kompleksasi dgn Panjang (5thn): Feb April June cyclodextrin,oksidasiantioksidan,cemaran 2006 January 11, August Nov.2006 July 11 mikroba-pengawet
12 KONDISI IKLIM DUNIA Zona Iklim Tempat Suhu rata2 tahunan I. Temperate climate/sedang II.Mediteranean dan subtropik III.Panas dan kering Eropa Utara, Kanada, Inggris,Rusia Eropa Selatan, Jepang. Amerika Serikat Sahara,Arab Saudi, Australia Kelembab an udara Kondisi Penyimpanan < atau = 15 o C Tanpa batas 21 o C/45%RH o C Tanpa batas 25 o C/60%RH >22 o C <60% 30 o C/35%RH IV.Panas dan lembab Afrika Tengah, Indonesia, Filipina >22 o C < atau = 60% 30 o C/70%RH
13 UJI STABILITAS cgmp 1972 FDA MARET 1984; REVISED FDA 1987 FDA Guidance for Industry 1998 ICH (International Conference on Harmonization) Oktober 1993: US,EU,JAPAN ICH QIA September 1994 WHO 1996 CPMP (The Committee for Propietary Medicinal Products) di bawah EU Okt 1997-April 1998
14 JENIS STABILITAS YANG UMUM DIKENAL Stabilitas kimia Stabilitas fisika Stabilitas mikrobiologi Stabilitas terapi Stabilitas toksikologi
15 STABILITAS KIMIA: MEMPERTAHANKAN KEUTUHAN KIMIAWI DAN POTENSI ZAT AKTIF YANG TERTERA PADA ETIKET DALAM BATASAN SPESIFIKASI Laju Reaksi : dinyatakan dalam term pengurangan konsentrasi reaktan (- dc/dt) atau penambahan konsentrasi produk (+dx/dt) per satuan waktu. Dimensinya : mol liter -1 detik 1 Orde Reaksi : jumlah atom atau molekul yang terlibat dalam reaksi yang konsentrasinya menentukan laju reaksi. Molekularita : jumlah molekul yang terlibat dalam reaksi elementer Orde dan cara menentukan orde reaksi Kondisi Penyimpanan : Pengaruh suhu dan faktor lain thd laju reaksi Penguraian dan penstabilan obat Analisis kestabilan dipercepat
16 ZERO-ORDER REACTION: loss in color of a product, suspension - da/dt = k 0 Integrated between initial absorbance A 0 at t 0 and A t, the absorbance after t hours : Ao At da = - k 0 0 t dt A t A 0 = - k 0 t A t = A 0 k 0 t A t 1/2 = ½ A 0 /k 0
17 FIRST-ORDER REACTION 2 H 2 O 2 = 2 H 2 O + O 2 - dc/dt = kc Integrating between C 0 at t 0 and C at time t, giving : Co C dc/c = - k 0 t dt ln C - ln C 0 = - k(t-0) ln C = lnc 0 kt log C = log C 0 kt/2.303 k = 2.303/t log C 0 /C C = C 0 e -kt C = C kt/2.303 k = 2.303/t log a/a-x ; k = det -1 ; t 90 = 0,105/k
18 C o n c e n t r a t i o n C 0 ½ C 0 C t -dc/dt t 1/2 Time
19 Log C -k/2,303 t
20 SECOND-ORDER REACTION A + B produk a b -d[a]/dt = -d[b]/dt = k[a][b] dx/dt = k(a-x)(b-x) Jika (A) = (B) maka dx/dt = k(a-x) 2 o x dx/(a-x) 2 = k 0 t dt (1/a-x)-(1/a-0) = kt k = 1/at (x/a-x) k = l mol -1 det -1 t 1/2 = 1/a k
21 Jika [A] = [B] x/a(a-x) k t
22 Jika [A] tidak sama dengan [B] Integrasi persamaan laju menghasilkan : 2,303/a-b log b(a-x)/a(b-x) = k t k = 2,303/t(a-b) log b(a-x)/a(b-x) log b(a-x)/a(b-x) (a-b)k/2,303 t
23 CARA MENENTUKAN ORDE REAKSI Dengan mensubstitusikan konsentrasi zat yang diperoleh ke dalam persamaan orde reaksi, bila diperoleh harga k yang relatif konstan berarti reaksi berjalan pada orde tersebut Dengan membuat grafik hubungan antara konsentrasi yang diperoleh terhadap t. Jika sesuai dengan salah satu grafik, maka reaksi berjalan pada orde tersebut - Grafik orde nol : c vs t - Grafik orde-satu : log c vs t - Grafik orde-dua : 1/c vs t
24 Lanjutan Dengan cara waktu paruh Secara umum : t 1/2 = 1/C n-1 Dilakukan 2 percobaan dengan konsentrasi yang berbeda, maka (t 1/2 ) 1 /(t 1/2 ) 2 = [C 2 /C 1 ] (n-1) log (t 1/2 ) 1 /(t 1/2 ) 2 = (n-1) log C 2 /C 1 n = log (t 1/2 ) 1 /(t 1/2 ) 2 / log C 2 /C 1 + 1
25 KONDISI PENYIMPANAN Pengaruh suhu : persamaan Arrhenius Pengaruh kelembaban Pengaruh cahaya Teori Tabrakan Teori Keadaan Transisi Pengaruh pelarut Pengaruh kekuatan ion Pengaruh tetapan dielektrik Pengaruh katalitis :katalitis asam-basa spesifik,katalitis asam-basa umum Pengaruh zona iklim dunia
26 PENGARUH SUHU : PERSAMAAN ARRHENIUS k = A. e -ΔE/RT log k = log A ΔE/2,303. 1/RT k = tetapan laju reaksi ΔE = energi aktifasi R = tetapan gas T = temperatur Laju reaksi akan naik 2-3 kali untuk setiap kenaikan suhu 10 o C Dengan menentukan harga k pada berbagai suhu dan menggambarkan 1/T vs log k, diperoleh ΔE dari kemiringan garis dan A dari intersep Persamaan Arrhenius tidak berlaku bagi reaksi eksplosif, reaksi enzimatis, reaksi peragian logk - ΔE/2,303R 1/T
27 PENGARUH KELEMBABAN : HIDROLISIS OBAT DAN USAHA PENCEGAHANNYA Penguraian obat : hidrolisis, oksidasi, isomerisasi, polimerisasi, dekarboksilasi, absorpsi CO2 dari udara dll Hidrolisis: sediaan larutan dalam air Ester:etilasetat; Amida: prokainamida hidrolisis molekuler Air+ion garam asam/basa lemah hidrolisis ionik Hidrolisis molekuler jauh lebih lambat dp hidrolisis ionik dan irreversibel pemutusan molekul obat: benzokain, sulfonilamida
28 LANJUTAN Hidrolisis dikatalisis ion H+ atau ion OHkatalisis asam basa spesifik: furosemid, prokain Hidrolisis dikatalisis spesies asam basa: katalisis asam basa umum Usaha penstabilan:1)menekan harga tetapan laju penguraian dan 2)konsentrasi obat yang akan terurai sampai sekecil mungkin
29 PERLINDUNGAN TERHADAP HIDROLISIS Menyesuaikan ph larutan/jenis dapar pada harga dimana tetapan laju reaksinya terkecil Metode kompleksasi shg laju reaksi turun Menekan kelarutan obat shg konsentrasi obat yang terpapar pada hidrolisis turun: suspensi/dispersi obat yang tidak larut Menghilangkan air:dry syrup Solubilisasi miselar dengan surfaktan
30 PENGARUH CAHAYA: OKSIDASI OBAT DAN USAHA PENSTABILANNYA Oksidasi: pelepasan suatu elektron dari molekul/lepasnya hidrogen(dehidrogenasi) Autooksidasi:minyak/lemak tak jenuh Radikal bebas reaksi berantai Oksidasi dalam fase gas:reaksi ledakan Reaksi oksidasi:laju reaksi bergantung pada konsentrasi molekul pengoksidasi tetapi tdk bergantung pada konsentrasi oksigen
31 PERLINDUNGAN TERHADAP OKSIDASI Thd lemak/minyak:1)hidrogenasi hasil reaksi 2)ganti udara dalam wadah dgn gas inert 3)penambahan antioksidan Thd obat2 yang mudah teroksidasi spt vit C, epinefrin: 1)mengganti udara dengan gas inert 2)larutan pada ph sesuai 3)pelarut bebas logam 4)antioksidan 5)menghindari cahaya 6)menyimpan pada suhu rendah
32 TEORI TABRAKAN Temperatur mempengaruhi reaksi uni/bi molekular Keadaan hipotetik : molekul bergerak pada arah dan kecepatan sama, jika menyimpang maka akan menabrak molekul lain sehingga molekul berhenti bergerak pada arah yang berlawanan, terjadi tabrakan berantai, sehingga akibatnya molekul bergerak acak Hanya sedikit fraksi molekul yang bergerak dengan kecepatan awal yang sama dari sistem yg teratur Untuk sejumlah tertentu molekul pd temperatur tertentu dan total energi tertentu distribusi kecepatan molekul bervariasi dari nol ke atas Energi kinetik sebanding dengan kecepatan molekul kuadrat, maka distribusi kecepatan molekul sebanding dengan distribusi energi molekul dan fraksi molekul yang mempunyai energi kinetik dinyatakan dalam hukum distribusi Nerntz : fi = Ni/Nt = e -Ei/RT
33 TEORI TABRAKAN TENTANG LAJU REAKSI : tabrakan antar molekul harus terjadi agar terjadi reaksi bagi molekul yang mempunyai energi tertentu. Jadi laju reaksi sebanding dgn jumlah mol reaktan yang mempunyai energi yg cukup utk berreaksi : Laju = P Z Ni Z = jumlah tabrakan per detik per cm3 P = faktor probability sterik untuk tabrakan yang menghasilkan reaksi Substitusi : Rate = (PZ e -Ei/RT ) Nt Rate = k [konsentrasi] k = (PZ e -Ei/RT ) Persamaan Arrhenius :k = A e -Ei/RT A = P Z ; Ea = Ei
34 Teori keadaan transisi Prinsip : Terjadinya kesetimbangan antara molekul-molekul reaktan normal dan kompleks teraktivasinya. Penguraian dari kompleks teraktivasinya akan menghasilkan suatu produk. A + B (A----B)* P Molekul reaktan Kompleks teraktivasi Produk normal Laju pembentukan produk : Laju = v(a----b)* (1) v merupakan frekuensi perubahan kompleks teraktivasi menjadi produk Kesetimbangan antara reaktan dan komples teraktivasi : (A B)* K* = (A)(B)
35 Sehingga : (A----B)* = K*(A)(B) (2) dari persamaan (1) dan (2) diperoleh : Laju = (vk*)(a)(b) (3) Karena reaksi berjalan dengan orde dua maka : Laju = k(a)(b) (4) Berdasarkan persamaan (3) dan (4) maka didapat : k = vk* (5)
36 Hukum Termodinamika G o = -RT ln K atau K = e - G o /RT (6) dan G o = H o - T S o (7) Dimana : G o adalah energi bebas standar H o adalah entalpi standar S o adalah entropi standar dengan mengganti K dengan K* dan melakukan substitusi terhadap persamaan (5), diperoleh : k = ve - G*/RT (8) kemudian berdasarkan hasil substitusi dengan persamaan (7) diperoleh : k = ve (- H*+ T So) /RT k = ( ve S*/R) e - H*/RT
37 Berdasarkan Hukum Arrhenius A = ve S*/R (9) Dan energi aktivasi Arrhenius dihubungkan dengan entalpi aktivasi keadaan transisi : Ea = H* = E* + P V* Dimana umumnya V* = 0; sehingga Ea = E* Pada dasarnya, teori keadaan transisi memberi pengaruh temperatur terhadap laju reaksi dengan persamaan umum : k = ( ve S*/R) e - E*/RT (10)
38 Menurut Eyring : besaran v dapat dianggap memberikan pendekatan yang baik sebagai faktor umum untuk reaksi, hanya bergantung pada temperatur dan dapat ditulis : v = RT Nh (11) dimana R adalah konstanta molar gas, T adalah temperatur, N adalah bilangan Avogadro, dan h adalah konstanta Planck. Sehingga faktor RT mempunyai Nh harga sekitar detik -1. Pada reaksi gas unimolekuler dimana S* = 0 maka e S*/R = 1. Sehingga : k = RT Nh e S*/R k = e - Ea/RT e - E*/RT R = 8,314x10 7 erg/mol.der R = 1,987 cal/mol.der N = 6,023x10 23 molekul/mol h = 6,62x10-27 erg.detik/molekul
39 k = e - Ea/RT Jika laju menyimpang dari harga ini, dapatlah dianggap sebagai akibat faktor e S*/R Jika S* positif maka laju reaksi akan lebih besar dari biasanya Jika S* negatif maka laju reaksi akan lebih lambat dari biasanya Hubungan teori tabrakan dengan keadaan transisi : [persamaan (9) dan (11) dan A = PZ RT PZ = e S*/R Nh Z = jumlah tabrakan, diidentifikasikan dengan RT/Nh, maka P = e S*/R
40 PENGARUH PELARUT Reaksi nonelektrolit berhubungan dengan: 1. Tekanan dalam relatif 2. parameter kelarutan dari pelarut dan zat pelarut Larutan biasanya bersifat non-ideal jadi harus dikoreksi dengan memasukkan koefisien aktivita Reaksi bimolekular : A + B (A B)* Produk Konstanta kesetimbangan termodinamik ditulis dalam bentuk aktifita sebagai: K* = a* = C* γ* a A a B C A C B γ A γ B dimana, a* = aktivita jenis dalam keadaan transisi a A dan a B = aktivita reaktan dalam keadaan normal
41 Laju = RT C* = RT K* CACB γ A γ B Nh Nh γ* dan k = Laju = RT K* γ A γ B C A C B Nh γ* Log k = log ko + log γ A + logγ B logγ*
42 atau k = k 0 γ A γ B γ* dimana, k 0 adalah konstanta laju dalam suatu larutan encer tidak terhingga, yaitu yang bersifat ideal. Koefisien aktifita (γ) dapat menghubungkan sifat dari zat terlarut dalam larutan dengan mempertimbangkan zat terlarut dalam larutan encer tidak terhingga. Jika larutannya ideal, koefisien aktifita = 1 dan k 0 = k
43 γ 2 koefisien aktivita suatu zat terlarut nonelektrolit polar yang tidak terlalu polar dalam suatu larutan encer log γ 2 = V 2 ( δ 1 δ 2 ) 2 2,303RT dimana, V 2 = volume molar zat terlarut δ 1 dan δ 2 = parameter kelarutan untuk pelarut dan zat terlarut Log k = log ko + logγa + log γb - log γ*
44 log k = log k 0 + V A (δ 1 δ A ) 2 2,303RT + V B (δ 1 δ B ) 2 2,303RT - V * (δ 1 δ * ) 2 2,303RT dimana, V A, V B dan V * dan δ A, δ B dan δ * volume molar dari parameter kelarutan reaktan A, B dan kompeks teraktivasi (A B)* Besaran δ 1 adalah parameter kelarutan pelarut Jadi, laju tergantung dari volume molar dan parameter kelarutan dari pelarut
45 Log k = log k 0 + V (Δδ A + Δδ B - Δδ * ) 2,303RT 1. Jika tekanan dalam atau polaritas produk sama dengan pelarutnya, maka Δδ * 0 2. Jika tekanan dalam reaktan tidak sama dengan pelarutnya, maka Δδ A dan Δδ B > 0, sehingga laju reaksi akan besar dalam pelarut dibandingkan laju dalam larutan ideal. Jika sebaliknya: Polaritas reaktan sama dengan pelarut, sehingga Δδ A dan Δδ B 0, sedangkan produk tidak sama dengan pelarut, yaitu Δδ * > 0, maka (Δδ A + Δδ B - Δδ * ) akan mempunyai harga negatif yang cukup besar dan laju reaksi menjadi lebih kecil dalam pelarut ini.
46 Kesimpulan: 1. Pelarut polar, yaitu yang mempunyai tekanan dalam yang tinggi, cenderung menghasilkan reaksi yang dipercepat membentuk produk yang mempunyai tekanan dalam yag lebih tinggi daripada reaktan. 2. Jika sebaliknya produk kurang polar daripada reaktan, produk akan dipercepat oleh pelarut dengan polaritas rendah atau tekanan dalam rendah, dan diperlambat oleh pelarut yang tekanan dalamnya tinggi.
47 PENGARUH KEKUATAN ION Reaksi antar ion : A ZA + B ZB (A.B) *(ZA+ZB) produk Persamaan Debye-Huckel : log γ i = - 0,51 z i 2 µ Ket : A dan B = reaktan Z = muatan γ i = koefisien aktivita ( 0,01 M, 25 C ) µ µ = kekuatan ion
48 maka dapat ditulis : log γ A + γ B - γ AB* = - 0,51 z A 2 µ - 0,51 z B 2 µ + 0,51 (z A + z B ) 2 µ = - 0,51 µ {z A 2 + z B 2 (z A+ z B ) 2 } = 0,51. 2 z A z B µ = 1,02 z A z B µ substitusi ke persamaan : log k = log k 0 + log γ A + γ B - γ AB* maka ; log k = log k 0 + 1,02 z A z B µ
49 pengecualian : 1. jika salah satu reaktan netral (dalam larutan encer), maka z A z B = 0 log k = log k 0 1. jika molekul yang bereaksi tidak bermuatan (pelarut dengan µ tertentu), maka log k = log k 0 + bµ ket ; b = tetapan yang diperoleh dari percobaan
50 PENGARUH TETAPAN DIELEKTRIK Efek konstanta dielektrik terhadap konstanta laju reaksi ionic yang diektrapolasikan sampai pengenceran tidak terbatas, yang pengaruh kekuatan ionnya adalah nol, sering menjadi informasi yang diperlukan dalam pengembangan obat baru. Salah satu persamaan yang menentukan efek ini adalah :
51 PENGARUH TETAPAN DIELEKTRIK Ln k = ln kє = ~ - NZ A Z B e 2 1 RTr є Dimana : kє = konstanta laju reaksi dalam medium dengan konstanta dielektrik tidak terbatas N = bilangan avogadro Z A Z B = muatan kedua ion e = satuan muatan listrik r = jarak antarion dalam kompleks teraktivasi
52 LANJUTAN Untuk reaksi antarion dengan muatan berlawanan, kenaikan konstanta dielektrik dari pelarut mengakibatkan penurunan konstanta laju reaksi. Sedangkan untuk ionion dengan muatan yang sama terjadi sebaliknya, kenaikan konstanta dielektrik mengakibatkan kenaikan laju reaksi
53 PENGARUH KATALISIS TERHADAP TETAPAN LAJU Laju reaksi sering dipengaruhi oleh adanya katalis Contoh : Hidrolisis sukrosa dalam air Suhu kamar lama (bisa beberapa bulan) Namun jika hidrolisis dilakukan dalam suasana asam (penaikkan konsentrasi ion hidrogen), reaksi akan berlangsung lebih cepat - Katalis : suatu zat yang dapat mempengaruhi kecepatan reaksi tanpa ikut berubah secara kimia pada akhir reaksi
54 Mekanisme Kerja Katalis Katalis bergabung dengan substrat dan membentuk suatu zat antara [senyawa kompleks] Katalis + produk Jadi katalis menurunkan energi aktifasi dengan mengubah mekanisme proses dan kecepatannya bertambah Katalis juga dapat bekerja dg menghasilkan radikal bebas spt CH3, yang akan mengadakan reaksi rantai yang cepat Reaksi Rantai : proses serangkaian reaksi yang melibatkan atom bebas atau radikal sebagai zat antara Tahapan reaksi rantai :- tahap pendahuluan, berakhir dengan - pemutusan rantai atau tahap terminasi Katalis negatif / inhibitor berperan sebagai pemutus rantai
55 Katalis homogen : katalis dan pereaksi bekerja pada satu fase yang sama (gas atau cair, katalis asam basa : fase cair - homogen) Katalis heterogen : katalis dan pereaksi membentuk fase terpisah dalam campuran Katalis serbuk padat/ Katalis lapisan pada dinding wadah : platina prosesnya disebut katalisis kontak: pereaksi teradsorpsi pada peermukaan kasar katalis yang dikenal sbg pusat aktif adsorpsi ini berakibat melemahnya ikatan molekul, menurunkan energi aktifasi. Molekul teraktifasi kemudian dapat berreaksi dan hasil reaksi melepaskan diri dari permukaan katalis
56 Katalis Asam Basa Spesifik Contoh : hidrolisis esrer dan inversi gula Ostwald&Arrhenius : kemampuan mengkatalisis dari katalis asam adalah karena kekuatan asam tsb atau konsentrasi hidrogennya Katalis basa : konsentrasi ion OH-
57 Hidrolisis Ester Dilakukan pada larutan asam yang cukup kuat : ion hidrogen adalah katalis efektif, ion hidroksil tidak memperlihatkan aktifitas bermakna Laju reaksi ; v = k H+ [H+] [S] kh+ : tetapan laju reaksi yang dikatalisis ion hidrogen. Orde keseluruhan reaksi terhadap konsentrasi = 2, tetapi terhadap waktu = 1, karena konsentrasi ion hidrogen tetap. Laju reaksi orde satu : v = kobs [S] kobs = k H+ [H+]
58 Utk reaksi yang dikatalisis ion hidroksil : kobs = k OH- [OH-] Jika reaksi dikatalisis ion ion hidrogen dan ion hidroksil serempak dan reaksi berlangsung spontan tanpa katalis, laju reaksi adalah : v = ko [S] + k H+ [H+] [S] + k OH- [OH-][S] k = v / [S] Maka k (tetapan laju orde 1) : k = ko + k H+ [H+] + k OH- [OH-] ko = tetapan laju reaksi spontan tanpa katalis k H+ dan k OHtetapan laju teaksi yang masing2 dikatalis oleh H+ dan OH- kw =[H+][OH-] k = ko + k H+ [H+] + k OH- Kw/[H+] k = ko + k H+ Kw/[0H-] + k OH- [0H-]
59 Katalisis Asam Basa Spesifik Reaksi hanya dikatalisis oleh asam (ion hidrogen) : k obs = k H+ [H+] log k obs = log [H+] + log k H+ log k obs = -(-log [H+]) + log k H+ log k obs = - ph + log k H+ y x intersep Sehingga kurva log kobs terhadap ph larutan memberikan garis lurus dengan kemiringan -1
60 SKRABAL Lihat garis a pada kurva Skrabal. Kurva yang paling umum adalah a yang memperlihatkan daerah kurva yang dikatalisis ion hidrogen (seb kiri) dan ion hidroksil (seb kanan) dan dipisahkan oleh daerah mendatar, dimana jumlah katalis tidak nermakna dibandingkan dengan reaksi spontan Untuk reaksi dengan KATALISIS ION HIDROKSIL SPESIFIK pada kurva sebelah kanan, kemiringannya adalah +1 dan kecepatan pada daerah tengah adalah ko[s], sehingga ko yaitu tetapan laju reaksi spontan tanpa katalis dapat ditentukan langsung dari laju pada daerah ini (biasanya lambat) Pada ph tertentu log kobs akan mempunyai harga paling kecil dan pada ph ini kestabilan obat adalah yang paling baik
61 Jika ko cukup kecil dibanding kh+ atau koh-, maka bagian datar dari kurva tidak ada, kedua garis akan berpotongan dengan tajam (b). Jiksa reaksi berjalan spontan, diperoleh kurva c, sedang bila tidak spontan diperoleh kurva d Jika koh- sangat kecil diperoleh kurva e dan f
62 Skrabal f Menggambarkan log k terhadap ph larutan b a c d e
63 Katalisis Asam Basa Umum Larutan dapar digunakan untuk mempertahankan larutan pada ph tertentu Reaksi katalisis terjadi karena salah satu komponen dapar yang dapat mempengaruhi laju reaksi, reaksi ini disebut KATALISIS ASAM BASA UMUM yang bergantung pada komponen katalitik asam atau basa
64 Profil laju-ph reaksi yang dipengaruhi katalisis asam basa umum memperlihatkan penyimpangan dari profil katalisis asam basa spesifik. Contoh hidrolisis streptozosin, laju reaksi dalam dapar fosfat > Laju reaksi dalam katalisis basa spesifik, karena adanya katalisis oleh anion fosfat. Kemirimgan garis profil laju-ph +1.
65 Kekuatan ion atau perbedaan pka substrat dapat juga memperlihatkan penyimpangan profil laju-ph. Pembuktian katalisis Asam Basa Umum dibuktikan dengan : Menentukan laju degradasi obat dalam suatu rangkaian dapar dengan ph sama (perbandingan asam dengan basa tetap), yang dibuat dengan konsentrasi komponen dapar yang menaik
66 Tetapan Laju Orde Satu Keseluruhan : k = ko + ki ci ko = tetapan laju spesifik dalam air ci = konsentrasi katalitik I ki = koefisien katalitik Dalam reaksi yang hanya terjadi katalisis asam basa spesifik saja, persamaaan menjadi : k = ko + k H+ [H+] + k OH- [OH-]
67 CONTOH SOAL Suatu sampel glukosa terurai pada 140 o C dalam larutan yang mengandung 0,030 M HCl. Konstanta laju reaksi k = 0,0080 jam -1 Jika konstanta laju reaksi spontan k o =0,0010, hitung koefisien katalitik k H. Katalisis yang disebabkan ion hidroksil dalam larutan asam ini dapat diabaikan. K = ko + k H [H + ] + k OH [OH - ]
68 ANALISIS KESTABILAN YANG DIPERCEPAT Nilai tetapan laju dinaikkan dengan menaikan suhu, plot c vs waktu Plot log k vs 1/T, ekstrapolasi garis pada suhu ruang Harga k 25o digunakan untuk memperoleh kestabilan obat pada suhu penyimpanan biasa
69 PENGURAIAN OBAT PADA SUHU YANG DINAIKKAN KONSENTRASI 40 O 50 O 70 O 60 O WAKTU
70 KURVA ARRHENIUS UNTUK MEMPERKIRAKAN KESTABILAN OBAT PADA SUHU KAMAR 70 o C 60 o C 50 o C 40 o C LOG K 30 o C 25 o C 20 o C /T X
71 Soal 1 Obat aspirin dalam sediaan cair mengandung 325 mg/5 ml atau 6.5 g100 ml KELARUTAN ASPIRIN PD 25 O C adalah 0.33 g/100 ml dimana ph = 6 Laju reaksi dlm larutan mengikuti orde 1, dimana k = 4.5 x 10 6 detik - 1 Hitung k orde 0, hitung pula t 90 ko = k [aspirin dlm lar] ko = x 10 6 g/100 ml.detik -1 [A] = [Ao] kot 0.9[Ao] = [Ao] k o t 90 k o t 90 = 0,1[Ao] t 90 = 0,1[Ao] / ko = 4.3 x 10 5 detik =..hari
72 Soal 2 k 1 orde 1= 2x10-7 det -1, ampisilin pada 35 o C dan ph 5,8. Solubility ampisilin 1,1 g /100 ml. Dibuat suspensi mengandung 125 mg ampisilin/5 ml, atau 2,5 g/100 ml. a)k 0 =k 1 [ampisilin] b)waktu t 90 (shelf life) suspensi pada 35 o C c)dalam fase larutan, berapa shelf life nya?
73 Soal 3 Penguraian katalitis orde 1 dari H 2 O 2 dpt diikuti dengan mengukur volume oksigen yang dibebaskan. Jumlah H 2 O 2 yang masih ada setelah 65 menit adalah 9,60 ml. Jumlah awal 57,90 ml. a) Hitung k b) Berapa H 2 O 2 yang tinggal setelah 25 menit k = 2,303/t. log a / a-x
74 Soal 4 Larutan obat mengandung 500 unit ketika dibuat. Setelah 40 hari, dilakukan analisis kadar ternyata konsentrasinya tinggal 300 unit. Bila reaksi penguraian berjalan pada orde 1, berapa lama obat akan terurai sampai konsentrasi tinggal setengah dari konsentrasi awal? k = 2,303/t log a / a-x
75 Soal 5 Penyabunan etil asetat pada 25oC Etilasetat + NaOH Naasetat + alkohol Konsentrasi awal dari etil asetat dan NaOH sama2 0,01000 M. Perubahan konsentrasi alkali (x) setelah 20 menit adalah 0, mol/liter. Hitung a) konstanta laju reaksi b) waktu paruh reaksi k = 1/at. [x/a-x] t1/2 = 1/ak
76 Soal 6 A B mengikuti orde 1. Uji kestabilan dipercepat pada 50 o C, 60 o C dan 70 o C, hitung t90, t1/2, E, A Waktu (jam) Konsentrasi pd 50oC Konsentr. Pd 60oC 0 0,5 M -0,3010 0,5M 0,5M 10 0,49-0,3098 0,48 0, ,47-0,3279 0,46 0, ,43-0,3665 0,42 0, ,40-0,3979 0,37 0, ,35-0,4559 0,32 0,25 Konsent. Pd 70oC
77 STABILITAS FISIKA MEMPERTAHANKAN SIFAT FISIKA AWAL DARI SUATU SEDIAAN : PENAMPILAN, KESESUAIAN, KESERAGAMAN, DISOLUSI, DISINTEGRASI, KEKERASAN, KEMAMPUAN DISUSPENSIKAN
78 STABILITAS MIKROBIOLOGI STERILITAS ATAU RESISTENSI TERHADAP PERTUMBUHAN MIKROBA DIPERTAHANKAN SESUAI DENGAN PERSYARATAN YANG DINYATAKAN (JUMLAH KOLONI DSB) Zat antimikroba yang ada harus dapat mempertahankan efektifitas sediaan dalam batas yang ditetapkan
79 STABILITAS TERAPI EFEK TERAPI TIDAK BERUBAH SELAMA WAKTU SIMPAN (SHELF LIFE) SEDIAAN
80 STABILITAS TOKSIKOLOGI TIDAK TERJADI PENINGKATAN TOKSISITAS YANG BERMAKNA SELAMA WAKTU SIMPAN MISALNYA TIDAK TERBENTUK SENYAWA EPI DAN ANHIDRO DALAM SUSPENSI TETRASIKLIN
81 KESTABILAN DALAM WUJUD PADAT 1. MODEL PENGURAIAN : s s + s, s -- s + l, s l + l, s s + g, s l + g, s g + g 2. Solid solid dengan reaksi gas: penguraian PAS 3. Solid likuid dengan reaksi gas: penguraian asam metilaminobenzoat 4. INTERAKSI 5. TEKNIK MENCEGAH INKOMTABILITAS
82 Solid solid + gas X T(jam) p-aminosalisilat [dn/dt] o = a [N + No]]; [dn/dt] o = (a+b) N; a dan b fungsi t
83 Solid likuid + gas Lapisan dekomposisi likuid, jenuh dalam intact drug Intact solid Penguraian asam p-metilaminobenzoat
84 INTERAKSI Lembab, air obat Asam tartrat + sodium bikarbonat R 2 (COOH) 2 + 2NaHCO 3 R 2 (COO - ) 2 +2Na + +2H 2 O + 2CO 2 Aspirin + Magnesium stearat Aspirin + phenylephrine
85 INKOMTABILITAS dan USAHA PENCEGAHANNYA Interaksi partikel dalam tablet bergantung pada ukuran partikel, makin halus serbuk semakin luas permukaan berarti semakin banyak kontak antar partikel Teknik pocketing atau dobel granulasi : 1. Cyanocobalamin, iron, ascorbic acid 2. Vitamin A 3. Calcium pantothenat 4. Tocopherol Compression-coated tablet
86 KESTABILAN SEDIAAN PADAT: pengaruh lembab 1. Keberadaan lembab dapat terikat atau tidak terikat. Lembab yang tidak terikat : terjadi pada penguraian yang membutuhkan lembab, sedangkan Lembab yang terikat : tidak seperti itu Keberadaan lembab digambarkan sbb : Lembab melibatkan suatu reaksi : A + H2O ---- penguraian [kelembaban tinggi] Lembab membentuk lapisan lembab teradsorbsi atau fase seperti karet dimana penguraian dapat terjadi dalam keadaan terlarut [kelembaban terbatas]
87 lanjutan 2. Kesetimbangan kandungan lembab Suatu padatan yang mengandung lembab ditempatkan dalam sebuah wadah vakum, lembab akan menguap sampai terjadi kesetimbangan.ada hubungan antara kandungan lembab, x, dengan tekanan uap air P H2O dalam fungsi sbb : P H2O = f(x) Disebut Kurva Kesetimbangan Lembab (Moisture Equilibrium Curve MEC)
88 MEC SMOOTH STEPWISE MOISTURE EQUILIBRIUM CURVE
89 3.PERTUKARAN LEMBAB ANTAR Mo exch KOMPONEN SEDIAAN
90 4. PENGURAIAN DENGAN LEMBAB YANG TIDAK HABIS
91 5. EKSIPIEN KHUSUS Corn starch, gelatin, avicel, lactose hydrate Calcium phosphates : DCPD, anhydrous dibasic Calcium Phosphate, Hydroxyapatite, Dicalcium Phosphate anhydrate Eksipien lain : sukrosa, manitol, sorbitol,
92 UJI STABILITAS SEDIAAN FARMASI/KOSMETIK: KIMIA DAN FISIKA UJI STABILITAS SEDIAAN PADAT: SERBUK, TABLET, KAPSUL, MIKRO-KAPSUL UJI STABILITAS SISTEM DISPERSI: SUSPENSI, EMULSI, SISTEM MISEL, LIPOSOME UJI STABILITAS SEDIAAN LARUTAN : LARUTAN SIRUP, LARUTAN PARENTERAL
93 UJI STABILITAS Umumnya uji stabilitas dilakukan secara kimia Walaupun secara kimia suatu produk dapat stabil selama 3 tahun sebelum expired, tetapi perubahan fisik dapat saja terjadi Ketidakstabilan Secara Fisika Sediaan padat: Penurunan BA yang disebabkan penurunan dissolusi tidak memenuhi syarat minimum utk terapi Larutan: timbul endapan. Mungkin kandungan kimianya tetap tetapi utk larutan parenteral jelas tidak dapat diterima, demikian juga untuk larutan oral Suspensi:caking dosis dalam 1 sendok teh akan berubah Cream/emulsi pecah: sifat emolient tidak akan sama dengan produk seharusnya
94 UJI STABILITAS FISIKA SEDIAAN PADAT: SERBUK Serbuk yang siap untuk direkonstitusi menjadi suspensi atau larutan:suspensi kloramfenikol/ kemicetin sirup, larutan metamucil, larutan achromycin im, serbuk analgesik-antipiretik, nutrisari, tang dll Sifat fisik yang diamati:penampilan, sifat organoleptik dan kemudahan untuk direkonstitusi Alasan umum terjadinya perubahan disolusi sbg fungsi waktu penyimpanan : kohesi, pertumbuhan kristal, penyerapan lembab lumping serbuk Lihat transparansi
95 UJI STABILITAS FISIKA SEDIAAN PADAT : TABLET Kekerasan tablet Pelembekan Disintegration Porosity Disolusi
96 UJI STABILITAS FISIKA SEDIAAN SUSTAINED RELEASE Prinsipnya adalah menetapkan profil disolusi dengan berubahnya waktu Granul/butiran bersalut Tablet erosi Matriks tidak larut Pompa osmotik Bentuk gel
97 UJI STABILITAS FISIKA SEDIAAN TABLET SALUT Tablet salut film Tablet salut gula Tablet salut enteric
98 UJI STABILITAS FISIKA SEDIAAN KAPSUL Kapsul keras Kapsul lunak Mikrokapsul
99 UJI STABILITAS FISIKA SEDIAAN SUSPENSI Suspensi yang diharapkan adalah yang tidak mengendap, tetapi sesuai dengan namanya, suspensi biasanya selalu mengendap Parameternya : laju sedimentasi (Stokes) dan volume sedimentasi Test : subjektif (setelah penyimpanan 3 bulan sukar diresuspensi/caking) dan kuantitatif (memutar botol pada kondisi keterulangan mis x putaran, kemudian supernatannya diambil dan ditetapkan kadarnya. Lakukan putaran 2x, 4x sampai 8x putaran). Y = Y [1-exp(-kt)]; ln [1-y/y ] = -kt Y = asymptot = dosis jika terjadi caking k dapat diperoleh dari ln nya dan Y diperoleh dari data treatment utk harga ekstrapolasi
100 lanjutan Uji dipercepat : suspensi ditempatkan dalam shaker pada 37 o C partikel bergerak cepat partikel halus nyelip di antara partikel besar closed packing Freeze-thaw test : 24 jam pada 25 o C dan 24 jam pada -5 o C pertumbuhan kristal Volume sedimentasi: Stokes V = n d 3 Q = ρ.n.πd3/6; n = Q 6/ πd 3 ρ V = Q.6/ ρ π
101 lanjutan Zeta potensial Laju sedimentasi Kestabilan dengan pengawet Uji kestabilan dgn suhu dinaikkan tidak berlaku bagi suspensi karena kelarutan zat padat adalah fungsi suhu Suspensi semi solid : konsistensi, viskositas, polimorfi (x-ray, metode termal trans esterifikasi) Ointment dan transdermal
102 UJI STABILITAS FISIKA SEDIAAN EMULSI Lihat Cosmetic Stability Lihat transparansi
103 UJI STABILITAS FISIKA SEDIAAN LARUTAN : Oral dan Parenteral ORAL Penampilan: faktor utama, untuk larutan oral:organoleptik juga penting Uji organoleptik : subjektif. Seorang tester akan menilai produk dan memberi skor, baik secara numerik maupun deskriptif Uji penampilan: ada statement subjektif walaupun ada parameter instrument kuantitatif yang dicatat mis colorimetry
104 Uji Organoleptik Uji panel: rasa, bau, flavor seorang tester:ada kelemahan mis. Sakit, cuti, berhenti bekerja. Mengatasinya, ganti dengan orang lain, tapi hasilnya bias antara kedua tester Kedalaman kapasitas organoleptik harus diujikan. Satu serial pengenceran sediaan yang berasa pahit level sensitivity bisa ditegakkan. Gunakan kontrol
105 Subjective Appearance Testing. Biasanya untuk larutan injeksi, mungkin ada perubahan warna. Gunakan standar warna, RCS Roche Color Standard Buat seri pengenceran RCS 1, RCS 2, RCS 3 dst
106 LARUTAN PARENTERAL Swirly Precipitates Whiskers Cloud Times
107 Uji Kestabilan : Leak testing UJI STABILITAS FISIKA SEDIAAN AEROSOL Karakteristik semprotan Analisis ukuran partikel Uji kelembaban Uji tekanan Batas mikroba Laju penyampaian Uji katup dan evaluasi Semprotan
STABILITAS KIMIA: MEMPERTAHANKAN KEUTUHAN KIMIAWI DAN POTENSI ZAT AKTIF YANG TERTERA PADA ETIKET DALAM BATASAN SPESIFIKASI Laju Reaksi : dinyatakan
 STABILITAS KIMIA: MEMPERTAHANKAN KEUTUHAN KIMIAWI DAN POTENSI ZAT AKTIF YANG TERTERA PADA ETIKET DALAM BATASAN SPESIFIKASI Laju Reaksi : dinyatakan dalam term pengurangan konsentrasi reaktan (- dc/dt)
STABILITAS KIMIA: MEMPERTAHANKAN KEUTUHAN KIMIAWI DAN POTENSI ZAT AKTIF YANG TERTERA PADA ETIKET DALAM BATASAN SPESIFIKASI Laju Reaksi : dinyatakan dalam term pengurangan konsentrasi reaktan (- dc/dt)
STABILITAS OBAT KULIAH PILIHAN S1. PHARM DR JOSHITA DJAJADISASTRA, MS, PhD 2008
 STABILITAS OBAT KULIAH PILIHAN S1 PHARM DR JOSHITA DJAJADISASTRA, MS, PhD 2008 ACUAN YANG DIGUNAKAN FDA Guideline 1984, 1987 Drug Stability, Carstensen JT, 3 rd ed,2000 Chemical Kinetics, Laidler KJ, 1980
STABILITAS OBAT KULIAH PILIHAN S1 PHARM DR JOSHITA DJAJADISASTRA, MS, PhD 2008 ACUAN YANG DIGUNAKAN FDA Guideline 1984, 1987 Drug Stability, Carstensen JT, 3 rd ed,2000 Chemical Kinetics, Laidler KJ, 1980
PENGARUH KATALISIS TERHADAP TETAPAN LAJU
 PENGARUH KATALISIS TERHADAP TETAPAN LAJU Laju reaksi sering dipengaruhi oleh adanya katalis Contoh : Hidrolisis sukrosa dalam air Suhu kamar lama (bisa beberapa bulan) Namun jika hidrolisis dilakukan dalam
PENGARUH KATALISIS TERHADAP TETAPAN LAJU Laju reaksi sering dipengaruhi oleh adanya katalis Contoh : Hidrolisis sukrosa dalam air Suhu kamar lama (bisa beberapa bulan) Namun jika hidrolisis dilakukan dalam
BAB 9. KINETIKA KIMIA
 BAB 9 BAB 9. KINETIKA KIMIA 9.1 TEORI TUMBUKAN DARI LAJU REAKSI 9.2 TEORI KEADAAN TRANSISI DARI LAJU REAKSI 9.3 HUKUM LAJU REAKSI 9.4 FAKTOR-FAKTOR LAJU REAKSI 9.5 MEKANISME REAKSI 9.6 ENZIM SEBAGAI KATALIS
BAB 9 BAB 9. KINETIKA KIMIA 9.1 TEORI TUMBUKAN DARI LAJU REAKSI 9.2 TEORI KEADAAN TRANSISI DARI LAJU REAKSI 9.3 HUKUM LAJU REAKSI 9.4 FAKTOR-FAKTOR LAJU REAKSI 9.5 MEKANISME REAKSI 9.6 ENZIM SEBAGAI KATALIS
Bab 10 Kinetika Kimia
 D e p a r t e m e n K i m i a F M I P A I P B Bab 0 Kinetika Kimia http://chem.fmipa.ipb.ac.id Ikhtisar 2 3 Laju Reaksi Teori dalam Kinetika Kimia 4 Mekanisme Reaksi 5 46 Faktor Penentu Laju Reaksi Enzim
D e p a r t e m e n K i m i a F M I P A I P B Bab 0 Kinetika Kimia http://chem.fmipa.ipb.ac.id Ikhtisar 2 3 Laju Reaksi Teori dalam Kinetika Kimia 4 Mekanisme Reaksi 5 46 Faktor Penentu Laju Reaksi Enzim
Pokok Bahasan. Teori tentang asam, basa dan garam Kesetimbangan asam-basa Skala ph Sörensen (Sörensen ph scale) Konstanta keasaman
 Kesetimbangan Ionik Pokok Bahasan Teori tentang asam, basa dan garam Kesetimbangan asam-basa Skala ph Sörensen (Sörensen ph scale) Konstanta keasaman Teori tentang asam dan basa Arrhenius: Asam: zat yg
Kesetimbangan Ionik Pokok Bahasan Teori tentang asam, basa dan garam Kesetimbangan asam-basa Skala ph Sörensen (Sörensen ph scale) Konstanta keasaman Teori tentang asam dan basa Arrhenius: Asam: zat yg
Pengaruh Suhu Q10. Dhadhang Wahyu Kurniawan Laboratorium Farmasetika Unsoed
 Pengaruh Suhu Q10 Dhadhang Wahyu Kurniawan Laboratorium Farmasetika Unsoed http://dhadhang.wordpress.com Twitter: Dhadhang_WK Facebook: Dhadhang Wahyu Kurniawan 10/20/2015 1 Faktor-faktor yang Mempengaruhi
Pengaruh Suhu Q10 Dhadhang Wahyu Kurniawan Laboratorium Farmasetika Unsoed http://dhadhang.wordpress.com Twitter: Dhadhang_WK Facebook: Dhadhang Wahyu Kurniawan 10/20/2015 1 Faktor-faktor yang Mempengaruhi
PETA KONSEP LAJU REAKSI. Percobaan. Waktu perubahan. Hasil reaksi. Pereaksi. Katalis. Suhu pereaksi. Konsentrasi. Luas. permukaan.
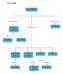 PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Chapter 8 Kinetika Kimia Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Chapter 8 Kinetika Kimia Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
Sulistyani, M.Si.
 Sulistyani, M.Si. Email: sulistyani@uny.ac.id Laju reaksi adalah laju pengurangan reaktan tiap satuan waktu atau laju pembentukan produk tiap satuan waktu. Laju reaksi dipengaruhi oleh: sifat dan keadan
Sulistyani, M.Si. Email: sulistyani@uny.ac.id Laju reaksi adalah laju pengurangan reaktan tiap satuan waktu atau laju pembentukan produk tiap satuan waktu. Laju reaksi dipengaruhi oleh: sifat dan keadan
KINETIKA & LAJU REAKSI
 KINETIKA & LAJU REAKSI 1 KINETIKA & LAJU REAKSI Tim Teaching MK Stabilitas Obat Jurusan Farmasi FKIK UNSOED 2013 2 Pendahuluan Seorang farmasis harus mengetahui profil suatu obat. Sifat fisika-kimia, stabilitas.
KINETIKA & LAJU REAKSI 1 KINETIKA & LAJU REAKSI Tim Teaching MK Stabilitas Obat Jurusan Farmasi FKIK UNSOED 2013 2 Pendahuluan Seorang farmasis harus mengetahui profil suatu obat. Sifat fisika-kimia, stabilitas.
Dalam bidang farmasetika, kata larutan sering mengacu pada suatu larutan dengan pembawa air.
 Pendahuluan Dalam bidang farmasetika, kata larutan sering mengacu pada suatu larutan dengan pembawa air. Pelarut lain yang digunakan adalah etanol dan minyak. Selain digunakan secara oral, larutan juga
Pendahuluan Dalam bidang farmasetika, kata larutan sering mengacu pada suatu larutan dengan pembawa air. Pelarut lain yang digunakan adalah etanol dan minyak. Selain digunakan secara oral, larutan juga
LAJU REAKSI MEKANISME REAKSI
 KINETIKA KIMIA LAJU REAKSI BAGAIMANA PERUB. KIMIA TSB BERLANGSUNG - BESI MUDAH BERKARAT PD UDARA YANG LEMBAB - MAKANAN LEBIH CEPAT BUSUK BILA TIDAK DIINGINKAN MEKANISME REAKSI - PENJUMLAHAN TAHAP TAHAP
KINETIKA KIMIA LAJU REAKSI BAGAIMANA PERUB. KIMIA TSB BERLANGSUNG - BESI MUDAH BERKARAT PD UDARA YANG LEMBAB - MAKANAN LEBIH CEPAT BUSUK BILA TIDAK DIINGINKAN MEKANISME REAKSI - PENJUMLAHAN TAHAP TAHAP
KINETIKA & LAJU REAKSI
 1 KINETIKA & LAJU REAKSI Tim Teaching MK Stabilitas Obat Jurusan Farmasi FKIK UNSOED 2013 2 Pendahuluan Seorang farmasis harus mengetahui profil suatu obat. Sifat fisika-kimia, stabilitas. Sifat tersebut
1 KINETIKA & LAJU REAKSI Tim Teaching MK Stabilitas Obat Jurusan Farmasi FKIK UNSOED 2013 2 Pendahuluan Seorang farmasis harus mengetahui profil suatu obat. Sifat fisika-kimia, stabilitas. Sifat tersebut
BAB VI KINETIKA REAKSI KIMIA
 BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
Laporan Kimia Fisik KI-3141
 Laporan Kimia Fisik KI-3141 PERCOBAAN M-2 PENENTUAN LAJU REAKSI DAN TETAPAN LAJU REAKSI Nama : Kartika Trianita NIM : 10510007 Kelompok : 2 Tanggal Percobaan : 2 November 2012 Tanggal Laporan : 9 November
Laporan Kimia Fisik KI-3141 PERCOBAAN M-2 PENENTUAN LAJU REAKSI DAN TETAPAN LAJU REAKSI Nama : Kartika Trianita NIM : 10510007 Kelompok : 2 Tanggal Percobaan : 2 November 2012 Tanggal Laporan : 9 November
Purwanti Widhy H, M.Pd. Laju Reaksi
 Purwanti Widhy H, M.Pd Laju Reaksi SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi, Kompetensi Dasar & Indikator
Purwanti Widhy H, M.Pd Laju Reaksi SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi, Kompetensi Dasar & Indikator
Waktu (t) Gambar 3.1 Grafik hubungan perubahan konsentrasi terhadap waktu
 3 LAJU REAKSI Setelah mempelajari bab ini, kamu diharapkan mampu: Menghitung konsentrasi larutan (molaritas larutan). Menganalisis faktor-faktor yang mempengaruhi laju reaksi (konsentrasi, luas permukaan,
3 LAJU REAKSI Setelah mempelajari bab ini, kamu diharapkan mampu: Menghitung konsentrasi larutan (molaritas larutan). Menganalisis faktor-faktor yang mempengaruhi laju reaksi (konsentrasi, luas permukaan,
SOAL LAJU REAKSI. Mol CaCO 3 = = 0.25 mol = 25. m Mr
 SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
c. Suhu atau Temperatur
 Pada laju reaksi terdapat faktor-faktor yang dapat mempengaruhi laju reaksi. Selain bergantung pada jenis zat yang beraksi laju reaksi dipengaruhi oleh : a. Konsentrasi Pereaksi Pada umumnya jika konsentrasi
Pada laju reaksi terdapat faktor-faktor yang dapat mempengaruhi laju reaksi. Selain bergantung pada jenis zat yang beraksi laju reaksi dipengaruhi oleh : a. Konsentrasi Pereaksi Pada umumnya jika konsentrasi
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
Kelarutan & Gejala Distribusi
 PRINSIP UMUM Kelarutan & Gejala Distribusi Oleh : Lusia Oktora RKS, S.F.,M.Sc., Apt Larutan jenuh : suatu larutan dimana zat terlarut berada dalam kesetimbangan dengan fase padat (zat terlarut). Kelarutan
PRINSIP UMUM Kelarutan & Gejala Distribusi Oleh : Lusia Oktora RKS, S.F.,M.Sc., Apt Larutan jenuh : suatu larutan dimana zat terlarut berada dalam kesetimbangan dengan fase padat (zat terlarut). Kelarutan
COSMETIC STABILITY. Rabu, 18 Nopember 2004, Hotel Menara Peninsula, Slipi, Jakarta
 COSMETIC STABILITY Pharm.Dr. Joshita Djajadisastra, MS, PhD Departemen Farmasi, FMIPA, Universitas Indonesia Disampaikan pada Seminar Setengah Hari HIKI Rabu, 18 Nopember 2004, Hotel Menara Peninsula,
COSMETIC STABILITY Pharm.Dr. Joshita Djajadisastra, MS, PhD Departemen Farmasi, FMIPA, Universitas Indonesia Disampaikan pada Seminar Setengah Hari HIKI Rabu, 18 Nopember 2004, Hotel Menara Peninsula,
BAB I PENGANTAR FARMAKOKINETIKA. meliputi ruang lingkup ilmu farmakokinetik dan dasar-dasar yang menunjang ilmu
 BAB I PENGANTAR FARMAKOKINETIKA DESKRIPSI MATA KULIAH Bab ini menguraikan secara singkat tentang ilmu farmakokinetik dasar yang meliputi ruang lingkup ilmu farmakokinetik dan dasar-dasar yang menunjang
BAB I PENGANTAR FARMAKOKINETIKA DESKRIPSI MATA KULIAH Bab ini menguraikan secara singkat tentang ilmu farmakokinetik dasar yang meliputi ruang lingkup ilmu farmakokinetik dan dasar-dasar yang menunjang
LARUTAN ELEKTROLIT DAN NON ELEKTROLIT
 BAB 6 LARUTAN ELEKTROLIT DAN NON ELEKTROLIT Standar Kompetensi Memahami sifat-sifat larutan non elektrolit dan elektrolit, serta reaksi oksidasi-reduksi Kompetensi Dasar Mengidentifikasi sifat larutan
BAB 6 LARUTAN ELEKTROLIT DAN NON ELEKTROLIT Standar Kompetensi Memahami sifat-sifat larutan non elektrolit dan elektrolit, serta reaksi oksidasi-reduksi Kompetensi Dasar Mengidentifikasi sifat larutan
Film adalah lapisan suatu zat yang menyebar melalui permukaan dengan ketebalan sangat kecil, dan pengaruh gravitasi dapat diabaikan.
 Jika suatu zat yang memiliki kelarutan dalam zat cair sangat rendah ditempatkan pada antarmuka cairan-udara, maka bolehjadi akan menyebar (spread out) membentuk suatu selaput (film) sangat tipis atau umumnya
Jika suatu zat yang memiliki kelarutan dalam zat cair sangat rendah ditempatkan pada antarmuka cairan-udara, maka bolehjadi akan menyebar (spread out) membentuk suatu selaput (film) sangat tipis atau umumnya
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A. D. Cu E. Zn
 1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN
 BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN STANDAR KOMPETENSI 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan
BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN STANDAR KOMPETENSI 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan
Chapter 7 Larutan tirtawi (aqueous solution)
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi modif oleh Dr I Kartini Chapter 7 Larutan tirtawi (aqueous solution) Larutan adalah campuran yang homogen dari dua atau lebih
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi modif oleh Dr I Kartini Chapter 7 Larutan tirtawi (aqueous solution) Larutan adalah campuran yang homogen dari dua atau lebih
Oleh: Dhadhang Wahyu Kurniawan 4/16/2013 1
 Oleh: Dhadhang Wahyu Kurniawan 4/16/2013 1 Melibatkan berbagai investigasi bahan obat mendapatkan informasi yang berguna Data preformulasi formulasi sediaan yang secara fisikokimia stabil dan secara biofarmasi
Oleh: Dhadhang Wahyu Kurniawan 4/16/2013 1 Melibatkan berbagai investigasi bahan obat mendapatkan informasi yang berguna Data preformulasi formulasi sediaan yang secara fisikokimia stabil dan secara biofarmasi
Kesetimbangan Kimia. A b d u l W a h i d S u r h i m
 Kesetimbangan Kimia A b d u l W a h i d S u r h i m 2 0 1 4 Rujukan Chapter 12 dan 14: Masterton, William L. and Hurley, Cecile N. 2009. Chemistry: Principles and Reactions. Sixth Edition. Books/Cole.
Kesetimbangan Kimia A b d u l W a h i d S u r h i m 2 0 1 4 Rujukan Chapter 12 dan 14: Masterton, William L. and Hurley, Cecile N. 2009. Chemistry: Principles and Reactions. Sixth Edition. Books/Cole.
SOAL SELEKSI NASIONAL TAHUN 2006
 SOAL SELEKSI NASIONAL TAHUN 2006 Soal 1 ( 13 poin ) KOEFISIEN REAKSI DAN LARUTAN ELEKTROLIT Koefisien reaksi merupakan langkah penting untuk mengamati proses berlangsungnya reaksi. Lengkapi koefisien reaksi-reaksi
SOAL SELEKSI NASIONAL TAHUN 2006 Soal 1 ( 13 poin ) KOEFISIEN REAKSI DAN LARUTAN ELEKTROLIT Koefisien reaksi merupakan langkah penting untuk mengamati proses berlangsungnya reaksi. Lengkapi koefisien reaksi-reaksi
OAL TES SEMESTER I. I. Pilihlah jawaban yang paling tepat! a. 2d d. 3p b. 2p e. 3s c. 3d 6. Unsur X dengan nomor atom
 KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
BAB I PENDAHULUAN 1.1 Latar Belakang 1.2 Perumusan Masalah
 BAB I PENDAHULUAN 1.1 Latar Belakang Lemak dan minyak adalah trigliserida yang berarti triester (dari) gliserol. Perbedaan antara suatu lemak adalah pada temperatur kamar, lemak akan berbentuk padat dan
BAB I PENDAHULUAN 1.1 Latar Belakang Lemak dan minyak adalah trigliserida yang berarti triester (dari) gliserol. Perbedaan antara suatu lemak adalah pada temperatur kamar, lemak akan berbentuk padat dan
Untuk mengetahui pengaruh ph medium terhadap profil disolusi. atenolol dari matriks KPI, uji disolusi juga dilakukan dalam medium asam
 Untuk mengetahui pengaruh ph medium terhadap profil disolusi atenolol dari matriks KPI, uji disolusi juga dilakukan dalam medium asam klorida 0,1 N. Prosedur uji disolusi dalam asam dilakukan dengan cara
Untuk mengetahui pengaruh ph medium terhadap profil disolusi atenolol dari matriks KPI, uji disolusi juga dilakukan dalam medium asam klorida 0,1 N. Prosedur uji disolusi dalam asam dilakukan dengan cara
A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI
 3 LAJU REAKSI A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI Materi dapat berubah dari bentuk yang satu ke bentuk yang
3 LAJU REAKSI A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI Materi dapat berubah dari bentuk yang satu ke bentuk yang
Kunci jawaban dan pembahasan soal laju reaksi
 Kunci jawaban dan pembahasan soal laju reaksi Soal nomor 1 Mencari volume yang dibutuhkan pada proses pengenceran. Rumus pengenceran V 1. M 1 = V 2. M 2 Misal volume yang dibutuhkan sebanyak x ml, maka
Kunci jawaban dan pembahasan soal laju reaksi Soal nomor 1 Mencari volume yang dibutuhkan pada proses pengenceran. Rumus pengenceran V 1. M 1 = V 2. M 2 Misal volume yang dibutuhkan sebanyak x ml, maka
Larutan Nonelektrolit dan Elektrolit Lemah yang Sendiri
 Kekuatan Ion Larutan Nonelektrolit dan Elektrolit Lemah yang Sendiri Pd larutan encer nonelektrolit, aktivitas dan konsentrasi dianggap praktis sama krn gaya elektrostatik tidak menyebabkan penyimpangan
Kekuatan Ion Larutan Nonelektrolit dan Elektrolit Lemah yang Sendiri Pd larutan encer nonelektrolit, aktivitas dan konsentrasi dianggap praktis sama krn gaya elektrostatik tidak menyebabkan penyimpangan
BAB IV HASIL DAN PEMBAHASAN. Berdasarkan hasil percobaan pendahuluan, ditentukan lima formula
 BAB IV HASIL DAN PEMBAHASAN A. HASIL 1. Formulasi Granul Mengapung Teofilin Berdasarkan hasil percobaan pendahuluan, ditentukan lima formula untuk dibandingkan karakteristiknya, seperti terlihat pada Tabel
BAB IV HASIL DAN PEMBAHASAN A. HASIL 1. Formulasi Granul Mengapung Teofilin Berdasarkan hasil percobaan pendahuluan, ditentukan lima formula untuk dibandingkan karakteristiknya, seperti terlihat pada Tabel
Soal ini terdiri dari 10 soal Essay (153 poin)
 Bidang Studi Kode Berkas : Kimia : KI-L01 (soal) Soal ini terdiri dari 10 soal Essay (153 poin) Tetapan Avogadro N A = 6,022 10 23 partikel.mol 1 Tetapan Gas Universal R = 8,3145 J.mol -1.K -1 = 0,08206
Bidang Studi Kode Berkas : Kimia : KI-L01 (soal) Soal ini terdiri dari 10 soal Essay (153 poin) Tetapan Avogadro N A = 6,022 10 23 partikel.mol 1 Tetapan Gas Universal R = 8,3145 J.mol -1.K -1 = 0,08206
Difusi adalah Proses Perpindahan Zat dari konsentrasi yang tinggi ke konsentrasi yang lebih rendah.
 Difusi adalah Proses Perpindahan Zat dari konsentrasi yang tinggi ke konsentrasi yang lebih rendah. Contoh difusi : a. Difusi gas b. Difusi air Hukum I Ficks : Q = - D dc/dx Ket : D Q dc/dx = Koofisien
Difusi adalah Proses Perpindahan Zat dari konsentrasi yang tinggi ke konsentrasi yang lebih rendah. Contoh difusi : a. Difusi gas b. Difusi air Hukum I Ficks : Q = - D dc/dx Ket : D Q dc/dx = Koofisien
D. Tinjauan Pustaka. Menurut Farmakope Indonesia (Anonim, 1995) pernyataan kelarutan adalah zat dalam
 JURNAL KELARUTAN D. Tinjauan Pustaka 1. Kelarutan Menurut Farmakope Indonesia (Anonim, 1995) pernyataan kelarutan adalah zat dalam bagian tertentu pelarut, kecuali dinyatakan lain menunjukkan bahwa 1 bagian
JURNAL KELARUTAN D. Tinjauan Pustaka 1. Kelarutan Menurut Farmakope Indonesia (Anonim, 1995) pernyataan kelarutan adalah zat dalam bagian tertentu pelarut, kecuali dinyatakan lain menunjukkan bahwa 1 bagian
Stoikhiometri : dan metron = mengukur. Membahas tentang : senyawa) senyawa (stoikhiometri. (stoikhiometri. reaksi)
 STOIKHIOMETRI Stoikhiometri : Dari kata Stoicheion = unsur dan metron = mengukur Membahas tentang : hub massa antar unsur dalam suatu senyawa (stoikhiometri senyawa) dan antar zat dalam suatu reaksi (stoikhiometri
STOIKHIOMETRI Stoikhiometri : Dari kata Stoicheion = unsur dan metron = mengukur Membahas tentang : hub massa antar unsur dalam suatu senyawa (stoikhiometri senyawa) dan antar zat dalam suatu reaksi (stoikhiometri
Gambar 2.1 Reaksi Saponifikasi tripalmitin
 I. JUDUL : Kinetika Reaksi Saponifikasi Etil Asetat II. TANGGAL PERCOBAAN : Rabu, 16 November 2011 III. TUJUAN : 1. Untuk memberikan gambaran bahwa reaksi penyabunan etil asetat oleh ion hidroksida adalah
I. JUDUL : Kinetika Reaksi Saponifikasi Etil Asetat II. TANGGAL PERCOBAAN : Rabu, 16 November 2011 III. TUJUAN : 1. Untuk memberikan gambaran bahwa reaksi penyabunan etil asetat oleh ion hidroksida adalah
Tahapan-tahapan disintegrasi, disolusi, dan difusi obat.
 I. Pembahasan Disolusi Suatu obat yang di minum secara oral akan melalui tiga fase: fase farmasetik (disolusi), farmakokinetik, dan farmakodinamik, agar kerja obat dapat terjadi. Dalam fase farmasetik,
I. Pembahasan Disolusi Suatu obat yang di minum secara oral akan melalui tiga fase: fase farmasetik (disolusi), farmakokinetik, dan farmakodinamik, agar kerja obat dapat terjadi. Dalam fase farmasetik,
Air adalah wahana kehidupan
 Air Air adalah wahana kehidupan Air merupakan senyawa yang paling berlimpah di dalam sistem hidup dan mencakup 70% atau lebih dari bobot semua bentuk kehidupan Reaksi biokimia menggunakan media air karena
Air Air adalah wahana kehidupan Air merupakan senyawa yang paling berlimpah di dalam sistem hidup dan mencakup 70% atau lebih dari bobot semua bentuk kehidupan Reaksi biokimia menggunakan media air karena
Kinetika Kimia dan Mekanisme Reaksi
 Kinetika Kimia dan Mekanisme Reaksi Kinetika Kimia Kinetika kimia adalah ilmu yang mempelajari laju reaksi, atau seberapa cepat proses reaksi berlangsung dalam waktu tertentu. Kinetika kimia menjelaskan
Kinetika Kimia dan Mekanisme Reaksi Kinetika Kimia Kinetika kimia adalah ilmu yang mempelajari laju reaksi, atau seberapa cepat proses reaksi berlangsung dalam waktu tertentu. Kinetika kimia menjelaskan
Struktur atom, dan Tabel periodik unsur,
 KISI-KISI PENULISAN USBN Jenis Sekolah : SMA/MA Mata Pelajaran : KIMIA Kurikulum : 2006 Alokasi Waktu : 120 menit Jumlah : Pilihan Ganda : 35 Essay : 5 1 2 3 1.1. Memahami struktur atom berdasarkan teori
KISI-KISI PENULISAN USBN Jenis Sekolah : SMA/MA Mata Pelajaran : KIMIA Kurikulum : 2006 Alokasi Waktu : 120 menit Jumlah : Pilihan Ganda : 35 Essay : 5 1 2 3 1.1. Memahami struktur atom berdasarkan teori
SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016)
 SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016) Bagian I: Pilihan Ganda 1) Suatu atom yang mempunyai energi ionisasi pertama bernilai besar, memiliki sifat/kecenderungan : A. Afinitas elektron rendah
SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016) Bagian I: Pilihan Ganda 1) Suatu atom yang mempunyai energi ionisasi pertama bernilai besar, memiliki sifat/kecenderungan : A. Afinitas elektron rendah
FAKTOR YANG MEMPENGARUHI DAYA HANTAR LISTRIK
 Nama : Ririn Vidiastuti NIM : 06111010015 Shift : A Kelompok : 5 (Lima) FAKTOR YANG MEMPENGARUHI DAYA HANTAR LISTRIK A. Jumlah Ion yang Ada Daya hantar listrik larutan elektrolit dipengaruhi oleh banyaknya
Nama : Ririn Vidiastuti NIM : 06111010015 Shift : A Kelompok : 5 (Lima) FAKTOR YANG MEMPENGARUHI DAYA HANTAR LISTRIK A. Jumlah Ion yang Ada Daya hantar listrik larutan elektrolit dipengaruhi oleh banyaknya
Kinetika Kimia. Abdul Wahid Surhim
 Kinetika Kimia bdul Wahid Surhim 2014 Kerangka Pembelajaran Laju Reaksi Hukum Laju dan Orde Reaksi Hukum Laju Terintegrasi untuk Reaksi Orde Pertama Setengah Reaksi Orde Pertama Reaksi Orde Kedua Laju
Kinetika Kimia bdul Wahid Surhim 2014 Kerangka Pembelajaran Laju Reaksi Hukum Laju dan Orde Reaksi Hukum Laju Terintegrasi untuk Reaksi Orde Pertama Setengah Reaksi Orde Pertama Reaksi Orde Kedua Laju
MODUL III KESETIMBANGAN KIMIA
 MODUL III KESETIMBANGAN KIMIA I. Petunjuk Umum 1. Kompetensi Dasar 1) Mahasiswa memahami Asas Le Chatelier 2) Mahasiswa mampu menjelaskan aplikasi reaksi kesetimbangan dalam dunia industry 3) Mahasiswa
MODUL III KESETIMBANGAN KIMIA I. Petunjuk Umum 1. Kompetensi Dasar 1) Mahasiswa memahami Asas Le Chatelier 2) Mahasiswa mampu menjelaskan aplikasi reaksi kesetimbangan dalam dunia industry 3) Mahasiswa
Oleh: Dhadhang Wahyu Kurniawan 4/16/2013 1
 Oleh: Dhadhang Wahyu Kurniawan 4/16/2013 1 Faktor yang harus diperhatikan dalam formulasi antara lain: Hal-hal yang berdampak pada kelarutan Hal-hal yang berdampak pada kecepatan disolusi Hal-hal yang
Oleh: Dhadhang Wahyu Kurniawan 4/16/2013 1 Faktor yang harus diperhatikan dalam formulasi antara lain: Hal-hal yang berdampak pada kelarutan Hal-hal yang berdampak pada kecepatan disolusi Hal-hal yang
UJI STABILITAS FISIK DAN KIMIA SEDIAAN SIRUP RACIKAN
 Prosiding SNaPP2012 : Sains, Teknologi, dan Kesehatan ISSN 2089-3582 UJI STABILITAS FISIK DAN KIMIA SEDIAAN SIRUP RACIKAN YANG MENGANDUNG ERDOSTEIN 1 Fetri Lestari, 2 Hilda Aprilia 1,2 Program Studi Farmasi,
Prosiding SNaPP2012 : Sains, Teknologi, dan Kesehatan ISSN 2089-3582 UJI STABILITAS FISIK DAN KIMIA SEDIAAN SIRUP RACIKAN YANG MENGANDUNG ERDOSTEIN 1 Fetri Lestari, 2 Hilda Aprilia 1,2 Program Studi Farmasi,
BAB II TINJAUAN PUSTAKA. lunak yang dapat larut dalam saluran cerna. Tergantung formulasinya kapsul terbagi
 BAB II TINJAUAN PUSTAKA 2.1 Kapsul Kapsul adalah sediaan padat yang terdiri dari obat dalam cangkang keras atau lunak yang dapat larut dalam saluran cerna. Tergantung formulasinya kapsul terbagi atas kapsul
BAB II TINJAUAN PUSTAKA 2.1 Kapsul Kapsul adalah sediaan padat yang terdiri dari obat dalam cangkang keras atau lunak yang dapat larut dalam saluran cerna. Tergantung formulasinya kapsul terbagi atas kapsul
Persiapan UN 2018 KIMIA
 Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan
 KINETIKA Pendahuluan Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan Namun persamaan reaksi tidak dapat menjawab :. Seberapa cepat reaksi berlangsung 2. Bagaimana
KINETIKA Pendahuluan Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan Namun persamaan reaksi tidak dapat menjawab :. Seberapa cepat reaksi berlangsung 2. Bagaimana
Rangkaian reaksi biokimia dalam sel hidup. Seluruh proses perubahan reaksi kimia beserta perubahan energi yg menyertai perubahan reaksi kimia tsb.
 Rangkaian reaksi biokimia dalam sel hidup. Seluruh proses perubahan reaksi kimia beserta perubahan energi yg menyertai perubahan reaksi kimia tsb. Anabolisme = (biosintesis) Proses pembentukan senyawa
Rangkaian reaksi biokimia dalam sel hidup. Seluruh proses perubahan reaksi kimia beserta perubahan energi yg menyertai perubahan reaksi kimia tsb. Anabolisme = (biosintesis) Proses pembentukan senyawa
Standarisasi Larutan
 Standarisasi Larutan Kimia Analitik Kimia analitik: Cabang ilmu kimia yg bertugas mengidentifikasi zat, memisahkannya serta menguraikannya dalam komponenkomponen, menentukan jenis serta jumlahnya. Kimia
Standarisasi Larutan Kimia Analitik Kimia analitik: Cabang ilmu kimia yg bertugas mengidentifikasi zat, memisahkannya serta menguraikannya dalam komponenkomponen, menentukan jenis serta jumlahnya. Kimia
METODE PENGUJIAN STABILITAS Stabilitas didefinisikan sebagai kemampuan zat obat atau produk obat untuk tetap di dalam spesifikasi yang dibentuk untuk
 METODE PENGUJIAN STABILITAS Stabilitas didefinisikan sebagai kemampuan zat obat atau produk obat untuk tetap di dalam spesifikasi yang dibentuk untuk menjaga identitas, kekuatan, kualitas dan kemurnian.
METODE PENGUJIAN STABILITAS Stabilitas didefinisikan sebagai kemampuan zat obat atau produk obat untuk tetap di dalam spesifikasi yang dibentuk untuk menjaga identitas, kekuatan, kualitas dan kemurnian.
BAB II DASAR TEORI. FeO. CO Fe CO 2. Fe 3 O 4. Fe 2 O 3. Gambar 2.1. Skema arah pergerakan gas CO dan reduksi
 BAB II DASAR TEORI Pengujian reduksi langsung ini didasari oleh beberapa teori yang mendukungnya. Berikut ini adalah dasar-dasar teori mengenai reduksi langsung yang mendasari penelitian ini. 2.1. ADSORPSI
BAB II DASAR TEORI Pengujian reduksi langsung ini didasari oleh beberapa teori yang mendukungnya. Berikut ini adalah dasar-dasar teori mengenai reduksi langsung yang mendasari penelitian ini. 2.1. ADSORPSI
kimia Kelas X LARUTAN ELEKTROLIT DAN NONELEKTROLIT K-13 A. Pengertian Larutan dan Daya Hantar Listrik
 K-13 Kelas X kimia LARUTAN ELEKTROLIT DAN NONELEKTROLIT Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami perbedaan antara larutan elektrolit dan
K-13 Kelas X kimia LARUTAN ELEKTROLIT DAN NONELEKTROLIT Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami perbedaan antara larutan elektrolit dan
PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP FAX KODE POS 60299
 PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP. 031-8415492 FAX 031-8430673 KODE POS 60299 ULANGAN AKHIR SEMESTER 2 (DUA) TAHUN PELAJARAN 2011 2012 Hari/Tanggal :
PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP. 031-8415492 FAX 031-8430673 KODE POS 60299 ULANGAN AKHIR SEMESTER 2 (DUA) TAHUN PELAJARAN 2011 2012 Hari/Tanggal :
BAB II TINJAUAN PUSTAKA
 21 BAB II TINJAUAN PUSTAKA 2.1 Polimer Emulsi 2.1.1 Definisi Polimer Emulsi Polimer emulsi adalah polimerisasi adisi terinisiasi radikal bebas dimana suatu monomer atau campuran monomer dipolimerisasikan
21 BAB II TINJAUAN PUSTAKA 2.1 Polimer Emulsi 2.1.1 Definisi Polimer Emulsi Polimer emulsi adalah polimerisasi adisi terinisiasi radikal bebas dimana suatu monomer atau campuran monomer dipolimerisasikan
SAP-GARIS-GARIS BESAR PROGRAM PENGAJARAN
 SAP-GARIS-GARIS BESAR PROGRAM PENGAJARAN Mata kuliah : Kimia Kode : Kim 101/3(2-3) Deskripsi : Mata kuliah ini membahas konsep-konsep dasar kimia yang disampaikan secara sederhana, meliputi pengertian
SAP-GARIS-GARIS BESAR PROGRAM PENGAJARAN Mata kuliah : Kimia Kode : Kim 101/3(2-3) Deskripsi : Mata kuliah ini membahas konsep-konsep dasar kimia yang disampaikan secara sederhana, meliputi pengertian
Sulistyani M.Si
 Sulistyani M.Si Email:sulistyani@uny.ac.id + Larutan terdiri dari pelarut (solvent) dan zat terlarut (solute). Jumlah zat terlarut dalam suatu larutan dinyatakan dengan konsentrasi larutan. Secara kuantitatif,
Sulistyani M.Si Email:sulistyani@uny.ac.id + Larutan terdiri dari pelarut (solvent) dan zat terlarut (solute). Jumlah zat terlarut dalam suatu larutan dinyatakan dengan konsentrasi larutan. Secara kuantitatif,
Kesetimbangan Kimia. Chapter 9 P N2 O 4. Kesetimbangan akan. Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Kesetimbangan adalah suatu keadaan di mana tidak ada perubahan yang terlihat seiring berjalannya waktu. Kesetimbangan kimia
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Kesetimbangan adalah suatu keadaan di mana tidak ada perubahan yang terlihat seiring berjalannya waktu. Kesetimbangan kimia
Kelas : XI IPA Guru : Tim Guru HSPG Tanggal : Senin, 23 Mei 2016 Mata pelajaran : Kimia Waktu : WIB
 Kelas : XI IPA Guru : Tim Guru HSPG Tanggal : Senin, 23 Mei 2016 Mata pelajaran : Kimia Waktu : 10.15 11.45 WIB Petunjuk Pengerjaan Soal Berdoa terlebih dahulu sebelum mengerjakan! Isikan identitas Anda
Kelas : XI IPA Guru : Tim Guru HSPG Tanggal : Senin, 23 Mei 2016 Mata pelajaran : Kimia Waktu : 10.15 11.45 WIB Petunjuk Pengerjaan Soal Berdoa terlebih dahulu sebelum mengerjakan! Isikan identitas Anda
PERCOBAAN POTENSIOMETRI (PENGUKURAN ph)
 PERCOBAAN POTENSIOMETRI (PENGUKURAN ph) I. Tujuan. Membuat kurva hubungan ph - volume pentiter 2. Menentukan titik akhir titrasi 3. Menghitung kadar zat II. Prinsip Prinsip potensiometri didasarkan pada
PERCOBAAN POTENSIOMETRI (PENGUKURAN ph) I. Tujuan. Membuat kurva hubungan ph - volume pentiter 2. Menentukan titik akhir titrasi 3. Menghitung kadar zat II. Prinsip Prinsip potensiometri didasarkan pada
Perubahan konsentrasi reaktan atau produk terhadap waktu. Secara matematis, untuk reaksi: A B Laju reaksi = r = -d[a]/dt = d[b]/dt
![Perubahan konsentrasi reaktan atau produk terhadap waktu. Secara matematis, untuk reaksi: A B Laju reaksi = r = -d[a]/dt = d[b]/dt Perubahan konsentrasi reaktan atau produk terhadap waktu. Secara matematis, untuk reaksi: A B Laju reaksi = r = -d[a]/dt = d[b]/dt](/thumbs/52/30298935.jpg) 1 Laju reaksi (r) Perubahan konsentrasi reaktan atau produk terhadap waktu Pengurangan konsentrasi reaktan Penambahan konsentrasi produk Dengan berjalannya waktu Secara matematis, untuk reaksi: A B Laju
1 Laju reaksi (r) Perubahan konsentrasi reaktan atau produk terhadap waktu Pengurangan konsentrasi reaktan Penambahan konsentrasi produk Dengan berjalannya waktu Secara matematis, untuk reaksi: A B Laju
SOAL KIMIA 1 KELAS : XI IPA
 SOAL KIIA 1 KELAS : XI IPA PETUNJUK UU 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja 3. Kerjakanlah soal anda pada lembar
SOAL KIIA 1 KELAS : XI IPA PETUNJUK UU 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja 3. Kerjakanlah soal anda pada lembar
C w : konsentrasi uap air dalam kesetimbangan, v f dan f w menyatakan laju penguapan dengan dan tanpa film di permukaan
 Adanya film monomolekuler menyebabkan laju penguapan substrat berkurang, sedangkan kesetimbangan tekanan uap tidak dipengaruhi Laju penguapan dinyatakan sebagai v = m/t A (g.det -1.cm -2 ) Tahanan jenis
Adanya film monomolekuler menyebabkan laju penguapan substrat berkurang, sedangkan kesetimbangan tekanan uap tidak dipengaruhi Laju penguapan dinyatakan sebagai v = m/t A (g.det -1.cm -2 ) Tahanan jenis
KISI-KISI PENULISAN SOAL USBN
 KISI-KISI PENULISAN USBN Jenis Sekolah : SMA/MA Mata Pelajaran : KIMIA Kurikulum : 2013 Alokasi Waktu : 120 menit Jumlah : Pilihan Ganda : 35 Essay : 5 1 2 3 4 3.4 Menganalisis hubungan konfigurasi elektron
KISI-KISI PENULISAN USBN Jenis Sekolah : SMA/MA Mata Pelajaran : KIMIA Kurikulum : 2013 Alokasi Waktu : 120 menit Jumlah : Pilihan Ganda : 35 Essay : 5 1 2 3 4 3.4 Menganalisis hubungan konfigurasi elektron
BAB IV HASIL DAN PEMBAHASAN. Berdasarkan hasil uji formula pendahuluan (Lampiran 9), maka dipilih
 BAB IV HASIL DAN PEMBAHASAN A. HASIL 1. Pembuatan Tablet Mengapung Verapamil HCl Berdasarkan hasil uji formula pendahuluan (Lampiran 9), maka dipilih lima formula untuk dibandingkan kualitasnya, seperti
BAB IV HASIL DAN PEMBAHASAN A. HASIL 1. Pembuatan Tablet Mengapung Verapamil HCl Berdasarkan hasil uji formula pendahuluan (Lampiran 9), maka dipilih lima formula untuk dibandingkan kualitasnya, seperti
TEORI TUMBUKAN PADA LAJU REAKSI KIMIA
 PENGEMBANGAN BAHAN AJAR TEORI TUMBUKAN PADA LAJU REAKSI KIMIA OLEH : Drs. I Wayan Suarsa, M.Si JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS UDAYANA 2017 Kata Pengantar Puji dan
PENGEMBANGAN BAHAN AJAR TEORI TUMBUKAN PADA LAJU REAKSI KIMIA OLEH : Drs. I Wayan Suarsa, M.Si JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS UDAYANA 2017 Kata Pengantar Puji dan
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi. Bab 16. Asam dan Basa
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Bab 16 Asam dan Basa Asam Memiliki rasa masam; misalnya cuka mempunyai rasa dari asam asetat, dan lemon serta buah-buahan sitrun
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Bab 16 Asam dan Basa Asam Memiliki rasa masam; misalnya cuka mempunyai rasa dari asam asetat, dan lemon serta buah-buahan sitrun
Hubungan koefisien dalam persamaan reaksi dengan hitungan
 STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
Kinetika kimia. Shinta Rosalia Dewi
 Kinetika kimia Shinta Rosalia Dewi Pendahuluan Termodinamika Kinetika Reaksi Mekanika fluida Pindah panas neraca massa ekonomi mendesain reaktor kimia Pendahuluan (cont ) Kinetika reaksi adalah studi tentang
Kinetika kimia Shinta Rosalia Dewi Pendahuluan Termodinamika Kinetika Reaksi Mekanika fluida Pindah panas neraca massa ekonomi mendesain reaktor kimia Pendahuluan (cont ) Kinetika reaksi adalah studi tentang
Sedangkan kerugiannya adalah tablet tidak bisa digunakan untuk pasien dengan kesulitan menelan. Absorpsi suatu obat ditentukan melalui disolusi
 BAB 1 PENDAHULUAN Sampai saat ini, sediaan farmasi yang paling banyak digunakan adalah sediaan tablet, yang merupakan sediaan padat kompak, dibuat secara kempa cetak, dalam bentuk tabung pipih atau sirkular,
BAB 1 PENDAHULUAN Sampai saat ini, sediaan farmasi yang paling banyak digunakan adalah sediaan tablet, yang merupakan sediaan padat kompak, dibuat secara kempa cetak, dalam bentuk tabung pipih atau sirkular,
 TRY OUT SELEKSI OLIMPIADE TINGKAT KABUPATEN/KOTA 2010 TIM OLIMPIADE KIMIA INDONESIA 2011 Waktu: 150 Menit PUSAT KLINIK PENDIDIKAN INDONESIA (PKPI) bekerjasama dengan LEMBAGA BIMBINGAN BELAJAR SSCIntersolusi
TRY OUT SELEKSI OLIMPIADE TINGKAT KABUPATEN/KOTA 2010 TIM OLIMPIADE KIMIA INDONESIA 2011 Waktu: 150 Menit PUSAT KLINIK PENDIDIKAN INDONESIA (PKPI) bekerjasama dengan LEMBAGA BIMBINGAN BELAJAR SSCIntersolusi
Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam
 Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam sistem pada kesetimbangan Uap mengembun dengan laju
Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam sistem pada kesetimbangan Uap mengembun dengan laju
LAPORAN PRAKTIKUM KIMIA ORGANIK PERCOBAAN II SIFAT-SIFAT KELARUTAN SENYAWA OGANIK
 LAPORAN PRAKTIKUM KIMIA ORGANIK PERCOBAAN II SIFAT-SIFAT KELARUTAN SENYAWA OGANIK OLEH NAMA : ISMAYANI NIM : F1F1 10 074 KELOMPOK : III ASISTEN : SYAWAL ABDURRAHMAN, S.Si. LABORATORIUM FARMASI FAKULTAS
LAPORAN PRAKTIKUM KIMIA ORGANIK PERCOBAAN II SIFAT-SIFAT KELARUTAN SENYAWA OGANIK OLEH NAMA : ISMAYANI NIM : F1F1 10 074 KELOMPOK : III ASISTEN : SYAWAL ABDURRAHMAN, S.Si. LABORATORIUM FARMASI FAKULTAS
PERCOBAAN 3 PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI
 LAPORAN PRAKTIKUM KIMIA FISIKA Nama : Any Kurniawati Kelompok : 6 NIM : 4301410009 Prodi/Jurusan : Pend. Kimia/Kimia Dosen : Ir. Sri Wahyuni, M.Si Tanggal Praktikum : 19 September 2012 Teman kerja : Fitriya
LAPORAN PRAKTIKUM KIMIA FISIKA Nama : Any Kurniawati Kelompok : 6 NIM : 4301410009 Prodi/Jurusan : Pend. Kimia/Kimia Dosen : Ir. Sri Wahyuni, M.Si Tanggal Praktikum : 19 September 2012 Teman kerja : Fitriya
Pembahasan Soal-soal Try Out Neutron, Sabtu tanggal 16 Oktober 2010
 Pembahasan Soal-soal Try Out Neutron, Sabtu tanggal 16 Oktober 2010 26. Diketahui lambing unsur Fe, maka jumlah p +, e - dan n o dalam ion Fe 3+ adalah.... Jawab :, Fe 3+ + 3e - Fe [ 18 Ar] 4s 2 3d 6 [
Pembahasan Soal-soal Try Out Neutron, Sabtu tanggal 16 Oktober 2010 26. Diketahui lambing unsur Fe, maka jumlah p +, e - dan n o dalam ion Fe 3+ adalah.... Jawab :, Fe 3+ + 3e - Fe [ 18 Ar] 4s 2 3d 6 [
PRESENTASI POWERPOINT PENGAJAR OLEH PENERBIT ERLANGGA DIVISI PERGURUAN TINGGI. BAB 16. ASAM DAN BASA
 PRESENTASI POWERPOINT PENGAJAR OLEH PENERBIT ERLANGGA DIVISI PERGURUAN TINGGI. BAB 16. ASAM DAN BASA Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Bab 16 Asam dan Basa Asam
PRESENTASI POWERPOINT PENGAJAR OLEH PENERBIT ERLANGGA DIVISI PERGURUAN TINGGI. BAB 16. ASAM DAN BASA Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Bab 16 Asam dan Basa Asam
HASIL DAN PEMBAHASAN
 HASIL DAN PEMBAHASAN Analisis Kebutuhan Daya Static Mixing Reactor Alat penelitian dirancang dan dibangun tanpa perhitungan rancangan struktural yang rinci. Meskipun demikian, perhitungan lebih rinci untuk
HASIL DAN PEMBAHASAN Analisis Kebutuhan Daya Static Mixing Reactor Alat penelitian dirancang dan dibangun tanpa perhitungan rancangan struktural yang rinci. Meskipun demikian, perhitungan lebih rinci untuk
1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat!
 Petunjuk : 1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat! 2. Soal Teori ini terdiri dari dua bagian: A. 30 soal pilihan Ganda : 60 poin B. 5 Nomor
Petunjuk : 1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat! 2. Soal Teori ini terdiri dari dua bagian: A. 30 soal pilihan Ganda : 60 poin B. 5 Nomor
Praktikum Kimia Fisika II Hidrolisis Etil Asetat dalam Suasana Asam Lemah & Asam Kuat
 I. Judul Percobaan Hidrolisis Etil Asetat dalam Suasana Asam Lemah & dalam Suasana Asam Kuat II. Tanggal Percobaan Senin, 8 April 2013 pukul 11.00 14.00 WIB III. Tujuan Percobaan Menentukan orde reaksi
I. Judul Percobaan Hidrolisis Etil Asetat dalam Suasana Asam Lemah & dalam Suasana Asam Kuat II. Tanggal Percobaan Senin, 8 April 2013 pukul 11.00 14.00 WIB III. Tujuan Percobaan Menentukan orde reaksi
BAB 2 DASAR TEORI. Universitas Indonesia. Pemodelan dan..., Yosi Aditya Sembada, FT UI
 BAB 2 DASAR TEORI Biodiesel adalah bahan bakar alternatif yang diproduksi dari sumber nabati yang dapat diperbaharui untuk digunakan di mesin diesel. Biodiesel mempunyai beberapa kelebihan dibandingkan
BAB 2 DASAR TEORI Biodiesel adalah bahan bakar alternatif yang diproduksi dari sumber nabati yang dapat diperbaharui untuk digunakan di mesin diesel. Biodiesel mempunyai beberapa kelebihan dibandingkan
PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH
 PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH TAHUN 2016 Soal diketik ulang oleh urip rukim (www.urip.info)
PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH TAHUN 2016 Soal diketik ulang oleh urip rukim (www.urip.info)
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL. UjianTeori. Waktu: 100 menit
 OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
LAPORAN PRAKTIKUM KIMIA FISIKA PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI
 LAPORAN PRAKTIKUM KIMIA FISIKA PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI OLEH : KELOMPOK III Nama : Rifqi Munip (061330401022) Riska (061330401023) Sarah Swasti Putri (061330401024) Siti Nurjanah (061330401025)
LAPORAN PRAKTIKUM KIMIA FISIKA PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI OLEH : KELOMPOK III Nama : Rifqi Munip (061330401022) Riska (061330401023) Sarah Swasti Putri (061330401024) Siti Nurjanah (061330401025)
KESETIMBANGAN FASE DALAM SISTEM SEDERHANA (ATURAN FASE)
 KESETIMBANGAN FASE DALAM SISTEM SEDERHANA (ATURAN FASE) Kondisi Kesetimbangan Untuk suatu sistem dalam kesetimbangan, potensial kimia setiap komponen pada setiap titik dlam system harus sama. Jika ada
KESETIMBANGAN FASE DALAM SISTEM SEDERHANA (ATURAN FASE) Kondisi Kesetimbangan Untuk suatu sistem dalam kesetimbangan, potensial kimia setiap komponen pada setiap titik dlam system harus sama. Jika ada
Bab IV Hasil dan Pembahasan
 Bab IV Hasil dan Pembahasan IV. 1 Analisis Hasil Pengujian Metalografi dan Spektrometri Sampel Baja Karbon Dari hasil uji material pipa pengalir hard water (Lampiran A.1), pipa tersebut terbuat dari baja
Bab IV Hasil dan Pembahasan IV. 1 Analisis Hasil Pengujian Metalografi dan Spektrometri Sampel Baja Karbon Dari hasil uji material pipa pengalir hard water (Lampiran A.1), pipa tersebut terbuat dari baja
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya.
 30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
BAB IV. HASIL DAN PEMBAHASAN
 BAB IV. HASIL DAN PEMBAHASAN 4.1 Sintesis dan Karakterisasi Karboksimetil Kitosan Spektrum FT-IR kitosan yang digunakan untuk mensintesis karboksimetil kitosan (KMK) dapat dilihat pada Gambar 8 dan terlihat
BAB IV. HASIL DAN PEMBAHASAN 4.1 Sintesis dan Karakterisasi Karboksimetil Kitosan Spektrum FT-IR kitosan yang digunakan untuk mensintesis karboksimetil kitosan (KMK) dapat dilihat pada Gambar 8 dan terlihat
FAKULTAS TEKNIK UNIVERSITAS NEGERI YOGYAKARTA BAHAN AJAR KIMIA DASAR
 No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 11 BAB VIII LARUTAN ASAM DAN BASA Asam dan basa sudah dikenal sejak dahulu. Istilah asam (acid) berasal dari bahasa Latin acetum yang berarti
No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 11 BAB VIII LARUTAN ASAM DAN BASA Asam dan basa sudah dikenal sejak dahulu. Istilah asam (acid) berasal dari bahasa Latin acetum yang berarti
BAB IV. HASIL DAN PEMBAHASAN. Pragel pati singkong yang dibuat menghasilkan serbuk agak kasar
 BAB IV. HASIL DAN PEMBAHASAN A. HASIL 1. Pembuatan Pragel Pati Singkong Pragel pati singkong yang dibuat menghasilkan serbuk agak kasar berwarna putih. Rendemen pati yang dihasilkan adalah sebesar 90,0%.
BAB IV. HASIL DAN PEMBAHASAN A. HASIL 1. Pembuatan Pragel Pati Singkong Pragel pati singkong yang dibuat menghasilkan serbuk agak kasar berwarna putih. Rendemen pati yang dihasilkan adalah sebesar 90,0%.
BAB 4. WUJUD ZAT 1. WUJUD GAS 2. HUKUM GAS 3. HUKUM GAS IDEAL 4. GAS NYATA 5. CAIRAN DAN PADATAN 6. GAYA ANTARMOLEKUL 7. TRANSISI FASA 8.
 BAB 4. WUJUD ZAT 1. WUJUD GAS 2. HUKUM GAS 3. HUKUM GAS IDEAL 4. GAS NYATA 5. CAIRAN DAN PADATAN 6. GAYA ANTARMOLEKUL 7. TRANSISI FASA 8. DIAGRAM FASA WUJUD ZAT: GAS CAIRAN PADATAN PERMEN (sukrosa) C 12
BAB 4. WUJUD ZAT 1. WUJUD GAS 2. HUKUM GAS 3. HUKUM GAS IDEAL 4. GAS NYATA 5. CAIRAN DAN PADATAN 6. GAYA ANTARMOLEKUL 7. TRANSISI FASA 8. DIAGRAM FASA WUJUD ZAT: GAS CAIRAN PADATAN PERMEN (sukrosa) C 12
