KAJIAN TEORITIS UNTUK MENENTUKAN CELAH ENERGI PORFIRIN TERKONJUGASI LOGAM KALSIUM MENGGUNAKAN TEORI FUNGSIONAL KERAPATAN (DFT)
|
|
|
- Doddy Sudirman
- 7 tahun lalu
- Tontonan:
Transkripsi
1 KAJIAN TEORITIS UNTUK MENENTUKAN CELAH ENERGI PORFIRIN TERKONJUGASI LOGAM KALSIUM MENGGUNAKAN TEORI FUNGSIONAL KERAPATAN (DFT) A THEORETICAL STUDIES TO DETERMINE BAND GAP OF CONJUGATED PORPHYRIN WITH CALCIUM METAL USING DENSITY FUNCTIONAL THEORY (DFT) Gawang Pamungkas and I Gusti Made Sanjaya Department of Chemistry, Faculty of Mathematics and Natural sciences State University of Surabaya igmass@gmail.com Abstrak. Telah dilakukan kajian teoritis untuk menentukan celah energi porfirin terkonjugasi logam kalsium (Ca). Metode komputasi yang digunakan adalah teori fungsional kerapatan (DFT) dengan basis set 6-31*G/B3LYP/grid=fine(x-fine)/Restricted Kohn-Sam (RKS). Celah energi porfirin terkonjugasi logam Ca ditentukan melalui selisih antara energi HOMO dan LUMO, celah energi yang kecil (E g ~ 1,1 ev) menyebabkan daya serapan yang besar. Hasil penelitian menunjukkan celah energi dari Ca-porfirin adalah ev. Celah energi itu mencerminkan kemudahan dalam eksitasi elektron, yang menyebabkan peningkatan sifat fotosensitivitas Ca-porfirin. Celah energi juga mempengaruhi kerapatan elektron pada masing-masing sumbu (x, y, dan z). Oleh karena itu, Ca-Porfirin berpotensi digunakan sebagai detektor inframerah (sensor optik). Kata kunci: porfirin, DFT, HOMO, LUMO, celah energi Abstract. A Theoretical study to determine band gap of conjugated porphyrin with calcium metal (Ca) has done. Density Functional Theory (DFT) with basis set 6-31 G */B3LYP/grid = fine (x-fine)/restricted Kohn-Sham (RKS) was used in computational method. Band gap of conjugated porphyrin with Ca was determined by the energy difference between the HOMO and LUMO, a small band gap (Eg ~ 1.1 ev) caused a large absorption power. The result showed band gap of Ca-porphyrin is ev. This band gap reflecting ease in excitation of electron, causing increased of photosensitivity properties Ca-porphyrin. Band gap affect the electron density in each axis (x, y, and z). Therefore, Ca- Porphyrin potentially to be used as infrared detector (optical sensor). Keywords: porphyrin, DFT, HOMO, LUMO, band gap PENDAHULUAN Dewasa ini banyak penggunaan senyawa organik yang dikonjugasikan dengan atom logam sebagai bahan pembuatan sensor. Satu diantara senyawa organik itu adalah porfirin. Struktur porfirin mempunyai ikatan rangkap terkonjugasi yang memungkinkan terjadinya proses serapan gelombang elektromagnetik yang mengeksitasi elektron-elektron dari tingkat dasar ke tingkat eksitasi. Senyawa ini merupakan bahan semikonduktor organik yang mampu menyerap sinar gelombang elektromagnetik. Apabila porfirin dikonjugasikan dengan atom logam kemungkinan sifat semikonduktornya bertambah. Sifat semikonduktor porfirin berhubungan erat dengan celah energi (band gap). Celah energinya yang kecil menyebabkan daya serapan yang besar, sehingga senyawa ini berpotensi menjadi detektor inframerah organik dan cahaya tampak yang menghasilkan spektra UV-Vis dan inframerah [1]. 54
2 Kajian terhadap porfirin yang dikonjugasikan dengan logam mulai dilakukan oleh Pedersen [1]. Porfirin dikonjugasikan dengan beberapa logam, seperti dengan ion Zn(II), Mg, dan Ni. Ketiga logam tersebut dikonjugasikan dengan porfirin pada posisi pusat (central) menggunakan metode ab-initio. Diperoleh bahwa Zn-porfirin dan Ni-Porfirin memilki peluang dijadikan detektor inframerah organik dan cahaya tampak karena memiliki celah enrgi yang kecil yaitu 0,63 ev. Selanjutnya dilakukan oleh Susi sudanti [2]. Porfirin dikonjugasikan dengan 2 atom logam, masing-masing adalah atom Ag dan atom Cu. Penelitian ini mengkonjugasikan atom Ag dan Cu dengan metode mekanika kuantum semiempirik ZINDO/1 pada posisi meso (sentral) terhadap senyawa porfirin. Hasil penelitiannya menunjukkan bahwa celah energi dari porfirin terkonjugasi atom Cu dan Ag, masing-masing sebesar 4,49 ev (7, J) dan 2,12 ev (3, J). Sementara daerah serapan inframerah untuk porfirin terkonjugasi atom Cu dan Ag, masing-masing berada pada panjang gelombang 4,22 μm (4, m) dan 5,08 μm (5, m). Salah satu bagian yang berperan penting dalam sifat semikonduktor yang dimiliki pofirin terkonjugasi adalah jenis atom logam yang dikonjugasikan. Logam yang memiliki energi ionisasi kecil akan mudah melepaskan elektron pada saat dikonjugasikan dengan porfirin. Semakin mudah melepaskan elektron, maka sifat konduktivitasnya (semikonduktor dan konduktor) akan bertambah. Sedangkan metode kimia komputasi sangat mempengaruhi keakuratan hasil perhitungan celah energi (band gap), spektra UV-Vis, dan inframerah Kalsium adalah elemen kimia dengan simbol Ca dan bernomor atom 20. Kalsium juga merupakan ion terabaikan kelima terbanyak di air laut dilihat dari segi molaritas dan massanya, setelah natrium, klorida, magnesium, dan sulfat. Logam kalsium berwarna putih keperakan dan memilki sifat yang mudah melepas elektron dibandingkan dengan logam-logam yang digunakan pada penelitian terdahulu. Logam kalsium memilki orbital d yang kosong sehingga dimungkinkan dapat terjadi transisi elektronik jika logam tersebut dikonjugasikan dengan porfirin. Modeling senyawa menggunakan metode komputasi Density Functional Theory (DFT). Metode ini dipilih karena memodelkan sistem molekul dengan akurat dan memberikan data dalam tingkat mikroskopik yang berkorelasi signifikan dengan hasil eksperimen laboratorium. Metode DFT yang digunakan dalam penelitian ini adalah Restricted Kohn- Sham (RKS) atau Closed Shell Kohn-Sham (CLKS). Metode tersebut digunakan karena molekul merupakan sebuah sistem yang tertutup dan logam pusat hanya saling berinteraksi dengan atom nitrogen dan cincin pirol. Sedangkan fungsional yang digunakan adalah fungsional hybrid (B3LYP). Fungsional hybrid (B3LYP) digunakan karena senyawa yang diprediksi sifat dan struktur elektroniknya merupakan senyawa organik yang mengandung logam. Set basis yang digunakan adalah 6-31G*. Notasi 6-31G* menandakan di dalam set basis ini terdapat enam fungsi Gaussian yang mewakili orbital ini, tiga fungsi Gaussian untuk orbital elektron valensi bagian yang terkontraksi, dan satu untuk bagian yang berdifusi. Notasi (*) menunjukkan fungsi polarisasi pada atom non hidrogen (dalam senyawa di atas adalah atom C dan N). Dengan metode komputasi, perhitungan akan aras-aras energi akan dapat ditentukan, terutama dalam penentuan energi HOMO (Highest Occupied Molecular Orbitals) dan energi LUMO (Lowest Unoccupied Molecular Orbitals), sehingga celah energi di dapat dirumuskan selisih antara energi LUMO (E LUMO ) dengan energi HOMO (E HOMO ). Pada penelitian ini akan dikaji porfirin yang dikonjugasikan dengan atom logam Ca. Harapanya, porfirin yang dikonjugasikan atom logam Ca memiliki celah energi (band gap) yang kecil (E g ~ 1,1 ev), sehingga dapat dijadikan devais semikonduktor untuk pembuatan sensor optik. METODE PENELITIAN Perangkat keras dan lunak Perhitungan dilakukan menggunakan komputer dengan spesifikasi prosesor Intel (R) Core i5 GHz dan RAM 4 GB. Perhitungan komputasi menggunakan sistem operasi Windows 7 Home Premium dan Linux 55
3 Ubuntu 10.1, sedangkan untuk perangkat lunak digunakan Gabedit , MPQC , Molden 5.0, Ghemical , dan Avogadro Software Gabedit digunakan untuk membuat input file MPQC, selanjutnya MPQC digunakan untuk melakukan semua perhitungan komputasi molekul meliputi optimasi geometri dan perhitungan energi satu titik serta E HOMO dan E LUMO. Ghemical dan molden 5.0 digunakan untuk memvisualisasikan kerapatan elektron dan orbital HOMO-LUMO dalam bentuk 3D. Avogadro digunakan untuk visualisasi molekul 3D. Prosedur penelitian Pembuatan model awal Untuk melakukan penelitian ini dibutuhkan struktur 3 dimensi dari molekul porfirin dan porfirin terkonjugasi atom logam Ca dengan bentuk serta konfigurasi yang tepat. Langkah pertama adalah memodelkan senyawa tersebut secara 2 dimensi. Selanjutnya, senyawa tersebut dibuat struktur 3 dimensi dengan menggunakan program Gabedit Untuk mendapatkan konfigurasi yang tepat, diambil informasi dari literatur dan penelitian terdahulu [2]. Untuk konfirmasi konfigurasi yang lebih tepat, diambil juga data dari situs Dengan demikian, diperoleh konfigurasi yang benar dan tepat. Struktur yang sudah jadi tersebut disimpan dengan jenis file gabedit. Selanjutnya digunakan sebagai senyawa awal pada penelitian ini. Optimasi geometri Langkah kedua yaitu meminimisasi struktur dengan menjalankan optimasi geometri terhadap senyawa porifin terkonjugasi hasil dari langkah pertama. Sebelum dilakukan optimasi geometri, terlebih dahulu dibuat simple input file dan object oriented file melalui menu terminal. Pada simple input file diatur metode perhitungan dengan Teori Fungsional Kerapatan (DFT) dengan basis set yang digunakan adalah 6-31G*. Pada object oriented file diatur write_pdb = 1. Tujuanya adalah agar hasil running MPQC tersimpan dalam file.pdb (protein data bank), sehingga dapat divisualisasikan dalam beberapa software komputasi. Setelah itu pada menu terminal ketik perintah : mpqc file.in >> file.out, hal ini bertujuan untuk mencatat semua hasil perhitungan. Selanjutnya, program MPQC mulai melakukan kovergensi sampai diperoleh energi potensial permukaan minimum. Penentuan celah energi (band gap) Langkah selanjutnya, menentukan celah energi. Celah energi merupakan selisih antara energi LUMO (E LUMO ) dengan energi HOMO (E HOMO ). HOMO adalah orbital tertinggi pada pita valensi yang ditempati elektron. Sedangkan LUMO adalah orbital terendah pada pita konduksi yang tidak ditempati elektron. Penghitungan celah energi ini dilakukan baik untuk senyawa porfirin maupun porfirin terkonjugasi. Setelah itu, dianalisis mengenai celah energi yang dihasilkan terhadap sifat fotosensitifitasnya, sehingga bahan tersebut mempunyai peluang untuk dikembangkan sebagai detektor inframerah organik atau sensor. HASIL DAN PEMBAHASAN Proses Komputasi Senyawa Porfirin Terkonjugasi Logam Pemodelan molekul dilakukan dengan menggunakan software Gabedit Sebagai contoh adalah pada struktur molekul porfirin, ditampilkan pada Gambar 1 Gambar 1 Visualisasi porfirin menggunakan Software Gabedit Setelah dilakukan pemodelan, molekul porfirin terkonjugasi dioptimasi dengan menggunakan metode density functional theory (DFT) untuk mendapatkan struktur paling stabil dengan tingkat energi minimum. Selanjutnya dilakukan perhitungan energi satu titik (single point energy calculation) untuk mengoptimasi fungsi gelombang sehingga didapatkan tingkat energi yang lebih minimum dibanding energi 56
4 hasil optimasi geometri. Tahapan yang sama juga dilakukan terhadap kompleks porfirin terkonjugasi atom logam Ca. Sebelum melakukan langkah-langkah di atas, terlebih dahulu ditentukan metode DFT dan set basis yang digunakan. Berdasarkan hasil optimasi dengan metode DFT dan set basis di atas, maka diperoleh data panjang ikatan, sudut ikatan, dan total SCF energy. Panjang ikatan (Å) Ca-N(6-21), Ca-N(6-32), Ca-N(6-34), Ca-N(6-46), N-Ca-N( ), dan N-Ca-N( ) secara berurutan adalah , , , dan Sementara itu, sudut ikatan ( o ) N-Ca-N ( ) dan N-Ca-N ( ) adalah dan Untuk total SCF energi sebesar Hartree. Senyawa kompleks terbentuk dari interaksi atom pusat sebagai asam Lewis dan ligan sebagai basa Lewis atau interaksi yang didasarkan pada teori HSAB (Hard and soft acid and bases) [5]. Porfirin terkonjugasi Ca termasuk senyawa kompleks, dimana terbentuk ikatan antara kalsium (Ca) dengan nitrogen (N) yang memiliki panjang ikatan pada rentang 2-3 Å sebanyak 4 ikatan. Logam Ca sebagai atom pusat dan berdasarkan teori HSAB termasuk dalam kelompok Hard, sementara itu ligan dari senyawa kompleks tersebut adalah porfirin dengan atom Nitrogen (N) sebagai sumber basanya. Teori HSAB tersebut berkaitan erat dalam menjelaskan ikatan kovalen dan kovalen koordinasi, atom oksigen dibandingkan dengan atom nitrogen memiliki kecenderungan yang lebih tinggi membentuk senyawa kompleks dengan logam magnesium dan kalsium [6]. Kecenderungan ikatan yang terbentuk adalah ikatan ionik dan kovalen koordinasi. Ikatan kovalen koordinasi disebabkan adanya orbital kosong pada atom kalsium sehingga pasangan elektron yang dimiliki oleh atom nitrogen pada porfirin akan dikoordinasikan/menempati orbital kosong tersebut untuk membentuk ikatan kovalen koordinasi. Kompleks Ca-Porfirin, atom pusatnya adalah Ca yang menggunakan orbital s dan d kosong sebagai akseptor untuk menerima 4 pasangan elektron dari 4 atom N pada ligan porfirin. Pembentukkan ikatan pada senyawa kompleks Ca-porfirin dapat dijelaskan melalui teori ikatan valensi (VBT). Menurut teori ikatan valensi (VBT) adalah sebagai berikut: Konfigurasi elektron logam Ca: 2p 3s 3p 4s 3d Konfigurasi elektron ion Ca 2+ : Konfigurasi Ca-Porfirin : Donor pasangan elektron ligan (4 atom N) Gambar 2. Teori Ikatan Valensi (VBT) Ca-porfirin 57
5 Gambar 3 Visualisasi Model Molekul Ca- Porfirin Menggunakan Software Avogadro Sudut ikatan berpengaruh dalam distribusi elektron pada suatu molekul dan fleksibilitas molekul, hal tersebut juga terjadi pada molekul porfirin yang dikonjugasikan dengan logam kalsium. Sudut ikatan adalah sudut yang terbentuk oleh atom pusat di puncak dengan dua atom di sekelilingnya. Semakin besar sudut yang dibentuk oleh atom-atom (semakin linier) maka semakin kurang fleksibel molekul yang terbentuk. Hal ini disebabkan oleh distribusi muatan elektron yang tersebar merata. Oleh karena itu, molekul Ca-porfirin memiliki tingkat fleksibilitas yang cukup tinggi, sehingga memungkinkan untuk dibentuk sangat tipis sebagai bahan semikonduktor. Ca-porfirin merupakan kompleks yang stabil. Hal tersebut dapat dijelaskan dengan panjang ikatan antara logam pusat dengan atom nitrogen porfirin dan distribusi muatan. Kation logam besar akan lebih stabil membentuk kompleks daripada kation logam kecil, hal ini disebabkan karena kation logam besar mempunyai bilangan koordinasi yang besar daripada kation logam kecil sehingga akan lebih mampu menampung donor atom oksigen atau nitrogen [7]. Kerapatan elektron merupakan daerah/ruang dimana elektron dapat ditemukan. Elektron merupakan elemen yang sangat penting dalam menjelaskan sifat dari molekul, dengan elektron kita dapat memprediksi struktur molekul, kekuatan ikatan, reaktivitas, dan kestabilan. Kerapatan elektron sering dihubungkan dengan ESP-surface yaitu peluang ditemukannya elektron pada koordinat kartesian (x, y, dan z) dalam sebuah molekul. Kerapatan elektron kompleks Ca-porfirin terlihat jelas di area interaksi antara logam pusat dengan atomatom nitrogen (warna biru), hal ini disebabkan oleh kerapatan elektron pada logam Ca yang dikonjugasikan ke porfirin relatif tinggi, kerapatan elektron golongan IIA Ca>Mg>Be [8]. Gambar 4 menunjukkan kerapatan elektron dari Ca-porfirin. Rapat muatan positif (biru) lebih meruah di daerah cincin makrosiklik, hal ini disebabkan adanya jembatan penghubung antar muatan positif yaitu logam Ca. Kompleks yang stabil dikarenakan memilki ligan yang berukuran besar (polidentat) yang cenderung akan mengkoordinasi atom pusat yang besar sehingga akan menghasilkan kompleks yang lebih sempit atau lebih rapat. Adanya atom pusat Ca akan menambah rapat muatan positif dan ligan yang juga besar akan memberikan efek tolakan yang sama besar sehingga dapat menyebabkan kompleks ini akan stabil. Logam Ca mempunyai kemampuan polarisasi yang lebih besar sehingga menghasilkan kompleks yang lebih stabil. Tabel 1. Kerapatan Elektron (ESP-Surface) Senyawa kompleks kerapatan elektron x Y z 386 points, 434 points, 638 points, Ca-Porfirin 1281 cycles 7681 cycles 2190 cycles 58
6 Gambar 4. Visualisasi ESP-Surface Kompleks Ca-Porfirin Menggunakan Software Ghemical Kajian Celah Energi Porfirin Terkonjugasi Logam Kalsium Tabel 2. Celah Energi Porfirin Terkonjugasi Logam Senyawa Energi HOMO-LUMO (Hartree) Celah energi Celah enegi (ev) kompleks (x10-19 Joule) Energi HOMO Energi LUMO Ca-Porfirin Dari tabel 2, terlihat bahwa Ca-Porfirin memiliki celah energi (band gap) medekati 1,1 ev. Selisih energi orbital HOMO-LUMO sebesar 1,1 ev ini akan mencerminkan kemudahan dalam proses terjadinya eksitasi elektron sehingga sifat kepekaannya terhadap cahaya (fotosensitivitas) akan cenderung lebih kuat. Oleh karena itu, dapat diklasifikasikan bahwa Ca-Porfirin memiliki sifat fotosensitivitas yang kuat. Pita energi adalah kumpulan garis pada tingkat energi yang sama saling berimpit dan membentuk pita. Pada orbit bagian luar terdapat elektron yang sangat banyak dengan tingkattingkat energi yang berimpit satu sama lain. Berdasarkan asas Pauli, dalam suatu tingkat energi tidak boleh terdapat lebih dari satu elektron pada keadaan yang sama, maka apabila ada elektron yang berada pada keadaan yang sama akan terjadi pergeseran tingkat energi sehingga tidak pernah ada garis garis energi yang bertindihan. Level Fermi adalah level energi tertinggi yang masih dapat ditempati elektron pada temperatur absolut nol. Apabila level Fermi suatu bahan lebih dekat dengan LUMO, dapat dikatakan bahan tipe-n, dan berperilaku sebagai penerima (akseptor) elektron, sedangkan apabila level Fermi suatu bahan lebih dekat dengan HOMO, bahan tersebut dapat dikatakan bahan tipe-p dan berperan sebagai pemberi (donor) elektron. Diagram pita energi menunjukkan (pita kuning) bahwa level fermi lebih mendekati orbital HOMO, sehingga porfirin terkojugasi logam Ca memiliki sifat semikonduktor tipe-p (gambar 5). Gambar 5. Diagram pita energi Ca-porfirin 59
7 Gambar 6. LUMO molekul Ca-Porfirin Bagian teratas dari keadaan yang ditempati oleh elektron pada pita valensi disebut Highest Occupied Molecular Orbital (HOMO), sedangkan bagian terbawah dari keadaan yang tidak ditempati elektron pada pita disebut dengan Lowest Unoccupied Molecular Orbital (LUMO), atau dapat juga dikatakan bahwa HOMO merupakan analog bagi pita valensi dalam kajian semikonduktor berbasis bahan anorganik, sedangkan LUMO merupakan analog bagi pita konduksi. Orbital molekul merupakan penyelesaian dari pendekatan persamaan mekanika kuantum dari gerakan elektron yang didapatkan sebagai hasil penjumlahan dan penyelesaian atomik (orbital atom), seperti halnya molekul dibuat sebagai kombinasi atom. Orbital molekul untuk molekul sederhana seringkali diinterpretasikan dalam istilah ikatan kimia atau sebagai pasangan elektron tak terikat (nonbonded). Secara umum semakin terdelokalisasi orbital, semakin stabil molekul ini (energi yang lebih rendah) [10]. Oleh karena itu, Ca-porfirin merupakan kompleks yang stabil. Seperti terlihat pada gambar 7 dan 8. PENUTUP Simpulan Celah energi porfirin terkonjugasi logam Ca adalah ev. Oleh karena itu, dapat diklasifikasikan bahwa Ca-Porfirin memiliki sifat fotosensitivitas yang kuat, sehingga berpotensi untuk dijadikan detektor (sensor) inframerah yang baik. Gambar 7. HOMO molekul Ca-Porfirin Saran Perlu dilakukan uji parameter sifat optik lain dari senyawa porfirin terkonjugasi logam kalsium dan dipelajari kembali porfirin terkonjugasi logam Ca dengan menggunakan basis set yang lebih tinggi pada proses komputasinya, sehingga didapatkan hasil prediksi yang lebih akurat. DAFTAR PUSTAKA 1. Pedersen, T.G., Density-functionalbased tight-binding calculation of excitons in conjugated polymers. Phys.Rev., B Sudanti, Susi Kajian Teoritis Untuk Menentukan Celah Energi Porfirin Terkonjugasi Atom Perak dan Tembaga dengan Menggunakan Metode Mekanika Kuantum semiempiris Zindo/1. Skripsi. Jurusan Kimia, FMIPA, Universitas Gadjah Mada, Yogyakarta. 3. Candra, Robby Sensor dan Transduser. Depok: Universitas Gunadarma 4. Ohno, Koichi Quantum Chemistry. Tokyo: Iwanami Publishing Company 5. Huheey J E Inorganic Chemistry: Principles of Structure and Reactivity. 2nd ed. New York, Harper & Row Publisher 6. C. Wilkins, Patricia dan Wilkins, Ralph G Inorganic Chemistry in Biology. New York: Oxford University Press. 7. Syaifuddin, M. dan Kasmui. ( ). Kajian Teoritis Kestabilan Kompleksasi Eter 60
8 Tetraaza-18Crown6 (TA-18C6) Terhadap Kation Cd 2+ Dan Kation Cu 2+ Dengan Menggunakan Teori Fungsi Kerapatan (Density Functional Theory = DFT). Jurusan Kimia, FMIPA, Unnes, Semarang. 8. Albert Cotton; Geoffrey Wilkinson Kimia Anorganik Dasar. Penerjemah: Suhati Suharto. Pedamping: Yanti R. A. Koestoer. Cetakan Pertama. Jakarta. Penerbit Universitas Indonesia (UI-Press) 9. Dwi Pranowo, Harno. (2002). Pengantar Kimia Komputasi Austrian-Indonesian Centre for Computational Chemistry (AIC). Yogyakarta : Kimia FMIPA UGM 10. Moffett, T. M., 2007, Molecular Orbital Theory, SUNY Plattsburgh, Platsburgh USA. 11. Zhi-Cheng Sun, Yuan-Bin She, Yang Zhou, Xu-Feng Song and Kai Li Synthesis, characterization and spectral properties of substituted tetraphenylporphyrin iron chloride complexes. Molecules, 16, M. Makarska, St. Radzki, J. Legendziewicz, J Alloys Comp Supriyanto A, Triyana K, Roto, Kusminarto Karakteristik optoelektronik larutan porphyrin hasil isolasi dari mikroalgae spirulina. Prosiding Seminar Nasional Aplikasi Fotonika E6-1-E Gadisa, A., 2006, Studies of Charge Transport and Energy Level in Solar CellsBased on Polymer/Fullerene Bulk Heterojunction, Dissertasi Doktoral, Universitas Linköping, Swedia. 15. Hoppe, H., Sariciftci, N. S., 2004, Modeling of optical absorption in conjugated polymeryfullerene bulkheterojunction plastic solar cells, Thin Solid Films, Nomor , halaman Kahn, Antoine, et al Electrical Doping of π-conjugated Organic Molecular Films: Fundamental Mecvhanisms and New Electronic Functions. Princenton University, USA. 17. Nasruddin dan Leenawaty Limantara Menggagas Fotosintesis Buatan Hibrida berbasis Struktur Nano Porfirin. Jurnal Nanosains & Nanoteknologi ISSN Vol. 2 No. 1, Februari
BAB I PENDAHULUAN I.1
 BAB I PENDAHULUAN I.1 Latar Belakang Matahari adalah sumber energi yang sangat besar dan tidak akan pernah habis. Energi sinar matahari yang dipancarkan ke bumi dapat dimanfaatkan untuk berbagai keperluan
BAB I PENDAHULUAN I.1 Latar Belakang Matahari adalah sumber energi yang sangat besar dan tidak akan pernah habis. Energi sinar matahari yang dipancarkan ke bumi dapat dimanfaatkan untuk berbagai keperluan
KAJIAN TEORITIS UNTUK MENENTUKAN CELAH ENERGI KOMPLEKS Ag-PHTHALOCYANINE DENGAN MENGGUNAKAN METODE MEKANIKA KUANTUM SEMIEMPIRIS ZINDO/1
 SEMINAR NASIONAL KIMIA DAN PENDIDIKAN KIMIA VI Pemantapan Riset Kimia dan Asesmen Dalam Pembelajaran Berbasis Pendekatan Saintifik Program Studi Pendidikan Kimia Jurusan PMIPA FKIP UNS Surakarta, 21 Juni
SEMINAR NASIONAL KIMIA DAN PENDIDIKAN KIMIA VI Pemantapan Riset Kimia dan Asesmen Dalam Pembelajaran Berbasis Pendekatan Saintifik Program Studi Pendidikan Kimia Jurusan PMIPA FKIP UNS Surakarta, 21 Juni
BAB I PENDAHULUAN. Gambar I.1 Struktur Porfirin (Jaung, 2005)
 BAB I PENDAHULUAN I.1 Latar Belakang Semikonduktor merupakan bahan dengan konduktivitas listrik yang berada di antara isolator dan konduktor dengan rentang energi band gap 1,5-4 ev (Mitchell, 2004). Semikonduktor
BAB I PENDAHULUAN I.1 Latar Belakang Semikonduktor merupakan bahan dengan konduktivitas listrik yang berada di antara isolator dan konduktor dengan rentang energi band gap 1,5-4 ev (Mitchell, 2004). Semikonduktor
KAJIAN TEORITIS UNTUK MENENTUKAN CELAH ENERGI KOMPLEKS 8-HIDROKSIQUINOLIN TERKONJUGASI LOGAM BESI DENGAN MENGGUNAKAN TEORI KERAPATAN FUNGSIONAL
 KAJIAN TEORITIS UNTUK MENENTUKAN CELAH ENERGI KOMPLEKS 8-HIDROKSIQUINOLIN TERKONJUGASI LOGAM BESI DENGAN MENGGUNAKAN TEORI KERAPATAN FUNGSIONAL A THEORETICAL STUDIESTO DETERMINE BAND GAP OF 8-HYDROXYQUINOLINE
KAJIAN TEORITIS UNTUK MENENTUKAN CELAH ENERGI KOMPLEKS 8-HIDROKSIQUINOLIN TERKONJUGASI LOGAM BESI DENGAN MENGGUNAKAN TEORI KERAPATAN FUNGSIONAL A THEORETICAL STUDIESTO DETERMINE BAND GAP OF 8-HYDROXYQUINOLINE
KARAKTERISASI TEORITIS SEMIKONDUTOR SILICON NANOTUBE ARMCHAIR MENGGUNAKAN METODE DFT
 KARAKTERISASI TEORITIS SEMIKONDUTOR SILICON NANOTUBE ARMCHAIR MENGGUNAKAN METODE DFT (THEORETICAL CHARACTERIZATION OF ARMCHAIR SILICON NANOTUBE BASED DFT METHOD) Rieska Amilia* dan I Gusti Made Sanjaya
KARAKTERISASI TEORITIS SEMIKONDUTOR SILICON NANOTUBE ARMCHAIR MENGGUNAKAN METODE DFT (THEORETICAL CHARACTERIZATION OF ARMCHAIR SILICON NANOTUBE BASED DFT METHOD) Rieska Amilia* dan I Gusti Made Sanjaya
PENGARUH ENKAPSULASI Be TERHADAP KARAKTERISASI SILICON NANOTUBE ARMCHAIR
 PENGARUH ENKAPSULASI Be TERHADAP KARAKTERISASI SILICON NANOTUBE ARMCHAIR ENCAPSULATION EFFECT OF Be ON THE SILICON NANOTUBES ARMCHAIR CHARACTERIZATION Cindy Putri Arinta* dan I Gusti Made Sanjaya Department
PENGARUH ENKAPSULASI Be TERHADAP KARAKTERISASI SILICON NANOTUBE ARMCHAIR ENCAPSULATION EFFECT OF Be ON THE SILICON NANOTUBES ARMCHAIR CHARACTERIZATION Cindy Putri Arinta* dan I Gusti Made Sanjaya Department
PEMODELAN INTERAKSI ETER MAHKOTA BZ15C5 TERHADAP KATION Zn 2+ BERDASARKAN METODE DENSITY FUNCTIONAL THEORY
 SEMINAR NASIONAL PENDIDIKAN SAINS Strategi Pengembangan Pembelajaran dan Penelitian Sains untuk Mengasah Keterampilan Abad 21 (Creativity and Universitas Sebelas Maret Surakarta, 26 Oktober 2017 PEMODELAN
SEMINAR NASIONAL PENDIDIKAN SAINS Strategi Pengembangan Pembelajaran dan Penelitian Sains untuk Mengasah Keterampilan Abad 21 (Creativity and Universitas Sebelas Maret Surakarta, 26 Oktober 2017 PEMODELAN
Senyawa Koordinasi. Ion kompleks memiliki ciri khas yaitu bilangan koordinasi, geometri, dan donor atom:
 Senyawa Koordinasi Terdiri dari atom pusat (kation logam transisi), ligan(molekul yang terikat pada ion kompleks) dan di netralkan dengan bilangan koordinasi. Dari gambar [Co(NH 3 )6]CI 3, 6 molekul NH3
Senyawa Koordinasi Terdiri dari atom pusat (kation logam transisi), ligan(molekul yang terikat pada ion kompleks) dan di netralkan dengan bilangan koordinasi. Dari gambar [Co(NH 3 )6]CI 3, 6 molekul NH3
BAB I PENDAHULUAN. Gambar I.1 Struktur (a) porfirin dan (b) corrole (Jaung, 2005)
 BAB I PENDAHULUAN I.1 Latar Belakang Semikonduktor adalah salah satu material yang paling banyak dikaji dewasa ini karena banyaknya pemanfaatan yang bisa dilakukan dengan material ini mulai dari komponen
BAB I PENDAHULUAN I.1 Latar Belakang Semikonduktor adalah salah satu material yang paling banyak dikaji dewasa ini karena banyaknya pemanfaatan yang bisa dilakukan dengan material ini mulai dari komponen
Struktur atom merupakan satuan dasar materi yang terdiri dari inti atom beserta awan elektron bermuatan negatif yang mengelilinginya.
 Struktur atom merupakan satuan dasar materi yang terdiri dari inti atom beserta awan elektron bermuatan negatif yang mengelilinginya. Inti atom mengandung campuran proton (bermuatan positif) dan neutron
Struktur atom merupakan satuan dasar materi yang terdiri dari inti atom beserta awan elektron bermuatan negatif yang mengelilinginya. Inti atom mengandung campuran proton (bermuatan positif) dan neutron
STUDI KOMPUTASI SENYAWA BERBASIS ANISIL INDOL DENGAN SENYAWA AKSEPTOR ASAM SIANOAKRILIK SEBAGAI SENSITIZER SOLAR SEL ORGANIK
 STUDI KOMPUTASI SENYAWA BERBASIS ANISIL INDOL DENGAN SENYAWA AKSEPTOR ASAM SIANOAKRILIK SEBAGAI SENSITIZER SOLAR SEL ORGANIK SONI SETIADJI,* ATTHAR LUQMAN IVANSYAH, DAN ADI BUNGSU PRIBADI. Jurusan Kimia,
STUDI KOMPUTASI SENYAWA BERBASIS ANISIL INDOL DENGAN SENYAWA AKSEPTOR ASAM SIANOAKRILIK SEBAGAI SENSITIZER SOLAR SEL ORGANIK SONI SETIADJI,* ATTHAR LUQMAN IVANSYAH, DAN ADI BUNGSU PRIBADI. Jurusan Kimia,
BAB I PENDAHULUAN 1.1 Latar Belakang
 BAB I PENDAHULUAN 1.1 Latar Belakang Pemodelan molekul untuk mempelajari sifat-sifat fisik dan sifat-sifat kimia sistem molekul dengan perlakuan komputasi merupakan penelitian yang banyak diminati. Pemodelan
BAB I PENDAHULUAN 1.1 Latar Belakang Pemodelan molekul untuk mempelajari sifat-sifat fisik dan sifat-sifat kimia sistem molekul dengan perlakuan komputasi merupakan penelitian yang banyak diminati. Pemodelan
ANALISIS PEMBUATAN SEMIKONDUKTOR DARI KOMPLEKS LOGAM
 Bimafika, 2009, 1, 07-12 ANALISIS PEMBUATAN SEMIKONDUKTOR DARI KOMPLEKS LOGAM Gazali Rahman 1 I Wayan Sutapa 2 * 1 Jurusan FisikaFKIP, Universitas Pattimura-Ambon 2 Jurusan Kimia FMIPA, Universitas Pattimura-Ambon
Bimafika, 2009, 1, 07-12 ANALISIS PEMBUATAN SEMIKONDUKTOR DARI KOMPLEKS LOGAM Gazali Rahman 1 I Wayan Sutapa 2 * 1 Jurusan FisikaFKIP, Universitas Pattimura-Ambon 2 Jurusan Kimia FMIPA, Universitas Pattimura-Ambon
Mengenal Sifat Material. Teori Pita Energi
 Mengenal Sifat Material Teori Pita Energi Ulas Ulang Kuantisasi Energi Planck : energi photon (partikel) bilangan bulat frekuensi gelombang cahaya h = 6,63 10-34 joule-sec De Broglie : Elektron sbg gelombang
Mengenal Sifat Material Teori Pita Energi Ulas Ulang Kuantisasi Energi Planck : energi photon (partikel) bilangan bulat frekuensi gelombang cahaya h = 6,63 10-34 joule-sec De Broglie : Elektron sbg gelombang
Edisi Juli 2015 Volume IX No. 2 ISSN STUDI KOMPUTASI SENYAWA DOPAMIN DAN DOPAMIN-TI(OH) 2 UNTUK APLIKASI SEL SURYA TERSENSITASI ZAT WARNA
 STUDI KOMPUTASI SENYAWA DOPAMIN DAN DOPAMIN-TI(OH) 2 UNTUK APLIKASI SEL SURYA TERSENSITASI ZAT WARNA Soni Setiadji*, Atthar Luqman Ivansyah, Bio Insan Akbar Abstrak Penelitian ini memprediksi sifat elektronik
STUDI KOMPUTASI SENYAWA DOPAMIN DAN DOPAMIN-TI(OH) 2 UNTUK APLIKASI SEL SURYA TERSENSITASI ZAT WARNA Soni Setiadji*, Atthar Luqman Ivansyah, Bio Insan Akbar Abstrak Penelitian ini memprediksi sifat elektronik
BAB I PENDAHULUAN Latar Belakang
 BAB I PENDAHULUAN 1.1. Latar Belakang Logam-logam yang bernilai ekonomi sangat tinggi, diantaranya emas, perak, platina, dan paladium, dikenal sebagai logam-logam yang berharga. Platina sangat berguna
BAB I PENDAHULUAN 1.1. Latar Belakang Logam-logam yang bernilai ekonomi sangat tinggi, diantaranya emas, perak, platina, dan paladium, dikenal sebagai logam-logam yang berharga. Platina sangat berguna
SIMULASI EFEKTIVITAS SENYAWA OBAT ERITROMISIN F DAN 6,7 ANHIDROERITROMISIN F DALAM LAMBUNG MENGGUNAKAN METODE SEMIEMPIRIS AUSTIN MODEL 1 (AM1)
 SIMULASI EFEKTIVITAS SENYAWA OBAT ERITROMISIN F DAN 6,7 ANHIDROERITROMISIN F DALAM LAMBUNG MENGGUNAKAN METODE SEMIEMPIRIS AUSTIN MODEL 1 (AM1) Agung Tri Prasetya, M. Alauhdin, Nuni Widiarti Kimia FMIPA
SIMULASI EFEKTIVITAS SENYAWA OBAT ERITROMISIN F DAN 6,7 ANHIDROERITROMISIN F DALAM LAMBUNG MENGGUNAKAN METODE SEMIEMPIRIS AUSTIN MODEL 1 (AM1) Agung Tri Prasetya, M. Alauhdin, Nuni Widiarti Kimia FMIPA
UNESA Journal of Chemistry Vol. 1, No. 1, May 2012
 RASIONALISASI JALUR SINTESIS LAEVIFONOL DARI trans-resveratrol DENGAN MENGGUNAKAN TEORI FUNGSIONAL KERAPATAN (DFT) THE RATIONALIZATION OF SYNTHESIS PATHWAY LAEVIFONOL From Trans- REVERATROL WITH DENSITY
RASIONALISASI JALUR SINTESIS LAEVIFONOL DARI trans-resveratrol DENGAN MENGGUNAKAN TEORI FUNGSIONAL KERAPATAN (DFT) THE RATIONALIZATION OF SYNTHESIS PATHWAY LAEVIFONOL From Trans- REVERATROL WITH DENSITY
KIMIA. Sesi KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA. a. Sifat Umum
 KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 12 Sesi NGAN KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA Keteraturan sifat keperiodikan unsur dalam satu periode dapat diamati pada unsur-unsur periode
KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 12 Sesi NGAN KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA Keteraturan sifat keperiodikan unsur dalam satu periode dapat diamati pada unsur-unsur periode
MAKALAH PITA ENERGI. Di susun oleh, Pradita Ajeng Wiguna ( ) Rombel 1. Untuk Memenuhi Tugas Mata Kuliah Fisika dan Teknologi Semikonduktor
 MAKALAH PITA ENERGI Untuk Memenuhi Tugas Mata Kuliah Fisika dan Teknologi Semikonduktor Di susun oleh, Pradita Ajeng Wiguna (4211412011) Rombel 1 JURUSAN FISIKA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
MAKALAH PITA ENERGI Untuk Memenuhi Tugas Mata Kuliah Fisika dan Teknologi Semikonduktor Di susun oleh, Pradita Ajeng Wiguna (4211412011) Rombel 1 JURUSAN FISIKA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
Ikatan Kimia. 2 Klasifikasi Ikatan Kimia :
 Ikatan Kimia Ikatan Kimia : Gaya tarik yang menyebabkan atom-atom yang terikat satu sama lain dalam suatu kombinasi untuk membentuk senyawa yang lebih kompleks. 2 Klasifikasi Ikatan Kimia : 1. Ikatan ion
Ikatan Kimia Ikatan Kimia : Gaya tarik yang menyebabkan atom-atom yang terikat satu sama lain dalam suatu kombinasi untuk membentuk senyawa yang lebih kompleks. 2 Klasifikasi Ikatan Kimia : 1. Ikatan ion
#1 Material Organik Elektronika Organik Eka Maulana, ST., MT., MEng. Teknik Elektro Universitas Brawijaya
 #1 Material Organik Elektronika Organik Eka Maulana, ST., MT., MEng. Teknik Elektro Universitas Brawijaya Februari, 2015 Kerangka materi Tujuan: Memberikan pemahaman tentang karakteristik material dan
#1 Material Organik Elektronika Organik Eka Maulana, ST., MT., MEng. Teknik Elektro Universitas Brawijaya Februari, 2015 Kerangka materi Tujuan: Memberikan pemahaman tentang karakteristik material dan
TEORI ORBITAL MOLEKUL
 Tugas Kelompok Mata Kuliah Kimia Anorganik TEORI ORBITAL MOLEKUL KELOMPOK V B EZZAR FITRIYANI ANWAR SAID ST. HUMAERAH SYARIF 12B160 12B160 12B16037 PROGRAM PASCASARJANA JURUSAN KIMIA UNIVERSITAS NEGERI
Tugas Kelompok Mata Kuliah Kimia Anorganik TEORI ORBITAL MOLEKUL KELOMPOK V B EZZAR FITRIYANI ANWAR SAID ST. HUMAERAH SYARIF 12B160 12B160 12B16037 PROGRAM PASCASARJANA JURUSAN KIMIA UNIVERSITAS NEGERI
LAPORAN PRAKTIKUM KIMIA ANORGANIK
 LAPORAN PRAKTIKUM KIMIA ANORGANIK Nama : Idatul Fitriyah NIM : 4301412036 Jurusan : Kimia Prodi : Pendidikan Kimia Dosen : Ella Kusumastuti Kelompok : 7 Tgl Praktikum : 21 Maret 2014 Kawan Kerja : 1. Izza
LAPORAN PRAKTIKUM KIMIA ANORGANIK Nama : Idatul Fitriyah NIM : 4301412036 Jurusan : Kimia Prodi : Pendidikan Kimia Dosen : Ella Kusumastuti Kelompok : 7 Tgl Praktikum : 21 Maret 2014 Kawan Kerja : 1. Izza
STRUKTUR SOLVASI ION SKANDIUM(I) DALAM AMMONIA BERDASARKAN METODE MEKANIKA KUANTUM DAN MEKANIKA KLASIK
 STRUKTUR SOLVASI ION SKANDIUM(I) DALAM AMMONIA BERDASARKAN METODE MEKANIKA KUANTUM DAN MEKANIKA KLASIK Crys Fajar Partana [1] email : crsfajar@gmail.com [1] Jurusan Pendidikan Kimia FMIPA Universitas Negeri
STRUKTUR SOLVASI ION SKANDIUM(I) DALAM AMMONIA BERDASARKAN METODE MEKANIKA KUANTUM DAN MEKANIKA KLASIK Crys Fajar Partana [1] email : crsfajar@gmail.com [1] Jurusan Pendidikan Kimia FMIPA Universitas Negeri
STRUKTUR LEWIS DAN TEORI IKATAN VALENSI
 Ikatan Kimia STRUKTUR LEWIS DAN TEORI IKATAN VALENSI Disusun oleh : Kelompok 11 Penty Cahyani 4301411038 Diyah Ayu Lestari 4301411040 Ifan Shovi 4301411041 Rombel 2 UNIVERSITAS NEGERI SEMARANG 2013 A.
Ikatan Kimia STRUKTUR LEWIS DAN TEORI IKATAN VALENSI Disusun oleh : Kelompok 11 Penty Cahyani 4301411038 Diyah Ayu Lestari 4301411040 Ifan Shovi 4301411041 Rombel 2 UNIVERSITAS NEGERI SEMARANG 2013 A.
LAPORAN PRAKTIKUM KIMIA ANORGANIK II PERCOBAAN IV PENENTUAN KOMPOSISI ION KOMPLEKS
 LAPORAN PRAKTIKUM KIMIA ANORGANIK II PERCOBAAN IV PENENTUAN KOMPOSISI ION KOMPLEKS DISUSUN OLEH : NAMA : FEBRINA SULISTYORINI NIM : 09/281447/PA/12402 KELOMPOK : 3 (TIGA) JURUSAN : KIMIA FAKULTAS/PRODI
LAPORAN PRAKTIKUM KIMIA ANORGANIK II PERCOBAAN IV PENENTUAN KOMPOSISI ION KOMPLEKS DISUSUN OLEH : NAMA : FEBRINA SULISTYORINI NIM : 09/281447/PA/12402 KELOMPOK : 3 (TIGA) JURUSAN : KIMIA FAKULTAS/PRODI
Penyelesaian Tugas Kuliah Kimia Umum C (Soal bagi kelompok jadwal kuliah Kamis pagi pukul 08.00)
 Penyelesaian Tugas Kuliah Kimia Umum C (Soal bagi kelompok jadwal kuliah Kamis pagi pukul 08.00) Nama : Archemi Puspita Wijaya NIM : L2C007010 Alamat blog : archemipuspita.wordpress.com 1. Jari-jari ion
Penyelesaian Tugas Kuliah Kimia Umum C (Soal bagi kelompok jadwal kuliah Kamis pagi pukul 08.00) Nama : Archemi Puspita Wijaya NIM : L2C007010 Alamat blog : archemipuspita.wordpress.com 1. Jari-jari ion
Austrian-Indonesian i Centre (AIC) for Computational ti lchemistry, Jurusan Kimia i. KIMIA KOMPUTASI Konsep Perhitungan Mekanika Kuantum 2 (Basis Set)
 Austrian Indonesian Centre (AIC) for Computational Chemistry Jurusan Kimia - FMIPA Universitas Gadjah Mada (UGM) KIMIA KOMPUTASI Konsep Perhitungan Mekanika Kuantum 2 (Basis Set) Drs. Iqmal Tahir, M.Si.
Austrian Indonesian Centre (AIC) for Computational Chemistry Jurusan Kimia - FMIPA Universitas Gadjah Mada (UGM) KIMIA KOMPUTASI Konsep Perhitungan Mekanika Kuantum 2 (Basis Set) Drs. Iqmal Tahir, M.Si.
TEORI TOLAKAN PASANGAN ELEKTRON VALENSI
 MAKALAH PENGABDIAN PADA MASYARAKAT TEORI TOLAKAN PASANGAN ELEKTRON VALENSI Oleh : M. PRANJOTO UTOMO Makalah ini disampaikan pada kegiatan: Pembinaan Intensif bagi Calon Peserta Olimpiade Sains Nasional
MAKALAH PENGABDIAN PADA MASYARAKAT TEORI TOLAKAN PASANGAN ELEKTRON VALENSI Oleh : M. PRANJOTO UTOMO Makalah ini disampaikan pada kegiatan: Pembinaan Intensif bagi Calon Peserta Olimpiade Sains Nasional
KIMIA KOMPUTASI Pengantar Konsep Kimia i Komputasi
 Austrian Indonesian Centre (AIC) for Computational Chemistry Jurusan Kimia - FMIPA Universitas Gadjah Mada (UGM) KIMIA KOMPUTASI Pengantar Konsep Kimia i Komputasi Drs. Iqmal Tahir, M.Si. Austrian-Indonesian
Austrian Indonesian Centre (AIC) for Computational Chemistry Jurusan Kimia - FMIPA Universitas Gadjah Mada (UGM) KIMIA KOMPUTASI Pengantar Konsep Kimia i Komputasi Drs. Iqmal Tahir, M.Si. Austrian-Indonesian
KAJIAN PERUBAHAN UKURAN RONGGA ZEOLIT RHO BERDASARKAN VARIASI RASIO Si/Al DAN VARIASI KATION ALKALI MENGGUNAKAN METODE MEKANIKA MOLEKULER
 Jurnal Kimia Mulawarman Volume 14 Nomor 1 November 2016 P-ISSN 1693-5616 Kimia FMIPA Unmul E-ISSN 2476-9258 KAJIAN PERUBAHAN UKURAN RONGGA ZEOLIT RHO BERDASARKAN VARIASI RASIO Si/Al DAN VARIASI KATION
Jurnal Kimia Mulawarman Volume 14 Nomor 1 November 2016 P-ISSN 1693-5616 Kimia FMIPA Unmul E-ISSN 2476-9258 KAJIAN PERUBAHAN UKURAN RONGGA ZEOLIT RHO BERDASARKAN VARIASI RASIO Si/Al DAN VARIASI KATION
KERAMIK Mimin Sukarmin, S.Si., M.Pd.
 KERAMIK Mimin Sukarmin, S.Si., M.Pd. m.sukar1982xx@gmail.com A. Keramik Bahan keramik merupakan senyawa antara logam dan bukan logam. Senyawa ini mempunyai ikatan ionik dan atau ikatan kovalen. Jadi sifat-sifatnya
KERAMIK Mimin Sukarmin, S.Si., M.Pd. m.sukar1982xx@gmail.com A. Keramik Bahan keramik merupakan senyawa antara logam dan bukan logam. Senyawa ini mempunyai ikatan ionik dan atau ikatan kovalen. Jadi sifat-sifatnya
TERHADAP PERUBAHAN UKURAN WINDOW
 Maria Amelia Pengaruh Variasi PENGARUH VARIASI RASIO Si/Al STRUKTUR ZEOLIT A DAN VARIASI KATION (Li +, Na +, K + ) TERHADAP PERUAHAN UKURAN WINDOW ZEOLIT A MENGGUNAKAN METODE MEKANIKA MOLEKULER THE STUDY
Maria Amelia Pengaruh Variasi PENGARUH VARIASI RASIO Si/Al STRUKTUR ZEOLIT A DAN VARIASI KATION (Li +, Na +, K + ) TERHADAP PERUAHAN UKURAN WINDOW ZEOLIT A MENGGUNAKAN METODE MEKANIKA MOLEKULER THE STUDY
Indo. J. Chem. Sci. 2 (1) (2013) Indonesian Journal of Chemical Science
 Indo. J. Chem. Sci. 2 (1) (2013) Indonesian Journal of Chemical Science http://journal.unnes.ac.id/sju/index.php/ijcs PENGARUH ENKAPSULASI Cu DAN Fe TERHADAP BAND GAP SILIKON NANOTUBE (10,0) MENGGUNAKAN
Indo. J. Chem. Sci. 2 (1) (2013) Indonesian Journal of Chemical Science http://journal.unnes.ac.id/sju/index.php/ijcs PENGARUH ENKAPSULASI Cu DAN Fe TERHADAP BAND GAP SILIKON NANOTUBE (10,0) MENGGUNAKAN
Komponen Materi. Kimia Dasar 1 Sukisman Purtadi
 Komponen Materi Kimia Dasar 1 Sukisman Purtadi Pengamatan ke Arah Pandangan Atomik Materi Konservasi Massa Komposisi Tetap Perbandingan Berganda Teori Atom Dalton Bagaimana Teori Dalton Menjelaskan Hukum
Komponen Materi Kimia Dasar 1 Sukisman Purtadi Pengamatan ke Arah Pandangan Atomik Materi Konservasi Massa Komposisi Tetap Perbandingan Berganda Teori Atom Dalton Bagaimana Teori Dalton Menjelaskan Hukum
Ikatan Kimia dan Struktur Molekul. Sulistyani, M.Si.
 Ikatan Kimia dan Struktur Molekul Sulistyani, M.Si. Email: sulistyani@uny.ac.id Pendahuluan Adalah ikatan yang terjadi antar atom atau antar molekul dengan cara sebagai berikut : - atom yang 1 melepaskan
Ikatan Kimia dan Struktur Molekul Sulistyani, M.Si. Email: sulistyani@uny.ac.id Pendahuluan Adalah ikatan yang terjadi antar atom atau antar molekul dengan cara sebagai berikut : - atom yang 1 melepaskan
IKATAN KIMIA Isana SYL
 IKATAN KIMIA Isana SYL IKATAN KIMIA Kebahagiaan atom Konfigurasi i elektronik stabil Konfigurasi elektronik gas mulia / gas lamban (Energi ionisasi relatif besar dan afinitas elektron relatif kecil) Ada
IKATAN KIMIA Isana SYL IKATAN KIMIA Kebahagiaan atom Konfigurasi i elektronik stabil Konfigurasi elektronik gas mulia / gas lamban (Energi ionisasi relatif besar dan afinitas elektron relatif kecil) Ada
MATERI II TINGKAT TENAGA DAN PITA TENAGA
 MATERI II TINGKAT TENAGA DAN PITA TENAGA A. Tujuan 1. Tujuan Umum Mahasiswa memahami konsep tingkat tenaga dan pita tenaga untuk menerangkan perbedaan daya hantar listrik.. Tujuan Khusus a. Mahasiswa dapat
MATERI II TINGKAT TENAGA DAN PITA TENAGA A. Tujuan 1. Tujuan Umum Mahasiswa memahami konsep tingkat tenaga dan pita tenaga untuk menerangkan perbedaan daya hantar listrik.. Tujuan Khusus a. Mahasiswa dapat
BAB FISIKA ATOM. Model ini gagal karena tidak sesuai dengan hasil percobaan hamburan patikel oleh Rutherford.
 1 BAB FISIKA ATOM Perkembangan teori atom Model Atom Dalton 1. Atom adalah bagian terkecil dari suatu unsur yang tidak dapat dibagi-bagi 2. Atom-atom suatu unsur semuanya serupa dan tidak dapat berubah
1 BAB FISIKA ATOM Perkembangan teori atom Model Atom Dalton 1. Atom adalah bagian terkecil dari suatu unsur yang tidak dapat dibagi-bagi 2. Atom-atom suatu unsur semuanya serupa dan tidak dapat berubah
Kimia Koordinasi Teori Ikatan Valensi
 Kimia Koordinasi Teori Ikatan Valensi Beberapa teori telah dirumuskan untuk menjelaskan ikatan dalam senyawaan koordinasi dan untuk merasionalisasi serta meramalkan sifat-sifatnya: teori ikatan valensi,
Kimia Koordinasi Teori Ikatan Valensi Beberapa teori telah dirumuskan untuk menjelaskan ikatan dalam senyawaan koordinasi dan untuk merasionalisasi serta meramalkan sifat-sifatnya: teori ikatan valensi,
MOLEKUL, ZAT PADAT DAN PITA ENERGI MOLEKUL ZAT PADAT PITA ENERGI
 MOLEKUL, ZAT PADAT DAN PITA ENERGI MOLEKUL ZAT PADAT PITA ENERGI edy wiyono 2004 PENDAHULUAN Pada umumnya atom tunggal tidak memiliki konfigurasi elektron yang stabil seperti gas mulia, maka atom atom
MOLEKUL, ZAT PADAT DAN PITA ENERGI MOLEKUL ZAT PADAT PITA ENERGI edy wiyono 2004 PENDAHULUAN Pada umumnya atom tunggal tidak memiliki konfigurasi elektron yang stabil seperti gas mulia, maka atom atom
Info Artikel. Indonesian Journal of Chemical Science
 Indo. J. Chem. Sci. 2 (1) (2013) Indonesian Journal of Chemical Science http://journal.unnes.ac.id/sju/index.php/ijcs PENGARUH ENKAPSULASI LOGAM TERHADAP NILAI CELAH PITA BORON NITRIDE NANOTUBES (4,4)
Indo. J. Chem. Sci. 2 (1) (2013) Indonesian Journal of Chemical Science http://journal.unnes.ac.id/sju/index.php/ijcs PENGARUH ENKAPSULASI LOGAM TERHADAP NILAI CELAH PITA BORON NITRIDE NANOTUBES (4,4)
Dr. Sci. Muhammad Zakir Laboratorium Kimia Fisika, Jurusan Kimia, FMIPA, Unhas Makassar
 Perhitungan Orbital Molekul Dr. Sci. Muhammad Zakir Laboratorium Kimia Fisika, Jurusan Kimia, FMIPA, Unhas Makassar Maksud percobaan 1. Mempelajari aplikasi software Hyperchem. Mempelajari cara menghitung
Perhitungan Orbital Molekul Dr. Sci. Muhammad Zakir Laboratorium Kimia Fisika, Jurusan Kimia, FMIPA, Unhas Makassar Maksud percobaan 1. Mempelajari aplikasi software Hyperchem. Mempelajari cara menghitung
BAB I PENDAHULUAN. 1.1 Latar Belakang Masalah
 BAB I PENDAHULUAN 1.1 Latar Belakang Masalah Intan adalah salah satu jenis perhiasan yang harganya relatif mahal. Intan merupakan kristal yang tersusun atas unsur karbon (C). Intan berdasarkan proses pembentukannya
BAB I PENDAHULUAN 1.1 Latar Belakang Masalah Intan adalah salah satu jenis perhiasan yang harganya relatif mahal. Intan merupakan kristal yang tersusun atas unsur karbon (C). Intan berdasarkan proses pembentukannya
Jilid 1. Penulis : Citra Deliana D.S, M.Si. Copyright 2013 pelatihan-osn.com. Cetakan I : Oktober Diterbitkan oleh : Pelatihan-osn.
 Jilid 1 Penulis : Citra Deliana D.S, M.Si. Copyright 2013 pelatihan-osn.com Cetakan I : Oktober 2012 Diterbitkan oleh : Pelatihan-osn.com Kompleks Sawangan Permai Blok A5 No.12 A Sawangan, Depok, Jawa
Jilid 1 Penulis : Citra Deliana D.S, M.Si. Copyright 2013 pelatihan-osn.com Cetakan I : Oktober 2012 Diterbitkan oleh : Pelatihan-osn.com Kompleks Sawangan Permai Blok A5 No.12 A Sawangan, Depok, Jawa
BENDA WUJUD, SIFAT DAN KEGUNAANNYA
 BENDA WUJUD, SIFAT DAN KEGUNAANNYA Benda = Materi = bahan Wujud benda : 1) Padat 2) Cair 3) Gas Benda Padat 1. Mekanis kuat (tegar), sukar berubah bentuk, keras 2. Titik leleh tinggi 3. Sebagian konduktor
BENDA WUJUD, SIFAT DAN KEGUNAANNYA Benda = Materi = bahan Wujud benda : 1) Padat 2) Cair 3) Gas Benda Padat 1. Mekanis kuat (tegar), sukar berubah bentuk, keras 2. Titik leleh tinggi 3. Sebagian konduktor
! " "! # $ % & ' % &
 Valensi ! " "! # $ % & ' %& # % ( ) # *+## )$,) & -#.. Semua unsur memiliki bilangan oksidasi +1 Semua unsur memiliki bilangan oksidasi +2 Semua unsur memiliki bilangan oksidasi +3. Tl juga memiliki bilangan
Valensi ! " "! # $ % & ' %& # % ( ) # *+## )$,) & -#.. Semua unsur memiliki bilangan oksidasi +1 Semua unsur memiliki bilangan oksidasi +2 Semua unsur memiliki bilangan oksidasi +3. Tl juga memiliki bilangan
PENENTUAN RUMUS ION KOMPLEKS BESI DENGAN ASAM SALISILAT
 PENENTUAN RUMUS ION KOMPLEKS BESI DENGAN ASAM SALISILAT Desi Eka Martuti, Suci Amalsari, Siti Nurul Handini., Nurul Aini Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Jenderal
PENENTUAN RUMUS ION KOMPLEKS BESI DENGAN ASAM SALISILAT Desi Eka Martuti, Suci Amalsari, Siti Nurul Handini., Nurul Aini Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Jenderal
SENYAWA KOMPLEKS. Definisi. Ion Kompleks. Bilangan koordinasi, geometri, dan ligan RINGKASAN MATERI
 KIMIA ANORGANIK 14 OKTOBER 2012 RINGKASAN MATERI SENYAWA KOMPLEKS Definisi Senyawa kompleks itu: Ada ion logam sebagai atom pusat Ada ligan yang berupa anion atau molekul netral Memiliki counter ion supaya
KIMIA ANORGANIK 14 OKTOBER 2012 RINGKASAN MATERI SENYAWA KOMPLEKS Definisi Senyawa kompleks itu: Ada ion logam sebagai atom pusat Ada ligan yang berupa anion atau molekul netral Memiliki counter ion supaya
E 2 E 1. E 3s r 2 r 1. energi. Jarak antar atom
 Teori Pita Zat Padat Atom Na : Nomor atomnya 11, punya 1 elektron valensi, menempati kulit 3s (energinya E 3s ) Saat 2 atom Na didekatkan (Na A dan Na B), elektron valensi A akan berinteraksi dengan elektron
Teori Pita Zat Padat Atom Na : Nomor atomnya 11, punya 1 elektron valensi, menempati kulit 3s (energinya E 3s ) Saat 2 atom Na didekatkan (Na A dan Na B), elektron valensi A akan berinteraksi dengan elektron
REAKSI Cr, Cr 2, Mn, Mn 2, Fe, DAN Fe 2 DENGAN F 2, H 2, N 2, DAN O 2 : KAJIAN TEORI FUNGSIONAL KERAPATAN
 REAKSI Cr, Cr 2, Mn, Mn 2, Fe, DAN Fe 2 DENGAN F 2, H 2, N 2, DAN O 2 : KAJIAN TEORI FUNGSIONAL KERAPATAN SKRIPSI BERLIN WIJAYA 10500017 PROGRAM STUDI KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
REAKSI Cr, Cr 2, Mn, Mn 2, Fe, DAN Fe 2 DENGAN F 2, H 2, N 2, DAN O 2 : KAJIAN TEORI FUNGSIONAL KERAPATAN SKRIPSI BERLIN WIJAYA 10500017 PROGRAM STUDI KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
Struktur Molekul:Teori Orbital Molekul
 Kimia Fisik III, Struktur Molekul:, Dr. Parsaoran Siahaan, November/Desember 2014, 1 Pokok Bahasan 3 Struktur Molekul:Teori Orbital Molekul Oleh: Dr. Parsaoran Siahaan Pendahuluan: motivasi/review pokok
Kimia Fisik III, Struktur Molekul:, Dr. Parsaoran Siahaan, November/Desember 2014, 1 Pokok Bahasan 3 Struktur Molekul:Teori Orbital Molekul Oleh: Dr. Parsaoran Siahaan Pendahuluan: motivasi/review pokok
BAB I PENDAHULUAN 1.1 Latar Belakang Masalah
 BAB I PENDAHULUAN 1.1 Latar Belakang Masalah Graphene merupakan susunan atom-atom karbon monolayer dua dimensi yang membentuk struktur kristal heksagonal menyerupai sarang lebah. Graphene memiliki sifat
BAB I PENDAHULUAN 1.1 Latar Belakang Masalah Graphene merupakan susunan atom-atom karbon monolayer dua dimensi yang membentuk struktur kristal heksagonal menyerupai sarang lebah. Graphene memiliki sifat
Dr. rer. Nat. Agustino Zulys M.Sc.
 Pendahuluan Teori Ikatan Mata Kuliah Ikatan Kimia Dr. rer. Nat. Agustino Zulys M.Sc. 1 6/12/2009 Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Indonesia Ikatan Kimia Dosen
Pendahuluan Teori Ikatan Mata Kuliah Ikatan Kimia Dr. rer. Nat. Agustino Zulys M.Sc. 1 6/12/2009 Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Indonesia Ikatan Kimia Dosen
ENERGI TOTAL KEADAAN EKSITASI ATOM LITIUM DENGAN METODE VARIASI
 Jurnal Ilmu dan Inovasi Fisika Vol 01, No 01 (2017) 6 10 Departemen Fisika FMIPA Universitas Padjadjaran ENERGI TOTAL KEADAAN EKSITASI ATOM LITIUM DENGAN METODE VARIASI LIU KIN MEN* DAN SETIANTO Departemen
Jurnal Ilmu dan Inovasi Fisika Vol 01, No 01 (2017) 6 10 Departemen Fisika FMIPA Universitas Padjadjaran ENERGI TOTAL KEADAAN EKSITASI ATOM LITIUM DENGAN METODE VARIASI LIU KIN MEN* DAN SETIANTO Departemen
BAB I PENDAHULUAN 1.1 Latar Belakang dan Permasalahan
 1 BAB I PENDAHULUAN 1.1 Latar Belakang dan Permasalahan Berdasarkan penelitian terdahulu, diketahui bahwa logam memegang peranan penting dalam proses metabolisme dalam tubuh makhluk hidup (Siu dkk., 2002),
1 BAB I PENDAHULUAN 1.1 Latar Belakang dan Permasalahan Berdasarkan penelitian terdahulu, diketahui bahwa logam memegang peranan penting dalam proses metabolisme dalam tubuh makhluk hidup (Siu dkk., 2002),
IKATAN KIMIA MAKALAH KIMIA DASAR
 IKATAN KIMIA MAKALAH KIMIA DASAR dibuat sebagai salah satu syarat untuk memperoleh nilai mata kuliah kimia dasar Oleh : AZKA WAFI EL HAKIM ( NPM : 301014000 ) HELGA RACHEL F ( NPM : 3010140014 ) MUHAMMAD
IKATAN KIMIA MAKALAH KIMIA DASAR dibuat sebagai salah satu syarat untuk memperoleh nilai mata kuliah kimia dasar Oleh : AZKA WAFI EL HAKIM ( NPM : 301014000 ) HELGA RACHEL F ( NPM : 3010140014 ) MUHAMMAD
PAH akan mengalami degradasi saat terkena suhu tinggi pada analisis dengan GC dan instrumen GC sulit digunakan untuk memisahkan PAH yang berbentuk
 BAB I PENDAHULUAN I.I Latar Belakang Poliaromatik hidrokarbon (PAH) adalah golongan senyawa organik yang terdiri atas dua atau lebih molekul cincin aromatik yang disusun dari atom karbon dan hidrogen.
BAB I PENDAHULUAN I.I Latar Belakang Poliaromatik hidrokarbon (PAH) adalah golongan senyawa organik yang terdiri atas dua atau lebih molekul cincin aromatik yang disusun dari atom karbon dan hidrogen.
#2 Steady-State Fotokonduktif Elektronika Organik Eka Maulana, ST., MT., MEng. Teknik Elektro Universitas Brawijaya
 #2 Steady-State Fotokonduktif Elektronika Organik Eka Maulana, ST., MT., MEng. Teknik Elektro Universitas Brawijaya 2015 Kerangka materi Tujuan: Memberikan pemahaman tentang mekanisme efek fotokonduktif
#2 Steady-State Fotokonduktif Elektronika Organik Eka Maulana, ST., MT., MEng. Teknik Elektro Universitas Brawijaya 2015 Kerangka materi Tujuan: Memberikan pemahaman tentang mekanisme efek fotokonduktif
PENENTUAN PANJANG GELOMBANG EMISI PADA NANOPARTIKEL CdS DAN ZnS BERDASARKAN VARIASI KONSENTRASI MERCAPTO ETHANOL
 PENENTUAN PANJANG GELOMBANG EMISI PADA NANOPARTIKEL CdS DAN ZnS BERDASARKAN VARIASI KONSENTRASI MERCAPTO ETHANOL Muhammad Salahuddin 1, Suryajaya 2, Edy Giri R. Putra 3, Nurma Sari 2 Abstrak:Pada penelitian
PENENTUAN PANJANG GELOMBANG EMISI PADA NANOPARTIKEL CdS DAN ZnS BERDASARKAN VARIASI KONSENTRASI MERCAPTO ETHANOL Muhammad Salahuddin 1, Suryajaya 2, Edy Giri R. Putra 3, Nurma Sari 2 Abstrak:Pada penelitian
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB I STRUKTUR ATOM
 BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB I 1. Suatu partikel X memiliki 16 proton, 16 neutron, dan 18 elektron. Partikel tersebut dapat dikategorikan sebagai A. Anion X bermuatan -1
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB I 1. Suatu partikel X memiliki 16 proton, 16 neutron, dan 18 elektron. Partikel tersebut dapat dikategorikan sebagai A. Anion X bermuatan -1
Struktur Atom. Struktur atom merupakan satuan dasar materi yang terdiri dari inti atom beserta awan elektron bermuatan negatif yang
 Struktur atom merupakan satuan dasar materi yang terdiri dari inti atom beserta awan elektron bermuatan negatif yang mengelilinginya. Inti atom mengandung campuran proton (bermuatan positif) dan neutron
Struktur atom merupakan satuan dasar materi yang terdiri dari inti atom beserta awan elektron bermuatan negatif yang mengelilinginya. Inti atom mengandung campuran proton (bermuatan positif) dan neutron
kimia KONFIGURASI ELEKTRON
 K-13 Kelas X kimia KONFIGURASI ELEKTRON Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konfigurasi elektron kulit dan subkulit. 2. Menyelesaikan
K-13 Kelas X kimia KONFIGURASI ELEKTRON Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konfigurasi elektron kulit dan subkulit. 2. Menyelesaikan
1.1 Senyawa Koordinasi (Coordination Coumpond)
 1.1 Senyawa Koordinasi (Coordination Coumpond) Sifat yang paling khas pada logam transisi adalah tentang persenyawaan dan ikatannya. Yang biasa disebut dengan ion kompleks. Ion kompleks sendiri terdiri
1.1 Senyawa Koordinasi (Coordination Coumpond) Sifat yang paling khas pada logam transisi adalah tentang persenyawaan dan ikatannya. Yang biasa disebut dengan ion kompleks. Ion kompleks sendiri terdiri
SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016)
 SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016) Bagian I: Pilihan Ganda 1) Suatu atom yang mempunyai energi ionisasi pertama bernilai besar, memiliki sifat/kecenderungan : A. Afinitas elektron rendah
SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016) Bagian I: Pilihan Ganda 1) Suatu atom yang mempunyai energi ionisasi pertama bernilai besar, memiliki sifat/kecenderungan : A. Afinitas elektron rendah
IKATAN KIMIA DALAM BAHAN
 IKATAN KIMIA DALAM BAHAN Sifat Atom dan Ikatan Kimia Suatu partikel baik berupa ion bermuatan, inti atom dan elektron, dimana diantara mereka, akan membentuk ikatan kimia yang akan menurunkan energi potensial
IKATAN KIMIA DALAM BAHAN Sifat Atom dan Ikatan Kimia Suatu partikel baik berupa ion bermuatan, inti atom dan elektron, dimana diantara mereka, akan membentuk ikatan kimia yang akan menurunkan energi potensial
Alur/flowchart perhitungan kimia komputasi
 Austrian Indonesian Centre (AIC) for Computational Chemistry Jurusan Kimia - FMIPA Universitas Gadjah Mada (UGM) KIMIA KOMPUTASI Proses Optimisasi i i Geometri Drs. Iqmal Tahir, M.Si. Austrian-Indonesian
Austrian Indonesian Centre (AIC) for Computational Chemistry Jurusan Kimia - FMIPA Universitas Gadjah Mada (UGM) KIMIA KOMPUTASI Proses Optimisasi i i Geometri Drs. Iqmal Tahir, M.Si. Austrian-Indonesian
KIMIA. Sesi POLIMER. A. LOGAM ALKALI a. Keberadaan dan Kelimpahan Logam Alkali. b. Sifat-Sifat Umum Logam Alkali. c. Sifat Keperiodikan Logam Alkali
 KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 11 Sesi NGAN POLIMER A. LOGAM ALKALI a. Keberadaan dan Kelimpahan Logam Alkali Logam alkali adalah kelompok unsur yang sangat reaktif dengan bilangan oksidasi +1,
KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 11 Sesi NGAN POLIMER A. LOGAM ALKALI a. Keberadaan dan Kelimpahan Logam Alkali Logam alkali adalah kelompok unsur yang sangat reaktif dengan bilangan oksidasi +1,
SEMIKONDUKTOR oleh: Ichwan Yelfianhar dirangkum dari berbagai sumber
 SEMIKONDUKTOR oleh: Ichwan Yelfianhar dirangkum dari berbagai sumber Pengertian Umum Bahan semikonduktor adalah bahan yang bersifat setengah konduktor karena celah energi yang dibentuk oleh struktur bahan
SEMIKONDUKTOR oleh: Ichwan Yelfianhar dirangkum dari berbagai sumber Pengertian Umum Bahan semikonduktor adalah bahan yang bersifat setengah konduktor karena celah energi yang dibentuk oleh struktur bahan
Kimia Organik 1. Pertemuan ke 2 Indah Solihah
 Kimia Organik 1 Pertemuan ke 2 Indah Solihah TEORI VALENCE SHELL ELECTRON REPULSION (VSEPR) (TEORI TOLAKAN PASANGAN ELEKTRON BEBAS) Pasangan elektron valensi mempunyai gaya tolak menolak Pasangan elektron
Kimia Organik 1 Pertemuan ke 2 Indah Solihah TEORI VALENCE SHELL ELECTRON REPULSION (VSEPR) (TEORI TOLAKAN PASANGAN ELEKTRON BEBAS) Pasangan elektron valensi mempunyai gaya tolak menolak Pasangan elektron
BAB 4 HASIL PERCOBAAN DAN PEMBAHASAN
 BAB 4 HASIL PERCOBAAN DAN PEMBAHASAN Falerin (4,5-dihidroksi-5 -metoksibenzofenon-3-o-glukosida) adalah isolat dari buah mahkota dewa berkerangka benzofenon yang mempunyai aktivitas antiinflamasi. Penelitian
BAB 4 HASIL PERCOBAAN DAN PEMBAHASAN Falerin (4,5-dihidroksi-5 -metoksibenzofenon-3-o-glukosida) adalah isolat dari buah mahkota dewa berkerangka benzofenon yang mempunyai aktivitas antiinflamasi. Penelitian
FAKULTAS TEKNIK UNIVERSITAS NEGERI YOGYAKARTA BAHAN AJAR KIMIA DASAR BAB VI IKATAN KIMIA
 No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 7 BAB VI IKATAN KIMIA Sebagian besar partikel materi adalah berupa molekul atau ion. Hanya beberapa partikel materi saja yang berupa atom. 1)
No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 7 BAB VI IKATAN KIMIA Sebagian besar partikel materi adalah berupa molekul atau ion. Hanya beberapa partikel materi saja yang berupa atom. 1)
ATOM BERELEKTRON BANYAK
 ATOM BERELEKTRON BANYAK A. MODEL ATOM BOHR * Keunggulan Dapat menjelaskan adanya : 1. Kestabilan atom. Spektrum garis pada atom hidrogen (deret Lyman, Balmer, Paschen, Brackett, Pfund) * Kelemahan Tidak
ATOM BERELEKTRON BANYAK A. MODEL ATOM BOHR * Keunggulan Dapat menjelaskan adanya : 1. Kestabilan atom. Spektrum garis pada atom hidrogen (deret Lyman, Balmer, Paschen, Brackett, Pfund) * Kelemahan Tidak
BAB I PENDAHULUAN 1.1 Latar Belakang Penelitian
 1 BAB I PENDAHULUAN 1.1 Latar Belakang Penelitian Beberapa bahan penting dalam peralatan elektronik adalah semikonduktor. Kegunaan semikonduktor dalam bidang elektronik antara lain adalah sebagai transistor,
1 BAB I PENDAHULUAN 1.1 Latar Belakang Penelitian Beberapa bahan penting dalam peralatan elektronik adalah semikonduktor. Kegunaan semikonduktor dalam bidang elektronik antara lain adalah sebagai transistor,
IKATAN KIMIA. RATNAWATI, S.Pd
 IKATAN KIMIA RATNAWATI, S.Pd Tujuan Pembelajaran Setelah mempelajari materi ini, diharapkan siswa dapat: Menjelaskan kecenderungan suatu unsur untuk mencapai kestabilannya Menggambarkan susunan elektron
IKATAN KIMIA RATNAWATI, S.Pd Tujuan Pembelajaran Setelah mempelajari materi ini, diharapkan siswa dapat: Menjelaskan kecenderungan suatu unsur untuk mencapai kestabilannya Menggambarkan susunan elektron
Yang akan dibahas: 1. Kristal dan Ikatan pada zat Padat 2. Teori Pita Zat Padat
 ZAT PADAT Yang akan dibahas: 1. Kristal dan Ikatan pada zat Padat 2. Teori Pita Zat Padat ZAT PADAT Sifat sifat zat padat bergantung pada: Jenis atom penyusunnya Struktur materialnya Berdasarkan struktur
ZAT PADAT Yang akan dibahas: 1. Kristal dan Ikatan pada zat Padat 2. Teori Pita Zat Padat ZAT PADAT Sifat sifat zat padat bergantung pada: Jenis atom penyusunnya Struktur materialnya Berdasarkan struktur
No. Dokumen : FTK-FR-AKD-001 FAKULTAS TARBIYAH DAN KEGURUAN Tgl. Terbit : 01 Februari SUNAN GUNUNG DJATI BANDUNG Hal : 1/2 SILABUS
 KEMENTERIAN AGAMA No. Dokumen : FTK-FR-AKD-001 FAKULTAS TARBIYAH DAN KEGURUAN Tgl. Terbit : 01 Februari 2013 UNIVERSITAS ISLAM NEGERI FORM (FR) No. Revisi: : 00 SUNAN GUNUNG DJATI BANDUNG Hal : 1/2 SILABUS
KEMENTERIAN AGAMA No. Dokumen : FTK-FR-AKD-001 FAKULTAS TARBIYAH DAN KEGURUAN Tgl. Terbit : 01 Februari 2013 UNIVERSITAS ISLAM NEGERI FORM (FR) No. Revisi: : 00 SUNAN GUNUNG DJATI BANDUNG Hal : 1/2 SILABUS
TUJUAN INSTRUKSIONAL KHUSUS
 ISI BAB I 1. Pendahuluan 2. Struktur Atom 3. Elektronegativitas 4. Ikatan Ionik 5. Ikatan Kovalen 6. Struktur Lewis 7. Polaritas Ikatan 8. Sifat-Sifat Senyawa Kovalen TUJUAN INSTRUKSIONAL KHUSUS Setelah
ISI BAB I 1. Pendahuluan 2. Struktur Atom 3. Elektronegativitas 4. Ikatan Ionik 5. Ikatan Kovalen 6. Struktur Lewis 7. Polaritas Ikatan 8. Sifat-Sifat Senyawa Kovalen TUJUAN INSTRUKSIONAL KHUSUS Setelah
REAKSI DEKOMPOSISI SENYAWA ERITROMISIN F DAN 6,7 ANHIDROERITROMISIN F SUATU KAJIAN MENGGUNAKAN METODE SEMIEMPIRIS AUSTIN MODEL 1 (AM1) ABSTRAK
 1 REAKSI DEKMPSISI SENYAWA ERITRMISIN F DAN 6,7 ANHIDRERITRMISIN F SUATU KAJIAN MENGGUNAKAN METDE SEMIEMPIRIS AUSTIN MDEL 1 (AM1) Enokta Hedi Permana 1, Agung Tri Prasetya 2, Kasmui 3 1) Mahasiawa Jurusan
1 REAKSI DEKMPSISI SENYAWA ERITRMISIN F DAN 6,7 ANHIDRERITRMISIN F SUATU KAJIAN MENGGUNAKAN METDE SEMIEMPIRIS AUSTIN MDEL 1 (AM1) Enokta Hedi Permana 1, Agung Tri Prasetya 2, Kasmui 3 1) Mahasiawa Jurusan
Kimia Organik I. Pertemuan ke 1 Indah Solihah
 Kimia Organik I Pertemuan ke 1 Indah Solihah Some organic chemicals DNA Medicines Active Pharmaceutical Ingredients Excipients Fuels Materials Essential oils Pigments Farmakodinamik Farmakokinetik Kimia
Kimia Organik I Pertemuan ke 1 Indah Solihah Some organic chemicals DNA Medicines Active Pharmaceutical Ingredients Excipients Fuels Materials Essential oils Pigments Farmakodinamik Farmakokinetik Kimia
LATIHAN SOAL IKATAN KIMIA
 LATIHAN SAL IKATAN KIMIA 1. Cara untuk mendapatkan kestabilan atom unsur yang bernomor atom 8 adalah dengan a. Melepaskan enam elektron muatan +6 b. Mengikat dua elektron dari atom lain menjadi ion dengan
LATIHAN SAL IKATAN KIMIA 1. Cara untuk mendapatkan kestabilan atom unsur yang bernomor atom 8 adalah dengan a. Melepaskan enam elektron muatan +6 b. Mengikat dua elektron dari atom lain menjadi ion dengan
LAMPIRAN C CCT pada Materi Ikatan Ion
 LAMPIRAN C CCT pada Materi Ikatan Ion 1 IKATAN ION A. KECENDERUNGAN ATOM UNTUK STABIL Gas mulia merupakan sebutan untuk unsur golongan VIIIA. Unsur unsur ini bersifat inert (stabil). Hal ini dikarenakan
LAMPIRAN C CCT pada Materi Ikatan Ion 1 IKATAN ION A. KECENDERUNGAN ATOM UNTUK STABIL Gas mulia merupakan sebutan untuk unsur golongan VIIIA. Unsur unsur ini bersifat inert (stabil). Hal ini dikarenakan
TUGAS KIMIA UMUM C (kelompok jadual kuliah Kamis Pagi jam 08.00)
 TUGAS KIMIA UMUM C (kelompok jadual kuliah Kamis Pagi jam 08.00) 1. The radii of the sodium and potassium ions are 102 pm and 138 pm, respectively. Which compound has stronger ionic attractions, sodium
TUGAS KIMIA UMUM C (kelompok jadual kuliah Kamis Pagi jam 08.00) 1. The radii of the sodium and potassium ions are 102 pm and 138 pm, respectively. Which compound has stronger ionic attractions, sodium
TEORI ATOM. Ramadoni Syahputra
 TEORI ATOM Ramadoni Syahputra STRUKTUR ATOM Teori tentang atom pertama kali dikemukakan oleh filsafat Yunani yaitu Leoclipus dan Democritus, pada abad ke-5 sebelum Masehi. Atom berasal dari kata Yunani:
TEORI ATOM Ramadoni Syahputra STRUKTUR ATOM Teori tentang atom pertama kali dikemukakan oleh filsafat Yunani yaitu Leoclipus dan Democritus, pada abad ke-5 sebelum Masehi. Atom berasal dari kata Yunani:
Studi Adsorpsi Molekul Nh 3 Pada Permukaan Cr(111) Menggunakan Program Calzaferri
 Jurnal Gradien Vol.3 No.1 Januari 2007 : 210-214 Studi Adsorpsi Molekul Nh 3 Pada Permukaan Cr(111) Menggunakan Program Calzaferri Charles Banon Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan
Jurnal Gradien Vol.3 No.1 Januari 2007 : 210-214 Studi Adsorpsi Molekul Nh 3 Pada Permukaan Cr(111) Menggunakan Program Calzaferri Charles Banon Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan
Rangkuman Kimia Anorganik Materi Struktur Lewis dan Bentuk Molekul
 Rangkuman Kimia Anorganik Materi Struktur Lewis dan Bentuk Molekul BAB 10 Nama :Rizky Ardias D NIM :21030112140170 Kelas :B Struktur Lewis dan Bentuk Molekul Pertama-tama kita melihat bagaimana untuk mengubah
Rangkuman Kimia Anorganik Materi Struktur Lewis dan Bentuk Molekul BAB 10 Nama :Rizky Ardias D NIM :21030112140170 Kelas :B Struktur Lewis dan Bentuk Molekul Pertama-tama kita melihat bagaimana untuk mengubah
A. KESTABILAN ATOM B. STRUKTUR LEWIS C. IKATAN ION D. IKATAN KOVALEN E. IKATAN KOVALEN POLAR DAN NONPOLAR F. KATAN KOVALEN KOORDINASI G
 2 IKATAN KIMIA A. KESTABILAN ATM B. STRUKTUR LEWIS C. IKATAN IN D. IKATAN KVALEN E. IKATAN KVALEN PLAR DAN NNPLAR F. KATAN KVALEN KRDINASI G. IKATAN LGAM. IKATAN CAMPURAN Nitrogen dan oksigen merupakan
2 IKATAN KIMIA A. KESTABILAN ATM B. STRUKTUR LEWIS C. IKATAN IN D. IKATAN KVALEN E. IKATAN KVALEN PLAR DAN NNPLAR F. KATAN KVALEN KRDINASI G. IKATAN LGAM. IKATAN CAMPURAN Nitrogen dan oksigen merupakan
1. Aturan Aufbau. Konfigurasi Elektron. 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p,
 Ingattt.. Tabel SPU Konfigurasi Elektron Struktur Lewis t 1. Aturan Aufbau Konfigurasi Elektron 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, Lanjutan 2. Aturan Hund orbital
Ingattt.. Tabel SPU Konfigurasi Elektron Struktur Lewis t 1. Aturan Aufbau Konfigurasi Elektron 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, Lanjutan 2. Aturan Hund orbital
Hari Gambar 17. Kurva pertumbuhan Spirulina fusiformis
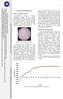 11 HASIL DAN PEMBAHASAN Kultivasi Spirulina fusiformis Pertumbuhan Spirulina fusiformis berlangsung selama 86 hari. Proses pertumbuhan diketahui dengan mengukur nilai kerapatan optik (Optical Density).
11 HASIL DAN PEMBAHASAN Kultivasi Spirulina fusiformis Pertumbuhan Spirulina fusiformis berlangsung selama 86 hari. Proses pertumbuhan diketahui dengan mengukur nilai kerapatan optik (Optical Density).
LATIHAN SOAL IKATAN KIMIA
 LATIHAN SOAL IKATAN KIMIA 1. Cara untuk mendapatkan ke stabilan atom unsur yang bernomor atom 10 adalah dengan a. Melepaskan dua elektron valensinya membentuk ion dengan muatan +2 b. Mengikat enam elektron
LATIHAN SOAL IKATAN KIMIA 1. Cara untuk mendapatkan ke stabilan atom unsur yang bernomor atom 10 adalah dengan a. Melepaskan dua elektron valensinya membentuk ion dengan muatan +2 b. Mengikat enam elektron
IKATAN KIMIA BAB 3. Pada pelajaran bab tiga ini akan dipelajari tentang ikatan ion, ikatan kovalen, dan ikatan logam.
 BAB 3 IKATAN KIMIA Gambar 3.1 Kisi Kristal Senyawa NaCl. Sumber: amparan Dunia Ilmu Time life Pada pelajaran bab tiga ini akan dipelajari tentang ikatan ion, ikatan kovalen, dan ikatan logam. Ikatan Kimia
BAB 3 IKATAN KIMIA Gambar 3.1 Kisi Kristal Senyawa NaCl. Sumber: amparan Dunia Ilmu Time life Pada pelajaran bab tiga ini akan dipelajari tentang ikatan ion, ikatan kovalen, dan ikatan logam. Ikatan Kimia
Ind. J. Chem. Res., 2015, 2,
 Ind. J. Chem. Res., 2015, 2, 205-212 COMPUTATIONAL STUDY NATURAL COLOR ESSENCE (DYES) AS ACTIVE MATERIAL ON ORGANIC SOLAR CELL WITH DENSITY FUNCTIONAL THEORY (DFT) Studi Komputasi Zat Warna (Dyes) Alami
Ind. J. Chem. Res., 2015, 2, 205-212 COMPUTATIONAL STUDY NATURAL COLOR ESSENCE (DYES) AS ACTIVE MATERIAL ON ORGANIC SOLAR CELL WITH DENSITY FUNCTIONAL THEORY (DFT) Studi Komputasi Zat Warna (Dyes) Alami
Semikonduktor. Sifat. (ohm.m) Tembaga 1,7 x 10-8 Konduktor Silikon pd 300 o K 2,3 x 10 3 Semikonduktor Gelas 7,0 x 10 6 Isolator
 Semikonduktor Definisi I: Bahan yang memiliki nilai hambatan jenis (ρ) antara konduktor dan isolator yakni sebesar 10 6 s.d. 10 4 ohm.m Perbandingan hambatan jenis konduktor, semikonduktor, dan isolator:
Semikonduktor Definisi I: Bahan yang memiliki nilai hambatan jenis (ρ) antara konduktor dan isolator yakni sebesar 10 6 s.d. 10 4 ohm.m Perbandingan hambatan jenis konduktor, semikonduktor, dan isolator:
KIMIA DASAR TEKNIK INDUSTRI UPNVYK C H R I S N A O C V A T I K A ( ) R I N I T H E R E S I A ( )
 KIMIA DASAR TEKNIK INDUSTRI UPNVYK C H R I S N A O C V A T I K A ( 1 2 2 1 5 0 1 1 3 ) R I N I T H E R E S I A ( 1 2 2 1 5 0 1 1 2 ) Menetukan Sistem Periodik Sifat-Sifat Periodik Unsur Sifat periodik
KIMIA DASAR TEKNIK INDUSTRI UPNVYK C H R I S N A O C V A T I K A ( 1 2 2 1 5 0 1 1 3 ) R I N I T H E R E S I A ( 1 2 2 1 5 0 1 1 2 ) Menetukan Sistem Periodik Sifat-Sifat Periodik Unsur Sifat periodik
Bab 1. Semi Konduktor
 Bab 1. Semi Konduktor Operasi komponen elektronika benda padat seperti dioda, LED, Transistor Bipolar dan FET serta Op-Amp atau rangkaian terpadu lainnya didasarkan atas sifat-sifat semikonduktor. Semikonduktor
Bab 1. Semi Konduktor Operasi komponen elektronika benda padat seperti dioda, LED, Transistor Bipolar dan FET serta Op-Amp atau rangkaian terpadu lainnya didasarkan atas sifat-sifat semikonduktor. Semikonduktor
Indo. J. Chem. Sci. 2 (1) (2013) Indonesian Journal of Chemical Science
 Indo. J. Chem. Sci. 2 (1) (2013) Indonesian Journal of Chemical Science http://journal.unnes.ac.id/sju/index.php/ijcs PENGARUH ENKAPSULASI Fe DAN Cu PADA BNNT TERHADAP PARAMETER NMR MENGGUNAKAN DFT Erwin
Indo. J. Chem. Sci. 2 (1) (2013) Indonesian Journal of Chemical Science http://journal.unnes.ac.id/sju/index.php/ijcs PENGARUH ENKAPSULASI Fe DAN Cu PADA BNNT TERHADAP PARAMETER NMR MENGGUNAKAN DFT Erwin
ORBITAL DAN IKATAN KIMIA ORGANIK
 ORBITAL DAN IKATAN KIMIA ORGANIK Objektif: Pada Bab ini, mahasiswa diharapkan untuk dapat memahami, Teori dasar orbital atom dan ikatan kimia organik, Orbital molekul orbital atom dan Hibridisasi orbital
ORBITAL DAN IKATAN KIMIA ORGANIK Objektif: Pada Bab ini, mahasiswa diharapkan untuk dapat memahami, Teori dasar orbital atom dan ikatan kimia organik, Orbital molekul orbital atom dan Hibridisasi orbital
BAB I PENDAHULUAN 1.1 Latar Belakang Penelitian
 BAB I PENDAHULUAN 1.1 Latar Belakang Penelitian Energi listrik merupakan energi primer, yang saat ini keberadaannya belum dapat digantikan oleh energi yang lain. Di Indonesia, kebutuhan energi listrik
BAB I PENDAHULUAN 1.1 Latar Belakang Penelitian Energi listrik merupakan energi primer, yang saat ini keberadaannya belum dapat digantikan oleh energi yang lain. Di Indonesia, kebutuhan energi listrik
Senyawa Koordinasi (senyawa kompleks)
 Senyawa Koordinasi (senyawa kompleks) Salah satu keistimewaan logam transisi adalah dapat membentuk senyawa klompeks, yaitu senyawa yang paling sedikit terdiri dari satu ion kompleks (terdiri dari kation
Senyawa Koordinasi (senyawa kompleks) Salah satu keistimewaan logam transisi adalah dapat membentuk senyawa klompeks, yaitu senyawa yang paling sedikit terdiri dari satu ion kompleks (terdiri dari kation
