AMALDO FIRJARAHADI TANE
|
|
|
- Harjanti Tan
- 6 tahun lalu
- Tontonan:
Transkripsi
1 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1
2 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom karbon adalah 6 (ditulis 6 C) dan nomor atom klor adalah 17 (ditulis 17 Cl). Soal ini meminta kita untuk mengidentifikasi senyawa yang dibentuk antara C dan Cl. Molekul yang biasanya dibentuk adalah CCl 4 karena telah oktet. Untuk menjawab pernyataan-pernyataan soal ini diperlukan struktur Lewis CCl 4 dengan menggambarkan elektron-elektron valensi masingmasing atom di sekitar atom-atom 6 C dan 17 Cl seperti gambar berikut: (1) Molekul CCl 4 memiliki ikatan kovalen polar, namun molekulnya bersifat nonpolar. Perbedaan ini terletak pada perbedaan keelektronegatifannya. Ikatan kovalen polarnya terjadi karena perbedaan keelektronegatifannya tergolong sedang (sekitar 0,61 Pauling). Sementara molekulnya bersifat nonpolar karena atom C sebagai atom pusat memiliki jarak yang sama ke 4 atom Cl lainnya sehingga selisih vektor muatan dan momen parsialnya bernilai nol. Tidak adanya kehadiran PEB di atom pusat C (karbon) mengakibatkan molekul CCl 4 ini juga bersifat nonpolar. (BENAR) (2) Molekul CCl 4 memiliki bentuk molekul tetrahedral atau AX 4 karena atom pusat C berikatan (PEI) dengan 4 atom Cl sementara jumlah elektron bebasnya (PEB) sama sekali tidak ada atau nol. (BENAR) (3) CCl 4 adalah molekul nonpolar sehingga antarmolekulnya dikukuhkan oleh gaya London atau gaya antarmolekul nonpolar dengan nonpolar. (BENAR) (4) Berdasarkan gambar struktur Lewis di atas terlihat bahwa atom pusat C tidak mempunyai pasangan elektron bebas (PEB). (BENAR) JAWABAN: E PEMBAHASAN SBMPTN KIMIA 2015 Page 2
3 2. MATERI: IKATAN KIMIA Air adalah senyawa yang memiliki rumus H 2 O dan bersifat polar serta memiliki ikatan kovalen polar. Hal ini dipengaruhi oleh perbedaan keelektronegatifan antara atom H dengan O (sekitar 1,24 Pauling). Apabila dilihat dari gambar di samping, vektor keelektronegatifan dari atom H ke atom O memiliki jarak yang sama dan terlihat vektornya adalah nol, tapi pernyataan ini adalah salah karena atom pusat O masih memiliki dua pasang PEB sehingga arah vektor dari atom H ke atom O tidak sepenuhnya sama, bisa saja sepasang PEB lainnya berada di sisi bawah atom O atau kedua PEB tersebut berada di sisi bawah atom O. Nah, jika ada sejumlah H 2 O dalam sebuah wadah, maka akan terjadi interaksi antarmolekul H 2 O yang dikenal dengan ikatan hidrogen, atau gaya dipol-dipol jika sesama molekul dipol. Etilen glikol adalah senyawa organik beracun yang biasanya digunakan untuk pembuatan fiber poliester. Rumus kimia senyawa ini adalah C 2 H 4 (OH) 2. Jika dilihat dari strukturnya pada gambar di samping, etilen glikol mengikat dua buah gugus alkohol ( OH). Gugus hidroksil ini memiliki polaritas elektron yang tinggi karena mengandung atom O (keelektronegatifannya tinggi) sehingga memiliki gaya dipol-dipol antarmolekunya. Berdasarkan uraian di atas, jelas bahwa gaya interaksi antarmolekul larutan etilen glikol di dalam air adalah gaya dipol-dipol. Pada gambar di samping adalah interaksi etilen glikol dengan air (ditandai kotak hijau), di mana atom O pada etilen glikol lebih mudah menarik atom H pada air sehingga gaya dipol-dipol yang ditunjukkan lebih cenderung ke ikatan hidrogen. JAWABAN: B PEMBAHASAN SBMPTN KIMIA 2015 Page 3
4 3. 4. MATERI: STOIKIOMETRI Soal ini penyelesaiannya sangat sederhana, yaitu cukup membandingkan volume tiap-tiap senyawa yang diketahui. Kenapa? Karena perbandingan volume menyatakan perbandingan mol atau koefisien tiap-tiap zat yang bereaksi. Hal inilah yang dinyatakan dalam hukum Avogadro, dengan syarat pada suhu dan tekanan yang sama dan tertentu. Reaksi pembakaran hidrokarbon X dengan perbandingan volumenya (masingmasing dibagi 80 ml) adalah sebagai berikut. X + O 2 CO 2 + H 2 O 80 ml 360 ml 240 ml 240 ml 1 9/2 3 3 Sehingga didapatkan reaksi setaranya: X + 9/2 O 2 3CO 2 + 3H 2 O Hidrokarbon pasti hanya memiliki atom C dan H, maka dari itu pada produklah dapat diprediksi hidrokarbon yang dimaksud di soal. Di sebelah produk terdapat 3 buah atom C pada CO 2 dan 6 buah atom H pada H 2 O. Jadi, dapat disimpulkan hidrokarbon X tersebut adalah C 3 H 6 atau propena. JAWABAN: C MATERI: STOIKIOMETRI Persentase dalam kimia dapat dinyatakan dalam persentase massa/massa (m/m), volume/volume (v/v), dan massa/volume (m/v). Biasanya, jenis-jenis persentase ini jarang banget lho disebutkan di SBMPTN, tapi sering banget muncul di SIMAK UI. PEMBAHASAN SBMPTN KIMIA 2015 Page 4
5 Oke, persentase yang dimaksud di soal ini adalah persentase m/m karena di soal hanya diketahui massanya saja. Persentase biasanya dihubungkan dengan rendemen, sesuai rumus (massa teoritis > massa eksperimen): % rendemen = massa eksperimen x 100% massa teoritis Di soal ditanya persentase (rendemen) hasil reaksi, yaitu rendemen senyawa SiC. Pada soal diketahui ada 1,5 gram SiC yang terbentuk dan massa inilah yang merupakan massa eksperimen karena berdasarkan teoritis atau stoikiometri, massa SiC yang didapatkan tidak tepat 1,5 gram. Hitung massa teoritisnya secara stoikiometri reaksi! n C = 4,5 gram/12 = 0,375 mol n SiO 2 = 3 gram/60 = 0, mol Reaksi setara: 2C (s) + SiO 2 (s) SiC (s) + CO 2 (g) M 0,375 0, B -0, , , , S 0, , , Berdasarkan reaksi di atas terlihat bahwa SiC pada keadaan sisa sebanyak 0, mol (M r SiC = 40) dengan massa 2 gram. Memang, secara eksperimen massa SiC yang didapatkan tidak sepenuhnya 2 gram, melainkan 1,5 gram. Hal ini dikarenakan pada stoikiometri kita menganggap ada suatu zat yang habis bereaksi sehingga adanya suatu zat reaktan yang bertindak sebagai pereaksi pembatas pada reaksi kimia. Nah, hitung rendemen SiC! % rendemen SiC = 1,5 gram x 100% 2 gram = 75% JAWABAN: D PEMBAHASAN SBMPTN KIMIA 2015 Page 5
6 5. MATERI: STOIKIOMETRI Di soal diketahui dan ditanya: m Ag = 216 gram m endapan = m AgCl = 71,75 gram Kadar Ag = %? Sama seperti soal sebelumnya, kadar Ag yang dimaksud adalah persentase m/m (rendemen). Massa 216 gram biji Ag belum bisa dipastikan apakah massa tersebut massa eksperimen atau teoritis. Untuk memeriksanya, kita bisa dapatkan massa Ag yang lain dari reaksi kimia yang menghasilkan 71,75 gram endapan. Reaksi 1: 2Ag (s) + 2HNO 3 (aq) 2AgNO 3 (aq) + H 2 (g) Reaksi 2: Pada reaksi 1 terbentuk larutan AgNO 3 dan garam ini dilanjutkan pada reaksi 2 ini. Data di soal dikatakan bahwa semua ion Ag + semuanya diendapkan menjadi AgCl, dengan maksud ion Ag + adalah ion yang berasal dari garam AgNO 3 sesuai reaksi berikut. 2AgNO 3 (aq) + CaCl 2 (aq) 2AgCl (s) + Ca(NO 3 ) 2 (aq) Hitung massa Ag melalui kedua reaksi stoikiometri di atas! n AgCl = 71,75 gram/143,5 = 0,5 mol 2AgNO 3 (aq) + CaCl 2 (s) 2AgCl (s) + Ca(NO 3 ) 2 (aq) x mol 0,5 mol Karena perbandingan mol AgNO 3 dengan AgCl adalah 2 : 2 atau 1 : 1, maka jumlah mol AgNO 3 adalah 0,5 mol (nilai x). 2Ag (s) + 2HNO 3 (aq) 2AgNO 3 (aq) + H 2 (g) y mol 0,5 mol Karena perbandingan mol Ag dengan AgNO 3 adalah 2 : 2 atau 1 : 1, maka jumlah mol padatan Ag adalah 0,5 mol juga (nilai y). Nah, sudah didapatkan bahwa jumlah mol padatan Ag yang terbentuk adalah 0,5 mol (A r Ag = 108) dengan massa 54 gram. Artinya, massa eksperimen dan PEMBAHASAN SBMPTN KIMIA 2015 Page 6
7 6. teoritisnya berturut-turut adalah 54 gram dan 216 gram sehingga kadar Mn sebagai berikut: % kadar (rendemen) Mn = 54 gram x 100% 216 gram = 25% JAWABAN: E MATERI: TERMOKIMIA Di soal diketahui dan ditanya: ΔH c PH 3 = kj (4 mol PH 3 ) ΔH f P 4 O 10 = kj (1 mol P 4 H 10 ) ΔH f H 2 O = -572 kj (2 mol air) ΔH f PH 3 = kj/mol? Untuk menjawab soal ini kita memerlukan konsep hukum Hess. Ingat, bahwa entalpi pembentukan adalah entalpi atau energi yang dibutuhkan untuk membentuk sebuah senyawa sebesar 1 kj per 1 mol senyawa tersebut dari unsur-unsurnya. Artinya, jika untuk membentuk PH 3 maka jumlah mol PH 3 yang terbentuk harus 1 mol, sesuai reaksi berikut: P (s) + 3/2 H 2 (g) PH 3 (g) ΔH f = kj/mol Berdasarkan konsep hukum Hess, kita bisa menghitung reaksi di atas dengan memainkan nilai ΔH senyawa lain yang telah diketahui! a) 4PH 3 (g) + 8O 2 (g) P 4 O 10 (s) + 6H 2 O (l) ΔH c = kj b) 4P (s) + 5O 2 (g) P 4 O 10 (s) ΔH f = kj c) 2H 2 (g) + O 2 (g) 2H 2 O (l) ΔH f = -572 kj d) P (s) + 3H 2 (g) PH 3 (g) ΔH f = kj/mol Untuk mendapatkan nilai entalpi pembentukan data (d), kita cukup membalikkan reaksi (a), reaksi (b) tidak diganggu, dan mengkalikan reaksi (c) dengan faktor 3, sehingga nantinya ada senyawa yang bisa dicoret karena berada di ruas yang berbeda (ditandai dengan warna merah) sebagai berikut. (a) P 4 H 10 (s) + 6H 2 O 4PH 3 + 8O 2 ΔH = kj (b) 4P (s) + 5O 2 P 4 H 10 (s) ΔH f = kj (c) 6H 2 (g) + 3O 2 (g) 6H 2 O (l) ΔH f = kj PEMBAHASAN SBMPTN KIMIA 2015 Page 7
8 7. (d) 4P (s) + 6H 2 (g) 4PH 3 (g) ΔH f = +432 kj Reaksi (d) ini masih dalam 4 mol PH 3 sebesar +432 kj. Agar didapatkan 1 mol PH 3 seluruh reaksi termasuk nilai ΔH f -nya dibagi dengan faktor 4 sehingga: P (s) + 3/2 H 2 (g) PH 3 ΔH f = +108 kj JAWABAN: D MATERI: REDOKS Fosfor (P) sebagai oksidasi artinya mengalami kenaikan bilangan oksidasi (biloks). Untuk memeriksanya, identifikasi dan pilih di reaktan dan produk yang mengandung unsur fosfor (P) saja. (1) Ca 3 (PO 4 ) 2 Ca(H 2 PO 4 ) 2 Ca 3 (PO 4 ) 2 = biloks +5 (warna cokelat) didapatkan dari reaksi ionisasi: Ca 3 (PO 4 ) 2 3Ca PO 4 biloks P + 4 (biloks O) = -3 biloks P + 4 (-2) = -3 biloks P = +5 Ca(H 2 PO 4 ) 2 = biloks +5 (warna cokelat) didapatkan dari reaksi ionisasi: Ca(H 2 PO 4 ) 2 Ca H 2 PO 4 2 (biloks H) + bilok P + 4 (biloks O) = -1 2 (+1) + biloks P + 4 (-2) = -1 biloks P = +5 Biloks +5 ke +5 adalah tetap. Bukan oksidasi maupun reduksi. (SALAH) 3- (2) PCl 3 PO 3 PCl 3 = biloks +3 didapatkan dari: biloks P + 3 (biloks Cl) = 0 biloks P + 3 (-1) = 0 biloks P = +3 PO 3-3 = biloks +3 didapatkan dari: biloks P + 3 (biloks O) = -3 biloks P + 3 (-2) = -3 biloks P = +3 Tidak mengalami perubahan biloks. (SALAH) (3) Na 3 P PH 3 Na 3 P = biloks -3 didapatkan dari: 3 (biloks Na) + biloks P = 0 PEMBAHASAN SBMPTN KIMIA 2015 Page 8
9 8. 3 (+1) + biloks P = 0 biloks P = -3 PH 3 = biloks -3 didapatkan dari: biloks P + 3 (biloks H) = 0 biloks P + 3 (+1) = 0 biloks P = -3 Tidak mengalami perubahan biloks. (SALAH) (4) P 4 O 6 P 4 O 10 P 4 O 6 = biloks +3 didapatkan dari: 4 (biloks P) + 6 (biloks O) = 0 4 (biloks P) + 6 (-2) = 0 biloks P = +3 P 4 O 10 = biloks +5 didapatkan dari: 4 (biloks P) + 10 (biloks O) = 0 4 (biloks P) + 10 (-2) = 0 biloks P = +5 Biloks +3 ke +5 adalah oksidasi. (BENAR) JAWABAN: D MATERI: REDOKS DAN ELEKTROKIMIA Di soal diketahui dan ditanya: i = 0,8 A t = 200 menit = detik E (oksidasi) = -0,40 volt (Cd) E (reduksi) = +0,34 volt (Cu) Pengurangan massa di anoda = gram? Soal ini menghubungkan konsep sel elektrolisis dengan sel volta (galvani). Nilai E sel pada soal hanya sebagai bahan bantu agar kita tahu zat mana yang mengalami reaksi oksidasi dan reduksi. Oleh karena reduksi potensial selnya lebih positif, maka Cu mengalami reaksi reduksi dan sebaliknya unsur Cd mengalami reaksi oksidasi. Untuk mencari massa di anoda, maka kita memerlukan massa yang terbentuk di PEMBAHASAN SBMPTN KIMIA 2015 Page 9
10 anoda yaitu massa Cd karena dalam elektrolisis katode tempat terjadi reaksi reduksi sementara anode tempat terjadi reaksi oksidasi (ingat singkatan KARAOS). Untuk mendapatkan massa Cd, kita memerlukan mol elektron. Ingat, bahwa elektron terbawa dalam arus listrik yang mengalir selama proses elektrolisis berlangsung dan arus listrik ini dirangkai secara seri sehingga arus listrik di kedua sel (sel Cd dan Cu) bernilai sama; ingat konsep fisika juga, ya. Cari besarnya mol elektron! Mol elektron = i x t = 0,8 A x detik = 96/965 mol Cari besarnya mol Cd di anode! Ingat, bahwa di anode terjadi pelepasan elektron karena terjadi reaksi oksidasi! Cd Cd e x mol 96/965 mol Nilai x bisa didapatkan dari perbandingan koefisien (mol): Mol Cd (ditanya) = koefisien Cd (ditanya) x mol e (diketahui) koefisien e (diketahui) = 1 x 98/965 mol 2 = 48/965 mol Cd Cari massa Cd dengan konsep mol! mol Cd = g (massa)/a r Cd 48/965 mol = g (massa)/112 g (massa) = 5,57 gram = 5,6 gram (pembulatan) JAWABAN: C PEMBAHASAN SBMPTN KIMIA 2015 Page 10
11 9. MATERI: LAJU DAN ORDE REAKSI Persamaan laju reaksi biasanya dinyatakan dengan: r = k [A] x [B] y. (persamaan 1) atau 1/t = k [A] x [B] y. (persamaan 2); dengan r adalah laju reaksi, k adalah konstanta laju reaksi, A dan B adalah zat pada reaktan, t adalah waktu, dan x dan y adalah orde reaksi. Untuk mendapatkan nilai x dan y pada soal, bisa didapatkan dengan perbandingan laju reaksi dari data-data di tabel, dengan pemisalan x adalah orde NO dan y adalah orde Br 2 sehingga nanti rumus laju reaksinya: r = k [NO] x [Br 2 ] y Cari orde x dengan perbandingan data 1 dan 3, dan ingat bahwa 1 dipangkatkan berapapun hasilnya tetap 1! (0,1/0,2) x (0,05/0,05) y = (1/4) x = 2 Cari orde y dengan perbandingan data 1 dan 2, dan ingat bahwa 1 dipangkatkan berapapun hasilnya tetap 1! (0,1/0,1) x (0,05/0,1) y = (2/4) y = 1 Sehingga rumus laju reaksinya adalah r = k [NO] 2 [Br 2 ] JAWABAN: E PEMBAHASAN SBMPTN KIMIA 2015 Page 11
12 10. MATERI: KESETIMBANGAN KIMIA Di soal diketahui dan ditanya: Volume sistem = 2 L [N 2 ] 0 = [O 2 ] 0 = [NO] 0 = 0,8 M n NO = 2 mol (saat penambahan) [N 2 ] 1 = M? Sistem kesetimbangan tersebut berada dalam volume 2 L, artinya kita bisa mendapatkan komposisi mol awal masing-masing senyawa pada reaksi sebagai berikut. Mol N 2, O 2, dan NO [N 2 ] = [O 2 ] = [NO] = n (N 2, O 2, dan NO) 2 L 0,8 M = n (N 2, O 2, dan NO) 2 L n (N 2, O 2, dan NO) 0 = 1,6 mol Cari nilai K c reaksi! K c = [NO] 2. [N 2 ][O 2 ] = [0,8] 2. [0,8][0,8] = 1 Untuk mencari nilai [N 2 ] 1 setelah penambahan 2 mol NO, kita perlu jumlah mol pada setimbang (label S ) di reaksi kesetimbangan yang baru di bawah ini. Nah, setelah adanya penambahan 2 mol NO, yang molnya berubah hanya NO saja sehingga: n N 2 (data ke-2) = 1,6 mol n O 2 (data ke-2) = 1,6 mol n NO (data ke-2) = 1,6 mol + 2 mol = 3,6 mol PEMBAHASAN SBMPTN KIMIA 2015 Page 12
13 Reaksi kesetimbangan baru di bawah ini adalah hasil penambahan gas NO. Ingat, saat gas NO bertambah maka bagian produk berada pada keadaan kelebihan konsentrasi sehingga kesetimbangan bergeser ke reaktan agar menyeimbangkan kelebihan konsentrasi di produk. Akibatnya adalah adanya pengurangan laju produk dan penambahan laju reaktan (dalam mol/detik) pada label B reaksi di bawah. Misal, banyaknya produk yang berkurang saat bereaksi (label B ) adalah 2x, maka: N 2 (g) + O 2 (g) 2NO (g) M 1,6 mol 1,6 mol 3,6 mol B +x mol +x mol -2x mol S (1,6 + x) (1,6 + x) (3,6 2x) Setelah ditemukan komposisi masing-masing senyawa pada keadaan sisa (label S ), maka dapat ditentukan nilai x-nya dengan konsep K c. Ingat, setelah penambahan gas NO dan tidak terjadi perubahan suhu, maka nilai K c -nya adalah tetap 1! K c = [NO] 2. [N 2 ][O 2 ] 1 = [3,6 2x/2 L] 2. [1,6+x/2 L][1,6+x/2 L] x = 2/3 mol Terhitung banyaknya gas N 2 dan O 2 yang bereaksi adalah 2/3 mol atau 0,67 mol. Dari sini didapatkan konsentrasi N 2 saat setimbang (label S ) adalah: n N 2 (data ke-2; label S ) = 1,6 + x = 1,6 + 2/3 mol = 2,27 mol [N 2 ] 1 = n N 2 (data ke-2; label S ) volume (L) = 2,27 mol 2 L = 1,135 L = 1,130 L (pembulatan) JAWABAN: A PEMBAHASAN SBMPTN KIMIA 2015 Page 13
14 11. MATERI: SIFAT KOLIGATIF LARUTAN Di soal diketahui dan ditanya: K b = 0,52 m MgCl 2 = 9,5 gram p larutan BaCl 2 = 500 gram m KNO 3 = 5,05 gram p larutan KNO 3 = 500 gram α = 1 (terdisosiasi sempurna) ΔT f larutan A : ΔT f larutan B =? Penurunan titik beku (ΔT f ) dipengaruhi oleh tetapan penurunan titik beku pelarut (K f ), molal terlarut, dan faktor Van t Hoff (i). Di soal, larutan A dan larutan B masing-masing merupakan zat elektrolit sehingga nilai ΔT f -nya dipengaruhi juga oleh faktor Van t Hoff juga. Nilai faktor Van t Hoff (i) larutan A: MgCl 2 1Mg Cl - (n = = 3) i = 1 + (n 1)α = 1 + (3 1).1 = 3 Nilai faktor Van t Hoff (i) larutan B: KNO 3 1K NO 3 (n = = 2) i = 1 + (n 1)α = 1 + (2 1).1 = 2 Hitung nilai ΔT ba larutan A! ΔT ba = K b x m x i = K b x g x 1000 x i M r x p (gram) = K b x 9,5 x 1000 x 3 95 x 500 = 0,3K b PEMBAHASAN SBMPTN KIMIA 2015 Page 14
15 Hitung nilai ΔT bb larutan B! ΔT bb = K b x m x i = K b x g x 1000 x i M r x p (gram) = K b x 5,05 x 1000 x x 500 = 0,1K b Bandingkan! ΔT ba = 0,3K b = 3 ΔT bb 0,1K b 1 JAWABAN: A 12. MATERI: LARUTAN PENYANGGA (BUFFER) Di soal diketahui senyawa HCN (asam lemah) dan KOH (basa kuat) dicampur dengan jumlah mol tertentu. Kita nggak tahu sistem ph apasih yang ada antara HCN dan KOH tersebut. Untuk memeriksanya, kita reaksikan! n HCN = 0,2 L x 0,3 M = 0,06 mol n KOH = 0,1 L x 0,3 M = 0,03 mol HCN + KOH KCN + H 2 O... (reaksi 1) M 0,06 mol 0,03 mol - - B -0,03 mol -0,03 mol +0,03 mol +0,03 mol S 0,03 mol - 0,03 mol 0,03 mol Terlihat bahwa saat sisa (label S ), yang habis bereaksi hanya basa kuat KOH, sehingga tidak terjadi sistem asam-basa dan hidrolisis di sini, melainkan sistem larutan penyangga asam. Reaksi di atas adalah reaksi awal HCN + KOH sebelum ditambah dengan basa kuat lainnya, yaitu NaOH. Ingat, jumlah mol HCN dan KOH setelah bereaksi tertera di label S reaksi 1 sudah ada sebelum penambahan NaOH! Jika suatu buffer asam ditambah basa kuat (di soal jenis NaOH), maka ion OH - dari NaOH tersebut akan bereaksi dengan zat asam dari buffer asam tersebut, yaitu HCN. n NaOH = 0,8 gram/40 = 0,02 mol PEMBAHASAN SBMPTN KIMIA 2015 Page 15
16 NaOH Na + + OH - 0,02 mol 0,02 mol Ketika ditambahkan NaOH dan terjadi reaksi pengikatan OH - oleh HCN pada reaksi awal: HCN + KOH KCN + H 2 O (reaksi 1) HCN + KOH + NaOH? (setelah ditambah NaOH) Maka, [HCN] atau konsentrasi HCN akan semakin berkurang karena terus-menerus mengikat ion OH - sehingga reaksi tersebut akhirnya nanti menjadi setimbang sehingga reaksi kesetimbangan tersebut bergeser ke kanan, akibatnya pada bagian reaktan lajunya (mol/detik) semakin berkurang sementara bagian produk lajunya (mol/detik) semakin bertambah (lihat label B reaksi di bawah). Paham? Lanjut! Setelah terjadi penambahan NaOH, ion OH - -nya tertarik ke senyawa HCN sesuai reaksi di bawah ini. Ingat, bahwa pada kondisi reaksi 2 di bawah ini, jumlah mol HCN, CN -, dan air mula-mula sudah ada karena berasal dari reaksi 1 di atas; dengan catatan ion CN - berasal dari garam KCN. Banyaknya ion CN - dari KCN pada reaksi 1 KCN K + + CN - 0,03 mol 0,03 mol Reaksi setelah penambahan NaOH (reaksi 2) HCN + OH - CN - + H 2 O... (reaksi 2) M 0,03 mol 0,02 mol 0,03 mol 0,03 mol B -0,02 mol -0,02 mol +0,02 mol +0,02 mol S 0,01 mol - 0,05 mol 0,05 mol Pada reaksi 2 di atas, terlihat ion OH - dari NaOH habis bereaksi dan reaksi ini masih dalam sistem buffer asam sehingga nilai ph-nya adalah: [H + ] = K a x [asam]. [basa konjugasi] = K a x [HCN] [CN - ] = 5 x x [0,01 mol/(0,2 L + 0,1 L)] [0,05 mol/(0,2 L + 0,1 L)] = 1 x ph = log[h + ] = log[1 x ] = 10 JAWABAN: D PEMBAHASAN SBMPTN KIMIA 2015 Page 16
17 13. MATERI: TITRASI ASIDI-ALKALIMETRI DAN PENGENCERAN Soal ini membicarakan tentang pengenceran dan titrasi asidi-alkalimetri. Jangan kaget dulu dengan nama titrasi asidi-alkalimetri. Titrasi ini adalah nama kerennya titrasi asam-basa. Hehe. Asam oksalat (rumusnya C 2 H 2 O 4 ) maksud di soal adalah asam bervalensi dua, artinya asam ini terionisasi menghasilkan 2 buah ion H +. Pada kondisi pertama, asam oksalat diencerkan hingga volumenya 100 ml, artinya agar volume asam oksalat tersebut 100 ml harus ada penambahan air sebanyak 90 ml. Dari sini bisa disimpulkan pengenceran C 2 H 2 O 4 sebagai berikut. Pengenceran asam oksalat V 1 M 1 = V 2 M 2 10 ml. M 1 = 100 ml. M 2 Nilai M 1 atau konsentrasi awal yang akan diencerkan belum diketahui dan M 1 inilah yang dicari atau ditanya di soal. Untuk mendapatkannya, kita memerlukan data M 2 atau konsentrasi C 2 H 2 O 4 setelah pengenceran. Data M 2 didapatkan dari hasil titrasi C 2 H 2 O 4 dengan basa kuat NaOH: Persamaan titrasi C 2 H 2 O 4 oleh NaOH: jumlah grek C 2 H 2 O 4 = jumlah grek NaOH V 1. M 1. valensi asam = V 2. M 2. valensi basa 25 ml. M 1. 2 = 20 ml. 0,2 M. 1 M 1 = 0,08 M Didapatkan bahwa konsentrasi M 1 asam oksalat untuk titrasinya dengan NaOH adalah 0,08 M. Ingat, bahwa konsentrasi inilah yang juga merupakan konsentrasi hasil pengenceran C 2 H 2 O 4 dengan 90 ml air tadi! Di sini bisa ditentukan nilai konsentrasi awal C 2 H 2 O 4 sebelum pengenceran! V 1 M 1 = V 2 M 2 10 ml. M 1 = 100 ml. M 2 10 ml. M 1 = 100 ml. 0,08 M M 1 = 0,8 M JAWABAN: C PEMBAHASAN SBMPTN KIMIA 2015 Page 17
18 14. MATERI: KIMIA ORGANIK Soal ini dikategorikan sangat sulit sebab penyelesaiannya saya temukan di buku yang ditulis oleh Ralph J. Fessenden dan Joan S. Fessenden atau lebih dikenal sebagai Fessenden Fessenden. Sebenarnya kita sudah mendapatkan kata kunci di soal: Memudarkan warna brom dalam CCl 4 Senyawa ini menghasilkan etanal dan pentanal Senyawa tersebut dapat bereaksi dengan ozon Hasil reaksi dengan ozon berupa etanal dan pentanal Walaupun seluruh obsein adalah hidrokarbon berjumlah 7 atom C, kita bisa mengeliminasi beberapa obsein. Ingat, bahwa senyawa yang dapat memudarkan warna Br dalam CCl 4 adalah hidrokarbon jenis alkena. Otomatis obsein A dan E salah. Nah, berdasarkan isi buku Fessenden Fessenden tentang reaksi senyawa tersebut dengan ozon (O 3 ). Sebenarnya jika sudah memahami mekanisme reaksinya dengan ozon, jawaban yang tepat adalah 2-heptena sebab hasil utama reaksinya adalah etanal dan hasil samping pentanal. Etanal sendiri adalah aldehid beratom karbon 2, maka dari itu ozon (O 3 ) akan mengambil alih agar terbentuk ikatan rangkap 2 tempat gugus aldehid ( CHO) berada. Sebelumnya, jika soal ini keluar lagi di seleksi PTN atau PTS, ingat bahwa jika suatu alkena bereaksi dengan ozon (O 3 ) maka kemungkinan akan terbentuk 3 buah produk, yaitu: a) Aldehid aldehid b) Keton keton c) Aldehid keton Jika masih gak ngerti, di bawah ini adalah penjabaran mekanisme reaksi 2-heptena dengan O 3 menghasilkan etanal (hasil utama) dan pentanal (hasil samping): (sumber Fessenden Fessenden) PEMBAHASAN SBMPTN KIMIA 2015 Page 18
19 (1) Reaksi pembentukan malozonida di produk. Pada skema reaksi (1) ini, reaktannya berupa 2-heptena dan ozon masingmasing perbandingannya 1 mol (1 : 1). Pada molekul alkena tersebut terdapat ikatan rangkap yang terletak di antara atom C nomor 2 (terkecil) sementara molekul ozon (O 3 ) ikatan rangkap dan tunggal masing-masing berjumlah 1. Ozon mudah menggantikan posisi ikatan rangkap alkena dengan sinar UV. Akibatnya, ikatan rangkap pada 2-heptena digantikan oleh satu atom O yang berikatan tunggal, sedangkan atom O yang berikatan rangkap berubah menjadi ikatan tunggal dan masing-masing berikatan ke atom C yang berikatan rangkap yaitu atom C nomor 2 dan 3 sehingga didapatkan produk berupa malozonida dengan struktur pada gambar di bawah ini. Dari uraian ini, yang menjadi penyebab ozon menyerang ikatan rangkap pada 2-heptena adalah karena O 3 bertindak sebagai nukleofil (suka muatan positif) sementara 2-heptena menyediakan proton sehingga bertindak sebagai elektrofil (suka muatan negatif). (2) Reaksi pemutusan cincin malozonida Pada skema reaksi (2) ini, malozonida yang terbentuk akibat serangan dari O 3 selanjutnya direaksikan dengan air. Reaksi ini berlangsung lambat. Agar PEMBAHASAN SBMPTN KIMIA 2015 Page 19
20 berlangsung cepat dibantu dengan katalis Zn (berupa cairan; l). Katalis ini nantinya mampu meningkatkan hidrolisis malozonida oleh air sehingga salah satu ikatan atom C O (antara atom C nomor 2 dan 3) dan O O terputus atau terhidrolisis. Hal ini menyebabkan terbentuknya dua buah produk baru yang mengandung gugus aldehid. Salah satu atom O yang terbuang nantinya berubah menjadi gas ½ O 2 seperti gambar di bawah ini: JAWABAN: D 15. MATERI: BIOKIMIA Makromolekul tersebut di soal dikatakan penyusunnya bersifat hidrofil maupun hidrofob. Kata kunci ini sudah merujuk kepada fosfolipid. Masih ingat kan pelajaran sel di biologi? Nah! Ikatan ester pun hanya terjadi pada makromolekul berlemak seperti fosfolipid, lipid, dsb. JAWABAN: A #SBMPTN2015 PEMBAHASAN SBMPTN KIMIA 2015 Page 20
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom fluor adalah 9 (ditulis 9 F) dan nomor atom belerang
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom fluor adalah 9 (ditulis 9 F) dan nomor atom belerang
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom nitrogen adalah 7 (ditulis 7 N) dan nomor atom
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom nitrogen adalah 7 (ditulis 7 N) dan nomor atom
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom karbon adalah 6 (ditulis 6 C) dan nomor atom klor
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom karbon adalah 6 (ditulis 6 C) dan nomor atom klor
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: HUKUM-HUKUM DASAR KIMIA Di soal diketahui dan ditanya: m (NH 2 ) 2 CO = 12.000 ton/tahun (pabrik) m N 2 = ton/tahun?
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: HUKUM-HUKUM DASAR KIMIA Di soal diketahui dan ditanya: m (NH 2 ) 2 CO = 12.000 ton/tahun (pabrik) m N 2 = ton/tahun?
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: TERMOKIMIA Pada soal diketahui dan ditanya: ΔH c C 2 H 5 OH = -1380 kj/mol ΔH d C 6 H 12 O 6 = -60 kj/mol ΔH c C
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: TERMOKIMIA Pada soal diketahui dan ditanya: ΔH c C 2 H 5 OH = -1380 kj/mol ΔH d C 6 H 12 O 6 = -60 kj/mol ΔH c C
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Y memiliki nomor atom 17. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Y memiliki nomor atom 17. Ingat, bahwa jumlah
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur X memiliki nomor atom 19. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur X memiliki nomor atom 19. Ingat, bahwa jumlah
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2014 Page 1 1. MATERI: STOIKIOMETRI Reaksi kondensasi berkaitan dengan reaksi pembentukan polimer, di samping ada juga yang mengalami reaksi
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2014 Page 1 1. MATERI: STOIKIOMETRI Reaksi kondensasi berkaitan dengan reaksi pembentukan polimer, di samping ada juga yang mengalami reaksi
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2015 Page 1 1. MATERI: STOIKIOMETRI Persen massa adalah persentase massa zat terlarut dalam 100 gram massa larutan (massa pelarut + massa
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2015 Page 1 1. MATERI: STOIKIOMETRI Persen massa adalah persentase massa zat terlarut dalam 100 gram massa larutan (massa pelarut + massa
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Cr memiliki nomor atom 24. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Cr memiliki nomor atom 24. Ingat, bahwa jumlah
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Se memiliki nomor atom 34. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Se memiliki nomor atom 34. Ingat, bahwa jumlah
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Q memiliki nomor atom 22. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Q memiliki nomor atom 22. Ingat, bahwa jumlah
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Ingat, bahwa jumlah neutron suatu unsur dan ionnya bernilai sama, yang membedakannya
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Ingat, bahwa jumlah neutron suatu unsur dan ionnya bernilai sama, yang membedakannya
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Ingat, bahwa jumlah neutron suatu unsur dan ionnya bernilai sama, yang membedakannya
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Ingat, bahwa jumlah neutron suatu unsur dan ionnya bernilai sama, yang membedakannya
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur R memiliki nomor atom 33. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur R memiliki nomor atom 33. Ingat, bahwa jumlah
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur X memiliki nomor atom 21. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur X memiliki nomor atom 21. Ingat, bahwa jumlah
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur A memiliki nomor atom 16. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur A memiliki nomor atom 16. Ingat, bahwa jumlah
Sulistyani, M.Si.
 Sulistyani, M.Si. sulistyani@uny.ac.id Reaksi oksidasi: perubahan kimia suatu spesies (atom, unsur, molekul) melepaskan elektron. Cu Cu 2+ + 2e Reaksi reduksi: perubahan kimia suatu spesies (atom, unsur,
Sulistyani, M.Si. sulistyani@uny.ac.id Reaksi oksidasi: perubahan kimia suatu spesies (atom, unsur, molekul) melepaskan elektron. Cu Cu 2+ + 2e Reaksi reduksi: perubahan kimia suatu spesies (atom, unsur,
D. 4,50 x 10-8 E. 1,35 x 10-8
 1. Pada suatu suhu tertentu, kelarutan PbI 2 dalam air adalah 1,5 x 10-3 mol/liter. Berdasarkan itu maka Kp PbI 2 adalah... A. 4,50 x 10-9 B. 3,37 x 10-9 C. 6,75 x 10-8 S : PbI 2 = 1,5. 10-3 mol/liter
1. Pada suatu suhu tertentu, kelarutan PbI 2 dalam air adalah 1,5 x 10-3 mol/liter. Berdasarkan itu maka Kp PbI 2 adalah... A. 4,50 x 10-9 B. 3,37 x 10-9 C. 6,75 x 10-8 S : PbI 2 = 1,5. 10-3 mol/liter
KISI-KISI UN KIMIA SMA/MA
 KISI-KISI UN KIMIA SMA/MA 2015-2016 Siswa mampu memahami, menguasai pengetahuan/ mengaplikasikan pengetahuan/ menggunakan nalar dalam hal: Struktur Atom Sistem Periodik Unsur Ikatan Kimia (Jenis Ikatan)
KISI-KISI UN KIMIA SMA/MA 2015-2016 Siswa mampu memahami, menguasai pengetahuan/ mengaplikasikan pengetahuan/ menggunakan nalar dalam hal: Struktur Atom Sistem Periodik Unsur Ikatan Kimia (Jenis Ikatan)
D kj/mol E kj/mol
 1. Dari data : 2H 2 (g) + O 2 (g) 2H 2 O (l) H = -571 kj 2Ca (s) + O 2 (g) 2CaO(s) H = -1269 kj CaO (s) + H 2 O (l) Ca(OH)2(s) H = -64 kj Dapat dihitung entalpi pembentukan Ca(OH) 2 (s) sebesar... A. -984
1. Dari data : 2H 2 (g) + O 2 (g) 2H 2 O (l) H = -571 kj 2Ca (s) + O 2 (g) 2CaO(s) H = -1269 kj CaO (s) + H 2 O (l) Ca(OH)2(s) H = -64 kj Dapat dihitung entalpi pembentukan Ca(OH) 2 (s) sebesar... A. -984
D. 2 dan 3 E. 2 dan 5
 1. Pada suhu dan tekanan sama, 40 ml P 2 tepat habis bereaksi dengan 100 ml, Q 2 menghasilkan 40 ml gas PxOy. Harga x dan y adalah... A. 1 dan 2 B. 1 dan 3 C. 1 dan 5 Kunci : E D. 2 dan 3 E. 2 dan 5 Persamaan
1. Pada suhu dan tekanan sama, 40 ml P 2 tepat habis bereaksi dengan 100 ml, Q 2 menghasilkan 40 ml gas PxOy. Harga x dan y adalah... A. 1 dan 2 B. 1 dan 3 C. 1 dan 5 Kunci : E D. 2 dan 3 E. 2 dan 5 Persamaan
2. Konfigurasi elektron dua buah unsur tidak sebenarnya:
 . Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
. Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
D. 3 dan 4 E. 1 dan 5
 1. Dari beberapa unsur berikut yang mengandung : 1. 20 elektron dan 20 netron 2. 10 elektron dan 12 netron 3. 15 proton dan 16 netron 4. 20 netron dan 19 proton 5. 12 proton dan 12 netron Yang memiliki
1. Dari beberapa unsur berikut yang mengandung : 1. 20 elektron dan 20 netron 2. 10 elektron dan 12 netron 3. 15 proton dan 16 netron 4. 20 netron dan 19 proton 5. 12 proton dan 12 netron Yang memiliki
Mengubah energi kimia menjadi energi listrik Mengubah energi listrik menjadi energi kimia Katoda sebagi kutub positif, anoda sebagai kutub negatif
 TUGAS 1 ELEKTROKIMIA Di kelas X, anda telah mempelajari bilangan oksidasi dan reaksi redoks. Reaksi redoks adalah reaksi reduksi dan oksidasi. Reaksi reduksi adalah reaksi penangkapan elektron atau reaksi
TUGAS 1 ELEKTROKIMIA Di kelas X, anda telah mempelajari bilangan oksidasi dan reaksi redoks. Reaksi redoks adalah reaksi reduksi dan oksidasi. Reaksi reduksi adalah reaksi penangkapan elektron atau reaksi
Redoks dan Elektrokimia Tim Kimia FTP
 Redoks dan Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis
Redoks dan Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis
Elektrokimia. Tim Kimia FTP
 Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis ini merupakan
Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis ini merupakan
SAP DAN SILABI KIMIA DASAR PROGRAM STUDI TEKNOLOGI PANGAN UNIVERSITAS PASUNDAN
 SAP DAN SILABI KIMIA DASAR PROGRAM STUDI TEKNOLOGI PANGAN UNIVERSITAS PASUNDAN KATA PENGANTAR Satuan acara perkuliahan (SAP) atau garis besar program pembelajaran (GBPP)merupakan panduan bagi dosen dan
SAP DAN SILABI KIMIA DASAR PROGRAM STUDI TEKNOLOGI PANGAN UNIVERSITAS PASUNDAN KATA PENGANTAR Satuan acara perkuliahan (SAP) atau garis besar program pembelajaran (GBPP)merupakan panduan bagi dosen dan
PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH
 PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH TAHUN 2016 Soal diketik ulang oleh urip rukim (www.urip.info)
PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH TAHUN 2016 Soal diketik ulang oleh urip rukim (www.urip.info)
D. 8 mol S E. 4 mol Fe(OH) 3 C. 6 mol S Kunci : B Penyelesaian : Reaksi :
 1. Perhatikan reaksi, 2 Fe 2 S 3 + 3O 2 + 6 H 2 O 4 Fe(OH) 3 + 6S Jika 2 mol Fe 2 S 3, 2 mol O 2 dan 3 mol H 2 O bereaksi dengan sempurna, akan dihasilkan : A. 3 mol Fe(OH) 3 B. 2 mol Fe(OH) 3 D. 8 mol
1. Perhatikan reaksi, 2 Fe 2 S 3 + 3O 2 + 6 H 2 O 4 Fe(OH) 3 + 6S Jika 2 mol Fe 2 S 3, 2 mol O 2 dan 3 mol H 2 O bereaksi dengan sempurna, akan dihasilkan : A. 3 mol Fe(OH) 3 B. 2 mol Fe(OH) 3 D. 8 mol
Ikatan kimia. 1. Peranan Elektron dalam Pembentukan Ikatan Kimia. Ikatan kimia
 Ikatan kimia 1. Peranan Elektron dalam Pembentukan Ikatan Kimia Ikatan kimia Gaya tarik menarik antara atom sehingga atom tersebut tetap berada bersama-sama dan terkombinasi dalam senyawaan. gol 8 A sangat
Ikatan kimia 1. Peranan Elektron dalam Pembentukan Ikatan Kimia Ikatan kimia Gaya tarik menarik antara atom sehingga atom tersebut tetap berada bersama-sama dan terkombinasi dalam senyawaan. gol 8 A sangat
PAKET UJIAN NASIONAL 7 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 7 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Dari beberapa unsur berikut yang mengandung : 1. 20
PAKET UJIAN NASIONAL 7 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Dari beberapa unsur berikut yang mengandung : 1. 20
LAMPIRAN 1. LEMBAR INSTRUMEN WAWANCARA UNTUK GURU KIMIA, DAN GURU KEPERAWATAN TENTANG RELEVANSI MATERI KIMIA TERHADAP MATERI KEPERAWATAN
 LAMPIRAN 1. LEMBAR INSTRUMEN WAWANCARA UNTUK GURU KIMIA, DAN GURU KEPERAWATAN TENTANG RELEVANSI MATERI KIMIA TERHADAP MATERI KEPERAWATAN Pertanyaan 1. Bagaimana pendapat Anda tentang relevansi (kesesuaian)
LAMPIRAN 1. LEMBAR INSTRUMEN WAWANCARA UNTUK GURU KIMIA, DAN GURU KEPERAWATAN TENTANG RELEVANSI MATERI KIMIA TERHADAP MATERI KEPERAWATAN Pertanyaan 1. Bagaimana pendapat Anda tentang relevansi (kesesuaian)
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A. D. Cu E. Zn
 1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
SOAL SELEKSI NASIONAL TAHUN 2006
 SOAL SELEKSI NASIONAL TAHUN 2006 Soal 1 ( 13 poin ) KOEFISIEN REAKSI DAN LARUTAN ELEKTROLIT Koefisien reaksi merupakan langkah penting untuk mengamati proses berlangsungnya reaksi. Lengkapi koefisien reaksi-reaksi
SOAL SELEKSI NASIONAL TAHUN 2006 Soal 1 ( 13 poin ) KOEFISIEN REAKSI DAN LARUTAN ELEKTROLIT Koefisien reaksi merupakan langkah penting untuk mengamati proses berlangsungnya reaksi. Lengkapi koefisien reaksi-reaksi
MODUL SEL ELEKTROLISIS
 MODUL SEL ELEKTROLISIS Standar Kompetensi : 2. Menerapkan konsep reaksi oksidasi-reduksi dan elektrokimia dalam teknologi dan kehidupan sehari-hari. Kompetensi dasar : 2.2. Menjelaskan reaksi oksidasi-reduksi
MODUL SEL ELEKTROLISIS Standar Kompetensi : 2. Menerapkan konsep reaksi oksidasi-reduksi dan elektrokimia dalam teknologi dan kehidupan sehari-hari. Kompetensi dasar : 2.2. Menjelaskan reaksi oksidasi-reduksi
1. Bilangan Oksidasi (b.o)
 Reaksi Redoks dan Elektrokimia 1. Bilangan Oksidasi (b.o) 1.1 Pengertian Secara sederhana, bilangan oksidasi sering disebut sebagai tingkat muatan suatu atom dalam molekul atau ion. Bilangan oksidasi bukanlah
Reaksi Redoks dan Elektrokimia 1. Bilangan Oksidasi (b.o) 1.1 Pengertian Secara sederhana, bilangan oksidasi sering disebut sebagai tingkat muatan suatu atom dalam molekul atau ion. Bilangan oksidasi bukanlah
PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53
PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53
OAL TES SEMESTER I. I. Pilihlah jawaban yang paling tepat! a. 2d d. 3p b. 2p e. 3s c. 3d 6. Unsur X dengan nomor atom
 KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
KISI UJI KOMPETENSI 2013 MATA PELAJARAN KIMIA
 KISI UJI KOMPETENSI 2013 MATA PELAJARAN KIMIA Kompetensi Menguasai karakteristik peserta Mengidentifikasi kesulitan belajar didik dari aspek fisik, moral, peserta didik dalam mata pelajaran spiritual,
KISI UJI KOMPETENSI 2013 MATA PELAJARAN KIMIA Kompetensi Menguasai karakteristik peserta Mengidentifikasi kesulitan belajar didik dari aspek fisik, moral, peserta didik dalam mata pelajaran spiritual,
 UJIAN MASUK BERSAMA (UMB) Mata Pelajaran : Kimia Tanggal : 07 Juni 009 Kode Soal : 9. Penamaan yang tepat untuk : CH CH CH CH CH CH OH CH CH adalah A. -etil-5-metil-6-heksanol B.,5-dimetil-1-heptanol C.
UJIAN MASUK BERSAMA (UMB) Mata Pelajaran : Kimia Tanggal : 07 Juni 009 Kode Soal : 9. Penamaan yang tepat untuk : CH CH CH CH CH CH OH CH CH adalah A. -etil-5-metil-6-heksanol B.,5-dimetil-1-heptanol C.
LARUTAN ELEKTROLIT DAN NONELEKTROLIT (Diskusi Informasi) INFORMASI Larutan adalah campuran yang homogen antara zat terlarut dan zat pelarut.
 LARUTAN ELEKTROLIT DAN NONELEKTROLIT (Diskusi Informasi) INFORMASI Larutan adalah campuran yang homogen antara zat terlarut dan zat pelarut. Berdasarkan daya hantar listriknya, larutan dapat digolongkan
LARUTAN ELEKTROLIT DAN NONELEKTROLIT (Diskusi Informasi) INFORMASI Larutan adalah campuran yang homogen antara zat terlarut dan zat pelarut. Berdasarkan daya hantar listriknya, larutan dapat digolongkan
UN SMA 2015 PRE Kimia
 UN SMA 2015 PRE Kimia Kode Soal Doc. UNSMAIPA2015KIM999 Doc. Version : 2015-11 halaman 1 01. Suatu unsur Z mempunyai konfigurasi elektron [Ar]4s 2 3d 7. Jika neutron unsur tersebut 32, letak unsur Z dalam
UN SMA 2015 PRE Kimia Kode Soal Doc. UNSMAIPA2015KIM999 Doc. Version : 2015-11 halaman 1 01. Suatu unsur Z mempunyai konfigurasi elektron [Ar]4s 2 3d 7. Jika neutron unsur tersebut 32, letak unsur Z dalam
PAKET UJIAN NASIONAL 11 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 11 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Unsur dengan nomor massa 45 dan mempunyai jumlah netron
PAKET UJIAN NASIONAL 11 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Unsur dengan nomor massa 45 dan mempunyai jumlah netron
PREDIKSI UJIAN NASIONAL 2011 KIMIA
 Soal PREDIKSI Latihan UJIAN NASIONAL 2011 2013 KIMIA 1 LATIHAN UJIAN AKHIR NASIONAL TAHUN AJARAN 2012/2013 KIMIA 1. Jika unsur 19 X berikatan dengan unsur 35 Z maka, rumus senyawa dan jenis ikatan yang
Soal PREDIKSI Latihan UJIAN NASIONAL 2011 2013 KIMIA 1 LATIHAN UJIAN AKHIR NASIONAL TAHUN AJARAN 2012/2013 KIMIA 1. Jika unsur 19 X berikatan dengan unsur 35 Z maka, rumus senyawa dan jenis ikatan yang
PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP FAX KODE POS 60299
 PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP. 031-8415492 FAX 031-8430673 KODE POS 60299 ULANGAN AKHIR SEMESTER 2 (DUA) TAHUN PELAJARAN 2011 2012 Hari/Tanggal :
PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP. 031-8415492 FAX 031-8430673 KODE POS 60299 ULANGAN AKHIR SEMESTER 2 (DUA) TAHUN PELAJARAN 2011 2012 Hari/Tanggal :
Lampiran 8. Dasar Pengembangan Kisi-Kisi Soal Kimia SwC Kelas XI
 Lampiran 8 Dasar Pengembangan Kisi-Kisi Kimia SwC Kelas XI 50 DASAR PENGEMBANGAN KISI-KISI SOAL KIMIA SwC KELAS XI SK-KD dalam Standar Isi, Ujian Nasional Kimia (), SNMPTN (4), UM UGM (4), UMB UNDIP (),
Lampiran 8 Dasar Pengembangan Kisi-Kisi Kimia SwC Kelas XI 50 DASAR PENGEMBANGAN KISI-KISI SOAL KIMIA SwC KELAS XI SK-KD dalam Standar Isi, Ujian Nasional Kimia (), SNMPTN (4), UM UGM (4), UMB UNDIP (),
Naskah SBMPTN 2016 Kode 208 No. 39 Soal Pengantar Siswa Medica Kimia 4P IPA/D No. 07 Naskah SBMPTN 2016 Kode 206 No. 40
 Soal Pengantar Siswa Medica Kimia 4P IPA/D No. 07 Reaksi penguraian N 2 O 5 diketahui merupakan reaksi orde 1 terhadap N 2 O 5 2N 2 O 5 4NO 2 + O 2 Jika laju awal pembentukan O 2 adalah 9 x 10-6 mol.l
Soal Pengantar Siswa Medica Kimia 4P IPA/D No. 07 Reaksi penguraian N 2 O 5 diketahui merupakan reaksi orde 1 terhadap N 2 O 5 2N 2 O 5 4NO 2 + O 2 Jika laju awal pembentukan O 2 adalah 9 x 10-6 mol.l
SOAL KIMIA 2 KELAS : XI IPA
 SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
OLIMPIADE KIMIA INDONESIA
 OLIMPIADE KIMIA INDONESIA OLIMPIADE SAINS NASIONAL SELEKSI KABUPATEN / KOTA UjianTeori Waktu 2 Jam Departemen Pendidikan Nasional Direktorat Jenderal Managemen Pendidikan Dasar dan Menengah Direktorat
OLIMPIADE KIMIA INDONESIA OLIMPIADE SAINS NASIONAL SELEKSI KABUPATEN / KOTA UjianTeori Waktu 2 Jam Departemen Pendidikan Nasional Direktorat Jenderal Managemen Pendidikan Dasar dan Menengah Direktorat
UJIAN NASIONAL TAHUN PELAJARAN 2007/2008
 UJIAN NASIONAL TAHUN PELAJARAN 2007/2008 PANDUAN MATERI SMA DAN MA K I M I A PROGRAM STUDI IPA PUSAT PENILAIAN PENDIDIKAN BALITBANG DEPDIKNAS KATA PENGANTAR Dalam rangka sosialisasi kebijakan dan persiapan
UJIAN NASIONAL TAHUN PELAJARAN 2007/2008 PANDUAN MATERI SMA DAN MA K I M I A PROGRAM STUDI IPA PUSAT PENILAIAN PENDIDIKAN BALITBANG DEPDIKNAS KATA PENGANTAR Dalam rangka sosialisasi kebijakan dan persiapan
Kegiatan Belajar 3: Sel Elektrolisis. 1. Mengamati reaksi yang terjadi di anoda dan katoda pada reaksi elektrolisis
 1 Kegiatan Belajar 3: Sel Elektrolisis Capaian Pembelajaran Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada sel elektrolisis Subcapaian pembelajaran: 1. Mengamati reaksi yang
1 Kegiatan Belajar 3: Sel Elektrolisis Capaian Pembelajaran Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada sel elektrolisis Subcapaian pembelajaran: 1. Mengamati reaksi yang
Hubungan koefisien dalam persamaan reaksi dengan hitungan
 STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
Struktur atom, dan Tabel periodik unsur,
 KISI-KISI PENULISAN USBN Jenis Sekolah : SMA/MA Mata Pelajaran : KIMIA Kurikulum : 2006 Alokasi Waktu : 120 menit Jumlah : Pilihan Ganda : 35 Essay : 5 1 2 3 1.1. Memahami struktur atom berdasarkan teori
KISI-KISI PENULISAN USBN Jenis Sekolah : SMA/MA Mata Pelajaran : KIMIA Kurikulum : 2006 Alokasi Waktu : 120 menit Jumlah : Pilihan Ganda : 35 Essay : 5 1 2 3 1.1. Memahami struktur atom berdasarkan teori
UN SMA 2012 IPA Kimia
 UN SMA 2012 IPA Kimia Kode Soal Doc. Name: UNSMAIPA2011KIM999 Doc. Version : 2012-12 halaman 1 01. Tahap awal pembuatan asam nitrat dalam industri melibatkan reaksi oksidasi ammonia yang menghasilkan nitrogen
UN SMA 2012 IPA Kimia Kode Soal Doc. Name: UNSMAIPA2011KIM999 Doc. Version : 2012-12 halaman 1 01. Tahap awal pembuatan asam nitrat dalam industri melibatkan reaksi oksidasi ammonia yang menghasilkan nitrogen
BAB VI KINETIKA REAKSI KIMIA
 BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
Soal ini terdiri dari 10 soal Essay (153 poin)
 Bidang Studi Kode Berkas : Kimia : KI-L01 (soal) Soal ini terdiri dari 10 soal Essay (153 poin) Tetapan Avogadro N A = 6,022 10 23 partikel.mol 1 Tetapan Gas Universal R = 8,3145 J.mol -1.K -1 = 0,08206
Bidang Studi Kode Berkas : Kimia : KI-L01 (soal) Soal ini terdiri dari 10 soal Essay (153 poin) Tetapan Avogadro N A = 6,022 10 23 partikel.mol 1 Tetapan Gas Universal R = 8,3145 J.mol -1.K -1 = 0,08206
OAL TES SEMESTER II. I. Pilihlah jawaban yang paling tepat!
 KIMIA XI SMA 217 S OAL TES SEMESTER II I. Pilihlah jawaban yang paling tepat! 1. Basa menurut Arhenius adalah senyawa yang bila dilarutkan dalam air akan menghasilkan a. proton d. ion H b. elektron e.
KIMIA XI SMA 217 S OAL TES SEMESTER II I. Pilihlah jawaban yang paling tepat! 1. Basa menurut Arhenius adalah senyawa yang bila dilarutkan dalam air akan menghasilkan a. proton d. ion H b. elektron e.
TES AWAL II KIMIA DASAR II (KI-112)
 TES AWAL II KIMIA DASAR II (KI112) NAMA : Tanda Tangan N I M : JURUSAN :... BERBAGAI DATA. Tetapan gas R = 0,082 L atm mol 1 K 1 = 1,987 kal mol 1 K 1 = 8,314 J mol 1 K 1 Tetapan Avogadro = 6,023 x 10
TES AWAL II KIMIA DASAR II (KI112) NAMA : Tanda Tangan N I M : JURUSAN :... BERBAGAI DATA. Tetapan gas R = 0,082 L atm mol 1 K 1 = 1,987 kal mol 1 K 1 = 8,314 J mol 1 K 1 Tetapan Avogadro = 6,023 x 10
OLIMPIADE KIMIA INDONESIA
 OLIMPIADE KIMIA INDONESIA OLIMPIADE SAINS NASIONAL SELEKSI KABUPATEN / KOTA UjianTeori Waktu 2 Jam Departemen Pendidikan Nasional Direktorat Jenderal Managemen Pendidikan Dasar dan Menengah Direktorat
OLIMPIADE KIMIA INDONESIA OLIMPIADE SAINS NASIONAL SELEKSI KABUPATEN / KOTA UjianTeori Waktu 2 Jam Departemen Pendidikan Nasional Direktorat Jenderal Managemen Pendidikan Dasar dan Menengah Direktorat
LEMBARAN SOAL 5. Pilih satu jawaban yang benar!
 LEMBARAN SOAL 5 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
LEMBARAN SOAL 5 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
Doc. Name: UNSMAIPA999KIM304 Doc. Version : (A) +2 (B) +3 (C) +4 (D) +5 (E) +7
 UN SA IPA Kimia Kode Soal 304 Doc. Name: UNSAIPA999KI304 Doc. Version : 2012-12 halaman 1 01. Perhatikan perubahan berikut : 1) petasan meledak 2) garaam melarut 3) kayu melapuk 4) susu menjadi asam 5)
UN SA IPA Kimia Kode Soal 304 Doc. Name: UNSAIPA999KI304 Doc. Version : 2012-12 halaman 1 01. Perhatikan perubahan berikut : 1) petasan meledak 2) garaam melarut 3) kayu melapuk 4) susu menjadi asam 5)
REDOKS dan ELEKTROKIMIA
 REDOKS dan ELEKTROKIMIA Overview Konsep termodinamika tidak hanya berhubungan dengan mesin uap, atau transfer energi berupa kalor dan kerja Dalam konteks kehidupan sehari-hari aplikasinya sangat luas mulai
REDOKS dan ELEKTROKIMIA Overview Konsep termodinamika tidak hanya berhubungan dengan mesin uap, atau transfer energi berupa kalor dan kerja Dalam konteks kehidupan sehari-hari aplikasinya sangat luas mulai
contoh-contoh sifat Pengertian sifat kimia perubahan fisika perubahan kimia ciri-ciri reaksi kimia percobaan materi
 MATA DIKLAT : KIMIA TUJUAN : 1. Mengembangkan pengetahuan, pemahaman dan kemampuan analisis peserta didik terhadap lingkungan, alam dan sekitarnya. 2. Siswa memiliki pemahaman dan kemampuan untuk menunjang
MATA DIKLAT : KIMIA TUJUAN : 1. Mengembangkan pengetahuan, pemahaman dan kemampuan analisis peserta didik terhadap lingkungan, alam dan sekitarnya. 2. Siswa memiliki pemahaman dan kemampuan untuk menunjang
KISI-KISI PENULISAN SOAL USBN
 KISI-KISI PENULISAN USBN Jenis Sekolah : SMA/MA Mata Pelajaran : KIMIA Kurikulum : 2013 Alokasi Waktu : 120 menit Jumlah : Pilihan Ganda : 35 Essay : 5 1 2 3 4 3.4 Menganalisis hubungan konfigurasi elektron
KISI-KISI PENULISAN USBN Jenis Sekolah : SMA/MA Mata Pelajaran : KIMIA Kurikulum : 2013 Alokasi Waktu : 120 menit Jumlah : Pilihan Ganda : 35 Essay : 5 1 2 3 4 3.4 Menganalisis hubungan konfigurasi elektron
 TRY OUT SELEKSI OLIMPIADE TINGKAT KABUPATEN/KOTA 2010 TIM OLIMPIADE KIMIA INDONESIA 2011 Waktu: 150 Menit PUSAT KLINIK PENDIDIKAN INDONESIA (PKPI) bekerjasama dengan LEMBAGA BIMBINGAN BELAJAR SSCIntersolusi
TRY OUT SELEKSI OLIMPIADE TINGKAT KABUPATEN/KOTA 2010 TIM OLIMPIADE KIMIA INDONESIA 2011 Waktu: 150 Menit PUSAT KLINIK PENDIDIKAN INDONESIA (PKPI) bekerjasama dengan LEMBAGA BIMBINGAN BELAJAR SSCIntersolusi
Soal-soal Redoks dan elektrokimia
 1. Reaksi redoks : MnO 4 (aq) + C 2 O 4 2- (aq) Mn 2+ (aq) + CO 2 (g), berlangsung dalam suasana asam. Setiap mol MnO 4 memerlukan H + sebanyak A. 4 mol B. 6 mol D. 10 mol C. 8 mol E. 12 mol 2. Reaksi
1. Reaksi redoks : MnO 4 (aq) + C 2 O 4 2- (aq) Mn 2+ (aq) + CO 2 (g), berlangsung dalam suasana asam. Setiap mol MnO 4 memerlukan H + sebanyak A. 4 mol B. 6 mol D. 10 mol C. 8 mol E. 12 mol 2. Reaksi
PAKET UJIAN NASIONAL 14 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASINAL 14 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
PAKET UJIAN NASINAL 14 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
REDOKS DAN ELEKTROKIMIA
 REDOKS DAN ELEKTROKIMIA 1. Bilangan oksidasi dari unsur Mn pada senyawa KMnO4 adalah... A. +7 B. +6 C. +3 D. +2 E. +1 Jumlah bilangan oksidasi senyawa adalah nol, Kalium (K) mempunyai biloks +1 karena
REDOKS DAN ELEKTROKIMIA 1. Bilangan oksidasi dari unsur Mn pada senyawa KMnO4 adalah... A. +7 B. +6 C. +3 D. +2 E. +1 Jumlah bilangan oksidasi senyawa adalah nol, Kalium (K) mempunyai biloks +1 karena
11. Mata Pelajaran Kimia Untuk Paket C Program IPA
 11. Mata Pelajaran Kimia Untuk Paket C Program IPA A. Latar Belakang Ilmu Pengetahuan Alam (IPA) berkaitan dengan cara mencari tahu tentang gejala alam secara sistematis, sehingga pendidikan IPA bukan
11. Mata Pelajaran Kimia Untuk Paket C Program IPA A. Latar Belakang Ilmu Pengetahuan Alam (IPA) berkaitan dengan cara mencari tahu tentang gejala alam secara sistematis, sehingga pendidikan IPA bukan
1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat!
 Petunjuk : 1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat! 2. Soal Teori ini terdiri dari dua bagian: A. 30 soal pilihan Ganda : 60 poin B. 5 Nomor
Petunjuk : 1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat! 2. Soal Teori ini terdiri dari dua bagian: A. 30 soal pilihan Ganda : 60 poin B. 5 Nomor
LOGO. Stoikiometri. Tim Dosen Pengampu MK. Kimia Dasar
 LOGO Stoikiometri Tim Dosen Pengampu MK. Kimia Dasar Konsep Mol Satuan jumlah zat dalam ilmu kimia disebut mol. 1 mol zat mengandung jumlah partikel yang sama dengan jumlah partikel dalam 12 gram C 12,
LOGO Stoikiometri Tim Dosen Pengampu MK. Kimia Dasar Konsep Mol Satuan jumlah zat dalam ilmu kimia disebut mol. 1 mol zat mengandung jumlah partikel yang sama dengan jumlah partikel dalam 12 gram C 12,
Persiapan UN 2018 KIMIA
 Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
Kelarutan (s) dan Hasil Kali Kelarutan (Ksp)
 Kelarutan (s) dan Hasil Kali Kelarutan (Ksp) Tim Dosen Kimia Dasar FTP UNIVERSITAS BRAWIJAYA Kelarutan (s) Kelarutan (solubility) adalah jumlah maksimum suatu zat yang dapat larut dalam suatu pelarut.
Kelarutan (s) dan Hasil Kali Kelarutan (Ksp) Tim Dosen Kimia Dasar FTP UNIVERSITAS BRAWIJAYA Kelarutan (s) Kelarutan (solubility) adalah jumlah maksimum suatu zat yang dapat larut dalam suatu pelarut.
UN SMA IPA Kimia. Kode Soal 305
 UN SMA IPA Kimia Kode Soal 305 Doc.name : UNSMAIPAKIM305 Version : 2012-12 halaman 1 1. Di antara hal-hal di bawah ini : 1. besi berpilar 2. pagar di cat 3. belerang meleleh 4. nasi jadi basi 5. bel berdering
UN SMA IPA Kimia Kode Soal 305 Doc.name : UNSMAIPAKIM305 Version : 2012-12 halaman 1 1. Di antara hal-hal di bawah ini : 1. besi berpilar 2. pagar di cat 3. belerang meleleh 4. nasi jadi basi 5. bel berdering
D. beta dan alfa E. alfa dan beta
 1. Pada peluruhan menjadi kemudian meluruh menjadi, partikel-partikel yang dipancarkan berturut-turut adalah... A. foton dan beta B. foton dan alfa C. beta dan foton Reaksi peluruhan : D. beta dan alfa
1. Pada peluruhan menjadi kemudian meluruh menjadi, partikel-partikel yang dipancarkan berturut-turut adalah... A. foton dan beta B. foton dan alfa C. beta dan foton Reaksi peluruhan : D. beta dan alfa
L A R U T A N _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA
 L A R U T A N _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA 1. Larutan Elektrolit 2. Persamaan Ionik 3. Reaksi Asam Basa 4. Perlakuan Larutan
L A R U T A N _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA 1. Larutan Elektrolit 2. Persamaan Ionik 3. Reaksi Asam Basa 4. Perlakuan Larutan
SAP-GARIS-GARIS BESAR PROGRAM PENGAJARAN
 SAP-GARIS-GARIS BESAR PROGRAM PENGAJARAN Mata kuliah : Kimia Kode : Kim 101/3(2-3) Deskripsi : Mata kuliah ini membahas konsep-konsep dasar kimia yang disampaikan secara sederhana, meliputi pengertian
SAP-GARIS-GARIS BESAR PROGRAM PENGAJARAN Mata kuliah : Kimia Kode : Kim 101/3(2-3) Deskripsi : Mata kuliah ini membahas konsep-konsep dasar kimia yang disampaikan secara sederhana, meliputi pengertian
Siswa diingatkan tentang struktur atom, bilangan kuantum, bentuk-bentuk orbital, dan konfigurasi elektron
 RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
1s 2 2s 2 2p 6 3s 2 2p 6 3d 4s 1 4p 4d 4f 5s 5p 5d 5f
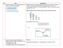 NO SOAL PEMBAHASAN 1 Konfigurasi elekttron ion X - yang memiliki nomor massa 39 dan 21 neutron adalah.. A. 1s2 2s2 2p6 3s2 3p6 4s2 3d1 B. 1s2 2s2 2p6 3s2 3p6 4s1 C. 1s2 2s2 2p6 3s2 3p6 3d1 D. 1s2 2s2 2p6
NO SOAL PEMBAHASAN 1 Konfigurasi elekttron ion X - yang memiliki nomor massa 39 dan 21 neutron adalah.. A. 1s2 2s2 2p6 3s2 3p6 4s2 3d1 B. 1s2 2s2 2p6 3s2 3p6 4s1 C. 1s2 2s2 2p6 3s2 3p6 3d1 D. 1s2 2s2 2p6
Soal-Soal. Bab 7. Latihan Larutan Penyangga, Hidrolisis Garam, serta Kelarutan dan Hasil Kali Kelarutan. Larutan Penyangga
 Bab 7 Soal-Soal Latihan Larutan Penyangga, Hidrolisis Garam, serta Kelarutan dan Hasil Kali Kelarutan Larutan Penyangga 1. Berikut ini yang merupakan pasangan asam basa terkonjugasi (A) H 3 O + dan OH
Bab 7 Soal-Soal Latihan Larutan Penyangga, Hidrolisis Garam, serta Kelarutan dan Hasil Kali Kelarutan Larutan Penyangga 1. Berikut ini yang merupakan pasangan asam basa terkonjugasi (A) H 3 O + dan OH
UNIVERSITAS NEGERI YOGYAKARTA F A K U L T A S M I P A
 RPP/KIC202/01 2. Mata Kuliah & Kode : Kimia Dasar 2 Kode : KIC 202 5 Kompetensi Dasar : Mahasiswa mampu menjelaskan sifat-sifat larutan mencakup derajat keasaman, terjadinya hidrolisis dan larutan buffer,
RPP/KIC202/01 2. Mata Kuliah & Kode : Kimia Dasar 2 Kode : KIC 202 5 Kompetensi Dasar : Mahasiswa mampu menjelaskan sifat-sifat larutan mencakup derajat keasaman, terjadinya hidrolisis dan larutan buffer,
HASIL ANALISIS KEBENARAN KONSEP PADA OBJEK PENELITIAN. Penjelasan Konsep
 LAMPIRAN 7 HASIL ANALISIS KEBENARAN KONSEP PADA OBJEK PENELITIAN Keterangan kriteria kebenaran konsep Benar (B) Salah (S) Indikator Pembelajaran : Jika penjelasan konsep subjek penelitian sesuai dengan
LAMPIRAN 7 HASIL ANALISIS KEBENARAN KONSEP PADA OBJEK PENELITIAN Keterangan kriteria kebenaran konsep Benar (B) Salah (S) Indikator Pembelajaran : Jika penjelasan konsep subjek penelitian sesuai dengan
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL. UjianTeori. Waktu: 100 menit
 OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
D. 50 E. 64. D. -1,40 kj E. -2,80 kj
 1. Atom-atom unsur tertentu mempunyai 16 elektron. Atom atom unsur lain dengan sifat-sifat yang mirip adalah yang mempunyai jumlah elektron : A. 10 B. 24 C. 34 D. 50 E. 64 Bila suatu atom mempunyai 16
1. Atom-atom unsur tertentu mempunyai 16 elektron. Atom atom unsur lain dengan sifat-sifat yang mirip adalah yang mempunyai jumlah elektron : A. 10 B. 24 C. 34 D. 50 E. 64 Bila suatu atom mempunyai 16
54. Mata Pelajaran Kimia untuk Sekolah Menengah Atas (SMA)/Madrasah Aliyah (MA) A. Latar Belakang Ilmu Pengetahuan Alam (IPA) berkaitan dengan cara
 54. Mata Pelajaran Kimia untuk Sekolah Menengah Atas (SMA)/Madrasah Aliyah (MA) A. Latar Belakang Ilmu Pengetahuan Alam (IPA) berkaitan dengan cara mencari tahu tentang gejala alam secara sistematis, sehingga
54. Mata Pelajaran Kimia untuk Sekolah Menengah Atas (SMA)/Madrasah Aliyah (MA) A. Latar Belakang Ilmu Pengetahuan Alam (IPA) berkaitan dengan cara mencari tahu tentang gejala alam secara sistematis, sehingga
Bab 4 KELARUTAN DAN HASIL KALI KELARUTAN
 Bab 4 KELARUTAN DAN HASIL KALI KELARUTAN Apa yang terjadi pada saat gula dilarutkan ke dalam air, mengapa bila gula yang dilarutkan dalam jumlah banyak tidak dapat terlarut semua? Mengapa gula tidak bisa
Bab 4 KELARUTAN DAN HASIL KALI KELARUTAN Apa yang terjadi pada saat gula dilarutkan ke dalam air, mengapa bila gula yang dilarutkan dalam jumlah banyak tidak dapat terlarut semua? Mengapa gula tidak bisa
KISI KISI SOAL UJIAN SEKOLAH SMK SE-KABUPATEN CIAMIS TP. 2013/2014
 Mata Pelajaran : KIMIA KISI KISI UJIAN SEKOLAH SMK SE-KABUPATEN CIAMIS TP. 2013/2014 TINGKAT 1 Memahami konsep materi dan perubahannya Pengertian perubahan Kimia dan Fisika dijelaskan melalui contoh-contoh
Mata Pelajaran : KIMIA KISI KISI UJIAN SEKOLAH SMK SE-KABUPATEN CIAMIS TP. 2013/2014 TINGKAT 1 Memahami konsep materi dan perubahannya Pengertian perubahan Kimia dan Fisika dijelaskan melalui contoh-contoh
ELEKTROKIMIA Reaksi Reduksi - Oksidasi
 Jurusan Kimia - FMIPA Universitas Gadjah Mada (UGM) ELEKTROKIMIA Reaksi Reduksi - Oksidasi Drs. Iqmal Tahir, M.Si. Laboratorium Kimia Fisika,, Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam
Jurusan Kimia - FMIPA Universitas Gadjah Mada (UGM) ELEKTROKIMIA Reaksi Reduksi - Oksidasi Drs. Iqmal Tahir, M.Si. Laboratorium Kimia Fisika,, Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam
RENCANA PELAKSANAAN PEMBELAJARAN
 RENCANA PELAKSANAAN PEMBELAJARAN Mata Pelajaran : Kimia Kelas/Semester : XI/1 Pertemuan ke : 1 Alokasi Waktu : 2 x 45 menit Standar Kompetensi : Memahami konsep kesetimbangan reaksi Kompetensi Dasar :
RENCANA PELAKSANAAN PEMBELAJARAN Mata Pelajaran : Kimia Kelas/Semester : XI/1 Pertemuan ke : 1 Alokasi Waktu : 2 x 45 menit Standar Kompetensi : Memahami konsep kesetimbangan reaksi Kompetensi Dasar :
ELEKTROKIMIA. VURI AYU SETYOWATI, S.T., M.Sc TEKNIK MESIN - ITATS
 ELEKTROKIMIA VURI AYU SETYOWATI, S.T., M.Sc TEKNIK MESIN - ITATS ELEKTROKIMIA Elektrokimia merupakan ilmu yang mempelajari hubungan antara perubahan (reaksi) kimia dengan kerja listrik, biasanya melibatkan
ELEKTROKIMIA VURI AYU SETYOWATI, S.T., M.Sc TEKNIK MESIN - ITATS ELEKTROKIMIA Elektrokimia merupakan ilmu yang mempelajari hubungan antara perubahan (reaksi) kimia dengan kerja listrik, biasanya melibatkan
UN SMA 2012 IPA Kimia
 UN SMA 0 IPA Kimia Kode Konten Doc. UNSMAIPA0KIM999 Doc. Version : 0- halaman 0. Dua buah unsur dengan notasi 7X dan Y. Jika unsur-unsur tersebut berikatan, bentuk molekul dan kepolaran yang terjadi berturutturut
UN SMA 0 IPA Kimia Kode Konten Doc. UNSMAIPA0KIM999 Doc. Version : 0- halaman 0. Dua buah unsur dengan notasi 7X dan Y. Jika unsur-unsur tersebut berikatan, bentuk molekul dan kepolaran yang terjadi berturutturut
Volume gas oksigen yang diperlukan pada reaksi tersebut pada keadaan standart adalah. (Mr propana = 44)
 1. Suatu unsut terletak pada periode ke-3 golongan IIIA, konfigurasi elektron unsur tersebut adalah... A. 1s 2 2s 2 2p 1 B. 1s 2 2s 2 2p 6 3s 2 C. 1s 2 2s 2 2p 6 3s 2 3p 1 D. 1s 2 2s 2 2p 6 3d 10 4s 2
1. Suatu unsut terletak pada periode ke-3 golongan IIIA, konfigurasi elektron unsur tersebut adalah... A. 1s 2 2s 2 2p 1 B. 1s 2 2s 2 2p 6 3s 2 C. 1s 2 2s 2 2p 6 3s 2 3p 1 D. 1s 2 2s 2 2p 6 3d 10 4s 2
SIMULASI UJIAN NASIONAL 1
 SIMULASI UJIAN NASIONAL 1 1. Bilangan-bilangan kuantum yang mungkin dimiliki oleh suatu elektron (A) n = 2, l = 2, m = 0, s = - 1 2 (B) n = 3, l = 0, m = +1, s = + 1 2 (C) n = 4, l = 2, m = - 3, s = -
SIMULASI UJIAN NASIONAL 1 1. Bilangan-bilangan kuantum yang mungkin dimiliki oleh suatu elektron (A) n = 2, l = 2, m = 0, s = - 1 2 (B) n = 3, l = 0, m = +1, s = + 1 2 (C) n = 4, l = 2, m = - 3, s = -
PAKET UJIAN NASIONAL 9 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 9 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Isotop terdiri dari A. 13 proton, 14 elektron dan 27
PAKET UJIAN NASIONAL 9 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Isotop terdiri dari A. 13 proton, 14 elektron dan 27
