AMALDO FIRJARAHADI TANE
|
|
|
- Doddy Tanuwidjaja
- 8 tahun lalu
- Tontonan:
Transkripsi
1 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1
2 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Y memiliki nomor atom 17. Ingat, bahwa jumlah neutron suatu unsur dan ionnya bernilai sama, yang membedakannya hanyalah nomor atom (Z) atau jumlah proton atau jumlah elektron. Ion Y - punya 18 elektron dalam bentuk anion (ion negatif) karena suatu unsur dalam bentuk ion negatif menangkap elektron sebanyak faktor valensi yang ditangkapnya. Ada sebuah elektron yang ditangkap dari unsur Y. Jadi, konfigurasi elektron ion Y - kelebihan 1 elektron pada subkulit terakhirnya (terluar): 17 Y = 1s 2 2s 2 2p 6 3s 2 3p 5 17 Y - = 1s 2 2s 2 2p 6 3s 2 3p 6 JAWABAN: C MATERI: KIMIA ORGANIK Dalam senyawa organik untuk membentuk suatu orbital hibrida dibentuk oleh dua buah ikatan kimia, yaitu ikatan sigma (σ) dan ikatan pi (π). Materi ini biasanya ada di bagian stereokimia kimia organik. Ikatan sigma adalah ikatan kimia yang paling sering terdapat pada atom senyawa organik berikatan tunggal. Biasanya berbentuk tetrahedral (AX 4 ) dengan sudut 109,5. Ikatan ini terbentuk akibat tumpang tindih orbital-orbital di sekelilingnya sehingga jika ditinjau akan tergambar secara horizontal seperti pada gambar di samping. PEMBAHASAN SBMPTN KIMIA 2017 Page 2
3 Berbeda dengan ikatan pi, yaitu ikatan kimia kovalen yang dua cuping orbital atom yang berlektron tunggal bertumpang tindih dengan dua cuping orbital atom lainnya yang juga berelektron tunggal. Hanya terdapat satu bidang simpul dari orbital yang melewati dua inti atom. Pada gambar di samping, ikatan pi memiliki bidang tegak lurus dengan atom yang terikat sehingga tergambarkan secara vertikal. Gambar di bawah ini menunjukkan pecahan struktur pada soal: Pada strukturnya, atom N berikatan rangkap dengan atom C serta berikatan tunggal atom C lainnya, dan menghasilkan ikatan rangkap, maka atom N butuh sebuah ikatan sigma dan sebuah ikatan pi. Orbital hibrida N yang terikat dengan atom C digambarkan di bawah ini. Sebelum terjadi hibridisasi (pembastaran), atom 7 N berada pada keadaan dasar (konfigurasi biasa), namun setelah berikatan dengan atom C lainnya maka terjadi hibridisasi tingkat lanjut (tereksitasi) sehingga orbital kosong pada 7 N tempat melekatnya atom-atom lain dan sebuah ikatan rangkap. Warna merah menunjukkan tempat melekatnya atom C ikatan tunggal, warna biru tempat melekatnya atom C ikatan rangkap, dan warna hijau menandakan adanya ikatan rangkap pada pembastarannya. Dikarenakan pada pembastaran di atas terikat pada sebuah subkulit s dan dua buah subkulit p (yaitu p x dan p y ), maka tipe hibridisasinya adalah sp 2. JAWABAN: D PEMBAHASAN SBMPTN KIMIA 2017 Page 3
4 3. MATERI: STOIKIOMETRI Di soal diketahui dan ditanya data: Massa O 2 = 9,6 gram Massa M 2 O = 28,4 gram A r M =? Untuk mendapatkan nilai massa atom relatif M bisa didapatkan dari konsep mol, yaitu membagi massa M 2 O yang terbentuk dengan mol M 2 O yang terbentuk, lalu nanti dicari lagi dengan konsep massa molekul relatif (M r ). Nilai M r senyawa M 2 O bisa kita dapatkan dengan reaksi stoikiometri setara di bawah ini, lalu membandingkan koefisiennya: 2M 2 S (s) + 3O 2 (g) 2M 2 O (s) + 2SO 2 (g) Mol O 2 = 9,6 gram/32 = 0,3 mol Mol M 2 O (ditanya) = koefisien M 2 O (ditanya) x mol O 2 (diketahui) koefisien O 2 (diketahui) = 2 x 0,3 mol 3 = 0,2 mol M 2 O Dalam 28,4 gram senyawa M 2 O dengan jumlah mol 0,2 mol bisa dipastikan dengan konsep mol bahwa massa molekul relatif (M r ) senyawa tersebut adalah 142 sehingga nilai A r M adalah: M r M 2 O = 2 (A r M) + A r O 142 = 2 (A r M) + 16 A r M = 63 Dalam tabel periodik, unsur M yang dimaksud adalah unsur Cu. JAWABAN: D PEMBAHASAN SBMPTN KIMIA 2017 Page 4
5 4. MATERI: STOIKIOMETRI Di soal diketahui dan ditanya data: Volume LiOH = 5 ml [LiOH] = 0,1 M Volume HCl = 5 ml [HCl] = 0,15 M [HCl] akhir = M? Untuk mendapatkan konsentrasi asam klorida setelah reaksi, kita dapat menggunakan konsep MBS (Mula-mula, Bereaksi, Sisa). Nantinya pasti ada senyawa bagian reaktan yang bertindak sebagai pereaksi pembatas. Perhatikan skema reaksi berikut! n LiOH = 5 ml x 0,1 M = 0,5 mmol n HCl = 5 ml x 0,15 M = 0,75 mmol LiOH (aq) + HCl (aq) LiCl (aq) + H 2 O (l) M 0,5 mmol 0,75 mmol - - B -0,5 mmol -0,5 mmol +0,5 mmol +0,5 mmol S - 0,25 mmol 0,5 mmol 0,5 mmol Tersisa sebanyak 0,25 mmol HCl pada label S, sehingga banyaknya konsentrasi asam klorida setelah reaksi adalah konsentrasi dalam volume total reaktan yang digunakan: [HCl] akhir = n HCl akhir. volume reaktan = 0,25 mmol. (5 + 5) ml = 0,025 M JAWABAN: A PEMBAHASAN SBMPTN KIMIA 2017 Page 5
6 5. MATERI: STOIKIOMETRI Di soal diketahui dan ditanya data: Jenis tabung = isokhorik (volume tetap) dan isotermis (suhu tetap) m H 2 = 6 gram P o = 12 atm P 1 = 40 atm Massa gas total = gram? Gas yang dimaksud di soal mungkin adalah jenis gas ideal. Berdasarkan persamaannya di bawah ini, nilai V adalah konstan sehingga bisa dihilangkan, begitu juga dengan nilai R karena sebuah tetapan, dan nilai T juga konstan karena suhu pada soal tidak berubah sehingga disebut juga kondisi isotermis. PV = nrt P = n Tekanan = jumlah mol Perbandingan tekanannya bukanlah tekanan awal dan akhir (tekanan total), tetapi perbandingan tekanan sebelum di tambah gas Ne dan saat tekanan setelah ditambah gas Ne atau dengan kata lain tekanan masing-masing gas. Tekanan total = tekanan awal + tekanan akhir 40 atm = 12 atm + tekanan akhir Tekanan akhir = tekanan gas Ne = 28 atm Cukup perbandingan antara tekanan banding mol, yang nantinya didapatkan massa gas Ne yang ditambahkan, sebagai berikut. P o gas H 2 = n H 2 P t gas Ne n Ne 12 atm = 6 gram/2 n Ne = 7 mol 28 atm n Ne Dalam 7 mol gas Ne (A r = 20) terdapat massanya 140 gram Jadi, massa gas totalnya adalah 140 gram (Ne) + 6 gram (H 2 ) atau 146 gram JAWABAN: D PEMBAHASAN SBMPTN KIMIA 2017 Page 6
7 6. MATERI: TERMOKIMIA Di soal diketahui dan ditanya data: m LiCl = 4,25 gram Volume H 2 O = 365,75 ml ΔH h = -37 kj/mol ΔT = (27,5 25) C = 2,5 C c LiCl = J/g. C? Di soal tertera bahwa kalorimeter sederhana tersebut kapasitas kalornya diabaikan, artinya kalorimeter tersebut berjenis kalorimeter yang terbuat dari styrofoam dengan kondisi isobarik. Jenis kalorimeter ini nilai kalor kalorimeter (q kal ) dianggap nol karena tidak menyerap panas. Besarnya harga entalpi bisa ΔH h dianggap sama dengan negatif kalor larutan (q lar ): ΔH f = - (q lar + q kal ) ΔH f = - (q lar + 0) ΔH f = - q lar = - (m lar. c lar. ΔT) Nilai entalpi pelarutan LiCl bernilai -37 kj untul 1 mol LiCl, namun kita memerlukan ΔH h LiCl untuk 4,25 gram! n LiCl = 4,25 gram/42,5 = 0,1 mol ΔH h LiCl (1) = n LiCl (1) ΔH h LiCl (2) n LiCl (2) -37 kj = 1 mol x 0,1 mol x = -3,7 kj = J Cari nilai kalor jenis LiCl! Massa larutan pada persamaan kimia di atas adalah massa air yang bisa didapatkan dari massa jenis (ρ) air: ρ = massa air volume air 1 g/ml = massa air/365,75 ml m lar = 365,75 gram PEMBAHASAN SBMPTN KIMIA 2017 Page 7
8 7. ΔH h = - q lar = - (m lar. c lar. ΔT) J = - (365,75 gram. c lar. (2,5 C)) c lar = 4,0 J/g. C (pembulatan) JAWABAN: D MATERI: LAJU & ORDE REAKSI DAN PELURUHAN RADIOAKTIF Soal ini bisa dikerjakan 2 buah cara. Pertama, dengan konsep laju dan orde reaksi satu; dengan bantuan kalkulator. Kedua, dengan konsep peluruhan radioaktif; tanpa kalkulator. Ingat, bahwa peluruhan radioaktif tergolong laju reaksi orde satu karena hanya bergantung pada jumlah nuklida radioaktif yang bereaksi. CARA 1 (Konsep laju dan orde reaksi): 1) Dalam laju reaksi orde satu dikenal persamaan kimia yang didapatkan dari pengintegralan matematis hingga akhirnya didapatkan rumus di bawah ini. Nah, penjabaran lengkap dari mana rumus ini berasal bisa kalian cari di internet, ya. In [A] t = In [A] 0 kt (persamaan a) t 1/2 = In 2 (persamaan b) k 2) Dari persamaan (b) di atas kita sudah dapat mencari nilai waktu paruh (t 1/2 ) senyawa Ni(CO) 4, dengan mencari terlebih dahulu nilai k (tetapan laju reaksi) pada persamaan (a) sebagai berikut. (In dibaca logaritma natural) In [A] t = In [A] 0 kt kt = In [A] 0 In [A] t kt = In [A 0 /A t ] k.(1,5 jam) = In [0,8/0,025] 1,5k = In [32] Nilai In 32 sekitar 3,466 1,5k = 3,466 k = 2,310 3) Cari nilai waktu paruh senyawa Ni(CO) 4! t 1/2 = In 2 Nilai In 2 sekitar 0,693 k t 1/2 = 0,693 = 0,3 jam = 18 menit. 2,310 PEMBAHASAN SBMPTN KIMIA 2017 Page 8
9 8. CARA 2 (Konsep peluruhan radioaktif): 1) Persamaan kimia peluruhan radioaktif adalah sebagai berikut. (N t /N 0 ) = (1/2) t/t1/2 dengan, N t = massa zat akhir N 0 = massa zat awal t = waktu awal reaksi t 1/2 = waktu paruh 2) Cari nilai waktu paruh senyawa Ni(CO) 4! (N t /N 0 ) = (1/2) t/t1/2 JAWABAN: E (0,025/0,8) = (1/2) (1/32) = (1/2) t 1/2 = 0,3 jam = 18 menit 1,5 jam/t/12 1,5 jam/t1/2 MATERI: KESETIMBANGAN KIMIA Dalam tabung tertutup bevolume 1 L terjadi reaksi seperti pada soal dengan komposisi konsentrasi masing-masing zat diketahui saat kesetimbangan. Nah, dari sini kita bisa mendapatkan jumlah mol masing-masing zat sebagai berikut. [O 3 ]= [O 2 ] = n (O 3 dan O 2 ) volume (L) 1 M = n (O 3 dan O 2 ) 1 L n (O 3 dan O 2 ) = 1 mol Untuk mencari ke arah mana sistem kesetimbangan bergeser, kita dapat mencari data tetapan kesetimbangan kedua (Q c ). Nanti data Q c ini dibandingkan dengan data K c reaksi kesetimbangan awal, yaitu: 1) Jika Q c < K c reaksi bergeser ke arah kanan 2) Jika Q c = K c reaksi tidak bergeser PEMBAHASAN SBMPTN KIMIA 2017 Page 9
10 3) Jika Q c > K c reaksi bergeser ke arah kiri Cari dahulu nilai K c awal reaksi! K c = [O 2 ] 3. [O 3 ] 2 = [1] 3. [1] 2 = 1 Nah, mari kita periksa seluruh obsein! a) Tidak bergeser jika ditambahkan 1 mol O 3 dan 1 mol O 2 n O 3 (penambahan) = 1 mol + 1 mol = 2 mol n O 2 (penambahan) = 1 mol + 1 mol = 2 mol Q c = [O 2 ] 3. [O 3 ] 2 = [2] 3. [2] 2 = 2 Q c > K c, jadi reaksi bergeser ke kiri. (SALAH) b) Bergeser ke kanan jika ditambahkan 1 mol O 3 dan 1 mol O 2 n O 3 (penambahan) = 1 mol + 1 mol = 2 mol n O 2 (penambahan) = 1 mol + 1 mol = 2 mol Q c = [O 2 ] 3. [O 3 ] 2 = [2] 3. [2] 2 = 2 Q c > K c, jadi reaksi bergeser ke kiri. (SALAH) c) Bergeser ke kiri jika ditambahkan 1 mol O 3 dan 1 mol O 2 n O 3 (penambahan) = 1 mol + 1 mol = 2 mol n O 2 (penambahan) = 1 mol + 1 mol = 2 mol Q c = [O 2 ] 3. [O 3 ] 2 = [2] 3. [2] 2 = 2 Q c > K c, jadi reaksi bergeser ke kiri. (BENAR) d) Bergeser ke kiri jika ditambahkan 2 mol O 3 dan 1 mol O 2 n O 3 (penambahan) = 1 mol + 2 mol = 3 mol n O 2 (penambahan) = 1 mol + 1 mol = 2 mol PEMBAHASAN SBMPTN KIMIA 2017 Page 10
11 Q c = [O 2 ] 3. [O 3 ] 2 = [2] 3. [3] 2 = 0,89 Q c < K c, jadi reaksi bergeser ke kanan. (SALAH) e) Tidak bergeser jika ditambahkan 1 mol O 3 dan 2 mol O 2 n O 3 (penambahan) = 1 mol + 1 mol = 2 mol n O 2 (penambahan) = 1 mol + 2 mol = 3 mol Q c = [O 2 ] 3. [O 3 ] 2 = [3] 3. [2] 2 = 6,75 Q c > K c, jadi reaksi bergeser ke kiri. (SALAH) JAWABAN: C 9. MATERI: SIFAT KOLIGATIF LARUTAN Besar massa molekul relatif (M r ) senyawa L 2 X dapat dicari menggunakan persamaan kimia tekanan osmosis: Π = MRTi dengan, M = molaritas R = tetapan gas (L.atm/mol.K) T = suhu (K) i = faktor Van t Hoof Cari nilai faktor Van t Hoof! Ingat, bahwa elektrolit kuat terdisosiasi sempurna sehingga nilai derajat ionisasi (α) bernilai 1! L 2 X 2L + + 1X 2- i = 1 + (n 1)α i = 1 + (3 1)1 i = 3 (warna merah = n = banyak ion) PEMBAHASAN SBMPTN KIMIA 2017 Page 11
12 Cari nilai M r L 2 X! Π = MRTi Π = g R. T. i M r. V (ml) 4 atm = 8 gram ,082 L.atm/mol.K. ( ) K. 3 M r L 2 X ml M r L 2 X = 147,6 JAWABAN: D 10. MATERI: LARUTAN PENYANGGA (BUFFER) Di soal diketahui dan ditanya data: K a HOBr = 1 x 10-9 ph = 10 [HOBr]/[OBr - ] =? Senyawa asam hipobromit adalah senyawa asam lemah dengan rumus kimia HOBr atau HBrO. Nah, asam lemah ini dalam larutan NaOBr atau NaBrO membentuk suatu sistem larutan penyangga (buffer) karena terdiri dari komponen asam lemah HBrO dan basa konjugasi BrO - yang bersifat basa. Besarnya perbandingan [HOBr] banding [OBr - ] bisa didapatkan dari reaksi ionisasi asam hipobromit karena konsep dasar dari nilai K a atau tetapan ionisasi asam pada larutan adalah kesetimbangan kimia. HOBr (aq) H + (aq) + OBr - (aq) ph = 10 maka, [H + ] = 1 x Ingat, dalam kesetimbangan konsentrasi (K c ) yang dimasukkan adalah zat dalam fase larutan dan gas. Pada kondisi reaksi di atas, semua zat dapat dimasukkan ke dalam persamaan tetapan ionisasi asam (K a ) sebagai berikut. K a = [H + ] [OBr - ] [HOBr] 1 x 10-9 = [1 x ] [OBr - ] [HOBr] [HOBr]/[BrO - ] = 1 x 10-1 JAWABAN: D PEMBAHASAN SBMPTN KIMIA 2017 Page 12
13 11. MATERI: KELARUTAN DAN HASIL KALI KELARUTAN (K sp ) Nilai data K sp dapat memprediksi seberapa banyak maksimum jumlah zat dapat larut dalam sebuah pelarut, dengan pemisalan setiap konsentrasi zat berwujud larutan (aq) dan gas (g) adalah s. Cari besar kelarutan PbSO 4! PbSO 4 (s) 1Pb 2+ (aq) + 1SO 2-4 (aq) Kelarutannya dengan konsep kesetimbangan: K sp = [Pb 2+ ] [SO 2-4 ] 1,6 x 10-8 = [s] [s] s = 1,265 x 10-4 Kelarutannya dengan rumus cepat (banyak ion ditandai warna merah pada reaksinya): s = pangkat 10 dari nilai K sp banyak ionnya = -8 2 = -4 Cari besar kelarutan PbI 2! PbI 2 (s) 1Pb 2+ (aq) + 2I - (aq) Kelarutannya dengan konsep kesetimbangan: K sp = [Pb 2+ ] [I - ] 2 7,1 x 10-9 = [s] [2s] 2 s = 1,922 x 10-3 Kelarutannya dengan rumus cepat (banyak ion ditandai warna merah pada reaksinya): s = pangkat 10 dari nilai K sp banyak ionnya = -9 3 = -3 PEMBAHASAN SBMPTN KIMIA 2017 Page 13
14 Dari uraian di atas sudah dapat disimpulkan bahwa kelarutan senyawa PbI 2 lebih besar daripada senyawa PbSO 4, dipandang dari kelarutannya pada konsep kesetimbangan maupun rumus cepat. Obsein B memiliki jawaban yang salah karena kelarutan PbSO 4 lebih kecil dibanding kelarutan PbI 2, artinya PbSO 4 sukar larut sementara PbI 2 mudah larut. Jadi, tidak mungkin dong anion SO 4 2- ditambahkan lebih banyak, toh PbSO 4 sudah pasti sukar larut dan kalau ditambahkan lagi malah menjadi lebih sukar larut. Jadi, harus dibutuhkan anion I - lebih banyak agar PbI 2 yang semula mudah larut menjadi sukar larut akibat lewat batas maksimum jumlah zat terlarut PbI 2 yang ditambahkan. JAWABAN: E 12. MATERI: KIMIA ORGANIK Sikloheksanol adalah senyawa alkohol beratom karbon siklik (rantai tertutup) yang berjumlah 6 atom C. Jenis senyawa ini adalah alkohol primer, karena sikloheksanol bisa juga diartikan namanya sebagai sikloheksan-1-ol. Gambar di bawah ini menunjukkan struktur sikloheksan-1-ol dengan rumus kimia C 6 H 12 O. Ingat, jika sebuah senyawa organik dioksidasi dengan KMnO 4, K 2 Cr 2 O 7, dan CrO 3 maka akan terjadi penambahan atom O pada bagian unsur lebih reaktif yang terikat pada senyawa tersebut. Bisa saja, ada unsur yang memiliki kereaktifan yang hampir sama (misal kereaktifan unsur A dalam wujud logam dan unsur B wujud nonlogam) kedua-duanya sama-sama mengalami oksidasi. PEMBAHASAN SBMPTN KIMIA 2017 Page 14
15 Perhatikan struktur sikloheksanol di atas, skema oksidasinya sebagai berikut. 1) Saat sikloheksanol dioksidasi oleh K 2 Cr 2 O 7 membuat penambahan atom O pada salah satu unsur yang reaktif di strukturnya yang terletak dekat dengan gugus fungsinya utamanya ( OH), yaitu atom H, yang ditunjukkan pada gambar berikut. 2) Senyawa pada bagian produk reaksi (1) di atas mengandung dua buah gugus alkohol ( OH) akibatnya kurang stabil. Untuk mencapai kestabilan, senyawa tersebut harus mengalami reaksi dehidrasi atau pelepasan gugus H 2 O (ditandai dengan coretan cokelat reaksi di bawah). Gambar di bawah ini menunjukkan skemanya. Mengapa atom O yang berikatan rangkap dengan C tetap berada di tempat gugus alkohol ( OH) pada senyawa awalnya dan bukan di tempat gugus alkohol satunya lagi? Hal ini dipengaruhi oleh letak gugus fungsi utama (yaitu alkohol OH) pada senyawa yang akan dioksidasi tadi. Berdasarkan skemanya, oksidasi sikloheksanol menghasilkan sebuah senyawa bergugus keton yang bernama IUAPC sikloheksanon. JAWABAN: C PEMBAHASAN SBMPTN KIMIA 2017 Page 15
16 13. MATERI: REAKSI REDOKS Untuk mencari apakah sebuah reaksi termasuk reaksi redoks atau bukan, dapat dicari melalui biloks tiap-tiap unsur. 1) 2HCl + CaCO 3 CaCl 2 + H 2 O + CO 2 Biloks C = +4 (CaCO 3 ) +4 (CO 2 ) = bukan reduksi atau oksidasi Biloks Ca = +2 (CaCO 3 ) +2 (CaCl 2 ) = bukan reduksi atau oksidasi Bukan merupakan reaksi redoks. (SALAH) 2) SiO 2 + CaO CaSiO 3 Biloks Si = +4 (SiO 2 ) +4 (CaSiO 3 ) = bukan reduksi atau oksidasi Bukan merupakan reaksi redoks. (SALAH) 3) Na 2 O 2 + 2H 2 O 2NaOH + H 2 O 2 Biloks O = -1 (Na 2 O 2 ) -2 (NaOH) = reduksi Biloks O = -1 (Na 2 O 2 ) -1 (H 2 O 2 ) = bukan reduksi atau oksidasi Biloks H = +1 (air) +1 (NaOH dan H 2 O 2 ) = bukan reduksi atau oksidasi Bukan merupakan reaksi redoks. (SALAH) 4) 4KO 2 + 2CO 2 2K 2 CO 3 + 3O 2 Biloks C = +4 (CO 2 ) +4 (K 2 CO 3 ) = bukan reduksi atau oksidasi Biloks O = - ½ (KO 2 ) -2 (K 2 CO 3 ) = reduksi Biloks O = -2 (CO 2 ) 0 (O 2 ) = oksidasi Merupakan reaksi redoks. (BENAR) JAWABAN: D PEMBAHASAN SBMPTN KIMIA 2017 Page 16
17 14. MATERI: ELEKTROKIMIA Di soal diketahui data: Volume CuSO 4 = 100 ml [CuSO 4 ] = 0,1 M Volume AgNO 3 = 100 ml [AgNO 3 ] = 0,1 M (ralat soal) i = 1 A t = 60 detik Ingat, pada elektrolisis jumlah kuantitas yang sama adalah aliran arus listrik (i) yang digunakan sehingga jumlah elektron (e) yang dibawa tiap satuan waktu (t) bernilai sama di katode maupun anode karena dihubungkan secara seri. mol e = i x t = 1 A x 60 detik = 0, mol 0,01 mol CuSO 4 serta 0,01 mol AgNO 3 di soal adalah jumlah mol total awal kedua senyawa saat dielektrolisis. Nah, di bawah ini tertera reaksi-reaksi yang terjadi di CuSO 4 dan AgNO 3 : a) CuSO 4 Reaksi ionisasi: CuSO 4 Cu 2+ + SO 4 2- Reaksi katode: Cu e Cu Reaksi anode: 2H 2 O 4H + + O 2 + 4e Reaksi elektrolisis: 2Cu H 2 O 2Cu + 4H + + O 2 b) AgNO 3 Reaksi ionisasi: AgNO 3 Ag + + NO 3 - Reaksi katode: Ag + + e Ag Reaksi anode: 2H 2 O 4H + + O 2 + 4e PEMBAHASAN SBMPTN KIMIA 2017 Page 17
18 Reaksi elektrolisis: 4Ag + + 2H 2 O 4Ag + 4H + + O 2 Analisis pernyataannya satu per satu! 1) Massa Cu yang mengendap lebih besar daripada massa Ag Massa Cu yang mengendap 0,01 mol CuSO 4 yang dielektrolisis menghasilkan 0,01 mol kation Cu 2+ juga karena perbandingan koefisien keduanya 1 : 1 sesuai reaksi: CuSO 4 Cu SO 4 0,01 mol 0,01 mol Nah, dalam reaksi elektrolisis CuSO 4 di katode terbentuk padatan Cu, maka dari reaksi ini bisa didapatkan jumlah padatan Cu yang terbentuk menggunakan konsep MBS (Mula-mula, Bereaksi, Sisa). Cu e Cu M 0,01 0, B -0, , , S 0, , Terbentuk 0, mol padatan Cu (A r = 63,5) dengan massa 0,01975 gram Massa Ag yang mengendap 0,01 mol AgNO 3 yang dielektrolisis menghasilkan 0,01 mol kation Ag + juga karena perbandingan koefisien keduanya 1 : 1 sebagai berikut. AgNO 3 Ag NO 3 0,01 mol 0,01 mol Nah, dalam reaksi elektrolisis AgNO 3 di katode terbentuk padatan Ag, maka dari reaksi ini bisa didapatkan jumlah padatan Ag yang terbentuk menggunakan konsep MBS (Mula-mula, Bereaksi, Sisa). Ag + + e Ag M 0,01 0, B -0, , , S 0, , Terbentuk 0, mol padatan Ag (A r = 108) dengan massa 0, gram Jelas pernyataan ini SALAH karena massa Ag yang mengendap lebih banyak daripada massa Cu yang mengendap. 2) Jumlah atom Cu yang mengendap sama dengan jumlah atom Ag Jumlah atom Cu Dari reaksi pernyataan (1) di atas terbentuk 0, mol padatan Cu, sehingga banyaknya jumlah atom Cu adalah: PEMBAHASAN SBMPTN KIMIA 2017 Page 18
19 N = n x L N = n x 6,02 x N = 0, x 6,02 x N = 18,72 x atom Jumlah atom Ag Dari reaksi pernyataan (1) di atas terbentuk 0, mol padatan Ag, sehingga banyaknya jumlah atom Ag adalah: N = n x L N = n x 6,02 x N = 0, mol x 6,02 x N = 37,44 x atom Jelas bahwa pernyataan ini SALAH. 3) Volume gas O 2 yang dihasilkan pada bejana A lebih besar dibandingkan volume gas O 2 pada bejana B Volume gas O 2 berjana A (CuSO 4 ), misalkan pada keadaan STP Volume gas O 2 bisa didapatkan dari reaksi di anode, lalu membandingkan mol elekron (e) dengan mol O 2 sehingga didapatkan jumlah mol oksigen sebesar 0, mol karena perbandingan koefisien O 2 banding elektron adalah 1 : 4. 2H 2 O 4H + + O 2 + 4e 0, , Terbentuk 0, mol oksigen jika pada keadaan STP (22,4), maka volumenya adalah 0, L Volume gas O 2 bejana B (AgNO 3 ), misalkan pada keadaan STP Sebenarnya reaksi di anode bejana B sama dengan reaksi di anode bejana A (lihat reaksi-reaksinya kembali!). Jadi, volume gas oksigen di bejana B juga bernilai 0, liter. Jelas pernyataan ini SALAH. 4) ph larutan dalam bejana A sama dengan ph larutan dalam bejana B ph bejana A (CuSO 4 ) Nilai ph dapat ditentukan oleh konsentrasi [H + ] dan [OH - ]. Nah, di bejana A ion H + maupun OH - hanya ditemukan pada reaksi di anode, yaitu kation H + atau ion proton. Jadi, besarnya mol ion proton tersebut banding mol elektron adalah 0, mol karena perbandingan koefisien keduanya adalah 4 : 4 atau 1 : 1. 2H 2 O 4H + + O 2 + 4e 0, , PEMBAHASAN SBMPTN KIMIA 2017 Page 19
20 Nilai ph dapat ditentukan sebagai berikut. ph = log [H + ] ph = log [0, mol/(0,1 L + 0,1 L)] ph = log [3,11 x 10-3 ] ph = 3 log 3,11 ph = 2,51 Terbukti bahwa ph tersebut berada pada suasana asam (ph < 7) ph bejana B (AgNO 3 ) Nah, ion H + pada reaksi elektrolisis AgNO 3 juga ditemukan pada reaksi di anode. Reaksi di anode elektrolisis AgNO 3 ini sama dengan reaksi di anode elektrolisis CuSO 4 sehingga nilai ph kedua senyawa setelah elektrolisis bernilai sama, yaitu 2,51. Jelas pernyataan ini BENAR. JAWABAN: D 15. MATERI: KIMIA ORGANIK Isomer adalah molekul-molekul dengan rumus kimia yang sama (dan sering dengan jenis ikatan yang sama), namun memiliki susunan atom yang berbeda (dapat diibaratkan sebagai sebuah anagram). Isomer secara umum ada dua macam, yaitu isomer struktur dan ruang. Di soal hanya ditanyakan tentang isomer struktur, yang terbagi lagi menjadi: Isomer kerangka Rumus molekul sama Gugus fungsi ada yang sama dan beda Rantai induk (panjang rantai) yang berbeda Isomer posisi Panjang rantai induk sama Posisi gugus fungsi (contohnya, gugus fungsi alkohol, eter, dsb) berbeda PEMBAHASAN SBMPTN KIMIA 2017 Page 20
21 Rumus molekul sama Isomer gugus fungsi Rumus molekul sama Panjang rantai induk berbeda Gugus fungsi berbeda Sikloheksilalkohol adalah senyawa siklik alkohol berantai 6 atom karbon. Nama lain senyawa ini adalah sikloheksanol atau sikloheksan-1-ol karena jenis alkohol primer. Gambar di bawah ini menunjukkan struktur sikloheksilalkohol dengan rumus molekul C 6 H 12 O. Analisis jawaban! 1) Senyawa pada soal memiliki rumus kimia C 6 H 12 O dan memiliki kerangka yang berbeda. Senyawa ini memiliki gugus fungsi eter ( O ) sehingga berisomer gugus fungsi dengan alkohol ( OH). Jadi, senyawa ini berisomer dengan sikloheksilalkohol. (BENAR) 2) Senyawa ini memiliki rumus kimia C 6 H 12 O dan memiliki gugus fungsi utama berupa alkohol ( OH). Senyawa ini jelas-jelas adalah isomer kerangka dari sikloheksilalkohol karena kerangkanya saja yang berbeda. (BENAR) 3) Senyawa ini juga memiliki rumus kimia C 6 H 12 O dan memiliki gugus fungsi alkohol ( OH). Jelas bahwa senyawa ini berisomer kerangka dengan sikloheksilalkohol karena kerangkanya saja yang berbeda. (BENAR) 4) Senyawa tersebut memiliki rumus kimia C 6 H 12 O dan bergugus fungsi utama eter ( O ). Seperti pernyataan nomor (1) bahwa eter bergugus fungsi dengan alkohol, jadi senyawa ini berisomer dengan sikloheksilalkohol. (BENAR) JAWABAN: E #SBMPTN2017 PEMBAHASAN SBMPTN KIMIA 2017 Page 21
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Cr memiliki nomor atom 24. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Cr memiliki nomor atom 24. Ingat, bahwa jumlah
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur X memiliki nomor atom 19. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur X memiliki nomor atom 19. Ingat, bahwa jumlah
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Q memiliki nomor atom 22. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Q memiliki nomor atom 22. Ingat, bahwa jumlah
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Ingat, bahwa jumlah neutron suatu unsur dan ionnya bernilai sama, yang membedakannya
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Ingat, bahwa jumlah neutron suatu unsur dan ionnya bernilai sama, yang membedakannya
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Se memiliki nomor atom 34. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Se memiliki nomor atom 34. Ingat, bahwa jumlah
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur A memiliki nomor atom 16. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur A memiliki nomor atom 16. Ingat, bahwa jumlah
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur X memiliki nomor atom 21. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur X memiliki nomor atom 21. Ingat, bahwa jumlah
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Ingat, bahwa jumlah neutron suatu unsur dan ionnya bernilai sama, yang membedakannya
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Ingat, bahwa jumlah neutron suatu unsur dan ionnya bernilai sama, yang membedakannya
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur R memiliki nomor atom 33. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur R memiliki nomor atom 33. Ingat, bahwa jumlah
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2014 Page 1 1. MATERI: STOIKIOMETRI Reaksi kondensasi berkaitan dengan reaksi pembentukan polimer, di samping ada juga yang mengalami reaksi
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2014 Page 1 1. MATERI: STOIKIOMETRI Reaksi kondensasi berkaitan dengan reaksi pembentukan polimer, di samping ada juga yang mengalami reaksi
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: HUKUM-HUKUM DASAR KIMIA Di soal diketahui dan ditanya: m (NH 2 ) 2 CO = 12.000 ton/tahun (pabrik) m N 2 = ton/tahun?
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: HUKUM-HUKUM DASAR KIMIA Di soal diketahui dan ditanya: m (NH 2 ) 2 CO = 12.000 ton/tahun (pabrik) m N 2 = ton/tahun?
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: TERMOKIMIA Pada soal diketahui dan ditanya: ΔH c C 2 H 5 OH = -1380 kj/mol ΔH d C 6 H 12 O 6 = -60 kj/mol ΔH c C
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: TERMOKIMIA Pada soal diketahui dan ditanya: ΔH c C 2 H 5 OH = -1380 kj/mol ΔH d C 6 H 12 O 6 = -60 kj/mol ΔH c C
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2015 Page 1 1. MATERI: STOIKIOMETRI Persen massa adalah persentase massa zat terlarut dalam 100 gram massa larutan (massa pelarut + massa
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2015 Page 1 1. MATERI: STOIKIOMETRI Persen massa adalah persentase massa zat terlarut dalam 100 gram massa larutan (massa pelarut + massa
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom fluor adalah 9 (ditulis 9 F) dan nomor atom belerang
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom fluor adalah 9 (ditulis 9 F) dan nomor atom belerang
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom karbon adalah 6 (ditulis 6 C) dan nomor atom klor
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom karbon adalah 6 (ditulis 6 C) dan nomor atom klor
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom karbon adalah 6 (ditulis 6 C) dan nomor atom klor
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom karbon adalah 6 (ditulis 6 C) dan nomor atom klor
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom nitrogen adalah 7 (ditulis 7 N) dan nomor atom
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom nitrogen adalah 7 (ditulis 7 N) dan nomor atom
D. 2 dan 3 E. 2 dan 5
 1. Pada suhu dan tekanan sama, 40 ml P 2 tepat habis bereaksi dengan 100 ml, Q 2 menghasilkan 40 ml gas PxOy. Harga x dan y adalah... A. 1 dan 2 B. 1 dan 3 C. 1 dan 5 Kunci : E D. 2 dan 3 E. 2 dan 5 Persamaan
1. Pada suhu dan tekanan sama, 40 ml P 2 tepat habis bereaksi dengan 100 ml, Q 2 menghasilkan 40 ml gas PxOy. Harga x dan y adalah... A. 1 dan 2 B. 1 dan 3 C. 1 dan 5 Kunci : E D. 2 dan 3 E. 2 dan 5 Persamaan
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A. D. Cu E. Zn
 1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
Sulistyani, M.Si.
 Sulistyani, M.Si. [email protected] Reaksi oksidasi: perubahan kimia suatu spesies (atom, unsur, molekul) melepaskan elektron. Cu Cu 2+ + 2e Reaksi reduksi: perubahan kimia suatu spesies (atom, unsur,
Sulistyani, M.Si. [email protected] Reaksi oksidasi: perubahan kimia suatu spesies (atom, unsur, molekul) melepaskan elektron. Cu Cu 2+ + 2e Reaksi reduksi: perubahan kimia suatu spesies (atom, unsur,
2. Konfigurasi elektron dua buah unsur tidak sebenarnya:
 . Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
. Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
PREDIKSI UJIAN NASIONAL 2011 KIMIA
 Soal PREDIKSI Latihan UJIAN NASIONAL 2011 2013 KIMIA 1 LATIHAN UJIAN AKHIR NASIONAL TAHUN AJARAN 2012/2013 KIMIA 1. Jika unsur 19 X berikatan dengan unsur 35 Z maka, rumus senyawa dan jenis ikatan yang
Soal PREDIKSI Latihan UJIAN NASIONAL 2011 2013 KIMIA 1 LATIHAN UJIAN AKHIR NASIONAL TAHUN AJARAN 2012/2013 KIMIA 1. Jika unsur 19 X berikatan dengan unsur 35 Z maka, rumus senyawa dan jenis ikatan yang
D. 4,50 x 10-8 E. 1,35 x 10-8
 1. Pada suatu suhu tertentu, kelarutan PbI 2 dalam air adalah 1,5 x 10-3 mol/liter. Berdasarkan itu maka Kp PbI 2 adalah... A. 4,50 x 10-9 B. 3,37 x 10-9 C. 6,75 x 10-8 S : PbI 2 = 1,5. 10-3 mol/liter
1. Pada suatu suhu tertentu, kelarutan PbI 2 dalam air adalah 1,5 x 10-3 mol/liter. Berdasarkan itu maka Kp PbI 2 adalah... A. 4,50 x 10-9 B. 3,37 x 10-9 C. 6,75 x 10-8 S : PbI 2 = 1,5. 10-3 mol/liter
Elektrokimia. Tim Kimia FTP
 Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis ini merupakan
Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis ini merupakan
Redoks dan Elektrokimia Tim Kimia FTP
 Redoks dan Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis
Redoks dan Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis
UJIAN NASIONAL TAHUN PELAJARAN 2007/2008
 UJIAN NASIONAL TAHUN PELAJARAN 2007/2008 PANDUAN MATERI SMA DAN MA K I M I A PROGRAM STUDI IPA PUSAT PENILAIAN PENDIDIKAN BALITBANG DEPDIKNAS KATA PENGANTAR Dalam rangka sosialisasi kebijakan dan persiapan
UJIAN NASIONAL TAHUN PELAJARAN 2007/2008 PANDUAN MATERI SMA DAN MA K I M I A PROGRAM STUDI IPA PUSAT PENILAIAN PENDIDIKAN BALITBANG DEPDIKNAS KATA PENGANTAR Dalam rangka sosialisasi kebijakan dan persiapan
kimia ASAM-BASA III Tujuan Pembelajaran
 KTSP K-13 kimia K e l a s XI ASAM-BASA III Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami mekanisme reaksi asam-basa. 2. Memahami stoikiometri
KTSP K-13 kimia K e l a s XI ASAM-BASA III Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami mekanisme reaksi asam-basa. 2. Memahami stoikiometri
Mengubah energi kimia menjadi energi listrik Mengubah energi listrik menjadi energi kimia Katoda sebagi kutub positif, anoda sebagai kutub negatif
 TUGAS 1 ELEKTROKIMIA Di kelas X, anda telah mempelajari bilangan oksidasi dan reaksi redoks. Reaksi redoks adalah reaksi reduksi dan oksidasi. Reaksi reduksi adalah reaksi penangkapan elektron atau reaksi
TUGAS 1 ELEKTROKIMIA Di kelas X, anda telah mempelajari bilangan oksidasi dan reaksi redoks. Reaksi redoks adalah reaksi reduksi dan oksidasi. Reaksi reduksi adalah reaksi penangkapan elektron atau reaksi
SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016)
 SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016) Bagian I: Pilihan Ganda 1) Suatu atom yang mempunyai energi ionisasi pertama bernilai besar, memiliki sifat/kecenderungan : A. Afinitas elektron rendah
SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016) Bagian I: Pilihan Ganda 1) Suatu atom yang mempunyai energi ionisasi pertama bernilai besar, memiliki sifat/kecenderungan : A. Afinitas elektron rendah
MODUL SEL ELEKTROLISIS
 MODUL SEL ELEKTROLISIS Standar Kompetensi : 2. Menerapkan konsep reaksi oksidasi-reduksi dan elektrokimia dalam teknologi dan kehidupan sehari-hari. Kompetensi dasar : 2.2. Menjelaskan reaksi oksidasi-reduksi
MODUL SEL ELEKTROLISIS Standar Kompetensi : 2. Menerapkan konsep reaksi oksidasi-reduksi dan elektrokimia dalam teknologi dan kehidupan sehari-hari. Kompetensi dasar : 2.2. Menjelaskan reaksi oksidasi-reduksi
L A R U T A N _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA
 L A R U T A N _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA 1. Larutan Elektrolit 2. Persamaan Ionik 3. Reaksi Asam Basa 4. Perlakuan Larutan
L A R U T A N _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA 1. Larutan Elektrolit 2. Persamaan Ionik 3. Reaksi Asam Basa 4. Perlakuan Larutan
Wardaya College IKATAN KIMIA STOIKIOMETRI TERMOKIMIA CHEMISTRY. Part III. Summer Olympiad Camp Kimia SMA
 Part I IKATAN KIMIA CHEMISTRY Summer Olympiad Camp 2017 - Kimia SMA 1. Untuk menggambarkan ikatan yang terjadi dalam suatu molekul kita menggunakan struktur Lewis atau 'dot and cross' (a) Tuliskan formula
Part I IKATAN KIMIA CHEMISTRY Summer Olympiad Camp 2017 - Kimia SMA 1. Untuk menggambarkan ikatan yang terjadi dalam suatu molekul kita menggunakan struktur Lewis atau 'dot and cross' (a) Tuliskan formula
PAKET UJIAN NASIONAL 11 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 11 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Unsur dengan nomor massa 45 dan mempunyai jumlah netron
PAKET UJIAN NASIONAL 11 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Unsur dengan nomor massa 45 dan mempunyai jumlah netron
SOAL KIMIA 2 KELAS : XI IPA
 SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
D. 8 mol S E. 4 mol Fe(OH) 3 C. 6 mol S Kunci : B Penyelesaian : Reaksi :
 1. Perhatikan reaksi, 2 Fe 2 S 3 + 3O 2 + 6 H 2 O 4 Fe(OH) 3 + 6S Jika 2 mol Fe 2 S 3, 2 mol O 2 dan 3 mol H 2 O bereaksi dengan sempurna, akan dihasilkan : A. 3 mol Fe(OH) 3 B. 2 mol Fe(OH) 3 D. 8 mol
1. Perhatikan reaksi, 2 Fe 2 S 3 + 3O 2 + 6 H 2 O 4 Fe(OH) 3 + 6S Jika 2 mol Fe 2 S 3, 2 mol O 2 dan 3 mol H 2 O bereaksi dengan sempurna, akan dihasilkan : A. 3 mol Fe(OH) 3 B. 2 mol Fe(OH) 3 D. 8 mol
Soal-soal Redoks dan elektrokimia
 1. Reaksi redoks : MnO 4 (aq) + C 2 O 4 2- (aq) Mn 2+ (aq) + CO 2 (g), berlangsung dalam suasana asam. Setiap mol MnO 4 memerlukan H + sebanyak A. 4 mol B. 6 mol D. 10 mol C. 8 mol E. 12 mol 2. Reaksi
1. Reaksi redoks : MnO 4 (aq) + C 2 O 4 2- (aq) Mn 2+ (aq) + CO 2 (g), berlangsung dalam suasana asam. Setiap mol MnO 4 memerlukan H + sebanyak A. 4 mol B. 6 mol D. 10 mol C. 8 mol E. 12 mol 2. Reaksi
PAKET UJIAN NASIONAL 17 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 17 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
PAKET UJIAN NASIONAL 17 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
SIMULASI UJIAN NASIONAL 2
 SIMULASI UJIAN NASIONAL 2. Diketahui nomor atom dan nomor massa dari atom X adalah 29 dan 63. Jumlah proton, elektron, dan neutron dalam ion X 2+ (A) 29, 27, dan 63 (B) 29, 29, dan 34 (C) 29, 27, dan 34
SIMULASI UJIAN NASIONAL 2. Diketahui nomor atom dan nomor massa dari atom X adalah 29 dan 63. Jumlah proton, elektron, dan neutron dalam ion X 2+ (A) 29, 27, dan 63 (B) 29, 29, dan 34 (C) 29, 27, dan 34
KISI-KISI UN KIMIA SMA/MA
 KISI-KISI UN KIMIA SMA/MA 2015-2016 Siswa mampu memahami, menguasai pengetahuan/ mengaplikasikan pengetahuan/ menggunakan nalar dalam hal: Struktur Atom Sistem Periodik Unsur Ikatan Kimia (Jenis Ikatan)
KISI-KISI UN KIMIA SMA/MA 2015-2016 Siswa mampu memahami, menguasai pengetahuan/ mengaplikasikan pengetahuan/ menggunakan nalar dalam hal: Struktur Atom Sistem Periodik Unsur Ikatan Kimia (Jenis Ikatan)
PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53
PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53
Reaksi Dan Stoikiometri Larutan
 A. PERSAMAAN REAKSI ION Reaksi Dan Stoikiometri Larutan Persamaan reaksi ion adalah persamaan reaksi yang menjelaskan bagaimana reaksi antar-ion terjadi pada elektrolit. Persamaan reaksi ion terdiri dari:
A. PERSAMAAN REAKSI ION Reaksi Dan Stoikiometri Larutan Persamaan reaksi ion adalah persamaan reaksi yang menjelaskan bagaimana reaksi antar-ion terjadi pada elektrolit. Persamaan reaksi ion terdiri dari:
Siswa diingatkan tentang struktur atom, bilangan kuantum, bentuk-bentuk orbital, dan konfigurasi elektron
 RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
 TRY OUT SELEKSI OLIMPIADE TINGKAT KABUPATEN/KOTA 2010 TIM OLIMPIADE KIMIA INDONESIA 2011 Waktu: 150 Menit PUSAT KLINIK PENDIDIKAN INDONESIA (PKPI) bekerjasama dengan LEMBAGA BIMBINGAN BELAJAR SSCIntersolusi
TRY OUT SELEKSI OLIMPIADE TINGKAT KABUPATEN/KOTA 2010 TIM OLIMPIADE KIMIA INDONESIA 2011 Waktu: 150 Menit PUSAT KLINIK PENDIDIKAN INDONESIA (PKPI) bekerjasama dengan LEMBAGA BIMBINGAN BELAJAR SSCIntersolusi
LEMBAR AKTIVITAS SISWA
 LEMBAR AKTIVITAS SISWA No SOAL & PENYELESAIAN 1 Pada elektrolisis leburan kalsium klorida dengan elektroda karbon, digunakan muatan listrik sebanyak 0,02 F. Volume gas klorin yg dihasilkan di anode, jika
LEMBAR AKTIVITAS SISWA No SOAL & PENYELESAIAN 1 Pada elektrolisis leburan kalsium klorida dengan elektroda karbon, digunakan muatan listrik sebanyak 0,02 F. Volume gas klorin yg dihasilkan di anode, jika
D kj/mol E kj/mol
 1. Dari data : 2H 2 (g) + O 2 (g) 2H 2 O (l) H = -571 kj 2Ca (s) + O 2 (g) 2CaO(s) H = -1269 kj CaO (s) + H 2 O (l) Ca(OH)2(s) H = -64 kj Dapat dihitung entalpi pembentukan Ca(OH) 2 (s) sebesar... A. -984
1. Dari data : 2H 2 (g) + O 2 (g) 2H 2 O (l) H = -571 kj 2Ca (s) + O 2 (g) 2CaO(s) H = -1269 kj CaO (s) + H 2 O (l) Ca(OH)2(s) H = -64 kj Dapat dihitung entalpi pembentukan Ca(OH) 2 (s) sebesar... A. -984
Reaksi dan Stoikiometri Larutan
 Reaksi dan Stoikiometri Larutan A. PERSAMAAN REAKSI ION Persamaan reaksi ion adalah persamaan reaksi yang menjelaskan bagaimana reaksi antar-ion terjadi pada larutan elektrolit. Persamaan reaksi ion terdiri
Reaksi dan Stoikiometri Larutan A. PERSAMAAN REAKSI ION Persamaan reaksi ion adalah persamaan reaksi yang menjelaskan bagaimana reaksi antar-ion terjadi pada larutan elektrolit. Persamaan reaksi ion terdiri
D. 3 dan 4 E. 1 dan 5
 1. Dari beberapa unsur berikut yang mengandung : 1. 20 elektron dan 20 netron 2. 10 elektron dan 12 netron 3. 15 proton dan 16 netron 4. 20 netron dan 19 proton 5. 12 proton dan 12 netron Yang memiliki
1. Dari beberapa unsur berikut yang mengandung : 1. 20 elektron dan 20 netron 2. 10 elektron dan 12 netron 3. 15 proton dan 16 netron 4. 20 netron dan 19 proton 5. 12 proton dan 12 netron Yang memiliki
Chapter 7 Larutan tirtawi (aqueous solution)
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi modif oleh Dr I Kartini Chapter 7 Larutan tirtawi (aqueous solution) Larutan adalah campuran yang homogen dari dua atau lebih
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi modif oleh Dr I Kartini Chapter 7 Larutan tirtawi (aqueous solution) Larutan adalah campuran yang homogen dari dua atau lebih
SOAL SELEKSI OLIMPIADE SAINS TINGKAT KABUPATEN/KOTA 2004 CALON TIM OLIMPIADE KIMIA INDONESIA
 SOAL SELEKSI OLIMPIADE SAINS TINGKAT KABUPATEN/KOTA 2004 CALON TIM OLIMPIADE KIMIA INDONESIA 2005 Bidang Kimia KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN DIREKTORAT JENDERAL PENDIDIKAN MENENGAH DIREKTORAT PEMBINAAN
SOAL SELEKSI OLIMPIADE SAINS TINGKAT KABUPATEN/KOTA 2004 CALON TIM OLIMPIADE KIMIA INDONESIA 2005 Bidang Kimia KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN DIREKTORAT JENDERAL PENDIDIKAN MENENGAH DIREKTORAT PEMBINAAN
HASIL ANALISIS KEBENARAN KONSEP PADA OBJEK PENELITIAN. Penjelasan Konsep
 LAMPIRAN 7 HASIL ANALISIS KEBENARAN KONSEP PADA OBJEK PENELITIAN Keterangan kriteria kebenaran konsep Benar (B) Salah (S) Indikator Pembelajaran : Jika penjelasan konsep subjek penelitian sesuai dengan
LAMPIRAN 7 HASIL ANALISIS KEBENARAN KONSEP PADA OBJEK PENELITIAN Keterangan kriteria kebenaran konsep Benar (B) Salah (S) Indikator Pembelajaran : Jika penjelasan konsep subjek penelitian sesuai dengan
1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat!
 Petunjuk : 1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat! 2. Soal Teori ini terdiri dari dua bagian: A. 30 soal pilihan Ganda : 60 poin B. 5 Nomor
Petunjuk : 1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat! 2. Soal Teori ini terdiri dari dua bagian: A. 30 soal pilihan Ganda : 60 poin B. 5 Nomor
PAKET UJIAN NASIONAL 14 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASINAL 14 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
PAKET UJIAN NASINAL 14 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
Soal ini terdiri dari 10 soal Essay (153 poin)
 Bidang Studi Kode Berkas : Kimia : KI-L01 (soal) Soal ini terdiri dari 10 soal Essay (153 poin) Tetapan Avogadro N A = 6,022 10 23 partikel.mol 1 Tetapan Gas Universal R = 8,3145 J.mol -1.K -1 = 0,08206
Bidang Studi Kode Berkas : Kimia : KI-L01 (soal) Soal ini terdiri dari 10 soal Essay (153 poin) Tetapan Avogadro N A = 6,022 10 23 partikel.mol 1 Tetapan Gas Universal R = 8,3145 J.mol -1.K -1 = 0,08206
OAL TES SEMESTER I. I. Pilihlah jawaban yang paling tepat! a. 2d d. 3p b. 2p e. 3s c. 3d 6. Unsur X dengan nomor atom
 KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
Contoh Soal & Pembahasan Reaksi Kesetimbangan
 Soal No.1 Contoh Soal & Pembahasan Reaksi Kesetimbangan Reaksi kimia ada yang berlangsung searah (berkesudahan) dan ada yang dapat balik (bolak-balik). Jelaskan perbedaanya disertai dengan contoh-contohnya.
Soal No.1 Contoh Soal & Pembahasan Reaksi Kesetimbangan Reaksi kimia ada yang berlangsung searah (berkesudahan) dan ada yang dapat balik (bolak-balik). Jelaskan perbedaanya disertai dengan contoh-contohnya.
PEMBAHASAN UJIAN NASIONAL KIMIA TAHUN 2006
 UJIAN NASIONAL KIMIA TAHUN 2006 HTTP://GUDANGSOALPRO.BLOGSPOT.COM 1 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53 T yang terletak pada golongan yang sama dalam sistem periodik unsur adalah...
UJIAN NASIONAL KIMIA TAHUN 2006 HTTP://GUDANGSOALPRO.BLOGSPOT.COM 1 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53 T yang terletak pada golongan yang sama dalam sistem periodik unsur adalah...
ELEKTROKIMIA. VURI AYU SETYOWATI, S.T., M.Sc TEKNIK MESIN - ITATS
 ELEKTROKIMIA VURI AYU SETYOWATI, S.T., M.Sc TEKNIK MESIN - ITATS ELEKTROKIMIA Elektrokimia merupakan ilmu yang mempelajari hubungan antara perubahan (reaksi) kimia dengan kerja listrik, biasanya melibatkan
ELEKTROKIMIA VURI AYU SETYOWATI, S.T., M.Sc TEKNIK MESIN - ITATS ELEKTROKIMIA Elektrokimia merupakan ilmu yang mempelajari hubungan antara perubahan (reaksi) kimia dengan kerja listrik, biasanya melibatkan
TES AWAL II KIMIA DASAR II (KI-112)
 TES AWAL II KIMIA DASAR II (KI112) NAMA : Tanda Tangan N I M : JURUSAN :... BERBAGAI DATA. Tetapan gas R = 0,082 L atm mol 1 K 1 = 1,987 kal mol 1 K 1 = 8,314 J mol 1 K 1 Tetapan Avogadro = 6,023 x 10
TES AWAL II KIMIA DASAR II (KI112) NAMA : Tanda Tangan N I M : JURUSAN :... BERBAGAI DATA. Tetapan gas R = 0,082 L atm mol 1 K 1 = 1,987 kal mol 1 K 1 = 8,314 J mol 1 K 1 Tetapan Avogadro = 6,023 x 10
Kelarutan (s) dan Hasil Kali Kelarutan (Ksp)
 Kelarutan (s) dan Hasil Kali Kelarutan (Ksp) Tim Dosen Kimia Dasar FTP UNIVERSITAS BRAWIJAYA Kelarutan (s) Kelarutan (solubility) adalah jumlah maksimum suatu zat yang dapat larut dalam suatu pelarut.
Kelarutan (s) dan Hasil Kali Kelarutan (Ksp) Tim Dosen Kimia Dasar FTP UNIVERSITAS BRAWIJAYA Kelarutan (s) Kelarutan (solubility) adalah jumlah maksimum suatu zat yang dapat larut dalam suatu pelarut.
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL. UjianTeori. Waktu: 100 menit
 OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
D. beta dan alfa E. alfa dan beta
 1. Pada peluruhan menjadi kemudian meluruh menjadi, partikel-partikel yang dipancarkan berturut-turut adalah... A. foton dan beta B. foton dan alfa C. beta dan foton Reaksi peluruhan : D. beta dan alfa
1. Pada peluruhan menjadi kemudian meluruh menjadi, partikel-partikel yang dipancarkan berturut-turut adalah... A. foton dan beta B. foton dan alfa C. beta dan foton Reaksi peluruhan : D. beta dan alfa
UN SMA IPA Kimia. Kode Soal 305
 UN SMA IPA Kimia Kode Soal 305 Doc.name : UNSMAIPAKIM305 Version : 2012-12 halaman 1 1. Di antara hal-hal di bawah ini : 1. besi berpilar 2. pagar di cat 3. belerang meleleh 4. nasi jadi basi 5. bel berdering
UN SMA IPA Kimia Kode Soal 305 Doc.name : UNSMAIPAKIM305 Version : 2012-12 halaman 1 1. Di antara hal-hal di bawah ini : 1. besi berpilar 2. pagar di cat 3. belerang meleleh 4. nasi jadi basi 5. bel berdering
REDOKS dan ELEKTROKIMIA
 REDOKS dan ELEKTROKIMIA Overview Konsep termodinamika tidak hanya berhubungan dengan mesin uap, atau transfer energi berupa kalor dan kerja Dalam konteks kehidupan sehari-hari aplikasinya sangat luas mulai
REDOKS dan ELEKTROKIMIA Overview Konsep termodinamika tidak hanya berhubungan dengan mesin uap, atau transfer energi berupa kalor dan kerja Dalam konteks kehidupan sehari-hari aplikasinya sangat luas mulai
KIMIa ASAM-BASA II. K e l a s. A. Kesetimbangan Air. Kurikulum 2006/2013
 Kurikulum 2006/2013 KIMIa K e l a s XI ASAM-BASA II Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami kesetimbangan air. 2. Memahami pengaruh asam
Kurikulum 2006/2013 KIMIa K e l a s XI ASAM-BASA II Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami kesetimbangan air. 2. Memahami pengaruh asam
1s 2 2s 2 2p 6 3s 2 2p 6 3d 4s 1 4p 4d 4f 5s 5p 5d 5f
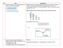 NO SOAL PEMBAHASAN 1 Konfigurasi elekttron ion X - yang memiliki nomor massa 39 dan 21 neutron adalah.. A. 1s2 2s2 2p6 3s2 3p6 4s2 3d1 B. 1s2 2s2 2p6 3s2 3p6 4s1 C. 1s2 2s2 2p6 3s2 3p6 3d1 D. 1s2 2s2 2p6
NO SOAL PEMBAHASAN 1 Konfigurasi elekttron ion X - yang memiliki nomor massa 39 dan 21 neutron adalah.. A. 1s2 2s2 2p6 3s2 3p6 4s2 3d1 B. 1s2 2s2 2p6 3s2 3p6 4s1 C. 1s2 2s2 2p6 3s2 3p6 3d1 D. 1s2 2s2 2p6
SIMULASI UJIAN NASIONAL 3
 SIMULASI UJIAN NASIONAL 3 1. Diketahui: H, Li, Be, O, F, Ne, Na, Mg, 1 3 4 8 9 10 11 12 Ar, 18 36 Kr Kelompok unsur atau ion berikut yang mempunyai konfigurasi elektron yang sama (A) O 2-, F -, Ne (D)
SIMULASI UJIAN NASIONAL 3 1. Diketahui: H, Li, Be, O, F, Ne, Na, Mg, 1 3 4 8 9 10 11 12 Ar, 18 36 Kr Kelompok unsur atau ion berikut yang mempunyai konfigurasi elektron yang sama (A) O 2-, F -, Ne (D)
Pembahasan Soal Multiplechoice OSK Kimia Tahun 2014 Oleh Urip
 Pembahasan Soal Multiplechoice OSK Kimia Tahun 2014 Oleh Urip Kalteng @ http://urip.wordpress.com Dengan senang hati jika ada yang mau mengoreksi pembahasan ini A. Pilih jawaban yang paling tepat ( 25
Pembahasan Soal Multiplechoice OSK Kimia Tahun 2014 Oleh Urip Kalteng @ http://urip.wordpress.com Dengan senang hati jika ada yang mau mengoreksi pembahasan ini A. Pilih jawaban yang paling tepat ( 25
LEMBARAN SOAL 5. Pilih satu jawaban yang benar!
 LEMBARAN SOAL 5 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
LEMBARAN SOAL 5 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
KISI UJI KOMPETENSI 2013 MATA PELAJARAN KIMIA
 KISI UJI KOMPETENSI 2013 MATA PELAJARAN KIMIA Kompetensi Menguasai karakteristik peserta Mengidentifikasi kesulitan belajar didik dari aspek fisik, moral, peserta didik dalam mata pelajaran spiritual,
KISI UJI KOMPETENSI 2013 MATA PELAJARAN KIMIA Kompetensi Menguasai karakteristik peserta Mengidentifikasi kesulitan belajar didik dari aspek fisik, moral, peserta didik dalam mata pelajaran spiritual,
SOAL KIMIA 1 KELAS : XI IPA
 SOAL KIIA 1 KELAS : XI IPA PETUNJUK UU 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja 3. Kerjakanlah soal anda pada lembar
SOAL KIIA 1 KELAS : XI IPA PETUNJUK UU 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja 3. Kerjakanlah soal anda pada lembar
STOKIOMETRI BAB. B. Konsep Mol 1. Hubungan Mol dengan Jumlah Partikel. Contoh: Jika Ar Ca = 40, Ar O = 16, Ar H = 1, tentukan Mr Ca(OH) 2!
 BAB 7 STOKIOMETRI A. Massa Molekul Relatif Massa Molekul Relatif (Mr) biasanya dihitung menggunakan data Ar masing-masing atom yang ada dalam molekul tersebut. Mr senyawa = (indeks atom x Ar atom) Contoh:
BAB 7 STOKIOMETRI A. Massa Molekul Relatif Massa Molekul Relatif (Mr) biasanya dihitung menggunakan data Ar masing-masing atom yang ada dalam molekul tersebut. Mr senyawa = (indeks atom x Ar atom) Contoh:
PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH
 PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH TAHUN 2016 Soal diketik ulang oleh urip rukim (www.urip.info)
PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH TAHUN 2016 Soal diketik ulang oleh urip rukim (www.urip.info)
STOIKIOMETRI Konsep mol
 STOIKIOMETRI Konsep mol Dalam hukum-hukum dasar materi ditegaskan bahwa senyawa terbentuk dari unsur bukan dengan perbandingan sembarang tetapi dalam jumlah yang spesifik, demikian juga reaksi kimia antara
STOIKIOMETRI Konsep mol Dalam hukum-hukum dasar materi ditegaskan bahwa senyawa terbentuk dari unsur bukan dengan perbandingan sembarang tetapi dalam jumlah yang spesifik, demikian juga reaksi kimia antara
LARUTAN ELEKTROLIT DAN NONELEKTROLIT (Diskusi Informasi) INFORMASI Larutan adalah campuran yang homogen antara zat terlarut dan zat pelarut.
 LARUTAN ELEKTROLIT DAN NONELEKTROLIT (Diskusi Informasi) INFORMASI Larutan adalah campuran yang homogen antara zat terlarut dan zat pelarut. Berdasarkan daya hantar listriknya, larutan dapat digolongkan
LARUTAN ELEKTROLIT DAN NONELEKTROLIT (Diskusi Informasi) INFORMASI Larutan adalah campuran yang homogen antara zat terlarut dan zat pelarut. Berdasarkan daya hantar listriknya, larutan dapat digolongkan
Kegiatan Belajar 3: Sel Elektrolisis. 1. Mengamati reaksi yang terjadi di anoda dan katoda pada reaksi elektrolisis
 1 Kegiatan Belajar 3: Sel Elektrolisis Capaian Pembelajaran Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada sel elektrolisis Subcapaian pembelajaran: 1. Mengamati reaksi yang
1 Kegiatan Belajar 3: Sel Elektrolisis Capaian Pembelajaran Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada sel elektrolisis Subcapaian pembelajaran: 1. Mengamati reaksi yang
Berdasarkan data di atas yang merupakan larutan non elektrolit adalah nomor A. 1 B. 2 C. 3 D. 4 E. 5
 PREDIKSI UN 2010 ( semoga soal soal ini ada manfaatnya) 1. Jika diketahui nuklida 11 Na 23, maka jumlah elektron, proton dan neutron adalah A. 23 proton, 12 elektron dan 11 neutron B. 11 proton, 12 elektron
PREDIKSI UN 2010 ( semoga soal soal ini ada manfaatnya) 1. Jika diketahui nuklida 11 Na 23, maka jumlah elektron, proton dan neutron adalah A. 23 proton, 12 elektron dan 11 neutron B. 11 proton, 12 elektron
BAB VI KINETIKA REAKSI KIMIA
 BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
PERSIAPAN UJIAN NASIONAL 2011 SMA MAARIF NU PANDAAN TAHUN PELAJARAN
 PERSIAPAN UJIAN NASIONAL 2011 SMA MAARIF NU PANDAAN TAHUN PELAJARAN 2010-2011 Mata Pelajaran : Kimia Hari/Tanggal : Minggu, 10 Mei 2011 Waktu : 120 menit 1. Perhatikan beberapa perubahan materi berikut!
PERSIAPAN UJIAN NASIONAL 2011 SMA MAARIF NU PANDAAN TAHUN PELAJARAN 2010-2011 Mata Pelajaran : Kimia Hari/Tanggal : Minggu, 10 Mei 2011 Waktu : 120 menit 1. Perhatikan beberapa perubahan materi berikut!
Bab 4 KELARUTAN DAN HASIL KALI KELARUTAN
 Bab 4 KELARUTAN DAN HASIL KALI KELARUTAN Apa yang terjadi pada saat gula dilarutkan ke dalam air, mengapa bila gula yang dilarutkan dalam jumlah banyak tidak dapat terlarut semua? Mengapa gula tidak bisa
Bab 4 KELARUTAN DAN HASIL KALI KELARUTAN Apa yang terjadi pada saat gula dilarutkan ke dalam air, mengapa bila gula yang dilarutkan dalam jumlah banyak tidak dapat terlarut semua? Mengapa gula tidak bisa
11. Mata Pelajaran Kimia Untuk Paket C Program IPA
 11. Mata Pelajaran Kimia Untuk Paket C Program IPA A. Latar Belakang Ilmu Pengetahuan Alam (IPA) berkaitan dengan cara mencari tahu tentang gejala alam secara sistematis, sehingga pendidikan IPA bukan
11. Mata Pelajaran Kimia Untuk Paket C Program IPA A. Latar Belakang Ilmu Pengetahuan Alam (IPA) berkaitan dengan cara mencari tahu tentang gejala alam secara sistematis, sehingga pendidikan IPA bukan
KISI KISI SOAL UJIAN SEKOLAH SMK SE-KABUPATEN CIAMIS TP. 2013/2014
 Mata Pelajaran : KIMIA KISI KISI UJIAN SEKOLAH SMK SE-KABUPATEN CIAMIS TP. 2013/2014 TINGKAT 1 Memahami konsep materi dan perubahannya Pengertian perubahan Kimia dan Fisika dijelaskan melalui contoh-contoh
Mata Pelajaran : KIMIA KISI KISI UJIAN SEKOLAH SMK SE-KABUPATEN CIAMIS TP. 2013/2014 TINGKAT 1 Memahami konsep materi dan perubahannya Pengertian perubahan Kimia dan Fisika dijelaskan melalui contoh-contoh
Hubungan koefisien dalam persamaan reaksi dengan hitungan
 STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL. UjianTeori. Waktu: 100 menit
 OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
LARUTAN PENYANGGA (BUFFER)
 LARUTAN PENYANGGA (BUFFER) Larutan penyangga Larutan penyangga atau larutan buffer adalah larutan yang ph-nya praktis tidak berubah walaupun kepadanya ditambahkan sedikit asam, sedikit basa, atau bila
LARUTAN PENYANGGA (BUFFER) Larutan penyangga Larutan penyangga atau larutan buffer adalah larutan yang ph-nya praktis tidak berubah walaupun kepadanya ditambahkan sedikit asam, sedikit basa, atau bila
1. Perhatikan struktur senyawa berikut!
 . Perhatikan struktur senyawa berikut! CH CH CH CH CH CH CH Jumlah atom C primer, atom C sekunder, dan atom C tersier dari senyawa di atas adalah...,, dan D.,, dan,, dan E.,, dan,, dan. Di bawah ini merupakan
. Perhatikan struktur senyawa berikut! CH CH CH CH CH CH CH Jumlah atom C primer, atom C sekunder, dan atom C tersier dari senyawa di atas adalah...,, dan D.,, dan,, dan E.,, dan,, dan. Di bawah ini merupakan
Kimia Proyek Perintis I Tahun 1979
 Kimia Proyek Perintis I Tahun 979 PP I-79-5 Kalsium mempunyai nomor 0, susunan elektron pada kulit K, L, M, N adalah A., 8, 0, 0 B., 8, 9, C., 8, 8, D., 8, 6, 4 E., 8,, 8 PP I-79-5 Larutan molal NaOH (BM
Kimia Proyek Perintis I Tahun 979 PP I-79-5 Kalsium mempunyai nomor 0, susunan elektron pada kulit K, L, M, N adalah A., 8, 0, 0 B., 8, 9, C., 8, 8, D., 8, 6, 4 E., 8,, 8 PP I-79-5 Larutan molal NaOH (BM
Wardaya College. Tes Simulasi Ujian Nasional SMA Berbasis Komputer. Mata Pelajaran Kimia Tahun Ajaran 2017/2018. Departemen Kimia - Wardaya College
 Tes Simulasi Ujian Nasional SMA Berbasis Komputer Mata Pelajaran Kimia Tahun Ajaran 2017/2018-1. Sebuah unsur X memiliki no massa 52 dan jumlah neutron sebesar 28. Kongurasi elektron dari ion X + adalah...
Tes Simulasi Ujian Nasional SMA Berbasis Komputer Mata Pelajaran Kimia Tahun Ajaran 2017/2018-1. Sebuah unsur X memiliki no massa 52 dan jumlah neutron sebesar 28. Kongurasi elektron dari ion X + adalah...
UN SMA 2012 IPA Kimia
 UN SMA 2012 IPA Kimia Kode Soal Doc. Name: UNSMAIPA2011KIM999 Doc. Version : 2012-12 halaman 1 01. Tahap awal pembuatan asam nitrat dalam industri melibatkan reaksi oksidasi ammonia yang menghasilkan nitrogen
UN SMA 2012 IPA Kimia Kode Soal Doc. Name: UNSMAIPA2011KIM999 Doc. Version : 2012-12 halaman 1 01. Tahap awal pembuatan asam nitrat dalam industri melibatkan reaksi oksidasi ammonia yang menghasilkan nitrogen
Struktur atom, dan Tabel periodik unsur,
 KISI-KISI PENULISAN USBN Jenis Sekolah : SMA/MA Mata Pelajaran : KIMIA Kurikulum : 2006 Alokasi Waktu : 120 menit Jumlah : Pilihan Ganda : 35 Essay : 5 1 2 3 1.1. Memahami struktur atom berdasarkan teori
KISI-KISI PENULISAN USBN Jenis Sekolah : SMA/MA Mata Pelajaran : KIMIA Kurikulum : 2006 Alokasi Waktu : 120 menit Jumlah : Pilihan Ganda : 35 Essay : 5 1 2 3 1.1. Memahami struktur atom berdasarkan teori
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA JAWABAN (DOKUMEN NEGARA) UjianTeori. Waktu: 100 menit
 OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA JAWABAN (DOKUMEN NEGARA) UjianTeori Waktu: 100 menit Kementerian Pendidikan Nasional Dan Kebudayaan Direktorat Jenderal Managemen Pendidikan Dasar
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA JAWABAN (DOKUMEN NEGARA) UjianTeori Waktu: 100 menit Kementerian Pendidikan Nasional Dan Kebudayaan Direktorat Jenderal Managemen Pendidikan Dasar
Persiapan UN 2018 KIMIA
 Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
MODUL 1 TERMOKIMIA. A. Hukum Pertama Termodinamika. B. Kalor Reaksi
 MODUL 1 TERMOKIMIA Termokimia adalah ilmu yang mempelajari hubungan antara energi panas dan energi kimia. Sebagai prasyarat untuk mempelajari termokimia, kita harus mengetahui tentang perbedaan kalor (Q)
MODUL 1 TERMOKIMIA Termokimia adalah ilmu yang mempelajari hubungan antara energi panas dan energi kimia. Sebagai prasyarat untuk mempelajari termokimia, kita harus mengetahui tentang perbedaan kalor (Q)
STANDAR KOMPETENSI. 1.Menjelaskan sifat- sifat
 SKL 1. Melakukan percobaan, antara lain merumuskan masalah, mengajukan menguji hipotesis, menentukan variabel, merancang merakit instrumen, mengumpulkan, mengolah menafsirkan data, menarik kesimpulan,
SKL 1. Melakukan percobaan, antara lain merumuskan masalah, mengajukan menguji hipotesis, menentukan variabel, merancang merakit instrumen, mengumpulkan, mengolah menafsirkan data, menarik kesimpulan,
Soal-Soal. Bab 7. Latihan Larutan Penyangga, Hidrolisis Garam, serta Kelarutan dan Hasil Kali Kelarutan. Larutan Penyangga
 Bab 7 Soal-Soal Latihan Larutan Penyangga, Hidrolisis Garam, serta Kelarutan dan Hasil Kali Kelarutan Larutan Penyangga 1. Berikut ini yang merupakan pasangan asam basa terkonjugasi (A) H 3 O + dan OH
Bab 7 Soal-Soal Latihan Larutan Penyangga, Hidrolisis Garam, serta Kelarutan dan Hasil Kali Kelarutan Larutan Penyangga 1. Berikut ini yang merupakan pasangan asam basa terkonjugasi (A) H 3 O + dan OH
SOAL SELEKSI NASIONAL TAHUN 2006
 SOAL SELEKSI NASIONAL TAHUN 2006 Soal 1 ( 13 poin ) KOEFISIEN REAKSI DAN LARUTAN ELEKTROLIT Koefisien reaksi merupakan langkah penting untuk mengamati proses berlangsungnya reaksi. Lengkapi koefisien reaksi-reaksi
SOAL SELEKSI NASIONAL TAHUN 2006 Soal 1 ( 13 poin ) KOEFISIEN REAKSI DAN LARUTAN ELEKTROLIT Koefisien reaksi merupakan langkah penting untuk mengamati proses berlangsungnya reaksi. Lengkapi koefisien reaksi-reaksi
