AMALDO FIRJARAHADI TANE
|
|
|
- Suharto Makmur
- 6 tahun lalu
- Tontonan:
Transkripsi
1 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2014 Page 1
2 1. MATERI: STOIKIOMETRI Reaksi kondensasi berkaitan dengan reaksi pembentukan polimer, di samping ada juga yang mengalami reaksi adisi. Polimer yang dimaksud dalam reaksi kondensasi di soal adalah biopolimer karbohidrat dengan hasil samping 100 molekul air. Dari sini dapat disimpulkan bahwa reaksi kondensasi adalah reaksi pembentukan polimer dari sebuah monomernya yang kehilangan sebuah gugus H 2 O berdasarkan reaksi di bawah ini (n = jumlah molekul): n (monomer) polimer + (n-1) H 2 O Nah, karena ada sejumlah molekul glukosa bergabung dan mengalami reaksi kondensasi menghasilkan sebuah biopolimer karbohidrat dan 100 molekul air dapat dipastikan ada 101 monomer glukosa yang terkondensasi agar terbentuk biopolimer sesuai reaksi di bawah ini: n (glukosa) biopolimer + (n-1) H 2 O 101 (glukosa) biopolimer + 100H 2 O [101 x M r glukosa] = [1 x M r biopolimer] + [100 x M r H 2 O] [101 x 180] = M r biopolimer + [100 x 18] M r biopolimer = JAWABAN: C PEMBAHASAN UTUL UGM KIMIA 2014 Page 2
3 2. 3. MATERI: ELEKTROKIMIA Untuk mendapatkan nilai potensial sel (E sel) reaksi yang ditanya di soal, kita cukup memainkan reaksi (1) dan (2) yang telah diketahui sebagai berikut. (1) Au e Au E = +1,50 V (2) Au + + e Au E = +1,69 V (3) 3Au + Au Au E = V? Agar nilai E sel (3) didapatkan, sesuai reaksinya ion Au 3+ berada di kanan dan ion Au + berada di kiri, sehingga reaksi (1) perlu dibalik dan reaksi (2) hanya dikalikan dengan faktor 3 agar elektron reaksi (1) dan (2) setara sehingga bisa dihilangkan (ditandai dengan warna merah) pada reaksi berikut. (1) Au Au e E = -1,50 V (2) 3Au + + 3e 3Au E = +1,69 V (3) 3Au + Au Au E = (-1,50 + 1,69) V = +0,19 V JAWABAN: C MATERI: SIFAT KOLIGATIF LARUTAN Di soal diketahui dan ditanya: Rumus empiris = C 5 H 4 m C 5 H 4 = 1,28 g PEMBAHASAN UTUL UGM KIMIA 2014 Page 3
4 4. m C 6 H 6 (benzena) = 50 g K f = 5,10 C/m ΔT f = 1,02 C M r C 5 H 4 =? Rumus empiris C 5 H 4 hanya memberitahu kita bahwa senyawa tersebutlah yang akan dilarutkan dalam pelarut benzena 50 gram. Untuk menghitung massa molar zat tersebut bisa langsung menggunakan persamaan penurunan titik beku C 5 H 4 sebagai berikut. ΔT f = K f x molal ΔT f = K f x g C 5 H 4 x 1000 M r C 5 H 4 x m C 6 H 6 1,02 C = 5,10 C/m x 1,28 gram x 1000 M r C 5 H 4 x 50 gram M r C 5 H 4 = 128 JAWABAN: B MATERI: SIFAT KOLIGATIF LARUTAN Di soal diketahui dan ditanya: m senyawa nonelektrolit: 3 gram Volume H 2 O = 100 ml ΔT b = 100,26 C Senyawa nonelektrolit =? Untuk mendapatkan tipe senyawa nonelektrolit yang dimaksud, bisa diketahui dari M r yang didapat kemudian cek seluruh obsein yang mengandung M r yang sama. Penyelesaiannya sama seperti soal di atas, namun perbedaannya adalah pelarutnya (H 2 O) dalam bentuk volume, tetapi kita memerlukannya dalam bentuk berat, dan hal ini bisa didapatkan dengan menghubungkannya ke massa jenis (densitas) air: ρ = massa volume 1 g/ml = massa/100 ml m H 2 O = 100 gram PEMBAHASAN UTUL UGM KIMIA 2014 Page 4
5 5. Cari M r senyawa nonelektrolit atau pemisalan Z! ΔT b = K b x molal T b(larutan) T b(pelaru) = K b x g Z x 1000 M r Z x m air 100,26 C 100 C = 0,52 C/m x 3,00 gram x 1000 M r Z x 100 gram M r = 60 JAWABAN: B MATERI: RADIOAKTIF Jika suatu partikel radioisotop ditembakkan sinar-sinar radioaktif akan menghasilkan suatu unsur baru dan sinar emisi (pemancar). Ingat, bahwa pada persamaan inti besarnya nomor massa (A) dan nomor atom (Z) kedua ruas haruslah sama. Nah, pada soal telah diketahui dan ditanya: Partikel radioisotop = 92 U 238 Partikel baru = 94 Pu 239 Sinar emisi dan penembak =? Dari yang diketahui di soal, dapat ditulis persamaan inti radioaktifnya: 92U a X b 94 Pu c Z d Untuk mencari nilai a, b, c, dan d pada kedua sinar radioaktif tersebut, kita harus menyamakan ruas kiri dan ruas kanan, dengan mengecek seluruh obsein. a) Ditembak satu partikel β dan melepaskan 2 partikel proton 92U β o 94 Pu ( 1 p 1 ) Nomor massa (A) (1) (SALAH) b) Ditembak satu partikel alpha dan melepaskan 3 partikel beta 92U α 4 94 Pu ( -1 β 0 ) Nomor massa (A) (0) (SALAH) PEMBAHASAN UTUL UGM KIMIA 2014 Page 5
6 6. c) Ditembak satu partikel alpha dan melepaskan 3 partikel neutron 92X He 4 94 Y ( 0 n 1 ) Nomor massa (A) = (1) 242 = 242 Nomor atom (Z) = (0) 94 = 94 (BENAR) JAWABAN: C MATERI: RADIOAKTIF Diketahui dan ditanya data di soal: t = 120 hari N t = 12,5%.N o t 1/2 = hari? Untuk mencari waktu paruhnya cukup memakai persamaan peluruhan radioaktif: (N t /N o ) = (1/2) t/t1/2 JAWABAN: D (0,125N o /N o ) = (1/2) 120/t1/2 t 1/2 = 40 hari PEMBAHASAN UTUL UGM KIMIA 2014 Page 6
7 7. MATERI: STOIKIOMETRI DAN LARUTAN PENYANGGA Nilai ph larutan antara pencampuran HCl dan NH 3 dapat dicari menggunakan konsep MBS (Mula-mula, Bereaksi, Sisa) dengan memasukkan mol masing-masing senyawa ke dalam reaksi. Nah, untuk mendapatkan jumlah molnya, perhatikan yang diketahui di soal: V HCl = 18 ml = 0,018 L V NH 3 = 24 ml = 0,024 L V H 2 O = 250 ml = 0,25 L P 0 = 76 cmhg = 1 atm T = 27 C R = 0,08 L.atm/mol.K Ada volume masing-masing gas, tekanan awal gas, suhu, dan tetapan gas ideal. Dari sini dapat disimpulkan HCl dan NH 3 yang direaksikan adalah sebuah gas ideal, artinya molnya didapatkan dari persamaan gas ideal: PV = nrt Mol HCl PV = nrt 1 atm x 0,018 L = n x 0,08 L.atm/mol.K x 300 K n HCl = 0,00075 mol Mol NH 3 PV = nrt 1 atm x 0,024 L = n x 0,08 L.atm/mol.K x 300 K n HCl = 0,001 mol PEMBAHASAN UTUL UGM KIMIA 2014 Page 7
8 8. Reaksikan kedua senyawa! HCl (g) + NH 3 (g) NH 4 Cl (aq) M 0,00075 mol 0,001 mol - B -0,00075 mol -0,00075 mol +0,00075 mol S - 0,00025 mol 0,00075 mol Terlihat yang bersisa hanya gas NH 3 dan larutan NH 4 Cl sehingga terdapat sistem larutan penyangga atau buffer yang bersifat basa. Artinya, nanti ph buffer ini pasti lebih besar dari 7 (ph > 7). Otomatis obsein A, B, dan C bisa dieliminasi. Cari ph buffer basanya! [OH - ] = K b x [basa]. [basa konjugasi] = K b x [NH 3 ] [NH 4 + ] = 1 x 10-5 x [0,00025 mol/(0,018 L + 0,024 L + 0,25 L)] [0,05 mol/(0,018 L + 0,024 L + 0,25 L)] = 1/3 x 10-5 poh = log[oh - ] = log[1/3 x 10-5 ] = log[3-1 x 10-5 ] = log[3-1 ] + ( log[10-5 ]) = log log 10 = log = 0, = 5,47 ph = 14 5,47 = 8,53 JAWABAN: E MATERI: HUKUM-HUKUM DASAR KIMIA Di soal diketahui dan ditanya: m (NH 2 ) 2 CO = 12 juta ton/tahun (pabrik) m N 2 = ton/tahun? PEMBAHASAN UTUL UGM KIMIA 2014 Page 8
9 9. Untuk menjawab soal ini, kita memerlukan dasar-dasar stoikiometri, yaitu hukumhukum dasar kimia. Hukum yang paling mendasari soal ini adalah hukum Proust, yang mengatakan bahwa perbandingan tiap-tiap unsur adalah bernilai tetap. Gas N 2 sebenarnya terdapat pada penguraian urea menjadi unsur-unsurnya. Dan, unsur N ini pasti terdapat di molekul urea sebab rumus molekul urea mengandung unsur N, yaitu (NH 2 ) 2 CO. Berdasarkan hukum Proust, massa unsur-unsur penyusun suatu senyawa dapat diketahui melalui persamaan (misalkan senyawa ZCl): m unsur Z = A r Z x jumlah atom Z di ZCl x massa ZCl M r ZCl Nah, dengan kesimpulan massa nitrogen dalam urea adalah: m unsur N = A r N x jumlah atom N di (NH 2 ) 2 CO x massa (NH 2 ) 2 CO M r (NH 2 ) 2 CO = 14 x 2 x 12 juta ton 60 = 5,6 juta ton JAWABAN: C MATERI: TERMOKIMIA DAN KIMIA ORGANIK Mencari nilai entalpi berdasarkan energi ikatan didasarkan pada selisih energi reaktan dan produk. Data di soal memperlihatkan besar energi ikatan terhadap letak atom C, yaitu C primer, sekunder, tersier, dan kuartener. Masih ingat, kan? Atom C primer = atom C yang hanya mengikat 1 atom C lainnya dan biasanya terletak di ujung-ujung rantai hidrokarbon Atom C sekunder = atom C yang mengikat 2 atom C lainnya (tidak termasuk dirinya sendiri) atau terapit oleh 2 atom C lainnya Atom C tersier = atom C yang mengikat 3 atom C lainnya Atom C kuartener = atom C yang mengikat 4 atom C lainnya PEMBAHASAN UTUL UGM KIMIA 2014 Page 9
10 Gambar struktur reaksi bagian reaktan di soal di bawah ini memperlihatkan mana yang atom C primer, sekunder, tersier, dan kuartener (kebetulan atom C tersier tidak ada): Cari nilai energinya, dengan catatan bahwa energi ikatan C dan H pada produk di reaksi soal masing-masing bernilai 0 kj karena hanya berupa unsur! Jumlah Cpri H = 12 buah Jumlah Cpri Ckuar = 4 buah Energi = Σ(energi reaktan) Σ(energi produk) = [12(Cpri H) + 4(Cpri C kuar)] 0 = 12(400) + 4(300) = 6000 kj JAWABAN: D 10. MATERI: STOIKIOMETRI Sukrosa didapatkan dari reaksi kondensasi antara glukosa dan fruktosa karena kedua karbohidrat inilah yang merupakan monomer sukrosa, dengan melepaskan sebuah gugus H 2 O (air). Nah, di soal sukrosa yang didapatkan dioksidasi sempurna, jadi di sini ada dua buah reaksi sebagai berikut. PEMBAHASAN UTUL UGM KIMIA 2014 Page 10
11 C 6 H 12 O 6 (glukosa) + C 6 H 12 O 6 (fruktosa) C 12 H 22 O 11 (sukrosa) + H 2 O (reaksi 1) C 12 H 22 O O 2 12CO H 2 O (reaksi 2) Agar didapatkan massa CO 2, kita hanya perlu membandingkan mol CO 2 dan sukrosa berdasarkan reaksi 2, sehingga: n C 12 H 22 O 11 = 17,1 gram/342 = 0,05 mol n CO 2 = 12 x 0,05 mol sukrosa = 0,6 mol CO 2 Dalam 0,6 mol CO 2 (M r = 44) terdapat 26,4 gram senyawanya JAWABAN: D 11. MATERI: KESETIMBANGAN KIMIA Di soal diketahui dan ditanya: m SO 2 Cl 2 = 13,5 gram Volume labu = 2 L T = 650 K n SO 2 = 0,05 mol (setimbang) K c =? Cari terlebih dahulu mol SO 2 Cl 2 saat awal reaksi (label M ), lalu masukkan ke sistem MBS (Mula-mula, Bereaksi, Sisa)! Ingat, jika pada setimbang ada 0,05 mol SO 2, berarti 0,05 mol SO 2 itulah yang bereaksi (label B ) dari hasil penguraian SO 2 Cl 2, dan karena perbandingan koefisien SO 2 Cl 2 dan SO 2 adalah 1 : 1, maka banyaknya SO 2 Cl 2 yang bereaksi juga 0,05 mol! n SO 2 Cl 2 = 13,5 gram/135 = 0,1 mol SO 2 Cl 2 (g) SO 2 (g) + Cl 2 (g) M 0,1 mol - - B -0,05 mol +0,05 mol +0,05 mol S 0,05 mol 0,05 mol 0,05 mol PEMBAHASAN UTUL UGM KIMIA 2014 Page 11
12 Hitung nilai K c reaksi! K c = [SO 2 ][Cl 2 ] [SO 2 Cl 2 ] = [0,05 mol/2 L][0,05 mol/2 L] [0,05 mol/2 L] = 5 x 10-2 JAWABAN: C 12. MATERI: TERMOKIMIA Diketahui dan ditanya: ΔH f CH 4 = a kj/mol ΔH f CO 2 = b kj/mol ΔH f H 2 O = c kj/mol ΔH c CH 4 80 gram = kj? Ingat, bahwa ΔH f dan ΔH c adalah energi yang dibutuhkan utnuk membentuk dan/atau membakar 1 mol zat yang direaksikan. Misal, pembentukan C 6 H 6 artinya banyaknya energi yang dibutuhkan untuk membentuk 1 mol benzena. Dengan pengertian tersebut, dapat kita selesaikan nilai ΔH c metana untuk 1 mol pada reaksi (d) dengan memainkan reaksi (a), (b), dan (c): a) C + 2H 2 CH 4 ΔH f = a b) C + O 2 CO 2 ΔH f = b c) H 2 + ½ O 2 H 2 O ΔH f = c d) CH 4 + 2O 2 CO 2 + 2H 2 O ΔH c = kj ΔH c reaksi (d) didapatkan dengan membalikkan reaksi (a), reaksi (b) tidak diganggu, dan reaksi (c) dikalikan dengan faktor 2 sehingga ada zat yang dihilangkan (ditandai dengan warna merah) sebagai berikut. a) CH 4 C + 2H 2 ΔH f = -a b) C + O 2 CO 2 ΔH f = b c) 2H 2 + O 2 2H 2 O ΔH f = 2c d) CH 4 + 2O 2 CO 2 + 2H 2 O ΔH c = (b + 2c a) kj PEMBAHASAN UTUL UGM KIMIA 2014 Page 12
13 Nilai ΔH c di atas untuk 1 mol CH 4, sementara kita memerlukan ΔH c untuk 80 gram metana atau setara dengan 5 mol CH 4 sehingga: ΔH c1 = n 1 ΔH c2 n 2 (b + 2c a) = 1 mol ΔH c2 5 mol ΔH c2 = 5(b + 2c a) kj JAWABAN: D 13. MATERI: ELEKTROLISIS 0,01 M AgNO ml atau 0,001 mol AgNO 3 yang, misalkan, dielektrolisis di sebuah wadah A akan menghasilkan katode Ag + - dan anode NO 3 sesuai reaksi ionisasinya: AgNO (aq) Ag + (aq) + NO - 3 (aq) 0,001 mol 0,001 mol 0,001 mol Ingat, pada elektrolisis jumlah kuantitas yang sama adalah aliran arus listrik (i) yang digunakan sehingga jumlah elektron (e) yang dibawa tiap satuan waktu (t) bernilai sama di katode maupun anode karena dihubungkan secara seri. Ag + (aq) + e Ag (s) 0,001 mol 0,001 mol Analisis jawaban! a) Nilai ph elektrolisis larutan AgNO 3 didapatkan dari bagian anode karena ion NO - 3 sesuai reaksi ionisasi AgNO 3 di atas adalah jenis sisa asam oksi sehingga air (H 2 O) yang teroksidasi sesuai persamaan elektrolisis berikut. 2H 2 O 4H + + O 2 + 4e 0,001 mol 0,001 mol Nah, karena perbandingan koefisien H + dengan e adalah 4 : 4 atau 1 : 1, maka jumlah mol ion proton juga 0,001 mol sehingga [H + ] dapat dihitung: PEMBAHASAN UTUL UGM KIMIA 2014 Page 13
14 [H + ] = 0,001 mol = 1 x 10-2 ph = 2 (SALAH) 0,1 L b) Berdasarkan reaksi ionisasi AgNO 3 0,001 mol di atas, didapatkan 0,001 mol ion Ag + di katode sebagai berikut. Ag + (aq) + e Ag (s) 0,001 mol 0,001 mol Karena perbandingan koefisien Ag + dan Ag adalah 1 : 1, jumlah mol Ag juga 0,001 mol (A r Ag = 108) dengan massa mg. (SALAH) - c) Di anode ada ion NO 3 dan air (H 2 O) sehingga air yang teroksidasi menghasilkan gas O 2 seperti di bawah ini. Gas H 2 hanya dihasilkan di anode. (SALAH) 2H 2 O 4H + + O 2 + 4e d) Reaksi di katode adalah reduksi ion Ag + menjadi padatan Ag dengan reaksinya di katode: (SALAH) Ag + (aq) + e Ag (s) e) Untuk menentukan reaksi total elektrolisis, tentukan spesi yang tereduksi di katode dan teroksidasi di anode: (BENAR) Katode = Ag + + e Ag (x4) Anode = 2H 2 O 4H + + O 2 + 4e Reaksi elektrolisis = 4Ag + + 2H 2 O 4Ag + 4H + + O 2 JAWABAN: E 14. MATERI: TERMOKIMIA Reaksi pembentukan CS 2 dari unsur-unsurnya adalah seperti yang tertera pada reaksi (d) di bawah ini. Agar didapatkan nilai entalpinya, kita cukup memainkan reaksi (a), (b), dan (c). a) C (s) + O 2 (g) CO 2 (g) ΔH f = -400 kj b) S (s) + O 2 (g) SO 2 (g) ΔH f = -300 kj c) CS 2 (l) + 3O 2 (g) CO 2 (g) + 2SO 2 (g) ΔH c = kj d) C (s) + 2S (s) CS 2 (l) ΔH f = kj PEMBAHASAN UTUL UGM KIMIA 2014 Page 14
15 Entalpi reaksi (d) bisa didapatkan dengan mengkalikan reaksi (b) dengan faktor 2, reaksi (a) tidak diganggu, dan reaksi (c) dibalik, dengan ada zat yang dihilangkan (ditandai dengan warna merah): a) C (s) + O 2 (g) CO 2 (g) ΔH f = -400 kj b) 2S (s) + 2O 2 (g) 2SO 2 (g) ΔH f = -600 kj c) CO 2 (g) + 2SO 2 (g) CS 2 (l) + 3O 2 (g) ΔH c = kj d) C (s) + 2S (s) CS 2 (l) ΔH f = = +100 kj JAWABAN: D 15. MATERI: ELEKTROLISIS Di soal diketahui dan ditanya: Volume CuSO 4 = 2 L ph = 2 log 5 m Cu = gram? Ingat, dalam elektrolisis jumlah kuantitas yang sama adalah mol elektron di katode dan anode karena arus listrik yang digunakan selama proses dirangkai secara seri sehingga muatan yang dibawa (e) sama besar di kedua kutub. Nah, untuk mendapatkan massa Cu di katode, kita bisa mencari terlebih dahulu nilai mol elektron di anode dengan membandingkan koefisiennya pada data ph. Cari jumlah mol ion protonnya dahulu: ph = 2 log 5 [H + ] = 5 x 10-2 [H + ] = n H + V 5 x 10-2 = n H + 2 L n H + = 0,1 mol CuSO 4 yang dielektrolisis dalam fase larutan, maka: Reaksi ionisasi = CuSO 4 (aq) Cu 2+ (aq) + SO 2-4 (aq) Katode = Cu e Cu Anode = 2H 2 O 4H + + O 2 + 4e PEMBAHASAN UTUL UGM KIMIA 2014 Page 15
16 Pada anode terbentuk ion proton hasil teroksidasinya H 2 O, dan karena perbandingan koefisien H + dengan elektron adalah 4 : 4 atau 1 : 1, maka jumlah mol elektron (e) juga sebesar 0,1 mol: 2H 2 O 4H + + O 2 + 4e 0,1 mol 0,1 mol Besarnya mol elektron ini sama besar di kutub katode seperti reaksi di bawah. Dan, perbandingan koefisien antara elektron banding Cu adalah 2 : 1, maka jumlah mol padatan Cu adalah ½ -nya atau 0,05 mol. Cu 2+ (aq) + 2e Cu (s) 0,05 mol 0,05 mol Ada 0,05 mol padatan Cu (A r = 63,5) yang terbentuk di katode sehingga padatan tersebut bermassa 3,175 gram. JAWABAN: B 16. MATERI: KIMIA UNSUR Pernyataan di soal membicarakan kelarutan perak halida (AgX; X = halida). Ingat, kelarutan perak halida dari atas ke bawah semakin kecil sehingga AgF merupakan perak halida mudah larut sementara AgI adalah perak halida sukar larut, artina nilai K sp AgF > K sp AgI. Agar reaksi terjadi, maka perak halida yang digunakan sebagai reaktan harus memiliki kelarutan yang lebih besar agar mudah larut yang nantinya membentuk sebuah produk perak halida lainnya dengan kelarutan yang lebih kecil. Jadi, AgI pada reaksi nilai K sp harus lebih kecil dibandingkan K sp AgBr, nyatanya nilai K sp AgI > K sp AgBr karena Br terletak lebih atas dibanding I. (SALAH) Sudah jelas bahwa K sp AgBr > K sp AgI. (SALAH) JAWABAN: E PEMBAHASAN UTUL UGM KIMIA 2014 Page 16
17 17. MATERI: KIMIA ORGANIK Molekul 2,2-dimetilpropana; 2-metilbutana; dan pentana adalah jenis hidrokarbon alkana. Untuk menjawab soal ini, kita memerlukan struktur ketiga senyawa alkana tersebut seperti gambar di bawah ini: Ketiga senyawa pada gambar di atas memang memiliki rumus yang sama, yaitu C 5 H 12. Nah, titik didih ketiga senyawa tersebut ditentukan dari banyaknya cabang yang ada dalam strukturnya. Semakin banyak cabang, semakin rendah titik didihnya sehingga jika dipanaskan mudah memutuskan ikatan-ikatan karbonnya. Jadi, urutan titik didih tertinggi adalah pentana > 2-metilbutana > 2,2-dimetilbutana. (SALAH) Luas singgung yang dimaksud adalah luas struktur molekulnya. Semakin kecil strukturnya, maka semakin banyak cabang yang dikandung. Jadi, pentana memiliki luas singgung terbesar, diikuti 2-metilbutana, dan 2,2-dimetilpropana. (SALAH) JAWABAN: E PEMBAHASAN UTUL UGM KIMIA 2014 Page 17
18 18. MATERI: KIMIA UNSUR Entalpi silikon dioksida (SiO 2 ) memang lebih tinggi dibandingkan entalpi silikon fluorida (SiF 4 ) karena SiO 2 mengandung ikatan kovalen raksasa yang sangat susah untuk diputuskan ikatannya. Berbeda dengan SiF 4 yang tidak memiliki ikatan kovalen raksasa, melainkan ikan kovalen. Hal inilah yang menyebabkan entalpi penguapan SiO 2 lebih tinggi daripada SiF 4. (BENAR) SiO 2 memiliki entalpi penguapan yang besar karena dalam fase padat, sedangkan SiF 4 berwujud gas dan mudah untuk merenggangkan molekul-molekul SiF 4 jika diuapkan lagi. (BENAR) JAWABAN: A 19. MATERI: KIMIA ORGANIK Garis-garis yang saling menyambung pada struktur di soal sebenarnya adalah atom karbon (C) dan hidrogen (H). Agar memudahkan untuk menjawabnya, pada gambar di bawah ini adalah struktur molekul organik yang dimaksud di soal: PEMBAHASAN UTUL UGM KIMIA 2014 Page 18
19 Lambang 1, 2, 3, dan tanda bintang (*) berturut-turut menunjukkan atom karbon C primer, sekunder, tersier, dan kiral (asimetris). Atom C kiral adalah atom C asimetris yang keempat lengannya terikat oleh gugus yang berbeda. Pada atom C bertanda bintang pada gambar di atas, terikat oleh gugus CH, H, Cl, dan CH 2. Nah, identikasi masing-masing jumlahnya: Atom C primer = 4 Atom C sekunder = 3 Aotm C tersier = 2 Atom C asimetris = 1 JAWABAN: A 20. MATERI: LAJU DAN ORDE REAKSI Analisis soal! a) Jika [P] dibuat tetap dan [Q] dijadikan dua kali, maka laju reaksi menjadi empat kali. Nah, dari sini kita bisa membuat perbandingan antara laju reaksi awal terhadap laju reaksi kedua, di mana laju reaksi kedua adalah laju ketika konsentrasi [Q] dijadikan dua kali. Misalkan orde terhadap P adalah x dan orde terhadap Q adalah y, sehingga: r 2 = k [P] x y 2 [Q] 2 r 1 k [P] x y 1 [Q] 1 4r 1 = k [P] x y [2Q] 1 r 1 k [P] x y [Q] 1 4 = [2] y y = 2 b) Jika [P] dan [Q] sama-sama dijadikan dua kali, maka laju reaksi tetap empat kali. Nah, dari sini sih sudah dapat disimpulkan orde terhadap P atau orde x PEMBAHASAN UTUL UGM KIMIA 2014 Page 19
20 bernilai 0 karena tidak berpengaruh apapun terhadap laju reaksi. Hal ini bisa dibuktikan berdasarkan hukum laju reaksi: r 2 = k [P] x y 2 [Q] 2 r 1 k [P] x y 1 [Q] 1 4r 1 = k [2P] x y 1 [2Q] 1 r 1 k [P] x y 1 [Q] 1 4 = [2] x [2] y 4 = [2] x [2] 2 4 = [2] x [4] 1 = [2] x x = 0 Oke, mari analisa jawaban! 1) Dari penyelesaian di atas, terlihat orde terhadap P (x) adalah nol dan orde terhadap Q (y) adalah 2. (BENAR) 2) Satuan konstanta laju reaksi (k) dapat dicari menggunakan hukum laju reaksinya, dengan mengingat bahwa satuan laju reaksi adalah mol/l.s. r = k [P] x [Q] y r = k [P] 0 [Q] 2 r = k [Q] 2 mol L -1 s -1 = k [mol L -1 s -1 ] 2 k = mol -1. L. s -1 (BENAR) 3) Karena orde terhadap P adalah nol, maka konsentrasi tidak berpengaruh. (BENAR) 4) Konsentrasi P tidak berpengaruh terhadap laju reaksi karena berorde nol. (SALAH) JAWABAN: A #UTULUGM2014 PEMBAHASAN UTUL UGM KIMIA 2014 Page 20
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2015 Page 1 1. MATERI: STOIKIOMETRI Persen massa adalah persentase massa zat terlarut dalam 100 gram massa larutan (massa pelarut + massa
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2015 Page 1 1. MATERI: STOIKIOMETRI Persen massa adalah persentase massa zat terlarut dalam 100 gram massa larutan (massa pelarut + massa
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: HUKUM-HUKUM DASAR KIMIA Di soal diketahui dan ditanya: m (NH 2 ) 2 CO = 12.000 ton/tahun (pabrik) m N 2 = ton/tahun?
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: HUKUM-HUKUM DASAR KIMIA Di soal diketahui dan ditanya: m (NH 2 ) 2 CO = 12.000 ton/tahun (pabrik) m N 2 = ton/tahun?
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: TERMOKIMIA Pada soal diketahui dan ditanya: ΔH c C 2 H 5 OH = -1380 kj/mol ΔH d C 6 H 12 O 6 = -60 kj/mol ΔH c C
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: TERMOKIMIA Pada soal diketahui dan ditanya: ΔH c C 2 H 5 OH = -1380 kj/mol ΔH d C 6 H 12 O 6 = -60 kj/mol ΔH c C
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Cr memiliki nomor atom 24. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Cr memiliki nomor atom 24. Ingat, bahwa jumlah
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Y memiliki nomor atom 17. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Y memiliki nomor atom 17. Ingat, bahwa jumlah
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur X memiliki nomor atom 19. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur X memiliki nomor atom 19. Ingat, bahwa jumlah
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur R memiliki nomor atom 33. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur R memiliki nomor atom 33. Ingat, bahwa jumlah
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Ingat, bahwa jumlah neutron suatu unsur dan ionnya bernilai sama, yang membedakannya
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Ingat, bahwa jumlah neutron suatu unsur dan ionnya bernilai sama, yang membedakannya
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur X memiliki nomor atom 21. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur X memiliki nomor atom 21. Ingat, bahwa jumlah
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Se memiliki nomor atom 34. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Se memiliki nomor atom 34. Ingat, bahwa jumlah
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur A memiliki nomor atom 16. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur A memiliki nomor atom 16. Ingat, bahwa jumlah
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Ingat, bahwa jumlah neutron suatu unsur dan ionnya bernilai sama, yang membedakannya
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Ingat, bahwa jumlah neutron suatu unsur dan ionnya bernilai sama, yang membedakannya
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Q memiliki nomor atom 22. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Q memiliki nomor atom 22. Ingat, bahwa jumlah
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom nitrogen adalah 7 (ditulis 7 N) dan nomor atom
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom nitrogen adalah 7 (ditulis 7 N) dan nomor atom
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom fluor adalah 9 (ditulis 9 F) dan nomor atom belerang
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom fluor adalah 9 (ditulis 9 F) dan nomor atom belerang
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom karbon adalah 6 (ditulis 6 C) dan nomor atom klor
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom karbon adalah 6 (ditulis 6 C) dan nomor atom klor
PREDIKSI UJIAN NASIONAL 2011 KIMIA
 Soal PREDIKSI Latihan UJIAN NASIONAL 2011 2013 KIMIA 1 LATIHAN UJIAN AKHIR NASIONAL TAHUN AJARAN 2012/2013 KIMIA 1. Jika unsur 19 X berikatan dengan unsur 35 Z maka, rumus senyawa dan jenis ikatan yang
Soal PREDIKSI Latihan UJIAN NASIONAL 2011 2013 KIMIA 1 LATIHAN UJIAN AKHIR NASIONAL TAHUN AJARAN 2012/2013 KIMIA 1. Jika unsur 19 X berikatan dengan unsur 35 Z maka, rumus senyawa dan jenis ikatan yang
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom karbon adalah 6 (ditulis 6 C) dan nomor atom klor
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom karbon adalah 6 (ditulis 6 C) dan nomor atom klor
D. 2 dan 3 E. 2 dan 5
 1. Pada suhu dan tekanan sama, 40 ml P 2 tepat habis bereaksi dengan 100 ml, Q 2 menghasilkan 40 ml gas PxOy. Harga x dan y adalah... A. 1 dan 2 B. 1 dan 3 C. 1 dan 5 Kunci : E D. 2 dan 3 E. 2 dan 5 Persamaan
1. Pada suhu dan tekanan sama, 40 ml P 2 tepat habis bereaksi dengan 100 ml, Q 2 menghasilkan 40 ml gas PxOy. Harga x dan y adalah... A. 1 dan 2 B. 1 dan 3 C. 1 dan 5 Kunci : E D. 2 dan 3 E. 2 dan 5 Persamaan
KISI-KISI UN KIMIA SMA/MA
 KISI-KISI UN KIMIA SMA/MA 2015-2016 Siswa mampu memahami, menguasai pengetahuan/ mengaplikasikan pengetahuan/ menggunakan nalar dalam hal: Struktur Atom Sistem Periodik Unsur Ikatan Kimia (Jenis Ikatan)
KISI-KISI UN KIMIA SMA/MA 2015-2016 Siswa mampu memahami, menguasai pengetahuan/ mengaplikasikan pengetahuan/ menggunakan nalar dalam hal: Struktur Atom Sistem Periodik Unsur Ikatan Kimia (Jenis Ikatan)
PAKET UJIAN NASIONAL 17 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 17 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
PAKET UJIAN NASIONAL 17 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
1s 2 2s 2 2p 6 3s 2 2p 6 3d 4s 1 4p 4d 4f 5s 5p 5d 5f
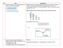 NO SOAL PEMBAHASAN 1 Konfigurasi elekttron ion X - yang memiliki nomor massa 39 dan 21 neutron adalah.. A. 1s2 2s2 2p6 3s2 3p6 4s2 3d1 B. 1s2 2s2 2p6 3s2 3p6 4s1 C. 1s2 2s2 2p6 3s2 3p6 3d1 D. 1s2 2s2 2p6
NO SOAL PEMBAHASAN 1 Konfigurasi elekttron ion X - yang memiliki nomor massa 39 dan 21 neutron adalah.. A. 1s2 2s2 2p6 3s2 3p6 4s2 3d1 B. 1s2 2s2 2p6 3s2 3p6 4s1 C. 1s2 2s2 2p6 3s2 3p6 3d1 D. 1s2 2s2 2p6
Wardaya College. Tes Simulasi Ujian Nasional SMA Berbasis Komputer. Mata Pelajaran Kimia Tahun Ajaran 2017/2018. Departemen Kimia - Wardaya College
 Tes Simulasi Ujian Nasional SMA Berbasis Komputer Mata Pelajaran Kimia Tahun Ajaran 2017/2018-1. Sebuah unsur X memiliki no massa 52 dan jumlah neutron sebesar 28. Kongurasi elektron dari ion X + adalah...
Tes Simulasi Ujian Nasional SMA Berbasis Komputer Mata Pelajaran Kimia Tahun Ajaran 2017/2018-1. Sebuah unsur X memiliki no massa 52 dan jumlah neutron sebesar 28. Kongurasi elektron dari ion X + adalah...
SOAL SELEKSI OLIMPIADE SAINS TINGKAT KABUPATEN/KOTA 2004 CALON TIM OLIMPIADE KIMIA INDONESIA
 SOAL SELEKSI OLIMPIADE SAINS TINGKAT KABUPATEN/KOTA 2004 CALON TIM OLIMPIADE KIMIA INDONESIA 2005 Bidang Kimia KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN DIREKTORAT JENDERAL PENDIDIKAN MENENGAH DIREKTORAT PEMBINAAN
SOAL SELEKSI OLIMPIADE SAINS TINGKAT KABUPATEN/KOTA 2004 CALON TIM OLIMPIADE KIMIA INDONESIA 2005 Bidang Kimia KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN DIREKTORAT JENDERAL PENDIDIKAN MENENGAH DIREKTORAT PEMBINAAN
KISI-KISI PENULISAN SOAL USBN
 KISI-KISI PENULISAN USBN Jenis Sekolah : SMA/MA Mata Pelajaran : KIMIA Kurikulum : 2013 Alokasi Waktu : 120 menit Jumlah : Pilihan Ganda : 35 Essay : 5 1 2 3 4 3.4 Menganalisis hubungan konfigurasi elektron
KISI-KISI PENULISAN USBN Jenis Sekolah : SMA/MA Mata Pelajaran : KIMIA Kurikulum : 2013 Alokasi Waktu : 120 menit Jumlah : Pilihan Ganda : 35 Essay : 5 1 2 3 4 3.4 Menganalisis hubungan konfigurasi elektron
D. 8 mol S E. 4 mol Fe(OH) 3 C. 6 mol S Kunci : B Penyelesaian : Reaksi :
 1. Perhatikan reaksi, 2 Fe 2 S 3 + 3O 2 + 6 H 2 O 4 Fe(OH) 3 + 6S Jika 2 mol Fe 2 S 3, 2 mol O 2 dan 3 mol H 2 O bereaksi dengan sempurna, akan dihasilkan : A. 3 mol Fe(OH) 3 B. 2 mol Fe(OH) 3 D. 8 mol
1. Perhatikan reaksi, 2 Fe 2 S 3 + 3O 2 + 6 H 2 O 4 Fe(OH) 3 + 6S Jika 2 mol Fe 2 S 3, 2 mol O 2 dan 3 mol H 2 O bereaksi dengan sempurna, akan dihasilkan : A. 3 mol Fe(OH) 3 B. 2 mol Fe(OH) 3 D. 8 mol
Soal ini terdiri dari 10 soal Essay (153 poin)
 Bidang Studi Kode Berkas : Kimia : KI-L01 (soal) Soal ini terdiri dari 10 soal Essay (153 poin) Tetapan Avogadro N A = 6,022 10 23 partikel.mol 1 Tetapan Gas Universal R = 8,3145 J.mol -1.K -1 = 0,08206
Bidang Studi Kode Berkas : Kimia : KI-L01 (soal) Soal ini terdiri dari 10 soal Essay (153 poin) Tetapan Avogadro N A = 6,022 10 23 partikel.mol 1 Tetapan Gas Universal R = 8,3145 J.mol -1.K -1 = 0,08206
D kj/mol E kj/mol
 1. Dari data : 2H 2 (g) + O 2 (g) 2H 2 O (l) H = -571 kj 2Ca (s) + O 2 (g) 2CaO(s) H = -1269 kj CaO (s) + H 2 O (l) Ca(OH)2(s) H = -64 kj Dapat dihitung entalpi pembentukan Ca(OH) 2 (s) sebesar... A. -984
1. Dari data : 2H 2 (g) + O 2 (g) 2H 2 O (l) H = -571 kj 2Ca (s) + O 2 (g) 2CaO(s) H = -1269 kj CaO (s) + H 2 O (l) Ca(OH)2(s) H = -64 kj Dapat dihitung entalpi pembentukan Ca(OH) 2 (s) sebesar... A. -984
Struktur atom, dan Tabel periodik unsur,
 KISI-KISI PENULISAN USBN Jenis Sekolah : SMA/MA Mata Pelajaran : KIMIA Kurikulum : 2006 Alokasi Waktu : 120 menit Jumlah : Pilihan Ganda : 35 Essay : 5 1 2 3 1.1. Memahami struktur atom berdasarkan teori
KISI-KISI PENULISAN USBN Jenis Sekolah : SMA/MA Mata Pelajaran : KIMIA Kurikulum : 2006 Alokasi Waktu : 120 menit Jumlah : Pilihan Ganda : 35 Essay : 5 1 2 3 1.1. Memahami struktur atom berdasarkan teori
LOGO STOIKIOMETRI. Marselinus Laga Nur
 LOGO STOIKIOMETRI Marselinus Laga Nur Materi Pokok Bahasan : A. Konsep Mol B. Penentuan Rumus Kimia C. Koefisien Reaksi D. Hukum-hukum Gas A. Konsep Mol Pengertian konsep mol Hubungan mol dengan jumlah
LOGO STOIKIOMETRI Marselinus Laga Nur Materi Pokok Bahasan : A. Konsep Mol B. Penentuan Rumus Kimia C. Koefisien Reaksi D. Hukum-hukum Gas A. Konsep Mol Pengertian konsep mol Hubungan mol dengan jumlah
D. 3 dan 4 E. 1 dan 5
 1. Dari beberapa unsur berikut yang mengandung : 1. 20 elektron dan 20 netron 2. 10 elektron dan 12 netron 3. 15 proton dan 16 netron 4. 20 netron dan 19 proton 5. 12 proton dan 12 netron Yang memiliki
1. Dari beberapa unsur berikut yang mengandung : 1. 20 elektron dan 20 netron 2. 10 elektron dan 12 netron 3. 15 proton dan 16 netron 4. 20 netron dan 19 proton 5. 12 proton dan 12 netron Yang memiliki
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A. D. Cu E. Zn
 1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH
 PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH TAHUN 2016 Soal diketik ulang oleh urip rukim (www.urip.info)
PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH TAHUN 2016 Soal diketik ulang oleh urip rukim (www.urip.info)
PAKET UJIAN NASIONAL 7 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 7 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Dari beberapa unsur berikut yang mengandung : 1. 20
PAKET UJIAN NASIONAL 7 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Dari beberapa unsur berikut yang mengandung : 1. 20
Materi Pokok Bahasan :
 STOIKIOMETRI Kompetensi : Memiliki kemampuan untuk menginterpretasikan serta menerapkan dalam perhitungan kimia. Memiliki kemampuan untuk mengaplikasikan pengetahuan yang dimilikinya dan terbiasa menggunakan
STOIKIOMETRI Kompetensi : Memiliki kemampuan untuk menginterpretasikan serta menerapkan dalam perhitungan kimia. Memiliki kemampuan untuk mengaplikasikan pengetahuan yang dimilikinya dan terbiasa menggunakan
PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53
PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53
D. beta dan alfa E. alfa dan beta
 1. Pada peluruhan menjadi kemudian meluruh menjadi, partikel-partikel yang dipancarkan berturut-turut adalah... A. foton dan beta B. foton dan alfa C. beta dan foton Reaksi peluruhan : D. beta dan alfa
1. Pada peluruhan menjadi kemudian meluruh menjadi, partikel-partikel yang dipancarkan berturut-turut adalah... A. foton dan beta B. foton dan alfa C. beta dan foton Reaksi peluruhan : D. beta dan alfa
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL. UjianTeori. Waktu: 100 menit
 OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
Mengubah energi kimia menjadi energi listrik Mengubah energi listrik menjadi energi kimia Katoda sebagi kutub positif, anoda sebagai kutub negatif
 TUGAS 1 ELEKTROKIMIA Di kelas X, anda telah mempelajari bilangan oksidasi dan reaksi redoks. Reaksi redoks adalah reaksi reduksi dan oksidasi. Reaksi reduksi adalah reaksi penangkapan elektron atau reaksi
TUGAS 1 ELEKTROKIMIA Di kelas X, anda telah mempelajari bilangan oksidasi dan reaksi redoks. Reaksi redoks adalah reaksi reduksi dan oksidasi. Reaksi reduksi adalah reaksi penangkapan elektron atau reaksi
UJIAN NASIONAL TAHUN PELAJARAN 2007/2008
 UJIAN NASIONAL TAHUN PELAJARAN 2007/2008 PANDUAN MATERI SMA DAN MA K I M I A PROGRAM STUDI IPA PUSAT PENILAIAN PENDIDIKAN BALITBANG DEPDIKNAS KATA PENGANTAR Dalam rangka sosialisasi kebijakan dan persiapan
UJIAN NASIONAL TAHUN PELAJARAN 2007/2008 PANDUAN MATERI SMA DAN MA K I M I A PROGRAM STUDI IPA PUSAT PENILAIAN PENDIDIKAN BALITBANG DEPDIKNAS KATA PENGANTAR Dalam rangka sosialisasi kebijakan dan persiapan
Sulistyani, M.Si.
 Sulistyani, M.Si. sulistyani@uny.ac.id Reaksi oksidasi: perubahan kimia suatu spesies (atom, unsur, molekul) melepaskan elektron. Cu Cu 2+ + 2e Reaksi reduksi: perubahan kimia suatu spesies (atom, unsur,
Sulistyani, M.Si. sulistyani@uny.ac.id Reaksi oksidasi: perubahan kimia suatu spesies (atom, unsur, molekul) melepaskan elektron. Cu Cu 2+ + 2e Reaksi reduksi: perubahan kimia suatu spesies (atom, unsur,
LEMBARAN SOAL 5. Pilih satu jawaban yang benar!
 LEMBARAN SOAL 5 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
LEMBARAN SOAL 5 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
KISI KISI SOAL UJIAN SEKOLAH SMK SE-KABUPATEN CIAMIS TP. 2013/2014
 Mata Pelajaran : KIMIA KISI KISI UJIAN SEKOLAH SMK SE-KABUPATEN CIAMIS TP. 2013/2014 TINGKAT 1 Memahami konsep materi dan perubahannya Pengertian perubahan Kimia dan Fisika dijelaskan melalui contoh-contoh
Mata Pelajaran : KIMIA KISI KISI UJIAN SEKOLAH SMK SE-KABUPATEN CIAMIS TP. 2013/2014 TINGKAT 1 Memahami konsep materi dan perubahannya Pengertian perubahan Kimia dan Fisika dijelaskan melalui contoh-contoh
TRY OUT UJIAN NASIONAL TAHUN AJARAN 2008 / 2009
 TRY UT UJIAN NASINAL TAHUN AJARAN 2008 / 2009 LEMBAR SAL B Bidang Studi : KIMIA Kelas/Program : XII (Dua Belas)/IPA PETUNJUK UMUM 1. Berdo alah sebelum mengerjakan soal 2. Tulislah dahulu nama dan kelas
TRY UT UJIAN NASINAL TAHUN AJARAN 2008 / 2009 LEMBAR SAL B Bidang Studi : KIMIA Kelas/Program : XII (Dua Belas)/IPA PETUNJUK UMUM 1. Berdo alah sebelum mengerjakan soal 2. Tulislah dahulu nama dan kelas
PAKET UJIAN NASIONAL 14 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASINAL 14 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
PAKET UJIAN NASINAL 14 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
D. 4,50 x 10-8 E. 1,35 x 10-8
 1. Pada suatu suhu tertentu, kelarutan PbI 2 dalam air adalah 1,5 x 10-3 mol/liter. Berdasarkan itu maka Kp PbI 2 adalah... A. 4,50 x 10-9 B. 3,37 x 10-9 C. 6,75 x 10-8 S : PbI 2 = 1,5. 10-3 mol/liter
1. Pada suatu suhu tertentu, kelarutan PbI 2 dalam air adalah 1,5 x 10-3 mol/liter. Berdasarkan itu maka Kp PbI 2 adalah... A. 4,50 x 10-9 B. 3,37 x 10-9 C. 6,75 x 10-8 S : PbI 2 = 1,5. 10-3 mol/liter
UN SMA 2012 IPA Kimia
 UN SMA 2012 IPA Kimia Kode Soal Doc. Name: UNSMAIPA2011KIM999 Doc. Version : 2012-12 halaman 1 01. Tahap awal pembuatan asam nitrat dalam industri melibatkan reaksi oksidasi ammonia yang menghasilkan nitrogen
UN SMA 2012 IPA Kimia Kode Soal Doc. Name: UNSMAIPA2011KIM999 Doc. Version : 2012-12 halaman 1 01. Tahap awal pembuatan asam nitrat dalam industri melibatkan reaksi oksidasi ammonia yang menghasilkan nitrogen
K13 Revisi Antiremed Kelas 11 Kimia
 K13 Revisi Antiremed Kelas 11 Kimia Persiapan UTS Semester Ganjil Doc. Name: RK13AR11KIM01UTS Doc. Version: 2016-10 halaman 1 01. Sebenarnya kimia organik dan anorganik tidaklah perlu dipisah-pisahkan,
K13 Revisi Antiremed Kelas 11 Kimia Persiapan UTS Semester Ganjil Doc. Name: RK13AR11KIM01UTS Doc. Version: 2016-10 halaman 1 01. Sebenarnya kimia organik dan anorganik tidaklah perlu dipisah-pisahkan,
UN SMA IPA Kimia. Kode Soal 305
 UN SMA IPA Kimia Kode Soal 305 Doc.name : UNSMAIPAKIM305 Version : 2012-12 halaman 1 1. Di antara hal-hal di bawah ini : 1. besi berpilar 2. pagar di cat 3. belerang meleleh 4. nasi jadi basi 5. bel berdering
UN SMA IPA Kimia Kode Soal 305 Doc.name : UNSMAIPAKIM305 Version : 2012-12 halaman 1 1. Di antara hal-hal di bawah ini : 1. besi berpilar 2. pagar di cat 3. belerang meleleh 4. nasi jadi basi 5. bel berdering
KIMIA SMA/MA PROGRAM STUDI IPA Waktu 120 menit. Berdasarkan Lampiran Permendiknas Nomor 77 Tahun 2008 Tanggal 5 Desember 2008
 KIMIA SMA/MA PROGRAM STUDI IPA Waktu 120 menit Berdasarkan Lampiran Permendiknas Nomor 77 Tahun 2008 Tanggal 5 Desember 2008 MATA PELAJARAN Mata Pelajaran Program Studi : Kimia : IPA PETUNJUK UMUM A. Isikan
KIMIA SMA/MA PROGRAM STUDI IPA Waktu 120 menit Berdasarkan Lampiran Permendiknas Nomor 77 Tahun 2008 Tanggal 5 Desember 2008 MATA PELAJARAN Mata Pelajaran Program Studi : Kimia : IPA PETUNJUK UMUM A. Isikan
SOAL KIMIA 2 KELAS : XI IPA
 SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
 TRY OUT SELEKSI OLIMPIADE TINGKAT KABUPATEN/KOTA 2010 TIM OLIMPIADE KIMIA INDONESIA 2011 Waktu: 150 Menit PUSAT KLINIK PENDIDIKAN INDONESIA (PKPI) bekerjasama dengan LEMBAGA BIMBINGAN BELAJAR SSCIntersolusi
TRY OUT SELEKSI OLIMPIADE TINGKAT KABUPATEN/KOTA 2010 TIM OLIMPIADE KIMIA INDONESIA 2011 Waktu: 150 Menit PUSAT KLINIK PENDIDIKAN INDONESIA (PKPI) bekerjasama dengan LEMBAGA BIMBINGAN BELAJAR SSCIntersolusi
KIMIA TERAPAN STOIKIOMETRI DAN HUKUM-HUKUM KIMIA Haris Puspito Buwono
 KIMIA TERAPAN STOIKIOMETRI DAN HUKUM-HUKUM KIMIA Haris Puspito Buwono Semester Gasal 2012/2013 STOIKIOMETRI 2 STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi
KIMIA TERAPAN STOIKIOMETRI DAN HUKUM-HUKUM KIMIA Haris Puspito Buwono Semester Gasal 2012/2013 STOIKIOMETRI 2 STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi
SIMULASI UJIAN NASIONAL 1
 SIMULASI UJIAN NASIONAL 1 1. Bilangan-bilangan kuantum yang mungkin dimiliki oleh suatu elektron (A) n = 2, l = 2, m = 0, s = - 1 2 (B) n = 3, l = 0, m = +1, s = + 1 2 (C) n = 4, l = 2, m = - 3, s = -
SIMULASI UJIAN NASIONAL 1 1. Bilangan-bilangan kuantum yang mungkin dimiliki oleh suatu elektron (A) n = 2, l = 2, m = 0, s = - 1 2 (B) n = 3, l = 0, m = +1, s = + 1 2 (C) n = 4, l = 2, m = - 3, s = -
Pilihan Ganda Soal dan Jawaban Sifat Koligatif Larutan 20 butir. 5 uraian Soal dan Jawaban Sifat Koligatif Larutan.
 1 Pilihan Ganda Soal dan Jawaban Sifat Koligatif Larutan 20 butir. 5 uraian Soal dan Jawaban Sifat Koligatif Larutan. Berilah tanda silang (X) pada huruf A, B, C, D atau E di depan jawaban yang benar!
1 Pilihan Ganda Soal dan Jawaban Sifat Koligatif Larutan 20 butir. 5 uraian Soal dan Jawaban Sifat Koligatif Larutan. Berilah tanda silang (X) pada huruf A, B, C, D atau E di depan jawaban yang benar!
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya.
 30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
OAL TES SEMESTER I. I. Pilihlah jawaban yang paling tepat! a. 2d d. 3p b. 2p e. 3s c. 3d 6. Unsur X dengan nomor atom
 KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
KISI UJI KOMPETENSI 2013 MATA PELAJARAN KIMIA
 KISI UJI KOMPETENSI 2013 MATA PELAJARAN KIMIA Kompetensi Menguasai karakteristik peserta Mengidentifikasi kesulitan belajar didik dari aspek fisik, moral, peserta didik dalam mata pelajaran spiritual,
KISI UJI KOMPETENSI 2013 MATA PELAJARAN KIMIA Kompetensi Menguasai karakteristik peserta Mengidentifikasi kesulitan belajar didik dari aspek fisik, moral, peserta didik dalam mata pelajaran spiritual,
SKL- 3: LARUTAN. Ringkasan Materi. 1. Konsep Asam basa menurut Arrhenius. 2. Konsep Asam-Basa Bronsted dan Lowry
 SKL- 3: LARUTAN 3 Menjelaskan sifat-sifat larutan, metode pengukuran dan terapannya. o Menganalisis data daya hantar listrik beberapa larutan o Mendeskripsikan konsep ph larutan o Menghitung konsentrasi
SKL- 3: LARUTAN 3 Menjelaskan sifat-sifat larutan, metode pengukuran dan terapannya. o Menganalisis data daya hantar listrik beberapa larutan o Mendeskripsikan konsep ph larutan o Menghitung konsentrasi
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA
 BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB V 1. Polipropena merupakan senyawa polimer yang digunakan untuk membuat botol minuman dan berbagai jenis karung. Senyawa ini dibuat dari monomer
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB V 1. Polipropena merupakan senyawa polimer yang digunakan untuk membuat botol minuman dan berbagai jenis karung. Senyawa ini dibuat dari monomer
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA JAWABAN (DOKUMEN NEGARA) UjianTeori. Waktu: 100 menit
 OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA JAWABAN (DOKUMEN NEGARA) UjianTeori Waktu: 100 menit Kementerian Pendidikan Nasional Dan Kebudayaan Direktorat Jenderal Managemen Pendidikan Dasar
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA JAWABAN (DOKUMEN NEGARA) UjianTeori Waktu: 100 menit Kementerian Pendidikan Nasional Dan Kebudayaan Direktorat Jenderal Managemen Pendidikan Dasar
STOKIOMETRI BAB. B. Konsep Mol 1. Hubungan Mol dengan Jumlah Partikel. Contoh: Jika Ar Ca = 40, Ar O = 16, Ar H = 1, tentukan Mr Ca(OH) 2!
 BAB 7 STOKIOMETRI A. Massa Molekul Relatif Massa Molekul Relatif (Mr) biasanya dihitung menggunakan data Ar masing-masing atom yang ada dalam molekul tersebut. Mr senyawa = (indeks atom x Ar atom) Contoh:
BAB 7 STOKIOMETRI A. Massa Molekul Relatif Massa Molekul Relatif (Mr) biasanya dihitung menggunakan data Ar masing-masing atom yang ada dalam molekul tersebut. Mr senyawa = (indeks atom x Ar atom) Contoh:
Disampaikan oleh : Dr. Sri Handayani 2013
 Disampaikan oleh : Dr. Sri Handayani 2013 PENGERTIAN Termokimia adalah cabang dari ilmu kimia yang mempelajari hubungan antara reaksi dengan panas. HAL-HAL YANG DIPELAJARI Perubahan energi yang menyertai
Disampaikan oleh : Dr. Sri Handayani 2013 PENGERTIAN Termokimia adalah cabang dari ilmu kimia yang mempelajari hubungan antara reaksi dengan panas. HAL-HAL YANG DIPELAJARI Perubahan energi yang menyertai
BAB VI KINETIKA REAKSI KIMIA
 BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
Kesetimbangan Kimia. Kimia Dasar 2 Sukisman Purtadi
 Kesetimbangan Kimia Kimia Dasar 2 Sukisman Purtadi Keadaan Setimbang dan tetapan Kesetimbangan Kesetimbangan dinamis dan statis Syarat kesetimbangan Tetapan kesetimbangan dan peranannya Q dan K Nilai Q
Kesetimbangan Kimia Kimia Dasar 2 Sukisman Purtadi Keadaan Setimbang dan tetapan Kesetimbangan Kesetimbangan dinamis dan statis Syarat kesetimbangan Tetapan kesetimbangan dan peranannya Q dan K Nilai Q
TES I : BABAK PENYISIHAN KIMIA. Olimpiade Sains si GaMeS Kode Soal: KIM - 103
 SMA MA TES I : BABAK PENYISIHAN KIMIA Olimpiade Sains si GaMeS 2014 Kode Soal: KIM - 103 Grand Master of Science (GaMeS) Tetapan dan Rumus Tetapan Avogadro Tetapan gas universal, R Tekanan gas Persamaan
SMA MA TES I : BABAK PENYISIHAN KIMIA Olimpiade Sains si GaMeS 2014 Kode Soal: KIM - 103 Grand Master of Science (GaMeS) Tetapan dan Rumus Tetapan Avogadro Tetapan gas universal, R Tekanan gas Persamaan
STANDAR KOMPETENSI. 1.Menjelaskan sifat- sifat
 SKL 1. Melakukan percobaan, antara lain merumuskan masalah, mengajukan menguji hipotesis, menentukan variabel, merancang merakit instrumen, mengumpulkan, mengolah menafsirkan data, menarik kesimpulan,
SKL 1. Melakukan percobaan, antara lain merumuskan masalah, mengajukan menguji hipotesis, menentukan variabel, merancang merakit instrumen, mengumpulkan, mengolah menafsirkan data, menarik kesimpulan,
BAB V PERHITUNGAN KIMIA
 BAB V PERHITUNGAN KIMIA KOMPETENSI DASAR 2.3 : Menerapkan hukum Gay Lussac dan hukum Avogadro serta konsep mol dalam menyelesaikan perhitungan kimia (stoikiometri ) Indikator : 1. Siswa dapat menghitung
BAB V PERHITUNGAN KIMIA KOMPETENSI DASAR 2.3 : Menerapkan hukum Gay Lussac dan hukum Avogadro serta konsep mol dalam menyelesaikan perhitungan kimia (stoikiometri ) Indikator : 1. Siswa dapat menghitung
Standar Kompetensi Kompetensi Dasar Nilai Indikator. Sifat Koligatif Larutan
 Model Pengintegrasian Nilai Pendidikan Karakter Standar Kompetensi Kompetensi Dasar Nilai Indikator 1. Menjelaskan sifat-sifat koligatif larutan nonelektrolit dan elektrolit. 1.1 Menjelaskan penurunan
Model Pengintegrasian Nilai Pendidikan Karakter Standar Kompetensi Kompetensi Dasar Nilai Indikator 1. Menjelaskan sifat-sifat koligatif larutan nonelektrolit dan elektrolit. 1.1 Menjelaskan penurunan
YAYASAN BINA SEJAHTERA SMK BINA SEJAHTERA 2 BOGOR Jl. Ledeng Sindangsari No. 05 Bogor Jl. Radar baru no. 08 Bogor ULANGAN SEMESTER GANJIL
 : XI (Semua Jurusan) Jawablah pertanyaan-pertanyaan di bawah ini dengan benar! 1. Apa yang dimaksud dengan pengertian istilah-istilah berikut : a. ikatan ionik b. reaksi basa c. reaksi reduksi d. reaksi
: XI (Semua Jurusan) Jawablah pertanyaan-pertanyaan di bawah ini dengan benar! 1. Apa yang dimaksud dengan pengertian istilah-istilah berikut : a. ikatan ionik b. reaksi basa c. reaksi reduksi d. reaksi
SIFAT KOLIGATIF LARUTAN
 SIFAT KOLIGATIF LARUTAN PENURUNAN TEKANAN UAP Penurunan Tekanan Uap adalah selisih antara tekanan uap jenuh pelarut murni dengan tekanan uap jenuh larutan. P = P - P P = Penurunan Tekanan Uap P = Tekanan
SIFAT KOLIGATIF LARUTAN PENURUNAN TEKANAN UAP Penurunan Tekanan Uap adalah selisih antara tekanan uap jenuh pelarut murni dengan tekanan uap jenuh larutan. P = P - P P = Penurunan Tekanan Uap P = Tekanan
PAKET UJIAN NASIONAL 9 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 9 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Isotop terdiri dari A. 13 proton, 14 elektron dan 27
PAKET UJIAN NASIONAL 9 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Isotop terdiri dari A. 13 proton, 14 elektron dan 27
1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat!
 Petunjuk : 1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat! 2. Soal Teori ini terdiri dari dua bagian: A. 30 soal pilihan Ganda : 60 poin B. 5 Nomor
Petunjuk : 1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat! 2. Soal Teori ini terdiri dari dua bagian: A. 30 soal pilihan Ganda : 60 poin B. 5 Nomor
kimia ASAM-BASA III Tujuan Pembelajaran
 KTSP K-13 kimia K e l a s XI ASAM-BASA III Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami mekanisme reaksi asam-basa. 2. Memahami stoikiometri
KTSP K-13 kimia K e l a s XI ASAM-BASA III Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami mekanisme reaksi asam-basa. 2. Memahami stoikiometri
PAKET UJIAN NASIONAL 11 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 11 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Unsur dengan nomor massa 45 dan mempunyai jumlah netron
PAKET UJIAN NASIONAL 11 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Unsur dengan nomor massa 45 dan mempunyai jumlah netron
Stoikhiometri : dan metron = mengukur. Membahas tentang : senyawa) senyawa (stoikhiometri. (stoikhiometri. reaksi)
 STOIKHIOMETRI Stoikhiometri : Dari kata Stoicheion = unsur dan metron = mengukur Membahas tentang : hub massa antar unsur dalam suatu senyawa (stoikhiometri senyawa) dan antar zat dalam suatu reaksi (stoikhiometri
STOIKHIOMETRI Stoikhiometri : Dari kata Stoicheion = unsur dan metron = mengukur Membahas tentang : hub massa antar unsur dalam suatu senyawa (stoikhiometri senyawa) dan antar zat dalam suatu reaksi (stoikhiometri
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL. UjianTeori. Waktu: 100 menit
 OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
Pembahasan Soal Multiplechoice OSK Kimia Tahun 2014 Oleh Urip
 Pembahasan Soal Multiplechoice OSK Kimia Tahun 2014 Oleh Urip Kalteng @ http://urip.wordpress.com Dengan senang hati jika ada yang mau mengoreksi pembahasan ini A. Pilih jawaban yang paling tepat ( 25
Pembahasan Soal Multiplechoice OSK Kimia Tahun 2014 Oleh Urip Kalteng @ http://urip.wordpress.com Dengan senang hati jika ada yang mau mengoreksi pembahasan ini A. Pilih jawaban yang paling tepat ( 25
SAP-GARIS-GARIS BESAR PROGRAM PENGAJARAN
 SAP-GARIS-GARIS BESAR PROGRAM PENGAJARAN Mata kuliah : Kimia Kode : Kim 101/3(2-3) Deskripsi : Mata kuliah ini membahas konsep-konsep dasar kimia yang disampaikan secara sederhana, meliputi pengertian
SAP-GARIS-GARIS BESAR PROGRAM PENGAJARAN Mata kuliah : Kimia Kode : Kim 101/3(2-3) Deskripsi : Mata kuliah ini membahas konsep-konsep dasar kimia yang disampaikan secara sederhana, meliputi pengertian
PAKET UJIAN NASIONAL 16 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 16 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. 27 Isotop 13 Al terdiri dari... A. 13 proton,14 elektron
PAKET UJIAN NASIONAL 16 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. 27 Isotop 13 Al terdiri dari... A. 13 proton,14 elektron
LATIHAN SOAL KIMIA KELAS XII
 LATIHAN SOAL KIMIA KELAS XII 1. Suatu larutan diperoleh dari melarutkan 6 gram urea (Mr= 60) dalam 1 liter air. Larutan yang lain diperoleh dari melarutkan 18 gram glukosa (Mr = 180) dalam 1 liter air.
LATIHAN SOAL KIMIA KELAS XII 1. Suatu larutan diperoleh dari melarutkan 6 gram urea (Mr= 60) dalam 1 liter air. Larutan yang lain diperoleh dari melarutkan 18 gram glukosa (Mr = 180) dalam 1 liter air.
TERMOKIMIA. Sistem terbagi atas: 1. Sistem tersekat: Antara sistem dan lingkungan tidak dapat terjadi pertukaran energi maupun materi
 TERMOKIMIA almair amrulloh 12:04:00 AM 11 IPAKimia 11 IPA Asas kekekalan energi menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan, tetapi energi dapat diubah dari satu bentuk kebentuk lain
TERMOKIMIA almair amrulloh 12:04:00 AM 11 IPAKimia 11 IPA Asas kekekalan energi menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan, tetapi energi dapat diubah dari satu bentuk kebentuk lain
Sifat Dasar Larutan Kelarutan Pengaruh Jenis Zat pada Kelarutan
 2. LARUTAN 1. Sifat Dasar Larutan Larutan adalah campuran yang bersifat homogen antara molekul, atom ataupun ion dari dua zat atau lebih. Disebut campuran karena susunannya atau komposisinya dapat berubah.
2. LARUTAN 1. Sifat Dasar Larutan Larutan adalah campuran yang bersifat homogen antara molekul, atom ataupun ion dari dua zat atau lebih. Disebut campuran karena susunannya atau komposisinya dapat berubah.
Kimia UMPTN Tahun 1981
 Kimia UMPTN Tahun 1981 UMPTN-81-51 Suatu atom unsury mempunyai susunan elektron : 1s s p 6 3s 3p 5. Unsur tersebut adalah A. logam alkali B. unsur halogen C. salah satu unsur golongan V D. belerang E.
Kimia UMPTN Tahun 1981 UMPTN-81-51 Suatu atom unsury mempunyai susunan elektron : 1s s p 6 3s 3p 5. Unsur tersebut adalah A. logam alkali B. unsur halogen C. salah satu unsur golongan V D. belerang E.
PAKET UJIAN NASIONAL 1 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 1 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Unsur X dengan konfigurasi electron 1S 2 2S 2 2p 6
PAKET UJIAN NASIONAL 1 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Unsur X dengan konfigurasi electron 1S 2 2S 2 2p 6
SOAL SELEKSI NASIONAL TAHUN 2006
 SOAL SELEKSI NASIONAL TAHUN 2006 Soal 1 ( 13 poin ) KOEFISIEN REAKSI DAN LARUTAN ELEKTROLIT Koefisien reaksi merupakan langkah penting untuk mengamati proses berlangsungnya reaksi. Lengkapi koefisien reaksi-reaksi
SOAL SELEKSI NASIONAL TAHUN 2006 Soal 1 ( 13 poin ) KOEFISIEN REAKSI DAN LARUTAN ELEKTROLIT Koefisien reaksi merupakan langkah penting untuk mengamati proses berlangsungnya reaksi. Lengkapi koefisien reaksi-reaksi
PAKET UJIAN NASIONAL 3 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 3 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Konfigurasi electron suatu ion adalah 2 8 8, bila unsur
PAKET UJIAN NASIONAL 3 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Konfigurasi electron suatu ion adalah 2 8 8, bila unsur
Soal 1. a. MgSO 4.nH 2O(s) Mg 2+ (aq) + SO 4
 Ofiice : 021-2951 1160. Contact Person : 0-878787-1-8585 / 0818691-2130 Bidang Studi Kode Berkas : Kimia : KI-L01 (solusi) Soal 1 a. MgSO 4.nH 2O(s) Mg 2+ (aq) + SO 4 (aq) + nh 2O(l) (3 poin) b. MgSO 4(aq)
Ofiice : 021-2951 1160. Contact Person : 0-878787-1-8585 / 0818691-2130 Bidang Studi Kode Berkas : Kimia : KI-L01 (solusi) Soal 1 a. MgSO 4.nH 2O(s) Mg 2+ (aq) + SO 4 (aq) + nh 2O(l) (3 poin) b. MgSO 4(aq)
HASIL ANALISIS KEBENARAN KONSEP PADA OBJEK PENELITIAN. Penjelasan Konsep
 LAMPIRAN 7 HASIL ANALISIS KEBENARAN KONSEP PADA OBJEK PENELITIAN Keterangan kriteria kebenaran konsep Benar (B) Salah (S) Indikator Pembelajaran : Jika penjelasan konsep subjek penelitian sesuai dengan
LAMPIRAN 7 HASIL ANALISIS KEBENARAN KONSEP PADA OBJEK PENELITIAN Keterangan kriteria kebenaran konsep Benar (B) Salah (S) Indikator Pembelajaran : Jika penjelasan konsep subjek penelitian sesuai dengan
LARUTAN PENYANGGA (BUFFER)
 LARUTAN PENYANGGA (BUFFER) Larutan penyangga Larutan penyangga atau larutan buffer adalah larutan yang ph-nya praktis tidak berubah walaupun kepadanya ditambahkan sedikit asam, sedikit basa, atau bila
LARUTAN PENYANGGA (BUFFER) Larutan penyangga Larutan penyangga atau larutan buffer adalah larutan yang ph-nya praktis tidak berubah walaupun kepadanya ditambahkan sedikit asam, sedikit basa, atau bila
MODUL SEL ELEKTROLISIS
 MODUL SEL ELEKTROLISIS Standar Kompetensi : 2. Menerapkan konsep reaksi oksidasi-reduksi dan elektrokimia dalam teknologi dan kehidupan sehari-hari. Kompetensi dasar : 2.2. Menjelaskan reaksi oksidasi-reduksi
MODUL SEL ELEKTROLISIS Standar Kompetensi : 2. Menerapkan konsep reaksi oksidasi-reduksi dan elektrokimia dalam teknologi dan kehidupan sehari-hari. Kompetensi dasar : 2.2. Menjelaskan reaksi oksidasi-reduksi
SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016)
 SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016) Bagian I: Pilihan Ganda 1) Suatu atom yang mempunyai energi ionisasi pertama bernilai besar, memiliki sifat/kecenderungan : A. Afinitas elektron rendah
SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016) Bagian I: Pilihan Ganda 1) Suatu atom yang mempunyai energi ionisasi pertama bernilai besar, memiliki sifat/kecenderungan : A. Afinitas elektron rendah
STOIKIOMETRI. STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi zat-zat kimia dan reaksi-reaksinya.
 STOIKIOMETRI STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi zat-zat kimia dan reaksi-reaksinya. 1.HUKUM KEKEKALAN MASSA = HUKUM LAVOISIER "Massa zat-zat sebelum
STOIKIOMETRI STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi zat-zat kimia dan reaksi-reaksinya. 1.HUKUM KEKEKALAN MASSA = HUKUM LAVOISIER "Massa zat-zat sebelum
Redoks dan Elektrokimia Tim Kimia FTP
 Redoks dan Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis
Redoks dan Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis
SIFAT KOLIGATIF LARUTAN
 BAB 1 SIFAT KOLIGATIF LARUTAN Gambar 1.1 Proses kenaikan titik didih Sumber: Jendela Iptek Materi Pada pelajaran bab pertama ini, akan dipelajari tentang penurunan tekanan uap larutan ( P), kenaikan titik
BAB 1 SIFAT KOLIGATIF LARUTAN Gambar 1.1 Proses kenaikan titik didih Sumber: Jendela Iptek Materi Pada pelajaran bab pertama ini, akan dipelajari tentang penurunan tekanan uap larutan ( P), kenaikan titik
