PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim ( JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH
|
|
|
- Ida Santoso
- 7 tahun lalu
- Tontonan:
Transkripsi
1 PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim ( JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH TAHUN 2016 Soal diketik ulang oleh urip rukim ( 1
2 1. Diagram berikut menunjukkan 4 partikel: Manakah dua diagram yang menunjukkan atom-atom yang merupakan isotop satu sama lain? a) 1 dan 2 b) 1 dan 3 c) 1 dan 4 d) 2 dan 3 e) 2 dan 4 Pembahasan soal #1: Isotop adalah partikel (unsur) yang memiliki yang memiliki nomor atom sama tetapi nomor massanya berbeda. Dengan kata lain isotop adalah partikel yang memiliki jumlah proton sama, jumlah elektron sama tetapi jumlah netron berbeda. Nomor atom = jumlah proton = jumlah elektron. Selisih antara nomor massa dengan nomor atom = jumlah netron. Dari diagram yang tersedia isotop satu dengan yang lain adalah diagram nomor 2 dan 4. Jawaban e. 2. Manakah di antara pasangan di bawah ini yang benar berkaitan dengan jari-jari spesinya? a) Fe 3+ > Fe 2+ b) Mg 2+ > Ca 2+ c) Na + > F d) N 3 > F e) Na + > Cl Pembahasan soal #2: Membandingkan jari-jari ion. Dalam sistem periodik unsur, bila unsur berada dalam periode yang sama, ion positif suatu unsur yang berada di sebelah kirinya akan memiliki jari-jari yang lebih besar, ion negatif yang seperiode maka ion unsur yang berada di sebelah kanan akan lebih besar. Dalam sistem periodik unsur, bila unsur berada dalam golongan yang sama, ion positif dan ion negatif suatu unsur yang berada di sebelah bawah akan memiliki jari-jari yang lebih besar. Soal diketik ulang oleh urip rukim ( 2
3 a) Fe 3+ < Fe 2+ karena pada Fe 3+ melepaskan 3 elektron sehingga jari-jarinya lebih kecil dibanding Fe 2+ yang hanya melepaskan 2 elektron. b) Mg 2+ < Ca 2+ ion unsur segolongan, unsur yang berada di bawah akan memiliki jari-jari ion yang lebih besar. c) Na + > F Posisi Na memang di periode 3 dan F di periode 2, ketika Na melepaskan 1 elektron maka jumlah kulitnya akan sama dengan F tetapi jumlah elektron F akan lebih banyak dibandingkan protonnya sehingga jari-jarinya lebih besar dibanding Na + d) N 3 > F N dan F unsur seperiode N lebih banyak menerima elektron dibanding F maka ini alternatif yang tepat. e) Na + > Cl unsur seperiode, maka yang bermuatan negatif yang jari-jari ionnya lebih besar. Jawaban d. 3. Pernyataan yang benar tentang NaCl dan MgO adalah: a) Ikatan kimia kedua senyawa tersebut berbeda b) Penulisan NaCl dan MgO mencerminkan lambang Lewis c) Jumlah elektron valensi kedua molekul sama d) Konfigurasi elektron tiap atom yang terlibat dalam kedua molekul setelah berikatan mengikuti konfigurasi elektron gas mulia e) Zat pembentuknya, kedua molekul akan menyerap energi Pembahasan soal #3: Pertama yang perlu dipahami adalah pemakaian kata molekul. NaCl dan MgO keduanya bukanlah molekul. Senyawa ion tidak terbentuk dari molekul-molekul. Ia membentuk kisi kristal yang besar yang terdiri dari ion positif dan negatif. Namun andai maksud pembuat soal mengartikan NaCl dan MgO sebagai molekul tentu saja alternatif jawaban ada yang benar, yaitu c dan d. Kedua senyawa memiliki jenis ikatan kimia yang sama (tidak berbeda) yaitu berikatan ion. Penulisan NaCl dan MgO tidak mencerminkan lambang Lewis yang biasa dilengkapi dengan jumlah elektron dengan tanda tertentu. NaCl jumlah elektron valensinya 8 (1 pada Na dan 7 pada Cl) demikian juga dalam MgO juga 8 (2 pada Mg dan 6 pada O) tapi NaCl bukanlah molekul. Setelah berikatan konfigurasi elektron tiap atom akan mengikuti konfigurasi elektron gas mulia. Na : 2-8, Cl : 2-8-8, Mg : 2-8, O : 2-8, tetapi keduanya bukanlah molekul. Ketika pembentukan (???molekul???) ion maka energi akan dihasilkan bukan menyerap energi. Jawaban tidak tersedia jawaban yang tepat. Soal diketik ulang oleh urip rukim ( 3
4 4. Seorang siswa menyelidiki laju reaksi antara magnesium dan asam sulfat berlebih. Volume hidrogen yang dilepaskan dalam reaksi diukur dari waktu ke waktu. Grafik berikut menunjukkan hasil dari dua percobaan, R dan S. Perubahan kondisi manakah yang dapat menyebabkan perbedaan antara R dan S? a) Katalis ditambahkan di S b) Asam lebih dipekatkan di R daripada di S c) Serbuk magnesium yang digunakan kurang halus di R daripada di S d) Temperatur di R lebih rendah daripada di S e) Percobaan R dan S masing-masing dilakukan dengan tiga kali pengulangan pada tekanan tetap. Pembahasan soal #4: Dilihat dari grafik tampak bahwa R lebih cepat membentuk gas hidrogen untuk volume yang sama. t R t s Dari alternatif jawaban yang tepat adalah b, asam lebih dipekatkan di R daripada di S sehingga reaksi R berlangsung lebih cepat untuk menghasilkan volume gas hidrogen yang sama. Bila katalis ditambahkan di S tentu S mestinya dapat berlangsung lebih cepat dibanding R. Demikian pula bila serbuk Mg lebih halus di S. Bila temperatur di R dibuat lebih rendah umumnya reaksi akan berlangsung lebih lambat. Pernyataan e tidak dapat dijadikan patokan. Soal diketik ulang oleh urip rukim ( 4
5 5. Untuk reaksi R + S RS diperoleh data sebagai berikut: i) Jika konsentrasi R dinaikkan dua kali pada konsentrasi S tetap, laju reaksi menjadi dua kali lebih besar ii) Jika konsentrasi R dan S masing-masing dinaikkan dua kali, laju reaksi menjadi delapan kali lebih besar. Persamaan laju reaksi yang tepat untuk reaksi di atas adalah a) k[r] 2 [S] 2 b) k[r] 2 [S] c) k[r] [S] d) k[r] [S] 2 e) k[r] [S] 3 Pembahasan soal #5: Terjemahan dari pernyataan: Data [R] [S] v (laju reaksi) 1 a a b 2 2a a 2b 3 2a 2a 8b Penentuan orde reaksi terhadap R Gunakan data 2 dan 1 (karena konsentrasi S tetap/sama) (2a/a) x = 2b/b 2 x = 2 x = 1 Penentuan orde reaksi terhadap S Gunakan data 3 dan 2 (karena konsentrasi R tetap/sama) (2a/a) z = 8b/2b 2 z = 4 z = 2 Jadi persamaan laju reaksi : v = k [R][S] 2 Jawaban d. Soal diketik ulang oleh urip rukim ( 5
6 6. Laju reaksi awal antara aseton dan Br2 yang berlangsung dalam suasana asam, tertera pada tabel di bawah ini. Perc. CH3COCH3 (M) Br2 (M) H + (M) Laju awal (M det 1 ) 1 0,500 0,005 0,200 4, ,000 0,005 0,200 9, ,000 0,005 0, ,500 0,010 0,200 4, ,500 0,020 0,200 4, Berapakah nilai konstanta laju reaksinya? a) 4, M det 1 b) 4, M 1 det 1 c) 4, M det 1 d) 4, M 1 det 1 e) 9, M 2 det 1 Pembahasan soal #6: Penentuan orde reaksi terhadap CH3COCH3 Gunakan data 2 dan 1 (karena konsentrasi Br2 dan H + tetap/sama) (1/0,5) x = 9 / 4,5 2 x = 2 x = 1 Penentuan orde reaksi terhadap Br2 Gunakan data 5 dan 4 (karena konsentrasi CH3COCH3 dan H + tetap/sama) (0,02/0,01) y = 4,5/4,5 2 y = 1 y = 0 Penentuan orde reaksi terhadap H + Gunakan data 3 dan 2 (karena konsentrasi CH3COCH3 dan Br2 tetap/sama) (0,4/0,2) z = 18/9 2 z = 2 z = 1 Jadi persamaan laju reaksi : v = k [CH3COCH3][H + ] Penentuan nilai k dapat menggunakan salah satu data percobaan, di sini digunakan data ke M det 1 = k 1 M 0,2 M k = ( M det 1 ) : 0,2 M 2 = 4, M 1 det 1 7. Berikut ini adalah beberapa sifat koloid: (i) Dialisis (ii) Gerak Brown (iii) Koagulasi (iv) Efek Tyndall (v) Elektroforesis Aspek sifat koloid pada proses pengolahan air untuk memperoleh air bersih adalah : a) i b) ii c) iii d) iv e) v Pembahasan soal #7: Jelas C Jawaban c. Soal diketik ulang oleh urip rukim ( 6
7 8. Perhatikan penerapan sifat koloid berikut: i) Penyaringan asap pabrik dengan alat Cotrel ii) Pemutihan gula dengan karbon aktif iii) Penjernihan air dengan tawas iv) Sorot lampu di malam hari berkabut v) Cuci darah pada penderita ginjal Sifat adsorbsi ditunjukkan pada nomor a) i dan ii d) iii dan v b) ii dan iii e) iv dan v c) ii dan iv Pembahasan soal #8: i) Penyaringan asap pabrik dengan alat Cotrel penerapan koagulasi ii) Pemutihan gula dengan karbon aktif penerapan adsorbsi iii) Penjernihan air dengan tawas penerapan adsorbsi iv) Sorot lampu di malam hari berkabut contoh efek Tyndall v) Cuci darah pada penderita ginjal penerapan dialisis 9. Untuk reaksi kesetimbangan N2(g) + 3H2(g) 2NH3(g) pada suhu 127 o C, dalam kondisi setimbang konsentrasi [N2] = 8, mol/l, [H2] = 3, mol/l, [NH3] = 3, mol/l. Tentukan nilai konstanta kesetimbangan (Kc). a) 11,765 (d) b) (e) 35,294 c) 23,529 Pembahasan soal #9: Reaksi kesetimbangan: N2(g) + 3H2(g) 2NH3(g) = (3, ) [N 2 ][H 2 ] 3 Kc = [NH 3 ]2 8, (3, ) 3 = Bila pada suhu dan tekanan yang sama, kesetimbangan dalam soal nomor 9 diganggu dengan menambahkan sejumlah NH3 sehingga campuran gas tidak lagi berada pada posisi kesetimbangan, tentukan apakah yang terjadi pada kesetimbangan tersebut. a) Tidak terjadi apa-apa b) Kesetimbangan bergeser ke kanan, semakin banyak NH3 yang terbentuk c) Kesetimbangan bergeser ke kiri, semakin banyak N2 yang terbentuk d) Nilai konstanta kesetimbangan akan turun e) Nilai konstanta kesetimbangan akan naik Pembahasan soal #10: Reaksi kesetimbangan: N2(g) + 3H2(g) 2NH3(g) Bila NH3 ditambahkan maka kesetimbangan akan bergeser ke kiri (pereaksi) sehingga jumlah N2 dan H2 berkemungkinan akan semakin banyak terbentuk dan NH3 akan semakin berkurang. Jawaban c. Soal diketik ulang oleh urip rukim ( 7
8 11. Seorang siswa melarutkan 2,00 gram kristal NaOH (s) ke dalam 250 ml air. Tentukan ph larutan. a) ph = 7,00 b) ph = 13,30 c) ph = 1,50 d) ph = 12,50 e) ph = 0,70 Pembahasan soal #11: 2,00 gram NaOH = 2,00 gram : 40 gram/mol = 0,05 mol Konsentrasi NaOH [NaOH] = 0,05 mol NaOH : 0,25 L air = 0,2 mol/l [OH ] = [NaOH] [OH ] = 0,2 mol/l ph larutan NaOH = 14 + log [OH ] = 14 + log 0,2 = 14 0,70 = 13, Bila ke dalam larutan yang mengandung 0,1 mol/l NaOH dalam 250 ml air, kemudian ditambahkan 250 ml larutan HCl yang memiliki ph 2,00 sehingga total volume larutan menjadi 500 ml, tentukan ph akhir dari campuran ini. a) ph = 4,00 b) ph = 3,45 c) ph = 11,55 d) ph = 10 e) ph = 12,65 Pembahasan soal #12: Ini adalah soal reaksi penetralan, reaksi larutan asam dengan larutan basa. NaOH + HCl NaCl + H2O Perbandingan mol zat-zat dalam reaksi adalah 1 : 1 : 1 : 1 Keadaan awal: Jumlah mol NaOH = 0,1 mol/l 0,25 L = 0,025 mol ph HCl = 2 [H + ] = 10 2 mol/l maka [HCl] = 10 2 mol/l juga atau 0,01 mol/l Jumlah mol HCl = 0,01 mol/l 0,25 L = 0,0025 mol Volume campuran = 0,25 L + 0,25 L = 0,50 L NaOH + HCl NaCl + H2O 0,025 mol 0,0025 mol - mula-mula -0,0025 mol -0,0025 mol +0,0025 mol bereaksi 0,0225 mol 0 +0,0025 mol akhir (campuran) Pada campuran yang tersisa adalah NaOH [NaOH] = 0,0225 mol : 0,50 L = 0,045 mol/l [OH ] = 0,045 mol/l ph campuran = 14 + log [OH ] = 14 + log 0,045 = 14 1,35 = 12,65 Jawaban e. Soal diketik ulang oleh urip rukim ( 8
9 13. Sebanyak 250 ml asam lemah HOCl yang memiliki nilai konstanta Ka = 3, terurai menurut reaksi kesetimbangan berikut: HOCl H + + OCl. Bila konsentrasi awal dari HOCl adalah 1 mol/l, tentukan ph dari larutan ini. a) ph = 7,00 b) ph = 4,55 c) ph = 3,73 d) ph = 10 e) ph = 9,35 Pembahasan soal #13: [H + ] = ([HOCl].Ka ) = (1 3, ) = 1, mol/l ph = -log (1, ) = 4 0,29 = 3,71 alternatif yang paling mendekati adalah c. Jawaban c. 14. Ketika kristal padatan NaOH (s) dilarutkan di air, dan terurai atau terionisasi di air menjadi Na + (aq) dan OH (aq), proses ini melepaskan panas sebesar 44,51 kj/mol (NaOH). Bila 100 gram kristal NaOH ini dilarutkan di air, maka kalor yang dilepaskan adalah: a) 55,64 kj b) 111,28 kj c) 89,02 kj d) 178,04 kj e) 133,53 kj Pembahasan soal #14: NaOH Na + + OH Hpelarutan = + 44,51 kj/mol Jumlah mol zat = massa zat : massa molar zat 100 gram NaOH = 100 gram : 40 gram/mol = 2,50 mol Hpelarutan NaOH sebanyak 2,50 mol = 2,50 +44,51 kj/mol = 111,275 ~ 111,28 kj 15. Hitung entalpi dari reaksi ( HR) berikut 2NO2(g) 2NO(g) + O2(g) dengan menggunakan data entalpi reaksi sebagai berikut. i) N2(g) + 2O2(g) 2NO2(g) HR = +68 kj ii) N2(g) + O2(g) 2NO(g) a) +112 kj b) -112 kj c) +248 kj d) -248 kj e) Data tidak mencukupi HR = +180 kj Pembahasan soal #15: Dengan menggunakan data yang tersedia, sesuaikan (atur dengan menukar posisi misal reaktan menjadi produk dan produk menjadi reaktan, tanda + pada H diubah menjadi ) agar gas-gas pada data itu bersesuaian dengan reaksi yang diberikan. NO2 harus diletakkan di sisi kiri tanda panah, NO dan O2 diletakkan sebelah kanan tanda panah. Ketika dijumlahkan hasilnya harus sama dengan reaksi yang diminta untuk dihitung. 2NO2(g) N2 (g) + 2O2(g) HR = 68 kj N2(g) + O2(g) 2NO(g) HR = +180 kj + 2NO2(g) 2NO(g) + O2(g) HR = +112 kj Jawaban a. Soal diketik ulang oleh urip rukim ( 9
10 16. Manakah proses yang bersifat endotermik: a) Pembakaran bensin di dalam mesin mobil b) Proses sublimasi CO2(s) CO2(g) c) Pembekuan air H2O(l) H2O(s) d) Pengembunan air menjadi hujan di awan H2O(g) H2O(l) e) Penggunaan molekul glukosa dalam tubuh manusia untuk memperoleh energi Pembahasan soal #16: Proses atau reaksi endotermik adalah reaksi kimia yang dapat berlangsung namun membutuhkan energi/kalor/panas. Pembakaran bensin dalam mesin mobil eksotermik Proses sublimasi CO2 endotermik Pembekuan air eksotermik Pengembunan air eksotermik Glukosa untuk memperoleh energi eksotermik 17. Untuk reaksi 2A + B A2B, bila pada saat awal ditambahkan sejumlah 1 mol A dan 1 mol B, dan 0 mol A2B, tentukan jumlah mol masing-masing ketika reaksi selesai. a) 0,5 mol A, 0 mol M B dan 1 mol A2B b) 0 mol A, 0,5 mol M B dan 0,5 mol A2B c) 0,5 mol A, 0,5 mol M B dan 0,5 mol A2B d) 0 mol A, 0 mol M B dan 2 mol A2B e) 0,5 mol A, 0,5 mol M B dan 1 mol A2B Pembahasan soal #17: Ini adalah soal yang terkait dengan pereaksi pembatas. 2A + B A2B 1 mol 1 mol 0 mol awal reaksi -1 mol -0,5 mol +0,5 mol saat bereaksi 0 mol 0,5 mol 0,5 mol akhir reaksi (selesai) Jadi pada saat reaksi selesai akan terdapat 0 mol zat A, 0,5 mol zat B dan 0,5 mol zat A2B Soal diketik ulang oleh urip rukim ( 10
11 18. Struktur Lewis yang tepat untuk NO2 adalah: Pembahasan soal #18: Sebisa mungkin dalam struktur Lewis atom N dan O masing-masing pada N2O harus mengikuti kaidah oktet, di sekitar atom harus terdapat 8 elektron. Pada setiap garis ikatan itu setara dengan 2 elektron atau sepasang elektron). Tanda titik hitam itu menggambarkan elektron. Di antara alternatif yang semua atom yang memenuhi syarat kaidah oktet adalah pada alternatif b. 19. Ada berapa banyak ikatan sigma dan pi pada senyawa berikut ini? a) 5 ikatan sigma dan 2 ikatan pi b) 5 ikatan sigma dan 3 ikatan pi c) 5 ikatan sigma dan 5 ikatan pi d) 7 ikatan sigma dan 2 ikatan pi e) 7 ikatan sigma dan 3 ikatan pi Pembahasan soal #19: Pada ikatan tunggal hanya terdiri ikatan sigma pada ikatan dobel terdiri 1 ikatan sigma dan 1 ikatan pi, pada ikatan tripel terdiri 1 ikatan sigma dan 2 ikatan pi. Bila dituliskan semua ikatan yang ada pada senyawa tersebut akan menjadi seperti gambar berikut. Total terdapat 7 ikatan sigma (pada gambar ditunjukkan dengan tanda panah merah) dan 3 ikatan pi (pada gambar ditunjukkan dengan tanda panah hijau) Jawaban e. Soal diketik ulang oleh urip rukim ( 11
12 20. Senyawa dengan rumus C7H12 dapat berupa: a) Metil sikloheksana b) 1-etil-1,3-siklopentadiena c) 1-metil-1,3-sikloheksadiena d) 2-metil-1-heksena e) 1,3-heptadiena Pembahasan soal #20: C7H12 secara umum rumus kimianya adalah CnH2n-2 ini adalah rumus umum alkuna atau alkadiena. Dari alternatif yang disediakan yang mungkin adalah hanya golongan alkadiena. CH2=CH CH=CH CH2 CH2 CH3 1,3-heptadiena Jawaban e. 21. Pada reaksi manakah nitrogen mengalami reduksi? a) 2NO + O2 2NO2 b) 4NH3 + 5O2 4NO + 6H2O c) Cu NO2 + 2H2O Cu + 4 H + + 2NO3 d) 4Zn + 10H + + NO3 4Zn 2+ + NH H2O e) 2HNO2 + O2 2HNO3 Pembahasan soal #21: Ciri kasad mata untuk mengetahui apakah suatu atom reduksi atau oksidasi dapat dilihat dari jumlah oksigen yang terikat apakah semakin sedikit atau semakin banyak. Bila semakin sedikit artinya unsur tersebut mengalami reduksi sebaliknya bila semakin banyak berarti ia mengalami oksidasi. Pada alternatif yang disediakan N yang mengalami reduksi adalah: 4Zn + 10H + + NO3 4Zn 2+ + NH H2O Di sisi kiri N mengikat 3 O, di sebelah kanan N tidak lagi mengikat O tetapi mengikat H. Jawaban d. 22. Kesetimbangan setengah reaksi: Cl2 ClO3 adalah: a) Cl2 + 3H2O ClO3 + 6H + + 5e b) Cl2 + 3H2O 2ClO3 + 6H + + 4e c) Cl2 + 6H2O + 2e 2ClO3 + 6H2 d) Cl2 + 6H2O 2ClO3 + 12H e e) Cl2 + 3H2O 2ClO3 + 6H + + 6e Pembahasan soal #22: Kesetimbangan yang dimaksud di sini adalah reaksi setara. Atom Cl pada kedua ruas harus disetarakan lebih dahulu Cl2 2ClO3 Setarakan jumlah atom O dengan menambahkan H2O, Cl2 + 6H2O 2ClO3 Setarakan jumlah H dengan menambahkan ion H + di ruas yang kekurangan H. Cl2 + 6H2O 2ClO3 + 12H + Setarakan muatan dengan menambahkan elektron pada ruas yang lebih positif. Cl2 + 6H2O 2ClO3 + 12H e Maka dari alternatif yang disediakan yang tepat adalah Cl2 + 6H2O 2ClO3 + 12H e Jawaban d. Soal diketik ulang oleh urip rukim ( 12
13 23. Pada sel elektrokimia di atas, elektron mengalir dari: (E 0 Zn 2+ Zn = 0,76 V dan E 0 Pb 2+ Pb = 0,13 V) a) seng ke timbal dan massa seng meningkat b) seng ke timbal dan massa timbal meningkat c) timbal ke seng dan massa seng meningkat d) timbal ke seng dan massa timbal meningkat e) timbal ke seng dan massa seng tetap Pembahasan soal #23: Pada sel elektrokimia elektron akan mengalir dari anoda (tempat terjadinya reaksi oksidasi, melepaskan elektron) menuju katoda (tempat terjadinya reaksi reduksi, menerima elektron). Potensial reduksi Zn lebih negatif (yang lebih mudah mengalami oksidasi) dibanding Pb (yang lebih mudah mengalami reduksi). Reaksi: Zn Zn e E 0 = +0,76 volt Pb e Pb E 0 = 0,13 volt Karena Zn mengalami oksidasi Zn 2+ maka massa Zn akan berkurang, sedang Pb 2+ akan mengendap menjadi Pb karena mengalami reduksi. Zn bertindak sebagai anoda dan Pb bertindak sebagai katoda. Elektron akan mengalir dari Zn menuju Pb. Soal diketik ulang oleh urip rukim ( 13
14 Pernyataan untuk soal nomor 24 dan 25 Arus sebesar 9,65 A dialirkan pada larutan CuSO4 selama 3 menit 20 detik. Endapan akan terbentuk pada katoda dan gelembung terbentuk pada anoda. 24. Berapakah massa tembaga yang diperoleh? a) 1,27100 gram b) 0,31775 gram c) 0,63550 gram d) 0,95325 gram e) 1,58875 gram Pembahasan soal #24: Reaksi elektrolisis CuSO4 Ion yang mengalami reduksi adalah Cu 2+ menjadi Cu yang mengendap. Ion SO4 2 tidak dapat mengalami oksidasi sehingga yang teroksidasi adalah H2O. Reaksi selengkapnya: Katoda: Cu e Cu Anoda: 2H2O O2 + 4H + + 4e 2Cu H2O 2Cu + O2 + 4H + Untuk menghitung massa Cu (tembaga) yang mengendap dapat menggunakan rumus: W = (e.i.t)/96500 e Cu = 63,55/2; i = 9,56 A ; t = 200 detik W = (63,55/2 9,56 200)/96500 = 0,63550 gram Jawaban c. 25. Berapakah massa oksigen yang diperoleh? a) 0,32 gram b) 0,16 gram c) 0,08 gram d) 0,24 gram e) 0,40 gram Pembahasan soal #25: Reaksi total: 2Cu H2O 2Cu + O2 + 4H + Jumlah mol O2 setara dengan ½ mol Cu. Jumlah mol Cu = 0,63550 gram : 63,55 gram/mol = 0,01 mol Jumlah mol O2 = ½ jumlah mol Cu = ½ 0,01 mol = 0,005 mol Massa 0,005 mol O2 = 0,005 mol 32 gram/mol = 0,16 gram Soal diketik ulang oleh urip rukim ( 14
PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP FAX KODE POS 60299
 PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP. 031-8415492 FAX 031-8430673 KODE POS 60299 ULANGAN AKHIR SEMESTER 2 (DUA) TAHUN PELAJARAN 2011 2012 Hari/Tanggal :
PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP. 031-8415492 FAX 031-8430673 KODE POS 60299 ULANGAN AKHIR SEMESTER 2 (DUA) TAHUN PELAJARAN 2011 2012 Hari/Tanggal :
SOAL KIMIA 2 KELAS : XI IPA
 SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
BAB VI KINETIKA REAKSI KIMIA
 BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
OAL TES SEMESTER I. I. Pilihlah jawaban yang paling tepat! a. 2d d. 3p b. 2p e. 3s c. 3d 6. Unsur X dengan nomor atom
 KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
SIMULASI UJIAN NASIONAL 2
 SIMULASI UJIAN NASIONAL 2. Diketahui nomor atom dan nomor massa dari atom X adalah 29 dan 63. Jumlah proton, elektron, dan neutron dalam ion X 2+ (A) 29, 27, dan 63 (B) 29, 29, dan 34 (C) 29, 27, dan 34
SIMULASI UJIAN NASIONAL 2. Diketahui nomor atom dan nomor massa dari atom X adalah 29 dan 63. Jumlah proton, elektron, dan neutron dalam ion X 2+ (A) 29, 27, dan 63 (B) 29, 29, dan 34 (C) 29, 27, dan 34
PAKET UJIAN NASIONAL 17 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 17 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
PAKET UJIAN NASIONAL 17 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A. D. Cu E. Zn
 1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
PAKET UJIAN NASIONAL 7 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 7 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Dari beberapa unsur berikut yang mengandung : 1. 20
PAKET UJIAN NASIONAL 7 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Dari beberapa unsur berikut yang mengandung : 1. 20
PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53
PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53
Pelatihan Online I OSN Bidang Kimia Page 1 PETUNJUK PENGERJAAN SOAL
 PETUNJUK PENGERJAAN SOAL 1. Periksalah terlebih dahulu soal yang Anda terima, apakah dalam keadaan baik, terbaca, lengkap, dan jelas, sebelum Anda mengerjakan. 2. Jawaban dikerjakan pada lembar jawaban
PETUNJUK PENGERJAAN SOAL 1. Periksalah terlebih dahulu soal yang Anda terima, apakah dalam keadaan baik, terbaca, lengkap, dan jelas, sebelum Anda mengerjakan. 2. Jawaban dikerjakan pada lembar jawaban
2. Konfigurasi elektron dua buah unsur tidak sebenarnya:
 . Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
. Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: HUKUM-HUKUM DASAR KIMIA Di soal diketahui dan ditanya: m (NH 2 ) 2 CO = 12.000 ton/tahun (pabrik) m N 2 = ton/tahun?
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: HUKUM-HUKUM DASAR KIMIA Di soal diketahui dan ditanya: m (NH 2 ) 2 CO = 12.000 ton/tahun (pabrik) m N 2 = ton/tahun?
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: TERMOKIMIA Pada soal diketahui dan ditanya: ΔH c C 2 H 5 OH = -1380 kj/mol ΔH d C 6 H 12 O 6 = -60 kj/mol ΔH c C
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: TERMOKIMIA Pada soal diketahui dan ditanya: ΔH c C 2 H 5 OH = -1380 kj/mol ΔH d C 6 H 12 O 6 = -60 kj/mol ΔH c C
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
Antiremed Kelas 11 Kimia
 Antiremed Kelas 11 Kimia Persiapan UAS 1 Kimia Doc. Name: AR11KIM01UAS Version: 016-08 halaman 1 01. Salah satu teori yang menjadi dasar sehingga tercipta model atom modern (A) Rutherford, Niels Bohr,
Antiremed Kelas 11 Kimia Persiapan UAS 1 Kimia Doc. Name: AR11KIM01UAS Version: 016-08 halaman 1 01. Salah satu teori yang menjadi dasar sehingga tercipta model atom modern (A) Rutherford, Niels Bohr,
TES AWAL II KIMIA DASAR II (KI-112)
 TES AWAL II KIMIA DASAR II (KI112) NAMA : Tanda Tangan N I M : JURUSAN :... BERBAGAI DATA. Tetapan gas R = 0,082 L atm mol 1 K 1 = 1,987 kal mol 1 K 1 = 8,314 J mol 1 K 1 Tetapan Avogadro = 6,023 x 10
TES AWAL II KIMIA DASAR II (KI112) NAMA : Tanda Tangan N I M : JURUSAN :... BERBAGAI DATA. Tetapan gas R = 0,082 L atm mol 1 K 1 = 1,987 kal mol 1 K 1 = 8,314 J mol 1 K 1 Tetapan Avogadro = 6,023 x 10
Redoks dan Elektrokimia Tim Kimia FTP
 Redoks dan Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis
Redoks dan Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis
 UJIAN MASUK BERSAMA (UMB) Mata Pelajaran : Kimia Tanggal : 07 Juni 009 Kode Soal : 9. Penamaan yang tepat untuk : CH CH CH CH CH CH OH CH CH adalah A. -etil-5-metil-6-heksanol B.,5-dimetil-1-heptanol C.
UJIAN MASUK BERSAMA (UMB) Mata Pelajaran : Kimia Tanggal : 07 Juni 009 Kode Soal : 9. Penamaan yang tepat untuk : CH CH CH CH CH CH OH CH CH adalah A. -etil-5-metil-6-heksanol B.,5-dimetil-1-heptanol C.
Antiremed Kelas 10 KIMIA
 Antiremed Kelas 10 KIMIA Persiapan UAS 1 Kimia Doc Name: AR10KIM01UAS Version : 2016-07 halaman 1 01. Partikel berikut yang muatannya sebesar 19 1,6 10 C dan bermassa 1 sma (A) elektron (B) proton (C)
Antiremed Kelas 10 KIMIA Persiapan UAS 1 Kimia Doc Name: AR10KIM01UAS Version : 2016-07 halaman 1 01. Partikel berikut yang muatannya sebesar 19 1,6 10 C dan bermassa 1 sma (A) elektron (B) proton (C)
OAL TES SEMESTER II. I. Pilihlah jawaban yang paling tepat!
 KIMIA XI SMA 217 S OAL TES SEMESTER II I. Pilihlah jawaban yang paling tepat! 1. Basa menurut Arhenius adalah senyawa yang bila dilarutkan dalam air akan menghasilkan a. proton d. ion H b. elektron e.
KIMIA XI SMA 217 S OAL TES SEMESTER II I. Pilihlah jawaban yang paling tepat! 1. Basa menurut Arhenius adalah senyawa yang bila dilarutkan dalam air akan menghasilkan a. proton d. ion H b. elektron e.
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PAKET UJIAN NASIONAL 14 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASINAL 14 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
PAKET UJIAN NASINAL 14 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
Elektrokimia. Tim Kimia FTP
 Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis ini merupakan
Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis ini merupakan
PREDIKSI UJIAN NASIONAL 2011 KIMIA
 Soal PREDIKSI Latihan UJIAN NASIONAL 2011 2013 KIMIA 1 LATIHAN UJIAN AKHIR NASIONAL TAHUN AJARAN 2012/2013 KIMIA 1. Jika unsur 19 X berikatan dengan unsur 35 Z maka, rumus senyawa dan jenis ikatan yang
Soal PREDIKSI Latihan UJIAN NASIONAL 2011 2013 KIMIA 1 LATIHAN UJIAN AKHIR NASIONAL TAHUN AJARAN 2012/2013 KIMIA 1. Jika unsur 19 X berikatan dengan unsur 35 Z maka, rumus senyawa dan jenis ikatan yang
PAKET UJIAN NASIONAL 11 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 11 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Unsur dengan nomor massa 45 dan mempunyai jumlah netron
PAKET UJIAN NASIONAL 11 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Unsur dengan nomor massa 45 dan mempunyai jumlah netron
SOAL SELEKSI NASIONAL TAHUN 2006
 SOAL SELEKSI NASIONAL TAHUN 2006 Soal 1 ( 13 poin ) KOEFISIEN REAKSI DAN LARUTAN ELEKTROLIT Koefisien reaksi merupakan langkah penting untuk mengamati proses berlangsungnya reaksi. Lengkapi koefisien reaksi-reaksi
SOAL SELEKSI NASIONAL TAHUN 2006 Soal 1 ( 13 poin ) KOEFISIEN REAKSI DAN LARUTAN ELEKTROLIT Koefisien reaksi merupakan langkah penting untuk mengamati proses berlangsungnya reaksi. Lengkapi koefisien reaksi-reaksi
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
 TRY OUT SELEKSI OLIMPIADE TINGKAT KABUPATEN/KOTA 2010 TIM OLIMPIADE KIMIA INDONESIA 2011 Waktu: 150 Menit PUSAT KLINIK PENDIDIKAN INDONESIA (PKPI) bekerjasama dengan LEMBAGA BIMBINGAN BELAJAR SSCIntersolusi
TRY OUT SELEKSI OLIMPIADE TINGKAT KABUPATEN/KOTA 2010 TIM OLIMPIADE KIMIA INDONESIA 2011 Waktu: 150 Menit PUSAT KLINIK PENDIDIKAN INDONESIA (PKPI) bekerjasama dengan LEMBAGA BIMBINGAN BELAJAR SSCIntersolusi
Sulistyani, M.Si.
 Sulistyani, M.Si. sulistyani@uny.ac.id Reaksi oksidasi: perubahan kimia suatu spesies (atom, unsur, molekul) melepaskan elektron. Cu Cu 2+ + 2e Reaksi reduksi: perubahan kimia suatu spesies (atom, unsur,
Sulistyani, M.Si. sulistyani@uny.ac.id Reaksi oksidasi: perubahan kimia suatu spesies (atom, unsur, molekul) melepaskan elektron. Cu Cu 2+ + 2e Reaksi reduksi: perubahan kimia suatu spesies (atom, unsur,
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya.
 30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
D. 3 dan 4 E. 1 dan 5
 1. Dari beberapa unsur berikut yang mengandung : 1. 20 elektron dan 20 netron 2. 10 elektron dan 12 netron 3. 15 proton dan 16 netron 4. 20 netron dan 19 proton 5. 12 proton dan 12 netron Yang memiliki
1. Dari beberapa unsur berikut yang mengandung : 1. 20 elektron dan 20 netron 2. 10 elektron dan 12 netron 3. 15 proton dan 16 netron 4. 20 netron dan 19 proton 5. 12 proton dan 12 netron Yang memiliki
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
1. Bilangan Oksidasi (b.o)
 Reaksi Redoks dan Elektrokimia 1. Bilangan Oksidasi (b.o) 1.1 Pengertian Secara sederhana, bilangan oksidasi sering disebut sebagai tingkat muatan suatu atom dalam molekul atau ion. Bilangan oksidasi bukanlah
Reaksi Redoks dan Elektrokimia 1. Bilangan Oksidasi (b.o) 1.1 Pengertian Secara sederhana, bilangan oksidasi sering disebut sebagai tingkat muatan suatu atom dalam molekul atau ion. Bilangan oksidasi bukanlah
PAKET UJIAN NASIONAL 16 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 16 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. 27 Isotop 13 Al terdiri dari... A. 13 proton,14 elektron
PAKET UJIAN NASIONAL 16 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. 27 Isotop 13 Al terdiri dari... A. 13 proton,14 elektron
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2015 Page 1 1. MATERI: STOIKIOMETRI Persen massa adalah persentase massa zat terlarut dalam 100 gram massa larutan (massa pelarut + massa
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2015 Page 1 1. MATERI: STOIKIOMETRI Persen massa adalah persentase massa zat terlarut dalam 100 gram massa larutan (massa pelarut + massa
UN SMA IPA 2009 Kimia
 UN SMA IPA 009 Kimia Kode Soal P88 Doc. Version : 011-06 halaman 1 01. Perhatikan tabel data fisik dan daya hantar larutan beberapa senyawa berikut: Senyawa Titik Leleh Daya Hantar Listrik Larutan L M
UN SMA IPA 009 Kimia Kode Soal P88 Doc. Version : 011-06 halaman 1 01. Perhatikan tabel data fisik dan daya hantar larutan beberapa senyawa berikut: Senyawa Titik Leleh Daya Hantar Listrik Larutan L M
LEMBARAN SOAL 7. Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA )
 LEMBARAN SOAL 7 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal
LEMBARAN SOAL 7 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal
D. 2 dan 3 E. 2 dan 5
 1. Pada suhu dan tekanan sama, 40 ml P 2 tepat habis bereaksi dengan 100 ml, Q 2 menghasilkan 40 ml gas PxOy. Harga x dan y adalah... A. 1 dan 2 B. 1 dan 3 C. 1 dan 5 Kunci : E D. 2 dan 3 E. 2 dan 5 Persamaan
1. Pada suhu dan tekanan sama, 40 ml P 2 tepat habis bereaksi dengan 100 ml, Q 2 menghasilkan 40 ml gas PxOy. Harga x dan y adalah... A. 1 dan 2 B. 1 dan 3 C. 1 dan 5 Kunci : E D. 2 dan 3 E. 2 dan 5 Persamaan
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL. UjianTeori. Waktu: 100 menit
 OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat!
 Petunjuk : 1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat! 2. Soal Teori ini terdiri dari dua bagian: A. 30 soal pilihan Ganda : 60 poin B. 5 Nomor
Petunjuk : 1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat! 2. Soal Teori ini terdiri dari dua bagian: A. 30 soal pilihan Ganda : 60 poin B. 5 Nomor
Persiapan UN 2018 KIMIA
 Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
1. Perhatikan struktur senyawa berikut!
 . Perhatikan struktur senyawa berikut! CH CH CH CH CH CH CH Jumlah atom C primer, atom C sekunder, dan atom C tersier dari senyawa di atas adalah...,, dan D.,, dan,, dan E.,, dan,, dan. Di bawah ini merupakan
. Perhatikan struktur senyawa berikut! CH CH CH CH CH CH CH Jumlah atom C primer, atom C sekunder, dan atom C tersier dari senyawa di atas adalah...,, dan D.,, dan,, dan E.,, dan,, dan. Di bawah ini merupakan
SMA UNGGULAN BPPT DARUS SHOLAH JEMBER UJIAN SEMESTER GENAP T.P 2012/2013 LEMBAR SOAL. Waktu : 90 menit Kelas : XII IPA T.
 SMA UNGGULAN BPPT DARUS SHOLAH JEMBER UJIAN SEMESTER GENAP T.P 0/0 LEMBAR SOAL Waktu : 90 menit Kelas : XII IPA T.P : 0/0 PETUNJUK :. Isikan identitas peserta pada tempat yang telah disediakan pada lembar
SMA UNGGULAN BPPT DARUS SHOLAH JEMBER UJIAN SEMESTER GENAP T.P 0/0 LEMBAR SOAL Waktu : 90 menit Kelas : XII IPA T.P : 0/0 PETUNJUK :. Isikan identitas peserta pada tempat yang telah disediakan pada lembar
UN SMA 2012 IPA Kimia
 UN SMA 2012 IPA Kimia Kode Soal Doc. Name: UNSMAIPA2011KIM999 Doc. Version : 2012-12 halaman 1 01. Tahap awal pembuatan asam nitrat dalam industri melibatkan reaksi oksidasi ammonia yang menghasilkan nitrogen
UN SMA 2012 IPA Kimia Kode Soal Doc. Name: UNSMAIPA2011KIM999 Doc. Version : 2012-12 halaman 1 01. Tahap awal pembuatan asam nitrat dalam industri melibatkan reaksi oksidasi ammonia yang menghasilkan nitrogen
Kimia Proyek Perintis I Tahun 1979
 Kimia Proyek Perintis I Tahun 979 PP I-79-5 Kalsium mempunyai nomor 0, susunan elektron pada kulit K, L, M, N adalah A., 8, 0, 0 B., 8, 9, C., 8, 8, D., 8, 6, 4 E., 8,, 8 PP I-79-5 Larutan molal NaOH (BM
Kimia Proyek Perintis I Tahun 979 PP I-79-5 Kalsium mempunyai nomor 0, susunan elektron pada kulit K, L, M, N adalah A., 8, 0, 0 B., 8, 9, C., 8, 8, D., 8, 6, 4 E., 8,, 8 PP I-79-5 Larutan molal NaOH (BM
D. 8 mol S E. 4 mol Fe(OH) 3 C. 6 mol S Kunci : B Penyelesaian : Reaksi :
 1. Perhatikan reaksi, 2 Fe 2 S 3 + 3O 2 + 6 H 2 O 4 Fe(OH) 3 + 6S Jika 2 mol Fe 2 S 3, 2 mol O 2 dan 3 mol H 2 O bereaksi dengan sempurna, akan dihasilkan : A. 3 mol Fe(OH) 3 B. 2 mol Fe(OH) 3 D. 8 mol
1. Perhatikan reaksi, 2 Fe 2 S 3 + 3O 2 + 6 H 2 O 4 Fe(OH) 3 + 6S Jika 2 mol Fe 2 S 3, 2 mol O 2 dan 3 mol H 2 O bereaksi dengan sempurna, akan dihasilkan : A. 3 mol Fe(OH) 3 B. 2 mol Fe(OH) 3 D. 8 mol
PEMERINTAH KABUPATEN BANYUMAS DINAS PENDIDIKAN SMA NEGERI PATIKRAJA Jalan Adipura 3 Patikraja Telp (0281) Banyumas 53171
 PEMERINTAH KABUPATEN BANYUMAS DINAS PENDIDIKAN SMA NEGERI PATIKRAJA Jalan Adipura 3 Patikraja Telp (0281) 6844576 Banyumas 53171 ULANGAN KENAIKAN KELAS TAHUN PELAJARAN 2010/ 2011 Mata Pelajaran : Kimia
PEMERINTAH KABUPATEN BANYUMAS DINAS PENDIDIKAN SMA NEGERI PATIKRAJA Jalan Adipura 3 Patikraja Telp (0281) 6844576 Banyumas 53171 ULANGAN KENAIKAN KELAS TAHUN PELAJARAN 2010/ 2011 Mata Pelajaran : Kimia
2013 LEMBAR SOAL. WAKTU : 90 MENIT KELAS : XII IPA T
 2013 LEMBAR SOAL. WAKTU : 90 MENIT KELAS : XII IPA T SMA UNGGULAN BPPT DARUS SHOLAH JEMBER UJIAN SEMESTER GENAP T.P 2012/2013 LEMBAR SOAL Waktu : 90 menit Kelas : XII IPA T.P : 2012/2013 PETUNJUK : 1.
2013 LEMBAR SOAL. WAKTU : 90 MENIT KELAS : XII IPA T SMA UNGGULAN BPPT DARUS SHOLAH JEMBER UJIAN SEMESTER GENAP T.P 2012/2013 LEMBAR SOAL Waktu : 90 menit Kelas : XII IPA T.P : 2012/2013 PETUNJUK : 1.
D. beta dan alfa E. alfa dan beta
 1. Pada peluruhan menjadi kemudian meluruh menjadi, partikel-partikel yang dipancarkan berturut-turut adalah... A. foton dan beta B. foton dan alfa C. beta dan foton Reaksi peluruhan : D. beta dan alfa
1. Pada peluruhan menjadi kemudian meluruh menjadi, partikel-partikel yang dipancarkan berturut-turut adalah... A. foton dan beta B. foton dan alfa C. beta dan foton Reaksi peluruhan : D. beta dan alfa
Pembahasan Soal Multiplechoice OSK Kimia Tahun 2014 Oleh Urip
 Pembahasan Soal Multiplechoice OSK Kimia Tahun 2014 Oleh Urip Kalteng @ http://urip.wordpress.com Dengan senang hati jika ada yang mau mengoreksi pembahasan ini A. Pilih jawaban yang paling tepat ( 25
Pembahasan Soal Multiplechoice OSK Kimia Tahun 2014 Oleh Urip Kalteng @ http://urip.wordpress.com Dengan senang hati jika ada yang mau mengoreksi pembahasan ini A. Pilih jawaban yang paling tepat ( 25
PAKET UJIAN NASIONAL 9 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 9 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Isotop terdiri dari A. 13 proton, 14 elektron dan 27
PAKET UJIAN NASIONAL 9 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Isotop terdiri dari A. 13 proton, 14 elektron dan 27
FAKULTAS TEKNIK UNIVERSITAS NEGERI YOGYAKARTA BAHAN AJAR KIMIA DASAR BAB VI IKATAN KIMIA
 No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 7 BAB VI IKATAN KIMIA Sebagian besar partikel materi adalah berupa molekul atau ion. Hanya beberapa partikel materi saja yang berupa atom. 1)
No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 7 BAB VI IKATAN KIMIA Sebagian besar partikel materi adalah berupa molekul atau ion. Hanya beberapa partikel materi saja yang berupa atom. 1)
D. 4,50 x 10-8 E. 1,35 x 10-8
 1. Pada suatu suhu tertentu, kelarutan PbI 2 dalam air adalah 1,5 x 10-3 mol/liter. Berdasarkan itu maka Kp PbI 2 adalah... A. 4,50 x 10-9 B. 3,37 x 10-9 C. 6,75 x 10-8 S : PbI 2 = 1,5. 10-3 mol/liter
1. Pada suatu suhu tertentu, kelarutan PbI 2 dalam air adalah 1,5 x 10-3 mol/liter. Berdasarkan itu maka Kp PbI 2 adalah... A. 4,50 x 10-9 B. 3,37 x 10-9 C. 6,75 x 10-8 S : PbI 2 = 1,5. 10-3 mol/liter
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
Ujian Akhir Semester Mata Pelajaran Kimia Kelas X Wacana berikut digunakan untuk menjawab soal no 1 dan 2. Ditentukan 5 unsur dengan konfigurasi
 Ujian Akhir Semester Mata Pelajaran Kimia Kelas X Wacana berikut digunakan untuk menjawab soal no 1 dan 2. Ditentukan 5 unsur dengan konfigurasi elektron sebagai berikut: P : 2 8 7 S : 2 8 8 Q : 2 8 8
Ujian Akhir Semester Mata Pelajaran Kimia Kelas X Wacana berikut digunakan untuk menjawab soal no 1 dan 2. Ditentukan 5 unsur dengan konfigurasi elektron sebagai berikut: P : 2 8 7 S : 2 8 8 Q : 2 8 8
SOAL LAJU REAKSI. Mol CaCO 3 = = 0.25 mol = 25. m Mr
 SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
Pembahasan Soal-soal Try Out Neutron, Sabtu tanggal 16 Oktober 2010
 Pembahasan Soal-soal Try Out Neutron, Sabtu tanggal 16 Oktober 2010 26. Diketahui lambing unsur Fe, maka jumlah p +, e - dan n o dalam ion Fe 3+ adalah.... Jawab :, Fe 3+ + 3e - Fe [ 18 Ar] 4s 2 3d 6 [
Pembahasan Soal-soal Try Out Neutron, Sabtu tanggal 16 Oktober 2010 26. Diketahui lambing unsur Fe, maka jumlah p +, e - dan n o dalam ion Fe 3+ adalah.... Jawab :, Fe 3+ + 3e - Fe [ 18 Ar] 4s 2 3d 6 [
Berdasarkan data di atas yang merupakan larutan non elektrolit adalah nomor A. 1 B. 2 C. 3 D. 4 E. 5
 PREDIKSI UN 2010 ( semoga soal soal ini ada manfaatnya) 1. Jika diketahui nuklida 11 Na 23, maka jumlah elektron, proton dan neutron adalah A. 23 proton, 12 elektron dan 11 neutron B. 11 proton, 12 elektron
PREDIKSI UN 2010 ( semoga soal soal ini ada manfaatnya) 1. Jika diketahui nuklida 11 Na 23, maka jumlah elektron, proton dan neutron adalah A. 23 proton, 12 elektron dan 11 neutron B. 11 proton, 12 elektron
Kimia UMPTN Tahun 1981
 Kimia UMPTN Tahun 1981 UMPTN-81-51 Suatu atom unsury mempunyai susunan elektron : 1s s p 6 3s 3p 5. Unsur tersebut adalah A. logam alkali B. unsur halogen C. salah satu unsur golongan V D. belerang E.
Kimia UMPTN Tahun 1981 UMPTN-81-51 Suatu atom unsury mempunyai susunan elektron : 1s s p 6 3s 3p 5. Unsur tersebut adalah A. logam alkali B. unsur halogen C. salah satu unsur golongan V D. belerang E.
I. Soal Pilihan ganda
 I. Soal Pilihan ganda 1. Perhatikan tabel berikut : Unsur P Q R S T titik leleh ( o C) 180,54 97.81-249 63.85 117 titik didih ( o C) 1347 883-246 773,9 184 Massa atom 6.94 22.99 20.18 39.10 126.9 Kelompok
I. Soal Pilihan ganda 1. Perhatikan tabel berikut : Unsur P Q R S T titik leleh ( o C) 180,54 97.81-249 63.85 117 titik didih ( o C) 1347 883-246 773,9 184 Massa atom 6.94 22.99 20.18 39.10 126.9 Kelompok
Elektrokimia. Sel Volta
 TI222 Kimia lanjut 09 / 01 47 Sel Volta Elektrokimia Sel Volta adalah sel elektrokimia yang menghasilkan arus listrik sebagai akibat terjadinya reaksi pada kedua elektroda secara spontan Misalnya : sebatang
TI222 Kimia lanjut 09 / 01 47 Sel Volta Elektrokimia Sel Volta adalah sel elektrokimia yang menghasilkan arus listrik sebagai akibat terjadinya reaksi pada kedua elektroda secara spontan Misalnya : sebatang
Materi Pokok Bahasan :
 STOIKIOMETRI Kompetensi : Memiliki kemampuan untuk menginterpretasikan serta menerapkan dalam perhitungan kimia. Memiliki kemampuan untuk mengaplikasikan pengetahuan yang dimilikinya dan terbiasa menggunakan
STOIKIOMETRI Kompetensi : Memiliki kemampuan untuk menginterpretasikan serta menerapkan dalam perhitungan kimia. Memiliki kemampuan untuk mengaplikasikan pengetahuan yang dimilikinya dan terbiasa menggunakan
SELEKSI OLIMPIADE NASIONAL MIPA PERGURUAN TINGGI (ONMIPA-PT) 2014 TINGKAT UNIVERSITAS MUHAMMADIYAH JAKARTA BIDANG KIMIA
 SELEKSI OLIMPIADE NASIONAL MIPA PERGURUAN TINGGI (ONMIPA-PT) 2014 TINGKAT UNIVERSITAS MUHAMMADIYAH JAKARTA BIDANG KIMIA Hari, tanggal: Rabu, 2 April 2014 Waktu: 60 menit Nama: NIM: A. PILIHAN GANDA [nilai
SELEKSI OLIMPIADE NASIONAL MIPA PERGURUAN TINGGI (ONMIPA-PT) 2014 TINGKAT UNIVERSITAS MUHAMMADIYAH JAKARTA BIDANG KIMIA Hari, tanggal: Rabu, 2 April 2014 Waktu: 60 menit Nama: NIM: A. PILIHAN GANDA [nilai
PETA KONSEP LAJU REAKSI. Percobaan. Waktu perubahan. Hasil reaksi. Pereaksi. Katalis. Suhu pereaksi. Konsentrasi. Luas. permukaan.
 PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
LAMPIRAN C CCT pada Materi Ikatan Ion
 LAMPIRAN C CCT pada Materi Ikatan Ion 1 IKATAN ION A. KECENDERUNGAN ATOM UNTUK STABIL Gas mulia merupakan sebutan untuk unsur golongan VIIIA. Unsur unsur ini bersifat inert (stabil). Hal ini dikarenakan
LAMPIRAN C CCT pada Materi Ikatan Ion 1 IKATAN ION A. KECENDERUNGAN ATOM UNTUK STABIL Gas mulia merupakan sebutan untuk unsur golongan VIIIA. Unsur unsur ini bersifat inert (stabil). Hal ini dikarenakan
OLIMPIADE KIMIA INDONESIA OLIMPIADE SAINS NASIONAL. UjianTeori
 OLIMPIADE KIMIA INDONESIA OLIMPIADE SAINS NASIONAL SELEKSI KABUPATEN-KOTA UjianTeori Waktu 120 menit Departemen Pendidikan Nasional Direktorat Jenderal Managemen Pendidikan Dasar dan Menengah Direktorat
OLIMPIADE KIMIA INDONESIA OLIMPIADE SAINS NASIONAL SELEKSI KABUPATEN-KOTA UjianTeori Waktu 120 menit Departemen Pendidikan Nasional Direktorat Jenderal Managemen Pendidikan Dasar dan Menengah Direktorat
STOKIOMETRI. Kimia Kelas X
 STOKIOMETRI Kimia Kelas X SEKOLAH MENENGAH ATAS NEGERI 12 SURABAYA 2015 STOKIOMETRI STOKIOMETRI Pada materi stokiometri, kita akan mempelajari beberapa hal seperti persamaan reaksi, hukum-hukum dasar kimia,
STOKIOMETRI Kimia Kelas X SEKOLAH MENENGAH ATAS NEGERI 12 SURABAYA 2015 STOKIOMETRI STOKIOMETRI Pada materi stokiometri, kita akan mempelajari beberapa hal seperti persamaan reaksi, hukum-hukum dasar kimia,
OAL TES SEMESTER I. I. Pilihlah jawaban yang paling tepat!
 KIMIA X SMA 103 S AL TES SEMESTER I I. Pilihlah jawaban yang paling tepat! 1. Partikel penyusun inti atom terdiri dari... a. proton dan elektron b. proton dan netron c. elektron dan netron d. elektron
KIMIA X SMA 103 S AL TES SEMESTER I I. Pilihlah jawaban yang paling tepat! 1. Partikel penyusun inti atom terdiri dari... a. proton dan elektron b. proton dan netron c. elektron dan netron d. elektron
Stoikiometri. OLEH Lie Miah
 Stoikiometri OLEH Lie Miah 1 STANDAR KOMPETENSI KOMPETENSI DASAR INDIKATOR KARAKTERISTIK MATERI KESULITAN BELAJAR SISWA STANDAR KOMPETENSI Memahami hukum-hukum dasar Kimia dan penerapannya dalam perhitungan
Stoikiometri OLEH Lie Miah 1 STANDAR KOMPETENSI KOMPETENSI DASAR INDIKATOR KARAKTERISTIK MATERI KESULITAN BELAJAR SISWA STANDAR KOMPETENSI Memahami hukum-hukum dasar Kimia dan penerapannya dalam perhitungan
L A R U T A N _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA
 L A R U T A N _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA 1. Larutan Elektrolit 2. Persamaan Ionik 3. Reaksi Asam Basa 4. Perlakuan Larutan
L A R U T A N _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA 1. Larutan Elektrolit 2. Persamaan Ionik 3. Reaksi Asam Basa 4. Perlakuan Larutan
UJIAN NASIONAL TAHUN PELAJARAN 2007/2008
 UJIAN NASIONAL TAHUN PELAJARAN 2007/2008 PANDUAN MATERI SMA DAN MA K I M I A PROGRAM STUDI IPA PUSAT PENILAIAN PENDIDIKAN BALITBANG DEPDIKNAS KATA PENGANTAR Dalam rangka sosialisasi kebijakan dan persiapan
UJIAN NASIONAL TAHUN PELAJARAN 2007/2008 PANDUAN MATERI SMA DAN MA K I M I A PROGRAM STUDI IPA PUSAT PENILAIAN PENDIDIKAN BALITBANG DEPDIKNAS KATA PENGANTAR Dalam rangka sosialisasi kebijakan dan persiapan
BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI
 BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI A. STANDAR KOMPETENSI Mendiskripsikan hukumhukum dasar kimia dan penerapannya dalam perhitungan kimia. B. Kompetensi Dasar : Menuliskan nama senyawa anorganik
BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI A. STANDAR KOMPETENSI Mendiskripsikan hukumhukum dasar kimia dan penerapannya dalam perhitungan kimia. B. Kompetensi Dasar : Menuliskan nama senyawa anorganik
1s 2 2s 2 2p 6 3s 2 2p 6 3d 4s 1 4p 4d 4f 5s 5p 5d 5f
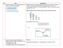 NO SOAL PEMBAHASAN 1 Konfigurasi elekttron ion X - yang memiliki nomor massa 39 dan 21 neutron adalah.. A. 1s2 2s2 2p6 3s2 3p6 4s2 3d1 B. 1s2 2s2 2p6 3s2 3p6 4s1 C. 1s2 2s2 2p6 3s2 3p6 3d1 D. 1s2 2s2 2p6
NO SOAL PEMBAHASAN 1 Konfigurasi elekttron ion X - yang memiliki nomor massa 39 dan 21 neutron adalah.. A. 1s2 2s2 2p6 3s2 3p6 4s2 3d1 B. 1s2 2s2 2p6 3s2 3p6 4s1 C. 1s2 2s2 2p6 3s2 3p6 3d1 D. 1s2 2s2 2p6
Siswa diingatkan tentang struktur atom, bilangan kuantum, bentuk-bentuk orbital, dan konfigurasi elektron
 RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI
 3 LAJU REAKSI A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI Materi dapat berubah dari bentuk yang satu ke bentuk yang
3 LAJU REAKSI A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI Materi dapat berubah dari bentuk yang satu ke bentuk yang
Volume gas oksigen yang diperlukan pada reaksi tersebut pada keadaan standart adalah. (Mr propana = 44)
 1. Suatu unsut terletak pada periode ke-3 golongan IIIA, konfigurasi elektron unsur tersebut adalah... A. 1s 2 2s 2 2p 1 B. 1s 2 2s 2 2p 6 3s 2 C. 1s 2 2s 2 2p 6 3s 2 3p 1 D. 1s 2 2s 2 2p 6 3d 10 4s 2
1. Suatu unsut terletak pada periode ke-3 golongan IIIA, konfigurasi elektron unsur tersebut adalah... A. 1s 2 2s 2 2p 1 B. 1s 2 2s 2 2p 6 3s 2 C. 1s 2 2s 2 2p 6 3s 2 3p 1 D. 1s 2 2s 2 2p 6 3d 10 4s 2
LOGO STOIKIOMETRI. Marselinus Laga Nur
 LOGO STOIKIOMETRI Marselinus Laga Nur Materi Pokok Bahasan : A. Konsep Mol B. Penentuan Rumus Kimia C. Koefisien Reaksi D. Hukum-hukum Gas A. Konsep Mol Pengertian konsep mol Hubungan mol dengan jumlah
LOGO STOIKIOMETRI Marselinus Laga Nur Materi Pokok Bahasan : A. Konsep Mol B. Penentuan Rumus Kimia C. Koefisien Reaksi D. Hukum-hukum Gas A. Konsep Mol Pengertian konsep mol Hubungan mol dengan jumlah
SIMULASI UJIAN NASIONAL 1
 SIMULASI UJIAN NASIONAL 1 1. Bilangan-bilangan kuantum yang mungkin dimiliki oleh suatu elektron (A) n = 2, l = 2, m = 0, s = - 1 2 (B) n = 3, l = 0, m = +1, s = + 1 2 (C) n = 4, l = 2, m = - 3, s = -
SIMULASI UJIAN NASIONAL 1 1. Bilangan-bilangan kuantum yang mungkin dimiliki oleh suatu elektron (A) n = 2, l = 2, m = 0, s = - 1 2 (B) n = 3, l = 0, m = +1, s = + 1 2 (C) n = 4, l = 2, m = - 3, s = -
KIMIA SMA/MA PROGRAM STUDI IPA Waktu 120 menit. Berdasarkan Lampiran Permendiknas Nomor 77 Tahun 2008 Tanggal 5 Desember 2008
 KIMIA SMA/MA PROGRAM STUDI IPA Waktu 120 menit Berdasarkan Lampiran Permendiknas Nomor 77 Tahun 2008 Tanggal 5 Desember 2008 MATA PELAJARAN Mata Pelajaran Program Studi : Kimia : IPA PETUNJUK UMUM A. Isikan
KIMIA SMA/MA PROGRAM STUDI IPA Waktu 120 menit Berdasarkan Lampiran Permendiknas Nomor 77 Tahun 2008 Tanggal 5 Desember 2008 MATA PELAJARAN Mata Pelajaran Program Studi : Kimia : IPA PETUNJUK UMUM A. Isikan
UN SMA IPA Kimia. Kode Soal 305
 UN SMA IPA Kimia Kode Soal 305 Doc.name : UNSMAIPAKIM305 Version : 2012-12 halaman 1 1. Di antara hal-hal di bawah ini : 1. besi berpilar 2. pagar di cat 3. belerang meleleh 4. nasi jadi basi 5. bel berdering
UN SMA IPA Kimia Kode Soal 305 Doc.name : UNSMAIPAKIM305 Version : 2012-12 halaman 1 1. Di antara hal-hal di bawah ini : 1. besi berpilar 2. pagar di cat 3. belerang meleleh 4. nasi jadi basi 5. bel berdering
3. ELEKTROKIMIA. Contoh elektrolisis: a. Elektrolisis larutan HCl dengan elektroda Pt, reaksinya: 2HCl (aq)
 3. ELEKTROKIMIA 1. Elektrolisis Elektrolisis adalah peristiwa penguraian elektrolit oleh arus listrik searah dengan menggunakan dua macam elektroda. Elektroda tersebut adalah katoda (elektroda yang dihubungkan
3. ELEKTROKIMIA 1. Elektrolisis Elektrolisis adalah peristiwa penguraian elektrolit oleh arus listrik searah dengan menggunakan dua macam elektroda. Elektroda tersebut adalah katoda (elektroda yang dihubungkan
a. Ion c. Molekul senyawa e. Campuran b. Molekul unsur d. Unsur a. Air c. Kuningan e. Perunggu b. Gula d. Besi
 A. PILIHAN GANDA 1. Molekul oksigen atau O2 merupakan lambang dari partikel a. Ion c. Molekul senyawa e. Campuran b. Molekul unsur d. Unsur 2. Di antara zat berikut yang merupakan unsur ialah... a. Air
A. PILIHAN GANDA 1. Molekul oksigen atau O2 merupakan lambang dari partikel a. Ion c. Molekul senyawa e. Campuran b. Molekul unsur d. Unsur 2. Di antara zat berikut yang merupakan unsur ialah... a. Air
PRODUKSI GAS HIDROGEN MELALUI PROSES ELEKTROLISIS SEBAGAI SUMBER ENERGI
 PRODUKSI GAS HIDROGEN MELALUI PROSES ELEKTROLISIS SEBAGAI SUMBER ENERGI Oleh: Ni Made Ayu Yasmitha Andewi 3307.100.021 Dosen Pembimbing: Prof. Dr.Ir. Wahyono Hadi, M.Sc JURUSAN TEKNIK LINGKUNGAN FAKULTAS
PRODUKSI GAS HIDROGEN MELALUI PROSES ELEKTROLISIS SEBAGAI SUMBER ENERGI Oleh: Ni Made Ayu Yasmitha Andewi 3307.100.021 Dosen Pembimbing: Prof. Dr.Ir. Wahyono Hadi, M.Sc JURUSAN TEKNIK LINGKUNGAN FAKULTAS
Wardaya College. Tes Simulasi Ujian Nasional SMA Berbasis Komputer. Mata Pelajaran Kimia Tahun Ajaran 2017/2018. Departemen Kimia - Wardaya College
 Tes Simulasi Ujian Nasional SMA Berbasis Komputer Mata Pelajaran Kimia Tahun Ajaran 2017/2018-1. Sebuah unsur X memiliki no massa 52 dan jumlah neutron sebesar 28. Kongurasi elektron dari ion X + adalah...
Tes Simulasi Ujian Nasional SMA Berbasis Komputer Mata Pelajaran Kimia Tahun Ajaran 2017/2018-1. Sebuah unsur X memiliki no massa 52 dan jumlah neutron sebesar 28. Kongurasi elektron dari ion X + adalah...
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA JAWABAN (DOKUMEN NEGARA) UjianTeori. Waktu: 100 menit
 OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA JAWABAN (DOKUMEN NEGARA) UjianTeori Waktu: 100 menit Kementerian Pendidikan Nasional Dan Kebudayaan Direktorat Jenderal Managemen Pendidikan Dasar
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA JAWABAN (DOKUMEN NEGARA) UjianTeori Waktu: 100 menit Kementerian Pendidikan Nasional Dan Kebudayaan Direktorat Jenderal Managemen Pendidikan Dasar
Chapter 7 Larutan tirtawi (aqueous solution)
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi modif oleh Dr I Kartini Chapter 7 Larutan tirtawi (aqueous solution) Larutan adalah campuran yang homogen dari dua atau lebih
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi modif oleh Dr I Kartini Chapter 7 Larutan tirtawi (aqueous solution) Larutan adalah campuran yang homogen dari dua atau lebih
KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN
 KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN 1. Suatu reaksi dikatakan mencapai kesetimbangan apabila. A. laju reaksi ke kiri sama dengan ke kanan B. jumlah koefisien reaksi ruas kiri sama dengan ruas kanan
KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN 1. Suatu reaksi dikatakan mencapai kesetimbangan apabila. A. laju reaksi ke kiri sama dengan ke kanan B. jumlah koefisien reaksi ruas kiri sama dengan ruas kanan
OLIMPIADE KIMIA INDONESIA
 OLIMPIADE KIMIA INDONESIA OLIMPIADE SAINS NASIONAL SELEKSI KABUPATEN / KOTA UjianTeori Waktu 2 Jam Departemen Pendidikan Nasional Direktorat Jenderal Managemen Pendidikan Dasar dan Menengah Direktorat
OLIMPIADE KIMIA INDONESIA OLIMPIADE SAINS NASIONAL SELEKSI KABUPATEN / KOTA UjianTeori Waktu 2 Jam Departemen Pendidikan Nasional Direktorat Jenderal Managemen Pendidikan Dasar dan Menengah Direktorat
SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016)
 SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016) Bagian I: Pilihan Ganda 1) Suatu atom yang mempunyai energi ionisasi pertama bernilai besar, memiliki sifat/kecenderungan : A. Afinitas elektron rendah
SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016) Bagian I: Pilihan Ganda 1) Suatu atom yang mempunyai energi ionisasi pertama bernilai besar, memiliki sifat/kecenderungan : A. Afinitas elektron rendah
Hubungan koefisien dalam persamaan reaksi dengan hitungan
 STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
STOKIOMETRI BAB. B. Konsep Mol 1. Hubungan Mol dengan Jumlah Partikel. Contoh: Jika Ar Ca = 40, Ar O = 16, Ar H = 1, tentukan Mr Ca(OH) 2!
 BAB 7 STOKIOMETRI A. Massa Molekul Relatif Massa Molekul Relatif (Mr) biasanya dihitung menggunakan data Ar masing-masing atom yang ada dalam molekul tersebut. Mr senyawa = (indeks atom x Ar atom) Contoh:
BAB 7 STOKIOMETRI A. Massa Molekul Relatif Massa Molekul Relatif (Mr) biasanya dihitung menggunakan data Ar masing-masing atom yang ada dalam molekul tersebut. Mr senyawa = (indeks atom x Ar atom) Contoh:
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
MODUL KIMIA SMA IPA Kelas 10
 SMA IPA Kelas 0 A. Massa Atom. Massa Atom Relatif (Ar) Massa atom relatif (Ar) merupakan perbandingan massa atom dengan massa satu atom yang tetap. Secara matematis dapat dirumuskan sebagai berikut. sma
SMA IPA Kelas 0 A. Massa Atom. Massa Atom Relatif (Ar) Massa atom relatif (Ar) merupakan perbandingan massa atom dengan massa satu atom yang tetap. Secara matematis dapat dirumuskan sebagai berikut. sma
K13 Revisi Antiremed Kelas 11 Kimia
 K13 Revisi Antiremed Kelas 11 Kimia Persiapan UTS Semester Ganjil Doc. Name: RK13AR11KIM01UTS Doc. Version: 2016-10 halaman 1 01. Sebenarnya kimia organik dan anorganik tidaklah perlu dipisah-pisahkan,
K13 Revisi Antiremed Kelas 11 Kimia Persiapan UTS Semester Ganjil Doc. Name: RK13AR11KIM01UTS Doc. Version: 2016-10 halaman 1 01. Sebenarnya kimia organik dan anorganik tidaklah perlu dipisah-pisahkan,
LEMBARAN SOAL 5. Pilih satu jawaban yang benar!
 LEMBARAN SOAL 5 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
LEMBARAN SOAL 5 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
SOAL KIMIA 1 KELAS : XI IPA
 SOAL KIIA 1 KELAS : XI IPA PETUNJUK UU 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja 3. Kerjakanlah soal anda pada lembar
SOAL KIIA 1 KELAS : XI IPA PETUNJUK UU 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja 3. Kerjakanlah soal anda pada lembar
PEMBAHASAN KIMIA 2011(NGACAK)
 PEMBAHASAN KIMIA 2011(NGACAK) Berikut adalah 3 soal kimia pada UNSUR 2011 tentang senyawa karbon. Soal yang pertama adalah pengenalan jenis-jenis reaksi kimia pada senyawaan karbon. Reaksi adisi ~ reaksi
PEMBAHASAN KIMIA 2011(NGACAK) Berikut adalah 3 soal kimia pada UNSUR 2011 tentang senyawa karbon. Soal yang pertama adalah pengenalan jenis-jenis reaksi kimia pada senyawaan karbon. Reaksi adisi ~ reaksi
KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN
 KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN DIREKTORAT JENDERAL PENDIDIKAN MENENGAH DIREKTORAT PEMBINAAN SEKOLAH MENENGAH ATAS Petunjuk 1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan
KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN DIREKTORAT JENDERAL PENDIDIKAN MENENGAH DIREKTORAT PEMBINAAN SEKOLAH MENENGAH ATAS Petunjuk 1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan
Ikatan kimia. 1. Peranan Elektron dalam Pembentukan Ikatan Kimia. Ikatan kimia
 Ikatan kimia 1. Peranan Elektron dalam Pembentukan Ikatan Kimia Ikatan kimia Gaya tarik menarik antara atom sehingga atom tersebut tetap berada bersama-sama dan terkombinasi dalam senyawaan. gol 8 A sangat
Ikatan kimia 1. Peranan Elektron dalam Pembentukan Ikatan Kimia Ikatan kimia Gaya tarik menarik antara atom sehingga atom tersebut tetap berada bersama-sama dan terkombinasi dalam senyawaan. gol 8 A sangat
