BAB IV HASIL PENELITIAN DAN PEMBAHASAN. kelompok mahasiswa dalam menyelesaikan soal-soal stoikiometri.
|
|
|
- Yanti Kusuma
- 7 tahun lalu
- Tontonan:
Transkripsi
1 4.1 Deskripsi Hasil Penelitian BAB IV HASIL PENELITIAN DAN PEMBAHASAN Cara Mahasiswa Menyelesaikan Soal-Soal Stoikiometri Cara mahasiswa menyelesaikan soal stoikiometri dianalisis berdasarkan respon jawaban mahasiswa yang benar dalam menyelesaikan soal stoikiometri. Soal yang diberikan pada mahasiswa terdiri dari 5 (lima) konsep turunan stoikiometri meliputi: volume molar (VM), masa molar (MM), persamaan reaksi (PR), rumus empiris (RE) dan gabungan dari komponen-komponen (KOM) tersebut. Sedangkan untuk memetakan struktur pengetahuan dianalisis dengan menggunakan KST. Persentase pengusaan konsep mahasiswa yang benar dalam menyelesaikan soal-soal stoikiometri untuk setiap kelompok mahasiswa berdasarkan semester disajikan pada Tabel 2 berikut: Tabel 4.1 Persentase pengusaan konsep yang benar mahasiswa untuk setiap Pengusaan konsep yang dianalisis kelompok mahasiswa dalam menyelesaikan soal-soal stoikiometri. Item Soal Semester I (n = 56) Perolehan Jawaban Benar Mahasiswa (%) Semseter III (n = 66) Semester V (n = 46) Volume Molar 1,3, Massa Molar 8, Persamaan Reaksi 5,6, Rumus empiris Kompleks Jumlah (n = 168) Berdasarkan Tabel 2 di atas diketahui bahwa persentase pengusaan konsep yang pada benar mahasiswa menyelesaikan soal-soal stoikiometri, untuk setiap konsep yang dianalisi setiap yaitu Volume molar (55 %), massa molar (49 %), persamaan reaksi (62 %), proposional (8 %) dan kompleks (4 %). Penjelasan berikut ini dalam menggambarkan secara riil bagaimana cara mahasiswa menyelesaikan soal-soal stoikiometri. Soal yang mengukur VM terdiri
2 dari 3 (tiga) soal yang diujikan: a) pengertian mol, b) perbedaan konsep mol pada larutan dan gas, c) menghitung mol. Soal yang mengukur MM terdiri dari 2 soal yang menguji tentang: a) menghitung mol dengan mnggunakan gas ideal, b) menghitung mol garam yang terbentuk. Soal yang mengukur tentang PR terdiri dari 3 soal yang menguji tentang: a) perngertian persamaan reaksi, b) menyetarakan persamaan reaksi, c) menyetarakan persamaan reaksi. Soal yang mengukur RE terdiri dari 1 soal yang mengitung rumus empiris. Soal yang ke-5 yaitu mengitung massa berdasarkan persamaan reaksi atau gabungan dari gabungan dari komponen-komponen tersebut. a) Cara Mahasiswa Menyelesaikan Soal Volume Molar dengan Benar Pengusaan konsep volume molar mahasiswa diidentifikasi melalui item soal tentang a) pengertian mol (item soal no 1), b) perbedaan konsep mol pada larutan dan gas (item soal no 3), c) menghitung mol (item soal no 4). 1) Cara mahasiswa mendefinisikan pengertian mol Menganalisis cara mahasiswa mendefinisikan pengertian mol diketahui dari jawaban atas pertanyaan sebagai berikut: Pertanyaan yang diajukan: Apakah yang dimaksud dengan mol dalam kimia? Jawaban yang benar yaitu mol adalah jumlah zat suatu sistem yang mengandung sejumlah besaran elementer (atom, molekul, dsb) sebanyak atom yang terdapat dalam 12 gram tepat isotop karbon-12 ( C). Berdasarkan variasi jawaban mahasiswa (Lampiran 5) diket ahui bahwa ditinjau dari cara mendefinisikan mol maka dapat ditentukan beberapa hal yakni a) mahasiswa dominan mendefinisikan mol adalah suatu ukuran yang digunakan untuk menyatakan berapa banyak molekul dalam suatu zat kimia, b) biasanya dinyatakan dalam bentuk massa dibagi dengan jumlah massa molekul relative, c) selain itu ada juga mahasiswa yang mendefinisikan mol adalah satuan yang digunakan untuk menyatakan banyaknya kadar suatu atom-atom senyawa, dimana 1 mol sebanding dengan 6, partikel (bilangan Avogadro). Berdasarkan jawaban mahasiswa (Lampiran 5) dapat dibenarkan karena memenuhi unsur-unsur yang menyebut bahwa mol adalah suatu ukuran yang menyatakan banyaknya kadar suatu atom, molekul senyawa. Tetapi ditinjau pada
3 umumnya bahwa mahasiswa belum dapat menjelaskan secara detail sesuai struktur variasi jawaban. 2) Cara Mahasiswa membedakan konsep mol pada gas dan larutan. Menganalisis cara mahasiswa membedakan konsep mol pada gas dan larutan diketahui dari jawaban atas pertanyaan sebagai berikut: Pertanyaan yang diajukan: Sebutkan perbedaan konsep mol pada gas dan larutan! Jawaban yang benar adalah perbedaan konsep mol pada gas dan larutan terletak pada penerapannya dimana pada gas menggunakan persamaan gas ideal (PV= n.rt) n = dan pada larutan menggunakan konsep molaritas yaitu (M = ) n = M.V Berdasarkan jawaban ( Lampiran 5) dari cara mahasiswa membedakan konsep mol pada gas dan larutan dapat ditentukan sebagian besar (52%) mahasiswa sudah mampu membedakannya. Akan tetapi ada beberapa mahasiswa yang menjawab konsep mol pada larutan yakni n =. Beberapa jawaban mahasiswa (Lampiran 5) dapat dibenarkan karena memenuhi unsur-unsur yang menyebut bahwa konsep mol pada larutan M = dan konsep mol pada gas PV=nRT. Tetapi ditinjau pada umumnya belum detail sesuai struktur variasi jawaban. 3) Cara mahasiswa membedakan konsep mol pada larutan dan menghitung harga mol Menganalisis cara mahasiswa membedakan konsep mol pada larutan dan menghitung mol harga diketahui dari jawaban atas pertanyaan sebagai berikut: Pertanyataan yang diajukan: Jika diketahui suatu masa H 2 SO 4 12,25 gram yang terdapat dalam 0,250 L H 2 SO 4 0,50 M: a) tulislah konsep mol yang digunakan pada persamaan di atas! (gas atau larutan). b) hitunglah jumlah mol H 2 SO 4! Jawaban yang benar diketahui: massa H 2 SO = 12,25 gram, V H 2 SO 4 = 0,250 L, M H 2 SO 4 = 0,50 M. Ditanya: a. Konsep mol yang digunakan, b.mol =?Penyelesaian: a) Konsep mol yang digunakan pada persamaan diatas adalah konsep mol pada larutan. b) M = = mol H 2 SO 4 = M H 2 SO 4 V H 2 SO = 0,50 M 0,25 L= 0,125 mol = mol.
4 Berdasrakan jawaban mahasiswa (Lampiran 5) diketahui bahwa ditinjau dari cara mahasiswa membedakan dan mengitung harga mol, maka dapat ditentukan sebagian besar (57 %) mahasiswa sudah mampu membedakan dan menghitung mol. Berdasarkan jawaban mahasiswa tersebut dapat dibenarkan karena memenuhi unsur-unsur yang menyebut bahwa konsep mol yang digunakan adalah konsep mol larutan dan memakai persamaan n = M.V. Hal ini berarti struktur pengetahuan mahasiswa sudah baik. b) Cara Mahasiswa Menyelesaikan Soal Massa Molar dengan Benar Pengusaan konsep massa molar mahasiswa diidentifikasi melalui item soal tentang a) menentukan harga mol dengan persamaan PV = nrt (item soal no 8), b) menghitung mol garam yang terbentuk dengan persamaan n = M.V (item soal no 9) 1) Variasi jawaban mahasiswa dalam menghitung harga mol dengan persamaan PV = nrt Menganalisis cara mahasiswa menghitung harga mol dengan persamaan PV=nRT diketahui dari jawaban atas pertanyaan sebagai berikut: Pertanyaan yang diajukan: Suatu senyawa diketahui terdiri atas nitrogen (Ar = 14) dan oksigen (Ar = 16). Jika pada suhu 0 C dan tekanan 2 atm, sen yawa tersebut memiliki volume 1 L dengan massa 4,107 g. Hitunglah berapa mol senyawa tersebut! (R = 0,082 L atm/k mol). Jawaban yang benar yaitu Diketahui : V = 1 L, gr = 4,107 g, R = 0,082 L atm/k mol, T=0 0 C = 273 K, Mr NO - 2 = 46Ditanya : n =?Penyelesaian : n = = ataun = = =,, / /, / = 0,089 mol. = 0,089 mol Berdasarkan jawaban mahasiswa (Lampiran 5) diketahui bahwa d itinjau dari cara mahasiswa dalam menentukan harga mol dengan persamaan PV = nrt, maka dapat ditentukan bahwa sebagian besar (64 %) mahasiswa sudah mampu menghitung mol dari soal wacana. Hal berarti mahasiswa sudah memiliki struktur pngetahuan yang baik. Tetapi pada umumnya belum secara detail.
5 2) Variasi jawaban mahasiswa dalam menghitung mol garam yang terbentuk dengan persamaan n = M.V Menganalisis cara mahasiswa dalam menghitung mol garam yang tebrbentuk diketahui dari jawaban atas pertanyaan sebagai berikut: Pertanyaan yang diajukan: Sebanyak 50 ml NaCO 3 0,05 M direaksikan dengan 20 ml HCl 0,1 M. Berapa mol garam yang terbentuk? Jawaban yang benar yaitu Dik: V Na 2 CO 3 = 50 ml = 0,05 L, M Na2CO3 = 0,05 M, V HCl = 20 ml = 0,02 L, M HCl = 0,1 M, Ditanya: mol NaCl =...? a) Persamaan reaksi setara: Na 2 CO 3(aq) + 2HCl (aq) 2NaCl (aq) + H 2 O (l) + CO 2(g) Mol Na 2 CO 3 dan HCl = n Na2CO3 = M VNa 2CO= 0,05 M 0,05 L= 0,0025 mol =n HCl = M V HCl = 0,1 M 0,02 L= 0,002 mol b) Menentukan mol garam yang terbentuk Na 2 CO 3(aq) + 2HCl (aq) 2NaCl (aq) + H 2 O (l) + CO 2(g) Awal : 0,0025 mol 0,002 mol Reaksi: -( 0,002) -0,002 +( 0,002) + ( 0,002) + ( 0,002) Akhir : 0,0015 mol 0 mol 0,002 mol 0,001 mol 0,001 mol Jadi garam yang terbentuk adalah NaCl sebanyak 0,002 mol Berdasarkan jawaban mahasiswa (Lampiran) diketahui bahwa ditinjau dari cara mahasiswa menghitung mol garam dengan persamaan n = M.V maka dapat ditentukan bahwa mahasiswa sebagian kecil (35 %) mampu memahami aplikasi mol dengan menggunakan persamaan reaksi. Hal ini berarti struktur pngetahuan mahasiswa belum baik. c) Cara Mahasiswa Menyelesaikan Soal Pesamaan Reaksi Pengusaan konsep persamaan reaksi mahasiswa diidentifikasi melalui soal tentang a) pengertian persamaan reaksi (item soal no 5), b) menyetarakan persamaan reaksi (item soal no 6), c) menyetarakan persamaan reaksi (item soal no 7). 1) Variasi jawaban mahasiswa mendefinisikan pengertian persamaan reaksi Menganalisis cara mahasiswa dalam mendefinisikan pengertianpersamaan reaksi diketahui dari jawaban atas pertanyaan sebagai berikut:
6 Pertanyaan yang diajukan: Apakah yang dimaksud dengan persamaan reaksi? Jawaban yang benar adalah persamaan reaksi menjelaskan secara kualitatif peristiwa yang terjadi jika dua pereaksi atau lebih bergabung dan secara kuantitatif menyatakan jumlah zat yang bereaksi serta jumlah produk reaksi. Berdasarkan jawaban mahasiswa (Lampiran 5) diketahui bahwa ditinjau dari jawaban yang ada dapat disimpulkan bahwa sebagian besar (69 %) mahasiswa kimia memiliki struktur pengetahuan baik. Berdasarkan jawaban mahasiswa tersebut dapat debenarkan karena memenuhi unsur-unsur yang menyebut bahwa persamaan reaksi kimia adalah suatu persamaan yang menggambarkan hubungan perubahan zat sebelum mengalami perubahan dan sesudah mengalami perubahan, baik hubungan kualitatif maupun kuantitatif. Zat yang direaksikan disebut sebagai reaktan, sedangkan zat hasil reaksi sebagai product. Tetapi ditinjau pada umumnya bahwa cara menjawab mahasiswa belum secara detail sesuai struktur variasi jawaban. 2) Variasi Jawaban mahasiswa dalam menjawab soal menyetarakan persamaan reaksi Menganalisis cara mahasiswa dalam menyetarakan persamaan reaksi diketahui dari jawaban atas pertanyaan berikut: Pertanyaan yang diajukan: Suatu larutan magnesium klorida bereaksi dengan perak nitrat menghasilkan perak klorida dan magnesium nitrat. Tulislah persamaan reaksi di atas! Jawaban yang benar yakni: MgCl 2 + 2AgNO 3 2AgCl + Mg(NO 3 ) 2 Berdasarkan jawaban mahasiswa (Lampiran 5) ditinjau dari jawaban mahasiswa dapat ditentukan sebagian kecil (42,6 %) mahasiswa kimia memiliki struktur pengetahuan yang baik tentang penulisan persamaan reaksi kimia. 3) Variasi cara mahasiswa menuliskan dan menyetarakan persamaan reaksi Menganalisis cara mahasiswa menuliskan dan menyetarakan persamaan reaksi diketahui atas pertanyaan berikut: Pertanyaan yang diajukan: Suatu propana dibakar dengan oksigen menghasilkan karbon dioksida dan air. Tulislah persamaan reaksinya! Jawaban yang benar yakni C 3 H 8 + 5O 2 3CO 2 + 4H 2 O
7 Berdasarkan jawaban mahasiswa (Lampiran 5) diketahui bahwa ditinjau dari cara mahasiswa menuliskan dan menyetarakan persamaan reaksi dapat disimpulkan sebagian besar (71 %) mah asiswa kimia sudah memiliki struktur pengetahuan yang baik. d) Cara Mahasiswa Menyelesaikan Soal Rumus Empiris (RE) Pengusaan konsep RE mahasiswa diidentifikasi melalui soal tentangmenentukan rumus empiris (item soal no 2). 1) Variasi jawaban mahasiswa dalam menentukan rumus empiris. Menganalisis cara mahasiswa menentukan rumus empiris didasarkan atas pertanyaan sebagai berikut: Pertanyaan yang diajukan: 1,025 g sampel suatu senyawa yang mengandung karbon dan hidrogen dibakar dengan oksigen menghasilkan karbon dioksida dan air. Hasilnya masing-masing ditampung dan ditimbang. Ternyata terbentuk 3,007 g CO 2 dan 1,845 g H 2 O. Tentukan rumus empiris senyawa tersebut! Jawaban yang benar yakni: Dik: Senyawa x (C x H x ) = 1,025 g, Massa CO 2 = 3,007 gr, Massa H 2 O = 1,845 gr, (Mr CO 2 = 44, Mr H 2 O = 18). Dit: RE C x H x =...?Penyelesaian : C x H x + O 2 = CO 2 + H 2 O Mencari massa atom karbon (C) Dalam 1 mol CO 2 (44,01 g) dan 1 mol C (12,01 g) Jadi dalam 3,007 g CO 2, massa karbon adalah: 3,007 g CO 2 (,, ) = 0,8206 g C Mencari massa atom hidrogen (H) Dalam 1 mol H 2 O (18,02 g) ada 2 mol H (2,016 g), sehingga massa H dalam 1,845 g H 2 O: 1,845 g H 2 O (,, ) = 0,2064 g H Setelah diketahui massa C dan H dalam sampel, kita menghitung molnya: 0,8206 g C (, ) = 0,06833 mol C dan 0,2064 g H (, ) = 0,2048 mol H Menentukan subskribnya: C 0,06833 H 0,2084
8 Membagi dengan subskrib yang paling kecil (0,06833) C,,, = C 1 H 2,977 Jadi rumus empiris dari senyawa x adalah CH 3. Berdasarkan jawaban mahasiswa (Lampiran 5) diketahui bahwa ditinjau dari cara mahasiswa menjawab, maka dapat disimpulkan bahwa hanya sebagian kecil (8 %) yang mampu menjawab. Hal ini berarti truktur pengetahuan mahasiswa kimia tentang rumus empisis cenderung tidak terstruktur dengan baik atau parsial. e) Kompleks Pengusaan konsep untuk menyelesaiakn soal yang kompleks mahasiswa melalui item soal tentang mengitung massa berdasarkan persamaan reaksi (item soal no 10). 1) Variasi jawaban mahasiswa dalam menghitung massa Menganalisis cara mahasiswa menghitung massa didasarkan atas pertanyaan sebagai berikut: Pertanyaan yang diajukan: Berapa gram asam klorida (Mr = 36,5 g/mol) menghasilkan 10 dm 3 karbon dioksida pada STP (V= 24,5 L/mol) menurut persamaan reaksi berikut Na 2 CO HCl 2NaCl + CO 2 + H 2 O. Jawaban yang benar yaitu Diketahui : V (CO 2 ) = 10,0 dm 3, Vm = 24,5 dm 3 /mol, Mr HCl = 36,5 g/mol.ditanya : gram HCl =...? Penyelesaian : n (CO 2 ) = ( ) =,, / = 0,408 mol n (HCl) = 2 n (CO 2 ) = 2 (0,408 mol) = 0,816 mol m (HCl) = n (HCl) Mr (HCl) = (0,816 mol) (36,5 g/mol = 29,8 g Berdasarkan jawaban mahasiswa (Lampiran 5) diketahui bahwa ditinjau dari cara mahasiswa menjawab dapat disimpulkan bahwa hanya sebagian kecil (3,5 %) mahasiswa kimia yang memiliki struktur pengetahuan yang baik atau parsial tentang penentuan massa dari suatu soal yang bersifat kompleks Struktur Pengetahuan Mahasiswa dalam Menyelesaikan Soal-Soal stoikiometri Deskripsi selanjutnya berkenaan dengan menentukan struktur pngetahuan mahasiswa dilakukan melalui tahap-tahap sebagai berikut:, H
9 1. Knowledge state yaitu keadaan pengetahuan yang diperoleh dari respon jawaban siswa yang terdiri dua bagian yakni: a) Penentuan response state yaitu mengkategorisasikan setiap jawaban responden (mahasiswa) b) Penentuan response structure yaitu mengelompokan response state sesuai jumlah respon mahasiswa. 2. Knowledge structure yaitu gambaran struktur pengetahuan mahasiswa yang diperoleh dari response structure 3. Learning patway yaitu kecenderungan jalur pembelajaran mahasiswa yang diperoleh dari knowledge structure Pemetaan struktur pengetahuan mahasiswa Jurusan Kimia Universitas Negeri Gorontalo.Pemetaan ini dilakukan berdasarkan response state,response structure dan knowledge. Untuk response state disajikan dalam Tabel 4.2 berikut: Tabel 4.2 Data perolehan response state mahasiswa Jurusan Kimia Semester 1 Universitas negeri Gorontalo (n = 56) Responden Respon State Responden Respon State Responden Respon State 1 [1,3,4,5,8,9] 20 [4,5,6,7,8] 39 2 [8,9] 21 [7,8,9] 40 [4] 3 [1,2,8,9] 22 [8,9] 41 [1,2,5,6,7] 4 [8,9] 23 [8,9] 42 [5,6,7] 5 [1,3,4] 24 [8,9] 43 [4] 6 [1,3,4,] 25 [8,9] 44 [5] 7 [5,6,7] 26 [5,6,7,8] 45 8 [1,5,6,7] 27 [8] 46 9 [1,3,4,7,8,9,10] 28 [1,5] 47 [5,6,7] 10 [1,3,4,5,6,7] [7] 11 [4,7] 30 [5,6,7] [1,5] 31 [5,6,7] 50 [5] [5,6,7] 51 [8,9] 14 [5] 33 [1,3,4,7,8,9,10] 52 [5] 15 [7] 34 [5] 53 [7,8,9] 16 [5] 35 [7] 54 [1,5,6,7,8] 17 [1,3,4,7] 36 [5] 55 [5,7,8] [1,8,9] 56 [1,8,9] 19 [7,8,9] 38 [7] Untuk memperoleh response structure, data pada Tabel 4.2 diformulasikan berdasarkan jenis response state yang disajikan pada Tabel 13 beriku:
10 Tabel 4.3 Data response structure mahasiswa Jurusan Kimia Universitas Negeri Gorontalo semester 1 (n = 56) Jenis response state Jumlah responden response structure Jenis response state Jumlah responden response structure 3 3 [4] 2 [4] 2 [1,2,8,9] 1 [1,2,8,9] 1 [4,5,6,7,8] 1 [4,5,6,7,8] 1 [1,2,5,6,7] 1 [1,2,5,6,7] 1 [4,7] 1 [4,7] 1 [1,3,4,5,6,7] 1 [1,3,4,5,6,7] 1 [5] 7 [5] 7 [1,3,4,5,8,9] 1 [1,3,4,5,8,9] 1 [5,6,7] 6 [5,6,7] 6 [1,3,4] 2 [1,3,4] 2 [5,6,7,8] 1 [5,6,7,8] 1 [1,3,4,7,8,9,10] 2 [1,3,4,7,8,9,10] 2 [5,7,8] 1 [5,7,8] 1 [1,3,4,7] 1 [1,3,4,7] 1 [7] 4 [7] 4 [1,5,6,7,8] 1 [1,5,6,7,8] 1 [7,8,9] 3 [7,8,9] 3 [1,5,6,7] 1 [1,5,6,7] 1 [8] 1 [8] 1 [1,5] 2 [1,5] 2 [8,9] 7 [8,9] 7 [1,8,9] 2 [1,8,9] 2 Jumlah Tabel 4.4 Data perolehan response state mahasiswa Jurusan Kimia Semester II Universitas negeri Gorontalo (n = 66) Responden Respon State Responden Respon State responden Response state 1 [1,3,4,7,8] 23 [4,7,8,9] 45 [8,9] 2 [1,3,4,5,6,7,8] 24 [4,8,9] 46 [1,3,4] 3 [1,5,6,7] 25 [1,5,6,7,8,9] 47 [5,7] 4 [1,3,4,5,6,7,8] 26 [5,7,8,9] 48 [4,8,9] 5 [4,5,6,7] 27 [3,5,6] 49 [4,5,6,7,8] 6 [1,3,4,5] 28 [1,3,4,5] 50 [1,3,4,7,8] 7 [1,3,5,6,7,] 29 [4,7,8,9] 51 [1,3,4,7,8,9] 8 [5,6,7] 30 [5,6,7,8,9] 52 [4,5,6,7,8,9] 9 [1,3,5] 31 [4,5,6,7] 53 [1,3,4,7,8,9] 10 [5,6,7] 32 [3,4,5,8] 54 [2,4,5,6,7,8,9] 11 [1,3,4,5,6,7] 33 [5,6,7] [1,5,6,7] 34 [1,3,4,7] 56 [5,6,7,8] 13 [5,6,7,8] 35 [4,5,8,9] 57 [1,3,4,5,6,7,8] 14 [3,4,5,6,7,] 36 [4,5,8,9] 58 [4,5,7,8,9] 15 [5,6,7] 37 [1,4,5,8,9] 59 [8,9] 16 [1,3,4,9] 38 [1,3,4,8] 60 [4,5,6,7] 17 [3,4,8] 39 [1,3,4,5,8,9] 61 [1,2,3,4,7,8,9] 18 [1,5,6,7] 40 [1,3,4,5,6,7,8] 62 [1,3,4,5,6,7,8] 19 [1,3,4,5,6,7] 41 [2,4,5,8,] 63 [1,2,4,5,6,7,8,9,10] 20 [1,3,5,6,7,8] 42 [4,5,8,9] 64 [1,3,4,5,6,7,8,9] 21 [4,5,6,7,] 43 [4,5,6,7,8,9] 65 [1,2,3,4,7,8,9,10] 22 [1,3,4,7,8] 44 [8,9] 66 [1,3,4,5,6,7,8]
11 Untuk memperoleh response structure, data pada Tabel 4.4 diformulasikan berdasarkan jenis response state yang disajikan pada Tabel 4.5 berikut: Tabel 4.5 Data response structure mahasiswa Jurusan Kimia Universitas Negeri Gorontalo semester II (n = 66) Jenis response state Jumlah responden response structure Jenis response state Jumlah responden response structure [1,2,3,4,7,8,9,10] 1 [1,2,3,4,7,8,9,10] 1 [2,4,5,6,7,8,9] 1 [2,4,5,6,7,8,9] 1 [1,2,3,4,7,8,9] 1 [1,2,3,4,7,8,9] 1 [2,4,5,8] 1 [2,4,5,8] 1 [1,2,4,5,6,7,8,9,10] 1 [1,2,4,5,6,7,8,9,10] 1 [3,4,5,6,7] 1 [3,4,5,6,7] 1 [1,3,4,5,6,7,8,9] 1 [1,3,4,5,6,7,8,9] 1 [3,4,5,8] 1 [3,4,5,8] 1 [1,3,4,5,6,7,8,9] 6 [1,3,4,5,6,7,8,9] 6 [3,4,8] 1 [3,4,8] 1 [1,3,4,5,6,7] 2 [1,3,4,5,6,7] 2 [3,5,6] 1 [3,5,6] 1 [1,3,4,5] 2 [1,3,4,5] 2 [4,5,6,7,8,9] 2 [4,5,6,7,8,9] 2 [1,3,4] 1 [1,3,4] 1 [4,5,6,7,8] 1 [4,5,6,7,8] 1 [1,3,4,7,8,9] 2 [1,3,4,7,8,9] 2 [4,5,6,7] 4 [4,5,6,7] 4 [1,3,4,7,8] 2 [1,3,4,7,8] 2 [4,5,7,8,9] 1 [4,5,7,8,9] 1 [1,3,4,7] 1 [1,3,4,7] 1 [4,5,8,9] 4 [4,5,8,9] 4 [1,3,4,8] 1 [1,3,4,8] 1 [4,7,8,9] 2 [4,7,8,9] 2 [1,3,4,9] 1 [1,3,4,9] 1 [4,8,9] 2 [4,8,9] 2 [1,3,4,5,8,9] 1 [1,3,4,5,8,9] 1 [5,6,7,8,9] 1 [5,6,7,8,9] 1 [1,3,5] 1 [1,3,5] 1 [5,6,7,8] 2 [5,6,7,8] 2 [1,3,5,6,7,8] 1 [1,3,5,6,7,8] 1 [5,6,7] 4 [5,6,7] 4 [1,4,5,8,9] 1 [1,4,5,8,9] 1 [5,7,8,9] 1 [5,7,8,9] 1 [1,4,5,8,9] 1 [1,4,5,8,9] 1 [5,7] 1 [5,7] 1 [1,5,6,7,8,9] 1 [1,5,6,7,8,9] 1 [8,9] 3 [8,9] 3 [1,5,6,7] 3 [1,5,6,7] 3 Jumlah
12 Tabel 4.6 Data perolehan response state mahasiswa Jurusan Kimia Semester V Universitas Negeri Gorontalo (n = 46) Responden Respon State Responden Respon State 1 [1,2,3,4,5,6,7,8,9] 24 [1,2,3,4,5,6,7,8] 2 [1,3,4,5,7,8,9] 25 [1,3,4,5,7,8,9,10] 3 [1,3,4,5,6,7,8,9] 26 [1,3,4,5,6,7,8,9,10] 4 [1,3,4,5,6,7,8,] 27 [3,4,5,6,7,8] 5 [1,3,4,7,8,9] 28 [1,3,5,7] 6 [1,3,4,5,6,7,8] 29 [1,3,4,5,6,7,8] 7 [3,5,6,7,8,9] 30 [1,3,4,5,6,7,8] 8 [1,2,3,4,7,8,9] 31 [1,3,4,7,8,9] 9 [1,5,6,7,8] 32 [1,2,3,4,5,7,8,9] 10 [1,3,4,5,7] 33 [1,3,4,5,7] 11 [1,3,4,5,7] 34 [1,2,3,5,6,7,8,9] 12 [1,3,4,5,6,7] 35 [1,2,3,4,5,7,8] 13 [1,3,4,5,6,7,8] 36 [1,3,4,5,7,8,9] 14 [1,3,4,5,7,8,9] 37 [1,5,6,7,8,] 15 [3,5,6,7,8,9] 38 [1,3,4,5,6,7,8,9] 16 [1,3,4,7,8,9] 39 [1,3,4,5,6,7,8,9] 17 [1,4,5,7,8,9] 40 [1,3,4,5,6,7,8] 18 [1,3,4,5,6,7,8,9] 41 [1,3,4,5,7,8] 19 [3,4,5,7,8,9] 42 [1,3,4,5,7] 20 [1,7,8,9] 43 [1,3,4,5,7,8] 21 [1,3,5,6,7] 44 [1,3,4,5,6,7,8,9] 22 [1,3,4,5,7,8] 45 [5,7,8] 23 [1,4,5,6,7,8] 46 [1,3,4,5,7] Untuk memperoleh response structure, data pada Tabel 4.6 diformulasikan berdasarkan jenis response state yang disajikan pada Tabel 4.7 berikut:
13 Tabel 4.7 Data response structure mahasiswa Jurusan Kimia Universitas Negeri Gorontalo semester V (n = 46) Jenis response state Jumlah responden response structure [1,2,3,4,5,6,7,8,9] 1 [1,2,3,4,5,6,7,8,9] 1 [1,2,3,4,5,6,7,8] 1 [1,2,3,4,5,6,7,8] 1 [1,2,3,4,5,7,8,9] 1 [1,2,3,4,5,7,8,9] 1 [1,2,3,4,5,7,8] 1 [1,2,3,4,5,7,8] 1 [1,2,3,4,7,8,9] 1 [1,2,3,4,7,8,9] 1 [1,2,3,5,6,7,8,9] 1 [1,2,3,5,6,7,8,9] 1 [1,3,4,5,6,7,8,9,10] 1 [1,3,4,5,6,7,8,9,10] 1 [1,3,4,5,6,7,8,9] 5 [1,3,4,5,6,7,8,9] 5 [1,3,4,5,6,7,8] 6 [1,3,4,5,6,7,8] 6 [1,3,4,5,6,7] 1 [1,3,4,5,6,7] 1 [1,3,4,5,7,8,9,10] 1 [1,3,4,5,7,8,9,10] 1 [1,3,4,5,7,8,9] 3 [1,3,4,5,7,8,9] 3 [1,3,4,5,7,8] 3 [1,3,4,5,7,8] 3 [1,3,4,5,7] 5 [1,3,4,5,7] 5 [1,3,4,7,8,9] 3 [1,3,4,7,8,9] 3 [1,3,5,6,7] 1 [1,3,5,6,7] 1 [1,3,5,7] 1 [1,3,5,7] 1 [1,4,5,6,7,8,9] 1 [1,4,5,6,7,8,9] 1 [1,4,5,6,7,8] 1 [1,4,5,6,7,8] 1 [1,5,6,7,8] 2 [1,5,6,7,8] 2 [1,7,8,9] 1 [1,7,8,9] 1 [3,4,5,6,7,8] 1 [3,4,5,6,7,8] 1 [3,4,5,7,8,9] 1 [3,4,5,7,8,9] 1 [3,5,6,7,8,9 2 [3,5,6,7,8,9] 2 [5,7,8] 1 [5,7,8] 1 Jumlah 46 Semua hasil response strukturdari semseter I, III dan V dikonversikan ke komponen-komponen a) Volume molar, b) Massa molar, c) Persamaan reaksi, d) Rumus Empiris dan e) kompleks.
14 Tabel 4.8 Data Konversi ke komponen VM, MM, PR, RE dan KOM SEMESTER 1 (n = 56) SEMESTER III(n = 66) SEMESTER V(n = 46) Response Structure Konversi ke komp struktur pengetahuan Response structure Konversi ke kom struktur pengetahuan Response structure Konversi ke kom struktur pengetahuan 3 [1,2,8,9] 1 [1,2,5,6,7] 1 [1,3,4,5,6,7] 1 [1,3,4,5,8,9] 1 [1,3,4] 2 [[1,3,4,7,8,9,10] 2 [1,3,4,7] 1 [1,5,6,7,8] 1 [1,5,6,7] 1 [1,5] 2 [1,8,9] 2 4 [4] 2 [4,5,6,7,8] 1 [4,7] 1 [5] 7 [5,6,7] 6 [5,6,7,8] 1 [5,7,8] 1 [7] 4 [7,8,9] 3 [8] 1 [8,9] 7 [2,4] [3,4] [1,3] [1,2] [1,2,5] [2] [2] [2] [1,2,3,4,7,8,9,10] 1 [1,2,3,4,7,8,9] 1 [1,2,4,5,6,7,8,9,10] 1 [1,3,4,5,6,7,8,9] 1 [1,3,4,5,6,7,8,9] 6 [1,3,4,5,6,7] 2 [1,3,4,5] 2 [1,3,4] 1 1,3,4,7,8,9] 2 [1,3,4,7,8] 2 [1,3,4,7] 1 [1,3,4,8] 1 [1,3,4,9] 1 [1,3,4,5,8,9] 1 [1,3,5] 1 [1,3,5,6,7,8] 1 [1,4,5,8,9] 1 [1,4,5,8,9] 1 [1,5,6,7,8,9] 1 [1,5,6,7] 3 1 [2,4,5,6,7,8,9] 1 [2,4,5,8] 1 [3,4,5,6,7] 1 [3,4,5,8] 1 [3,4,8] 1 [3,5,6] 1 [4,5,6,7,8,9] 2 [4,5,6,7,8] 1 [4,5,6,7] 4 [4,5,7,8,9] 1 [4,5,8,9] 4 [4,7,8,9] 2 [4,8,9] 2 [5,6,7,8,9] 1 [5,6,7,8] 2 [5,6,7] 4 [5,7,8,9] 1 [5,7] 1 [8,9] 3 [1,2,4,5] [1,2,4] [2,3,4,5] [1,2,3] [1,2,3] [1,3] [1,2] [1,2] [1,3] [2] [2] [2,3] [2,3,4] [4] [2,3] [2] [2] [2] [2] [2,3] [2] [1,2,3,4,5,6,7,8,9] 1 [1,2,3,4,5,6,7,8] 1 [1,2,3,4,5,7,8,9] 1 [1,2,3,4,5,7,8] 1 [1,2,3,4,7,8,9] 1 [1,2,3,5,6,7,8,9] 1 [1,3,4,5,6,7,8,9,10] 1 [1,3,4,5,6,7,8,9] 5 [1,3,4,5,6,7,8] 6 [1,3,4,5,6,7] 1 [1,3,4,5,7,8,9,10] 1 [1,3,4,5,7,8,9] 3 [1,3,4,5,7,8] 3 [1,3,4,5,7] 5 [1,3,4,7,8,9] 3 [1,3,5,6,7] 1 [1,3,5,7] 1 [1,4,5,6,7,8,9] 1 [1,4,5,6,7,8] 1 [1,5,6,7,8] 2 [1,7,8,9] 1 [3,4,5,6,7,8] 1 [3,4,5,7,8,9] 1 [3,5,6,7,8,9] 2 [5,7,8] 1 [1,2,3,4] [1,3,4] [1,2,4] [1,4] [1,2] [1,2,3,4] [1,2,3,5] [1,2,3] [1,3] [1,3] [1,2,5] [1,2] [1,2] [2,3] [2] [2,3] Hasil dari konversi pada Tabel 4.8 diurutkan berdasarkan tingkat konsep dari VM, MM, PR, RE dan KOM pada Tabel 4.9 berikut:
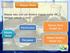
15 Tabel 4.9: Urutan konversi Respon Struktur Mahasiswa (n=168) [1,2] 11 [1,2,3] 12 [1,2,3,4] 2 [1,2,3,5] 1 [1,2,4] 2 [1,2,4,5] 1 [1,2,5] 3 [1,3] 11 Respon Struktur Mahasiswa (n=168) [1,3,4] 1 [1,4] 1 [2] 28 [2,3] 7 [2,3,4] 1 [2,3,4,5] 1 31 [3,4] 1 [4] 1 Hasil dari Tabel 4.9 disusun menjadi knowledge srtucture sehingga diperoleh peta struktur pengetahuan mahasiswa jurusan kimia Universitas negeri Gorontalo adalah sebagai berikut:
16 KOM [1,2,5] [1,2,4,5].. 1 [1,2,3,5] 1 [5] 1 RE [4] 1 [1,3,4] 1 [1,4] 1 [1,2,4] 2 [1,2,3,4] 2 [2,3,4] 1 [3,4] 1 4 PR [1,3] [1,2,3] 12...[3,4]. 1 3 MM [2] [1,2] VM TPK Gambar 4.1: Peta Struktur Mahasiswa Kimia TA 2013/2014 dalam Menyelesaikan Soal-Soal Stoikiometri Berdasarkan Gambar 4.1, cara mahasiswa menyelesaian soal stoikiometri dibedakan atas: 1. TPK = Tidak paham konsep sebanyak 32 orang. 2. TPL = Tidak memahami keterkaitan (Linkage) antar konsep masing -masing yaitu VM sebanyak 21 orang, MM sebanyak 28 orang, PR sebanyak 31 orang dan RE sebanyak satu orang. 3. Mampu menggunakan konsep VM (volume molar) dan PR (persamaan reaksi) untuk menyelesaikan soal rumus empiris (RE) hanya 1 orang. 4. Mampu menggunakan konsep VM untuk menyelesaikan soal rumus empiris (RE) hanya 1 orang.
17 5. Mampu menggunkan konsep VM dan MM utnuk menyelesaikan soal rumus empiris (RE) sebnyak 2 orang. 6. Mampu menggunakan VM, MM, PR utnuk menyelesaikn soal rumus empiris (RE) sebanyak 2 orang. 7. Mampu menggunakan MM, PR, untuk menyelesaikan soal rumus empiris (RE) hanya 1 orang. 8. Mampu menggunakan konsep PR untuk menyelesaikan soal RE hanyak 1 orang. 9. Mampu menggunakan konsep VM, MM, RE untuk menyelesaikan soal yang KOM (kompeks) hanya 1 orang. 10. Mampu menggunakan konsep VM, MM dan RE utnuk menyelesaikan soal yang KOM hanya 1 orang. 11. Mampu menggunakan konsep VM, MM untuk menyelesaikan soal yang KOM sebnyak 3 orang. 12. Mampu menggunakan konsep MM, PR dan RE untuk menyelesaikan soal yang KOM hanya 1 orang. 4.2 Pembahasan Cara Mahasiswa Menyelesaikan Soal-Soal Stokiometri Perolehan persentase pengusaan konsep yang benar cenderumg dapat mencerminkan cara menyelesaikan soal-soal stoikimetri yang memenuhi kriteria cara pemecahan masalah yang dikemukakan oleh Toth dan Sebestyen (2009) bahwa struktur kognitif berperan penting untuk pemecahan masalah dalam kimia. Struktur kognitif dimaksud berkenaan dengan tiga variable yang diprediksi sebagai kunci utama dalam pemechana masalah yang meliputi: (1) Pengetahuan awal yakni pengetahuan spesifik dan spesifik. Artinya, pengetahuan yang langsung berhubungan dengan masalah, sedangkan pengetahuan yang tidak spesifik tapi sesuai dengan pengetahuan yang terkait dengan wilayah subjek masalah. (2) Linkage,meliputi dua variable yakni keterkaitan antar konsep dan keterkaitan antar ide. (3) Keterkaitan mengenali masalah: keterampilan menerjemahkan masalah dan pengalamn memecahkan pengalaman sebelumnya.
18 Berdasarkan deskripsi hasil penelitian diatas bahwa sebagian besar mahasiswa menjawab soal-soal stokiometri belum memiliki struktur pnegetahuan yang baik atau parsial. Hal disebabkan banyak faktor salah satunya kurang pemahaman konsep mahasiswa terhadap materi stokiometri. Materi stokiometri pada penelitian ini terdiri dari 5 komponen turunan stoikiometri yaitu volume molar, massa molar, persamaan reaksi, proposional dan kompleks. Setiap komponen terdiri dari satu, dua dan tiga soal yang berbentuk essay. Untuk pembahasan lebih rinci mengenai cara mahasiswa menyelesaikan soal-soal stokiometri adalah sebagai berikut: 1. Cara mahasiswa menyelesaikan soal-soal stokiometri pada volume molar Volume molar terdiri dari tiga soal yaitu pengertian mol, perbedaan konsep mol pada gas dan larutan, dan menghitung mol. Cara mahasiswa menyelesaikan soal-soal volume molar cenderung memiliki struktur pengetahuan yang tidak lengkap atau parsial pada soal pengertian mol dan perbedaan konsep mol pada larutan dan gas. Sedangkan untuk menyelesaikan soal wacana menghitung harga mol mahasiswa cenderung memiliki struktur pengetahuan yang lengkap atau baik. 2. Cara mahasiswa menyelesaikan soal-soal stokiometri pada massa molar Massa molar terdiri dari dua soal yaitu penetuan harga mol dengan mengunakan persamaan PV= nrt, dan menghitung massa garam yang terbentuk dengan persamaan n= M V. Cara mahasiswa menyelesaikan soal-soal volume molar cenderung memiliki struktur pengetahuan yang lengkap atau terstruktur baik. 3. Cara mahasiswa menyelesaikan soal-soal stokiometri pada persamaan reaksi Persamaan reaksi terdiri dari 3 soal yaitu pengertian persamaan reaksi, penyetaraan reaksi larutan magnesium dengan perak nitrat menghasilkan perak klorida dan magnesium klorida. Cara mahasiswa menyelesaikan soal-soal volume molar cenderung memiliki struktur pengetahuan yang lengkap atau terstruktur baik. 4. Cara mahasiswa menyelesaikan soal-soal stokiometri pada RE terdiri dari satu soal yaitu penetuan rumus empiris dari soal wacana. Cara mahasiswa
19 menyelesaikan soal-soal persamaan reaksi cenderung memiliki struktur pengetahuan yang tidak lengkap atau parsial. 5. Cara mahasiswa menyelesaikan soal-soal stokiometri pada kompleks Kompleks terdiri dari satu soal yaitu penetuan massa dari soal wacana. Cara mahasiswa menyelesaikan soal-soal kompleks cenderung memiliki struktur pengetahuan yang tidak lengkap atau parsial Struktur Pengetahuan Mahasiswa Tentang CaraMenyelesaikan Soal- Soal Stoikiometri Disamping itu diketahui bahwa jalur pengetahuan mahasiswa dalam menyelesaikan stoikiometri cenderung tidak beraturan karena sulit ditemukan yang struktur pengetahuan yang relatif sama. Variasi struktur pengetahuan ditinjau dari urutan penggunaan komponen pengetahuan menyelesaikan soal-soal stoikiometri maka struktur pengetahuan dapat digambarkan sebagai berikut: Level Kemampuan RE KOM Menyelesaikan M O l PR Menggunakan VM Gambar 4.2: Level kemampuan Keterangan: VM = Volume Molar MM = Massa Molar PR = Persamaan Reaksi RE = Rumus Empiris KOM = Kompleks MM Mengingat
20 Berdasarkan Gambar 4.2 karakteristik struktur pengetahuan dibedakan atas tipe: VM MM PR RE KOM Tipe 1: VM MM PR RE KOM Tipe 2: VM MM PR... KOM Tipe 3: VM... PR RE KOM Tipe 4: VM... PR... KOM Tipe 5: VM MM... KOM Didasarkan pada tipe di atas, maka hasil pemetaan karakteristik pengetahuan mahasiswa berdasarkan jalur (gambar 4.1) yaitu sebagai berikut: (1) Tipe 1 (n = 0 dari 168 orang) RE KOM M O l PR VM MM Gambar 4.3: Model terbaik struktur pngetahuan mahasiswa Gambar 4.3 menunjukkan bahwa model terbaik untuk struktur pengetahuan tentang cara menyelesaikan soal-soal stoikiometri dibangun dari VM, MM, PR, RE dan kompleks. Tetapi pada model ini, tidak ada seorangpun yang termasuk dari 168 mahasiswa. (2) Tipe 2 (n = 1 dari 168 orang) RE KOM M O l PR VM MM Gambar 4.4: Model kemungkinan kedua struktur pengetahuan mahasiswa
21 Gambar 4.4 di atas menunjukan bahwa pada model ini struktur pengetahuan mahasiswa untuk menyelesaikan soal yang kompleks dibangun dari VM, MM dan PR. Tetapi pada model ini hanya 1 orang yang termasuk dari 168 mahasiswa (3) Tipe 3 (n = 0 dari 168 orang) RE KOM M O l PR VM MM Gambar 4.5: Model kemungkinan ketiga struktur pengetahuan mahasiswa Gambar 4.5 di atas menunjukan bahwa pada model ini struktur pengetahuan mahasiswa dalam menyelesaiakna soal-soal kompleks dibangun dari VM, PR dan RE. Tetapi pada model ini tidak ada seorangpun yang mampu menyelesaikan dari 168 mahasiswa. (4) Tipe 4 (n = 0 dari 168 orang) RE KOM M O l PR VM MM
22 Gambar 4.6: Model kemungkinan keempat struktur pengetahuan mahasiswa Gambar 4.6 di atas menunjukan bahwa struktur pengetahuan mahasiswa dalam menyelesaikan soal yang kompleks dibangun dari konsep VM dan RE. Tetapi pada model ini, tidak ada yang mampu menyelesaikan dari 168 mahasiswa. (5) Tipe 5 (n = 0 dari 168 orang) RE KOM M O l PR VM MM Gambar 4.7 Model kemungkinan kelima struktur pengetahuan mahasiswa Gambar 4.7 di atas menunjukan bahwa struktur pengetahuan mahasiswa dalam menyelesaikan soal kompleks dibangun dari konsep VM dan MM. Tetapi pada model ini, tidak ada yang mampu menyelesaikan dari 168 mahasiswa.
Hukum Dasar Kimia Dan Konsep Mol
 A. PENDAHULUAN Hukum Dasar Kimia Dan Konsep Mol Hukum dasar kimia merupakan hukum dasar yang digunakan dalam stoikiometri (perhitungan kimia), antara lain: 1) Hukum Lavoisier atau hukum kekekalan massa.
A. PENDAHULUAN Hukum Dasar Kimia Dan Konsep Mol Hukum dasar kimia merupakan hukum dasar yang digunakan dalam stoikiometri (perhitungan kimia), antara lain: 1) Hukum Lavoisier atau hukum kekekalan massa.
KONSEP MOL DAN STOIKIOMETRI
 BAB V KONSEP MOL DAN STOIKIOMETRI Dalam ilmu fisika, dikenal satuan mol untuk besaran jumlah zat. Dalam bab ini, akan dibahas mengenai konsep mol yang mendasari perhitungan kimia (stoikiometri). A. KONSEP
BAB V KONSEP MOL DAN STOIKIOMETRI Dalam ilmu fisika, dikenal satuan mol untuk besaran jumlah zat. Dalam bab ini, akan dibahas mengenai konsep mol yang mendasari perhitungan kimia (stoikiometri). A. KONSEP
MODUL STOIKIOMETRI 1
 MODUL STOIKIOMETRI 1 1. Pengertian Mol Mol merupakan suatu satuan jumlah, yang berasal dari kata moles yang artinya sejumlah massa / sejumlah kecil massa, hampir sama dengan lusin. 1 mol = 6,02 X 10 23
MODUL STOIKIOMETRI 1 1. Pengertian Mol Mol merupakan suatu satuan jumlah, yang berasal dari kata moles yang artinya sejumlah massa / sejumlah kecil massa, hampir sama dengan lusin. 1 mol = 6,02 X 10 23
Hubungan koefisien dalam persamaan reaksi dengan hitungan
 STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
KIMIA TERAPAN STOIKIOMETRI DAN HUKUM-HUKUM KIMIA Haris Puspito Buwono
 KIMIA TERAPAN STOIKIOMETRI DAN HUKUM-HUKUM KIMIA Haris Puspito Buwono Semester Gasal 2012/2013 STOIKIOMETRI 2 STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi
KIMIA TERAPAN STOIKIOMETRI DAN HUKUM-HUKUM KIMIA Haris Puspito Buwono Semester Gasal 2012/2013 STOIKIOMETRI 2 STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi
STOKIOMETRI BAB. B. Konsep Mol 1. Hubungan Mol dengan Jumlah Partikel. Contoh: Jika Ar Ca = 40, Ar O = 16, Ar H = 1, tentukan Mr Ca(OH) 2!
 BAB 7 STOKIOMETRI A. Massa Molekul Relatif Massa Molekul Relatif (Mr) biasanya dihitung menggunakan data Ar masing-masing atom yang ada dalam molekul tersebut. Mr senyawa = (indeks atom x Ar atom) Contoh:
BAB 7 STOKIOMETRI A. Massa Molekul Relatif Massa Molekul Relatif (Mr) biasanya dihitung menggunakan data Ar masing-masing atom yang ada dalam molekul tersebut. Mr senyawa = (indeks atom x Ar atom) Contoh:
BAB V PERHITUNGAN KIMIA
 BAB V PERHITUNGAN KIMIA KOMPETENSI DASAR 2.3 : Menerapkan hukum Gay Lussac dan hukum Avogadro serta konsep mol dalam menyelesaikan perhitungan kimia (stoikiometri ) Indikator : 1. Siswa dapat menghitung
BAB V PERHITUNGAN KIMIA KOMPETENSI DASAR 2.3 : Menerapkan hukum Gay Lussac dan hukum Avogadro serta konsep mol dalam menyelesaikan perhitungan kimia (stoikiometri ) Indikator : 1. Siswa dapat menghitung
LOGO. Stoikiometri. Tim Dosen Pengampu MK. Kimia Dasar
 LOGO Stoikiometri Tim Dosen Pengampu MK. Kimia Dasar Konsep Mol Satuan jumlah zat dalam ilmu kimia disebut mol. 1 mol zat mengandung jumlah partikel yang sama dengan jumlah partikel dalam 12 gram C 12,
LOGO Stoikiometri Tim Dosen Pengampu MK. Kimia Dasar Konsep Mol Satuan jumlah zat dalam ilmu kimia disebut mol. 1 mol zat mengandung jumlah partikel yang sama dengan jumlah partikel dalam 12 gram C 12,
Tugas Kimia STOIKIOMETRI
 Tugas Kimia STOIKIOMETRI NAMA ANGGOTA : 1. Nyoman Dharma Triyasa (10) 2. Komang Jnana Shindu Putra (17) 3. I.G.A Dharsasasmitha Yani (19) 4. Ni Putu Riska Valentini (25) 5. Putu Ayu Rosita Octaviani (26)
Tugas Kimia STOIKIOMETRI NAMA ANGGOTA : 1. Nyoman Dharma Triyasa (10) 2. Komang Jnana Shindu Putra (17) 3. I.G.A Dharsasasmitha Yani (19) 4. Ni Putu Riska Valentini (25) 5. Putu Ayu Rosita Octaviani (26)
FAKULTAS TEKNIK UNIVERSITAS NEGERI YOGYAKARTA BAHAN AJAR KIMIA DASAR BAB IV STOIKIOMETRI
 No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 6 BAB IV STOIKIOMETRI A. HUKUM GAY LUSSAC Bila diukur pada suhu dan tekanan yang sama, volum gas yang bereaksi dan volum gas hasil reaksi berbanding
No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 6 BAB IV STOIKIOMETRI A. HUKUM GAY LUSSAC Bila diukur pada suhu dan tekanan yang sama, volum gas yang bereaksi dan volum gas hasil reaksi berbanding
STOIKIOMETRI. Oleh. Sitti Rahmawati S.Pd.
 STOIKIOMETRI Oleh Sitti Rahmawati S.Pd Copyright oke.or.id Artikel ini boleh dicopy,diubah, dikutip, di cetak dalam media kertas atau yang lain, dipublikasikan kembali dalam berbagai bentuk dengan tetap
STOIKIOMETRI Oleh Sitti Rahmawati S.Pd Copyright oke.or.id Artikel ini boleh dicopy,diubah, dikutip, di cetak dalam media kertas atau yang lain, dipublikasikan kembali dalam berbagai bentuk dengan tetap
HUKUM DASAR KIMIA. 2CUO. 28GRAM NITROGEN 52 GRAM MAGNESIUM NITRIDA 3 MG + N 2 MG 3 N 2
 HUKUM DASAR KIMIA. 2CUO. 28GRAM NITROGEN 52 GRAM MAGNESIUM NITRIDA 3 MG + N 2 MG 3 N 2 HUKUM DASAR KIMIA 1) Hukum Kekekalan Massa ( Hukum Lavoisier ). Yaitu : Dalam sistem tertutup, massa zat sebelum
HUKUM DASAR KIMIA. 2CUO. 28GRAM NITROGEN 52 GRAM MAGNESIUM NITRIDA 3 MG + N 2 MG 3 N 2 HUKUM DASAR KIMIA 1) Hukum Kekekalan Massa ( Hukum Lavoisier ). Yaitu : Dalam sistem tertutup, massa zat sebelum
STOIKIOMETRI. STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi zat-zat kimia dan reaksi-reaksinya.
 STOIKIOMETRI STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi zat-zat kimia dan reaksi-reaksinya. 1.HUKUM KEKEKALAN MASSA = HUKUM LAVOISIER "Massa zat-zat sebelum
STOIKIOMETRI STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi zat-zat kimia dan reaksi-reaksinya. 1.HUKUM KEKEKALAN MASSA = HUKUM LAVOISIER "Massa zat-zat sebelum
STOIKIOMETRI Konsep mol
 STOIKIOMETRI Konsep mol Dalam hukum-hukum dasar materi ditegaskan bahwa senyawa terbentuk dari unsur bukan dengan perbandingan sembarang tetapi dalam jumlah yang spesifik, demikian juga reaksi kimia antara
STOIKIOMETRI Konsep mol Dalam hukum-hukum dasar materi ditegaskan bahwa senyawa terbentuk dari unsur bukan dengan perbandingan sembarang tetapi dalam jumlah yang spesifik, demikian juga reaksi kimia antara
Konsep Mol. 1. Jumlah Partikel Dalam 1 Mol Zat
 Konsep Mol Setiap zat yang ada di alam tersusun atas partikel-partikel bentuk atom, molekul, dan ion. Ukuran dan massa partikel-partikel zat tersebut sangat kecil sehingga kita kesulitan untuk mengukurnya.
Konsep Mol Setiap zat yang ada di alam tersusun atas partikel-partikel bentuk atom, molekul, dan ion. Ukuran dan massa partikel-partikel zat tersebut sangat kecil sehingga kita kesulitan untuk mengukurnya.
STOKIOMETRI. Kimia Kelas X
 STOKIOMETRI Kimia Kelas X SEKOLAH MENENGAH ATAS NEGERI 12 SURABAYA 2015 STOKIOMETRI STOKIOMETRI Pada materi stokiometri, kita akan mempelajari beberapa hal seperti persamaan reaksi, hukum-hukum dasar kimia,
STOKIOMETRI Kimia Kelas X SEKOLAH MENENGAH ATAS NEGERI 12 SURABAYA 2015 STOKIOMETRI STOKIOMETRI Pada materi stokiometri, kita akan mempelajari beberapa hal seperti persamaan reaksi, hukum-hukum dasar kimia,
Materi Pokok Bahasan :
 STOIKIOMETRI Kompetensi : Memiliki kemampuan untuk menginterpretasikan serta menerapkan dalam perhitungan kimia. Memiliki kemampuan untuk mengaplikasikan pengetahuan yang dimilikinya dan terbiasa menggunakan
STOIKIOMETRI Kompetensi : Memiliki kemampuan untuk menginterpretasikan serta menerapkan dalam perhitungan kimia. Memiliki kemampuan untuk mengaplikasikan pengetahuan yang dimilikinya dan terbiasa menggunakan
LOGO STOIKIOMETRI. Marselinus Laga Nur
 LOGO STOIKIOMETRI Marselinus Laga Nur Materi Pokok Bahasan : A. Konsep Mol B. Penentuan Rumus Kimia C. Koefisien Reaksi D. Hukum-hukum Gas A. Konsep Mol Pengertian konsep mol Hubungan mol dengan jumlah
LOGO STOIKIOMETRI Marselinus Laga Nur Materi Pokok Bahasan : A. Konsep Mol B. Penentuan Rumus Kimia C. Koefisien Reaksi D. Hukum-hukum Gas A. Konsep Mol Pengertian konsep mol Hubungan mol dengan jumlah
Stoikiometri. OLEH Lie Miah
 Stoikiometri OLEH Lie Miah 1 STANDAR KOMPETENSI KOMPETENSI DASAR INDIKATOR KARAKTERISTIK MATERI KESULITAN BELAJAR SISWA STANDAR KOMPETENSI Memahami hukum-hukum dasar Kimia dan penerapannya dalam perhitungan
Stoikiometri OLEH Lie Miah 1 STANDAR KOMPETENSI KOMPETENSI DASAR INDIKATOR KARAKTERISTIK MATERI KESULITAN BELAJAR SISWA STANDAR KOMPETENSI Memahami hukum-hukum dasar Kimia dan penerapannya dalam perhitungan
HUKUM DASAR KIMIA DAN STOIKIOMETRI
 HUKUM DASAR KIMIA DAN STOIKIOMETRI Bagaimana cara untuk mengukur jumlah suatu senyawa yang terkandung dalam suatu material? Ini merupakan pertanyaan dasar yang telah dijawab oleh para kimiawan terdahulu.
HUKUM DASAR KIMIA DAN STOIKIOMETRI Bagaimana cara untuk mengukur jumlah suatu senyawa yang terkandung dalam suatu material? Ini merupakan pertanyaan dasar yang telah dijawab oleh para kimiawan terdahulu.
Emas yang terbentuk sebanyak 20 gram, jika ArAu = 198, maka tentukan Ar M!
 1. Suatu senyawa mengandung kadar unsur (% berat) sebagai berikut : S = 35,97%; O = 62,9%; dan H = 1,13%. Rumus molekul senyawa tersebut adalah. 2. Gas hidrogen dapat dibuat dari reaksi antara logam magnesium
1. Suatu senyawa mengandung kadar unsur (% berat) sebagai berikut : S = 35,97%; O = 62,9%; dan H = 1,13%. Rumus molekul senyawa tersebut adalah. 2. Gas hidrogen dapat dibuat dari reaksi antara logam magnesium
SKL 2 RINGKASAN MATERI. 1. Konsep mol dan Bagan Stoikiometri ( kelas X )
 SKL 2 Menerapkan hukum-hukum dasar kimia untuk memecahkan masalah dalam perhitungan kimia. o Menganalisis persamaan reaksi kimia o Menyelesaikan perhitungan kimia yang berkaitan dengan hukum dasar kimia
SKL 2 Menerapkan hukum-hukum dasar kimia untuk memecahkan masalah dalam perhitungan kimia. o Menganalisis persamaan reaksi kimia o Menyelesaikan perhitungan kimia yang berkaitan dengan hukum dasar kimia
Stoikiometri. Bab 3. Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Secara Mikro atom & molekul.
 Bab 3 Stoikiometri Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional: 1 atom 12 C beratnya 12 sma Jika ditimbang
Bab 3 Stoikiometri Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional: 1 atom 12 C beratnya 12 sma Jika ditimbang
KONSEP MOL DAN STOIKIOMETRI
 KONSEP MOL DAN STOIKIOMETRI HUKUM-HUKUM DASAR KIMIA 1. Asas Lavoiser atau kekekalan massa jumlah sebelum dan setelah reaksi kimia adalah tetap 2. Hukum Gas Ideal P V = nrt Dengan P adalah tekanan (atm),
KONSEP MOL DAN STOIKIOMETRI HUKUM-HUKUM DASAR KIMIA 1. Asas Lavoiser atau kekekalan massa jumlah sebelum dan setelah reaksi kimia adalah tetap 2. Hukum Gas Ideal P V = nrt Dengan P adalah tekanan (atm),
kimia Kelas X KONSEP MOL I K-13 A. Persamaan Reaksi
 K-13 Kelas X kimia KNSEP ML I Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami persamaan reaksi kimia dan komponen-komponennya. 2. Memahami cara
K-13 Kelas X kimia KNSEP ML I Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami persamaan reaksi kimia dan komponen-komponennya. 2. Memahami cara
STOIKIOMETRI STOIKIOMETRI
 BAB V STOIKIOMETRI Standar Kompetensi Memahami hukum-hukum dasar kimia dan penerapannya dalam perhitungan kimia (stoikiometri) Kompetensi Dasar Mendeskripsikan tata nama senyawa anorganik dan organik sederhana
BAB V STOIKIOMETRI Standar Kompetensi Memahami hukum-hukum dasar kimia dan penerapannya dalam perhitungan kimia (stoikiometri) Kompetensi Dasar Mendeskripsikan tata nama senyawa anorganik dan organik sederhana
STOIKIOMETRI _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA
 STOIKIOMETRI _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA 1. Hukum-Hukum Dasar 2. Persamaan Gas Ideal 3. Persamaan Kimia 4. Yield STOIKIOMETRI
STOIKIOMETRI _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA 1. Hukum-Hukum Dasar 2. Persamaan Gas Ideal 3. Persamaan Kimia 4. Yield STOIKIOMETRI
Tabel Hasil Analisis Kebenaran Konsep pada Objek Penelitian
 202 Lampiran B Label Pengertian stoikiometri Pengertian massa atom Perhitungan massa atom Tabel Hasil Analisis pada Objek Penelitian Penjelasan pada Stoikiometri berasal dari bahasa Yunani (stoicheion,
202 Lampiran B Label Pengertian stoikiometri Pengertian massa atom Perhitungan massa atom Tabel Hasil Analisis pada Objek Penelitian Penjelasan pada Stoikiometri berasal dari bahasa Yunani (stoicheion,
MATA PELAJARAN/PAKET KEAHLIAN ILMU KIMIA
 SUMBER BELAJAR PENUNJANG PLPG 2016 MATA PELAJARAN/PAKET KEAHLIAN ILMU KIMIA BAB II HUKUM-HUKUM DASAR KIMIA, STOIKIOMETRI Prof. Dr. Sudarmin, M.Si Dra. Woro Sumarni, M.Si Cepi Kurniawan, M.Si, Ph.D KEMENTERIAN
SUMBER BELAJAR PENUNJANG PLPG 2016 MATA PELAJARAN/PAKET KEAHLIAN ILMU KIMIA BAB II HUKUM-HUKUM DASAR KIMIA, STOIKIOMETRI Prof. Dr. Sudarmin, M.Si Dra. Woro Sumarni, M.Si Cepi Kurniawan, M.Si, Ph.D KEMENTERIAN
Massa atom merupakan massa dari atom dalam satuan massa atom (sma).
 Bab 3 Stoikiometri Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional: 1 atom 12 C beratnya 12 sma Jika ditimbang
Bab 3 Stoikiometri Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional: 1 atom 12 C beratnya 12 sma Jika ditimbang
Sumber: Silberberg, Chemistry: The Molecular Nature of Matter and Change
 Bab V Perhitungan Kimia Sumber: Silberberg, Chemistry: The Molecular Nature of Matter and Change Jumlah permen dalam stoples dapat diketahui jika berat dari satu permen dan seluruh permen diketahui. Cara
Bab V Perhitungan Kimia Sumber: Silberberg, Chemistry: The Molecular Nature of Matter and Change Jumlah permen dalam stoples dapat diketahui jika berat dari satu permen dan seluruh permen diketahui. Cara
Stoikhiometri : dan metron = mengukur. Membahas tentang : senyawa) senyawa (stoikhiometri. (stoikhiometri. reaksi)
 STOIKHIOMETRI Stoikhiometri : Dari kata Stoicheion = unsur dan metron = mengukur Membahas tentang : hub massa antar unsur dalam suatu senyawa (stoikhiometri senyawa) dan antar zat dalam suatu reaksi (stoikhiometri
STOIKHIOMETRI Stoikhiometri : Dari kata Stoicheion = unsur dan metron = mengukur Membahas tentang : hub massa antar unsur dalam suatu senyawa (stoikhiometri senyawa) dan antar zat dalam suatu reaksi (stoikhiometri
Rumus Kimia. Mol unsur =
 Rumus Kimia Menentukan Rumus Kimia Zat Rumus kimia zat dapat dibedakan menjadi rumus empiris dan rumus molekul. Rumus empiris dapat ditentukan dengan menghitung mol komponen penyusun zat dengan menggunakan
Rumus Kimia Menentukan Rumus Kimia Zat Rumus kimia zat dapat dibedakan menjadi rumus empiris dan rumus molekul. Rumus empiris dapat ditentukan dengan menghitung mol komponen penyusun zat dengan menggunakan
Stoikiometri. Berasal dari kata Stoicheion (partikel) dan metron (pengukuran). Cara perhitungan dan pengukuran zat serta campuran kimia.
 Stoikiometri Berasal dari kata Stoicheion (partikel) dan metron (pengukuran). Cara perhitungan dan pengukuran zat serta campuran kimia. Bilangan Avogadro Stoikometri: pengukuran kuantitatif sehingga perlu
Stoikiometri Berasal dari kata Stoicheion (partikel) dan metron (pengukuran). Cara perhitungan dan pengukuran zat serta campuran kimia. Bilangan Avogadro Stoikometri: pengukuran kuantitatif sehingga perlu
STOIKIOMETRI. Massa molekul relatif suatu zat sama dengan jumlah massa atom relatif atomatom penyusun molekul zat tersebut.
 STOIKIOMETRI Istilah STOIKIOMETRI berasal dari kata-kata Yunani yaitu Stoicheion (partikel) dan metron (pengukuran). STOIKIOMETRI akhirnya mengacu kepada cara perhitungan dan pengukuran zat serta campuran
STOIKIOMETRI Istilah STOIKIOMETRI berasal dari kata-kata Yunani yaitu Stoicheion (partikel) dan metron (pengukuran). STOIKIOMETRI akhirnya mengacu kepada cara perhitungan dan pengukuran zat serta campuran
Ujian Akhir Semester Mata Pelajaran Kimia Kelas X Wacana berikut digunakan untuk menjawab soal no 1 dan 2. Ditentukan 5 unsur dengan konfigurasi
 Ujian Akhir Semester Mata Pelajaran Kimia Kelas X Wacana berikut digunakan untuk menjawab soal no 1 dan 2. Ditentukan 5 unsur dengan konfigurasi elektron sebagai berikut: P : 2 8 7 S : 2 8 8 Q : 2 8 8
Ujian Akhir Semester Mata Pelajaran Kimia Kelas X Wacana berikut digunakan untuk menjawab soal no 1 dan 2. Ditentukan 5 unsur dengan konfigurasi elektron sebagai berikut: P : 2 8 7 S : 2 8 8 Q : 2 8 8
MODUL KIMIA SMA IPA Kelas 10
 SMA IPA Kelas 0 A. Massa Atom. Massa Atom Relatif (Ar) Massa atom relatif (Ar) merupakan perbandingan massa atom dengan massa satu atom yang tetap. Secara matematis dapat dirumuskan sebagai berikut. sma
SMA IPA Kelas 0 A. Massa Atom. Massa Atom Relatif (Ar) Massa atom relatif (Ar) merupakan perbandingan massa atom dengan massa satu atom yang tetap. Secara matematis dapat dirumuskan sebagai berikut. sma
BAB III HASIL PENELITIAN
 BAB III HASIL PENELITIAN A. Gambaran Umum Buku Teks Kimia SMA Kelas X 1. Identitas Buku Teks Kimia SMA Kelas X Buku yang menjadi obyek penelitian peneliti adalah buku teks kimia SMA kelas X jilid 1 materi
BAB III HASIL PENELITIAN A. Gambaran Umum Buku Teks Kimia SMA Kelas X 1. Identitas Buku Teks Kimia SMA Kelas X Buku yang menjadi obyek penelitian peneliti adalah buku teks kimia SMA kelas X jilid 1 materi
K13 Revisi Antiremed Kelas 11 Kimia
 K13 Revisi Antiremed Kelas 11 Kimia Stoikiometri Larutan - Soal Doc. Name: RK13AR11KIM0601 Doc. Version : 2016-12 01. Zat-zat berikut ini dapat bereaksi dengan larutan asam sulfat, kecuali... (A) kalsium
K13 Revisi Antiremed Kelas 11 Kimia Stoikiometri Larutan - Soal Doc. Name: RK13AR11KIM0601 Doc. Version : 2016-12 01. Zat-zat berikut ini dapat bereaksi dengan larutan asam sulfat, kecuali... (A) kalsium
LATIHAN ULANGAN TENGAH SEMESTER 2
 Pilihlah jawaban yang paling benar LATIHAN ULANGAN TENGAH SEMESTER 2 TATANAMA 1. Nama senyawa berikut ini sesuai dengan rumus kimianya, kecuali. A. NO = nitrogen oksida B. CO 2 = karbon dioksida C. PCl
Pilihlah jawaban yang paling benar LATIHAN ULANGAN TENGAH SEMESTER 2 TATANAMA 1. Nama senyawa berikut ini sesuai dengan rumus kimianya, kecuali. A. NO = nitrogen oksida B. CO 2 = karbon dioksida C. PCl
Soal 5 Jumlah mol dari 29,8 gram amonium fosfat ((NH4)3PO4) (Ar N = 14, H = 1, dan P = 31) adalah. A. 0,05 mol
 Bank Soal Stoikiometri Kimia Bagian 2 Soal 1 Satu liter campuran gas terdiri dari 60% volume metana (CH4) dan sisanya gas etana (C2H6) dibakar sempurna sesuai reaksi: CH4 + 3 O2 2 CO2 + 2 H2O 2 C2H6 +
Bank Soal Stoikiometri Kimia Bagian 2 Soal 1 Satu liter campuran gas terdiri dari 60% volume metana (CH4) dan sisanya gas etana (C2H6) dibakar sempurna sesuai reaksi: CH4 + 3 O2 2 CO2 + 2 H2O 2 C2H6 +
BAB 2. PERSAMAAN KIMIA DAN HASIL REAKSI
 BAB 2. PERSAMAAN KIMIA DAN HASIL REAKSI 1. RUMUS KIMIA 2. MENULISKAN PERSAMAAN KIMIA YANG BALANS 3. HUBUNGAN MASSA DALAM REAKSI KIMIA 4. REAKTAN PEMBATAS 5. HASIL PERSENTASE Reaktan (Pereaksi) Produk (Hasil
BAB 2. PERSAMAAN KIMIA DAN HASIL REAKSI 1. RUMUS KIMIA 2. MENULISKAN PERSAMAAN KIMIA YANG BALANS 3. HUBUNGAN MASSA DALAM REAKSI KIMIA 4. REAKTAN PEMBATAS 5. HASIL PERSENTASE Reaktan (Pereaksi) Produk (Hasil
BAB III METODOLOGI PENELITIAN
 BAB III METODOLOGI PENELITIAN A. Lokasi dan Subjek Penelitian Penelitian ini dilaksanakan di SMA Negeri 2 Bandung. Subyek penelitian dalam penelitian ini adalah siswa SMA kelas X dan XI yang telah mempelajari
BAB III METODOLOGI PENELITIAN A. Lokasi dan Subjek Penelitian Penelitian ini dilaksanakan di SMA Negeri 2 Bandung. Subyek penelitian dalam penelitian ini adalah siswa SMA kelas X dan XI yang telah mempelajari
WEEK 3, 4 & 5 Bag 3:STOIKIOMETRI. Joko Sedyono Benyamin
 WEEK 3, 4 & 5 Bag 3:STOIKIOMETRI Joko Sedyono Benyamin 1 Diskripsi Stoikiometri adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif/jumlah zat yang terlibat dalam reaksi kimia. Kata ini berasal
WEEK 3, 4 & 5 Bag 3:STOIKIOMETRI Joko Sedyono Benyamin 1 Diskripsi Stoikiometri adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif/jumlah zat yang terlibat dalam reaksi kimia. Kata ini berasal
Abdul Wahid Surhim 2014
 Abdul Wahid Surhim 2014 Kerangka Pembelajaran Persamaan Kimia Pola Reaktivitas Kimia Berat Atom dan Molekul Mol Rumus Empirik dari Analisis Informasi Kuantitatif dari Persamaan yang Disetarakan Membatasi
Abdul Wahid Surhim 2014 Kerangka Pembelajaran Persamaan Kimia Pola Reaktivitas Kimia Berat Atom dan Molekul Mol Rumus Empirik dari Analisis Informasi Kuantitatif dari Persamaan yang Disetarakan Membatasi
1. Hukum Lavoisier 2. Hukum Proust 3. Hukum Dalton 4. Hukum Gay Lussac & Hipotesis Avogadro
 - - 1. Hukum Lavoisier 2. Hukum Proust 3. Hukum Dalton 4. Hukum Gay Lussac & Hipotesis Avogadro 1. Hukum Lavoisier (Hukum Kekekalan Massa) : Dalam sistem tertutup, massa zat sebelum dan sesudah reaksi
- - 1. Hukum Lavoisier 2. Hukum Proust 3. Hukum Dalton 4. Hukum Gay Lussac & Hipotesis Avogadro 1. Hukum Lavoisier (Hukum Kekekalan Massa) : Dalam sistem tertutup, massa zat sebelum dan sesudah reaksi
STOIKIOMETRI. Purwanti Widhy H, M.Pd
 STOIKIOMETRI Purwanti Widhy H, M.Pd widhy_ipauny@yahoo.com Menentukan jumlah partikel dan jumlah mol Jumlah molx(n) = jumlah partikelx L 1 mol = L partikel L= bilangan avogadro (6.02 x 10 23 /mol)
STOIKIOMETRI Purwanti Widhy H, M.Pd widhy_ipauny@yahoo.com Menentukan jumlah partikel dan jumlah mol Jumlah molx(n) = jumlah partikelx L 1 mol = L partikel L= bilangan avogadro (6.02 x 10 23 /mol)
soal stoikiometri larutan I. KEGIATAN: 1. Logam aluminium sebanyak 2,7 gram direaksikan dengan larutan asam sulfat. Hitunglah: (a) Volume gas yang
 soal stoikiometri larutan I. KEGIATAN: 1. Logam aluminium sebanyak 2,7 gram direaksikan dengan larutan asam sulfat. Hitunglah: (a) Volume gas yang dihasilkan pada t,p tertentu bila 8 gram gas oksigen volumenya
soal stoikiometri larutan I. KEGIATAN: 1. Logam aluminium sebanyak 2,7 gram direaksikan dengan larutan asam sulfat. Hitunglah: (a) Volume gas yang dihasilkan pada t,p tertentu bila 8 gram gas oksigen volumenya
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya.
 30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
STOIKIOMETRI LARUTAN. Andian Ari Anggraeni, M.Sc
 STOIKIOMETRI LARUTAN Andian Ari Anggraeni, M.Sc A.1. MASSA ATOM RELATIF (A r ) DAN MASSA MOLEKUL RELATIF (M r ) Dari percobaan diketahui bahwa perbandingan massa hidrogen dan oksigen dalam air adalah 1
STOIKIOMETRI LARUTAN Andian Ari Anggraeni, M.Sc A.1. MASSA ATOM RELATIF (A r ) DAN MASSA MOLEKUL RELATIF (M r ) Dari percobaan diketahui bahwa perbandingan massa hidrogen dan oksigen dalam air adalah 1
Antiremed Kelas 11 Kimia
 Antiremed Kelas 11 Kimia Stoikiometri Larutan - Latihan Soal Doc. Name: AR11KIM0699 Doc. Version : 2012-07 01. Zat-zat berikut ini dapat bereaksi dengan larutan asam sulfat, kecuali... (A) kalsium oksida
Antiremed Kelas 11 Kimia Stoikiometri Larutan - Latihan Soal Doc. Name: AR11KIM0699 Doc. Version : 2012-07 01. Zat-zat berikut ini dapat bereaksi dengan larutan asam sulfat, kecuali... (A) kalsium oksida
Massa atom merupakan massa dari atom dalam satuan massa atom (sma).
 Bab 3 1. Apakah yang dimaksud dengan Ar dan Mr? 2. Apakah yang dimaksud dengan mol? 3. Bagaimana cara mencari mol jika diketahui massa zat, volume (dalam STP), dan jumah molekul/partikelnya? 4. Berapa
Bab 3 1. Apakah yang dimaksud dengan Ar dan Mr? 2. Apakah yang dimaksud dengan mol? 3. Bagaimana cara mencari mol jika diketahui massa zat, volume (dalam STP), dan jumah molekul/partikelnya? 4. Berapa
BAB IV ANALISIS HASIL PENELITIAN
 BAB IV ANALISIS HASIL PENELITIAN Bab ini peneliti menganalisis hasil penelitian, yaitu isi buku Teks Kimia SMA Kelas X jilid 1 Materi Pokok Stoikiometri karangan Unggul Sudarmo yang diterbitkan oleh Erlangga
BAB IV ANALISIS HASIL PENELITIAN Bab ini peneliti menganalisis hasil penelitian, yaitu isi buku Teks Kimia SMA Kelas X jilid 1 Materi Pokok Stoikiometri karangan Unggul Sudarmo yang diterbitkan oleh Erlangga
BAB 1V HASIL DAN PEMBAHASAN
 4.1.1 HASIL PENELITIAN BAB 1V HASIL DAN PEMBAHASAN Berdasarkan data hasil penelitian, persentase kemampuan siswa kelas dalam menyelesaikan soal-soal persamaan reaksi kimia dapat dilihat pada tabel dibawah
4.1.1 HASIL PENELITIAN BAB 1V HASIL DAN PEMBAHASAN Berdasarkan data hasil penelitian, persentase kemampuan siswa kelas dalam menyelesaikan soal-soal persamaan reaksi kimia dapat dilihat pada tabel dibawah
STOIKIOMETRI A. HUKUM-HUKUM DASAR KIMIA B. PERHITUNGAN KIMIA
 4 STOIKIOMETRI A. HUKUM-HUKUM DASAR KIMIA B. PERHITUNGAN KIMIA Kata Stoikiometri berasal dari bahasa Yunani, stoicheion yang berarti unsur (partikel) dan metron yang berarti pengukuran. Stoikiometri menggambarkan
4 STOIKIOMETRI A. HUKUM-HUKUM DASAR KIMIA B. PERHITUNGAN KIMIA Kata Stoikiometri berasal dari bahasa Yunani, stoicheion yang berarti unsur (partikel) dan metron yang berarti pengukuran. Stoikiometri menggambarkan
BAB IV HASIL DAN PEMBAHASAN
 BAB IV HASIL DAN PEMBAHASAN Stoikiometri kimia merupakan suatu materi pelajaran kimia yang menekankan pada segi kuantitatif analisis kimia. Materi stoikiometri kimia di SMA berdasarkan silabus kimia KTSP
BAB IV HASIL DAN PEMBAHASAN Stoikiometri kimia merupakan suatu materi pelajaran kimia yang menekankan pada segi kuantitatif analisis kimia. Materi stoikiometri kimia di SMA berdasarkan silabus kimia KTSP
HUKUM DASAR KIMIA DAN PERHITUNGAN KIMIA
 HUKUM DASAR KIMIA DAN PERHITUNGAN KIMIA Mata Pelajaran : Kimia Kelas : X (Sepuluh) Nomor Modul : Kim.X.06 Penulis : Dorthy Hariandja, S.Pd. Penyunting Materi : Drs. Darsef, M.Si Penyunting Media : Drs.
HUKUM DASAR KIMIA DAN PERHITUNGAN KIMIA Mata Pelajaran : Kimia Kelas : X (Sepuluh) Nomor Modul : Kim.X.06 Penulis : Dorthy Hariandja, S.Pd. Penyunting Materi : Drs. Darsef, M.Si Penyunting Media : Drs.
BAB III STOIKIOMETRI
 BAB III STOIKIOMETRI A. Standar Kompetensi: Memahami tentang ilmu kimia dan dasar-dasarnya serta mampu menerapkannya dalam kehidupan se-hari-hari terutama yang berhubungan langsung dengan kehidupan. B.
BAB III STOIKIOMETRI A. Standar Kompetensi: Memahami tentang ilmu kimia dan dasar-dasarnya serta mampu menerapkannya dalam kehidupan se-hari-hari terutama yang berhubungan langsung dengan kehidupan. B.
Antiremed Kelas 10 KIMIA
 Antiremed Kelas 10 KIMIA Persiapan UAS 1 Kimia Doc Name: AR10KIM01UAS Version : 2016-07 halaman 1 01. Partikel berikut yang muatannya sebesar 19 1,6 10 C dan bermassa 1 sma (A) elektron (B) proton (C)
Antiremed Kelas 10 KIMIA Persiapan UAS 1 Kimia Doc Name: AR10KIM01UAS Version : 2016-07 halaman 1 01. Partikel berikut yang muatannya sebesar 19 1,6 10 C dan bermassa 1 sma (A) elektron (B) proton (C)
K13 Revisi Antiremed Kelas 10 Kimia
 K1 Revisi Antiremed Kelas 10 Kimia Stoikiometri - Soal Doc. Name:RK1AR10KIM0901 Version : 2016-10 halaman 1 1. Jika diketahui massa atom C-12= p gram dan massa 1 atom unsur X adalah a gram. Massa atom
K1 Revisi Antiremed Kelas 10 Kimia Stoikiometri - Soal Doc. Name:RK1AR10KIM0901 Version : 2016-10 halaman 1 1. Jika diketahui massa atom C-12= p gram dan massa 1 atom unsur X adalah a gram. Massa atom
LEMBAR AKTIVITAS SISWA ( LAS )
 LEMBAR AKTIVITAS SISWA ( LAS ) 1. Sebanyak 2 gram suatu logam alkali tanah dilarutkan dalam asam klorida menghasilan 1,25 liter gas hidrogen ( T,P ).Pada ( T,P ) yang sama 5,6 gram N 2 mempunyai volume
LEMBAR AKTIVITAS SISWA ( LAS ) 1. Sebanyak 2 gram suatu logam alkali tanah dilarutkan dalam asam klorida menghasilan 1,25 liter gas hidrogen ( T,P ).Pada ( T,P ) yang sama 5,6 gram N 2 mempunyai volume
Reaksi Dan Stoikiometri Larutan
 A. PERSAMAAN REAKSI ION Reaksi Dan Stoikiometri Larutan Persamaan reaksi ion adalah persamaan reaksi yang menjelaskan bagaimana reaksi antar-ion terjadi pada elektrolit. Persamaan reaksi ion terdiri dari:
A. PERSAMAAN REAKSI ION Reaksi Dan Stoikiometri Larutan Persamaan reaksi ion adalah persamaan reaksi yang menjelaskan bagaimana reaksi antar-ion terjadi pada elektrolit. Persamaan reaksi ion terdiri dari:
Konsep Mol : Menghubungkan Dunia Makroskopik dan Dunia Molekular
 Konsep Mol : Menghubungkan Dunia Makroskopik dan Dunia Molekular 1 Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional:
Konsep Mol : Menghubungkan Dunia Makroskopik dan Dunia Molekular 1 Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional:
Soal ini terdiri dari 25 soal PG (50 poin) dan 6 soal essay (88 poin)
 Bidang Studi Kode Berkas : Kimia : KI-T01 (soal) Soal ini terdiri dari 25 soal PG (50 poin) dan 6 soal essay (88 poin) Tetapan Avogadro N A = 6,022 10 23 partikel.mol 1 Tetapan Gas Universal R = 8,3145
Bidang Studi Kode Berkas : Kimia : KI-T01 (soal) Soal ini terdiri dari 25 soal PG (50 poin) dan 6 soal essay (88 poin) Tetapan Avogadro N A = 6,022 10 23 partikel.mol 1 Tetapan Gas Universal R = 8,3145
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2015 Page 1 1. MATERI: STOIKIOMETRI Persen massa adalah persentase massa zat terlarut dalam 100 gram massa larutan (massa pelarut + massa
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2015 Page 1 1. MATERI: STOIKIOMETRI Persen massa adalah persentase massa zat terlarut dalam 100 gram massa larutan (massa pelarut + massa
Reaksi dan Stoikiometri Larutan
 Reaksi dan Stoikiometri Larutan A. PERSAMAAN REAKSI ION Persamaan reaksi ion adalah persamaan reaksi yang menjelaskan bagaimana reaksi antar-ion terjadi pada larutan elektrolit. Persamaan reaksi ion terdiri
Reaksi dan Stoikiometri Larutan A. PERSAMAAN REAKSI ION Persamaan reaksi ion adalah persamaan reaksi yang menjelaskan bagaimana reaksi antar-ion terjadi pada larutan elektrolit. Persamaan reaksi ion terdiri
6.1 HUKUM-HUKUM DASAR KIMIA
 6.1 HUKUM-HUKUM DASAR KIMIA 1. Hukum kekekalan massa oleh Antoine Laurent Lavoiser (1789). Lavoiser mengemukakan pernyataan yang disebut hukum kekekalan massa, yang berbunyi : Pada reaksi kimia, massa
6.1 HUKUM-HUKUM DASAR KIMIA 1. Hukum kekekalan massa oleh Antoine Laurent Lavoiser (1789). Lavoiser mengemukakan pernyataan yang disebut hukum kekekalan massa, yang berbunyi : Pada reaksi kimia, massa
BAB IV HUKUM DASAR KIMIA
 BAB IV HUKUM DASAR KIMIA KOMPETENSI DASAR : 2.1 Membuktikan dan mengkomunikasikan berlakunya hukum-hukum dasar kimia melalui percobaan Indikator : 1. Membuktikan berdasarkan percobaan bahwa massa zat sebelum
BAB IV HUKUM DASAR KIMIA KOMPETENSI DASAR : 2.1 Membuktikan dan mengkomunikasikan berlakunya hukum-hukum dasar kimia melalui percobaan Indikator : 1. Membuktikan berdasarkan percobaan bahwa massa zat sebelum
BAB I STOIKHIOMETRI I - 1
 BAB I STOIKHIOMETRI 1.1 PENDAHULUAN Setiap zat, unsur, senyawa dalam kimia mempunyai nama dan rumus uniknya sendiri. Cara tersingkat untuk memerikan suatu reaksi kimia adalah dengan menuliskan rumus untuk
BAB I STOIKHIOMETRI 1.1 PENDAHULUAN Setiap zat, unsur, senyawa dalam kimia mempunyai nama dan rumus uniknya sendiri. Cara tersingkat untuk memerikan suatu reaksi kimia adalah dengan menuliskan rumus untuk
BAB 5 HUKUM DASAR KIMIA
 BAB 5 HUKUM DASAR KIMIA Dalam ilmu kimia perlu dipelajari massa dan volume zat-zat yang bereaksi dan zat yang dihasilkan dalam suatu reaksi kimia. Studi tentang hubungan-hubungan kuantitatif dalam suatu
BAB 5 HUKUM DASAR KIMIA Dalam ilmu kimia perlu dipelajari massa dan volume zat-zat yang bereaksi dan zat yang dihasilkan dalam suatu reaksi kimia. Studi tentang hubungan-hubungan kuantitatif dalam suatu
LARUTAN ELEKTROLIT DAN KONSEP REDOKS
 LARUTAN ELEKTROLIT DAN KONSEP REDOKS LARUTAN ELEKTROLIT DAN KONSEP REDOKS \usepackage{chemmacros} \ch{n2 \gas{} + 3 H2 \gas{} ->2 NH3 \gas{} } Stoikimiometri Membahas tentang hubungan massa antar unsur
LARUTAN ELEKTROLIT DAN KONSEP REDOKS LARUTAN ELEKTROLIT DAN KONSEP REDOKS \usepackage{chemmacros} \ch{n2 \gas{} + 3 H2 \gas{} ->2 NH3 \gas{} } Stoikimiometri Membahas tentang hubungan massa antar unsur
Antiremed Kelas 10 Kimia
 Antiremed Kelas 10 Kimia Stokiometri - Latihan Soal Doc. Name:K1 AR10KIM0901 Version : 201-09 halaman 1 1. Jika diketahui massa atom C-12= p gram dan massa 1 atom unsur X adalah a gram. Massa atom relatif
Antiremed Kelas 10 Kimia Stokiometri - Latihan Soal Doc. Name:K1 AR10KIM0901 Version : 201-09 halaman 1 1. Jika diketahui massa atom C-12= p gram dan massa 1 atom unsur X adalah a gram. Massa atom relatif
Hukum Dasar Ilmu Kimia Sumber :
 A Hukum Kekekalan Massa (Hukum Lavoisier) Hukum Dasar Ilmu Kimia Sumber : wwwe-dukasinet Pernahkah Anda memperhatikan sepotong besi yang dibiarkan di udara terbuka, dan pada suatu waktu kita akan menemukan,
A Hukum Kekekalan Massa (Hukum Lavoisier) Hukum Dasar Ilmu Kimia Sumber : wwwe-dukasinet Pernahkah Anda memperhatikan sepotong besi yang dibiarkan di udara terbuka, dan pada suatu waktu kita akan menemukan,
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A. D. Cu E. Zn
 1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
kimia ASAM-BASA III Tujuan Pembelajaran
 KTSP K-13 kimia K e l a s XI ASAM-BASA III Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami mekanisme reaksi asam-basa. 2. Memahami stoikiometri
KTSP K-13 kimia K e l a s XI ASAM-BASA III Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami mekanisme reaksi asam-basa. 2. Memahami stoikiometri
A. HUKUM PERBANDINGAN VOLUM DAN HIPOTESIS AVOGADRO*
 Di muka kita telah membahas tentang jenis perubahan materi. Bagian dari Kimia yang membahas hubungan kuantitatif (jumlah) antara zat-zat yang terlibat dalam suatu perubahan kimia atau reaksi kimia dikenal
Di muka kita telah membahas tentang jenis perubahan materi. Bagian dari Kimia yang membahas hubungan kuantitatif (jumlah) antara zat-zat yang terlibat dalam suatu perubahan kimia atau reaksi kimia dikenal
Bab IV Hukum Dasar Kimia
 Bab IV Hukum Dasar Kimia Sumber: Silberberg, Chemistry :The Molecular Nature of Matter and Change Kalsium karbonat ditemukan pada beberapa bentuk seperti pualam, batu koral, dan kapur. Persen massa unsur-unsur
Bab IV Hukum Dasar Kimia Sumber: Silberberg, Chemistry :The Molecular Nature of Matter and Change Kalsium karbonat ditemukan pada beberapa bentuk seperti pualam, batu koral, dan kapur. Persen massa unsur-unsur
LEMBARAN SOAL 4. Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA )
 LEMBARAN SOAL 4 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
LEMBARAN SOAL 4 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL. UjianTeori. Waktu: 100 menit
 OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
KATA PENGANTAR. Bangko, sepetember Penyusun
 KATA PENGANTAR Puji syukur kami ucapkan ke hadirat Tuhan Yang Maha Esa karena atas rahmat-nya lah sehingga kami dapat menyelesaikan makalah ini sebagai salah satu tugas dari mata kuliah Kimia Dasar. Makalah
KATA PENGANTAR Puji syukur kami ucapkan ke hadirat Tuhan Yang Maha Esa karena atas rahmat-nya lah sehingga kami dapat menyelesaikan makalah ini sebagai salah satu tugas dari mata kuliah Kimia Dasar. Makalah
HUKUM DASAR KIMIA DAN PERHITUNGAN KIMIA
 Modul Hukum Dasar Kimia dan Perhitungan Kimia EV Page of 8 HUKUM DASAR KIMIA DAN PERHITUNGAN KIMIA Mata Pelajaran K e l a s Nomor Modul Penulis : Kimia : X : Kim.X.04 : Ernavita M.Pd Sekolah Menengah Atas
Modul Hukum Dasar Kimia dan Perhitungan Kimia EV Page of 8 HUKUM DASAR KIMIA DAN PERHITUNGAN KIMIA Mata Pelajaran K e l a s Nomor Modul Penulis : Kimia : X : Kim.X.04 : Ernavita M.Pd Sekolah Menengah Atas
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL. UjianTeori. Waktu: 100 menit
 OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
SATUAN ACARA PERKULIAHAN (SAP)
 Mata Kuliah : Kimia Teknik Kode Mata Kuliah : MKT 1105 SKS : 2(2-0) Waktu Pertemuan : 100 Menit SATUAN ACARA PERKULIAHAN (SAP) A. Tujuan Pembelajaran 1. Tujuan pembelajaran umum mata kuliah Setelah menyelesaikan
Mata Kuliah : Kimia Teknik Kode Mata Kuliah : MKT 1105 SKS : 2(2-0) Waktu Pertemuan : 100 Menit SATUAN ACARA PERKULIAHAN (SAP) A. Tujuan Pembelajaran 1. Tujuan pembelajaran umum mata kuliah Setelah menyelesaikan
BAB 5 KONSEP LARUTAN 1. KOMPOSISI LARUTAN 2. SIFAT-SIFAT ZAT TERLARUT 3. KESETIMBANGAN LARUTAN 4. SIFAT KOLIGATIF LARUTAN
 BAB 5 KONSEP LARUTAN 1. KOMPOSISI LARUTAN 2. SIFAT-SIFAT ZAT TERLARUT 3. KESETIMBANGAN LARUTAN 4. SIFAT KOLIGATIF LARUTAN ZAT TERLARUT + PELARUT LARUTAN Komponen minor Komponen utama Sistem homogen PELARUTAN
BAB 5 KONSEP LARUTAN 1. KOMPOSISI LARUTAN 2. SIFAT-SIFAT ZAT TERLARUT 3. KESETIMBANGAN LARUTAN 4. SIFAT KOLIGATIF LARUTAN ZAT TERLARUT + PELARUT LARUTAN Komponen minor Komponen utama Sistem homogen PELARUTAN
Pilihan Ganda Soal dan Jawaban Sifat Koligatif Larutan 20 butir. 5 uraian Soal dan Jawaban Sifat Koligatif Larutan.
 1 Pilihan Ganda Soal dan Jawaban Sifat Koligatif Larutan 20 butir. 5 uraian Soal dan Jawaban Sifat Koligatif Larutan. Berilah tanda silang (X) pada huruf A, B, C, D atau E di depan jawaban yang benar!
1 Pilihan Ganda Soal dan Jawaban Sifat Koligatif Larutan 20 butir. 5 uraian Soal dan Jawaban Sifat Koligatif Larutan. Berilah tanda silang (X) pada huruf A, B, C, D atau E di depan jawaban yang benar!
Chapter 6. Gas. Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Chapter 6 Gas Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Beberapa zat yang berwujud gas pada suhu 25 0 C dan tekanan 1 Atm 5.1 1 5.1 Sifat-sifat fisis yang
Chapter 6 Gas Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Beberapa zat yang berwujud gas pada suhu 25 0 C dan tekanan 1 Atm 5.1 1 5.1 Sifat-sifat fisis yang
MATERI adalah segala sesuatu yang mempunyai massa dan menempati ruang ( punya volume )
 MATERI adalah segala sesuatu yang mempunyai massa dan menempati ruang ( punya volume ) Perubahan materi 1. perubahan fisis a) perubahan yang tidak menghasilkan zat baru b) perubahan bentuk dan wujud tanpa
MATERI adalah segala sesuatu yang mempunyai massa dan menempati ruang ( punya volume ) Perubahan materi 1. perubahan fisis a) perubahan yang tidak menghasilkan zat baru b) perubahan bentuk dan wujud tanpa
PENENTUAN KADAR KARBONAT DAN HIDROGEN KARBONAT MELALUI TITRASI ASAM BASA
 PENENTUAN KADAR KARBONAT DAN HIDROGEN KARBONAT MELALUI TITRASI ASAM BASA 1 Tujuan Percobaan Tujuan dari percobaan ini adalah menentukan kadar natrium karbonat dan natrium hidrogen karbonat dengan titrasi
PENENTUAN KADAR KARBONAT DAN HIDROGEN KARBONAT MELALUI TITRASI ASAM BASA 1 Tujuan Percobaan Tujuan dari percobaan ini adalah menentukan kadar natrium karbonat dan natrium hidrogen karbonat dengan titrasi
Gas. Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Bab 5 Gas Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Beberapa zat yang berwujud gas pada suhu 25 0 C dan tekanan 1At Atm 5.1 5.1 Sifat-sifat fisis yang khas
Bab 5 Gas Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Beberapa zat yang berwujud gas pada suhu 25 0 C dan tekanan 1At Atm 5.1 5.1 Sifat-sifat fisis yang khas
D. 2 dan 3 E. 2 dan 5
 1. Pada suhu dan tekanan sama, 40 ml P 2 tepat habis bereaksi dengan 100 ml, Q 2 menghasilkan 40 ml gas PxOy. Harga x dan y adalah... A. 1 dan 2 B. 1 dan 3 C. 1 dan 5 Kunci : E D. 2 dan 3 E. 2 dan 5 Persamaan
1. Pada suhu dan tekanan sama, 40 ml P 2 tepat habis bereaksi dengan 100 ml, Q 2 menghasilkan 40 ml gas PxOy. Harga x dan y adalah... A. 1 dan 2 B. 1 dan 3 C. 1 dan 5 Kunci : E D. 2 dan 3 E. 2 dan 5 Persamaan
LEMBAR KERJA SISWA 2
 76 LEMBAR KERJA SISWA 2 Mata Pelajaran Kelas / Semester Materi pokok Submateri pokok Alokasi Waktu : Kimia : XI/ganjil : Laju Reaksi : Konsep Laju Reaksi : 2 x 45 menit Standar Kompetensi 3. Memahami Kinetika
76 LEMBAR KERJA SISWA 2 Mata Pelajaran Kelas / Semester Materi pokok Submateri pokok Alokasi Waktu : Kimia : XI/ganjil : Laju Reaksi : Konsep Laju Reaksi : 2 x 45 menit Standar Kompetensi 3. Memahami Kinetika
BAB IV TERMOKIMIA A. PENGERTIAN KALOR REAKSI
 BAB IV TERMOKIMIA A. Standar Kompetensi: Memahami tentang ilmu kimia dan dasar-dasarnya serta mampu menerapkannya dalam kehidupan se-hari-hari terutama yang berhubungan langsung dengan kehidupan. B. Kompetensi
BAB IV TERMOKIMIA A. Standar Kompetensi: Memahami tentang ilmu kimia dan dasar-dasarnya serta mampu menerapkannya dalam kehidupan se-hari-hari terutama yang berhubungan langsung dengan kehidupan. B. Kompetensi
SOAL LAJU REAKSI. Mol CaCO 3 = = 0.25 mol = 25. m Mr
 SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
Fraksi mol adalah perbandingan antara jumiah mol suatu komponen dengan jumlah mol seluruh komponen yang terdapat dalam larutan.
 Konsentrasi Larutan Ditulis oleh Redaksi chem-is-try.org pada 02-05-2009 Konsentrasi merupakan cara untuk menyatakan hubungan kuantitatif antara zat terlarut dan pelarut. Menyatakan konsentrasi larutan
Konsentrasi Larutan Ditulis oleh Redaksi chem-is-try.org pada 02-05-2009 Konsentrasi merupakan cara untuk menyatakan hubungan kuantitatif antara zat terlarut dan pelarut. Menyatakan konsentrasi larutan
LAPORAN PRAKTIKUM KIMIA DASAR I STOIKIOMETRI REAKSI
 LAPORAN PRAKTIKUM KIMIA DASAR I STOIKIOMETRI REAKSI Nama Anggota: Isrenna Ratu Rezky Suci 1157040029 Helmi Fauzi 1157040025 Fajar Gunawan 1157040022 Fresa Agustini 1157040024 JURUSAN KIMIA 1A FAKULTAS
LAPORAN PRAKTIKUM KIMIA DASAR I STOIKIOMETRI REAKSI Nama Anggota: Isrenna Ratu Rezky Suci 1157040029 Helmi Fauzi 1157040025 Fajar Gunawan 1157040022 Fresa Agustini 1157040024 JURUSAN KIMIA 1A FAKULTAS
Amin Fatoni, M.Si 2008
 Amin Fatoni, M.Si 2008 Massa rumus (Mr) = massa molekul = bobot molekul (BM) merupakan penjumlahan dari massa atom penyusun-penyusunnya Contoh: Air - H 2 O 1 atom Oksigen 2(1.0079 u) + 15.9994 u = 18.0152
Amin Fatoni, M.Si 2008 Massa rumus (Mr) = massa molekul = bobot molekul (BM) merupakan penjumlahan dari massa atom penyusun-penyusunnya Contoh: Air - H 2 O 1 atom Oksigen 2(1.0079 u) + 15.9994 u = 18.0152
Soal dan Jawaban Titrasi Asam Basa
 Soal dan Jawaban Titrasi Asam Basa Rabu, 16 Januari 20130 komentar Inilah beberapa contoh soal dan jawaban tentang titrasi asam basa. Bacalah benarbenar setiap latihan soal asam basa berikut. Kalau perlu,
Soal dan Jawaban Titrasi Asam Basa Rabu, 16 Januari 20130 komentar Inilah beberapa contoh soal dan jawaban tentang titrasi asam basa. Bacalah benarbenar setiap latihan soal asam basa berikut. Kalau perlu,
BAB 4. WUJUD ZAT 1. WUJUD GAS 2. HUKUM GAS 3. HUKUM GAS IDEAL 4. GAS NYATA 5. CAIRAN DAN PADATAN 6. GAYA ANTARMOLEKUL 7. TRANSISI FASA 8.
 BAB 4. WUJUD ZAT 1. WUJUD GAS 2. HUKUM GAS 3. HUKUM GAS IDEAL 4. GAS NYATA 5. CAIRAN DAN PADATAN 6. GAYA ANTARMOLEKUL 7. TRANSISI FASA 8. DIAGRAM FASA WUJUD ZAT: GAS CAIRAN PADATAN PERMEN (sukrosa) C 12
BAB 4. WUJUD ZAT 1. WUJUD GAS 2. HUKUM GAS 3. HUKUM GAS IDEAL 4. GAS NYATA 5. CAIRAN DAN PADATAN 6. GAYA ANTARMOLEKUL 7. TRANSISI FASA 8. DIAGRAM FASA WUJUD ZAT: GAS CAIRAN PADATAN PERMEN (sukrosa) C 12
Soal 2.1. unsurnya dan menghasilkan. Penyelesaian. Perbandingan unsur-unsur Zn : O : P 25,40 : 16,58 : 8,02 65,
 Soal. Seng fosfat digunakan sebagai semen gigi. Sebanyak 50,00 mg sampel dihancurkan menjadi unsur-unsurnya unsurnya dan menghasilkan 6,58 mg oksigen,, 8,0 mg fosforus, dan 5,40 mg seng. Tentukan rumus
Soal. Seng fosfat digunakan sebagai semen gigi. Sebanyak 50,00 mg sampel dihancurkan menjadi unsur-unsurnya unsurnya dan menghasilkan 6,58 mg oksigen,, 8,0 mg fosforus, dan 5,40 mg seng. Tentukan rumus
1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat!
 Petunjuk : 1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat! 2. Soal Teori ini terdiri dari dua bagian: A. 30 soal pilihan Ganda : 60 poin B. 5 Nomor
Petunjuk : 1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat! 2. Soal Teori ini terdiri dari dua bagian: A. 30 soal pilihan Ganda : 60 poin B. 5 Nomor
