Purwanti Widhy H, M.Pd. Laju Reaksi
|
|
|
- Erlin Darmali
- 7 tahun lalu
- Tontonan:
Transkripsi
1 Purwanti Widhy H, M.Pd Laju Reaksi
2 SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai
3 Standar Kompetensi, Kompetensi Dasar & Indikator SK KD Ind 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri
4 Standar Kompetensi, Kompetensi Dasar & Indikator SK KD Ind 3.1 Mendeskripsikan pengertian laju reaksi dengan melakukan percobaan tentang faktor-faktor yang mempengaruhi laju reaksi
5 Standar Kompetensi, Kompetensi Dasar & Indikator SK KD Ind 1. Menjelaskan kemolaran larutan 2. Menghitung kemolaran larutan 3. Menjelaskan pengertian laju reaksi 4. Menjelaskan faktor-faktor yang mempengaruhi laju reaksi
6 Kemolaran Kemolaran adalah satuan konsentrasi larutan yang menyatakan banyaknya mol zat terlarut dalam 1 liter larutan Kemolaran (M) sama dengan jumlah mol (n) zat terlarut dibagi volume (v) larutan M n V atau M gr Mr 1000 x V
7 Kemolaran Pengenceran larutan menyebabkan konsentrasi berubah dengan rumusan : V 1M1 V2M 2 dimana: V 1 M 1 : volume dan konsentrasi larutan asal V 2 M 2 : volume dan konsentrasi hasil pengenceran
8 Kemolaran Pencampuran larutan sejenis dengan konsentrasi berbeda menghasilkan konsentrasi baru, dengan rumusan : M campuran V M 1 1 V V 1 2 M V V... V n n M n
9 Konsep Laju Reaksi Laju reaksi menyatakan laju perubahan konsentrasi zat-zat komponen reaksi setiap satuan waktu: V [ M ] t Laju pengurangan konsentrasi pereaksi per satuan waktu Laju penambahan konsentrasi hasil reaksi per satuan waktu Perbadingan laju perubahan masing-masing komponen sama dengan perbandingan koefisien reaksinya
10 Konsep Laju Reaksi Pada reaksi : N 2(g) + 3 H 2(g) 2 NH 3(g), Laju reaksi : - laju penambahan konsentrasi NH 3 - laju pengurangan konsentrasi N 2 dan H 2.
11 Laju reaksi menggambarkan seberapa cepat reaktan terpakai dan produk terbentuk
12 Faktor-faktor yang mempengaruhi Laju Reaksi Laju reaksi dipengaruhi oleh : Suhu Konsentrasi Luas permukaan sentuhan/ Ukuran partikel Katalis Kembali
13 Suhu Kenaikan suhu dapat mempercepat laju reaksi karena dengan naiknya suhu energi kinetik partikel zat-zat meningkat sehingga memungkinkan semakn banyaknya tumbukan efektif yang menghasilkan perubahan
14 Suhu Hubungan Kuntitatif perubahan suhu terhadap laju reaksi: Hubungan ini ditetapkan dari suatu percobaan, misal diperoleh data sebagai berikut: Suhu ( o C) t Laju reaksi (M/detik) 0,3 0,6 1,2 2,4 Vt
15 Suhu Hubungan Kuntitatif perubahan suhu terhadap laju reaksi: Dari data diperoleh hubungan: Setiap kenaikan suhu 10 o C, maka laju mengalami kenaikan 2 kali semula, maka secara matematis dapat dirumuskan V V t 0.2 tt 10 Dimana : V t = laju reaksi pada suhu t V o = laju reaksi pada suhu awal (t o ) 0
16 Reaksi Order Pertama Beberapa aplikasi dari reaksi order I Menggabarkan berapa banyak obat yang dilepas pada peredaran darah atau yang digunakan tubuh Sangat berguna di bidang geokimia Peluruhan radioakif Waktu Paruh (t 1/2 ) Waktu yang dibutuhkan untuk meluruhkan ½ dari kuantitas awal suatu reaktan
17 Dari data N 2 O 5 dilihat bahwa dibutuhkan waktu 1900 detik untuk mereduksi jumlah awal N 2 O 5 menjadi setengahnya. Butuh 1900 detik lagi untuk mereduksi setengahnya kembali Kimia Dasar II-Rahmat Wibowo
18 Waktu Paruh Hubungan waktu paruh dengan konstanta laju reaksi Waktu paruh dapat digunakan untuk menghitung konsntanta laju reaksi orde pertama Contoh N 2 O 5 dengan waktu paruh 1900 detik Kimia Dasar II-Rahmat Wibowo
19 Pengaruh Temperatur Laju reaksi sangat bergantung dengan temperatur Berikut adalah konstanta reaksi dekomposisi N 2 O 5 pada berbagai temperatur Kimia Dasar II-Rahmat Wibowo
20 Waktu Paruh Reaksi Orde 2
21 Pengaruh Temperatur Persamaan yang menyatakan hubungan ini adalah persamaan Arrhenius
22 Pengaruh Temperatur Bentuk lain persamaan Arrhenius: Jika ln k diplot terhadap 1/T maka akan didapat garis lurus dengan nilai tangensial Ea/R Energi Aktivasi Energi yang dibutuhkan oleh suatu molekul untuk dapat bereksi
23 Hasil dari perhitungan data N 2 O 5 Kimia Dasar II-Rahmat Wibowo
24 Temperatur dan E a Bila temperatur meningkat, fraksi molekul yang memiliki energi kinetik pun meningkat sehingga meningkatkan energi aktivasinya Kimia Dasar II-Rahmat Wibowo
25 Mekanisme Reaksi Kebanyakan reaksi kimia berjalan dengan beberapa tahap yang berurutan Setiap tahapan memiliki laju yang bersesuaian Laju keseluruhan ditentukan oleh tahapan yang berlangsung paling lambat (rate-determining step) Prinsip: Jika konsentrasi suatu reaktan muncul dalam persamaan laju reaksi, maka reaktan tersebut atau sesuatu yang merupakan hasil penurunan reaktan tsb terlibat dalam tahapan yang lambat. Jika tidak muncul dalam persamaan laju reaksi, maka baik reaktan maupun turunannya tidak terlibat dalam tahapan yang lambat.
26 Go to Reaksi dekomposisi N 2 O 5 2N 2 O 5 (g) 2N 2 O 4 (g) + O 2 (g) Reaksi ini bukan reaksi orde 2 walaupun ini merupakan reaksi bimolecular Dua molekul gas dalam tumbukan tumbukan
27 v = k [N 2 O 5 ] Persamaan ini menunjukkan bahwa tahapan yang paling lambat melibatkan satu molekul N 2 O 5 yang terdekomposisi lambat cepat lambat + cepat Tahapan pertama merupakan unimolecular dimana tiap molekul pecah. Mereka tidak bertumbukan terlebih dahulu
28 Tahap I e n e r g i E a1 Tahap II E a2 Tahap III E a3 Kembali Koordinat reaksi
29 Konsentrasi Konsentrasi mempengaruhi laju reaksi, karena banyaknya partikel memungkinkan lebih banyak tumbukan, dan itu membuka peluang semakin banyak tumbukan efektif yang menghasilkan perubahan. Ilustrasi Mana yang lebih mungkin terjadi tabrakan, di jalan lenggang atau dijalanan padat??
30 Konsentrasi Hubungan kuantitatif perubahan konsentrasi dengan laju reaksi tidak dapat ditetapkan dari persamaan reaksi, tetapi harus melalui percobaan. Dalam penetapan laju reaksi ditetapkan yang menjadi patokan adalah laju perubahan konsentrasi reaktan. Ada reaktan yang perubahan konsentrasinya tidak mempengaruhi laju reaksi: [reaktan] V [reaktan] x n 1 n o x V 1
31 Konsentrasi Orde Reaksi Pangkat perubahan konsentrasi terhadap perubahan laju disebut orde reaksi Ada reaksi berorde O, dimana tidak terjadi perubahan laju reaksi berapapun perubahan konsentrasi pereaksi. Ada reaksi berorde 1, dimana perubahan konsentrasi pereaksi 2 kali menyebabkan laju reaksi lebih cepat 2 kali. Ada reaksi berorde 2, dimana laju perubahan konsentrasi pereaksi 2 kali menyebabkan laju reaksi lebih cepat 4 kali, dst.
32 Laju reaksi Konsentrasi Grafik hubungan perubahan konsentrasi terhadap laju reaksi Reaksi Orde 0 Reaksi Orde 1 Reaksi Orde 2 Konsentrasi
33 Laju reaksi Konsentrasi Grafik hubungan perubahan konsentrasi terhadap laju reaksi Reaksi Orde 0 Reaksi Orde 1 Reaksi Orde 2 Konsentrasi
34 Laju reaksi Konsentrasi Grafik hubungan perubahan konsentrasi terhadap laju reaksi Reaksi Orde 0 Reaksi Orde 1 Reaksi Orde 2 Konsentrasi Lanjut
35 Konsentrasi Untuk reaksi A + B C Rumusan laju reaksi adalah : V =k.[a] m.[b] n Dimana : k = tetapan laju reaksi m = orde reaksi untuk A n = orde reaksi untuk B Orde reakasi total = m + n
36 Konsentrasi Rumusan laju reaksi tersebut diperoleh dari percobaan. Misalkan diperoleh data percobaan untuk reaksi : NO (g) + Cl 2(g) NOCl 2(g) Diperoleh data sebagai berikut : Perc [NO] M [Cl 2 ] M V M/s 1 0,1 0, ,1 0, ,2 0, ,3 0,3?
37 Konsentrasi ,1 0,2 ] [ ] [ ] [ m V V NO NO V NO m m m m Rumusan laju reaksi untuk reaksi tersebut adalah : V = k.[no] m.[cl 2 ] n Orde NO = m Orde Cl 2 = n Percobaan 1 dan 3 Percobaan 1 dan ,1 0,2 ] [ ] [ ] [ n V V Cl Cl V Cl n n n n
38 Konsentrasi Maka rumusan laju reaksinya adalah : V=k.[NO] 1.[Cl 2 ] 2 Harga k diperoleh dengan memasukan salah satu data percobaan k k k V [ NO].[ Cl 4 0,1.0, M 2 2 ] s 2 1
39 Konsentrasi Maka laju reaksi pada percobaan 4 adalah : V= k.[no].[cl 2 ] 2 V= ,3. 0,3 2 V= 108 Ms -1 Kembali
40 Luas Permukaan Mana yang lebih luas permukaannya? Sepotong tahu utuh atau sepotong tahu dipotong 4?
41 Luas Permukaan Pisahkan
42 Luas Permukaan
43 Luas Permukaan Ulangi Lanjut
44 Luas Permukaan Perhatikan bahwa luas permukaan tahu utuh lebih kecil dari tahu yang dipotong 4 Sekarang! Mana yang lebih luas permukaannya, gula berukuran butir kasar atau gula berukuran butiran halus? Mana yang lebih mudah larut, gula yang berukuran butir kasar atau yang berukuran butiran halus?
45 Luas Permukaan Luas permukaan mempercepat laju reaksi karena semakin luas permukaan zat, semakin banyak bagian zat yang saling bertumbukan dan semakin besar peluang adanya tumbukan efektif menghasilkan perubahan Semakin luas permukaan zat, semakin kecil ukuran partikel zat. Jadi semakin kecil ukuran partikel zat, reaksi pun akan semakin cepat. Kembali
46 Katalis Katalis adalah zat yang dapat mempercepat laju reaksi. Ada 2 jenis katalis : 1. Katalis aktif yaitu katalis yang ikut terlibat reaksi dan pada akhir rekasi terbentuk kembali. 2. Katalis pasif yaitu katalis yang tidak ikut bereaksi, hanya sebagai media reaksi saja. Bagaimana katalis bekerja akan dibahas pada teori tumbukan
47 Katalis meningatkan koefisien reaksi dengan menyediakan jalur reaksi alternatif (atau mekanisme) dengan energi aktivasi yang lebih rendah Katalis tidak mengubah kesetimbangan hanya mempercepat terjadinya kesetimbangan Contoh: Produksi NH 3 menggunakan katalis Pt Catalytic converter pada knalpot
48 Kembali Aksi Katalis
49 Katalisis Homogen : satu fasa Heterogen : reaktan dan katalis berada pada fasa yang berbeda Contoh : pada produksi amonia N 2 + 3H 2 2NH 3 (katalis Pt) Tahapan penentu laju adalah pemutusan ikatan H-H Kembali
50 Evaluasi Dalam bejana bervolume 10 L, mula-mula terdapat 5 mol gas NO 2. Gas tersebut mengalami penguraian menurut reaksi : 2 NO 2(g) 2 NO (g) + O 2(g). Setelah tiga jam tersisa 1,4 mol gas NO 2. Tentukan a.laju reaksi penguraian gas NO 2! b.laju pembentukan gas NO! c.laju pembentukan gas O 2! 5
51 Evaluasi Diketahui reaksi A + B + C D. Jika persamaan laju reaksi reaksi tersebut v = k.[b] 2.[C] 1, berapa kali perubahan laju reaksinya bila konsentrasi masing-masing komponen pereaksi diperbesar 2 kali semula? 5
52 Evaluasi Dari percobaan reaksi A + B AB, diperoleh data sebagai berikut 1 Perc [A] M [B] M V M/s 1 1, , , , , , , , , , , Tentukan A. Orde reaksi untuk A dan B B. Persamaan laju reaksi C. Harga tetapan laju reaksi D. Laju reaksi jika konsentrasi A 0,026 M dan konsentrasi B 0,021 M
53 Evaluasi 1 Jika laju suatu reaksi meningkat 2 kali lebih cepat setiap kenaikan suhu 15 o C dan pada suhu 30 o C lajunya M/s, berapakah laju reaksinya pada 105 o C?
54 Evaluasi Dari data berikut : 1 Perc Fe [HCl] M Suhu o C 1 Serbuk 0, Kepingan 0, Serbuk 0, Kepingan Serbuk 0,1 0, Urutkan kelajuan reaksinya dari yang paling lambat ke yang paling cepat 5 Kembali
55 Exercise The initial rate of a reaction depended on the concentration of a substance J as follows. [J] 0 /(10-3 M) r 0 /(10-7 M s -1 ) Find the order of the reaction with respect to J and the rate constant. r 0 = k[j] 0n, so log r 0 = n log [J] 0 + log k log [J] log r log r 0 goes up twice as fast as log [J] 0, so n = 2 and log k = (0.70) = -0.84; k = 0.15 M -1 s -1
56 Exercise The concentration of N 2 O 5 in liquid bromine varied with time as follows: t/s [N 2 O 5 ]/M Show that the reaction is first order in N 2 O 5 and determine the rate constant. Kembali
57 Referensi Petrucci, Ralph. H, Kimia Dasar, Prinsip dan Terapan Modern. Terjemahan Suminar. Jakarta: Erlangga Brady, James E. dan J.R. Holum Fundamentals of Chemistry. Edisi 3, New York: Jon Willey & Sons, Inc. Kembali
58
59 Turunkan persaman t ½ = 0.693/k, Jika diketahui : [A] = [A] 0 exp(-kt) dimana t ½ = t dan A= A 0 /2.!
Laju Reaksi. Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I
 Laju Reaksi Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi,
Laju Reaksi Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi,
KESETIMBANGAN KIMIA. Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I. SK+KD+Indikator Materi Evaluasi Referensi
 KESETIMBANGAN KIMIA Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I SK+KD+Indikator Materi Evaluasi Referensi Standar Kompetensi dan Kompetensi Dasar Standar Kompetensi Kompetensi Dasar Standar Kompetensi
KESETIMBANGAN KIMIA Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I SK+KD+Indikator Materi Evaluasi Referensi Standar Kompetensi dan Kompetensi Dasar Standar Kompetensi Kompetensi Dasar Standar Kompetensi
Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan
 KINETIKA Pendahuluan Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan Namun persamaan reaksi tidak dapat menjawab :. Seberapa cepat reaksi berlangsung 2. Bagaimana
KINETIKA Pendahuluan Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan Namun persamaan reaksi tidak dapat menjawab :. Seberapa cepat reaksi berlangsung 2. Bagaimana
Kunci jawaban dan pembahasan soal laju reaksi
 Kunci jawaban dan pembahasan soal laju reaksi Soal nomor 1 Mencari volume yang dibutuhkan pada proses pengenceran. Rumus pengenceran V 1. M 1 = V 2. M 2 Misal volume yang dibutuhkan sebanyak x ml, maka
Kunci jawaban dan pembahasan soal laju reaksi Soal nomor 1 Mencari volume yang dibutuhkan pada proses pengenceran. Rumus pengenceran V 1. M 1 = V 2. M 2 Misal volume yang dibutuhkan sebanyak x ml, maka
MODUL LAJU REAKSI. Laju reaksi _ 2013 Page 1
 MODUL LAJU REAKSI Standar Kompetensi ( SK ) : Memahami kinetika reaksi, kesetimbangan kimia dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri. Kompetensi
MODUL LAJU REAKSI Standar Kompetensi ( SK ) : Memahami kinetika reaksi, kesetimbangan kimia dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri. Kompetensi
BAB VI KINETIKA REAKSI KIMIA
 BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
BAB II KAJIAN PUSTAKA. kemampuan adalah karakteristik yang menonjol dari seorang individu yang
 BAB II KAJIAN PUSTAKA 2.1 Defenisi Kemampuan Kemampuan sama dengan kata kesanggupan atau kecakapan. Dengan bahasa yang lebih terperinci, kemampuan dapat diartikan sebagai kesanggupan individu untuk melakukan
BAB II KAJIAN PUSTAKA 2.1 Defenisi Kemampuan Kemampuan sama dengan kata kesanggupan atau kecakapan. Dengan bahasa yang lebih terperinci, kemampuan dapat diartikan sebagai kesanggupan individu untuk melakukan
PETA KONSEP LAJU REAKSI. Percobaan. Waktu perubahan. Hasil reaksi. Pereaksi. Katalis. Suhu pereaksi. Konsentrasi. Luas. permukaan.
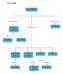 PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Chapter 8 Kinetika Kimia Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Chapter 8 Kinetika Kimia Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN
 BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN STANDAR KOMPETENSI 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan
BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN STANDAR KOMPETENSI 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan
c. Suhu atau Temperatur
 Pada laju reaksi terdapat faktor-faktor yang dapat mempengaruhi laju reaksi. Selain bergantung pada jenis zat yang beraksi laju reaksi dipengaruhi oleh : a. Konsentrasi Pereaksi Pada umumnya jika konsentrasi
Pada laju reaksi terdapat faktor-faktor yang dapat mempengaruhi laju reaksi. Selain bergantung pada jenis zat yang beraksi laju reaksi dipengaruhi oleh : a. Konsentrasi Pereaksi Pada umumnya jika konsentrasi
A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI
 3 LAJU REAKSI A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI Materi dapat berubah dari bentuk yang satu ke bentuk yang
3 LAJU REAKSI A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI Materi dapat berubah dari bentuk yang satu ke bentuk yang
kimia LAJU REAKSI 1 TUJUAN PEMBELAJARAN
 KTSP & K-13 kimia K e l a s XI LAJU REAKSI 1 TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konsep molaritas. 2. Memahami definisi dan faktor-faktor
KTSP & K-13 kimia K e l a s XI LAJU REAKSI 1 TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konsep molaritas. 2. Memahami definisi dan faktor-faktor
Kinetika kimia. Shinta Rosalia Dewi
 Kinetika kimia Shinta Rosalia Dewi Pendahuluan Termodinamika Kinetika Reaksi Mekanika fluida Pindah panas neraca massa ekonomi mendesain reaktor kimia Pendahuluan (cont ) Kinetika reaksi adalah studi tentang
Kinetika kimia Shinta Rosalia Dewi Pendahuluan Termodinamika Kinetika Reaksi Mekanika fluida Pindah panas neraca massa ekonomi mendesain reaktor kimia Pendahuluan (cont ) Kinetika reaksi adalah studi tentang
Kinetika Kimia. Abdul Wahid Surhim
 Kinetika Kimia bdul Wahid Surhim 2014 Kerangka Pembelajaran Laju Reaksi Hukum Laju dan Orde Reaksi Hukum Laju Terintegrasi untuk Reaksi Orde Pertama Setengah Reaksi Orde Pertama Reaksi Orde Kedua Laju
Kinetika Kimia bdul Wahid Surhim 2014 Kerangka Pembelajaran Laju Reaksi Hukum Laju dan Orde Reaksi Hukum Laju Terintegrasi untuk Reaksi Orde Pertama Setengah Reaksi Orde Pertama Reaksi Orde Kedua Laju
Waktu (t) Gambar 3.1 Grafik hubungan perubahan konsentrasi terhadap waktu
 3 LAJU REAKSI Setelah mempelajari bab ini, kamu diharapkan mampu: Menghitung konsentrasi larutan (molaritas larutan). Menganalisis faktor-faktor yang mempengaruhi laju reaksi (konsentrasi, luas permukaan,
3 LAJU REAKSI Setelah mempelajari bab ini, kamu diharapkan mampu: Menghitung konsentrasi larutan (molaritas larutan). Menganalisis faktor-faktor yang mempengaruhi laju reaksi (konsentrasi, luas permukaan,
Faktor-faktor yang Mempengaruhi Laju Reaksi
 Faktor-faktor yang Mempengaruhi Laju Reaksi Faktor yang mempengaruhi laju reaksi adalah sebagai berikut. Konsentrasi Jika konsentrasi suatu larutan makin besar, larutan akan mengandung jumlah partikel
Faktor-faktor yang Mempengaruhi Laju Reaksi Faktor yang mempengaruhi laju reaksi adalah sebagai berikut. Konsentrasi Jika konsentrasi suatu larutan makin besar, larutan akan mengandung jumlah partikel
BAB 9. KINETIKA KIMIA
 BAB 9 BAB 9. KINETIKA KIMIA 9.1 TEORI TUMBUKAN DARI LAJU REAKSI 9.2 TEORI KEADAAN TRANSISI DARI LAJU REAKSI 9.3 HUKUM LAJU REAKSI 9.4 FAKTOR-FAKTOR LAJU REAKSI 9.5 MEKANISME REAKSI 9.6 ENZIM SEBAGAI KATALIS
BAB 9 BAB 9. KINETIKA KIMIA 9.1 TEORI TUMBUKAN DARI LAJU REAKSI 9.2 TEORI KEADAAN TRANSISI DARI LAJU REAKSI 9.3 HUKUM LAJU REAKSI 9.4 FAKTOR-FAKTOR LAJU REAKSI 9.5 MEKANISME REAKSI 9.6 ENZIM SEBAGAI KATALIS
Bab 10 Kinetika Kimia
 D e p a r t e m e n K i m i a F M I P A I P B Bab 0 Kinetika Kimia http://chem.fmipa.ipb.ac.id Ikhtisar 2 3 Laju Reaksi Teori dalam Kinetika Kimia 4 Mekanisme Reaksi 5 46 Faktor Penentu Laju Reaksi Enzim
D e p a r t e m e n K i m i a F M I P A I P B Bab 0 Kinetika Kimia http://chem.fmipa.ipb.ac.id Ikhtisar 2 3 Laju Reaksi Teori dalam Kinetika Kimia 4 Mekanisme Reaksi 5 46 Faktor Penentu Laju Reaksi Enzim
wanibesak.wordpress.com
 1. Diberikan beberapa pernyataan 1) katalis dapat mempercepat laju reaksi dengan cara menaikan energi aktivasi 2) tahap penentu laju reaksi adalah tahap reaksi yang berlangsung paling lambat 3) laju reaksi
1. Diberikan beberapa pernyataan 1) katalis dapat mempercepat laju reaksi dengan cara menaikan energi aktivasi 2) tahap penentu laju reaksi adalah tahap reaksi yang berlangsung paling lambat 3) laju reaksi
RENCANA PELAKSANAAN PEMBELAJARAN (RPP) KELAS EKSPERIMEN PERTEMUAN KE-1
 RENCANA PELAKSANAAN PEMBELAJARAN (RPP) KELAS EKSPERIMEN PERTEMUAN KE-1 Sekolah : SMAN 3 Tangerang Selatan Mata Pelajaran : Kimia Kelas/ Semester : XI/ I Tahun Pelajaran : 010/011 Pokok Bahasan : Laju Reaksi
RENCANA PELAKSANAAN PEMBELAJARAN (RPP) KELAS EKSPERIMEN PERTEMUAN KE-1 Sekolah : SMAN 3 Tangerang Selatan Mata Pelajaran : Kimia Kelas/ Semester : XI/ I Tahun Pelajaran : 010/011 Pokok Bahasan : Laju Reaksi
SOAL LAJU REAKSI. Mol CaCO 3 = = 0.25 mol = 25. m Mr
 SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
LEMBAR KERJA SISWA 4
 88 LEMBAR KERJA SISWA 4 Mata Pelajaran Kelas/Semester Materi Pokok Submateri Pokok Alokasi Waktu : Kimia : I/ganjil : Laju Reaksi : Teori Tumbukan : 2 x 45 menit Standar Kompetensi Memahami Kinetika Reaksi,
88 LEMBAR KERJA SISWA 4 Mata Pelajaran Kelas/Semester Materi Pokok Submateri Pokok Alokasi Waktu : Kimia : I/ganjil : Laju Reaksi : Teori Tumbukan : 2 x 45 menit Standar Kompetensi Memahami Kinetika Reaksi,
Bahasan: Mempelajari kecepatan/laju reaksi suatu proses/perubahan kimia. reaksi berlangsung mekanisme reaksi
 Mempelajari kecepatan/laju reaksi suatu proses/perubahan kimia. Kinetika juga mempelajari bagaimana reaksi berlangsung mekanisme reaksi Referensi: Brown et.al; Chemistry, The Central Science, 11th edition
Mempelajari kecepatan/laju reaksi suatu proses/perubahan kimia. Kinetika juga mempelajari bagaimana reaksi berlangsung mekanisme reaksi Referensi: Brown et.al; Chemistry, The Central Science, 11th edition
KINETIKA REAKSI KIMIA TIM DOSEN KIMIA DASAR FTP UB 2012
 KINETIKA REAKSI KIMIA TIM DOSEN KIMIA DASAR FTP UB Konsep Kinetia/ Laju Reasi Laju reasi menyataan laju perubahan onsentrasi zat-zat omponen reasi setiap satuan watu: V [ M ] t Laju pengurangan onsentrasi
KINETIKA REAKSI KIMIA TIM DOSEN KIMIA DASAR FTP UB Konsep Kinetia/ Laju Reasi Laju reasi menyataan laju perubahan onsentrasi zat-zat omponen reasi setiap satuan watu: V [ M ] t Laju pengurangan onsentrasi
yang berkaitan dengan Laju Reaksi, diberikan pada tabel berikut ini.
 BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Hasil Penelitian Berdasarkan hasil pengumpulan data, persentase siswa SMA Negeri 1 Paguyaman, Kabupaten Boalemo yang memberikan jawaban untuk tiap item tes yang
BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Hasil Penelitian Berdasarkan hasil pengumpulan data, persentase siswa SMA Negeri 1 Paguyaman, Kabupaten Boalemo yang memberikan jawaban untuk tiap item tes yang
LAJU REAKSI MEKANISME REAKSI
 KINETIKA KIMIA LAJU REAKSI BAGAIMANA PERUB. KIMIA TSB BERLANGSUNG - BESI MUDAH BERKARAT PD UDARA YANG LEMBAB - MAKANAN LEBIH CEPAT BUSUK BILA TIDAK DIINGINKAN MEKANISME REAKSI - PENJUMLAHAN TAHAP TAHAP
KINETIKA KIMIA LAJU REAKSI BAGAIMANA PERUB. KIMIA TSB BERLANGSUNG - BESI MUDAH BERKARAT PD UDARA YANG LEMBAB - MAKANAN LEBIH CEPAT BUSUK BILA TIDAK DIINGINKAN MEKANISME REAKSI - PENJUMLAHAN TAHAP TAHAP
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
BAB IV HASIL PENELITIAN DAN PEMBAHASAN. Paguyaman yang berhubungan dengan materi laju reaksi diberikan dalam Tabel 2 berikut.
 BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Hasil Penelitian Dari hasil penelitian diperoleh presentase jawaban siswa kelas XI SMA Negeri 1 Paguyaman yang berhubungan dengan materi laju reaksi diberikan
BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Hasil Penelitian Dari hasil penelitian diperoleh presentase jawaban siswa kelas XI SMA Negeri 1 Paguyaman yang berhubungan dengan materi laju reaksi diberikan
Laju Reaksi KIM 2 A. KEMOLARAN B. LAJU REAKSI C. UNGKAPAN LAJU REAKSI LAJU REAKSI. materi78.co.nr
 Laju eaksi A. KEMOLAAN Dalam laju reaksi, besaran yang digunakan adalah kemolaran benda. Kemolaran menyatakan jumlah mol zat terlarut dari tiap liter larutan atau gas, menunjukkan kekentalan atau kepekatan.
Laju eaksi A. KEMOLAAN Dalam laju reaksi, besaran yang digunakan adalah kemolaran benda. Kemolaran menyatakan jumlah mol zat terlarut dari tiap liter larutan atau gas, menunjukkan kekentalan atau kepekatan.
KINETIKA KIMIA. SHINTA ROSALIA DEWI
 KINETIKA KIMIA. SHINTA ROSALIA DEWI Kinetika kimia Shinta Rosalia Dewi Pendahuluan Kinetika Reaksi Mekanika fluida mendesain reaktor kimia Pindah panas neraca massa ekonomi Termodinamika Pendahuluan (cont
KINETIKA KIMIA. SHINTA ROSALIA DEWI Kinetika kimia Shinta Rosalia Dewi Pendahuluan Kinetika Reaksi Mekanika fluida mendesain reaktor kimia Pindah panas neraca massa ekonomi Termodinamika Pendahuluan (cont
LAPORAN PRAKTIKUM DINAMIKA KIMIA JUDUL PERCOBAAN : PENENTUAN LAJU REAKSI IODINASI ASETON DALAM SUASANA ASAM. Nama : SantiNurAini NRP :
 LAPORAN PRAKTIKUM DINAMIKA KIMIA JUDUL PERCOBAAN : PENENTUAN LAJU REAKSI IODINASI ASETON DALAM SUASANA ASAM Nama : SantiNurAini NRP : 1413100048 Tanggal Praktikum : 28 April 2015 Nama Asisten : Mas Mattius
LAPORAN PRAKTIKUM DINAMIKA KIMIA JUDUL PERCOBAAN : PENENTUAN LAJU REAKSI IODINASI ASETON DALAM SUASANA ASAM Nama : SantiNurAini NRP : 1413100048 Tanggal Praktikum : 28 April 2015 Nama Asisten : Mas Mattius
Laboratorium Kimia SMA... Praktikum II Kelas XI IPA Semester I Tahun Pelajaran.../...
 Laboratorium Kimia SMA... Praktikum II Kelas XI IPA Semester I Tahun Pelajaran.../... Judul : Faktor-Faktor yang Mempengaruhi Laju Reaksi Praktikan : mor Absen : Kelas : Tanggal : Lembar Kegiatan Siswa
Laboratorium Kimia SMA... Praktikum II Kelas XI IPA Semester I Tahun Pelajaran.../... Judul : Faktor-Faktor yang Mempengaruhi Laju Reaksi Praktikan : mor Absen : Kelas : Tanggal : Lembar Kegiatan Siswa
PRAKTIKUM KIMIA DASAR I KECEPATAN REAKSI. Kelompok V : Amir Hamzah Umi Kulsum
 PRAKTIKUM KIMIA DASAR I KECEPATAN REAKSI Kelompok V : Amir Hamzah 1415005 Umi Kulsum 1415018 AKADEMI KIMIA ANALISIS CARAKA NUSANTARA CIMANGGIS, KELAPA DUA DEPOK, 2015 BAB 1 PENDAHULUAN 1.1 Latar Belakang
PRAKTIKUM KIMIA DASAR I KECEPATAN REAKSI Kelompok V : Amir Hamzah 1415005 Umi Kulsum 1415018 AKADEMI KIMIA ANALISIS CARAKA NUSANTARA CIMANGGIS, KELAPA DUA DEPOK, 2015 BAB 1 PENDAHULUAN 1.1 Latar Belakang
SOAL KIMIA 2 KELAS : XI IPA
 SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
tanya-tanya.com Soal No.2 Apabila anda diminta untuk mengukur laju reaksi terhadap reaksi : Zn(s) + 2HCI(aq)
 Soal No.1 Apa yang di maksud dengan laju reaksi dan satuan dari laju reaksi? Laju reaksi dinyatakan sebagai berkurangnya jumlah pereaksi untuk setiap satuan waktu atau bertambahnya jumlah hasil reaksi
Soal No.1 Apa yang di maksud dengan laju reaksi dan satuan dari laju reaksi? Laju reaksi dinyatakan sebagai berkurangnya jumlah pereaksi untuk setiap satuan waktu atau bertambahnya jumlah hasil reaksi
KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN
 KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN 1. Suatu reaksi dikatakan mencapai kesetimbangan apabila. A. laju reaksi ke kiri sama dengan ke kanan B. jumlah koefisien reaksi ruas kiri sama dengan ruas kanan
KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN 1. Suatu reaksi dikatakan mencapai kesetimbangan apabila. A. laju reaksi ke kiri sama dengan ke kanan B. jumlah koefisien reaksi ruas kiri sama dengan ruas kanan
LAPORAN PRAKTIKUM PERCOBAAN PRAKTKUM 1 LAJU REAKSI
 LAPORAN PRAKTIKUM PERCOBAAN PRAKTKUM 1 LAJU REAKSI DOSEN PENGAMPU : ANDI HIMYATUL HIDAYAH, S.Si.,Apt. DISUSUSN OLEH : FILDZAH MAULIDA NIM. 37.2016.7.1.81454 PROGRAM STUDI FARMASI FAKULTAS ILMU KESEHATAN
LAPORAN PRAKTIKUM PERCOBAAN PRAKTKUM 1 LAJU REAKSI DOSEN PENGAMPU : ANDI HIMYATUL HIDAYAH, S.Si.,Apt. DISUSUSN OLEH : FILDZAH MAULIDA NIM. 37.2016.7.1.81454 PROGRAM STUDI FARMASI FAKULTAS ILMU KESEHATAN
Soal Soal Kesetimbangan Kimia. Proses Haber-Bosch merupakan proses pembentukan atau produksi ammonia berdasarkan reaksi:
 Nama : Fitria Puspita NIM : 1201760 Kelas : Pendidikan Kimia A Soal Soal Kesetimbangan Kimia SBMPTN 2014 Untuk soal no 1-3, bacalah narasi berikut. Proses Haber-Bosch merupakan proses pembentukan atau
Nama : Fitria Puspita NIM : 1201760 Kelas : Pendidikan Kimia A Soal Soal Kesetimbangan Kimia SBMPTN 2014 Untuk soal no 1-3, bacalah narasi berikut. Proses Haber-Bosch merupakan proses pembentukan atau
KINETIKA KIMIA LAJU DAN MEKANISME DALAM REAKSI KIMIA
 KINETIKA KIMIA LAJU DAN MEKANISME DALAM REAKSI KIMIA Pendahuluan Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan koefisien seimbang Namun persamaan reaksi tidak dapat menjawab 3
KINETIKA KIMIA LAJU DAN MEKANISME DALAM REAKSI KIMIA Pendahuluan Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan koefisien seimbang Namun persamaan reaksi tidak dapat menjawab 3
Kesetimbangan Kimia. Tim Dosen Kimia Dasar FTP
 Kesetimbangan Kimia Tim Dosen Kimia Dasar FTP Pengertian kesetimbangan kimia Suatu sistem dikatakan setimbang jika dua proses yang berlawanan terjadi dengan laju yang sama atau dengan kata lain tidak terjadi
Kesetimbangan Kimia Tim Dosen Kimia Dasar FTP Pengertian kesetimbangan kimia Suatu sistem dikatakan setimbang jika dua proses yang berlawanan terjadi dengan laju yang sama atau dengan kata lain tidak terjadi
Soal-Soal. Bab 4. Latihan. Laju Reaksi. 1. Madu dengan massa jenis 1,4 gram/ cm 3 mengandung glukosa (M r. 5. Diketahui reaksi:
 Bab Laju Reaksi Soal-Soal Latihan. Madu dengan massa jenis, gram/ cm 3 mengandung glukosa (M r = 80) sebanyak 35 % b/b. Kemolaran glukosa dalam madu adalah... 0,8 M (D),7 M,8 M (E) 3,0 M, M. Untuk membuat
Bab Laju Reaksi Soal-Soal Latihan. Madu dengan massa jenis, gram/ cm 3 mengandung glukosa (M r = 80) sebanyak 35 % b/b. Kemolaran glukosa dalam madu adalah... 0,8 M (D),7 M,8 M (E) 3,0 M, M. Untuk membuat
Laporan Praktikum Kimia Laju Reaksi
 Laporan Praktikum Kimia Laju Reaksi Oleh: 1. Kurniawan Eka Yuda (5) 2. Tri Puji Lestari (23) 3. Rina Puspitasari (17) 4. Elva Alvivah Almas (11) 5. Rusti Nur Anggraeni (35) 6. Eki Aisyah (29) Kelas XI
Laporan Praktikum Kimia Laju Reaksi Oleh: 1. Kurniawan Eka Yuda (5) 2. Tri Puji Lestari (23) 3. Rina Puspitasari (17) 4. Elva Alvivah Almas (11) 5. Rusti Nur Anggraeni (35) 6. Eki Aisyah (29) Kelas XI
Kinetika Kimia dan Mekanisme Reaksi
 Kinetika Kimia dan Mekanisme Reaksi Kinetika Kimia Kinetika kimia adalah ilmu yang mempelajari laju reaksi, atau seberapa cepat proses reaksi berlangsung dalam waktu tertentu. Kinetika kimia menjelaskan
Kinetika Kimia dan Mekanisme Reaksi Kinetika Kimia Kinetika kimia adalah ilmu yang mempelajari laju reaksi, atau seberapa cepat proses reaksi berlangsung dalam waktu tertentu. Kinetika kimia menjelaskan
Gambar 2.1 Reaksi Saponifikasi tripalmitin
 I. JUDUL : Kinetika Reaksi Saponifikasi Etil Asetat II. TANGGAL PERCOBAAN : Rabu, 16 November 2011 III. TUJUAN : 1. Untuk memberikan gambaran bahwa reaksi penyabunan etil asetat oleh ion hidroksida adalah
I. JUDUL : Kinetika Reaksi Saponifikasi Etil Asetat II. TANGGAL PERCOBAAN : Rabu, 16 November 2011 III. TUJUAN : 1. Untuk memberikan gambaran bahwa reaksi penyabunan etil asetat oleh ion hidroksida adalah
Kesetimbangan Kimia. A b d u l W a h i d S u r h i m
 Kesetimbangan Kimia A b d u l W a h i d S u r h i m 2 0 1 4 Rujukan Chapter 12 dan 14: Masterton, William L. and Hurley, Cecile N. 2009. Chemistry: Principles and Reactions. Sixth Edition. Books/Cole.
Kesetimbangan Kimia A b d u l W a h i d S u r h i m 2 0 1 4 Rujukan Chapter 12 dan 14: Masterton, William L. and Hurley, Cecile N. 2009. Chemistry: Principles and Reactions. Sixth Edition. Books/Cole.
Kesetimbangan Kimia KIM 2 A. PENDAHULUAN B. REAKSI KESETIMBANGAN. α = KESETIMBANGAN KIMIA. materi78.co.nr. setimbang
 konsentrasi laju reaksi materi78.co.nr Kesetimbangan Kimia A. PENDAHULUAN Reaksi satu arah (irreversible) atau reaksi tidak dapat balik adalah reaksi yang terjadi pada satu arah, dan produknya tidak dapat
konsentrasi laju reaksi materi78.co.nr Kesetimbangan Kimia A. PENDAHULUAN Reaksi satu arah (irreversible) atau reaksi tidak dapat balik adalah reaksi yang terjadi pada satu arah, dan produknya tidak dapat
RENCANA PELAKSANAAN PEMBELAJARAN ( R P P )
 PEMERINTAH KOTA YOGYAKARTA DINAS PENDIDIKAN SMA NEGERI 6 YOGYAKARTA The Research School of Jogja Jalan C. Simanjuntak No Yogyakarta 55, Telepon 0 55/ Faximile 0 5660 E-mail : sman6@sman6-yogya.sch.id,
PEMERINTAH KOTA YOGYAKARTA DINAS PENDIDIKAN SMA NEGERI 6 YOGYAKARTA The Research School of Jogja Jalan C. Simanjuntak No Yogyakarta 55, Telepon 0 55/ Faximile 0 5660 E-mail : sman6@sman6-yogya.sch.id,
JURNAL PRAKTIKUM KIMIA LAJU REAKSI 24 MARET 2014
 JURNAL PRAKTIKUM KIMIA LAJU REAKSI 24 MARET 204 Oleh MIRRAH AGHNIA NAFILAH F (306200055) FITRIA KUSUMA WARDHANI (306200060) INTAN MUTHIAH AFIFAH (30620006) NUR AZIZAH APRIANI (306200064) PROGRAM STUDI
JURNAL PRAKTIKUM KIMIA LAJU REAKSI 24 MARET 204 Oleh MIRRAH AGHNIA NAFILAH F (306200055) FITRIA KUSUMA WARDHANI (306200060) INTAN MUTHIAH AFIFAH (30620006) NUR AZIZAH APRIANI (306200064) PROGRAM STUDI
KESETIMBANGAN. titik setimbang
 KESETIMBANGAN STANDART KOMPETENSI;. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang berpengaruh, serta penerapannya dalam kehidupan sehari-hari. KOMPETENSI DASAR;.. Menjelaskan kestimbangan
KESETIMBANGAN STANDART KOMPETENSI;. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang berpengaruh, serta penerapannya dalam kehidupan sehari-hari. KOMPETENSI DASAR;.. Menjelaskan kestimbangan
Laju reaksi menunjukkan perubahan konsentrasi pereaksi atau hasil reaksi persatuan waktu.
 Bab IV Laju Reaksi Sumber: Ebbing, General Chemistry Laju reaksi menunjukkan perubahan konsentrasi pereaksi atau hasil reaksi persatuan waktu. TUJUAN PEMBELAJARAN Setelah mengikuti pembelajaran siswa dapat
Bab IV Laju Reaksi Sumber: Ebbing, General Chemistry Laju reaksi menunjukkan perubahan konsentrasi pereaksi atau hasil reaksi persatuan waktu. TUJUAN PEMBELAJARAN Setelah mengikuti pembelajaran siswa dapat
Kode KIM.10. Laju Reaksi
 Kode KIM.10 Laju Reaksi BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN NASIONAL 2004 BAB I. PENDAHULUAN
Kode KIM.10 Laju Reaksi BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN NASIONAL 2004 BAB I. PENDAHULUAN
kimia KESETIMBANGAN KIMIA 2 Tujuan Pembelajaran
 KTSP & K-13 kimia K e l a s XI KESETIMBANGAN KIMIA 2 Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami faktor-faktor yang memengaruhi kesetimbangan.
KTSP & K-13 kimia K e l a s XI KESETIMBANGAN KIMIA 2 Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami faktor-faktor yang memengaruhi kesetimbangan.
MODUL KESETIMBANGAN. Perhatikan reaksi berikut
 MODUL KESETIMBANGAN Perhatikan reaksi berikut a.n 2 (g) + 3H 2 (g) 2NH 3 (g), di sebut juga reaksi... b. N 2 (g) + 3H 2 (g) 2NH 3 (g), di sebut juga reaksi... Perhatikan reaksi: Maka persamaan laju reaksi
MODUL KESETIMBANGAN Perhatikan reaksi berikut a.n 2 (g) + 3H 2 (g) 2NH 3 (g), di sebut juga reaksi... b. N 2 (g) + 3H 2 (g) 2NH 3 (g), di sebut juga reaksi... Perhatikan reaksi: Maka persamaan laju reaksi
OAL TES SEMESTER I. I. Pilihlah jawaban yang paling tepat! a. 2d d. 3p b. 2p e. 3s c. 3d 6. Unsur X dengan nomor atom
 KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka
 Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka waktu reaksi berlangsung pada suhu 90 o C Susu dipasteurisasi
Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka waktu reaksi berlangsung pada suhu 90 o C Susu dipasteurisasi
RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 2 JP
 RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 2 JP Standar Kompetensi 1. Memahami kinetika reaksi dan kesetimbangan kimia
RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 2 JP Standar Kompetensi 1. Memahami kinetika reaksi dan kesetimbangan kimia
KESETIMBANGAN KIMIA A. Pendahuluan 1. Latar Belakang Keadaan setimbang adalah suatu keadaaan dimana konsentrasi seluruh zat tidak lagi mengalami
 KESETIMBANGAN KIMIA A. Pendahuluan 1. Latar Belakang Keadaan setimbang adalah suatu keadaaan dimana konsentrasi seluruh zat tidak lagi mengalami perubahan, sebab zat-zat diruas kanan terbentuk dan terurai
KESETIMBANGAN KIMIA A. Pendahuluan 1. Latar Belakang Keadaan setimbang adalah suatu keadaaan dimana konsentrasi seluruh zat tidak lagi mengalami perubahan, sebab zat-zat diruas kanan terbentuk dan terurai
Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka
 Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka waktu reaksi berlangsung pada suhu 90 o C Susu dipasteurisasi
Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka waktu reaksi berlangsung pada suhu 90 o C Susu dipasteurisasi
SOAL-SOAL KESETIMBANGAN KIMIA
 H=+380 kj/mol SOAL-SOAL KESETIMBANGAN KIMIA 1. Ebtanas 99 Suatu reaksi berada dalam keadaan setimbang apabila A. Reaksi ke kanan dan kiri telah berhenti B. Mol pereaksi selalu sama dengan mol hasil reaksi
H=+380 kj/mol SOAL-SOAL KESETIMBANGAN KIMIA 1. Ebtanas 99 Suatu reaksi berada dalam keadaan setimbang apabila A. Reaksi ke kanan dan kiri telah berhenti B. Mol pereaksi selalu sama dengan mol hasil reaksi
Sulistyani, M.Si.
 Sulistyani, M.Si. Email: sulistyani@uny.ac.id Laju reaksi adalah laju pengurangan reaktan tiap satuan waktu atau laju pembentukan produk tiap satuan waktu. Laju reaksi dipengaruhi oleh: sifat dan keadan
Sulistyani, M.Si. Email: sulistyani@uny.ac.id Laju reaksi adalah laju pengurangan reaktan tiap satuan waktu atau laju pembentukan produk tiap satuan waktu. Laju reaksi dipengaruhi oleh: sifat dan keadan
Laporan Kimia Fisik KI-3141
 Laporan Kimia Fisik KI-3141 PERCOBN M-1 KINETIK HLOGENSI SETON DENGN KTLISTOR SM Nama : Kartika Trianita NIM : 1517 Kelompok : 2 Tanggal Percobaan : 22 Oktober 212 Tanggal Laporan : 2 November 212 sisten
Laporan Kimia Fisik KI-3141 PERCOBN M-1 KINETIK HLOGENSI SETON DENGN KTLISTOR SM Nama : Kartika Trianita NIM : 1517 Kelompok : 2 Tanggal Percobaan : 22 Oktober 212 Tanggal Laporan : 2 November 212 sisten
PERCOBAAN 3 PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI
 LAPORAN PRAKTIKUM KIMIA FISIKA Nama : Any Kurniawati Kelompok : 6 NIM : 4301410009 Prodi/Jurusan : Pend. Kimia/Kimia Dosen : Ir. Sri Wahyuni, M.Si Tanggal Praktikum : 19 September 2012 Teman kerja : Fitriya
LAPORAN PRAKTIKUM KIMIA FISIKA Nama : Any Kurniawati Kelompok : 6 NIM : 4301410009 Prodi/Jurusan : Pend. Kimia/Kimia Dosen : Ir. Sri Wahyuni, M.Si Tanggal Praktikum : 19 September 2012 Teman kerja : Fitriya
MODUL III KESETIMBANGAN KIMIA
 MODUL III KESETIMBANGAN KIMIA I. Petunjuk Umum 1. Kompetensi Dasar 1) Mahasiswa memahami Asas Le Chatelier 2) Mahasiswa mampu menjelaskan aplikasi reaksi kesetimbangan dalam dunia industry 3) Mahasiswa
MODUL III KESETIMBANGAN KIMIA I. Petunjuk Umum 1. Kompetensi Dasar 1) Mahasiswa memahami Asas Le Chatelier 2) Mahasiswa mampu menjelaskan aplikasi reaksi kesetimbangan dalam dunia industry 3) Mahasiswa
LAPORAN PRAKTIKUM KIMIA DASAR
 LAPORAN PRAKTIKUM KIMIA DASAR KECEPATAN REAKSI Disusun Oleh : 1. Achmad Zaimul Khaqqi (132500030) 2. Dinda Kharisma Asmara (132500014) 3. Icha Restu Maulidiah (132500033) 4. Jauharatul Lailiyah (132500053)
LAPORAN PRAKTIKUM KIMIA DASAR KECEPATAN REAKSI Disusun Oleh : 1. Achmad Zaimul Khaqqi (132500030) 2. Dinda Kharisma Asmara (132500014) 3. Icha Restu Maulidiah (132500033) 4. Jauharatul Lailiyah (132500053)
PENGARUH KATALISIS TERHADAP TETAPAN LAJU
 PENGARUH KATALISIS TERHADAP TETAPAN LAJU Laju reaksi sering dipengaruhi oleh adanya katalis Contoh : Hidrolisis sukrosa dalam air Suhu kamar lama (bisa beberapa bulan) Namun jika hidrolisis dilakukan dalam
PENGARUH KATALISIS TERHADAP TETAPAN LAJU Laju reaksi sering dipengaruhi oleh adanya katalis Contoh : Hidrolisis sukrosa dalam air Suhu kamar lama (bisa beberapa bulan) Namun jika hidrolisis dilakukan dalam
LAPORAN PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI
 LAPORAN PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI I. Tujuan Percobaan 1. Mempelajari pengaruh suhu terhadap laju reaksi 2. Menghitung energi aktivasi (Ea) dengan menggunakan persamaan Arrhenius II. Dasar
LAPORAN PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI I. Tujuan Percobaan 1. Mempelajari pengaruh suhu terhadap laju reaksi 2. Menghitung energi aktivasi (Ea) dengan menggunakan persamaan Arrhenius II. Dasar
kimia KTSP & K-13 KESETIMBANGAN KIMIA 1 K e l a s A. Reaksi Kimia Reversible dan Irreversible Tujuan Pembelajaran
 KTSP & K-13 kimia K e l a s XI KESETIMBANGAN KIMIA 1 Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami definisi reaksi kimia reversible dan irreversible..
KTSP & K-13 kimia K e l a s XI KESETIMBANGAN KIMIA 1 Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami definisi reaksi kimia reversible dan irreversible..
KINETIKA REAKSI PEMBUATAN KALSIUM KARBONAT DARI LIMBAH PUPUK ZA DENGAN PROSES SODA. Suprihatin, Ambarita R.
 KINETIKA REAKSI PEMBUATAN KALSIUM KARBONAT DARI LIMBAH PUPUK ZA DENGAN PROSES SODA Suprihatin, Ambarita R. Jurusan Teknik Kimia, Fakultas Teknologi Industri UPN Veteran Jawa Timur Jl. Raya Rungkut Madya
KINETIKA REAKSI PEMBUATAN KALSIUM KARBONAT DARI LIMBAH PUPUK ZA DENGAN PROSES SODA Suprihatin, Ambarita R. Jurusan Teknik Kimia, Fakultas Teknologi Industri UPN Veteran Jawa Timur Jl. Raya Rungkut Madya
No Indikator Soal Valid
 107 Lampiran 3 Rekapitulasi asi Instrumen TDM-TWO-TIER No Indikator Soal 1 Memahami kesetimbangan Reaksi kesetimbangan antara N 2 O 4 dengan NO 2 mengikuti persamaan kimia berikut ini : ator 1 :- dinamis
107 Lampiran 3 Rekapitulasi asi Instrumen TDM-TWO-TIER No Indikator Soal 1 Memahami kesetimbangan Reaksi kesetimbangan antara N 2 O 4 dengan NO 2 mengikuti persamaan kimia berikut ini : ator 1 :- dinamis
HAND OUT KIMIA XI IPA BAB III LAJU REAKSI
 HAND OUT KIMIA XI IPA BAB III LAJU REAKSI 1 BAB III LAJU REAKSI I. Standarkompetensi Memahami Kinetika reaksi, kesetimbangan kimia dan factor-faktor yang mempengaruhinya serta penerapannya dalam kehidupan
HAND OUT KIMIA XI IPA BAB III LAJU REAKSI 1 BAB III LAJU REAKSI I. Standarkompetensi Memahami Kinetika reaksi, kesetimbangan kimia dan factor-faktor yang mempengaruhinya serta penerapannya dalam kehidupan
BAB II KAJIAN PUSTAKA. salah yang artinya tidak benar, tidak betul atau keliru. Jadi, kesalahan dalam memecahkan
 BAB II KAJIAN PUSTAKA. Kesalahan Pemahaman Siswa Kesalahan menurut kamus besar Bahasa Indonesia (007:98) berasal dari kata dasar salah yang artinya tidak benar, tidak betul atau keliru. Jadi, kesalahan
BAB II KAJIAN PUSTAKA. Kesalahan Pemahaman Siswa Kesalahan menurut kamus besar Bahasa Indonesia (007:98) berasal dari kata dasar salah yang artinya tidak benar, tidak betul atau keliru. Jadi, kesalahan
LAPORAN PRAKTIKUM KIMIA FISIKA PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI
 LAPORAN PRAKTIKUM KIMIA FISIKA PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI OLEH : KELOMPOK III Nama : Rifqi Munip (061330401022) Riska (061330401023) Sarah Swasti Putri (061330401024) Siti Nurjanah (061330401025)
LAPORAN PRAKTIKUM KIMIA FISIKA PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI OLEH : KELOMPOK III Nama : Rifqi Munip (061330401022) Riska (061330401023) Sarah Swasti Putri (061330401024) Siti Nurjanah (061330401025)
Laporan Kimia Fisik KI-3141
 Laporan Kimia Fisik KI-3141 PERCOBAAN M-2 PENENTUAN LAJU REAKSI DAN TETAPAN LAJU REAKSI Nama : Kartika Trianita NIM : 10510007 Kelompok : 2 Tanggal Percobaan : 2 November 2012 Tanggal Laporan : 9 November
Laporan Kimia Fisik KI-3141 PERCOBAAN M-2 PENENTUAN LAJU REAKSI DAN TETAPAN LAJU REAKSI Nama : Kartika Trianita NIM : 10510007 Kelompok : 2 Tanggal Percobaan : 2 November 2012 Tanggal Laporan : 9 November
Termodinamika dan Kesetimbangan Kimia
 Termodinamika dan Kesetimbangan Kimia Dalam kesetimbangan kimia terdapat 2 reaksi yaitu reaksi irreversible dan reaksi reversible. Reaksi irreversible (reaksi searah) adalah reaksi yang berlangsung searah.
Termodinamika dan Kesetimbangan Kimia Dalam kesetimbangan kimia terdapat 2 reaksi yaitu reaksi irreversible dan reaksi reversible. Reaksi irreversible (reaksi searah) adalah reaksi yang berlangsung searah.
KEMOLARAN. M = n/v. M = g/mr x 1000/V
 KEMOLARAN Kemolaran atau molaritas menyatakan konsentrasi dari suatu larutan yang menggambarkan jumlah mol zat terlarut dalam setiap liter larutan.kemolaran berkaitan dengan jumlah mol dan volume larutan.hubungan
KEMOLARAN Kemolaran atau molaritas menyatakan konsentrasi dari suatu larutan yang menggambarkan jumlah mol zat terlarut dalam setiap liter larutan.kemolaran berkaitan dengan jumlah mol dan volume larutan.hubungan
Kesetimbangan Kimia. Bab 4
 Kesetimbangan Kimia Bab 4 Standar Kompetensi 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang memengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri Kompetensi
Kesetimbangan Kimia Bab 4 Standar Kompetensi 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang memengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri Kompetensi
Pengaruh Suhu Q10. Dhadhang Wahyu Kurniawan Laboratorium Farmasetika Unsoed
 Pengaruh Suhu Q10 Dhadhang Wahyu Kurniawan Laboratorium Farmasetika Unsoed http://dhadhang.wordpress.com Twitter: Dhadhang_WK Facebook: Dhadhang Wahyu Kurniawan 10/20/2015 1 Faktor-faktor yang Mempengaruhi
Pengaruh Suhu Q10 Dhadhang Wahyu Kurniawan Laboratorium Farmasetika Unsoed http://dhadhang.wordpress.com Twitter: Dhadhang_WK Facebook: Dhadhang Wahyu Kurniawan 10/20/2015 1 Faktor-faktor yang Mempengaruhi
MODUL 1 TERMOKIMIA. A. Hukum Pertama Termodinamika. B. Kalor Reaksi
 MODUL 1 TERMOKIMIA Termokimia adalah ilmu yang mempelajari hubungan antara energi panas dan energi kimia. Sebagai prasyarat untuk mempelajari termokimia, kita harus mengetahui tentang perbedaan kalor (Q)
MODUL 1 TERMOKIMIA Termokimia adalah ilmu yang mempelajari hubungan antara energi panas dan energi kimia. Sebagai prasyarat untuk mempelajari termokimia, kita harus mengetahui tentang perbedaan kalor (Q)
TEORI TUMBUKAN PADA LAJU REAKSI KIMIA
 PENGEMBANGAN BAHAN AJAR TEORI TUMBUKAN PADA LAJU REAKSI KIMIA OLEH : Drs. I Wayan Suarsa, M.Si JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS UDAYANA 2017 Kata Pengantar Puji dan
PENGEMBANGAN BAHAN AJAR TEORI TUMBUKAN PADA LAJU REAKSI KIMIA OLEH : Drs. I Wayan Suarsa, M.Si JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS UDAYANA 2017 Kata Pengantar Puji dan
SAP-GARIS-GARIS BESAR PROGRAM PENGAJARAN
 SAP-GARIS-GARIS BESAR PROGRAM PENGAJARAN Mata kuliah : Kimia Kode : Kim 101/3(2-3) Deskripsi : Mata kuliah ini membahas konsep-konsep dasar kimia yang disampaikan secara sederhana, meliputi pengertian
SAP-GARIS-GARIS BESAR PROGRAM PENGAJARAN Mata kuliah : Kimia Kode : Kim 101/3(2-3) Deskripsi : Mata kuliah ini membahas konsep-konsep dasar kimia yang disampaikan secara sederhana, meliputi pengertian
MODUL I Pembuatan Larutan
 MODUL I Pembuatan Larutan I. Tujuan percobaan - Membuat larutan dengan metode pelarutan padatan. - Melakukan pengenceran larutan dengan konsentrasi tinggi untuk mendapatkan larutan yang diperlukan dengan
MODUL I Pembuatan Larutan I. Tujuan percobaan - Membuat larutan dengan metode pelarutan padatan. - Melakukan pengenceran larutan dengan konsentrasi tinggi untuk mendapatkan larutan yang diperlukan dengan
Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam
 Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam sistem pada kesetimbangan Uap mengembun dengan laju
Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam sistem pada kesetimbangan Uap mengembun dengan laju
H 2 O (l) H 2 O (g) Kesetimbangan kimia. N 2 O 4 (g) 2NO 2 (g)
 Purwanti Widhy H Kesetimbangan adalah suatu keadaan di mana tidak ada perubahan yang terlihat seiring berjalannya waktu. Kesetimbangan kimia tercapai jika: Laju reaksi maju dan laju reaksi balik sama besar
Purwanti Widhy H Kesetimbangan adalah suatu keadaan di mana tidak ada perubahan yang terlihat seiring berjalannya waktu. Kesetimbangan kimia tercapai jika: Laju reaksi maju dan laju reaksi balik sama besar
HASIL KALI KELARUTAN (Ksp)
 LAPORAN PRAKTIKUM KIMIA FISIKA HASIL KALI KELARUTAN (Ksp) NAMA : YUSI ANDA RIZKY NIM : H311 08 003 KELOMPOK : II (DUA) HARI/TGL PERC. : SENIN/08 MARET 2010 ASISTEN : FITRI JUNIANTI LABORATORIUM KIMIA FISIKA
LAPORAN PRAKTIKUM KIMIA FISIKA HASIL KALI KELARUTAN (Ksp) NAMA : YUSI ANDA RIZKY NIM : H311 08 003 KELOMPOK : II (DUA) HARI/TGL PERC. : SENIN/08 MARET 2010 ASISTEN : FITRI JUNIANTI LABORATORIUM KIMIA FISIKA
BAB II DASAR TEORI. FeO. CO Fe CO 2. Fe 3 O 4. Fe 2 O 3. Gambar 2.1. Skema arah pergerakan gas CO dan reduksi
 BAB II DASAR TEORI Pengujian reduksi langsung ini didasari oleh beberapa teori yang mendukungnya. Berikut ini adalah dasar-dasar teori mengenai reduksi langsung yang mendasari penelitian ini. 2.1. ADSORPSI
BAB II DASAR TEORI Pengujian reduksi langsung ini didasari oleh beberapa teori yang mendukungnya. Berikut ini adalah dasar-dasar teori mengenai reduksi langsung yang mendasari penelitian ini. 2.1. ADSORPSI
Materi pelajaran Biologi. Disusun oleh: Dra. Tetty Afianti.
 Materi pelajaran Biologi kelas 11 Disusun oleh: Dra. Tetty Afianti KECEPATAN REAKSI Diriwayatkan dari Umar abi Salamah ra. : Aku seorang anak laki-laki di bawah asuhan Rasulullah Saw dan tanganku biasa
Materi pelajaran Biologi kelas 11 Disusun oleh: Dra. Tetty Afianti KECEPATAN REAKSI Diriwayatkan dari Umar abi Salamah ra. : Aku seorang anak laki-laki di bawah asuhan Rasulullah Saw dan tanganku biasa
SILABUS Sekolah : SMA Negeri 5 Surabaya Mata Pelajaran : Kimia Kelas/semester : XI/1 Referensi : BSNP / CIE Standar Kompetensi
 SILABUS Sekolah : SMA Negeri 5 Surabaya Mata Pelajaran : Kimia Kelas/semester : /1 Referensi : BSNP / CIE Standar Kompetensi : 1.Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur
SILABUS Sekolah : SMA Negeri 5 Surabaya Mata Pelajaran : Kimia Kelas/semester : /1 Referensi : BSNP / CIE Standar Kompetensi : 1.Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur
Perubahan konsentrasi reaktan atau produk terhadap waktu. Secara matematis, untuk reaksi: A B Laju reaksi = r = -d[a]/dt = d[b]/dt
![Perubahan konsentrasi reaktan atau produk terhadap waktu. Secara matematis, untuk reaksi: A B Laju reaksi = r = -d[a]/dt = d[b]/dt Perubahan konsentrasi reaktan atau produk terhadap waktu. Secara matematis, untuk reaksi: A B Laju reaksi = r = -d[a]/dt = d[b]/dt](/thumbs/52/30298935.jpg) 1 Laju reaksi (r) Perubahan konsentrasi reaktan atau produk terhadap waktu Pengurangan konsentrasi reaktan Penambahan konsentrasi produk Dengan berjalannya waktu Secara matematis, untuk reaksi: A B Laju
1 Laju reaksi (r) Perubahan konsentrasi reaktan atau produk terhadap waktu Pengurangan konsentrasi reaktan Penambahan konsentrasi produk Dengan berjalannya waktu Secara matematis, untuk reaksi: A B Laju
10 mlhcl2 M. 10 ml HCl2 M. Na 2 S 2 O 3 0,2 M KIM/ IND- II
 10 mlhcl2 M 10 ml HCl2 M 10 mlhcl2 M Na 2 S 2 O 3 0,2 M Na 2 S 2 O 3 0,2 M Na 2 S 2 O 3 0,2 M KIM/ IND- II BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL
10 mlhcl2 M 10 ml HCl2 M 10 mlhcl2 M Na 2 S 2 O 3 0,2 M Na 2 S 2 O 3 0,2 M Na 2 S 2 O 3 0,2 M KIM/ IND- II BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL
II. KOMPETENSI DASAR 3.1 Mendeskripsikan pengertian laju reaksi dengan melakukan percobaan tentang faktor-faktor yang mempengaruhi laju reaksi.
 RENCANA PELAKSANAAN PEMBELAJARAN (RPP) LAJU REAKSI SEKOLAH : SMAN 6 SURABAYA MATA PELAJARAN : KIMIA KELAS / SEMESTER : XI / (satu) PERTEMUAN KE : 3 ALOKASI WAKTU : 6 Jam Pelajaran I. STANDAR KOMPETENSI
RENCANA PELAKSANAAN PEMBELAJARAN (RPP) LAJU REAKSI SEKOLAH : SMAN 6 SURABAYA MATA PELAJARAN : KIMIA KELAS / SEMESTER : XI / (satu) PERTEMUAN KE : 3 ALOKASI WAKTU : 6 Jam Pelajaran I. STANDAR KOMPETENSI
Oleh. Dewi Candrawati
 126 Lampiran 4 Oleh Dewi Candrawati 2014 127 Petunjuk Pengerjaan: 1. Tes diagnostik ini terdiri dari delapan soal pilihan ganda dua tingkat. 2. Setiap soal memiliki 4 pilihan jawaban dan 5 pilihan alasan.
126 Lampiran 4 Oleh Dewi Candrawati 2014 127 Petunjuk Pengerjaan: 1. Tes diagnostik ini terdiri dari delapan soal pilihan ganda dua tingkat. 2. Setiap soal memiliki 4 pilihan jawaban dan 5 pilihan alasan.
PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH
 PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH TAHUN 2016 Soal diketik ulang oleh urip rukim (www.urip.info)
PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH TAHUN 2016 Soal diketik ulang oleh urip rukim (www.urip.info)
Siswa diingatkan tentang struktur atom, bilangan kuantum, bentuk-bentuk orbital, dan konfigurasi elektron
 RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
MODUL KESETIMBANGAN. Perhatikan reaksi berikut
 MODUL KESETIMBANGAN Perhatikan reaksi berikut a.n 2 (g) + 3H 2 (g) 2NH 3 (g), di sebut juga reaksi... b. N 2 (g) + 3H 2 (g) 2NH 3 (g), di sebut juga reaksi... Perhatikan reaksi: Maka persamaan laju reaksi
MODUL KESETIMBANGAN Perhatikan reaksi berikut a.n 2 (g) + 3H 2 (g) 2NH 3 (g), di sebut juga reaksi... b. N 2 (g) + 3H 2 (g) 2NH 3 (g), di sebut juga reaksi... Perhatikan reaksi: Maka persamaan laju reaksi
HUBUNGAN ANTARA KONSENTRASI DAN TEMPERATUR TERHADAP LAJU REAKSI DAN NILAI ENERGI AKTIFASI
 HUBUNGAN ANTARA KONSENTRASI DAN TEMPERATUR TERHADAP LAJU REAKSI DAN NILAI ENERGI AKTIFASI Fitriyah*, Ikhsannudin, Ninda yerasetyo Lab. Kimi Dasar Jurusan Kimia Universitas Negeri Semarang Gedung D8 Lt
HUBUNGAN ANTARA KONSENTRASI DAN TEMPERATUR TERHADAP LAJU REAKSI DAN NILAI ENERGI AKTIFASI Fitriyah*, Ikhsannudin, Ninda yerasetyo Lab. Kimi Dasar Jurusan Kimia Universitas Negeri Semarang Gedung D8 Lt
PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP FAX KODE POS 60299
 PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP. 031-8415492 FAX 031-8430673 KODE POS 60299 ULANGAN AKHIR SEMESTER 2 (DUA) TAHUN PELAJARAN 2011 2012 Hari/Tanggal :
PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP. 031-8415492 FAX 031-8430673 KODE POS 60299 ULANGAN AKHIR SEMESTER 2 (DUA) TAHUN PELAJARAN 2011 2012 Hari/Tanggal :
KINETIKA REAKSI HIDROLISA PATI DARI KULIT NANGKA DENGAN KATALISATOR ASAM CHLORIDA MENGGUNAKAN TANGKI BERPENGADUK
 KINETIKA REAKSI HIDROLISA PATI DARI KULIT NANGKA DENGAN KATALISATOR ASAM CHLORIDA MENGGUNAKAN TANGKI BERPENGADUK Indra B.K. 1), Retno D. 2) Program Studi Teknik Kimia, Fakultas Teknologi Industri, UPN
KINETIKA REAKSI HIDROLISA PATI DARI KULIT NANGKA DENGAN KATALISATOR ASAM CHLORIDA MENGGUNAKAN TANGKI BERPENGADUK Indra B.K. 1), Retno D. 2) Program Studi Teknik Kimia, Fakultas Teknologi Industri, UPN
1. Ciri-Ciri Reaksi Kimia
 Apakah yang dimaksud dengan reaksi kimia? Reaksi kimia adalah peristiwa perubahan kimia dari zat-zat yang bereaksi (reaktan) menjadi zat-zat hasil reaksi (produk). Pada reaksi kimia selalu dihasilkan zat-zat
Apakah yang dimaksud dengan reaksi kimia? Reaksi kimia adalah peristiwa perubahan kimia dari zat-zat yang bereaksi (reaktan) menjadi zat-zat hasil reaksi (produk). Pada reaksi kimia selalu dihasilkan zat-zat
