yang berkaitan dengan Laju Reaksi, diberikan pada tabel berikut ini.
|
|
|
- Herman Sudirman
- 6 tahun lalu
- Tontonan:
Transkripsi
1 BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Hasil Penelitian Berdasarkan hasil pengumpulan data, persentase siswa SMA Negeri 1 Paguyaman, Kabupaten Boalemo yang memberikan jawaban untuk tiap item tes yang berkaitan dengan Laju Reaksi, diberikan pada tabel berikut ini. Tabel 4: Persentase siswa Kelas XI IPA Yang Memberikan Jawaban Item Tes Tentang Laju Reaksi Aspek yang diteliti Nomor Soal Persentase siswa yang Menjawab Benar Menjawab Salah Kriteria kemampuan Siswa A. Konsep Konsentrasi (kemolaran larutan). 1. Menghitung konsentrasi larutan ,53 18,60 29,07 60,47 81,4 70,94 B. Konsep laju reaksi berdasarkan perubahan konsentrasi pereaksi atau produk. 1. Konsep perubahan konsentrasi pereaksi atau produk. 2. Menghitung laju reaksi berdasarkan perubahan konsentrasi pereaksi atau produk ,27 9, ,85 83,73 90,7 0 58,14 baik C. Menganalisis faktorfaktor yang mempengaruhi laju reaksi (konsentrasi, luas permukaan, suhu, dan katalis) melalui percobaan. 1. Menganalisis faktor ,88 34, ,58 65,12 65, ,41 Kurang Kurang baik
2 faktor yang mempengaruhi laju reaksi (luas permukaan) D. Menafsirkan grafik dari data percobaan tentang faktor-faktor yang mempengaruhi laju reaksi 1. Menafsirkan grafik laju reaksi 4 11,62 88,38 E. Menjelaskan pengaruh konsentrasi, luas permukaan bidang sentuh dan suhu terhadap laju reaksi berdasarkan teori tumbukan. 1. Konsep faktor yang mempengaruhi laju reaksi berdasarkan teori tumbukan ,6 46,51 32,55 81,4 53,49 67,45 F. Membedakan diagram energi potensial dari reaksi kimia dengan menggunakan katalis dan yang tidak menggunakan katalis. 1. Konsep Membedakan diagram energi potensial dari reaksi kimia dengan menggunakan katalis dan yang tidak menggunakan katalis. 9 18,6 81,4 G. Menjelaskan pengertian, peranan katalis dan energi 10 32,55 67,45
3 pengaktifan dengan menggunakan diagram 1. Konsep peranan katalis dan energi pengaktifan dengan menggunakan diagram H. Menentukan orde reaksi 1. Menentukan orde reaksi , ,98 86, ,03 I. Menjelaskan peranan katalis dalam mahluk hidup dan industri 1. Menjelaskan peranan katalis pada industri 12 9,30 90,7 Rata-rata Total 32,12 67,87 Baik Catatan : Angka yang dicetak miring adalah harga rata-rata, dan angka yang dicetak merah adalah soal hitungan yang di identifikasi 4.2 Pembahasan Hasil Penelitian Data pada Tabel 4 diperoleh persentase rata-rata total siswa yang mampu menjawab soal kimia materi Laju Reaksi sebesar 32,12%. Pembahasan lebih rinci untuk masing-masing aspek adalah sebagai berikut: Konsep Konsentrasi (Kemolaran Larutan). Berdasarkan data pada Tabel 4 diperoleh rata-rata 29,07% siswa yang mampu menghitung kemolaran dan konsentrasi larutan. Hal ini menunjukkan bahwa pemahaman siswa pada aspek tersebut termasuk dalam kategori sangat. Pemahaman siswa terhadap konsep kemolaran larutan dengan tepat dilihat dari jawaban yang diberikan. Fakta ini disebabkan siswa memahami konsep kemolaran dengan baik terutama dalam menghitung konsentrasi larutan.
4 Pada Tabel 4 sebanyak 39,53% siswa yang menjawab benar pada soal nomor 1. Hal tersebut menunjukkan bahwa siswa dapat menghitung volume campuran setelah penambahan Air pada larutan NaOH. Sedangkan siswa yang menjawab salah sebanyak 60,47%. Hal tersebut dapat dilihat dari jawaban yang diberikan oleh siswa sebanyak 13,9% obsen D, 4,4% obsen A, 34,9% obsen B yang merupakan jawaban benar, dan 44,2% obsen C. Ketidakmampuan siswa dalam hal ini bisa disebabkan karena siswa cenderung memahami konsep kemolaran dengan baik terutama dalam menghitung volume campuran atau molaritas campuran. Berdasarkan jawaban yag diberikan bisa juga disebabkan karena pembelajaran yang diberikan oleh guru menitikberatkan pada materi yang dianggap sulit oleh siswa. Pada Tabel 4 soal nomor 3 diperoleh sebanyak 18,60% siswa yang menjawab benar karena mereka memahami konsep kemolaran dengan tepat sehingga meskipun konsep dalam soal diubah, namun mereka masih mampu untuk menyelesaikannya. Sedangkan sebanyak 81,4% siswa yang menjawab salah. Kenyataan ini menandakan bahwa pemahaman siswa pada aspek tersebut termasuk dalam kategori sangat. Penyebab kesalahan ini yaitu siswa belum memahami konsep kemolaran dengan tepat. Dari fakta diatas dapat dijelaskan penyebab utama ketidakmampuan siswa terletak pada pemahaman siswa yang sangat terhadap konsep kemolaran pada materi laju reaksi. Hal tersebut dapat dibuktikan dengan hasil persentase jawaban siswa tiap obsen yaitu sebanyak 23,26% memilih obsen A (jawaban benar), 39,5% obsen B, 23,26% obsen C serta D 9,3%.
5 4.2.2 Konsep Laju Reaksi Berdasarkan Perubahan Konsentrasi Pereaksi Atau Produk. Berdasarkan data pada Tabel 4 diperoleh rata-rata 41,85% siswa mampu memahami konsep laju reaksi berdasarkan perubahan konsentrasi pereaksi atau produk. konsep laju reaksi berdasarkan perubahan konsentrasi pereaksi atau produk ditinjau dari laju bertambahnya konsentrasi produk dalam satu satuan waktu ketika penambahan pada reaktan kemudian menghitung laju reaksi berdasarkan perubahan konsentrasi pereaksi atau produk. Hal ini termasuk dalam kategori sangat. Penyebabnya adalah siswa memahami masingmasing konsep yang terkandung dalam indikator. Pada soal nomor 2 mengenai laju bertambahnya konsentrasi produk dalam satu satuan waktu berdasarkan reaksi 4NH 3(g) + 5O 2(g) 4NO (g) + 6H 2 O (g) maka laju NO akan bertambah. Berdasarkan hal tersebut persentase dari siswa menjawab benar sebanyak 16,27%. Sedangkan siswa yang menjawab salah sebesar 83,73%. Hal ini menunjukkan bahwa kemampuan siswa dalam menyelesaikan soal tersebut dapat dikategorikan sangat. Penyebab kesalahan siswa dalam soal tersebut karena memahami konsep laju reaksi berdasarkan perubahan konsentrasi produk, dimana mereka menganggap bahwa laju bernya konsentrasi H 2 O dalam satu satuan waktu (pilihan jawaban B) berdasarkan persamaan reaksi diatas. Persentase jawaban siswa tiap obsen yaitu: sebanyak 32,6% A, 11,6% B, 26,7% C, serta D hanya sebesar 13,9% jawaban benar yang dipilih oleh siswa
6 Soal berikutnya yang ditunjukan oleh soal nomor 5 yakni menghitung laju reaksi perubahan konsentrasi pereaksi atau produk berdasarkan persamaan reaksi 2A + B A 2 B. Persentase siswa yang menjawab benar sebanyak 9,30%, sedangkan siswa yang menjawab salah sebesar 90,7%. Fakta ini menunjukan bahwa pemahaman siswa pada aspek ini termasuk dalam kategori sangat sehingga kemampuan mereka dalam menyelesaikan soal hitungan khususnya menghitung laju reaksi belum tepat. Menentukan laju reaksi setelah 25% A bereaksi maka hal yang paling utama dicari adalah 25% zat A yang bereaksi setelah diketahui mol zat A mula-mula, untuk memperoleh sisa zat setelah bereaksi maka mol zat A mula-mula dii mol zat a setelah bereaksi. Kemudian masukan formula rumus v = k[a][b] maka akan diketahui hasilnya. Namun hanya 6,9% yang menjawab benar yaitu obsen B, 34,9% obsen A, 27,9% C, dan D 20,9%. Soal nomor 13 Berdasarkan data pada Tabel 4 merupakan soal essay yang membutuhkan cara penyelesaian siswa dari minimal diketahui sampai benar menulis formula rumusnya. Dalam penyelesaian soal ini 100% siswa mampu menjawab benar. Selain pemahaman mereka mengenai penentuan konsentrasi campuran. Kemampuan mereka dalam menyelesaikan soal khususnya hitungan dari penulisan minimal diketahui sampai benar menulis formula rumus pun hampir semua tepat. Fakta ini menunjukan pemahaman siswa dalam menyelesaikan soal tersebut termasuk dalam kategori sangat baik. Jawaban yang diberikan mulai dari diketahui V 1, V 2, M 1, M 2 dan ditanya konsentrasi campuran hingga penyelesaian menggunakan formula rumus ditulis dengan tepat.
7 4.2.3 Menganalisis Faktor-Faktor Yang Mempengaruhi Laju Reaksi (Konsentrasi, Luas Permukaan, Suhu, Dan Katalis) Melalui Percobaan. Berdasarkan data pada Tabel 4 diperoleh rata-rata siswa yang menjawab benar 56,58%. Fakta ini menunjukan pemahaman siswa dalam menyelesaikan soal tersebut termasuk dalam kategori cukup baik. Sementara rata-rata siswa yang belum mampu menjawab dengan benar atau salah sebesar 43,41%. Dari 56,58% siswa yang menjawab benar, sebanyak 34,88% siswa menjawab benar pada soal nomor 6, sedangkan sebesar 65,12% menjawab salah. Soal berikutnya yang ditunjukan oleh soal nomor tujuh yakni menganalisis faktor-faktor yang mempengaruhi laju reaksi berdasarkan persamaan reaksi CaCO 3(s) + 2HCl (aq) CaCl 2(aq) + H 2 O (l) + CO 2(g) yang disediakan dalam bentuk tabel namun persentase siswa yang menjawab benar sama dengan persentase siswa menjawab benar pada soal nomor 6 yaitu hanya sekitar 34,88%. Dan persentase siswa yang menjawab salah pun lebih besar dari persentase jawaban benar yaitu sebanyak 65,12%. Persentase tiap-tiap obsen sebanyak 25,58% A, 2,33% B, 32,56% B (pilihan jawaban benar), dan 25,58% untuk obsen D. Hal ini menunjukan bahwa masih nya pemahaman siswa dalam menentukan faktor-faktor yang memepengaruhi laju reaksi. Sehingga aspek ini dikategorikan sangat. Kenyataan ini dikarenakan siswa mendapatkan kesulitan pada saat menentukan gambar wadah yang laju reaksinya dipengaruhi oleh faktor luas permukaan. Berdasarkan data pada Tabel 4 Soal nomor 15 merupakan soal essay yang membutuhkan analisis yang cermat oleh siswa. Persentase siswa dalam menyelesaikan soal ini sebanyak 100% siswa menjawab benar. Fakta ini
8 menunjukan pemahaman siswa dalam menyelesaikan soal tersebut termasuk dalam kategori sangat baik.. Hal ini disebabkan karena dalam menentukan pengaruh laju rekasi berdasarkan gambar yang telah di sajikan maka ke-2 tabung hanya dipengaruhi oleh luas permukaan bidang sentuh yaitu antara kepingan dan serbuk MgCO3 serta suhu air yang berbeda yaitu 25 C dan 35 C karena pelarut yang digunakan sama. Hampir semua mereka menjawab yang mempengaruhi laju reaksi berdasarkan gambar tersebut adalah luas permukaan dan bidang sentuh yang berbeda Menafsirkan Grafik Dari Data Percobaan Tentang Faktor-Faktor Yang Mempengaruhi Laju Reaksi Berdasarkan data pada Tabel 4 diperoleh rata-rata 11,62% siswa yang menjawab benar untuk soal nomor 4. Sedangkan sebanyak 88,38% siswa yang menjawab salah pada soal tersebut. Hal ini menunjukkan bahwa pemahaman siswa pada aspek tersebut termasuk dalam kategori sangat. Penyebab kesalahan siswa dalam soal tersebut karena memahami konsep penentuan grafik orde reaksi berdasarkan persmaan reaksi NO2 NO N O5 g 3 g 2 g yang merupakan grafik reaksi orde dua. Ketidakmampuan siswa dalam hal ini disebabkan karena siswa cenderung memahami konsep penentuan orde reaksi. Mereka berpikir bahwa reaksi tersebut merupakan reaksi orde satu sehingga sebanyak 51,16% memilih obsen D, 25,58% obsen C, 9,3% obsen B, dan hanya sedikit siswa yang menjawab benar yaitu 11,6% menjawab obsen A Menjelaskan Pengaruh Konsentrasi, Luas Permukaan Bidang Sentuh Dan Suhu Terhadap Laju Reaksi Berdasarkan Teori Tumbukan.
9 Berdasarkan data pada Tabel 4 soal nomor 8 sebanyak 18,6% siswa yang mampu menjelaskan pengaruh konsentrasi, luas permukaan bidang sentuh dan suhu terhadap laju reaksi berdasarkan teori tumbukan. Makin besar frekunsi tumbukan maka makin besar konsentrasi, makin luas permukaan, serta makin tinggi suhu sehingga semakin cepat rekasi dan banyak molekul yang mencapai energi pengaktifan. Namun hanya 23,36% menjawab benar (pilihan jawaban C), 26,7% memilih B, 41,86% D dan tdak ada satu pun yang memilih obsen A. Hal ini menunjukkan bahwa pemahaman siswa pada aspek tersebut termasuk dalam kategori sangat. Pemahaman siswa terhadap konsep faktor yang mempengaruhi laju reaksi berdasarkan teori tumbukan dengan tepat dilihat dari jawaban yang diberikan. Fakta ini disebabkan siswa memahami konsep laju reaksi berdasarkan teori tumbukan dengan baik sehingga siswa mengalami kesulitan saat menentukan faktor-faktor yang mempengaruhi laju reaksi berdasarkan teori tummbukan. Soal berikutnya yang ditunjukan oleh soal nomor 16 yakni menentukan laju pembentukan senyawa. Soal ini merupakan soal essay yang membutuhkan cara penyelesaian siswa dari minimal diketahui sampai benar menulis formula rumusnya. Dalam penyelesaian soal ini kebanyakan siswa hanya mampu menulis dari minimal diketahu dalam soal sampai apa yang ditanyakan dalam soal. Persentase siswa dalam menyelesaikan soal ini sebanyak 46,51% siswa menjawab benar. Sedangkan sebanyak 53,49% siswa yang menjawab salah pada soal tersebut. Hal ini menunjukkan bahwa pemahaman siswa pada aspek tersebut termasuk dalam kategori sangat. Ketidakmampuan siswa dalam hal ini
10 disebabkan karena siswa cenderung memahami konsep laju pembentukan senyawa. Dari uraian diatas diperoleh rata-rata total siswa yang menjawab benar untuk konsep laju reaksi berdasarkan teori tumbukan sebanyak 32,55% dan siswa yang mengalami kesulitan atau menjawab salah sebesar 67,45%. Hal ini menunjukkan bahwa kemampuan siswa dalam menyelesaikan soal tersebut dapat dikategorikan sangat Membedakan Diagram Energi Potensial Dari Reaksi Kimia Dengan Menggunakan Katalis Dan Yang Tidak Menggunakan Katalis. Berdasarkan data pada Tabel 4 diperoleh rata-rata 18,6% siswa yang menjawab benar untuk soal nomor 9. Sedangkan sebanyak 81,4% siswa yang menjawab salah pada soal tersebut. Hanya sedikit siswa yang mampu membedakan diagram energi potensial dari reaksi kimia dengan menggunakan katalis dan yang tidak menggunakan katalis. Karena katalis berfungsi menurunkan energi pengaktifan yaitu mempercepat laju reaksi dan menurunkan energi aktivasi namun tidak ikut bereaksi. Sebagian besar siswa memilih reaksi tanpa katalis yaitu sebanyak 51,26% obsen C, 6,9% D, 25,58% A, dan hanya sedikit yang memilih jawaban benar yaitu B sebanyak 13,9%. Hal ini menunjukkan bahwa pemahaman siswa pada aspek tersebut termasuk dalam kategori sangat. Ketidakmampuan siswa dalam hal ini disebabkan karena siswa cenderung memahami energi potensial dari reaksi kimia dengan menggunakan katalis dan tanpa menggunakan katalis.
11 4.2.7 Menjelaskan Pengertian, Peranan Katalis Dan Energi Pengaktifan Dengan Menggunakan Diagram. Berdasarkan data pada Tabel 4 untuk soal nomor 10 diperoleh rata-rata 32,55% siswa yang mampu menentukan menentukan peranan katalis dan energi pengaktifan dengan menggunakan diagram. Sementara itu sebanyak 67,45% siswa yang mengalami kesulitan dalam menentukan peranan katalis dan energi pengaktifan dengan menggunakan diagram. Karena pengaruh katalis adalah menurunkan energi aktivasi tapi hasil reaksi tetap, hal ini tidak dipahami oleh siswa. Mereka hanya mampu menentukan defenisi katalis namun konsepnya belum dipahami dengan baik sehingga hanya 34,9% menjawab benar yaitu obsen B, sementara itu sebanyak 32,56% menjawab D, 2,33% C, 20,9% A. Hal ini menunjukkan bahwa pemahaman siswa pada aspek tersebut termasuk dalam kategori sangat Menentukan Orde Reaksi Berdasarkan data pada Tabel 4 soal nomor 11 sekitar 13,95% siswa yang mampu menentukan orde reaksi. Hal ini menunjukkan bahwa pemahaman siswa pada aspek tersebut termasuk dalam kategori sangat. Pemahaman siswa terhadap konsep penentuan orde reaksi dengan tepat dilihat dari jawaban yang diberikan. Sebanyak 44,2% menjawab B, 27,9% menjawab D yaitu reaksi orde dua, 6,9% memilih A, dan hanya 13,9% yang menjawab benar obsen C yaitu reaksi orde satu. Fakta ini disebabkan siswa memahami konsep penentuan orde reaksi dengan baik sehingga siswa mengalami kesulitan saat menentukan orde reaksi yang untuk reaksi X Y P Q. Sedangkan sebesar
12 86,05% menjawab salah atau siswa mengalami kesulitan saat menentukan orde reaksi. Soal berikutnya yang ditunjukan oleh soal nomor 14 yakni menentukan orde reaksi. Soal ini merupakan soal essay yang membutuhkan cara penyelesaian siswa dari minimal diketahui sampai benar menulis formula rumusnya. Persentase siswa dalam menyelesaikan soal ini sebanyak 100% siswa menjawab benar. Fakta ini menunjukan pemahaman siswa dalam menyelesaikan soal tersebut termasuk dalam kategori sangat baik. Selain hal tersebut, cara penyelesaian soal siswa juga mendukung artinya mereka mampu menulis dari minimal soal itu diketahui sampai benar menulis formula rumusnya. Meskipun hasil akhir jawaban tersebut tepat namun siswa sudah mampu dalam mengidentifikasi soal. Dari uraian diatas diperoleh rata-rata total siswa yang menjawab benar untuk konsep penentuan orde reaksi sebanyak 56,98% dan siswa yang mengalami kesulitan atau menjawab salah sebesar 43,03%. Hal ini menunjukkan bahwa kemampuan siswa dalam menyelesaikan soal tersebut dapat dikategorikan cukup baik Menjelaskan Peranan Katalis Dalam Mahluk Hidup Dan Industri Berdasarkan data pada Tabel 4 soal nomor 12 diperoleh rata-rata 9,30% siswa yang mampu menentukan peranan katalis dalam mahluk hidup dan industri. Sementara itu sebanyak 90,7% siswa yang mengalami kesulitan dalam menentukan peranan katalis dalam mahluk hidup dan industri. Pemahaman siswa terhadap konsep peranan katalis dalam mahluk hidup dan industri dengan tepat
13 dilihat dari jawaban yang diberikan yaitu sebanyak 53,5% memilih obsen B, mereka tidak berpikir bahwa penggunakan vanadium pentaoksida dalam pembuatan SO 3 adalah sebagai katalis yaitu menurunkan energi aktivasi sehingga hanya 9,5% yang menjawab benar obsen C, sementara 6,12% memilih A, 9,5% memilih obsen D. Fakta ini disebabkan siswa memahami peranan katalis dalam mahluk hidup dan industri. Hal ini menunjukkan bahwa pemahaman siswa pada aspek tersebut termasuk dalam kategori sangat.
BAB IV HASIL PENELITIAN DAN PEMBAHASAN. Paguyaman yang berhubungan dengan materi laju reaksi diberikan dalam Tabel 2 berikut.
 BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Hasil Penelitian Dari hasil penelitian diperoleh presentase jawaban siswa kelas XI SMA Negeri 1 Paguyaman yang berhubungan dengan materi laju reaksi diberikan
BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Hasil Penelitian Dari hasil penelitian diperoleh presentase jawaban siswa kelas XI SMA Negeri 1 Paguyaman yang berhubungan dengan materi laju reaksi diberikan
BAB I PENDAHULUAN. keberhasilan proses pengajaran yang diterapkan pada siswa khususnya dan sekaligus
 1 BAB I PENDAHULUAN 1.1 Latar Belakang Masalah Hasil belajar siswa merupakan topik yang sangat menarik dan tidak pernah habis dibicarakan dalam dunia pendidikan, karena hasil belajar merupakan indikator
1 BAB I PENDAHULUAN 1.1 Latar Belakang Masalah Hasil belajar siswa merupakan topik yang sangat menarik dan tidak pernah habis dibicarakan dalam dunia pendidikan, karena hasil belajar merupakan indikator
Faktor-faktor yang Mempengaruhi Laju Reaksi
 Faktor-faktor yang Mempengaruhi Laju Reaksi Faktor yang mempengaruhi laju reaksi adalah sebagai berikut. Konsentrasi Jika konsentrasi suatu larutan makin besar, larutan akan mengandung jumlah partikel
Faktor-faktor yang Mempengaruhi Laju Reaksi Faktor yang mempengaruhi laju reaksi adalah sebagai berikut. Konsentrasi Jika konsentrasi suatu larutan makin besar, larutan akan mengandung jumlah partikel
kimia LAJU REAKSI 1 TUJUAN PEMBELAJARAN
 KTSP & K-13 kimia K e l a s XI LAJU REAKSI 1 TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konsep molaritas. 2. Memahami definisi dan faktor-faktor
KTSP & K-13 kimia K e l a s XI LAJU REAKSI 1 TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konsep molaritas. 2. Memahami definisi dan faktor-faktor
Kunci jawaban dan pembahasan soal laju reaksi
 Kunci jawaban dan pembahasan soal laju reaksi Soal nomor 1 Mencari volume yang dibutuhkan pada proses pengenceran. Rumus pengenceran V 1. M 1 = V 2. M 2 Misal volume yang dibutuhkan sebanyak x ml, maka
Kunci jawaban dan pembahasan soal laju reaksi Soal nomor 1 Mencari volume yang dibutuhkan pada proses pengenceran. Rumus pengenceran V 1. M 1 = V 2. M 2 Misal volume yang dibutuhkan sebanyak x ml, maka
wanibesak.wordpress.com
 1. Diberikan beberapa pernyataan 1) katalis dapat mempercepat laju reaksi dengan cara menaikan energi aktivasi 2) tahap penentu laju reaksi adalah tahap reaksi yang berlangsung paling lambat 3) laju reaksi
1. Diberikan beberapa pernyataan 1) katalis dapat mempercepat laju reaksi dengan cara menaikan energi aktivasi 2) tahap penentu laju reaksi adalah tahap reaksi yang berlangsung paling lambat 3) laju reaksi
LEMBAR KERJA SISWA 4
 88 LEMBAR KERJA SISWA 4 Mata Pelajaran Kelas/Semester Materi Pokok Submateri Pokok Alokasi Waktu : Kimia : I/ganjil : Laju Reaksi : Teori Tumbukan : 2 x 45 menit Standar Kompetensi Memahami Kinetika Reaksi,
88 LEMBAR KERJA SISWA 4 Mata Pelajaran Kelas/Semester Materi Pokok Submateri Pokok Alokasi Waktu : Kimia : I/ganjil : Laju Reaksi : Teori Tumbukan : 2 x 45 menit Standar Kompetensi Memahami Kinetika Reaksi,
Laboratorium Kimia SMA... Praktikum II Kelas XI IPA Semester I Tahun Pelajaran.../...
 Laboratorium Kimia SMA... Praktikum II Kelas XI IPA Semester I Tahun Pelajaran.../... Judul : Faktor-Faktor yang Mempengaruhi Laju Reaksi Praktikan : mor Absen : Kelas : Tanggal : Lembar Kegiatan Siswa
Laboratorium Kimia SMA... Praktikum II Kelas XI IPA Semester I Tahun Pelajaran.../... Judul : Faktor-Faktor yang Mempengaruhi Laju Reaksi Praktikan : mor Absen : Kelas : Tanggal : Lembar Kegiatan Siswa
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN
 BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN STANDAR KOMPETENSI 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan
BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN STANDAR KOMPETENSI 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan
SOAL LAJU REAKSI. Mol CaCO 3 = = 0.25 mol = 25. m Mr
 SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
PETA KONSEP LAJU REAKSI. Percobaan. Waktu perubahan. Hasil reaksi. Pereaksi. Katalis. Suhu pereaksi. Konsentrasi. Luas. permukaan.
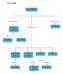 PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
Waktu (t) Gambar 3.1 Grafik hubungan perubahan konsentrasi terhadap waktu
 3 LAJU REAKSI Setelah mempelajari bab ini, kamu diharapkan mampu: Menghitung konsentrasi larutan (molaritas larutan). Menganalisis faktor-faktor yang mempengaruhi laju reaksi (konsentrasi, luas permukaan,
3 LAJU REAKSI Setelah mempelajari bab ini, kamu diharapkan mampu: Menghitung konsentrasi larutan (molaritas larutan). Menganalisis faktor-faktor yang mempengaruhi laju reaksi (konsentrasi, luas permukaan,
Laju Reaksi. Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I
 Laju Reaksi Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi,
Laju Reaksi Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi,
Laporan Praktikum Kimia Laju Reaksi
 Laporan Praktikum Kimia Laju Reaksi Oleh: 1. Kurniawan Eka Yuda (5) 2. Tri Puji Lestari (23) 3. Rina Puspitasari (17) 4. Elva Alvivah Almas (11) 5. Rusti Nur Anggraeni (35) 6. Eki Aisyah (29) Kelas XI
Laporan Praktikum Kimia Laju Reaksi Oleh: 1. Kurniawan Eka Yuda (5) 2. Tri Puji Lestari (23) 3. Rina Puspitasari (17) 4. Elva Alvivah Almas (11) 5. Rusti Nur Anggraeni (35) 6. Eki Aisyah (29) Kelas XI
BAB II KAJIAN PUSTAKA. kemampuan adalah karakteristik yang menonjol dari seorang individu yang
 BAB II KAJIAN PUSTAKA 2.1 Defenisi Kemampuan Kemampuan sama dengan kata kesanggupan atau kecakapan. Dengan bahasa yang lebih terperinci, kemampuan dapat diartikan sebagai kesanggupan individu untuk melakukan
BAB II KAJIAN PUSTAKA 2.1 Defenisi Kemampuan Kemampuan sama dengan kata kesanggupan atau kecakapan. Dengan bahasa yang lebih terperinci, kemampuan dapat diartikan sebagai kesanggupan individu untuk melakukan
A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI
 3 LAJU REAKSI A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI Materi dapat berubah dari bentuk yang satu ke bentuk yang
3 LAJU REAKSI A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI Materi dapat berubah dari bentuk yang satu ke bentuk yang
RENCANA PELAKSANAAN PEMBELAJARAN (RPP) KELAS EKSPERIMEN PERTEMUAN KE-1
 RENCANA PELAKSANAAN PEMBELAJARAN (RPP) KELAS EKSPERIMEN PERTEMUAN KE-1 Sekolah : SMAN 3 Tangerang Selatan Mata Pelajaran : Kimia Kelas/ Semester : XI/ I Tahun Pelajaran : 010/011 Pokok Bahasan : Laju Reaksi
RENCANA PELAKSANAAN PEMBELAJARAN (RPP) KELAS EKSPERIMEN PERTEMUAN KE-1 Sekolah : SMAN 3 Tangerang Selatan Mata Pelajaran : Kimia Kelas/ Semester : XI/ I Tahun Pelajaran : 010/011 Pokok Bahasan : Laju Reaksi
tanya-tanya.com Soal No.2 Apabila anda diminta untuk mengukur laju reaksi terhadap reaksi : Zn(s) + 2HCI(aq)
 Soal No.1 Apa yang di maksud dengan laju reaksi dan satuan dari laju reaksi? Laju reaksi dinyatakan sebagai berkurangnya jumlah pereaksi untuk setiap satuan waktu atau bertambahnya jumlah hasil reaksi
Soal No.1 Apa yang di maksud dengan laju reaksi dan satuan dari laju reaksi? Laju reaksi dinyatakan sebagai berkurangnya jumlah pereaksi untuk setiap satuan waktu atau bertambahnya jumlah hasil reaksi
BAB VI KINETIKA REAKSI KIMIA
 BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
MODUL LAJU REAKSI. Laju reaksi _ 2013 Page 1
 MODUL LAJU REAKSI Standar Kompetensi ( SK ) : Memahami kinetika reaksi, kesetimbangan kimia dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri. Kompetensi
MODUL LAJU REAKSI Standar Kompetensi ( SK ) : Memahami kinetika reaksi, kesetimbangan kimia dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri. Kompetensi
OAL TES SEMESTER I. I. Pilihlah jawaban yang paling tepat! a. 2d d. 3p b. 2p e. 3s c. 3d 6. Unsur X dengan nomor atom
 KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 2 JP
 RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 2 JP Standar Kompetensi 1. Memahami kinetika reaksi dan kesetimbangan kimia
RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 2 JP Standar Kompetensi 1. Memahami kinetika reaksi dan kesetimbangan kimia
Soal-Soal. Bab 4. Latihan. Laju Reaksi. 1. Madu dengan massa jenis 1,4 gram/ cm 3 mengandung glukosa (M r. 5. Diketahui reaksi:
 Bab Laju Reaksi Soal-Soal Latihan. Madu dengan massa jenis, gram/ cm 3 mengandung glukosa (M r = 80) sebanyak 35 % b/b. Kemolaran glukosa dalam madu adalah... 0,8 M (D),7 M,8 M (E) 3,0 M, M. Untuk membuat
Bab Laju Reaksi Soal-Soal Latihan. Madu dengan massa jenis, gram/ cm 3 mengandung glukosa (M r = 80) sebanyak 35 % b/b. Kemolaran glukosa dalam madu adalah... 0,8 M (D),7 M,8 M (E) 3,0 M, M. Untuk membuat
SOAL KIMIA 2 KELAS : XI IPA
 SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
Purwanti Widhy H, M.Pd. Laju Reaksi
 Purwanti Widhy H, M.Pd Laju Reaksi SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi, Kompetensi Dasar & Indikator
Purwanti Widhy H, M.Pd Laju Reaksi SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi, Kompetensi Dasar & Indikator
PRAKTIKUM KIMIA DASAR I KECEPATAN REAKSI. Kelompok V : Amir Hamzah Umi Kulsum
 PRAKTIKUM KIMIA DASAR I KECEPATAN REAKSI Kelompok V : Amir Hamzah 1415005 Umi Kulsum 1415018 AKADEMI KIMIA ANALISIS CARAKA NUSANTARA CIMANGGIS, KELAPA DUA DEPOK, 2015 BAB 1 PENDAHULUAN 1.1 Latar Belakang
PRAKTIKUM KIMIA DASAR I KECEPATAN REAKSI Kelompok V : Amir Hamzah 1415005 Umi Kulsum 1415018 AKADEMI KIMIA ANALISIS CARAKA NUSANTARA CIMANGGIS, KELAPA DUA DEPOK, 2015 BAB 1 PENDAHULUAN 1.1 Latar Belakang
Kritis Variabel Superordinat Koordinat Subordinat. reaksi. Katalis. Partikelpartikel. Molekul pereaksi dalam wadahnya selalu bergerak
 19 Tabel 2. Analisis konsep materi laju Label Konsep Laju Reaksi Definisi Konsep Menyatakan laju perubahan konsentrasi zatzat yaitu zat pe (reaktan) atau zat hasil (produk), setiap satuan waktu berlangsung
19 Tabel 2. Analisis konsep materi laju Label Konsep Laju Reaksi Definisi Konsep Menyatakan laju perubahan konsentrasi zatzat yaitu zat pe (reaktan) atau zat hasil (produk), setiap satuan waktu berlangsung
LEMBAR KERJA SISWA 2
 76 LEMBAR KERJA SISWA 2 Mata Pelajaran Kelas / Semester Materi pokok Submateri pokok Alokasi Waktu : Kimia : XI/ganjil : Laju Reaksi : Konsep Laju Reaksi : 2 x 45 menit Standar Kompetensi 3. Memahami Kinetika
76 LEMBAR KERJA SISWA 2 Mata Pelajaran Kelas / Semester Materi pokok Submateri pokok Alokasi Waktu : Kimia : XI/ganjil : Laju Reaksi : Konsep Laju Reaksi : 2 x 45 menit Standar Kompetensi 3. Memahami Kinetika
Laju reaksi menunjukkan perubahan konsentrasi pereaksi atau hasil reaksi persatuan waktu.
 Bab IV Laju Reaksi Sumber: Ebbing, General Chemistry Laju reaksi menunjukkan perubahan konsentrasi pereaksi atau hasil reaksi persatuan waktu. TUJUAN PEMBELAJARAN Setelah mengikuti pembelajaran siswa dapat
Bab IV Laju Reaksi Sumber: Ebbing, General Chemistry Laju reaksi menunjukkan perubahan konsentrasi pereaksi atau hasil reaksi persatuan waktu. TUJUAN PEMBELAJARAN Setelah mengikuti pembelajaran siswa dapat
LEMBARAN SOAL 5. Pilih satu jawaban yang benar!
 LEMBARAN SOAL 5 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
LEMBARAN SOAL 5 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
SILABUS PEMBELAJARAN
 SILABUS PEMBELAJARAN Nama Sekolah : SMA... mata Pelajaran : KIMIA Kelas/Semester : XI/1 Standar Kompetensi : 3. Memahami kinetika, kimia dan nya, serta penerapannya dalam kehidupan sehari-hari dan industri.
SILABUS PEMBELAJARAN Nama Sekolah : SMA... mata Pelajaran : KIMIA Kelas/Semester : XI/1 Standar Kompetensi : 3. Memahami kinetika, kimia dan nya, serta penerapannya dalam kehidupan sehari-hari dan industri.
SILABUS PEMBELAJARAN
 SILABUS PEMBELAJARAN Nama Sekolah : SMA... mata Pelajaran : KIMIA Kelas/Semester : XI/1 Standar Kompetensi : 1. Memahami struktur atom dan meramalkan sifat-sifat periodik unsur, struktur molekul dan dan
SILABUS PEMBELAJARAN Nama Sekolah : SMA... mata Pelajaran : KIMIA Kelas/Semester : XI/1 Standar Kompetensi : 1. Memahami struktur atom dan meramalkan sifat-sifat periodik unsur, struktur molekul dan dan
Gambar 2.1 Reaksi Saponifikasi tripalmitin
 I. JUDUL : Kinetika Reaksi Saponifikasi Etil Asetat II. TANGGAL PERCOBAAN : Rabu, 16 November 2011 III. TUJUAN : 1. Untuk memberikan gambaran bahwa reaksi penyabunan etil asetat oleh ion hidroksida adalah
I. JUDUL : Kinetika Reaksi Saponifikasi Etil Asetat II. TANGGAL PERCOBAAN : Rabu, 16 November 2011 III. TUJUAN : 1. Untuk memberikan gambaran bahwa reaksi penyabunan etil asetat oleh ion hidroksida adalah
MENYARING DAN MENDEKANTASI
 MENYARING DAN MENDEKANTASI MENYARING - Menyaring adalah suatu proses dimana partikelpartikel dipisahkan dari cairan dengan melewatkan cairan melalui bahan permeabel (kertas saring,dll). - Endapan : suatu
MENYARING DAN MENDEKANTASI MENYARING - Menyaring adalah suatu proses dimana partikelpartikel dipisahkan dari cairan dengan melewatkan cairan melalui bahan permeabel (kertas saring,dll). - Endapan : suatu
MODUL I Pembuatan Larutan
 MODUL I Pembuatan Larutan I. Tujuan percobaan - Membuat larutan dengan metode pelarutan padatan. - Melakukan pengenceran larutan dengan konsentrasi tinggi untuk mendapatkan larutan yang diperlukan dengan
MODUL I Pembuatan Larutan I. Tujuan percobaan - Membuat larutan dengan metode pelarutan padatan. - Melakukan pengenceran larutan dengan konsentrasi tinggi untuk mendapatkan larutan yang diperlukan dengan
Laju Reaksi KIM 2 A. KEMOLARAN B. LAJU REAKSI C. UNGKAPAN LAJU REAKSI LAJU REAKSI. materi78.co.nr
 Laju eaksi A. KEMOLAAN Dalam laju reaksi, besaran yang digunakan adalah kemolaran benda. Kemolaran menyatakan jumlah mol zat terlarut dari tiap liter larutan atau gas, menunjukkan kekentalan atau kepekatan.
Laju eaksi A. KEMOLAAN Dalam laju reaksi, besaran yang digunakan adalah kemolaran benda. Kemolaran menyatakan jumlah mol zat terlarut dari tiap liter larutan atau gas, menunjukkan kekentalan atau kepekatan.
c. Suhu atau Temperatur
 Pada laju reaksi terdapat faktor-faktor yang dapat mempengaruhi laju reaksi. Selain bergantung pada jenis zat yang beraksi laju reaksi dipengaruhi oleh : a. Konsentrasi Pereaksi Pada umumnya jika konsentrasi
Pada laju reaksi terdapat faktor-faktor yang dapat mempengaruhi laju reaksi. Selain bergantung pada jenis zat yang beraksi laju reaksi dipengaruhi oleh : a. Konsentrasi Pereaksi Pada umumnya jika konsentrasi
Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Chapter 8 Kinetika Kimia Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Chapter 8 Kinetika Kimia Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
RENCANA PELAKSANAAN PEMBELAJARAN ( R P P )
 PEMERINTAH KOTA YOGYAKARTA DINAS PENDIDIKAN SMA NEGERI 6 YOGYAKARTA The Research School of Jogja Jalan C. Simanjuntak No Yogyakarta 55, Telepon 0 55/ Faximile 0 5660 E-mail : sman6@sman6-yogya.sch.id,
PEMERINTAH KOTA YOGYAKARTA DINAS PENDIDIKAN SMA NEGERI 6 YOGYAKARTA The Research School of Jogja Jalan C. Simanjuntak No Yogyakarta 55, Telepon 0 55/ Faximile 0 5660 E-mail : sman6@sman6-yogya.sch.id,
LEMBAR KERJA SISWA 3
 82 LEMBAR KERJA SISWA 3 Mata Pelajaran Kelas/Semester Materi Pokok Sub Materi Pokok Alokasi Waktu : Kimia : XI IPA 3/Ganjil : Laju Reaksi : Faktor-faktor yang mempengaruhi laju reaksi : 2 45 menit Standar
82 LEMBAR KERJA SISWA 3 Mata Pelajaran Kelas/Semester Materi Pokok Sub Materi Pokok Alokasi Waktu : Kimia : XI IPA 3/Ganjil : Laju Reaksi : Faktor-faktor yang mempengaruhi laju reaksi : 2 45 menit Standar
Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan
 KINETIKA Pendahuluan Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan Namun persamaan reaksi tidak dapat menjawab :. Seberapa cepat reaksi berlangsung 2. Bagaimana
KINETIKA Pendahuluan Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan Namun persamaan reaksi tidak dapat menjawab :. Seberapa cepat reaksi berlangsung 2. Bagaimana
BAB 9. KINETIKA KIMIA
 BAB 9 BAB 9. KINETIKA KIMIA 9.1 TEORI TUMBUKAN DARI LAJU REAKSI 9.2 TEORI KEADAAN TRANSISI DARI LAJU REAKSI 9.3 HUKUM LAJU REAKSI 9.4 FAKTOR-FAKTOR LAJU REAKSI 9.5 MEKANISME REAKSI 9.6 ENZIM SEBAGAI KATALIS
BAB 9 BAB 9. KINETIKA KIMIA 9.1 TEORI TUMBUKAN DARI LAJU REAKSI 9.2 TEORI KEADAAN TRANSISI DARI LAJU REAKSI 9.3 HUKUM LAJU REAKSI 9.4 FAKTOR-FAKTOR LAJU REAKSI 9.5 MEKANISME REAKSI 9.6 ENZIM SEBAGAI KATALIS
SILABUS Sekolah : SMA Negeri 5 Surabaya Mata Pelajaran : Kimia Kelas/semester : XI/1 Referensi : BSNP / CIE Standar Kompetensi
 SILABUS Sekolah : SMA Negeri 5 Surabaya Mata Pelajaran : Kimia Kelas/semester : /1 Referensi : BSNP / CIE Standar Kompetensi : 1.Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur
SILABUS Sekolah : SMA Negeri 5 Surabaya Mata Pelajaran : Kimia Kelas/semester : /1 Referensi : BSNP / CIE Standar Kompetensi : 1.Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Lokasi dan Subyek Penelitian Subyek penelitian dalam penelitian ini adalah siswa kelas XII jurusan IPA di salah satu SMA Negeri di Kota Bandung. Subyek penelitian yang dipilih
BAB III METODE PENELITIAN A. Lokasi dan Subyek Penelitian Subyek penelitian dalam penelitian ini adalah siswa kelas XII jurusan IPA di salah satu SMA Negeri di Kota Bandung. Subyek penelitian yang dipilih
No Indikator Soal Valid
 107 Lampiran 3 Rekapitulasi asi Instrumen TDM-TWO-TIER No Indikator Soal 1 Memahami kesetimbangan Reaksi kesetimbangan antara N 2 O 4 dengan NO 2 mengikuti persamaan kimia berikut ini : ator 1 :- dinamis
107 Lampiran 3 Rekapitulasi asi Instrumen TDM-TWO-TIER No Indikator Soal 1 Memahami kesetimbangan Reaksi kesetimbangan antara N 2 O 4 dengan NO 2 mengikuti persamaan kimia berikut ini : ator 1 :- dinamis
LAPORAN PRAKTIKUM DINAMIKA KIMIA JUDUL PERCOBAAN : PENENTUAN LAJU REAKSI IODINASI ASETON DALAM SUASANA ASAM. Nama : SantiNurAini NRP :
 LAPORAN PRAKTIKUM DINAMIKA KIMIA JUDUL PERCOBAAN : PENENTUAN LAJU REAKSI IODINASI ASETON DALAM SUASANA ASAM Nama : SantiNurAini NRP : 1413100048 Tanggal Praktikum : 28 April 2015 Nama Asisten : Mas Mattius
LAPORAN PRAKTIKUM DINAMIKA KIMIA JUDUL PERCOBAAN : PENENTUAN LAJU REAKSI IODINASI ASETON DALAM SUASANA ASAM Nama : SantiNurAini NRP : 1413100048 Tanggal Praktikum : 28 April 2015 Nama Asisten : Mas Mattius
kimia ASAM-BASA III Tujuan Pembelajaran
 KTSP K-13 kimia K e l a s XI ASAM-BASA III Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami mekanisme reaksi asam-basa. 2. Memahami stoikiometri
KTSP K-13 kimia K e l a s XI ASAM-BASA III Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami mekanisme reaksi asam-basa. 2. Memahami stoikiometri
Tentukan ph dari suatu larutan yang memiliki konsentrasi ion H + sebesar 10 4 M dengan tanpa bantuan alat hitung kalkulator!
 Kimia Study Center - Contoh soal dan pembahasan tentang cara menghitung ph dan poh larutan asam basa berdasarkan konsentrasi ion [H + ] dan [OH ] SMA kelas 11 IPA. Berikut contoh-contoh soal yang bisa
Kimia Study Center - Contoh soal dan pembahasan tentang cara menghitung ph dan poh larutan asam basa berdasarkan konsentrasi ion [H + ] dan [OH ] SMA kelas 11 IPA. Berikut contoh-contoh soal yang bisa
Bab 10 Kinetika Kimia
 D e p a r t e m e n K i m i a F M I P A I P B Bab 0 Kinetika Kimia http://chem.fmipa.ipb.ac.id Ikhtisar 2 3 Laju Reaksi Teori dalam Kinetika Kimia 4 Mekanisme Reaksi 5 46 Faktor Penentu Laju Reaksi Enzim
D e p a r t e m e n K i m i a F M I P A I P B Bab 0 Kinetika Kimia http://chem.fmipa.ipb.ac.id Ikhtisar 2 3 Laju Reaksi Teori dalam Kinetika Kimia 4 Mekanisme Reaksi 5 46 Faktor Penentu Laju Reaksi Enzim
MODUL 1 TERMOKIMIA. A. Hukum Pertama Termodinamika. B. Kalor Reaksi
 MODUL 1 TERMOKIMIA Termokimia adalah ilmu yang mempelajari hubungan antara energi panas dan energi kimia. Sebagai prasyarat untuk mempelajari termokimia, kita harus mengetahui tentang perbedaan kalor (Q)
MODUL 1 TERMOKIMIA Termokimia adalah ilmu yang mempelajari hubungan antara energi panas dan energi kimia. Sebagai prasyarat untuk mempelajari termokimia, kita harus mengetahui tentang perbedaan kalor (Q)
Pendahuluan 1. Guru memberikan salam kemudian mengecek kehadiran
 RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 2 JP Standar Kompetensi 1. Memahami kinetika reaksi dan kesetimbangan kimia
RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 2 JP Standar Kompetensi 1. Memahami kinetika reaksi dan kesetimbangan kimia
MODUL STOIKIOMETRI 1
 MODUL STOIKIOMETRI 1 1. Pengertian Mol Mol merupakan suatu satuan jumlah, yang berasal dari kata moles yang artinya sejumlah massa / sejumlah kecil massa, hampir sama dengan lusin. 1 mol = 6,02 X 10 23
MODUL STOIKIOMETRI 1 1. Pengertian Mol Mol merupakan suatu satuan jumlah, yang berasal dari kata moles yang artinya sejumlah massa / sejumlah kecil massa, hampir sama dengan lusin. 1 mol = 6,02 X 10 23
STOKIOMETRI BAB. B. Konsep Mol 1. Hubungan Mol dengan Jumlah Partikel. Contoh: Jika Ar Ca = 40, Ar O = 16, Ar H = 1, tentukan Mr Ca(OH) 2!
 BAB 7 STOKIOMETRI A. Massa Molekul Relatif Massa Molekul Relatif (Mr) biasanya dihitung menggunakan data Ar masing-masing atom yang ada dalam molekul tersebut. Mr senyawa = (indeks atom x Ar atom) Contoh:
BAB 7 STOKIOMETRI A. Massa Molekul Relatif Massa Molekul Relatif (Mr) biasanya dihitung menggunakan data Ar masing-masing atom yang ada dalam molekul tersebut. Mr senyawa = (indeks atom x Ar atom) Contoh:
Soal Soal Kesetimbangan Kimia. Proses Haber-Bosch merupakan proses pembentukan atau produksi ammonia berdasarkan reaksi:
 Nama : Fitria Puspita NIM : 1201760 Kelas : Pendidikan Kimia A Soal Soal Kesetimbangan Kimia SBMPTN 2014 Untuk soal no 1-3, bacalah narasi berikut. Proses Haber-Bosch merupakan proses pembentukan atau
Nama : Fitria Puspita NIM : 1201760 Kelas : Pendidikan Kimia A Soal Soal Kesetimbangan Kimia SBMPTN 2014 Untuk soal no 1-3, bacalah narasi berikut. Proses Haber-Bosch merupakan proses pembentukan atau
BAB IV TEMUAN DAN PEMBAHASAN. Dalam pengembangan strategi pembelajaran intertekstual pada materi
 BAB IV TEMUAN DAN PEMBAHASAN Dalam pengembangan strategi pembelajaran intertekstual pada materi pokok kesetimbangan kimia secara garis besar penelitian terbagi dalam beberapa tahapan yaitu: Tahap pertama
BAB IV TEMUAN DAN PEMBAHASAN Dalam pengembangan strategi pembelajaran intertekstual pada materi pokok kesetimbangan kimia secara garis besar penelitian terbagi dalam beberapa tahapan yaitu: Tahap pertama
- Melakukan percobaan penentuan laju reaksi. - Mendiskusikan data-data percobaan laju reaksi dalam bentuk grafik untuk menentukan harga laju
 Silabus RPP SMK KLS 12 CONTOH SILABUS Nama Sekolah : SMK SEDC Mata Pelajaran : KIMIA Kelas/Semester : XII Standar Kompetensi : 11. Mengidentifikasi faktor-faktor yang mempengaruhi laju reaksi Alokasi Waktu
Silabus RPP SMK KLS 12 CONTOH SILABUS Nama Sekolah : SMK SEDC Mata Pelajaran : KIMIA Kelas/Semester : XII Standar Kompetensi : 11. Mengidentifikasi faktor-faktor yang mempengaruhi laju reaksi Alokasi Waktu
LEMBARAN SOAL 7. Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA )
 LEMBARAN SOAL 7 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal
LEMBARAN SOAL 7 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal
kimia KTSP & K-13 KESETIMBANGAN KIMIA 1 K e l a s A. Reaksi Kimia Reversible dan Irreversible Tujuan Pembelajaran
 KTSP & K-13 kimia K e l a s XI KESETIMBANGAN KIMIA 1 Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami definisi reaksi kimia reversible dan irreversible..
KTSP & K-13 kimia K e l a s XI KESETIMBANGAN KIMIA 1 Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami definisi reaksi kimia reversible dan irreversible..
Kekekalan Energi energi tidak dapat diciptakan maupun dimusnahkan
 Termokimia XI IPA CO 2, mineral, panas, cahaya Kekekalan Energi energi tidak dapat diciptakan maupun dimusnahkan Manusia Fotosintesis Sayuran dan Buah Entalpi energi / kalor yang terdapat dalam suatu materi.
Termokimia XI IPA CO 2, mineral, panas, cahaya Kekekalan Energi energi tidak dapat diciptakan maupun dimusnahkan Manusia Fotosintesis Sayuran dan Buah Entalpi energi / kalor yang terdapat dalam suatu materi.
BAB IV HASIL PENELITIAN DAN PEMBAHASAN. Pemahaman siswa yang dimaksud adalah pemahaman konseptual dan pemahaman
 36 BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4. 1 Hasil Penelitian Tujuan utama penelitian ini adalah mendeskripsikan tingkat pemahaman siswa XI IPA SMA Negeri 2 Limboto pada materi kesetimbangan kimia. Pemahaman
36 BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4. 1 Hasil Penelitian Tujuan utama penelitian ini adalah mendeskripsikan tingkat pemahaman siswa XI IPA SMA Negeri 2 Limboto pada materi kesetimbangan kimia. Pemahaman
SILABUS. : 1. Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur molekul, dan sifat sifat senyawa.
 Nama Sekolah Mata Pelajaran Kelas/Semester Standar Kompetensi Alokasi Waktu SILABUS : SMA : KIMIA : XI/1 : 1. Memahami struktur atom meramalkan sifat-sifat periodik unsur, struktur molekul, dan sifat sifat
Nama Sekolah Mata Pelajaran Kelas/Semester Standar Kompetensi Alokasi Waktu SILABUS : SMA : KIMIA : XI/1 : 1. Memahami struktur atom meramalkan sifat-sifat periodik unsur, struktur molekul, dan sifat sifat
Oleh. Dewi Candrawati
 126 Lampiran 4 Oleh Dewi Candrawati 2014 127 Petunjuk Pengerjaan: 1. Tes diagnostik ini terdiri dari delapan soal pilihan ganda dua tingkat. 2. Setiap soal memiliki 4 pilihan jawaban dan 5 pilihan alasan.
126 Lampiran 4 Oleh Dewi Candrawati 2014 127 Petunjuk Pengerjaan: 1. Tes diagnostik ini terdiri dari delapan soal pilihan ganda dua tingkat. 2. Setiap soal memiliki 4 pilihan jawaban dan 5 pilihan alasan.
kimia KESETIMBANGAN KIMIA 2 Tujuan Pembelajaran
 KTSP & K-13 kimia K e l a s XI KESETIMBANGAN KIMIA 2 Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami faktor-faktor yang memengaruhi kesetimbangan.
KTSP & K-13 kimia K e l a s XI KESETIMBANGAN KIMIA 2 Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami faktor-faktor yang memengaruhi kesetimbangan.
KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN
 KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN 1. Suatu reaksi dikatakan mencapai kesetimbangan apabila. A. laju reaksi ke kiri sama dengan ke kanan B. jumlah koefisien reaksi ruas kiri sama dengan ruas kanan
KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN 1. Suatu reaksi dikatakan mencapai kesetimbangan apabila. A. laju reaksi ke kiri sama dengan ke kanan B. jumlah koefisien reaksi ruas kiri sama dengan ruas kanan
SOAL-SOAL KESETIMBANGAN KIMIA
 H=+380 kj/mol SOAL-SOAL KESETIMBANGAN KIMIA 1. Ebtanas 99 Suatu reaksi berada dalam keadaan setimbang apabila A. Reaksi ke kanan dan kiri telah berhenti B. Mol pereaksi selalu sama dengan mol hasil reaksi
H=+380 kj/mol SOAL-SOAL KESETIMBANGAN KIMIA 1. Ebtanas 99 Suatu reaksi berada dalam keadaan setimbang apabila A. Reaksi ke kanan dan kiri telah berhenti B. Mol pereaksi selalu sama dengan mol hasil reaksi
LEMBARAN SOAL 4. Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA )
 LEMBARAN SOAL 4 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
LEMBARAN SOAL 4 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
Kimia Study Center - Contoh soal dan pembahasan tentang hidrolisis larutan garam dan menentukan ph atau poh larutan garam, kimia SMA kelas 11 IPA.
 Kimia Study Center - Contoh soal dan pembahasan tentang hidrolisis larutan garam dan menentukan ph atau poh larutan garam, kimia SMA kelas 11 IPA. Soal No. 1 Dari beberapa larutan berikut ini yang tidak
Kimia Study Center - Contoh soal dan pembahasan tentang hidrolisis larutan garam dan menentukan ph atau poh larutan garam, kimia SMA kelas 11 IPA. Soal No. 1 Dari beberapa larutan berikut ini yang tidak
RENCANA PELAKSANAAN PEMBELAJARAN. Satuan Pendidikan : SMA NEGERI 12 SIJUNJUNG
 RENCANA PELAKSANAAN PEMBELAJARAN A. IDENTITAS MATA PELAJARAN Satuan Pendidikan : SMA NEGERI 12 SIJUNJUNG Kelas : XI (Sebelas) Semester/Tahun Pelajaran : I/ 2013-2014 Program : IPA Mata Pelajaran : KIMIA
RENCANA PELAKSANAAN PEMBELAJARAN A. IDENTITAS MATA PELAJARAN Satuan Pendidikan : SMA NEGERI 12 SIJUNJUNG Kelas : XI (Sebelas) Semester/Tahun Pelajaran : I/ 2013-2014 Program : IPA Mata Pelajaran : KIMIA
I. PENDAHULUAN. belajar pada suatu lingkungan belajar. Pembelajaran merupakan bantuan yang
 I. PENDAHULUAN A. Latar Belakang Pembelajaran adalah proses interaksi peserta didik dengan pendidik dan sumber belajar pada suatu lingkungan belajar. Pembelajaran merupakan bantuan yang diberikan pendidik
I. PENDAHULUAN A. Latar Belakang Pembelajaran adalah proses interaksi peserta didik dengan pendidik dan sumber belajar pada suatu lingkungan belajar. Pembelajaran merupakan bantuan yang diberikan pendidik
Kesetimbangan Kimia KIM 2 A. PENDAHULUAN B. REAKSI KESETIMBANGAN. α = KESETIMBANGAN KIMIA. materi78.co.nr. setimbang
 konsentrasi laju reaksi materi78.co.nr Kesetimbangan Kimia A. PENDAHULUAN Reaksi satu arah (irreversible) atau reaksi tidak dapat balik adalah reaksi yang terjadi pada satu arah, dan produknya tidak dapat
konsentrasi laju reaksi materi78.co.nr Kesetimbangan Kimia A. PENDAHULUAN Reaksi satu arah (irreversible) atau reaksi tidak dapat balik adalah reaksi yang terjadi pada satu arah, dan produknya tidak dapat
2. Konfigurasi elektron dua buah unsur tidak sebenarnya:
 . Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
. Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
SILABUS. Agustien Zulaidah,ST,MT. Kompetensi Dasar Indikator Materi Pokok & Sub Materi pokok. Alokasi Waktu pengalaman belajar
 SILABUS Mata Kuliah : Azas Rekayasa Proses Kode mata Kuliah / SKS : MTK 113 / 2 ( Dua ) Semester : II ( Dua ) Deskripsi Mata Kuliah : Mata kuliah Azas Rekayasa Proses ini mata kuliah yang membahas tentang
SILABUS Mata Kuliah : Azas Rekayasa Proses Kode mata Kuliah / SKS : MTK 113 / 2 ( Dua ) Semester : II ( Dua ) Deskripsi Mata Kuliah : Mata kuliah Azas Rekayasa Proses ini mata kuliah yang membahas tentang
KONSEP MOL DAN STOIKIOMETRI
 BAB V KONSEP MOL DAN STOIKIOMETRI Dalam ilmu fisika, dikenal satuan mol untuk besaran jumlah zat. Dalam bab ini, akan dibahas mengenai konsep mol yang mendasari perhitungan kimia (stoikiometri). A. KONSEP
BAB V KONSEP MOL DAN STOIKIOMETRI Dalam ilmu fisika, dikenal satuan mol untuk besaran jumlah zat. Dalam bab ini, akan dibahas mengenai konsep mol yang mendasari perhitungan kimia (stoikiometri). A. KONSEP
BAB IV HASIL PENELITIAN DAN PEMBAHASAN
 BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1.Hasil Penelitian Pada dasarnya tujuan utama penelitian ini adalah untuk mengetahui kesulitan belajar siswa pada materi persamaan reaksi di Kelas X dan XI IPA
BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1.Hasil Penelitian Pada dasarnya tujuan utama penelitian ini adalah untuk mengetahui kesulitan belajar siswa pada materi persamaan reaksi di Kelas X dan XI IPA
PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP FAX KODE POS 60299
 PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP. 031-8415492 FAX 031-8430673 KODE POS 60299 ULANGAN AKHIR SEMESTER 2 (DUA) TAHUN PELAJARAN 2011 2012 Hari/Tanggal :
PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP. 031-8415492 FAX 031-8430673 KODE POS 60299 ULANGAN AKHIR SEMESTER 2 (DUA) TAHUN PELAJARAN 2011 2012 Hari/Tanggal :
Karena volumnya adalah satu liter, maka konsentrasinya tinggal masukkan molnya masingmasing.
 Kimia Study Center - Contoh soal dan pembahasan tentang kesetimbangan kimia SMA kelas 11 IPA. Tetapan kesetimbangan berdasarkan konsentrasi dan tekanan parsial gas. Soal No. 1 Tentukan persamaan tetapan
Kimia Study Center - Contoh soal dan pembahasan tentang kesetimbangan kimia SMA kelas 11 IPA. Tetapan kesetimbangan berdasarkan konsentrasi dan tekanan parsial gas. Soal No. 1 Tentukan persamaan tetapan
Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam
 Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam sistem pada kesetimbangan Uap mengembun dengan laju
Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam sistem pada kesetimbangan Uap mengembun dengan laju
BAB II KAJIAN PUSTAKA. salah yang artinya tidak benar, tidak betul atau keliru. Jadi, kesalahan dalam memecahkan
 BAB II KAJIAN PUSTAKA. Kesalahan Pemahaman Siswa Kesalahan menurut kamus besar Bahasa Indonesia (007:98) berasal dari kata dasar salah yang artinya tidak benar, tidak betul atau keliru. Jadi, kesalahan
BAB II KAJIAN PUSTAKA. Kesalahan Pemahaman Siswa Kesalahan menurut kamus besar Bahasa Indonesia (007:98) berasal dari kata dasar salah yang artinya tidak benar, tidak betul atau keliru. Jadi, kesalahan
BAB 8. Jika Anda memasukkan satu sendok gula ke dalam segelas air, kemudian Anda. Kelarutan Garam Sukar Larut. Kata Kunci.
 Kimia XI SMA 205 BAB 8 Kelarutan Garam Sukar Larut Gambar Larutan Tujuan Pembelajaran: Setelah mempelajari bab ini, Anda diharapkan mampu: 1. Menjelaskan kesetimbangan dalam larutan jenuh atau larutan
Kimia XI SMA 205 BAB 8 Kelarutan Garam Sukar Larut Gambar Larutan Tujuan Pembelajaran: Setelah mempelajari bab ini, Anda diharapkan mampu: 1. Menjelaskan kesetimbangan dalam larutan jenuh atau larutan
Wardaya College IKATAN KIMIA STOIKIOMETRI TERMOKIMIA CHEMISTRY. Part III. Summer Olympiad Camp Kimia SMA
 Part I IKATAN KIMIA CHEMISTRY Summer Olympiad Camp 2017 - Kimia SMA 1. Untuk menggambarkan ikatan yang terjadi dalam suatu molekul kita menggunakan struktur Lewis atau 'dot and cross' (a) Tuliskan formula
Part I IKATAN KIMIA CHEMISTRY Summer Olympiad Camp 2017 - Kimia SMA 1. Untuk menggambarkan ikatan yang terjadi dalam suatu molekul kita menggunakan struktur Lewis atau 'dot and cross' (a) Tuliskan formula
K13 Revisi Antiremed Kelas 10 Kimia
 K13 Revisi Antiremed Kelas 10 Kimia Hukum Dasar Perhitungan Kimia - Latihan Soal Doc. Name: RK13AR10KIM0801 Version : 2016-11 halaman 1 01. Pernyataan yang paling sesuai tentang hukum Lavoisier (A) Jumlah
K13 Revisi Antiremed Kelas 10 Kimia Hukum Dasar Perhitungan Kimia - Latihan Soal Doc. Name: RK13AR10KIM0801 Version : 2016-11 halaman 1 01. Pernyataan yang paling sesuai tentang hukum Lavoisier (A) Jumlah
Lampiran 9. Kisi-Kisi Soal Kimia SwC Kelas XI
 Lampiran 9 Kisi-Kisi Kimia SwC Kelas XI 159 Bidang Studi : Kimia Kelas/Semester : XI/1 : 50 KISI-KISI SOAL LATIHAN KIMIA SwC KELAS XI Standar 1. Memahami struktur atom untuk meramalkan sifat-sifat periodik
Lampiran 9 Kisi-Kisi Kimia SwC Kelas XI 159 Bidang Studi : Kimia Kelas/Semester : XI/1 : 50 KISI-KISI SOAL LATIHAN KIMIA SwC KELAS XI Standar 1. Memahami struktur atom untuk meramalkan sifat-sifat periodik
Bab IV Hasil dan Diskusi
 Bab IV Hasil dan Diskusi IV.1 Hasil Eksperimen Eksperimen dikerjakan di laboratorium penelitian Kimia Analitik. Suhu ruang saat bekerja berkisar 24-25 C. Data yang diperoleh mencakup data hasil kalibrasi
Bab IV Hasil dan Diskusi IV.1 Hasil Eksperimen Eksperimen dikerjakan di laboratorium penelitian Kimia Analitik. Suhu ruang saat bekerja berkisar 24-25 C. Data yang diperoleh mencakup data hasil kalibrasi
Analisis Keterkaitan KI - KD dengan IPK dan Materi Pembelajaran. Kompetensi Inti Kompetensi Dasar Indikator Pencapaian Kompetensi
 No. Dokumen : F/751/WKS1/P/6 No. Revisi : 1 Tanggal Berlaku : 1 Juli 2016 Analisis Keterkaitan KI - KD dengan IPK dan Sekolah : SMA NEGERI 1 GODEAN Mata Pelajaran : Kimia Kelas / Program : XI/MIPA Semester
No. Dokumen : F/751/WKS1/P/6 No. Revisi : 1 Tanggal Berlaku : 1 Juli 2016 Analisis Keterkaitan KI - KD dengan IPK dan Sekolah : SMA NEGERI 1 GODEAN Mata Pelajaran : Kimia Kelas / Program : XI/MIPA Semester
LAPORAN PRAKTIKUM KIMIA FISIKA II PENENTUAN LAJU REAKSI DAN TETAPAN LAJU
 LAPORAN PRAKTIKUM KIMIA FISIKA II PENENTUAN LAJU REAKSI DAN TETAPAN LAJU Nama NIM Prodi Anggota kelompok Disusun oleh: : Edi Siswanto : H13112071 : Kimia : 1. Alpius Suriadi 2. Gloria Sindora 3. Indri
LAPORAN PRAKTIKUM KIMIA FISIKA II PENENTUAN LAJU REAKSI DAN TETAPAN LAJU Nama NIM Prodi Anggota kelompok Disusun oleh: : Edi Siswanto : H13112071 : Kimia : 1. Alpius Suriadi 2. Gloria Sindora 3. Indri
1. Perhatikan struktur senyawa berikut!
 . Perhatikan struktur senyawa berikut! CH CH CH CH CH CH CH Jumlah atom C primer, atom C sekunder, dan atom C tersier dari senyawa di atas adalah...,, dan D.,, dan,, dan E.,, dan,, dan. Di bawah ini merupakan
. Perhatikan struktur senyawa berikut! CH CH CH CH CH CH CH Jumlah atom C primer, atom C sekunder, dan atom C tersier dari senyawa di atas adalah...,, dan D.,, dan,, dan E.,, dan,, dan. Di bawah ini merupakan
Materi pelajaran Biologi. Disusun oleh: Dra. Tetty Afianti.
 Materi pelajaran Biologi kelas 11 Disusun oleh: Dra. Tetty Afianti KECEPATAN REAKSI Diriwayatkan dari Umar abi Salamah ra. : Aku seorang anak laki-laki di bawah asuhan Rasulullah Saw dan tanganku biasa
Materi pelajaran Biologi kelas 11 Disusun oleh: Dra. Tetty Afianti KECEPATAN REAKSI Diriwayatkan dari Umar abi Salamah ra. : Aku seorang anak laki-laki di bawah asuhan Rasulullah Saw dan tanganku biasa
Hukum Dasar Kimia Dan Konsep Mol
 A. PENDAHULUAN Hukum Dasar Kimia Dan Konsep Mol Hukum dasar kimia merupakan hukum dasar yang digunakan dalam stoikiometri (perhitungan kimia), antara lain: 1) Hukum Lavoisier atau hukum kekekalan massa.
A. PENDAHULUAN Hukum Dasar Kimia Dan Konsep Mol Hukum dasar kimia merupakan hukum dasar yang digunakan dalam stoikiometri (perhitungan kimia), antara lain: 1) Hukum Lavoisier atau hukum kekekalan massa.
Stoikiometri. Bab 3. Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Secara Mikro atom & molekul.
 Bab 3 Stoikiometri Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional: 1 atom 12 C beratnya 12 sma Jika ditimbang
Bab 3 Stoikiometri Secara Mikro atom & molekul Secara Makro gram Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Perjanjian internasional: 1 atom 12 C beratnya 12 sma Jika ditimbang
UJIAN NASIONAL TAHUN PELAJARAN 2007/2008
 UJIAN NASIONAL TAHUN PELAJARAN 2007/2008 PANDUAN MATERI SMA DAN MA K I M I A PROGRAM STUDI IPA PUSAT PENILAIAN PENDIDIKAN BALITBANG DEPDIKNAS KATA PENGANTAR Dalam rangka sosialisasi kebijakan dan persiapan
UJIAN NASIONAL TAHUN PELAJARAN 2007/2008 PANDUAN MATERI SMA DAN MA K I M I A PROGRAM STUDI IPA PUSAT PENILAIAN PENDIDIKAN BALITBANG DEPDIKNAS KATA PENGANTAR Dalam rangka sosialisasi kebijakan dan persiapan
Siswa diingatkan tentang struktur atom, bilangan kuantum, bentuk-bentuk orbital, dan konfigurasi elektron
 RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
DAFTAR ISI KATA PENGANTAR... DAFTAR ISI... DAFTAR TABEL... DAFTAR BAGAN... DAFTAR GAMBAR... DAFTAR LAMPIRAN... A. Latar Belakang Masalah...
 DAFTAR ISI ABSTRAK Halaman KATA PENGANTAR... DAFTAR ISI... DAFTAR TABEL... DAFTAR BAGAN... DAFTAR GAMBAR... DAFTAR LAMPIRAN... i iv vi viii ix xi BAB I PENDAHULUAN A. Latar Belakang Masalah... 1 B. Rumusan
DAFTAR ISI ABSTRAK Halaman KATA PENGANTAR... DAFTAR ISI... DAFTAR TABEL... DAFTAR BAGAN... DAFTAR GAMBAR... DAFTAR LAMPIRAN... i iv vi viii ix xi BAB I PENDAHULUAN A. Latar Belakang Masalah... 1 B. Rumusan
TERMOKIMIA. Sistem terbagi atas: 1. Sistem tersekat: Antara sistem dan lingkungan tidak dapat terjadi pertukaran energi maupun materi
 TERMOKIMIA almair amrulloh 12:04:00 AM 11 IPAKimia 11 IPA Asas kekekalan energi menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan, tetapi energi dapat diubah dari satu bentuk kebentuk lain
TERMOKIMIA almair amrulloh 12:04:00 AM 11 IPAKimia 11 IPA Asas kekekalan energi menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan, tetapi energi dapat diubah dari satu bentuk kebentuk lain
KESETIMBANGAN. titik setimbang
 KESETIMBANGAN STANDART KOMPETENSI;. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang berpengaruh, serta penerapannya dalam kehidupan sehari-hari. KOMPETENSI DASAR;.. Menjelaskan kestimbangan
KESETIMBANGAN STANDART KOMPETENSI;. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang berpengaruh, serta penerapannya dalam kehidupan sehari-hari. KOMPETENSI DASAR;.. Menjelaskan kestimbangan
kimia KTSP & K-13 TERMOKIMIA I K e l a s A. HUKUM KEKEKALAN ENERGI TUJUAN PEMBELAJARAN
 KTSP & K-13 kimia K e l a s XI TERMOKIMIA I TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Menjelaskan hukum kekekalan energi, membedakan sistem dan
KTSP & K-13 kimia K e l a s XI TERMOKIMIA I TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Menjelaskan hukum kekekalan energi, membedakan sistem dan
TERMOKIMIA. STANDART KOMPETENSI; 2. Memahami perubahan energi dalam kimia dan cara pengukuran. ENTALPI DAN PERUBAHANNYA
 TERMOKIMIA STANDART KOMPETENSI; 2. Memahami perubahan energi dalam kimia dan cara pengukuran. ENTALPI DAN PERUBAHANNYA KOMPETENSI DASAR; 2.1. Mendeskripsikan perubahan entalpi suatu reaksi, reaksi eksoterm
TERMOKIMIA STANDART KOMPETENSI; 2. Memahami perubahan energi dalam kimia dan cara pengukuran. ENTALPI DAN PERUBAHANNYA KOMPETENSI DASAR; 2.1. Mendeskripsikan perubahan entalpi suatu reaksi, reaksi eksoterm
TEORI TUMBUKAN PADA LAJU REAKSI KIMIA
 PENGEMBANGAN BAHAN AJAR TEORI TUMBUKAN PADA LAJU REAKSI KIMIA OLEH : Drs. I Wayan Suarsa, M.Si JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS UDAYANA 2017 Kata Pengantar Puji dan
PENGEMBANGAN BAHAN AJAR TEORI TUMBUKAN PADA LAJU REAKSI KIMIA OLEH : Drs. I Wayan Suarsa, M.Si JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS UDAYANA 2017 Kata Pengantar Puji dan
BAB I STOIKHIOMETRI I - 1
 BAB I STOIKHIOMETRI 1.1 PENDAHULUAN Setiap zat, unsur, senyawa dalam kimia mempunyai nama dan rumus uniknya sendiri. Cara tersingkat untuk memerikan suatu reaksi kimia adalah dengan menuliskan rumus untuk
BAB I STOIKHIOMETRI 1.1 PENDAHULUAN Setiap zat, unsur, senyawa dalam kimia mempunyai nama dan rumus uniknya sendiri. Cara tersingkat untuk memerikan suatu reaksi kimia adalah dengan menuliskan rumus untuk
