MODUL LAJU REAKSI. Laju reaksi _ 2013 Page 1
|
|
|
- Yulia Darmali
- 6 tahun lalu
- Tontonan:
Transkripsi
1 MODUL LAJU REAKSI Standar Kompetensi ( SK ) : Memahami kinetika reaksi, kesetimbangan kimia dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri. Kompetensi Dasar ( KD ) : Mendeskrip-sikan pengertian laju reaksi dengan melakukan percobaan tentang faktor-faktor yang mempengaruhi laju reaksi Indikator Pembelajaran : : 1. Menghitung laju reaksi berdasarkan perubahan konsentrasi pereaksi atau produk. 2. Menganalisis faktor-faktor yang mempengaruhi laju reaksi (konsentrasi, luas permukaan, suhu, dan katalis) melalui percobaan. 3. Menafsirkan grafikdari data percobaan tentang faktor-faktor yang mempengaruhi laju reaksi. A. KONSEP Suatu reaksi kimia dapat berlangsung dengan laju yang berbeda-beda. Ada yang lambat,, cepat dan sangat cepat. Laju reaksi adalah Perubahan konsentrasi pereaksi atau hasil reaksi per satuan waktu. Contoh V Reaksi : A + B AB Laju reaksi dapat kita ukur dengan menghitung pertambahan konsentrasi produk tiap satuan waktu tertentu, atau dengan menghitung pengurangan konsentrasi pereaksi tiap satuan waktu. Untuk reaksi di atas pernyataan laju dapat dinyatakan dengan kalimat/persamaan matematis. Dengan kalimat pernyataan: V = pengurangan [A] per satuan waktu V = pengurangn [B] per satuan waktu V = pertambahan [AB] per satuan waktu. Dengan persamaan matematis : V = V = v = M t det ik BM t det ik M t detik Bagaimana hubungan laju reaksi di bawah ini : 2NH 3 N 2 + 3H 2 adalah : Laju reaksi _ 2013 Page 1
2 Contoh: Sebanyak 0,8 mol NH 3 dipanaskan dalam ruang 2 liter sampai suhunya C, hingga terurai menjadi gas N 2 dan H 2. Setelah 5 detik dalam ruang tsb masih ada 0,2 mol NH 3. Bagaimana hubungan laju reaksi masing-masing zat? B. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI 1. Luas Permukaan Zat Jika luas permukaan zat yang direaksikan diperbesar, kecepatan reaksi makin besar, dan produk makin cepat terbentuk 2. Konsentrasi Makin besar konsentrasi zat yang direaksikan, makin cepat reaksi berlangsung, makin cepat produk terbentuk 3. Suhu Jika suhu dinaikan, kecepatan reaksi bertambah besar, produk makin cepat terbentuk. Umumnya, laju reaksi naik 2 kali tiap kenaikan suhu 10 0 C. Semakin tinggi suhu reaksi,semakin besar laju reaksi Perumusan : V2 =. V1 atau t2 =. t1 Laju reaksi _ 2013 Page 2
3 Dengan : x = Faktor pengali T = perubahan suhu t = waktu Y = suhu berapa tiap kali kenaikan Contoh : Bila kecepatan reaksi menjadi 2 kali lebih cepat setiap kenaikan suhu 10 0 C, maka berapa kali lebih cepat reaksi tersebut pada suhu 90 0 C dibandingkan pada suhu 20 0 C. Jawab : 4. Katalis Katalis adalah zat yang dapat mempercepat suatu reaksi, tetapi tidak ikut bereaksi. Katalis tidak dapat mengubah zat yang tidak bereaksi menjadi bereaksi. Katalis dapat mempercepat reaksi karena dapat menurunkan energi aktivasi (E a ) dari suatu reaksi. Perhatikan grafik reaksi eksoterm dan endoterm di bawah ini : C. KONSENTRASI DAN LAJU REAKSI Hubungan antara laju reaksi dan konsentrasi dapat bermacam-macam. Ada reaksi yang berlangsung dua kali lebih cepat bila konsentrasi dinaikan dua kali dari konsentrasi zat sebelumnya. Ada pula jika konsentrasinya dinaikan dua kali kecepatannya akan bertambah empat kali, dst. Orde reaksi adalah bilangan pangkat menyatakan hubungan konsentrasi zat dengan kecepatan reaksi. Harga orde reaksi hanya dapat ditentukan melalui eksperimen. Untuk reaksi umum A + B AB, maka kecepatan reaksi ditentukan oleh konsentrasi A dan konsentrasi B. Secara matematis persamaan kecepatannya dapat dituliskan sbb : v = k [A] x [B] y dimana : v = Laju reaksi k = tetapan laju [A] = konsentrasi zat A [B] = konsentrasi zat B x = orde reaksi terhadap A y = orde reaksi terhadap B Orde reaksi total dari reaksi keseluruhan adalah x + y Orde nol : Berarti laju reaksi tidak dipengaruhi oleh perubahan konsentrasi, atau v= [x] 0. Laju reaksi _ 2013 Page 3
4 Orde satu : Berarti laju reaksi berbanding lurus dengan konsentrasi pereaksi, atau v= [x] 1. Jika [x] dinaikan tiga kali semula, maka kecepatannya menjadi 3 1 atau 3 kali lebih besar. Orde dua : Berarti laju rekasi itu berubah secara eksponensial (kuadrat) terhadap perubahan konsentrasi, atau v= [x] 2. Jika [x] dinaikan tiga kali semula, maka laju reaksi akan menjadi 3 2 atau 9 kali lebih besar, dst. Orde negatif : berarti laju reaksi berbanding terbalik terhadap konsentrasi pereaksi. Jika konsentrasi pereaksi diperbesar, maka laju reaksi akan makin kecil. Perhatikan grafik orde reaksi di bawah ini : Contoh : 1. Reaksi A + B mempunyai data eksperimen sebagai berikut : Percobaan A B Laju ( M/det ) ,2 0,3 0,2 0,3 1/36 1/18 1/12 1/9 1/4 Tentukan : a. Orde reaksi total b. Tetapan laju reaksi c. Persamaan laju reaksi 2. Data hasil eksperimen reaksi ; CH 3 CH 2 OCH 3 + I 2 Laju reaksi _ 2013 Page 4
5 Percobaan CH 3 CH 2 OCH 3 0,25 0,50 1,00 0,50 I 2 0 Waktu ( det ) 7,2 3,6 1,8 3,6 Tentukan : a. Orde reaksi total b. Tetapan laju reaksi c. Persamaan laju reaksi TEORI TUMBUKAN Agar reaksi kimia dapat berlanagsung,molekul-molekul pereaksi harus bertumbukan satu sama lain dan memiliki energy kinetic yang sangat besar.energi kinetic minimum yang diperlukan oleh partikel-partikal pereaksi agar dapat bereaksi membentuk komplek teraktivasi disebut energy aktivasi ( Ea).Hubungan antara energy aktivasi dengan laju reaksi digambarkan pada grafik reaksi eksoterm dan reaksi endoterm di bawah ini. ( BACA BUKU PAKET ) Laju reaksi _ 2013 Page 5
Laju Reaksi. Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I
 Laju Reaksi Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi,
Laju Reaksi Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi,
tanya-tanya.com Soal No.2 Apabila anda diminta untuk mengukur laju reaksi terhadap reaksi : Zn(s) + 2HCI(aq)
 Soal No.1 Apa yang di maksud dengan laju reaksi dan satuan dari laju reaksi? Laju reaksi dinyatakan sebagai berkurangnya jumlah pereaksi untuk setiap satuan waktu atau bertambahnya jumlah hasil reaksi
Soal No.1 Apa yang di maksud dengan laju reaksi dan satuan dari laju reaksi? Laju reaksi dinyatakan sebagai berkurangnya jumlah pereaksi untuk setiap satuan waktu atau bertambahnya jumlah hasil reaksi
kimia LAJU REAKSI 1 TUJUAN PEMBELAJARAN
 KTSP & K-13 kimia K e l a s XI LAJU REAKSI 1 TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konsep molaritas. 2. Memahami definisi dan faktor-faktor
KTSP & K-13 kimia K e l a s XI LAJU REAKSI 1 TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konsep molaritas. 2. Memahami definisi dan faktor-faktor
Faktor-faktor yang Mempengaruhi Laju Reaksi
 Faktor-faktor yang Mempengaruhi Laju Reaksi Faktor yang mempengaruhi laju reaksi adalah sebagai berikut. Konsentrasi Jika konsentrasi suatu larutan makin besar, larutan akan mengandung jumlah partikel
Faktor-faktor yang Mempengaruhi Laju Reaksi Faktor yang mempengaruhi laju reaksi adalah sebagai berikut. Konsentrasi Jika konsentrasi suatu larutan makin besar, larutan akan mengandung jumlah partikel
LEMBAR KERJA SISWA 4
 88 LEMBAR KERJA SISWA 4 Mata Pelajaran Kelas/Semester Materi Pokok Submateri Pokok Alokasi Waktu : Kimia : I/ganjil : Laju Reaksi : Teori Tumbukan : 2 x 45 menit Standar Kompetensi Memahami Kinetika Reaksi,
88 LEMBAR KERJA SISWA 4 Mata Pelajaran Kelas/Semester Materi Pokok Submateri Pokok Alokasi Waktu : Kimia : I/ganjil : Laju Reaksi : Teori Tumbukan : 2 x 45 menit Standar Kompetensi Memahami Kinetika Reaksi,
Kunci jawaban dan pembahasan soal laju reaksi
 Kunci jawaban dan pembahasan soal laju reaksi Soal nomor 1 Mencari volume yang dibutuhkan pada proses pengenceran. Rumus pengenceran V 1. M 1 = V 2. M 2 Misal volume yang dibutuhkan sebanyak x ml, maka
Kunci jawaban dan pembahasan soal laju reaksi Soal nomor 1 Mencari volume yang dibutuhkan pada proses pengenceran. Rumus pengenceran V 1. M 1 = V 2. M 2 Misal volume yang dibutuhkan sebanyak x ml, maka
wanibesak.wordpress.com
 1. Diberikan beberapa pernyataan 1) katalis dapat mempercepat laju reaksi dengan cara menaikan energi aktivasi 2) tahap penentu laju reaksi adalah tahap reaksi yang berlangsung paling lambat 3) laju reaksi
1. Diberikan beberapa pernyataan 1) katalis dapat mempercepat laju reaksi dengan cara menaikan energi aktivasi 2) tahap penentu laju reaksi adalah tahap reaksi yang berlangsung paling lambat 3) laju reaksi
MODUL KESETIMBANGAN. Perhatikan reaksi berikut
 MODUL KESETIMBANGAN Perhatikan reaksi berikut a.n 2 (g) + 3H 2 (g) 2NH 3 (g), di sebut juga reaksi... b. N 2 (g) + 3H 2 (g) 2NH 3 (g), di sebut juga reaksi... Perhatikan reaksi: Maka persamaan laju reaksi
MODUL KESETIMBANGAN Perhatikan reaksi berikut a.n 2 (g) + 3H 2 (g) 2NH 3 (g), di sebut juga reaksi... b. N 2 (g) + 3H 2 (g) 2NH 3 (g), di sebut juga reaksi... Perhatikan reaksi: Maka persamaan laju reaksi
A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI
 3 LAJU REAKSI A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI Materi dapat berubah dari bentuk yang satu ke bentuk yang
3 LAJU REAKSI A. MOLARITAS (M) B. KONSEP LAJU REAKSI C. PERSAMAAN LAJU REAKSI D. TEORI TUMBUKAN E. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI Materi dapat berubah dari bentuk yang satu ke bentuk yang
Purwanti Widhy H, M.Pd. Laju Reaksi
 Purwanti Widhy H, M.Pd Laju Reaksi SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi, Kompetensi Dasar & Indikator
Purwanti Widhy H, M.Pd Laju Reaksi SK, KD dan Indikator Kemolaran Konsep Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi Evaluasi Referensi Selesai Standar Kompetensi, Kompetensi Dasar & Indikator
Soal-Soal. Bab 4. Latihan. Laju Reaksi. 1. Madu dengan massa jenis 1,4 gram/ cm 3 mengandung glukosa (M r. 5. Diketahui reaksi:
 Bab Laju Reaksi Soal-Soal Latihan. Madu dengan massa jenis, gram/ cm 3 mengandung glukosa (M r = 80) sebanyak 35 % b/b. Kemolaran glukosa dalam madu adalah... 0,8 M (D),7 M,8 M (E) 3,0 M, M. Untuk membuat
Bab Laju Reaksi Soal-Soal Latihan. Madu dengan massa jenis, gram/ cm 3 mengandung glukosa (M r = 80) sebanyak 35 % b/b. Kemolaran glukosa dalam madu adalah... 0,8 M (D),7 M,8 M (E) 3,0 M, M. Untuk membuat
OAL TES SEMESTER I. I. Pilihlah jawaban yang paling tepat! a. 2d d. 3p b. 2p e. 3s c. 3d 6. Unsur X dengan nomor atom
 KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
BAB VI KINETIKA REAKSI KIMIA
 BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
kimia KESETIMBANGAN KIMIA 2 Tujuan Pembelajaran
 KTSP & K-13 kimia K e l a s XI KESETIMBANGAN KIMIA 2 Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami faktor-faktor yang memengaruhi kesetimbangan.
KTSP & K-13 kimia K e l a s XI KESETIMBANGAN KIMIA 2 Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami faktor-faktor yang memengaruhi kesetimbangan.
BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN
 BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN STANDAR KOMPETENSI 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan
BY SMAN 16 SURABAYA : Sri Utami, S. P LAJU REAKSI KESIMPULAN STANDAR KOMPETENSI 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan
BAB IV HASIL PENELITIAN DAN PEMBAHASAN. Paguyaman yang berhubungan dengan materi laju reaksi diberikan dalam Tabel 2 berikut.
 BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Hasil Penelitian Dari hasil penelitian diperoleh presentase jawaban siswa kelas XI SMA Negeri 1 Paguyaman yang berhubungan dengan materi laju reaksi diberikan
BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Hasil Penelitian Dari hasil penelitian diperoleh presentase jawaban siswa kelas XI SMA Negeri 1 Paguyaman yang berhubungan dengan materi laju reaksi diberikan
RENCANA PELAKSANAAN PEMBELAJARAN (RPP) KELAS EKSPERIMEN PERTEMUAN KE-1
 RENCANA PELAKSANAAN PEMBELAJARAN (RPP) KELAS EKSPERIMEN PERTEMUAN KE-1 Sekolah : SMAN 3 Tangerang Selatan Mata Pelajaran : Kimia Kelas/ Semester : XI/ I Tahun Pelajaran : 010/011 Pokok Bahasan : Laju Reaksi
RENCANA PELAKSANAAN PEMBELAJARAN (RPP) KELAS EKSPERIMEN PERTEMUAN KE-1 Sekolah : SMAN 3 Tangerang Selatan Mata Pelajaran : Kimia Kelas/ Semester : XI/ I Tahun Pelajaran : 010/011 Pokok Bahasan : Laju Reaksi
MODUL KESETIMBANGAN. Perhatikan reaksi berikut
 MODUL KESETIMBANGAN Perhatikan reaksi berikut a.n 2 (g) + 3H 2 (g) 2NH 3 (g), di sebut juga reaksi... b. N 2 (g) + 3H 2 (g) 2NH 3 (g), di sebut juga reaksi... Perhatikan reaksi: Maka persamaan laju reaksi
MODUL KESETIMBANGAN Perhatikan reaksi berikut a.n 2 (g) + 3H 2 (g) 2NH 3 (g), di sebut juga reaksi... b. N 2 (g) + 3H 2 (g) 2NH 3 (g), di sebut juga reaksi... Perhatikan reaksi: Maka persamaan laju reaksi
Laju Reaksi KIM 2 A. KEMOLARAN B. LAJU REAKSI C. UNGKAPAN LAJU REAKSI LAJU REAKSI. materi78.co.nr
 Laju eaksi A. KEMOLAAN Dalam laju reaksi, besaran yang digunakan adalah kemolaran benda. Kemolaran menyatakan jumlah mol zat terlarut dari tiap liter larutan atau gas, menunjukkan kekentalan atau kepekatan.
Laju eaksi A. KEMOLAAN Dalam laju reaksi, besaran yang digunakan adalah kemolaran benda. Kemolaran menyatakan jumlah mol zat terlarut dari tiap liter larutan atau gas, menunjukkan kekentalan atau kepekatan.
Termodinamika dan Kesetimbangan Kimia
 Termodinamika dan Kesetimbangan Kimia Dalam kesetimbangan kimia terdapat 2 reaksi yaitu reaksi irreversible dan reaksi reversible. Reaksi irreversible (reaksi searah) adalah reaksi yang berlangsung searah.
Termodinamika dan Kesetimbangan Kimia Dalam kesetimbangan kimia terdapat 2 reaksi yaitu reaksi irreversible dan reaksi reversible. Reaksi irreversible (reaksi searah) adalah reaksi yang berlangsung searah.
PETA KONSEP LAJU REAKSI. Percobaan. Waktu perubahan. Hasil reaksi. Pereaksi. Katalis. Suhu pereaksi. Konsentrasi. Luas. permukaan.
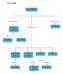 PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
yang berkaitan dengan Laju Reaksi, diberikan pada tabel berikut ini.
 BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Hasil Penelitian Berdasarkan hasil pengumpulan data, persentase siswa SMA Negeri 1 Paguyaman, Kabupaten Boalemo yang memberikan jawaban untuk tiap item tes yang
BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Hasil Penelitian Berdasarkan hasil pengumpulan data, persentase siswa SMA Negeri 1 Paguyaman, Kabupaten Boalemo yang memberikan jawaban untuk tiap item tes yang
Soal Soal Kesetimbangan Kimia. Proses Haber-Bosch merupakan proses pembentukan atau produksi ammonia berdasarkan reaksi:
 Nama : Fitria Puspita NIM : 1201760 Kelas : Pendidikan Kimia A Soal Soal Kesetimbangan Kimia SBMPTN 2014 Untuk soal no 1-3, bacalah narasi berikut. Proses Haber-Bosch merupakan proses pembentukan atau
Nama : Fitria Puspita NIM : 1201760 Kelas : Pendidikan Kimia A Soal Soal Kesetimbangan Kimia SBMPTN 2014 Untuk soal no 1-3, bacalah narasi berikut. Proses Haber-Bosch merupakan proses pembentukan atau
BAB 9. KINETIKA KIMIA
 BAB 9 BAB 9. KINETIKA KIMIA 9.1 TEORI TUMBUKAN DARI LAJU REAKSI 9.2 TEORI KEADAAN TRANSISI DARI LAJU REAKSI 9.3 HUKUM LAJU REAKSI 9.4 FAKTOR-FAKTOR LAJU REAKSI 9.5 MEKANISME REAKSI 9.6 ENZIM SEBAGAI KATALIS
BAB 9 BAB 9. KINETIKA KIMIA 9.1 TEORI TUMBUKAN DARI LAJU REAKSI 9.2 TEORI KEADAAN TRANSISI DARI LAJU REAKSI 9.3 HUKUM LAJU REAKSI 9.4 FAKTOR-FAKTOR LAJU REAKSI 9.5 MEKANISME REAKSI 9.6 ENZIM SEBAGAI KATALIS
Bab 10 Kinetika Kimia
 D e p a r t e m e n K i m i a F M I P A I P B Bab 0 Kinetika Kimia http://chem.fmipa.ipb.ac.id Ikhtisar 2 3 Laju Reaksi Teori dalam Kinetika Kimia 4 Mekanisme Reaksi 5 46 Faktor Penentu Laju Reaksi Enzim
D e p a r t e m e n K i m i a F M I P A I P B Bab 0 Kinetika Kimia http://chem.fmipa.ipb.ac.id Ikhtisar 2 3 Laju Reaksi Teori dalam Kinetika Kimia 4 Mekanisme Reaksi 5 46 Faktor Penentu Laju Reaksi Enzim
Materi pelajaran Biologi. Disusun oleh: Dra. Tetty Afianti.
 Materi pelajaran Biologi kelas 11 Disusun oleh: Dra. Tetty Afianti KECEPATAN REAKSI Diriwayatkan dari Umar abi Salamah ra. : Aku seorang anak laki-laki di bawah asuhan Rasulullah Saw dan tanganku biasa
Materi pelajaran Biologi kelas 11 Disusun oleh: Dra. Tetty Afianti KECEPATAN REAKSI Diriwayatkan dari Umar abi Salamah ra. : Aku seorang anak laki-laki di bawah asuhan Rasulullah Saw dan tanganku biasa
Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Chapter 8 Kinetika Kimia Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Chapter 8 Kinetika Kimia Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
Kode KIM.10. Laju Reaksi
 Kode KIM.10 Laju Reaksi BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN NASIONAL 2004 BAB I. PENDAHULUAN
Kode KIM.10 Laju Reaksi BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN NASIONAL 2004 BAB I. PENDAHULUAN
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
Kesetimbangan Kimia KIM 2 A. PENDAHULUAN B. REAKSI KESETIMBANGAN. α = KESETIMBANGAN KIMIA. materi78.co.nr. setimbang
 konsentrasi laju reaksi materi78.co.nr Kesetimbangan Kimia A. PENDAHULUAN Reaksi satu arah (irreversible) atau reaksi tidak dapat balik adalah reaksi yang terjadi pada satu arah, dan produknya tidak dapat
konsentrasi laju reaksi materi78.co.nr Kesetimbangan Kimia A. PENDAHULUAN Reaksi satu arah (irreversible) atau reaksi tidak dapat balik adalah reaksi yang terjadi pada satu arah, dan produknya tidak dapat
Waktu (t) Gambar 3.1 Grafik hubungan perubahan konsentrasi terhadap waktu
 3 LAJU REAKSI Setelah mempelajari bab ini, kamu diharapkan mampu: Menghitung konsentrasi larutan (molaritas larutan). Menganalisis faktor-faktor yang mempengaruhi laju reaksi (konsentrasi, luas permukaan,
3 LAJU REAKSI Setelah mempelajari bab ini, kamu diharapkan mampu: Menghitung konsentrasi larutan (molaritas larutan). Menganalisis faktor-faktor yang mempengaruhi laju reaksi (konsentrasi, luas permukaan,
Sulistyani, M.Si.
 Sulistyani, M.Si. Email: sulistyani@uny.ac.id Laju reaksi adalah laju pengurangan reaktan tiap satuan waktu atau laju pembentukan produk tiap satuan waktu. Laju reaksi dipengaruhi oleh: sifat dan keadan
Sulistyani, M.Si. Email: sulistyani@uny.ac.id Laju reaksi adalah laju pengurangan reaktan tiap satuan waktu atau laju pembentukan produk tiap satuan waktu. Laju reaksi dipengaruhi oleh: sifat dan keadan
Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan
 KINETIKA Pendahuluan Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan Namun persamaan reaksi tidak dapat menjawab :. Seberapa cepat reaksi berlangsung 2. Bagaimana
KINETIKA Pendahuluan Perubahan kimia secara sederhana ditulis dalam persamaan reaksi dengan kondisi kesetimbangan Namun persamaan reaksi tidak dapat menjawab :. Seberapa cepat reaksi berlangsung 2. Bagaimana
SOAL LAJU REAKSI. Mol CaCO 3 = = 0.25 mol = 25. m Mr
 SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
SOAL LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml A. 5 ml B. 10 ml C. 2.5 ml D. 15 ml E. 5.5 ml : A Mencari volume yang dibutuhkan pada proses
Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam
 Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam sistem pada kesetimbangan Uap mengembun dengan laju
Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam sistem pada kesetimbangan Uap mengembun dengan laju
Kesetimbangan Kimia. Tim Dosen Kimia Dasar FTP
 Kesetimbangan Kimia Tim Dosen Kimia Dasar FTP Pengertian kesetimbangan kimia Suatu sistem dikatakan setimbang jika dua proses yang berlawanan terjadi dengan laju yang sama atau dengan kata lain tidak terjadi
Kesetimbangan Kimia Tim Dosen Kimia Dasar FTP Pengertian kesetimbangan kimia Suatu sistem dikatakan setimbang jika dua proses yang berlawanan terjadi dengan laju yang sama atau dengan kata lain tidak terjadi
TERMOKIMIA. VURI AYU SETYOWATI, S.T., M.Sc TEKNIK MESIN - ITATS
 TERMOKIMIA VURI AYU SETYOWATI, S.T., M.Sc TEKNIK MESIN - ITATS PENGERTIAN Termokimia adalah cabang dari ilmu kimia yang mempelajari hubungan antara reaksi dengan panas. HAL-HAL YANG DIPELAJARI Perubahan
TERMOKIMIA VURI AYU SETYOWATI, S.T., M.Sc TEKNIK MESIN - ITATS PENGERTIAN Termokimia adalah cabang dari ilmu kimia yang mempelajari hubungan antara reaksi dengan panas. HAL-HAL YANG DIPELAJARI Perubahan
MODUL 1 TERMOKIMIA. A. Hukum Pertama Termodinamika. B. Kalor Reaksi
 MODUL 1 TERMOKIMIA Termokimia adalah ilmu yang mempelajari hubungan antara energi panas dan energi kimia. Sebagai prasyarat untuk mempelajari termokimia, kita harus mengetahui tentang perbedaan kalor (Q)
MODUL 1 TERMOKIMIA Termokimia adalah ilmu yang mempelajari hubungan antara energi panas dan energi kimia. Sebagai prasyarat untuk mempelajari termokimia, kita harus mengetahui tentang perbedaan kalor (Q)
Bahasan: Mempelajari kecepatan/laju reaksi suatu proses/perubahan kimia. reaksi berlangsung mekanisme reaksi
 Mempelajari kecepatan/laju reaksi suatu proses/perubahan kimia. Kinetika juga mempelajari bagaimana reaksi berlangsung mekanisme reaksi Referensi: Brown et.al; Chemistry, The Central Science, 11th edition
Mempelajari kecepatan/laju reaksi suatu proses/perubahan kimia. Kinetika juga mempelajari bagaimana reaksi berlangsung mekanisme reaksi Referensi: Brown et.al; Chemistry, The Central Science, 11th edition
Laboratorium Kimia SMA... Praktikum II Kelas XI IPA Semester I Tahun Pelajaran.../...
 Laboratorium Kimia SMA... Praktikum II Kelas XI IPA Semester I Tahun Pelajaran.../... Judul : Faktor-Faktor yang Mempengaruhi Laju Reaksi Praktikan : mor Absen : Kelas : Tanggal : Lembar Kegiatan Siswa
Laboratorium Kimia SMA... Praktikum II Kelas XI IPA Semester I Tahun Pelajaran.../... Judul : Faktor-Faktor yang Mempengaruhi Laju Reaksi Praktikan : mor Absen : Kelas : Tanggal : Lembar Kegiatan Siswa
Contoh Soal & Pembahasan Reaksi Kesetimbangan
 Soal No.1 Contoh Soal & Pembahasan Reaksi Kesetimbangan Reaksi kimia ada yang berlangsung searah (berkesudahan) dan ada yang dapat balik (bolak-balik). Jelaskan perbedaanya disertai dengan contoh-contohnya.
Soal No.1 Contoh Soal & Pembahasan Reaksi Kesetimbangan Reaksi kimia ada yang berlangsung searah (berkesudahan) dan ada yang dapat balik (bolak-balik). Jelaskan perbedaanya disertai dengan contoh-contohnya.
PRAKTIKUM KIMIA DASAR I KECEPATAN REAKSI. Kelompok V : Amir Hamzah Umi Kulsum
 PRAKTIKUM KIMIA DASAR I KECEPATAN REAKSI Kelompok V : Amir Hamzah 1415005 Umi Kulsum 1415018 AKADEMI KIMIA ANALISIS CARAKA NUSANTARA CIMANGGIS, KELAPA DUA DEPOK, 2015 BAB 1 PENDAHULUAN 1.1 Latar Belakang
PRAKTIKUM KIMIA DASAR I KECEPATAN REAKSI Kelompok V : Amir Hamzah 1415005 Umi Kulsum 1415018 AKADEMI KIMIA ANALISIS CARAKA NUSANTARA CIMANGGIS, KELAPA DUA DEPOK, 2015 BAB 1 PENDAHULUAN 1.1 Latar Belakang
SOAL-SOAL KESETIMBANGAN KIMIA
 H=+380 kj/mol SOAL-SOAL KESETIMBANGAN KIMIA 1. Ebtanas 99 Suatu reaksi berada dalam keadaan setimbang apabila A. Reaksi ke kanan dan kiri telah berhenti B. Mol pereaksi selalu sama dengan mol hasil reaksi
H=+380 kj/mol SOAL-SOAL KESETIMBANGAN KIMIA 1. Ebtanas 99 Suatu reaksi berada dalam keadaan setimbang apabila A. Reaksi ke kanan dan kiri telah berhenti B. Mol pereaksi selalu sama dengan mol hasil reaksi
Siswa diingatkan tentang struktur atom, bilangan kuantum, bentuk-bentuk orbital, dan konfigurasi elektron
 RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
SOAL KIMIA 2 KELAS : XI IPA
 SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
c. Suhu atau Temperatur
 Pada laju reaksi terdapat faktor-faktor yang dapat mempengaruhi laju reaksi. Selain bergantung pada jenis zat yang beraksi laju reaksi dipengaruhi oleh : a. Konsentrasi Pereaksi Pada umumnya jika konsentrasi
Pada laju reaksi terdapat faktor-faktor yang dapat mempengaruhi laju reaksi. Selain bergantung pada jenis zat yang beraksi laju reaksi dipengaruhi oleh : a. Konsentrasi Pereaksi Pada umumnya jika konsentrasi
Katalis 1. Pengertian Katalis 2. Jenis Katalis a. Katalis Homogen
 Katalis 1. Pengertian Katalis Katalis merupakan suatu zat yang dapat mempercepat laju reaksi dalam reaksi kimia pada suhu tertentu, tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri. Suatu
Katalis 1. Pengertian Katalis Katalis merupakan suatu zat yang dapat mempercepat laju reaksi dalam reaksi kimia pada suhu tertentu, tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri. Suatu
k = A. e -E/RT Secara sistematis hubungan suhu dan laju reaksi dapat ditulis sebagai berikut: v 2 = 2n x v 1 dan t 2 = t 1/ 2 n
 POKOK BAHASAN I. LAJU REAKSI 1.1 Pengertian Laju Reaksi Laju reaksi didefinisikan sebagai laju berkurangnya konsentrasi zat pereaksi (reaktan) atau laju bertambahnya hasil reaksi (produk) tiap satu satuan
POKOK BAHASAN I. LAJU REAKSI 1.1 Pengertian Laju Reaksi Laju reaksi didefinisikan sebagai laju berkurangnya konsentrasi zat pereaksi (reaktan) atau laju bertambahnya hasil reaksi (produk) tiap satu satuan
LAJU REAKSI MEKANISME REAKSI
 KINETIKA KIMIA LAJU REAKSI BAGAIMANA PERUB. KIMIA TSB BERLANGSUNG - BESI MUDAH BERKARAT PD UDARA YANG LEMBAB - MAKANAN LEBIH CEPAT BUSUK BILA TIDAK DIINGINKAN MEKANISME REAKSI - PENJUMLAHAN TAHAP TAHAP
KINETIKA KIMIA LAJU REAKSI BAGAIMANA PERUB. KIMIA TSB BERLANGSUNG - BESI MUDAH BERKARAT PD UDARA YANG LEMBAB - MAKANAN LEBIH CEPAT BUSUK BILA TIDAK DIINGINKAN MEKANISME REAKSI - PENJUMLAHAN TAHAP TAHAP
KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN
 KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN 1. Suatu reaksi dikatakan mencapai kesetimbangan apabila. A. laju reaksi ke kiri sama dengan ke kanan B. jumlah koefisien reaksi ruas kiri sama dengan ruas kanan
KESETIMBANGAN KIMIA SOAL DAN PEMBAHASAN 1. Suatu reaksi dikatakan mencapai kesetimbangan apabila. A. laju reaksi ke kiri sama dengan ke kanan B. jumlah koefisien reaksi ruas kiri sama dengan ruas kanan
RENCANA PELAKSANAAN PEMBELAJARAN ( R P P )
 PEMERINTAH KOTA YOGYAKARTA DINAS PENDIDIKAN SMA NEGERI 6 YOGYAKARTA The Research School of Jogja Jalan C. Simanjuntak No Yogyakarta 55, Telepon 0 55/ Faximile 0 5660 E-mail : sman6@sman6-yogya.sch.id,
PEMERINTAH KOTA YOGYAKARTA DINAS PENDIDIKAN SMA NEGERI 6 YOGYAKARTA The Research School of Jogja Jalan C. Simanjuntak No Yogyakarta 55, Telepon 0 55/ Faximile 0 5660 E-mail : sman6@sman6-yogya.sch.id,
LAPORAN PRAKTIKUM KIMIA FISIKA PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI
 LAPORAN PRAKTIKUM KIMIA FISIKA PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI OLEH : KELOMPOK III Nama : Rifqi Munip (061330401022) Riska (061330401023) Sarah Swasti Putri (061330401024) Siti Nurjanah (061330401025)
LAPORAN PRAKTIKUM KIMIA FISIKA PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI OLEH : KELOMPOK III Nama : Rifqi Munip (061330401022) Riska (061330401023) Sarah Swasti Putri (061330401024) Siti Nurjanah (061330401025)
Laporan Praktikum Kimia Laju Reaksi
 Laporan Praktikum Kimia Laju Reaksi Oleh: 1. Kurniawan Eka Yuda (5) 2. Tri Puji Lestari (23) 3. Rina Puspitasari (17) 4. Elva Alvivah Almas (11) 5. Rusti Nur Anggraeni (35) 6. Eki Aisyah (29) Kelas XI
Laporan Praktikum Kimia Laju Reaksi Oleh: 1. Kurniawan Eka Yuda (5) 2. Tri Puji Lestari (23) 3. Rina Puspitasari (17) 4. Elva Alvivah Almas (11) 5. Rusti Nur Anggraeni (35) 6. Eki Aisyah (29) Kelas XI
10 mlhcl2 M. 10 ml HCl2 M. Na 2 S 2 O 3 0,2 M KIM/ IND- II
 10 mlhcl2 M 10 ml HCl2 M 10 mlhcl2 M Na 2 S 2 O 3 0,2 M Na 2 S 2 O 3 0,2 M Na 2 S 2 O 3 0,2 M KIM/ IND- II BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL
10 mlhcl2 M 10 ml HCl2 M 10 mlhcl2 M Na 2 S 2 O 3 0,2 M Na 2 S 2 O 3 0,2 M Na 2 S 2 O 3 0,2 M KIM/ IND- II BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL
SILABUS Sekolah : SMA Negeri 5 Surabaya Mata Pelajaran : Kimia Kelas/semester : XI/1 Referensi : BSNP / CIE Standar Kompetensi
 SILABUS Sekolah : SMA Negeri 5 Surabaya Mata Pelajaran : Kimia Kelas/semester : /1 Referensi : BSNP / CIE Standar Kompetensi : 1.Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur
SILABUS Sekolah : SMA Negeri 5 Surabaya Mata Pelajaran : Kimia Kelas/semester : /1 Referensi : BSNP / CIE Standar Kompetensi : 1.Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur
BAB II KAJIAN PUSTAKA. kemampuan adalah karakteristik yang menonjol dari seorang individu yang
 BAB II KAJIAN PUSTAKA 2.1 Defenisi Kemampuan Kemampuan sama dengan kata kesanggupan atau kecakapan. Dengan bahasa yang lebih terperinci, kemampuan dapat diartikan sebagai kesanggupan individu untuk melakukan
BAB II KAJIAN PUSTAKA 2.1 Defenisi Kemampuan Kemampuan sama dengan kata kesanggupan atau kecakapan. Dengan bahasa yang lebih terperinci, kemampuan dapat diartikan sebagai kesanggupan individu untuk melakukan
LAPORAN PRAKTIKUM KIMIA DASAR
 LAPORAN PRAKTIKUM KIMIA DASAR KECEPATAN REAKSI Disusun Oleh : 1. Achmad Zaimul Khaqqi (132500030) 2. Dinda Kharisma Asmara (132500014) 3. Icha Restu Maulidiah (132500033) 4. Jauharatul Lailiyah (132500053)
LAPORAN PRAKTIKUM KIMIA DASAR KECEPATAN REAKSI Disusun Oleh : 1. Achmad Zaimul Khaqqi (132500030) 2. Dinda Kharisma Asmara (132500014) 3. Icha Restu Maulidiah (132500033) 4. Jauharatul Lailiyah (132500053)
BAB IV TEMUAN DAN PEMBAHASAN. Dalam pengembangan strategi pembelajaran intertekstual pada materi
 BAB IV TEMUAN DAN PEMBAHASAN Dalam pengembangan strategi pembelajaran intertekstual pada materi pokok kesetimbangan kimia secara garis besar penelitian terbagi dalam beberapa tahapan yaitu: Tahap pertama
BAB IV TEMUAN DAN PEMBAHASAN Dalam pengembangan strategi pembelajaran intertekstual pada materi pokok kesetimbangan kimia secara garis besar penelitian terbagi dalam beberapa tahapan yaitu: Tahap pertama
K13 Revisi Antiremed Kelas 11 Kimia
 K3 Revisi Antiremed Kelas Kimia Persiapan Penilaian Ahir Semester (PAS) Ganjil Doc. Name: RK3ARKIM0PAS Version : 06- halaman 0. Untu memperoleh onsentrasi Cl - =0,0 M, maa 50 ml larutan CaCl 0,5 M harus
K3 Revisi Antiremed Kelas Kimia Persiapan Penilaian Ahir Semester (PAS) Ganjil Doc. Name: RK3ARKIM0PAS Version : 06- halaman 0. Untu memperoleh onsentrasi Cl - =0,0 M, maa 50 ml larutan CaCl 0,5 M harus
Laju reaksi menunjukkan perubahan konsentrasi pereaksi atau hasil reaksi persatuan waktu.
 Bab IV Laju Reaksi Sumber: Ebbing, General Chemistry Laju reaksi menunjukkan perubahan konsentrasi pereaksi atau hasil reaksi persatuan waktu. TUJUAN PEMBELAJARAN Setelah mengikuti pembelajaran siswa dapat
Bab IV Laju Reaksi Sumber: Ebbing, General Chemistry Laju reaksi menunjukkan perubahan konsentrasi pereaksi atau hasil reaksi persatuan waktu. TUJUAN PEMBELAJARAN Setelah mengikuti pembelajaran siswa dapat
Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka
 Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka waktu reaksi berlangsung pada suhu 90 o C Susu dipasteurisasi
Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka waktu reaksi berlangsung pada suhu 90 o C Susu dipasteurisasi
Laju Reaksi. Kode KIM.10
 Kode KIM.10 Laju Reaksi BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN NASIONAL 004 Kim. 10. Laju Reaksi
Kode KIM.10 Laju Reaksi BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN NASIONAL 004 Kim. 10. Laju Reaksi
Laporan Kimia Fisik KI-3141
 Laporan Kimia Fisik KI-3141 PERCOBN M-1 KINETIK HLOGENSI SETON DENGN KTLISTOR SM Nama : Kartika Trianita NIM : 1517 Kelompok : 2 Tanggal Percobaan : 22 Oktober 212 Tanggal Laporan : 2 November 212 sisten
Laporan Kimia Fisik KI-3141 PERCOBN M-1 KINETIK HLOGENSI SETON DENGN KTLISTOR SM Nama : Kartika Trianita NIM : 1517 Kelompok : 2 Tanggal Percobaan : 22 Oktober 212 Tanggal Laporan : 2 November 212 sisten
KESETIMBANGAN KIMIA. Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I. SK+KD+Indikator Materi Evaluasi Referensi
 KESETIMBANGAN KIMIA Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I SK+KD+Indikator Materi Evaluasi Referensi Standar Kompetensi dan Kompetensi Dasar Standar Kompetensi Kompetensi Dasar Standar Kompetensi
KESETIMBANGAN KIMIA Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I SK+KD+Indikator Materi Evaluasi Referensi Standar Kompetensi dan Kompetensi Dasar Standar Kompetensi Kompetensi Dasar Standar Kompetensi
Kesetimbangan Kimia. Bab 4
 Kesetimbangan Kimia Bab 4 Standar Kompetensi 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang memengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri Kompetensi
Kesetimbangan Kimia Bab 4 Standar Kompetensi 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang memengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri Kompetensi
Disampaikan oleh : Dr. Sri Handayani 2013
 Disampaikan oleh : Dr. Sri Handayani 2013 PENGERTIAN Termokimia adalah cabang dari ilmu kimia yang mempelajari hubungan antara reaksi dengan panas. HAL-HAL YANG DIPELAJARI Perubahan energi yang menyertai
Disampaikan oleh : Dr. Sri Handayani 2013 PENGERTIAN Termokimia adalah cabang dari ilmu kimia yang mempelajari hubungan antara reaksi dengan panas. HAL-HAL YANG DIPELAJARI Perubahan energi yang menyertai
LAPORAN PRAKTIKUM DINAMIKA KIMIA JUDUL PERCOBAAN : PENENTUAN LAJU REAKSI IODINASI ASETON DALAM SUASANA ASAM. Nama : SantiNurAini NRP :
 LAPORAN PRAKTIKUM DINAMIKA KIMIA JUDUL PERCOBAAN : PENENTUAN LAJU REAKSI IODINASI ASETON DALAM SUASANA ASAM Nama : SantiNurAini NRP : 1413100048 Tanggal Praktikum : 28 April 2015 Nama Asisten : Mas Mattius
LAPORAN PRAKTIKUM DINAMIKA KIMIA JUDUL PERCOBAAN : PENENTUAN LAJU REAKSI IODINASI ASETON DALAM SUASANA ASAM Nama : SantiNurAini NRP : 1413100048 Tanggal Praktikum : 28 April 2015 Nama Asisten : Mas Mattius
Kurikulum 2013 Kelas 11 Kimia
 Kuriulum 03 Kelas Kimia Persiapan UAS - Latihan Soal Doc. Name: K3ARKIM0UAS Version : 06-05 halaman 0. Untu memperoleh onsentrasi Cl - = 0,0 M, maa 50 ml larutan CaCl 0,5 M harus dienceran sampai 500 ml
Kuriulum 03 Kelas Kimia Persiapan UAS - Latihan Soal Doc. Name: K3ARKIM0UAS Version : 06-05 halaman 0. Untu memperoleh onsentrasi Cl - = 0,0 M, maa 50 ml larutan CaCl 0,5 M harus dienceran sampai 500 ml
STOIKIOMETRI I. HUKUM DASAR ILMU KIMIA
 STOIKIOMETRI I. HUKUM DASAR ILMU KIMIA a. Hukum Kekekalan Massa (Hukum Lavoisier) Massa zat sebelum dan sesudah reaksi adalah sama. Contoh: S + O 2 SO 2 2 gr 32 gr 64 gr b. Hukum Perbandingan Tetap (Hukum
STOIKIOMETRI I. HUKUM DASAR ILMU KIMIA a. Hukum Kekekalan Massa (Hukum Lavoisier) Massa zat sebelum dan sesudah reaksi adalah sama. Contoh: S + O 2 SO 2 2 gr 32 gr 64 gr b. Hukum Perbandingan Tetap (Hukum
SILABUS PEMBELAJARAN
 SILABUS PEMBELAJARAN Nama Sekolah : SMA... mata Pelajaran : KIMIA Kelas/Semester : XI/1 Standar Kompetensi : 1. Memahami struktur atom dan meramalkan sifat-sifat periodik unsur, struktur molekul dan dan
SILABUS PEMBELAJARAN Nama Sekolah : SMA... mata Pelajaran : KIMIA Kelas/Semester : XI/1 Standar Kompetensi : 1. Memahami struktur atom dan meramalkan sifat-sifat periodik unsur, struktur molekul dan dan
KISI KISI SOAL UJIAN SEKOLAH SMK SE-KABUPATEN CIAMIS TP. 2013/2014
 Mata Pelajaran : KIMIA KISI KISI UJIAN SEKOLAH SMK SE-KABUPATEN CIAMIS TP. 2013/2014 TINGKAT 1 Memahami konsep materi dan perubahannya Pengertian perubahan Kimia dan Fisika dijelaskan melalui contoh-contoh
Mata Pelajaran : KIMIA KISI KISI UJIAN SEKOLAH SMK SE-KABUPATEN CIAMIS TP. 2013/2014 TINGKAT 1 Memahami konsep materi dan perubahannya Pengertian perubahan Kimia dan Fisika dijelaskan melalui contoh-contoh
Gambar 2.1 Reaksi Saponifikasi tripalmitin
 I. JUDUL : Kinetika Reaksi Saponifikasi Etil Asetat II. TANGGAL PERCOBAAN : Rabu, 16 November 2011 III. TUJUAN : 1. Untuk memberikan gambaran bahwa reaksi penyabunan etil asetat oleh ion hidroksida adalah
I. JUDUL : Kinetika Reaksi Saponifikasi Etil Asetat II. TANGGAL PERCOBAAN : Rabu, 16 November 2011 III. TUJUAN : 1. Untuk memberikan gambaran bahwa reaksi penyabunan etil asetat oleh ion hidroksida adalah
Kelompok 8. Agustinus Hardika Abdurahman yahya Adimas Syahputra Fernando Basadumanta Mahadin Zatirahman Muhammad Farhan Kamal
 ENERGI IKATAN Kelompok 8 Agustinus Hardika Abdurahman yahya Adimas Syahputra Fernando Basadumanta Mahadin Zatirahman Muhammad Farhan Kamal Pengertian Energi ikatan didefinisikan sebagai sejumlah energi
ENERGI IKATAN Kelompok 8 Agustinus Hardika Abdurahman yahya Adimas Syahputra Fernando Basadumanta Mahadin Zatirahman Muhammad Farhan Kamal Pengertian Energi ikatan didefinisikan sebagai sejumlah energi
LAPORAN PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI
 LAPORAN PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI I. Tujuan Percobaan 1. Mempelajari pengaruh suhu terhadap laju reaksi 2. Menghitung energi aktivasi (Ea) dengan menggunakan persamaan Arrhenius II. Dasar
LAPORAN PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI I. Tujuan Percobaan 1. Mempelajari pengaruh suhu terhadap laju reaksi 2. Menghitung energi aktivasi (Ea) dengan menggunakan persamaan Arrhenius II. Dasar
HALAMAN PENGESAHAN LAPORAN RESMI PRAKTIKUM KIMIA DASAR. :4. Pengaruh Konsentrasi dan Suhu Pada Laju Reaksi. 6. John Peterson Serius
 HALAMAN PENGESAHAN LAPORAN RESMI PRAKTIKUM KIMIA DASAR Nama Percobaan :4. Pengaruh Konsentrasi dan Suhu Pada Laju Reaksi Kelompok :12 (Dua Belas) Nama :1 Muhammad Dary Dzaky (1404015185) 2. Ina Subiyanti
HALAMAN PENGESAHAN LAPORAN RESMI PRAKTIKUM KIMIA DASAR Nama Percobaan :4. Pengaruh Konsentrasi dan Suhu Pada Laju Reaksi Kelompok :12 (Dua Belas) Nama :1 Muhammad Dary Dzaky (1404015185) 2. Ina Subiyanti
LEMBAR KERJA SISWA 2
 76 LEMBAR KERJA SISWA 2 Mata Pelajaran Kelas / Semester Materi pokok Submateri pokok Alokasi Waktu : Kimia : XI/ganjil : Laju Reaksi : Konsep Laju Reaksi : 2 x 45 menit Standar Kompetensi 3. Memahami Kinetika
76 LEMBAR KERJA SISWA 2 Mata Pelajaran Kelas / Semester Materi pokok Submateri pokok Alokasi Waktu : Kimia : XI/ganjil : Laju Reaksi : Konsep Laju Reaksi : 2 x 45 menit Standar Kompetensi 3. Memahami Kinetika
Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka
 Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka waktu reaksi berlangsung pada suhu 90 o C Susu dipasteurisasi
Laju reaksi meningkat menjadi 2 kali laju reaksi semula pada setiap kenaikan suhu 15 o C. jika pada suhu 30 o C reaksi berlangsung 64 menit, maka waktu reaksi berlangsung pada suhu 90 o C Susu dipasteurisasi
Kritis Variabel Superordinat Koordinat Subordinat. reaksi. Katalis. Partikelpartikel. Molekul pereaksi dalam wadahnya selalu bergerak
 19 Tabel 2. Analisis konsep materi laju Label Konsep Laju Reaksi Definisi Konsep Menyatakan laju perubahan konsentrasi zatzat yaitu zat pe (reaktan) atau zat hasil (produk), setiap satuan waktu berlangsung
19 Tabel 2. Analisis konsep materi laju Label Konsep Laju Reaksi Definisi Konsep Menyatakan laju perubahan konsentrasi zatzat yaitu zat pe (reaktan) atau zat hasil (produk), setiap satuan waktu berlangsung
Sulistyani, M.Si.
 Sulistyani, M.Si. sulistyani@uny.ac.id Termokimia adalah cabang dari ilmu kimia yang mempelajari hubungan antara reaksi dengan panas. Cakupan Perubahan energi yang menyertai reaksi kimia Reaksi kimia yang
Sulistyani, M.Si. sulistyani@uny.ac.id Termokimia adalah cabang dari ilmu kimia yang mempelajari hubungan antara reaksi dengan panas. Cakupan Perubahan energi yang menyertai reaksi kimia Reaksi kimia yang
LAPORAN PRAKTIKUM PERCOBAAN PRAKTKUM 1 LAJU REAKSI
 LAPORAN PRAKTIKUM PERCOBAAN PRAKTKUM 1 LAJU REAKSI DOSEN PENGAMPU : ANDI HIMYATUL HIDAYAH, S.Si.,Apt. DISUSUSN OLEH : FILDZAH MAULIDA NIM. 37.2016.7.1.81454 PROGRAM STUDI FARMASI FAKULTAS ILMU KESEHATAN
LAPORAN PRAKTIKUM PERCOBAAN PRAKTKUM 1 LAJU REAKSI DOSEN PENGAMPU : ANDI HIMYATUL HIDAYAH, S.Si.,Apt. DISUSUSN OLEH : FILDZAH MAULIDA NIM. 37.2016.7.1.81454 PROGRAM STUDI FARMASI FAKULTAS ILMU KESEHATAN
BAB II KAJIAN PUSTAKA. salah yang artinya tidak benar, tidak betul atau keliru. Jadi, kesalahan dalam memecahkan
 BAB II KAJIAN PUSTAKA. Kesalahan Pemahaman Siswa Kesalahan menurut kamus besar Bahasa Indonesia (007:98) berasal dari kata dasar salah yang artinya tidak benar, tidak betul atau keliru. Jadi, kesalahan
BAB II KAJIAN PUSTAKA. Kesalahan Pemahaman Siswa Kesalahan menurut kamus besar Bahasa Indonesia (007:98) berasal dari kata dasar salah yang artinya tidak benar, tidak betul atau keliru. Jadi, kesalahan
PERCOBAAN 3 PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI
 LAPORAN PRAKTIKUM KIMIA FISIKA Nama : Any Kurniawati Kelompok : 6 NIM : 4301410009 Prodi/Jurusan : Pend. Kimia/Kimia Dosen : Ir. Sri Wahyuni, M.Si Tanggal Praktikum : 19 September 2012 Teman kerja : Fitriya
LAPORAN PRAKTIKUM KIMIA FISIKA Nama : Any Kurniawati Kelompok : 6 NIM : 4301410009 Prodi/Jurusan : Pend. Kimia/Kimia Dosen : Ir. Sri Wahyuni, M.Si Tanggal Praktikum : 19 September 2012 Teman kerja : Fitriya
Karena volumnya adalah satu liter, maka konsentrasinya tinggal masukkan molnya masingmasing.
 Kimia Study Center - Contoh soal dan pembahasan tentang kesetimbangan kimia SMA kelas 11 IPA. Tetapan kesetimbangan berdasarkan konsentrasi dan tekanan parsial gas. Soal No. 1 Tentukan persamaan tetapan
Kimia Study Center - Contoh soal dan pembahasan tentang kesetimbangan kimia SMA kelas 11 IPA. Tetapan kesetimbangan berdasarkan konsentrasi dan tekanan parsial gas. Soal No. 1 Tentukan persamaan tetapan
RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 2 JP
 RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 2 JP Standar Kompetensi 1. Memahami kinetika reaksi dan kesetimbangan kimia
RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 2 JP Standar Kompetensi 1. Memahami kinetika reaksi dan kesetimbangan kimia
Reaksi kimia. Lambang-lambang yang digunakan dalam persamaan reaksi, antara lain:
 Reaksi kimia Reaksi kimia A Persamaan Reaksi Persamaan reaksi menggambarkan reaksi kimia yang terdiri atas rumus kimia pereaksi dan hasil reaksi disertai koefisien masing-masing. Pada reaksi kimia, satu
Reaksi kimia Reaksi kimia A Persamaan Reaksi Persamaan reaksi menggambarkan reaksi kimia yang terdiri atas rumus kimia pereaksi dan hasil reaksi disertai koefisien masing-masing. Pada reaksi kimia, satu
Oleh. Dewi Candrawati
 126 Lampiran 4 Oleh Dewi Candrawati 2014 127 Petunjuk Pengerjaan: 1. Tes diagnostik ini terdiri dari delapan soal pilihan ganda dua tingkat. 2. Setiap soal memiliki 4 pilihan jawaban dan 5 pilihan alasan.
126 Lampiran 4 Oleh Dewi Candrawati 2014 127 Petunjuk Pengerjaan: 1. Tes diagnostik ini terdiri dari delapan soal pilihan ganda dua tingkat. 2. Setiap soal memiliki 4 pilihan jawaban dan 5 pilihan alasan.
LEMBARAN SOAL 7. Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA )
 LEMBARAN SOAL 7 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal
LEMBARAN SOAL 7 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal
HAND OUT KIMIA XI IPA BAB III LAJU REAKSI
 HAND OUT KIMIA XI IPA BAB III LAJU REAKSI 1 BAB III LAJU REAKSI I. Standarkompetensi Memahami Kinetika reaksi, kesetimbangan kimia dan factor-faktor yang mempengaruhinya serta penerapannya dalam kehidupan
HAND OUT KIMIA XI IPA BAB III LAJU REAKSI 1 BAB III LAJU REAKSI I. Standarkompetensi Memahami Kinetika reaksi, kesetimbangan kimia dan factor-faktor yang mempengaruhinya serta penerapannya dalam kehidupan
No Indikator Soal Valid
 107 Lampiran 3 Rekapitulasi asi Instrumen TDM-TWO-TIER No Indikator Soal 1 Memahami kesetimbangan Reaksi kesetimbangan antara N 2 O 4 dengan NO 2 mengikuti persamaan kimia berikut ini : ator 1 :- dinamis
107 Lampiran 3 Rekapitulasi asi Instrumen TDM-TWO-TIER No Indikator Soal 1 Memahami kesetimbangan Reaksi kesetimbangan antara N 2 O 4 dengan NO 2 mengikuti persamaan kimia berikut ini : ator 1 :- dinamis
SILABUS DAN PENILAIAN
 SILABUS DAN PENILAIAN Sekolah : SMA Negeri 78 Jakarta Mata Pelajaan : Kimia 2 ( 4 SKS) Standar Kompetensi : 1. Memahami perubahan energi dalam kimia dan cara pengukurannya Kompetensi Dasar Indikator Materi
SILABUS DAN PENILAIAN Sekolah : SMA Negeri 78 Jakarta Mata Pelajaan : Kimia 2 ( 4 SKS) Standar Kompetensi : 1. Memahami perubahan energi dalam kimia dan cara pengukurannya Kompetensi Dasar Indikator Materi
MODUL I Pembuatan Larutan
 MODUL I Pembuatan Larutan I. Tujuan percobaan - Membuat larutan dengan metode pelarutan padatan. - Melakukan pengenceran larutan dengan konsentrasi tinggi untuk mendapatkan larutan yang diperlukan dengan
MODUL I Pembuatan Larutan I. Tujuan percobaan - Membuat larutan dengan metode pelarutan padatan. - Melakukan pengenceran larutan dengan konsentrasi tinggi untuk mendapatkan larutan yang diperlukan dengan
Kinetika Kimia. Abdul Wahid Surhim
 Kinetika Kimia bdul Wahid Surhim 2014 Kerangka Pembelajaran Laju Reaksi Hukum Laju dan Orde Reaksi Hukum Laju Terintegrasi untuk Reaksi Orde Pertama Setengah Reaksi Orde Pertama Reaksi Orde Kedua Laju
Kinetika Kimia bdul Wahid Surhim 2014 Kerangka Pembelajaran Laju Reaksi Hukum Laju dan Orde Reaksi Hukum Laju Terintegrasi untuk Reaksi Orde Pertama Setengah Reaksi Orde Pertama Reaksi Orde Kedua Laju
Lampiran 9. Kisi-Kisi Soal Kimia SwC Kelas XI
 Lampiran 9 Kisi-Kisi Kimia SwC Kelas XI 159 Bidang Studi : Kimia Kelas/Semester : XI/1 : 50 KISI-KISI SOAL LATIHAN KIMIA SwC KELAS XI Standar 1. Memahami struktur atom untuk meramalkan sifat-sifat periodik
Lampiran 9 Kisi-Kisi Kimia SwC Kelas XI 159 Bidang Studi : Kimia Kelas/Semester : XI/1 : 50 KISI-KISI SOAL LATIHAN KIMIA SwC KELAS XI Standar 1. Memahami struktur atom untuk meramalkan sifat-sifat periodik
KESETIMBANGAN. titik setimbang
 KESETIMBANGAN STANDART KOMPETENSI;. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang berpengaruh, serta penerapannya dalam kehidupan sehari-hari. KOMPETENSI DASAR;.. Menjelaskan kestimbangan
KESETIMBANGAN STANDART KOMPETENSI;. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang berpengaruh, serta penerapannya dalam kehidupan sehari-hari. KOMPETENSI DASAR;.. Menjelaskan kestimbangan
DAFTAR ISI. KATA PENGANTAR... i. DAFTAR ISI... iv. DAFTAR TABEL... vi. DAFTAR GAMBAR... vii. DAFTAR LAMPIRAN... ix BAB I PENDAHULUAN...
 DAFTAR ISI ABSTRAK KATA PENGANTAR... i DAFTAR ISI... iv DAFTAR TABEL... vi DAFTAR GAMBAR... vii DAFTAR LAMPIRAN... ix BAB I PENDAHULUAN... 1 A. Latar Belakang... 1 B. Rumusan Masalah... 5 C. Tujuan Penelitian...
DAFTAR ISI ABSTRAK KATA PENGANTAR... i DAFTAR ISI... iv DAFTAR TABEL... vi DAFTAR GAMBAR... vii DAFTAR LAMPIRAN... ix BAB I PENDAHULUAN... 1 A. Latar Belakang... 1 B. Rumusan Masalah... 5 C. Tujuan Penelitian...
KISI UJI KOMPETENSI 2013 MATA PELAJARAN KIMIA
 KISI UJI KOMPETENSI 2013 MATA PELAJARAN KIMIA Kompetensi Menguasai karakteristik peserta Mengidentifikasi kesulitan belajar didik dari aspek fisik, moral, peserta didik dalam mata pelajaran spiritual,
KISI UJI KOMPETENSI 2013 MATA PELAJARAN KIMIA Kompetensi Menguasai karakteristik peserta Mengidentifikasi kesulitan belajar didik dari aspek fisik, moral, peserta didik dalam mata pelajaran spiritual,
Kinetika Kimia dan Mekanisme Reaksi
 Kinetika Kimia dan Mekanisme Reaksi Kinetika Kimia Kinetika kimia adalah ilmu yang mempelajari laju reaksi, atau seberapa cepat proses reaksi berlangsung dalam waktu tertentu. Kinetika kimia menjelaskan
Kinetika Kimia dan Mekanisme Reaksi Kinetika Kimia Kinetika kimia adalah ilmu yang mempelajari laju reaksi, atau seberapa cepat proses reaksi berlangsung dalam waktu tertentu. Kinetika kimia menjelaskan
BAB IV HASIL PENELITIAN DAN PEMBAHASAN. Pemahaman siswa yang dimaksud adalah pemahaman konseptual dan pemahaman
 36 BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4. 1 Hasil Penelitian Tujuan utama penelitian ini adalah mendeskripsikan tingkat pemahaman siswa XI IPA SMA Negeri 2 Limboto pada materi kesetimbangan kimia. Pemahaman
36 BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4. 1 Hasil Penelitian Tujuan utama penelitian ini adalah mendeskripsikan tingkat pemahaman siswa XI IPA SMA Negeri 2 Limboto pada materi kesetimbangan kimia. Pemahaman
Teori Tumbukan. HI(g) + HI(g) H 2 (g) + I 2 (g) Secara umum, dituliskan: AB + AB A 2 + B 2
 Teori Tumbukan Tumbukan yang menghasilkan reaksi hanyalah tumbukan yang efektif. Tumbukan efektif harus memenuhi dua syarat, yaitu posisinya tepat dan energinya cukup. Bagaimanakah posisi tumbukan yang
Teori Tumbukan Tumbukan yang menghasilkan reaksi hanyalah tumbukan yang efektif. Tumbukan efektif harus memenuhi dua syarat, yaitu posisinya tepat dan energinya cukup. Bagaimanakah posisi tumbukan yang
