LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Mutiara Mukti Farma (MUTIFA) Medan. Dewi Lumban Batu, S. Farm NIM
|
|
|
- Ade Hartono
- 6 tahun lalu
- Tontonan:
Transkripsi
1 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Mutiara Mukti Farma (MUTIFA) Medan Disusun oleh : Dewi Lumban Batu, S. Farm NIM FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2008
2 Lembar Pengesahan LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. MUTIARA MUKTI FARMA (MUTIFA) MEDAN Laporan ini disusun untuk melengkapi salah satu syarat untuk memperoleh gelar Apoteker pada Fakultas Farmasi Universitas Sumatera Utara Medan Disusun oleh: Dewi Lumban Batu, S. Farm NIM PT. Mutiara Mukti Farma (MUTIFA) Medan Pembimbing, Drs. D.R. Nainggolan, Apt SIK. 370/S.U Fakultas Farmasi Universitas Sumatera Utara Dekan, Prof. Dr. Sumadio Hadisahputra, Apt. NIP
3 DAFTAR ISI Halaman HALAMAN JUDUL... LEMBAR PENGESAHAN... KATA PENGANTAR... DAFTAR ISI... DAFTAR GAMBAR... DAFTAR TABEL... DAFTAR LAMPIRAN... RINGKASAN... i ii iii v vii viii ix x BAB I PENDAHULUAN Latar Belakang Tujuan... 2 BAB II TINJAUAN UMUM PT. MUTIARA MUKTI FARMA (MUTIFA) MEDAN Sejarah Visi dan Misi Lokasi dan Sarana Produksi Lokasi Sarana Produksi Penerapan CPOB di PT. Mutiara Mukti Farma (MUTIFA) BAB III KEGIATAN DI PT. MUTIARA MUKTI FARMA (MUTIFA) MEDAN Keterlibatan dalam Produksi Tinjauan ke bagian-bagian lain... 21
4 Research and Development Quality Control (QC) Quality Assurance (QA) Gudang Limbah BAB IV PEMBAHASAN Personalia Bangunan dan Fasilitas Peralatan Sanitasi dan Higiene Produksi Pengawasan Mutu Inspeksi Diri Penanganan Keluhan, Penarikan Obat yang Beredar, dan produk kembalian Dokumentasi Pengamatan Pengolahan Limbah BAB V KESIMPULAN DAN SARAN Kesimpulan Saran DAFTAR PUSTAKA LAMPIRAN TUGAS KHUSUS
5 DAFTAR GAMBAR Gambar 1. Denah lokasi PT. MUTIFA Medan... 5 Gambar 2. Struktur Organisasi R & D di PT. MUTIFA Gambar 3. Struktur Pemastian Mutu di PT. MUTIFA Gambar 4. Diagram Sistem Pengolahan Limbah Cair di PT. MUTIFA Gambar 5. Diagram Sistem Pengolahan Limbah Padat di PT. MUTIFA... 37
6 DAFTAR TABEL Tabel 1. Ukuran Ruangan masing-masing Bagian di PT. MUTIFA Medan... 6 Tabel 2. Jumlah Personil pada PT. MUTIFA Medan... 9 Tabel 3. Personalia PT. MUTIFA Medan Beradasarkan Jenjang Pendidikan Tabel 4. Tolak Ukur yang dipakai untuk Pemantauan Limbah Cair Tabel 5. Sistem Penanggulangan Limbah Udara... 37
7 DAFTAR LAMPIRAN Lampiran 1. Struktur Organisasi PT. MUTIFA Medan Lampiran 2. Bagan Proses Pembuatan Tablet/Kaplet Lampiran 3. Bagan Proses Pembuatan Kapsul Lampiran 4. Bagan Proses Pembuatan Serbuk Oral Lampiran 5. Bagan Proses Pembuatan Liquida Lampiran 6. Bagan Proses Pembuatan Salep... 54
8 RINGKASAN Telah dilakukan Praktek Kerja Profesi (PKP) di Industri Farmasi PT. Mutiara Mukti Farma (MUTIFA) Medan yang merupakan salah satu program dalam pendidikan profesi apoteker, yang bertujuan agar mahasiswa/mahasisiwi mengetahui dan memahami tugas dan fungsi apoteker dalam industri farmasi, yang diharapkan dapat sebagai bekal untuk menghadapi dunia kerja yang sesungguhnya. Memperoleh wawasan dan pengetahuan yang lebih luas, serta memahami penerapan CPOB di PT. Mutiara Mukti Farma (MUTIFA) dan mengetahui gambaran tentang situasi dan kondisi kerja di PT. Mutiara Mukti Farma (MUTIFA). Praktek kerja profesi di Industri Farmasi PT. Mutiara Mukti Farma (MUTIFA) Medan dilaksanakan pada tanggal 7 April 2008 sampai dengan 08 Mei 2008 dengan jumlah jam efektif 300 jam. Kegiatan yang dilakukan selama Praktek Kerja Profesi (PKP) di Industri antara lain membuat catatan kegiatan harian yang berisi absensi dan materi kegiatan yang ditandatangani oleh pembimbing, melihat kegiatan di Ruang Produksi, Laboratorium Quality Control (QC), Gudang Bahan Baku, Ruang β laktam, sistem pengolahan air minum dan untuk produksi, sistem pengaturan udara (AHU) dan sistem pengolahan air limbah. Tugas khusus yang diberikan berupa metoda analisa penetapan kadar untuk tablet dan sirup dari beberapa produk obat PT. MUTIFA.
9 BAB I PENDAHULUAN 1.1 Latar Belakang Obat adalah bahan atau paduan bahan-bahan yang digunakan untuk mempengaruhi atau menyelidiki sistem fisiologi atau keadaan patologi dalam rangka penetapan diagnosa, pencegahan, penyembuhan, pemulihan dan peningkatan kesehatan. Oleh karena itu, proses produksi obat memerlukan pengawasan yang ketat untuk menjamin kualitas obat yang dihasilkan. Salah satu upaya yang dilakukan pemerintah untuk menjamin tersedianya obat yang bermutu, aman dan berkhasiat yaitu dengan mengharuskan setiap industri farmasi untuk menerapkan Cara Pembuatan Obat yang Baik (CPOB) sesuai keputusan Menteri Kesehatan RI Nomor 43/MENKES/SK/II/1988 pada tanggal 2 Februari CPOB adalah pedoman pembuatan obat bagi industri farmasi di Indonesia yang bertujuan untuk memastikan agar sifat dan mutu obat yang dihasilkan senantiasa memenuhi persyaratan mutu yang telah ditentukan dan sesuai dengan tujuan penggunaannya. Mutu suatu obat tidak dapat ditentukan berdasarkan pemeriksaan produk akhir saja, melainkan harus dibentuk ke dalam produk selama keseluruhan proses pembuatan. Apoteker merupakan salah satu tenaga inti dalam industri farmasi karena turut berperan dalam menghasilkan obat yang bermutu, aman dan berkhasiat. Kedudukan apoteker juga diatur dalam CPOB, yaitu sebagai penanggung jawab
10 produksi dan pengawas mutu. Oleh karena itu, dibutuhkan apoteker yang memiliki wawasan, pengetahuan, keterampilan dan kemampuan dalam mengaplikasikan dan mengembangkan ilmunya secara profesional, terutama dalam memahami kenyataan di lapangan industri. Dengan demikian, Praktek Kerja Profesi di industri farmasi menjadi salah satu kebutuhan mahasiswa calon apoteker. Program Pendidikan Profesi Apoteker Fakultas Farmasi Universitas Sumatera Utara (USU) telah bekerja sama dengan PT. Mutiara Mukti Farma (MUTIFA) untuk menyelenggarakan Praktek Kerja Profesi. Praktek Kerja Profesi ini dilaksanakan pada tanggal 10 April 2008 hingga 25 April Praktek Kerja Profesi di industri farmasi ini diharapkan dapat memberikan pengetahuan praktis kepada mahasiswa calon apoteker tentang pekerjaan kefarmasian di industri dengan penerapan CPOB. 1.2 Tujuan Adapun tujuan Praktek Kerja Profesi Apoteker Fakultas Farmasi USU di industri PT. Mutiara Mukti Farma (MUTIFA) adalah : a. Mengetahui dan memahami tugas dan fungsi apoteker dalam industri farmasi, yang diharapkan dapat sebagai bekal untuk menghadapi dunia kerja yang sesungguhnya. b. Memperoleh wawasan dan pengetahuan yang lebih luas, serta memahami penerapan CPOB di PT. Mutiara Mukti Farma (MUTIFA). c. Mengetahui gambaran tentang situasi dan kondisi kerja di PT. Mutiara Mukti Farma (MUTIFA).
11 BAB II TINJAUAN UMUM PT. MUTIARA MUKTI FARMA (MUTIFA) MEDAN 2.1 Sejarah Pada tahun 1975 didirikan Industri Farmasi di kota Medan dengan nama Sejati Pharmaceutical Industries, yang memproduksi obar merek SIAGOGO. Setelah beberapa tahun berproduksi, perusahaan ini kemudian dialihkan pemiliknya kepada Bapak Drs. W. H. Siahaan dan memindahnamakan perusahaan tersebut dalam suatu akte notaris tertanggal 31 Januari 1980 dengan nama PT. Mutiara Mukti Farma (MUTIFA) yang berlokasi di Jl. Brigjen Katamso No. 220 Medan. Berdasarkan Surat Keputusan Menteri Kesehatan RI tahun 1981 No. 0098/SK/PAB/81 memutuskan memberikan izin untuk mendirikan pabrik Farmasi kepada PT. Mutiara Mukti Farma (MUTIFA) dengan nama MUTIFA INDUSTRI FARMASI untuk memproduksi obat-obatan. Dengan dikeluarkannya surat izin produksi oleh Departemen Kesehatan RI c/q Badan Pengawasan Obat dan Makanan No. 213/AA/III/81, mulailah PT Mutiara Mukti Farma memproduksi obat-obatan. Pada tahun 1983, perusahaan ini menjalankan dan melaksanakan operasinya dalam menghasilkan berbagai jenis dan bentuk sediaan obat untuk memenuhi kebutuhan masyarakat Indonesia wilayah barat umumnya dan daerah Sumatera Utara pada khususnya. 3
12 Pada Tanggal 29 November 1988, dengan akte notaris No. 35 diadakanlah perubahan akte atas pemegang saham serta manajemen perusahaan, yang ditetapkan melalui keputusan Menteri Kehakiman RI No. C HT th 89 tanggal 31 Januari Dalam akte tersebut, berdasarkan keputusan rapat Dewan Komisaris serta pemegang saham, ditetapkan bahwa yang menjadi penanggung jawab dengan jabatan Direktur Utama adalah Bapak Jacob. Sesuai dengan Keputusan Menteri Kesehatan RI No. 43/Menkes/SK/II/1988 tentang Pedoman Cara Pembuatan Obat yang Baik (CPOB), bahwa setiap industri farmasi harus mengacu pada pedoman tersebut, maka untuk memenuhi ketentuan tersebut PT. MUTIFA telah membangun pabrik yang baru di Jl. Karya Jaya No. 68 Km 8,5 Namorambe. Pada Mei 1994 produksi telah dilaksanakan di pabrik yang baru dan pada saat ini kegiatan administrasi juga telah dilakukan dilokasi tersebut. Pada tanggal 27 Juli 1994 PT. MUTIFA diberikan sertifikat sebagai industri farmasi yang telah memenuhi CPOB. Bentuk sediaan yang telah diproduksi sampai saat ini terdiri dari 8 jenis sediaan yaitu : tablet, sirup, salep, serbuk oral, serbuk obat luar dan cairan obat luar sebanyak 114 item. Pendistribusian sediaan yang diproduksi PT. MUTIFA Medan meliputi wilayah : Provinsi Sumatera Utara, Riau, Sumatera Selatan, DKI Jakarta, Jawa Barat, Jawa Tengah, Jawa Timur, Sulawesi Utara dan Sulawesi Selatan. Untuk wilayah Sumatera obat didistribusikan melalui PBF Mekada Abadi.
13 Untuk memproduksi obat-obatan dilakukan dengan sistem skala prioritas, yang mengutamakan obat yang lebih cepat laku di pasaran. Hal ini tidak berlaku untuk obat Inpres dan Askes. Bahan baku, yaitu bahan berkhasiat dan bahan tambahan yang diperlukan oleh perusahaan untuk pembuatan sediaan obat diperoleh dari RRC, Amerika Serikat, Jerman, Belanda, India, Taiwan, dan Switzerland melalui distributor masing-masing. 2.2 Visi dan Misi Visi dan Misi PT. Mutifa adalah Anda sehat kami bangga. 2.3 Lokasi dan Sarana Produksi Lokasi PT. MUTIFA Medan berada di Jl. Karya Jaya No. 68 Km 8,5 Namorambe Medan. Denah lokasi PT. MUTIFA ditunjukkan pada Gambar 1 berikut ini : Jl. Letjen Jamin Ginting Lokasi PT. MUTIFA Jl. Karya Yasa Jl. Karya Jaya Ke Bandara Polonia Jl. M. Basyir Titi Kuning Ke Deli Tua Jl. Brigjen Katamso Gambar 1. Denah lokasi PT. MUTIFA Medan
14 Luas areal PT. MUTIFA Medan mempunyai luas areal 9600 m 2 dan luas bangunan 6259 m 2. Luas masing-masing ruangan adalah sebagai berikut : Tabel 1. Ukuran Ruangan masing-masing Bagian di PT. MUTIFA Medan. No. Ruang/Gudang Ukuran (m 2 ) 1. Ruang Perkantoran Ruang β laktam Ruang Laboratorium dan Pengawasan Mutu Ruang Teknik dan Bengkel Ruang Produksi Ruang Produksi Sirup Ruang Produksi Serbuk Oral Ruang Produksi Kapsul Ruang Produksi Salep Ruang Produksi Aseptis Gudang Bahan Baku Gudang Kemasan Gudang Hasil Jadi Janitor Kantin Ruang Sirup Gudang Alat 25
15 Sumber arus listrik berasal dari Perusahaan Listrik Negara (PLN) dan apabila arus listrik dari PLN terputus digunakan generator. Sumber air berasal dari sumur pompa dan air PAM. Untuk keperluan produksi digunakan air PAM yang telah diolah menjadi air demineral, aquadest dan aquabidest. Air sumur digunakan untuk pencucian alat, mandi, dan bila aliran PAM mengalami kerusakan digunakan untuk menggantikan air PAM dimana air sumur ini telah mengalami tiga kali penyaringan. Bangunan penunjang lainnya terdiri dari musholla, kamar mandi dan pos jaga Sarana Produksi Ruangan produksi dengan gudang bahan baku, gudang kemasan dan obat jadi dibuat sedemikian rupa sehingga waktu yang dibutuhkan untuk mengangkut bahan baku ke ruang produksi, bahan kemasan ke ruang pengemasan, obat jadi dari ruang karantina ke gudang obat jadi relatif singkat dan tidak melalui ruang produksi lainnya sehingga kemungkinan terjadinya pencemaran silang dapat dihindari. Keadaan ruang produksi adalah sebagai berikut : a. Lantai Lantai ruang produksi beta laktam, kapsul, puyer, salep, dan sirup, terbuat dari beton yang dilapisi traso dan bata diantaranya diisi dengan semen putih. Lantai mempunyai permukaan yang rata, mudah dibersihkan, tidak menahan partikel, tahan terhadap deterjen dan desinfektan tetapi tidak tahan terhadap bahan kimia.
16 b. Dinding Dinding ruang terbuat dari beton, yang dilapisi epoksi sehingga permukaan dinding menjadi licin dan rata, kedap air, mudah dibersihkan, tahan terhadap deterjen, desinfektan, tidak menahan partikel dan tidak menjadi tempat bersarangnya binatang kecil. c. Langit-langit Langit-langit ruang terbuat dari beton, yang dilapisi epoksi sehingga permukaan langit-langit menjadi licin dan rata, kedap air, mudah dibersihkan, tahan terhadap detergent, desinfektan, tidak menahan partikel tetapi tidak tahan terhadap goresan logam. d. Pengaturan Udara Aliran udara yang digunakan dalam ruangan produksi beta laktam, kapsul, puyer, salep, dan sirup adalah sirkulasi sistem filter, berarti udara masuk ke dalam ruangan melalui proses penyaringan. Udara masuk dari luar disalurkan ke dalam ruangan produksi, lalu udara kotor dihisap dan dialirkan keluar. Dengan adanya sirkulasi sistem filter dengan proses penyaringan maka dapat menghasilkan efisiensi penyaringan 80% terhadap partikel yang berukuran 10µ. Kecepatan pertukaran udara dalam ruangan produksi cairan 25 kali per jam untuk koridor 20 kali per jam. Sedangkan untuk produksi beta laktam dan non beta laktam (kapsul, puyer, tablet, dan salep), kecepatan pertukaran udara dalam ruangan produksi 20 kali per jam dan untuk koridor 25 kali per jam. Pengaturan
17 temperatur, kelembaban udara agar kondisi ruangan baik dan nyaman dipakai Air Conditioner (AC) pada ruang kapsul dan puyer. Sistem pengaturan udara ruang beta laktam dibuat tersendiri yaitu udara yang masuk dari luar disaring dan dialirkan keruang beta laktam. Lalu udara kotor yang berada di ruangan beta laktam dihisap dan dikeluarkan dengan menggunakan alat Wet Scrubbs, merupakan serangkaian alat yang bekerja dengan cara menghisap dan mengalirkan udara yang berada di ruang beta laktam melalui suatu corong yang dilengkapi dengan suatu alat pemercik air. Percikan air yang sudah bercampur dengan udara kotor ditampung di dalam bak, diklorinasi, diencerkan dan dialirkan ke penampungan limbah. e. Personalia Untuk mendukung kegiatan operasionalnya, PT. MUTIFA memerlukan personil yang cakap, terampil dan terlatih. Status personil dilihat pada tabel 2 berikut ini : Tabel 2. Jumlah Personil pada PT. MUTIFA Medan. No. Bagian Unit Jumlah 1. Direktur Utama 1 2. Direktur 1 3. Manajer 9 4. Administrasi dan Keuangan 7 5. Research & Development 2 6. Unit Sirup 28
18 7. Unit Kapsul 5 8. Unit Tablet Unit Puyer Unit Cuci Botol Gudang Kemasan Gudang Bahan Baku Gudang Barang Jadi Teknisi Laboratorium Kolektor Akuntansi Penjualan/Pemasaran Supir Pembelian Cleaning Service Satpam 5 Jumlah seluruhnya 135 Dalam rangka memenuhi persyaratan CPOB, langkah-langkah yang diambil PT. MUTIFA Medan dibidang personalia adalah dengan cara mengirim pimpinan atau staf untuk mengikuti penataran mengenai CPOB. Selanjutnya diharapkan pimpinan atau staf tersebut dapat memberikan bimbingan dan pelatihan tentang CPOB kepada karyawan sehingga kegiatan perusahaan akan memenuhi ketentuan CPOB. Berdasarkan jenjang pendidikan, maka personil PT. MUTIFA Medan dapat diuraikan sebagai berikut:
19 Tabel 3. Personalia PT. MUTIFA Medan Beradasarkan Jenjang Pendidikan. No. Jenjang Pendidikan Jumlah (Orang) 1. Sarjana Sarjana Muda 5 3. SLTA/sederajat SLTP SD 2 f. Struktur Organisasi Struktur organisasi pada PT. MUTIFA merupakan struktur organisasi yang memperlihatkan wewenang dan tanggung jawab vertikal, yang berarti bahwa tiaptiap orang dalam organisasi kecuali buruh mempunyai beberapa orang bawahan. Kekuasaan tertinggi berada pada rapat umum pemegang saham yang pelaksanaannya harus dipertanggungjawabkan oleh Direktur Utama. Untuk menjalankan aktifitas perusahaan, Direktur Utama melimpahkan wewenang, tugas dan tanggungjawab kepada Direktur. Direktur membawahi 9 bagian, dan masingmasing bawahan dipimpin oleh manajer yang langsung bertanggungjawab penuh kepada Direktur. Masing-masing bagian membawahi sub bagian yang bertanggungjawab penuh kepada Kepala bagiannya dalam melaksanakan tugas yang telah dibebankan kepadanya. Struktur Organisasi PT. MUTIFA Medan dapat dilihat pada lampiran 1 halaman 49.
20 2.4 Penerapan CPOB di PT. Mutiara Mukti Farma (MUTIFA) CPOB adalah bagian dari Pemastian Mutu yang memastikan bahwa obat dibuat dan dikendalikan secara konsisten untuk mencapai standar mutu yang sesuai dengan tujuan penggunaan dan dipersyaratkan dalam izin edar dan spesifikasi produk. CPOB mencakup seluruh aspek produksi dan pengendalian mutu. Pada pembuatan obat, pengendalian menyeluruh adalah sangat esensial untuk menjamin bahwa konsumen menerima obat yang bermutu tinggi. Pembuatan secara sembarangan tidak dibenarkan bagi produk yang digunakan untuk menyelamatkan jiwa, atau memulihkan atau memelihara kesehatan. Tidaklah cukup bila produk jadi hanya sekedar lulus dari serangkaian pengujian, tetapi yang lebih penting adalah bahwa mutu harus dibentuk ke dalam produk tersebut. Mutu obat tergantung pada bahan awal, bahan pengemas, proses produksi dan pengendalian mutu, bangunan, peralatan yang dipakai dan personil yang terlibat. Persyaratan dasar dari CPOB adalah: a) Semua proses pembuatan obat dijabarkan dengan jelas, dikaji secara sistematis berdasarkan pengalaman dan terbukti mampu secara konsisten menghasilkan obat yang memenuhi persyaratan mutu dan spesifikasi yang telah ditetapkan. b) Tahap proses yang kritis dalam pembuatan, pengawasan proses dan sarana penunjang serta perubahannya yang signifikan divalidasi.
21 c) Tersedia semua sarana yang diperlukan dalam CPOB termasuk : personil yang terkualifikasi dan terlatih bangunan dan sarana dengan luas yang memadai peralatan dan sarana penunjang yang sesuai bahan, wadah, dan label yang benar prosedur dan instruksi yang disetujui tempat penyimpanan dan transportasi yang memadai. d) Prosedur dan instruksi ditulis dalam bentuk instruksi dengan bahasa yang jelas, tidak bermakna ganda, dapat diterapkan secara spesifik pada sarana yang tersedia. e) Operator memperoleh pelatihan untuk menjalankan prosedur secara benar f) Pencatatan dilakukan secara manual atau dengan alat pencatat selama pembuatan yang menunjukkan bahwa semua langkah yang dipersyaratkan dalam prosedur dan instruksi yang ditetapkan benar-benar dilaksanakan dan jumlah serta mutu produk yang dihasilkan sesuai dengan yang diharapkan. Tiap penyimpangan dicatat secara lengkap dan diinvestigasi. g) Catatan pembuatan termasuk distribusi yang memungkinkan penelusuran riwayat bets secara lengkap, disimpan secara komprehensif dan dalam bentuk yang mudah diakses. h) Penyimpanan dan distribusi obat yang dapat memperkecil risiko terhadap mutu obat. i) Tersedia sistem penarikan kembali batch obat manapun dari peredaran.
22 j) Keluhan terhadap produk yang beredar dikaji, penyebab cacat mutu diinvestigasi serta dilakukan tindakan perbaikan yang tepat dan pencegahan pengulangan kembali keluhan. Sumber daya manusia sangat penting dalam pembentukan dan penerapan sistem pemastian mutu yang memuaskan dan pembuatan obat yang benar. Oleh sebab itu industri farmasi bertanggung jawab untuk menyediakan personil yang terkualifikasi dalam jumlah yang memadai untuk melaksanakan semua tugas. Tiap personil hendaklah memahami tanggung jawab masing-masing dan dicatat. Seluruh personil hendaklah memahami prinsip CPOB dan memperoleh pelatihan awal dan berkesinambungan, termasuk instruksi mengenai higiene yang berkaitan dengan pekerjaan. Bangunan dan fasilitas untuk pembuatan obat hendaklah memiliki desain, konstruksi dan letak yang memadai, serta disesuaikan kondisinya dan dirawat dengan baik untuk memudahkan pelaksanaan operasi yang benar. Tata letak dan desain ruangan harus dibuat sedemikian rupa untuk memperkecil risiko terjadinya kekeliruan, pencemaran silang dan kesalahan lain, dan memudahkan pembersihan, sanitasi dan perawatan yang efektif untuk menghindari pencemaran-silang, penumpukan debu atau kotoran, dan dampak lain yang dapat menurunkan mutu obat. Peralatan untuk pembuatan obat hendaklah memiliki desain dan konstruksi yang tepat, ukuran yang memadai serta ditempatkan dan dikualifikasi dengan tepat, agar mutu obat terjamin sesuai desain serta seragam dari bets ke bets dan untuk memudahkan pembersihan serta perawatan.
23 Tingkat sanitasi dan higiene yang tinggi hendaklah diterapkan pada setiap aspek pembuatan obat. Ruang lingkup sanitasi dan higiene meliputi personil, bangunan, peralatan dan perlengkapan, bahan produksi serta wadahnya, dan segala sesuatu yang dapat merupakan sumber pencemaran produk. Sumber pencemaran potensial hendaklah dihilangkan melalui suatu program sanitasi dan higiene yang menyeluruh dan terpadu. Tujuan inspeksi diri adalah untuk mengevaluasi apakah semua aspek produksi dan pengawasan mutu industri farmasi memenuhi ketentuan CPOB. Program inspeksi diri hendaklah dirancang untuk mendeteksi kelemahan dalam pelaksanaan CPOB dan untuk menetapkan tindakan perbaikan yang diperlukan. Inspeksi diri hendaklah dilakukan secara independen dan rinci oleh petugas yang kompeten dari perusahaan. Ada manfaatnya bila juga menggunakan auditor luar yang independen. Inspeksi diri hendaklah dilakukan secara rutin dan, di samping itu, pada situasi khusus, misalnya dalam hal terjadi penarikan kembali obat jadi atau terjadi penolakan yang berulang. Semua saran untuk tindakan perbaikan supaya dilaksanakan. Prosedur dan catatan inspeksi diri hendaklah didokumentasikan dan dibuat program tindak lanjut yang efektif. Semua keluhan dan informasi lain yang berkaitan dengan kemungkinan terjadi kerusakan obat hendaklah dikaji dengan teliti sesuai dengan prosedur tertulis. Untuk menangani semua kasus yang mendesak, hendaklah disusun suatu sistem, bila perlu mencakup penarikan kembali produk yang diketahui atau diduga cacat dari peredaran secara cepat dan efektif. Penarikan kembali produk adalah
24 suatu proses penarikan kembali dari satu atau beberapa batch atau seluruh batch produk tertentu dari peredaran. Penarikan kembali produk dilakukan apabila ditemukan produk yang cacat mutu atau bila ada laporan mengenai reaksi yang merugikan yang serius serta berisiko terhadap kesehatan. Penarikan kembali produk dari peredaran dapat mengakibatkan penundaan atau penghentian pembuatan obat tersebut. Produk kembalian adalah obat jadi yang telah beredar, yang kemudian dikembalikan ke industri farmasi karena keluhan mengenai kerusakan, daluwarsa, atau alasan lain misalnya kondisi wadah atau kemasan yang dapat menimbulkan keraguan akan identitas, mutu, jumlah dan keamanan obat yang bersangkutan. Dokumentasi adalah bagian dari sistem informasi manajemen dan dokumentasi yang baik merupakan bagian yang esensial dari pemastian mutu. Dokumentasi yang jelas adalah fundamental untuk memastikan bahwa tiap personil menerima uraian tugas yang relevan secara jelas dan rinci sehingga memperkecil risiko terjadi salah tafsir dan kekeliruan yang biasanya timbul karena hanya mengandalkan komunikasi lisan. Spesifikasi, Dokumen Produksi Induk/Formula Pembuatan, prosedur, metode dan instruksi, laporan dan catatan harus bebas dari kekeliruan dan tersedia secara tertulis.
25 BAB III KEGIATAN DI PT. MUTIARA MUKTI FARMA (MUTIFA) MEDAN 3.1 Keterlibatan dalam Produksi Yang dimaksud dengan produksi adalah semua kegiatan mulai dari penerimaan bahan awal, pengolahan sampai dengan pengemasan untuk menghasilkan obat jadi. Tugas dan fungsi bagian produksi PT. MUTIFA antara lain : 1. Melaksanakan pembuatan obat mulai dari permintaan bahan baku ke gudang, pengolahan, pengemasan, sampai pengiriman obat ke gudang obat jadi. 2. Melaksanakan secara teknis dan administrasi semua tugas selama pengolahan dan pengemasan dengan berpedoman kepada prosedur tetap (protap) yang telah ditetapkan. Sasaran utama yang harus dicapai oleh bagian produksi antara lain adalah sebagai berikut : 1. Memenuhi dan menyerahkan permintaan sesuai jumlah yang diharapkan dan waktu penyerahan yang diminta. 2. Menghasilkan produk yang diminta sesuai dengan jumlah yang ditetapkan secara efektif dan efisien.
26 Sebelum proses berlangsung, ada beberapa hal yang perlu dipersiapkan agar produksi dapat berjalan lancar dan menghasilkan suatu produk sesuai dengan yang diharapkan. Tahapan yang perlu diperhatikan sebelum produksi adalah sebagai berikut : 1. Ruang produksi harus tetap dijaga kebersihannya, dengan menggunakan desinfektan untuk memperkecil terjadinya kontaminasi oleh mikroorganisme. 2. Temperatur dan kelembaban ruangan harus diatur sedemikian rupa sesuai dengan sifat bahan yang akan digunakan. Bila perlu dapat digunakan Air Conditioner (AC) sebagai alat pendingin ruangan dan dehumidifier sebagai alat pengatur kelembaban. 3. Ruangan produksi harus mendapat penerangan dan pertukaran udara yang cukup, karena dapat memperlancar kegiatan. 4. Alat-alat yang digunakan harus selalu dalam keadaan bersih dan dalam kondisi yang baik. Sebelum proses produksi berlangsung, dibuat laporan proses produksi yang bertujuan untuk dokumentasi, sehingga jika terjadi kekeliruan atau kesalahan pada proses produksi, dan dapat segera diketahui pada proses mana kesalahan tersebut terjadi dan dilakukan langkah-langkah untuk mengatasi permasalahan tersebut. Laporan proses produksi, berguna untuk menghitung jam kerja yang diperlukan dalam mengerjakan suatu batch sediaan. Laporan ini dibuat dan ditandatangani oleh petugas yang melaksanakan tahapan proses produksi.
27 Selama proses produksi berlangsung dilakukan pengawasan dalam proses (In Process Control/IPC) baik terhadap produk antara maupun terhadap produk ruahan dari tiap tahapan proses produksi. Bagian pengawasan mutu akan melaksanakan IPC setelah seksi bagian produksi membuat permohonan pemeriksaan. Produk antara maupun produk ruahan yang sedang diperiksa (berstatus karantina) diberi label kuning dan jika lulus pemeriksaan diberi label hijau dan dapat diteruskan ke proses selanjutnya. Produk yang tidak memenuhi persyaratan akan diberi label merah dan tidak boleh diteruskan sebelum persyaratan yang telah ditentukan dipenuhi, atau bahan tersebut akan dimusnahkan jika tidak memungkinkan untuk proses ulang. Setelah tahap pengemasan selesai, obat jadi dikarantina, kemudian dibuat permohonan pemeriksaan ke bagian pengawasan mutu untuk dilakukan Finished Pack Analysis. Obat jadi yang lulus pemeriksaan selanjutnya diserahkan ke gudang obat jadi. Bagian-bagian produksi pada PT. MUTIFA terdiri atas: a. Unit tablet Unit ini dilengkapi dengan mesin pencampuran bahan, granulator dan mesin pencetak tablet. Dalam memproduksi sediaan bentuk tablet perlu diperhatikan kondisi bahan baku, komposisi dan pencampuran bahan pengikat, karena hal tersebut berpengaruh dalam proses pencetakan tablet. Hal-hal yang diperiksa selama produksi adalah keseragaman bobot, waktu hancur, ketebalan, kekerasan,
28 kadar zat berkhasiat dan disolusi. Bagan proses pembuatan tablet dapat dilihat pada lampiran 2 halaman 50. b. Unit kapsul Mesin-mesin yang digunakan pada produksi kapsul adalah mesin pencampuran bahan dan mesin pengisi kapsul. Pada produksi kapsul perlu diperhatikan kondisi ruangan yaitu temperatur dan kelembaban. Pengaturan temperatur dengan memakai alat pendingin (AC) untuk mendapatkan temperatur 25 C. Hal-hal yang diperiksa selama produksi adalah keseragaman bobot, kadar zat berkhasiat dan waktu hancur. Bagan proses pembuatan kapsul dapat dilihat pada lampiran 3 halaman 51. Unit sebuk oral Alat-alat yang digunakan pada produksi ini antara lain mesin pencampuran bahan, alat pengisi serbuk dan oven. Hal-hal yang diperiksa selama produksi adalah keseragaman bobot dan kadar zat berkhasiat. Bagan proses pembuatan serbuk oral dapat dilihat pada lampiran 4 halaman 52. c. Unit Liquida Unit liquida memproduksi sediaan bentuk cair seperti suspensi, sirup dan cairan obat luar. Unit ini dilengkapi dengan mesin pencampuran dan mesin pengisi sediaan. Hal-hal yang diperiksa selama produksi adalah ph larutan, BJ larutan, keseragaman volume, viskositas larutan, kadar zat berkhasiat dan kebocoran wadah. Bagan proses pembuatan liquida dapat dilihat pada lampiran 5 halaman 53.
29 d. Unit salep Mesin-mesin yang digunakan pada produksi salep antara lain mesin pencampur bahan (mixer) dan mesin pengisi. Hal-hal yang diperiksa selama produksi adalah keseragaman bobot, kadar zat berkhasiat dan homogenitas. Bagan proses pembuatan salep dapat dilihat pada lampiran 6 halaman Tinjauan ke bagian-bagian lain Research and Development (R&D) Research and Development (R&D) di PT. MUTIFA baru dibentuk pada tahun R & D bertanggung jawab dalam menghasilkan produk-produk baru di PT. MUTIFA. Kegiatan-kegiatan yang terlibat dalam menghasilkan produkproduk baru tersebut adalah formulasi, registrasi dan standarisasi/metoda analisa. Disamping itu, bagian R & D juga bertanggung jawab untuk menyusun semua protap, protokol, validasi maupun program yang diperlukan untuk semua bagian yang terdapat di PT. MUTIFA. Manager R & D Wakil Manager R & D FORMULASI REGISTRASI STANDARISASI/ METODA ANALISA Gambar 2. Struktur Organisasi R & D di PT. MUTIFA
30 3.2.2 Quality Control (QC) Bagian pengawasan mutu bertanggung jawab dalam melaksanakan mutu suatu produk yang dihasilkan oleh industri farmasi agar senantiasa memiliki persyaratan mutu yang telah ditetapkan sesuai dengan tujuan penggunaannya. Sistem pengawasan mutu harus dirancang dengan tepat untuk menjamin bahwa tiap obat mengandung bahan dengan mutu yang benar dan jumlah yang tepat sesuai dengan prosedur sehingga obat tersebut senantiasa memenuhi spesefikasi yang telah ditetapkan. Manajer pengawasan mutu PT. MUTIFA adalah seorang apoteker yang cakap, terlatih, yang dapat bekerja secara professional. Ruang lingkup tugas, wewenang dan tanggung jawab dari manajer pengawasan mutu adalah : 1. Manajer pengawasan mutu diberi wewenang dan tanggung jawab penuh atas penyusunan, verifikasi, dan pelaksanaan seluruh proses pengawasan mutu. 2. Manajer pengawasan mutu sebagai satu-satunya yang memiliki wewenang untuk meluluskan bahan awal, produk antara, produk ruahan dan obat jadi. Bila produk tersebut tidak sesuai dengan speseifikasinya, atau bahan yang dibuat tidak sesuai dengan prosedur yang disetujui dan kondisi yang ditentukan maka manajer produksi langsung menolaknya. 3. Memberikan pengarahan dalam melaksanakan tugas di laboratorium kimia, mikrobiologi, pelaksanaan pengawasan dalam proses (In Process Control/IPC) maupun pelaksanaan CPOB.
31 4. Bertanggung jawab untuk menjamin bahwa semua pengujian dilaksanakan dengan metode yang benar dan telah disetujui. 5. Bertanggung jawab atas pelaksanaan inspeksi bahan baku, bahan pengemas, maupun proses produksi. 6. Bertanggung jawab untuk meninjau sebuah catatan pengolahan batch dan catatan pengemasan batch sebelum meluluskan obat jadi. 7. Jika ada kegagalan dalam produksi, mendiskusikan hal tersebut dengan manajer produksi dan ikut serta mencari penyebab dan jalan keluarnya. 8. Bertanggung jawab atas pengadaan, pemakaian dan pembuatan pereaksi. 9. Bertanggung jawab agar alat-alat untuk analisa dipakai serta dijaga dengan benar, dikalibrasi dan senantiasa tersedia suku cadangnya. 10. Bertanggung jawab moral yang tinggi, kemampuan, pengembangan dan pelatihan serta melakukan evaluasi tahunan atas semua karyawan yang dibawahinya. 11. Bertanggung jawab atas pelaksanaan inspeksi CPOB dan menjamin pelaksanaan CPOB secara ketat. 12. Membuat laporan bulanan dan anggaran tahunan bagian pengawasan mutu. 13. Memastikan bahwa semua prosedur analisa disimpan secara baik dan benar. 14. Mengusahakan perbaikan biaya pengawasan mutu. Laboratorium pengawasan mutu di PT. MUTIFA dibagi atas laboratorium kimia dan mikrobiologi. Kedua laboratorium tersebut dalam ruangan yang terpisah dan memiliki alat pengujian masing-masing. Selain itu,
32 ruangpenimbangan, ruang penyimpanan bahan dan ruangan instrumen dipisahkan secara tersendiri. Area ruangan produksi berada pada satu area dengan kegiatan produksi dan pengemasan. Terdapat ruangan khusus untuk instrumen spektrofotometer dan ruang instrumen HPLC. Pada laboratorium kimia terdapat lemari asam yang memiliki sistem penghisap udara tersendiri. Sampah dan sisa bahan laboratorium QC dibuang pada tempat yang telah disediakan. Bahan beracun dan bahan yang mudah terbakar disimpan pada tempat khusus dan terpisah, zat-zat tersebut berupa asam atau basa. limbah yang dihasilkan dari bagian QC dibuang ke Instalasi Pengolahan Air Limbah di PT. MUTIFA. Personil bagian QC terdiri dari apoteker dan analis yang terdidik dan terlatih serta berpengalaman dibidangnya. Tugas dan wewenang personil diterangkan dalam protap yang disimpan oleh yang bersangkutan. Tiap personil menggunakan pakaian jas laboratorium, masker dan sarung tangan tahan asam dan basa yang diperlukan untuk tugasnya. Peralatan serta instrumen laboratorium uji disesuaikan dengan prosedur pengujian. Dibuat protap-protap untuk pengoperasian instrumen dan peralatan serta dilekatkan pada dinding yang berdekatan dengan peralatan yang bersangkutan. Perawatan dan kalibrasi intrumen dilakukan secara rutin dan didokumentasikan, sedangkan verifikasi tetap dilakukan setiap hari sebelum digunakan. Terdapat penandaan yang jelas tentang keadaan instrumen, apakah
33 berfungsi baik atau tidak. Tanggal dan waktu kalibrasi selanjutnya tertera pada instrumen dengan jelas. Penerimaan dan pembuatan pereaksi serta media biakan dicatat dalam buku khusus. Pembuatan perekasi dilakukan di laboratorium berdasarkan petunjuk pembuatan yang tertulis dan setiap pereaksi diberi label yang sesuai seperti konsentrasi, faktor standarisasi, batas waktu penggunaan, tanggal standarisasi ulang, kondisi penyimpanan, tanggal pembuatan dan tanda tangan petugas pembuat. Media biakan seloalu dilakukan kontrol untuk membuktikan tidak adanya kesalahan terhadap interpretasi hasil pengujian. Prosedur pengujian yang akan digunakan terlebih dahulu divalidasi dengan memperhatikan fasilitas dan peralatan yang ada. Spesifikasi dan prosedur pengujian untuk setiap bahan awal, produk antara, produk ruahan dan obat jadi memuat ketentuan dan cara pemeriksaan serta pengujian identitas, kemurnian, kualitas dan kadar atau potensi. Prosedur pengujian memuat: Jumlah contoh yang diperlukan Banyaknya pereaksi yang digunakan untuk pengujian Alat atau instrument yang digunakan Rumus perhitungan yang digunakan Range yang diperbolehkan
34 Referensi yang digunakan sebagai acuan Pengujian dilakukan mengikuti instruksi pada prosedur pengujian untuk masing-masing bahan atau produk dan diperiksa oleh supervisor. Catatan analisa meliputi : Nama dan nomor batch. Nama petugas yang mengambil contoh. Metoda analisa yang digunakan. Perhitungan dalam unit ukuran, rumus yang digunakan dan range yang diperbolehkan. Kesimpulan (diterima atau ditolak). Perhitungan dalam unit ukuran, rumus yang digunakan dan range yang diperbolehkan. Tanggal dan tanda tangan petugas yang melakukan pengujian. Nama pemasok, jumlah keseluruhan dan jumlah bahan awal yang diterima. Jumlah keseluruhan, wadah, bahan baku, abahan pengemas, produk antara, produk ruahan dan obat jadi dari batch yang dianalisa. Rujukan pustaka dari mana prosedur pengujian diambil. Contoh pertinggal diberi identitas yang jelas, mewakili tiap batch bahan baku yang diterima, dan obat jadi dalam kemasan lengkap, disimpan dalam jangka
35 waktu tertentu (sampai batas waktu kadaluarsa) dengan kondisi yang sesuai dengan label penandaan. Jumlah contoh pertinggal adalah minimal 3 kali jumlah untuk pengujian lengkap. Validasi yang dilakukan oleh PT. MUTIFA antara lain: Prosedur penetapan kadar, untuk mengetahui ketelitian dan ketepatan metode yang digunakan dalam memenuhi spesifikasi yang telah ditetapkan. Kalibrasi instrumen yang dipakai dalam pengujian, dilakukan secara berkala untuk menjamin bahwa instrumen tersebut memberikan hasil pengukuran dengan presisi dan akurasi yang tinggi. Validasi proses. Validasi proses terdiri dari komposisi/formula, spesifikasi bahan baku, bagan alur proses, perlengkapan dan peralatan terkait, sistem penunjang, kondisi ruangan, proses pembuatan dan parameter kritis, dokumentasi, stabilitas dan pengemasan. Spesifikasi ditetapkan sendiri oleh pabrik yang telah memenuhi persyaratan yang ada dalam farmakope dan senantiasa direvisi secara rutin. Spesifikasi dibuat dalam bentuk dokumen dan disimpan tersendiri, yang meliputi : Spesifikasi bahan baku Spesifikasi produk antara Spesifikasi produk ruahan
36 Spesifikasi produk jadi Pengambilan contoh dilakukan terhadap sebagian kecil dari batch yang ada. Contoh yang diambil hendaklah mewakili batch yang ada dan berdasarkan prosedur tetap yang telah dibuat. Untuk zat aktif yang harus diukur potensinya, contoh diambil dari tiap wadah, sedangkan untuk bahan lain umumnya mengikuti rumus n + 1. Sampel bahan awal dan produk antara, diambil secara acak mewakili tiap wadah menggunakan peralatan yang sesuai. Sedangkan untuk obat jadi diambil pada proses awal, tengah, dan akhir. Pengambilan sampel dilakukan dengan tepat untuk mencegah kontaminasi silang. Wadah untuk bahan sampel diberi label yang menunjukkan isi wadah, nomor batch, tanggal pengambilan dan tanda bahwa sampel telah diambil dari wadah tersebut. Pengambilan sampel bahan baku dilakukan pada tempat yang bersih dan dilakukan pemeriksaan awal terlebih dahulu sebelum pengambilan sampel. Bahan baku yang akan diuji telah dilengkapi dengan sertifikat analisis dari produsen atau supplier, bahan pengemas dilihat dari segi fisiknya. Pengawasan pada kemasan diperiksa oleh IPC sebelum kegiatan pengemasan berjalan, selama proses berlangsung dan pada produk akhir yang sudah dikemas. Untuk menjamin keseragaman batch, sampel diambil mewakili setiap batch produk antara dan produk ruahan untuk diuji identitas, kekuatan, kemurnian dan kualitasnya. Produk antara dan produk ruahan yang ditolak diberi penandaan dan diawasi dengan sistem karantina.
37 Setiap batch obat jadi dilakukan pengujian terhadap spesifikasi yang ditetapkan. Sampel diambil pada awal, tengah dan akhir dengan jumlah tertentu (sesuai prosedur yang ada) untuk diuji dan sebagai sampel pertinggal. Batch yang tidak memenuhi syarat, diselidiki kesalahannya dan dilakukan pengujian ulang bersama bagian penelitian dan pengembangan. Bila dilakukan pengolahan ulang, maka prosedur tersebut harus diperiksa dan disetujui oleh bagian QC. Setiap bahan awal, produk antara, produk ruahan dan produk jadi yang telah diuji dan memenuhi persyaratan yang ditetapkan diberi label DILULUSKAN Setiap bahan awal, produk antara, produk ruahan dan obat jadi telah ditetapkan batas waktu penyimpanannya. Jika obat telah melewati batas waktu penyimpanan, maka bagian QC akan melakukan pengujian ulang berdasarkan tanggal pengujian ulang. Jika masih memenuhi syarat maka bahan diberi label DILULUSKAN. Bagian QC ikut berperan serta dalam pembuatan prosedur pengolahan induk dan proses pengemasan. Setiap perubahan dan penyesuaian pada prosedur tersebut harus disetujui oleh bagian QC sebelum ditetapkan. Selain itu, juga memberikan persetujuan terhadap setiap prosedur pembersihan dan sanitasi peralatan produksi. Bagian QC memeriksa semua catatan produksi tiap batch obat untuk menentukan apakah proses pengolahan telah memenuhi semua prosedur yang telah ditetapkan.
38 Untuk mengetahui stabilitas obat jadi, kondisi penyimpanan yang cocok dan tanggal kadaluarsa maka QC menyusun protap untuk pengujian stabilitas obat. Pengujian stabilitas obat meliputi: Jumlah contoh dan jadwal pengujian berdasarkan sifat zat yang diuji Kondisi penyimpanan Metode pengujian yang spesifik, bermakna, dan handal Pengujian produk dalam kemasan yang sama dengan kemasan produk yang dipasarkan Bagian QC bersama litbang bertanggung jawab dalam memilih pemasok yang mampu dan dapat dipercaya dalam penyediaan bahan awal. Semua calon pemasok dievaluasi secara berkala sebelum diberi pesanan. Inspeksi selalu dilakukan terhadap kredibilitas pemasok. Inspeksi tersebut dilakukan bersama litbang, bagian produksi, dan bagian pembelian. Selain itu mereka juga menilai kualifikasi pemasok Quality Assurance (QA) Pemastian Mutu adalah suatu konsep luas yang mencakup semua hal baik secara tersendiri maupun secara kolektif, yang akan mempengaruhi mutu dari obat yang dihasilkan. Pemastian mutu adalah totalitas semua pengaturan yang dibuat dengan tujuan untuk memastikan bahwa obat yang dihasilkan dengan mutu yang sesuai dengan tujuan pemakaiannya.
39 Tugas-tugas bagian pemastian mutu mencakup: a. Pengawasan terhadap bahan awal, termasuk di dalamnya bahan baku dan bahan pengemas. b. Pengawasan terhadap produk antara dan pengawasan selama proses (in process control) serta validasi yabg diperlukan. c. Pengkajian terhadap semua dokumen yang terkait dengan proses, pengemasan dan pengujian batch, dilakukan sebelum memberikan pengesahan pelulusan untuk distribusi. d. Melakukan kualifikasi terhadap meliputi semua faktor yang relevan termasuk kondisi pembuatan, hasil pengujian dan/atau pengawasan selama proses, pengkajian dokumen produksi termasuk pengemasan, pengkajian penyimpangan dari prosedur yang telah ditetapkan, pemenuhan dan persyaratan dari spesifikasi produk jadi dan pemeriksaan produk dalam kemasan akhir. e. Menyediakan prosedur inspeksi diri dan/atau audit mutu yang secara berkala mengevaluasi efektivitas dan penerapan sistem Pemastian Mutu. f. Melaporkan, menyelidiki, dan mencatat apabila terjadi penyimpangan. g. Mengevaluasi dan menyetujui pemasok bahan awal dan pengemas untuk memenuhi spesifikasi mutu yang telah ditentukan oleh perusahaan. h. Mengevaluasi dan menyetujui prosedur pengolahan ulang. i. Evaluasi mutu berkala dilakukan untuk verifikasi konsistensi proses dan memastikan perbaikan proses yang berkesinambungan.
40 j. Mengevaluasi perubahan yang akan dilakukan yang dianggap berdampak pada mutu produk. k. Mengatur dan memastikan bahwa sedapat mungkin, produk disimpan, didistribusikan dan selanjutnya ditangani sedemikian rupa agar mutu tetap dijaga selama masa edar/ simpan obat. l. Meluluskan produk untuk didistribusikan dengan dasar tiap batch produksi dibuat dan dikendalikan sesuai dengan persyaratan yang tercantum dalam izin edar dan peraturan lain yang berkaitan dengan aspek produksi, pengawasan mutu dan pelulusan produk. m. Sarana penunjang, mesin-mesin dan personalia. QA Manager QA Pharmacist QA Staff Senior QA Staffs Gambar 3. Struktur Pemastian Mutu di PT. MUTIFA Gudang Gudang bertugas melaksanakan penerimaan, penyimpanan, pemeliharaan bahan baku, kemasan dan sediaan jadi. Gudang melaksanakan penyimpanan dan pengeluaran bahan baku, sediaan jadi dan kemasan dengan memakai prinsip FIFO
41 (First In First Out) dan FEFO (First expire first Out). Gudang terbagi 3 yaitu gudang bahan baku, gudang sediaan jadi dan gudang kemasan yang dibuat dengan sistem satu pintu. Pelaksanaan kegiatan di gudang adalah menerima, menyimpan, memelihara, menyalurkan bahan baku, bahan sediaan dan kemasan serta melaksanakan administrasi penerimaan, penyimpanan, penyaluran sesuai peraturan dan ketentuan yang berlaku. Proses masuknya bahan baku ke gudang bahan dipesan menggunakan Surat Pesanan (SP) dengan prosedur: 1. Barang yang masuk ke gudang disertai dengan sertifikat analisis (CA) dan disesuaikan dengan SP. 2. Memeriksa kondisi fisik dari bahan tersebut. 3. Bon faktur ditandatangani oleh Kepala gudang, lalu diserahkan ke kasir industri. 4. Bahan baku yang masuk tersebut langsung dibuat Bukti Barang Masuk (BBM). Selanjutnya bahan di karantina untuk dianalisis lebih lanjut. Barang yang belum diperiksa atau dalam tahap pemeriksaan diberi label karantina. Label karantina ini berwarna kuning berisi nama barang, jumlah, nomor batch, tanggal diterima, unit penerimaan, tanda tangan. Barang yang diluluskan diberi label diluluskan berwarna hijau dan berisi nama barang, tanggal diterima, jumlah, pembuat/penyalur, nomor batch asal dan data yang diisi oleh Unit Quality Assurance (QA) (tanggal tes, nomor lot, tanda tangan dan tanggal kadaluarsa), sedangkan barang yang ditolak diberi label ditolak yang berwarna merah dan
42 berisi nama barang, jumlah, nomor batch, tanggal diterima dan tanda tangan bagian QC. Bahan baku atau kemasan dianalisis oleh Unit Quality Control (QC) setelah menerima Surat Pengiriman contoh bahan baku atau kemasan. Unit ini bertugas memberikan persetujuan atau penolakan terhadap bahan baku atau kemasan berdasarkan hasil analisis. Bahan baku atau kemasan yang diluluskan oleh Unit Quality Assurance (QA) akan merobek label karantina, menempelkan label diluluskan yang berwarna hijau dan ditempatkan di daerah yang diluluskan. Bahan baku atau kemasan yang ditolak oleh Unit Quality Assurance (QA) akan dirobek label karantina dan ditempelkan label ditolak yang berwarna merah serta menempatkan di daerah ditolak. Khusus bahan baku dan kemasan yang ditolak, Unit Quality Assurance (QA) harus membuat surat penolakan kepada pemasok dengan menyebutkan alasan penolakan. Barang yang sesuai dengan spesifikasi atau persyaratan selanjutnya disimpan di gudang obat jadi/bahan baku dan dibuat berita acara penerimaan barang. Bahan baku, sediaan jadi maupun kemasan yang disimpan di gudang memiliki kartu stok yang berfungsi sebagai kontrol dan memudahkan pemeriksaan jika ada kekeliruan. Untuk penyimpanan bahan baku disusun berdasarkan jenis bahan baku, sedang untuk bahan baku cair dan beta laktam disimpan terpisah. Untuk penyimpanan kemasan disusun berdasarkan jenis dan bentuknya, sehingga mudah dalam pengambilan maupun penyusunannya.
43 Masuknya obat jadi/sediaan jadi di gudang obat jadi berasal dari hasil produksi diserahkan oleh kepala unit produksi kepada kepala gudang obat jadi. Kemudian kepala gudang obat jadi membuat surat Bukti Penyerahan Hasil Produksi (BPHP) yang menerangkan nama obat jadi, kemasan, jumlah, nomor batch yang ditandatangani oleh kepala gudang obat jadi. Penyimpanan sediaan jadi berdasarkan efek farmakologis obat, alfabetis dan bentuk sediaan guna memudahkan dalam pencarian. Jadi untuk proses administrasi, masing-masing kepala gudang tersebut membuat laporan masuk atau keluarnya bahan baku, obat jadi dan kemasan secara komputerisasi maupun manual.
44 3.2.4 Limbah Limbah Non Beta Laktam Jenis limbah di PT. MUTIFA ada 3 jenis yaitu : 1. Limbah cair, limbah ini berasal dari limbah produksi, limbah laboratorium, limbah domsetik dan limbah bengkel. Air Hujan, Limbah domestik Limbah Cair produksi termasuk pembersihan daerah produksi Limbah Cair laboratorium kecuali reagen yg berbahaya Bak Penampungan (Penyaringan, sedimentasi) Bak Aerasi Fish Pond Produk Antara/ruahan/ Obat jadi bentuk cair yang rusak Badan Air buangan Limbah bengkel cair kecuali oli Oli bekas bengkel Dijual Gambar 4. Diagram Sistem Pengolahan Limbah Cair di PT. MUTIFA
45 2. Limbah Padat, berasal dari kemasan bahan awal (bahan baku/bahan kemasan), buangan proses produksi, bahan awal yang rusak, produk obat jadi yang rusak, wadah bekas bahan produksi dan limbah padat domestik. Debu Produksi Debu Lantai Dust Collector Vacum Cleaner Limbah Domestik Bahan baku, produk antara, ruahan dan produk jadi yang rusak Incenerator Tong/Vat karton Aluoil, botol, pot plastic, yang rusak atau sisa cetakan lama Pembuangan terakhir milik PEMDA Kertas karton&plastic yang tidak penandaan nama pabrik, botol kada rusak Kemasan bahan awal Dijual Gambar 5. Diagram Sistem Pengolahan Limbah Padat di PT. MUTIFA 2. Limbah Udara, berasal dari gas, uap dan asap dari bahan kimia, bahan baku dan proses produksi, pembakaran zat padat, debu produksi, suara/getaran mesin. Limbah ini sebagian berbahaya, sebagian tidak berbahaya. Sistem penanggulan limbah udara antara lain pada tabel berikut:
46 Jenis 1. Suara/getaran mesin produksi 2. Suara/blowdown steam boiler 3. Gas/asam laboratorium 4. Asap pembakaran sampah 5. Uap solven/uap sair Cara Pengendalian 1. Pemasangan partieal enclosure dan pemakaian inert oleh pekerja 2. Pemasangan bak penangakap uap 3. Lemari Asam 4. Incenerator cerobong tinggi 5. Exhaust fan dengan sistem penangkap uap Limbah Beta Laktam Jenis limbah beta laktam dapat berupa limbah cair, padat dan udara. Limbah cair berasal dari gedung produksi beta laktam berupa pencucian alat/mesin, pembersihan ruangan, meja dan kursi serta loundry. Limbah padat berupa wadah bekas bahan baku antibiotik beta laktam, bahan baku beta laktam yang rusak, buangan proses produksi dan produk jadi antibiotika beta laktam yang rusak. Limbah udara berupa debu produksi antibiotika beta laktam. Kesemua limbah ini memiliki sifat yang berbahaya. Pengelolaan Limbah Beta Laktam: 1. Limbah Cair Limbah cair yang berasal dari gedung beta laktam dialirkan ke bak/kolam perusakan cincin beta laktam dengan menggunakan larutan NaOH, setelah itu dialirkan/digabung dengan limbah cair non beta laktam di bak penampungan, dan seterusnya diolah bersama.
47 2. Limbah Padat Limbah padat yang berupa wadah yang mengandung bahan antibiotika beta laktam dicuci dan dibilas bersih dengan air bersih diruang pencucian di dalam gedung beta laktam. Air pencucian tersebut merupakan limbah cair dari gedung beta laktam yang dialirkan ke bak perusak cincin beta laktam, sedangkan wadah yang telah dicuci dan dibilas bersih tersebut dikeluarkan dari gedung beta laktam dan ditangani limbahnya seperti pada pengelolaan limbah padat non beta laktam. 3. Limbah Udara Limbah udara berupa debu produksi disedot dan dikumpulkan oleh dust collector. Cara pembuangan limbah debu produksi yang dikumpulkan oleh dust collector pada gedung beta laktam adalah sebagai berikut : Catridge atau filter dust collector dilepas, kemudian dimasukkan ke dalam kantong dan diikat. Filter yang sudah terbungkus dan terisolasi kemudian dibawa ke ruang khusus yang dipersiapkan untuk melebur/melarutkan limbah debu dari filter dust collector. Kantong yang terisi filter dust collector tersebut dibuka kemudian dilarutkan kedalam air yang kemudian air tersebut dialirkan ke kolam pengolahan limbah gedung beta laktam untuk dinetralisir. Kemudian
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Mutiara Mukti Farma (MUTIFA) Medan
 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Mutiara Mukti Farma (MUTIFA) Medan Disusun oleh : Janti Kosman, S. Farm NIM 073202044 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2008 KATA PENGANTAR
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Mutiara Mukti Farma (MUTIFA) Medan Disusun oleh : Janti Kosman, S. Farm NIM 073202044 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2008 KATA PENGANTAR
BAB II TINJAUAN PUSTAKA. (CPOB). Hal ini didasarkan oleh Keputusan Menteri Kesehatan RI.
 BAB II TINJAUAN PUSTAKA Industri farmasi diwajibkan menerapkan Cara Pembuatan Obat yang Baik (CPOB). Hal ini didasarkan oleh Keputusan Menteri Kesehatan RI. No.43/MENKES/SK/II/1988 tentang CPOB dan Keputusan
BAB II TINJAUAN PUSTAKA Industri farmasi diwajibkan menerapkan Cara Pembuatan Obat yang Baik (CPOB). Hal ini didasarkan oleh Keputusan Menteri Kesehatan RI. No.43/MENKES/SK/II/1988 tentang CPOB dan Keputusan
BAB II TINJAUAN PUSTAKA
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 tentang Ketentuan dan Tata cara Pelaksanaan Pemberian Izin Usaha
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 tentang Ketentuan dan Tata cara Pelaksanaan Pemberian Izin Usaha
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI. PT. Mutiara Mukti Farma (MUTIFA) Medan
 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Mutiara Mukti Farma (MUTIFA) Medan Disusun oleh: Sri Mady Astuti, S. Farm. 073202163 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2009 KATA PENGANTAR
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Mutiara Mukti Farma (MUTIFA) Medan Disusun oleh: Sri Mady Astuti, S. Farm. 073202163 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2009 KATA PENGANTAR
BAB II TINJAUAN PUSTAKA. Obat Jadi dan Industri Bahan Baku Obat. Definisi dari obat jadi yaitu
 BAB II TINJAUAN PUSTAKA A. Industri Farmasi 1. Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan No. 245/MenKes/SK/V/1990 tentang Ketentuan dan Tata Cara Pelaksanaan Pemberian Izin
BAB II TINJAUAN PUSTAKA A. Industri Farmasi 1. Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan No. 245/MenKes/SK/V/1990 tentang Ketentuan dan Tata Cara Pelaksanaan Pemberian Izin
BAB II TINJAUAN UMUM. Universitas Sumatera Utara
 BAB II TINJAUAN UMUM 2.1 Industri Farmasi Industri farmasi adalah industri obat jadi dan industri bahan baku obat. Industri farmasi sebagai industri penghasil obat, dituntut untuk dapat menghasilkan obat
BAB II TINJAUAN UMUM 2.1 Industri Farmasi Industri farmasi adalah industri obat jadi dan industri bahan baku obat. Industri farmasi sebagai industri penghasil obat, dituntut untuk dapat menghasilkan obat
BAB II TINJAUAN PUSTAKA. Industri farmasi menurut Peraturan Menteri Kesehatan RI No.
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Peraturan Menteri Kesehatan RI No. 1799/Menkes/Per/XII/2010 tentang Industri Farmasi adalah badan
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Peraturan Menteri Kesehatan RI No. 1799/Menkes/Per/XII/2010 tentang Industri Farmasi adalah badan
BAB II TINJAUAN PUSTAKA. menurut Peraturan Menteri Kesehatan RI No. 1799/Menkes/Per/XII/2010 tentang Industri Farmasi adalah badan usaha yang
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Peraturan Menteri Kesehatan RI No. 1799/Menkes/Per/XII/2010 tentang Industri Farmasi adalah badan
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Peraturan Menteri Kesehatan RI No. 1799/Menkes/Per/XII/2010 tentang Industri Farmasi adalah badan
BAB II TINJAUAN PUSTAKA. Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri obat jadi dan
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri
BAB II TINJAUAN PUSTAKA. Industri farmasi menurut SK Menkes No. 245/Menkes/SK/V/1990 adalah
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi Industri farmasi menurut SK Menkes No. 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri obat jadi adalah industri yang
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi Industri farmasi menurut SK Menkes No. 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri obat jadi adalah industri yang
BAB II TINJAUAN UMUM INDUSTRI FARMASI. (BUMN) dibentuk sebagai Perusahaan Perseroan pada tanggal 16 Agustus
 BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Tinjauan PT. Kimia Farma (Persero) Tbk. 2.1.1 Sejarah Perusahaan. PT. Kimia Farma (Persero) Tbk. sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan
BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Tinjauan PT. Kimia Farma (Persero) Tbk. 2.1.1 Sejarah Perusahaan. PT. Kimia Farma (Persero) Tbk. sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan
BAB II TINJAUAN PUSTAKA. Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri obat jadi dan
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri
BAB II TINJAUAN PUSTAKA. Industri farmasi menurut SK Menkes No. 245/Menkes/SK/V/1990
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut SK Menkes No. 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut SK Menkes No. 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri
BAB II TINJAUAN PUSTAKA
 BAB II TINJAUAN PUSTAKA 2.1 Pengertian Industri Farmasi. Industri farmasi menurut Surat Keputusan Menteri Kesehatan Nomor. 245/Menkes/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri
BAB II TINJAUAN PUSTAKA 2.1 Pengertian Industri Farmasi. Industri farmasi menurut Surat Keputusan Menteri Kesehatan Nomor. 245/Menkes/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI PT. MUTIFA MEDAN
 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. MUTIFA MEDAN Disusun Oleh : Miss Naimah Abdunroni, S. Farm. 083202053 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2010 Lembar Pengesahan LAPORAN
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. MUTIFA MEDAN Disusun Oleh : Miss Naimah Abdunroni, S. Farm. 083202053 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2010 Lembar Pengesahan LAPORAN
BAB II TINJAUAN UMUM INDUSTRI FARMASI. Lembaga Farmasi Direktorat Kesehatan Angkatan Darat (Lafi Ditkesad)
 BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Perkembangan Lafi Ditkesad Lembaga Farmasi Direktorat Kesehatan Angkatan Darat (Lafi Ditkesad) merupakan lembaga yang telah ada sejak zaman penjajahan Belanda.
BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Perkembangan Lafi Ditkesad Lembaga Farmasi Direktorat Kesehatan Angkatan Darat (Lafi Ditkesad) merupakan lembaga yang telah ada sejak zaman penjajahan Belanda.
BAB II TINJAUAN PUSTAKA
 BAB II TINJAUAN PUSTAKA 2.1. Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia No.245 /Menkes/VI/1990, industri farmasi adalah industri obat jadi dan industri
BAB II TINJAUAN PUSTAKA 2.1. Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia No.245 /Menkes/VI/1990, industri farmasi adalah industri obat jadi dan industri
GAMBARAN UMUM PERUSAHAAN
 BAB II GAMBARAN UMUM PERUSAHAAN 2.1. Sejarah Pada tahun 1975, didirikan Industri Farmasi di Kota Medan dengan nama Sejati Pharmaceutical Industries, yang memproduksi obat merek SIAGOGO. Setelah beberapa
BAB II GAMBARAN UMUM PERUSAHAAN 2.1. Sejarah Pada tahun 1975, didirikan Industri Farmasi di Kota Medan dengan nama Sejati Pharmaceutical Industries, yang memproduksi obat merek SIAGOGO. Setelah beberapa
BAB II TINJAUAN PUSTAKA. Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri obat jadi dan
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI PT. MUTIARA MUKTI FARMA (MUTIFA) MEDAN
 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. MUTIARA MUKTI FARMA (MUTIFA) MEDAN Disusun Oleh: Nelli Purba, S.Farm. NIM 083202142 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. MUTIARA MUKTI FARMA (MUTIFA) MEDAN Disusun Oleh: Nelli Purba, S.Farm. NIM 083202142 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS
BAB II TINJAUAN PUSTAKA. Industri Farmasi menurut Peraturan Menteri Kesehatan RI Nomor
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri Farmasi menurut Peraturan Menteri Kesehatan RI Nomor 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki izin
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri Farmasi menurut Peraturan Menteri Kesehatan RI Nomor 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki izin
Industri farmasi menurut Surat Keputusan Menteri Kesehatan Nomor. 245/Menkes/V/1990 adalah industri obat jadi dan industri bahan baku obat.
 BAB II TINJAUAN PUSTAKA 2.1. Pengertian Industri Farmasi. Industri farmasi menurut Surat Keputusan Menteri Kesehatan Nomor. 245/Menkes/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri
BAB II TINJAUAN PUSTAKA 2.1. Pengertian Industri Farmasi. Industri farmasi menurut Surat Keputusan Menteri Kesehatan Nomor. 245/Menkes/V/1990 adalah industri obat jadi dan industri bahan baku obat. Industri
LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI PT. KIMIA FARMA PLANT MEDAN
 LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI DI PT. KIMIA FARMA PLANT MEDAN DISUSUN OLEH : ERNITA, S. Farm 093202016 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN
LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI DI PT. KIMIA FARMA PLANT MEDAN DISUSUN OLEH : ERNITA, S. Farm 093202016 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI. PT. Kimia Farma (Persero) Tbk Plant Medan
 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Kimia Farma (Persero) Tbk Plant Medan Disusun Oleh : Astrie Rezky, S. Farm. 093202004 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2010 Lembar
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Kimia Farma (Persero) Tbk Plant Medan Disusun Oleh : Astrie Rezky, S. Farm. 093202004 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2010 Lembar
BAB II TINJAUAN PUSTAKA. Gudang merupakan sarana pendukung kegiatan produksi industri farmasi
 BAB II TINJAUAN PUSTAKA 2.1 Definisi Gudang merupakan sarana pendukung kegiatan produksi industri farmasi yang berfungsi untuk menyimpan bahan baku, bahan kemas dan obat jadi yang belum didistribusikan.
BAB II TINJAUAN PUSTAKA 2.1 Definisi Gudang merupakan sarana pendukung kegiatan produksi industri farmasi yang berfungsi untuk menyimpan bahan baku, bahan kemas dan obat jadi yang belum didistribusikan.
BAB II TINJAUAN UMUM. Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik
 BAB II TINJAUAN UMUM 2.1 Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat.
BAB II TINJAUAN UMUM 2.1 Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat.
BAB II TINJAUAN UMUM INDUSTRI FARMASI. Belanda, pada tahun 1958 pemerintah melebur sejumlah perusahaan farmasi
 BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Sejarah PT. Kimia Farma (Persero) Tbk. Sejalan dengan kebijakan nasionalisasi bekas perusahaan-perusahaan Belanda, pada tahun 1958 pemerintah melebur sejumlah
BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Sejarah PT. Kimia Farma (Persero) Tbk. Sejalan dengan kebijakan nasionalisasi bekas perusahaan-perusahaan Belanda, pada tahun 1958 pemerintah melebur sejumlah
B. Tujuan Tujuan Qualiy Assurance adalah untuk memastikan bahwa obat dihasilkan dengan mutu yang sesuai dengan tujuan pemakaiannya.
 PEMASTIAN MUTU (QUALITY ASSURANCE/QA) A. Pendahuluan Industri farmasi bertujuan untuk menghasilkan obat yang harus memenuhi persyaratan khasiat (efficacy), keamanan (safety) dan mutu (quality). Berdasarkan
PEMASTIAN MUTU (QUALITY ASSURANCE/QA) A. Pendahuluan Industri farmasi bertujuan untuk menghasilkan obat yang harus memenuhi persyaratan khasiat (efficacy), keamanan (safety) dan mutu (quality). Berdasarkan
BAB II TINJAUAN PUSTAKA. Indonesia Nomor 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat.
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri bahan baku obat.
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI DI PT. KIMIA FARMA (PERSERO) Tbk PLANT MEDAN
 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI DI PT. KIMIA FARMA (PERSERO) Tbk PLANT MEDAN DISUSUN OLEH : SRI ROMAITO HASIBUAN, S.Farm 093202065 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI DI PT. KIMIA FARMA (PERSERO) Tbk PLANT MEDAN DISUSUN OLEH : SRI ROMAITO HASIBUAN, S.Farm 093202065 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI. PT. Mutiara Mukti Farma (MUTIFA) Medan
 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Mutiara Mukti Farma (MUTIFA) Medan Disusun oleh : Teuku Mirza, S. Farm NIM 083202086 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2009 LEMBAR
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Mutiara Mukti Farma (MUTIFA) Medan Disusun oleh : Teuku Mirza, S. Farm NIM 083202086 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA MEDAN 2009 LEMBAR
BAB II TINJAUAN PUSTAKA. Obat Jadi dan Industri Bahan Baku Obat. Definisi dari obat jadi yaitu
 BAB II TINJAUAN PUSTAKA A. Industri Farmasi 1. Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan No. 245/MenKes/SK/V/1990 tentang Ketentuan dan Tata Cara Pelaksanaan Pemberian Izin
BAB II TINJAUAN PUSTAKA A. Industri Farmasi 1. Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan No. 245/MenKes/SK/V/1990 tentang Ketentuan dan Tata Cara Pelaksanaan Pemberian Izin
BAB II TINJAUAN UMUM INDUSTRI. 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki izin dari menteri
 BAB II TINJAUAN UMUM INDUSTRI 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri Farmasi menurut Peraturan Menteri Kesehatan RI Nomor 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki
BAB II TINJAUAN UMUM INDUSTRI 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri Farmasi menurut Peraturan Menteri Kesehatan RI Nomor 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki
BAB II TINJAUAN PUSTAKA. Industri farmasi adalah industri obat jadi dan industri bahan baku obat.
 BAB II TINJAUAN PUSTAKA A. Industri Farmasi Industri farmasi adalah industri obat jadi dan industri bahan baku obat. Industri farmasi sebagai industri penghasil obat, dituntut untuk dapat menghasilkan
BAB II TINJAUAN PUSTAKA A. Industri Farmasi Industri farmasi adalah industri obat jadi dan industri bahan baku obat. Industri farmasi sebagai industri penghasil obat, dituntut untuk dapat menghasilkan
KEPUTUSAN MENTERI KESEHATAN REPUBLIK INDONESIA NOMOR : 965/MENKES/SK/XI/1992 TENTANG
 KEPUTUSAN MENTERI KESEHATAN NOMOR : 965/MENKES/SK/XI/1992 TENTANG CARA PRODUKSI KOSMETIKA YANG BAIK MENTERI KESEHATAN, Menimbang : a. bahwa langkah utama untuk menjamin keamanan kosmetika adalah penerapan
KEPUTUSAN MENTERI KESEHATAN NOMOR : 965/MENKES/SK/XI/1992 TENTANG CARA PRODUKSI KOSMETIKA YANG BAIK MENTERI KESEHATAN, Menimbang : a. bahwa langkah utama untuk menjamin keamanan kosmetika adalah penerapan
Tugas Individu Farmasi Industri. Uraian Tugas Kepala Bagian Produksi, Pengawasan Mutu dan Pemastian Mutu
 Tugas Individu Farmasi Industri Uraian Tugas Kepala Bagian Produksi, Pengawasan Mutu dan Pemastian Mutu Disusun Oleh : Eka Wahyu Lestari 14340004 Dosen : Drs. Kosasih, M.Sc., Apt. Program Profesi Apoteker
Tugas Individu Farmasi Industri Uraian Tugas Kepala Bagian Produksi, Pengawasan Mutu dan Pemastian Mutu Disusun Oleh : Eka Wahyu Lestari 14340004 Dosen : Drs. Kosasih, M.Sc., Apt. Program Profesi Apoteker
BAB III KEGIATAN DI INDUSTRI FARMASI P.T. KIMIA FARMA (PERSERO) TBK. PLANT MEDAN
 BAB III KEGIATAN DI INDUSTRI FARMASI P.T. KIMIA FARMA (PERSERO) TBK. PLANT MEDAN 3.1 Keterlibatan Dalam Produksi Praktek Kerja Profesi Apoteker di P.T. Kimia Farma (Persero) Tbk. Plant Medan, dilaksanakan
BAB III KEGIATAN DI INDUSTRI FARMASI P.T. KIMIA FARMA (PERSERO) TBK. PLANT MEDAN 3.1 Keterlibatan Dalam Produksi Praktek Kerja Profesi Apoteker di P.T. Kimia Farma (Persero) Tbk. Plant Medan, dilaksanakan
BAB II TINJAUAN UMUM INDUSTRI FARMASI. mendapatkan sertifikat Cara Pembuatan Obat yang Baik pada tahun Saat ini
 BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1. Sejarah PT. Universal Pharmaceutical Industries didirikan pada tahun 1975 dan mendapatkan sertifikat Cara Pembuatan Obat yang Baik pada tahun 1995. Saat ini dalam
BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1. Sejarah PT. Universal Pharmaceutical Industries didirikan pada tahun 1975 dan mendapatkan sertifikat Cara Pembuatan Obat yang Baik pada tahun 1995. Saat ini dalam
KATA PENGANTAR QUALITY CONTROL
 KATA PENGANTAR Assalamu alaikum, wr, wb, Segala Puji senantiasa kami panjatkan kehadirat Allah SWT beserta junjungan kita Nabi Besar Muhammad Rasulullah S.A.W yang telah melimpahkan rahmat, berkah, dan
KATA PENGANTAR Assalamu alaikum, wr, wb, Segala Puji senantiasa kami panjatkan kehadirat Allah SWT beserta junjungan kita Nabi Besar Muhammad Rasulullah S.A.W yang telah melimpahkan rahmat, berkah, dan
BAB II TINJAUAN UMUM PT. COMBIPHAR. bawah pengelolaan Drs. Handoko Prayogo, Apt. Berawal dari industri rumah
 BAB II TINJAUAN UMUM PT. COMBIPHAR 2.1 Sejarah Perkembangan PT. Combiphar PT. Combiphar didirikan pada tahun 1971 di Jl. Sukabumi 61 Bandung, di bawah pengelolaan Drs. Handoko Prayogo, Apt. Berawal dari
BAB II TINJAUAN UMUM PT. COMBIPHAR 2.1 Sejarah Perkembangan PT. Combiphar PT. Combiphar didirikan pada tahun 1971 di Jl. Sukabumi 61 Bandung, di bawah pengelolaan Drs. Handoko Prayogo, Apt. Berawal dari
BAB II TINJAUAN UMUM INDUSTRI. 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki izin dari menteri
 BAB II TINJAUAN UMUM INDUSTRI 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri Farmasi menurut Peraturan Menteri Kesehatan RI Nomor 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki
BAB II TINJAUAN UMUM INDUSTRI 2.1 Industri Farmasi 2.1.1 Pengertian Industri Farmasi Industri Farmasi menurut Peraturan Menteri Kesehatan RI Nomor 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki
Tugas dan tanggungjawab Quality Assurance (QA) / Jaminan Mutu
 Tugas dan tanggungjawab Quality Assurance (QA) / Jaminan Mutu Departemen QA merupakan departemen yang bertanggung jawab antara lain : a) Audit internal QA melakukan evaluasi kerja kesemua bagian/departemen
Tugas dan tanggungjawab Quality Assurance (QA) / Jaminan Mutu Departemen QA merupakan departemen yang bertanggung jawab antara lain : a) Audit internal QA melakukan evaluasi kerja kesemua bagian/departemen
CPOB. (Cara Pembuatan Obat yang Baik)
 CPOB { (Cara Pembuatan Obat yang Baik) CPOB (Cara Pembuatan Obat Yang Baik) 2006 atau GMP (Good Manufacturing Practices) 2006 adalah suatu pedoman pembuatan obat berdasarkan berbagai ketentuan dalam CPOB
CPOB { (Cara Pembuatan Obat yang Baik) CPOB (Cara Pembuatan Obat Yang Baik) 2006 atau GMP (Good Manufacturing Practices) 2006 adalah suatu pedoman pembuatan obat berdasarkan berbagai ketentuan dalam CPOB
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI PT. UNIVERSAL PHARMACEUTICAL INDUSTRIES MEDAN
 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. UNIVERSAL PHARMACEUTICAL INDUSTRIES MEDAN Disusun oleh: KATARIN SITOMPUL, S.Farm NIM 093202039 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. UNIVERSAL PHARMACEUTICAL INDUSTRIES MEDAN Disusun oleh: KATARIN SITOMPUL, S.Farm NIM 093202039 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI
UNIVERSITAS INDONESIA
 UNIVERSITAS INDONESIA LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. COMBIPHAR JL. RAYA SIMPANG NO. 383 PADALARANG BANDUNG PERIODE 07 MARET 01 APRIL 2011 LAPORAN PRAKTEK KERJA PROFESI APOTEKER MOCHAMAD
UNIVERSITAS INDONESIA LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. COMBIPHAR JL. RAYA SIMPANG NO. 383 PADALARANG BANDUNG PERIODE 07 MARET 01 APRIL 2011 LAPORAN PRAKTEK KERJA PROFESI APOTEKER MOCHAMAD
BAB I PENDAHULUAN. Kesehatan merupakan kebutuhan terpenting bagi manusia sehingga
 BAB I PENDAHULUAN A. Latar Belakang Kesehatan merupakan kebutuhan terpenting bagi manusia sehingga berbagai usaha dilakukan untuk memperoleh tubuh yang sehat. Mulai dari melakukan olah raga, hidup secara
BAB I PENDAHULUAN A. Latar Belakang Kesehatan merupakan kebutuhan terpenting bagi manusia sehingga berbagai usaha dilakukan untuk memperoleh tubuh yang sehat. Mulai dari melakukan olah raga, hidup secara
BAB 2 GAMBARAN UMUM OBJEK
 BAB 2 GAMBARAN UMUM OBJEK 2.1 Sejarah Singkat Berdirinya PT. Metiska Farma PT. Metiska Farma didirikan pada tahun 1970, atas prakarsa Bapak Memet Tanuwijaya, Bapak Ismail dan Bapak Karim Johan, yang pada
BAB 2 GAMBARAN UMUM OBJEK 2.1 Sejarah Singkat Berdirinya PT. Metiska Farma PT. Metiska Farma didirikan pada tahun 1970, atas prakarsa Bapak Memet Tanuwijaya, Bapak Ismail dan Bapak Karim Johan, yang pada
LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI PT. SANBE FARMA UNIT II CIMAHI
 LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI di PT. SANBE FARMA UNIT II CIMAHI Disusun Oleh : Syabrina Naulita Pane, S.Farm. NIM 093202066 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS
LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI di PT. SANBE FARMA UNIT II CIMAHI Disusun Oleh : Syabrina Naulita Pane, S.Farm. NIM 093202066 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS
Produksi di Industri Farmasi
 Produksi di Industri Farmasi PRODUKSI istilah terkait Pembuatan Seluruh rangkaian kegiatan dalam menghasilkan suatu obat, meliputi produksi dan pengawasan mutu, mulai dari pengadaan bahan awal dan bahan
Produksi di Industri Farmasi PRODUKSI istilah terkait Pembuatan Seluruh rangkaian kegiatan dalam menghasilkan suatu obat, meliputi produksi dan pengawasan mutu, mulai dari pengadaan bahan awal dan bahan
BAB II TINJAUAN PUSTAKA. yang berfungsi untuk menyimpan bahan baku, bahan kemas, dan obat jadi yang
 BAB II TINJAUAN PUSTAKA 2.1 Definisi Gudang merupakan sarana pendukung kegiatan produksi industri farmasi yang berfungsi untuk menyimpan bahan baku, bahan kemas, dan obat jadi yang belum didistribusikan.
BAB II TINJAUAN PUSTAKA 2.1 Definisi Gudang merupakan sarana pendukung kegiatan produksi industri farmasi yang berfungsi untuk menyimpan bahan baku, bahan kemas, dan obat jadi yang belum didistribusikan.
Oleh : Bambang Priyambodo
 Oleh : Bambang Priyambodo SISTEMATIKA CPOB: 2012 merupakan penyempurnaan dari CPOB: 2006, mencakup revisi terhadap : Pedoman CPOB: 2006 Suplemen I Pedoman CPOB: 2006 tahun 2009 Aneks 8 : Cara Pembuatan
Oleh : Bambang Priyambodo SISTEMATIKA CPOB: 2012 merupakan penyempurnaan dari CPOB: 2006, mencakup revisi terhadap : Pedoman CPOB: 2006 Suplemen I Pedoman CPOB: 2006 tahun 2009 Aneks 8 : Cara Pembuatan
BAB II TINJAUAN UMUM PT. COMBIPHAR. PT. Combiphar didirikan pada tahun 1971 di Jl. Sukabumi no. 61,
 BAB II TINJAUAN UMUM PT. COMBIPHAR 2.1 Sejarah Perkembangan PT. Combiphar PT. Combiphar didirikan pada tahun 1971 di Jl. Sukabumi no. 61, Bandung di bawah pengelolaan Drs. Handoko Prayogo, Apt. Berawal
BAB II TINJAUAN UMUM PT. COMBIPHAR 2.1 Sejarah Perkembangan PT. Combiphar PT. Combiphar didirikan pada tahun 1971 di Jl. Sukabumi no. 61, Bandung di bawah pengelolaan Drs. Handoko Prayogo, Apt. Berawal
UNIVERSITAS INDONESIA
 UNIVERSITAS INDONESIA LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. SYDNA FARMA JL. RC. VETERAN NO. 89 BINTARO, JAKARTA SELATAN PERIODE 1 APRIL 3 JUNI 2013 LAPORAN PRAKTEK KERJA PROFESI APOTEKER KARTIKA
UNIVERSITAS INDONESIA LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. SYDNA FARMA JL. RC. VETERAN NO. 89 BINTARO, JAKARTA SELATAN PERIODE 1 APRIL 3 JUNI 2013 LAPORAN PRAKTEK KERJA PROFESI APOTEKER KARTIKA
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT BANDUNG
 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT BANDUNG Disusun Oleh : Eka Saputra, S. Farm. 073202020 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT BANDUNG Disusun Oleh : Eka Saputra, S. Farm. 073202020 FAKULTAS FARMASI UNIVERSITAS SUMATERA UTARA
2016, No Mengingat : 1. Undang-Undang Nomor 8 Tahun 1999 tentang Perlindungan Konsumen (Lembaran Negara Republik Indonesia Tahun 1999 Nomor 42,
 BERITA NEGARA REPUBLIK INDONESIA No.880, 2016 BPOM. Industri Kosmetika Gol. B. Higiene Sanitasi. Dokumen. Penerapan. Pedoman. PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR 11
BERITA NEGARA REPUBLIK INDONESIA No.880, 2016 BPOM. Industri Kosmetika Gol. B. Higiene Sanitasi. Dokumen. Penerapan. Pedoman. PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR 11
PT. Universal Pharmaceutical Industries Medan
 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Universal Pharmaceutical Industries Medan Disusun oleh: Chairunnisya Arief, S. Farm. 073202011 Ratna Aurora, S. Farm. 073202075 Sumantri S, S. Farm.
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Universal Pharmaceutical Industries Medan Disusun oleh: Chairunnisya Arief, S. Farm. 073202011 Ratna Aurora, S. Farm. 073202075 Sumantri S, S. Farm.
BAB 1 PENDAHULUAN. Dalam industri manufaktur saat ini sebagian besar proses produksi
 BAB 1 PENDAHULUAN 1.1 Latar Belakang Dalam industri manufaktur saat ini sebagian besar proses produksi dilakukan dengan menggunakan mesin sebagai pengganti tenaga manusia. Dimana dengan menggunakan mesin
BAB 1 PENDAHULUAN 1.1 Latar Belakang Dalam industri manufaktur saat ini sebagian besar proses produksi dilakukan dengan menggunakan mesin sebagai pengganti tenaga manusia. Dimana dengan menggunakan mesin
2. KETENTUAN UMUM Obat tradisional Bahan awal Bahan baku Simplisia
 1. PNGERTIAN CPOTB Cara Pembuatan Obat Tradisional yang Baik (CPOTB) meliputi seluruh aspek yang menyangkut pembuatan obat tradisional, Tujuan untuk menjamin agar produk yang dihasilkan senantiasa memenuhi
1. PNGERTIAN CPOTB Cara Pembuatan Obat Tradisional yang Baik (CPOTB) meliputi seluruh aspek yang menyangkut pembuatan obat tradisional, Tujuan untuk menjamin agar produk yang dihasilkan senantiasa memenuhi
BAB II TINJAUAN PUSTAKA. Industri Farmasi adalah badan usaha yang memiliki izin dari Menteri
 BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian industri farmasi Industri Farmasi adalah badan usaha yang memiliki izin dari Menteri Kesehatan untuk melakukan kegiatan pembuatan obat atau
BAB II TINJAUAN PUSTAKA 2.1 Industri Farmasi 2.1.1 Pengertian industri farmasi Industri Farmasi adalah badan usaha yang memiliki izin dari Menteri Kesehatan untuk melakukan kegiatan pembuatan obat atau
BAB 1 PENDAHULUAN. yang terdepan, suatu industri harus mampu mengoptimalkan produksinya dalam
 1 BAB 1 PENDAHULUAN 1.1 Latar Belakang Masalah Pada zaman sekarang ini, dengan semakin banyaknya industri baru yang muncul menjadikan persaingan antar industri semakin ketat. Sehingga, untuk menjadi yang
1 BAB 1 PENDAHULUAN 1.1 Latar Belakang Masalah Pada zaman sekarang ini, dengan semakin banyaknya industri baru yang muncul menjadikan persaingan antar industri semakin ketat. Sehingga, untuk menjadi yang
SESLA BAG. PROD GUPUSFI BAG. UJIBANG BAG. JANG UNIT GUTRANS UNIT GULUR UNIT GUPALKES UNIT GUHANJABAKU
 Lampiran 1. Struktur Organisasi Lafiau KALAFIAU ESELON SESLA ESELON PEMBANTU PIMPINAN/STAF ESELON BAG. PROD GUPUSFI BAG. UJIBANG BAG. JANG TABLET GUTRANS UJI COBA JANGMAT KAPSUL GULUR LITBANG HARFASMAT
Lampiran 1. Struktur Organisasi Lafiau KALAFIAU ESELON SESLA ESELON PEMBANTU PIMPINAN/STAF ESELON BAG. PROD GUPUSFI BAG. UJIBANG BAG. JANG TABLET GUTRANS UJI COBA JANGMAT KAPSUL GULUR LITBANG HARFASMAT
(BUMN) dibentuk sebagai Perusahaan Perseroan pada tanggal 16 Agustus Sejak berdirinya hingga sekarang ini PT. Kimia Farma (Persero) Tbk.
 BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Tinjauan PT. Kimia Farma (Persero) Tbk. 2.1.1 Sejarah Perusahaan. PT. Kimia Farma (Persero) Tbk. sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan
BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1 Tinjauan PT. Kimia Farma (Persero) Tbk. 2.1.1 Sejarah Perusahaan. PT. Kimia Farma (Persero) Tbk. sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan
MENTERI KESEHATAN REPUBLIK INDONESIA
 KEPUTUSAN MENTERI KESEHATAN NOMOR: 659/MENKES/SK/X/1991 TENTANG CARA PEMBUATAN OBAT TRADISIONAL YANG BAIK MENTERI KESEHATAN Menimbang : a. bahwa untuk membuat obat tradisional yang memenuhi persyaratan
KEPUTUSAN MENTERI KESEHATAN NOMOR: 659/MENKES/SK/X/1991 TENTANG CARA PEMBUATAN OBAT TRADISIONAL YANG BAIK MENTERI KESEHATAN Menimbang : a. bahwa untuk membuat obat tradisional yang memenuhi persyaratan
Quality Control (QC) dan Quality Assurance (QA) Mata Kuliah : Rancangan Produk Industri (2 SKS) Dosen : Kuni Zu aimah B.,S.Farm., M.Farm., Apt.
 Quality Control (QC) dan Quality Assurance (QA) Mata Kuliah : Rancangan Produk Industri (2 SKS) Dosen : Kuni Zu aimah B.,S.Farm., M.Farm., Apt. Industri farmasi harus membuat obat sedemikian rupa agar
Quality Control (QC) dan Quality Assurance (QA) Mata Kuliah : Rancangan Produk Industri (2 SKS) Dosen : Kuni Zu aimah B.,S.Farm., M.Farm., Apt. Industri farmasi harus membuat obat sedemikian rupa agar
DOKUMENTASI
 DOKUMENTASI PENDAHULUAN Dokumentasi adalah suatu bukti yang dapat dipercaya pada penerapan/pemenuhan CPOTB. Mutu yang direncanakan adalah satu-satunya solusi untuk mengatasi keluhan yang terkait dengan
DOKUMENTASI PENDAHULUAN Dokumentasi adalah suatu bukti yang dapat dipercaya pada penerapan/pemenuhan CPOTB. Mutu yang direncanakan adalah satu-satunya solusi untuk mengatasi keluhan yang terkait dengan
UNIVERSITAS INDONESIA
 UNIVERSITAS INDONESIA LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT ASTRAZENECA INDONESIA CIKARANG SITE JALAN TEKNO RAYA BLOK B1A B1B, CIKARANG, BEKASI JAWA BARAT PERIODE 6 JANUARI 21 FEBRUARI 2014 LAPORAN
UNIVERSITAS INDONESIA LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT ASTRAZENECA INDONESIA CIKARANG SITE JALAN TEKNO RAYA BLOK B1A B1B, CIKARANG, BEKASI JAWA BARAT PERIODE 6 JANUARI 21 FEBRUARI 2014 LAPORAN
BAB II TINJAUAN PUSTAKA. Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia No.
 BAB II TINJAUAN PUSTAKA 2.1 Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia No. 245/Menkes/SK/V/1990, yang dimaksud dengan industri farmasi adalah industri
BAB II TINJAUAN PUSTAKA 2.1 Pengertian Industri Farmasi Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia No. 245/Menkes/SK/V/1990, yang dimaksud dengan industri farmasi adalah industri
SESLA BAG. PROD BAG. GUPUSFI BAG. UJIBANG BAG. JANG UNIT GUTRANS UNIT GULUR UNIT GUPALKES UNIT GUHANJABAKU
 Lampiran 1. Struktur Organisasi Lafiau KALAFIAU ESELON SESLA ESELON PEMBANTU PIMPINAN/STAF ESELON BAG. PROD BAG. GUPUSFI BAG. UJIBANG BAG. JANG TABLET GUTRANS UJI COBA JANGMAT KAPSUL GULUR LITBANG HARFASMAT
Lampiran 1. Struktur Organisasi Lafiau KALAFIAU ESELON SESLA ESELON PEMBANTU PIMPINAN/STAF ESELON BAG. PROD BAG. GUPUSFI BAG. UJIBANG BAG. JANG TABLET GUTRANS UJI COBA JANGMAT KAPSUL GULUR LITBANG HARFASMAT
BAB I PENDAHULUAN. A. Latar Belakang Penelitian. Obat merupakan komoditi utama yang digunakan manusia untuk
 BAB I PENDAHULUAN A. Latar Belakang Penelitian Obat merupakan komoditi utama yang digunakan manusia untuk menunjang kesehatannya. Semua orang rela mengeluarkan uangnya untuk mendapatkan kesehatan, bahkan
BAB I PENDAHULUAN A. Latar Belakang Penelitian Obat merupakan komoditi utama yang digunakan manusia untuk menunjang kesehatannya. Semua orang rela mengeluarkan uangnya untuk mendapatkan kesehatan, bahkan
PERSONALIA
 PERSONALIA 1. Persyaratan Umum Jumlah dan Pengetahuan: Memiliki pengetahuan, keterampilan dan kemampuan sesuai dengan tugasnya. Mempunyai sikap dan kesadaran yang tinggi untuk melaksanakan Cara Pembuatan
PERSONALIA 1. Persyaratan Umum Jumlah dan Pengetahuan: Memiliki pengetahuan, keterampilan dan kemampuan sesuai dengan tugasnya. Mempunyai sikap dan kesadaran yang tinggi untuk melaksanakan Cara Pembuatan
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI. PT. Universal Pharmaceutical Industri Medan. Disusun oleh: Ratna Aurora, S.
 1 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Universal Pharmaceutical Industri Medan Disusun oleh: Ratna Aurora, S.Farm 073202075 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS
1 LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI di PT. Universal Pharmaceutical Industri Medan Disusun oleh: Ratna Aurora, S.Farm 073202075 PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI UNIVERSITAS
BAB II TINJAUAN UMUM INDUSTRI FARMASI. (BUMN) dibentuk sebagai Perusahaan Perseroan pada tanggal 16 Agustus 1971.
 BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1. Tinjauan PT. Kimia Farma (Persero) Tbk. 2.1.1. Sejarah Perusahaan. PT.Kimia Farma (Persero) Tbk sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan
BAB II TINJAUAN UMUM INDUSTRI FARMASI 2.1. Tinjauan PT. Kimia Farma (Persero) Tbk. 2.1.1. Sejarah Perusahaan. PT.Kimia Farma (Persero) Tbk sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan
PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR:. TENTANG PEDOMAN PENERAPAN CARA PEMBUATAN KOSMETIKA YANG BAIK
 PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR:. TENTANG PEDOMAN PENERAPAN CARA PEMBUATAN KOSMETIKA YANG BAIK KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA, Menimbang
PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR:. TENTANG PEDOMAN PENERAPAN CARA PEMBUATAN KOSMETIKA YANG BAIK KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA, Menimbang
UNIVERSITAS INDONESIA
 UNIVERSITAS INDONESIA LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. MOLEX AYUS JL. RAYA SERANG KM 11,5 CIKUPA TANGERANG PERIODE 6 FEBRUARI 30 MARET 2012 LAPORAN PRAKTEK KERJA PROFESI APOTEKER AGATHA DWI
UNIVERSITAS INDONESIA LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. MOLEX AYUS JL. RAYA SERANG KM 11,5 CIKUPA TANGERANG PERIODE 6 FEBRUARI 30 MARET 2012 LAPORAN PRAKTEK KERJA PROFESI APOTEKER AGATHA DWI
Lampiran 1. Bagan proses Pembuatan Krim / Salep
 Lampiran 1. Bagan proses Pembuatan Krim / Salep Penimbangan Peleburan bahan D ki (F i k) Pencampuran D lt t Pelarutan zat aktif, P t(f i) ph Pencampuran Identifikasi ph Kadar zat berkhasiat Homogenitas
Lampiran 1. Bagan proses Pembuatan Krim / Salep Penimbangan Peleburan bahan D ki (F i k) Pencampuran D lt t Pelarutan zat aktif, P t(f i) ph Pencampuran Identifikasi ph Kadar zat berkhasiat Homogenitas
Viddy A R. II Selasa, 5 September 2017
 INDUSTRI No. Tanggal Topik/Pokok Bahasan Substansi materi Dosen I Selasa, 29 Agustus 2017 Pendahuluan -Ruang lingkup industri farmasi -Pemenuhan CPOB -Jenis-jenis industri farmasi -Ciri-ciri industri farmasi
INDUSTRI No. Tanggal Topik/Pokok Bahasan Substansi materi Dosen I Selasa, 29 Agustus 2017 Pendahuluan -Ruang lingkup industri farmasi -Pemenuhan CPOB -Jenis-jenis industri farmasi -Ciri-ciri industri farmasi
BAB II TINJAUAN UMUM INDUSTRI FARMASI PT. KIMIA FARMA (PERSERO) TBK. PLANT MEDAN
 BAB II TINJAUAN UMUM INDUSTRI FARMASI PT. KIMIA FARMA (PERSERO) TBK. PLANT MEDAN 2.1 Sejarah Perusahaan Kimia Farma adalah perusahaan industri farmasi pertama di Indonesia yang didirikan oleh Pemerintah
BAB II TINJAUAN UMUM INDUSTRI FARMASI PT. KIMIA FARMA (PERSERO) TBK. PLANT MEDAN 2.1 Sejarah Perusahaan Kimia Farma adalah perusahaan industri farmasi pertama di Indonesia yang didirikan oleh Pemerintah
PEDOMAN CARA PEMBUATAN OBAT TRADISIONAL YANG BAIK
 Lampiran Peraturan Kepala Badan Pengawas Obat dan Makanan RI Nomor :HK.00.05.4.1380 PEDOMAN CARA PEMBUATAN OBAT TRADISIONAL YANG BAIK 1. PENDAHULUAN 1.1. Latar Belakang Obat tradisional merupakan produk
Lampiran Peraturan Kepala Badan Pengawas Obat dan Makanan RI Nomor :HK.00.05.4.1380 PEDOMAN CARA PEMBUATAN OBAT TRADISIONAL YANG BAIK 1. PENDAHULUAN 1.1. Latar Belakang Obat tradisional merupakan produk
LAPORAN PRAKTEK KERJA PROFESI APOTEKER FARMASI INDUSTRI
 LAPORAN PRAKTEK KERJA PROFESI APOTEKER FARMASI INDUSTRI LAPORAN PRAKTEK KERJA PROFESI APOTEKER FARMASI INDUSTRI di LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT (LAFI DITKESAD) PERIODE 01 30 NOVEMBER
LAPORAN PRAKTEK KERJA PROFESI APOTEKER FARMASI INDUSTRI LAPORAN PRAKTEK KERJA PROFESI APOTEKER FARMASI INDUSTRI di LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT (LAFI DITKESAD) PERIODE 01 30 NOVEMBER
1 dari1717 I. PENDAHULUAN. I. Latar Belakang
 I. PENDAHULUAN I. Latar Belakang Pembinaan terhadap sarana produksi Perbekalan Kesehatan Rumah Tangga dalam rangka pengamanan alat kesehatan dan PKRT seperti yang disebutkan dalam Permenkes 1184/MENKES/PER/IX/2004
I. PENDAHULUAN I. Latar Belakang Pembinaan terhadap sarana produksi Perbekalan Kesehatan Rumah Tangga dalam rangka pengamanan alat kesehatan dan PKRT seperti yang disebutkan dalam Permenkes 1184/MENKES/PER/IX/2004
No Kode DAR2/Profesional/582/010/2018 PENDALAMAN MATERI FARMASI MODUL 010: CARA DISTRIBUSI OBAT YANG BAIK. Dr. NURKHASANAH, M.Si., Apt.
 No Kode DAR2/Profesional/582/010/2018 PENDALAMAN MATERI FARMASI MODUL 010: CARA DISTRIBUSI OBAT YANG BAIK Dr. NURKHASANAH, M.Si., Apt. Kementerian Pendidikan dan Kebudayaan Kementerian Riset, Teknologi
No Kode DAR2/Profesional/582/010/2018 PENDALAMAN MATERI FARMASI MODUL 010: CARA DISTRIBUSI OBAT YANG BAIK Dr. NURKHASANAH, M.Si., Apt. Kementerian Pendidikan dan Kebudayaan Kementerian Riset, Teknologi
BAB II TINJAUAN UMUM INDUSTRI. 2.1 Tinjauan Lembaga Farmasi Angkatan Udara (LAFIAU) Sejarah dan Perkembangan Lembaga Farmasi Angkatan Udara
 BAB II TINJAUAN UMUM INDUSTRI 2.1 Tinjauan Lembaga Farmasi Angkatan Udara (LAFIAU) 2.1.1 Sejarah dan Perkembangan Lembaga Farmasi Angkatan Udara Perjalanan sejarah dimulai ketika di pangkalan udara belum
BAB II TINJAUAN UMUM INDUSTRI 2.1 Tinjauan Lembaga Farmasi Angkatan Udara (LAFIAU) 2.1.1 Sejarah dan Perkembangan Lembaga Farmasi Angkatan Udara Perjalanan sejarah dimulai ketika di pangkalan udara belum
KISI-KISI MATERI PLPG MATA PELAJARAN FARMASI INDUSTRI
 KISI-KISI MATERI PLPG MATA PELAJARAN FARMASI INDUSTRI Standar Guru (SKG) Inti Guru (KI) Guru Mata Pelajaran 1 Menguasai karakteristik Mengidentifikasi karakteristik peserta didik yang berkaitan dengan
KISI-KISI MATERI PLPG MATA PELAJARAN FARMASI INDUSTRI Standar Guru (SKG) Inti Guru (KI) Guru Mata Pelajaran 1 Menguasai karakteristik Mengidentifikasi karakteristik peserta didik yang berkaitan dengan
Aspek-aspek CPOB. Manajemen Mutu Personalia Bangunan dan Fasilitas Peralatan Sanitasi dan Higiene Produksi
 Personalia Aspek-aspek CPOB Manajemen Mutu Personalia Bangunan dan Fasilitas Peralatan Sanitasi dan Higiene Produksi Pengawasan mutu Inspeksi diri dan audit mutu Penanganan keluhan terhadap produk, penarikan
Personalia Aspek-aspek CPOB Manajemen Mutu Personalia Bangunan dan Fasilitas Peralatan Sanitasi dan Higiene Produksi Pengawasan mutu Inspeksi diri dan audit mutu Penanganan keluhan terhadap produk, penarikan
(BUMN) dibentuk sebagai Perusahaan Perseroan pada tanggal 16 Agustus Sejak berdirinya hingga sekarang ini PT. Kimia Farma (Persero) Tbk telah
 BAB II TINJAUAN UMUM INDUSTRI FARMASI PT. KIMIA FARMA 2.1 Sejarah Perusahaan. PT.Kimia Farma (Persero) Tbk sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan Perseroan pada tanggal 16
BAB II TINJAUAN UMUM INDUSTRI FARMASI PT. KIMIA FARMA 2.1 Sejarah Perusahaan. PT.Kimia Farma (Persero) Tbk sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan Perseroan pada tanggal 16
BAB II PT. KIMIA FARMA. (BUMN) dibentuk sebagai Perusahaan Perseroan pada tanggal 16 Agustus
 BAB II PT. KIMIA FARMA 2.1 Tinjauan PT. Kimia Farma(Persero) Tbk. 2.1.1 Sejarah Perusahaan. PT.Kimia Farma (Persero) Tbk sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan Perseroan pada
BAB II PT. KIMIA FARMA 2.1 Tinjauan PT. Kimia Farma(Persero) Tbk. 2.1.1 Sejarah Perusahaan. PT.Kimia Farma (Persero) Tbk sebagai Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan Perseroan pada
Lampiran 1. Bagan proses Pembuatan Krim
 Lampiran 1. Bagan proses Pembuatan Krim Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph -Stabilitas krim Pencampuran Dengan
Lampiran 1. Bagan proses Pembuatan Krim Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph -Stabilitas krim Pencampuran Dengan
2 Presiden Nomor 55 Tahun 2013 (Lembaran Negara Republik Indonesia Tahun 2013 Nomor 125); 3. Peraturan Presiden Nomor 24 Tahun 2010 tentang Kedudukan,
 BERITA NEGARA REPUBLIK INDONESIA No.794, 2014 KEMEN KP. Obat Ikan. Cara Pembuatan. PERATURAN MENTERI KELAUTAN DAN PERIKANAN REPUBLIK INDONESIA NOMOR 24/PERMEN-KP/2014 TENTANG CARA PEMBUATAN OBAT IKAN YANG
BERITA NEGARA REPUBLIK INDONESIA No.794, 2014 KEMEN KP. Obat Ikan. Cara Pembuatan. PERATURAN MENTERI KELAUTAN DAN PERIKANAN REPUBLIK INDONESIA NOMOR 24/PERMEN-KP/2014 TENTANG CARA PEMBUATAN OBAT IKAN YANG
UNIVERSITAS INDONESIA LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. COMBIPHAR JL. RAYA SIMPANG NO. 383 PADALARANG PERIODE MARET 2012
 UNIVERSITAS INDONESIA LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. COMBIPHAR JL. RAYA SIMPANG NO. 383 PADALARANG PERIODE MARET 2012 LAPORAN PRAKTEK KERJA PROFESI APOTEKER MUTIA ANGGRIANI, S.Farm 1106047215
UNIVERSITAS INDONESIA LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. COMBIPHAR JL. RAYA SIMPANG NO. 383 PADALARANG PERIODE MARET 2012 LAPORAN PRAKTEK KERJA PROFESI APOTEKER MUTIA ANGGRIANI, S.Farm 1106047215
LAMPIRAN 1 DENAH PT. OTTO PHARMACEUTICAL INDUSTRIES
 LAMPIRAN 1 DENAH PT. OTTO PHARMACEUTICAL INDUSTRIES 78 Direktur Utama Divisi Pemasaran Produksi Direktur Pemasaran Divisi Pengembangan Bisnis Logistik Divisi Pabrik Ass. Pabrik Umum Divisi Manajemen Mutu
LAMPIRAN 1 DENAH PT. OTTO PHARMACEUTICAL INDUSTRIES 78 Direktur Utama Divisi Pemasaran Produksi Direktur Pemasaran Divisi Pengembangan Bisnis Logistik Divisi Pabrik Ass. Pabrik Umum Divisi Manajemen Mutu
PEDOMAN CARA PEMBUATAN OBAT YANG BAIK
 7 2013, No.122 LAMPIRAN PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR HK.03.1.33.12.12.8195 TAHUN 2012 TENTANG PENERAPAN PEDOMAN CARA PEMBUATAN OBAT YANG BAIK PENDAHULUAN PRINSIP
7 2013, No.122 LAMPIRAN PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK INDONESIA NOMOR HK.03.1.33.12.12.8195 TAHUN 2012 TENTANG PENERAPAN PEDOMAN CARA PEMBUATAN OBAT YANG BAIK PENDAHULUAN PRINSIP
BAB 1 MANAJEMEN MUTU
 Lampiran Peraturan Kepala Badan Pengawas Obat dan Makanan Nomor HK.03.1.23.06.11.5629 Tahun 2011 BAB 1 MANAJEMEN MUTU PRINSIP Industri obat tradisional harus membuat obat tradisional sedemikian rupa agar
Lampiran Peraturan Kepala Badan Pengawas Obat dan Makanan Nomor HK.03.1.23.06.11.5629 Tahun 2011 BAB 1 MANAJEMEN MUTU PRINSIP Industri obat tradisional harus membuat obat tradisional sedemikian rupa agar
Penggunaan terbesar herbal. Fitofarmaka. supplement. kosmetik
 Penggunaan terbesar herbal Fitofarmaka supplement kosmetik Pasar herbal Pasar dunia 10 M USD Nilai export indonesia 100 Triliun Kualitas Produksi herbal GAP GMP GDP GAP ON FARM Iklim Tanah Ketinggian bibit
Penggunaan terbesar herbal Fitofarmaka supplement kosmetik Pasar herbal Pasar dunia 10 M USD Nilai export indonesia 100 Triliun Kualitas Produksi herbal GAP GMP GDP GAP ON FARM Iklim Tanah Ketinggian bibit
BAB II TINJAUAN UMUM PT. PRADJA PHARIN (PRAFA) mengalami perkembangan pesat. PT. Prafa didirikan pada tahun 1960 oleh Tjipto
 BAB II TINJAUAN UMUM PT. PRADJA PHARIN (PRAFA) 2.1 Sejarah dan Perkembangan Perusahaan PT. Prafa merupakan salah satu perusahaan farmasi Indonesia yang mengalami perkembangan pesat. PT. Prafa didirikan
BAB II TINJAUAN UMUM PT. PRADJA PHARIN (PRAFA) 2.1 Sejarah dan Perkembangan Perusahaan PT. Prafa merupakan salah satu perusahaan farmasi Indonesia yang mengalami perkembangan pesat. PT. Prafa didirikan
PERSYARATAN TAMBAHAN LABORATORIUM LINGKUNGAN
 PERSYARATAN TAMBAHAN LABORATORIUM LINGKUNGAN Lampiran I Peraturan Menteri Negara Lingkungan Hidup Nomor : 06 Tahun 2009 Tanggal : 6 April 2009 PERSYARATAN TAMBAHAN LABORATORIUM LINGKUNGAN Persyaratan
PERSYARATAN TAMBAHAN LABORATORIUM LINGKUNGAN Lampiran I Peraturan Menteri Negara Lingkungan Hidup Nomor : 06 Tahun 2009 Tanggal : 6 April 2009 PERSYARATAN TAMBAHAN LABORATORIUM LINGKUNGAN Persyaratan
Lampiran 1. Bagan proses Pembuatan Krim
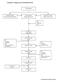 Lampiran 1. Bagan proses Pembuatan Krim Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph Pencampuran Dengan mikser -Identifikasi
Lampiran 1. Bagan proses Pembuatan Krim Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph Pencampuran Dengan mikser -Identifikasi
Lampiran 1. Bagan proses Pembuatan Krim
 Lampiran 1. Bagan proses Pembuatan Krim Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph -Stabilitas krim Pencampuran Dengan
Lampiran 1. Bagan proses Pembuatan Krim Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph -Stabilitas krim Pencampuran Dengan
LAPORAN PRAKTEK KERJA PROFESI APOTEKER FARMASI INDUSTRI
 LAPORAN PRAKTEK KERJA PROFESI APOTEKER FARMASI INDUSTRI di LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT (LAFI DITKESAD) PERIODE 01 30 NOVEMBER 2010 Disusun oleh: RANI MELINTAN, S.Farm. NIM 093202145
LAPORAN PRAKTEK KERJA PROFESI APOTEKER FARMASI INDUSTRI di LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT (LAFI DITKESAD) PERIODE 01 30 NOVEMBER 2010 Disusun oleh: RANI MELINTAN, S.Farm. NIM 093202145
PERSYARATAN TAMBAHAN LABORATORIUM LINGKUNGAN
 Lampiran I Peraturan Menteri Negara Lingkungan Hidup Nomor : 06 Tahun 2009 Tanggal : 6 April 2009 PERSYARATAN TAMBAHAN LABORATORIUM LINGKUNGAN Persyaratan ini digunakan sebagai persyaratan tambahan ISO/IEC
Lampiran I Peraturan Menteri Negara Lingkungan Hidup Nomor : 06 Tahun 2009 Tanggal : 6 April 2009 PERSYARATAN TAMBAHAN LABORATORIUM LINGKUNGAN Persyaratan ini digunakan sebagai persyaratan tambahan ISO/IEC
Lampiran 1. Bagan proses Pembuatan Krim / Salep
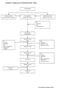 Lampiran 1. Bagan proses Pembuatan Krim / Salep Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph -Stabilitas krim Pencampuran
Lampiran 1. Bagan proses Pembuatan Krim / Salep Penimbangan Peleburan bahan Dasar krim (Fase minyak) Pencampuran Dengan ultra turrax Pelarutan zat aktif, Pengawet (Fase cair) -ph -Stabilitas krim Pencampuran
