PEMBAHASAN SOAL KIMIA SELEKSI KOMPETISI SAINS MADRASAH (KSM) TINGKAT KAB/KOTA 2013 Oleh Urip Kalteng (
|
|
|
- Shinta Budiaman
- 7 tahun lalu
- Tontonan:
Transkripsi
1 PEMBAHASAN SOAL KIMIA SELEKSI KOMPETISI SAINS MADRASAH (KSM) TINGKAT KAB/KOTA 2013 Oleh Urip Kalteng ( 1. Gas mulia xenon ditemukan pertama kali tahun 1962, gas tersebut dapat bersenyawa dengan platina dan fluor. Jika suatu senyawa tersebut terdiri dari 30% Xe, 44% Pt, dan 26% F, maka rumus empiris senyawa tersebut: A. XePtF B. XePtF 4 C. XePtF 5 D. XePtF 6 E. XePtF 8 Anggap senyawa tersebut 100 gram, sehingga massa: Xe = 30 g; Pt = 44 g; F = 26 g Perbandingan mol (massa/massa molar) setiap unsur dalam senyawa: Xe Pt F Massa : Massa molar 30 : 131,2 44 : : 19 Mol Unsur 0,2287 0,2256 1,2684 Bagi dgn angka mol terkecil 0,2287 : 0,2256 0,2256 : 0,2256 1,2684 : 0,2256 Perbandingan 1,0137 1,0000 5,6223 Pembulatan perbandingan Massa molar setiap unsur tersedia pada tabel periodik yang disediakan. Jadi rumus kimia senyawa tersebut adalah XePtF6 alternatif D. 2. Sebanyak 156,0 g sampel unsur X dicampur dengan silikon, membentuk 268,3 g senyawa X 3 Si 4 murni. Massa atom X adalah A. 48 B. 52 C. 55 D. 57 E. 59 Reaksi yang mungkin: 3X + 4Si X 3 Si 4 156,0 g (268,3 156,0) g 268,3 g 156,0 g 112,3 g 268,3 g Mol Mol X 112,3 : 28,09 = 4,00 mol Mol X 3 Si 4 Berdasar perbandingan koefisien reaksi 3 mol 4 mol 1 mol Karena yang tersedia unsur X sebesar 156,0 g dan ini setara dengan 3 mol maka massa molar unsur X adalah 156,0 g : 3 mol = 52 g/mol (Alternatif B) 1
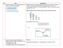
2 3. Senyawa LXO 3 sebanyak 4,9020 gram dalam keadaan kering dan murni dipanaskan membentuk 1,9200 gram gas oksigen dan padatan LX sebanyak 2,980 gram. Jika padatan LX ditambahkan AgNO 3 terjadi reaksi sempurna membentuk AgX sebanyak 5,7380 gram. Massa atom relatif L dan X adalah... A. L = 39,10 dan X = 70,90 B. L = 39,10 dan X = 35,45 C. L = 22,99 dan X = 70,90 D. L = 22,99 dan X = 35,45 E. L = 39,10 dan X = 79,90 Reaksi yang mungkin: 2LXO 3 2LX + 3O 2 Massa 4,9020 g 2,9800 g 1,9200 g Mol Mol LXO 3 Mol LX 1,92 : 32 Berdasar perbandingan koefisien reaksi 0,04 mol 0,04 mol 0,06 mol Jika 2,98 g LX = 0,04 mol, maka massa molar LX = 2,98 g : 0,04 mol = 74,5 g/mol Reaksi sempurna AgNO 3 + LX AgX + LNO 3 AgNO 3 + LX AgX + LNO 3 Massa 2,9800 g 5,7380 g Mol 0,04 mol Mol AgX Berdasar perbandingan koefisien reaksi 0,04 mol 0,04 mol Massa molar AgX = 5,7380 g : 0,04 mol = 143,45 g/mol Jadi massa molar X = massa molar AgX massa molar Ag = 143,45 g/mol 108 g/mol = 35,45 g/mol Massa molar L = massa molar LX massa molar X = 74,5 g/mol 35,45 g/mol = 39,05 g/mol Massa molar di sini dianggap sama dengan massa atom relatif jadi jawaban yang mendekati adalah B. L = 39,10 dan X = 35,45 4. Suatu sel elektrokimia disusun dengan menggunakan elektroda Cu dalam larutan Cu(II) dan elektroda Ni dalam larutan Ni(II) sedemikian rupa sehingga reaksi redoks terjadi secara spontan. Diketahui: E 0 Cu 2+ Cu = +0,34 V dan E 0 Ni 2+ Ni = 0,25 V. Jika konsentrasi ion Cu(II) ditingkatan pada suhu tetap, maka pengaruhnya terhadap E sel sel elektrokimia tersebut adalah... A. Tidak ada perubahan pada nilai E sel B. Tidak cukup informasi untuk menentukan perubahan nilai E sel C. Nilai E sel meningkat D. Nilai E sel berkurang E. Nilai E sel = 0 V Karena reaksi berlangsung secara spontan maka E 0 harus bernilai + : Anoda (oksidasi) : Ni Ni e - E 0 = +0,25 V Katoda (reduksi) : Cu e - Cu E 0 = +0,34 V Reaksi Redoks : Ni + Cu 2+ Ni 2+ + Cu E 0 = + 0,59 V Terkait dengan peingkatan konsentrasi Cu 2+ maka dapat digunakan Persamaan Nernst 2
3 x Oksidasi + n e- y Reduksi [ ] [ ] Jika yang ditingkatkan adalah konsentrasi zat yang ter-reduksi maka nilai log dari persamaan itu akan semakin kecil, dengan semakin kecilnya nilai log maka faktor pengurangnya juga semakin kecil artinya E akan semakin besar (meningkat). Bahkan ketika hasil log-nya negatif maka hasilnya E-nya akan lebih meningkat lagi. 5. Suatu sel elektrokimia dirangkai sebagaimana gambar di bawah ini. Di antara pernyataan berikut yang tepat mengenai perubahan yang terjadi pada anoda dan katoda ketika sel tersebut dioperasikan adalah... Setengah sel oksidasi Setengah sel reduksi A. Massa elektroda bertambah Massa elektroda berkurang B. [HO + 3 ] bertambah Massa elektroda bertambah C. [HO + 3 ] bertambah Massa elektroda berkurang D. [HO + 3 ] berkurang Massa elektroda bertambah E. [HO + 3 ] berkurang Massa elektroda berkurang Pada anoda (Pt~inert) terjadi reaksi oksidasi : H 2 +2H 2 O 2H 3 O + + 2e - Pada katoda (Cu) terjadi reduksi : Cu e - Cu (s) Jadi pada setengah sel oksidasi jumlah [HO 3 + ] bertambah dan massa elektroda (Cu) bertambah 6. Elektolisis umum digunakan untuk mendapatkan logarn murni dari ion-ionnya. Suatu percobaan dilakukan dengan memberikan arus sebesar 3 A selama 2 jam terhadap larutan ion logam X yang bermuatan +2. Di akhir percobaan, didapatkan logam X sebanyak 7,1l g. Logam X tersebut adalah A. Ba B. Ni C. Sr D. Cu E. Mn Dari soal diketahui massa endapan (w) = 7,11 g; i = 3 A; t = (2 x 60 x 60 )detik W = (e. i. t): ,11 g = (e x 3 x 2x60x60):96500 e = 31,76 g Karena logam tersebut bermuatan +2 maka massa molar-nya = 2 x 31,76 = 63,52 g/mol Berdasarkan data pada tabel periodik unsur yang memiliki massa molar sekitar 63,52 adalah logam Cu. Alternatif D yang benar. 3
4 7. Persamaan reaksi kimia yang tepat untuk menunjukkan kesetimbangan es dan air pada suhu 0 o C adalah A. H 2 O (s) H 2 O (l) H 2 O (g) B. H 2 O (s) H 2(g) + O 2(g) C. H 2 O (s) H 2 O (l) D. H 2 O (s) + energi H 2 O (l) E. H 2 O (s) H 2 O (l) H 2(g) + O 2(g) Persamaan reaksi kimia yang tepat adalah H 2 O (s) + energi H 2 O (l) Ketika pada suhu 0 o C air membeku (es) dan siap berubah mencair, ketika dikenai energi maka ia berubah wujud menjadi air cair. 8. Pada suhu tertentu, dalam wadah bervolume 1 L dimasukkan gas H 2 dan gas I 2 masing-masing sebanyak 2,0 mol. Pada saat kesetimbangan terdapat 3,5 mol gas HI. Nilai Kc reaksi tersebut sebesar A. 5, B. 8, C. 3, D. 5, E. 1, Persamaan reaksi setimbang: H 2(g) + I 2(g) 2HI (g) Berdasarkan persamaan tersebut maka: H 2(g) + I 2(g) 2HI (g) Mula-mula : 2 mol 2 mol - Reaksi : 1,75 mol 1,75 mol +3,5 mol Setimbang : 0,25 mol 0,25 mol 3,5 mol Karena volume tetap (1) maka pernyataan konsentrasi bisa digunakan jumlah mol zat saja Kc = [ ] [ ][ ] 9. Kelarutan molar magnesium hidroksida (K sp = ) dalam suatu larutan penyangga dengan ph = 11 sebesar... A. 1, M B. 1, M C. 8, M D. 8, M E. 8, M ph = 11 poh = 3 [OH ] = 10 3 M Magnesium hidroksida Mg(OH) 2 K sp = [Mg 2+ ][OH - ] = [Mg 2+ ](10 3 ) 2 [Mg 2+ ] = ( ) : (10 6 ) = M Mg(OH) 2 Mg OH - Karena koefisien Mg(OH) 2 = koefisien Mg 2+ maka kelarutan Mg(OH) 2 = [Mg 2+ ] = M 4
5 10. I 2(g) + 3 Cl 2(g) 2 ICl 3(s) H o = 214 kj/mol I 2(s) I 2(g) H o = 38 kj/mol Perubahan entalpi standar pembentukan yod triklorida ICl 3 adalah A. 176 kj/mol B. 138 kj/mol C. 88 kj/mol D. 138 kj/mol E. 214 kj/mol Perubahan entalpi standar pembentukan adalah perubahan entalpi untuk pembentukan setiap 1 mol senyawa dari unsur-unsur-nya. I 2(g) + 3 Cl 2(g) 2 ICl 3(s) H o = 214 kj/mol I 2(s) I 2(g) H o = 38 kj/mol I 2(s) + 3 Cl 2(g) 2 ICl 3(s) H o = -176 kj (ini pembentukan ICl 3(s) sebanyak 2 mol ~ lihat koefisien ICl 3(s) ) Jadi perubahan entalpi standar pembentukan ICl 3(s) = 176 kj : 2 mol = 88 kj/mol 11. Bila 2,3 g dimetil eter (M r = 46) dibakar pada tekanan tetap, kalor yang dilepaskan adalah 82,5 kj. Berdasarkan data ini, kalor pembakaran dimetil eter adalah... A kj/mol B kj/mol C. 825 kj/mol D kj/mol E kj/mol Kalor pembakaran dimetil eter untuk setiap mol-nya dapat dihitung dengan suatu cara sebagai berikut: 2,3 g dimetil eter = 2,3 g : 46 g/mol = 0,05 mol ~ 82,5 kj, maka kalor pembakaran per mol-nya = 82,5 kj : 0,05 mol = 1650 kj/mol 12. Diketahui persamaan termokimia berikut: C 2 H 4(g) + 3 O 2(g) 2 CO 2(g) + 2 H 2 O (l) H o = kj 2 C 2 H 6(g) + 7 O 2(g) 4 CO 2(g) + 6 H 2 O (l) H o = kj 2 H 2(g) + O 2(g) 2 H 2 O (l) H o = -570 kj Perubahan entalpi untuk reaksi C 2 H 4(g) + H 2(g) C 2 H 6(g) adalah A. 420 kj B. 270 kj C. 135 kj D kj E kj C 2 H 4(g) + 3 O 2(g) 2 CO 2(g) + 2 H 2 O (l) H o = 1400 kj 2 CO 2(g) + 3 H 2 O (l) C 2 H 6(g) +3 ½ O 2(g) H o = kj H 2(g) + ½ O 2(g) H 2 O (l) H o = 285 kj C 2 H 4(g) + H 2(g) C 2 H 6(g) H = 135 kj 13. Diketahui energi ikatan: C=C = 614 kj/mol; C Cl = 328 kj/mol; C H = 413 kj/mol C C = 348 kj/mol; Cl Cl = 244 kj/mol Perubahan entalpi bagi reaksi H 2 C=CH 2(g) + Cl 2(g) ClH 2 C CH 2 Cl adalah... A. 31 kj B. 62 kj C. 93 kj D. 124 kj E. 146 kj 5
6 Energi Ikatan pada Ruas Kiri Energi Ikatan pada Ruas Kanan 4 x C H = 4 x 413 kj = 1652 kj 4 x C H = 4 x 413 kj = 1652 kj 1 x C=C = 1 x 614 kj = 614 kj 2 x C Cl = 2 x 328 kj = 656 kj 1 x Cl Cl = 1 x 244 kj = 244 kj 1 x C C = 348 kj = 348 kj Total Energi Ikatan = kj Total energi ikatan = kj Perubahan entalpi = energi ikatan ruas kiri energi ikatan ruas kanan Perubahan entalpi = kj kj = 146 kj 14. Nitrogen oksida bereaksi dengan hidrogen pada suhu tinggi menurut persamaan: 2NO (g) + 2H 2(g) N 2(g) + 2H 2 O (g) Jika pada waktu tertentu laju reaksi nitrogen oksida 0,36 mol L 1 s 1, maka laju reaksi gas nitrogen adalah... A. 0,09 mol L 1 s 1 B. 0,18 mol L 1 s 1 C. 0,36 mol L 1 s 1 D. 0,54mol L 1 s 1 E. 0,72 mol L 1 s 1 Hubungan koefisien reaksi di atas secara stoikiometri dengan laju reaksi dapat dituliskan: Laju rekasi = ½ [NO]/ t = ½ [H2]/ t = + [N 2 ] / t Laju reaksi = ½ [NO] / t = + [N 2 ] / t (ingat tanda plus-minus bukan merupakan nilai) ½ x 0,36 mol L 1 s 1 = + [N 2 ] / t [N 2 ] / t = 0,18 mol L 1 s Pada reaksi: H 2 O 2 + 2I + H + 2H 2 O + I 2 Jika konsentrasi H 2 O 2 berubah dari 1,00 M menjadi 0,95 M dalam waktu 100 detik, maka perubahan laju rekasi I dalam M.detik 1 adalah... A. 0,500 B. 0,200 C. 0,050 D. 0,010 E. 0,001 Penyelesaian soal ini seperti pada pembahasan soal no 14 Laju rekasi = [ H 2 O 2 ]/ t = ½ [ I ]/ t ½ [ I ]/ t = [ H 2 O 2 ]/ t [ I ]/ t = 2 x (1,00 0,95)M : 100 detik = 2 x 0,0005 M/detik = 0,001 M/detik 16. Pada reaksi: Cl 2(g) + 2NO (g) 2NOCl (g) Jika konsentrasi kedua pereaksi diperbesar 2 kali, laju reaksi menjadi 8 kali semula. Jika hanya konsentrasi Cl 2 yang diperbesar 2 kali, laju reaksi menjadi 2 kali semula. Maka orde reaksi NO adalah A. 0 B. ½ C. 1 D. 2 E. 3 6
7 Sebaiknya dibuat permisalan seperti contoh berikut: Percobaan [Cl 2 ] [NO] Laju 1 x y v 2 2x 2y 8v 3 2x y 2v Orde reaksi (m) terhadap NO kita gunakan data 2 dan 3 (2y/y) m = (8v/2v) 2 m = 4 m = Oksidasi NO menjadi NO 2 menurut rekasi 2NO (g) + O 2(g) 2NO 2(g) Memberikan data sebagai berikut: Percobaan [O 2 ], M [NO], M Laju NO 2 (M/det) 1 0,001 0,001 7,10 2 0,004 0,001 28,40 3 0,004 0, ,6 4 0,002 0,002 X Nilai X dalam tabel tersebut adalah... A. 3,65 B. 14,20 C. 28,40 D. 56,80 E. 85,20 Penentuan orde reaksi: Orde reaksi terhadap O 2 (0,004/0,001) x = (28,40/7,10) 4 x = 4 x = 1 Orde reaksi terhadap NO (0,003/0,001) y = (255,6/28,40) 3 y = 9 y = 2 Penentuan konstanta laju reaksi: Ambil salah satu data percobaan, misal data 1: v = k[o 2 ] [NO] 2 k = V: ([O 2 ] [NO] 2 ) k = 7,10 : (0,001 x (0,001) 2 ) k = 7,10 x 10 9 Penentuan laju pada data ke 4: v = 7,10 x 10 9 x (0,002)(0,002) 2 v = 7,10 x 8 v = 56, Berdasarkan data titik didih berikut, urutan kekuatan interaksi molekular unsur senyawa-senyawa di bawah ini adalah Senyawa Titik didih ( o C) Etanol (C 2 H 5 OH) 78,4 Etilen glikol (C 2 H 4 (OH) 2 197,2 Air, H 2 O 100,0 Dietil eter, C 4 H 10 O 34,5 A. dietil eter < etanol <etilen glikol < air B. air < etanol < etilen glikol < dietil eter C. dietil eter < etanol < air < etilen glikol D. etilen glikol < dietil eter < etanol < air E. etanol < air < dietil eter < etilen glikol Interaksi molekular dapat ditandai dengan tingginya titik didik suatu senyawa, semakin tinggi titik didih menunjukkan interaksinya semakin kuat. Ketika mendidih maka ia harus mendapatkan energi yang cukup untuk melepaskan kekuatan interaksi yang ia miliki hingga berubah menjadi uap (gas). Urutan yang benar adalah seperti pada alternatif C. dietil eter < etanol < air < etilen glikol 7
8 19. Diketahui struktur molekul XCl 3 adalah segitiga piramida. Pada sistem periodik, unsur X berada pada golongan A. 3 B. 5 C. 13 D. 15 E. 17 Polaritas senyawa atau ion poliatomik ditentukan oleh Struktur molekul yang berbentuk setiga piramida harus memiliki rumus umum AX 3 E, A atom pusat, 3 pasang elektron berikatan dan sebuah pasangan elektron bebas pada atom pusat. elektron valensi atom pusat berjumlah 5, yaitu 2 (dari pasangan elektron bebas) dan 3 (berasal dari elektron yang digunakan berikatan dengan Cl). Jadi unsur X tersebut terletak pada golongan V-A (elektron valensi 5) atau berada pada golongan 15 pada sistem periodik dengan penggolongan terbaru. 20. Senyawa di bawah ini yang bersifat polar adalah... A. NH 4 + B. SbCl 5 C. I 3 D. ClO 2 E. SnCl 4 Polaritas senyawa atau ion poliatomik ditentukan oleh perbedaan keelektronegatifan, semakin besar perbedaan-nya maka senyawa semakin polar. Atau dengan mengamati struktur Lewis-nya atau melihat bentuk molekul-nya. Jika simetris maka bersifat non polar, sebaliknta jika asimetris maka bersifat polar. NH 4 + bentuk molekulnya tetrahedral non polar SbCl 5 bentuk molekulnya bipiramida trigonal non polar I 3 bentuk molekulnya linier non polar ClO 2 bentuk molekulnya bengkok - polar SnCl 4 bentuk molekulnya tetrahedral non polar 21. Pernyataan berikut berkaitan dengan molekul NH 3 dan NF 3 (1) NH 3 lebih mudah larut dalam air dibandingkan NF 3 (2) Hibridisasi atom N pada kedua molekul tersebut adalah sp 3 (3) Sudut ikatan pada molekul NH 3 ( H N H) lebih kecil dibandingkan dengan molekul NF 3 ( F N F) (4) Titik didih molekul NH 3 lebih kecil dibandingkna dengan NF 3 Pernyataan yang benar adalah A. 1 dan 2 B. 1 dan 3 C. 2 dan 4 D. 3 saja E. 4 saja Perbandingan beberapa sifat NH 3 dengan NF 3 : NH 3 lebih mudah larut dalam air dibandingkan NF 3, senyawa yang polar akan mudah larut dalam air yang juga bersifat polar, NH 3 polar dan akan mudah larut dalam air. Hibridisasi atom N pada kedua molekul tersebut adalah sp 3 (1 pasang elektron bebas, dan 3 pasang elektron berikatan) Sudut ikatan pada molekul NH 3 ( H N H) justru lebih besar dibandingkan dengan molekul NF 3 ( F N F). Pada NH 3 elektronegatifitas N lebih besar dibanding H, sementara pada NF 3 elektronegatifitas N lebih kecil dibandingkan F. NH 3 lebih polar karena terpusatnya pasangan elektron bebas dan ini akan menyebabkan pembesaran sudut ikatan antara N-H, sedang pada NF 3 cenderung lebih merata sebaran elektronnya. ( H N H = 107 o, F N F = 102 o ) 8
9 Titik didih molekul NH 3 lebih besar dibandingkan dengan NF 3, ini dapat dikaitkan dengan polaritas antara kedua senyawa bahwa NH 3 lebih polar dibanding NF 3 senyawa polar akan memiliki titik didih yang lebih tinggi yang juga terkait adanya ikatan hidrogen pada senyawa NH Kelarutan PbCl 2 dalam larutan HCl lebih besar karena A. Efek ion senama B. PbCl 2 lebih mudah terionisasi dalam suasana asam C. Pembentukan senyawa kompleks [PbCl 4 ] 2 D. PbCl 2 bersifat basa E. HCl lebih polar dibandingkan air Ketika PbCl 2 dilarutkan dalam HCl (artinya HCl ini berlebih) maka kelarutan PbCl 2 akan meningkat kelebihan ion klorida (Cl ) ini akan bereaksi dengan ion Pb 2+ membentuk ion kompleks [PbCl 4 ] 2 yang stabil seperti reaksi berikut: PbCl 2 Pb Cl Pb Cl [PbCl 4 ] Diketahui K sp AgI = 8, dan K sp PbI 2 = 7, Konsentrasi I - minimum yang diperlukan untuk mengendapkan ion Ag + dalam suatu larutan yang mengandung campuran ion Ag + (0,1 M) dan Pb 2+ (0,1 M) adalah A. 8, B. 9, C. 7, D. 2, E. 1, AgI Ag + + I - 0,1 M [I - ] K sp AgI = [Ag + ][I - ] 8, = [0,1][I - ], [I - ] = 8, : 0,1 [I - ] = 8, M PbI 2 Pb I - 0,1 M [I - ] K sp PbI 2 = [Pb +2 ] [I - ] 2 7, = [0,1] [ I - ] 2 [ I - ] 2 = 7, [ I - ] = (7,9) 10 4 M Karena yang ditanyakan adalah konsentrasi ion I - minimum maka jawaban yang tepat adalah [I - ] = 8, M 24. Diketahui K b NH 3 = 1, dan K a HC 2 H 3 O 2 = 1, Nilai ph dari larutan amonium asetat, NH 4 C 2 H 3 O 2 0,065 M adalah A. 1,19 B. 2,96 C. 7,00 D. 11,06 E. 12,81 Ketika garam yang terbentuk dari asam lemah dan basa lemah yang memiliki K a = K b maka berapapun konsentrasi garam itu ph-nya dianggap netral = Suatu larutan buffer sebanyak 1 L mengandung campuran 0,14 M HC 2 H 3 O 2 dan 0,27 M C 2 H 3 O 2. Diketahui K a HC 2 H 3 O 2 = 1, Nilai ph larutan buffer tersebut setelah ditambah 0,025 mol HCl adalah A. 0,85 B. 1,15 C. 4,92 D. 5,03 E. 6,47 9
10 Larutan buffer ditambah sedikit asam kuat maka akan terjadi peningkatan jumlah mol asam dan pengurangan jumlah konjugat (karena konjugatnya bereaksi dengan H + membentuk asam tadi). HC 2 H 3 O 2 = CH 3 COOH, C 2 H 3 O 2 = CH 3 COO - 1 L CH 3 COOH 0,14 M = 0,14 mol 1 L CH 3 COO - 0,27 M = 0,27 mol HCl = 0,025 mol = K a CH 3 COOH = 1, pk a = 5 log 1,8 CH 3 COOH H + + CH 3 COO - Mula-mula : 0,14 mol 0,27 mol Perubahan : + 0,025 mol 0,025 mol Akhir : 0,165 mol? 0,255 mol ph = pk a + log (0,255/0,165) ph = 5 log 1,8 + log 1,545 ph = 5 0,26 + 0,19 = 4, Dalam perkembangan teori atom tercatat beberapa hal berikut: (1) Percobaan Rutherford membuktikan bahwa muatan positif terkonsentrasi pada pusat bola atom (2) Postulat Bohr merupakan perumusan kuantitatif pertama tentang struktur atom (3) Data-data eksperimen selain atom hidrogen diperoleh dari hasil percobaan Bohr Pernyataan yang benar adalah... A. 1, 2, dan 3 B. 1 dan 2 C. 2 dan 3 D. 1 saja E. 3 saja (1) Benar bahwa percobaan Rutherford membuktikan bahwa muatan positif terkonsentrasi pada pusat bola atom dengan melakukan penembakan menggunakan sinar alfa pada lempeng tipis emas, ternyata sebagian ada yang dibelokkan (yang mengenai inti atom). (2) Postulat Bohr merupakan perumusan kuantitatif pertama tentang struktur atom hidrogen beserta spektrumnya. (3) Data-data eksperimen hanya atom hidrogen diperoleh dari hasil percobaan Bohr 27. Berdasarkan letaknya dalam sistem periodik, muatan, dan jumlah elektronnya, maka urutan ukuran atom/ion isoelektronik di bawah ini adalah A. Ca 2+ > K + > Ar > Cl > S 2 B. S 2 > Cl > Ar > K + > Ca 2+ C. S 2 > Ca 2+ > Cl > K + > Ar D. Cl > S 2 > Ca 2+ > K + > Ar E. Ca 2+ > S 2 > K + > Ar > Cl Sesuai data pada tabel periodik unsur diketahui bahwa: S nomor atom 16 Cl nomor atom 17 Ar nomor atom 18 K nomor atom 19 Ca nomor atom 20 Ukuran atom/ion isoeletronik (memiliki jumlah elektron sama dalam hal ini semua punya 18 elektron) semakin kecil jika jumlah proton (= nomor atom) semakin besar. Dengan demikian urutan yang benar adalah S 2 > Cl > Ar > K + > Ca 2+ sesuai dengan alternatif B 10
11 28. Pasangan unsur yang mempunyai ukuran/volume atom yang hampir sama adalah A. K, Ca B. Ti, Zr C. K, Rb D. Ne, Kr E. HF, Zr Dapat disimak dalam tabel periodik unsur, bahwa unsur yang terletak dalam satu periode akan memiliki ukuran volume yang hampir sama, terutama yang memang golongannya berdekatan. Dalam hal ini pasangan yang punya volume atom yang hampir sama adalah K dan Ca terletak pada periode ke 3 (K golongan IA (golongan 1), Ca golongan IIA(golongan 2)). 29. Suatu senyawa murni terdiri dari C, H, N, O, S, dan Fe. Jumlah atom Fe dalam senyawa tersebut adalah satu. Kadar Fe dalam senyawa tersebut 8,09% (w/w). Massa molekul relatif senyawa tersebut adalah... A. 56 B. 346 C. 453 D. 692 E. 785 A r Fe = 56 massa molar Fe = 56 g/mol % Fe = massa molar Fe : massa molar senyawa (M r ) 8,09% = 56 : M r Senyawa 0,0809 = 56 : M r Senyawa M r Senyawa = 56 : 0,0808 = 692,21 ~ Perhatikan pernyataan berikut: (1) Titik didih/leleh unsur golongan non logam dari bawah ke atas makin besar sebab kekuatan ikatan van des Waals yang terjadi makin kuat (2) Semua senyawa logam memiliki kecenderungan untuk membentuk ion kompleks (3) Keelektronegatifan unsur golongan logam dari atas ke bawah makin kecil Pernyataan di atas benar, kecuali: A. 1, 2, 3 B. 1, 2 C. 2, 3 D. 1 saja E. 3 saja Cukup jelas, titik didih unsur golongan non logam dari bawah ke atas semakin kecil dan tidak semua senyawaan logam dapat membentuk ion kompleks. 31. Sifat-sifat berikut yang bukan sifat koloid adalah A. Dapat mengalami koagulasi B. Menunjukkan efek Tyndall C. Jika mengadsorbsi ion, dapat dipisahkan dengan elektroforesis D. Terdiri dari satu fasa E. Menunjukkan gerak Brown Sifat koloid salah satunya adalah memiliki dua fasa (bukan satu fasa), yaitu fasa terdispersi dan medium pendispersi. 11
12 32. Senyawa yang dapat digunakan sebagai penstabil emulsi adalah A. ZnS 2 B. Natrium oleat C. HCl D. Na 2 S 2 O 3 E. Natrium asetat Senyawa yang dapat digunakan sebagai penstabil emulsi antara lain natrium oleat, 33. Di antara unsur-unsur di bawah ini yang mempunyai afinitas elektron terbesar adalah A. Be B. B C. C D. N E. Ne Unsur-unsur yang di sajikan pada alternatif jawaban adalah unsur yang terletak dalam satu periode. Dalam satu periode dari kiri ke kana afinitasnya semakin besar. Ne terletak paling kanan dalam tabel periodik unsur. Jadi Ne-lah yang mempunyai afinitas elektron terbesar. 34. Dalam suasana basa, logam kobalt (Co) dapat mengalami reaksi oksidasi menjadi Co(OH) 3 sementara natrium hipoklorit, NaOCl, dapat dioksidasi menjadi NaCl. Apabila reaksi tersebut disetarakan maka koefisien reaksi kobalt dan NaOCl yaitu: A. 2 dan 3 B. 1 dan 3 C. 3 dan 2 D. 1 dan 2 E. 3 dan 1 Reaksi Oksidasi : Co Co e - x2 Reaksi Reduksi : H 2 O + OCl - + 2e - Cl - + 2OH - x3 Reaksi redoks : 2Co + 3H 2 O + 3OCl - 2Co Cl - + 6OH - Reaksi lengkapnya: 2Co + 3H 2 O + 3NaOCl 2 Co(OH) 3 + 3NaCl Jadi koefisien reaksi kobalt = 2, dan koefisien reaksi NaOCl = Hidrogensulfat atau ion bisulfat, HSO 4 - dapat bertindak sebagai asam atau basa di dalam air. Di antara persamaan reaksi berikut, ion HSO 4 - yang bertindak sebagai asam adalah dalam reaksi: A. HSO 4 + H 2 O H 2 SO 4 + OH - B. HSO 4 + H 3 O+ SO 3 + 2H 2 O C. HSO 4 + OH- H 2 SO 4 + O 2 - D. HSO 4 + H 2 O SO H 3 O + E. HSO 4 + H 3 O + H 2 SO 4 + H 2 O Jika suatu spesi mampu melepaskan proton (ion H + ) maka ia dikatakan bertindak sebagai basa, sementar itu H 2 O akan bertindak sebagai basa yang ditandai dengan diterima-nya ion H + dari ion HSO 4 - membentuk H 3 O +. Jadi reaksi pada alternatif D yang menunjukkan HSO 4 - bertindak sebagai asam. 12
13 36. Larutan 0,2 M natrium klorobenzoat (NaC 7 H 4 ClO 2 ) memiliki ph 8,65. Nilai ph larutan 0,2 M asam klorobenzoat (HC 7 H 4 ClO 2 ) adalah A. 5,35 B. 8,65 C. 2,35...? ph = 2,65 D. 3,45 E. 3,25 Natrium klorobenzoat adalah garam yang berasal dari basa kuat dengan asam lemah, sehingga ia bersifat basa (ph > 7) Untuk dapat menghitung ph asam klorobenzoat harus diketahui K a asam tersebut, K a ini dapat dihitung dari hitungan garam-nya. ph = 8,65 poh = 14 8,65 = 5,35 [OH - ] = 10 5,35 M [ ] [ ] [H + ] = = 10 2,65 ph = 2,65 Dari alternatif jawaban tidak tersedia. 37. Warfarin digunakan sebagai racun tikus. Jumlah pusat kiral yang terdapat dalam molekul warfarin di bawah ini adalah A. 0 B. 1 C. 2 D. 3 E. 4 Atom C kiral (pusat kiral) adalah atom C yang mengikat 4 gugus berbeda-beda, pada molekul warfarin terdapat 1atom C kiral yang ditunjukkan pada lingkar merah gambar berikut ini: Setiap ujung ikatan dan setiap sudut menunjukkan adanya atom C, atom H tidak ditampilkan, setiap atom C memiliki 4 ikatan, kalau tidak tampak sebanyak 4 ikatan artinya ada satu ikatan C dengan atom H. 38. Di antara pasangan senyawa di bawah ini, yang memiliki titik didih yang identik adalah A. CH 3 CH 2 CH 2 CH 2 OH dan (CH 3 ) 2 CHCH 2 OH B. CH 3 (CH 2 ) 4 CH 3 dan (CH 3 ) 2 CHCH(CH 3 ) 2 C. D. E. 13
14 Senyawa dengan rumus struktur sama dan rumus molekul yang sama akan memiliki titik didih yang identik. Pada alternatif D rumus molekul dan rumus strukturnya sama, hanya letak gugus Cl ada yang ke arah belakang bidang datar dan ke arah depan bidang datar. 39. Berikut ini adalah struktur vitamin C (asam askorbat): Pernyataan yang tepat mengenai jumlah atom karbon kiral dan konfigurasi absolut atom C kiral yang terdapat pada cincin adalah A. 1 dan R B. 2 dan R C. 1 dan S D. 2 dan S E. 3 dan R 40. Jumlah isomer, termasuk isomer geometrinya yang dimiliki senyawa C 3 H 4 Cl 2 adalah A. 3 B. 4 C. 5 D. 6 E. 7 Tidak tersedia jawaban...! 14
TES AWAL II KIMIA DASAR II (KI-112)
 TES AWAL II KIMIA DASAR II (KI112) NAMA : Tanda Tangan N I M : JURUSAN :... BERBAGAI DATA. Tetapan gas R = 0,082 L atm mol 1 K 1 = 1,987 kal mol 1 K 1 = 8,314 J mol 1 K 1 Tetapan Avogadro = 6,023 x 10
TES AWAL II KIMIA DASAR II (KI112) NAMA : Tanda Tangan N I M : JURUSAN :... BERBAGAI DATA. Tetapan gas R = 0,082 L atm mol 1 K 1 = 1,987 kal mol 1 K 1 = 8,314 J mol 1 K 1 Tetapan Avogadro = 6,023 x 10
PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH
 PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH TAHUN 2016 Soal diketik ulang oleh urip rukim (www.urip.info)
PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH TAHUN 2016 Soal diketik ulang oleh urip rukim (www.urip.info)
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: HUKUM-HUKUM DASAR KIMIA Di soal diketahui dan ditanya: m (NH 2 ) 2 CO = 12.000 ton/tahun (pabrik) m N 2 = ton/tahun?
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: HUKUM-HUKUM DASAR KIMIA Di soal diketahui dan ditanya: m (NH 2 ) 2 CO = 12.000 ton/tahun (pabrik) m N 2 = ton/tahun?
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: TERMOKIMIA Pada soal diketahui dan ditanya: ΔH c C 2 H 5 OH = -1380 kj/mol ΔH d C 6 H 12 O 6 = -60 kj/mol ΔH c C
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: TERMOKIMIA Pada soal diketahui dan ditanya: ΔH c C 2 H 5 OH = -1380 kj/mol ΔH d C 6 H 12 O 6 = -60 kj/mol ΔH c C
SIMULASI UJIAN NASIONAL 2
 SIMULASI UJIAN NASIONAL 2. Diketahui nomor atom dan nomor massa dari atom X adalah 29 dan 63. Jumlah proton, elektron, dan neutron dalam ion X 2+ (A) 29, 27, dan 63 (B) 29, 29, dan 34 (C) 29, 27, dan 34
SIMULASI UJIAN NASIONAL 2. Diketahui nomor atom dan nomor massa dari atom X adalah 29 dan 63. Jumlah proton, elektron, dan neutron dalam ion X 2+ (A) 29, 27, dan 63 (B) 29, 29, dan 34 (C) 29, 27, dan 34
Redoks dan Elektrokimia Tim Kimia FTP
 Redoks dan Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis
Redoks dan Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis
Elektrokimia. Tim Kimia FTP
 Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis ini merupakan
Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis ini merupakan
 UJIAN MASUK BERSAMA (UMB) Mata Pelajaran : Kimia Tanggal : 07 Juni 009 Kode Soal : 9. Penamaan yang tepat untuk : CH CH CH CH CH CH OH CH CH adalah A. -etil-5-metil-6-heksanol B.,5-dimetil-1-heptanol C.
UJIAN MASUK BERSAMA (UMB) Mata Pelajaran : Kimia Tanggal : 07 Juni 009 Kode Soal : 9. Penamaan yang tepat untuk : CH CH CH CH CH CH OH CH CH adalah A. -etil-5-metil-6-heksanol B.,5-dimetil-1-heptanol C.
SOAL KIMIA 2 KELAS : XI IPA
 SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2015 Page 1 1. MATERI: STOIKIOMETRI Persen massa adalah persentase massa zat terlarut dalam 100 gram massa larutan (massa pelarut + massa
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2015 Page 1 1. MATERI: STOIKIOMETRI Persen massa adalah persentase massa zat terlarut dalam 100 gram massa larutan (massa pelarut + massa
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A. D. Cu E. Zn
 1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
Persiapan UN 2018 KIMIA
 Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
SOAL KIMIA 1 KELAS : XI IPA
 SOAL KIIA 1 KELAS : XI IPA PETUNJUK UU 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja 3. Kerjakanlah soal anda pada lembar
SOAL KIIA 1 KELAS : XI IPA PETUNJUK UU 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja 3. Kerjakanlah soal anda pada lembar
D. 4,50 x 10-8 E. 1,35 x 10-8
 1. Pada suatu suhu tertentu, kelarutan PbI 2 dalam air adalah 1,5 x 10-3 mol/liter. Berdasarkan itu maka Kp PbI 2 adalah... A. 4,50 x 10-9 B. 3,37 x 10-9 C. 6,75 x 10-8 S : PbI 2 = 1,5. 10-3 mol/liter
1. Pada suatu suhu tertentu, kelarutan PbI 2 dalam air adalah 1,5 x 10-3 mol/liter. Berdasarkan itu maka Kp PbI 2 adalah... A. 4,50 x 10-9 B. 3,37 x 10-9 C. 6,75 x 10-8 S : PbI 2 = 1,5. 10-3 mol/liter
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2014 Page 1 1. MATERI: STOIKIOMETRI Reaksi kondensasi berkaitan dengan reaksi pembentukan polimer, di samping ada juga yang mengalami reaksi
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2014 Page 1 1. MATERI: STOIKIOMETRI Reaksi kondensasi berkaitan dengan reaksi pembentukan polimer, di samping ada juga yang mengalami reaksi
Antiremed Kelas 11 Kimia
 Antiremed Kelas 11 Kimia Persiapan UAS 1 Kimia Doc. Name: AR11KIM01UAS Version: 016-08 halaman 1 01. Salah satu teori yang menjadi dasar sehingga tercipta model atom modern (A) Rutherford, Niels Bohr,
Antiremed Kelas 11 Kimia Persiapan UAS 1 Kimia Doc. Name: AR11KIM01UAS Version: 016-08 halaman 1 01. Salah satu teori yang menjadi dasar sehingga tercipta model atom modern (A) Rutherford, Niels Bohr,
Kimia UMPTN Tahun 1981
 Kimia UMPTN Tahun 1981 UMPTN-81-51 Suatu atom unsury mempunyai susunan elektron : 1s s p 6 3s 3p 5. Unsur tersebut adalah A. logam alkali B. unsur halogen C. salah satu unsur golongan V D. belerang E.
Kimia UMPTN Tahun 1981 UMPTN-81-51 Suatu atom unsury mempunyai susunan elektron : 1s s p 6 3s 3p 5. Unsur tersebut adalah A. logam alkali B. unsur halogen C. salah satu unsur golongan V D. belerang E.
Review II. 1. Pada elektrolisis larutan NaCl dengan elektroda karbon, reaksi yang terjadi pada katoda adalah... A. 2H 2
 KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 14 Sesi NGAN Review II A. ELEKTROLISIS 1. Pada elektrolisis larutan NaCl dengan elektroda karbon, reaksi yang terjadi pada katoda adalah... A. 2H 2 O 4H + + O 2
KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 14 Sesi NGAN Review II A. ELEKTROLISIS 1. Pada elektrolisis larutan NaCl dengan elektroda karbon, reaksi yang terjadi pada katoda adalah... A. 2H 2 O 4H + + O 2
2. Konfigurasi elektron dua buah unsur tidak sebenarnya:
 . Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
. Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53
PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53
OAL TES SEMESTER I. I. Pilihlah jawaban yang paling tepat! a. 2d d. 3p b. 2p e. 3s c. 3d 6. Unsur X dengan nomor atom
 KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
D. 3 dan 4 E. 1 dan 5
 1. Dari beberapa unsur berikut yang mengandung : 1. 20 elektron dan 20 netron 2. 10 elektron dan 12 netron 3. 15 proton dan 16 netron 4. 20 netron dan 19 proton 5. 12 proton dan 12 netron Yang memiliki
1. Dari beberapa unsur berikut yang mengandung : 1. 20 elektron dan 20 netron 2. 10 elektron dan 12 netron 3. 15 proton dan 16 netron 4. 20 netron dan 19 proton 5. 12 proton dan 12 netron Yang memiliki
D. 2 dan 3 E. 2 dan 5
 1. Pada suhu dan tekanan sama, 40 ml P 2 tepat habis bereaksi dengan 100 ml, Q 2 menghasilkan 40 ml gas PxOy. Harga x dan y adalah... A. 1 dan 2 B. 1 dan 3 C. 1 dan 5 Kunci : E D. 2 dan 3 E. 2 dan 5 Persamaan
1. Pada suhu dan tekanan sama, 40 ml P 2 tepat habis bereaksi dengan 100 ml, Q 2 menghasilkan 40 ml gas PxOy. Harga x dan y adalah... A. 1 dan 2 B. 1 dan 3 C. 1 dan 5 Kunci : E D. 2 dan 3 E. 2 dan 5 Persamaan
PAKET UJIAN NASIONAL 9 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 9 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Isotop terdiri dari A. 13 proton, 14 elektron dan 27
PAKET UJIAN NASIONAL 9 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Isotop terdiri dari A. 13 proton, 14 elektron dan 27
Hubungan koefisien dalam persamaan reaksi dengan hitungan
 STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
K13 Revisi Antiremed Kelas 10 KIMIA
 K13 Revisi Antiremed Kelas 10 KIMIA Persiapan Penilaian Akhir Semester (PAS) Ganjil Doc Name: RK13AR10KIM01PAS Version : 2016-11 halaman 1 01. Pernyataaan berikut yang tidak benar (A) elektron ditemukan
K13 Revisi Antiremed Kelas 10 KIMIA Persiapan Penilaian Akhir Semester (PAS) Ganjil Doc Name: RK13AR10KIM01PAS Version : 2016-11 halaman 1 01. Pernyataaan berikut yang tidak benar (A) elektron ditemukan
Tabel Periodik. Bab 3a. Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr.
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Bab 3a Tabel Periodik Kapan unsur-unsur ditemukan? 8.1 1 ns 1 Konfigurasi elektron
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Bab 3a Tabel Periodik Kapan unsur-unsur ditemukan? 8.1 1 ns 1 Konfigurasi elektron
 TRY OUT SELEKSI OLIMPIADE TINGKAT KABUPATEN/KOTA 2010 TIM OLIMPIADE KIMIA INDONESIA 2011 Waktu: 150 Menit PUSAT KLINIK PENDIDIKAN INDONESIA (PKPI) bekerjasama dengan LEMBAGA BIMBINGAN BELAJAR SSCIntersolusi
TRY OUT SELEKSI OLIMPIADE TINGKAT KABUPATEN/KOTA 2010 TIM OLIMPIADE KIMIA INDONESIA 2011 Waktu: 150 Menit PUSAT KLINIK PENDIDIKAN INDONESIA (PKPI) bekerjasama dengan LEMBAGA BIMBINGAN BELAJAR SSCIntersolusi
PAKET UJIAN NASIONAL 11 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 11 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Unsur dengan nomor massa 45 dan mempunyai jumlah netron
PAKET UJIAN NASIONAL 11 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Unsur dengan nomor massa 45 dan mempunyai jumlah netron
Sulistyani, M.Si.
 Sulistyani, M.Si. sulistyani@uny.ac.id Reaksi oksidasi: perubahan kimia suatu spesies (atom, unsur, molekul) melepaskan elektron. Cu Cu 2+ + 2e Reaksi reduksi: perubahan kimia suatu spesies (atom, unsur,
Sulistyani, M.Si. sulistyani@uny.ac.id Reaksi oksidasi: perubahan kimia suatu spesies (atom, unsur, molekul) melepaskan elektron. Cu Cu 2+ + 2e Reaksi reduksi: perubahan kimia suatu spesies (atom, unsur,
Pembahasan Soal Multiplechoice OSK Kimia Tahun 2014 Oleh Urip
 Pembahasan Soal Multiplechoice OSK Kimia Tahun 2014 Oleh Urip Kalteng @ http://urip.wordpress.com Dengan senang hati jika ada yang mau mengoreksi pembahasan ini A. Pilih jawaban yang paling tepat ( 25
Pembahasan Soal Multiplechoice OSK Kimia Tahun 2014 Oleh Urip Kalteng @ http://urip.wordpress.com Dengan senang hati jika ada yang mau mengoreksi pembahasan ini A. Pilih jawaban yang paling tepat ( 25
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
Pembahasan Soal-soal Try Out Neutron, Sabtu tanggal 16 Oktober 2010
 Pembahasan Soal-soal Try Out Neutron, Sabtu tanggal 16 Oktober 2010 26. Diketahui lambing unsur Fe, maka jumlah p +, e - dan n o dalam ion Fe 3+ adalah.... Jawab :, Fe 3+ + 3e - Fe [ 18 Ar] 4s 2 3d 6 [
Pembahasan Soal-soal Try Out Neutron, Sabtu tanggal 16 Oktober 2010 26. Diketahui lambing unsur Fe, maka jumlah p +, e - dan n o dalam ion Fe 3+ adalah.... Jawab :, Fe 3+ + 3e - Fe [ 18 Ar] 4s 2 3d 6 [
UN SMA IPA 2009 Kimia
 UN SMA IPA 009 Kimia Kode Soal P88 Doc. Version : 011-06 halaman 1 01. Perhatikan tabel data fisik dan daya hantar larutan beberapa senyawa berikut: Senyawa Titik Leleh Daya Hantar Listrik Larutan L M
UN SMA IPA 009 Kimia Kode Soal P88 Doc. Version : 011-06 halaman 1 01. Perhatikan tabel data fisik dan daya hantar larutan beberapa senyawa berikut: Senyawa Titik Leleh Daya Hantar Listrik Larutan L M
UN SMA 2012 IPA Kimia
 UN SMA 2012 IPA Kimia Kode Soal Doc. Name: UNSMAIPA2011KIM999 Doc. Version : 2012-12 halaman 1 01. Tahap awal pembuatan asam nitrat dalam industri melibatkan reaksi oksidasi ammonia yang menghasilkan nitrogen
UN SMA 2012 IPA Kimia Kode Soal Doc. Name: UNSMAIPA2011KIM999 Doc. Version : 2012-12 halaman 1 01. Tahap awal pembuatan asam nitrat dalam industri melibatkan reaksi oksidasi ammonia yang menghasilkan nitrogen
1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat!
 Petunjuk : 1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat! 2. Soal Teori ini terdiri dari dua bagian: A. 30 soal pilihan Ganda : 60 poin B. 5 Nomor
Petunjuk : 1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat! 2. Soal Teori ini terdiri dari dua bagian: A. 30 soal pilihan Ganda : 60 poin B. 5 Nomor
1. Bilangan Oksidasi (b.o)
 Reaksi Redoks dan Elektrokimia 1. Bilangan Oksidasi (b.o) 1.1 Pengertian Secara sederhana, bilangan oksidasi sering disebut sebagai tingkat muatan suatu atom dalam molekul atau ion. Bilangan oksidasi bukanlah
Reaksi Redoks dan Elektrokimia 1. Bilangan Oksidasi (b.o) 1.1 Pengertian Secara sederhana, bilangan oksidasi sering disebut sebagai tingkat muatan suatu atom dalam molekul atau ion. Bilangan oksidasi bukanlah
D. golongan IIIA perioda 4 E. golongan VIA perioda 5
 1. Isotop terdiri dari... A. 13 proton, 14 elektron dan 27 neutron B. 13 proton, 13 elektron dan 27 neutron C. 13 proton, 13 elektron dan 14 neutron D. 14 proton, 14 elektron dan 13 neutron E. 27 proton,
1. Isotop terdiri dari... A. 13 proton, 14 elektron dan 27 neutron B. 13 proton, 13 elektron dan 27 neutron C. 13 proton, 13 elektron dan 14 neutron D. 14 proton, 14 elektron dan 13 neutron E. 27 proton,
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya.
 30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
Ikatan kimia. 1. Peranan Elektron dalam Pembentukan Ikatan Kimia. Ikatan kimia
 Ikatan kimia 1. Peranan Elektron dalam Pembentukan Ikatan Kimia Ikatan kimia Gaya tarik menarik antara atom sehingga atom tersebut tetap berada bersama-sama dan terkombinasi dalam senyawaan. gol 8 A sangat
Ikatan kimia 1. Peranan Elektron dalam Pembentukan Ikatan Kimia Ikatan kimia Gaya tarik menarik antara atom sehingga atom tersebut tetap berada bersama-sama dan terkombinasi dalam senyawaan. gol 8 A sangat
SOAL SELEKSI OLIMPIADE SAINS TINGKAT KABUPATEN/KOTA 2004 CALON TIM OLIMPIADE KIMIA INDONESIA
 SOAL SELEKSI OLIMPIADE SAINS TINGKAT KABUPATEN/KOTA 2004 CALON TIM OLIMPIADE KIMIA INDONESIA 2005 Bidang Kimia KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN DIREKTORAT JENDERAL PENDIDIKAN MENENGAH DIREKTORAT PEMBINAAN
SOAL SELEKSI OLIMPIADE SAINS TINGKAT KABUPATEN/KOTA 2004 CALON TIM OLIMPIADE KIMIA INDONESIA 2005 Bidang Kimia KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN DIREKTORAT JENDERAL PENDIDIKAN MENENGAH DIREKTORAT PEMBINAAN
SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016)
 SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016) Bagian I: Pilihan Ganda 1) Suatu atom yang mempunyai energi ionisasi pertama bernilai besar, memiliki sifat/kecenderungan : A. Afinitas elektron rendah
SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016) Bagian I: Pilihan Ganda 1) Suatu atom yang mempunyai energi ionisasi pertama bernilai besar, memiliki sifat/kecenderungan : A. Afinitas elektron rendah
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PAKET UJIAN NASIONAL 17 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 17 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
PAKET UJIAN NASIONAL 17 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
Mengubah energi kimia menjadi energi listrik Mengubah energi listrik menjadi energi kimia Katoda sebagi kutub positif, anoda sebagai kutub negatif
 TUGAS 1 ELEKTROKIMIA Di kelas X, anda telah mempelajari bilangan oksidasi dan reaksi redoks. Reaksi redoks adalah reaksi reduksi dan oksidasi. Reaksi reduksi adalah reaksi penangkapan elektron atau reaksi
TUGAS 1 ELEKTROKIMIA Di kelas X, anda telah mempelajari bilangan oksidasi dan reaksi redoks. Reaksi redoks adalah reaksi reduksi dan oksidasi. Reaksi reduksi adalah reaksi penangkapan elektron atau reaksi
D. 8 mol S E. 4 mol Fe(OH) 3 C. 6 mol S Kunci : B Penyelesaian : Reaksi :
 1. Perhatikan reaksi, 2 Fe 2 S 3 + 3O 2 + 6 H 2 O 4 Fe(OH) 3 + 6S Jika 2 mol Fe 2 S 3, 2 mol O 2 dan 3 mol H 2 O bereaksi dengan sempurna, akan dihasilkan : A. 3 mol Fe(OH) 3 B. 2 mol Fe(OH) 3 D. 8 mol
1. Perhatikan reaksi, 2 Fe 2 S 3 + 3O 2 + 6 H 2 O 4 Fe(OH) 3 + 6S Jika 2 mol Fe 2 S 3, 2 mol O 2 dan 3 mol H 2 O bereaksi dengan sempurna, akan dihasilkan : A. 3 mol Fe(OH) 3 B. 2 mol Fe(OH) 3 D. 8 mol
Doc. Name: UNSMAIPA999KIM304 Doc. Version : (A) +2 (B) +3 (C) +4 (D) +5 (E) +7
 UN SA IPA Kimia Kode Soal 304 Doc. Name: UNSAIPA999KI304 Doc. Version : 2012-12 halaman 1 01. Perhatikan perubahan berikut : 1) petasan meledak 2) garaam melarut 3) kayu melapuk 4) susu menjadi asam 5)
UN SA IPA Kimia Kode Soal 304 Doc. Name: UNSAIPA999KI304 Doc. Version : 2012-12 halaman 1 01. Perhatikan perubahan berikut : 1) petasan meledak 2) garaam melarut 3) kayu melapuk 4) susu menjadi asam 5)
I. Soal Pilihan ganda
 I. Soal Pilihan ganda 1. Perhatikan tabel berikut : Unsur P Q R S T titik leleh ( o C) 180,54 97.81-249 63.85 117 titik didih ( o C) 1347 883-246 773,9 184 Massa atom 6.94 22.99 20.18 39.10 126.9 Kelompok
I. Soal Pilihan ganda 1. Perhatikan tabel berikut : Unsur P Q R S T titik leleh ( o C) 180,54 97.81-249 63.85 117 titik didih ( o C) 1347 883-246 773,9 184 Massa atom 6.94 22.99 20.18 39.10 126.9 Kelompok
Chapter 7 Larutan tirtawi (aqueous solution)
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi modif oleh Dr I Kartini Chapter 7 Larutan tirtawi (aqueous solution) Larutan adalah campuran yang homogen dari dua atau lebih
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi modif oleh Dr I Kartini Chapter 7 Larutan tirtawi (aqueous solution) Larutan adalah campuran yang homogen dari dua atau lebih
kimia ASAM-BASA III Tujuan Pembelajaran
 KTSP K-13 kimia K e l a s XI ASAM-BASA III Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami mekanisme reaksi asam-basa. 2. Memahami stoikiometri
KTSP K-13 kimia K e l a s XI ASAM-BASA III Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami mekanisme reaksi asam-basa. 2. Memahami stoikiometri
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi. Bab17. Kesetimbangan Asam-Basa dan Kesetimbangan Kelarutan
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Bab17 Kesetimbangan Asam-Basa dan Kesetimbangan Kelarutan Larutan buffer adalah larutan yg terdiri dari: 1. asam lemah/basa
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Bab17 Kesetimbangan Asam-Basa dan Kesetimbangan Kelarutan Larutan buffer adalah larutan yg terdiri dari: 1. asam lemah/basa
PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP FAX KODE POS 60299
 PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP. 031-8415492 FAX 031-8430673 KODE POS 60299 ULANGAN AKHIR SEMESTER 2 (DUA) TAHUN PELAJARAN 2011 2012 Hari/Tanggal :
PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP. 031-8415492 FAX 031-8430673 KODE POS 60299 ULANGAN AKHIR SEMESTER 2 (DUA) TAHUN PELAJARAN 2011 2012 Hari/Tanggal :
TINGKAT PERGURUAN TINGGI 2017 (ONMIPA-PT) SUB KIMIA FISIK. 16 Mei Waktu : 120menit
 OLIMPIADE NASIONAL MATEMATIKA DAN ILMU PENGETAHUAN ALAM TINGKAT PERGURUAN TINGGI 2017 (ONMIPA-PT) BIDANG KIMIA SUB KIMIA FISIK 16 Mei 2017 Waktu : 120menit Petunjuk Pengerjaan H 1. Tes ini terdiri atas
OLIMPIADE NASIONAL MATEMATIKA DAN ILMU PENGETAHUAN ALAM TINGKAT PERGURUAN TINGGI 2017 (ONMIPA-PT) BIDANG KIMIA SUB KIMIA FISIK 16 Mei 2017 Waktu : 120menit Petunjuk Pengerjaan H 1. Tes ini terdiri atas
LOGO. Stoikiometri. Tim Dosen Pengampu MK. Kimia Dasar
 LOGO Stoikiometri Tim Dosen Pengampu MK. Kimia Dasar Konsep Mol Satuan jumlah zat dalam ilmu kimia disebut mol. 1 mol zat mengandung jumlah partikel yang sama dengan jumlah partikel dalam 12 gram C 12,
LOGO Stoikiometri Tim Dosen Pengampu MK. Kimia Dasar Konsep Mol Satuan jumlah zat dalam ilmu kimia disebut mol. 1 mol zat mengandung jumlah partikel yang sama dengan jumlah partikel dalam 12 gram C 12,
Kimia Proyek Perintis I Tahun 1979
 Kimia Proyek Perintis I Tahun 979 PP I-79-5 Kalsium mempunyai nomor 0, susunan elektron pada kulit K, L, M, N adalah A., 8, 0, 0 B., 8, 9, C., 8, 8, D., 8, 6, 4 E., 8,, 8 PP I-79-5 Larutan molal NaOH (BM
Kimia Proyek Perintis I Tahun 979 PP I-79-5 Kalsium mempunyai nomor 0, susunan elektron pada kulit K, L, M, N adalah A., 8, 0, 0 B., 8, 9, C., 8, 8, D., 8, 6, 4 E., 8,, 8 PP I-79-5 Larutan molal NaOH (BM
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur X memiliki nomor atom 19. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur X memiliki nomor atom 19. Ingat, bahwa jumlah
SMA UNGGULAN BPPT DARUS SHOLAH JEMBER UJIAN SEMESTER GENAP T.P 2012/2013 LEMBAR SOAL. Waktu : 90 menit Kelas : XII IPA T.
 SMA UNGGULAN BPPT DARUS SHOLAH JEMBER UJIAN SEMESTER GENAP T.P 0/0 LEMBAR SOAL Waktu : 90 menit Kelas : XII IPA T.P : 0/0 PETUNJUK :. Isikan identitas peserta pada tempat yang telah disediakan pada lembar
SMA UNGGULAN BPPT DARUS SHOLAH JEMBER UJIAN SEMESTER GENAP T.P 0/0 LEMBAR SOAL Waktu : 90 menit Kelas : XII IPA T.P : 0/0 PETUNJUK :. Isikan identitas peserta pada tempat yang telah disediakan pada lembar
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA JAWABAN (DOKUMEN NEGARA) UjianTeori. Waktu: 100 menit
 OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA JAWABAN (DOKUMEN NEGARA) UjianTeori Waktu: 100 menit Kementerian Pendidikan Nasional Dan Kebudayaan Direktorat Jenderal Managemen Pendidikan Dasar
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA JAWABAN (DOKUMEN NEGARA) UjianTeori Waktu: 100 menit Kementerian Pendidikan Nasional Dan Kebudayaan Direktorat Jenderal Managemen Pendidikan Dasar
Elektrokimia. Sel Volta
 TI222 Kimia lanjut 09 / 01 47 Sel Volta Elektrokimia Sel Volta adalah sel elektrokimia yang menghasilkan arus listrik sebagai akibat terjadinya reaksi pada kedua elektroda secara spontan Misalnya : sebatang
TI222 Kimia lanjut 09 / 01 47 Sel Volta Elektrokimia Sel Volta adalah sel elektrokimia yang menghasilkan arus listrik sebagai akibat terjadinya reaksi pada kedua elektroda secara spontan Misalnya : sebatang
OAL TES SEMESTER I. I. Pilihlah jawaban yang paling tepat!
 KIMIA X SMA 103 S AL TES SEMESTER I I. Pilihlah jawaban yang paling tepat! 1. Partikel penyusun inti atom terdiri dari... a. proton dan elektron b. proton dan netron c. elektron dan netron d. elektron
KIMIA X SMA 103 S AL TES SEMESTER I I. Pilihlah jawaban yang paling tepat! 1. Partikel penyusun inti atom terdiri dari... a. proton dan elektron b. proton dan netron c. elektron dan netron d. elektron
LOGO TEORI ASAM BASA
 LOGO TEORI ASAM BASA TIM DOSEN KIMIA DASAR FTP 2012 Beberapa ilmuan telah memberikan definisi tentang konsep asam basa Meskipun beberapa definisi terlihat kurang jelas dan berbeda satu sama lain, tetapi
LOGO TEORI ASAM BASA TIM DOSEN KIMIA DASAR FTP 2012 Beberapa ilmuan telah memberikan definisi tentang konsep asam basa Meskipun beberapa definisi terlihat kurang jelas dan berbeda satu sama lain, tetapi
PEMERINTAH KABUPATEN BANYUMAS DINAS PENDIDIKAN SMA NEGERI PATIKRAJA Jalan Adipura 3 Patikraja Telp (0281) Banyumas 53171
 PEMERINTAH KABUPATEN BANYUMAS DINAS PENDIDIKAN SMA NEGERI PATIKRAJA Jalan Adipura 3 Patikraja Telp (0281) 6844576 Banyumas 53171 ULANGAN KENAIKAN KELAS TAHUN PELAJARAN 2010/ 2011 Mata Pelajaran : Kimia
PEMERINTAH KABUPATEN BANYUMAS DINAS PENDIDIKAN SMA NEGERI PATIKRAJA Jalan Adipura 3 Patikraja Telp (0281) 6844576 Banyumas 53171 ULANGAN KENAIKAN KELAS TAHUN PELAJARAN 2010/ 2011 Mata Pelajaran : Kimia
kimia Kelas X REVIEW I K-13 A. Hakikat Ilmu Kimia
 K-13 Kelas X kimia REVIEW I Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami hakikat ilmu kimia dan metode ilmiah. 2. Memahami teori atom dan
K-13 Kelas X kimia REVIEW I Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami hakikat ilmu kimia dan metode ilmiah. 2. Memahami teori atom dan
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom fluor adalah 9 (ditulis 9 F) dan nomor atom belerang
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom fluor adalah 9 (ditulis 9 F) dan nomor atom belerang
SIMULASI UJIAN NASIONAL 3
 SIMULASI UJIAN NASIONAL 3 1. Diketahui: H, Li, Be, O, F, Ne, Na, Mg, 1 3 4 8 9 10 11 12 Ar, 18 36 Kr Kelompok unsur atau ion berikut yang mempunyai konfigurasi elektron yang sama (A) O 2-, F -, Ne (D)
SIMULASI UJIAN NASIONAL 3 1. Diketahui: H, Li, Be, O, F, Ne, Na, Mg, 1 3 4 8 9 10 11 12 Ar, 18 36 Kr Kelompok unsur atau ion berikut yang mempunyai konfigurasi elektron yang sama (A) O 2-, F -, Ne (D)
UN SMA 2012 IPA Kimia
 UN SMA 0 IPA Kimia Kode Konten Doc. UNSMAIPA0KIM999 Doc. Version : 0- halaman 0. Dua buah unsur dengan notasi 7X dan Y. Jika unsur-unsur tersebut berikatan, bentuk molekul dan kepolaran yang terjadi berturutturut
UN SMA 0 IPA Kimia Kode Konten Doc. UNSMAIPA0KIM999 Doc. Version : 0- halaman 0. Dua buah unsur dengan notasi 7X dan Y. Jika unsur-unsur tersebut berikatan, bentuk molekul dan kepolaran yang terjadi berturutturut
Ikatan Kimia. 2 Klasifikasi Ikatan Kimia :
 Ikatan Kimia Ikatan Kimia : Gaya tarik yang menyebabkan atom-atom yang terikat satu sama lain dalam suatu kombinasi untuk membentuk senyawa yang lebih kompleks. 2 Klasifikasi Ikatan Kimia : 1. Ikatan ion
Ikatan Kimia Ikatan Kimia : Gaya tarik yang menyebabkan atom-atom yang terikat satu sama lain dalam suatu kombinasi untuk membentuk senyawa yang lebih kompleks. 2 Klasifikasi Ikatan Kimia : 1. Ikatan ion
PEMBAHASAN UJIAN NASIONAL KIMIA TAHUN 2006
 UJIAN NASIONAL KIMIA TAHUN 2006 HTTP://GUDANGSOALPRO.BLOGSPOT.COM 1 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53 T yang terletak pada golongan yang sama dalam sistem periodik unsur adalah...
UJIAN NASIONAL KIMIA TAHUN 2006 HTTP://GUDANGSOALPRO.BLOGSPOT.COM 1 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53 T yang terletak pada golongan yang sama dalam sistem periodik unsur adalah...
PAKET UJIAN NASIONAL 14 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASINAL 14 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
PAKET UJIAN NASINAL 14 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
Antiremed Kelas 10 KIMIA
 Antiremed Kelas 10 KIMIA Persiapan UAS 1 Kimia Doc Name: AR10KIM01UAS Version : 2016-07 halaman 1 01. Partikel berikut yang muatannya sebesar 19 1,6 10 C dan bermassa 1 sma (A) elektron (B) proton (C)
Antiremed Kelas 10 KIMIA Persiapan UAS 1 Kimia Doc Name: AR10KIM01UAS Version : 2016-07 halaman 1 01. Partikel berikut yang muatannya sebesar 19 1,6 10 C dan bermassa 1 sma (A) elektron (B) proton (C)
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom nitrogen adalah 7 (ditulis 7 N) dan nomor atom
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom nitrogen adalah 7 (ditulis 7 N) dan nomor atom
UJIAN NASIONAL TAHUN PELAJARAN 2007/2008
 UJIAN NASIONAL TAHUN PELAJARAN 2007/2008 PANDUAN MATERI SMA DAN MA K I M I A PROGRAM STUDI IPA PUSAT PENILAIAN PENDIDIKAN BALITBANG DEPDIKNAS KATA PENGANTAR Dalam rangka sosialisasi kebijakan dan persiapan
UJIAN NASIONAL TAHUN PELAJARAN 2007/2008 PANDUAN MATERI SMA DAN MA K I M I A PROGRAM STUDI IPA PUSAT PENILAIAN PENDIDIKAN BALITBANG DEPDIKNAS KATA PENGANTAR Dalam rangka sosialisasi kebijakan dan persiapan
SOAL SELEKSI NASIONAL TAHUN 2006
 SOAL SELEKSI NASIONAL TAHUN 2006 Soal 1 ( 13 poin ) KOEFISIEN REAKSI DAN LARUTAN ELEKTROLIT Koefisien reaksi merupakan langkah penting untuk mengamati proses berlangsungnya reaksi. Lengkapi koefisien reaksi-reaksi
SOAL SELEKSI NASIONAL TAHUN 2006 Soal 1 ( 13 poin ) KOEFISIEN REAKSI DAN LARUTAN ELEKTROLIT Koefisien reaksi merupakan langkah penting untuk mengamati proses berlangsungnya reaksi. Lengkapi koefisien reaksi-reaksi
UJIAN I - KIMIA DASAR I A (KI1111)
 KIMIA TAHAP PERSIAPAN BERSAMA Departemen Kimia, Fakultas MIPA Institut Teknologi Bandung E-mail: first-year@chem.itb.ac.id UJIAN I - KIMIA DASAR I A (KI1111) http://courses.chem.itb.ac.id/ki1111/ 22 Oktober
KIMIA TAHAP PERSIAPAN BERSAMA Departemen Kimia, Fakultas MIPA Institut Teknologi Bandung E-mail: first-year@chem.itb.ac.id UJIAN I - KIMIA DASAR I A (KI1111) http://courses.chem.itb.ac.id/ki1111/ 22 Oktober
Kegiatan Belajar 3: Sel Elektrolisis. 1. Mengamati reaksi yang terjadi di anoda dan katoda pada reaksi elektrolisis
 1 Kegiatan Belajar 3: Sel Elektrolisis Capaian Pembelajaran Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada sel elektrolisis Subcapaian pembelajaran: 1. Mengamati reaksi yang
1 Kegiatan Belajar 3: Sel Elektrolisis Capaian Pembelajaran Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada sel elektrolisis Subcapaian pembelajaran: 1. Mengamati reaksi yang
TRY OUT UJIAN NASIONAL SMA PROGRAM IPA AKSES PRIVATE. Mata pelajaran : KIMIA Hari/Tanggal : / 2013
 TRY OUT UJIAN NASIONAL SMA PROGRAM IPA AKSES PRIVATE Mata pelajaran : KIMIA Hari/Tanggal : / 2013 Waktu : 120 Menit PETUNJUK UMUM: 1. Isikan nomor ujian, nama peserta, dan data pada Lembar Jawaban yang
TRY OUT UJIAN NASIONAL SMA PROGRAM IPA AKSES PRIVATE Mata pelajaran : KIMIA Hari/Tanggal : / 2013 Waktu : 120 Menit PETUNJUK UMUM: 1. Isikan nomor ujian, nama peserta, dan data pada Lembar Jawaban yang
PAKET UJIAN NASIONAL 7 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 7 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Dari beberapa unsur berikut yang mengandung : 1. 20
PAKET UJIAN NASIONAL 7 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Dari beberapa unsur berikut yang mengandung : 1. 20
OLIMPIADE KIMIA INDONESIA
 OLIMPIADE KIMIA INDONESIA OLIMPIADE SAINS NASIONAL SELEKSI KABUPATEN / KOTA UjianTeori Waktu 2 Jam Departemen Pendidikan Nasional Direktorat Jenderal Managemen Pendidikan Dasar dan Menengah Direktorat
OLIMPIADE KIMIA INDONESIA OLIMPIADE SAINS NASIONAL SELEKSI KABUPATEN / KOTA UjianTeori Waktu 2 Jam Departemen Pendidikan Nasional Direktorat Jenderal Managemen Pendidikan Dasar dan Menengah Direktorat
Soal-Soal. Bab 7. Latihan Larutan Penyangga, Hidrolisis Garam, serta Kelarutan dan Hasil Kali Kelarutan. Larutan Penyangga
 Bab 7 Soal-Soal Latihan Larutan Penyangga, Hidrolisis Garam, serta Kelarutan dan Hasil Kali Kelarutan Larutan Penyangga 1. Berikut ini yang merupakan pasangan asam basa terkonjugasi (A) H 3 O + dan OH
Bab 7 Soal-Soal Latihan Larutan Penyangga, Hidrolisis Garam, serta Kelarutan dan Hasil Kali Kelarutan Larutan Penyangga 1. Berikut ini yang merupakan pasangan asam basa terkonjugasi (A) H 3 O + dan OH
Bab V Ikatan Kimia. B. Struktur Lewis Antar unsur saling berinteraksi dengan menerima dan melepaskan elektron di kulit terluarnya. Gambaran terjadinya
 Bab V Ikatan Kimia Sebagian besar unsur yang ada di alam mempunyai kecenderungan untuk berinteraksi (berikatan) dengan unsur lain. Hal itu dilakukan karena unsur tersebut ingin mencapai kestabilan. Cara
Bab V Ikatan Kimia Sebagian besar unsur yang ada di alam mempunyai kecenderungan untuk berinteraksi (berikatan) dengan unsur lain. Hal itu dilakukan karena unsur tersebut ingin mencapai kestabilan. Cara
UN SMA 2015 PRE Kimia
 UN SMA 2015 PRE Kimia Kode Soal Doc. UNSMAIPA2015KIM999 Doc. Version : 2015-11 halaman 1 01. Suatu unsur Z mempunyai konfigurasi elektron [Ar]4s 2 3d 7. Jika neutron unsur tersebut 32, letak unsur Z dalam
UN SMA 2015 PRE Kimia Kode Soal Doc. UNSMAIPA2015KIM999 Doc. Version : 2015-11 halaman 1 01. Suatu unsur Z mempunyai konfigurasi elektron [Ar]4s 2 3d 7. Jika neutron unsur tersebut 32, letak unsur Z dalam
BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI
 BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI A. STANDAR KOMPETENSI Mendiskripsikan hukumhukum dasar kimia dan penerapannya dalam perhitungan kimia. B. Kompetensi Dasar : Menuliskan nama senyawa anorganik
BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI A. STANDAR KOMPETENSI Mendiskripsikan hukumhukum dasar kimia dan penerapannya dalam perhitungan kimia. B. Kompetensi Dasar : Menuliskan nama senyawa anorganik
Siswa diingatkan tentang struktur atom, bilangan kuantum, bentuk-bentuk orbital, dan konfigurasi elektron
 RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
RENCANA PELAKSANAAN PEMBELAJARAN NO: 1 Mata Pelajaran : Kimia Kelas/Semester : XI/1 Materi Pokok : Stuktur atom dan sistem periodik unsur Pertemuan Ke- : 1 dan 2 Alokasi Waktu : 2 x pertemuan (4 x 45 menit)
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Y memiliki nomor atom 17. Ingat, bahwa jumlah
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Di soal diketahui bahwa unsur Y memiliki nomor atom 17. Ingat, bahwa jumlah
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Ingat, bahwa jumlah neutron suatu unsur dan ionnya bernilai sama, yang membedakannya
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Ingat, bahwa jumlah neutron suatu unsur dan ionnya bernilai sama, yang membedakannya
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Ingat, bahwa jumlah neutron suatu unsur dan ionnya bernilai sama, yang membedakannya
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2017 Page 1 1. 2. MATERI: STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR Ingat, bahwa jumlah neutron suatu unsur dan ionnya bernilai sama, yang membedakannya
1s 2 2s 2 2p 6 3s 2 2p 6 3d 4s 1 4p 4d 4f 5s 5p 5d 5f
 NO SOAL PEMBAHASAN 1 Konfigurasi elekttron ion X - yang memiliki nomor massa 39 dan 21 neutron adalah.. A. 1s2 2s2 2p6 3s2 3p6 4s2 3d1 B. 1s2 2s2 2p6 3s2 3p6 4s1 C. 1s2 2s2 2p6 3s2 3p6 3d1 D. 1s2 2s2 2p6
NO SOAL PEMBAHASAN 1 Konfigurasi elekttron ion X - yang memiliki nomor massa 39 dan 21 neutron adalah.. A. 1s2 2s2 2p6 3s2 3p6 4s2 3d1 B. 1s2 2s2 2p6 3s2 3p6 4s1 C. 1s2 2s2 2p6 3s2 3p6 3d1 D. 1s2 2s2 2p6
UJIAN I - KIMIA DASAR I A (KI1111)
 KIMIA TAHAP PERSIAPAN BERSAMA Departemen Kimia, Fakultas MIPA Institut Teknologi Bandung E-mail: first-year@chem.itb.ac.id UJIAN I - KIMIA DASAR I A (KI1111) http://courses.chem.itb.ac.id/ki1111/ 20 Oktober
KIMIA TAHAP PERSIAPAN BERSAMA Departemen Kimia, Fakultas MIPA Institut Teknologi Bandung E-mail: first-year@chem.itb.ac.id UJIAN I - KIMIA DASAR I A (KI1111) http://courses.chem.itb.ac.id/ki1111/ 20 Oktober
Soal dan jawaban tentang Kimia Unsur
 Soal dan jawaban tentang Kimia Unsur 1. Identifikasi suatu unsur dapat dilakukan melalui pengamatan fisis maupun kimia. Berikut yang bukan merupakan pengamatan kimia adalah. A. perubahan warna B. perubahan
Soal dan jawaban tentang Kimia Unsur 1. Identifikasi suatu unsur dapat dilakukan melalui pengamatan fisis maupun kimia. Berikut yang bukan merupakan pengamatan kimia adalah. A. perubahan warna B. perubahan
Materi Pokok Bahasan :
 STOIKIOMETRI Kompetensi : Memiliki kemampuan untuk menginterpretasikan serta menerapkan dalam perhitungan kimia. Memiliki kemampuan untuk mengaplikasikan pengetahuan yang dimilikinya dan terbiasa menggunakan
STOIKIOMETRI Kompetensi : Memiliki kemampuan untuk menginterpretasikan serta menerapkan dalam perhitungan kimia. Memiliki kemampuan untuk mengaplikasikan pengetahuan yang dimilikinya dan terbiasa menggunakan
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL. UjianTeori. Waktu: 100 menit
 OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
OAL TES SEMESTER II. I. Pilihlah jawaban yang paling tepat!
 KIMIA XI SMA 217 S OAL TES SEMESTER II I. Pilihlah jawaban yang paling tepat! 1. Basa menurut Arhenius adalah senyawa yang bila dilarutkan dalam air akan menghasilkan a. proton d. ion H b. elektron e.
KIMIA XI SMA 217 S OAL TES SEMESTER II I. Pilihlah jawaban yang paling tepat! 1. Basa menurut Arhenius adalah senyawa yang bila dilarutkan dalam air akan menghasilkan a. proton d. ion H b. elektron e.
Volume gas oksigen yang diperlukan pada reaksi tersebut pada keadaan standart adalah. (Mr propana = 44)
 1. Suatu unsut terletak pada periode ke-3 golongan IIIA, konfigurasi elektron unsur tersebut adalah... A. 1s 2 2s 2 2p 1 B. 1s 2 2s 2 2p 6 3s 2 C. 1s 2 2s 2 2p 6 3s 2 3p 1 D. 1s 2 2s 2 2p 6 3d 10 4s 2
1. Suatu unsut terletak pada periode ke-3 golongan IIIA, konfigurasi elektron unsur tersebut adalah... A. 1s 2 2s 2 2p 1 B. 1s 2 2s 2 2p 6 3s 2 C. 1s 2 2s 2 2p 6 3s 2 3p 1 D. 1s 2 2s 2 2p 6 3d 10 4s 2
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom karbon adalah 6 (ditulis 6 C) dan nomor atom klor
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN SBMPTN KIMIA 2015 Page 1 1. MATERI: IKATAN KIMIA DAN GEOMETRI MOLEKUL Pada soal diketahui bahwa nomor atom karbon adalah 6 (ditulis 6 C) dan nomor atom klor
KISI-KISI UN KIMIA SMA/MA
 KISI-KISI UN KIMIA SMA/MA 2015-2016 Siswa mampu memahami, menguasai pengetahuan/ mengaplikasikan pengetahuan/ menggunakan nalar dalam hal: Struktur Atom Sistem Periodik Unsur Ikatan Kimia (Jenis Ikatan)
KISI-KISI UN KIMIA SMA/MA 2015-2016 Siswa mampu memahami, menguasai pengetahuan/ mengaplikasikan pengetahuan/ menggunakan nalar dalam hal: Struktur Atom Sistem Periodik Unsur Ikatan Kimia (Jenis Ikatan)
OLIMPIADE KIMIA INDONESIA
 OLIMPIADE KIMIA INDONESIA OLIMPIADE SAINS NASIONAL SELEKSI KABUPATEN / KOTA UjianTeori Waktu 2 Jam Departemen Pendidikan Nasional Direktorat Jenderal Managemen Pendidikan Dasar dan Menengah Direktorat
OLIMPIADE KIMIA INDONESIA OLIMPIADE SAINS NASIONAL SELEKSI KABUPATEN / KOTA UjianTeori Waktu 2 Jam Departemen Pendidikan Nasional Direktorat Jenderal Managemen Pendidikan Dasar dan Menengah Direktorat
D. 50 E. 64. D. -1,40 kj E. -2,80 kj
 1. Atom-atom unsur tertentu mempunyai 16 elektron. Atom atom unsur lain dengan sifat-sifat yang mirip adalah yang mempunyai jumlah elektron : A. 10 B. 24 C. 34 D. 50 E. 64 Bila suatu atom mempunyai 16
1. Atom-atom unsur tertentu mempunyai 16 elektron. Atom atom unsur lain dengan sifat-sifat yang mirip adalah yang mempunyai jumlah elektron : A. 10 B. 24 C. 34 D. 50 E. 64 Bila suatu atom mempunyai 16
