Gambar 4-12 Skema dari spektrofotometer inframerah.
|
|
|
- Sukarno Iskandar
- 6 tahun lalu
- Tontonan:
Transkripsi
1 4-4 Spektroskopi Molekul Tabel 4-2 menunjukkan kisaran radiasi elektromagnetik, yang mana dapat memberikan energi di seluruh unit umum yang digunakan, dan menunjukkan jenis Spektroskopi yang digunakan dalam jarak masingmasing. Perhatikan bahwa transisi rotasi membutuhkan energi yang sangat sedikit ( cm -1 ) dan sesuai dengan penyerapan radiasi di inframerah yang jauh untuk daerah microwave Vibrationai transisi lebih energik ( cm -1 ) dan sesuai dengan penyerapan di daerah deka inframerah dan disini juga diketahui bahwa inframerah transisi Elektronik masih lebih energik. (- 10, ,000 cm -1 ) dan sesuai dengan penyerapan di bagian terlihat dan ultraviolet spektrum. Dan selanjutnya mari kita periksa tiga jenis transisi spektroskopi untuk molekul hidrogen. Seperti yang kita telah mengatakan, ia dapat memutar pada akhir setiap sumbu yang tegak lurus dengan sumbu internukler, seperti ditunjukkan pada Gambar 4-10(a). pembelajaran tentang transisi rotasi jauh-inframerah dan microwave-scopy spektrofotometri digunakan untuk memperoleh data yang sangat tepat pada panjang ikatan dan sudut ikatan. Panjang ikatan H 2 telah ditentukan untuk menjadi 0,74116 A. Spektroskopi inframerah dan Romawi adalah metode eksperimental yang digunakan untuk mempelajari transisi energi getaran. Dalam inframerah spektroskopi sinar radiasi inframerah, yang biasanya mempunyai panjang gelombang yang bervariasi dari 2,5 μ sampai 15 μ. (Bilangan gelombang bervariasi dari 4000 cm -1 sampai 667 cm -1 ), dilewatkan melalui sampel suatu senyawa; lihat Gambar Sebuah prisma natrium klorida digunakan karena kuarsa atau kaca buram terhadap cahaya inframerah. Natrium klorida prisma posisi dan lebar celah menentukan panjang gelombang radiasi yang diperbolehkan untuk mencapai detektor. Penyerapan radiasi pada gelombang yang berbeda Gambar 4-12 Skema dari spektrofotometer inframerah.
2 Gambar 4-13 Skema dari sebuah spektrometer Raman. nomor yang diberikan sesuai dengan eksitasi molekul yang terendah ke tingkat energi vibrasi yang lebih tinggi. Radiasi yang diserap diidentifikasi oleh panjang gelombang (λ dalam Å, μ atau nm; 1μ = I0 3 nm = 10 4 Å = 10-4 cm), dengan frekuensi (v dalam detik -1 ), atau pada gelombang ( ṽ dalam cm -1 ) penyerapan Radiasi dideteksi secara elektronik dan dicatat dalam beberapa bentuk yang sesuai sebagai grafis jejak. penyerapan yang kuat di seluruh rentang frekuensi yang sempit menyebabkan "puncak-nya menjadi tajam atau "band" dalam catatan spektrum. Penyerapan puncak tidak selalu sempit dan tajam karena masing-masing tingkat energi vibrasi telah ditumpangkan di atasnya array tingkat energi rotasi (Gambar 4-11), sehingga transisi getaran tertentu benar-benar, superposisi transisi dari banyak vibrasi (rotasi tingkat). Tidak semua molekul merespon radiasi inframerah secara khusus, yang dapat merespon hanya molekul dengan unsur-unsur tertentu dari simetri, seperti molekul diatomik homo-nukler yang tidak menyerap radiasi inframerah. Untuk membantu dalam memeriksa getaran molekul-molekul (spektroskopi raman), cara dari Chan-drasekhara ilmuwan India V Raman, sering dapat digunakan. Hasil spektrum Raman dari iradiasi molekul ringan (di daerah terlihat) dari panjang gelombang dapat diketahui jika menggunakan cara ini. Caranya yaitu sinar laser digunakan untuk menyinari sampel dalam spektrometer Raman, seperti yang ditunjukkan pada Gambar Radiasi penyerapan tidak terdeteksi secara langsung. Ketika disinari dengan cahaya energi tinggi molekul bertambah kemudian hasil dari perlakuan ini akan menghasilan sejumlah energi yang sesuai dengan energi getaran molekul. Cahaya yang dihasilkan dari perlakuan tersebut lebih banyak tersebar daripada terserap, dan cahaya tersebut dapat diamati sebagai cahaya yang mempunyai panjang gelombang yang berbeda dari perlakuan ringan. Spektrum Raman H 2 mencapai puncak pada 4159,2 cm -1. dan energi getarannya tergantung massa atom, Direktori molekul menunjukkan sebuah puncak (band) pada energi yang lebih rendah (2990,3 cm -1 ). jika Ingin memeriksa lebih terinci transisi energi getaran yang berhubungan energy lain untuk massa atom tetapi juga ikatan,dan kekuatan. Jika getaran molekuler dapat digambarkan sebagai osilator harmonik sederhana, tingkat energi getaran yang diberikan oleh
3 E V 1 v hv 2 (4-16) di mana nilai-nilai hanya diperbolehkan dari bilangan kuantum v getaran adalah v = 0, I, 2, 3,... dan v adalah frekuensi getaran (detik -1 ) - A potensial Jarak inter-nuklir Gambar 4-14 kurva energi potensial untuk sebuah molekul diatomik dengan asumsi bahwa gerak vibrasi yang dapat digambarkan sebagai osilator harmonik. Daerah berbayang pada setiap tingkat energi vibrasi merupakan distribusi probabilitas dari fungsi gelombang yang bergetar. Energi kurva berkaitan dengan osilator harmonik ditunjukkan pada Gambar 4-14, tingkat energi getaran ditumpangkan bersama dengan perhitungan kemungkinan distribusi di setiap tingkat energi vibrasi. Perhatikan bahwa angka ini agak analog dengan Gambar 4-2, kecuali bahwa di bekas hanya tingkat energi terendah digambarkan vibrasi (v = 0). Ada beberapa fitur penting dari tingkat energi osilator harmonik getaran. Pertama, tingkat energi secara merata spasi, sebagaimana yang dituntut oleh Persamaan Kedua, perhatikan bahwa bahkan di tingkat energi terendah (v = 0) ada energi titik nol: E O = ½ hv* Ketiga, distribusi peluang vibrasi menunjukkan kemungkinan besar menemukan molekul pada jarak internuclear keseimbangan dalam terendah tingkat getaran (v = 0). Namun, dalam probabilitas mempunyai tingkat getaran yang lebih tinggi di kompresi ekstrem obligasi dan ekspansi. Kurva potensial osilator harmonik membandingkan baik dengan kurva potensi khas molekul, dekat bagian bawah potensial (Gambar 4-15). Namun, osilator harmonik tidak menunjukkan disosiasi yang benar pada jarak internuclear lebih besar. Karena pemisahan molekul, getar tingkat energi nasional secara merata spasi hanya di dekat bagian bawah kurva-energi potensial. Tingkat getaran yang lebih tinggi datang berturut-turut lebih dekat bersama-sama energi.
4 Mari kita memeriksa hubungan antara kekuatan ikatan dan getar energi nasional. Hubungan antara frekuensi getaran dan kekuatan ikatan konstan untuk masalah osilator harmonik adalah 1 v 2 k (4-17) Dalam persamaan k adalah konstanta gaya ikatan (yaitu, ukuran gaya yang dibutuhkan untuk merusak ikatan dengan jumlah yang diberikan) dan karenanya diukur kekuatan ikatan; μ. adalah massa atom berkurang untuk bergetar. Untuk molekul diatomik AB di mana massa atom berbeda, massa berkurang m AmB diberikan oleh ( m m ) B A Dari Persamaan 4-17, kita bisa melihat sebuah thatfor givenforce konstan, sebuah molekul dengan dikurangi massa yang lebih besar akan memiliki getaran frekuensi yang lebih rendah (dan Oleh karena itu energi getaran yang lebih rendah, dalam bilangan gelombang). Kita sudah memiliki * pada titik nol energy untuk H 2 adalah sekitar 6 kkal mol -1. Hal ini dapat dihitung antara lain : sebagai Eksperimen, pemisahan obligasi pada suatu ikatan berlangsung dari tingkat energi terendah vibrasi (v = 0) dan 103,24 kkal mol -1 Ikatan Hipotesis energi disosiasi H 2 dari bagian bawah kurva energi potensial adalah 109,5 kkal mol -1. Perbedaan antara dua nilai ini 1/2 hv dan merupakan energi titik nol untuk H 2. Dalam Bagian 4-3 kami disebut energi ikatan eksperimental (103,24 kkal mol -1 ); dalam Bagian 4-2 kita mengacu pada nilai hipotetis 109,5 kkal mol -1. Perhitungan dibuat dalam Bagian 4-2 tidak termasuk pengaruh dari titik nol energy vibrasi Gambar 4-15 menunjukan Perbandingan antara potensi aktual dan potensial osilator harmonik untuk sebuah molekul diatomic Menunjukkan misalnya dalam suatu lingkup dapat membandingkan H 2 dan D 2. molekul-molekul ini memiliki energi getar antara cm -1 dan cm -1 masing Aspek penting kedua dari Persamaan 4-17 berkaitan dengan membandingkan molekul dari massa berkurang sama tetapi konstanta gaya yang
5 berbeda seperti contoh pertama yang diberikan oleh H 2 dan H 2 +, energi getaran adalah 4159,2 cm -1 dan 2173 cm -1, masing-masing dengan konstanta gaya yang sesuai dihitung dari Persamaan 4-17 adalah 5,2 mdyn Å -1 dan 1,4 mdyn Å -1 Kita melihat bahwa frekuensi yang lebih besar dari hasil getaran dalam.. lebih besar gaya obligasi konstan, sesuai dengan ikatan yang lebih kuat. Selanjutnya untuk transisi elektronik. Sebagaimana dinyatakan sebelumnya, transisi elektronik sesuai dengan penyerapan sejumlah besar energy perbandingkan dengan energi yang diserap dalam getaran atau transisi rotasi. Eksitasi electronic biasanya dikaitkan dengan penyerapan cahaya tampak dan ultraviolet. Diagram skematik dari sebuah fotometer-spektrofotometri ultraviolet terlihat dan ditunjukkan pada Gambar Sebuah prisma atau difraksi kisi, dan lebar celah mengatur penyebaran panjang gelombang melalui sampel. Peristiwa cahaya pada sampel dilambangkan I 0 dan cahaya yang ditransmisikan dilambangkan I Penyerapan cahaya dapat dinyatakan secara kuantitatif dengan hubungan Gambar 4-16 diagram skema yang tampak dan spectrometer ultraviolet yang dikenal sebagai hukum Beer's = εcl, di mana A adalah absorbansi (log I 0 / I), c adalah konsentrasi zat (dalam mol liter -1 ), dan I adalah panjang (cm) dari jalan cahaya melalui substansi. Kepunahan koefisien molar, ε, merupakan karakteristik dari sampel menyerap. Nilai untuk kepunahan koefisien molar bervariasi dari senyawa ke senyawa dan dari puncak ke puncak dalam spektrum penyerapan senyawa yang sama. Sejauh mana transisi elektronik "diizinkan" atau "dilarang" oleh peraturan pemilihan kuantum-mekanis tercermin dalam nilai ε untuk puncak penyerapan menyertai transisi. Jadi eksperimen ditentukan nilai ε sering bisa sangat berguna dalam menentukan puncak absorpsi diberikan kepada jenis tertentu transisi elektronik Jika ε adalah dalam kisaran transisi memenuhi semua, persyaratan peraturan pemilihan kuantum mekanik, dan penyerapan dikatakan "diperbolehkan." Aturan seleksi hanya perkiraan ketika mereka menggambarkan transisi sebagai "forbtdden" karena dalam praktek yang sebenarnya sebuah band penyerapan umumnya dapat diamati. Meskipun demikian, intensitas band akan berkurang jika itu sesuai dengan sebuah transisi "orbital dilarang", dalam situasi ini ε biasanya dalam kisaran Akhirnya, nilai-sangat kecil ε ( ) Fberhubungan dengan transisi elektronik di mana satu elektron spin diperlukan untuk perubahan terjadi dari keadaan dasar negara-senang. Jadi "perputaran yang dilarang" transisi seringkali sulit untuk mengamati. Sebagai band penyerapan karena intensitasnya sangat lemah. Mari kita mempertimbangkan beberapa transisi elektronik mungkin di mol hydrogen. Kita bisa bayangkan transisi elektronik di mana sebuah elektron dipromosikan dari σ g b orbital ke orbital σ u * orbital
6 : (σ g b ) 2 (σ g b ) 1 (σ u *) 1 Transisi ini diperkirakan untuk memimpin pada molekul tidak stabil atau lemah terikat, karena efek dari elektron ikatan dibatalkan oleh bahwa dari elektron anti-ikatan. Ada banyak lainnya transisi elektronik mungkin. Salah satu contoh akan menjadi promosi salah satu elektron ERF ke orbital molekul terbentuk TT kosong dari 2p orbital pada atom hidrogen: seperti sebuah transisi sebelumnya (σ g b ) 2 (σ g b ) 1 (σ u *) 1 dan biasanya disebut sebagai σ π transisi elektronik. Elektronik transisi ini terjadi pada sekitar cm -1 pada molekul H 2. Ada dua cara untuk menyajikan, transisi elektronik dalam mode grafis. Dalam pertama, diagram tingkat energi orbital molekul-diambil untuk H 2 dan σ π transisi elektronik digambarkan (Gambar 4-17). Perhatikan bahwa angka ini termasuk orbital molekul π, yang tidak ditunjukkan dalam Gambar 4-8. Metode kedua dengan mana kita dapat menggambarkan ini transisi elektronik untuk menggambar kurva energi potensial untuk molekul dalam keadaan dasar dan di negara elektronik bersemangat. Gambaran ini ditunjukkan pada Gambar Perhatikan bahwa molekul tanah-negara terdisosiasi menjadi dua atom hidrogen keadaan dasar: H 2 H(1s)+H(1s) Sebaliknya, molekul senang-negara (yang ditunjuk *) terdisosiasi menjadi satu-keadaan dasar dan satu atom senang-negara hidrogen: H 2 * H(1s)+H(2p)
7 Gambar Ilustrasi dari σ π transisi elektronik pada H 2. Molekul orbital lain yang terbentuk dari 2s dan 2p orbital atom. Yang akan dibahas di pembahasan 4-6 Sampai saat ini kita telah mengasumsikan bahwa transisi elektronik berlangsung dengan tidak memandang gerakan rotasi dan vibrasi molekul. Sebenarnya, hal ini tidak benar, dan dalam Gambar 4-18 kita juga telah melapis tingkat energi getaran pada kurva energi potensial dari lingkungan elektronik. Pada suhu normal, molekul tanah-negara berada di tingkat energi terendah vibrasi (v "= 0).* Namun, dalam menjalani transisi elektronik, molekul gembira-negara dapat berada di sejumlah tingkat energi getar-tionai, v' = 0, 1, 2, 3,..., seperti yang ditunjukkan pada Gambar Oleh karena itu, * Nomor kuantum getaran molekul H 2 keadaan dasar: akan diberi label v"; sedangkan H 2 * akan diberi label v'.
8 Gambar 4-18 Hubungan antara potensi kurva energi-untuk H 2 dan H 2 * A spektrum penyerapan skematik juga ditunjukkan di sebelah kurva H 2 *. tidak satu penyerapan tetapi beberapa serapan akan dipamerkan, karena tingkat getaran dalam keadaan eksitasi. Tidak semua transisi ini akan mempunyai intensitas sama. 'Transisi intensitas maksimum akan terjadi ke tingkat yang ada maksimal tumpang tindih antara fungsi gelombang getaran dari tingkat bersemangat-keadaan energi dasar dan menengah. Karena keadaan dasar tingkat energi vibrasi memiliki probabilitas maksimum pada pusat obligasi, ini selalu akan menjadi transisi yang-terjadi secara vertikal dari posisi. Sebagai contoh yang ditunjukkan pada Gambar 4-18, pita intensitas maksimum
9 Gambar 4-19 spektrum absorpsi skematik pada σ π transisi elektronik untuk H 2 akan terjadi untuk transisi v n = 0 v = 3. transisi lainnya akan memiliki intensitas yang lebih rendah. Sebuah representasi skematis untuk penyerapan spektrum ini juga ditunjukkan pada Gambar 4-18 spektrum adalah digambarkan lebih lengkap pada Gambar Setiap transisi disebut sebagai transisi Franck-Condon, dan intensitas relatif dari puncak adalah yang disebut distribusi Franck-Condon Kepunahan koefisien molar ε dapat dihitung dari intensitas puncak di Gambar 4-19 Sejak σ π transisinya "diperbolehkan," nilai ε terkait akan besar. 4-5 fotoelektron Spektroskopi: Sebuah Metode Eksperimen Belajar orbital molekul Pembahasan dalam Bagian 4-3 menunjukkan bahwa teori orbital molekul diatomik untuk pembahasan sederhana homonuclear sebanding juga dengan energi ikatan eksperimental dan panjang ikatan. Dalam Bagian 4-4 kita menunjukkan bagaimana molekul spektroskopi dapat digunakan untuk menentukan sifat obligasi. Pada bagian ini kita akan melihat bahwa bukti lebih lanjut untuk kevalidan dari teori MO diperoleh dari jenis lain spektroskopi molekul yang disebut photoelektron spektroskopi (PES). Pada teknik eksperimental ukuran energy yang diperlukan untuk mengeluarkan elektron dari masing-masing menjabat molecuiar bitals. Nama teknik ini menunjukkan cara kerjanya: jika foton monokroatik energi yang cukup, hv, yang dilanggar pada sampel gas, ectrons dengan1/2 mv 2 energi kinetik yang dikeluarkan menurut hukum lotoelectric Einstein '(Bagian 1-6): M + hv M + + e - Hv = IE + ½ mv 2 PES ayam dapat diterapkan pada molekul atau atom, hanya M + diproduksi, dan M 2+, [ 3+,... biasanya tidak diamati. Dalam percobaan, spektrometer merupakan jumlah elektron yang dipancarkan dan energi kinetik
10 mereka. Sejak diketahui nilai konstan dikenal IE dapat dihitung dari Persamaan 4-18 Sebuah diagram skematik dari sebuah spektrometer fotoelektron ditunjukkan pada Gambar 20. Sebuah sumber foton khas untuk studi elektron valensi Gambar 4-20 begitu iyurc Skema diagram dari spektrometer fotoelektron. Diadaptasi srmission dengan dari H. Bock AOD P.O. Mollere, 7. Chem. Educ. 51: 506 (1974).
11 Gambar 4-21 Skema photoelectron spektrum atom hidrogen (a) atom hydrogen, (b) Molekul H 2 dan (c) atom He. Band yang tajam dalam spektrum atom H adalah karena ionisasi elektron 1s 1 di 13,60 ev. Band dalam spektrum molekul H 2 sesuai dengan elektron ejeksi dari molekul orbital σ g b. Puncak tajam ditumpangkan pada band akibat getaran ion H 2 +. Ini merupakan energi getaran sekitar 2200 cm -1 band tajam di 24,59 ev dalam spektrum ionisasi dari salah satu elektron dari elektron konfigurasi adalah 1s 2 Diadaptasi dengan ijin dari WC Harga, Endeavour 26:. 75 (1967). Yang disebut dengan sumber Hel (hv = 21,22 ev). Foton pemogokan sampel dalam ruang target dan sebagian dari elektron dikeluarkan melalui analyzer silinder. Tegangan pada pelat analyzer dipindai dalam rangka untuk memfokuskan energi kinetik elektron yang berbeda ke detektor. Dari detektor sinyal diperkuat dan ditampilkan pada perekam grafik sebagai pemancar elektron" per satuan waktu (hitungan per detik, cps) pada energi ionisasi pada ordinat dan absis ini. Sebuah forum sampel spektrum atom H skematik ditunjukkan pada Gambar 4-21 (a). Hanya satu puncak tajam (band) yang sesuai dengan energi ionisasi elektron 1s l dari atom hidrogen pada 13,60 ev: H + hv H + + e - Energi ionisasi dari atom H adalah sama dengan negatif dari orbital energy yang ditentukan oleh teori Bohr dan persamaan Schrodinger: k E 13, 60eV 2 n Pernyataan sederhana yang IE n = -E n (Persamaan 1-11) persis benar untuk atom satu elektron. Untuk multielectron atom dan molekul, teorema Koopmans 'menyatakan bahwa persamaan IE n = -E n masih benar, memberikan orbital dalam ion M + tidak berubah dari molekul netral atau atom M. Pernyataan ini sering disebut " orbital beku " pendekatan Sebuah pendekatan kedua negara yang terlibat dalam teorema
12 Koopmans 'bahwa electron'cor-hubungan di ion tidak berubah dari bahwa dalam molekul netral.. Asumsi ini tidak dapat sepenuhnya benar. Karena ion memiliki satu elektron lebih kecil dari netral molekul, jumlah korelasi elektron dalam ion akan selalu berkurang dari molekul, bahkan jika orbital dibekukan. Meskipun perkiraan yang terlibat dalam acara teorema Koopmans 'bahwa kita tidak bisa benar-benar menyamakan energi ionisasi dengan negatif dari orbital energi, masih merupakan teorema berguna dalam atom multielectron dan Cules-mol. Hal ini karena kesalahan dalam dua pendekatan cenderung untuk membatalkan satu sama lain, sehingga membuat kesalahan dalam teorema Koopmans 'relatif kecil. Spektrum fotoelektron H, molekul ditunjukkan pada Gambar 4-21(b). Hanya satu band hadir, sejak 15,45 ev dan memanjang sampai hampir 18 ev dengan puncak teratur beberapa spasi ditumpangkan di atasnya. Band ini sesuai dengan ionisasi (σ g b ) 2 elektron dari H 2. Karena dua elektron yang bisa dibedakan, itu tidak membuat perbedaan yang elektron terionisasi dalam pembentukan H 2 + : H 2 (σ g b ) 2 + hv H 2 + (σ g b ) 1 +e - Perhatikan bahwa (σ g b ) 2 elektron H 2 lebih stabil daripada elektron Is 1 pada H oleh 15,45-13,60 = 1,85 ev, yang dalam perjanjian dengan prediksi Gambar 4-8. Puncak tajam tindih pada pita pada Gambar 4-2(b) adalah penyebab dari gerak getaran dari inti relatif satu sama lain. Terjadinya dikarenakan "struktur halus" dapat dipahami dengan cara yang sama seperti yang dibahas pada H 2 H 2 * transisi elektronik ( Gambar 4-18 dan 4-19). Pada kenyataanya, ionisasi hanya tipe khusus transisi elektronik di mana elektron sudah benar-benar dikeluarkan dari molekul daripada dipromosikan ke tingkat lebih tinggi. Gambar 4-22 mengilustrasikan kurva energi potensial relatif H 2 ke H 2 +. Seperti telah dibahas sebelumnya, beberapa vibrasi
13 Gambar Energy kurva untuk H2 dan H2+. Pada kedalaman setiap kurva menyesuaikan terhadap energy pemisahan ikatan untuk sebuah jenis. Energy berbeda antara minimal dari setiap kurva yang sesuai untuk IE pada H 2 (15,45 ev). Garis lurus dala rentang H 2 +. Energy ikat untuk H 2 (4,48 ev = 103 kkal. Mol -1 ) dan H 2 + (2,65 ev = 61 kkal. Mol -1 ) juga dapat digambarkan. Di adapsikan dari W.C. Price, Endeavour 26: 75 (1967).
Spektrofotometer UV /VIS
 Spektrofotometer UV /VIS Spektrofotometer adalah alat untuk mengukur transmitan atau absorban suatu sampel sebagai fungsi panjang gelombang. Spektrofotometer merupakan gabungan dari alat optic dan elektronika
Spektrofotometer UV /VIS Spektrofotometer adalah alat untuk mengukur transmitan atau absorban suatu sampel sebagai fungsi panjang gelombang. Spektrofotometer merupakan gabungan dari alat optic dan elektronika
I. KONSEP DASAR SPEKTROSKOPI
 I. KONSEP DASAR SPEKTROSKOPI Pendahuluan Spektroskopi adalah studi mengenai antaraksi cahaya dengan atom dan molekul. Radiasi cahaya atau elektromagnet dapat dianggap menyerupai gelombang. Beberapa sifat
I. KONSEP DASAR SPEKTROSKOPI Pendahuluan Spektroskopi adalah studi mengenai antaraksi cahaya dengan atom dan molekul. Radiasi cahaya atau elektromagnet dapat dianggap menyerupai gelombang. Beberapa sifat
HAND OUT FISIKA KUANTUM MEKANISME TRANSISI DAN KAIDAH SELEKSI
 HAND OUT FISIKA KUANTUM MEKANISME TRANSISI DAN KAIDAH SELEKSI Disusun untuk memenuhi tugas mata kuliah Fisika Kuantum Dosen Pengampu: Drs. Ngurah Made Darma Putra, M.Si., PhD Disusun oleh kelompok 8:.
HAND OUT FISIKA KUANTUM MEKANISME TRANSISI DAN KAIDAH SELEKSI Disusun untuk memenuhi tugas mata kuliah Fisika Kuantum Dosen Pengampu: Drs. Ngurah Made Darma Putra, M.Si., PhD Disusun oleh kelompok 8:.
ANALISIS SPEKTROSKOPI UV-VIS. PENENTUAN KONSENTRASI PERMANGANAT (KMnO 4 )
 ANALISIS SPEKTROSKOPI UV-VIS PENENTUAN KONSENTRASI PERMANGANAT (KMnO 4 ) Kusnanto Mukti W, M 0209031 Jurusan Fisika, FMIPA Universitas Sebelas Maret Surakarta kusnantomukti@yahoo.com ABSTRAK Telah dilakukan
ANALISIS SPEKTROSKOPI UV-VIS PENENTUAN KONSENTRASI PERMANGANAT (KMnO 4 ) Kusnanto Mukti W, M 0209031 Jurusan Fisika, FMIPA Universitas Sebelas Maret Surakarta kusnantomukti@yahoo.com ABSTRAK Telah dilakukan
Fisika Modern (Teori Atom)
 Fisika Modern (Teori Atom) 13:05:05 Sifat-Sifat Atom Atom stabil adalah atom yang memiliki muatan listrik netral. Atom memiliki sifat kimia yang memungkinkan terjadinya ikatan antar atom. Atom memancarkan
Fisika Modern (Teori Atom) 13:05:05 Sifat-Sifat Atom Atom stabil adalah atom yang memiliki muatan listrik netral. Atom memiliki sifat kimia yang memungkinkan terjadinya ikatan antar atom. Atom memancarkan
CATATAN KULIAH PENGANTAR SPEKSTOSKOPI. Diah Ayu Suci Kinasih Departemen Fisika Universitas Diponegoro Semarang 2016
 CATATAN KULIAH PENGANTAR SPEKSTOSKOPI Diah Ayu Suci Kinasih -24040115130099- Departemen Fisika Universitas Diponegoro Semarang 2016 PENGANTAR SPEKTROSKOPI Pengertian Berdasarkan teori klasik spektoskopi
CATATAN KULIAH PENGANTAR SPEKSTOSKOPI Diah Ayu Suci Kinasih -24040115130099- Departemen Fisika Universitas Diponegoro Semarang 2016 PENGANTAR SPEKTROSKOPI Pengertian Berdasarkan teori klasik spektoskopi
PELURUHAN GAMMA ( ) dengan memancarkan foton (gelombang elektromagnetik) yang dikenal dengan sinar gamma ( ).
 PELURUHAN GAMMA ( ) Peluruhan inti yang memancarkan sebuah partikel seperti partikel alfa atau beta, selalu meninggalkan inti pada keadaan tereksitasi. Seperti halnya atom, inti akan mencapai keadaan dasar
PELURUHAN GAMMA ( ) Peluruhan inti yang memancarkan sebuah partikel seperti partikel alfa atau beta, selalu meninggalkan inti pada keadaan tereksitasi. Seperti halnya atom, inti akan mencapai keadaan dasar
BAB I PENDAHULUAN Latar Belakang
 BAB I PENDAHULUAN Latar Belakang Dengan semakin kompleksisitas berbagai keperluan saat ini, analisis kimia dengan mempergunakan metoda fisik dalam hal identifikasi dari berbagai selektifitas fungsi polimer
BAB I PENDAHULUAN Latar Belakang Dengan semakin kompleksisitas berbagai keperluan saat ini, analisis kimia dengan mempergunakan metoda fisik dalam hal identifikasi dari berbagai selektifitas fungsi polimer
MATERI II TINGKAT TENAGA DAN PITA TENAGA
 MATERI II TINGKAT TENAGA DAN PITA TENAGA A. Tujuan 1. Tujuan Umum Mahasiswa memahami konsep tingkat tenaga dan pita tenaga untuk menerangkan perbedaan daya hantar listrik.. Tujuan Khusus a. Mahasiswa dapat
MATERI II TINGKAT TENAGA DAN PITA TENAGA A. Tujuan 1. Tujuan Umum Mahasiswa memahami konsep tingkat tenaga dan pita tenaga untuk menerangkan perbedaan daya hantar listrik.. Tujuan Khusus a. Mahasiswa dapat
ENERGI & PROSES FISIOLOGI TUMBUHAN
 ENERGI & PROSES FISIOLOGI TUMBUHAN Contoh: Bahan bakar minyak digunakan sebagai sumber energi untuk kendaraan bermotor. Proses Pertumbuhan Tanaman : Merupakan kumpulan dari berbagai aktivitas mulai dari
ENERGI & PROSES FISIOLOGI TUMBUHAN Contoh: Bahan bakar minyak digunakan sebagai sumber energi untuk kendaraan bermotor. Proses Pertumbuhan Tanaman : Merupakan kumpulan dari berbagai aktivitas mulai dari
ENERGI & PROSES FISIOLOGI TUMBUHAN
 ENERGI & PROSES FISIOLOGI TUMBUHAN ENERGI & PROSES FISIOLOGI TUMBUHAN Contoh: Bahan bakar minyak digunakan sebagai sumber energi untuk kendaraan bermotor. Proses Pertumbuhan Tanaman : Merupakan kumpulan
ENERGI & PROSES FISIOLOGI TUMBUHAN ENERGI & PROSES FISIOLOGI TUMBUHAN Contoh: Bahan bakar minyak digunakan sebagai sumber energi untuk kendaraan bermotor. Proses Pertumbuhan Tanaman : Merupakan kumpulan
MAKALAH Spektrofotometer
 MAKALAH Spektrofotometer Nama Kelompok : Adhitiya Oprasena 201430100 Zulfikar Adli Manzila 201430100 Henky Gustian 201430100 Riyan Andre.P 201430100 Muhammad Khairul Huda 20143010029 Kelas : A Jurusan
MAKALAH Spektrofotometer Nama Kelompok : Adhitiya Oprasena 201430100 Zulfikar Adli Manzila 201430100 Henky Gustian 201430100 Riyan Andre.P 201430100 Muhammad Khairul Huda 20143010029 Kelas : A Jurusan
Getaran Dalam Zat Padat BAB I PENDAHULUAN
 BAB I PENDAHULUAN 1.1 Pendahuluan Getaran atom dalam zat padat dapat disebabkan oleh gelombang yang merambat pada Kristal. Ditinjau dari panjang gelombang yang digelombang yang digunakan dan dibandingkan
BAB I PENDAHULUAN 1.1 Pendahuluan Getaran atom dalam zat padat dapat disebabkan oleh gelombang yang merambat pada Kristal. Ditinjau dari panjang gelombang yang digelombang yang digunakan dan dibandingkan
PENENTUAN RUMUS ION KOMPLEKS BESI DENGAN ASAM SALISILAT
 PENENTUAN RUMUS ION KOMPLEKS BESI DENGAN ASAM SALISILAT Desi Eka Martuti, Suci Amalsari, Siti Nurul Handini., Nurul Aini Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Jenderal
PENENTUAN RUMUS ION KOMPLEKS BESI DENGAN ASAM SALISILAT Desi Eka Martuti, Suci Amalsari, Siti Nurul Handini., Nurul Aini Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Jenderal
SPEKTROFOTOMETRI SERAPAN UV-VIS
 SPEKTROFOTOMETRI SERAPAN UV-VIS SPEKTROFOTOMETRI SERAPAN UV-VIS PRINSIP DASAR HUKUM BEER INSTRUMENTASI APLIKASI 1 Pengantar Istilah-Istilah: 1. Spektroskopi : Ilmu yang mempelajari interaksi materi dengan
SPEKTROFOTOMETRI SERAPAN UV-VIS SPEKTROFOTOMETRI SERAPAN UV-VIS PRINSIP DASAR HUKUM BEER INSTRUMENTASI APLIKASI 1 Pengantar Istilah-Istilah: 1. Spektroskopi : Ilmu yang mempelajari interaksi materi dengan
PENDAHULUAN RADIOAKTIVITAS TUJUAN
 PENDAHULUAN RADIOAKTIVITAS TUJUAN Maksud dan tujuan kuliah ini adalah memberikan dasar-dasar dari fenomena radiaktivitas serta sumber radioaktif Diharapkan agar dengan pengetahuan dasar ini kita akan mempunyai
PENDAHULUAN RADIOAKTIVITAS TUJUAN Maksud dan tujuan kuliah ini adalah memberikan dasar-dasar dari fenomena radiaktivitas serta sumber radioaktif Diharapkan agar dengan pengetahuan dasar ini kita akan mempunyai
FISIKA. Sesi TEORI ATOM A. TEORI ATOM DALTON B. TEORI ATOM THOMSON
 FISIKA KELAS XII IPA - KURIKULUM GABUNGAN 11 Sesi NGAN TEORI ATOM A. TEORI ATOM DALTON 1. Atom adalah bagian terkecil suatu unsur yang tidak dapat dibagi lagi.. Atom suatu unsur serupa semuanya, dan tak
FISIKA KELAS XII IPA - KURIKULUM GABUNGAN 11 Sesi NGAN TEORI ATOM A. TEORI ATOM DALTON 1. Atom adalah bagian terkecil suatu unsur yang tidak dapat dibagi lagi.. Atom suatu unsur serupa semuanya, dan tak
VII. PELURUHAN GAMMA. Sub-pokok Bahasan Meliputi: Peluruhan Gamma Absorbsi Sinar Gamma Interaksi Sinar Gamma dengan Materi
 VII. PELURUHAN GAMMA Sub-pokok Bahasan Meliputi: Peluruhan Gamma Absorbsi Sinar Gamma Interaksi Sinar Gamma dengan Materi 7.1. PELURUHAN GAMMA TUJUAN INSTRUKSIONAL KHUSUS: Setelah mempelajari Sub-pokok
VII. PELURUHAN GAMMA Sub-pokok Bahasan Meliputi: Peluruhan Gamma Absorbsi Sinar Gamma Interaksi Sinar Gamma dengan Materi 7.1. PELURUHAN GAMMA TUJUAN INSTRUKSIONAL KHUSUS: Setelah mempelajari Sub-pokok
BAGIAN 1 PITA ENERGI DALAM ZAT PADAT
 1.1. Partikel bermuatan BAGIAN 1 PITA ENERGI DALAM ZAT PADAT - Muatan elektron : -1,6 x 10-19 C - Massa elektron : 9,11 x 10-31 kg - Jumlah elektron dalam setiap Coulomb sekitar 6 x 10 18 buah (resiprokal
1.1. Partikel bermuatan BAGIAN 1 PITA ENERGI DALAM ZAT PADAT - Muatan elektron : -1,6 x 10-19 C - Massa elektron : 9,11 x 10-31 kg - Jumlah elektron dalam setiap Coulomb sekitar 6 x 10 18 buah (resiprokal
BAB II TINJAUAN PUSTAKA
 BAB II TINJAUAN PUSTAKA 2.1 Uraian Bahan 2.1.1 Parasetamol Menurut Ditjen BKAK (2014), uraian mengenai parasetamol adalah sebagai berikut: Rumus struktur : Gambar 2.1 Rumus Struktur Parasetamol Nama Kimia
BAB II TINJAUAN PUSTAKA 2.1 Uraian Bahan 2.1.1 Parasetamol Menurut Ditjen BKAK (2014), uraian mengenai parasetamol adalah sebagai berikut: Rumus struktur : Gambar 2.1 Rumus Struktur Parasetamol Nama Kimia
KIMIA ANALISIS ORGANIK (2 SKS)
 KIMIA ANALISIS ORGANIK (2 SKS) 1.PENDAHULUAN 2.KONSEP DASAR SPEKTROSKOPI 3.SPEKTROSKOPI UV-VIS 4.SPEKTROSKOPI IR 5.SPEKTROSKOPI 1 H-NMR 6.SPEKTROSKOPI 13 C-NMR 7.SPEKTROSKOPI MS 8.ELUSIDASI STRUKTUR Teknik
KIMIA ANALISIS ORGANIK (2 SKS) 1.PENDAHULUAN 2.KONSEP DASAR SPEKTROSKOPI 3.SPEKTROSKOPI UV-VIS 4.SPEKTROSKOPI IR 5.SPEKTROSKOPI 1 H-NMR 6.SPEKTROSKOPI 13 C-NMR 7.SPEKTROSKOPI MS 8.ELUSIDASI STRUKTUR Teknik
Fungsi distribusi spektrum P (λ,t) dapat dihitung dari termodinamika klasik secara langsung, dan hasilnya dapat dibandingkan dengan Gambar 1.
 Fungsi distribusi spektrum P (λ,t) dapat dihitung dari termodinamika klasik secara langsung, dan hasilnya dapat dibandingkan dengan Gambar 1. Hasil perhitungan klasik ini dikenal sebagai Hukum Rayleigh-
Fungsi distribusi spektrum P (λ,t) dapat dihitung dari termodinamika klasik secara langsung, dan hasilnya dapat dibandingkan dengan Gambar 1. Hasil perhitungan klasik ini dikenal sebagai Hukum Rayleigh-
BAB IV OSILATOR HARMONIS
 Tinjauan Secara Mekanika Klasik BAB IV OSILATOR HARMONIS Osilator harmonis terjadi manakala sebuah partikel ditarik oleh gaya yang besarnya sebanding dengan perpindahan posisi partikel tersebut. F () =
Tinjauan Secara Mekanika Klasik BAB IV OSILATOR HARMONIS Osilator harmonis terjadi manakala sebuah partikel ditarik oleh gaya yang besarnya sebanding dengan perpindahan posisi partikel tersebut. F () =
BAB II TINJAUAN PUSTAKA. Dalam buku British pharmacopoeia (The Departemen of Health, 2006) dan
 BAB II TINJAUAN PUSTAKA 2.1 Domperidone Dalam buku British pharmacopoeia (The Departemen of Health, 2006) dan buku Martindale (Sweetman, 2009) sediaan tablet domperidone merupakan sediaan yang mengandung
BAB II TINJAUAN PUSTAKA 2.1 Domperidone Dalam buku British pharmacopoeia (The Departemen of Health, 2006) dan buku Martindale (Sweetman, 2009) sediaan tablet domperidone merupakan sediaan yang mengandung
LAPORAN PRAKTIKUM INSTRUMENT INDUSTRI PERALATAN ANALISIS (SPEKTROFOTOMETER)
 LAPORAN PRAKTIKUM INSTRUMENT INDUSTRI PERALATAN ANALISIS (SPEKTROFOTOMETER) I. PENDAHULUAN a. Latar Belakang Spektrofotometer sangat berhubungan dengan pengukuran jauhnya pengabsorbansian energi cahaya
LAPORAN PRAKTIKUM INSTRUMENT INDUSTRI PERALATAN ANALISIS (SPEKTROFOTOMETER) I. PENDAHULUAN a. Latar Belakang Spektrofotometer sangat berhubungan dengan pengukuran jauhnya pengabsorbansian energi cahaya
SPEKTROSKOPI INFRA RED & SERAPAN ATOM
 SPEKTROSKOPI INFRA RED & SERAPAN ATOM SPEKTROSKOPI INFRA RED Daerah radiasi IR: 1. IR dekat: 0,78 2,5 µm 2. IR tengah: 2,5 50 µm 3. IR jauh: 50 1000 µm Daerah radiasi spektroskopi IR: 0,78 1000 µm Penggunaan
SPEKTROSKOPI INFRA RED & SERAPAN ATOM SPEKTROSKOPI INFRA RED Daerah radiasi IR: 1. IR dekat: 0,78 2,5 µm 2. IR tengah: 2,5 50 µm 3. IR jauh: 50 1000 µm Daerah radiasi spektroskopi IR: 0,78 1000 µm Penggunaan
Berdasarkan interaksi yang terjadi, dikembangkan teknik-teknik analisis kimia yang memanfaatkan sifat dari interaksi.
 TEKNIK SPEKTROSKOPI Teknik Spektrokopi adalah suatu teknik fisiko-kimia yang mengamati tentang interaksi atom maupun molekul dengan radiasi elektromagnetik (REM) Hasil interaksi tersebut bisa menimbulkan
TEKNIK SPEKTROSKOPI Teknik Spektrokopi adalah suatu teknik fisiko-kimia yang mengamati tentang interaksi atom maupun molekul dengan radiasi elektromagnetik (REM) Hasil interaksi tersebut bisa menimbulkan
Xpedia Fisika. Soal Fismod 1
 Xpedia Fisika Soal Fismod 1 Doc. Name: XPPHY0501 Version: 2013-04 halaman 1 01. Pertanyaan 01-02 : Sebuah botol tertutup berisi 100 gram iodin radioaktif. Setelah 24 hari, botol itu berisi 12,5 gram iodin
Xpedia Fisika Soal Fismod 1 Doc. Name: XPPHY0501 Version: 2013-04 halaman 1 01. Pertanyaan 01-02 : Sebuah botol tertutup berisi 100 gram iodin radioaktif. Setelah 24 hari, botol itu berisi 12,5 gram iodin
LATIHAN UJIAN NASIONAL
 LATIHAN UJIAN NASIONAL 1. Seorang siswa menghitung luas suatu lempengan logam kecil berbentuk persegi panjang. Siswa tersebut menggunakan mistar untuk mengukur panjang lempengan dan menggunakan jangka
LATIHAN UJIAN NASIONAL 1. Seorang siswa menghitung luas suatu lempengan logam kecil berbentuk persegi panjang. Siswa tersebut menggunakan mistar untuk mengukur panjang lempengan dan menggunakan jangka
LAPORAN PRAKTIKUM REKAYASA PROSES PEMBUATAN KURVA STANDAR DARI LARUTAN - KAROTEN HAIRUNNISA E1F109041
 LAPORAN PRAKTIKUM REKAYASA PROSES PEMBUATAN KURVA STANDAR DARI LARUTAN - KAROTEN HAIRUNNISA E1F109041 PROGRAM STUDI TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS PERTANIAN UNIVERSITAS LAMBUNG MANGKURAT BANJARBARU
LAPORAN PRAKTIKUM REKAYASA PROSES PEMBUATAN KURVA STANDAR DARI LARUTAN - KAROTEN HAIRUNNISA E1F109041 PROGRAM STUDI TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS PERTANIAN UNIVERSITAS LAMBUNG MANGKURAT BANJARBARU
Penentuan struktur senyawa organik
 Penentuan struktur senyawa organik Tujuan Umum: memahami metoda penentuan struktur senyawa organik moderen, yaitu dengan metoda spektroskopi Tujuan Umum: mampu membaca dan menginterpretasikan data spektrum
Penentuan struktur senyawa organik Tujuan Umum: memahami metoda penentuan struktur senyawa organik moderen, yaitu dengan metoda spektroskopi Tujuan Umum: mampu membaca dan menginterpretasikan data spektrum
LAPORAN PRAKTIKUM KIMIA ANORGANIK II PERCOBAAN IV PENENTUAN KOMPOSISI ION KOMPLEKS
 LAPORAN PRAKTIKUM KIMIA ANORGANIK II PERCOBAAN IV PENENTUAN KOMPOSISI ION KOMPLEKS DISUSUN OLEH : NAMA : FEBRINA SULISTYORINI NIM : 09/281447/PA/12402 KELOMPOK : 3 (TIGA) JURUSAN : KIMIA FAKULTAS/PRODI
LAPORAN PRAKTIKUM KIMIA ANORGANIK II PERCOBAAN IV PENENTUAN KOMPOSISI ION KOMPLEKS DISUSUN OLEH : NAMA : FEBRINA SULISTYORINI NIM : 09/281447/PA/12402 KELOMPOK : 3 (TIGA) JURUSAN : KIMIA FAKULTAS/PRODI
SPEKTROSKOPI INFRA MERAH (IR)
 SPEKTROSKOPI INFRA MERAH (IR) Spektrum Elektromagnetik tinggi tinggi Frekuensi (ν) Energi rendah rendah X-RAY ULTRAVIOLET INFRARED MICRO- WAVE RADIO FREQUENCY Ultraviolet Visible Vibrasi Infrared Resonansi
SPEKTROSKOPI INFRA MERAH (IR) Spektrum Elektromagnetik tinggi tinggi Frekuensi (ν) Energi rendah rendah X-RAY ULTRAVIOLET INFRARED MICRO- WAVE RADIO FREQUENCY Ultraviolet Visible Vibrasi Infrared Resonansi
MODUL 05 SPEKTRUM ATOM
 MODUL 05 SPEKTRUM ATOM dari DUA ELEKTRON : He, Hg Indah Darapuspa, Rizky Budiman,Tisa I Ariani, Taffy Ukhtia P, Dimas M Nur 10211008, 10211004, 1021354, 10213074, 10213089 Program Studi Fisika, Institut
MODUL 05 SPEKTRUM ATOM dari DUA ELEKTRON : He, Hg Indah Darapuspa, Rizky Budiman,Tisa I Ariani, Taffy Ukhtia P, Dimas M Nur 10211008, 10211004, 1021354, 10213074, 10213089 Program Studi Fisika, Institut
CHAPTER I RADIASI BENDA HITAM
 CHAPTER I RADIASI BENDA HITAM - Perpindahan panas matahari kebumi disebut salah satu contoh peristiwa radiasi - Setiap benda memancarkan radiasi panas - Pada suhu 1 K benda mulai berpijar kemerahan seperti
CHAPTER I RADIASI BENDA HITAM - Perpindahan panas matahari kebumi disebut salah satu contoh peristiwa radiasi - Setiap benda memancarkan radiasi panas - Pada suhu 1 K benda mulai berpijar kemerahan seperti
Spektrofotometer UV-Vis
 Spektrofotometer UV-Vis Spektrofotometri UV-Vis adalah anggota teknik analisis spektroskopik yang memakai sumber REM (radiasi elektromagnetik) ultraviolet dekat (190-380 nm) dan sinar tampak (380-780 nm)
Spektrofotometer UV-Vis Spektrofotometri UV-Vis adalah anggota teknik analisis spektroskopik yang memakai sumber REM (radiasi elektromagnetik) ultraviolet dekat (190-380 nm) dan sinar tampak (380-780 nm)
BAB FISIKA ATOM. Model ini gagal karena tidak sesuai dengan hasil percobaan hamburan patikel oleh Rutherford.
 1 BAB FISIKA ATOM Perkembangan teori atom Model Atom Dalton 1. Atom adalah bagian terkecil dari suatu unsur yang tidak dapat dibagi-bagi 2. Atom-atom suatu unsur semuanya serupa dan tidak dapat berubah
1 BAB FISIKA ATOM Perkembangan teori atom Model Atom Dalton 1. Atom adalah bagian terkecil dari suatu unsur yang tidak dapat dibagi-bagi 2. Atom-atom suatu unsur semuanya serupa dan tidak dapat berubah
Prof.Dr.Ir.Krishna Purnawan Candra, M.S. Jurusan Teknologi Hasil Pertanian FAPERTA UNMUL
 Prof.Dr.Ir.Krishna Purnawan Candra, M.S. Jurusan Teknologi Hasil Pertanian FAPERTA UNMUL Abstrak Spektrofotometri: pengukuran dengan menggunakan prinsip spektroskopi / cahaya Cahaya terdiri dari banyak
Prof.Dr.Ir.Krishna Purnawan Candra, M.S. Jurusan Teknologi Hasil Pertanian FAPERTA UNMUL Abstrak Spektrofotometri: pengukuran dengan menggunakan prinsip spektroskopi / cahaya Cahaya terdiri dari banyak
Simetri Molekul, Dasar-dasar Spektroskopi, dan Mekanika Kuantum
 Modul 1 Simetri Molekul, Dasar-dasar Spektroskopi, dan Mekanika Kuantum Drs. Ida Bagus Suryadharma, M.S. D PENDAHULUAN ari judulnya tampak bahwa Modul 1 terdiri dari 3 hal, yaitu simetri molekul, dasar-dasar
Modul 1 Simetri Molekul, Dasar-dasar Spektroskopi, dan Mekanika Kuantum Drs. Ida Bagus Suryadharma, M.S. D PENDAHULUAN ari judulnya tampak bahwa Modul 1 terdiri dari 3 hal, yaitu simetri molekul, dasar-dasar
D. I, U, X E. X, I, U. D. 5,59 x J E. 6,21 x J
 1. Bila sinar ultra ungu, sinar inframerah, dan sinar X berturut-turut ditandai dengan U, I, dan X, maka urutan yang menunjukkan paket (kuantum) energi makin besar ialah : A. U, I, X B. U, X, I C. I, X,
1. Bila sinar ultra ungu, sinar inframerah, dan sinar X berturut-turut ditandai dengan U, I, dan X, maka urutan yang menunjukkan paket (kuantum) energi makin besar ialah : A. U, I, X B. U, X, I C. I, X,
1. Hasil pengukuran yang ditunjukkan oleh alat ukur dibawah ini adalah.
 1. Hasil pengukuran yang ditunjukkan oleh alat ukur dibawah ini adalah. 1 A. 5, 22 mm B. 5, 72 mm C. 6, 22 mm D. 6, 70 mm E. 6,72 mm 5 25 20 2. Dua buah vektor masing-masing 5 N dan 12 N. Resultan kedua
1. Hasil pengukuran yang ditunjukkan oleh alat ukur dibawah ini adalah. 1 A. 5, 22 mm B. 5, 72 mm C. 6, 22 mm D. 6, 70 mm E. 6,72 mm 5 25 20 2. Dua buah vektor masing-masing 5 N dan 12 N. Resultan kedua
PERKEMBANGAN TEORI ATOM
 DEMOKRITUS PERKEMBANGAN TEORI ATOM DALTON THOMSON RUTHERFORD BOHR MEKANIKA KUANTUM + + GAMBAR GAMBAR GAMBAR GAMBAR GAMBAR CATATAN : CATATAN : CATATAN : CATATAN : CATATAN : 1 PENEMUAN DERET BALMER Peralatan
DEMOKRITUS PERKEMBANGAN TEORI ATOM DALTON THOMSON RUTHERFORD BOHR MEKANIKA KUANTUM + + GAMBAR GAMBAR GAMBAR GAMBAR GAMBAR CATATAN : CATATAN : CATATAN : CATATAN : CATATAN : 1 PENEMUAN DERET BALMER Peralatan
ATOM BERELEKTRON BANYAK
 ATOM BERELEKTRON BANYAK A. MODEL ATOM BOHR * Keunggulan Dapat menjelaskan adanya : 1. Kestabilan atom. Spektrum garis pada atom hidrogen (deret Lyman, Balmer, Paschen, Brackett, Pfund) * Kelemahan Tidak
ATOM BERELEKTRON BANYAK A. MODEL ATOM BOHR * Keunggulan Dapat menjelaskan adanya : 1. Kestabilan atom. Spektrum garis pada atom hidrogen (deret Lyman, Balmer, Paschen, Brackett, Pfund) * Kelemahan Tidak
ACARA IV PERCOBAAN DASAR ALAT SPEKTROFOTOMETER SERAPAN ATOM
 ACARA IV PERCOBAAN DASAR ALAT SPEKTROFOTOMETER SERAPAN ATOM A. PELAKSANAAN PRAKTIKUM 1. Tujuan Praktikum a. Percobaan dasar spektrofotometri serapan atom. b. Penentuan konsentrasi sampel dengan alat spektrofotometri
ACARA IV PERCOBAAN DASAR ALAT SPEKTROFOTOMETER SERAPAN ATOM A. PELAKSANAAN PRAKTIKUM 1. Tujuan Praktikum a. Percobaan dasar spektrofotometri serapan atom. b. Penentuan konsentrasi sampel dengan alat spektrofotometri
FISIKA IPA SMA/MA 1 D Suatu pipa diukur diameter dalamnya menggunakan jangka sorong diperlihatkan pada gambar di bawah.
 1 D49 1. Suatu pipa diukur diameter dalamnya menggunakan jangka sorong diperlihatkan pada gambar di bawah. Hasil pengukuran adalah. A. 4,18 cm B. 4,13 cm C. 3,88 cm D. 3,81 cm E. 3,78 cm 2. Ayu melakukan
1 D49 1. Suatu pipa diukur diameter dalamnya menggunakan jangka sorong diperlihatkan pada gambar di bawah. Hasil pengukuran adalah. A. 4,18 cm B. 4,13 cm C. 3,88 cm D. 3,81 cm E. 3,78 cm 2. Ayu melakukan
BAB FISIKA ATOM. a) Tetes minyak diam di antara pasangan keping sejajar karena berat minyak mg seimbang dengan gaya listrik qe.
 BAB FISIKA ATOM Contoh 9. Hitungan mengenai percobaan Milikan. Sebuah tetes minyak yang beratnya,9-4 N diam di antara pasangan keping sejajar yang kuat medan listriknya 4, 4 N/C. a) Berapa besar muatan
BAB FISIKA ATOM Contoh 9. Hitungan mengenai percobaan Milikan. Sebuah tetes minyak yang beratnya,9-4 N diam di antara pasangan keping sejajar yang kuat medan listriknya 4, 4 N/C. a) Berapa besar muatan
BAB II TINJAUAN PUSTAKA. unsur-unsur kimia secara terus menerus terhadap lingkungan di sekelilingnya di
 BAB II TINJAUAN PUSTAKA 2.1. Besi (Fe) dalam Air Tanah Aliran air tanah merupakan perantara goelogi yang memberikan pengaruh unsur-unsur kimia secara terus menerus terhadap lingkungan di sekelilingnya
BAB II TINJAUAN PUSTAKA 2.1. Besi (Fe) dalam Air Tanah Aliran air tanah merupakan perantara goelogi yang memberikan pengaruh unsur-unsur kimia secara terus menerus terhadap lingkungan di sekelilingnya
Struktur Molekul:Teori Orbital Molekul
 Kimia Fisik III, Struktur Molekul:, Dr. Parsaoran Siahaan, November/Desember 2014, 1 Pokok Bahasan 3 Struktur Molekul:Teori Orbital Molekul Oleh: Dr. Parsaoran Siahaan Pendahuluan: motivasi/review pokok
Kimia Fisik III, Struktur Molekul:, Dr. Parsaoran Siahaan, November/Desember 2014, 1 Pokok Bahasan 3 Struktur Molekul:Teori Orbital Molekul Oleh: Dr. Parsaoran Siahaan Pendahuluan: motivasi/review pokok
BAB I Jenis Radiasi dan Interaksinya dengan Materi
 BAB I Jenis Radiasi dan Interaksinya dengan Materi Radiasi adalah pancaran energi yang berasal dari proses transformasi atom atau inti atom yang tidak stabil. Ketidak-stabilan atom dan inti atom mungkin
BAB I Jenis Radiasi dan Interaksinya dengan Materi Radiasi adalah pancaran energi yang berasal dari proses transformasi atom atau inti atom yang tidak stabil. Ketidak-stabilan atom dan inti atom mungkin
: Dr. Budi Mulyanti, MSi. Pertemuan ke-15 CAKUPAN MATERI
 MATA KULIAH KODE MK Dosen : FISIKA DASAR II : EL-122 : Dr. Budi Mulyanti, MSi Pertemuan ke-15 CAKUPAN MATERI 1. EKSITASI ATOMIK 2. SPEKTRUM EMISI HIDROGEN 3. DERET SPEKTRUM HIDROGEN 4. TINGKAT ENERGI DAN
MATA KULIAH KODE MK Dosen : FISIKA DASAR II : EL-122 : Dr. Budi Mulyanti, MSi Pertemuan ke-15 CAKUPAN MATERI 1. EKSITASI ATOMIK 2. SPEKTRUM EMISI HIDROGEN 3. DERET SPEKTRUM HIDROGEN 4. TINGKAT ENERGI DAN
PENENTUAN STRUKTUR MENGGUNAKAN SPEKTROFOTOMETER UV- VIS
 PENENTUAN STRUKTUR MENGGUNAKAN SPEKTROFOTOMETER UV- VIS Anggota Kelompok : Azizah Puspitasari 4301412042 Rouf Khoironi 4301412050 Nur Fatimah 4301412057 Singgih Ade Triawan 4301412079 PENGERTIAN DAN PRINSIP
PENENTUAN STRUKTUR MENGGUNAKAN SPEKTROFOTOMETER UV- VIS Anggota Kelompok : Azizah Puspitasari 4301412042 Rouf Khoironi 4301412050 Nur Fatimah 4301412057 Singgih Ade Triawan 4301412079 PENGERTIAN DAN PRINSIP
JURNAL PRAKTIKUM ANALITIK III SPEKTROSKOPI UV-VIS
 JURNAL PRAKTIKUM ANALITIK III SPEKTROSKOPI UV-VIS Disusun Oleh : RENI ALFIYANI (14030194086 ) PENDIDIKAN KIMIA A 2014 JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI SURABAYA
JURNAL PRAKTIKUM ANALITIK III SPEKTROSKOPI UV-VIS Disusun Oleh : RENI ALFIYANI (14030194086 ) PENDIDIKAN KIMIA A 2014 JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI SURABAYA
Fisika EBTANAS Tahun 1997
 Fisika EBTANAS Tahun 997 EBTANAS-97-0 Perhatikan gambar percobaan vektor gaya resultan r r r R = F + F dengan menggunakan neraca pegas berikut ini () () () α α α Yang sesuai dengan rumus vektor gaya resultan
Fisika EBTANAS Tahun 997 EBTANAS-97-0 Perhatikan gambar percobaan vektor gaya resultan r r r R = F + F dengan menggunakan neraca pegas berikut ini () () () α α α Yang sesuai dengan rumus vektor gaya resultan
BAB 2 TINJAUAN PUSTAKA
 BAB 2 TINJAUAN PUSTAKA 2.1 Potensial Coulomb untuk Partikel yang Bergerak Dalam bab ini, akan dikemukakan teori-teori yang mendukung penyelesaian pembahasan pengaruh koreksi relativistik potensial Coulomb
BAB 2 TINJAUAN PUSTAKA 2.1 Potensial Coulomb untuk Partikel yang Bergerak Dalam bab ini, akan dikemukakan teori-teori yang mendukung penyelesaian pembahasan pengaruh koreksi relativistik potensial Coulomb
Beberapa definisi berkaitan dengan spektrofotometri. Spektroskopi (spectroscopy) : ilmu yang mempelajari interaksi antara bahan dengan
 Dr.Krishna P Candra Jurusan Teknologi Hasil Pertanian FAPERTA UNMUL Beberapa definisi berkaitan dengan spektrofotometri Spektroskopi (spectroscopy) : ilmu yang mempelajari interaksi antara bahan dengan
Dr.Krishna P Candra Jurusan Teknologi Hasil Pertanian FAPERTA UNMUL Beberapa definisi berkaitan dengan spektrofotometri Spektroskopi (spectroscopy) : ilmu yang mempelajari interaksi antara bahan dengan
Antiremed Kelas 12 Fisika
 Antiremed Kelas 12 Fisika Fisika Kuantum - Latihan Soal Doc. Name: AR12FIS0799 Version: 2012-09 halaman 1 01. Daya radiasi benda hitam pada suhu T 1 besarnya 4 kali daya radiasi pada suhu To, maka T 1
Antiremed Kelas 12 Fisika Fisika Kuantum - Latihan Soal Doc. Name: AR12FIS0799 Version: 2012-09 halaman 1 01. Daya radiasi benda hitam pada suhu T 1 besarnya 4 kali daya radiasi pada suhu To, maka T 1
4 Hasil dan Pembahasan
 4 Hasil dan Pembahasan 4.1 Sintesis Padatan TiO 2 Amorf Proses sintesis padatan TiO 2 amorf ini dimulai dengan melarutkan titanium isopropoksida (TTIP) ke dalam pelarut etanol. Pelarut etanol yang digunakan
4 Hasil dan Pembahasan 4.1 Sintesis Padatan TiO 2 Amorf Proses sintesis padatan TiO 2 amorf ini dimulai dengan melarutkan titanium isopropoksida (TTIP) ke dalam pelarut etanol. Pelarut etanol yang digunakan
Spektroskopi IR Dalam Penentuan Struktur Molekul Organik Posted by ferry
 Spektroskopi IR Dalam Penentuan Struktur Molekul Organik 08.30 Posted by ferry Spektrofotometri inframerah lebih banyak digunakan untuk identifikasi suatu senyawa melalui gugus fungsinya. Untuk keperluan
Spektroskopi IR Dalam Penentuan Struktur Molekul Organik 08.30 Posted by ferry Spektrofotometri inframerah lebih banyak digunakan untuk identifikasi suatu senyawa melalui gugus fungsinya. Untuk keperluan
Laporan Kimia Analitik KI-3121
 Laporan Kimia Analitik KI-3121 PERCOBAAN 5 SPEKTROFOTOMETRI SERAPAN ATOM Nama : Kartika Trianita NIM : 10510007 Kelompok : 1 Tanggal Percobaan : 19 Oktober 2012 Tanggal Laporan : 2 November 2012 Asisten
Laporan Kimia Analitik KI-3121 PERCOBAAN 5 SPEKTROFOTOMETRI SERAPAN ATOM Nama : Kartika Trianita NIM : 10510007 Kelompok : 1 Tanggal Percobaan : 19 Oktober 2012 Tanggal Laporan : 2 November 2012 Asisten
RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 2 JP
 RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 2 JP Standar Kompetensi 1. Memahami struktur atom untuk meramalkan sifat-sifat
RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 2 JP Standar Kompetensi 1. Memahami struktur atom untuk meramalkan sifat-sifat
Hari Gambar 17. Kurva pertumbuhan Spirulina fusiformis
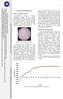 11 HASIL DAN PEMBAHASAN Kultivasi Spirulina fusiformis Pertumbuhan Spirulina fusiformis berlangsung selama 86 hari. Proses pertumbuhan diketahui dengan mengukur nilai kerapatan optik (Optical Density).
11 HASIL DAN PEMBAHASAN Kultivasi Spirulina fusiformis Pertumbuhan Spirulina fusiformis berlangsung selama 86 hari. Proses pertumbuhan diketahui dengan mengukur nilai kerapatan optik (Optical Density).
ORBITAL DAN IKATAN KIMIA ORGANIK
 ORBITAL DAN IKATAN KIMIA ORGANIK Objektif: Pada Bab ini, mahasiswa diharapkan untuk dapat memahami, Teori dasar orbital atom dan ikatan kimia organik, Orbital molekul orbital atom dan Hibridisasi orbital
ORBITAL DAN IKATAN KIMIA ORGANIK Objektif: Pada Bab ini, mahasiswa diharapkan untuk dapat memahami, Teori dasar orbital atom dan ikatan kimia organik, Orbital molekul orbital atom dan Hibridisasi orbital
Latihan Soal UAS Fisika Panas dan Gelombang
 Latihan Soal UAS Fisika Panas dan Gelombang 1. Grafik antara tekanan gas y yang massanya tertentu pada volume tetap sebagai fungsi dari suhu mutlak x adalah... a. d. b. e. c. Menurut Hukum Gay Lussac menyatakan
Latihan Soal UAS Fisika Panas dan Gelombang 1. Grafik antara tekanan gas y yang massanya tertentu pada volume tetap sebagai fungsi dari suhu mutlak x adalah... a. d. b. e. c. Menurut Hukum Gay Lussac menyatakan
Hukum Dasar dalam Spektrofotometri UV-Vis Instrumen Spektrofotometri Uv Vis
 Spektrofotometri UV-Vis adalah salah satu teknik analisis spektroskopik yang memakai sumber REM (radiasi elektromagnetik) UV (190-380 nm) dan sinar tampak (380-780 nm) dengan memakai instrumen spektrofotometer.
Spektrofotometri UV-Vis adalah salah satu teknik analisis spektroskopik yang memakai sumber REM (radiasi elektromagnetik) UV (190-380 nm) dan sinar tampak (380-780 nm) dengan memakai instrumen spektrofotometer.
Oleh : Rahayu Dwi Harnum ( )
 LAPORAN PRAKTIKUM EKSPERIMEN FISIKA II SPEKTRUM ATOM SODIUM Diajukan untuk memenuhi salah satu tugas mata kuliah Eksperimen Fisika II Dosen Pengampu : Drs. Parlindungan Sinaga, M.Si Oleh : Rahayu Dwi Harnum
LAPORAN PRAKTIKUM EKSPERIMEN FISIKA II SPEKTRUM ATOM SODIUM Diajukan untuk memenuhi salah satu tugas mata kuliah Eksperimen Fisika II Dosen Pengampu : Drs. Parlindungan Sinaga, M.Si Oleh : Rahayu Dwi Harnum
FISIKA MODERN UNIT. Radiasi Benda Hitam. Hamburan Compton & Efek Fotolistrik. Kumpulan Soal Latihan UN
 Kumpulan Soal Latihan UN UNIT FISIKA MODERN Radiasi Benda Hitam 1. Suatu benda hitam pada suhu 27 0 C memancarkan energi sekitar 100 J/s. Benda hitam tersebut dipanasi sehingga suhunya menjadi 327 0 C.
Kumpulan Soal Latihan UN UNIT FISIKA MODERN Radiasi Benda Hitam 1. Suatu benda hitam pada suhu 27 0 C memancarkan energi sekitar 100 J/s. Benda hitam tersebut dipanasi sehingga suhunya menjadi 327 0 C.
Latihan Soal UN Fisika SMA. 1. Dimensi energi potensial adalah... A. MLT-1 B. MLT-2 C. ML-1T-2 D. ML2 T-2 E. ML-2T-2
 Latihan Soal UN Fisika SMA 1. Dimensi energi potensial adalah... A. MLT-1 B. MLT-2 ML-1T-2 ML2 T-2 ML-2T-2 2. Apabila tiap skala pada gambar di bawah ini = 2 N, maka resultan kedua gaya tersebut adalah...
Latihan Soal UN Fisika SMA 1. Dimensi energi potensial adalah... A. MLT-1 B. MLT-2 ML-1T-2 ML2 T-2 ML-2T-2 2. Apabila tiap skala pada gambar di bawah ini = 2 N, maka resultan kedua gaya tersebut adalah...
UN SMA IPA 2009 Fisika
 UN SMA IPA 009 isika Kode Soal P88 Doc. Version : 0-06 halaman 0. itria melakukan perjalanan napak tilas dimulai dari titik A ke titik B : 600 m arah utara; ke titik C 400 m arah barat; ke titik D 00 m
UN SMA IPA 009 isika Kode Soal P88 Doc. Version : 0-06 halaman 0. itria melakukan perjalanan napak tilas dimulai dari titik A ke titik B : 600 m arah utara; ke titik C 400 m arah barat; ke titik D 00 m
BAB IV HASIL PENGAMATAN
 BAB IV HASIL PENGAMATAN 4.1 Absorbansi Panjang Gelombang Maksimal No λ (nm) Absorbansi 1 500 0.634 2 510 0.555 3 520 0.482 4 530 0.457 5 540 0.419 6 550 0.338 7 560 0.293 8 570 0.282 9 580 0.181 10 590
BAB IV HASIL PENGAMATAN 4.1 Absorbansi Panjang Gelombang Maksimal No λ (nm) Absorbansi 1 500 0.634 2 510 0.555 3 520 0.482 4 530 0.457 5 540 0.419 6 550 0.338 7 560 0.293 8 570 0.282 9 580 0.181 10 590
KEGIATAN BELAJAR 2 KONFIGURASI ELEKTRON, HUBUNGANNYA DENGAN LETAK UNSUR DALAM SISTEM PERIODIK, DAN SIFAT PERIODIK UNSUR
 KEGIATAN BELAJAR 2 KONFIGURASI ELEKTRON, HUBUNGANNYA DENGAN LETAK UNSUR DALAM SISTEM PERIODIK, DAN SIFAT PERIODIK UNSUR A. CAPAIAN PEMBELAJARAN 1. Menentukan letak suatu unsur dalam SPU berdasarkan konfigurasi
KEGIATAN BELAJAR 2 KONFIGURASI ELEKTRON, HUBUNGANNYA DENGAN LETAK UNSUR DALAM SISTEM PERIODIK, DAN SIFAT PERIODIK UNSUR A. CAPAIAN PEMBELAJARAN 1. Menentukan letak suatu unsur dalam SPU berdasarkan konfigurasi
PR ONLINE MATA UJIAN: FISIKA (KODE A07)
 PR ONLINE MATA UJIAN: FISIKA (KODE A07) 1. Gambar di samping ini menunjukkan hasil pengukuran tebal kertas karton dengan menggunakan mikrometer sekrup. Hasil pengukurannya adalah (A) 4,30 mm. (D) 4,18
PR ONLINE MATA UJIAN: FISIKA (KODE A07) 1. Gambar di samping ini menunjukkan hasil pengukuran tebal kertas karton dengan menggunakan mikrometer sekrup. Hasil pengukurannya adalah (A) 4,30 mm. (D) 4,18
FISIKA MODERN. Staf Pengajar Fisika Departemen Fisika,, FMIPA, IPB
 FISIKA MODERN Staf Pengajar Fisika Departemen Fisika,, FMIPA, IPB 1 MANFAAT KULIAH Memberikan pemahaman tentang fenomena alam yang tidak dapat dijelaskan melalui fisika klasik Fenomena alam yang berkaitan
FISIKA MODERN Staf Pengajar Fisika Departemen Fisika,, FMIPA, IPB 1 MANFAAT KULIAH Memberikan pemahaman tentang fenomena alam yang tidak dapat dijelaskan melalui fisika klasik Fenomena alam yang berkaitan
PENDAHULUAN. Gambar 1 Ilustrasi hukum Lambert Beer (Sabrina 2012) Absorbsi sinar oleh larutan mengikuti hukum lambert Beer, yaitu:
 PENDAHULUAN Spektrofotometer adalah alat untuk mengukur transmitan atau absorbans suatu sampel yang dinyatakan sebagai fungsi panjang gelombang. Absorbsi radiasi oleh suatu sampel diukur pada berbagai
PENDAHULUAN Spektrofotometer adalah alat untuk mengukur transmitan atau absorbans suatu sampel yang dinyatakan sebagai fungsi panjang gelombang. Absorbsi radiasi oleh suatu sampel diukur pada berbagai
BAB II TINJAUAN PUSTAKA
 5 BAB II TIJAUA PUSTAKA A. Terapi Fotodinamik (Photodynamic Therapy, PDT) Proses terapi PDT dapat diilustrasikan secara lengkap pada tahapan berikut. Mula-mula pasien diinjeksi dengan senyawa fotosensitizer
5 BAB II TIJAUA PUSTAKA A. Terapi Fotodinamik (Photodynamic Therapy, PDT) Proses terapi PDT dapat diilustrasikan secara lengkap pada tahapan berikut. Mula-mula pasien diinjeksi dengan senyawa fotosensitizer
4. Sebuah sistem benda terdiri atas balok A dan B seperti gambar. Pilihlah jawaban yang benar!
 Pilihlah Jawaban yang Paling Tepat! Pilihlah jawaban yang benar!. Sebuah pelat logam diukur menggunakan mikrometer sekrup. Hasilnya ditampilkan pada gambar berikut. Tebal pelat logam... mm. 0,08 0.,0 C.,8
Pilihlah Jawaban yang Paling Tepat! Pilihlah jawaban yang benar!. Sebuah pelat logam diukur menggunakan mikrometer sekrup. Hasilnya ditampilkan pada gambar berikut. Tebal pelat logam... mm. 0,08 0.,0 C.,8
Model Atom Bohr Tingkat Energi dan Spektrum Asas Persesuaian Eksitasi Atomik (Percobaan Frank-Hertz)
 Pertemuan Ke-9 dan 10 STRUKTUR ATOM LANJUTAN NURUN NAYIROH, M.Si FISIKA MODERN SUB TEMA Model Atom Bohr Tingkat Energi dan Spektrum Asas Persesuaian Eksitasi Atomik (Percobaan Frank-Hertz) 1 MODEL ATOM
Pertemuan Ke-9 dan 10 STRUKTUR ATOM LANJUTAN NURUN NAYIROH, M.Si FISIKA MODERN SUB TEMA Model Atom Bohr Tingkat Energi dan Spektrum Asas Persesuaian Eksitasi Atomik (Percobaan Frank-Hertz) 1 MODEL ATOM
Struktur Atom dan Sistem Periodik
 Modul 1 Struktur Atom dan Sistem Periodik Drs. Ucu Cahyana, M.Si. M PENDAHULUAN odul Kimia Anorganik I merupakan suatu seri yang terdiri atas 9 modul. Dalam Modul 1 3, Anda akan mempelajari teori dasar
Modul 1 Struktur Atom dan Sistem Periodik Drs. Ucu Cahyana, M.Si. M PENDAHULUAN odul Kimia Anorganik I merupakan suatu seri yang terdiri atas 9 modul. Dalam Modul 1 3, Anda akan mempelajari teori dasar
PERTEMUAN KEEMPAT FISIKA MODERN TEORI KUANTUM TENTANG RADIASI ELEKTROMAGNET TEKNIK PERTAMBANGAN UNIVERSITAS MULAWARMAN
 PERTEMUAN KEEMPAT FISIKA MODERN TEORI KUANTUM TENTANG RADIASI ELEKTROMAGNET TEKNIK PERTAMBANGAN UNIVERSITAS MULAWARMAN TEORI FOTON Gelombang Elektromagnetik termasuk cahaya memiliki dwi-sifat (Dualisme)
PERTEMUAN KEEMPAT FISIKA MODERN TEORI KUANTUM TENTANG RADIASI ELEKTROMAGNET TEKNIK PERTAMBANGAN UNIVERSITAS MULAWARMAN TEORI FOTON Gelombang Elektromagnetik termasuk cahaya memiliki dwi-sifat (Dualisme)
Spektrum Gelombang Elektromagnetik
 Spektrum Gelombang Elektromagnetik Hubungan spektrum dengan elektron Berkaitan dengan energi energi cahaya. energi gerak elektron dan Keadaan elektron : Saat arus dilewatkan melalui gas pada tekanan rendah,
Spektrum Gelombang Elektromagnetik Hubungan spektrum dengan elektron Berkaitan dengan energi energi cahaya. energi gerak elektron dan Keadaan elektron : Saat arus dilewatkan melalui gas pada tekanan rendah,
: Surya Lihidayatina Mustopa. : Jadwal Kuliah Senin Petang WIB
 Nama NIM Kelompok : Surya Lihidayatina Mustopa : L2C009132 : Jadwal Kuliah Senin Petang 13.50 WIB 1. Perhatikan gambar skema percobaan milikan di bawah ini Percobaan tetes minyak milikan dilakukan sebagai
Nama NIM Kelompok : Surya Lihidayatina Mustopa : L2C009132 : Jadwal Kuliah Senin Petang 13.50 WIB 1. Perhatikan gambar skema percobaan milikan di bawah ini Percobaan tetes minyak milikan dilakukan sebagai
A. 100 N B. 200 N C. 250 N D. 400 N E. 500 N
 1. Sebuah lempeng besi tipis, tebalnya diukur dengan menggunakan mikrometer skrup. Skala bacaan hasil pengukurannya ditunjukkan pada gambar berikut. Hasilnya adalah... A. 3,11 mm B. 3,15 mm C. 3,61 mm
1. Sebuah lempeng besi tipis, tebalnya diukur dengan menggunakan mikrometer skrup. Skala bacaan hasil pengukurannya ditunjukkan pada gambar berikut. Hasilnya adalah... A. 3,11 mm B. 3,15 mm C. 3,61 mm
BAB II TINJAUAN PUSTAKA. Menurut Ditjen BKAK (2014), uraian mengenai teofilin adalah sebagai. Gambar 2.1 Struktur Teofilin
 BAB II TINJAUAN PUSTAKA 2.1 Uraian Bahan 2.1.1 Teofilin Menurut Ditjen BKAK (2014), uraian mengenai teofilin adalah sebagai berikut: Rumus Struktur : Gambar 2.1 Struktur Teofilin Nama Kimia : 1,3-dimethyl-7H-purine-2,6-dione
BAB II TINJAUAN PUSTAKA 2.1 Uraian Bahan 2.1.1 Teofilin Menurut Ditjen BKAK (2014), uraian mengenai teofilin adalah sebagai berikut: Rumus Struktur : Gambar 2.1 Struktur Teofilin Nama Kimia : 1,3-dimethyl-7H-purine-2,6-dione
Struktur atom merupakan satuan dasar materi yang terdiri dari inti atom beserta awan elektron bermuatan negatif yang mengelilinginya.
 Struktur atom merupakan satuan dasar materi yang terdiri dari inti atom beserta awan elektron bermuatan negatif yang mengelilinginya. Inti atom mengandung campuran proton (bermuatan positif) dan neutron
Struktur atom merupakan satuan dasar materi yang terdiri dari inti atom beserta awan elektron bermuatan negatif yang mengelilinginya. Inti atom mengandung campuran proton (bermuatan positif) dan neutron
Komponen Materi. Kimia Dasar 1 Sukisman Purtadi
 Komponen Materi Kimia Dasar 1 Sukisman Purtadi Pengamatan ke Arah Pandangan Atomik Materi Konservasi Massa Komposisi Tetap Perbandingan Berganda Teori Atom Dalton Bagaimana Teori Dalton Menjelaskan Hukum
Komponen Materi Kimia Dasar 1 Sukisman Purtadi Pengamatan ke Arah Pandangan Atomik Materi Konservasi Massa Komposisi Tetap Perbandingan Berganda Teori Atom Dalton Bagaimana Teori Dalton Menjelaskan Hukum
INTERAKSI RADIASI DENGAN BAHAN
 SPEKTROSKOPI DEFINISI Merupakan teknik analisis dengan menggunakan spektrum elektrtomagnetik Spektrum elektromagnetik meliputi kisaran panjang gelombang yang sangat besar Misal: sinar tampak: 380-780 nm
SPEKTROSKOPI DEFINISI Merupakan teknik analisis dengan menggunakan spektrum elektrtomagnetik Spektrum elektromagnetik meliputi kisaran panjang gelombang yang sangat besar Misal: sinar tampak: 380-780 nm
D. 30 newton E. 70 newton. D. momentum E. percepatan
 1. Sebuah benda dengan massa 5 kg yang diikat dengan tali, berputar dalam suatu bidang vertikal. Lintasan dalam bidang itu adalah suatu lingkaran dengan jari-jari 1,5 m Jika kecepatan sudut tetap 2 rad/s,
1. Sebuah benda dengan massa 5 kg yang diikat dengan tali, berputar dalam suatu bidang vertikal. Lintasan dalam bidang itu adalah suatu lingkaran dengan jari-jari 1,5 m Jika kecepatan sudut tetap 2 rad/s,
Wardaya College. Tes Simulasi Ujian Nasional SMA Berbasis Komputer. Mata Pelajaran Fisika Tahun Ajaran 2017/2018. Departemen Fisika - Wardaya College
 Tes Simulasi Ujian Nasional SMA Berbasis Komputer Mata Pelajaran Fisika Tahun Ajaran 2017/2018-1. Hambatan listrik adalah salah satu jenis besaran turunan yang memiliki satuan Ohm. Satuan hambatan jika
Tes Simulasi Ujian Nasional SMA Berbasis Komputer Mata Pelajaran Fisika Tahun Ajaran 2017/2018-1. Hambatan listrik adalah salah satu jenis besaran turunan yang memiliki satuan Ohm. Satuan hambatan jika
BAB FISIKA ATOM I. SOAL PILIHAN GANDA
 FISIK TOM I. SOL PILIHN GND 0. Pernyataan berikut yang termasuk teori atom menurut Dalton adala... agian terkecil suatu atom adala elektron. lektron dari suatu unsur sama dengan elektron dari unsure lain.
FISIK TOM I. SOL PILIHN GND 0. Pernyataan berikut yang termasuk teori atom menurut Dalton adala... agian terkecil suatu atom adala elektron. lektron dari suatu unsur sama dengan elektron dari unsure lain.
TUGAS ANALISIS FARMASI ANALISIS OBAT DENGAN METODE SPEKTROFOTOMETRI UV-VIS
 TUGAS ANALISIS FARMASI ANALISIS OBAT DENGAN METODE SPEKTROFOTOMETRI UV-VIS OLEH NAMA : RAHMAD SUTRISNA STAMBUK : F1F1 11 048 KELAS : FARMASI A JURUSAN FARMASI FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
TUGAS ANALISIS FARMASI ANALISIS OBAT DENGAN METODE SPEKTROFOTOMETRI UV-VIS OLEH NAMA : RAHMAD SUTRISNA STAMBUK : F1F1 11 048 KELAS : FARMASI A JURUSAN FARMASI FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
PRAKTIKUM STRUKTUR ATOM
 MAKALAH PENGABDIAN PADA MASYARAKAT PRAKTIKUM STRUKTUR ATOM Oleh : M. PRANJOTO UTOMO Makalah ini disampaikan pada kegiatan: Pengayaan Praktikum Guru-Guru pada Acara Pendampingan SMA oleh FMIPA UNY Di FMIPA
MAKALAH PENGABDIAN PADA MASYARAKAT PRAKTIKUM STRUKTUR ATOM Oleh : M. PRANJOTO UTOMO Makalah ini disampaikan pada kegiatan: Pengayaan Praktikum Guru-Guru pada Acara Pendampingan SMA oleh FMIPA UNY Di FMIPA
Spektrum Gelombang Elektromagnetik
 Spektrum Gelombang Elektromagnetik Gelombang elektromagnetik yang dirumuskan oleh Maxwell ternyata terbentang dalam rentang frekuensi yang luas. Sebagai sebuah gejala gelombang, gelombang elektromagnetik
Spektrum Gelombang Elektromagnetik Gelombang elektromagnetik yang dirumuskan oleh Maxwell ternyata terbentang dalam rentang frekuensi yang luas. Sebagai sebuah gejala gelombang, gelombang elektromagnetik
FISIKA MODERN DAN FISIKA ATOM
 MATA KULIAH KODE MK Dosen : FISIKA DASAR II : EL-1 : Dr. Budi Mulyanti, MSi Pertemuan ke-14 CAKUPAN MATERI 1. TEORI RELATIVITAS KHUSUS. EFEK FOTOLISTRIK 3. GELOMBANG DE BROGLIE 4. ATOM HIDROGEN 5. DIAGRAM
MATA KULIAH KODE MK Dosen : FISIKA DASAR II : EL-1 : Dr. Budi Mulyanti, MSi Pertemuan ke-14 CAKUPAN MATERI 1. TEORI RELATIVITAS KHUSUS. EFEK FOTOLISTRIK 3. GELOMBANG DE BROGLIE 4. ATOM HIDROGEN 5. DIAGRAM
PREDIKSI UN FISIKA V (m.s -1 ) 20
 PREDIKSI UN FISIKA 2013 1. Perhatikan gambar berikut Hasil pengukuran yang bernar adalah. a. 1,23 cm b. 1,23 mm c. 1,52mm d. 1,73 cm e. 1,73 mm* 2. Panjang dan lebar lempeng logam diukur dengan jangka
PREDIKSI UN FISIKA 2013 1. Perhatikan gambar berikut Hasil pengukuran yang bernar adalah. a. 1,23 cm b. 1,23 mm c. 1,52mm d. 1,73 cm e. 1,73 mm* 2. Panjang dan lebar lempeng logam diukur dengan jangka
PAKET SOAL 1.c LATIHAN SOAL UJIAN NASIONAL TAHUN PELAJARAN 2011/2012
 UJI COBA MATA PELAJARAN KELAS/PROGRAM ISIKA SMA www.rizky-catatanku.blogspot.com PAKET SOAL 1.c LATIHAN SOAL UJIAN NASIONAL TAHUN PELAJARAN 2011/2012 : FISIKA : XII (Dua belas )/IPA HARI/TANGGAL :.2012
UJI COBA MATA PELAJARAN KELAS/PROGRAM ISIKA SMA www.rizky-catatanku.blogspot.com PAKET SOAL 1.c LATIHAN SOAL UJIAN NASIONAL TAHUN PELAJARAN 2011/2012 : FISIKA : XII (Dua belas )/IPA HARI/TANGGAL :.2012
PERCOBAAN EFEK FOTOLISTRIK
 PERCOBAAN EFEK FOTOLISTRIK A. TUJUAN PERCOBAAN 1. Mempelajari efek/gejala fotolistrik secara eksperimen. 2. Menentukan fungsi kerja/work function sel foto (photo cell). 3. Menentukan nilai tetapan Planck
PERCOBAAN EFEK FOTOLISTRIK A. TUJUAN PERCOBAAN 1. Mempelajari efek/gejala fotolistrik secara eksperimen. 2. Menentukan fungsi kerja/work function sel foto (photo cell). 3. Menentukan nilai tetapan Planck
UJIAN NASIONAL TAHUN PELAJARAN 2007/2008
 UJIAN NASIONAL TAHUN PELAJARAN 007/008 PANDUAN MATERI SMA DAN MA F I S I K A PROGRAM STUDI IPA PUSAT PENILAIAN PENDIDIKAN BALITBANG DEPDIKNAS KATA PENGANTAR Dalam rangka sosialisasi kebijakan dan persiapan
UJIAN NASIONAL TAHUN PELAJARAN 007/008 PANDUAN MATERI SMA DAN MA F I S I K A PROGRAM STUDI IPA PUSAT PENILAIAN PENDIDIKAN BALITBANG DEPDIKNAS KATA PENGANTAR Dalam rangka sosialisasi kebijakan dan persiapan
Copyright all right reserved
 Latihan Soal UN SMA / MA 2011 Program IPA Mata Ujian : Fisika Jumlah Soal : 20 1. Gas helium (A r = gram/mol) sebanyak 20 gram dan bersuhu 27 C berada dalam wadah yang volumenya 1,25 liter. Jika tetapan
Latihan Soal UN SMA / MA 2011 Program IPA Mata Ujian : Fisika Jumlah Soal : 20 1. Gas helium (A r = gram/mol) sebanyak 20 gram dan bersuhu 27 C berada dalam wadah yang volumenya 1,25 liter. Jika tetapan
D. 6,25 x 10 5 J E. 4,00 x 10 6 J
 1. Besarnya usaha untuk menggerakkan mobil (massa mobil dan isinya adalah 1000 kg) dari keadaan diam hingga mencapai kecepatan 72 km/jam adalah... (gesekan diabaikan) A. 1,25 x 10 4 J B. 2,50 x 10 4 J
1. Besarnya usaha untuk menggerakkan mobil (massa mobil dan isinya adalah 1000 kg) dari keadaan diam hingga mencapai kecepatan 72 km/jam adalah... (gesekan diabaikan) A. 1,25 x 10 4 J B. 2,50 x 10 4 J
RANCANGAN PEMBELAJARAN KIMIA FISIKA III
 RANCANGAN PEMBELAJARAN KIMIA FISIKA III Nama / Kode Matakuliah : Kimia Fisika III / 301 H310 3 / 3 sks Komptensi Sasaran : 1. Kompetensi Utama : Memiliki kemampuan dalam menerapkan pengetahuan dasar Kimia.
RANCANGAN PEMBELAJARAN KIMIA FISIKA III Nama / Kode Matakuliah : Kimia Fisika III / 301 H310 3 / 3 sks Komptensi Sasaran : 1. Kompetensi Utama : Memiliki kemampuan dalam menerapkan pengetahuan dasar Kimia.
BAB I PENDAHULUAN 1.1 Latar Belakang
 BAB I PENDAHULUAN 1.1 Latar Belakang Analisis adalah suatu kegiatan yang dilakukan untuk memeriksa, mengidentifikasi, menentukan suatu zat dalam suatu cuplikan. Dalam menganalisa terdapat 3 aspek komprehensif
BAB I PENDAHULUAN 1.1 Latar Belakang Analisis adalah suatu kegiatan yang dilakukan untuk memeriksa, mengidentifikasi, menentukan suatu zat dalam suatu cuplikan. Dalam menganalisa terdapat 3 aspek komprehensif
