Kunci : A Penyelesaian : Campuran adalah materi yang terdiri dan dua macam zat atau lebih. Campuran yang menunjukkan dua senyawa adalah :
|
|
|
- Sucianty Harjanti Tedja
- 7 tahun lalu
- Tontonan:
Transkripsi
1 1. Pernyataan yang benar tentang unsur, senyawa, dan campuran adalah... A. Unsur merupakan komponen yang tidak dapat dipisahkan. B. Senyawa adalah zat tunggal yang masih dapat diuraikan dengan pemanasan. C. Campuran merupakan gabungan beberapa zat tunggal. D. Unsur dan senyawa merupakan zat-zat tunggal. E. Senyawa dan campuran adalah gabungan dari unsur-unsur. Zat tunggal atau zat murni adalah materi yang memiliki sifat dan susunan yang sama pada setiap susunannya. Unsur dan senyawa merupakan zat tunggal. 2. Di antara gambar-gambar partikel materi berikut yang menunjukkan campuran dari dua senyawa adalah... A. D. B. E. C. Kunci : A Campuran adalah materi yang terdiri dan dua macam zat atau lebih. Campuran yang menunjukkan dua senyawa adalah : 3. Di antara perubahan materi berikut : 1. Pembuatan tape 4. Penyepuhan logam 2. Penguapan air 5. Beras digiling menjadi tepung 3. Susu menjadi masam 6. Garam dapur larut dalam air Kelompok yang tergolong perubahan kimia adalah... A. 1, 2, 3 B. 1, 2, 4 C. 1, 3, 4 Kunci : C D. 2, 3, 5 E. 3, 4, 6 1
2 Perubahan kimia adalah perubahan materi yang disertai dengan pembentukan materi baru. Kelompok yang tergolong perubahan kimia yaitu pembuatan tape, susu menjadi masam, dan penyepuhan logam. 4. Di antara reaksi di bawah ini, yang tidak mengikuti hukum kekekalan massa adalah... (Ar : S = 32; Cu = 673,5; O = 16; C = 12; Fe = 56; H = 1) A. 5 g belerang + 10 g tembaga 15 g tembaga (II) sulfida B. 2 g belerang + 3,5 g besi 5,5 g besi (II) sulfida C. 5 g belerang + 10 g oksigen 10 g belerang dioksida D. 3 g karbon + 8 g oksigen 11 g karbondioksida E. 1 g oksigen + 8 hidrogen 9 g air Kunci : C Hukum Kekekalan Massa (Hukum Lavoisier), menyatakan bahwa massa zat sebelum dan sesudah reaksi adalah sama. 5 gr belerang + 10 gr oksigen 10 gram belerang, dioksida, tidak sesuai dengan Hukum Kekekalan Massa. 5. Manakah pernyataan berikut yang paling tepat? A. Bila diukur pada suhu dan tekanan yang sama, volum gas yang bereaksi dan gas hasil reaksi berbanding sebagai bilangan bulat dan sederhana. B. Bila diukur pada suhu yang sama volum gas yang bereaksi dan gas hasil reaksi berbanding sebagai bilangan bulat dan sederhana. C. Bila diukur pada tekanan yang sama volum gas yang bereaksi dan gas hasil reaksi berbanding sebagai bilangan bulat dan sederhana. D. Bila diukur pada suhu dan tekanan yang berbeda volum gas yang bereaksi berbanding sebagai bilangan bulat dan sederhana. E. Bila diukur pada suhu rendah dan tekanan tinggi, volum gas yang bereaksi berbanding sebagai bilangan bulat dan sederhana. Kunci : A Hukum Perbandingan Volum (Hukum Gay Lussac) : Pada suhu dan tekanan yang sama, perbandingan volum gas-gas yang bereaksi dan gas-gas hasil reaksi merupakan bilangan bulat dan sederhana Massa adalah atom... relatif : Na = 23; O = 16; S = 32. Massa molekul relatif dari senyawa Na 2 SO A B. 2 (23) + (32) + 4 (16) 142 C (32) D. 4 (23) + 1 (32) + 2 (16) 156 E Jika Ar Na = 23; O = 16; S = 32, maka : Mr Na 2 SO 4 = 2. Ar Na + 1. ArS + 4. Ar O = = = 142 2
3 7. Unsur X sebanyak 3,01 x atom mempunyai massa = 2 gram. Massa molar unsur X adalah... A. 4 gram B. 10 gram C. 20 gram D. 40 gram E. 80 gram Massa molar adalah hubungan massa dengan jumlah mol. Untuk atom : Massa molar (gr/mol) = massa atom relatif (sma). Mm = Ar (sma) Mol unsur X = Massa molar X = x 1 mol = 0,05 mol = 40 gram 8. Unsur klor dengan lambang mengandung... A. 17 n, 18 p B. 17 n, 35 p C. 18 n, 17 p Kunci : C mengandung : p = 17 n = = 18 D. 18 n, 35 p E. 35 n, 17 p 9. Unsur V, W, X, Y, Z berturut-turut mempunyai nomor atom 2, 3, 8, 13, 16. Pasangan unsur yang berada dalam satu golongan adalah... A. W dan Z B. X dan Y C. U dan X D. X dan Z E. Van Y K L M V = W = X = Y = Z = Yang mempunyai kulit terluar sama adalah X dan Z yaitu Nomor atom unsur A, B, C, D dan E berturut-turut 6, 8, 9, 16, 19. Pasangan unsur yang dapat membentuk ikatan ion adalah pasangan antara unsur... A. A dan C B. C dan E C. B dan D Pembentukan ion dapat terjadi melalui dua cara : D. D dan C E. A dan B 3
4 1. Pelepasan elektron dari atom itu kepada atom lain (pembentukan ion positif). 2. Penerimaan elektron dari atom lain (pembentukan ion negatif). K L M N A(6) = B(8) = C(9) = D(16) = E(19) = Pelepasan elektron cenderung terjadi pada unsur E (kulit terluar 1) dan penerimaan elektron pada unsur C (kulit terluar 7). 11. Di antara persamaan reaksi berikut, yang merupakan reaksi redoks adalah... A. NaOH (s) + HCl (aq) NaCl (aq) + H 2 O (l) B. CaSO 4 (aq) + 2 LiOH (aq) Ca(OH) 2 (s) + Li 2 SO 4 (aq) C. Mg(OH) 2 (s) + 2 HCl (aq) MgCl 2 (aq) + 2 H 2 O (1) D. BaCl 12 (aq) + H 2 SO 4 (aq) BaSO 4 (s) + 2 HCl (aq) E. MnO 2 (s) + 4 HCl (aq) MnCl 2 (aq) + 2 H 2 O (1) + Cl 2 (g) Kunci : E Yang merupakan reaksi redoks : MnO 2 (s) + 4 HCl (aq) MnCl 2 (aq) + 2 H 2 O (1) + Cl 2 (g) 12. Contoh pasangan senyawa di bawah ini yang tergolong senyawa hidrokarbon adalah... A. C 2 H 5 OH dan CO 2 B. CH 3 COOH dan C 4 H 10 C. H 2 CO 3 dan C 2 H 4 D. C 5 H 12 dan C 6 H 6 E. CCl 4 dan C 12 H 22 O 11 Senyawa hidrokarbon adalah senyawa yang mengandung hidrogen dan karbon. Pasangan yang termasuk senyawa hidrokarbon adalah C 5 H 12 dan C 6 H Perhatikan rumus struktur di bawah ini! Pasangan yang merupakan atom C sekunder diperlihatkan oleh... A. 2 dan 7 B. 3 dan 8 C. 1 dan 4 D. 6 dan 9 E. 2 dan 5 Atom C primer adalah atom C yang mengikat satu atom C yang lain. 4
5 Atom C sekunder adalah atom C yang mengikat dua atom C yang lain. Atom C kuarter adalah atom C yang mengikat empat atom C yang lain. Yang merupakan pasangan atom sekunder pada gambar adalah 3 dan Senyawa-senyawa berikut ini yang merupakan zat aditif pada bensin adalah... A. 2, 2, 4 - trimetil pentana B. Metil tersier butil eter C. Dimetil keton D. Etil propil eter E. 2, 3, - dimetil butana Yang merupakan zat aditif pada bensin adalah Metil Tersier Butil Eter (MTBE) 15. Sebanyak 2,8 gram besi direaksikan dengan asam sulfat secukupnya, menurut reaksi : 2 Fe (s) + 3 H 2 SO 4 (aq) Fe 2 (SO 4 ) 3 (aq) + 3 H 2 (g) Pada akhir reaksi, gas H 2 yang terbentuk diukur pada keadaan standar adalah... (Ar Fe = 56) A. 0,56 liter B. 0,60 liter C. 1,12 liter D. 1,68 liter E. 2,24 liter 2 Fe (s) + 3 H 2 SO 4 (aq) Fe 2 (SO 4 ) 3 (aq) + 3 H 2 (g) mol Fe = = 0,05 mol mol H 2 = x 0,05 mol = 0,075 mol Volume H 2 pada keadaan standar = 0,075 x 22,41 = 1,68 liter 16. Untuk menetralkan 5,8 gram senyawa Mg (OH) 2 dalam reaksi : Mg(OH) 2 (aq) + HCl (aq) MgCl 2 (aq) + H 2 O (l) diperlukan massa HCl sebanyak... (Ar : Mg = 24, O = 16, H = 1, Cl = 35,5) A. 3,65 gram B. 4,21 gram C. 7,30 gram Kunci : C Mg(OH) 2 (aq) + HCl (aq) D. 8,90 gram E. 11,70 gram MgCl 2 (aq) + H 2 O (l) mol Mg(OH) 2 = = 0,1 mol mol HCl = x 0,1 mol = 0,2 mol Massa HCl = 0,2 x (1 + 35,5) = 0,2 x 36,5 = 7,30 gram 5
6 17. Perhatikan diagram entalpi di atas yang merupakan reaksi : H 2 O (l) H 2 O (g) Berdasarkan data-data diagram tersebut harga H 3 adalah... A. -41 kj/mol B. +41 kj/mol C kj/mol D kj/mol E kj/mol Berdasarkan Hukum Hess : Perubahan entalpi reaksi hanya bergantung pada entalpi awal dan entalpi akhir. H 2 O(1) - H 2 (g) + 2 O 2 (g) H 2 (g) + 2 O 2 (g) - H 2 O(g) H 1 = +283 kj H 2 = -242 kj H 2 O(l) H 2 O (g) H 3 = +41 kj 18. Jika diketahui perubahan entalpi untuk reaksi berikut : 2 Fe (s) + O 2 (g) Fe 2 O 3 (s) H = -822 kj/mol C (s) + O 2 (g) CO (g) H = -110 kj/mol Perubahan entalpi untuk reaksi : 3 C (s) + Fe 2 O 3 (s) 2 Fe (s) + 3 CO (g), adalah... A kj/mol B kj/mol C kj/mol D kj/mol E kj/mol 1) 2 Fe (s) + O 2 (g) Fe 2 O 3 (s) H = -822 kj/mol 2) C (s) + O 2 (g) CO (g) H = -110 kj/mol Reaksi 1) dibalik panahnya dan Reaksi 2) dikalikan 3 : 3) Fe 2 O 3 (s) 2 Fe (s) + O 2 (g) H = +822 kj/mol 4) 3 C (s) + O 2 (g) 3 CO (g) H = -330 kj/mol 6
7 3 C (s) + Fe 2 O 3 (s) 2 Fe (s) + 3 CO (g) H = +492 kj/mol 19. Dari reaksi : 2 NO (g) + 2 H 2 (g) N 2 (g) + 2 H 2 O (g) diperoleh data percobaan sebagai berikut : Persamaan laju reaksi tersebut adalah... A. V = k [NO] [H 2 ] B. V = k [NO] 2 [H 2 ] C. V = k [NO] [H 2 ] 2 D. V = k [NO] 2 [H 2 ] E. V = k [H 2 ] 2 Kunci : A Menentukan pangkat reaksi NO, dengan laju reaksi untuk H 2 tetap. Menentukan pangkat reaksi H 2, laju reaksi untuk [NO] tetap Jadi persamaan laju reaksinya adalah : V = k [NO] [H 2 ] 20. Grafik hubungan antara katalis dan energi pengaktifan : 7
8 Energi pengaktifan yang merupakan tahap penentu laju reaksi ditunjukkan oleh... A. Ea 1 D. Ea 4 B. Ea 2 E. Ea 5 C. Ea 3 Energi pengaktifan suatu reaksi menjadi lebih rendah jika digunakan katalis, sehingga persentase partikel yang mempunyai energi lebih besar daripada energi pengaktifan lebih banyak tumbukan sehingga reaksi lebih cepat. 21. Perhatikan reaksi : 2 SO 2 (g) + O 2 (g) 2 SO 3 (g) + 45 kkal Jika suhu diturunkan, yang terjadi adalah... A. Tidak terjadi pergeseran B. Jumlah SO 2 dan O 2 bertambah C. Jumlah O 2 bertambah D. Jumlah SO 2 bertambah E. Jumlah SO 3 bertambah Kunci : E 2 SO 2 (g) + O 2 (g) 2 SO 3 (g) + 45 kkal Jika suhu diturunkan maka sistem akan melepas kalor dan kesetimbangan bergeser ke arah reaksi eksoterm atau bergeser ke arah SO 3, sehingga jumlah SO 3 bertambah. 22. Dalam bejana 3 liter, 5 mol amoniak terurai dengan derajat disosiasi 0,4 menurut reaksi : 2 NH 3 (g) N 2 (g) + 3 H 2 (g) Tekanan pada kesetimbangan adalah 3,5 atm. Harga Kp adalah... A. B. C. 1 2 NH 3 (g) N 2 (g) + 3 H 2 (g) m : 5 mol b : 2 mol S : 3 mol 1 mol 3 mol D. E. 1,5 8
9 Tekanan parsial gas NH 3 = Tekanan parsial gas N 2 = Tekanan parsial gas H 2 = Maka : x 3,5 = 1,5 atm x 3,5 = 0,5 atm x 3,5 atm = 1,5 atm 23. Berikut data hasil pengujian daya hantar listrik terhadap beberapa larutan : Pasangan larutan elektrolit lemah adalah... A. 1 dan 2 B. 1 dan 5 C. 2 dan 3 D. 2 dan 5 E. 3 dan 4 Larutan elektrolit dapat dibedakan menjadi elektrolit kuat dan elektrolit lemah. Elektrolit lemah : - Tidak menyala, gelembung gas ada. - Menyala redup, gelembung gas ada. 24. Diketahui reaksi : CH 3 COOH + HNO 2 CH 3 COOH NO 2 - Spesi yang keduanya bersifat asam menurut teori Bronsted Lowrey adalah... A. CH 3 COOH dan CH 3 COOH 2 + B. CH 3 COOH dan NO 2 - C. HNO 2 dan CH 3 COOH 2 + Kunci : C CH 3 COOH + HNO 2 CH 3 COOH NO 2 - Menurut Bronsted Lowry : - Asam : jika melepaskan proton - Basa : menerima proton HNO 2 dan CH 3 COOH 2 + melepaskan proton. D. HNO 2 dan NO 2 - E. CH 3 COOH 2 + dan NO Sebanyak 18 gram glukosa (Mr = 180) dilarutkan dalam 72 gram air. Pada suhu tertentu, tekanan uap air murni = 20,1 cmhg. Maka penurunan tekanan uap larutan glukosa tersebut adalah... (cmhg). A. 0,49 B. 1,96 C. 4,90 D. 9,80 E. 19,60 9
10 Kunci : C Mol glukosa = Mol air = = 4 mol = 0,1 mol Fraksi mol glukosa = p = X glukosa. P = x 20,1 = = 4,9 cmhg. 26. Besarnya ph larutan asam metanoat 0,01 M adalah 5. Maka harga tetapan asam metanoat tersebut adalah... A. 1 x 10-5 B. 1 x 10-6 C. 1 x ,01 M asam metanoat ph = 5 ph = -log(h + ) 5 = -log(h + ) H + = 10-5 H + = (H + )² = Ka. M Ka = (H + )² : M = (10-5 ) 2 : 10-2 = : 10-2 = 10-8 Ka = 1 x 10-8 D. 1 x 10-8 E. 2 x Ke dalam 600 gram air dilarutkan 27 gram senyawa non elektrolit. Larutan itu mendidih pada temperatur 100,13 C. Jika diketahui Kb air = 0,52 C/m maka massa molekul relatif senyawa tersebut adalah... A. 60 B. 90 C. 120 T b larutan = T b pelarut + D. 180 E. 342 T b T b = T b larutan - T b pelarut = 100,13 C C = 0,13 C 28. Sebanyak 100 ml larutan HCl 0,1 M dicampurkan dengan 100 ml larutan Ba (OH) 2 0,1 M. Maka [OH - ] dalam larutan adalah... 10
11 A. 0,010 M B. 0,020 M C. 0,025 M D. 0,050 M E. 0,250 M 2 HCl(aq) + Ba(OH) 2 (aq) BaCl H 2 O (l) m : 10 mmol 10 mmol b : 10 mmol 5 mmol s : - 5 mmol [OH - ] = b. M = 2. = 0,05 M = 0,050 M 29. Proses pembuatan koloid berikut yang tergolong cara kondensasi adalah... A. Menambahkan larutan AlCl 3 ke dalam endapan Al (OH) 3. B. Menambahkan larutan jenuh FeCl 3 ke dalam air panas. C. Mengalirkan arus listrik tegangan tinggi ke dalam larutan AuCl 3, D. Memasukkan serbuk belerang yang sadah di.gerus ke dalam air. E. Menambahkan alkohol 95% ke dalam larutan jenuh kalsium asetat. Cara kondensasi adalah mengubah partikel larutan sejati menjadi partial koloid. Jika beberapa tetes FeCl 3 jenuh dimasukkan ke dalam air mendidih dan diaduk maka Fe 3+ akan mengalami reaksi hidrolisis menjadi Fe(OH) 3 FeCl 3 (ag) + 3 H 2 O(l) Fe(OH) 3 (s) + 3 HCl(aq) 30. Polimer berikut termasuk polimer termoplas, kecuali... A. Dakron B. Paralon C. Poliester D. Bakelit E. Nillon - Polimer termoplas meleleh bila dipanaskan dan mengeras lagi bila didinginkan tanpa mengalami perubahan kimia. Contoh: Dakron, paralon dan poliester. - Polimer termoset tidak dapat melunak bila dipanaskan, kecuali penguraian terlebih dahulu. Contoh: bakelit. 31. Nama senyawa di bawah ini adalah... A. Meta bromo fenol B. Orto bromo fenol C. Para bromo fenol Kunci : A D. Orto bromo benzol E. Orto bromo benzil alkohol 11
12 Hasil substitusi pada benzena mempunyai 3 isomer yaitu : orto, meta, dan para. Letak substituen yang terikat pada atom C dari benzena dapat dinyatakan oleh : Orto (1, 2) Meta (1, 3) Para (1, 4) Maka : adalah senyawa Meta Bromo Fenol 32. Nama dari senyawa turunan benzena dengan rumus struktur di bawah ini adalah... A. 3,5 - dikloro fenol B. 1,3 - dikloro fenol C. 3,5 - dikloro toluena D. 1,3 - dikloro benzena E. 3,5 - dikloro benzoat Kunci : A Jika subtituennya berbeda jenis maka penomorannya dimulai dari atom C lingkar yang mengikat gugus paling negatif. 3,5 - dikloro fenol 33. Air sadah sementara dapat dilunakkan dengan cara... A. Penambahan tawas B. Pemanasan C. Pendinginan D. Pemberian soda E. Pengadukkan Air sadah sementara adalah air sadah yang mengandung anion bikarbonat (HCO 3 - ),. Air sadah sementara dapat dihilangkan dengan cara pemanasan dan penambahan air kapur. 34. Zat aditif dalam makanan dengan rumus struktur : 12
13 sering ditambahkan dalam makanan. Adapun fungsi senyawa tersebut sebagai... A. Pengawet B. Pewarna C. Pemanis D. Antioksidan E. Sekuestran Zat antioksidan adalah zat yang dapat mencegah proses oksidasi oleh udara, antara lain : a. BHA (Butil Hidroksi Anisol) b. BHT (Butil Hidroksi Toluen) c. Propil Gallate Zat antioksidan yang ditambahkan pada makanan di antaranya butil hidroksi anisol yang mempunyai rumus senyawa : 35. Suatu reaksi redoks : a Br 2 (aq) + b OH - (aq) c BrO 3 - (aq) + d Br - (aq) + e H 2 O (1) Harga a, b, c, d, dan e berturut-turut agar reaksi di atas setara adalah... A. 3, 6, 1, 5, dan 3 B. 3, 6, 5, 1, dan 3 C. 6, 1, 5, 3, dan 3 D. 6, 1, 3, 5, dan 3 E. 1, 5, 3, 6, dan 3 Kunci : A a Br 2 (aq) + b OH - (aq) c BrO 3 - (aq) + d Br - (aq) + e H 2 O (1) Persamaan setaranya : 3 Br 2 (aq) + 6 OH - (aq) BrO 3 - (aq) + 5 Br - (aq) + 3 H 2 O (1) Jadi a = 3, b = 6, c = 1, d = 5 dan e = Diketahui harga potensial reduksi untuk : Cu 2+ (aq) + 2e Cu (s) E = + 0,35 volt I 2 (s) + 2e 2 I - (aq) E = + 0,54 volt Fe 3+ (aq) + e Fe 2+ (aq) E = + 0,77 volt Br 2 (1) + e 2 Br - (aq) E = + 1,07 volt Reaksi berikut yang tidak dapat berlangsung spontan adalah... A. Cu 2+ (aq) + 2 I - (aq) B. Fe 3+ (aq) + 2I - (aq) C. 2 I - (aq) + Br 2 (1) Cu (s) + I 2 (s) Fe 2+ (aq) + I 2 (s) 2 Br - (aq) + I 2 (s) 13
14 D. Br 2 (1) + Cu (s) 2 Br - (aq) + Cu +2 (aq) E. Fe 2+ (aq) + Br 2 (1) Fe 3+ (aq) + 2 Br - (aq) Kunci : A Cu 2+ (aq) + 2e Cu (s) E = + 0,35 volt I 2 (s) + 2e 2 I - (aq); E = + 0,54 volt + Cu 2+ (aq) + 2 I - (aq) Cu (s) + I 2 (s) E = -0,19 volt Karena nilai potensial hasilnya negatif berarti reaksi redoks tersebut tidak berlangsung. 37. Elektrolisis larutan KCl menggunakan elektroda karbon akan menghasilkan... A. Logam K di katoda B. Gas H 2 di katoda C. Gas O 2 di anoda KCl K + + Cl - x 2 2 KCl 2 K Cl - Katoda : 2 H 2 O + 2e H OH - Anoda : 2 Cl - Cl 2 + 2e - Pada bagian katoda menghasilkan Gas H 2. D. Gas Cl 2 di katoda E. larutan basa di anoda 38. Pasangan pupuk berikut yang keduanya mengandung unsur N adalah... A. Urea dan ZA B. TSP dan Urea C. DS dan ES D. ZA dan TSP E. ES dan TSP Kunci : A Pupuk nitrogen terdiri dari: ZA, Urea, ASK, ACl Pupuk posfor terdiri dari: ES, DS dan TSP Pasangan pupuk yang mengandung unsur N adalah Urea dan ZA. 39. Bila 3,1 gram glikol (C 2 H 6 O) dilarutkan dalam 250 gram air dicampur dengan 17,1 gram sukrosa (C 12 H 22 O 11 ) dalam 500 gram air. Bila diketahui K f air = 1,86 C. (Ar : H = 1, O = 16, C = 12). Titik beku campuran larutan adalah... A. +0,372 C B. +0,248 C C. +0,186 C T f = K f (m 1 + m 2 ) = = 0,93 (0,27 + 0,1) = 0,334 T f = titik beku pelarut (air) - titik beku larutan 0,334 = 0 - titik beku larutan D. -0,334 C E. -0,372 C 14
15 Titik beku larutan = -0,334 C Jadi titik beku campuran larutan = -0,334 C 40. Perhatikan diagram P-T berikut! Pernyataan berikut yang tidak sesuai dengan data pada grafik ialah... A. Makin tinggi P maka titik didih pelarut makin tinggi. B. Makin rendah P maka titik beku pelarut makin rendah. C. Makin rendah P maka titik beku larutan makin tinggi. D. Makin rendah P maka titik didih larutan makin rendah. E. Makin tinggi P maka titik didih larutan makin tinggi. Kunci : C Berdasarkan diagram P - T Yang tidak sesuai adalah Makin rendah P maka titik beku larutan makin tinggi seharusnya makin rendah. 41. Larutan 25 ml NH 4 OH 0,2 M (Kb = 10-5 ), dicampurkan dengan 25 ml larutan HCl 0,1 M. ph larutan yang terjadi adalah... A. 5,0 B. 5,5 C. 8,5 NH 4 OH + HCl NH 4 Cl + H 2 O 25 ml 0,2 M 25 ml 0,1 M m : 5 mmol 2,5 mmol b : 2,5 mmol s : 2,5 mmol D. 9,0 E. 13,0 [OH - ] = Kb. = 10-5 = 10-5 poh = - log [OH - ] = - log 10-5 = 5 ph + poh = 14 ph + 5 = 14 ph =
16 ph = Sepuluh ml larutan K-asetat (Mr = 98) mempunyai ph = 9, jika Ka CH 3 COOH = CH 3 COOK yang terlarut dalam 500 ml larutannya ialah... (K=39,C=12,H=1,0=16) A. 98 gram B. 78,4 gram C. 39,2 gram ph = 9 poh = 14-9 = 5 Maka [OH - ] = 10-5 D. 9,8 gram E. 7,8 gram 43. Larutan jenuh dari L (OH) 2 mempunyai ph = 10, Ksp dari L (OH) 2 tersebut ialah... A. 5 x B. 2 x C. 5 x Kunci : A L(OH) 2 L OH - D. 2 x E. 2 x 10-8 ph = 10 x x 10-4 poh = = 4 [OH - ] = 10-4 Kp L(OH) 2 = [L +2 ] [OH - ] 2 = (5 x 10-5 ) (10-4 ) 2 = 5 x 10-5 x 10-8 = 5 x Diketahui persamaan reaksi redoks : Cr 2 O 7 2- (aq) + a Fe 2+ (aq) + H (aq) b Cr 3+ (aq) + c Fe 3+ (aq) + H 2 O (1) Jika persamaan reaksi disetarakan, harga koefisien a, b dan c masing-masing adalah... 16
17 A. 6, 3 dan 6 B. 6, 2 dan 6 C. 4, 3 dan 5 D. 3, 4 dan 3 E. 3, 2 dan 3 Cr 2 O 7 2- (aq) + a Fe 2+ (aq) + H (aq) b Cr 3+ (aq) + c Fe 3+ (aq) + H 2 O (1) Disetarakan menjadi : 2 Cr 2 O 7 2- (aq) + 6 Fe 2+ (aq) + 14 H (aq) 2 Cr 3+ (aq) + 6 Fe 3+ (aq) + 7 H 2 O (1) Jadi koefisien a = 6, b = 2, dan c = Diketahui potensial elektroda dari : Al e Al E = -1,66 volt Fe e Fe E = -0,44 volt Reaksi redoks : 2 Al (aq) + 3 Fe 2+ (aq) 2 Al 3+ (aq) + 3 Fe (s) menghasilkan potensial sel sebesar... A. +2,10 volt B. +2,00 volt C. +1,22 volt D. -1,22 volt E. -2,10 volt (1) Al e Al E = +1,66 volt (2) Fe e Fe E = -0,44 volt Untuk membentuk reaksi : 2 Al (aq) + 3 Fe 2+ (aq) 2 Al 3+ (aq) + 3 Fe (s) Reaksi (1) dibalik : Al Al e E = +1,66 volt x 2 Fe e Fe E = -0,44 volt x 3 2Al 2Al e E = +3,32 volt 3Fe e 3Fe E = -1,32 volt 2Al + 3Fe 2+ 2Al Fe E = +2,00 volt 46. Pada reaksi elektrolisa Larutan NiSO 4 dengan elektroda Ag. Reaksi yang terjadi pada anoda adalah... A. Ni 2+ (aq) + 2e Ni (s) B. Ag (aq) Ag + (aq) + e C. Ni (s) Ni 2+ (aq) + 2e D. 2 H 2 O (l) + 2e H 2 (g) + 2 OH - (aq) E. 2 H 2 O (l) 4 H + (aq) + O 2 (g) + 4e Kunci : E Reaksi Elektrolisis larutan NiSO 4 dengan elektroda Ag NiSO 4 (aq) Ni +2 (aq) + SO -2 4 (aq) Sisa asam dari (SO -2 4, NO - 3, PO -3 4 ) tidak dioksidasi yang mengalami oksidasi adalah pelarut air. Anoda (oksidasi) : 2 H 2 O(aq) 4 H + (aq) + O 2 (g) + 4e 17
18 47. Bilangan-bilangan kuantum yang mungkin dimiliki oleh suatu elektron adalah... A. n = 2, l = 2, m = 0, s = ½ B. n = 3, l = 0, m = +1, s = +½ C. n = 4, l = 2, m = -3, s = +½ D. n = 3, l = 3, m = 0, s = -½ E. n = 2, 1 = 0, m = 0, s = -½ Kunci : E Bilangan kuantum yang mungkin dimiliki oleh suatu elektron adalah : n = 2, 1 = 0, m = 0, s = -½ 48. Konfigurasi elektron unsur X adalah : ls 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 4 Dalam sistem periodik, X terletak pada... A. Golongan VIA periode 4 B. Golongan IVA periode 4 C. Golongan VIB periode 4 Kunci : A Konfigurasi elektron : ls 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 4 Merupakan golongan VIA, periode 4 D. Golongan IVB periode 4 E. Golongan VIIIA periode Gas mulia mempunyai konfigurasi elektron paling stabil. Pernyataan berikut yang tidak sesuai dengan keadaan gas mulia tersebut ialah... A. Di alam selalu dalam keadaan bebas. B. Semua gas mulia tidak dapat dibuat senyawanya. C. Energi ionisasinya terbesar dalam periodenya. D. Semua elektron gas mulia telah berpasangan. E. Makin besar nomor atomnya makin reaktif. Ada beberapa senyawa gas mulia yang dapat dibuat senyawanya. Contoh : PtFe 6, XeF 6 dan KrF 2 Jadi pernyataan yang salah adalah Semua gas mulia tidak dapat dibuat senyawanya. 50. Diketahui potensial reduksi standar unsur-unsur halogen sebagai berikut : F 2 (g) + 2e 2 F - (aq) E = 2,87 volt Cl 2 (g) + 2e 2 Cl - (aq) E = 1,36 volt Br 2 (g) + 2e 2 Br - (aq) E = 1,06 volt I 2 (g) + 2e 2I - (aq) E = 0,54 volt Berdasarkan harga E, reaksi di bawah ini yang tidak berlangsung adalah... A. F 2 + NaCl B. Cl 2 + KBr C. Br 2 + KI D. Br 2 + NaF E. Cl 2 + KI Reaksi : Br 2 + NaF tidak dapat berlangsung karena bernilai negatif. 2 F - (aq) F 2 (g) + 2e E = -2,87 volt Br 2 (g) + 2e 2 Br - (aq) E = 1,06 volt Br 2 (g) + 2 F - (g) 2 Br - (g) + F 2 (g) E = -181 volt 18
19 51. Di.antara senyawa berikut ini yang dapat dipakai sebagai obat pencuci perut adalah... A. KNO 3 B. NaHCO 3 C. Na 2 CO 3 D. MgSO 4. 7 H 2 O E. CaSO 4. 2 H 2 O Magnesium (MgSO 4. 7 H 2 O) sulfat banyak dipakai dalam farmasi, misalnya sebagai obat pembersih perut yang dikenal dengan garam inggris. 52. Data pengamatan logam Na direaksikan dengan air yang ditetesi dengan phenolptalein : - Timbul gas - Terjadi nyala - Timbul letupan - Warna air berubah merah Zat yang dihasilkan adalah... A. Gas H 2 dan gas H 2 O B. Gas O 2 dan gas H 2 C. Gas O 2 dan energi yang besar D. Larutan NaOH dan gas H 2 E. Larutan NaOH dan gas O 2 Logam alkali kalau bereaksi dengan air akan menghasilkan suatu hidroksida dan gas hidrogen. Na(s)+ H 2 O(l) NaOH(aq) + H 2 (g) 53. Reaksi adisi dari propena dengan HBr menghasilkan... A. Propil bromida B. 1 - bromo propana C. 2 - bromo propana D. 2 - dibromo propana E. 3 - bromo propana Kunci : C terpenting dari alkena dan semua senyawa lain yang tidak jenuh adalah reaksi adisi, pada reaksi adisi ikatan rangkap (=) dijenuhkan (-). Adisi HBr pada propena menghasilkan 2-bromo propana CH 2 = CH -CH 3 +HBr CH 3 - CHBr -CH 3 propena 2-bromo propana 54. Tri nitro toluena adalah salah satu turunan benzena yang digunakan untuk... A. Bahan pembuatan detergen B. Bahan antioksidan C. Bahan penyedap D. Bahan pengawet E. Bahan peledak Kunci : E TNT dibuat dari toluen dengan mengganti H pada inti benzen secara bertahap dan digunakan sebagai bahan peledak. 19
20 Tri Nitro Tuluen 55. Senyawa di bawah ini yang menyebabkan lapisan ozon berlubang adalah... A. CCl 4 B. CHCl 3 C. C 2 H 2 Cl 3 F D. C 2 H 4 E. CCl 2 F 2 Kunci : E Freon (-12) merupakan senyawa CFC digunakan sebagai zat pendingin. Sifat Freon-12 sebagai pencemar udara yang membahayakan bumi, karena mudah bereaksi dengan lapisan ozon di atmosfer sehingga membuat atmosfer bumi menjadi berlubang. Senyawa tersebut adalah CCl 2 F Suatu ion kompleks terdiri dan ion pusat Cr 3+, mengikat 4 ligan ion tiosianato dan 2 ligan molekul amoniak. Maka muatan ion kompleks yang benar adalah... A. 3+ B. 2+ C. 1+ Ion pusat Cr 3+ 4 ligan ion tiosinato (SCN - ) 2 ligan molekul amoniak (NH 3 ) [Cr (SCN) 4 (NH 3 ) 2 ] +3 +(- 4) + 0 = -1 D. 1- E Sifat-sifat berikut yang tidak dimiliki oleh logam transisi periode keempat adalah... A. Bersifat paramagnetik B. Dapat membentuk ion kompleks C. Senyawa-senyawanya berwarna Sifat-sifat logam transisi perioda keempat : 1. Memiliki beberapa bilangan oksidasi 2. Mempunyai titik lebur yang tinggi 3. Paramagnetik 4. Membentuk ion kompleks 5. Senyawanya berwarna D. Mempunyai titik lebur yang rendah E. Memiliki beberapa bilangan oksidasi 58. Jika bahan makanan yang mengandung glukosa direaksikan dengan pereaksi Fehling akan menjadi endapan merah bata. Hal ini disebabkan glukosa... A. Mengandung gugus -OH yang dapat mengoksidasi Fehling 20
21 B. Mengandung gugus yang dapat mereduksi Fehling C. Mengandung gugus yang dapat mengoksidasi Fehling D. Mengandung gugus yang dapat mereduksi Fehling. E. Mengandung gugus -NH 2 yang bersifat basa. Glukosa tergolong gula yang mengandung gugus aldehid Adanya gugus aldehid ini, glukosa merupakan gula yang mereduksi, memberikan warna merah bata dari Cu 2 O. + 2 CuO + Cu 2 O 59. Larutan protein dapat bereaksi dengan asam maupun basa. Ini menunjukkan bahwa protein bersifat... A. Kovalen B. Basa lemah C. Asam lemah D. Netral E. Amfoter Kunci : E Asam amino merupakan senyawa amfoter, jadi bersifat basa dalam suasana asam kuat dan bersifat asam dalam suasana basa kuat. 60. Jenis ikatan peptida pada asam amino ditunjukkan oleh adanya struktur... A. D. B. - NH 2 C. E. Kunci : C Ikatan peptida adalah antara gugus amino NH, dari suatu asam amino dan gugus karboksil 21
22 -COOH dari asam amino yang lain, yang disertai dengan pelepasan molekul air. Jenis ikatan peptida mempunyai struktur : 22
Kimia EBTANAS Tahun 2002
 Kimia EBTANAS Tahun 00 EBTANAS-0-0 Pernyataan yang benar tentang unsur, senyawa dan campuran A. unsur merupakan komponen yang tidak dapat dipisahkan B. senyawa adalah zat tunggal yang masih dapat diuraikan
Kimia EBTANAS Tahun 00 EBTANAS-0-0 Pernyataan yang benar tentang unsur, senyawa dan campuran A. unsur merupakan komponen yang tidak dapat dipisahkan B. senyawa adalah zat tunggal yang masih dapat diuraikan
PAKET UJIAN NASIONAL 17 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 17 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
PAKET UJIAN NASIONAL 17 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53
PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53
SIMULASI UJIAN NASIONAL 2
 SIMULASI UJIAN NASIONAL 2. Diketahui nomor atom dan nomor massa dari atom X adalah 29 dan 63. Jumlah proton, elektron, dan neutron dalam ion X 2+ (A) 29, 27, dan 63 (B) 29, 29, dan 34 (C) 29, 27, dan 34
SIMULASI UJIAN NASIONAL 2. Diketahui nomor atom dan nomor massa dari atom X adalah 29 dan 63. Jumlah proton, elektron, dan neutron dalam ion X 2+ (A) 29, 27, dan 63 (B) 29, 29, dan 34 (C) 29, 27, dan 34
PAKET UJIAN NASIONAL 14 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASINAL 14 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
PAKET UJIAN NASINAL 14 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
UN SMA IPA Kimia. Kode Soal 305
 UN SMA IPA Kimia Kode Soal 305 Doc.name : UNSMAIPAKIM305 Version : 2012-12 halaman 1 1. Di antara hal-hal di bawah ini : 1. besi berpilar 2. pagar di cat 3. belerang meleleh 4. nasi jadi basi 5. bel berdering
UN SMA IPA Kimia Kode Soal 305 Doc.name : UNSMAIPAKIM305 Version : 2012-12 halaman 1 1. Di antara hal-hal di bawah ini : 1. besi berpilar 2. pagar di cat 3. belerang meleleh 4. nasi jadi basi 5. bel berdering
SIMULASI UJIAN NASIONAL 1
 SIMULASI UJIAN NASIONAL 1 1. Bilangan-bilangan kuantum yang mungkin dimiliki oleh suatu elektron (A) n = 2, l = 2, m = 0, s = - 1 2 (B) n = 3, l = 0, m = +1, s = + 1 2 (C) n = 4, l = 2, m = - 3, s = -
SIMULASI UJIAN NASIONAL 1 1. Bilangan-bilangan kuantum yang mungkin dimiliki oleh suatu elektron (A) n = 2, l = 2, m = 0, s = - 1 2 (B) n = 3, l = 0, m = +1, s = + 1 2 (C) n = 4, l = 2, m = - 3, s = -
Wardaya College. Tes Simulasi Ujian Nasional SMA Berbasis Komputer. Mata Pelajaran Kimia Tahun Ajaran 2017/2018. Departemen Kimia - Wardaya College
 Tes Simulasi Ujian Nasional SMA Berbasis Komputer Mata Pelajaran Kimia Tahun Ajaran 2017/2018-1. Sebuah unsur X memiliki no massa 52 dan jumlah neutron sebesar 28. Kongurasi elektron dari ion X + adalah...
Tes Simulasi Ujian Nasional SMA Berbasis Komputer Mata Pelajaran Kimia Tahun Ajaran 2017/2018-1. Sebuah unsur X memiliki no massa 52 dan jumlah neutron sebesar 28. Kongurasi elektron dari ion X + adalah...
Berdasarkan data di atas yang merupakan larutan non elektrolit adalah nomor A. 1 B. 2 C. 3 D. 4 E. 5
 PREDIKSI UN 2010 ( semoga soal soal ini ada manfaatnya) 1. Jika diketahui nuklida 11 Na 23, maka jumlah elektron, proton dan neutron adalah A. 23 proton, 12 elektron dan 11 neutron B. 11 proton, 12 elektron
PREDIKSI UN 2010 ( semoga soal soal ini ada manfaatnya) 1. Jika diketahui nuklida 11 Na 23, maka jumlah elektron, proton dan neutron adalah A. 23 proton, 12 elektron dan 11 neutron B. 11 proton, 12 elektron
Volume gas oksigen yang diperlukan pada reaksi tersebut pada keadaan standart adalah. (Mr propana = 44)
 1. Suatu unsut terletak pada periode ke-3 golongan IIIA, konfigurasi elektron unsur tersebut adalah... A. 1s 2 2s 2 2p 1 B. 1s 2 2s 2 2p 6 3s 2 C. 1s 2 2s 2 2p 6 3s 2 3p 1 D. 1s 2 2s 2 2p 6 3d 10 4s 2
1. Suatu unsut terletak pada periode ke-3 golongan IIIA, konfigurasi elektron unsur tersebut adalah... A. 1s 2 2s 2 2p 1 B. 1s 2 2s 2 2p 6 3s 2 C. 1s 2 2s 2 2p 6 3s 2 3p 1 D. 1s 2 2s 2 2p 6 3d 10 4s 2
UJIAN AKHIR NASIONAL (UAN) SMA Hari :... Tanggal :.../.../2008. Mulai :... Selesai :...
 UJIAN AKHIR NASIONAL (UAN) SMA 2008 Mata Pelajaran : K I M I A Hari :... Tanggal :.../.../2008 Mulai :... Selesai :... Lamanya Jumlah soal : 120 menit : 45 butir PETUNJUK UMUM: 1. Berdoalah sebelum mengerjakan
UJIAN AKHIR NASIONAL (UAN) SMA 2008 Mata Pelajaran : K I M I A Hari :... Tanggal :.../.../2008 Mulai :... Selesai :... Lamanya Jumlah soal : 120 menit : 45 butir PETUNJUK UMUM: 1. Berdoalah sebelum mengerjakan
PERSIAPAN UJIAN NASIONAL 2011 SMA MAARIF NU PANDAAN TAHUN PELAJARAN
 PERSIAPAN UJIAN NASIONAL 2011 SMA MAARIF NU PANDAAN TAHUN PELAJARAN 2010-2011 Mata Pelajaran : Kimia Hari/Tanggal : Minggu, 10 Mei 2011 Waktu : 120 menit 1. Perhatikan beberapa perubahan materi berikut!
PERSIAPAN UJIAN NASIONAL 2011 SMA MAARIF NU PANDAAN TAHUN PELAJARAN 2010-2011 Mata Pelajaran : Kimia Hari/Tanggal : Minggu, 10 Mei 2011 Waktu : 120 menit 1. Perhatikan beberapa perubahan materi berikut!
UN SMA 2015 PRE Kimia
 UN SMA 2015 PRE Kimia Kode Soal Doc. UNSMAIPA2015KIM999 Doc. Version : 2015-11 halaman 1 01. Suatu unsur Z mempunyai konfigurasi elektron [Ar]4s 2 3d 7. Jika neutron unsur tersebut 32, letak unsur Z dalam
UN SMA 2015 PRE Kimia Kode Soal Doc. UNSMAIPA2015KIM999 Doc. Version : 2015-11 halaman 1 01. Suatu unsur Z mempunyai konfigurasi elektron [Ar]4s 2 3d 7. Jika neutron unsur tersebut 32, letak unsur Z dalam
TRY OUT UJIAN NASIONAL TAHUN AJARAN 2008 / 2009
 TRY UT UJIAN NASINAL TAHUN AJARAN 2008 / 2009 LEMBAR SAL B Bidang Studi : KIMIA Kelas/Program : XII (Dua Belas)/IPA PETUNJUK UMUM 1. Berdo alah sebelum mengerjakan soal 2. Tulislah dahulu nama dan kelas
TRY UT UJIAN NASINAL TAHUN AJARAN 2008 / 2009 LEMBAR SAL B Bidang Studi : KIMIA Kelas/Program : XII (Dua Belas)/IPA PETUNJUK UMUM 1. Berdo alah sebelum mengerjakan soal 2. Tulislah dahulu nama dan kelas
PAKET UJIAN NASIONAL 9 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 9 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Isotop terdiri dari A. 13 proton, 14 elektron dan 27
PAKET UJIAN NASIONAL 9 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Isotop terdiri dari A. 13 proton, 14 elektron dan 27
D. 8 mol S E. 4 mol Fe(OH) 3 C. 6 mol S Kunci : B Penyelesaian : Reaksi :
 1. Perhatikan reaksi, 2 Fe 2 S 3 + 3O 2 + 6 H 2 O 4 Fe(OH) 3 + 6S Jika 2 mol Fe 2 S 3, 2 mol O 2 dan 3 mol H 2 O bereaksi dengan sempurna, akan dihasilkan : A. 3 mol Fe(OH) 3 B. 2 mol Fe(OH) 3 D. 8 mol
1. Perhatikan reaksi, 2 Fe 2 S 3 + 3O 2 + 6 H 2 O 4 Fe(OH) 3 + 6S Jika 2 mol Fe 2 S 3, 2 mol O 2 dan 3 mol H 2 O bereaksi dengan sempurna, akan dihasilkan : A. 3 mol Fe(OH) 3 B. 2 mol Fe(OH) 3 D. 8 mol
D. beta dan alfa E. alfa dan beta
 1. Pada peluruhan menjadi kemudian meluruh menjadi, partikel-partikel yang dipancarkan berturut-turut adalah... A. foton dan beta B. foton dan alfa C. beta dan foton Reaksi peluruhan : D. beta dan alfa
1. Pada peluruhan menjadi kemudian meluruh menjadi, partikel-partikel yang dipancarkan berturut-turut adalah... A. foton dan beta B. foton dan alfa C. beta dan foton Reaksi peluruhan : D. beta dan alfa
D. golongan IIIA perioda 4 E. golongan VIA perioda 5
 1. Isotop terdiri dari... A. 13 proton, 14 elektron dan 27 neutron B. 13 proton, 13 elektron dan 27 neutron C. 13 proton, 13 elektron dan 14 neutron D. 14 proton, 14 elektron dan 13 neutron E. 27 proton,
1. Isotop terdiri dari... A. 13 proton, 14 elektron dan 27 neutron B. 13 proton, 13 elektron dan 27 neutron C. 13 proton, 13 elektron dan 14 neutron D. 14 proton, 14 elektron dan 13 neutron E. 27 proton,
Kimia EBTANAS Tahun 2003
 Kimia EBTANAS Tahun 003 EBTANAS-03-0 Di antara perubahan berikut ini yang termasuk perubahan kimia adalah A. tebu menjadi gula B. beras menjadi tepung C. minyak wangi menguap D. singkong menjadi tape E.
Kimia EBTANAS Tahun 003 EBTANAS-03-0 Di antara perubahan berikut ini yang termasuk perubahan kimia adalah A. tebu menjadi gula B. beras menjadi tepung C. minyak wangi menguap D. singkong menjadi tape E.
SIMULASI UJIAN NASIONAL 3
 SIMULASI UJIAN NASIONAL 3 1. Diketahui: H, Li, Be, O, F, Ne, Na, Mg, 1 3 4 8 9 10 11 12 Ar, 18 36 Kr Kelompok unsur atau ion berikut yang mempunyai konfigurasi elektron yang sama (A) O 2-, F -, Ne (D)
SIMULASI UJIAN NASIONAL 3 1. Diketahui: H, Li, Be, O, F, Ne, Na, Mg, 1 3 4 8 9 10 11 12 Ar, 18 36 Kr Kelompok unsur atau ion berikut yang mempunyai konfigurasi elektron yang sama (A) O 2-, F -, Ne (D)
PAKET UJIAN NASIONAL 7 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 7 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Dari beberapa unsur berikut yang mengandung : 1. 20
PAKET UJIAN NASIONAL 7 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Dari beberapa unsur berikut yang mengandung : 1. 20
LATIHAN ULANGAN TENGAH SEMESTER 2
 Pilihlah jawaban yang paling benar LATIHAN ULANGAN TENGAH SEMESTER 2 TATANAMA 1. Nama senyawa berikut ini sesuai dengan rumus kimianya, kecuali. A. NO = nitrogen oksida B. CO 2 = karbon dioksida C. PCl
Pilihlah jawaban yang paling benar LATIHAN ULANGAN TENGAH SEMESTER 2 TATANAMA 1. Nama senyawa berikut ini sesuai dengan rumus kimianya, kecuali. A. NO = nitrogen oksida B. CO 2 = karbon dioksida C. PCl
PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP FAX KODE POS 60299
 PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP. 031-8415492 FAX 031-8430673 KODE POS 60299 ULANGAN AKHIR SEMESTER 2 (DUA) TAHUN PELAJARAN 2011 2012 Hari/Tanggal :
PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP. 031-8415492 FAX 031-8430673 KODE POS 60299 ULANGAN AKHIR SEMESTER 2 (DUA) TAHUN PELAJARAN 2011 2012 Hari/Tanggal :
D. 3 dan 4 E. 1 dan 5
 1. Dari beberapa unsur berikut yang mengandung : 1. 20 elektron dan 20 netron 2. 10 elektron dan 12 netron 3. 15 proton dan 16 netron 4. 20 netron dan 19 proton 5. 12 proton dan 12 netron Yang memiliki
1. Dari beberapa unsur berikut yang mengandung : 1. 20 elektron dan 20 netron 2. 10 elektron dan 12 netron 3. 15 proton dan 16 netron 4. 20 netron dan 19 proton 5. 12 proton dan 12 netron Yang memiliki
Kimia Ujian Nasional Tahun 2004
 Kimia Ujian Nasional Tahun 2004 UNAS-04-01 Perhatikan perubahan-perubahan materi berikut : 1. singkong jadi tape 2. lilin mencair 3. susu menjadi basi perubahan yang berlangsung secara kimiawi A. 1, 2,
Kimia Ujian Nasional Tahun 2004 UNAS-04-01 Perhatikan perubahan-perubahan materi berikut : 1. singkong jadi tape 2. lilin mencair 3. susu menjadi basi perubahan yang berlangsung secara kimiawi A. 1, 2,
D. 4,50 x 10-8 E. 1,35 x 10-8
 1. Pada suatu suhu tertentu, kelarutan PbI 2 dalam air adalah 1,5 x 10-3 mol/liter. Berdasarkan itu maka Kp PbI 2 adalah... A. 4,50 x 10-9 B. 3,37 x 10-9 C. 6,75 x 10-8 S : PbI 2 = 1,5. 10-3 mol/liter
1. Pada suatu suhu tertentu, kelarutan PbI 2 dalam air adalah 1,5 x 10-3 mol/liter. Berdasarkan itu maka Kp PbI 2 adalah... A. 4,50 x 10-9 B. 3,37 x 10-9 C. 6,75 x 10-8 S : PbI 2 = 1,5. 10-3 mol/liter
PAKET UJIAN NASIONAL 11 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 11 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Unsur dengan nomor massa 45 dan mempunyai jumlah netron
PAKET UJIAN NASIONAL 11 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Unsur dengan nomor massa 45 dan mempunyai jumlah netron
Doc. Name: UNSMAIPA999KIM304 Doc. Version : (A) +2 (B) +3 (C) +4 (D) +5 (E) +7
 UN SA IPA Kimia Kode Soal 304 Doc. Name: UNSAIPA999KI304 Doc. Version : 2012-12 halaman 1 01. Perhatikan perubahan berikut : 1) petasan meledak 2) garaam melarut 3) kayu melapuk 4) susu menjadi asam 5)
UN SA IPA Kimia Kode Soal 304 Doc. Name: UNSAIPA999KI304 Doc. Version : 2012-12 halaman 1 01. Perhatikan perubahan berikut : 1) petasan meledak 2) garaam melarut 3) kayu melapuk 4) susu menjadi asam 5)
PAKET UJIAN NASIONAL 6 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 6 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Elektron ditemukan oleh. A. J.J. Thomson D. Henri Becquerel
PAKET UJIAN NASIONAL 6 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Elektron ditemukan oleh. A. J.J. Thomson D. Henri Becquerel
KONSEP MOL DAN STOIKIOMETRI
 BAB V KONSEP MOL DAN STOIKIOMETRI Dalam ilmu fisika, dikenal satuan mol untuk besaran jumlah zat. Dalam bab ini, akan dibahas mengenai konsep mol yang mendasari perhitungan kimia (stoikiometri). A. KONSEP
BAB V KONSEP MOL DAN STOIKIOMETRI Dalam ilmu fisika, dikenal satuan mol untuk besaran jumlah zat. Dalam bab ini, akan dibahas mengenai konsep mol yang mendasari perhitungan kimia (stoikiometri). A. KONSEP
PAKET UJIAN NASIONAL 15 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 15 Pelajaran : KIMIA Waktu : 10 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. Elektron ditemukan oleh. A. J.J. Thomson D. Henri
PAKET UJIAN NASIONAL 15 Pelajaran : KIMIA Waktu : 10 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. Elektron ditemukan oleh. A. J.J. Thomson D. Henri
TES AWAL II KIMIA DASAR II (KI-112)
 TES AWAL II KIMIA DASAR II (KI112) NAMA : Tanda Tangan N I M : JURUSAN :... BERBAGAI DATA. Tetapan gas R = 0,082 L atm mol 1 K 1 = 1,987 kal mol 1 K 1 = 8,314 J mol 1 K 1 Tetapan Avogadro = 6,023 x 10
TES AWAL II KIMIA DASAR II (KI112) NAMA : Tanda Tangan N I M : JURUSAN :... BERBAGAI DATA. Tetapan gas R = 0,082 L atm mol 1 K 1 = 1,987 kal mol 1 K 1 = 8,314 J mol 1 K 1 Tetapan Avogadro = 6,023 x 10
PAKET UJIAN NASIONAL 16 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 16 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. 27 Isotop 13 Al terdiri dari... A. 13 proton,14 elektron
PAKET UJIAN NASIONAL 16 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. 27 Isotop 13 Al terdiri dari... A. 13 proton,14 elektron
LARUTAN ELEKTROLIT DAN NON ELEKTROLIT
 BAB 6 LARUTAN ELEKTROLIT DAN NON ELEKTROLIT Standar Kompetensi Memahami sifat-sifat larutan non elektrolit dan elektrolit, serta reaksi oksidasi-reduksi Kompetensi Dasar Mengidentifikasi sifat larutan
BAB 6 LARUTAN ELEKTROLIT DAN NON ELEKTROLIT Standar Kompetensi Memahami sifat-sifat larutan non elektrolit dan elektrolit, serta reaksi oksidasi-reduksi Kompetensi Dasar Mengidentifikasi sifat larutan
1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat!
 Petunjuk : 1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat! 2. Soal Teori ini terdiri dari dua bagian: A. 30 soal pilihan Ganda : 60 poin B. 5 Nomor
Petunjuk : 1. Isilah Biodata anda dengan lengkap (di lembar Jawaban) Tulis dengan huruf cetak dan jangan disingkat! 2. Soal Teori ini terdiri dari dua bagian: A. 30 soal pilihan Ganda : 60 poin B. 5 Nomor
D. 2 dan 3 E. 2 dan 5
 1. Pada suhu dan tekanan sama, 40 ml P 2 tepat habis bereaksi dengan 100 ml, Q 2 menghasilkan 40 ml gas PxOy. Harga x dan y adalah... A. 1 dan 2 B. 1 dan 3 C. 1 dan 5 Kunci : E D. 2 dan 3 E. 2 dan 5 Persamaan
1. Pada suhu dan tekanan sama, 40 ml P 2 tepat habis bereaksi dengan 100 ml, Q 2 menghasilkan 40 ml gas PxOy. Harga x dan y adalah... A. 1 dan 2 B. 1 dan 3 C. 1 dan 5 Kunci : E D. 2 dan 3 E. 2 dan 5 Persamaan
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A. D. Cu E. Zn
 1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
PAKET UJIAN NASIONAL 5 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 5 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Unsur klor dengan nomor atom 17 dan nomor massa 35
PAKET UJIAN NASIONAL 5 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Unsur klor dengan nomor atom 17 dan nomor massa 35
Evaluasi Belajar Tahap Akhir K I M I A Tahun 2005
 Evaluasi Belajar Tahap Akhir K I M I A Tahun 2005 UN-SMK-05-01 Perhatikan perubahan materi yang terjadi di bawah ini: (1) sampah membusuk (2) fotosintesis (3) fermentasi (4) bensin menguap (5) air membeku
Evaluasi Belajar Tahap Akhir K I M I A Tahun 2005 UN-SMK-05-01 Perhatikan perubahan materi yang terjadi di bawah ini: (1) sampah membusuk (2) fotosintesis (3) fermentasi (4) bensin menguap (5) air membeku
PREDIKSI UJIAN NASIONAL 2011 KIMIA
 Soal PREDIKSI Latihan UJIAN NASIONAL 2011 2013 KIMIA 1 LATIHAN UJIAN AKHIR NASIONAL TAHUN AJARAN 2012/2013 KIMIA 1. Jika unsur 19 X berikatan dengan unsur 35 Z maka, rumus senyawa dan jenis ikatan yang
Soal PREDIKSI Latihan UJIAN NASIONAL 2011 2013 KIMIA 1 LATIHAN UJIAN AKHIR NASIONAL TAHUN AJARAN 2012/2013 KIMIA 1. Jika unsur 19 X berikatan dengan unsur 35 Z maka, rumus senyawa dan jenis ikatan yang
SOAL UN DAN PENYELESAIANNYA 2007
 1. Isotop terdiri dari... A. 13 proton, 14 elektron dan 27 neutron B. 13 proton, 13 elektron dan 27 neutron C. 13 proton, 13 elektron dan 14 neutron D. 14 proton, 14 elektron dan 13 neutron E. 27 proton,
1. Isotop terdiri dari... A. 13 proton, 14 elektron dan 27 neutron B. 13 proton, 13 elektron dan 27 neutron C. 13 proton, 13 elektron dan 14 neutron D. 14 proton, 14 elektron dan 13 neutron E. 27 proton,
PAKET UJIAN NASIONAL Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. 70 Konfigurasi electron dari unsur 1 Ga adalah. A. 2
PAKET UJIAN NASIONAL Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. 70 Konfigurasi electron dari unsur 1 Ga adalah. A. 2
Ujian Akhir Sekolah Tahun 2006 Kimia
 Ujian Akhir Sekolah Tahun 2006 Kimia UAS-05-01 Perhatikan perubahan-perubahan berikut: 1. warna kain memudar 2. es mencair 3. air dipanaskan 4. susu menggumpal 5. singkong menjadi tape Perubahan yang berlangsung
Ujian Akhir Sekolah Tahun 2006 Kimia UAS-05-01 Perhatikan perubahan-perubahan berikut: 1. warna kain memudar 2. es mencair 3. air dipanaskan 4. susu menggumpal 5. singkong menjadi tape Perubahan yang berlangsung
Try Out UN 2011 paket 61
 Try Out UN 2011 paket 61 1. Unsur Y pada tabel sistem periodik terletak pada periode ke-1 golongan I A dan unsur X terletak pada periode ke-2 golongan VA, keduanya saling berikatan. Rumus senyawa dan jenis
Try Out UN 2011 paket 61 1. Unsur Y pada tabel sistem periodik terletak pada periode ke-1 golongan I A dan unsur X terletak pada periode ke-2 golongan VA, keduanya saling berikatan. Rumus senyawa dan jenis
OAL TES SEMESTER I. I. Pilihlah jawaban yang paling tepat! a. 2d d. 3p b. 2p e. 3s c. 3d 6. Unsur X dengan nomor atom
 KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
a. Ion c. Molekul senyawa e. Campuran b. Molekul unsur d. Unsur a. Air c. Kuningan e. Perunggu b. Gula d. Besi
 A. PILIHAN GANDA 1. Molekul oksigen atau O2 merupakan lambang dari partikel a. Ion c. Molekul senyawa e. Campuran b. Molekul unsur d. Unsur 2. Di antara zat berikut yang merupakan unsur ialah... a. Air
A. PILIHAN GANDA 1. Molekul oksigen atau O2 merupakan lambang dari partikel a. Ion c. Molekul senyawa e. Campuran b. Molekul unsur d. Unsur 2. Di antara zat berikut yang merupakan unsur ialah... a. Air
PAKET UJIAN NASIONAL 13 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 3 Pelajaran : KIMIA Waktu : 0 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah.. Elektron ditemukan oleh. A. J.J. Thomson B. Henri Becquerel
PAKET UJIAN NASIONAL 3 Pelajaran : KIMIA Waktu : 0 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah.. Elektron ditemukan oleh. A. J.J. Thomson B. Henri Becquerel
SKL- 3: LARUTAN. Ringkasan Materi. 1. Konsep Asam basa menurut Arrhenius. 2. Konsep Asam-Basa Bronsted dan Lowry
 SKL- 3: LARUTAN 3 Menjelaskan sifat-sifat larutan, metode pengukuran dan terapannya. o Menganalisis data daya hantar listrik beberapa larutan o Mendeskripsikan konsep ph larutan o Menghitung konsentrasi
SKL- 3: LARUTAN 3 Menjelaskan sifat-sifat larutan, metode pengukuran dan terapannya. o Menganalisis data daya hantar listrik beberapa larutan o Mendeskripsikan konsep ph larutan o Menghitung konsentrasi
SOAL KIMIA 2 KELAS : XI IPA
 SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
KIMIA 2 KELAS X. D. molekul-molekul kovalen yang bereaksi dengan air E. molekul-molekul kovalen yang bergerak bebas di dalam air
 KIMIA 2 KELAS X PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja 3. Kerjakanlah soal anda pada lembar jawaban
KIMIA 2 KELAS X PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja 3. Kerjakanlah soal anda pada lembar jawaban
UN SMA 2012 IPA Kimia
 UN SMA 2012 IPA Kimia Kode Soal Doc. Name: UNSMAIPA2011KIM999 Doc. Version : 2012-12 halaman 1 01. Tahap awal pembuatan asam nitrat dalam industri melibatkan reaksi oksidasi ammonia yang menghasilkan nitrogen
UN SMA 2012 IPA Kimia Kode Soal Doc. Name: UNSMAIPA2011KIM999 Doc. Version : 2012-12 halaman 1 01. Tahap awal pembuatan asam nitrat dalam industri melibatkan reaksi oksidasi ammonia yang menghasilkan nitrogen
UJIAN SEKOLAH KOTA METRO 2012
 UJIAN SEKOLAH KOTA METRO 2012 1. Diberikan notasi beberapa unsur sebagai berikut : 9Q 19, 11R 23, 14T 28, 17X 35, 38Z 87 Pasangan yang merupakan unsur-unsur yang terdapat dalam satu golongan pada sistem
UJIAN SEKOLAH KOTA METRO 2012 1. Diberikan notasi beberapa unsur sebagai berikut : 9Q 19, 11R 23, 14T 28, 17X 35, 38Z 87 Pasangan yang merupakan unsur-unsur yang terdapat dalam satu golongan pada sistem
LATIHAN SOAL KIMIA KELAS XII
 LATIHAN SOAL KIMIA KELAS XII 1. Suatu larutan diperoleh dari melarutkan 6 gram urea (Mr= 60) dalam 1 liter air. Larutan yang lain diperoleh dari melarutkan 18 gram glukosa (Mr = 180) dalam 1 liter air.
LATIHAN SOAL KIMIA KELAS XII 1. Suatu larutan diperoleh dari melarutkan 6 gram urea (Mr= 60) dalam 1 liter air. Larutan yang lain diperoleh dari melarutkan 18 gram glukosa (Mr = 180) dalam 1 liter air.
Kimia EBTANAS Tahun 2000
 Kimia EBTANAS Tahun 2000 EBTANAS-00-01 Seorang siswa mencampurkan dua zat kimia. Diantara pernyataan di bawah ini yang tidak menunjukkan telah terjadi reaksi kimia adalah A. timbul gas B. terjadi endapan
Kimia EBTANAS Tahun 2000 EBTANAS-00-01 Seorang siswa mencampurkan dua zat kimia. Diantara pernyataan di bawah ini yang tidak menunjukkan telah terjadi reaksi kimia adalah A. timbul gas B. terjadi endapan
UN SMA 2012 IPA Kimia
 UN SMA 0 IPA Kimia Kode Konten Doc. UNSMAIPA0KIM999 Doc. Version : 0- halaman 0. Dua buah unsur dengan notasi 7X dan Y. Jika unsur-unsur tersebut berikatan, bentuk molekul dan kepolaran yang terjadi berturutturut
UN SMA 0 IPA Kimia Kode Konten Doc. UNSMAIPA0KIM999 Doc. Version : 0- halaman 0. Dua buah unsur dengan notasi 7X dan Y. Jika unsur-unsur tersebut berikatan, bentuk molekul dan kepolaran yang terjadi berturutturut
Kimia Ebtanas Tahun 1988
 Kimia Ebtanas Tahun 988 EBTANAS-88-0 Zat-zat dibawah ini tergolong unsur, kecuali A. besi B. emas C. nikrom D. belerang E. kalium EBTANAS-88-0 Didalam rumus senyawa K CO terdapat A. atom K, atom C, atom
Kimia Ebtanas Tahun 988 EBTANAS-88-0 Zat-zat dibawah ini tergolong unsur, kecuali A. besi B. emas C. nikrom D. belerang E. kalium EBTANAS-88-0 Didalam rumus senyawa K CO terdapat A. atom K, atom C, atom
PR ONLINE MATA UJIAN : KIMIA (KODE: A06)
 PR ONLINE MATA UJIAN : KIMIA (KODE: A06) 1. Diketahui atom suatu unsur mempunyai notasi 60 27P, maka konfigurasi elektron ion P 3+ (A) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 7 4s 2. (B) 1s 2 2s 2 2p 6 3s 2 3p 6 3d
PR ONLINE MATA UJIAN : KIMIA (KODE: A06) 1. Diketahui atom suatu unsur mempunyai notasi 60 27P, maka konfigurasi elektron ion P 3+ (A) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 7 4s 2. (B) 1s 2 2s 2 2p 6 3s 2 3p 6 3d
Struktur atom, dan Tabel periodik unsur,
 KISI-KISI PENULISAN USBN Jenis Sekolah : SMA/MA Mata Pelajaran : KIMIA Kurikulum : 2006 Alokasi Waktu : 120 menit Jumlah : Pilihan Ganda : 35 Essay : 5 1 2 3 1.1. Memahami struktur atom berdasarkan teori
KISI-KISI PENULISAN USBN Jenis Sekolah : SMA/MA Mata Pelajaran : KIMIA Kurikulum : 2006 Alokasi Waktu : 120 menit Jumlah : Pilihan Ganda : 35 Essay : 5 1 2 3 1.1. Memahami struktur atom berdasarkan teori
Antiremed Kelas 10 KIMIA
 Antiremed Kelas 10 KIMIA Persiapan UAS 1 Kimia Doc Name: AR10KIM01UAS Version : 2016-07 halaman 1 01. Partikel berikut yang muatannya sebesar 19 1,6 10 C dan bermassa 1 sma (A) elektron (B) proton (C)
Antiremed Kelas 10 KIMIA Persiapan UAS 1 Kimia Doc Name: AR10KIM01UAS Version : 2016-07 halaman 1 01. Partikel berikut yang muatannya sebesar 19 1,6 10 C dan bermassa 1 sma (A) elektron (B) proton (C)
Ujian Akhir Tahun 2006 Kimia
 Ujian Akhir Tahun 006 Kimia UAS-06-01 Suatu atom X memiliki maasa atom relatif 35 dan 18 neutron. Atom X dalam system periodik terletak pada A. golongan IA perioda 3 B. golongan IV A perioda 4 C. golongan
Ujian Akhir Tahun 006 Kimia UAS-06-01 Suatu atom X memiliki maasa atom relatif 35 dan 18 neutron. Atom X dalam system periodik terletak pada A. golongan IA perioda 3 B. golongan IV A perioda 4 C. golongan
MODUL KIMIA SMA IPA Kelas 10
 SMA IPA Kelas 0 A. Massa Atom. Massa Atom Relatif (Ar) Massa atom relatif (Ar) merupakan perbandingan massa atom dengan massa satu atom yang tetap. Secara matematis dapat dirumuskan sebagai berikut. sma
SMA IPA Kelas 0 A. Massa Atom. Massa Atom Relatif (Ar) Massa atom relatif (Ar) merupakan perbandingan massa atom dengan massa satu atom yang tetap. Secara matematis dapat dirumuskan sebagai berikut. sma
PREDIKSI 2. Ikatan kovalen koordinat dan ikatan kovalen berturut-turut adalah... A. 1 dan 2 B. 1 dan 3 C. 2 dan 3 D. 3 dan 4 E.
 PREDIKSI 2 Pilihlah jawaban yang paling tepat! 1. Perhatikan gambar struktur Lewis senyawa NH 4 Cl sebagai berikut; Ikatan kovalen koordinat dan ikatan kovalen berturut-turut adalah... A. 1 dan 2 B. 1
PREDIKSI 2 Pilihlah jawaban yang paling tepat! 1. Perhatikan gambar struktur Lewis senyawa NH 4 Cl sebagai berikut; Ikatan kovalen koordinat dan ikatan kovalen berturut-turut adalah... A. 1 dan 2 B. 1
Pembahasan Soal-soal Try Out Neutron, Sabtu tanggal 16 Oktober 2010
 Pembahasan Soal-soal Try Out Neutron, Sabtu tanggal 16 Oktober 2010 26. Diketahui lambing unsur Fe, maka jumlah p +, e - dan n o dalam ion Fe 3+ adalah.... Jawab :, Fe 3+ + 3e - Fe [ 18 Ar] 4s 2 3d 6 [
Pembahasan Soal-soal Try Out Neutron, Sabtu tanggal 16 Oktober 2010 26. Diketahui lambing unsur Fe, maka jumlah p +, e - dan n o dalam ion Fe 3+ adalah.... Jawab :, Fe 3+ + 3e - Fe [ 18 Ar] 4s 2 3d 6 [
SOAL UJIAN AKHIR SEMESTER 2 KIMIA KELAS X (SEPULUH) TP. 2008/2009
 SOAL UJIAN AKHIR SEMESTER 2 KIMIA KELAS X (SEPULUH) TP. 2008/2009 1. Dari suatu percobaan daya hantar listrik suatu larutan diperoleh data sebagai berikut: Percobaan Larutan Lampu Gelembung gas 1 2 3 4
SOAL UJIAN AKHIR SEMESTER 2 KIMIA KELAS X (SEPULUH) TP. 2008/2009 1. Dari suatu percobaan daya hantar listrik suatu larutan diperoleh data sebagai berikut: Percobaan Larutan Lampu Gelembung gas 1 2 3 4
OLIMPIADE KIMIA INDONESIA
 OLIMPIADE KIMIA INDONESIA OLIMPIADE SAINS NASIONAL SELEKSI KABUPATEN / KOTA UjianTeori Waktu 2 Jam Departemen Pendidikan Nasional Direktorat Jenderal Managemen Pendidikan Dasar dan Menengah Direktorat
OLIMPIADE KIMIA INDONESIA OLIMPIADE SAINS NASIONAL SELEKSI KABUPATEN / KOTA UjianTeori Waktu 2 Jam Departemen Pendidikan Nasional Direktorat Jenderal Managemen Pendidikan Dasar dan Menengah Direktorat
KIMIA IPA SMA/MA 1 E49
 1 E49 1. Atom A memiliki nomor atom 19 dan atom B memiliki nomor atom 11. Pernyataan di bawah ini yang benar mengenai dua atom tersebut adalah... A. atom A memiliki jari-jari lebih besar dari atom B B.
1 E49 1. Atom A memiliki nomor atom 19 dan atom B memiliki nomor atom 11. Pernyataan di bawah ini yang benar mengenai dua atom tersebut adalah... A. atom A memiliki jari-jari lebih besar dari atom B B.
2. Pada senyawa berikut yang mengandung jumlah atom paling banyak terdapat pada... A. CO(NH 2 ) 2 B. Ca(NO 3 ) 2 C. Pb(NO 3 ) 2
 1. Dalam 200 mg contoh bahan terdapat 25 mg perak dan 10 mg emas. Presentase perak dan emas berturut-turut dalam batuan tersebut adalah... A. 5 % dan 12.5 % B. 10 % dan 25 % C. 12,5 % dan 5 % 25 mg Perak
1. Dalam 200 mg contoh bahan terdapat 25 mg perak dan 10 mg emas. Presentase perak dan emas berturut-turut dalam batuan tersebut adalah... A. 5 % dan 12.5 % B. 10 % dan 25 % C. 12,5 % dan 5 % 25 mg Perak
1. Perhatikan struktur senyawa berikut!
 . Perhatikan struktur senyawa berikut! CH CH CH CH CH CH CH Jumlah atom C primer, atom C sekunder, dan atom C tersier dari senyawa di atas adalah...,, dan D.,, dan,, dan E.,, dan,, dan. Di bawah ini merupakan
. Perhatikan struktur senyawa berikut! CH CH CH CH CH CH CH Jumlah atom C primer, atom C sekunder, dan atom C tersier dari senyawa di atas adalah...,, dan D.,, dan,, dan E.,, dan,, dan. Di bawah ini merupakan
D. 3, 4, dan 5 E. 1, 4, dan 5
 1. Perhatikan perubahan berikut : 1) petasan meledak 4) susu menjadi asam 2) garam melarut 5) belerang meleleh 3) kayu melapuk Yang merupakan perubahan kimia adalah... A. 1, 2, dan 3 B. 2, 3, dan 4 C.
1. Perhatikan perubahan berikut : 1) petasan meledak 4) susu menjadi asam 2) garam melarut 5) belerang meleleh 3) kayu melapuk Yang merupakan perubahan kimia adalah... A. 1, 2, dan 3 B. 2, 3, dan 4 C.
D kj/mol E kj/mol
 1. Dari data : 2H 2 (g) + O 2 (g) 2H 2 O (l) H = -571 kj 2Ca (s) + O 2 (g) 2CaO(s) H = -1269 kj CaO (s) + H 2 O (l) Ca(OH)2(s) H = -64 kj Dapat dihitung entalpi pembentukan Ca(OH) 2 (s) sebesar... A. -984
1. Dari data : 2H 2 (g) + O 2 (g) 2H 2 O (l) H = -571 kj 2Ca (s) + O 2 (g) 2CaO(s) H = -1269 kj CaO (s) + H 2 O (l) Ca(OH)2(s) H = -64 kj Dapat dihitung entalpi pembentukan Ca(OH) 2 (s) sebesar... A. -984
KISI-KISI PENULISAN SOAL USBN
 KISI-KISI PENULISAN USBN Jenis Sekolah : SMA/MA Mata Pelajaran : KIMIA Kurikulum : 2013 Alokasi Waktu : 120 menit Jumlah : Pilihan Ganda : 35 Essay : 5 1 2 3 4 3.4 Menganalisis hubungan konfigurasi elektron
KISI-KISI PENULISAN USBN Jenis Sekolah : SMA/MA Mata Pelajaran : KIMIA Kurikulum : 2013 Alokasi Waktu : 120 menit Jumlah : Pilihan Ganda : 35 Essay : 5 1 2 3 4 3.4 Menganalisis hubungan konfigurasi elektron
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA JAWABAN (DOKUMEN NEGARA) UjianTeori. Waktu: 100 menit
 OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA JAWABAN (DOKUMEN NEGARA) UjianTeori Waktu: 100 menit Kementerian Pendidikan Nasional Dan Kebudayaan Direktorat Jenderal Managemen Pendidikan Dasar
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA JAWABAN (DOKUMEN NEGARA) UjianTeori Waktu: 100 menit Kementerian Pendidikan Nasional Dan Kebudayaan Direktorat Jenderal Managemen Pendidikan Dasar
UN SMA IPA 2009 Kimia
 UN SMA IPA 009 Kimia Kode Soal P88 Doc. Version : 011-06 halaman 1 01. Perhatikan tabel data fisik dan daya hantar larutan beberapa senyawa berikut: Senyawa Titik Leleh Daya Hantar Listrik Larutan L M
UN SMA IPA 009 Kimia Kode Soal P88 Doc. Version : 011-06 halaman 1 01. Perhatikan tabel data fisik dan daya hantar larutan beberapa senyawa berikut: Senyawa Titik Leleh Daya Hantar Listrik Larutan L M
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: HUKUM-HUKUM DASAR KIMIA Di soal diketahui dan ditanya: m (NH 2 ) 2 CO = 12.000 ton/tahun (pabrik) m N 2 = ton/tahun?
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: HUKUM-HUKUM DASAR KIMIA Di soal diketahui dan ditanya: m (NH 2 ) 2 CO = 12.000 ton/tahun (pabrik) m N 2 = ton/tahun?
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: TERMOKIMIA Pada soal diketahui dan ditanya: ΔH c C 2 H 5 OH = -1380 kj/mol ΔH d C 6 H 12 O 6 = -60 kj/mol ΔH c C
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: TERMOKIMIA Pada soal diketahui dan ditanya: ΔH c C 2 H 5 OH = -1380 kj/mol ΔH d C 6 H 12 O 6 = -60 kj/mol ΔH c C
OLIMPIADE KIMIA INDONESIA
 OLIMPIADE KIMIA INDONESIA OLIMPIADE SAINS NASIONAL SELEKSI KABUPATEN / KOTA UjianTeori Waktu 2 Jam Departemen Pendidikan Nasional Direktorat Jenderal Managemen Pendidikan Dasar dan Menengah Direktorat
OLIMPIADE KIMIA INDONESIA OLIMPIADE SAINS NASIONAL SELEKSI KABUPATEN / KOTA UjianTeori Waktu 2 Jam Departemen Pendidikan Nasional Direktorat Jenderal Managemen Pendidikan Dasar dan Menengah Direktorat
2. Konfigurasi elektron dua buah unsur tidak sebenarnya:
 . Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
. Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
D. penyulingan E. kromatografi
 1. Seorang siswa mencampur dua zat kimia. Di antara pernyataan di bawah ini. Yang tidak menunjukkan telah terjadi reaksi kimia adalah... A. timbul gas B. terjadi endapan C. perubahan suhu Ciri-ciri terjadinya
1. Seorang siswa mencampur dua zat kimia. Di antara pernyataan di bawah ini. Yang tidak menunjukkan telah terjadi reaksi kimia adalah... A. timbul gas B. terjadi endapan C. perubahan suhu Ciri-ciri terjadinya
PAKET UJIAN NASIONAL 12 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 12 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. Wacana berikut digunakan untuk mengerjakan soal nomor
PAKET UJIAN NASIONAL 12 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. Wacana berikut digunakan untuk mengerjakan soal nomor
Kimia UMPTN Tahun 1981
 Kimia UMPTN Tahun 1981 UMPTN-81-51 Suatu atom unsury mempunyai susunan elektron : 1s s p 6 3s 3p 5. Unsur tersebut adalah A. logam alkali B. unsur halogen C. salah satu unsur golongan V D. belerang E.
Kimia UMPTN Tahun 1981 UMPTN-81-51 Suatu atom unsury mempunyai susunan elektron : 1s s p 6 3s 3p 5. Unsur tersebut adalah A. logam alkali B. unsur halogen C. salah satu unsur golongan V D. belerang E.
Persiapan UN 2018 KIMIA
 Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
PREDIKSI UAN KIMIA 2009 Sesuai Kisi-Kisi Pemerintah
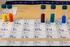 PREDIKSI UAN KIMIA 2009 Sesuai Kisi-Kisi Pemerintah 24 19 1. Diketahui unsur 12 X dan 9 Y. Jika keduanya membentuk senyawa, maka muatan X dan Y adalah. a. X = 2, Y = -2 b. X = 2, Y = -1 c. X = 1, Y = -2
PREDIKSI UAN KIMIA 2009 Sesuai Kisi-Kisi Pemerintah 24 19 1. Diketahui unsur 12 X dan 9 Y. Jika keduanya membentuk senyawa, maka muatan X dan Y adalah. a. X = 2, Y = -2 b. X = 2, Y = -1 c. X = 1, Y = -2
PEMERINTAH KABUPATEN BANYUMAS DINAS PENDIDIKAN SMA NEGERI PATIKRAJA Jalan Adipura 3 Patikraja Telp (0281) Banyumas 53171
 PEMERINTAH KABUPATEN BANYUMAS DINAS PENDIDIKAN SMA NEGERI PATIKRAJA Jalan Adipura 3 Patikraja Telp (0281) 6844576 Banyumas 53171 ULANGAN KENAIKAN KELAS TAHUN PELAJARAN 2010/ 2011 Mata Pelajaran : Kimia
PEMERINTAH KABUPATEN BANYUMAS DINAS PENDIDIKAN SMA NEGERI PATIKRAJA Jalan Adipura 3 Patikraja Telp (0281) 6844576 Banyumas 53171 ULANGAN KENAIKAN KELAS TAHUN PELAJARAN 2010/ 2011 Mata Pelajaran : Kimia
 PEMBAHASAN UJIAN NASIONAL TAHUN PELAJARAN 2009/2010 Mata Pelajaran : Kimia Tanggal : 26 Maret 2010 Kode Soal : D14 / P 12 1. Jawab : B = 11 elektron :[Ne] 3s 1 X +1 = 16 elektron : [Ne] 3s 2 3p 4 Z 2 berikatan
PEMBAHASAN UJIAN NASIONAL TAHUN PELAJARAN 2009/2010 Mata Pelajaran : Kimia Tanggal : 26 Maret 2010 Kode Soal : D14 / P 12 1. Jawab : B = 11 elektron :[Ne] 3s 1 X +1 = 16 elektron : [Ne] 3s 2 3p 4 Z 2 berikatan
 TRY OUT SELEKSI OLIMPIADE TINGKAT KABUPATEN/KOTA 2010 TIM OLIMPIADE KIMIA INDONESIA 2011 Waktu: 150 Menit PUSAT KLINIK PENDIDIKAN INDONESIA (PKPI) bekerjasama dengan LEMBAGA BIMBINGAN BELAJAR SSCIntersolusi
TRY OUT SELEKSI OLIMPIADE TINGKAT KABUPATEN/KOTA 2010 TIM OLIMPIADE KIMIA INDONESIA 2011 Waktu: 150 Menit PUSAT KLINIK PENDIDIKAN INDONESIA (PKPI) bekerjasama dengan LEMBAGA BIMBINGAN BELAJAR SSCIntersolusi
D. 50 E. 64. D. -1,40 kj E. -2,80 kj
 1. Atom-atom unsur tertentu mempunyai 16 elektron. Atom atom unsur lain dengan sifat-sifat yang mirip adalah yang mempunyai jumlah elektron : A. 10 B. 24 C. 34 D. 50 E. 64 Bila suatu atom mempunyai 16
1. Atom-atom unsur tertentu mempunyai 16 elektron. Atom atom unsur lain dengan sifat-sifat yang mirip adalah yang mempunyai jumlah elektron : A. 10 B. 24 C. 34 D. 50 E. 64 Bila suatu atom mempunyai 16
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
Rangkuman Materi Larutan Elektrolit dan Non elektrolit
 Rangkuman Materi Larutan Elektrolit dan Non elektrolit LARUTAN ELEKTROLIT DAN LARUTAN NON ELEKTROLIT LARUTAN ELEKTROLIT 1. Pengertian Larutan Elektrolit Larutan elektrolit adalah larutan yang dapat menghantarkan
Rangkuman Materi Larutan Elektrolit dan Non elektrolit LARUTAN ELEKTROLIT DAN LARUTAN NON ELEKTROLIT LARUTAN ELEKTROLIT 1. Pengertian Larutan Elektrolit Larutan elektrolit adalah larutan yang dapat menghantarkan
LEMBARAN SOAL 10. Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : X ( SEPULUH) Pilihlah jawaban yang paling tepat.
 LEMBARAN SOAL 10 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : X ( SEPULUH) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan
LEMBARAN SOAL 10 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : X ( SEPULUH) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan
PAKET UJIAN NASIONAL 1 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 1 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Unsur X dengan konfigurasi electron 1S 2 2S 2 2p 6
PAKET UJIAN NASIONAL 1 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Unsur X dengan konfigurasi electron 1S 2 2S 2 2p 6
Review II. 1. Pada elektrolisis larutan NaCl dengan elektroda karbon, reaksi yang terjadi pada katoda adalah... A. 2H 2
 KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 14 Sesi NGAN Review II A. ELEKTROLISIS 1. Pada elektrolisis larutan NaCl dengan elektroda karbon, reaksi yang terjadi pada katoda adalah... A. 2H 2 O 4H + + O 2
KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 14 Sesi NGAN Review II A. ELEKTROLISIS 1. Pada elektrolisis larutan NaCl dengan elektroda karbon, reaksi yang terjadi pada katoda adalah... A. 2H 2 O 4H + + O 2
Kimia EBTANAS Tahun 1998
 Kimia EBTANAS Tahun 998 EBTANAS980 Diantara perubahan berikut:. besi berkarat. lilin menyala. iodium menyublim. bensin terbakar. emas melebur yang termasuk perubahan kimia A.,, B.,, C.,, D.,, E.,, EBTANAS980
Kimia EBTANAS Tahun 998 EBTANAS980 Diantara perubahan berikut:. besi berkarat. lilin menyala. iodium menyublim. bensin terbakar. emas melebur yang termasuk perubahan kimia A.,, B.,, C.,, D.,, E.,, EBTANAS980
SOAL DAN KUNCI JAWABAN LARUTAN ELEKTROLIT DAN NON ELEKTROLIT
 SOAL DAN KUNCI JAWABAN LARUTAN ELEKTROLIT DAN NON ELEKTROLIT SOAL DAN KUNCI JAWABAN LARUTAN ELEKTROLIT DAN NON ELEKTROLIT 1. Pernyataan yang benar tentang elektrolit adalah. A. Elektrolit adalah zat yang
SOAL DAN KUNCI JAWABAN LARUTAN ELEKTROLIT DAN NON ELEKTROLIT SOAL DAN KUNCI JAWABAN LARUTAN ELEKTROLIT DAN NON ELEKTROLIT 1. Pernyataan yang benar tentang elektrolit adalah. A. Elektrolit adalah zat yang
OAL TES SEMESTER II. I. Pilihlah jawaban yang paling tepat!
 KIMIA XI SMA 217 S OAL TES SEMESTER II I. Pilihlah jawaban yang paling tepat! 1. Basa menurut Arhenius adalah senyawa yang bila dilarutkan dalam air akan menghasilkan a. proton d. ion H b. elektron e.
KIMIA XI SMA 217 S OAL TES SEMESTER II I. Pilihlah jawaban yang paling tepat! 1. Basa menurut Arhenius adalah senyawa yang bila dilarutkan dalam air akan menghasilkan a. proton d. ion H b. elektron e.
UJIAN NASIONAL Wacana berikut diberikan untuk mengerjakan soal nomor 1 s.d. 3. Dua buah unsur memiliki notasi: X dan 12
 UJIAN NASIONAL 008 Wacana berikut diberikan untuk mengerjakan soal nomor 1 s.d.. Dua buah unsur memiliki notasi: 4 5, X dan 175 1 1. Diagram orbital yang paling tepat untuk elektron terakhir dari unsur
UJIAN NASIONAL 008 Wacana berikut diberikan untuk mengerjakan soal nomor 1 s.d.. Dua buah unsur memiliki notasi: 4 5, X dan 175 1 1. Diagram orbital yang paling tepat untuk elektron terakhir dari unsur
Soal UN Kimia Tahun 2013 dan Pembahasannya
 Soal UN Kimia Tahun 2013 dan Pembahasannya 1. Perhatikan rumus struktur Lewis senyawa NH 4 Cl berikut: Ikatan kovalen koordinasi pada gambar tersebut ditunjukkan nomor... (Nomor atom N = 7; H = 1; Cl =
Soal UN Kimia Tahun 2013 dan Pembahasannya 1. Perhatikan rumus struktur Lewis senyawa NH 4 Cl berikut: Ikatan kovalen koordinasi pada gambar tersebut ditunjukkan nomor... (Nomor atom N = 7; H = 1; Cl =
OAL TES SEMESTER II. I. Pilihlah jawaban yang paling tepat!
 176 KIMIA X SMA S AL TES SEMESTER II I. Pilihlah jawaban yang paling tepat! 1. Suatu zat padat dilarutkan dalam air, ternyata larutannya dapat menghantarkan arus listrik. Pernyataan yang benar tentang
176 KIMIA X SMA S AL TES SEMESTER II I. Pilihlah jawaban yang paling tepat! 1. Suatu zat padat dilarutkan dalam air, ternyata larutannya dapat menghantarkan arus listrik. Pernyataan yang benar tentang
LEMBARAN SOAL 5. Pilih satu jawaban yang benar!
 LEMBARAN SOAL 5 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
LEMBARAN SOAL 5 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2015 Page 1 1. MATERI: STOIKIOMETRI Persen massa adalah persentase massa zat terlarut dalam 100 gram massa larutan (massa pelarut + massa
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2015 Page 1 1. MATERI: STOIKIOMETRI Persen massa adalah persentase massa zat terlarut dalam 100 gram massa larutan (massa pelarut + massa
Pembahasan Soal Multiplechoice OSK Kimia Tahun 2014 Oleh Urip
 Pembahasan Soal Multiplechoice OSK Kimia Tahun 2014 Oleh Urip Kalteng @ http://urip.wordpress.com Dengan senang hati jika ada yang mau mengoreksi pembahasan ini A. Pilih jawaban yang paling tepat ( 25
Pembahasan Soal Multiplechoice OSK Kimia Tahun 2014 Oleh Urip Kalteng @ http://urip.wordpress.com Dengan senang hati jika ada yang mau mengoreksi pembahasan ini A. Pilih jawaban yang paling tepat ( 25
