Bahasan. Senyawa Koordinasi. Bahasan. 1. Teori Werner tentang Senyawa Koordinasi : Tinjauan Ulang. Irwansyah, M.Si
|
|
|
- Shinta Sasmita
- 7 tahun lalu
- Tontonan:
Transkripsi
1 Bahasan Ion Kompleks dan 1 Teori Werner tentang Senyawa koordinasi : Tinjauan Ulang 2 Ligan 3 Tatanama 4 Isomerisasi 5 Ikatan dalam Ion Kompleks : Teori Medan Kristal 6 Sifat Magnet dan Teori Medan Kristal 7 Warna Senyawa Kompleks Bahasan 8 Aspek Kesetimbangan Ion Kompleks 9 Reaksi Asam-Basa Ion Kompleks 10 Tatanama 11 Aplikasi Kimia Koordinasi Fokus Warna pada batu permata 1. Teori Werner tentang : Tinjauan Ulang Senyawa tersusun dari senyawa sederhana yang disebut senyawa koordinasi. CoCl 3 and NH 3. CoCl 3 (NH 3 ) 6 dan CoCl 3 (NH 3 ) 5. Reaktivitas yang berbeda terhadap AgNO 3.
2 Teori Werner Bilangan Koordinasi Dua jenis valensi atau Kapasitas Ikatan. Valensi Primer. Berdasarkan jumlah e - suatu atom yang hilang ketika membentuk ion. Valensi Sekunder. Berhubungan dengan ikatan dengan gugus lain, (ligands) pada atom pusat. [Co(NH 3 ) 6 ]Cl 3 [Co(NH 3 ) 6 ] Cl - [CoCl(NH 3 ) 5 ]Cl 2 [CoCl(NH 3 ) 5 ] Cl - Contoh 1 : Contoh 1: Hubungan rumus Kompleks dengan Bilangan Koordinasi dan Bilangan Oksidasi Atom Pusat. Muatan pada atom pusat: Berapakah bilangan koordinasi dan bilangan oksidasi Co dalam ion kompleks [CoCl(NO + 2 )(NH 3 ) 4 ]? Jawab: Kompleks memiliki ligan: 1Cl, 1 NO 2 2, 4 NH 3 Bilangan Koordinasi : 6
3 2. Ligan Table 25.2 Some Common Monodentate Ligands. Ligand adalah dlhbasa Lewis. Mendonorkan pasangan elektron kepada atom pusat (Asam Lewis). Ligand Monodentat. Menggunakan satu pasang elektron untuk membentuk satu titik pengikatan pada atom pusat. Ligand Bidentat. Menggunakan dua pasang elektron untuk membentuk dua titik ikatan pada atom pusat. Tridentat, tetradentat..polidentat Tabel : Beberapa Ligan Polidentat (Agen Pengkelat) Etilen Diamina
4 3. Tata Nama Tata Nama Dalam penamaan dan menuliskan rumus senyawa kompleks, kation ditulis lebih awal, diikuti anion. Anion sebagai ligan ditulis dengan akhiran o. Biasanya : ida menjadi o. ita menjadi ito. at menjadi ato. Ligan molekul netral umumnya tidak mengalami perubahan Jumlah hligan didahului ioleh lhawalan (prefix). Mono, di, tri, tetra, penta, hexa Jika nama ligan merupakan nama komposit Tempatkan nama dalam kurung dan diawali prefix: Bis, tris, tetrakis, pentakis... Tata Nama Tata Nama Nama ligan lebih awal,(berdasarkan abjad), diikuti nama atom pusat. Prefixes diabaikan dalam pengurutan abjad Bilangan Oksidasi atom pusat ditulis dengan angka Romawi. Jika kompleks merupakan anion diberi akhiran ate pada nama atom pusat. Apabila menuliskan rumus Simbol kimia atom pusat ditulis lebih awal, Diikuti rumus anion, Berdasarkan abjad. Dan kemudian rumus molekul netral, Berdasarkan abjad.
5 4. Isomerisasi Contoh Keisomeran Isomer. Berbeda dalam struktur and sifat. Isomer Struktural. Berbeda pada struktur dasar. Stereoisomer. Same number and type of ligands with the same mode of attachement. Differ in the way the ligands occupy space around the metal ion. Isomer Ionisasi [CrSO 4 (NH 3 ) 5 ]Cl [CrCl(NH 3 ) 5 ]SO 4 pentaaminsulfatochromium(iii) chloride Isomer Koordinasi [Co(NH 3 ) 6 ][CrCN 6 ] hexaaminecobalt(iii) hexacyanochromate(iii) pentaaminchlorochromium(iii) sulfate [Cr(NH 3 ) 6 ][CoCN 6 ] hexaaminechromium(iii) hexacyanocobaltate(iii) Isomer Ikatan Isomer Geometri
6 Isomer Geometri Isomer Optik Isomer Optik Bayangan Cermin
7 Aktivitas Optik 5. Ikatan dalam Ion Kompleks: Teori Medan Kristal Menganggap ikatan dalam Kompleks merupakan tarikan elektrostatik antara suatu inti muatan positif dan elektron pada ligand. Elektron pada atom pusat menolak elektron ligan. Fokus pada elektron d atom pusat. dextrorotatory d- levorotatory l- Kompleks Oktahedral dan Energi Orbital-d Konfigurasi Elektron pada Orbital d P Δ Hund s rule Δ > P pairing energy considerations Δ < P Spin rendah d 4 Spin tinggi d 4
8 Deret Spektrokimia Ligan Medan Kuat dan Lemah Large Δ Ligan Medan Kuat Dua Kompleks d 6 : CN - > NO 2- > en > py NH 3 > EDTA 4- > SCN - > H 2 O > ONO - > ox 2- > OH - > F - > SCN - > Cl - > Br - > I - Small Δ Ligan Medan Lemah Efek Energi pada Sistem d 10 Medan Kristal Tetrahedral
9 Medan Kristal Square Planar 6. Sifat Magnet dan Teori Medan Kristal Paramagnetism illustrated: Contoh 4: Menggunakan Deret Spectrokimia untuk Memprediksi Sifat Magnet. Berapa elektron tunggal yang anda perkirakan dalam kompleks oktahedral [Fe(CN) 3-6 ]? Jawab: Fe [Ar]3d 6 4s 2 Fe 3+ [Ar]3d 5 Contoh 5 : Menggunakan Teori Medan Kristal untuk Memprediksi Struktur Kompleks dari Sifat Magnet. Ion Kompleks[Ni(CN 4 )] 2- diamagnetik. Gunakan teori medan kristal untuk menentukan strukturnya. Jawab : Bilangan koordinasi 4 jadi oktahedral compleks tidak mungkin. Kompleks tetrahedral atau square planar. Gambar diagram level energi dan isi orbital dengan e -. Pertimbangkan sifat magnet.
10 Contoh 5 : 7. Warna Kompleks Tetrahedral: Square planar: Warna Pi Primer : Merah (R), hijau (G) dan biru (B). Warna Sekunder: Dihasilkan dari pencampuran warna primer. Warna Komplementer: Warna sekunder merupakan komplemen warna primer. Cyan (C), yellow (Y) and magenta (M) Penambahan suatu warna dan komplemennya menghasilkan warna putih. Warna Kompleks
11 Efek Ligan terhadap warna Senyawa Koordinasi Table 25.5 Some Coordination Compounds of Cr 3+ and Their Colors 8. Aspek Kesetimbangan Ion Kompleks Zn 2+ (aq) + 4 NH 3 (aq) [Zn(NH 3 ) 4 ] 2+ (aq) = [[Zn(NH 3) 4 ] 2+ ] K = f [Zn 2+ ][NH 3 ] Pertukaran ligan merupakan proses bertahap dari ion yang terhidasi: Step 1: [Zn(H 2 O) 2+ (aq) + NH 3 (aq) [Zn(H O) (NH ] (q) 3( 2 3 3)] (aq) (q) + H 2 O(aq) (q) [[Zn(H 2O) 3 (NH 3 )] 2+ ] K = = [[Zn(H2 O) 4 ] 2+ ][NH 3 ] = β Step 2: 8. Aspek Kesetimbangan Ion Kompleks [Zn(H 2 O) 3 (NH 3 )] 2+ (aq) + NH 3 (aq) [Zn(H 2 O) 2 (NH 3 ) 2 ] 2+ (aq) + H 2 O(aq) [[Zn(H 2+ 2 O) 2 (NH 3 ) 2 ] ] K 2 = [[Zn(H 2 O) 3 (NH 3 )] 2+ ][NH 3 ] = Kombinasi step 1 dan 2: [Zn(H 2 O) 4 ] 2+ (aq) + 2 NH 3 (aq) [Zn(H 2 O) 2 (NH 3 ) 2 ] 2+ (aq) + 2 H 2 O(aq) [[Zn(H 2 O) 2 (NH 3 ) 2 ] 2+ ] K = β = [[Zn(H2 O) 4 ] 2+ ][NH 3 ] = K 2 1 K 2 =
12 Aspek Kesetimbangan Ion Kompleks 9. Reaksi Asam-Basa Ion Kompleks β 4 = K 1 x K 2 x K 3 x K 4 = K f [Fe(H 2 O) 6 ] 3+ (aq) + H 2 O(aq) [Fe(H 2 O) 5 (OH)] 2+ (aq) + H 3 O + (aq) K a1 = 9x10-4 [Fe(H 2 O) 5 (OH)] 2+ (aq) + H 2 O(aq) [Fe(H 2 O) 4 (OH) 2 ] 2+ (aq) + H 3 O + (aq) K a2 = 5x10-4 cepat 10. Aspek Kinetik [Cu(H 2 O) 4 ] NH 3 [Cu(NH 3 ) 4 ] H 2 O cepat [Cu(H 2+ +4Cl O) 4 ] [Cu(Cl) 4 ] +4H 2 O Hidrat 11. Aplikasi Kimia Koordinasi Kristal sering berada dalam bentuk terhidrat. Sejumlah tertentu molekul air per satuan rumus. Air disebut sebagai labile ligan. Reaksi lambat (sering dimonitor melalui perubahan warna) disebabkan oleh non-labile ligan.
13 Kestabilan Bilangan Oksidasi Kation Sequestering Co 3+ (aq) + e - Co 2+ (aq) E =+182V tetranatrium EDTA 4C Co 3+ (aq)+2 H 4C )+4 2 O(l) Co 2+ (aq) H + +O( 2 (g) E cell = V tetapi: Co 3+ (aq) + NH 2+ 45x (aq) [Co(NH 3 ) 6 ] (aq) K f = 4.5x10 dan [Co(NH 3 ) 6 ] 3+ (aq) + e - [Co(NH 3 ) 6 ] 2+ (aq) E = V Kation Sequestering Aplikasi Pada Sistem Biologi Log β : 10.6 (Ca 2+ ), 18.3 (Pb 2+ ), 24.6 (Fe 3+ ). porphyrin chlorophyl a
14 Warna pada Gemstones Emerald 3BeO Al 2 O 3 6SiO 2 + Cr 3+ in Al 3+ sites Ruby Al 2 O 3 + Cr 3+ in Al 3+ sites
Senyawa Koordinasi (senyawa kompleks)
 Senyawa Koordinasi (senyawa kompleks) Salah satu keistimewaan logam transisi adalah dapat membentuk senyawa klompeks, yaitu senyawa yang paling sedikit terdiri dari satu ion kompleks (terdiri dari kation
Senyawa Koordinasi (senyawa kompleks) Salah satu keistimewaan logam transisi adalah dapat membentuk senyawa klompeks, yaitu senyawa yang paling sedikit terdiri dari satu ion kompleks (terdiri dari kation
SENYAWA KOORDINASI Putri Anjarsari, S.Si., M.Pd
 SENYAWA KOORDINASI Putri Anjarsari, S.Si., M.Pd putri_anjarsari@uny.ac.id Pengertian Senyawa Koordinasi Senyawa koordinasi adalah senyawa yang mengandung satu atau lebih ion kompleks dengan sejumlah kecil
SENYAWA KOORDINASI Putri Anjarsari, S.Si., M.Pd putri_anjarsari@uny.ac.id Pengertian Senyawa Koordinasi Senyawa koordinasi adalah senyawa yang mengandung satu atau lebih ion kompleks dengan sejumlah kecil
8.4 Senyawa Kompleks
 8.4 Senyawa Kompleks Alfred Werner (1866-1919): kelompok baru senyawa logam transisi yang terdiri dari ion logam transisi (LT) yang dikelilingi oleh ion atau molekul yang lain. Ion atau molekul yang terikat
8.4 Senyawa Kompleks Alfred Werner (1866-1919): kelompok baru senyawa logam transisi yang terdiri dari ion logam transisi (LT) yang dikelilingi oleh ion atau molekul yang lain. Ion atau molekul yang terikat
1.1 Senyawa Koordinasi (Coordination Coumpond)
 1.1 Senyawa Koordinasi (Coordination Coumpond) Sifat yang paling khas pada logam transisi adalah tentang persenyawaan dan ikatannya. Yang biasa disebut dengan ion kompleks. Ion kompleks sendiri terdiri
1.1 Senyawa Koordinasi (Coordination Coumpond) Sifat yang paling khas pada logam transisi adalah tentang persenyawaan dan ikatannya. Yang biasa disebut dengan ion kompleks. Ion kompleks sendiri terdiri
Senyawa Koordinasi. Ion kompleks memiliki ciri khas yaitu bilangan koordinasi, geometri, dan donor atom:
 Senyawa Koordinasi Terdiri dari atom pusat (kation logam transisi), ligan(molekul yang terikat pada ion kompleks) dan di netralkan dengan bilangan koordinasi. Dari gambar [Co(NH 3 )6]CI 3, 6 molekul NH3
Senyawa Koordinasi Terdiri dari atom pusat (kation logam transisi), ligan(molekul yang terikat pada ion kompleks) dan di netralkan dengan bilangan koordinasi. Dari gambar [Co(NH 3 )6]CI 3, 6 molekul NH3
Bab 11 Senyawa Koordinasi
 Bab 11 http://chem.fmipa.ipb.ac.id Cisplatin (cis-pt(nh 3 ) 2 Cl 2 ) Cisplatin menghancurkan sel kanker untuk bereproduksi dengan mengubah konfigurasi DNAnya 1 Ikthisar Sumber: Chang Bab 20 1 Kimia Logam
Bab 11 http://chem.fmipa.ipb.ac.id Cisplatin (cis-pt(nh 3 ) 2 Cl 2 ) Cisplatin menghancurkan sel kanker untuk bereproduksi dengan mengubah konfigurasi DNAnya 1 Ikthisar Sumber: Chang Bab 20 1 Kimia Logam
Senyawa Koordinasi. Kompleks ion dengan pusat d B memiliki empat ligan dengan dengan bentuk persegi planar (B)
 Senyawa Koordinasi Aspek umum dari logam transisi adalah pembentukan dari senyawa koordinasi (kompleks). Senyawa koordinasi ini setidaknya memiliki satu ion kompleks yang terdiri dari logam kation yang
Senyawa Koordinasi Aspek umum dari logam transisi adalah pembentukan dari senyawa koordinasi (kompleks). Senyawa koordinasi ini setidaknya memiliki satu ion kompleks yang terdiri dari logam kation yang
SENYAWA KOMPLEKS. Definisi. Ion Kompleks. Bilangan koordinasi, geometri, dan ligan RINGKASAN MATERI
 KIMIA ANORGANIK 14 OKTOBER 2012 RINGKASAN MATERI SENYAWA KOMPLEKS Definisi Senyawa kompleks itu: Ada ion logam sebagai atom pusat Ada ligan yang berupa anion atau molekul netral Memiliki counter ion supaya
KIMIA ANORGANIK 14 OKTOBER 2012 RINGKASAN MATERI SENYAWA KOMPLEKS Definisi Senyawa kompleks itu: Ada ion logam sebagai atom pusat Ada ligan yang berupa anion atau molekul netral Memiliki counter ion supaya
Kimia Koordinasi SOAL LATIHAN. Jawab soal sudah tersedia. Selesaikan soalnya, dan pelajari mengapa dipilih jawaban tersebut
 Kimia Koordinasi SOAL LATIHAN Jawab soal sudah tersedia. Selesaikan soalnya, dan pelajari mengapa dipilih jawaban tersebut 1. Suatu logam nickel dapat ditulis sebagai [Ar] 4s 2 3d 8, manakah representasi
Kimia Koordinasi SOAL LATIHAN Jawab soal sudah tersedia. Selesaikan soalnya, dan pelajari mengapa dipilih jawaban tersebut 1. Suatu logam nickel dapat ditulis sebagai [Ar] 4s 2 3d 8, manakah representasi
COORDINATION COMPOUND. Disusun oleh : Bintang Ayu Kalimantini NIM : KELAS D 10.30
 COORDINATION COMPOUND Disusun oleh : Bintang Ayu Kalimantini NIM : 21030112120019 KELAS D 10.30 S enyawa kompleks ditemukan sekitar tahun 1890an oleh Alfred Werner. Senyawa kompleks terdiri dari setidaknya
COORDINATION COMPOUND Disusun oleh : Bintang Ayu Kalimantini NIM : 21030112120019 KELAS D 10.30 S enyawa kompleks ditemukan sekitar tahun 1890an oleh Alfred Werner. Senyawa kompleks terdiri dari setidaknya
Kegiatan Belajar 4 Kimia Unsur. Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada materi Kimia Unsur.
 1 Kegiatan Belajar 4 Kimia Unsur Capaian Pembelajaran Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada materi Kimia Unsur. Subcapaian pembelajaran: 1. Menjelaskan sifat unsur golongan
1 Kegiatan Belajar 4 Kimia Unsur Capaian Pembelajaran Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada materi Kimia Unsur. Subcapaian pembelajaran: 1. Menjelaskan sifat unsur golongan
SENYAWA KOORDINASI Ion kompleks: Angka koordinasi, Geometri, dan Ligan
 SENYAWA KOORDINASI Keistimewaan dari ilmu kimia peralihan logam adalah rumus dari senyawa koordinasi (kompleks). Ada unsur yang berisi paling sedikit satu ion kompleks, yang terdiri dari satu atom pusat
SENYAWA KOORDINASI Keistimewaan dari ilmu kimia peralihan logam adalah rumus dari senyawa koordinasi (kompleks). Ada unsur yang berisi paling sedikit satu ion kompleks, yang terdiri dari satu atom pusat
MODUL VI KIMIA KOORDINASI
 MODUL VI KIMIA KOORDINASI I. Petunjuk Umum 1. Kompetensi Dasar 1) Mahasiswa memahami definisi senyawa komplek 2) Mahasiswa memahami Teori Koordinasi Werner 3) Mahasiswa memahami jenis-jenis ligan 4) Mahasiswa
MODUL VI KIMIA KOORDINASI I. Petunjuk Umum 1. Kompetensi Dasar 1) Mahasiswa memahami definisi senyawa komplek 2) Mahasiswa memahami Teori Koordinasi Werner 3) Mahasiswa memahami jenis-jenis ligan 4) Mahasiswa
Bilangankoordinasi, bentukgeometri, danligandarisenyawakompleks
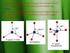 Senyawakoordinasi Senyawa koordinasi (coordination coumpounds) yang disebut juga kompleks adalah senyawa yang memiliki paling sedikit satu ion kompleks dengan kation sebagai pusat kompleks dan anion sebagailigan
Senyawakoordinasi Senyawa koordinasi (coordination coumpounds) yang disebut juga kompleks adalah senyawa yang memiliki paling sedikit satu ion kompleks dengan kation sebagai pusat kompleks dan anion sebagailigan
Kimia Koordinasi Teori Ikatan Valensi
 Kimia Koordinasi Teori Ikatan Valensi Beberapa teori telah dirumuskan untuk menjelaskan ikatan dalam senyawaan koordinasi dan untuk merasionalisasi serta meramalkan sifat-sifatnya: teori ikatan valensi,
Kimia Koordinasi Teori Ikatan Valensi Beberapa teori telah dirumuskan untuk menjelaskan ikatan dalam senyawaan koordinasi dan untuk merasionalisasi serta meramalkan sifat-sifatnya: teori ikatan valensi,
I. PENDAHULUAN. Kualitas udara yang dipergunakan untuk kehidupan tergantung dari lingkungannya. Udara
 I. PENDAHULUAN 1.1 Latar Belakang Masalah Kualitas udara yang dipergunakan untuk kehidupan tergantung dari lingkungannya. Udara mengandung sejumlah oksigen, yang merupakan komponen esensial bagi kehidupan,
I. PENDAHULUAN 1.1 Latar Belakang Masalah Kualitas udara yang dipergunakan untuk kehidupan tergantung dari lingkungannya. Udara mengandung sejumlah oksigen, yang merupakan komponen esensial bagi kehidupan,
OLIMPIADE NASIONAL MATEMATIKA DAN ILMU PENGETAHUAN ALAM TINGKAT PERGURUAN TINGGI (ONMIPA-PT) Bidang Kimia Sub bidang Kimia Anorganik
 OLIMPIADE NASIONAL MATEMATIKA DAN ILMU PENGETAHUAN ALAM TINGKAT PERGURUAN TINGGI (ONMIPA-PT) 2017 Bidang Kimia Sub bidang Kimia Anorganik 16 Mei 2017 Waktu : 120 menit Petunjuk Pengerjaan 1. Tes ini berlangsung
OLIMPIADE NASIONAL MATEMATIKA DAN ILMU PENGETAHUAN ALAM TINGKAT PERGURUAN TINGGI (ONMIPA-PT) 2017 Bidang Kimia Sub bidang Kimia Anorganik 16 Mei 2017 Waktu : 120 menit Petunjuk Pengerjaan 1. Tes ini berlangsung
I. PENDAHULUAN. Pencemaran udara adalah masuknya, atau tercampurnya unsur-unsur berbahaya ke dalam
 I. PENDAHULUAN 1.1 Latar Belakang Masalah Pencemaran udara adalah masuknya, atau tercampurnya unsur-unsur berbahaya ke dalam atmosfir yang dapat mengakibatkan terjadinya kerusakan lingkungan, gangguan
I. PENDAHULUAN 1.1 Latar Belakang Masalah Pencemaran udara adalah masuknya, atau tercampurnya unsur-unsur berbahaya ke dalam atmosfir yang dapat mengakibatkan terjadinya kerusakan lingkungan, gangguan
7) Diketahui 20 X dan 35 Y. Jika keduanya berikatan, tentukan: a. Jenis ikatannya? ikatan ion b. rumus senyawa yang terbentuk. c.
 Ikatan Kimia 1. Di antara spesi berikut yang memiliki konfigurasi stabil adalah : 1) 11 Na + (stabil) 2) 18 X (stabil) 3) 17 Y (stabil) 4) 20 Ca (tidak stabil) 5) 35 Br stabil) Tulis formula elektron masing-masing
Ikatan Kimia 1. Di antara spesi berikut yang memiliki konfigurasi stabil adalah : 1) 11 Na + (stabil) 2) 18 X (stabil) 3) 17 Y (stabil) 4) 20 Ca (tidak stabil) 5) 35 Br stabil) Tulis formula elektron masing-masing
Teori medan kristal adalah model yang hampir secara menyeluruh menggantikan teori ikatan valensi, pertama kali dimunculkan oleh Hans Bethe pada 1929.
 Teori Medan Kristal Teori medan kristal adalah model yang hampir secara menyeluruh menggantikan teori ikatan valensi, pertama kali dimunculkan oleh Hans Bethe pada 1929. Pada mulanya merupakan model yang
Teori Medan Kristal Teori medan kristal adalah model yang hampir secara menyeluruh menggantikan teori ikatan valensi, pertama kali dimunculkan oleh Hans Bethe pada 1929. Pada mulanya merupakan model yang
Ikatan Kimia. 2 Klasifikasi Ikatan Kimia :
 Ikatan Kimia Ikatan Kimia : Gaya tarik yang menyebabkan atom-atom yang terikat satu sama lain dalam suatu kombinasi untuk membentuk senyawa yang lebih kompleks. 2 Klasifikasi Ikatan Kimia : 1. Ikatan ion
Ikatan Kimia Ikatan Kimia : Gaya tarik yang menyebabkan atom-atom yang terikat satu sama lain dalam suatu kombinasi untuk membentuk senyawa yang lebih kompleks. 2 Klasifikasi Ikatan Kimia : 1. Ikatan ion
~ gaya tarik antar atom yang pemutusan atau pembentukannya dapat menyebabkan terjadinya perubahan kimia.
 1. Ikatan Kimia Struktur Molekul 1.1 Pengertian ~ gaya tarik antar atom yang pemutusan atau pembentukannya dapat menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang
1. Ikatan Kimia Struktur Molekul 1.1 Pengertian ~ gaya tarik antar atom yang pemutusan atau pembentukannya dapat menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang
1. Ikatan Kimia. Struktur Molekul. 1.1 Pengertian. 1.2 Macam-Macam. ~ gaya tarik antar atom
 1. Ikatan Kimia 1.1 Pengertian ~ gaya tarik antar atom Struktur Molekul 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang terbentuk akibat tarik-menarik elektrostatik antara ion positif (kation) dan ion
1. Ikatan Kimia 1.1 Pengertian ~ gaya tarik antar atom Struktur Molekul 1.2 Macam-Macam 1. Ikatan Ion: ikatan kimia yang terbentuk akibat tarik-menarik elektrostatik antara ion positif (kation) dan ion
KIMIA. Sesi KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA. a. Sifat Umum
 KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 12 Sesi NGAN KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA Keteraturan sifat keperiodikan unsur dalam satu periode dapat diamati pada unsur-unsur periode
KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 12 Sesi NGAN KIMIA UNSUR (BAGIAN IV) A. UNSUR-UNSUR PERIODE KETIGA Keteraturan sifat keperiodikan unsur dalam satu periode dapat diamati pada unsur-unsur periode
Ikatan Kimia. Ikatan kimia adalah gaya tarik antar atom yang pemutusan atau pembentukannya menyebabkan terjadinya perubahan kimia.
 Ikatan Kimia 1. Ikatan Kimia 1.1 Pengertian Ikatan kimia adalah gaya tarik antar atom yang pemutusan atau pembentukannya menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam Ikatan Kimia Ikatan Ion:
Ikatan Kimia 1. Ikatan Kimia 1.1 Pengertian Ikatan kimia adalah gaya tarik antar atom yang pemutusan atau pembentukannya menyebabkan terjadinya perubahan kimia. 1.2 Macam-Macam Ikatan Kimia Ikatan Ion:
Tabel Periodik Unsur. Keperiodikan=keteraturan Kemiripan di antara sifat unsur secara teratur & periodik jika unsur diatur menurut bobot atom (ba).
 Tabel Periodik Unsur Keperiodikan=keteraturan Kemiripan di antara sifat unsur secara teratur & periodik jika unsur diatur menurut bobot atom (ba). Perkembangan Tabel Periodik Lavosier (1769) Unsur: logam
Tabel Periodik Unsur Keperiodikan=keteraturan Kemiripan di antara sifat unsur secara teratur & periodik jika unsur diatur menurut bobot atom (ba). Perkembangan Tabel Periodik Lavosier (1769) Unsur: logam
FAKULTAS TEKNIK UNIVERSITAS NEGERI YOGYAKARTA BAHAN AJAR KIMIA DASAR BAB II RUMUS KIMIA DAN TATANAMA
 No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 6 BAB II RUMUS KIMIA DAN TATANAMA A. Rumus Kimia Rumus kimia merupakan kumpulan lambang atom dengan komposisi tertentu. Rumus kimia terdiri dari
No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 6 BAB II RUMUS KIMIA DAN TATANAMA A. Rumus Kimia Rumus kimia merupakan kumpulan lambang atom dengan komposisi tertentu. Rumus kimia terdiri dari
BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI
 BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI A. STANDAR KOMPETENSI Mendiskripsikan hukumhukum dasar kimia dan penerapannya dalam perhitungan kimia. B. Kompetensi Dasar : Menuliskan nama senyawa anorganik
BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI A. STANDAR KOMPETENSI Mendiskripsikan hukumhukum dasar kimia dan penerapannya dalam perhitungan kimia. B. Kompetensi Dasar : Menuliskan nama senyawa anorganik
Coordination Chemistry
 Lecture Presentation Coordination Chemistry By : Agung Nugroho Catur Saputro, S.Pd., M.Sc NIP. 19770723 200501 1 001 JENIS-JENIS LIGAN DAN TATA NAMA SENYAWA KOMPLEKS o o o o o Menentukan atom pusat, bilangan
Lecture Presentation Coordination Chemistry By : Agung Nugroho Catur Saputro, S.Pd., M.Sc NIP. 19770723 200501 1 001 JENIS-JENIS LIGAN DAN TATA NAMA SENYAWA KOMPLEKS o o o o o Menentukan atom pusat, bilangan
Persiapan UN 2018 KIMIA
 Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
LAPORAN LENGKAP PRAKTIKUM KIMIA ANORGANIK PERCOBAAN 3 PENENTUAN BILANGAN KOORDINAI KOMPLEKS TEMBAGA (II)
 LAPORAN LENGKAP PRAKTIKUM KIMIA ANORGANIK PERCOBAAN 3 PENENTUAN BILANGAN KOORDINAI KOMPLEKS TEMBAGA (II) OLEH : NAMA : IMENG NIM: ACC 109 011 KELOMPOK : 2 ( DUA ) HARI, TANGGAL : RABU, 8 JUNI 2011 ASISTEN
LAPORAN LENGKAP PRAKTIKUM KIMIA ANORGANIK PERCOBAAN 3 PENENTUAN BILANGAN KOORDINAI KOMPLEKS TEMBAGA (II) OLEH : NAMA : IMENG NIM: ACC 109 011 KELOMPOK : 2 ( DUA ) HARI, TANGGAL : RABU, 8 JUNI 2011 ASISTEN
Bilangan Kuantum Utama (n)
 Bilangan Kuantum Utama (n) Menyatakan nomer kulit tempat elektron berada atau bilangan ini juga menyatakan ukuran orbital/ jarak/ jari-jari atom. Dinyatakan dengan bilangan bulat positif. Mempunyai dua
Bilangan Kuantum Utama (n) Menyatakan nomer kulit tempat elektron berada atau bilangan ini juga menyatakan ukuran orbital/ jarak/ jari-jari atom. Dinyatakan dengan bilangan bulat positif. Mempunyai dua
TITRASI PEMBENTUKAN KOMPLEKS. Drs. DJADJAT TISNADJAJA, M.Tech.
 TITRASI PEMBENTUKAN KOMPLEKS Drs. DJADJAT TISNADJAJA, M.Tech. 1 Pendahuluan Salah satu tipe reaksi kimia yang berlaku sebagai dasar penentuan titrimetrik melibatkan pembentukan kompleks atau ion kompleks
TITRASI PEMBENTUKAN KOMPLEKS Drs. DJADJAT TISNADJAJA, M.Tech. 1 Pendahuluan Salah satu tipe reaksi kimia yang berlaku sebagai dasar penentuan titrimetrik melibatkan pembentukan kompleks atau ion kompleks
ELEKTROKIMIA Reaksi Reduksi - Oksidasi
 Jurusan Kimia - FMIPA Universitas Gadjah Mada (UGM) ELEKTROKIMIA Reaksi Reduksi - Oksidasi Drs. Iqmal Tahir, M.Si. Laboratorium Kimia Fisika,, Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam
Jurusan Kimia - FMIPA Universitas Gadjah Mada (UGM) ELEKTROKIMIA Reaksi Reduksi - Oksidasi Drs. Iqmal Tahir, M.Si. Laboratorium Kimia Fisika,, Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam
Tabel Periodik. Bab 3a. Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr.
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Bab 3a Tabel Periodik Kapan unsur-unsur ditemukan? 8.1 1 ns 1 Konfigurasi elektron
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Bab 3a Tabel Periodik Kapan unsur-unsur ditemukan? 8.1 1 ns 1 Konfigurasi elektron
BAB I PENDAHULUAN. A. Latar Belakang
 BAB I PEDAHULUA A. Latar Belakang Senyawa kovalen koordinasi terbentuk antara ion logam yang memiliki orbital d yang belum terisi penuh (umumnya ion logam transisi) dengan ligan yang memiliki pasangan
BAB I PEDAHULUA A. Latar Belakang Senyawa kovalen koordinasi terbentuk antara ion logam yang memiliki orbital d yang belum terisi penuh (umumnya ion logam transisi) dengan ligan yang memiliki pasangan
Elektron maksimal: 2(3 2 ) = Elektron maksimal: 2(4 2 ) = 32 elektron = elektron terakhir: 2 golongan II A 10 sisa 10
 Struktur Atom Isotop: atom/ion yang memiliki jumlah proton (no atom) yang sama. Contoh: 17 Cl dan 17 Cl Isoton: atom/ion yang memiliki jumlah neutron (no massa-no atom) yang sama. Contoh: 14 6C dan 16
Struktur Atom Isotop: atom/ion yang memiliki jumlah proton (no atom) yang sama. Contoh: 17 Cl dan 17 Cl Isoton: atom/ion yang memiliki jumlah neutron (no massa-no atom) yang sama. Contoh: 14 6C dan 16
kimia KONFIGURASI ELEKTRON
 K-13 Kelas X kimia KONFIGURASI ELEKTRON Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konfigurasi elektron kulit dan subkulit. 2. Menyelesaikan
K-13 Kelas X kimia KONFIGURASI ELEKTRON Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami konfigurasi elektron kulit dan subkulit. 2. Menyelesaikan
Pembuatan Garam Kompleks dan Garam Rangkap.
 A. JUDUL PERCOBAAN Pembuatan Garam Kompleks dan Garam Rangkap. B. TUJUAN PERCOBAAN Mahasiswa diharapkan mampu mempelajari pembuatan dan sifat-sifat garam rangkap kupri ammonium sulfat dan garam kompleks
A. JUDUL PERCOBAAN Pembuatan Garam Kompleks dan Garam Rangkap. B. TUJUAN PERCOBAAN Mahasiswa diharapkan mampu mempelajari pembuatan dan sifat-sifat garam rangkap kupri ammonium sulfat dan garam kompleks
b. Ruas yang kurang H maka ditambah H 2 O. untuk suasana basa: a. Ruas yang kurang O maka ditambah OH - ( tetapi koefisien OH - langsung dikali 2)
 Cara Perubahan Bilangan Oksidasi 1. Tentukan bilangan oksidasi dari atom yang mengalami kenaikan biloks (oksidasi) dan penurunan biloks (reduksi). 2. Setarakan (samakan) nilai kenaikan dan penurunan biloks
Cara Perubahan Bilangan Oksidasi 1. Tentukan bilangan oksidasi dari atom yang mengalami kenaikan biloks (oksidasi) dan penurunan biloks (reduksi). 2. Setarakan (samakan) nilai kenaikan dan penurunan biloks
C. Reaksi oksidasi reduksi berdasarkan peningkatan dan penurunan bilangan oksidasi. Bilangan Oksidasi (biloks)
 97 Nama : Kelompok : Mata Pelajaran : Kimia Kelas/Semester : X 5 /2 Alokasi Waktu : 2 x 45 menit. Materi pokok : Konsep Redoks Standar Kompetensi : 3. Memahami sifat-sifat larutan elektrolit dan non elektrolit
97 Nama : Kelompok : Mata Pelajaran : Kimia Kelas/Semester : X 5 /2 Alokasi Waktu : 2 x 45 menit. Materi pokok : Konsep Redoks Standar Kompetensi : 3. Memahami sifat-sifat larutan elektrolit dan non elektrolit
2. Konfigurasi elektron dua buah unsur tidak sebenarnya:
 . Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
. Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
Molekul, Ion dan Senyawa Kimia
 Molekul, Ion dan Senyawa Kimia Drs. Iqmal Tahir, M.Si. iqmal@gadjahmada.edu Molekul - Bentuk satuan terkecil yang dapat diidentifikasikan menjadi unsur-unsur melalui suatu reaksi peruraian dan memiliki
Molekul, Ion dan Senyawa Kimia Drs. Iqmal Tahir, M.Si. iqmal@gadjahmada.edu Molekul - Bentuk satuan terkecil yang dapat diidentifikasikan menjadi unsur-unsur melalui suatu reaksi peruraian dan memiliki
LATIHAN SOAL IKATAN KIMIA
 LATIHAN SOAL IKATAN KIMIA 1. Cara untuk mendapatkan ke stabilan atom unsur yang bernomor atom 10 adalah dengan a. Melepaskan dua elektron valensinya membentuk ion dengan muatan +2 b. Mengikat enam elektron
LATIHAN SOAL IKATAN KIMIA 1. Cara untuk mendapatkan ke stabilan atom unsur yang bernomor atom 10 adalah dengan a. Melepaskan dua elektron valensinya membentuk ion dengan muatan +2 b. Mengikat enam elektron
Ikatan Kimia II: VSEPR dan prediksi geometri Molekular, teori ikatan valensi dan Hibridisasi Orbital Atom; teori orbital atom
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Chapter 3c Ikatan Kimia II: VSEPR dan prediksi geometri Molekular, teori ikatan
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi 2010 dimodifikasi oleh Dr. Indriana Kartini Chapter 3c Ikatan Kimia II: VSEPR dan prediksi geometri Molekular, teori ikatan
! " "! # $ % & ' % &
 Valensi ! " "! # $ % & ' %& # % ( ) # *+## )$,) & -#.. Semua unsur memiliki bilangan oksidasi +1 Semua unsur memiliki bilangan oksidasi +2 Semua unsur memiliki bilangan oksidasi +3. Tl juga memiliki bilangan
Valensi ! " "! # $ % & ' %& # % ( ) # *+## )$,) & -#.. Semua unsur memiliki bilangan oksidasi +1 Semua unsur memiliki bilangan oksidasi +2 Semua unsur memiliki bilangan oksidasi +3. Tl juga memiliki bilangan
Jilid 1. Penulis : Citra Deliana D.S, M.Si. Copyright 2013 pelatihan-osn.com. Cetakan I : Oktober Diterbitkan oleh : Pelatihan-osn.
 Jilid 1 Penulis : Citra Deliana D.S, M.Si. Copyright 2013 pelatihan-osn.com Cetakan I : Oktober 2012 Diterbitkan oleh : Pelatihan-osn.com Kompleks Sawangan Permai Blok A5 No.12 A Sawangan, Depok, Jawa
Jilid 1 Penulis : Citra Deliana D.S, M.Si. Copyright 2013 pelatihan-osn.com Cetakan I : Oktober 2012 Diterbitkan oleh : Pelatihan-osn.com Kompleks Sawangan Permai Blok A5 No.12 A Sawangan, Depok, Jawa
Terminologi-Karakteristik-Metode Pendeteksian-Aplikasi, Klasifikasi, Tatanama dan Isomerisasi Senyawa Koordinasi
 Modul 1 Terminologi-Karakteristik-Metode Pendeteksian-Aplikasi, Klasifikasi, Tatanama dan Isomerisasi Senyawa Koordinasi Drs. Momo Rosbiono, M.Pd., M.Si. M PENDAHULUAN odul ini merupakan modul pertama
Modul 1 Terminologi-Karakteristik-Metode Pendeteksian-Aplikasi, Klasifikasi, Tatanama dan Isomerisasi Senyawa Koordinasi Drs. Momo Rosbiono, M.Pd., M.Si. M PENDAHULUAN odul ini merupakan modul pertama
kimia REVIEW I TUJUAN PEMBELAJARAN
 KTSP kimia K e l a s XI REVIEW I TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami teori atom mekanika kuantum dan hubungannya dengan bilangan
KTSP kimia K e l a s XI REVIEW I TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami teori atom mekanika kuantum dan hubungannya dengan bilangan
Gambar ikatan tunggal dari masing-masing atom yang mengelilingi ke pusat.
 Stuktur Lewis terdiri dari simbol elektron-dot yang menggambarkan masing-masing atom dan atom yang ada disebelahnya. Bonding pairs adalah pasangan elektron ikatan, sedangkan lone pairs adalah pasangan
Stuktur Lewis terdiri dari simbol elektron-dot yang menggambarkan masing-masing atom dan atom yang ada disebelahnya. Bonding pairs adalah pasangan elektron ikatan, sedangkan lone pairs adalah pasangan
LAPORAN PRAKTIKUM KIMIA ANORGANIK
 LAPORAN PRAKTIKUM KIMIA ANORGANIK Nama : Idatul Fitriyah NIM : 4301412036 Jurusan : Kimia Prodi : Pendidikan Kimia Dosen : Ella Kusumastuti Kelompok : 7 Tgl Praktikum : 21 Maret 2014 Kawan Kerja : 1. Izza
LAPORAN PRAKTIKUM KIMIA ANORGANIK Nama : Idatul Fitriyah NIM : 4301412036 Jurusan : Kimia Prodi : Pendidikan Kimia Dosen : Ella Kusumastuti Kelompok : 7 Tgl Praktikum : 21 Maret 2014 Kawan Kerja : 1. Izza
LAMPIRAN C CCT pada Materi Ikatan Ion
 LAMPIRAN C CCT pada Materi Ikatan Ion 1 IKATAN ION A. KECENDERUNGAN ATOM UNTUK STABIL Gas mulia merupakan sebutan untuk unsur golongan VIIIA. Unsur unsur ini bersifat inert (stabil). Hal ini dikarenakan
LAMPIRAN C CCT pada Materi Ikatan Ion 1 IKATAN ION A. KECENDERUNGAN ATOM UNTUK STABIL Gas mulia merupakan sebutan untuk unsur golongan VIIIA. Unsur unsur ini bersifat inert (stabil). Hal ini dikarenakan
COORDINATION COMPOUNDS
 COORDINATION COMPOUNDS Coordination Compounds (senyawa koordinasi) adalah senyawa yang mengandung paling tidak satu ion komplek, yang merupakan jenis kation logam pusat(baik pada logam transisi ataupun
COORDINATION COMPOUNDS Coordination Compounds (senyawa koordinasi) adalah senyawa yang mengandung paling tidak satu ion komplek, yang merupakan jenis kation logam pusat(baik pada logam transisi ataupun
(2) kekuatan ikatan yang dibentuk untuk karbon;
 Reaksi Subsitusi Nukleofilik Alifatik Reaksi yang berlangsung karena penggantian satu atau lebih atom atau gugus dari suatu senyawa oleh atom atau gugus lain disebut reaksi substitusi. Bila reaksi substitusi
Reaksi Subsitusi Nukleofilik Alifatik Reaksi yang berlangsung karena penggantian satu atau lebih atom atau gugus dari suatu senyawa oleh atom atau gugus lain disebut reaksi substitusi. Bila reaksi substitusi
Ikatan kimia. 1. Peranan Elektron dalam Pembentukan Ikatan Kimia. Ikatan kimia
 Ikatan kimia 1. Peranan Elektron dalam Pembentukan Ikatan Kimia Ikatan kimia Gaya tarik menarik antara atom sehingga atom tersebut tetap berada bersama-sama dan terkombinasi dalam senyawaan. gol 8 A sangat
Ikatan kimia 1. Peranan Elektron dalam Pembentukan Ikatan Kimia Ikatan kimia Gaya tarik menarik antara atom sehingga atom tersebut tetap berada bersama-sama dan terkombinasi dalam senyawaan. gol 8 A sangat
Peranan elektron dalam pembentukan ikatan kimia
 IKATAN KIMIA IKATAN KIMIA Gaya yang memegangi atom atau ion membentuk molekul atau kristal disebut Ikatan Kimia. Elektron memegang peran penting dalam pembentukan ikatan kimia. Peranan elektron dalam pembentukan
IKATAN KIMIA IKATAN KIMIA Gaya yang memegangi atom atau ion membentuk molekul atau kristal disebut Ikatan Kimia. Elektron memegang peran penting dalam pembentukan ikatan kimia. Peranan elektron dalam pembentukan
IKATAN KIMIA Isana SYL
 IKATAN KIMIA Isana SYL IKATAN KIMIA Kebahagiaan atom Konfigurasi i elektronik stabil Konfigurasi elektronik gas mulia / gas lamban (Energi ionisasi relatif besar dan afinitas elektron relatif kecil) Ada
IKATAN KIMIA Isana SYL IKATAN KIMIA Kebahagiaan atom Konfigurasi i elektronik stabil Konfigurasi elektronik gas mulia / gas lamban (Energi ionisasi relatif besar dan afinitas elektron relatif kecil) Ada
Aris Arianto. Guru Kimia di SMAN Madani Palu. STUDENT S BOOk
 STUDENT S BOOk Aris Arianto Guru Kimia di SMAN Madani Palu Website/blog penulis : Website : http://blendedlearningkimia.com Weblog : 1. http://www.arisarianto.web.id 2. http://arisarianto.wordpress.com
STUDENT S BOOk Aris Arianto Guru Kimia di SMAN Madani Palu Website/blog penulis : Website : http://blendedlearningkimia.com Weblog : 1. http://www.arisarianto.web.id 2. http://arisarianto.wordpress.com
PB = Psgan elektron bebas Dari BK dan PB atom pusat dpt diramalkan struktur molekul dng teori VSEPR
 Pasangan elektron valensi mempunyai gaya tolak menolak Pasangan elektron bebas menempati ruang sesuai jenisnya BK = Bilangan Koordinasi = Jumlah atom / substituen yang terikat pada atom pusat PB = Psgan
Pasangan elektron valensi mempunyai gaya tolak menolak Pasangan elektron bebas menempati ruang sesuai jenisnya BK = Bilangan Koordinasi = Jumlah atom / substituen yang terikat pada atom pusat PB = Psgan
LARUTAN ELEKTROLIT DAN NON ELEKTROLIT. Perbandingan sifat-sifat larutan elektrolit dan larutan non elektrolit.
 KIMIA DASAR I PERTEMUAN 1 Tujuan Perkuliahan: Setelah proses pembelajaran ini selesai, diharapkan mahasiswa dapat: 1. Menjelaskan pengertian dari larutan beserta contohnya. 2. Menjelaskan perbedaan larutan
KIMIA DASAR I PERTEMUAN 1 Tujuan Perkuliahan: Setelah proses pembelajaran ini selesai, diharapkan mahasiswa dapat: 1. Menjelaskan pengertian dari larutan beserta contohnya. 2. Menjelaskan perbedaan larutan
Tata Nama Senyawa Kimia
 ~CO2 = KARBONDIOKSIDA ~NaCl = NATRIUM KLORIDA ~CH3COOH = CUKA / ASAM ASETAT ~H2SO4 = ASAM SULFAT ~Na2CO3 = NATRIUM KARBONAT ~MgCO3 = MAGNESIUM KARBONAT ~NaOH = NATRIUM KARBONAT ~(NH4)2SO4 = AMONIUM SULFAT
~CO2 = KARBONDIOKSIDA ~NaCl = NATRIUM KLORIDA ~CH3COOH = CUKA / ASAM ASETAT ~H2SO4 = ASAM SULFAT ~Na2CO3 = NATRIUM KARBONAT ~MgCO3 = MAGNESIUM KARBONAT ~NaOH = NATRIUM KARBONAT ~(NH4)2SO4 = AMONIUM SULFAT
IKATAN KIMIA. RATNAWATI, S.Pd
 IKATAN KIMIA RATNAWATI, S.Pd Tujuan Pembelajaran Setelah mempelajari materi ini, diharapkan siswa dapat: Menjelaskan kecenderungan suatu unsur untuk mencapai kestabilannya Menggambarkan susunan elektron
IKATAN KIMIA RATNAWATI, S.Pd Tujuan Pembelajaran Setelah mempelajari materi ini, diharapkan siswa dapat: Menjelaskan kecenderungan suatu unsur untuk mencapai kestabilannya Menggambarkan susunan elektron
Mengubah energi kimia menjadi energi listrik Mengubah energi listrik menjadi energi kimia Katoda sebagi kutub positif, anoda sebagai kutub negatif
 TUGAS 1 ELEKTROKIMIA Di kelas X, anda telah mempelajari bilangan oksidasi dan reaksi redoks. Reaksi redoks adalah reaksi reduksi dan oksidasi. Reaksi reduksi adalah reaksi penangkapan elektron atau reaksi
TUGAS 1 ELEKTROKIMIA Di kelas X, anda telah mempelajari bilangan oksidasi dan reaksi redoks. Reaksi redoks adalah reaksi reduksi dan oksidasi. Reaksi reduksi adalah reaksi penangkapan elektron atau reaksi
JAWABAN. 8. Untuk obligasi tunggal antara sejenis atom, bagaimana kekuatan ikatan yang berhubungan dengan ukuran dari atom?jelaskan secara ilmiah.
 SOAL 1. Thomson mampu menentukan massa / rasio muatan elektron tetapi tidak massa. Bagaimana Percobaan Millikan memungkinkan penentuan massa elektron? 2. Bagaimana senyawa ion netral jika mereka terdiri
SOAL 1. Thomson mampu menentukan massa / rasio muatan elektron tetapi tidak massa. Bagaimana Percobaan Millikan memungkinkan penentuan massa elektron? 2. Bagaimana senyawa ion netral jika mereka terdiri
UNSUR-UNSUR TRANSISI PERIODE KE EMPAT : TEMBAGA
 Nama : Laurensius E. Seran NIM : 607332411998 UNSUR-UNSUR TRANSISI PERIODE KE EMPAT : TEMBAGA lah soal-soal berikut dengan cara menjodohkan dengan jawaban-jawaban yang telah disiapkan dikolom pilihan.
Nama : Laurensius E. Seran NIM : 607332411998 UNSUR-UNSUR TRANSISI PERIODE KE EMPAT : TEMBAGA lah soal-soal berikut dengan cara menjodohkan dengan jawaban-jawaban yang telah disiapkan dikolom pilihan.
1. Aturan Aufbau. Konfigurasi Elektron. 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p,
 Ingattt.. Tabel SPU Konfigurasi Elektron Struktur Lewis t 1. Aturan Aufbau Konfigurasi Elektron 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, Lanjutan 2. Aturan Hund orbital
Ingattt.. Tabel SPU Konfigurasi Elektron Struktur Lewis t 1. Aturan Aufbau Konfigurasi Elektron 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, Lanjutan 2. Aturan Hund orbital
Sophie Damayanti / SF ITB
 Prinsip dasar Titrasi Kompleksometri reaksi pembentukan senyawa kompleks Dalam bidang FA reaksi pembentukan senyawa kompleks digunakan untuk ANALISIS LOGAM Uji batas CEMARAN LOGAM ZAT AKTIF Kualitatif
Prinsip dasar Titrasi Kompleksometri reaksi pembentukan senyawa kompleks Dalam bidang FA reaksi pembentukan senyawa kompleks digunakan untuk ANALISIS LOGAM Uji batas CEMARAN LOGAM ZAT AKTIF Kualitatif
Kimia Study Center - Contoh soal dan pembahasan tentang hidrolisis larutan garam dan menentukan ph atau poh larutan garam, kimia SMA kelas 11 IPA.
 Kimia Study Center - Contoh soal dan pembahasan tentang hidrolisis larutan garam dan menentukan ph atau poh larutan garam, kimia SMA kelas 11 IPA. Soal No. 1 Dari beberapa larutan berikut ini yang tidak
Kimia Study Center - Contoh soal dan pembahasan tentang hidrolisis larutan garam dan menentukan ph atau poh larutan garam, kimia SMA kelas 11 IPA. Soal No. 1 Dari beberapa larutan berikut ini yang tidak
BAB I PENDAHULUAN. 1.1 Pengertian Kobalt
 1.1 Pengertian Kobalt BAB I PENDAHULUAN Cobalt adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Co dan nomor atom 27. Cobalt merupakan unsur transisi yang terletak pada golongan 9 pada
1.1 Pengertian Kobalt BAB I PENDAHULUAN Cobalt adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Co dan nomor atom 27. Cobalt merupakan unsur transisi yang terletak pada golongan 9 pada
Review II. 1. Pada elektrolisis larutan NaCl dengan elektroda karbon, reaksi yang terjadi pada katoda adalah... A. 2H 2
 KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 14 Sesi NGAN Review II A. ELEKTROLISIS 1. Pada elektrolisis larutan NaCl dengan elektroda karbon, reaksi yang terjadi pada katoda adalah... A. 2H 2 O 4H + + O 2
KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 14 Sesi NGAN Review II A. ELEKTROLISIS 1. Pada elektrolisis larutan NaCl dengan elektroda karbon, reaksi yang terjadi pada katoda adalah... A. 2H 2 O 4H + + O 2
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi. Bab17. Kesetimbangan Asam-Basa dan Kesetimbangan Kelarutan
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Bab17 Kesetimbangan Asam-Basa dan Kesetimbangan Kelarutan Larutan buffer adalah larutan yg terdiri dari: 1. asam lemah/basa
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Bab17 Kesetimbangan Asam-Basa dan Kesetimbangan Kelarutan Larutan buffer adalah larutan yg terdiri dari: 1. asam lemah/basa
Ikatan kovalen koordinat adalah ikatan dimana elektronelektron yang dipakai bersama-sama hanya berasal dari satu atom.
 IKATAN KIMIA 1. Pada molekul CH 4 terdapat ikatan kovalen SEBAB paa tiap molekul CH 4 terdapat 4 atom hidrogen SMU/Ebtanas/Kimia/Tahun 1988 Ikatan Kovalen adalah ikatan kimia yang terjadi karena penggunaan
IKATAN KIMIA 1. Pada molekul CH 4 terdapat ikatan kovalen SEBAB paa tiap molekul CH 4 terdapat 4 atom hidrogen SMU/Ebtanas/Kimia/Tahun 1988 Ikatan Kovalen adalah ikatan kimia yang terjadi karena penggunaan
Chapter 7 Larutan tirtawi (aqueous solution)
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi modif oleh Dr I Kartini Chapter 7 Larutan tirtawi (aqueous solution) Larutan adalah campuran yang homogen dari dua atau lebih
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi modif oleh Dr I Kartini Chapter 7 Larutan tirtawi (aqueous solution) Larutan adalah campuran yang homogen dari dua atau lebih
LATIHAN SOAL IKATAN KIMIA
 LATIHAN SAL IKATAN KIMIA 1. Cara untuk mendapatkan kestabilan atom unsur yang bernomor atom 8 adalah dengan a. Melepaskan enam elektron muatan +6 b. Mengikat dua elektron dari atom lain menjadi ion dengan
LATIHAN SAL IKATAN KIMIA 1. Cara untuk mendapatkan kestabilan atom unsur yang bernomor atom 8 adalah dengan a. Melepaskan enam elektron muatan +6 b. Mengikat dua elektron dari atom lain menjadi ion dengan
LAPORAN PRAKTIKUM KIMIA ANORGANIK PERCOBAAN V (STOIKIOMETRI KOMPLEKS AMMIN-TEMBAGA (II))
 LAPORAN PRAKTIKUM KIMIA ANORGANIK PERCOBAAN V (STOIKIOMETRI KOMPLEKS AMMIN-TEMBAGA (II)) OLEH : NAMA : HANIFA NUR HIKMAH STAMBUK : A1C4 09001 KELOMPOK ASISTEN : II (DUA) : ANDI AHMADI LABORATORIUM PENGEMBANGAN
LAPORAN PRAKTIKUM KIMIA ANORGANIK PERCOBAAN V (STOIKIOMETRI KOMPLEKS AMMIN-TEMBAGA (II)) OLEH : NAMA : HANIFA NUR HIKMAH STAMBUK : A1C4 09001 KELOMPOK ASISTEN : II (DUA) : ANDI AHMADI LABORATORIUM PENGEMBANGAN
SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016)
 SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016) Bagian I: Pilihan Ganda 1) Suatu atom yang mempunyai energi ionisasi pertama bernilai besar, memiliki sifat/kecenderungan : A. Afinitas elektron rendah
SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016) Bagian I: Pilihan Ganda 1) Suatu atom yang mempunyai energi ionisasi pertama bernilai besar, memiliki sifat/kecenderungan : A. Afinitas elektron rendah
Ikatan yang terjadi antara atom O dengan O membentuk molekul O 2
 Ikatan Kovalen adalah ikatan yang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan. Ikatan kovalen terjadi akibat ketidakmampuan salah 1 atom yang akan berikatan untuk
Ikatan Kovalen adalah ikatan yang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan. Ikatan kovalen terjadi akibat ketidakmampuan salah 1 atom yang akan berikatan untuk
BAB II TINJAUAN PUSTAKA. kesetimbangan. Dalam larutan garam jenuh dengan amonia perak, misalnya,
 BAB II TINJAUAN PUSTAKA Pembentukan kompleks dalam larutan berair dapat diakui oleh sejumlah metode yang berbeda, dimana tes klasik modifikasi propertiesis kimia hanya satu, dan yang agak tidak bisa diandalkan
BAB II TINJAUAN PUSTAKA Pembentukan kompleks dalam larutan berair dapat diakui oleh sejumlah metode yang berbeda, dimana tes klasik modifikasi propertiesis kimia hanya satu, dan yang agak tidak bisa diandalkan
BAB 7. ASAM DAN BASA
 BAB 7. ASAM DAN BASA 7. 1 TEORI ASAM BASA 7. 2 TETAPAN KESETIMBANGAN PENGIONAN ASAM DAN BASA 7. 3 KONSENTRASI ION H + DAN ph 7. 4 INDIKATOR ASAM-BASA (INDIKATOR ph) 7. 5 CAMPURAN PENAHAN 7. 6 APLIKASI
BAB 7. ASAM DAN BASA 7. 1 TEORI ASAM BASA 7. 2 TETAPAN KESETIMBANGAN PENGIONAN ASAM DAN BASA 7. 3 KONSENTRASI ION H + DAN ph 7. 4 INDIKATOR ASAM-BASA (INDIKATOR ph) 7. 5 CAMPURAN PENAHAN 7. 6 APLIKASI
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB I STRUKTUR ATOM
 BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB I 1. Suatu partikel X memiliki 16 proton, 16 neutron, dan 18 elektron. Partikel tersebut dapat dikategorikan sebagai A. Anion X bermuatan -1
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB I 1. Suatu partikel X memiliki 16 proton, 16 neutron, dan 18 elektron. Partikel tersebut dapat dikategorikan sebagai A. Anion X bermuatan -1
Bentuk-Bentuk Molekul
 Bentuk-Bentuk Molekul Di bab ini, kita akan mempelajari bagaimana cara mengubah rumus molekul dari suatu senyawa menjadi sebuah rumus struktur senyawa dalam bentuk dua dimensi yang memperlihatkan hubungan
Bentuk-Bentuk Molekul Di bab ini, kita akan mempelajari bagaimana cara mengubah rumus molekul dari suatu senyawa menjadi sebuah rumus struktur senyawa dalam bentuk dua dimensi yang memperlihatkan hubungan
H? H 2 O? 9/23/2015 KIMIA TEKNIK KIMIA TEKNIK KIMIA TEKNIK. Teori Atom. Pengertian : Unsur? Senyawa? Teori Atom. Teori Atom
 Pengertian : Unsur? Senyawa? H? H 2 O? Materi adalah segala benda yang mempunyai massa dan volume Ada 3 bentuk materi liquids Pengertian : Unsur = bentuk paling sederhana dari substansi murni Senyawa =
Pengertian : Unsur? Senyawa? H? H 2 O? Materi adalah segala benda yang mempunyai massa dan volume Ada 3 bentuk materi liquids Pengertian : Unsur = bentuk paling sederhana dari substansi murni Senyawa =
MAKALAH PENGABDIAN PADA MASYARAKAT TEORI ASAM - BASA. Oleh : M. PRANJOTO UTOMO
 MAKALA PENGABDIAN PADA MASYARAKAT TEORI ASAM - BASA Oleh : M. PRANJOTO UTOMO Makalah ini disampaikan pada kegiatan: Pelatihan Olimpiade SMAN 7 Purworejo Di SMAN 7 Purworejo Pada tanggal 26 28 Februari
MAKALA PENGABDIAN PADA MASYARAKAT TEORI ASAM - BASA Oleh : M. PRANJOTO UTOMO Makalah ini disampaikan pada kegiatan: Pelatihan Olimpiade SMAN 7 Purworejo Di SMAN 7 Purworejo Pada tanggal 26 28 Februari
STRUKTUR LEWIS DAN BENTUK MOLEKUL (BAB 10)
 TUGAS RESUME STRUKTUR LEWIS DAN BENTUK MOLEKUL (BAB 10) Di susun oleh : Usya Rahmatika (21030112120015) Kelas B FAKULTAS TEKNIK JURUSAN TEKNIK KIMIA UNIVERSITAS DIPONEGORO SEMARANG 10.1 MENGGAMBARKAN BENTUK
TUGAS RESUME STRUKTUR LEWIS DAN BENTUK MOLEKUL (BAB 10) Di susun oleh : Usya Rahmatika (21030112120015) Kelas B FAKULTAS TEKNIK JURUSAN TEKNIK KIMIA UNIVERSITAS DIPONEGORO SEMARANG 10.1 MENGGAMBARKAN BENTUK
Chemical Chemic al Bonding Bonding
 Chemical Bonding Di alam banyak ditemukan zat baik berupa unsur atau senyawa. Keberadaan zat tersebut sangat ditentukan oleh kestabilan zat itu sendiri. Jika suatu zat stabil maka kita akan menemukannya
Chemical Bonding Di alam banyak ditemukan zat baik berupa unsur atau senyawa. Keberadaan zat tersebut sangat ditentukan oleh kestabilan zat itu sendiri. Jika suatu zat stabil maka kita akan menemukannya
SKL 1. Ringkasan Materi
 SKL 1 Menganalisis struktur atom, sistem periodik unsur dan ikatan kimia untuk menentukan sifat-sifat unsur dan senyawa. o o o Mendeskripsikan notasi unsur dan kaitannya dengan konfigurasi elektron serta
SKL 1 Menganalisis struktur atom, sistem periodik unsur dan ikatan kimia untuk menentukan sifat-sifat unsur dan senyawa. o o o Mendeskripsikan notasi unsur dan kaitannya dengan konfigurasi elektron serta
PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53
PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53
Bab V Ikatan Kimia. B. Struktur Lewis Antar unsur saling berinteraksi dengan menerima dan melepaskan elektron di kulit terluarnya. Gambaran terjadinya
 Bab V Ikatan Kimia Sebagian besar unsur yang ada di alam mempunyai kecenderungan untuk berinteraksi (berikatan) dengan unsur lain. Hal itu dilakukan karena unsur tersebut ingin mencapai kestabilan. Cara
Bab V Ikatan Kimia Sebagian besar unsur yang ada di alam mempunyai kecenderungan untuk berinteraksi (berikatan) dengan unsur lain. Hal itu dilakukan karena unsur tersebut ingin mencapai kestabilan. Cara
BENTUK-BENTUK MOLEKUL
 BENTUK-BENTUK MOLEKUL 10. 1. Menggambarkan Molekul dan Ion dengan Struktur Lewis Berikut adalah langkah-langkah dalam menggambarkan molekul dengan ikatan tunggal menggunakan struktur Lewis: 1) Letakkan
BENTUK-BENTUK MOLEKUL 10. 1. Menggambarkan Molekul dan Ion dengan Struktur Lewis Berikut adalah langkah-langkah dalam menggambarkan molekul dengan ikatan tunggal menggunakan struktur Lewis: 1) Letakkan
LOGO TEORI ASAM BASA
 LOGO TEORI ASAM BASA TIM DOSEN KIMIA DASAR FTP 2012 Beberapa ilmuan telah memberikan definisi tentang konsep asam basa Meskipun beberapa definisi terlihat kurang jelas dan berbeda satu sama lain, tetapi
LOGO TEORI ASAM BASA TIM DOSEN KIMIA DASAR FTP 2012 Beberapa ilmuan telah memberikan definisi tentang konsep asam basa Meskipun beberapa definisi terlihat kurang jelas dan berbeda satu sama lain, tetapi
BENTUK MOLEKUL CITRAWATI NUGRAHENI MINASTI Struktur Lewis dan Teori VSEPR. disusun oleh :
 BENTUK MOLEKUL Struktur Lewis dan Teori VSEPR disusun oleh : CITRAWATI NUGRAHENI MINASTI 21030112130045 TEKNIK KIMIA UNIVERSITAS DIPONEGORO 2012/2013 STRUKTUR LEWIS dan BENTUK MOLEKUL 10.1 Menggambarkan
BENTUK MOLEKUL Struktur Lewis dan Teori VSEPR disusun oleh : CITRAWATI NUGRAHENI MINASTI 21030112130045 TEKNIK KIMIA UNIVERSITAS DIPONEGORO 2012/2013 STRUKTUR LEWIS dan BENTUK MOLEKUL 10.1 Menggambarkan
BAB IV BILANGAN OKSIDASI DAN TATA NAMA SENYAWA
 BAB IV BILANGAN OKSIDASI DAN TATA NAMA SENYAWA 1. BILANGAN OKSIDASI Bilangan oksidasi suatu unsur menggambarkan kemampuan unsur tersebut berikatan dengan unsur lain dan menunjukkan bagaimana peranan elektron
BAB IV BILANGAN OKSIDASI DAN TATA NAMA SENYAWA 1. BILANGAN OKSIDASI Bilangan oksidasi suatu unsur menggambarkan kemampuan unsur tersebut berikatan dengan unsur lain dan menunjukkan bagaimana peranan elektron
Bab 10 Bentuk Bentuk Molekul
 Bab 10 Bentuk Bentuk Molekul 10.1 Menjelaskan Bentuk-Bentuk Molekul dan Ion Menurut Struktur Lewis Hal pertama yang dilakukan untuk mengetahui bentuk dari suatu molekul ialah dengan mengubah rumus suatu
Bab 10 Bentuk Bentuk Molekul 10.1 Menjelaskan Bentuk-Bentuk Molekul dan Ion Menurut Struktur Lewis Hal pertama yang dilakukan untuk mengetahui bentuk dari suatu molekul ialah dengan mengubah rumus suatu
MODUL KIMIA SMA IPA Kelas 10
 SMA IPA Kelas Atom Bagian terkecil dari materi yang sudah tidak dapat dibagi lagi disebut atom (berasal dari bahasa Yunani atomos yang berarti tidak dapat dibagi lagi). Namun, berakhir pendapat tersebut
SMA IPA Kelas Atom Bagian terkecil dari materi yang sudah tidak dapat dibagi lagi disebut atom (berasal dari bahasa Yunani atomos yang berarti tidak dapat dibagi lagi). Namun, berakhir pendapat tersebut
LARUTAN ELEKTROLIT DAN NONELEKTROLIT (Diskusi Informasi) INFORMASI Larutan adalah campuran yang homogen antara zat terlarut dan zat pelarut.
 LARUTAN ELEKTROLIT DAN NONELEKTROLIT (Diskusi Informasi) INFORMASI Larutan adalah campuran yang homogen antara zat terlarut dan zat pelarut. Berdasarkan daya hantar listriknya, larutan dapat digolongkan
LARUTAN ELEKTROLIT DAN NONELEKTROLIT (Diskusi Informasi) INFORMASI Larutan adalah campuran yang homogen antara zat terlarut dan zat pelarut. Berdasarkan daya hantar listriknya, larutan dapat digolongkan
STRUKTUR MOLEKUL SEDERHANA
 STRUKTUR MOLEKUL SEDERHANA Oleh : Dr. Suyanta Ikatan ionik dibentuk oleh tarikan elekrostatik antara kation dan anion. Karena medan listrik suatu ion bersimetri bola, ikatan ion tidak memiliki karakter
STRUKTUR MOLEKUL SEDERHANA Oleh : Dr. Suyanta Ikatan ionik dibentuk oleh tarikan elekrostatik antara kation dan anion. Karena medan listrik suatu ion bersimetri bola, ikatan ion tidak memiliki karakter
1. Bilangan Oksidasi (b.o)
 Reaksi Redoks dan Elektrokimia 1. Bilangan Oksidasi (b.o) 1.1 Pengertian Secara sederhana, bilangan oksidasi sering disebut sebagai tingkat muatan suatu atom dalam molekul atau ion. Bilangan oksidasi bukanlah
Reaksi Redoks dan Elektrokimia 1. Bilangan Oksidasi (b.o) 1.1 Pengertian Secara sederhana, bilangan oksidasi sering disebut sebagai tingkat muatan suatu atom dalam molekul atau ion. Bilangan oksidasi bukanlah
TITRASI KOMPLEKSOMETRI
 TITRASI KOMPLEKSOMETRI I. TUJUAN a. Menstandarisasi EDTA dengan larutan ZnSO 4 b. Menentukan konsentrasi larutan Ni 2+ c. Memahami prinsip titrasi kompleksometri II. TEORI Titrasi kompleksometri adalah
TITRASI KOMPLEKSOMETRI I. TUJUAN a. Menstandarisasi EDTA dengan larutan ZnSO 4 b. Menentukan konsentrasi larutan Ni 2+ c. Memahami prinsip titrasi kompleksometri II. TEORI Titrasi kompleksometri adalah
PEMBUATAN PARTIKEL NIKEL DIMETILGLIOKSIM YANG HALUS DAN HOMOGEN
 PEMBUATAN PARTIKEL NIKEL DIMETILGLIOKSIM YANG HALUS DAN HOMOGEN I. TUJUAN Mempelajari cara mesintesis senyawa nikel dimetilglioksim yang halus dan homogen. II. TEORI Suatu ion atau molekul kompleks terdiri
PEMBUATAN PARTIKEL NIKEL DIMETILGLIOKSIM YANG HALUS DAN HOMOGEN I. TUJUAN Mempelajari cara mesintesis senyawa nikel dimetilglioksim yang halus dan homogen. II. TEORI Suatu ion atau molekul kompleks terdiri
SISTEM PERIODIK UNSUR
 SISTEM PERIODIK UNSUR Abad 18, baru 51 unsur diketahui (gas mulia belum ditemukan) John Newland (1864) : Penyusunan unsur-unsur berdasarkan kenaikan massa atom. Di alam ada 109 unsur, bagaimana penyusunan
SISTEM PERIODIK UNSUR Abad 18, baru 51 unsur diketahui (gas mulia belum ditemukan) John Newland (1864) : Penyusunan unsur-unsur berdasarkan kenaikan massa atom. Di alam ada 109 unsur, bagaimana penyusunan
