UJIAN NASIONAL 2011 MATA PELAJARAN KIMIA
|
|
|
- Ida Hadiman
- 7 tahun lalu
- Tontonan:
Transkripsi
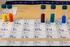
1 UJIAN NASIONAL 2011 MATA PELAJARAN KIMIA OLEH: MUHAMAD NURISSALAM, S.Si Kimia untuk kehidupan, kimia untuk kehidupan lebih baik di www. Kimiaindah.wordpress.com 1. Konfigurasi electron X 2- dari suatu ion unsur 16X 32 adalah. A. 1s 2 2s 2 2p 6 3s 2 3p 2 B. 1s 2 2s 2 2p 6 3s 2 3p 4 C. 1s 2 2s 2 2p 6 3s 2 3p 6 D. 1s 2 2s 2 2p 6 3s 2 3p 6 3d 2 E. 1s 2 2s 2 2p 6 3s 2 3p 2 3d 2 16X = 1s 2 2s 2 2p 6 3s 2 3p 4 Ikatan ion memberikan sifat pada senyawa: 1 titik leleh dan titik didih tinggi 2.dalam larutan merupakan penghantar listrik yang baik 4. Perhatikan gambar pengujian daya hantar beberapa larutan berikut ini 16X 2- = 1s 2 2s 2 2p 6 3s 2 3p 6 Jawaban: C 2. Letak unsur X dengan nomor atom 26 dan nomor massa 56, dalam system periodic pada golongan dan periode. A. II A dan 6 B. VI B dan 3 C. VIB dan 4 D. VIIIB dan 3 E. VIIIB dan X = 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 Konfigurasi Terakhir adalah 4s 2 3d 6 Golongan VIII B periode 4 3. Senyawa M mempunyai sifat sebagai berikut: 1. mudah larut dalam air 2. dapat menghantar listrik dalam fase cair; 3. titik didihnya dan titik lelehnya tinggi Jenis ikatan dalam senyawa M tersebut adalah A. Kovalen polar B. Kovalen non polar C. Hydrogen D. Logam E. Ion 3 4 5
2 Larutan yang bersifat elektrolit kuat dan elektrolit lemah berturut turut adalah. B. 1 dan 3 C. 1 dan 5 D. 2 dan 3 E. 4 dan 5 Elektrolit kuat mempunkyai gelembung yang banyak dan nyala lampu terang (1) sedangkan elektrolit lemah gelembung sedikit dan lampu redup atau tidak menyala 2 dan 4, sedangkan pada non elektrolit tidak ada gelembung dan tidak ada nyala lampu. 5. Di daerah bukit kapur, air sukar berbuih. Hal ini disebabkan terjadi kesadahan sementara pada air tersebut. Kesadahan sementara tersebut dapat dihilangkan dengan pemanasan. Persamaan reaksi setara yang tepat adalah A. CaCO 3 (s) + CO 2 (g) + H 2 O (l) Ca(HCO 3 ) 2 (aq) B. MgSO 4 (s) + CO 2 (g) + H2O (l) Mg(HCO 3 ) 2 (aq) C. CaCO 3 (aq) CaO (s) + CO 2 (g) D. Ca(HCO 3 ) 2 (aq) CaCO 3 (s) + CO 2 (g) + H 2 O (l) E. MgSO 4 (aq) MgO (s) + SO 3 (g) Sadah sementara mengandung kation Mg 2+ atau Ca 2+ dan anion HCO 3 2- Dapat dihilangkan dengan pemanasan dan terurai menjadi garam karbonat, uap air dan gas karbon dioksida Jawaban: D 6. Tahap awal pembuatan asam nitrat dalam industri melibatkan reaksi oksidasi ammonia yang menghasilkan nitrogen monoksida dan uap air menurut reaksi berikut ini; 4NH 3 (g) + 5O 2 (g) 4NO (g) + 6H 2 O Volume nitrogen monoksida yang dihasilkan pada reaksi 6 liter gas ammonia (P,T) adalah A. 4 liter B. 6 liter C. 10 liter D. 12 liter E. 14 liter Perbandingan koefisien menunjukkan perbandingan mol atau volume gas. 4NH 3 (g) + 5O 2 (g) 4NO (g) + 6H 2 O 6 liter? Karena koefisien NH 3 dan NO sama maka volume juga sama 7. Data percobaan ph beberapa larutan: Lar. ph awal ph dengan penambahan sedikit Basa Asam I 5,60 6,00 5,00 II 5,40 5,42 5,38 III 5,20 5,25 5,18 IV 8,20 8,80 7,80 V 9,20 9,60 8,70 Larutan yang mempunyai sifat penyangga adalah. A. I dan II B. II dan III C. III dan IV D. III dan V E. IV dan V Larutan penyangga akan tetap mempertahankan ph jika ditambah sedikit asam atau sedikit basa. Mempertahankan yang dimaksud akan terjadi perubahan ph tapi sangat sedikit sekali 8. Perhatikan data pengujian ph beberapa sample air limbah berikut! Jenis air limbah ph P 8 Q 5,5 R 7,6 S 9,4 T 4,7 Air limbah yang tercemar asam adalah. A. P dan Q B. Q dan T
3 C. R dan S D. S dan T E. T dan R Limbah yang tercemar asam adalah limbah dengan ph kurang dari Perhatikan diagram P-T berikut: P P. Udara K L M N Cair S 9. Berikut data hasil titrasi larutan HCl dengan NaOH 0,1 M Perc Volume HCl Volume NaOH yang dipakai yang dititrasi 1 20 ml 15 ml 2 20 ml 14 ml 3 20 ml 16 ml Berdasarkan data tersebut, konsentrasi larutan HCl adalah. A. 0,070 M B. 0,075 M C. 0,080 M D. 0,133 M E. 0,143 M Setiap proses titrasi akan muncul persamaan Mol H + = Mol OH - M.val. Vol = M. val. Vol HCl adalah asam bervalensi 1 sedangkan NaOH adalah basa bervalensi 1. masukkan data data yang tersedia pada persamaan: Mol H + = Mol OH - M.val. Vol = M. val. Vol M mL = 0,1M ml M = ( 0,1. 15) / 20 = 0,075M Padat Q R gas garis beku pelarut ditunjukkan oleh A. MS B. MN C. KL D. LR E. KQ Garis beku pelarut adalah yang paling gari kiri atas: L sampai R Jawaban: D 11. Sebanyak 100 ml larutan CH 3 COOH 0,2 M dicampur dengan 100 ml larutan NaOH 0,2 M. JIka Ka CH 3 COOH = , maka ph larutan setelah dicampur adalah. A. 2 B. 4 C. 5 D. 6 E. 9 T AL BK a. 100 ml CH 3 COOH 0,2 M ml NaOH 0,2 M 20mmol 20 mmol Campuran adalah hidrolisis (molnya sama) bersifat basa (yang kuat menjadi sifat)
4 [OH - ] = = Kw mol Ka V total Maka garam yang akan larut adalah. A. Ag 2 S dan Ag 3 PO 4 B. Ag 2 S dan AgBr C. Ag 2 CrO 4 dan Ag 2 SO 4 D. Ag 3 PO 4 dan AgBr E. AgBr dan Ag 2 SO 4 = = 10-5 poh = 5 ph = 9 Jawaban = E 12. Perhatikan Persamaan reaksi berikut! (1). CH 3 COO - + H 2 O CH 3 COOH + OH - (2). CN - + H 2 O HCN + OH - (3). Al H 2 O Al(OH) 3 + 3H + (4). NH H 2 O NH 4 OH + H + (5). S H 2 O H 2 S + 2OH - Pasangan persmaan reaksi hidrolisis untuk garam yang bersifat asam adalah. B. 1 dan 3 C. 2 dan 3 D. 3 dan 4 E. 4 dan 5 Pembahasan Hidrolisis bersifat asam bila mengandung basa konjugasi dari asam lemah cirinya adalah mengandung OH - pada hasil reaksi; 1,2 dan Sebanyak 200 ml larutan AgNO 3 0,02M, masing masing dimasukkan ke dalam 5 wadah yang berisi 5 jenis larutan yang mengandung ion S 2-, PO 4 3-, CrO 4 2-, Br -, dan SO 4 2- dengan volume dan molaritas yang sama. Jika harga Ksp dari Ag 2 S = Ag 3 PO 4 = Ag 2 CrO 4 = AgBr = Ag 2 SO 4 = Garam yang mudah larut adalah garam dengan harga Ksp paling besar 14. Perhatikan contoh penerapan sifat koloid berkut: 1. Sorot lampu mobil pada saat kabut 2. Pembentukan delta di muara sungai 3. Proses cuci darah 4. gelatin dalam es krim 5. pemutihan gula tebu Contoh yang merupakan penerapan sifat adsorpsi adalah. A. 1 B. 2 C. 3 D. 4 E. 5 Jawaban: C Sifat sifat koloid adalah: 1. menghamburkan cahaya (efek tyndall) contohnya langit berwarna biru pada siang hari, sorot lampu mobil pada malam berkabut 2. Partikelnya terus bergerak (gerak Brown) contoh gerak sitoplasma 3. Dapat mengalami penggumpalan (koagulasi) contohnya: pembentukan delta muara sungai, Lumpur koloid pada sungai, karet dalam lateks asap atau debu dari pabrik ditarik listrik (elektroforesis). 4. Dapat mengadsorpsi ion (adsorpsi) contohnya pemutihan gula tebu, pembuatan obat norit, penjernihan air dengan tawas 5. Dapat tertariki oleh medan listrik (elektrolisis) contohnya asap pada cerobong pabrik yang diberikan tegangan listrik ribuan volt. 6. Dapat bermuatan listrik dapat dimurnikan (dialysis) contohnya cuci darah jawaban: E
5 15. Perhatikan beberapa proses pembuatan koloid berikut: 1 H 2 S ditambahkan ke dalam endapan NiS 2. sol logam dibuat dengan cara busur bredig 3. larutan AgNO 3 diteteskan ke dalam larutan HCl 4. Larutan FeCl 3 diteteskan ke dalam air mendidih; 5. Agar agar dipeptisasi dalam air Contoh penmbuatan koloid dengan cara kondensasi adalah. B. 1 dan 3 C. 3 dan 4 D. 3 dan 5 E. 4 dan 5 Pembuatan koloid 1. Cara kondensasi dari larutan ke koloid a. Redoks contoh pembuatan belerang dari H 2 S dengan SO 2 b. Hidrolisis contoh pembuatan Fe(OH) 3 dengan FeCl 3 c. Dekomposisi rangkap contoh As 2 S 3 d. Pergantian pelarut conotoh pembuatan AgCl 2. Cara dispersi dari suspensi ke koloid a. Mekanik, contoh sol belerang dibuat dengan menggerus belerang, kemudian dicampur dan diaduk dengan air b. Cara peptisasi contoh agar agar oleh air, nitroselulosa oleh asetaon, karet oleh bensin, endapan NiS oleh H 2 S, endapan Al(OH) 3 oleh AlCl 3 c. Busur bredig contoh pembuatan sol logam Jawaban: C Reaksi berikut digunakan untuk mengerjakan soal nomor 16 dan CH 3 CH 2 CH 2 OH + HCl (pekat) CH 3 CH 2 CH 2 Cl+H 2 O 2. CH 3 CH=CHCH 3 + HCl CH 3 CH 2 CHClCH Jenis reaksi yang terjadi pada kedua persamaan reaksi tersebut berturut turut adalah. A. adisi dan eliminasi B. subtitusi dan adisi C. eliminasi dan adisi D. substitusi dan eliminasi E. adisi dan substitusi Reaksi pertama adalah subtitusi karena hanya terjadi pertukaran zat sedangkan pada reaksi ke dua adalah adisi karena memecah ikatan rangkap 17. Isomer posisi dari pereaksi paa persamaan reaksi (2) adalah. A. CH 2 =CH-CH 2 CH 3 B. CH 3 -CH=CH-CH 3 C. CH 3 -CH 2 -CH 2 CH 3 D. CH 3 -C=CH 3 CH 3 E. CH 3 -CH-CH 3 CH 3 Isomer posisi hanyalah mengubah posisi ikatan rangkap pada atom karbon lain CH 3 CH=CHCH 3 dengan CH 2 =CH-CH 2 CH Senyawa C 2 H 4 O 2 merupakan senyawa yang dapat ditambahkan dalam makanan sebagai penambah rasa. Senyawa tersebut dapat dibuat dari oksidasi alcohol primer. Gugus fungsi dari senyawa tersebut adalah. A. C=O H B. C=O OH C. O- D. C- O E. OH
6 Hasil oksidasi alcohol primer adalah aldehid kemudian asam karboksilat. Aldehid empunyai rumus C n H 2n O, sedangkan asam karboksilat mempunyai rumus C n H 2n O 2 Maka jawaban adalah asam karboksilat 5 CH 3 O 2 N NO 2 Bahan baku plastic 19. Beberapa kegunaan senyawa karbon: 1. Pendingin AC 2. antiseptic 3. obat bius 4. pelarut senyawa Kegunaan senyawa eter adalah. B. 1 dan 3 C. 2 dan 3 D. 2 dan 4 E. 3 dan 4 Eter digunakan sebagai obat bius karena mudah menguap (volatile) sehingga mempercepat ketidaksadaran, eter juga digunakan sebagai pelarut senyawa. 20. Perhatikan informasi senyawa benzene berikut No Struktur Penggunaan 1 COOH Pengawet makanan NO 2 Pasangan yang tepat antara senyawa dan kegunaanya adalah. A. 1 B. 2 C. 3 D. 4 E. 5 Turunan benzena CH 3 COOH Toluena sebagai bahan peledak Asam benzoat untuk bahan pengawet makanan COONa Na- benzoat untuk pengawet makanan OH NH 2 Fenol: dipakai untuk antiseptik Anilin ; dipakai pewarna tekstil 2 OH Zat warna CHO : benzaldehid: aneka obat gosok, 3 CH 3 Disinfektan 21. Perhatikan gambar berikut! 4 NO 2 Obat NaOH CaCO 3 Na 2 S 2 O 4 T 1 =27 0 T 1 =27 0 T 1 =27 0 T 2 = 30 0 T 2 = 35 0 T 2 =22 0 NH 2 5mL air 5mLHCl 5mLair 1 2 3
7 NH 4 Cl H 2 SO 4 T 1 = 27 0 T 1 = 27 0 T 2 = 20 0 T 2 = mlba(oh) 2 5mLHCl 4 5 Peristiwa yang merupakan reaksi endoterm adalah B. 2 dan 3 C. 2 dan 4 D. 3 dan 4 E. 3 dan 5 Endoterm memiliki cirri terjadi penurunan suhu Jawaban: D 22. Perhatikan percobaan berikut ini! Sebanyak 5 gram logam magnesium masing masing dilarutkan dalam 5 wadah yang berbeda. (1) (2) (3) (4) (5) Mg Mg Mg Mg Mg HNO 31M HNO 32M HNO 31M HNO 31M HNO 32M Laju reaksi yang hanya dipengaruhi oleh konsentrasi terdapat pada tabung nomor. A. 1 terhadap 2 B. 1 terhadap 3 C. 2 terhadap 4 D. 3 terhadap 4 E. 4 terhadap 5 Jika yang mempengaruhi hanya konsentrasi maka konsentrasinya beda, faktor lain yang sama. Faktor lain pada soal adalah luas permukaan. Maka yang merupakan pilihan jawaban adalah 2 terhadap 3 dan 4 terhadap Pada reaksi kesetimbangan berikut: 6NO (g) + 4NH 3 (g) 5N 2 (g) + 6H 2 O (g) H= -xkj Jika suhu diturunkan pada volume tetap, maka system kesetimbangan akan bergeser ke. A. kanan, konsentrasi N 2 berkurang B. kanan, konsentrasi N 2 bertambah C. kanan, konsentrasi N 2 tetap D. kiri, konsentrasi NO bertambah E. kiri, konsentrasi NO berkurang Jika suhu diturunkan maka reaksi akan bergeser kearah eksoterm ( H= -) berarti kea rah kanan, jika ke kanan maka N 2 bertambah, sedangkan NO berkurang Jawaban : B 24. Data percobaan uji protein beberapa bahan makanan sebagai berikut; Bahan Pereaksi yang digunakan/perubahan warna makanan Biuret Xantoproteat Timbal II asetat K Ungu Jingga Coklat kehitaman Coklat kehitaman L Biru muda Kuning M Ungu Jingga Coklat kehitaman N Ungu Kuning Tak berubah O Biru muda Tak berubah Tak berubah Bahan makanan berprotein yang mengandung inti benzene dan unsure belerang adalah. A. K dan L B. L dan N C. K dan M D. M dan N E. L dan O Uji Protein: 1. Biuret (posift ungu) = menguji adanya ikatan peptida pada protein 2. Xantoproteat ( positif Jingga)= menguji adanya inti benzena pada protein 3. Pb-Asetat (Positif Hitam ) = menguji adanya sulfur atau belerang pada protein 4. Ninhidrin = gugus asam amino pada protein 5. millons = mengetahui gugus fenol pada protein Jawaban: C
8 25. Perhatikan sel elektrokimia berikut ini! Zn V - + Cu ZnSO 4 CuSO 4 Penulisan diagram yang tepat dari gambar adalah. A. Zn / Zn 2+ // Cu 2+ / Cu B. Cu / Cu 2+ // Zn 2 / Zn C. Zn 2+ / Zn // Cu / Cu 2+ D. Cu 2+ / Cu // Zn 2+ / Zn E. Zn / Zn 2+ // Cu / Cu 2+ Deret volta Li K Ba Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb (H) Cu Hg Ag Pt Au Cu di kanan dan Zn dikiri. Maka notasi sel adalah Zn / Zn 2+ // Cu 2+ / Cu, Zn teroksidasi (biloks naik) sedangkan Cu tereduksi (biloks turun) 26. Pada persamaan reaksi redoks: a MnO bh + +cc 2 O 4 2-2Mn 2+ +8H 2 O+10CO 2 Harga koefisien reaksi a, b,dan c adalah. A. 1,4 dan 2 B. 1,8, dan 3 C. 2,6, dan 5 D. 2,8, dan 5 E. 2,16, dan 5 MnO C 2 O 4 Mn 2+ + CO 2, (oks) 1x2 (oks) 27. Diantara reaksi berik Perhatikan persamaan reaksi redoks berikut: 2HBr + H 2 SO 4 Br 2 + SO H 2 O Zat yang merupakan oksidator adalah. A. HBr B. H 2 SO 4 C. Br 2 D. SO 2 E. H 2 O Oksidator adalah zat yang mengalami reduksi 2HBr + H 2 SO 4 Br 2 + SO H 2 O oksidasi reduksi maka yang merupakan oksidator adalah H 2 SO Berikut ini diberikan data percobaan laju reaksi Q + 2T T 2 Q No [Q] [T] V (M/S) 1 0,1 0,1 1, ,2 0, ,1 0, Jika [Q] dan[t] masing masing diubah menjadi 0,5 M, maka harga laju (V) reaksi saat itu adalah.. A. 5,0 B. 7,5 C. 10,5 D. 12,5 E. 39,0 Cari ordo masing masingt 2 Q No [Q] [T] V (M/S) 1 0,1 0,1 1, ,2 0, ,1 0, Kali silang 2MnO H C 2 O 4 +10CO 2, 2Mn 2+ +8H 2 O Jika mencari ordo Q maka cari lah yang T sama (data 1 dan 2) (0,1/0,2) a = (1, ) / ( ½ ) a = ¼ a = 2
9 Jika mencari ordo T maka carilah yang data Q sama (data 1 dan 3) (0,1/0,2) b = (1, ) /.10-1 ( ½ ) b = 1/8 b = 3 Persamaan: v = k [Q] 2 [T] 3 Masukkan data 3 untuk menentukan k 0,1 = k (0.1) 2.(0,2) 3 0,1 = k K = 0, = 1250 Jika [Q] dan[t] masing masing diubah menjadi 0,5 M, maka harga laju (V) reaksi saat itu menjadi V = (0,5) 2.(0,5) 3 = = Harga tetapan setimbangan Kc untuk reaksi : Al 3+ (aq) +3 H 2 O (l) Al(OH) 3(s) + 3H + (aq) Ditentukan oleh persamaan. [Al(OH) 3 ] [H + ] 3 A. Kc = [Al 3+ ] [H 2 O] B. Kc = C. Kc = D. Kc = E. Kc = [H + ] 3 [Al 3+ ] [H 2 O] 3 [Al 3+ ][H 2 O] [Al(OH) 3 ] [H + ] 3 [H + ] 3 [Al 3+ ] [Al(OH) 3 ] [H 2 ] 3 Pada penentuan rumus Kc yang digunakan adalah fase gas(g) dan larutan (aq), sedangkan fasa padatan (s) dan fase likuid (l) tidak Kc = [H + ] 3 [Al 3+ ] Jawaban: D Informasi berikut untuk menjawab soal no 30 dan 31 Persamaan reaksi pembuatan suatu logam: Al 2 O 3 (l) 2Al O 2 Katoda: 2Al e 2Al (l) Anoda : 3O 2-3/2 O 2 + 6e Reaksi : Al 2 O 3 (l) 2Al + 3/2O 2 (g) 30. Proses pembuatan unsure tersebut dikenal dengan nama. A. Hall-Herault B. Wohler C. Frasch D. Dacon E. Dow Proses pembuatan Unsur 1. Proses kontak Pembuatan asam sulfat cirinya menggunakan katalis Fe 2 O 5 2. Proses Bilik timbal : pembuatan asam sulfat dengan katalis NO 3. Wohler : urea 4. Frach : belerang 5. hall Herault : alumunium 6. Haber Bosh : Amonia 7. Bessemer : baja 8. tanur tiup/tinggi : Besi 9. Down : Na, Mg dan K 10. Solvay : Na 2 CO flotasi dan pemanggangan: tembaga 31. Sifat unsure yang dihasilkan proses tersebut adalah A. mudah berkarat B. membentuk oksida amfoter C. Konduktor listrik yang buruk D. Oksidanya bersifat asam E. Membentuk molekul diatomic Alumunium oksida karat melindungi dari karat terus menerus sehingga sukar berkarat, bisa membentuk oksida bersifat amfoter ( bisa asam maupun basa), penghantar listrik yang baik karena logam dan bersifat monoatomik
10 32. Dalam suatu sel volta terjadi reaksi ; Sn + 2Ag + Sn Ag E 0 Sn 2+ /Sn = -0,14 V E 0 Ag + /Ag = =0,80 volt, harga potensial sel reaksi tersebut adalah. A. 1,88 Volt B. 1,74 volt C. 0,94 volt D. 0,36 volt E. -0,94 volt Potensial pada sel volta selalu positif maka pasti potensial besar potensial kecil E 0 sel= E red -E oks = 0,8 - -0,14 = 0,94volt Jawaban : C 33. Proses elektrolisis lelehan NaCl dengan elektroda karbon, digunakan arus sebesar 10 amper selama 30 menit. Massa logam natrium yang diperoleh adalah A B. C. D. E , , , W = (e. i. t) / Ar. I.t W = Biloks W = Perhatikan gambar proses korosi berikut! (1) (2) (3) (4) (5) udara CaCO 3 anhidros paku+air paku+air paku+minyak paku+air garam Proses korosi yang berlangsung paling lambat terjadi pada gambar. A. 1 B. 2 C. 3 D. 4 E. 5 Korosi dipengaruhi oleh air dan udara. CaCO 3 di dalam tabung berfungsi menyerap uap air (kurang berkarat), wadah tertutup berarti miskin air, korosi paling lambat adalah apabila tidak ada air dan udara. Jika di masukkan dalam minyak maka tidak beraksi dengan air maupun udara Jawaban: D 35. Sebanyak 2 gram cuplikan NaOH dilarutkan dalam 250 ml air kemudian 20 ml dari larutan ini dititrasi dengan larutan HCl 0,1 M, diperoleh data sebagai berikut: Percobaan Volume HCl 1 24 ml 2 26 ml 3 25 ml Kadar NaOH dalam cuplikan tersebut adalah A. 20% B. 25% C. 40% D. 62,5% E. 75%
11 Proses titrasi adalah menentukan jumlah dalam gram NaOH yang dititrasi. Mol H + = mol OH - M. Vol. Valensi = M.Vol. Valensi 0, = M ,5 = 20. M M = 2,5 /20 = 0,125M Mmol NaOH bervolume 20 ml Mmol = M. V = 0, = 2,5 mmol Mg = mmol. Mr = 2,5. 40 = 100 mg dalam 20 ml Maka dalam 250 ml sebanyak = 250/ mg = 1250 mg = 1,25 gram Kadar = 1,25 / % = 62,5 % Jawaban: D 36. Gambar berikut merupakan gambar partikel zat terlarut dan pelarut yang bukan sebenarnya (1) (2) (3) (4) (5) Keterangan: Partikel zat pelarut Partikel zat terlarut Tekanan uap larutan paling kecil terdapat pada wadah. A. 1 B. 2 C. 3 D. 4 E. 5 Tekanan uap larutan paling kecil jika P besar, karena semakin besar P maka tekanan uap larutan semakin turun. Oleh karena itu harus jumlah zat terlarut yang terbanyak 37. Data energi ikatan rata rata C=C :609 kj/mol C-Cl : 326 kj/mol C-H : 412 kj/mol C-C : 345 kj/mol H-Cl : 426 kj/mol Besarnya entalphi reaksi CH 2 =CH 2 + HCl Adalah A kj/mol B. -48 kj/mol C. +48 kj/mol D kj/mol E kj/mol CH 3 CH 2 Cl H = [Kiri] [kanan] = [4.C-H+C=C+H-Cl] [5.C-H +C-C +C-Cl] = [ C=C + H-Cl] [C-H + C-C +C-Cl] = [ ] [ ] = = -48 Jawaban: C 38. Perhatikan table unsure unsure mineral dan kegunaanya berikut ini! No Unsure Mineral Kegunaan 1 Barium Wiserit Penyamak kulit 2 Stronsium Selestit Nyala merah kembang api 3 Kalium Dolomit Campuran asbes 4 Mangan Pirolusit Zat aktif dalam baterai 5 Magnesium Karnalit Antsida Pasangan dat yang ketiganya berhubungan dengan tepat adalah. B. 2 dan 3 C. 3 dan 4 D. 3 dan 5 E. 4 dan 5 1. Selestit : SrSO 4 2. Karnalit : KMgCl 3.6H 2 O 3. dolomit : CaMg(CO 3 ) 4. Pirolusit : MnO 2
12 39. Berikut tabel yang berisi data polimer, monomer, proses pembentukan, dan kegunaanya No Polimer Monomer Poses pembuatan Kegunaan 1 Teflon Tetra Pelapis Adisi flouroetilena panic 2 Amilum Propena Kndensasi Adonan kue 3 PVC Vinil klorida Adisi Plastic 4 Karet alam Etena Kondensasi Ban 5 Protein Isoprene Kondensasi Serat sintesis Pasangan data yang keempatnya berhubungan secara tepat adalah. B. 1 dan 3 C. 2 dan 3 D. 3 dan 5 E. 4 dan 5 Teflon buatan proses adisi Amilum monomer glukosa cara kondensasi PVC mnomer vinil klorida proses adis Karet alam monomer poliisoprena cara adisi Protein monomer asam amino cara kondensasi 40. Perhatikan siklus energi berikut: 41. H=x kj 2S (s) +3O 2 (g) 2SO 3 (g) X = = kj untuk 2 mol Maka untuk satu mol = -790 /2 = -395 kj Jawaban: C H= -593kj H= -197 kj 2SO 2 (g) + O 2 (g) Harga perubahan entalpi pembentukan 1 mol gas SO 3 adalah. A kj B kj C kj D kj E kj
UJIAN NASIONAL Konfigurasi electron X 2- dari suatu ion unsur
 UJIAN NASIONAL 2011 1. Konfigurasi electron X 2- dari suatu ion unsur 16X 32. A. 1s 2 2s 2 2p 6 3s 2 3p 2 B. 1s 2 2s 2 2p 6 3s 2 3p 4 C. 1s 2 2s 2 2p 6 3s 2 3p 6 D. 1s 2 2s 2 2p 6 3s 2 3p 6 3d 2 E. 1s
UJIAN NASIONAL 2011 1. Konfigurasi electron X 2- dari suatu ion unsur 16X 32. A. 1s 2 2s 2 2p 6 3s 2 3p 2 B. 1s 2 2s 2 2p 6 3s 2 3p 4 C. 1s 2 2s 2 2p 6 3s 2 3p 6 D. 1s 2 2s 2 2p 6 3s 2 3p 6 3d 2 E. 1s
UN SMA 2012 IPA Kimia
 UN SMA 2012 IPA Kimia Kode Soal Doc. Name: UNSMAIPA2011KIM999 Doc. Version : 2012-12 halaman 1 01. Tahap awal pembuatan asam nitrat dalam industri melibatkan reaksi oksidasi ammonia yang menghasilkan nitrogen
UN SMA 2012 IPA Kimia Kode Soal Doc. Name: UNSMAIPA2011KIM999 Doc. Version : 2012-12 halaman 1 01. Tahap awal pembuatan asam nitrat dalam industri melibatkan reaksi oksidasi ammonia yang menghasilkan nitrogen
UJIAN NASIONAL SMA/MA TAHUN PELAJARAN 2010/ Mata pelajaran : KIMIA Program Studi : IPA Hari/ Tanggal : Senin, 19 April 2011 Jam :
 UJIAN NASIONAL KIMIA SMA 011 UJIAN NASIONAL SMA/MA TAHUN PELAJARAN 010/ 011 Mata pelajaran : KIMIA Program Studi : IPA Hari/ Tanggal : Senin, 19 April 011 Jam : 11.00 1.00 PETUNJUK UMUM 1. Isikan identitas
UJIAN NASIONAL KIMIA SMA 011 UJIAN NASIONAL SMA/MA TAHUN PELAJARAN 010/ 011 Mata pelajaran : KIMIA Program Studi : IPA Hari/ Tanggal : Senin, 19 April 011 Jam : 11.00 1.00 PETUNJUK UMUM 1. Isikan identitas
PEMBAHASAN KIMIA 2011(NGACAK)
 PEMBAHASAN KIMIA 2011(NGACAK) Berikut adalah 3 soal kimia pada UNSUR 2011 tentang senyawa karbon. Soal yang pertama adalah pengenalan jenis-jenis reaksi kimia pada senyawaan karbon. Reaksi adisi ~ reaksi
PEMBAHASAN KIMIA 2011(NGACAK) Berikut adalah 3 soal kimia pada UNSUR 2011 tentang senyawa karbon. Soal yang pertama adalah pengenalan jenis-jenis reaksi kimia pada senyawaan karbon. Reaksi adisi ~ reaksi
3. Jika unsur III membentuk ion, maka gambar yang paling tepat untuk menunjukkan susunan elektron ion tersebut adalah.
 Untuk soal nomor 1 s.d. 3 menggunakan data berikut. Diketahui konfigurasi elektron dari tiga buah unsur : I. [ 2 He ] 2s 2 2p 5 II. [ 10 Ne ] 3s 2 3p 1 III. [ 10 Ne ] 3s 2 3p 4 1. Jika unsur I mempunyai
Untuk soal nomor 1 s.d. 3 menggunakan data berikut. Diketahui konfigurasi elektron dari tiga buah unsur : I. [ 2 He ] 2s 2 2p 5 II. [ 10 Ne ] 3s 2 3p 1 III. [ 10 Ne ] 3s 2 3p 4 1. Jika unsur I mempunyai
PEMERINTAH KABUPATEN BANYUMAS DINAS PENDIDIKAN SMA NEGERI PATIKRAJA Jalan Adipura 3 Patikraja Telp (0281) Banyumas 53171
 PEMERINTAH KABUPATEN BANYUMAS DINAS PENDIDIKAN SMA NEGERI PATIKRAJA Jalan Adipura 3 Patikraja Telp (0281) 6844576 Banyumas 53171 ULANGAN KENAIKAN KELAS TAHUN PELAJARAN 2010/ 2011 Mata Pelajaran : Kimia
PEMERINTAH KABUPATEN BANYUMAS DINAS PENDIDIKAN SMA NEGERI PATIKRAJA Jalan Adipura 3 Patikraja Telp (0281) 6844576 Banyumas 53171 ULANGAN KENAIKAN KELAS TAHUN PELAJARAN 2010/ 2011 Mata Pelajaran : Kimia
 PEMBAHASAN UJIAN NASIONAL TAHUN PELAJARAN 2009/2010 Mata Pelajaran : Kimia Tanggal : 26 Maret 2010 Kode Soal : D14 / P 12 1. Jawab : B = 11 elektron :[Ne] 3s 1 X +1 = 16 elektron : [Ne] 3s 2 3p 4 Z 2 berikatan
PEMBAHASAN UJIAN NASIONAL TAHUN PELAJARAN 2009/2010 Mata Pelajaran : Kimia Tanggal : 26 Maret 2010 Kode Soal : D14 / P 12 1. Jawab : B = 11 elektron :[Ne] 3s 1 X +1 = 16 elektron : [Ne] 3s 2 3p 4 Z 2 berikatan
KIMIA SMA/MA PROGRAM STUDI IPA Waktu 120 menit. Berdasarkan Lampiran Permendiknas Nomor 77 Tahun 2008 Tanggal 5 Desember 2008
 KIMIA SMA/MA PROGRAM STUDI IPA Waktu 120 menit Berdasarkan Lampiran Permendiknas Nomor 77 Tahun 2008 Tanggal 5 Desember 2008 MATA PELAJARAN Mata Pelajaran Program Studi : Kimia : IPA PETUNJUK UMUM A. Isikan
KIMIA SMA/MA PROGRAM STUDI IPA Waktu 120 menit Berdasarkan Lampiran Permendiknas Nomor 77 Tahun 2008 Tanggal 5 Desember 2008 MATA PELAJARAN Mata Pelajaran Program Studi : Kimia : IPA PETUNJUK UMUM A. Isikan
SIMULASI UJIAN NASIONAL 2
 SIMULASI UJIAN NASIONAL 2. Diketahui nomor atom dan nomor massa dari atom X adalah 29 dan 63. Jumlah proton, elektron, dan neutron dalam ion X 2+ (A) 29, 27, dan 63 (B) 29, 29, dan 34 (C) 29, 27, dan 34
SIMULASI UJIAN NASIONAL 2. Diketahui nomor atom dan nomor massa dari atom X adalah 29 dan 63. Jumlah proton, elektron, dan neutron dalam ion X 2+ (A) 29, 27, dan 63 (B) 29, 29, dan 34 (C) 29, 27, dan 34
UN SMA 2015 PRE Kimia
 UN SMA 2015 PRE Kimia Kode Soal Doc. UNSMAIPA2015KIM999 Doc. Version : 2015-11 halaman 1 01. Suatu unsur Z mempunyai konfigurasi elektron [Ar]4s 2 3d 7. Jika neutron unsur tersebut 32, letak unsur Z dalam
UN SMA 2015 PRE Kimia Kode Soal Doc. UNSMAIPA2015KIM999 Doc. Version : 2015-11 halaman 1 01. Suatu unsur Z mempunyai konfigurasi elektron [Ar]4s 2 3d 7. Jika neutron unsur tersebut 32, letak unsur Z dalam
SIMULASI UJIAN NASIONAL 1
 SIMULASI UJIAN NASIONAL 1 1. Bilangan-bilangan kuantum yang mungkin dimiliki oleh suatu elektron (A) n = 2, l = 2, m = 0, s = - 1 2 (B) n = 3, l = 0, m = +1, s = + 1 2 (C) n = 4, l = 2, m = - 3, s = -
SIMULASI UJIAN NASIONAL 1 1. Bilangan-bilangan kuantum yang mungkin dimiliki oleh suatu elektron (A) n = 2, l = 2, m = 0, s = - 1 2 (B) n = 3, l = 0, m = +1, s = + 1 2 (C) n = 4, l = 2, m = - 3, s = -
PAKET UJIAN NASIONAL 17 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 17 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
PAKET UJIAN NASIONAL 17 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
Pembahasan Soal-soal Try Out Neutron, Sabtu tanggal 16 Oktober 2010
 Pembahasan Soal-soal Try Out Neutron, Sabtu tanggal 16 Oktober 2010 26. Diketahui lambing unsur Fe, maka jumlah p +, e - dan n o dalam ion Fe 3+ adalah.... Jawab :, Fe 3+ + 3e - Fe [ 18 Ar] 4s 2 3d 6 [
Pembahasan Soal-soal Try Out Neutron, Sabtu tanggal 16 Oktober 2010 26. Diketahui lambing unsur Fe, maka jumlah p +, e - dan n o dalam ion Fe 3+ adalah.... Jawab :, Fe 3+ + 3e - Fe [ 18 Ar] 4s 2 3d 6 [
Persiapan UN 2018 KIMIA
 Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
Persiapan UN 2018 KIMIA 1. Perhatikan gambar berikut! Teori atom yang muncul setelah percobaan tersebut menyatakan bahwa... A. Atom-atom dari sebuah unsur identik dan berbeda dengan atom unsur lain B.
PERSIAPAN UJIAN NASIONAL 2011 SMA MAARIF NU PANDAAN TAHUN PELAJARAN
 PERSIAPAN UJIAN NASIONAL 2011 SMA MAARIF NU PANDAAN TAHUN PELAJARAN 2010-2011 Mata Pelajaran : Kimia Hari/Tanggal : Minggu, 10 Mei 2011 Waktu : 120 menit 1. Perhatikan beberapa perubahan materi berikut!
PERSIAPAN UJIAN NASIONAL 2011 SMA MAARIF NU PANDAAN TAHUN PELAJARAN 2010-2011 Mata Pelajaran : Kimia Hari/Tanggal : Minggu, 10 Mei 2011 Waktu : 120 menit 1. Perhatikan beberapa perubahan materi berikut!
PREDIKSI UJIAN NASIONAL 2011 KIMIA
 Soal PREDIKSI Latihan UJIAN NASIONAL 2011 2013 KIMIA 1 LATIHAN UJIAN AKHIR NASIONAL TAHUN AJARAN 2012/2013 KIMIA 1. Jika unsur 19 X berikatan dengan unsur 35 Z maka, rumus senyawa dan jenis ikatan yang
Soal PREDIKSI Latihan UJIAN NASIONAL 2011 2013 KIMIA 1 LATIHAN UJIAN AKHIR NASIONAL TAHUN AJARAN 2012/2013 KIMIA 1. Jika unsur 19 X berikatan dengan unsur 35 Z maka, rumus senyawa dan jenis ikatan yang
PAKET UJIAN NASIONAL 7 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 7 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Dari beberapa unsur berikut yang mengandung : 1. 20
PAKET UJIAN NASIONAL 7 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Dari beberapa unsur berikut yang mengandung : 1. 20
D. 3 dan 4 E. 1 dan 5
 1. Dari beberapa unsur berikut yang mengandung : 1. 20 elektron dan 20 netron 2. 10 elektron dan 12 netron 3. 15 proton dan 16 netron 4. 20 netron dan 19 proton 5. 12 proton dan 12 netron Yang memiliki
1. Dari beberapa unsur berikut yang mengandung : 1. 20 elektron dan 20 netron 2. 10 elektron dan 12 netron 3. 15 proton dan 16 netron 4. 20 netron dan 19 proton 5. 12 proton dan 12 netron Yang memiliki
KIMIA IPA SMA/MA 1 E49
 1 E49 1. Atom A memiliki nomor atom 19 dan atom B memiliki nomor atom 11. Pernyataan di bawah ini yang benar mengenai dua atom tersebut adalah... A. atom A memiliki jari-jari lebih besar dari atom B B.
1 E49 1. Atom A memiliki nomor atom 19 dan atom B memiliki nomor atom 11. Pernyataan di bawah ini yang benar mengenai dua atom tersebut adalah... A. atom A memiliki jari-jari lebih besar dari atom B B.
Kelas : XI IPA Guru : Tim Guru HSPG Tanggal : Senin, 23 Mei 2016 Mata pelajaran : Kimia Waktu : WIB
 Kelas : XI IPA Guru : Tim Guru HSPG Tanggal : Senin, 23 Mei 2016 Mata pelajaran : Kimia Waktu : 10.15 11.45 WIB Petunjuk Pengerjaan Soal Berdoa terlebih dahulu sebelum mengerjakan! Isikan identitas Anda
Kelas : XI IPA Guru : Tim Guru HSPG Tanggal : Senin, 23 Mei 2016 Mata pelajaran : Kimia Waktu : 10.15 11.45 WIB Petunjuk Pengerjaan Soal Berdoa terlebih dahulu sebelum mengerjakan! Isikan identitas Anda
PAKET UJIAN NASIONAL 1 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 1 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Unsur X dengan konfigurasi electron 1S 2 2S 2 2p 6
PAKET UJIAN NASIONAL 1 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Unsur X dengan konfigurasi electron 1S 2 2S 2 2p 6
PAKET UJIAN NASIONAL 14 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASINAL 14 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
PAKET UJIAN NASINAL 14 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Diketahui ion X 3+ mempunyai 10 elektron dan 14 neutron.
UN SMA IPA 2009 Kimia
 UN SMA IPA 009 Kimia Kode Soal P88 Doc. Version : 011-06 halaman 1 01. Perhatikan tabel data fisik dan daya hantar larutan beberapa senyawa berikut: Senyawa Titik Leleh Daya Hantar Listrik Larutan L M
UN SMA IPA 009 Kimia Kode Soal P88 Doc. Version : 011-06 halaman 1 01. Perhatikan tabel data fisik dan daya hantar larutan beberapa senyawa berikut: Senyawa Titik Leleh Daya Hantar Listrik Larutan L M
SOLUSI PR ONLINE MATA UJIAN: KIMIA (KODE: A06)
 SLUSI PR NLINE MATA UJIAN: KIMIA (KDE: A06) 1. Jawaban: D 60 P : [Ar] 27 4s2 3d 7 60 3 27 P : [Ar] 3d 6 2. Jawaban: B 63 29 Cu : [Ar] 4s1 3d 10 Periode 4 Golongan I B 3. Jawaban: C Senyawa Ionik Titik
SLUSI PR NLINE MATA UJIAN: KIMIA (KDE: A06) 1. Jawaban: D 60 P : [Ar] 27 4s2 3d 7 60 3 27 P : [Ar] 3d 6 2. Jawaban: B 63 29 Cu : [Ar] 4s1 3d 10 Periode 4 Golongan I B 3. Jawaban: C Senyawa Ionik Titik
SIMULASI UJIAN NASIONAL 3
 SIMULASI UJIAN NASIONAL 3 1. Diketahui: H, Li, Be, O, F, Ne, Na, Mg, 1 3 4 8 9 10 11 12 Ar, 18 36 Kr Kelompok unsur atau ion berikut yang mempunyai konfigurasi elektron yang sama (A) O 2-, F -, Ne (D)
SIMULASI UJIAN NASIONAL 3 1. Diketahui: H, Li, Be, O, F, Ne, Na, Mg, 1 3 4 8 9 10 11 12 Ar, 18 36 Kr Kelompok unsur atau ion berikut yang mempunyai konfigurasi elektron yang sama (A) O 2-, F -, Ne (D)
PAKET UJIAN NASIONAL 9 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 9 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Isotop terdiri dari A. 13 proton, 14 elektron dan 27
PAKET UJIAN NASIONAL 9 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Isotop terdiri dari A. 13 proton, 14 elektron dan 27
PR ONLINE MATA UJIAN: KIMIA XII IPA (KODE A04) Informasi berikut digunakan untuk mengerjakan soal nomor 1 dan 2. R; T
 PR ONLINE MATA UJIAN: KIMIA XII IPA (KODE A04) Informasi berikut digunakan untuk mengerjakan soal nomor 1 dan 2. Perhatikan notasi 2 buah unsur berikut ini: 28 12 14 R; T 6 1. Konfigurasi elektron unsur
PR ONLINE MATA UJIAN: KIMIA XII IPA (KODE A04) Informasi berikut digunakan untuk mengerjakan soal nomor 1 dan 2. Perhatikan notasi 2 buah unsur berikut ini: 28 12 14 R; T 6 1. Konfigurasi elektron unsur
SOAL KIMIA 1 KELAS : XI IPA
 SOAL KIIA 1 KELAS : XI IPA PETUNJUK UU 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja 3. Kerjakanlah soal anda pada lembar
SOAL KIIA 1 KELAS : XI IPA PETUNJUK UU 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja 3. Kerjakanlah soal anda pada lembar
UJIAN SEKOLAH KOTA METRO 2012
 UJIAN SEKOLAH KOTA METRO 2012 Informasi berikut untuk mengerjakan soal nomor 1 sampai 3 Perhatikan dua buah diagram orbital unsur berikut ini: X : [Ar] Y : [He] 1. Nomor atom dari unsur X adalah.. A. 10
UJIAN SEKOLAH KOTA METRO 2012 Informasi berikut untuk mengerjakan soal nomor 1 sampai 3 Perhatikan dua buah diagram orbital unsur berikut ini: X : [Ar] Y : [He] 1. Nomor atom dari unsur X adalah.. A. 10
Volume gas oksigen yang diperlukan pada reaksi tersebut pada keadaan standart adalah. (Mr propana = 44)
 1. Suatu unsut terletak pada periode ke-3 golongan IIIA, konfigurasi elektron unsur tersebut adalah... A. 1s 2 2s 2 2p 1 B. 1s 2 2s 2 2p 6 3s 2 C. 1s 2 2s 2 2p 6 3s 2 3p 1 D. 1s 2 2s 2 2p 6 3d 10 4s 2
1. Suatu unsut terletak pada periode ke-3 golongan IIIA, konfigurasi elektron unsur tersebut adalah... A. 1s 2 2s 2 2p 1 B. 1s 2 2s 2 2p 6 3s 2 C. 1s 2 2s 2 2p 6 3s 2 3p 1 D. 1s 2 2s 2 2p 6 3d 10 4s 2
5. Sebanyak 24 gram batu pualam direaksikan dengan 36 gram klorida dalam wadah tertutup menurut persamaan reaksi: CaCO 3. Pilihlah jawaban yang benar!
 Pilihlah jawaban yang benar! Informasi berikut ini digunakan untuk mengerjakan soal nomor 1 sampai 3. Dua buah unsur mempunyai notasi 7 3 X dan 19 9 Y. 1. Konfigurasi elektron unsur X yaitu... (nomor atom
Pilihlah jawaban yang benar! Informasi berikut ini digunakan untuk mengerjakan soal nomor 1 sampai 3. Dua buah unsur mempunyai notasi 7 3 X dan 19 9 Y. 1. Konfigurasi elektron unsur X yaitu... (nomor atom
I. Soal Pilihan ganda
 I. Soal Pilihan ganda 1. Perhatikan tabel berikut : Unsur P Q R S T titik leleh ( o C) 180,54 97.81-249 63.85 117 titik didih ( o C) 1347 883-246 773,9 184 Massa atom 6.94 22.99 20.18 39.10 126.9 Kelompok
I. Soal Pilihan ganda 1. Perhatikan tabel berikut : Unsur P Q R S T titik leleh ( o C) 180,54 97.81-249 63.85 117 titik didih ( o C) 1347 883-246 773,9 184 Massa atom 6.94 22.99 20.18 39.10 126.9 Kelompok
PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53
PAKET UJIAN NASIONAL 8 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53
PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP FAX KODE POS 60299
 PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP. 031-8415492 FAX 031-8430673 KODE POS 60299 ULANGAN AKHIR SEMESTER 2 (DUA) TAHUN PELAJARAN 2011 2012 Hari/Tanggal :
PEMERINTAH KOTA SURABAYA DINAS PENDIDIKAN SMA NEGERI 16 SURABAYA JL. RAYA PRAPEN TELP. 031-8415492 FAX 031-8430673 KODE POS 60299 ULANGAN AKHIR SEMESTER 2 (DUA) TAHUN PELAJARAN 2011 2012 Hari/Tanggal :
Reaksi Dan Stoikiometri Larutan
 A. PERSAMAAN REAKSI ION Reaksi Dan Stoikiometri Larutan Persamaan reaksi ion adalah persamaan reaksi yang menjelaskan bagaimana reaksi antar-ion terjadi pada elektrolit. Persamaan reaksi ion terdiri dari:
A. PERSAMAAN REAKSI ION Reaksi Dan Stoikiometri Larutan Persamaan reaksi ion adalah persamaan reaksi yang menjelaskan bagaimana reaksi antar-ion terjadi pada elektrolit. Persamaan reaksi ion terdiri dari:
PAKET UJIAN NASIONAL 3 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 3 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Konfigurasi electron suatu ion adalah 2 8 8, bila unsur
PAKET UJIAN NASIONAL 3 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 1. Konfigurasi electron suatu ion adalah 2 8 8, bila unsur
REDOKS DAN ELEKTROKIMIA
 REDOKS DAN ELEKTROKIMIA 1. Bilangan oksidasi dari unsur Mn pada senyawa KMnO4 adalah... A. +7 B. +6 C. +3 D. +2 E. +1 Jumlah bilangan oksidasi senyawa adalah nol, Kalium (K) mempunyai biloks +1 karena
REDOKS DAN ELEKTROKIMIA 1. Bilangan oksidasi dari unsur Mn pada senyawa KMnO4 adalah... A. +7 B. +6 C. +3 D. +2 E. +1 Jumlah bilangan oksidasi senyawa adalah nol, Kalium (K) mempunyai biloks +1 karena
Reaksi dan Stoikiometri Larutan
 Reaksi dan Stoikiometri Larutan A. PERSAMAAN REAKSI ION Persamaan reaksi ion adalah persamaan reaksi yang menjelaskan bagaimana reaksi antar-ion terjadi pada larutan elektrolit. Persamaan reaksi ion terdiri
Reaksi dan Stoikiometri Larutan A. PERSAMAAN REAKSI ION Persamaan reaksi ion adalah persamaan reaksi yang menjelaskan bagaimana reaksi antar-ion terjadi pada larutan elektrolit. Persamaan reaksi ion terdiri
MATA PELAJARAN PELAKSANAAN PETUNJUK UMUM
 1 MATA PELAJARAN Mata Pelajaran : Kimia Program Studi : IPA PELAKSANAAN Hari/Tanggal : Rabu, 3 April 008 Jam :.30 1.30 PETUNJUK UMUM 1. Isikan identitas Anda ke dalam Lembar Jawabam Ujian Nasional (LJUN)
1 MATA PELAJARAN Mata Pelajaran : Kimia Program Studi : IPA PELAKSANAAN Hari/Tanggal : Rabu, 3 April 008 Jam :.30 1.30 PETUNJUK UMUM 1. Isikan identitas Anda ke dalam Lembar Jawabam Ujian Nasional (LJUN)
MATA PELAJARAN PELAKSANAAN PETUNJUK UMUM
 1 MATA PELAJARAN Mata Pelajaran : Kimia Program Studi : IPA PELAKSANAAN Hari/Tanggal : Rabu, 3 April 008 Jam :.30 1.30 PETUNJUK UMUM 1. Isikan identitas Anda ke dalam Lembar Jawabam Ujian Nasional (LJUN)
1 MATA PELAJARAN Mata Pelajaran : Kimia Program Studi : IPA PELAKSANAAN Hari/Tanggal : Rabu, 3 April 008 Jam :.30 1.30 PETUNJUK UMUM 1. Isikan identitas Anda ke dalam Lembar Jawabam Ujian Nasional (LJUN)
Download Soal dan Pembahasan Lainnya di: SOAL ULANGAN AKHIR SEMESTER GENAP TAHUN PELAJARAN..
 SOAL ULANGAN AKHIR SEMESTER GENAP TAHUN PELAJARAN../ MATA PELAJARAN : KIMIA KELAS : XI (Sebelas) HARI/TANGGAL : WAKTU : 07.30 09.30 (120 menit) 1. Kelarutan Mg(OH)2 dalam air adalah 10-3 mol/l. Maka harga
SOAL ULANGAN AKHIR SEMESTER GENAP TAHUN PELAJARAN../ MATA PELAJARAN : KIMIA KELAS : XI (Sebelas) HARI/TANGGAL : WAKTU : 07.30 09.30 (120 menit) 1. Kelarutan Mg(OH)2 dalam air adalah 10-3 mol/l. Maka harga
UN SMA 2013 IPA Kimia
 UN SMA 013 IPA Kimia Kode Soal Doc. UNSMAIPA013KIM999 Doc. Version : 013-07 halaman 1 01. Perhatikan gambar struktur Lewis senyawa H SO 4 sebagai berikut! Ikatan kovalen koordinasi ditunjukkan oleh nomor
UN SMA 013 IPA Kimia Kode Soal Doc. UNSMAIPA013KIM999 Doc. Version : 013-07 halaman 1 01. Perhatikan gambar struktur Lewis senyawa H SO 4 sebagai berikut! Ikatan kovalen koordinasi ditunjukkan oleh nomor
UJIAN SEKOLAH KOTA METRO 2012
 UJIAN SEKOLAH KOTA METRO 2012 1. Diberikan notasi beberapa unsur sebagai berikut : 9Q 19, 11R 23, 14T 28, 17X 35, 38Z 87 Pasangan yang merupakan unsur-unsur yang terdapat dalam satu golongan pada sistem
UJIAN SEKOLAH KOTA METRO 2012 1. Diberikan notasi beberapa unsur sebagai berikut : 9Q 19, 11R 23, 14T 28, 17X 35, 38Z 87 Pasangan yang merupakan unsur-unsur yang terdapat dalam satu golongan pada sistem
PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH
 PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH TAHUN 2016 Soal diketik ulang oleh urip rukim (www.urip.info)
PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH TAHUN 2016 Soal diketik ulang oleh urip rukim (www.urip.info)
PREDIKSI UAN KIMIA 2009 Sesuai Kisi-Kisi Pemerintah
 PREDIKSI UAN KIMIA 2009 Sesuai Kisi-Kisi Pemerintah 24 19 1. Diketahui unsur 12 X dan 9 Y. Jika keduanya membentuk senyawa, maka muatan X dan Y adalah. a. X = 2, Y = -2 b. X = 2, Y = -1 c. X = 1, Y = -2
PREDIKSI UAN KIMIA 2009 Sesuai Kisi-Kisi Pemerintah 24 19 1. Diketahui unsur 12 X dan 9 Y. Jika keduanya membentuk senyawa, maka muatan X dan Y adalah. a. X = 2, Y = -2 b. X = 2, Y = -1 c. X = 1, Y = -2
Try Out UN 2011 paket 61
 Try Out UN 2011 paket 61 1. Unsur Y pada tabel sistem periodik terletak pada periode ke-1 golongan I A dan unsur X terletak pada periode ke-2 golongan VA, keduanya saling berikatan. Rumus senyawa dan jenis
Try Out UN 2011 paket 61 1. Unsur Y pada tabel sistem periodik terletak pada periode ke-1 golongan I A dan unsur X terletak pada periode ke-2 golongan VA, keduanya saling berikatan. Rumus senyawa dan jenis
Soal UN Kimia Tahun 2013 dan Pembahasannya
 Soal UN Kimia Tahun 2013 dan Pembahasannya 1. Perhatikan rumus struktur Lewis senyawa NH 4 Cl berikut: Ikatan kovalen koordinasi pada gambar tersebut ditunjukkan nomor... (Nomor atom N = 7; H = 1; Cl =
Soal UN Kimia Tahun 2013 dan Pembahasannya 1. Perhatikan rumus struktur Lewis senyawa NH 4 Cl berikut: Ikatan kovalen koordinasi pada gambar tersebut ditunjukkan nomor... (Nomor atom N = 7; H = 1; Cl =
MATA PELAJARAN WAKTU PELAKSANAAN PETUNJUK UMUM
 1 MATA PELAJARAN Mata Pelajaran Jenjang Program Studi : Kimia : SMA/MA : IPA Hari/Tanggal : Jumat, 4 April 009 Jam : 08.00 10.00 WAKTU PELAKSANAAN PETUNJUK UMUM 1. Isikan identitas Anda ke dalam Lembar
1 MATA PELAJARAN Mata Pelajaran Jenjang Program Studi : Kimia : SMA/MA : IPA Hari/Tanggal : Jumat, 4 April 009 Jam : 08.00 10.00 WAKTU PELAKSANAAN PETUNJUK UMUM 1. Isikan identitas Anda ke dalam Lembar
D. E. 3. Bila kedua unsur tersebut berikatan, maka rumus senyawa yang dihasilkan adalah... A. XY 2
 Dua buah unsur memiliki notasi dan 1. Diagram orbital yang paling tepat untuk elektron terakhir dari unsur X adalah... A. B. C. X nomor atom 13 Konfigurasi elektron terakhirnya ada pada nomor 13. [Ne]
Dua buah unsur memiliki notasi dan 1. Diagram orbital yang paling tepat untuk elektron terakhir dari unsur X adalah... A. B. C. X nomor atom 13 Konfigurasi elektron terakhirnya ada pada nomor 13. [Ne]
1 E50 KIMIA IPA SMA/MA
 1 E50 1. Unsur Li, Na, dan K terletak dalam satu golongan. Pernyataan berikut yang benar adalah... A. unsur Na memiliki energi ionisasi terbesar B. unsur Li paling mudah melapas elektron C. ketiga unsur
1 E50 1. Unsur Li, Na, dan K terletak dalam satu golongan. Pernyataan berikut yang benar adalah... A. unsur Na memiliki energi ionisasi terbesar B. unsur Li paling mudah melapas elektron C. ketiga unsur
PAKET UJIAN NASIONAL 4 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 4 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. Data berikut untuk menjawab soal no 1 dan 2 Lambang proton
PAKET UJIAN NASIONAL 4 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. Data berikut untuk menjawab soal no 1 dan 2 Lambang proton
UJIAN NASIONAL Wacana berikut diberikan untuk mengerjakan soal nomor 1 s.d. 3. Dua buah unsur memiliki notasi: X dan 12
 UJIAN NASIONAL 008 Wacana berikut diberikan untuk mengerjakan soal nomor 1 s.d.. Dua buah unsur memiliki notasi: 4 5, X dan 175 1 1. Diagram orbital yang paling tepat untuk elektron terakhir dari unsur
UJIAN NASIONAL 008 Wacana berikut diberikan untuk mengerjakan soal nomor 1 s.d.. Dua buah unsur memiliki notasi: 4 5, X dan 175 1 1. Diagram orbital yang paling tepat untuk elektron terakhir dari unsur
2. Konfigurasi elektron dua buah unsur tidak sebenarnya:
 . Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
. Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
LEMBARAN SOAL 11. Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : X ( SEPULUH )
 LEMBARAN SOAL 11 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : X ( SEPULUH ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan
LEMBARAN SOAL 11 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : X ( SEPULUH ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan
Mata Pelajaran : KIMIA
 Mata Pelajaran : KIMIA Kelas/ Program : XII IPA Waktu : 90 menit Petunjuk untuk nomor 1 s.d. 40 Pilihlah jawaban yang dianggap paling benar pada lembar jawaban yang tersedia (LJK)! Dilarang menggunakan
Mata Pelajaran : KIMIA Kelas/ Program : XII IPA Waktu : 90 menit Petunjuk untuk nomor 1 s.d. 40 Pilihlah jawaban yang dianggap paling benar pada lembar jawaban yang tersedia (LJK)! Dilarang menggunakan
D. golongan IIIA perioda 4 E. golongan VIA perioda 5
 1. Isotop terdiri dari... A. 13 proton, 14 elektron dan 27 neutron B. 13 proton, 13 elektron dan 27 neutron C. 13 proton, 13 elektron dan 14 neutron D. 14 proton, 14 elektron dan 13 neutron E. 27 proton,
1. Isotop terdiri dari... A. 13 proton, 14 elektron dan 27 neutron B. 13 proton, 13 elektron dan 27 neutron C. 13 proton, 13 elektron dan 14 neutron D. 14 proton, 14 elektron dan 13 neutron E. 27 proton,
Elektrokimia. Tim Kimia FTP
 Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis ini merupakan
Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis ini merupakan
SKL- 3: LARUTAN. Ringkasan Materi. 1. Konsep Asam basa menurut Arrhenius. 2. Konsep Asam-Basa Bronsted dan Lowry
 SKL- 3: LARUTAN 3 Menjelaskan sifat-sifat larutan, metode pengukuran dan terapannya. o Menganalisis data daya hantar listrik beberapa larutan o Mendeskripsikan konsep ph larutan o Menghitung konsentrasi
SKL- 3: LARUTAN 3 Menjelaskan sifat-sifat larutan, metode pengukuran dan terapannya. o Menganalisis data daya hantar listrik beberapa larutan o Mendeskripsikan konsep ph larutan o Menghitung konsentrasi
OAL TES SEMESTER II. I. Pilihlah jawaban yang paling tepat!
 KIMIA XI SMA 217 S OAL TES SEMESTER II I. Pilihlah jawaban yang paling tepat! 1. Basa menurut Arhenius adalah senyawa yang bila dilarutkan dalam air akan menghasilkan a. proton d. ion H b. elektron e.
KIMIA XI SMA 217 S OAL TES SEMESTER II I. Pilihlah jawaban yang paling tepat! 1. Basa menurut Arhenius adalah senyawa yang bila dilarutkan dalam air akan menghasilkan a. proton d. ion H b. elektron e.
SMA UNGGULAN BPPT DARUS SHOLAH JEMBER UJIAN SEMESTER GENAP T.P 2012/2013 LEMBAR SOAL. Waktu : 90 menit Kelas : XII IPA T.
 SMA UNGGULAN BPPT DARUS SHOLAH JEMBER UJIAN SEMESTER GENAP T.P 0/0 LEMBAR SOAL Waktu : 90 menit Kelas : XII IPA T.P : 0/0 PETUNJUK :. Isikan identitas peserta pada tempat yang telah disediakan pada lembar
SMA UNGGULAN BPPT DARUS SHOLAH JEMBER UJIAN SEMESTER GENAP T.P 0/0 LEMBAR SOAL Waktu : 90 menit Kelas : XII IPA T.P : 0/0 PETUNJUK :. Isikan identitas peserta pada tempat yang telah disediakan pada lembar
Petunjuk : Pilihlah satu jawaban yang paling benar
 Petunjuk : Pilihlah satu jawaban yang paling benar 1. Unsur seng di alam terdapat dua isotop yaitu Zn 65 sebanyak 60 % dan Zn 66 sebanyak 40 %. Massa atom realtif seng adalah a. 64,5 b. 65 c. 65,4 d. 66
Petunjuk : Pilihlah satu jawaban yang paling benar 1. Unsur seng di alam terdapat dua isotop yaitu Zn 65 sebanyak 60 % dan Zn 66 sebanyak 40 %. Massa atom realtif seng adalah a. 64,5 b. 65 c. 65,4 d. 66
4. Sebanyak 3 gram glukosa dimasukkan ke dalam 36 gram air akan diperoleh fraksi mol urea sebesar.
 LATIHAN ULUM 1. Sebutkan kegunaan dari sifat koligarif larutan. 2. Sebanyak 27 gram urea ditimbang dan dimasukkan ke dalam 500 gram. Berapakah molalitas larutan yang terjadi?. 3. Apa definisi dari 4. Sebanyak
LATIHAN ULUM 1. Sebutkan kegunaan dari sifat koligarif larutan. 2. Sebanyak 27 gram urea ditimbang dan dimasukkan ke dalam 500 gram. Berapakah molalitas larutan yang terjadi?. 3. Apa definisi dari 4. Sebanyak
PROKSIMA [SIMULASI UJIAN NASIONAL TINGKAT MA] 1. Jawaban: B Q Jawaban: C Pembahasan: Unsur X mempunyai nomor atom 21 (Ar=18 + 3= 21)
![PROKSIMA [SIMULASI UJIAN NASIONAL TINGKAT MA] 1. Jawaban: B Q Jawaban: C Pembahasan: Unsur X mempunyai nomor atom 21 (Ar=18 + 3= 21) PROKSIMA [SIMULASI UJIAN NASIONAL TINGKAT MA] 1. Jawaban: B Q Jawaban: C Pembahasan: Unsur X mempunyai nomor atom 21 (Ar=18 + 3= 21)](/thumbs/54/34213337.jpg) KUNCI JAWABAN DAN PEMBAHASAN KIMIA 1. Jawaban: B IA IIA 1 IIIA IVA VA VIA VIIA VIIIA 2 3 4 Q 5 6 7 Q terletak pada golongan IIIA pada periode 4 maka konfigurasi nya adalah. Q = 2 8 18 3 Q = 1s 2 2s 2 2p
KUNCI JAWABAN DAN PEMBAHASAN KIMIA 1. Jawaban: B IA IIA 1 IIIA IVA VA VIA VIIA VIIIA 2 3 4 Q 5 6 7 Q terletak pada golongan IIIA pada periode 4 maka konfigurasi nya adalah. Q = 2 8 18 3 Q = 1s 2 2s 2 2p
Sulistyani, M.Si.
 Sulistyani, M.Si. sulistyani@uny.ac.id Reaksi oksidasi: perubahan kimia suatu spesies (atom, unsur, molekul) melepaskan elektron. Cu Cu 2+ + 2e Reaksi reduksi: perubahan kimia suatu spesies (atom, unsur,
Sulistyani, M.Si. sulistyani@uny.ac.id Reaksi oksidasi: perubahan kimia suatu spesies (atom, unsur, molekul) melepaskan elektron. Cu Cu 2+ + 2e Reaksi reduksi: perubahan kimia suatu spesies (atom, unsur,
PAKET UJIAN NASIONAL 16 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 16 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. 27 Isotop 13 Al terdiri dari... A. 13 proton,14 elektron
PAKET UJIAN NASIONAL 16 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. 27 Isotop 13 Al terdiri dari... A. 13 proton,14 elektron
PR ONLINE MATA UJIAN : KIMIA (KODE: A06)
 PR ONLINE MATA UJIAN : KIMIA (KODE: A06) 1. Diketahui atom suatu unsur mempunyai notasi 60 27P, maka konfigurasi elektron ion P 3+ (A) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 7 4s 2. (B) 1s 2 2s 2 2p 6 3s 2 3p 6 3d
PR ONLINE MATA UJIAN : KIMIA (KODE: A06) 1. Diketahui atom suatu unsur mempunyai notasi 60 27P, maka konfigurasi elektron ion P 3+ (A) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 7 4s 2. (B) 1s 2 2s 2 2p 6 3s 2 3p 6 3d
UJIAN NASIONAL TAHUN PELAJARAN 2007/2008
 UJIAN NASIONAL TAHUN PELAJARAN 2007/2008 PANDUAN MATERI SMA DAN MA K I M I A PROGRAM STUDI IPA PUSAT PENILAIAN PENDIDIKAN BALITBANG DEPDIKNAS KATA PENGANTAR Dalam rangka sosialisasi kebijakan dan persiapan
UJIAN NASIONAL TAHUN PELAJARAN 2007/2008 PANDUAN MATERI SMA DAN MA K I M I A PROGRAM STUDI IPA PUSAT PENILAIAN PENDIDIKAN BALITBANG DEPDIKNAS KATA PENGANTAR Dalam rangka sosialisasi kebijakan dan persiapan
SOAL UN DAN PENYELESAIANNYA 2008
 1. Perhatikan data hasil percobaan berikut ini! Berdasarkan data tersebut, maka dapat disimpulkan bahwa jenis ikatan yang terdapat pada zat A dan zat B berturut-turut adalah... A. ionik dan kovalen non
1. Perhatikan data hasil percobaan berikut ini! Berdasarkan data tersebut, maka dapat disimpulkan bahwa jenis ikatan yang terdapat pada zat A dan zat B berturut-turut adalah... A. ionik dan kovalen non
PAKET UJIAN NASIONAL 10 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJAN NASONAL 1 Pelajaran : KMA Waktu : 1 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah Dua buah unsur memiliki notasi 1 Diagram orbital yang paling
PAKET UJAN NASONAL 1 Pelajaran : KMA Waktu : 1 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah Dua buah unsur memiliki notasi 1 Diagram orbital yang paling
PAKET UJIAN NASIONAL Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. 70 Konfigurasi electron dari unsur 1 Ga adalah. A. 2
PAKET UJIAN NASIONAL Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. 70 Konfigurasi electron dari unsur 1 Ga adalah. A. 2
TES AWAL II KIMIA DASAR II (KI-112)
 TES AWAL II KIMIA DASAR II (KI112) NAMA : Tanda Tangan N I M : JURUSAN :... BERBAGAI DATA. Tetapan gas R = 0,082 L atm mol 1 K 1 = 1,987 kal mol 1 K 1 = 8,314 J mol 1 K 1 Tetapan Avogadro = 6,023 x 10
TES AWAL II KIMIA DASAR II (KI112) NAMA : Tanda Tangan N I M : JURUSAN :... BERBAGAI DATA. Tetapan gas R = 0,082 L atm mol 1 K 1 = 1,987 kal mol 1 K 1 = 8,314 J mol 1 K 1 Tetapan Avogadro = 6,023 x 10
Ujian Akhir Tahun 2006 Kimia
 Ujian Akhir Tahun 006 Kimia UAS-06-01 Suatu atom X memiliki maasa atom relatif 35 dan 18 neutron. Atom X dalam system periodik terletak pada A. golongan IA perioda 3 B. golongan IV A perioda 4 C. golongan
Ujian Akhir Tahun 006 Kimia UAS-06-01 Suatu atom X memiliki maasa atom relatif 35 dan 18 neutron. Atom X dalam system periodik terletak pada A. golongan IA perioda 3 B. golongan IV A perioda 4 C. golongan
UN SMA 2013 PRE Kimia
 UN SMA 2013 PRE Kimia Kode Soal Doc. UNSMA2013PREKIM999 Doc. Version : 2013-12 halaman 1 Wacana berikut digunakan untuk mengerjakan soal nomor 1 sampai dengan 3. Dua buah unsure mempunyai notasi 16 dan
UN SMA 2013 PRE Kimia Kode Soal Doc. UNSMA2013PREKIM999 Doc. Version : 2013-12 halaman 1 Wacana berikut digunakan untuk mengerjakan soal nomor 1 sampai dengan 3. Dua buah unsure mempunyai notasi 16 dan
Antiremed Kelas 11 Kimia
 Antiremed Kelas 11 Kimia Persiapan UAS 1 Kimia Doc. Name: AR11KIM01UAS Version: 016-08 halaman 1 01. Salah satu teori yang menjadi dasar sehingga tercipta model atom modern (A) Rutherford, Niels Bohr,
Antiremed Kelas 11 Kimia Persiapan UAS 1 Kimia Doc. Name: AR11KIM01UAS Version: 016-08 halaman 1 01. Salah satu teori yang menjadi dasar sehingga tercipta model atom modern (A) Rutherford, Niels Bohr,
SMA IPA Berikut ini adalah data fisik dari 2 buah zat tak dikenal : Wacana berikut digunakan untuk mengerjakan soal nomor 1 sampai dengan 3.
 SMA IPA 008 Kode Soal P11 Doc. Version : 011-06 halaman 1 Wacana berikut digunakan untuk mengerjakan soal nomor 1 sampai dengan. 04. Berikut ini adalah data fisik dari buah zat tak dikenal : Dua buah unsur
SMA IPA 008 Kode Soal P11 Doc. Version : 011-06 halaman 1 Wacana berikut digunakan untuk mengerjakan soal nomor 1 sampai dengan. 04. Berikut ini adalah data fisik dari buah zat tak dikenal : Dua buah unsur
MATA PELAJARAN KIMIA 2011
 PEMBAHASAN SAOL UJIAN SEKOLAH METRO MATA PELAJARAN KIMIA 2011 1. Di antara konfigurasi electron berikut yang merupakan konfigurasi electron unsure X (nomor atom 29). A. 1s 2 2s 2 2p 6 3s 2 3p 6 3d 4 4s
PEMBAHASAN SAOL UJIAN SEKOLAH METRO MATA PELAJARAN KIMIA 2011 1. Di antara konfigurasi electron berikut yang merupakan konfigurasi electron unsure X (nomor atom 29). A. 1s 2 2s 2 2p 6 3s 2 3p 6 3d 4 4s
Berdasarkan data di atas yang merupakan larutan non elektrolit adalah nomor A. 1 B. 2 C. 3 D. 4 E. 5
 PREDIKSI UN 2010 ( semoga soal soal ini ada manfaatnya) 1. Jika diketahui nuklida 11 Na 23, maka jumlah elektron, proton dan neutron adalah A. 23 proton, 12 elektron dan 11 neutron B. 11 proton, 12 elektron
PREDIKSI UN 2010 ( semoga soal soal ini ada manfaatnya) 1. Jika diketahui nuklida 11 Na 23, maka jumlah elektron, proton dan neutron adalah A. 23 proton, 12 elektron dan 11 neutron B. 11 proton, 12 elektron
D kj/mol E kj/mol
 1. Dari data : 2H 2 (g) + O 2 (g) 2H 2 O (l) H = -571 kj 2Ca (s) + O 2 (g) 2CaO(s) H = -1269 kj CaO (s) + H 2 O (l) Ca(OH)2(s) H = -64 kj Dapat dihitung entalpi pembentukan Ca(OH) 2 (s) sebesar... A. -984
1. Dari data : 2H 2 (g) + O 2 (g) 2H 2 O (l) H = -571 kj 2Ca (s) + O 2 (g) 2CaO(s) H = -1269 kj CaO (s) + H 2 O (l) Ca(OH)2(s) H = -64 kj Dapat dihitung entalpi pembentukan Ca(OH) 2 (s) sebesar... A. -984
UN SMA IPA 2010 Kimia
 UN SMA IPA 2010 Kimia Kode Soal Doc. Name: UNSMAIPA2010KIM999 Doc. Version : 2013-03 halaman 1 01. Perhatikan tabel sifat fisik senyawa berikut: Dari data tersebut, jenis ikatan yang terdapat dalam senyawa
UN SMA IPA 2010 Kimia Kode Soal Doc. Name: UNSMAIPA2010KIM999 Doc. Version : 2013-03 halaman 1 01. Perhatikan tabel sifat fisik senyawa berikut: Dari data tersebut, jenis ikatan yang terdapat dalam senyawa
Try Out-2/kimia/2015 Halaman - 1
 1. Konfigurasi elektron unsur : 19 X 39 adalah A. Ne 3s 2 B. Ar 4s 1 C. Ar 4s 2 3d 4 D. Kr 4s 1 E. Kr 5s 2 2. Konfigurasi elektron ion 20 X +2 : 1s 2 2s 2 2p 6 3s 2 3p 6. Letak unsur X dalam sistem periodik
1. Konfigurasi elektron unsur : 19 X 39 adalah A. Ne 3s 2 B. Ar 4s 1 C. Ar 4s 2 3d 4 D. Kr 4s 1 E. Kr 5s 2 2. Konfigurasi elektron ion 20 X +2 : 1s 2 2s 2 2p 6 3s 2 3p 6. Letak unsur X dalam sistem periodik
LEMBARAN SOAL 4. Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA )
 LEMBARAN SOAL 4 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
LEMBARAN SOAL 4 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
MATA PELAJARAN KIMIA 2011
 PEMBAHASAN SAOL UJIAN SEKOLAH METRO MATA PELAJARAN KIMIA 2011 1. Di antara konfigurasi electron berikut yang merupakan konfigurasi electron unsure X (nomor atom 24). A. 1s 2 2s 2 2p 6 3s 2 3p 6 3d 4 4s
PEMBAHASAN SAOL UJIAN SEKOLAH METRO MATA PELAJARAN KIMIA 2011 1. Di antara konfigurasi electron berikut yang merupakan konfigurasi electron unsure X (nomor atom 24). A. 1s 2 2s 2 2p 6 3s 2 3p 6 3d 4 4s
Mengubah energi kimia menjadi energi listrik Mengubah energi listrik menjadi energi kimia Katoda sebagi kutub positif, anoda sebagai kutub negatif
 TUGAS 1 ELEKTROKIMIA Di kelas X, anda telah mempelajari bilangan oksidasi dan reaksi redoks. Reaksi redoks adalah reaksi reduksi dan oksidasi. Reaksi reduksi adalah reaksi penangkapan elektron atau reaksi
TUGAS 1 ELEKTROKIMIA Di kelas X, anda telah mempelajari bilangan oksidasi dan reaksi redoks. Reaksi redoks adalah reaksi reduksi dan oksidasi. Reaksi reduksi adalah reaksi penangkapan elektron atau reaksi
Perc. Massa Fe Massa S Zat Sisa Massa Fes g 32 g 16 gs 44 g g 8 g - 22 g g 20 g 5g Fe 55 g
 1. Atom unsur-unsur A, B, C, D, dan E mempunyai konfigurasi electron sebagai berikut : A : [He] 2s 2 2p 5 B : [Ne] 3s 2 C : [Ne] 3s 1 D: [He] 2s 2 2p 4 E : [Ne] 3s 2 3p 3 Pasangan unsur yang dapat membentuk
1. Atom unsur-unsur A, B, C, D, dan E mempunyai konfigurasi electron sebagai berikut : A : [He] 2s 2 2p 5 B : [Ne] 3s 2 C : [Ne] 3s 1 D: [He] 2s 2 2p 4 E : [Ne] 3s 2 3p 3 Pasangan unsur yang dapat membentuk
Redoks dan Elektrokimia Tim Kimia FTP
 Redoks dan Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis
Redoks dan Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis
SOAL UN DAN PENYELESAIANNYA 2007
 1. Isotop terdiri dari... A. 13 proton, 14 elektron dan 27 neutron B. 13 proton, 13 elektron dan 27 neutron C. 13 proton, 13 elektron dan 14 neutron D. 14 proton, 14 elektron dan 13 neutron E. 27 proton,
1. Isotop terdiri dari... A. 13 proton, 14 elektron dan 27 neutron B. 13 proton, 13 elektron dan 27 neutron C. 13 proton, 13 elektron dan 14 neutron D. 14 proton, 14 elektron dan 13 neutron E. 27 proton,
LATIHAN SOAL KIMIA KELAS XII
 LATIHAN SOAL KIMIA KELAS XII 1. Suatu larutan diperoleh dari melarutkan 6 gram urea (Mr= 60) dalam 1 liter air. Larutan yang lain diperoleh dari melarutkan 18 gram glukosa (Mr = 180) dalam 1 liter air.
LATIHAN SOAL KIMIA KELAS XII 1. Suatu larutan diperoleh dari melarutkan 6 gram urea (Mr= 60) dalam 1 liter air. Larutan yang lain diperoleh dari melarutkan 18 gram glukosa (Mr = 180) dalam 1 liter air.
UJIAN NASIONAL Informasi berikut digunakan untuk mengerjakan soal nomor 1 s.d. 3.
 UJIAN NASIONAL 009 Informasi berikut digunakan untuk mengerjakan soal nomor s.d.. Perhatikan notasi buah unsur berikut ini : 7 6 9 R ; Q; T 8 9. Konfigurasi elektron untuk unsur R adalah. (Nomor atom He
UJIAN NASIONAL 009 Informasi berikut digunakan untuk mengerjakan soal nomor s.d.. Perhatikan notasi buah unsur berikut ini : 7 6 9 R ; Q; T 8 9. Konfigurasi elektron untuk unsur R adalah. (Nomor atom He
PAKET UJIAN NASIONAL 15 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 15 Pelajaran : KIMIA Waktu : 10 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. Elektron ditemukan oleh. A. J.J. Thomson D. Henri
PAKET UJIAN NASIONAL 15 Pelajaran : KIMIA Waktu : 10 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. 01. Elektron ditemukan oleh. A. J.J. Thomson D. Henri
Review II. 1. Pada elektrolisis larutan NaCl dengan elektroda karbon, reaksi yang terjadi pada katoda adalah... A. 2H 2
 KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 14 Sesi NGAN Review II A. ELEKTROLISIS 1. Pada elektrolisis larutan NaCl dengan elektroda karbon, reaksi yang terjadi pada katoda adalah... A. 2H 2 O 4H + + O 2
KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 14 Sesi NGAN Review II A. ELEKTROLISIS 1. Pada elektrolisis larutan NaCl dengan elektroda karbon, reaksi yang terjadi pada katoda adalah... A. 2H 2 O 4H + + O 2
Kimia Ujian Nasional Tahun 2004
 Kimia Ujian Nasional Tahun 2004 UNAS-04-01 Perhatikan perubahan-perubahan materi berikut : 1. singkong jadi tape 2. lilin mencair 3. susu menjadi basi perubahan yang berlangsung secara kimiawi A. 1, 2,
Kimia Ujian Nasional Tahun 2004 UNAS-04-01 Perhatikan perubahan-perubahan materi berikut : 1. singkong jadi tape 2. lilin mencair 3. susu menjadi basi perubahan yang berlangsung secara kimiawi A. 1, 2,
PREDIKSI 2. Ikatan kovalen koordinat dan ikatan kovalen berturut-turut adalah... A. 1 dan 2 B. 1 dan 3 C. 2 dan 3 D. 3 dan 4 E.
 PREDIKSI 2 Pilihlah jawaban yang paling tepat! 1. Perhatikan gambar struktur Lewis senyawa NH 4 Cl sebagai berikut; Ikatan kovalen koordinat dan ikatan kovalen berturut-turut adalah... A. 1 dan 2 B. 1
PREDIKSI 2 Pilihlah jawaban yang paling tepat! 1. Perhatikan gambar struktur Lewis senyawa NH 4 Cl sebagai berikut; Ikatan kovalen koordinat dan ikatan kovalen berturut-turut adalah... A. 1 dan 2 B. 1
PEMERINTAH KABUPATEN MUKOMUKO DINAS PENDIDIKAN SMA NEGERI 03 MUKOMUKO Desa Agung Jaya, Kec. Air Manjuto, Kabupaten Mukomuko
 PEMERINTAH KABUPATEN MUKOMUKO DINAS PENDIDIKAN SMA NEGERI 03 MUKOMUKO Desa Agung Jaya, Kec. Manjuto, Kabupaten Mukomuko SOAL UAS 011 Mata Pelajaran : Kimia Hari, tanggal : Senin, 8 Maret 011 : 10.30 1.30
PEMERINTAH KABUPATEN MUKOMUKO DINAS PENDIDIKAN SMA NEGERI 03 MUKOMUKO Desa Agung Jaya, Kec. Manjuto, Kabupaten Mukomuko SOAL UAS 011 Mata Pelajaran : Kimia Hari, tanggal : Senin, 8 Maret 011 : 10.30 1.30
PAKET UJIAN NASIONAL 12 Pelajaran : KIMIA Waktu : 120 Menit
 PAKET UJIAN NASIONAL 12 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. Wacana berikut digunakan untuk mengerjakan soal nomor
PAKET UJIAN NASIONAL 12 Pelajaran : KIMIA Waktu : 120 Menit Pilihlah salah satu jawaban yang tepat! Jangan lupa Berdoa dan memulai dari yang mudah. Wacana berikut digunakan untuk mengerjakan soal nomor
UN SMA 2012 IPA Kimia
 UN SMA 0 IPA Kimia Kode Konten Doc. UNSMAIPA0KIM999 Doc. Version : 0- halaman 0. Dua buah unsur dengan notasi 7X dan Y. Jika unsur-unsur tersebut berikatan, bentuk molekul dan kepolaran yang terjadi berturutturut
UN SMA 0 IPA Kimia Kode Konten Doc. UNSMAIPA0KIM999 Doc. Version : 0- halaman 0. Dua buah unsur dengan notasi 7X dan Y. Jika unsur-unsur tersebut berikatan, bentuk molekul dan kepolaran yang terjadi berturutturut
TRY OUT UJIAN NASIONAL SMA PROGRAM IPA AKSES PRIVATE. Mata pelajaran : KIMIA Hari/Tanggal : / 2013
 TRY OUT UJIAN NASIONAL SMA PROGRAM IPA AKSES PRIVATE Mata pelajaran : KIMIA Hari/Tanggal : / 2013 Waktu : 120 Menit PETUNJUK UMUM: 1. Isikan nomor ujian, nama peserta, dan data pada Lembar Jawaban yang
TRY OUT UJIAN NASIONAL SMA PROGRAM IPA AKSES PRIVATE Mata pelajaran : KIMIA Hari/Tanggal : / 2013 Waktu : 120 Menit PETUNJUK UMUM: 1. Isikan nomor ujian, nama peserta, dan data pada Lembar Jawaban yang
Wardaya College. Tes Simulasi Ujian Nasional SMA Berbasis Komputer. Mata Pelajaran Kimia Tahun Ajaran 2017/2018. Departemen Kimia - Wardaya College
 Tes Simulasi Ujian Nasional SMA Berbasis Komputer Mata Pelajaran Kimia Tahun Ajaran 2017/2018-1. Sebuah unsur X memiliki no massa 52 dan jumlah neutron sebesar 28. Kongurasi elektron dari ion X + adalah...
Tes Simulasi Ujian Nasional SMA Berbasis Komputer Mata Pelajaran Kimia Tahun Ajaran 2017/2018-1. Sebuah unsur X memiliki no massa 52 dan jumlah neutron sebesar 28. Kongurasi elektron dari ion X + adalah...
2013 LEMBAR SOAL. WAKTU : 90 MENIT KELAS : XII IPA T
 2013 LEMBAR SOAL. WAKTU : 90 MENIT KELAS : XII IPA T SMA UNGGULAN BPPT DARUS SHOLAH JEMBER UJIAN SEMESTER GENAP T.P 2012/2013 LEMBAR SOAL Waktu : 90 menit Kelas : XII IPA T.P : 2012/2013 PETUNJUK : 1.
2013 LEMBAR SOAL. WAKTU : 90 MENIT KELAS : XII IPA T SMA UNGGULAN BPPT DARUS SHOLAH JEMBER UJIAN SEMESTER GENAP T.P 2012/2013 LEMBAR SOAL Waktu : 90 menit Kelas : XII IPA T.P : 2012/2013 PETUNJUK : 1.
Sel Volta KIM 2 A. PENDAHULUAN B. SEL VOLTA ELEKTROKIMIA. materi78.co.nr
 Sel Volta A. PENDAHULUAN Elektrokimia adalah cabang ilmu kimia yang mempelajari aspek elektronik dari reaksi kimia. Sel elektrokimia adalah suatu sel yang disusun untuk mengubah energi kimia menjadi energi
Sel Volta A. PENDAHULUAN Elektrokimia adalah cabang ilmu kimia yang mempelajari aspek elektronik dari reaksi kimia. Sel elektrokimia adalah suatu sel yang disusun untuk mengubah energi kimia menjadi energi
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A. D. Cu E. Zn
 1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
