KEEFEKTIFAN BAKTERI ENDOFIT DAN PLANT GROWTH PROMOTING RHIZOBACTERIA DALAM MENEKAN PENYAKIT LAYU BAKTERI (Ralstonia solanacearum) PADA TOMAT
|
|
|
- Veronika Chandra
- 6 tahun lalu
- Tontonan:
Transkripsi
1 KEEFEKTIFAN BAKTERI ENDOFIT DAN PLANT GROWTH PROMOTING RHIZOBACTERIA DALAM MENEKAN PENYAKIT LAYU BAKTERI (Ralstonia solanacearum) PADA TOMAT ZHENITA VINDA TRI HANDINI DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN INSTITUT PERTANIAN BOGOR BOGOR 2011
2 ABSTRAK ZHENITA VINDA TRI HANDINI. Keefektifan Bakteri Endofit dan Plant Growth Promoting Rhizobacteria dalam Menekan Penyakit Layu Bakteri (Ralstonia solanacearum) pada Tomat. Dibimbing oleh ABDJAD ASIH NAWANGSIH. Penyakit layu bakteri merupakan salah satu penyakit penting pada tanaman tomat. Penyakit ini disebabkan oleh bakteri patogen Ralstonia solanacearum. Kisaran inang dari R. solanacearum sangat luas. Penelitian ini bertujuan untuk mengetahui keefektifan bakteri endofit jika dikombinasikan dengan bakteri PGPR dalam menekan penyakit layu bakteri pada tomat secara in planta di rumah kaca dan di lapangan serta mengetahui pengaruhnya terhadap pemacuan pertambahan tinggi tanaman. Metode penelitian yang dilakukan yaitu dengan menyiram bibit tomat dengan agens biokontrol yang dilakukan sebelum pindah tanam dan media tanam yang digunakan mengandung R. solanacearum. Bakteri endofit yang digunakan berasal dari penelitian sebelumnya yaitu isolat dengan kode BL10, BC4, dan BC10. Bakteri PGPR yang digunakan merupakan koleksi Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, IPB yaitu P. fluorescens RH4003 dan B. subtilis AB89. Perlakuan yang diberikan terdiri dari 12 perlakuan yaitu aplikasi dari masing-masing bakteri endofit, masing-masing bakteri PGPR, dan kombinasi keduanya serta kontrol. Rancangan percobaan yang digunakan yaitu Rancangan Acak Kelompok (RAK) dan data yang diperoleh dianalisis menggunakan analisis ragam (anova) dengan menggunakan program SAS. R. solanacearum kurang berkembang baik di rumah kaca sehingga tingkat kejadian penyakitnya cukup rendah. Gabungan antara bakteri endofit dan PGPR kurang efektif dalam menekan perkembangan penyakit layu bakteri di lapangan. Aplikasi gabungan antara PGPR dan endofit juga tidak mempengaruhi pertambahan tinggi tanaman dan bobot kering. Bakteri endofit S. epidermidis (BC4) bersifat antagonis jika dikombinasikan dengan bakteri PGPR P. fluorescens RH4003 dan B. subtilis AB89.
3 KEEFEKTIFAN BAKTERI ENDOFIT DAN PLANT GROWTH PROMOTING RHIZOBACTERIA DALAM MENEKAN PENYAKIT LAYU BAKTERI (Ralstonia solanacearum) PADA TOMAT ZHENITA VINDA TRI HANDINI Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Departemen Proteksi Tanaman DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN INSTITUT PERTANIAN BOGOR BOGOR 2011
4 Judul Nama NIM : Keefektifan Bakteri Endofit dan Plant Growth Promoting Rhizobacteria dalam Menekan Penyakit Layu Bakteri (Ralstonia solanacearum) pada Tomat : Zhenita Vinda Tri Handini : A Menyetujui Dosen Pembimbing Dr. Ir. Abdjad Asih Nawangsih, MSi NIP Mengetahui Ketua Departemen Proteksi Tanaman Dr. Ir. Dadang, MSc NIP Tanggal lulus :
5 RIWAYAT HIDUP Penulis dilahirkan di Klaten, Jawa Tengah pada tanggal 3 September Penulis merupakan anak ketiga dari tiga bersaudara pasangan Wuryanto dan Siti Salami. Pada tahun 2004, penulis diterima di SMA Negeri 1 Karanganom dan menamatkan pendidikan di SMA pada tahun Setelah lulus dari SMA, penulis diterima di Institut Pertanian Bogor pada tahun 2007 melalui jalur Undangan Seleksi Masuk IPB (USMI). Pada tahun 2008, penulis menjadi mahasiswa Proteksi Tanaman, Fakultas Pertanian IPB. Selama di IPB penulis bergabung dengan organisasi Himpunan Mahasiswa Proteksi Tanaman (HIMASITA) dan Organic Farming Club. Penulis pernah menjadi asisten praktikum Ilmu Hama Tumbuhan Dasar dan pernah mengikuti Program Kreativitas Mahasiswa (PKM).
6 PRAKATA Puji syukur penulis panjatkan kepada Allah swt. yang telah memberikan rahmat dan karunia-nya sehingga penulis dapat menyelesaikan skripsi yang berjudul Keefektifan Bakteri Endofit dan Plant Growth Promoting Rhizobacteria dalam Menekan Penyakit Layu Bakteri (Ralstonia solanacearum) pada Tomat. Skripsi ini telah mendapatkan banyak bantuan dari beberapa pihak sehingga dapat diselesaikan dengan baik. Penulis mengucapkan banyak terima kasih kepada : 1. Dr. Ir. Abdjad Asih Nawangsih, MSi selaku dosen pembimbing yang telah sabar membimbing dan meluangkan banyak waktu serta telah banyak memberikan ilmu, nasihat, masukan, dan saran kepada penulis. 2. Dr. Ir. Sugeng Santoso, MAgr selaku dosen penguji tamu yang telah memberikan banyak masukan dan saran dalam penyempurnaan skripsi ini. 3. Ibunda dan ayahanda tercinta yang selalu mendoakan penulis dan telah banyak berkorban serta selalu memberikan motivasi dan dukungan bagi penulis sehingga penulis dapat memperoleh gelar sarjana. 4. Kakak-kakakku, Ririn dan Dhian yang telah turut memberikan semangat, doa, dan dukungan selama penelitian sampai penulisan skripsi. 5. Yana Anisa dan Ida Parida sebagai teman satu bimbingan yang telah banyak membantu dan memberikan semangat. 6. Bapak Mput, mbak Didi, teman-teman di laboratorium bakteriologi tumbuhan, dan saudara-saudaraku PTN44 yang telah banyak membantu dan memberikan motivasi. Skripsi ini masih jauh dari sempurna, oleh karena itu saran dan kritik sangat diharapkan oleh penulis. Semoga skripsi ini bisa memberikan banyak manfaat kepada semua pihak yang membaca dan terutama dalam bidang proteksi tanaman. Bogor, Agustus 2011 Zhenita Vinda Tri Handini
7 DAFTAR ISI DAFTAR TABEL... DAFTAR GAMBAR... DAFTAR LAMPIRAN... PENDAHULUAN... 1 Halaman Latar Belakang... 1 Tujuan Penelitian... 3 Hipotesis... 3 TINJAUAN PUSTAKA... 4 Layu Bakteri... 4 Pengendalian Layu Bakteri... 5 Penggabungan Berbagai Jenis Agens Biokontrol... 6 Bakteri Endofit... 7 Isolat Bakteri Endofit BC Isolat Bakteri Endofit BC Isolat Bakteri Endofit BL Rizobakteri Pemacu Pertumbuhan Tanaman... 9 Bacillus subtilis AB Pseudomonas fluorescens RH BAHAN DAN METODE Tempat dan Waktu Penelitian Bahan dan Alat Metode Penelitian Penyiapan Tanaman Uji Isolasi Bakteri Ralstonia solanacearum Peremajaan Bakteri Endofit, PGPR,dan Bakteri Patogen (R. solanacearum) Penyiapan Suspensi Bakteri Patogen, endofit dan PGPR Pengujian Pengaruh Aplikasi Bakteri Endofit dan PGPR terhadap Penyakit Layu Bakteri pada Tomat Percobaan di Rumah Kaca Percobaan di Lapangan Analisis Data HASIL DAN PEMBAHASAN Pengaruh Aplikasi Bakteri Endofit dan PGPR terhadap Pertumbuhan Tanaman dan Kejadian Penyakit Layu Bakteri di Rumah Kaca Laju Pertambahan Tinggi Tanaman Kejadian Penyakit Layu Bakteri x xi xii
8 ix Masa Inkubasi Penyakit Layu Bakteri Bobot Kering Tanaman Pengaruh Aplikasi Bakteri Endofit dan PGPR terhadap Kejadian Penyakit Layu Bakteri di Lapangan Jenis Hubungan Antar Agens Biokontrol KESIMPULAN DAN SARAN Kesimpulan Saran DAFTAR PUSTAKA LAMPIRAN... 45
9 x DAFTAR TABEL Halaman 1 Laju Pertambahan Tinggi Tanaman Tomat pada Berbagai Perlakuan Bakteri PGPR dan Endofit secara Tunggal dan Kombinasi serta Nilai AUHPGC di Rumah Kaca pada Musim Kemarau Laju Pertambahan Tinggi Tanaman Tomat pada Berbagai Perlakuan Bakteri PGPR dan Endofit secara Tunggal dan Kombinasi serta Nilai AUHPGC di Rumah Kaca pada Musim Penghujan Kejadian Penyakit Layu Bakteri pada Berbagai Perlakuan Bakteri PGPR dan Endofit secara Tunggal dan Kombinasi serta Nilai AUDPC di Rumah Kaca pada Musim Penghujan Masa Inkubasi Penyakit Layu Bakteri pada Berbagai Perlakuan Bakteri PGPR dan Endofit secara Tunggal dan Kombinasi di Rumah Kaca pada Musim Penghujan Rata-rata Bobot Kering Tanaman Tomat pada Berbagai Perlakuan Bakteri PGPR dan Endofit secara Tunggal dan Kombinasi di Rumah Kaca pada Musim Penghujan Rata-rata Bobot Kering Tanaman Tomat pada setiap Blok di Rumah Kaca pada Musim Penghujan Kejadian Penyakit Layu Bakteri pada Berbagai Perlakuan Bakteri PGPR dan Endofit secara Tunggal dan Kombinasi serta Nilai AUDPC di Lapangan Hasil Perbandingan Rata-Rata Kejadian Penyakit pada Masing-Masing Perlakuan dengan Kontrol (Uji Dunnett) Keefektifan Pengendalian (Index Penekanan), Nilai SF (Synergy Factor) dan Jenis Hubungan Antar Agens Biokontrol Berdasarkan Nilai AUDPC... 38
10 xi DAFTAR GAMBAR Halaman 1 Hasil Isolasi Patogen; R. solanacearum pada Media TZC Hasil Peremajaan Bakteri endofit, PGPR, dan R. solanacearum; bakteri endofit Bacillus amyloliquefaciens (BL10) a), bakteri endofit Staphylococcus epidermidis (BC4) b), bakteri endofit isolat BC10 c), bakteri PGPR B. subtilis AB89 (B12) d), bakteri PGPR P. fluorescens RH4003 (P1) e), R. solanacearum pada media King s B f)... 15
11 xii DAFTAR LAMPIRAN Halaman 1 Hasil Analisis Ragam Laju Pertambahan Tinggi Tanaman Tomat di Rumah Kaca pada Musim Kemarau Hasil Analisis Ragam Laju Pertambahan Tinggi Tanaman Tomat di Rumah Kaca pada Musim Penghujan Hasil Analisis Ragam Kejadian Penyakit Layu Bakteri pada Tanaman Tomat di Rumah Kaca pada Musim Penghujan Hasil Analisis Ragam Bobot Kering Tanaman Tomat di Rumah Kaca pada Musim Penghujan Hasil Analisis Ragam Kejadian Penyakit Layu Bakteri pada Tanaman Tomat di Lapangan Persiapan Tanah Terinfestasi R. solanacearum; pencampuran suspense R. solanacearum dengan air (a), pencampuran tanaman tomat terserang layu bakteri dengan air (b), pencampuran suspensi R. solanacearum dengan tanah dari lapangan Persiapan Perlakuan Agens Biokontrol; 200 ml suspensi agens biokontrol dimasukkan ke dalam ember (a), pencampuran 200 ml agens biokontrol dengan 1800 ml air Gejala Layu Bakteri di Rumah Kaca Keadaan Pertanaman Tomat di Rumah Kaca; umur 25 hst (kiri), umur 32 hst (kanan) Pengukuran Bobot Kering Tanaman Tomat; penjemuran tanaman (a), penimbangan bobot kering tanaman (b) Gejala Layu Bakteri di Lapangan... 54
12 PENDAHULUAN Latar Belakang Tomat merupakan salah satu dari kelompok sayuran yang memiliki banyak manfaat. Tanaman tomat mudah ditemukan dimana saja dan dapat tumbuh di daerah dataran rendah serta tinggi. Tomat termasuk dalam famili Solanaceae, genus Lycopersicon, dan spesies Lycopersicum esculentum (Tigchelaar 2006). Tanaman tomat termasuk tanaman semusim yaitu tanaman dengan sekali panen dan setelah itu tanaman akan mati. Budidaya tomat lebih banyak dilakukan di daerah dataran tinggi daripada di daerah dataran rendah, karena budidaya tomat di daerah dataran rendah sering terjadi serangan penyakit layu bakteri. Menurut Tigchelaar (2006) suhu optimum bagi pertumbuhan tomat yaitu C, pertumbuhan dan perkembangan tomat hampir akan berhenti jika suhu di bawah 10 0 C. Masa tanam tomat yang baik yaitu pada awal musim kemarau atau pada akhir musim hujan. Salah satu penyakit penting pada tomat yaitu layu bakteri yang dapat mengakibatkan penurunan hasil panen. Layu bakteri menyebabkan tanaman menjadi layu dan akhirnya mati. Gejala awal dari penyakit layu bakteri yaitu layunya daun-daun termuda dari tanaman. Gejala selanjutnya yaitu seluruh tanaman menjadi layu secara tiba-tiba. Sampai saat ini penyakit layu bakteri merupakan penyakit penting dan sangat merugikan sampai ± 75% (Gunawan 1997). Penyakit layu bakteri disebabkan oleh bakteri patogen Ralstonia solanacearum (McCarter 2006). Penyakit ini penting karena dapat menyerang beberapa tanaman yang termasuk ke dalam famili Solanaceae dan beberapa famili tanaman yang lain. Menurut Yang (1979) patogen ini dapat menyerang lebih dari 25 famili tanaman, kebanyakan terdiri dari tanaman seperti tomat, kentang, tembakau, lada, terung, kacang tanah, kedelai, dan pisang. Sampai saat ini beberapa cara pengendalian layu bakteri sudah dilakukan, seperti diproduksinya benih tahan layu bakteri. Namun, variasi ras dan strain dari R. solanacearum menyebabkan sulitnya penggunaan varietas tahan tersebut di beberapa daerah, varietas tahan yang akan digunakan harus mampu bertahan dan cocok di daerah setempat (AVRDC 2004). Beberapa teknik pengendalian secara
13 2 biologi atau hayati sudah banyak dicoba. Sebagai contohnya yaitu yang telah dilakukan oleh Nawangsih (2006) yang menggunakan bakteri antagonis Pseudomonas fluorescens RH4003 dan Bacillus subtilis AB89 dalam menghambat perkembangan R. solanacearum pada tomat. P. flurorescens RH40003 merupakan bakteri gram negatif, tidak membentuk spora, menghasilkan senyawa floresen pada medium King s B agar (Nawangsih 2006). Dari hasil penelitian Nawangsih (2006) diketahui bahwa B. subtilis AB89 menghasilkan zone hambatan dengan diameter paling besar dan mampu menginduksi aktifitas peroxidase paling tinggi, serta menghasilkan siderofor dan protease. Pseudomonas fluorescens RH4003 dan Bacillus subtilis AB89 tersebut merupakan kelompok bakteri PGPR. Menurut Soesanto (2008) PGPR merupakan rizobakteri pemacu pertumbuhan tanaman, bakteri PGPR mampu mengkoloni perakaran tanaman. Karena keaktifan pengkolonian akar tersebut, akar dapat menyerap produk mikroba yang secara langsung mempengaruhi pertumbuhan dan fisiologi akar serta invasi patogen. Selain penggunaan bakteri PGPR tersebut, bakteri endofit juga telah diteliti untuk menekan perkembangan patogen R. solanacearum. Menurut Hayward & Hartman (1994) bakteri endofit yaitu mikroorganisme yang hidup di dalam jaringan tanaman dan akan bersaing dengan patogen. Damayanti (2010) mengisolasi bakteri endofit dari tanaman tomat sehat dan diperoleh beberapa isolat bakteri endofit yang mampu menekan perkembangan patogen R. solanacearum. Bakteri endofit tersebut diantaranya yaitu isolat dengan kode BC4, BC10, dan BL10. Ketiga isolat tersebut akan digunakan dalam penelitian ini. Penggunaan bakteri antagonis memiliki beberapa keuntungan. Pada dasarnya bakteri antagonis mampu mengeksploitasi kondisi yang disukai patogen. Bakteri antagonis yang ideal harus dapat mengkolonisasi dan bertahan pada jaringan pada berbagai kondisi saat jaringan tumbuh tanpa mengurangi hasil (Saddler 2008). Sampai saat ini pengujian bakteri antagonis (bakteri PGPR dan bakteri endofit) untuk menekan perkembangan bakteri R. solanacearum dilakukan secara masing-masing, belum ada penelitian yang menggabungkan bakteri PGPR dengan bakteri endofit dalam menekan perkembangan patogen. Dalam penelitian ini akan dilakukan penggabungan bakteri PGPR dan bakteri endofit dalam menekan
14 3 perkembangan penyakit layu bakteri pada tomat. Pemberian agens biokontrol dengan cara kombinasi/ penggabungan dari dua atau lebih agens biokontrol dimaksudkan untuk meningkatkan keefektifannya dalam mengendalikan suatu penyakit pada tanaman. Seperti yang telah diketahui bahwa bakteri PGPR berfungsi melindungi (memberikan proteksi) tanaman dari serangan patogen dengan mengkolonisasi di daerah perakaran dan bakteri endofit hidup dalam jaringan tanaman yang berfungsi melindungi tanaman dari serangan patogen. Dengan aplikasi gabungan dari kedua bakteri ini diharapkan tanaman dapat terlindungi dari serangan patogen. Patogen yang akan masuk melalui akar akan dicegah masuknya oleh bakteri PGPR dan apabila patogen masih lolos maka patogen tersebut akan dihambat perkembangannya oleh bakteri endofit dalam jaringan tanaman. Penggabungan kedua bakteri ini untuk melihat apakah kedua bakteri efektif dalam mengendalikan penyakit layu bakteri jika diaplikasikan secara bersama dan apakah kedua bakteri tersebut bersifat sinergis (saling mendukung) atau antagonis (saling menghambat). Tujuan Penelitian ini bertujuan untuk mengetahui keefektifan bakteri endofit jika dikombinasikan dengan bakteri PGPR dalam menekan perkembangan penyakit layu bakteri pada tomat secara in planta di rumah kaca dan di lapangan serta mengetahui pengaruhnya terhadap pemacuan pertambahan tinggi tanaman tomat. Hipotesis Gabungan bakteri endofit dan PGPR dapat menekan perkembangan penyakit layu bakteri pada tomat dengan efektif dan dapat memacu pertambahan tinggi tanaman tomat.
15 TINJAUAN PUSTAKA Layu Bakteri Salah satu penyakit yang banyak menyerang tanaman tomat yaitu penyakit layu bakteri. Penyakit ini disebabkan oleh bakteri Ralstonia solanacearum (McCarter 2006). Serangan berat penyakit layu bakteri banyak terjadi di daerah beriklim tropis dan subtropis dengan curah hujan tinggi dan temperatur panas. R. solanacearum masuk dan memperbanyak diri melalui pembuluh xylem dalam jaringan tanaman sehingga mengganggu proses translokasi air dan nutrisi, akibatnya tanaman menjadi terkulai layu dan mati (Agrios 1988). Tanaman yang pertama layu terjadi pada daun paling muda selama suhu panas (AVRDC 2004), selanjutnya dalam waktu 7-25 hari tanaman akan mati (Nasrun et al. 2007). Tanaman yang terinfeksi dapat kembali segar untuk sementara pada sore hari ketika suhu udara menjadi lebih dingin. Beberapa hari kemudian, tiba-tiba tanaman menjadi layu permanen. Akar dan bagian bawah dari batang berwarna cokelat pada sistem pembuluhnya, warna cokelat pada berkas pembuluh tersebut akan terlihat jika akar atau batang dipotong/ diiris secara melintang (AVRDC 2004). Gejala lain dari layu bakteri yaitu jika batang tanaman terserang dipotong dan diletakkan pada suatu wadah kecil yang berisi air maka akan terlihat oose (massa) bakteri seperti benang-benang putih halus yang keluar dari potongan batang tersebut (AVRDC 2004). Ketika keadaan kurang menguntungkan bagi perkembangan penyakit (seperti kondisi yang terlalu dingin dan kering), tanaman yang terinfeksi hanya akan menunjukkan gejala kerdil dan akar adventif berkembang pada batang utama, daun bagian bawah akan menjadi kuning sebelum gejala layu terjadi (AVRDC 2004). Tanaman tampak seolah-olah seperti kekurangan air. Hal ini karena bakteri menyerang pembuluh kayu (xylem) sehingga air dan unsur hara tidak dapat masuk ke dalam tanaman akibat tersumbat oleh massa bakteri (Gunawan 1997). Layu bakteri biasanya muncul pada saat tanaman dalam fase paling rentan yaitu menjelang pembungaan (Nawangsih 2006). R. solanacearum dapat bertahan dalam jaringan tanaman atau berasosiasi
16 5 dengan inang alternatif seperti Ageratum conyzoides, Crassocephalum crepidiodes, Crotalaria juncea, dan Croton hirtus (Mehan et al. 1994). Penyakit layu bakteri menyerang tanaman tomat pada berbagai stadia pertumbuhan dan dapat menyebabkan kerugian sampai ± 75% (Gunawan 1997). Penyakit layu bakteri ini kadang-kadang dikelirukan dengan penyakit yang disebabkan oleh cendawan seperti layu Fusarium (AVRDC 2004). Untuk membedakannya, batang tanaman dipotong lalu dimasukkan ke dalam air steril. Jika mengeluarkan lendir maka layu tersebut disebabkan oleh bakteri (McCarter 2006). Pengendalian Layu Bakteri Teknik pengendalian yang dapat dilakukan untuk menekan atau mengurangi penyakit layu bakteri yaitu: 1) rotasi tanaman dengan menggunakan tanaman yang bukan termasuk famili Solanaceae (jagung, kubis, wortel) yang dipadukan dengan sanitasi tanah, 2) perbaikan drainase dan irigasi serta pengendalian gulma, 3) pemberian kapur untuk meningkatkan ph tanah sehingga semua unsur hara dapat diserap tanaman, 4) menghindari tanah yang terinfeksi berat dengan cara pergiliran tanaman yang lama dan hindari penyebaran nematoda dengan menggunakan nematisida/ insektisida untuk mengendalikan serangga tanah yang diaplikasikan sebelum tanam (Gunawan 1997). Bustamam (2006) melakukan seleksi mikroba rizosfer antagonis dari tanah suppressive yang terinfeksi R. solanacearum, dari hasil isolasi diperoleh beberapa mikroba antagonis yang efektif dalam mengendalikan penyakit layu bakteri pada jahe. Menurut McCarter (2006) pengendalian layu bakteri pada tanaman yang tumbuh pada tanah yang telah terinfestasi R. solanacearum sulit dilakukan. Varietas tahan yang berhasil di daerah setempat mungkin akan gagal ketika ditanam di tempat lain. Hal tersebut dapat terjadi karena strain patogen yang berbeda dan keadaan lingkungan yang berbeda. Menurut Sigee (1993) pengendalian layu bakteri banyak menggunakan strain-strain bakteri yang bersifat antagonis terhadap patogen, agens antagonis tersebut dapat berasal dari mikroorganisme alamiah atau strain hasil rekayasa genetik.
17 6 Pengendalian secara biologi terhadap layu bakteri yang telah dilakukan yaitu dengan menggunakan P. fluorescens dan Bacillus spp. pada nilam (Chrisnawati et al. 2009) serta P. fluorescens dan B. subtilis pada tomat (Nawangsih 2006). Damayanti (2010) menggunakan bakteri endofit untuk menekan perkembangan penyakit layu bakteri pada tomat. Dari beberapa isolat yang digunakan terdapat tiga isolat yang menunjukkan potensinya dalam menekan perkembangan penyakit layu bakteri. Ketiga isolat tersebut yaitu BC4, BC10, dan BL10. Tingkat kejadian penyakit dari ketiga isolat tersebut lebih rendah dibandingkan tingkat kejadian penyakit pada perlakuan lain dan kontrol. Sehingga diambil isolat dengan kode BC4, BC10, dan BL10 untuk uji lanjut. Penggabungan Berbagai Jenis Agens Biokontrol Konsep dari penggunaan agens biokontrol didasarkan pada kemampuan agens biokontrol itu untuk berkolonisasi di rizosfer, untuk menghasilkan antibiotik dalam jaringan tanaman, untuk mendukung perkembangan agens biokontrol, dan mencegah atau menghambat perkembangan patogen (Hayward & Hartman 1994). Berdasarkan hasil pengujian Nawangsih (2006) bahwa P. fluorescens RH4003, Bacillus subtilis AB89 dan B. cereus L32 menunjukkan antagonisme bila diaplikasikan secara bersamaan. Hal tersebut dapat terjadi karena adanya kompetisi ruang maupun nutrisi atau agens biokontrol mengeluarkan senyawa yang dapat menghambat populasi maupun kinerja agens biokontrol yang lain. Ketiga agens biokontrol yang digunakan dalam pengujian (B. subtilis AB89, B.cereus L32, dan P. fluorescens RH4003) menghasilkan siderofor sehingga bila diaplikasikan secara bersamaan akan terjadi persaingan antar agens biokontrol dalam mengchelat Fe 3+ (Nawangsih 2006). Persyaratan agar aplikasi dua agens biokontrol atau lebih dapat bekerja secara optimal yaitu: 1) bekerja pada tempat yang berbeda misalnya pada rizosfer atau sisa-sisa bahan organik, 2) memiliki mekanisme pengendalian yang berbeda, misalnya kompetisi dan antibiosis, 3) memerlukan substrat yang berbeda, misalnya lendir tanaman dan bakteri untuk cendawan dan eksudat akar untuk bakteri kelompok pseudomonas, dan 4) kompatibel dengan lingkungan tanah serta
18 7 perubahan yang terjadi karena peningkatan cara bercocok tanam (Graham & Mitchell 1999 dalam Nawangsih 2006). Penggabungan P. fluorescens dengan Bacillus spp. juga diuji untuk mengendalikan layu bakteri pada nilam dan diperoleh hasil bahwa kombinasi kedua bakteri tersebut mampu menekan perkembangan layu bakteri, selain itu mampu meningkatkan tinggi tanaman, jumlah daun, jumlah tunas, berat basah daun, dan berat kering daun (Chrisnawati et al. 2009). Sudarsono & Malik (2006) melakukan pengujian untuk mengendalikan penyakit layu bakteri pada kentang dengan mengkombinasikan agens antagonis P. fluorescens dan B. subtilis yang diaplikasikan bersama dengan EM4 dan bokashi. Dari beberapa perlakuan yang diberikan yaitu kombinasi antara P. fluorescens, B. subtilis, dan bokashi mampu memberikan efektifitas pengendalian yang lebih besar daripada perlakuan lain yaitu sebesar 53,13%. Kombinasi tersebut juga memiliki bobot kering yang lebih besar dibanding perlakuan yang lain yaitu sebesar 4,08 gram. Bakteri Endofit Bakteri endofit yaitu mikroorganisme yang hidup di dalam jaringan tanaman dan akan bersaing dengan patogen serta keberadaannya dalam jaringan tanaman tidak membahayakan inangnya (Hayward & Hartman 1994; Tan 2001 dalam Radji 2005). Penggunaan endofit yang bersifat antagonis ini memiliki beberapa keuntungan dibanding dengan penggunaan mikroba antagonis lain, diantaranya yaitu: mikroba endofit sudah terbentuk dalam tanaman yang akan tetap ada atau bertahan selama perkembangan tanaman dan terus memberikan perlindungan bagi tanaman (Hayward & Hartman 1994). Damayanti (2010) melakukan isolasi bakteri endofit dari tanaman tomat yang berasal dari tiga tempat yaitu Bogor, Cipanas, dan Lembang. Dari hasil isolasi diperoleh sebanyak 49 isolat, 17 diisolasi dari tanaman asal Bogor, 18 isolat dari Cipanas, dan 14 isolat dari Lembang. Masing-masing bakteri endofit memiliki ciri fisik yang berbeda satu sama lain. Berdasarkan uji reaksi hipersensitif (HR) diketahui bahwa terdapat sejumlah bakteri endofit yang menimbulkan reaksi negatif pada uji tersebut, seperti BC4, BC10, dan BL10 yang akan digunakan dalam penelitian ini. Isolat dengan kode BC4 dan BC10 mampu
19 8 memberikan penekanan terhadap perkembangan R. solanacearum sebesar 66,67% dan 60% lebih baik dibandingkan dengan BL10. Isolat Bakteri Endofit BC4 BC4 merupakan isolat untuk bakteri endofit yang diisolasi dari bagian batang bawah tanaman tomat asal Cipanas. Dalam pengujian penghambatan pertumbuhan R. solanacearum secara in vitro dengan metode dual culture diperoleh hasil bahwa BC4 membentuk zona bening (zona hambatan) dengan diameter rata-rata terpanjang sebesar 0,5 cm. Karakter biokimia dan fisiologi dari isolat ini yaitu: 1) karakter biokimia; memiliki reaksi positif terhadap uji katalase, strach, glukosa, manitol, laktosa, maltosa, dan salicin, 2) karakter fisiologi; gram negatif, bentuk batang, tidak berspora, non motil, dapat tumbuh dalam suhu anaerob dan anaerob fakultatif, katalase positif, oksidase positif. Karakter morfologi dari BC4 yaitu: permukaan cembung, tepian rata, bentuk bulat licin, ukuran sedang, dan ciri lain yaitu tidak lengket serta pertumbuhannya cepat pada medium King s B (Damayanti 2010). Berdasarkan sekuens 16S rrna (Nawangsih 7 Maret 2011, komunikasi pribadi) spesies dari isolat BC4 yaitu Staphylococcus epidermidis. Isolat Bakteri Endofit BC10 BC10 merupakan isolat untuk bakteri endofit yang diisolasi dari bagian batang bawah tanaman tomat asal Cipanas. Dalam pengujian penghambatan pertumbuhan R. solanacearum secara in vitro dengan metode dual culture diperoleh hasil bahwa BC10 membentuk zona bening (zona hambatan) dengan diameter sebesar 0,4 cm. Karakter morfologi dari BC10 yaitu: permukaan datar, tepian bergerigi, bentuk bulat, ukuran kecil, dan ciri lain yaitu tidak lengket serta pertumbuhan pada medium King s B sedang. Untuk isolat dengan kode BC10 ini belum dilakukan uji untuk mengetahui spesies dan belum dilakukan pengujian terhadap karakter fisiologi dan biokimianya (Damayanti 2010). Isolat Bakteri Endofit BL10 BL10 merupakan isolat untuk bakteri endofit yang diisolasi dari bagian batang bawah tanaman tomat asal Lembang. Karakter morfologi dari BL10 berdasarkan uji kemampuan penghambatan populasi R. solanacearum yaitu: permukaan cembung, tepian rata, bentuknya bulat licin, ukuran sedang, dan ciri
20 9 lain yaitu tidak lengket serta pertumbuhannya cepat pada media King s B. Karakter fisiologi dan biokimia dari isolat ini yaitu: 1) karakter biokimia; memiliki reaksi positif terhadap uji katalase, strach, glukosa, manitol, laktosa, maltosa, dan salicin, 2) karakter fisiologi; gram negatif, bentuk batang, tidak berspora, motilitas dubius, dapat tumbuh dalam suhu anaerob dan anaerob fakultatif, katalase positif, oksidase negatif (Damayanti 2010). Berdasarkan sekuens 16S rrna spesies dari isolat BL10 yaitu Bacillus amyloliquefaciens (Nawangsih 7 Maret 2011, komunikasi pribadi). Dari hasil pengujian tersebut diketahui bahwa isolat asal Cipanas memiliki zona hambatan yang lebih besar dibandingkan isolat asal Bogor dan Lembang. Oleh karena itu, isolat asal Cipanas lebih besar potensinya untuk dijadikan sebagai bakteri antagonis untuk melawan patogen dalam menekan penyakit layu bakteri pada tanaman tomat. Damayanti (2010) juga melakukan uji pengaruh aplikasi bakteri endofit terhadap tinggi tanaman tomat. Dari uji tersebut diketahui bahwa aplikasi bakteri endofit tidak menunjukkan perbedaan yang nyata terhadap tinggi tanaman. Rizobakteri Pemacu Pertumbuhan Tanaman (PGPR) Menurut Soesanto (2008) PGPR merupakan rizobakteri pendukung pertumbuhan tanaman, bakteri PGPR mampu mengkoloni perakaran tanaman. Oleh karena itu, keaktifan pengkolonian akar tersebut, akar dapat menyerap produk mikroba yang secara langsung mempengaruhi pertumbuhan dan fisiologi akar serta invasi patogen. Kecepatan pertumbuhan PGPR di sepanjang akar menentukan tingkat persaingan untuk mengkoloni akar. Kemampuan pengkolonian akar oleh PGPR dipengaruhi oleh faktor di dalam tanah dan persaingannya dengan mikroba lain. Menurut Kloepper (1991) pengaruh PGPR terhadap tanaman secara umum terdiri dari dua kategori yaitu: pemacu pertumbuhan tanaman, kelompok Pseudomonas sp. menghasilkan pengkelat Ca 2+ yang berguna bagi pertumbuhan tanaman (Soesanto 2008) dan sebagai pengendalian biologi (Kloepper 1991). Beberapa strain PGPR memacu pertumbuhan tanaman secara langsung dengan memproduksi metabolit yang merangsang pertumbuhan tanaman sendiri dari mikroflora tanah.
21 10 Menurut Soesanto (2008) kelebihan dari PGPR yaitu: a) mampu menghasilkan atau mengubah konsentrasi fitohormon asam indolasetat (IAA), b) antagonisme terhadap mikroba fitopatogen melalui produksi siderofor, glukanase, kitinase, selulase, antibiotika, dan sianida, c) pelarut fosfat mineral dan nutrisi lainnya, d) mengatur produksi etilen pada perakaran, e) menurunkan ketoksinan logam berat. Keaktifan PGPR dipengaruhi oleh beberapa faktor diantaranya yaitu: potensi kelembaban, tekanan oksigen, suhu, ph, kandungan lempung, daya larut ion, dan tahap organik tanah (Soesanto 2008). Menurut Glick & Pasternak (2003) keuntungan dari mekanisme PGPR dibedakan menjadi dua yaitu secara langsung dan tidak langsung. Keuntungan secara langsung pada tanaman mencakup mampu memfiksasi nitrogen dan memberikannya pada tanaman; meningkatkan ketersediaan atau menyimpan besi dan fosfor dari tanah, menyediakan mineral-mineral tersebut dalam bentuk yang dapat digunakan oleh tanaman; mensintesis enzim yang dapat mengatur tingkat hormon etilen tanaman; dan mensintesis fitohormon seperti auksin, sitokinin, atau giberelin yang memicu perkembangbiakan sel tanaman (Glick & Pasternak 2003). Keuntungan PGPR secara tidak langsung terjadi ketika strain mikroba bermanfaat mencegah pertumbuhan patogen dalam tanah yang dapat mengganggu pertumbuhan dan perkembangan normal tanaman. PGPR menghasilkan siderofor yang menghasilkan strain bermanfaat untuk mencegah perkembangan fitopatogen (Glick & Pasternak 2003). B. subtilis AB89 Nawangsih (2006) menggunakan isolat B. subtilis AB89 untuk menghambat perkembangan bakteri patogen R. solanacearum pada tomat. Aplikasi agens biokontrol di lapangan menunjukkan bahwa isolat AB89 mampu menekan perkembangan penyakit layu bakteri. Bacillus subtilis AB89 positif menghasilkan siderofor setelah diinkubasi selama 3 hari (Nawangsih 2006). Siderofor dari bahasa Yunani berarti pembawa ion besi, siderofor akan muncul pada saat kondisi lingkungan dengan ion Fe 3+ terbatas dan mengakibatkan besi tidak tersedia bagi patogen. Menurut Nawangsih (2006) B. subtilis AB89 memiliki kelebihan dibandingkan dengan agens biokontrol lain yang digunakan dalam pengujian
22 11 antara lain yaitu: menghasilkan zone hambatan dengan diameter paling besar, menghasilkan penekanan paling tinggi terhadap keparahan penyakit di lapangan meskipun kemampuan mengkolonisasi perakaran bibit lebih rendah, mampu menginduksi aktifitas peroxidase paling tinggi, serta menghasilkan siderofor dan protease. Enzim peroksidase merupakan salah satu enzim yang berperan dalam proses ketahanan tanaman terhadap patogen (Brimecombe et al dalam Nawangsih 2006). P. fluorescens RH4003 Isolat P. fluorescens RH4003 menurut Nawangsih (2006) tidak menghasilkan zona hambatan pada media NA tetapi pada media King s B dan CPMA Ca 2+ menunjukkan adanya zona hambatan. Luas zona hambatan dipengaruhi oleh jenis media. Media King s B merupakan media yang memiliki kandungan Fe yang sangat rendah, hal tersebut sangat cocok bagi pembentukan siderofor oleh P. fluorescens. Isolat RH4003 membentuk zona hambatan pada media yang mengandung glukosa tetapi tidak pada media yang mengandung mannitol maupun dextrose. Pengujian di rumah kaca menunjukkan bahwa isolat RH4003 mampu menekan perkembangan penyakit layu bakteri, indeks penekanan oleh isolat RH4003 yaitu sebesar 62%. Berdasarkan hasil sekuensing parsial 16S rdna, isolat RH4003 memiliki kesamaan 98% dengan P. fluorescens. Karakter fisiologi RH4003 yaitu gram negatif, tidak membentuk spora, menghasilkan senyawa floresen pada medium King s B agar, Levan negatif, reaksi oksidase positif, Arginine dihydrolase positif, tidak menghasilkan reaksi hipersensitif pada tembakau, tidak tumbuh pada 41 0 C, tidak mencairkan gelatin, dan pertumbuhannya positif pada L-arabinosa, D- galaktosa serta sorbitol. Produksi asam dari xylose positif, lactose negatif, glukosa positif, maltosa negatif, dan sukrosa positif lemah (Nawangsih 2006).
23 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilakukan pada bulan Juli 2010 Maret Penelitian dilakukan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dan di Rumah Kaca serta di Kebun Percobaan, University Farm, Institut Pertanian Bogor. Bahan dan Alat Bakteri endofit yang digunakan diperoleh dari penelitian sebelumnya yang diisolasi dari batang tanaman tomat sehat di wilayah Bogor, Cipanas, dan Lembang yaitu isolat dengan kode BL10, BC4, dan BC10 (Damayanti 2010). Bakteri PGPR yang digunakan yaitu Pseudomonas fluorescens RH4003 dan Bacillus subtilis AB89 yang merupakan koleksi Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, IPB (Nawangsih 2006). Bakteri Ralstonia solanacearum diisolasi dari tanaman tomat yang terserang layu bakteri, tanaman sampel berasal dari Lembang, Bandung. Dalam penelitian digunakan pula tanah dari lapangan yang telah mengandung bakteri R. solanacearum yang diambil di sekitar pertanaman tomat yang terserang layu bakteri dan tanah steril. Digunakan pula pupuk kandang untuk menambah unsur hara tanah. Bahan-bahan kimia yang digunakan terdiri dari media TZC, King s B Agar (KBA), media cair 523, nutrient agar dan nutrient broth. Benih tomat yang digunakan dalam pengujian adalah varietas Arthaloka. Pot tray dan polybag digunakan dalam pembibitan dan pengujian tanaman tomat di rumah kaca. Metode Penelitian Penyiapan tanaman uji Varietas tomat yang digunakan dalam pengujian yaitu varietas Arthaloka. Media tanam yang digunakan dalam pembibitan yaitu kompos dan sekam dengan perbandingan 1:1. Benih tomat disemai pada pot tray dengan dua benih tiap lubang. Setelah disemai, benih disiram secukupnya kemudian pot tray ditutup menggunakan koran selama dua hari untuk menjaga kelembaban. Bibit disiram
24 13 setiap dua hari sekali. Setelah berumur tiga minggu bibit tomat dipindah tanam pada polybag untuk aplikasi di rumah kaca dan dipindah tanam ke lahan untuk aplikasi di lapangan. Polybag yang digunakan berdiameter 20 cm dengan media tanam yang terdiri dari tanah, kompos, dan tanah yang telah terinfestasi bakteri R. solanacearum. Tanah dan kompos dicampur lalu disterilkan. Tanah yang terinfestasi bakteri patogen berasal dari lapangan di sekitar pertanaman tomat yang terserang layu bakteri dan ditambah dengan biakan bakteri patogen yang telah diisolasi dari tanaman tomat yang terserang layu bakteri. Suspensi bakteri patogen yang digunakan sebanyak 600 ml dalam media cair 523. Kemudian suspensi terebut dilarutkan dalam 2 liter air. Media tanam tersebut dimasukkan ke dalam polybag dengan susunan dari bawah yang terdiri dari tanah steril ± 6 cm, tanah terinfestasi bakteri patogen ± 9 cm, lalu ditutup lagi dengan tanah steril ± 10 cm. Isolasi bakteri R. solanacearum Isolasi bakteri patogen dilakukan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, IPB. Tanaman sampel diperoleh dari Lembang, Bandung. Tanaman dicuci lalu batangnya dipotong melintang. Potongan batang tersebut dicelupkan ke dalam air steril dalam tabung reaksi. Massa bakteri (oose) yang mirip dengan benang-benang putih halus akan keluar dari potongan batang selama beberapa menit. Batang dibiarkan tercelup beberapa saat sampai air steril menjadi keruh. Massa bakteri (oose) patogen dari hasil isolasi diambil sebanyak 100 µl dengan pipet volumetrik dan disebar pada media TZC, kemudian diinkubasikan pada suhu ruang selama jam. Setelah jam akan terlihat koloni bakteri patogen seperti pada Gambar 1. Koloni yang digunakan untuk infestasi tanah adalah yang virulen ditandai dengan bentuk koloni berlendir (fluidal) dan dibagian tengah berwarna merah muda.
25 14 Gambar 1 Hasil isolasi patogen; R. solanacearum pada media TZC Peremajaan bakteri endofit, PGPR, dan bakteri patogen (R. solanacearum) Bakteri endofit yang digunakan diperoleh dari penelitian sebelumnya yang diisolasi dari batang tanaman tomat sehat yang dipilih diantara tanaman tomat yang terserang parah oleh layu bakteri (Damayanti 2010). Sumber bakteri endofit tersebut diisolasi dari pertanaman tomat di daerah Bogor, Lembang, dan Cipanas. Kode isolat yang digunakan dalam penelitian yaitu BL10, BC4, dan BC10. Bakteri endofit hasil isolasi pada penelian sebelumnya dan bakteri PGPR yang ada di laboratorium disimpan dalam media cair yang mengandung gliserol 20% pada suhu C. Bakteri endofit dan PGPR diremajakan terlebih dulu pada media nutrient agar dalam cawan petri (Gambar 2). Sebelum digunakan untuk pengujian, bakteri patogen diremajakan pada media King s B Agar (KBA) dan diinkubasikan selama jam pada suhu kamar (Gambar 2). Bakteri patogen diremajakan pada media King s B untuk dilihat koloni tunggalnya.
26 15 a b c d e f Gambar 2 Hasil peremajaan bakteri endofit, PGPR, dan R. solanacearum; bakteri endofit Bacillus amyloliquefaciens (BL10) a), bakteri endofit Staphylococcus epidermidis (BC4) b), bakteri endofit isolat BC10 c), bakteri PGPR B. subtilis AB89 (B12) d), bakteri PGPR P. fluorescens RH4003 (P1) e), R. solanacearum pada media King s B f) Penyiapan suspensi bakteri patogen, endofit, dan PGPR Permukaan media King s B Agar yang telah ditumbuhi bakteri patogen disiram dengan 6 ml air steril dan digosok menggunakan jarum ose hingga bakteri terlepas dari media dan membentuk suspensi. Suspensi tersebut diambil sebanyak 6 ml menggunakan pipet volumetrik lalu diinokulasikan ke dalam media cair 523 yang ditambah dengan supernatan daun tomat sebanyak 100 µl. Kemudian
27 16 suspensi tersebut dikocok menggunakan shaker selama jam. Supernatan dibuat dengan cara mencampur 0,5 gram daun tomat dengan air steril 10 ml lalu ditumbuk dan diambil ekstraknya sebanyak 1 ml kemudian dimasukkan ke dalam Eppendorf. Eppendorf yang berisi ekstrak daun tomat disentrifugasi dengan kecepatan rpm pada suhu 25 0 C selama lima menit. Suspensi bakteri patogen tersebut disiapkan sebanyak 600 ml. Bakteri endofit dan PGPR yang digunakan diambil dari stok yang disimpan pada suhu C. Bakteri tersebut didiamkan beberapa saat sampai mencair. Setelah mencair, suspensi bakteri diambil sebanyak 100 µl menggunakan pipet volumetrik dan masing-masing bakteri disebar pada permukaan media nutrient agar dalam cawan petri. Cawan yang telah diinokulasi bakteri endofit dan PGPR kemudian diinkubasikan pada suhu ruang selama jam. Pada permukaan media yang telah ditumbuhi bakteri endofit dan PGPR selanjutnya disiram dengan 5 ml air steril dan digosok menggunakan jarum ose hingga bakteri terlepas dari media agar dan membentuk suspensi. Selanjutnya suspensi tersebut diambil sebanyak 1 ml menggunakan pipet volumetrik dan diinokulasikan ke dalam media cair nutrient broth 250 ml, lalu dikocok menggunakan shaker selama jam. Kerapatan bakteri yang digunakan yaitu cfu/ml. Pengujian pengaruh aplikasi bakteri endofit dan PGPR terhadap penyakit layu bakteri pada tomat Percobaan di Rumah Kaca Percobaan di rumah kaca dilakukan pada dua musim yaitu musim kemarau (bulan September-November) dan musim penghujan (bulan Desember-Maret). Bibit tomat yang telah berumur 3 minggu disiram akarnya dengan agens biokontrol sesuai perlakuan. Untuk perlakuan tunggal setiap bibit disiram sebanyak 50 ml agens biokontrol dan untuk perlakuan kombinasi disiram sebanyak 25 ml dari masing-masing agens biokontrol yang dikombinasikan. Sebelumnya, agens biokontrol yang akan digunakan dilarutkan terlebih dulu. Suspensi agens biokontrol dalam 250 ml media cair nutrient broth diambil sebanyak 200 ml lalu dilarutkan dalam 1800 ml air. Sehingga diperkirakan
28 17 populasi bakteri adalah cfu/ml. Untuk pelakuan kontrol, bibit tomat disiram dengan air sebanyak 50 ml tanpa diberi perlakuan agens biokontrol. Perlakuan yang diberikan terdiri dari 12 perlakuan termasuk kontrol dan tiap perlakuan diulang sebanyak 3 kali. Perlakuan tersebut yaitu: K = perlakuan kontrol diberi patogen tetapi tanpa agens biokontrol P1 = P. fluorescens RH4003 B12 = B. subtilis AB89 BC4 = bakteri endofit isolat BC4 BC10 = bakteri endofit isolat BC10 BL10 = bakteri endofit isolat BL10 P1 + BC4 = P. fluorescens RH bakteri endofit isolat BC4 P1 + BC10 = P. fluorescens RH bakteri endofit isolat BC10 P1 + BL10 = P. fluorescens RH bakteri endofit isolat BL10 B12 + BC4 = B. subtilis AB89 + bakteri endofit isolat BC4 B12 + BC10 = B. subtilis AB89 + bakteri endofit isolat BC10 B12 + BL10 = B. subtilis AB89 + bakteri endofit isolat BL10 Bibit tomat yang telah diberi perlakuan tersebut didiamkan selama satu hari, selanjutnya bibit tomat dipindah tanam pada polybag. Media tanam terdiri dari tanah yang telah mengandung R. solanacearum dari lapangan dan ditambah dengan tanah yang telah terinfestasi patogen R. solanacearum (patogen tersebut dibiakkan dalam media cair 523) serta tanaman tomat yang terserang layu bakteri. Tanaman tomat yang terserang layu bakteri tersebut dipotong-potong dan ditambah air. Potongan tanaman beserta airnya kemudian dicampur dengan tanah yang mengandung R. solanaceaum. Sebanyak 600 ml suspensi biakan bakteri patogen dilarutkan dalam 2 liter air lalu dicampur dengan tanah dari lapangan. Lokasi untuk tiap perlakuan dilakukan secara acak. Setiap unit perlakuan di rumah kaca terdiri dari lima tanaman. Setiap ulangan terdiri dari 12 plot, sehingga dalam satu lahan terdiri 36 plot/ petak. Penyiraman dengan air dalam rangka pemeliharaan dilakukan setiap dua hari sekali. Namun jika tanah masih cukup lembab, maka tanaman tidak disiram. Tanaman tomat dipasang ajir setelah satu minggu dari waktu pindah tanam.
29 18 Peubah yang diamati yaitu kejadian penyakit, masa inkubasi, bobot kering, dan tinggi tanaman. Pengamatan dilakukan selama 9 minggu dan data diambil setiap dua hari sekali. Kejadian penyakit (Kp) dihitung menggunakan rumus: Selain kejadian penyakit dihitung pula nilai AUHPGC (Area Under Height of Plant Growth Curve) dengan rumus yang dinyatakan oleh Van der Plank (1963 dalam Cooke 1998) sebagai berikut: y = laju pertambahan tinggi tanaman t = hari Serta dihitung pula nilai AUDPC (Area Under Disease Progress Curve) dengan rumus yang dinyatakan oleh Van der Plank (1963 dalam Cooke 1998) sebagai berikut: y = persentase kejadian penyakit t = hari Percobaan di Lapangan Percobaan di lapangan dilakukan pada bulan Juli-Oktober Bibit tomat yang telah berumur 3 minggu disiram dengan agens biokontrol. Perlakuan yang diberikan sama dengan perlakuan di rumah kaca. Namun jumlah suspensi agens biokontrol yang digunakan yaitu sebanyak 100 ml untuk aplikasi tunggal dan 50 ml dari masing-masing agens biokontrol untuk aplikasi kombinasi. Kontrol disiram dengan 100 ml air. Setelah disiram, bibit akan dipindah tanam di lapangan pada plot percobaan di luar rumah kaca yaitu di Kebun Percobaan, University Farm, IPB. Media tanam di lapangan berbeda dengan media tanam untuk percobaan di rumah kaca. Tanah di lapangan hanya ditambah dengan kompos karena tanah sudah
30 19 mengandung patogen R. solanacearum. Kondisi lahan di lapangan berlereng antara blok satu dengan blok yang lain. Lahan yang digunakan dipersiapkan dengan membuat bedengan dan dilakukan pemupukan pada setiap lubang tanam. Dalam satu blok terdiri dari 12 bedeng. Dalam satu bedeng/ setiap unit perlakuan ditanam dengan 20 bibit tomat, setiap lubang tanam terdiri dari satu bibit tomat. Jarak tanam yang digunakan yaitu 60 x 75 cm. Setiap ulangan terdiri dari 12 plot, sehingga dalam satu lahan terdiri 36 plot/ petak. Perawatan yang dilakukan di lapangan hanya mencakup penyiangan. Pengamatan di lapangan dilakukan selama 9 minggu dan peubah yang diamati yaitu kejadian penyakit layu bakteri. Pengamatan terhadap kejadian penyakit dilakukan setiap satu minggu sekali. Kejadian penyakit dihitung dengan menggunakan rumus sama seperti di rumah kaca. Serta dilakukan perhitungan terhadap nilai AUDPC menggunakan rumus sama seperti di rumah kaca. Dilakukan pula perhitungan terhadap index penekanan penyakit (keefektifan pengendalian) dengan rumus: DIc = AUDPC pada kontrol DIb = AUDPC pada perlakuan agens biokontrol Untuk mengetahui tingkat sinergisme antara dua agens biokontrol diprediksi menggunakan rumus Abbott s (Guetsky et al dalam Nawangsih 2006), yaitu: E (exp) = a + b a x b/ 100 dan SF (Synergy Factor) = E (obs) /E (exp) a b E (exp) E (obs) = keefektifan pengendalian oleh agens biokontrol I = keefektifan pengendalian oleh agens biokontrol II = keefektifan pengendalian dugaan oleh campuran agens biokontrol = keefektifan pengendalian oleh campuran berdasarkan hasil pengamatan
31 20 Nilai SF = 1 ; interaksi antar agens biokontrol bersifat additif SF < 1 ; interaksi antar agens biokontrol bersifat antagonis SF > 1 ; interaksi antar agens biokontrol bersifat sinergis Analisis Data Rancangan percobaan yang digunakan yaitu Rancangan Acak Kelompok (RAK) dengan kelompok sebagai ulangan. Data yang diperoleh dianalisis menggunakan analisis ragam (anova) dengan menggunakan program Statistical Analysis System (SAS) versi 9.1 dan dilanjutkan dengan uji Duncan dan Dunnett masing-masing pada taraf 5% untuk pengujian di rumah kaca. Pengujian di lapangan menggunakan uji lanjut Duncan dan Dunnett masing-masing pada taraf 10%.
32 HASIL DAN PEMBAHASAN Pengaruh Aplikasi Bakteri Endofit dan PGPR terhadap Pertumbuhan Tanaman dan Kejadian Penyakit Layu Bakteri di Rumah Kaca Laju pertambahan tinggi tanaman Pengukuran laju pertambahan tinggi tanaman di rumah kaca dilakukan pada dua musim tanam yaitu musim kemarau dan penghujan. Pengukuran dilakukan setiap satu minggu sekali selama 5 minggu. Pengukuran terhadap laju pertambahan tinggi tanaman dilakukan untuk mengetahui apakah agens biokontrol yang diberikan berpengaruh terhadap pemacuan pertambahan tinggi tanaman atau tidak. Berdasarkan hasil analisis ragam, perlakuan yang diberikan tidak berpengaruh nyata terhadap pertambahan tinggi tanaman baik pada musim kemarau maupun penghujan (Tabel 1 & 2). Meskipun pada beberapa minggu terdapat huruf yang berbeda antar perlakuan, namun tidak dikatakan berbeda nyata karena berdasarkan hasil analisis ragam nilai dari Pr>F lebih dari taraf nyata yang digunakan yaitu 5%. Hal tersebut disebabkan adanya keragaman data yang tinggi. Pengaruh perlakuan tidak berbeda nyata, namun agens biokontrol yang diaplikasikan tidak memberikan efek negatif terhadap tanaman. Hal tersebut dikarenakan agens biokontrol tidak menyebabkan pertumbuhan tanaman menjadi kerdil meskipun terjadi penekanan laju pertambahan tinggi tanaman pada beberapa perlakuan. Berdasarkan uji lanjut dengan Dunnett baik pada musim kemarau maupun penghujan tidak terdapat perlakuan yang berbeda nyata dengan kontrol. Pada musim kemarau, laju pertambahan tinggi tanaman tomat relatif lebih rendah (Tabel 1) dibandingkan dengan laju pertambahan tinggi pada musim penghujan (Tabel 2). Hal ini kemungkinan terjadi karena di dalam rumah kaca suhu relatif lebih tinggi sehingga tanah menjadi cepat kering dan kebutuhan air meningkat. Pada musim penghujan kondisi lingkungan lebih mendukung bagi pertumbuhan tanaman. Suhu di dalam rumah kaca relatif lebih rendah sehingga tanaman tumbuh lebih nyaman.
33 22 Berdasarkan nilai AUHPGC pada Tabel 1 dan Tabel 2, yang menunjukkan laju pertambahan tinggi tanaman total selama pengamatan, perlakuan yang cenderung mampu memacu pertambahan tinggi tanaman pada musim kemarau adalah perlakuan kombinasi antara P. fluorescens RH4003 dengan bakteri endofit isolat BC10 (P1BC10). Nilai AUHPGC pada perlakuan P1BC10 paling besar yaitu sebesar 26 cm hari. Pada musim penghujan nilai AUHPGC yang terbesar terjadi pada perlakuan kombinasi antara B. subtilis AB89 dengan bakteri endofit isolat BC10 (B12BC10) sebesar 153 cm hari. Nilai AUHPGC paling rendah pada musim kemarau terlihat pada kontrol yaitu sebesar 7 cm hari sedangkan pada musim penghujan nilai AUHPGC paling rendah terjadi pada perlakuan B. subtilis AB89 (B12) sebesar 92 cm hari. Berdasarkan nilai AUHPGC dari dua musim tanam diperoleh hasil yang tidak konsisten. Pada musim kemarau perlakuan yang cenderung lebih baik memacu tinggi tanaman yaitu kombinasi antara P. fluorescens RH4003 dengan bakteri endofit isolat BC10 (P1BC10) sedangkan pada musim penghujan yaitu kombinasi antara B. subtilis AB89 dengan bakteri endofit isolat BC10 (B12BC10). Untuk meningkatkan potensi dari agens biokontrol ini salah satunya yaitu dengan menambah frekuensi aplikasi. Dalam penelitian ini terlihat jelas bahwa pada musim penghujan (Tabel 2) aplikasi bakteri PGPR P. fluorescens RH4003 (P1) dengan bakteri endofit cenderung menurunkan laju pertambahan tinggi tanaman. Karena aplikasi tunggal P. fluorescens RH4003 (P1) mampu memacu pertambahan tinggi tanaman lebih baik dibandingkan aplikasi P. fluorescens RH4003 (P1) secara kombinasi. Namun, bakteri PGPR B. subtilis AB89 (B12) justru menunjukkan sinergis jika dikombinasikan dengan bakteri endofit. Perlakuan kombinasi antara B. subtilis AB89 (B12) dan bakteri endofit mampu memacu pertambahan tinggi lebih besar dibandingkan aplikasi B. subtilis AB89 (B12) secara tunggal.
34 Tabel 1 Laju pertambahan tinggi tanaman tomat pada berbagai perlakuan bakteri PGPR dan endofit secara tunggal dan kombinasi serta nilai AUHPGC di rumah kaca pada musim kemarau Laju pertambahan tinggi tanaman (cm) Perlakuan AUHPGC *) Minggu I Minggu II Minggu III Minggu IV Minggu V ( cm hari ) P1 **) 2.1 ± 0.8ab ***) 5.4 ± 1.6b 7.0 ± 1.9ab 6.5 ± 1.6b 2.8 ± 0.6ab 10 B ± 0.2ab 6.5 ± 1.0ab 6.4 ± 2.9ab 11.5 ± 7.6ab 4 ± 2.0ab 14 BC4 3.0 ± 0.9ab 6.4 ± 0.4ab 4.4 ± 2.8b 9.9 ± 1.3ab 4.2 ± 0.2ab 15 BC ± 1.4ab 6.1 ± 3.1ab 8.9 ± 1.1a 9.1 ± 4.3ab 3.2 ± 0.9ab 11 BL ± 0.4ab 5.5 ± 1.1b 6 ± 3.2ab 11 ± 1.2ab 4.4 ± 3.1ab 15 P1BC4 1.6 ± 0.5b 6.9 ± 0.6ab 7.1 ± 1.0ab 8.9 ± 2.3ab 3.2 ± 1.0ab 11 P1BC ± 1.6a 9.0 ± 1.6a 6.4 ± 1.7ab 8.7 ± 3.9ab 7.4 ± 6.1a 26 P1BL ± 1.5ab 6.4 ± 2.0ab 6.9 ± 1.5ab 9.6 ± 0.8ab 2.3 ± 0.2b 8 B12BC4 2.2 ± 1.1ab 5.8 ± 1.2ab 6.2 ± 2.8ab 8.4 ± 2.9ab 3.8 ± 3.1ab 13 B12BC ± 2.0ab 6 ± 0.7ab 5.8 ± 1.8ab 12 ± 0.7a 4.2 ± 1.9ab 15 B12BL ± 0.4ab 8.1 ± 2.0ab 6.7 ± 1.2ab 9.4 ± 1.5ab 3 ± 1.0ab 11 K 2.0 ± 1.1ab 6.5 ± 3.2ab 4.6 ± 1.0b 9.3 ± 3.1ab 2.1 ± 0.9b 7 *) AUHPGC= Area Under Height of Plant Growth Curve. **) Kode isolat bakteri: P1= Pseudomonas fluorescens RH4003, B12= Bacillus subtilis AB89, BC4= Staphylococcus epidermidis, BC10= bakteri endofit isolat BC10, BL10= Bacillus amyloliquefaciens, K= kontrol. **) Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf 5%. 23
35 24 Tabel 2 Laju pertambahan tinggi tanaman tomat pada berbagai perlakuan bakteri PGPR dan endofit secara tunggal dan kombinasi serta nilai AUHPGC di rumah kaca pada musim penghujan Perlakuan Laju pertambahan tinggi tanaman (cm) AUHPGC *) Minggu I Minggu II Minggu III Minggu IV Minggu V (cm hari) P1 **) 19.4 ± 1.3a ***) 22.7 ± 8.8a 23.7 ± 6.3a 15.4 ± 2.0a 35 ± 4.6abc 123 *) B ± 1.2a 20.6 ± 4.7a 20.6 ± 3a 11.6 ± 3.0a 26.4 ± 2.0c 92 BC ± 2.5a 19.1 ± 6.4a 19.1 ± 7.7a 14.3 ± 4.4a 30.2 ± 5.7bc 106 BC ± 1.0a 20.5 ± 2.4a 19.5 ± 3.8a 15.6 ± 2.2a 39.2 ± 7.9ab 137 BL ± 3.4a 20.2 ± 5.0a 19.9 ± 2.6a 13.1 ± 2.4a 30.9 ± 7.6bc 108 P1BC ± 3.1a 21.4 ± 9.8a 21 ± 10.2a 12.8 ± 3.2a 30.1 ± 6.7bc 105 P1BC ± 3.0a 17.8 ± 3.6a 19.3 ± 4.3a 12.0 ± 4.8a 27.3 ± 12.1c 96 P1BL10 20 ± 1.6a 17.6 ± 0.8a 17.2 ± 4a 13.7 ± 2.6a 32 ± 5.2bc 112 B12BC ± 0.7a 23.1 ± 7.2a 22 ± 3.8a 12.8 ± 0.5a 30.3 ± 8.7bc 106 B12BC ± 1.1a 21.9 ± 2.5a 21.4 ± 0.8a 15.3 ± 2.0a 43.7 ± 8.1a 153 B12BL10 20 ± 0.2a 21.3 ± 2.2a 22.1 ± 1.1a 15.4 ± 1.3a 36.7 ± 6.1abc 128 K 18.7 ± 1.4a 22 ± 3.3a 21.2 ± 4.4a 14.8 ± 1.1a 38.8 ± 7.2ab 136 AUHPGC = Area Under Height of Plant Growth Curve. *) Kode isolat bakteri: P1= Pseudomonas fluorescens RH4003, B12= Bacillus subtilis AB89, BC4= Staphylococcus epidermidis, BC10= bakteri endofit isolat BC10, BL10= Bacillus amyloliquefaciens, K= kontrol. **) Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf 5%. 24
36 25 Kejadian Penyakit Layu Bakteri Pengamatan terhadap kejadian penyakit layu bakteri di rumah kaca dilakukan selama 9 minggu. Data yang disajikan merupakan data tiap minggu meskipun sebenarnya pengamatan terhadap kejadian penyakit layu bakteri dilakukan setiap dua hari sekali. Hal itu dikarenakan tidak terjadi peningkatan gejala layu bakteri yang cukup mencolok. Pada Tabel 3 dapat dilihat bahwa ratarata tingkat kejadian penyakit layu bakteri menunjukkan angka yang rendah. Hal tersebut berarti tanaman yang terserang penyakit layu bakteri terjadi dalam jumlah yang cukup rendah. Rendahnya tingkat kejadian penyakit layu bakteri di rumah kaca dapat terjadi karena beberapa kemungkinan seperti: populasi R. solanacearum yang rendah sehingga tidak menunjukkan gejala layu bakteri, R. solanacearum kurang aktif masuk ke dalam jaringan tanaman, dan keadaan lingkungan yang kurang mendukung bagi perkembangan R. solanacearum misalnya intensitas hujan yang cukup tinggi ketika dilakukan penelitian karena R. solanacearum tidak menyukai kondisi yang terlalu basah atau lembab dan jarak tanam antar tanaman yang cukup rapat sehingga mengakibatkan terjadinya kelembaban dalam rumah kaca. Bakteri R. solanacearum merupakan patogen yang unik karena patogen ini kisaran inangnya sangat luas, dapat mengakibatkan kegagalan panen hingga 50%, dan R. solanacearum merupakan bakteri patogen yang cepat kehilangan virulensinya sehingga cukup sulit untuk membiakkan R. solanacearum. Berdasarkan hasil analisis ragam dengan uji lanjut Duncan (Tabel 3), perlakuan yang diberikan tidak berpengaruh nyata dalam menghambat perkembangan penyakit layu bakteri. Berdasarkan uji lanjut dengan Dunnett tidak terdapat pula pengaruh dari masing-masing perlakuan yang berbeda nyata dengan kontrol. Meskipun tidak berbeda nyata, agens biokontrol yang digunakan dalam penelitian ini yaitu bakteri endofit dan PGPR juga tidak memberikan efek negatif bagi tanaman. Perkembangan dan pertumbuhan tanaman tidak terhambat akibat adanya agens biokontrol.
37 Tabel 3 Kejadian penyakit layu bakteri pada berbagai perlakuan bakteri PGPR dan endofit secara tunggal dan kombinasi serta nilai AUDPC di rumah kaca pada musim penghujan Perlakuan Kejadian penyakit AUDPC *) Minggu I Minggu II Minggu III Minggu IV Minggu V Minggu VI Minggu VII Minggu VIII Minggu IX (% hari) P1 **) 0a ***) 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 13.3 ± 23.1a 13.3 ± 23.1a 13.3 ± 23.1a 13.3 ± 23.1a 13.3 ± 23.1a 46.6 B ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 13.3 ± 11.5a 13.3 ± 11.5a 13.3 ± 11.5a 13.3 ± 11.5a 46.6 BC4 0a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 23.5 BC ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 13.3 ± 11.5a 20.0 ± 20a 70.0 BL10 0a 0a 0a 0a 0a 0a 0a 0a 6.7 ± 11.5a 23.5 P1BC4 0a 0a 0a 0a 0a 0a 0a 0a 0a 0.0 P1BC10 0a 0a 0a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 13.3 ± 11.5a 46.6 P1BL10 0a 13.3 ± 11.5a 13.3 ± 11.5a 13.3 ± 11.5a 20.0 ± 0a 20.0 ± 0a 20.0 ± 0a 20.0 ± 0a 20.0 ± 0a 70.0 B12BC4 0a 0a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 13.3 ± 11.5a 13.3 ± 11.5a 20.0 ± 0a 70.0 B12BC10 0a 0a 0a 0a 0a 0a 0a 0a 6.7 ± 11.5a 23.5 B12BL10 0a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 13.3 ± 11.5a 13.3 ± 11.5a 13.3 ± 11.5a 20.0 ± 20a 70.0 K 0a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 6.7 ± 11.5a 20.0 ± 0a 70.0 *) AUDPC = Area Under Disease Progress Curve. **) Kode isolat bakteri: P1= Pseudomonas fluorescens RH4003, B12= Bacillus subtilis AB89, BC4= Staphylococcus epidermidis, BC10= bakteri endofit isolat BC10, BL10= Bacillus amyloliquefaciens, K= kontrol. ***) Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf 5%. 26
38 27 Pada minggu pertama pengamatan, tanaman belum banyak yang menunjukkan gejala layu bakteri dan baru terlihat pada dua perlakuan yaitu B. subtilis AB89 (B12) dan bakteri endofit isolat BC10 dengan masing-masing ratarata kejadian penyakitnya 6,7%. Rata-rata kejadian penyakit dari minggu ke minggu tidak menunjukkan perbedaan yang terlalu mencolok, rata-rata kejadian penyakit yang terjadi di rumah kaca hanya berkisar pada 6,7%; 13,3%; dan 20%. Total rata-rata tingkat kejadian penyakit selama pengamatan berdasarkan nilai AUDPC yang terendah yaitu sebesar 0 % hari pada perlakuan kombinasi antara P. fluorescens RH4003 dengan bakteri endofit Staphylococcus epidermidis (P1BC4) dan AUDPC tertinggi sebesar 70 % hari pada beberapa perlakuan bakteri endofit isolat BC10, kombinasi antara P. fluorescens RH4003 dengan bakteri endofit Bacillus amyloliquefaciens (P1BL10), kombinasi antara B. subtilis AB89 dengan bakteri endofit S. epidermidis (B12BC4), kombinasi antara B. subtilis AB89 dengan bakteri endofit B. amyloliquefaciens (B12BL10), dan kontrol. Berdasarkan hasil analisis ragam dan nilai AUDPC, tanaman dengan perlakuan kombinasi antara P. fluorescens RH4003 dengan bakteri endofit S. epidermidis (P1BC4) belum menunjukkan gejala layu bakteri sampai minggu kesembilan setelah aplikasi. Namun, dalam penelitian ini P1BC4 tidak dapat dikatakan sebagai agens biokontrol yang berpotensi atau mampu menghambat perkembangan layu bakteri meskipun kejadian penyakitnya 0%. Karena dalam penelitian ini secara keseluruhan tingkat kejadian penyakitnya cukup rendah. R. solanacearum kurang berkembang dengan baik sehingga tanaman yang menunjukkan gejala layu bakteri hanya sedikit. Dari penelitian ini dapat diketahui bahwa bakteri patogen R. solanacearum kurang menunjukkan pertumbuhan yang baik sehingga tanaman yang terserang layu bakteri cukup sedikit jumlahnya, hal ini dapat terjadi karena beberapa kemungkinan seperti yang telah disebutkan sebelumnya. Menurut Agrios (1988) perkembangan R. solanaceraum dapat dipengaruhi oleh keadaan inang atau keadaan sekelilingnya sehingga gejala layu bakteri akan muncul dalam waktu yang cukup lama. Nilai AUDPC bakteri PGPR P. fluorescens RH4003 dan B. subtilis AB89 lebih rendah dibandingkan nilai AUDPC pada kontrol. Nilai AUDPC pada P.
39 28 fluorescens RH4003 dan B. subtilis AB89 masing-masing yaitu sebesar 46,6 % hari sedangkan pada kontrol sebesar 70 % hari. Hal tersebut menunjukkan bahwa bakteri PGPR P. fluorescens RH4003 dan B. subtilis AB89 memiliki potensi dalam menekan perkembangan penyakit layu bakteri. Menurut Nawangsih (2006) kedua isolat bakteri PGPR yang digunakan yaitu P. fluorescens RH4003 dan B. subtilis AB89 mampu menekan penyakit layu bakteri pada tomat. Beberapa penelitian lain juga mengemukakan bahwa P. fluorescens dan B. subtilis memiliki kemampuan dalam mengendalikan penyakit, seperti yang dikemukakan oleh Ratih & Eviyati (2007) bahwa kedua bakteri tersebut mampu menghambat perkembangan bakteri Xanthomonas campestris pv. glycines penyebab pustul pada kedelai. Khalimi & Wirya (2009) menyatakan bahwa Pseudomonas aeruginosa sebagai bakteri PGPR mampu menghambat pertumbuhan enam cendawan patogen, dan penelitian yang dilakukan oleh Chrisnawati et al. (2009) menunjukkan bahwa gabungan antara bakteri PGPR Bacillus spp. Bc 26 dan Pseudomonas fluorescens Pf 101 mampu mengendalikan layu bakteri pada nilam. Pengendalian penyakit di lapangan menggunakan mikroorganisme sering mengalami kendala antara lain disebabkan oleh kolonisasi dari bakteri PGPR pada akar cukup rendah dan karena adanya persaingan tempat maupun nutrisi dengan bakteri patogen. Menurut Soesanto (2008) B. subtilis mengalami kesulitan utama yaitu pengendalian sering sangat beragam dengan hasil sangat berbeda di lokasi yang berbeda dan pengaruh metabolit sekunder yang dihasilkan P. fluorescens pada umumnya menunjukkan keberhasilan di laboratorium, sedangkan di lapangan belum tentu berhasil. Salah satu cara untuk meningkatkan potensi PGPR dalam menekan perkembangan penyakit yaitu dengan menambah frekuensi aplikasi agens biokontrol pada tanaman sehingga memungkinkan semakin tingginya kolonisasi PGPR pada akar. Menurut Soesanto (2008) pengkolonian akar oleh PGPR lebih awal akan mencegah pengkolonian akar oleh mikroba patogen. PGPR harus menempati niche yang sama dengan patogen untuk meningkatkan kemampuan PGPR dalam mengendalikan penyakit (Kloepper 1991). Penelitian ini merupakan serangkaian penelitian yang telah dilakukan sebelumnya oleh Damayanti (2010). Pada penelitian sebelumnya dilakukan
40 29 pengujian terhadap kemampuan bakteri endofit dalam menekan perkembangan penyakit layu bakteri pada tomat di rumah kaca. Bakteri endofit yang digunakan dalam pengujian diaplikasikan secara tunggal (tidak dikombinasikan dengan bakteri PGPR). Dari hasil penelitian tersebut diketahui bahwa bakteri endofit S. epidermidis (BC4) mampu memberikan penekanan terbaik terhadap perkembangan penyakit layu bakteri pada tomat yaitu sebesar 66,67%. Dan dalam penelitian ini bakteri endofit S. epidermidis (BC4) menunjukkan nilai AUDPC yang lebih rendah dari kontrol meskipun sama besar dengan bakteri endofit B. amyloliquefaciens (BL10) yaitu sebesar 23,5 % hari. Masa inkubasi penyakit layu bakteri Pada Tabel 4 terlihat bahwa R. solanacearum pada masing-masing perlakuan memiliki masa inkubasi yang berbeda-beda. Gejala layu bakteri ratarata mulai muncul pada 17 hari setelah pindah tanam (hst). Penghitungan masa inkubasi ini dimulai dari pindah tanam bibit ke polybag. Masa inkubasi R. solanacearum yang paling cepat adalah 15 (hst). Pada tabel tersebut terlihat bahwa tanaman yang diberi bakteri PGPR B. subtilis AB89 (B12) dan bakteri endofit isolat BC10 menunjukkan gejala layu bakteri lebih cepat dibandingkan perlakuan lain yaitu pada 15 hst. Masa inkubasi penyakit layu bakteri pada tanaman yang diberi kedua agens biokontrol tersebut lebih cepat dari kontrol yang baru menunjukkan gejala layu bakteri pada 17 hst. Tetapi kedua isolat bakteri tersebut (B12 dan BC10) mampu menekan perkembangan R. solanacearum lebih lama jika diaplikasikan secara kombinasi yaitu antara B. subtilis AB89 (B12) dengan bakteri endofit S. epidermidis (BC4), bakteri endofit isolat BC10, dan dengan bakteri endofit B. amyloliquefaciens (BL10). Bakteri endofit isolat BC10 mampu menekan perkembangan R. solanacearum lebih lama jika diaplikasikan secara kombinasi yaitu antara bakteri endofit isolat BC10 dengan bakteri PGPR P. fluorescens RH4003 (P1) dan B. subtilis AB89 (B12).
41 30 Tabel 4 Masa inkubasi penyakit layu bakteri pada berbagai perlakuan bakteri PGPR dan endofit secara tunggal dan kombinasi di rumah kaca pada musim penghujan Masa inkubasi Masa inkubasi Perlakuan (hari setelah tanam) Perlakuan (hari setelah tanam) P1 *) 17 P1BC10 29 *) B12 15 P1BL10 17 BC4 17 B12BC4 25 BC10 15 B12BC10 57 BL10 61 B12BL10 17 P1BC4 > 63 K 17 Kode isolat bakteri: P1= Pseudomonas fluorescens RH4003, B12= Bacillus subtilis AB89, BC4= Staphylococcus epidermidis, BC10= bakteri endofit isolat BC10, BL10= Bacillus amyloliquefaciens, K= kontrol. Bakteri endofit B. amyloliquefaciens (BL10) menunjukkan masa inkubasi yang lebih lama jika diaplikasikan secara tunggal dibandingkan secara kombinasi dengan bakteri PGPR P. fluorescens RH4003 (P1) dan B. subtilis AB89 (B12). Dalam percobaan ini terdapat tiga perlakuan yang menunjukkan masa inkubasi yang lebih lama. Ketiga perlakuan tersebut yaitu kombinasi antara P. fluorescens RH4003 dengan bakteri endofit S. epidermidis (P1BC4), bakteri endofit B. amyloliquefaciens (BL10), dan kombinasi antara B. subtilis AB89 dengan bakteri endofit isolat BC10 (B12BC10) dengan masing-masing masa inkubasi > 63, 61, dan 57 hst. Tanaman dengan perlakuan kombinasi antara P. fluorescens RH4003 dengan bakteri endofit S. epidermidis (P1BC4) belum menunjukkan gejala penyakit layu bakteri sampai minggu kesembilan. Bobot kering tanaman Pada Tabel 5 dapat dilihat bahwa pemberian bakteri PGPR maupun endofit tidak berpengaruh nyata terhadap bobot kering tanaman dibandingkan dengan kontrol. Bobot kering tanaman yang lebih besar dibanding perlakuan lain yaitu pada tanaman yang diberi P. fluorescens RH4003 (P1) sebesar 15,9 gram/tanaman. Sedangkan bobot kering tanaman yang paling rendah yaitu pada tanaman dengan perlakuan kombinasi antara P. fluorescens RH4003 dengan
42 31 bakteri endofit isolat BC10 (P1BC10) sebesar 9,4 gram/tanaman. Dalam penelitian ini kombinasi antara P. fluorescens dan B. subtilis dengan bakteri endofit tidak menunjukkan bobot kering yang lebih besar bila dibandingkan dengan kontrol bahkan perlakuan dengan B12 (B. subtilis AB89) baik yang diaplikasikan secara tunggal maupun kombinasi tidak lebih besar dari kontrol. Tabel 5 Rata-rata bobot kering tanaman tomat pada berbagai perlakuan bakteri PGPR dan endofit secara tunggal dan kombinasi di rumah kaca pada musim penghujan *) Bobot kering Bobot kering Perlakuan (gram/tanaman) Perlakuan (gram/tanaman) P1 *) 15.9 ± 7.7a **) P1BC ± 3.8a B ± 3.1a P1BL ± 2.6a BC ± 7a B12BC ± 3a BC ± 0.8a B12BC ± 1.2a BL ± 2.1a B12BL ± 2.4a P1BC ± 9.9a K 13.7 ± 2.8a Kode isolat bakteri: P1= Pseudomonas fluorescens RH4003, B12= Bacillus subtilis AB89, BC4= Staphylococcus epidermidis, BC10= bakteri endofit isolat BC10, BL10= Bacillus amyloliquefaciens, K= kontrol. **) Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf 5%. Dalam penelitian ini perlakuan yang diberikan tidak nyata meningkatkan bobot kering tanaman berdasarkan hasil analisis ragam, namun perlakuan yang diberikan juga tidak memberikan efek negatif bagi tanaman. Perlakuan yang diberikan tidak menghambat pertumbuhan dan perkembangan tanaman. Berdasarkan hasil analisis ragam, perlakuan berpengaruh nyata terhadap blok untuk bobot kering tanaman (Tabel 6). Rata-rata bobot kering tanaman pada blok 1 berbeda nyata dengan bobot kering tanaman pada blok 3, sedangkan pada blok 2 tidak berbeda nyata baik dengan blok 1 maupun blok 3. Rata-rata bobot kering tanaman yang lebih besar terdapat pada blok 3 dengan rata-rata 14,7 gram/tanaman. Tanaman pada blok 3 memang lebih besar dan lebih baik pertumbuhannya dibandingkan dengan blok lain. Pada blok 1, rata-rata bobot kering tanamannya paling rendah bila dibandingkan dengan blok 3 dan 2, tanaman pada blok 1 lebih kecil ukurannya dan menunjukkan pertumbuhan yang kurang
43 32 baik. Hal tersebut kemungkinan dapat terjadi karena tanaman pada blok 1 kurang mendapatkan penyinaran matahari secara sempurna. Tabel 6 Rata-rata bobot kering tanaman tomat pada setiap blok di rumah kaca pada musim penghujan Blok Bobot kering (gram/tanaman) ± 2.8b *) ± 2.4ab ± 5.5a **) Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf 5%. Menurut Sudarsono & Malik (2006) kombinasi P. fluorescens dan B. subitilis dengan bokashi mampu meningkatkan bobot kering tanaman kentang, dan menurut Chrisnawati et al. (2009) kombinasi antara Bacillus spp. Bc 26 dengan P. fluorescens Pf 101 mampu meningkatkan bobot kering daun nilam. Bakteri endofit Pseudomonas pseudomallei, Bacillus mycoides dan Klebsiella ozaenae baik yang diaplikasikan secara tunggal maupun kombinasi mampu meningkatkan bobot kering tanaman kentang (Juwita 2010). Pengaruh Aplikasi Bakteri Endofit dan PGPR terhadap Kejadian Penyakit Layu Bakteri di Lapangan Kejadian penyakit layu bakteri di lapangan menunjukkan angka yang lebih tinggi dibandingkan tingkat kejadian penyakit di rumah kaca yang berarti bahwa tanaman yang terserang layu bakteri lebih banyak terjadi di lapangan (Tabel 7). Hal ini bisa disebabkan oleh kondisi di lapangan yang lebih heterogen, patogen R. solanacearum memiliki virulensi yang tinggi dan terdapat dalam jumlah yang banyak karena tanah di lapangan merupakan tanah yang pernah ditanami tanaman tomat yang terserang layu bakteri dan kondisi lingkungan yang lebih kompleks seperti suhu udara dan sinar matahari. Patogen R. solanacearum tidak diinokulasikan ke dalam media tanam seperti pada perlakuan di rumah kaca karena tanah di lapangan sudah mengandung patogen R. solanaceraum dari pertanaman tomat sebelumnya. Pada percobaan di lapangan tidak dilakukan pengukuran tinggi tanaman, bobot kering, dan pengamatan masa inkubasi seperti pada pengujian di rumah kaca. Kondisi lapangan yang digunakan dalam
44 33 penelitian ini tidak rata atau tidak datar antar blok, antara blok 1 dengan blok lain agak berlereng. Berdasarkan hasil analisis ragam, perlakuan yang berpengaruh nyata hanya pada minggu ketiga baik berdasarkan uji lanjut dengan Duncan maupun Dunnett (Tabel 7 & 8). Meskipun pada minggu-minggu yang lain terdapat huruf yang berbeda antar perlakuan dengan uji lanjut Duncan, namun tidak dikatakan berbeda nyata karena berdasarkan hasil analisis ragam nilai dari Pr>F lebih dari taraf nyata yang digunakan yaitu 10%. Perlakuan yang berbeda nyata berdasarkan uji lanjut Duncan yaitu bakteri endofit S. epidermidis (BC4), kombinasi antara P. fluorescens RH4003 dengan bakteri endofit B. amyloliquefaciens (P1BL10), dan kombinasi antara B. subtilis AB89 dengan bakteri endofit B. amyloliquefaciens (B12BL10) yang masing-masing berbeda nyata dengan kontrol. Rata-rata tingkat kejadian penyakit pada tanaman dengan ketiga perlakuan tersebut secara berturutturut yaitu 33,3%; 35%; dan 36,7% sedangkan pada kontrol sebesar 65%. Pada Tabel 7 dapat dilihat pula bahwa bakteri endofit S. epidermidis (BC4) berbeda nyata dengan bakteri endofit yang lain yaitu bakteri endofit isolat BC10 dan bakteri endofit B. amyloliquefaciens (BL10) dengan rata-rata kejadian penyakit pada tanaman dengan bakteri endofit S. epidermidis (BC4) lebih rendah dari kedua isolat bakteri endofit tersebut. Hasil pengolahan dengan uji lanjut Dunnett merupakan selisih dari masing-masing perlakuan agens biokontol dengan kontrol. Selisih rata-rata antara dua perlakuan yang menunjukkan hasil negatif berarti bahwa kejadian penyakit pada kontrol lebih tinggi dibandingkan kejadian penyakit pada agens biokontrol. Uji lanjut dengan Dunnett menunjukkan bahwa terdapat dua perlakuan yang berbeda nyata dengan kontrol yaitu kombinasi antara P. fluorescens RH4003 dengan bakteri endofit B. amyloliquefaciens (P1BL10) dan bakteri endofit S. epidermidis (BC4). Uji Dunnett ini digunakan untuk melihat pengaruh dari masing-masing perlakuan terhadap kontrol. Berdasarkan nilai AUDPC, bakteri endofit S. epidermidis (BC4) menunjukkan potensi yang lebih baik dalam menekan kejadian penyakit layu bakteri bila dibandingkan dengan bakteri endofit yang lain yaitu bakteri endofit isolat BC10 dan bakteri endofit B. amyloliquefaciens (BL10). Hal tersebut karena
45 34 total rata-rata kejadian penyakit (AUDPC) pada tanaman yang diberi bakteri endofit S. epidermidis (BC4) lebih rendah dari tanaman dengan bakteri endofit isolat BC10 dan bakteri endofit B. amyloliquefaciens (BL10) yaitu sebesar 303,5 % hari. Hal ini sesuai dengan penelitian yang telah dilakukan oleh Damayanti (2010) bahwa bakteri endofit S. epidermidis (BC4) mampu menekan kejadian penyakit layu bakteri pada tomat dengan lebih baik dibandingkan bakteri endofit B. amyloliquefaciens (BL10) dan bakteri endofit isolat BC10. Secara keseluruhan agens biokontrol yang menunjukkan total rata-rata kejadian penyakit (AUDPC) yang paling rendah adalah kombinasi antara B. subtilis AB89 dengan bakteri endofit B. amyloliquefaciens (B12BL10) sebesar 297,5 % hari sedangkan yang tertinggi yaitu pada bakteri endofit isolat BC10 sebesar 344,1 % hari. Pada Tabel 7 terlihat bahwa tanaman yang diberi perlakuan kombinasi antara bakteri PGPR dengan bakteri endofit menunjukkan nilai AUDPC yang lebih rendah dibandingkan dengan kontrol. Sedangkan untuk perlakuan tunggal, tidak semua nilai AUDPC lebih rendah dari kontrol. Nilai AUDPC dari bakteri endofit isolat BC10 lebih tinggi dari kontrol yaitu sebesar 344,1 % hari sedangkan pada kontrol sebesar 338,5 % hari. Terdapat pula nilai AUDPC yang sama besar dengan kontrol yaitu pada perlakuan bakteri endofit B. amyloliquefaciens (BL10) masing-masing sebesar 338,5 % hari. Meskipun nilai AUDPC dari semua kombinasi bakteri endofit dengan bakteri PGPR lebih rendah dari kontrol, namun tidak semua kombinasi agens biokontrol tersebut bersifat sinergis. Seperti pada perlakuan tunggal bakteri endofit S. epidermidis (BC4) yang memiliki nilai AUDPC lebih rendah dibandingkan perlakuan kombinasi antara bakteri endofit S. epidermidis baik dengan bakteri PGPR P. fluorescens RH4003 (P1BC4) maupun dengan bakteri PGPR B. subtilis AB89 (B12BC4). Nilai AUDPC dari masingmasing perlakuan bakteri endofit S. epidermidis (BC4), kombinasi antara bakteri endofit S. epidermidis dengan P. fluorescens RH4003 (P1BC4), dan kombinasi antara bakteri endofit S. epidermidis dengan B. subtilis AB89 (B12BC4) secara berturut-turut yaitu 303,5 % hari; 309,1 % hari; dan 326,6 % hari.
46 Tabel 7 Kejadian penyakit layu bakteri pada berbagai perlakuan bakteri PGPR dan endofit secara tunggal dan kombinasi serta nilai AUDPC di lapangan Perlakuan Kejadian penyakit Minggu I Minggu II Minggu III Minggu IV Minggu V Minggu VI Minggu VII Minggu VIII Minggu IX P1 **) 15 ± 13.2c ***) 36.7 ± 10.4ab 43.3 ± 12.6ab 51.7 ± 25.7abc 61.7 ± 24.7b 66.7 ± 20.2c 73.3 ± 15.3bc 86.7 ± 5.8a 95 ± 5abc B12 35 ± 22.9abc 45 ± 21.8ab 45 ± 21.8ab 53.3 ± 23.6abc 71.7 ± 22.5ab 76.7 ± 16.1abc 83.3 ± 16.1abc 86.7 ± 15.3a 91.7 ± 7.6abcd BC ± 22.5abc 26.7 ± 23.6b 33.3 ± 29.3b 46.7 ± 23.6bc 61.7 ± 20.2b 68.3 ± 20.2bc 71.7 ± 14.4c 81.7 ± 10.4a 86.7 ± 12.6cd BC ± 41.6ab 60 ± 35a 63.3 ± 33.3a 68.3 ± 24.7a 73.3 ± 20.8ab 83.3 ± 12.6ab 88.3 ± 16.1ab 95 ± 5a 98.3 ± 2.9a BL ± 5.8a 58.3 ± 7.6a 63.3 ± 11.5a 68.3 ± 12.6a 78.3 ± 16.1a 85 ± 13.2a 86.7 ± 10.4abc 93.3 ± 7.6a 96.7 ± 2.9ab P1BC4 45 ± 36.1abc 48.3 ± 34ab 55 ± 26.5ab 65 ± 21.8ab 73.3 ± 20.8ab 78.3 ± 16.1abc 78.3 ± 16.1abc 83.3 ± 11.5a 88.3 ± 7.6bcd P1BC ± 23.6abc 43.3 ± 7.6ab 48.3 ± 15.3ab 58.3 ± 18.9abc 70 ± 18ab 76.7 ± 12.6abc 78.3 ± 12.6abc 85 ± 18a 91.7 ± 14.4abcd P1BL ± 20.2bc 31.7 ± 14.4b 35 ± 8.7b 45 ± 20c 66.7 ± 18.9ab 68.3 ± 16.1bc 76.7 ± 5.8abc 83.3 ± 2.9a 90 ± 5abcd B12BC ± 30.1abc 36.7 ± 32.1ab 45 ± 31.2ab 61.7 ± 20.2abc 70 ± 22.9ab 75 ± 26bc 83.3 ± 16.1abc 88.3 ± 16.1a 93.3 ± 7.6abcd B12BC ± 36.9abc 45 ± 27.8ab 48.3 ± 27.5ab 51.7 ± 28.4abc 61.7 ± 15.3b 68.3 ± 7.6abc 73.3 ± 11.5bc 85 ± 5a 86.7 ± 5.8cd B12BL10 15 ± 15c 33.3 ± 16.1b 36.7 ± 18.9b 48.3 ± 24.7bc 66.7 ± 14.4ab 71.7 ± 15.3abc 76.7 ± 18.9abc 81.7 ± 14.4a 85 ± 8.7d K 50 ± 27.8ab 58.3 ± 25.7a 65 ± 22.9a 70 ± 18a 76.7 ± 15.3ab 83.3 ± 20.2ab 90 ± 8.7a 95 ± 5a 96.7 ± 5.8ab *) AUDPC = Area Under Disease Progress Curve. **) Kode isolat bakteri: P1= Pseudomonas fluorescens RH4003, B12= Bacillus subtilis AB89, BC4= Staphylococcus epidermidis, BC10= bakteri endofit isolat BC10, BL10= Bacillus amyloliquefaciens, K= kontrol. ***) Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf 10%. AUDPC *) (% hari) 35
47 36 Tabel 8 Hasil perbandingan rata-rata kejadian penyakit pada masing-masing perlakuan dengan kontrol (Uji Dunnett) Perbandingan Minggu 1 Minggu 2 Minggu 3 Minggu 4 Minggu 5 Minggu 6 Minggu 7 Minggu 8 Minggu 9 1) Selisih rata-rata 2) P1 K 3) -35 4) B12 -K BC4 - K *** BC10 - K BL10 - K P1BC4 - K P1BC10 - K P1BL10 - K *** B12BC4 - K B12BC10 - K B12BL10 - K ) Perbandingan dua perlakuan. 2) Selisih rata-rata dua perlakuan. 3) Kode isolat bakteri: P1= Pseudomonas fluorescens RH4003, B12= Bacillus subtilis AB89, BC4= Staphylococcus epidermidis, BC10= bakteri endofit isolat BC10, BL10= Bacillus amyloliquefaciens, K= kontrol. 4) Angka yang diikuti *** berbeda nyata berdasarkan uji Dunnett pada taraf 10%. 36
48 37 Dalam penelitian yang telah dilakukan ini menunjukkan bahwa agens biokontrol yang diberikan yaitu bakteri endofit S. epidermidis (BC4), bakteri endofit isolat BC10, dan bakteri endofit B. amyloliquefaciens (BL10) serta bakteri PGPR yaitu P. fluorescens (P1) dan B. subtilis (B12) belum menunjukkan potensi yang maksimal dalam mengendalikan penyakit layu bakteri di lapangan. Hal tersebut dikarenakan tingkat kejadian penyakit layu bakteri yang masih cukup tinggi meskipun telah diberi perlakuan dengan agens biokontrol. Beberapa kemungkinan yang menyebabkan masih tingginya tingkat kejadian penyakit di lapangan yaitu: populasi R. solanacearum yang cukup tinggi karena R. solanacearum sudah terdapat dalam tanah, populasi R. solanacearum lebih banyak dibandingkan populasi dari bakteri antagonis, kurangnya frekuensi aplikasi agens biokontrol, kondisi lapangan yang cukup heterogen, cukup rendahnya populasi bakteri agens biokontrol yang mampu mengkolonisasi daerah perakaran, dan adanya patogen lain yang menyebabkan terjadinya persaingan antara agens biokontrol dengan patogen. Untuk meningkatkan kemampuan agens biokontrol tersebut yaitu dengan menambah frekuensi aplikasi agens biokontrol pada beberapa umur tanaman, sehingga agens biokontrol yang diberikan mampu mengkolonisasi akar dalam jumlah yang cukup besar dan mampu masuk ke dalam jaringan tanaman sehingga dapat bersaing dengan R. solanacearum. Jenis hubungan antar agens biokontrol Berdasarkan Tabel 9 dapat dilihat bahwa bakteri endofit B. amyloliquefaciens (BL10) tidak memberikan penekanan terhadap kejadian penyakit layu bakteri karena index penekanannya sebesar 0%. Penekanan terbaik terhadap kejadian penyakit layu bakteri yaitu pada perlakuan kombinasi antara B. subtilis AB89 dengan bakteri endofit B. amyloliquefaciens (B12BL10) karena index penekanannya paling besar dibandingkan perlakuan yang lain yaitu sebesar 12,11%.
49 38 Tabel 9 Keefektifan pengendalian (Index Penekanan), nilai SF (Synergy Factor) dan jenis hubungan antar agens biokontrol berdasarkan nilai AUDPC Perlakuan Index penekanan (%) 1) 2) E (exp) SF JH 3) P1 4) 1.77 B BC BC BL10 0 P1BC A P1BC S P1BL S B12BC A B12BC S B12BL S 1) 2) 3) 4) Relatif dibandingkan dengan kontrol. Keefektifan pengendalian dugaan oleh campuran agens biokontrol. JH = Jenis Hubungan; A = antagonis dan S = sinergis. Kode isolat bakteri: P1= Pseudomonas fluorescens RH4003, B12= Bacillus subtilis AB89, BC4= Staphylococcus epidermidis, BC10= bakteri endofit isolat BC10, BL10= Bacillus amyloliquefaciens, K= kontrol. Untuk mengetahui apakah antar agens biokontrol yang dikombinasikan bersifat sinergis atau antagonis maka dilakukan pendugaan dengan menggunakan rumus Abbott s (Guetsky et al dalam Nawangsih 2006). Agens biokontrol yang dikombinasikan tidak selalu memberikan hasil yang lebih baik dibandingkan aplikasi secara tunggal. Kombinasi antar agens biokontrol kemungkinan ada yang bersifat sinergis dan ada yang antagonis. Berdasarkan Tabel 9 terlihat bahwa bakteri endofit S. epidermidis (BC4) bersifat antagonis jika diaplikasikan secara kombinasi baik dengan P. fluorescens RH4003 (P1) maupun dengan B. subtilis AB89 (B12). Hal tersebut menunjukkan bahwa bakteri endofit S. epidermidis (BC4) lebih baik jika diaplikasikan secara tunggal/ sendiri-sendiri. Bakteri endofit isolat BC10 dan bakteri endofit B. amyloliquefaciens (BL10) menunjukkan sifat sinergis jika dikombinasikan dengan bakteri PGPR P. fluorescens RH4003 (P1) maupun dengan B. subtilis AB89 (B12). Salah satu cara yang mungkin perlu dicoba untuk meningkatkan potensi bakteri endofit S. epidermidis (BC4) jika dikombinasikan dengan bakteri PGPR yaitu dengan mengaplikasikan masing-masing bakteri pada waktu yang berbeda. Misalnya, bakteri endofit S. epidermidis (BC4) diaplikasikan satu minggu setelah aplikasi
50 39 bakteri PGPR P. fluorescens RH4003 (P1) maupun B. subtilis AB89 (B12) dilakukan. Beberapa penelitian telah menunjukkan hasil bahwa penggunaan bakteri endofit dan PGPR mampu mengendalikan penyakit pada tumbuhan termasuk penyakit layu bakteri pada beberapa tanaman. Namun, penelitian yang telah dilakukan tersebut merupakan aplikasi dari bakteri PGPR dan endofit secara masing-masing bukan penggabungan dari bakteri PGPR dengan bakteri endofit. Penggabungan antar agens biokontrol belum tentu memberikan hasil yang lebih baik dari aplikasi agens biokontrol secara sendiri-sendiri. Seperti yang disebutkan oleh Arwiyanto & Hartana (1999) bahwa kombinasi antara P. fluorescens Pf20 dengan B. subtilis Ba118 justru memperparah munculnya penyakit layu bakteri pada tembakau. Arwiyanto & Hartana (1999) juga menyatakan bahwa kombinasi antar P. fluorescens Pf33 dengan P. fluorescens Pf15 bersifat antagonis karena menunjukkan indeks penyakit yang tinggi. Hal tersebut kemungkinan terjadi karena adanya kompetisi nutrisi dan ruang fisik maupun ruang biologi antar P. fluorescens (Arwiyanto & Hartana 1999). Namun, terdapat pula kombinasi antar agens biokontrol yang menunjukkan sifat sinergis. Handiyanti (2010) menyatakan bahwa kombinasi antara P. fluorescens Pf10 dengan B. subtilis B12 bersifat kompatibel atau sinergis. Kombinasi antar kedua agens biokontrol tersebut mampu menekan perkembangan penyakit busuk lunak pada anggrek. Tanaman dengan perlakuan P. fluorescens RH4003 (P1) memiliki bobot kering yang lebih tinggi dibanding perlakuan yang lain meskipun secara keseluruhan tidak berbeda nyata. Namun disisi lain P. fluorescens RH4003 (P1) tidak berpotensi dalam memacu tinggi tanaman. Karena laju pertambahan tinggi tanaman dengan perlakuan P1 lebih rendah dari kontrol pada musim penghujan. Tingkat kejadian penyakit pada tanaman yang diberi P. fluorescens RH4003 (P1) lebih rendah dari kontrol baik pengujian di rumah kaca maupun di lapangan. Berdasarkan nilai AUHPGC, bakteri endofit isolat BC10 yang diaplikasikan bersama bakteri PGPR P. fluorescens RH4003 (P1) dan B. subtilis AB89 (B12) menunjukkan laju pertambahan tinggi yang lebih besar dibandingkan perlakuan yang lain. Namun jika dilihat dari pengaruhnya terhadap tingkat
51 40 kejadian penyakit layu bakteri, bakteri endofit isolat BC10 yang diaplikasikan baik secara tunggal maupun kombinasi kurang menunjukkan kemampuannya dalam menghambat perkembangan penyakit layu bakteri terutama di lapangan. Meskipun tanaman dengan perlakuan kombinasi antara P. fluorescens RH4003 dengan bakteri endofit isolat BC10 (P1BC10) dan kombinasi antara B. subtilis AB89 dengan bakteri endofit isolat BC10 (B12BC10) menunjukkan laju pertambahan yang lebih tinggi dibandingkan perlakuan lain, namun bobot kering tanaman dengan kedua perlakuan tersebut tidak menunjukkan bobot yang besar pula. Hal tersebut karena tanaman yang tumbuh lebih tinggi belum tentu memiliki bobot yang lebih besar juga, sebab mungkin saja tanaman yang lebih tinggi tersebut jaringannya lebih sukulen. Dari uraian diatas dapat diketahui bahwa suatu agens antagonis yang digunakan dalam penelitian ini tidak semuanya berpotensi menekan perkembangan layu bakteri sekaligus meningkatkan laju pertambahan tinggi maupun bobot kering tanaman.
52 KESIMPULAN DAN SARAN Kesimpulan Diantara 5 isolat bakteri agens biokontrol yang diuji di lapangan secara tunggal ternyata bakteri Staphylococcus epidermidis (BC4) paling efektif dalam menekan kejadian penyakit layu bakteri berdasarkan nilai AUDPC. Gabungan antara bakteri endofit dan PGPR kurang efektif dalam menekan perkembangan penyakit layu bakteri di lapangan. Bakteri endofit S. epidermidis (BC4) bersifat antagonis jika dikombinasikan dengan bakteri PGPR P. fluorescens RH4003 (P1) maupun B. subtilis AB89 (B12). Sedangkan bakteri endofit Bacillus amyloliquefaciens (BL10) dan bakteri endofit isolat BC10 bersifat sinergis ketika dikombinasikan dengan bakteri PGPR P. fluorescens RH4003 (P1) maupun B. subtilis AB89 (B12). Aplikasi gabungan antara PGPR dan endofit tidak mempengaruhi pertambahan tinggi tanaman dan bobot kering. Namun, aplikasi tersebut juga tidak memberikan efek yang negatif bagi pertumbuhan tanaman. Saran Untuk meningkatkan potensi agens antagonis ini perlu ditambah frekuensi aplikasi pada berbagai usia tanaman serta perlu dilakukan penelitian mengenai perbandingan konsentrasi antara bakteri endofit dengan PGPR yang efektif dalam menekan penyakit layu bakteri.
53 DAFTAR PUSTAKA Agrios GN Plant Pathology. Ed ke- 3. London: Academic Press. Arwiyanto T, Hartana I Pengendalian hayati penyakit layu baketri tembakau: 2. percobaan di rumah kaca. Jurnal Perlindungan Tanaman Indonesia 5(1):50-59 [jurnal on-line]. download.php [23 Juli 2011]. [AVRDC] Asian Vegetable Research and Development Center Bacterial wilt. The World Vegetable Center. Bacterial wilt.pdf [22 Oktober2010]. Bustamam H Seleksi mikroba rizosfer antagonis terhadap bakteri Ralstonia solanacearum penyebab penyakit layu bakteri pada tanaman jahe di lahan tertindas. Jipi 8(1):12-18 [jurnal on-line]. [22 Oktober 2010]. Chrisnawati, Nasrun, Arwiyanto T Pengendalian penyakit layu bakteri nilam menggunakan Bacillus spp. dan Pseudomonas fluorescens. Littri 15(3): [jurnal on-line]. [22 April 2010]. Cooke BM Disease assessment and yield loss. Di dalam: Jones DG, editor. The Epidomiology of Plant Diseases. London: Kluwer Academic Publishers. hlm Damayanti I Seleksi dan karakterisasi bakteri endofit untuk menekan kejadian penyakit layu bakteri (Ralstonia solanacearum) pada tanaman tomat [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor. Glick BR, Pasternak JJ Molecular Biotechnology Principles and Applications of Recombinant DNA. Ed ke-3. Washington, DC: American Society for Microbiology ASM Press. Gunawan OS Teknologi Produksi Tomat. Bandung: Balai Penelitian Tanaman Sayuran. Handiyanti M Potensi Bacillus spp. dan Pseudomonas fluorescens sebagai agens pengendali penyakit busuk lunak bakteri (Erwinia carotovora) pada anggrek Phalaenopsis [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor. Hayward AC, Hartman GL Bacterial Wilt. Wallingford: Cab International. Juwita Potensi bakteri endofit dalam meningkatkan ketahanan tanaman kentang (Solanum tuberosum) terhadap serangan nematoda sista kuning (Globodera rostochiensis) [skripsi]. Malang: Fakultas Sains dan Teknologi, Universitas Islam Negeri Malang.
54 43 Khalimi K, Wirya GNAS Pemanfaatan plant growth promoting rhizobakteria untuk biostimulants dan bioprotectants. Ecotrophic 4(2): [jurnal on-line]. khamdan_edit.pdf [22 Oktober 2010]. Kloepper JW Plant Growth-Promoting Rhizobacteria as biological control agents of soilborne diseases. Di dalam: Petersen JB, editor. The Biological Control of Plant Diseases. Proceedings of The International Seminar Biological Control of Plant Diseases and Virus Vectors ; Tsukuba, September Japan: NARC. hlm McCarter SM Bacterial wilt. Di dalam: Jones JB et al., editor. Compendium of Tomato Diseases. Minnesota: The American Phytopathological Society. hlm Mehan VK, Liao BS, Tan YJ, Smith AR, McDonald D, Hayward AC Bacterial Wilt of Groundnut. India: International Crops Research Institute for the Semi-Arid Tropics. Nasrun, Christanti, Arwiyanto T, Mariska I Karakteristik fisiologis Ralstonia solanacearum penyebab penyakit layu bakteri nilam. Littri 13 (2): [jurnal on-line]. Files/File/publikasi/jurnal/Jurnal%202007/Artikel% NASRUN. pdf [22 Oktober 2010]. Nawangsih AA Seleksi dan karakterisasi bakteri biokontrol untuk mengendalikan penyakit layu bakteri (Ralstonia solanacearum) pada tomat [disertasi]. Bogor: Sekolah Pasca Sarjana, Institut Pertanian Bogor. Radji M Peranan bioteknologi dan mikroba endofit dalam pengembangan obat herbal. Majalah Ilmu Kefarmasian 2(3): [jurnal on-line]. [22 Oktober 2010]. Ratih S, Eviyati R Pestisida organik berbahan aktif bakteri agensia hayati yang efektif mengendalikan pustul kedelai. Agrijati 6(1): [jurnal on-line]. [22 Oktober 2010]. Saddler GS Management of bacterial wilt disease. Di dalam: Allen C et al., editor. Bacterial Wilt Disease and The Ralstonia solanacearum Species Complex. Minnesota: The American Phytopathological Society. hlm Sigee DC Bacterial Plant Pathology : Cell and Molecular Aspect. Manchester : Cambridge University Press. Soesanto L Pengantar Pengendalian Hayati Penyakit Tanaman. Jakarta: PT Raja Grafindo Persada. Sudarsono, Malik A Efektifitas bakteri antagonis yang dikombinasikan dengan EM 4 dan bokashi terhadap penyakit layu bakteri pada tanaman kentang. Agros 8(1): 1-8 [jurnal on-line]. jurnal/ pdf [22 Oktober 2010].
55 44 Tigchelaar E.C Botany and culture. Di dalam: Jones JB et al., editor. Compendium of Tomato Diseases. Minnesota: The American Phytopathological Society. hlm 2-4. Yang CY Bacterial and fungal diseases of tomato. Di dalam: Robert C, editor. 1 st International Symposium on Tropical Tomato. Shanhua: AVRDC. hlm
56 LAMPIRAN Lampiran 1 Hasil analisis ragam laju pertambahan tinggi tanaman tomat di rumah kaca pada musim kemarau Sumber DB JK KT F hit Pr > F Minggu 1 Blok Perlakuan Error/ galat Total terkoreksi Minggu Blok Perlakuan Error/ galat Total terkoreksi Minggu Blok Perlakuan Error/ galat Total terkoreksi Minggu Blok Perlakuan Error/ galat Total terkoreksi
57 46 Lampiran 1 (lanjutan) Sumber DB JK KT F hit Pr > F Minggu 5 Blok Perlakuan Error/ galat Total terkoreksi Lampiran 2 Hasil analisis ragam laju pertambahan tinggi tanaman tomat di rumah kaca pada musim penghujan Sumber DB JK KT F hit Pr > F Minggu 1 Blok Perlakuan Error/ galat Total terkoreksi Minggu Blok Perlakuan Error/ galat Total terkoreksi Minggu Blok Perlakuan Error/ galat Total terkoreksi
58 47 Lampiran 2 (lanjutan) Sumber DB JK KT F hit Pr > F Minggu 4 Blok Perlakuan Error/ galat Total terkoreksi Minggu Blok Perlakuan Error/ galat Total terkoreksi Lampiran 3 Hasil analisis ragam kejadian penyakit layu bakteri pada tanaman tomat di rumah kaca pada musim penghujan Sumber DB JK KT F hit Pr > F Minggu 1 Blok Perlakuan Error/ galat Total terkoreksi Minggu Blok Perlakuan Error/ galat Total terkoreksi
59 48 Lampiran 3 (lanjutan) Sumber DB JK KT F hit Pr > F Minggu 3 Blok Perlakuan Error/ galat Total terkoreksi Minggu Blok Perlakuan Error/ galat Total terkoreksi Minggu Blok Perlakuan Error/ galat Total terkoreksi Minggu Blok Perlakuan Error/ galat Total terkoreksi Minggu Blok Perlakuan Error/ galat Total terkoreksi
60 49 Lampiran 3 (lanjutan) Sumber DB JK KT F hit Pr > F Minggu 8 Blok Perlakuan Error/ galat Total terkoreksi Minggu 9 Blok Perlakuan Error/ galat Total terkoreksi Lampiran 4 Hasil analisis ragam bobot kering tanaman tomat di rumah kaca pada musim penghujan Sumber DB JK KT F hit Pr > F Blok Perlakuan Error/ galat Total terkoreksi
61 50 Lampiran 5 Hasil analisis ragam kejadian penyakit layu bakteri pada tanaman tomat di lapangan Sumber DB JK KT F hit Pr > F Minggu 1 Blok Perlakuan Error/ galat Total terkoreksi Minggu Blok <.0001 Perlakuan Error/ galat Total terkoreksi Minggu Blok <.0001 Perlakuan Error/ galat Total terkoreksi Minggu Blok <.0001 Perlakuan Error/ galat Total terkoreksi
62 51 Lampiran 5 (lanjutan) Sumber DB JK KT F hit Pr > F Minggu 5 Blok <.0001 Perlakuan Error/ galat Total terkoreksi Minggu 6 Minggu Blok <.0001 Perlakuan Error/ galat Total terkoreksi Blok <.0001 Perlakuan Error/ galat Total terkoreksi Minggu Blok Perlakuan Error/ galat Total terkoreksi Minggu Blok Perlakuan Error/ galat Total terkoreksi
63 52 a b c Lampiran 6 Persiapan tanah terinfestasi R. solanacearum; pencampuran suspensi R. solanacearum dengan air (a), pencampuran tanaman tomat terserang layu bakteri dengan air (b), pencampuran suspensi R. solanacearum dengan tanah dari lapangan (c) a b Lampiran 7 Persiapan perlakuan agens biokontrol; 200 ml suspensi agens biokontrol dimasukkan ke dalam ember (a), pencampuran 200 ml agens biokontrol dengan 1800 ml air (b)
64 53 Lampiran 8 Gejala layu bakteri di rumah kaca Lampiran 9 Keadaan pertanaman tomat di rumah kaca; umur 25 hst (kiri), umur 32 hst (kanan)
65 54 a b Lampiran 10 Pengukuran bobot kering tanaman tomat; penjemuran tanaman (a), penimbangan bobot kering tanaman (b) Lampiran 11 Gejala layu bakteri di lapangan
BAHAN DAN METODE Tempat dan Waktu Penelitian Bahan dan Alat Metode Penelitian Penyiapan tanaman uji
 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilakukan pada bulan Juli 2010 Maret 2011. Penelitian dilakukan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian,
BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilakukan pada bulan Juli 2010 Maret 2011. Penelitian dilakukan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian,
BAHAN DAN METODE Tempat dan Waktu Penyiapan Tanaman Uji Pemeliharaan dan Penyiapan Suspensi Bakteri Endofit dan PGPR
 17 BAHAN DAN METODE Tempat dan Waktu Penelitian dilakukan di Laboratorium Bakteriologi Tumbuhan Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dan di Rumah Kaca, University Farm,
17 BAHAN DAN METODE Tempat dan Waktu Penelitian dilakukan di Laboratorium Bakteriologi Tumbuhan Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dan di Rumah Kaca, University Farm,
BAHAN DAN METODE. Metode Penelitian
 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilakukan di Laboratorium Bakteriologi Tumbuhan dan Rumah Kaca University Farm, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian
BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilakukan di Laboratorium Bakteriologi Tumbuhan dan Rumah Kaca University Farm, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian
HASIL DAN PEMBAHASAN
 HASIL DAN PEMBAHASAN Isolasi Bakteri Endofit Asal Bogor, Cipanas, dan Lembang Bakteri endofit yang digunakan dalam penelitian ini berasal dari tiga tempat yang berbeda dalam satu propinsi Jawa Barat. Bogor,
HASIL DAN PEMBAHASAN Isolasi Bakteri Endofit Asal Bogor, Cipanas, dan Lembang Bakteri endofit yang digunakan dalam penelitian ini berasal dari tiga tempat yang berbeda dalam satu propinsi Jawa Barat. Bogor,
BAHAN DAN METODE Tempat dan waktu penelitian Bahan dan Alat Isolasi dan Uji Reaksi Hipersensitif Bakteri Penghasil Siderofor
 BAHAN DAN METODE Tempat dan waktu penelitian Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, dari Oktober 2010
BAHAN DAN METODE Tempat dan waktu penelitian Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, dari Oktober 2010
BAHAN. bulan Juli diremajakan. pertumbuhan. Gambar 4
 14 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilakukan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian serta di Rumah Kaca University Farm, Institut
14 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilakukan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian serta di Rumah Kaca University Farm, Institut
HASIL DAN PEMBAHASAN Pengaruh Kombinasi Agens Biokontrol terhadap Kejadian Penyakit Layu Bakteri
 HASIL DAN PEMBAHASAN Pengaruh Kombinasi Agens Biokontrol terhadap Kejadian Penyakit Layu Bakteri Kejadian penyakit adalah angka yang menunjukkan jumlah tanaman sakit dibandingkan dengan jumlah tanaman
HASIL DAN PEMBAHASAN Pengaruh Kombinasi Agens Biokontrol terhadap Kejadian Penyakit Layu Bakteri Kejadian penyakit adalah angka yang menunjukkan jumlah tanaman sakit dibandingkan dengan jumlah tanaman
BAHAN DAN METODE. Tabel 1 Kombinasi perlakuan yang dilakukan di lapangan
 13 BAHAN DAN METODE Tempat dan waktu Penelitian ini dilaksanakan di Desa Ciburuy, Kecamatan Cigombong, Kabupaten Bogor serta di Laboratorium Bakteriologi, Departemen Proteksi Tanaman, Fakultas Pertanian,
13 BAHAN DAN METODE Tempat dan waktu Penelitian ini dilaksanakan di Desa Ciburuy, Kecamatan Cigombong, Kabupaten Bogor serta di Laboratorium Bakteriologi, Departemen Proteksi Tanaman, Fakultas Pertanian,
SELEKSI DAN KARAKTERISASI BAKTERI ENDOFIT UNTUK MENEKAN KEJADIAN PENYAKIT LAYU BAKTERI (Ralstonia solanacearum) PADA TANAMAN TOMAT IKA DAMAYANTI
 SELEKSI DAN KARAKTERISASI BAKTERI ENDOFIT UNTUK MENEKAN KEJADIAN PENYAKIT LAYU BAKTERI (Ralstonia solanacearum) PADA TANAMAN TOMAT IKA DAMAYANTI DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN INSTITUT
SELEKSI DAN KARAKTERISASI BAKTERI ENDOFIT UNTUK MENEKAN KEJADIAN PENYAKIT LAYU BAKTERI (Ralstonia solanacearum) PADA TANAMAN TOMAT IKA DAMAYANTI DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN INSTITUT
Gambar 1 Tanaman uji hasil meriklon (A) anggrek Phalaenopsis, (B) bunga Phalaenopsis yang berwarna putih
 BAHAN DAN METODE Tempat dan Waktu Penelitian Isolasi dan perbanyakan sumber inokulum E. carotovora dilakukan di Laboratorium Bakteriologi Departemen Proteksi Tanaman Fakultas Pertanian, Institut Pertanian
BAHAN DAN METODE Tempat dan Waktu Penelitian Isolasi dan perbanyakan sumber inokulum E. carotovora dilakukan di Laboratorium Bakteriologi Departemen Proteksi Tanaman Fakultas Pertanian, Institut Pertanian
BAHAN DAN METODE. Tempat dan Waktu
 15 BAHAN DAN METODE Tempat dan Waktu Penelitian dilaksanakan di laboratorium dan rumah kaca Hama dan Penyakit dan rumah kaca Balai penelitian Tanaman Obat dan Aromatik (BALITTRO), Bogor; pada bulan Oktober
15 BAHAN DAN METODE Tempat dan Waktu Penelitian dilaksanakan di laboratorium dan rumah kaca Hama dan Penyakit dan rumah kaca Balai penelitian Tanaman Obat dan Aromatik (BALITTRO), Bogor; pada bulan Oktober
HASIL DAN PEMBAHASAN Pengaruh PGPR terhadap Laju Pertambahan Tinggi Tanaman Kedelai
 23 HASIL DAN PEMBAHASAN Pengaruh PGPR terhadap Laju Pertambahan Tinggi Tanaman Kedelai PGPR sebagai rizobakteria memberikan pengaruh tertentu terhadap pertumbuhan tanaman kedelai yang diujikan di rumah
23 HASIL DAN PEMBAHASAN Pengaruh PGPR terhadap Laju Pertambahan Tinggi Tanaman Kedelai PGPR sebagai rizobakteria memberikan pengaruh tertentu terhadap pertumbuhan tanaman kedelai yang diujikan di rumah
HASIL DAN PEMBAHASAN Isolasi dan Inokulasi Penyebab Busuk Lunak Karakterisasi Bakteri Penyebab Busuk Lunak Uji Gram
 HASIL DAN PEMBAHASAN Isolasi dan Inokulasi Penyebab Busuk Lunak Isolasi daun anggrek yang bergejala busuk lunak dihasilkan 9 isolat bakteri. Hasil uji Gram menunjukkan 4 isolat termasuk bakteri Gram positif
HASIL DAN PEMBAHASAN Isolasi dan Inokulasi Penyebab Busuk Lunak Isolasi daun anggrek yang bergejala busuk lunak dihasilkan 9 isolat bakteri. Hasil uji Gram menunjukkan 4 isolat termasuk bakteri Gram positif
HASIL DAN PEMBAHASAN
 HASIL DAN PEMBAHASAN Isolasi dan Reaksi Hipersensitif Bakteri Penghasil Siderofor Asal Cipanas dan Lembang Daerah perakaran tanaman tomat sehat diduga lebih banyak dikolonisasi oleh bakteri yang bermanfaat
HASIL DAN PEMBAHASAN Isolasi dan Reaksi Hipersensitif Bakteri Penghasil Siderofor Asal Cipanas dan Lembang Daerah perakaran tanaman tomat sehat diduga lebih banyak dikolonisasi oleh bakteri yang bermanfaat
EKSPLORASI Pseudomonad fluorescens DARI PERAKARAN GULMA PUTRI MALU (Mimosa invisa)
 EKSPLORASI Pseudomonad fluorescens DARI PERAKARAN GULMA PUTRI MALU (Mimosa invisa) A. Pendahuluan Pseudomonad fluorescens merupakan anggota kelompok Pseudomonas yang terdiri atas Pseudomonas aeruginosa,
EKSPLORASI Pseudomonad fluorescens DARI PERAKARAN GULMA PUTRI MALU (Mimosa invisa) A. Pendahuluan Pseudomonad fluorescens merupakan anggota kelompok Pseudomonas yang terdiri atas Pseudomonas aeruginosa,
BAHAN DAN METODE. Pembiakan P. fluorescens dari Kultur Penyimpanan
 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor mulai bulan Februari
BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor mulai bulan Februari
BAHAN DAN METODE. Metode Penelitian
 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilaksanakan di Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, dari bulan Februari sampai
BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilaksanakan di Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, dari bulan Februari sampai
BAHAN DAN METODE Tempat dan Waktu Penelitian Bahan dan Alat Metode Penelitian Pra-pengamatan atau survei
 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilaksanakan di Kebun Percobaan Pusat Kajian Buah-Buahan Tropika IPB (PKBT-IPB) Pasir Kuda, Desa Ciomas, Bogor, dan Laboratorium Bakteriologi Tumbuhan,
BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilaksanakan di Kebun Percobaan Pusat Kajian Buah-Buahan Tropika IPB (PKBT-IPB) Pasir Kuda, Desa Ciomas, Bogor, dan Laboratorium Bakteriologi Tumbuhan,
BAB I PENDAHULUAN. Tomat (Lycopersicum esculantum Mill.) merupakan salah satu komoditas
 BAB I PENDAHULUAN 1.1 Latar Belakang Tomat (Lycopersicum esculantum Mill.) merupakan salah satu komoditas yang bersifat multiguna dan banyak diminati oleh masyarakat, khususnya di Indonesia, saat ini tomat
BAB I PENDAHULUAN 1.1 Latar Belakang Tomat (Lycopersicum esculantum Mill.) merupakan salah satu komoditas yang bersifat multiguna dan banyak diminati oleh masyarakat, khususnya di Indonesia, saat ini tomat
BAHAN DAN METODE Waktu dan Tempat Penelitian Bahan Penelitian Metode Penelitian Isolasi dan Identifikasi Cendawan Patogen
 14 BAHAN DAN METODE Waktu dan Tempat Penelitian Percobaan dilaksanakan dari bulan Maret sampai bulan Juli 2012 di Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut
14 BAHAN DAN METODE Waktu dan Tempat Penelitian Percobaan dilaksanakan dari bulan Maret sampai bulan Juli 2012 di Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut
Tabel 1 Persentase penghambatan koloni dan filtrat isolat Streptomyces terhadap pertumbuhan S. rolfsii Isolat Streptomyces spp.
 4 Tinggi tanaman kumulatif dikonversi menjadi LADKT (luasan area di bawah kurva perkembangan tinggi tanaman) menggunakan rumus sama seperti perhitungan LADKP. KB dihitung dengan rumus (Sutopo 2002): Perhitungan
4 Tinggi tanaman kumulatif dikonversi menjadi LADKT (luasan area di bawah kurva perkembangan tinggi tanaman) menggunakan rumus sama seperti perhitungan LADKP. KB dihitung dengan rumus (Sutopo 2002): Perhitungan
PENGENDALIAN LAYU FUSARIUM PADA TANAMAN PISANG (Musa paradisiaca L.) SECARA KULTUR TEKNIS DAN HAYATI MIFTAHUL HUDA
 PENGENDALIAN LAYU FUSARIUM PADA TANAMAN PISANG (Musa paradisiaca L.) SECARA KULTUR TEKNIS DAN HAYATI MIFTAHUL HUDA DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN INSTITUT PERTANIAN BOGOR 2010 ABSTRAK MIFTAHUL
PENGENDALIAN LAYU FUSARIUM PADA TANAMAN PISANG (Musa paradisiaca L.) SECARA KULTUR TEKNIS DAN HAYATI MIFTAHUL HUDA DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN INSTITUT PERTANIAN BOGOR 2010 ABSTRAK MIFTAHUL
BAHAN DAN METODE Waktu dan Tempat Bahan dan Alat Metode Penelitian Penyediaan Isolat Fusarium sp. dan Bakteri Aktivator
 BAHAN DAN METODE Waktu dan Tempat Penelitian ini dilakukan di Laboratorium Mikologi, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, dan Laboratorium Mikrobiologi dan Kesehatan
BAHAN DAN METODE Waktu dan Tempat Penelitian ini dilakukan di Laboratorium Mikologi, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, dan Laboratorium Mikrobiologi dan Kesehatan
Penyakit Layu Bakteri pada Kentang
 Penyakit Layu Bakteri pada Kentang Penyakit layu bakteri dapat mengurangi kehilangan hasil pada tanaman kentang, terutama pada fase pembibitan. Penyakit layu bakteri disebabkan oleh bakteri Ralstonia solanacearum
Penyakit Layu Bakteri pada Kentang Penyakit layu bakteri dapat mengurangi kehilangan hasil pada tanaman kentang, terutama pada fase pembibitan. Penyakit layu bakteri disebabkan oleh bakteri Ralstonia solanacearum
KEEFEKTIFAN BERBAGAI FOMULASI PLANT GROWTH PROMOTING RHIZOBACTERIA
 KEEFEKTIFAN BERBAGAI FOMULASI PLANT GROWTH PROMOTING RHIZOBACTERIA (PGPR) DAN BAKTERI ENDOFIT TERHADAP PENYAKIT LAYU BAKTERI YANG DISEBABKAN OLEH Ralstonia solanacearum PADA TOMAT NOVRA ERNALIANA SINAGA
KEEFEKTIFAN BERBAGAI FOMULASI PLANT GROWTH PROMOTING RHIZOBACTERIA (PGPR) DAN BAKTERI ENDOFIT TERHADAP PENYAKIT LAYU BAKTERI YANG DISEBABKAN OLEH Ralstonia solanacearum PADA TOMAT NOVRA ERNALIANA SINAGA
TINJAUAN PUSTAKA Arti Penting Tanaman Tomat Penyakit Layu Bakteri pada Tomat oleh Ralstonia solanacearum
 TINJAUAN PUSTAKA Arti Penting Tanaman Tomat Tomat (Lycopersicon esculentum Mill.) adalah komoditas hortikultura yang penting di Indonesia dan merupakan salah satu jenis sayuran yang banyak digemari orang
TINJAUAN PUSTAKA Arti Penting Tanaman Tomat Tomat (Lycopersicon esculentum Mill.) adalah komoditas hortikultura yang penting di Indonesia dan merupakan salah satu jenis sayuran yang banyak digemari orang
BAHAN DAN METODE Tempat dan Waktu Bahan Peremajaan Aktinomiset dari Kultur Penyimpanan Perbanyakan Sclerotium rolfsii dari Kultur Penyimpanan
 BAHAN DAN METODE Tempat dan Waktu Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor (IPB) mulai Maret 2011 sampai
BAHAN DAN METODE Tempat dan Waktu Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor (IPB) mulai Maret 2011 sampai
EFIKASI BAKTERI ENDOFIT DAN PLANT GROWTH PROMOTING RHIZOBACTERIA DALAM MENEKAN PERKEMBANGAN PENYAKIT LAYU BAKTERI (Ralstonia solanacearum) PADA TOMAT
 1 EFIKASI BAKTERI ENDOFIT DAN PLANT GROWTH PROMOTING RHIZOBACTERIA DALAM MENEKAN PERKEMBANGAN PENYAKIT LAYU BAKTERI (Ralstonia solanacearum) PADA TOMAT FITRI FATMA WARDANI DEPARTEMEN PROTEKSI TANAMAN FAKULTAS
1 EFIKASI BAKTERI ENDOFIT DAN PLANT GROWTH PROMOTING RHIZOBACTERIA DALAM MENEKAN PERKEMBANGAN PENYAKIT LAYU BAKTERI (Ralstonia solanacearum) PADA TOMAT FITRI FATMA WARDANI DEPARTEMEN PROTEKSI TANAMAN FAKULTAS
Ralstonia solanacearum
 NAMA : Zuah Eko Mursyid Bangun NIM : 6030066 KELAS : AET-2A Ralstonia solanacearum (Bakteri penyebab penyakit layu). Klasifikasi Kingdom : Prokaryotae Divisi : Gracilicutes Subdivisi : Proteobacteria Famili
NAMA : Zuah Eko Mursyid Bangun NIM : 6030066 KELAS : AET-2A Ralstonia solanacearum (Bakteri penyebab penyakit layu). Klasifikasi Kingdom : Prokaryotae Divisi : Gracilicutes Subdivisi : Proteobacteria Famili
III. BAHAN DAN METODE
 III. BAHAN DAN METODE 3.1. Tempat dan Waktu Penelitian ini telah dilaksanakan di Laboratorium Penyakit Tumbuhan Fakultas Pertanian Universitas Riau, Pekanbaru yang berlangsung selama 4 bulan, dimulai dari
III. BAHAN DAN METODE 3.1. Tempat dan Waktu Penelitian ini telah dilaksanakan di Laboratorium Penyakit Tumbuhan Fakultas Pertanian Universitas Riau, Pekanbaru yang berlangsung selama 4 bulan, dimulai dari
POTENSI BAKTERISIDA SENYAWA METABOLIT Penicillium spp. TERHADAP Ralstonia solanacearum PENYEBAB PENYAKIT LAYU BAKTERI PADA CABAI KHOIRUNNISYA
 POTENSI BAKTERISIDA SENYAWA METABOLIT Penicillium spp. TERHADAP Ralstonia solanacearum PENYEBAB PENYAKIT LAYU BAKTERI PADA CABAI KHOIRUNNISYA DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN INSTITUT PERTANIAN
POTENSI BAKTERISIDA SENYAWA METABOLIT Penicillium spp. TERHADAP Ralstonia solanacearum PENYEBAB PENYAKIT LAYU BAKTERI PADA CABAI KHOIRUNNISYA DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN INSTITUT PERTANIAN
MENGENAL LEBIH DEKAT PENYAKIT LAYU BEKTERI Ralstonia solanacearum PADA TEMBAKAU
 PEMERINTAH KABUPATEN PROBOLINGGO DINAS PERKEBUNAN DAN KEHUTANAN JL. RAYA DRINGU 81 TELPON 0335-420517 PROBOLINGGO 67271 MENGENAL LEBIH DEKAT PENYAKIT LAYU BEKTERI Ralstonia solanacearum PADA TEMBAKAU Oleh
PEMERINTAH KABUPATEN PROBOLINGGO DINAS PERKEBUNAN DAN KEHUTANAN JL. RAYA DRINGU 81 TELPON 0335-420517 PROBOLINGGO 67271 MENGENAL LEBIH DEKAT PENYAKIT LAYU BEKTERI Ralstonia solanacearum PADA TEMBAKAU Oleh
III. METODE PENELITIAN
 III. METODE PENELITIAN A. Tahap Laboratorium 1. Uji Kemampuan Isolat a. Tempat dan Waktu Penelitian Uji kemampuan 40 isolat bakteri dilaksanakan di laboratorium Biologi dan Bioteknologi Tanah, Fakultas
III. METODE PENELITIAN A. Tahap Laboratorium 1. Uji Kemampuan Isolat a. Tempat dan Waktu Penelitian Uji kemampuan 40 isolat bakteri dilaksanakan di laboratorium Biologi dan Bioteknologi Tanah, Fakultas
BAHAN DAN METODE. Pengambilan sampel tanaman nanas dilakukan di lahan perkebunan PT. Great
 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Pengambilan sampel tanaman nanas dilakukan di lahan perkebunan PT. Great Giant Pineapple (GGP) di Lampung Timur dan PT. Nusantara Tropical Farm, Lampung
III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Pengambilan sampel tanaman nanas dilakukan di lahan perkebunan PT. Great Giant Pineapple (GGP) di Lampung Timur dan PT. Nusantara Tropical Farm, Lampung
SELEKSI DAN KARAKTERISASI BAKTERI ENDOFIT UNTUK MENEKAN KEJADIAN PENYAKIT LAYU BAKTERI (Ralstonia solanacearum) PADA TANAMAN TOMAT IKA DAMAYANTI
 SELEKSI DAN KARAKTERISASI BAKTERI ENDOFIT UNTUK MENEKAN KEJADIAN PENYAKIT LAYU BAKTERI (Ralstonia solanacearum) PADA TANAMAN TOMAT IKA DAMAYANTI DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN INSTITUT
SELEKSI DAN KARAKTERISASI BAKTERI ENDOFIT UNTUK MENEKAN KEJADIAN PENYAKIT LAYU BAKTERI (Ralstonia solanacearum) PADA TANAMAN TOMAT IKA DAMAYANTI DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN INSTITUT
TINJAUAN PUSTAKA Tanaman Tomat Layu Bakteri pada Tomat
 TINJAUAN PUSTAKA Tanaman Tomat Tomat termasuk tanaman perdu semusim, berbatang lemah, daun berbentuk segi tiga, bunga berwarna kuning atau hijau di waktu muda dan kuning atau merah di waktu tua, serta
TINJAUAN PUSTAKA Tanaman Tomat Tomat termasuk tanaman perdu semusim, berbatang lemah, daun berbentuk segi tiga, bunga berwarna kuning atau hijau di waktu muda dan kuning atau merah di waktu tua, serta
PENGARUH MEDIA FORMULASI DAN JENIS KEMASAN
 PENGARUH MEDIA FORMULASI DAN JENIS KEMASAN Bacillus subtilis UNTUK PENGENDALIAN Ralstonia solanacearum (Yabuuchi et al.) PADA TANAMAN TOMAT SECARA IN VITRO SKRIPSI Oleh Tri Vita Lestari NIM. 011510401050
PENGARUH MEDIA FORMULASI DAN JENIS KEMASAN Bacillus subtilis UNTUK PENGENDALIAN Ralstonia solanacearum (Yabuuchi et al.) PADA TANAMAN TOMAT SECARA IN VITRO SKRIPSI Oleh Tri Vita Lestari NIM. 011510401050
I. PENDAHULUAN. A. Latar Belakang. Tomat merupakan salah satu tanaman hortikultura yang penting di dunia.
 I. PENDAHULUAN A. Latar Belakang Tomat merupakan salah satu tanaman hortikultura yang penting di dunia. Tanaman ini mempunyai daya adaptasi yang baik pada berbagai kondisi lingkungan. Luas lahan pertanaman
I. PENDAHULUAN A. Latar Belakang Tomat merupakan salah satu tanaman hortikultura yang penting di dunia. Tanaman ini mempunyai daya adaptasi yang baik pada berbagai kondisi lingkungan. Luas lahan pertanaman
BAB I PENDAHULUAN. Teknologi pertanian, khususnya dalam pengendalian penyakit tanaman di
 BAB I PENDAHULUAN A. Latar Belakang Teknologi pertanian, khususnya dalam pengendalian penyakit tanaman di Indonesia masih banyak mengandalkan penggunaan pestisida. Penggunaan pestisida yang tidak bijaksana
BAB I PENDAHULUAN A. Latar Belakang Teknologi pertanian, khususnya dalam pengendalian penyakit tanaman di Indonesia masih banyak mengandalkan penggunaan pestisida. Penggunaan pestisida yang tidak bijaksana
KARAKTERISTIK PENYEBAB PENYAKIT LAYU BAKTERI PADA TANAMAN TEMBAKAU DI PROBOLINGGO
 KARAKTERISTIK PENYEBAB PENYAKIT LAYU BAKTERI PADA TANAMAN TEMBAKAU DI PROBOLINGGO Pendahuluan Tembakau merupakan salah satu komoditas perkebunan yang strategis dan memiliki nilai ekonomi cukup tinggi.
KARAKTERISTIK PENYEBAB PENYAKIT LAYU BAKTERI PADA TANAMAN TEMBAKAU DI PROBOLINGGO Pendahuluan Tembakau merupakan salah satu komoditas perkebunan yang strategis dan memiliki nilai ekonomi cukup tinggi.
PENDAHULUAN 1.1. Latar Belakang
 I. PENDAHULUAN 1.1. Latar Belakang Tanaman cabai (Capsicum annuum L.) merupakan salah satu komoditas hortikultura yang banyak dibudidayakan oleh petani di Indonesia, karena memiliki harga jual yang tinggi.
I. PENDAHULUAN 1.1. Latar Belakang Tanaman cabai (Capsicum annuum L.) merupakan salah satu komoditas hortikultura yang banyak dibudidayakan oleh petani di Indonesia, karena memiliki harga jual yang tinggi.
BAB III METODE PENELITIAN. Mikrobiologi Tanah dan Rumah Kaca Balai Penelitian Tanaman Kacang- kacangan dan Umbiumbian
 BAB III METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian Penelitian dilaksanakan pada tanggal 01 Februari sampai 31 Mei 2011 di Laboratorium Mikrobiologi Tanah dan Rumah Kaca Balai Penelitian Tanaman
BAB III METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian Penelitian dilaksanakan pada tanggal 01 Februari sampai 31 Mei 2011 di Laboratorium Mikrobiologi Tanah dan Rumah Kaca Balai Penelitian Tanaman
TAHLIYATIN WARDANAH A
 PEMANFAATAN BAKTERI PERAKARAN PEMACU PERTUMBUHAN TANAMAN (PLANT GROWTH- PROMOTING RHIZOBACTERIA) UNTUK MENGENDALIKAN PENYAKIT MOSAIK TEMBAKAU (TOBACCO MOSAIC VIRUS) PADA TANAMAN CABAI TAHLIYATIN WARDANAH
PEMANFAATAN BAKTERI PERAKARAN PEMACU PERTUMBUHAN TANAMAN (PLANT GROWTH- PROMOTING RHIZOBACTERIA) UNTUK MENGENDALIKAN PENYAKIT MOSAIK TEMBAKAU (TOBACCO MOSAIC VIRUS) PADA TANAMAN CABAI TAHLIYATIN WARDANAH
IDENTIFIKASI DAN PENANGGULANGAN PENYAKIT PADA BUDIDAYA CABAI MERAH
 IDENTIFIKASI DAN PENANGGULANGAN PENYAKIT PADA BUDIDAYA CABAI MERAH Nurbaiti Pendahuluan Produktifitas cabai di Aceh masih rendah 10.3 ton/ha (BPS, 2014) apabila dibandingkan dengan potensi produksi yang
IDENTIFIKASI DAN PENANGGULANGAN PENYAKIT PADA BUDIDAYA CABAI MERAH Nurbaiti Pendahuluan Produktifitas cabai di Aceh masih rendah 10.3 ton/ha (BPS, 2014) apabila dibandingkan dengan potensi produksi yang
BAHAN DAN METODE Bahan Waktu dan Tempat Penelitian Rancangan Percobaan ProsedurPenelitian
 11 BAHAN DAN METODE Bahan Bahan tanaman yang digunakan adalah benih jagung hibrida varietas BISI 816 produksi PT. BISI International Tbk (Lampiran 1) dan benih cabai merah hibrida varietas Wibawa F1 cap
11 BAHAN DAN METODE Bahan Bahan tanaman yang digunakan adalah benih jagung hibrida varietas BISI 816 produksi PT. BISI International Tbk (Lampiran 1) dan benih cabai merah hibrida varietas Wibawa F1 cap
BAHAN DAN METODE. Hrp -, IAA +, BPF Hrp -, IAA + + , BPF Hrp. , BPF Hrp -, IAA +, BPF + Hrp. , BPF Hrp. , BPF Hrp. Penambat Nitrogen Penambat Nitrogen
 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB dan lahan pertanian Kampung Bongkor, Desa Situgede, Karang Pawitan-Wanaraja,
BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB dan lahan pertanian Kampung Bongkor, Desa Situgede, Karang Pawitan-Wanaraja,
III. BAHAN DAN METODE. Penelitian ini dilaksanakan di Laboratorium Penyakit Tumbuhan dan Kebun
 17 III. BAHAN DAN MEODE 3.1 empat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Penyakit umbuhan dan ebun Percobaan di dalam kampus di Program Studi Agroteknologi Fakultas Pertanian,
17 III. BAHAN DAN MEODE 3.1 empat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Penyakit umbuhan dan ebun Percobaan di dalam kampus di Program Studi Agroteknologi Fakultas Pertanian,
PENDAHULUAN. Sebagian besar produk perkebunan utama diekspor ke negara-negara lain. Ekspor. teh dan kakao (Kementerian Pertanian, 2015).
 12 PENDAHULUAN Latar Belakang Sub-sektor perkebunan merupakan penyumbang ekspor terbesar di sektor pertanian dengan nilai ekspor yang jauh lebih besar dibandingkan nilai impornya. Sebagian besar produk
12 PENDAHULUAN Latar Belakang Sub-sektor perkebunan merupakan penyumbang ekspor terbesar di sektor pertanian dengan nilai ekspor yang jauh lebih besar dibandingkan nilai impornya. Sebagian besar produk
HASIL DAN PEMBAHASAN
 HASIL DAN PEMBAHASAN Pembiakan P. fluorescens pada Beberapa Formulasi Limbah Organik Populasi P. fluorescens pada beberapa limbah organik menunjukkan adanya peningkatan populasi. Pengaruh komposisi limbah
HASIL DAN PEMBAHASAN Pembiakan P. fluorescens pada Beberapa Formulasi Limbah Organik Populasi P. fluorescens pada beberapa limbah organik menunjukkan adanya peningkatan populasi. Pengaruh komposisi limbah
BAHAN DAN METODE. Bahan
 9 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilaksanakan di Laboratorium Patologi Serangga, dan Laboratorium Fisiologi dan Toksikologi Serangga, Departemen Proteksi Tanaman, Fakultas Pertanian,
9 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilaksanakan di Laboratorium Patologi Serangga, dan Laboratorium Fisiologi dan Toksikologi Serangga, Departemen Proteksi Tanaman, Fakultas Pertanian,
BAHAN DAN METODE Waktu dan Tempat Penelitian Bahan Metode Penelitian Pembuatan Pupuk Hayati
 BAHAN DAN METODE Waktu dan Tempat Penelitian Penelitian dilaksanakan di Laboratorium Fisiologi Tumbuhan dan Laboratorium Mikrobiologi Departemen Biologi Institut Pertanian Bogor, serta di kebun percobaan
BAHAN DAN METODE Waktu dan Tempat Penelitian Penelitian dilaksanakan di Laboratorium Fisiologi Tumbuhan dan Laboratorium Mikrobiologi Departemen Biologi Institut Pertanian Bogor, serta di kebun percobaan
HASIL DAN PEMBAHASAN
 HASIL DAN PEMBAHASAN Penyediaan Isolat Fusarium sp. dan Perkembangan Koloni Bakteri Aktivator pada NA dengan Penambahan Asam Humat Pengujian di laboratorium menunjukkan bahwa pada bagian tanaman tomat
HASIL DAN PEMBAHASAN Penyediaan Isolat Fusarium sp. dan Perkembangan Koloni Bakteri Aktivator pada NA dengan Penambahan Asam Humat Pengujian di laboratorium menunjukkan bahwa pada bagian tanaman tomat
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN 3.1. Rancangan Penelitian Penelitian ini merupakan penelitian eksperimental. Rancangan yang digunakan dalam penelitian ini adalah rancangan acak lengkap (RAL) tunggal, dengan
BAB III METODE PENELITIAN 3.1. Rancangan Penelitian Penelitian ini merupakan penelitian eksperimental. Rancangan yang digunakan dalam penelitian ini adalah rancangan acak lengkap (RAL) tunggal, dengan
II. METODELOGI PENELITIAN
 II. METODELOGI PENELITIAN 2.1 Metode Pengumpulan Data 2.1.1 Waktu dan Tempat Penelitian Penelitian ini dilakukan di UPT Laboratorium Biosain dan Bioteknologi Universitas Udayana. Penelitian ini berlangsung
II. METODELOGI PENELITIAN 2.1 Metode Pengumpulan Data 2.1.1 Waktu dan Tempat Penelitian Penelitian ini dilakukan di UPT Laboratorium Biosain dan Bioteknologi Universitas Udayana. Penelitian ini berlangsung
I. PENDAHULUAN. Pisang Cavendish merupakan komoditas pisang segar (edible banana) yang
 1 I. PENDAHULUAN 1.1. Latar Belakang Pisang Cavendish merupakan komoditas pisang segar (edible banana) yang mendominasi 95% perdagangan pisang di dunia dan produsen pisang Cavendish banyak berasal dari
1 I. PENDAHULUAN 1.1. Latar Belakang Pisang Cavendish merupakan komoditas pisang segar (edible banana) yang mendominasi 95% perdagangan pisang di dunia dan produsen pisang Cavendish banyak berasal dari
BAB III METODE PENELITIAN. Pangan dan Hortikultura Sidoarjo dan Laboratorium Mikrobiologi, Depertemen
 BAB III METODE PENELITIAN 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di UPT Pengembangan Agrobisnis Tanaman Pangan dan Hortikultura Sidoarjo dan Laboratorium Mikrobiologi, Depertemen Biologi,
BAB III METODE PENELITIAN 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di UPT Pengembangan Agrobisnis Tanaman Pangan dan Hortikultura Sidoarjo dan Laboratorium Mikrobiologi, Depertemen Biologi,
I. BAHAN DAN METODE. Penelitian ini dilaksanakan di Politeknik Negeri Lampung, Bandar Lampung.
 I. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Politeknik Negeri Lampung, Bandar Lampung. Waktu penelitian dilaksanakan sejak bulan Mei 2010 sampai dengan panen sekitar
I. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Politeknik Negeri Lampung, Bandar Lampung. Waktu penelitian dilaksanakan sejak bulan Mei 2010 sampai dengan panen sekitar
BAHAN DAN METODE Tempat dan Waktu Metode Penelitian Perbanyakan Propagul Agens Antagonis Perbanyakan Massal Bahan Pembawa Biopestisida
 7 BAHAN DAN METODE Tempat dan Waktu Penelitian ini dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dan Balai Penelitian Tanaman
7 BAHAN DAN METODE Tempat dan Waktu Penelitian ini dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dan Balai Penelitian Tanaman
PERAN AGENS ANTAGONIS DAN TEKNIK BUDIDAYA DALAM PENGENDALIAN TERPADU PENYAKIT LAYU FUSARIUM PADA PISANG LANDES BRONSON SIBARANI
 PERAN AGENS ANTAGONIS DAN TEKNIK BUDIDAYA DALAM PENGENDALIAN TERPADU PENYAKIT LAYU FUSARIUM PADA PISANG LANDES BRONSON SIBARANI PROGRAM STUDI HAMA DAN PENYAKIT TUMBUHAN FAKULTAS PERTANIAN INSTITUT PERTANIAN
PERAN AGENS ANTAGONIS DAN TEKNIK BUDIDAYA DALAM PENGENDALIAN TERPADU PENYAKIT LAYU FUSARIUM PADA PISANG LANDES BRONSON SIBARANI PROGRAM STUDI HAMA DAN PENYAKIT TUMBUHAN FAKULTAS PERTANIAN INSTITUT PERTANIAN
BAHAN DAN METODE Tempat dan Waktu . Bahan dan Alat Metode Penelitian Survei Buah Pepaya Sakit
 5 BAHAN DAN METODE Tempat dan Waktu Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman dan Kebun Percobaan Leuwikopo, Fakultas Pertanian, Institut Pertanian Bogor.
5 BAHAN DAN METODE Tempat dan Waktu Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman dan Kebun Percobaan Leuwikopo, Fakultas Pertanian, Institut Pertanian Bogor.
BAHAN DAN METODE. Pertanian Universitas Sumatera Utara, Medan dengan ketinggian tempat + 25
 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Penyakit Tumbuhan Fakultas Pertanian, Medan dengan ketinggian tempat + 25 meter di atas permukaan laut pada bulan
BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Penyakit Tumbuhan Fakultas Pertanian, Medan dengan ketinggian tempat + 25 meter di atas permukaan laut pada bulan
HASIL DAN PEMBAHASAN
 HASIL DAN PEMBAHASAN Pengaruh Aplikasi Agen Antagonis terhadap Viabilitas Benih Proses perkecambahan dipengaruhi oleh faktor internal dan eksternal. Faktor internal terdiri atas faktor genetik, tingkat
HASIL DAN PEMBAHASAN Pengaruh Aplikasi Agen Antagonis terhadap Viabilitas Benih Proses perkecambahan dipengaruhi oleh faktor internal dan eksternal. Faktor internal terdiri atas faktor genetik, tingkat
I. PENDAHULUAN. bertujuan untuk memenuhi kebutuhan pangan, tetapi juga untuk mendukung
 1 I. PENDAHULUAN 1.1 Latar Belakang Kedelai [Glycine max (L.) Merril] merupakan komoditas strategis di Indonesia. Oleh karena itu, upaya untuk berswasembada kedelai tidak hanya bertujuan untuk memenuhi
1 I. PENDAHULUAN 1.1 Latar Belakang Kedelai [Glycine max (L.) Merril] merupakan komoditas strategis di Indonesia. Oleh karena itu, upaya untuk berswasembada kedelai tidak hanya bertujuan untuk memenuhi
BUDIDAYA CABAI PUSAT PENELITIAN DAN PENGEMBANGAN HORTIKULTURA
 BUDIDAYA CABAI PUSAT PENELITIAN DAN PENGEMBANGAN HORTIKULTURA 1. PERENCANAAN TANAM 1. Pemilihan lokasi tanam 2. Sistem tanam 3. Pola tanam 4. Waktu tanam 5. Pemilihan varietas Perencanaan Persyaratan Tumbuh
BUDIDAYA CABAI PUSAT PENELITIAN DAN PENGEMBANGAN HORTIKULTURA 1. PERENCANAAN TANAM 1. Pemilihan lokasi tanam 2. Sistem tanam 3. Pola tanam 4. Waktu tanam 5. Pemilihan varietas Perencanaan Persyaratan Tumbuh
KEEFEKTIFAN BIOPESTISIDA ORGANIK CAIR UNTUK MENGENDALIKAN PENYAKIT BUSUK LUNAK YANG DISEBABKAN OLEH Erwinia carotovora PADA ANGGREK Phalaenopsis sp.
 KEEFEKTIFAN BIOPESTISIDA ORGANIK CAIR UNTUK MENGENDALIKAN PENYAKIT BUSUK LUNAK YANG DISEBABKAN OLEH Erwinia carotovora PADA ANGGREK Phalaenopsis sp. CHAIRUL HAKIM DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN
KEEFEKTIFAN BIOPESTISIDA ORGANIK CAIR UNTUK MENGENDALIKAN PENYAKIT BUSUK LUNAK YANG DISEBABKAN OLEH Erwinia carotovora PADA ANGGREK Phalaenopsis sp. CHAIRUL HAKIM DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Jenis penelitian ini adalah penelitian eksplorasi dan eksperimental dengan menguji isolat bakteri endofit dari akar tanaman kentang (Solanum tuberosum
BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Jenis penelitian ini adalah penelitian eksplorasi dan eksperimental dengan menguji isolat bakteri endofit dari akar tanaman kentang (Solanum tuberosum
KEEFEKTIFAN FORMULASI BIOPESTISIDA BERBAHAN AKTIF BAKTERI ENDOFIT DAN PLANT GROWTH PROMOTING RHIZOBACTERIA
 KEEFEKTIFAN FORMULASI BIOPESTISIDA BERBAHAN AKTIF BAKTERI ENDOFIT DAN PLANT GROWTH PROMOTING RHIZOBACTERIA SETELAH PENYIMPANAN UNTUK MENGENDALIKAN LAYU BAKTERI PADA TOMAT FATHIAH ISLAM ABADAN DEPARTEMEN
KEEFEKTIFAN FORMULASI BIOPESTISIDA BERBAHAN AKTIF BAKTERI ENDOFIT DAN PLANT GROWTH PROMOTING RHIZOBACTERIA SETELAH PENYIMPANAN UNTUK MENGENDALIKAN LAYU BAKTERI PADA TOMAT FATHIAH ISLAM ABADAN DEPARTEMEN
PERLAKUAN AGEN ANTAGONIS DAN GUANO UNTUK PENGENDALIAN PENYAKIT DAN HAMA PENGGEREK BUAH TANAMAN TOMAT (Lycopersicum esculentum Mill) DI LAPANGAN
 PERLAKUAN AGEN ANTAGONIS DAN GUANO UNTUK PENGENDALIAN PENYAKIT DAN HAMA PENGGEREK BUAH TANAMAN TOMAT (Lycopersicum esculentum Mill) DI LAPANGAN IZZATI SHABRINA DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN
PERLAKUAN AGEN ANTAGONIS DAN GUANO UNTUK PENGENDALIAN PENYAKIT DAN HAMA PENGGEREK BUAH TANAMAN TOMAT (Lycopersicum esculentum Mill) DI LAPANGAN IZZATI SHABRINA DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN
Pseudomonas fluorescence Bacillus cereus Klebsiella cloacae (Enterobacter cloacae) MATERI DAN METODE Lokasi dan Waktu Penelitian
 6 mudah pada medium nutrien sederhana (Pelczar dan Chan 1988). Escherichia coli bersifat motil atau non-motil dengan kisaran suhu pertumbuhannya adalah 10-40 o C, dengan suhu pertumbuhan optimum adalah
6 mudah pada medium nutrien sederhana (Pelczar dan Chan 1988). Escherichia coli bersifat motil atau non-motil dengan kisaran suhu pertumbuhannya adalah 10-40 o C, dengan suhu pertumbuhan optimum adalah
III. BAHAN DAN METODE. Penelitian ini dilaksanakan di Kebun Percobaan Tanaman Industri dan Penyegar
 25 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Kebun Percobaan Tanaman Industri dan Penyegar Cahaya Negeri, Abung Barat, Lampung Utara dan Laboratorium Penyakit
25 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Kebun Percobaan Tanaman Industri dan Penyegar Cahaya Negeri, Abung Barat, Lampung Utara dan Laboratorium Penyakit
BAHAN DAN METODE Tempat dan Waktu Penelitian Perbanyakan Inokulum BCMV Persiapan Lahan dan Tanaman Uji
 9 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilakukan di kebun percobaan Cikabayan dan Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian
9 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilakukan di kebun percobaan Cikabayan dan Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian
BAB 2 TINJAUAN PUSTAKA
 BAB 2 TINJAUAN PUSTAKA 2.1 Bakteri Endofit Bakteri endofit adalah mikroba yang hidup di dalam jaringan membentuk koloni dalam jaringan tanaman tanpa membahayakan inangnya. Setiap tanaman tingkat tinggi
BAB 2 TINJAUAN PUSTAKA 2.1 Bakteri Endofit Bakteri endofit adalah mikroba yang hidup di dalam jaringan membentuk koloni dalam jaringan tanaman tanpa membahayakan inangnya. Setiap tanaman tingkat tinggi
TERM OF REFFERENCE (TOR) PENINGKATAN SERAPAN HARA, PENGISIAN TONGKOL, DAN PENCEGAHAN SERANGAN PENYAKIT HAWAR DAUN PADA TANAMAN JAGUNG (Zea mays)
 TERM OF REFFERENCE (TOR) PENINGKATAN SERAPAN HARA, PENGISIAN TONGKOL, DAN PENCEGAHAN SERANGAN PENYAKIT HAWAR DAUN PADA TANAMAN JAGUNG (Zea mays) 2016 PENDAHULUAN Daerah rhizosper tanaman banyak dihuni
TERM OF REFFERENCE (TOR) PENINGKATAN SERAPAN HARA, PENGISIAN TONGKOL, DAN PENCEGAHAN SERANGAN PENYAKIT HAWAR DAUN PADA TANAMAN JAGUNG (Zea mays) 2016 PENDAHULUAN Daerah rhizosper tanaman banyak dihuni
PENDAHULUAN Latar Belakang
 PENDAHULUAN Latar Belakang Penyakit darah (blood disease) merupakan salah satu penyakit penting pada tanaman pisang di Indonesia (Supriadi 2005). Penyakit ini pertama kali dilaporkan pada tahun 1920-an
PENDAHULUAN Latar Belakang Penyakit darah (blood disease) merupakan salah satu penyakit penting pada tanaman pisang di Indonesia (Supriadi 2005). Penyakit ini pertama kali dilaporkan pada tahun 1920-an
Pertumbuhan tanaman dan produksi yang tinggi dapat dicapai dengan. Pemupukan dilakukan untuk menyuplai unsur hara yang dibutuhkan oleh
 45 4.2 Pembahasan Pertumbuhan tanaman dan produksi yang tinggi dapat dicapai dengan memperhatikan syarat tumbuh tanaman dan melakukan pemupukan dengan baik. Pemupukan dilakukan untuk menyuplai unsur hara
45 4.2 Pembahasan Pertumbuhan tanaman dan produksi yang tinggi dapat dicapai dengan memperhatikan syarat tumbuh tanaman dan melakukan pemupukan dengan baik. Pemupukan dilakukan untuk menyuplai unsur hara
BAHAN DAN METODE. Kasa Fakultas Pertanian Universitas Sumatera Utara, Medan dengan ketinggian tempat
 BAHAN DAN METODE Tempat dan waktu penelitian Penelitian ini dilaksanakan di Laboratorium Penyakit Tumbuhan dan di Rumah Kasa Fakultas Pertanian, Medan dengan ketinggian tempat + 25 m dpl pada Bulan Mei
BAHAN DAN METODE Tempat dan waktu penelitian Penelitian ini dilaksanakan di Laboratorium Penyakit Tumbuhan dan di Rumah Kasa Fakultas Pertanian, Medan dengan ketinggian tempat + 25 m dpl pada Bulan Mei
III BAHAN DAN METODE
 meliputi daerah Jawa, Kalimantan dan Sumatera. Tanaman Kilemo di daerah Jawa banyak ditemui pada daerah dengan ketinggian 230 700 meter di atas permukaan laut (mdpl). Tanaman ini terutama banyak ditemui
meliputi daerah Jawa, Kalimantan dan Sumatera. Tanaman Kilemo di daerah Jawa banyak ditemui pada daerah dengan ketinggian 230 700 meter di atas permukaan laut (mdpl). Tanaman ini terutama banyak ditemui
BAB 5. HASIL DAN PEMBAHASAN. Percobaan 1 : Isolasi dan identifikasi bakteri penambat nitrogen nonsimbiotik
 Tahap I BAB 5. HASIL DAN PEMBAHASAN Percobaan 1 : Isolasi dan identifikasi bakteri penambat nitrogen nonsimbiotik Hasil pengukuran sampel tanah yang digunakan pada percobaan 1 meliputi ph tanah, kadar
Tahap I BAB 5. HASIL DAN PEMBAHASAN Percobaan 1 : Isolasi dan identifikasi bakteri penambat nitrogen nonsimbiotik Hasil pengukuran sampel tanah yang digunakan pada percobaan 1 meliputi ph tanah, kadar
TINJAUAN PUSTAKA. Gambar 1 : Pengamatan mikroskopis S. rolfsii Sumber :
 4 TINJAUAN PUSTAKA Biologi Penyebab Penyakit Jamur penyebab penyakit rebah semai ini dapat diklasifikasikan sebagai berikut : Kingdom Divisi Kelas Ordo Famili Genus Spesies : Fungi : Basidiomycota : Basidiomycetes
4 TINJAUAN PUSTAKA Biologi Penyebab Penyakit Jamur penyebab penyakit rebah semai ini dapat diklasifikasikan sebagai berikut : Kingdom Divisi Kelas Ordo Famili Genus Spesies : Fungi : Basidiomycota : Basidiomycetes
Keefektifan Bakteri Endofit dan Bakteri Perakaran Pemacu Pertumbuhan Tanaman dalam Menekan Penyakit Layu Bakteri pada Tomat
 ISSN: 2339-2479 Volume 10, Nomor 2, April 2014 Halaman 61 67 DOI: 10.14692/jfi.10.2.61 Keefektifan Bakteri Endofit dan Bakteri Perakaran Pemacu Pertumbuhan Tanaman dalam Menekan Penyakit Layu Bakteri pada
ISSN: 2339-2479 Volume 10, Nomor 2, April 2014 Halaman 61 67 DOI: 10.14692/jfi.10.2.61 Keefektifan Bakteri Endofit dan Bakteri Perakaran Pemacu Pertumbuhan Tanaman dalam Menekan Penyakit Layu Bakteri pada
BAB III METODE PENELITIAN. Jenis percobaan pada penelitian ini adalah penelitian eksperimental,
 35 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Jenis percobaan pada penelitian ini adalah penelitian eksperimental, dengan menggunakan Rancangan Acak Kelompok (RAL), yang dilakukan dengan 9 perlakuan
35 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Jenis percobaan pada penelitian ini adalah penelitian eksperimental, dengan menggunakan Rancangan Acak Kelompok (RAL), yang dilakukan dengan 9 perlakuan
III. BAHAN DAN METODE. Tanaman, serta Laboratorium Lapang Terpadu, Fakultas Pertanian, Universitas
 13 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Hama dan Penyakit Bidang Proteksi Tanaman, serta Laboratorium Lapang Terpadu, Fakultas Pertanian, Universitas
13 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Hama dan Penyakit Bidang Proteksi Tanaman, serta Laboratorium Lapang Terpadu, Fakultas Pertanian, Universitas
II. TINJAUAN PUSTAKA. udara yang baik untuk pertumbuhan tanaman cabai adalah 25-27º C pada siang
 10 II. TINJAUAN PUSTAKA 2.1 Deskripsi Umum Tanaman Cabai Tanaman cabai mempunyai daya adaptasi yang cukup luas. Tanaman ini dapat diusahakan di dataran rendah maupun dataran tinggi sampai ketinggian 1400
10 II. TINJAUAN PUSTAKA 2.1 Deskripsi Umum Tanaman Cabai Tanaman cabai mempunyai daya adaptasi yang cukup luas. Tanaman ini dapat diusahakan di dataran rendah maupun dataran tinggi sampai ketinggian 1400
BAB I PENDAHULUAN A. Latar Belakang
 BAB I PENDAHULUAN A. Latar Belakang Antraknosa merupakan salah satu penyakit tanaman yang dapat menurunkan produksi tanaman bahkan dapat mengakibatkan gagal panen. Penyakit ini menyerang hampir semua tanaman.
BAB I PENDAHULUAN A. Latar Belakang Antraknosa merupakan salah satu penyakit tanaman yang dapat menurunkan produksi tanaman bahkan dapat mengakibatkan gagal panen. Penyakit ini menyerang hampir semua tanaman.
BAB III METODE PENELITIAN. eksplorasi dengan cara menggunakan isolasi jamur endofit dari akar kentang
 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Jenis penelitian ini adalah penelitian eksplorasi dan eksperimen. Penelitian eksplorasi dengan cara menggunakan isolasi jamur endofit dari akar kentang
BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Jenis penelitian ini adalah penelitian eksplorasi dan eksperimen. Penelitian eksplorasi dengan cara menggunakan isolasi jamur endofit dari akar kentang
BAHAN DAN METODE Tempat dan Waktu Penelitian Wawancara Pengamatan dan Pengambilan Contoh
 21 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilakukan di enam perkebunan buah naga di Provinsi Daerah Istimewa Yogyakarta yang terdiri dari tiga kabupaten. Kebun pengamatan di Kabupaten
21 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilakukan di enam perkebunan buah naga di Provinsi Daerah Istimewa Yogyakarta yang terdiri dari tiga kabupaten. Kebun pengamatan di Kabupaten
BAHAN DAN METODE. Tempat dan Waktu Penelitian. Bahan dan Alat
 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilaksanakan di kebun percobaan Cikabayan-University Farm IPB, Darmaga Bogor. Areal penelitian bertopografi datar dengan elevasi 250 m dpl dan curah
BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilaksanakan di kebun percobaan Cikabayan-University Farm IPB, Darmaga Bogor. Areal penelitian bertopografi datar dengan elevasi 250 m dpl dan curah
DAFTAR ISI. I. PENDAHULUAN... 1 A. Latar Belakang... 1 B. Tujuan Penelitian... 2 C. Manfaat Penelitian... 2
 DAFTAR ISI Halaman HALAMAN JUDUL... i HALAMAN PENGESAHAN... iii KATA PENGANTAR... iv DAFTAR ISI... v DAFTAR TABEL... vii DAFTAR GAMBAR... viii DAFTAR LAMPIRAN... x INTISARI... xi ABSTRACT... xii I. PENDAHULUAN...
DAFTAR ISI Halaman HALAMAN JUDUL... i HALAMAN PENGESAHAN... iii KATA PENGANTAR... iv DAFTAR ISI... v DAFTAR TABEL... vii DAFTAR GAMBAR... viii DAFTAR LAMPIRAN... x INTISARI... xi ABSTRACT... xii I. PENDAHULUAN...
POTENSI LIMA EKSTRAK TUMBUHAN DALAM MENEKAN INFEKSI VIRUS MOSAIK PADA TANAMAN KACANG PANJANG (Vigna unguiculata subsp.
 POTENSI LIMA EKSTRAK TUMBUHAN DALAM MENEKAN INFEKSI VIRUS MOSAIK PADA TANAMAN KACANG PANJANG (Vigna unguiculata subsp. sesquipedalis) LULU KURNIANINGSIH DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN INSTITUT
POTENSI LIMA EKSTRAK TUMBUHAN DALAM MENEKAN INFEKSI VIRUS MOSAIK PADA TANAMAN KACANG PANJANG (Vigna unguiculata subsp. sesquipedalis) LULU KURNIANINGSIH DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN INSTITUT
III. BAHAN DAN METODE
 10 III. BAHAN DAN METODE 3.1 Waktu dan Tempat Penelitian dilaksanakan dari bulan Oktober 2011 sampai Oktober 2012. Sampel gubal dan daun gaharu diambil di Desa Pulo Aro, Kecamatan Tabir Ulu, Kabupaten
10 III. BAHAN DAN METODE 3.1 Waktu dan Tempat Penelitian dilaksanakan dari bulan Oktober 2011 sampai Oktober 2012. Sampel gubal dan daun gaharu diambil di Desa Pulo Aro, Kecamatan Tabir Ulu, Kabupaten
III. BAHAN DAN METODE. Penelitian dilaksanakan di Laboratorium Penyakit Tumbuhan Jurusan Proteksi
 20 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian dilaksanakan di Laboratorium Penyakit Tumbuhan Jurusan Proteksi Tanaman Fakultas Pertanian Universitas Lampung dari bulan Januari sampai dengan
20 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian dilaksanakan di Laboratorium Penyakit Tumbuhan Jurusan Proteksi Tanaman Fakultas Pertanian Universitas Lampung dari bulan Januari sampai dengan
EKSPLORASI BAKTERI DAN CENDAWAN RIZOSFER YANG BERASOSIASI DENGAN PENYAKIT BUSUK BASAH PADA BATANG PEPAYA
 EKSPLORASI BAKTERI DAN CENDAWAN RIZOSFER YANG BERASOSIASI DENGAN PENYAKIT BUSUK BASAH PADA BATANG PEPAYA (Carica papaya L.) DI PASIR KUDA, DESA CIOMAS, BOGOR ANGGIE FERFINIA DEPARTEMEN PROTEKSI TANAMAN
EKSPLORASI BAKTERI DAN CENDAWAN RIZOSFER YANG BERASOSIASI DENGAN PENYAKIT BUSUK BASAH PADA BATANG PEPAYA (Carica papaya L.) DI PASIR KUDA, DESA CIOMAS, BOGOR ANGGIE FERFINIA DEPARTEMEN PROTEKSI TANAMAN
IV. HASIL DAN PEMBAHASAN
 23 IV. HASIL DAN PEMBAHASAN 4.1. Di Laboratorium 4.1.1. Karakterisasi Sifat Morfologi Bakteri Pseudomonas Berfluorescens Asal Perakaran Kelapa Sawit Pada Lahan Gambut di Medium NA Hasil pengamatan karakterisasi
23 IV. HASIL DAN PEMBAHASAN 4.1. Di Laboratorium 4.1.1. Karakterisasi Sifat Morfologi Bakteri Pseudomonas Berfluorescens Asal Perakaran Kelapa Sawit Pada Lahan Gambut di Medium NA Hasil pengamatan karakterisasi
III. METODE PENELITIAN. Persiapan alat dan bahan yang akan digunakan. Pembuatan media PDA (Potato Dextrose Agar)
 III. METODE PENELITIAN A. Bagan Alir Penelitian Persiapan alat dan bahan yang akan digunakan Pembuatan media PDA (Potato Dextrose Agar) Pengambilan sampel tanah dekat perakaran tanaman Cabai merah (C.
III. METODE PENELITIAN A. Bagan Alir Penelitian Persiapan alat dan bahan yang akan digunakan Pembuatan media PDA (Potato Dextrose Agar) Pengambilan sampel tanah dekat perakaran tanaman Cabai merah (C.
METODE PENELITIAN. Penelitian dilaksanakan pada bulan Agustus sampai Februari 2014.
 10 METODE PENELITIAN Waktu dan Tempat Penelitian dilaksanakan pada bulan Agustus sampai Februari 2014. Pengambilan sampel tanah dilakukan di Hutan mangrove Percut Sei Tuan Kabupaten Deli Serdang. Analisis
10 METODE PENELITIAN Waktu dan Tempat Penelitian dilaksanakan pada bulan Agustus sampai Februari 2014. Pengambilan sampel tanah dilakukan di Hutan mangrove Percut Sei Tuan Kabupaten Deli Serdang. Analisis
III. BAHAN DAN METODE
 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian dilaksanakan di Laboratorium Lapang Terpadu dan di Laboratorium Penyakit Tumbuhan, Fakultas Pertanian, Universtitas Lampung dari Desember
III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian dilaksanakan di Laboratorium Lapang Terpadu dan di Laboratorium Penyakit Tumbuhan, Fakultas Pertanian, Universtitas Lampung dari Desember
BAB III KERANGKA BERPIKIR, KONSEP, DAN HIPOTESIS PENELITIAN. mengalami peningkatan. Salah satu faktor yang menyebabkan penurunan produksi
 BAB III KERANGKA BERPIKIR, KONSEP, DAN HIPOTESIS PENELITIAN 3.1 Kerangka Berpikir Produksi kedelai di Indonesia dari tahun 2009 sampai 2013 secara terus menerus mengalami penurunan, walaupun permintaan
BAB III KERANGKA BERPIKIR, KONSEP, DAN HIPOTESIS PENELITIAN 3.1 Kerangka Berpikir Produksi kedelai di Indonesia dari tahun 2009 sampai 2013 secara terus menerus mengalami penurunan, walaupun permintaan
HASIL DAN PEMBAHASAN
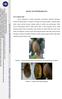 10 HASIL DAN PEMBAHASAN Survei Buah Sakit Survei dilakukan di kebun percobaan Leuwikopo, Fakultas Pertanian, Institut Pertanian Bogor, di lahan ini terdapat 69 tanaman pepaya. Kondisi lahan tidak terawat
10 HASIL DAN PEMBAHASAN Survei Buah Sakit Survei dilakukan di kebun percobaan Leuwikopo, Fakultas Pertanian, Institut Pertanian Bogor, di lahan ini terdapat 69 tanaman pepaya. Kondisi lahan tidak terawat
III. BAHAN DAN METODE. Penelitian dilaksanakan di Laboratorium Ilmu Penyakit Tumbuhan, Bidang
 8 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian dilaksanakan di Laboratorium Ilmu Penyakit Tumbuhan, Bidang Proteksi Tanaman, Jurusan Agroteknologi, Fakultas Pertanian Universitas Lampung
8 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian dilaksanakan di Laboratorium Ilmu Penyakit Tumbuhan, Bidang Proteksi Tanaman, Jurusan Agroteknologi, Fakultas Pertanian Universitas Lampung
BAHAN DAN METODE Tempat dan Waktu Bahan dan Alat Metode Penelitian
 15 BAHAN DAN METODE Tempat dan Waktu Percobaan dilaksanakan di Kebun Percobaan Margahayu Lembang Balai Penelitian Tanaman Sayuran 1250 m dpl mulai Juni 2011 sampai dengan Agustus 2012. Lembang terletak
15 BAHAN DAN METODE Tempat dan Waktu Percobaan dilaksanakan di Kebun Percobaan Margahayu Lembang Balai Penelitian Tanaman Sayuran 1250 m dpl mulai Juni 2011 sampai dengan Agustus 2012. Lembang terletak
