KEGIATAN PEMBELAJARAN 1 SIFAT KOLIGATIF LARUTAN
|
|
|
- Yenny Budiono
- 7 tahun lalu
- Tontonan:
Transkripsi
1 KEGIATAN PEMBELAJARAN 1 SIFAT KOLIGATIF LARUTAN Uraian Materi Laut mati yang memiliki kadar garam tinggi, menyebabkan seseorang tidak akan tenggelam. Hal ini dikarenakan terjadinya penurunan tekanan uap dari pelarut, zat terlarutnya tidak mudah menguap. Sumber: Gambar 1.1. Laut mati dengan kadar garam tinggi Beberapa sifat penting larutan bergantung pada banyaknya partikel zat terlarut dalam larutan dan tidak tergantung pada jenis partikel zat terlarut. Sifat ini disebut sifat koligatif, yaitu penurunan tekanan uap, peningkatan titik didih, penurunan titik beku dan tekanan osmotik. Sifat koligatif larutan dapat di bedakan menjadi dua macam yaitu sifat larutan elektrolit dan non elektrolit. Hal itu disebabkan zat terlarut dalam larutan elektrolit bertambah jumlahnya karena terurai menjadi ion-ion, sedangkan zat terlarut pada larutan non elektrolit jumlahnya tetap karena tidak terurai menjadi ion-ion, sesuai dengan hal tersebut maka sifat koligatif larutan nonelektrolit lebih rendah daripada sifat koligatif larutan elektolit. Pada pembahasan materi ini, sifat koligatif yang terjadi pada larutan encer, yang berarti larutan yang konsentrasinya < 2M. 1
2 PPPPTK IPA Direktorat Jenderal Guru dan Tenaga Kependidikan - KEMDIKBUD SIFAT KOLIGATIF LARUTAN NON ELEKTROLIT 1. Penurunan Tekanan Uap Jenuh Pada peristiwa penguapan terjadi perubahan dari zat cair menjadi gas. Jika zat cair dimasukkan ke dalam suatu ruangan tertutup maka zat tersebut akan menguap hingga ruangan tersebut jenuh. Pada keadaan ini proses penguapan tetap berlangsung dan pada saat yang sama juga terjadi proses pengembunan. Laju penguapan sama dengan laju pengembunan. Keadaan ini dikatakan terjadi kesetimbangan dinamis antara zat cair dan uap jenuhnya. Artinya bahwa tidak akan terjadi perubahan lebih lanjut tetapi reaksi atau proses yang terjadi masih terus berlangsung. Tekanan yang disebabkan oleh uap jenuh dinamakan tekanan uap jenuh. Besarnya tekanan uap jenuh dipengaruhi oleh jumlah zat dan suhu. Makin besar tekanan uap suatu cairan, makin mudah molekul-molekul cairan itu berubah menjadi uap. Untuk mengetahui penurunan tekanan uap maka pada tahun 1880-an kimiawan Perancis F.M. Raoult mendapati bahwa melarutkan suatu zat terlarut mempunyai efek penurunan tekanan uap dari pelarut. Apabila pada pelarut murni kita tambahkan sejumlah zat terlarut yang tidak mudah menguap, apa yang akan terjadi? Coba perhatikan gambar berikut ini. uap P<P o cair (a) (b) Gambar 1.2 (a) Peristiwa penguapan zat cair dalam ruang tertutup sampai mencapai kesetimbangan antara laju penguapan dan laju pengembunan 2 KEGIATAN PEMBELAJARAN 1: SIFAT KOLIGATIF LARUTAN
3 Modul Guru Pembelajar Mata Pelajaran Kimia SMA (b) Tekanan uap jenuh pelarut lebih besar daripada tekanan uap jenuh larutan (Po>P) (Sumber: General Chemistry, Principles and Structure, James E Brady, 1990) Gambar 1.2 menjelaskan bahwa partikel-partikel pada larutan lebih tidak teratur dibandingkan partikel-partikel pada pelarut murni. Hal ini menyebabkan tekanan uap larutan lebih kecil daripada pelarut murni. Inilah yang dinamakan penurunan tekanan uap jenuh. Selisih antara tekanan uap murni dengan tekanan uap larutan jenuh dapat dituliskan secara matematis seperti berikut P = P 0 - P Keterangan: P = penurunan tekanan uap P 0 = tekanan uap pelarut murni P = tekanan uap jenuh larutan Jika zat terlarut bersifat tidak menguap (non volatile), artinya tidak memiliki tekanan uap yang dapat diukur sehingga tekanan uap dari larutan selalu lebih kecil daripada pelarut murninya. Jadi, hubungan antara tekanan uap larutan dan tekanan uap pelarut bergantung konsentrasi zat terlarut dalam larutan. Hubungan itu dirumuskan dalam Hukum Raoult (berasal dari nama kimiawan Perancis Francois Raoult) menyatakan bahwa tekanan uap larutan (P 1 ) sama dengan tekanan uap pelarut murni (P o 1 ), dikalikan fraksi mol pelarut dalam larutan X 1 0 P 1 = X 1 P 1 Dalam larutan yang mengandung hanya satu zat terlarut, X 1 =1-X 2 dimana X 2 adalah fraksi mol zat terlarut 0 P 1 = (1-X 2 ) P 1 sehingga P P1 = P= X 2.P 1 3
4 PPPPTK IPA Direktorat Jenderal Guru dan Tenaga Kependidikan - KEMDIKBUD Jadi penurunan tekanan uap, P, berbanding lurus terhadap konsentrasi zat terlarut yang diukur dalam fraksi mol. Tekanan uap larutan lebih rendah daripada tekanan uap pelarut murninya, karena meningkatnya ketidakteraturan, akibat proses fisis dan proses kimia, semakin tidak teratur maka semakin besar kecenderungan berlangsungnya suatu proses. Penguapan meningkatkan ketidakteraturan suatu sistem sebab molekul dalam fasa uap kurang teratur dibandingkan molekul dalam fasa cairan.larutan lebih tidak teratur dibandingkan pelarut murni, maka selisih ketidakteraturan antara larutan dan uap lebih kecil dibandingkan antara pelarut murni dan uap. Dengan demikian, molekul pelarut lebih kecil kecenderungannya untuk meninggalkan larutan dibandingkan meninggalkan pelarut murni untuk menjadi uap, dan tekanan uap larutan lebih kecil dibandingkan tekanan uap pelarut. Contoh Soal 1 Pada 25 o C tekanan uap air murni adalah 23,76 mmhg dan tekanan uap larutan urea adalah 22,98 mmhg. Perkirakan molalitas larutan tersebut! Penjelasan dan penyelesaian : 1. Penentuan fraksi mol urea P = P o - P = 23,76-22,98 mmhg = 0,78 mmhg Dengan menggunakan rumus P= X 2.P 1 0 didapat X 2 = 0,033 X 2 = 0,033 Rumus: X 2 = Keterangan: n 1 dan n 2 masing-masing adalah jumlah mol pelarut dan zat terlarut. Oleh karena fraksi mol urea dalam larutan ini hanya 0,033, larutan ini termasuk encer sehingga dapat diasumsikan bahwa n 1 jauh lebih besar daripada n 2. Jadi dapat dituliskan: X 2 = (n 1 > n 2 ) 4 KEGIATAN PEMBELAJARAN 1: SIFAT KOLIGATIF LARUTAN
5 Modul Guru Pembelajar Mata Pelajaran Kimia SMA n 2 = n 1. X 2 Jumlah mol air dalam 1 kg air adalah: 1000 g H 2 O x dan jumlah mol urea yang ada dalam 1 kg air adalah : n 2 = n 1. X 2 = (55,49 mol) (0,033) = 1,8 mol Jadi konsentrasi larutan urea adalah 1,8 molal Jika kedua komponen cairan yang mudah menguap (volatil) artinya memiliki tekanan uap yang dapat diukur, maka tekanan uap total dalam campuran adalah adalah jumlah dari tekanan parsial masing-masing komponen. Hukum Raoult juga berlaku untuk cair-cair: 0 P A = X A P A 0 P B = X B P B P A dan P B adalah tekanan uap parsial untuk komponen A dan B P A 0 dan P B 0 adalah tekanan uap zat murni X A dan X B adalah fraksi mol masing masing zat. Bunyi Hukum Raoult: Tekanan uap jenuh larutan sama dengan fraksi mol pelarut dikalikan dengan tekanan uap jenuh pelarut murni. Ketika komponen dalam campuran telah mencapai kesetimbangan, total tekanan uap pada campuran dapat ditentukan dengan menggabungkan hukum Roult dengan hukum Dalton. Tekanan total diberikan oleh hukum Dalton untuk tekanan parsial P T = P A + P B Atau: P T = X A P o A + X B P o B 5
6 PPPPTK IPA Direktorat Jenderal Guru dan Tenaga Kependidikan - KEMDIKBUD 2. Kenaikan Titik Didih Pada proses pendidihan terjadi karena panas meningkatkan gerakan atau energi kinetik, dari molekul yang menyebabkan cairan berada pada titik di mana cairan itu menguap. Titik didih cairan berhubungan dengan tekanan uap. Jika sebuah larutan mempunyai tekanan uap yang tinggi pada suhu tertentu, maka molekulmolekul yang berada dalam larutan tersebut mudah untuk melepaskan diri dari permukaan larutan menuju fasa uap jika mempunyai tekanan uap yang rendah, maka molekul-molekul dalam larutan tersebut tidak dapat dengan mudah melepaskan diri dari larutan menuju fasa uap. Jadi larutan dengan tekanan uap yang lebih tinggi pada suhu tertentu akan memiliki titik didih yang lebih rendah. Cairan akan mendidih ketika tekanan uapnya menjadi sama dengan tekanan udara luar. Titik didih cairan pada tekanan udara 760 mmhg disebut titik didih standar atau titik didih normal. Jadi yang dimaksud dengan titik didih adalah suhu pada saat tekanan uap jenuh cairan itu sama dengan tekanan udara luar (tekanan pada permukaan cairan). Telah dijelaskan di depan bahwa tekanan uap larutan lebih rendah dari tekanan uap pelarutnya. Hal ini disebabkan karena zat terlarut itu mengurangi bagian atau fraksi dari pelarut sehingga laju penguapan berkurang. Hubungan antara tekanan uap jenuh dan suhu air dalam larutan berair ditunjukkan pada Gambar 1.3 berikut. Sumber: Kimia Dasar, Konsep konsep Inti, Raymond Chang, KEGIATAN PEMBELAJARAN 1: SIFAT KOLIGATIF LARUTAN
7 Modul Guru Pembelajar Mata Pelajaran Kimia SMA Gambar 1.3: Diagram fasa yang mengilustrasikan kenaikan titik didih dan penurunan titik beku larutan berair Pada diagram 1.3 terlihat kurva putus-putus untuk larutan dan kurva biasa untuk pelarut murni. Coba Anda amati dan pelajari, diagram juga memperlihatkan titik didih larutan lebih tinggi dibandingkan titik didih air dan titik beku larutan lebih rendah dibandingkan titik beku air. Titik bertemunya ketiga garis kurva biasa disebut dengan titik Triple yang menyatakan keseimbangan ketiga fasa, yaitu padat, cair dan gas. Selain itu, dapat terlihat bahwa pada suhu berapapun tekanan uap larutan lebih rendah daripada tekanan uap pelarut murninya. Sehingga mengakibatkan kurva larutan (putus-putus) memotong garis horisontal yang bertanda P=1 atm pada suhu yang lebih tinggi daripada titik didih normal pelarut murni. Analisis dari gambar menunjukkan bahwa titik didih larutan lebih tinggi daripada titik didih pelarut murninya sehingga kenaikan titik didih Tb di definiskan sebagai berikut. Tb = Tb -Tb o Dimana Tb adalah titik didih larutan dan Tb o adalah titik didih pelarut murni. Kenaikan titik didih ( Tb) berbanding urus dengan penurunan tekanan uap maka akan berbanding lurus juga dengan konsentrasi (molalitas) larutan, sehingga dapat dirumuskan: Tb = Kb.m Tb = Kb. w M. massapelarut Dengan Tb = kenaikan titik didih larutan ( o C) W = massa zat terlarut (gram) massa pelarut (gram) M = massa molar (g/mol) Kb = kenaikan titik didih molal ( o C/m) yang bergantung pada pelarut 7
8 PPPPTK IPA Direktorat Jenderal Guru dan Tenaga Kependidikan - KEMDIKBUD Kb adalah konstanta kenaikan titik didih molal dan m adalah molalitas larutan. Satuan Kb adalah o C/m. Perlu diketahui bahwa sistem larutan suhunya tidak dijaga tetap sehingga kita tidak dapat menyatakan satuan konsentrasi bukan dalam molaritas, karena molaritas berubah jika suhu berubah atau terkait dengan volume jadi jika dipanaskan/didinginkan volume akan berubah. Untuk menghindarinya digunakan satuan molal. Tabel 1.1 Konstanta kenaikan titik didih molal untuk beberapa cairan yang umum Contoh Soal 2 Suatu larutan non elektrolit mengandung 4 gram zat terlarut dalam 1000 gram air. Larutan tersebut mendidih pada suhu 100, 0347 o C. Berapa massa molekul zat tersebut, jika Kb = 0,52 o C.m -1? Penyelesaian: Tb = Kb. w M. massapelarut Sehingga: Massa molar (Mr) =.. =.. 8 KEGIATAN PEMBELAJARAN 1: SIFAT KOLIGATIF LARUTAN
9 Modul Guru Pembelajar Mata Pelajaran Kimia SMA Jadi massa molar adalah 60 = 60 g/mol 3. Penurunan Titik Beku Pada kehidupan sehari hari, Anda bisa menemukan penerapan penurunan titik beku, seperti : a. Cairan pendingin adalah larutan berair yang memiliki titik beku jauh di bawah 0 o C. Cairan pendingin digunakan pada pabrik es, juga digunakan untuk membuat es putar. Cairan pendingin dibuat dengan melarutkan berbagai jenis garam ke dalam air. Pada pembuatan es putar cairan pendingin dibuat dengan mencampurkan garam dapur dengan kepingan es batu dalam sebuah bejana berlapis kayu. Pada pencampuran itu, es batu akan mencair sedangkan suhu campuran turun. Campuran bahan pembuat es putar dimasukan dalam bejana lain yang terbuat dari bahan stainless steel. Bejana ini kemudian ke dalam cairan pendingin, sambil terus menerus diaduk sehingga campuran membeku. b. Antibeku pada radiator mobil Pada daerah beriklim dingin, biasanya air radiator mudah membeku sehingga radiator kendaraan cepat rusak. Oleh karena itu, air radiator tersebut perlu ditambahkan etilen glikol agar titik beku air radiator menurun sehingga tidak mudah membeku Gambar 1.4 penambahan etilen glikol pada air radiator agar terjadi penurunan titik beku c. Antibeku dalam tubuh hewan 9
10 PPPPTK IPA Direktorat Jenderal Guru dan Tenaga Kependidikan - KEMDIKBUD Prinsip sifat koligatif larutan penurunan titik beku terdapat pula pada hewan hewan yang tinggal di daerah beriklim dingin, karena di dalam tubuhnya mengandung zat zat antibeku yang mampu menurunkan titik beku air 0,8 o C sehingga ikan laut dapat bertahan di musim dingin. Zat antibeku dalam tubuh hewan daerah beriklim dingin dapat mencegah pembentukan kristal es dalam jaringan dan selnya. d. Antibeku untuk mencairkan salju Daerah beriklim dingin memanfaatkan sifat koligatif penurunan titik beku larutan untuk mencairkan salju. Jalanan bersalju ditaburi garam NaCl dan CaCl 2, agar mencairkan salju. Semakin banyak garam yang ditaburkan maka akan semakin banyak salju yang mencair karena terjadi penurunan titik beku air. Setelah Anda mengetahui penerapan sifat koligatif larutan penurunan titik beku sebagaimana yang telah dijelaskan, maka Anda perlu lebih memperdalam mengenai penurunan titik beku larutan tersebut. Mengapa bisa terjadi penurunan titik beku? Faktor apa sajakah yang dapat mempengaruhi terjadinya penurunan titik beku? Pada diagram fasa, gambar 1.3 menunjukan bahwa penurunan tekanan uap larutan bergeser kurva padatan cairan ke arah kiri. Akibatnya, garis ini memotong garis horisontal pada suhu yang lebih rendah daripada titik beku air. Penurunan titik beku air didefinisikan sebagai berikut. Tf = Tf o - Tf Dimana Tf adalah titik didih larutan dan Tf o adalah titik didih pelarut murni. Penurunan titik beku ( Tf) berbanding lurus dengan penurunan tekanan uap maka akan berbanding lurus juga dengan konsentrasi (molalitas) larutan, sehingga dapat dirumuskan: Tf= Kf.m Tf = Kf. w M. massapelarut 10 KEGIATAN PEMBELAJARAN 1: SIFAT KOLIGATIF LARUTAN
11 Modul Guru Pembelajar Mata Pelajaran Kimia SMA Dengan Tf = penurunan titik beku larutan ( o C) w = massa zat terlarut (gram) massa pelarut (gram) M = massa molar (g/mol) Kf = kenaikan titik didih molal ( o C/m) Dimana dalam persamaan tersebut terdapat m adalah konsentrasi dari zat terlarut dalam satuan molalitas dan Kf adalah konstanta penrunan titik beku molal ( o C/molal). 11
12 PPPPTK IPA Direktorat Jenderal Guru dan Tenaga Kependidikan - KEMDIKBUD Berikut ini adalah data konstanta penurunan titik beku molal. Tabel 1.2 Data konstanta penurunan titik beku molal dari beberapa cairan yang umum Mengapa dapat terjadi penurunan titik beku larutan? Pembekuan melibatkan transisi dari keadaan tidak teratur menjadi teratur sehingga energi harus diambil dari sistem. Larutan lebih tidak teratur dibandingkan pelarut, maka lebih banyak energi yang harus diambil darinya untuk menciptakan keteraturan dibandingkan dalam kasus pelarut murni. Jadi, larutan memiliki titik beku lebih rendah dibandingkan pelarut. Contoh Soal 3 Berapa gram urea yang terlarut di dalam 500 gram air jika larutan tersebut titik bekunya -1,4 o C?(Kf air = 1,86 o Cm -1 dan Mr Urea =60) Penentuan Mr zat terlarut dapat dihitung dengan rumus: Penyelesaian: Tb = Kb. w M. massa pelarut Sehingga: Tf = Kf. w M. massapelarut 12 KEGIATAN PEMBELAJARAN 1: SIFAT KOLIGATIF LARUTAN
13 Modul Guru Pembelajar Mata Pelajaran Kimia SMA 1,4 o C = 1,4 o C = 1,86 o C/molal. W = x 6 x x 6 w (g). 6 g/mol kg-1 = 22,58 gram Jadi massa urea adalah 22, 58 gram 4. Tekanan Osmotik Pada penerapan sifat koligatif larutan, tekanan osmotik dapat dijumpai pada proses kimia dan biologi bergantung pada aliran molekul pelarut secara selektif melewati membran berpori dari larutan encer ke larutan yang lebih pekat. Hal ini diperlihatkan pada gambar 1.5 berikut. Gambar 1.5 Proses osmotik: pergerakan molekul dari larutan encer ke larutan pekat melalui membran semipermiabel Gerakan molekul pelarut murni/larutan yang lebih encer melewati membran semipermiabel dari pelarut murni atau pelarut encer ke larutan yang lebih pekat disebut osmosis, sedangkan Tekanan osmotik ( ) suatu larutan adalah tekanan yang diperlukan untuk menghentikan osmosis. Akibat laju ke kanan lebih besar dari laju ke kiri maka timbul peristiwa osmosis. Agar laju ke kanan sama dengan laju ke kiri maka harus diberi tekanan sedemikian 13
14 PPPPTK IPA Direktorat Jenderal Guru dan Tenaga Kependidikan - KEMDIKBUD rupa sedemikian rupa sehingga seimbang dan tekanan disebut tekanan osmosis. Bagaimana bisa terjadi tekanan osmotik? Hal ini diilustrasikan menggunakan gambar 1.6. Pada gambar 1.6 (a) kondisi awal kedua permukaan yang sama tinggi antara pelarut/larutan encer dengan lartan yang lebih pekat; sedangkan (b) tekanan osmotik sama dengan tekanan hidrostatik yang diberikan oleh kolom cairan sebelah kanan a keadaan kesetimbangan. Pada dasarnya pengaruh yang sama terjadi jika pelarut murni digantikan dengan larutan yang lebih encer daripada larutan yang ada di sebelah kanan. Pada wadah tersebut, kedua larutan dipisahkan dengan membran semipermiabel yang memungkinkan molekul pelarut melewatinya tetapi menghalangi lewatnya zat terlarut. Pada awalnya, permukaan air memiliki tinggi permukaan yang sama. Setelah beberapa saat, permukaan di bagian kanan mulai naik hingga mencapai kondisi kesetimbangan. Gerakan molekul pelarut murni melewati membran semipermiabel dari pelarut murni atau pelarut encer ke larutan yang lebih pekat disebut osmosis. Tekanan osmotik ( ) suatu larutan adalah tekanan yang diperlukan untuk menghentikan osmosis. Tekanan ini dapat diukur langsung dari selisih permukaan-permukaan cairan pada keadaan akhir Sumber: general chemistry book, colligative properties of solution, Gambar 1.6 Tekanan osmotik (a) permukaan pelarut murni (kiri) dan permukaan larutan (kanan) pada awalnya sama tinggi, (b) proses selama osmosis permukaan pada sisi larutan naik sebagai akibat aliran pelarut murni dari kiri ke kanan. 14 KEGIATAN PEMBELAJARAN 1: SIFAT KOLIGATIF LARUTAN
15 Modul Guru Pembelajar Mata Pelajaran Kimia SMA Berdasarkan penjelasan tersebut, sebagai berikut. tekanan osmotik dapat dirumuskan = MRT V = nrt Keterangan: M = molaritas larutan R = konstanta gas (0,0821 L.atm/K.mol) T = suhu mutlak ; = tekanan (atm) n = jumlah mol zat terlarut V = volume larutan (L) Konsentrasi dinyatakan dengan molaritas, karena pengukuran tekanan osmotik dilakukan pada suhu tetap. Tekanan osmotik pun berbanding lurus dengan konsentrasi larutan.jika kedua larutan mempunyai konsentrasi yang sama maka tekanan osmotik pun akan sama akan disebut keadaan isotonik. Jika kedua larutan memiliki tekanan osmotik yang tidak sama, larutan yang lebih pekat disebut hipertonik dan larutan yang lebih encer disebut hipotonik. Sumber: kimia.upi.edu Gambar 1.7 Partikel zat terlarut dan pelarut murni (air) pada kondisi isotonik, hipotonik dan hipertonik 15
16 PPPPTK IPA Direktorat Jenderal Guru dan Tenaga Kependidikan - KEMDIKBUD Fenomena tekanan osmotik dapat diamati dalam banyak contoh yang menarik, diantaranya: 1. Hemolisis, yaitu kadar sel darah merah yang terlindungi dari lingkungan eksternal oleh membran semipermiable. Sel darah merah diletakkan dalam larutan hipotonik, karena larutan hipotonik kurang pekat dibandingkan larutan di dalam sel, air bergerak ke dalam sel. Sel akan menggembung dan akhirnya pecah membebaskan hemoglobin dan molekul lain. Sumber: General chemistry Gambar 1.8 (a) larutan hipotonik (b) larutan isotonik (c) larutan hipertonik yang terjadi pada sel darah merah 2. Pengawetan selai dan jelly. Kadar gula pada selai dan jelly sangat tinggi yang penting dalam proses pengawetan, karena gula membantu membunuh bakteri. Jika sel bakteri berada dalam larutan gula hipertonik, air intrasel cenderung bergerak keluar dari sel bakteri ke larutan yang lebih pekat melalui proses osmosis. Proses ini disebut kreasi, menyebabkan sel mengerut dan akhirnya tidak berfungsi lagi. Tekanan osmotik merupakan mekanisme utama dalam pengangkutan air ke bagian atas pada tumbuhan. Karena daun terus menerus kehilangan air ke udara, dalam proses yang disebut transpirasi, konsentrasi zat terlarut dalam cairan daun meningkat. Air didorong ke atas lewat batang, cabang dan ranting ranting pohon oleh tekanan osmotik. Penggunaan sifat koligatif untuk menentukan massa molar Sifat koligatif larutan non elektrolit dapat digunakan untuk menentukan massa molar zat terlarut. Berikut ini adalah contoh soal dalam penentuan massa molar 16 KEGIATAN PEMBELAJARAN 1: SIFAT KOLIGATIF LARUTAN
17 Modul Guru Pembelajar Mata Pelajaran Kimia SMA Contoh Soal 4 Sebanyak 7,85 g sampel senyawa dengan rumus empiris C 5 H 4 dilarutkan ke dalam 301 g benzena. Titik beku larutan adalah 1,05 o C di bawah titik beku benzena murni. Berapa massa molar dan rumus molekul senyawa tersebut? Penyelesaian Tahap 1 Menghitung molalitas larutan dari titik bekunya Molalitas = / Karena ada 0,205 mol zat terlarut dalam 1 kg pelarut, jumlah mol zat terlarut dalam 301 g atau 0,301 kg, pelarut adalah: Tahap 2 menentukan jumlah mol senyawa dalam 7,58 g Molalitas = Sehingga dapat dihitung massa molar zat terlarut 6 / Karena massa rumus C 5 H 4 adalah 64 g dan massa molarnya adalah 127 g, maka rumus molekulnya adalah C 10 H 8 (naftalena) SIFAT KOLIGATIF LARUTAN ELEKTROLIT Sifat koligatif larutan dapat terjadi pula pada larutan elektrolit. Pada larutan elektrolit terjadi proses terurainya ion-ion dalam larutan. Banyaknya partikel zat terlarut adalah yang menentukan sifat koligatif larutan. Contohnya adalah, larutan garam NaCl didalamnya akan terurai menjadi ion ion Na + dan Cl - sehingga 0,1 m larutan NaCl akan dua kali lebih besar dibandingkan 0,1 molal larutan nonelektrolit. Larutan non elektrolit, misalnya sukrosa atau gula. Bagaimana dengan Larutan CaCl 2 pada penurunan titik beku? 0,1 m larutan CaCl 2 tentunya akan menurunkan titik beku tiga kali lebih banyak daripada 0,1 m larutan sukrosa. Mengapa hal ini terjadi? Untuk melihat pengaruh ini,perhatikan persamaan berikut ini 17
18 PPPPTK IPA Direktorat Jenderal Guru dan Tenaga Kependidikan - KEMDIKBUD Tb = i.kb.m Tf = i.kf.m = i.m.r.t Variabel i adalah faktor Van t Hoff yang didefinisikan sebagai berikut. i = Jadi i harus bernilai 1 untuk semua non elektrolit. Pada larutan elektrolit i ditentukan dari ion ion yang terurai dalam larutan. Misalnya setiap satuan NaCl atau KNO 3 akan terurai menjadi 2 ion sehingga i=2, sedangkan setiap satuan Na 2 SO 4 atau MgCl 2 yang terurai menghasilkan 3 ion (i=3). Pada kenyataannya sifat koligatif larutan elektrolit biasanya lebih kecil daripada yang diperhitungkan, karena pada konsentrasi yang lebih tinggi, gaya elektrostatik berpengaruh sehingga kation dan anion saling tarik menarik. Suatu kation dan satu anion yang terikat oleh gaya elektrolistrik dinamakan gaya elektrostatik (pasangan ion) Pembentukan satu pasangan ion menurunkan jumlah partikel dalam larutan sebanyak satu, mengakibatkan berkurangnya sifat koligatif. Tekanan osmotik termasuk dalam sifat-sifat koligatif karena besarnya hanya tergantung pada jumlah partikel zat terlarut. Perbedaan sifat koligatif larutan elektrolit dengan larutan non elektrolit secara kuantitatif dinyatakan oleh faktor van t Hoff (i).harga i dapat ditentukan dengan rumus berikut. ( ) ( ) ( ) i merupakan faktor van t Hoff sebagai pengali untuk memperoleh harga sifat koligatif larutan elektrolit, n adalah jumlah ion dari zat elektrolit, dan α adalah derajat ionisasi zat elektrolit. Harga faktor Van t Hoff setiap zat elektrolit sangat bervariasi bergantung pada konsentrasi larutannya. Harga i berlaku untuk larutan elektrolit encer. 18 KEGIATAN PEMBELAJARAN 1: SIFAT KOLIGATIF LARUTAN
19 Modul Guru Pembelajar Mata Pelajaran Kimia SMA Contoh Soal 5 Larutan kalsium klorida dibuat dengan melarutkan 25 gram CaCl 2 dalam 500 gram air. Hitung tekanan uap larutan pada 80 o C jika tekanan uap air pada suhu 80 o C = 355 mmhg (massa atom relatif Ca=40, Cl=35,5, H= 1, O = 16) Penyelesaian Mol H 2 O = 500/18 = 27,8 mol Mol CaCl 2 = 25/111 = 0,225 mol CaCl 2 dalam air terurai menjadi tiga ion (Ca 2+, dan 2 ion Cl - ) maka dalam larutan terdapat 3x0,225 mol ion = 0,675 mol ion Jadi X H 2 O = mol H2O/mol H 2 O + mol CaCl 2 = 6 P larutan = X pelarut. P o pelarut = 0, mmhg = 346,5mmHg 19
SIFAT KOLIGATIF LARUTAN
 BAB 1 SIFAT KOLIGATIF LARUTAN Gambar 1.1 Proses kenaikan titik didih Sumber: Jendela Iptek Materi Pada pelajaran bab pertama ini, akan dipelajari tentang penurunan tekanan uap larutan ( P), kenaikan titik
BAB 1 SIFAT KOLIGATIF LARUTAN Gambar 1.1 Proses kenaikan titik didih Sumber: Jendela Iptek Materi Pada pelajaran bab pertama ini, akan dipelajari tentang penurunan tekanan uap larutan ( P), kenaikan titik
Sifat Koligatif Larutan
 Sifat Koligatif Larutan A. PENDAHULUAN Sifat koligatif larutan adalah sifat larutan yang tidak bergantung kepada jenis zat, tetapi hanya bergantung pada konsentrasi larutan. Sifat koligatif terdiri dari
Sifat Koligatif Larutan A. PENDAHULUAN Sifat koligatif larutan adalah sifat larutan yang tidak bergantung kepada jenis zat, tetapi hanya bergantung pada konsentrasi larutan. Sifat koligatif terdiri dari
SIFAT KOLIGATIF LARUTAN
 SIFAT KOLIGATIF LARUTAN PENURUNAN TEKANAN UAP Penurunan Tekanan Uap adalah selisih antara tekanan uap jenuh pelarut murni dengan tekanan uap jenuh larutan. P = P - P P = Penurunan Tekanan Uap P = Tekanan
SIFAT KOLIGATIF LARUTAN PENURUNAN TEKANAN UAP Penurunan Tekanan Uap adalah selisih antara tekanan uap jenuh pelarut murni dengan tekanan uap jenuh larutan. P = P - P P = Penurunan Tekanan Uap P = Tekanan
I Sifat Koligatif Larutan
 Bab I Sifat Koligatif Larutan Tujuan Pembelajaran Setelah mempelajari bab ini Anda dapat menjelaskan dan membandingkan sifat koligatif larutan nonelektrolit dengan sifat koligatif larutan elektrolit. Pernahkah
Bab I Sifat Koligatif Larutan Tujuan Pembelajaran Setelah mempelajari bab ini Anda dapat menjelaskan dan membandingkan sifat koligatif larutan nonelektrolit dengan sifat koligatif larutan elektrolit. Pernahkah
SIFAT KOLIGATIF LARUTAN
 SIFAT KOLIGATIF LARUTAN Sifat koligatif larutan yaitu sifat larutan yang hanya dipengaruhi oleh jumlah partikel zat terlarut. Syarat sifat koligatis: 1. Larutan harus encer (larutan dianggap ideal) tidak
SIFAT KOLIGATIF LARUTAN Sifat koligatif larutan yaitu sifat larutan yang hanya dipengaruhi oleh jumlah partikel zat terlarut. Syarat sifat koligatis: 1. Larutan harus encer (larutan dianggap ideal) tidak
Sifat-sifat Fisis Larutan
 Chapter 7a Sifat-sifat Fisis Larutan Larutan adalah campuran homogen dari dua atau lebih zat Zat yang jumlahnya lebih sedikit disebut zat terlarut Zat yang jumlahnya lebih banyak disebut zat pelarut. 13.1
Chapter 7a Sifat-sifat Fisis Larutan Larutan adalah campuran homogen dari dua atau lebih zat Zat yang jumlahnya lebih sedikit disebut zat terlarut Zat yang jumlahnya lebih banyak disebut zat pelarut. 13.1
SIFAT KOLIGATIF LARUTAN
 1 SIFAT KOLIGATIF LARUTAN A. KONSENTRASI LARUTAN B. PENGERTIAN SIFAT KOLIGATIF LARUTAN C. SIFAT KOLIGATIF LARUTAN NONELEKTROLIT D. SIFAT KOLIGATIF LARUTAN ELEKTROLIT Di dalam kehidupan sehari-hari, banyak
1 SIFAT KOLIGATIF LARUTAN A. KONSENTRASI LARUTAN B. PENGERTIAN SIFAT KOLIGATIF LARUTAN C. SIFAT KOLIGATIF LARUTAN NONELEKTROLIT D. SIFAT KOLIGATIF LARUTAN ELEKTROLIT Di dalam kehidupan sehari-hari, banyak
SIFAT KOLIGATIF LARUTAN
 SIFAT KOLIGATIF LARUTAN STANDAR KOMPETENSI 1. Mendeskripsikan sifat-sifat Larutan, metode pengukuran dan terapannya. KOMPETENSI DASAR 1.1 Mendeskripsikan sifat-sifat Larutan, metode pengukuran dan terapannya.
SIFAT KOLIGATIF LARUTAN STANDAR KOMPETENSI 1. Mendeskripsikan sifat-sifat Larutan, metode pengukuran dan terapannya. KOMPETENSI DASAR 1.1 Mendeskripsikan sifat-sifat Larutan, metode pengukuran dan terapannya.
SIFAT KOLIGATIF LARUTAN
 SIFAT KOLIGATIF LARUTAN DEFINISI Sifat koligatif larutan : sifat larutan yang tidak tergantung pada jenis zat terlarut tetapi hanya tergantung pada banyakknya partikel zat terlarut dalam larutan. Sifat
SIFAT KOLIGATIF LARUTAN DEFINISI Sifat koligatif larutan : sifat larutan yang tidak tergantung pada jenis zat terlarut tetapi hanya tergantung pada banyakknya partikel zat terlarut dalam larutan. Sifat
BAB 5 KONSEP LARUTAN 1. KOMPOSISI LARUTAN 2. SIFAT-SIFAT ZAT TERLARUT 3. KESETIMBANGAN LARUTAN 4. SIFAT KOLIGATIF LARUTAN
 BAB 5 KONSEP LARUTAN 1. KOMPOSISI LARUTAN 2. SIFAT-SIFAT ZAT TERLARUT 3. KESETIMBANGAN LARUTAN 4. SIFAT KOLIGATIF LARUTAN ZAT TERLARUT + PELARUT LARUTAN Komponen minor Komponen utama Sistem homogen PELARUTAN
BAB 5 KONSEP LARUTAN 1. KOMPOSISI LARUTAN 2. SIFAT-SIFAT ZAT TERLARUT 3. KESETIMBANGAN LARUTAN 4. SIFAT KOLIGATIF LARUTAN ZAT TERLARUT + PELARUT LARUTAN Komponen minor Komponen utama Sistem homogen PELARUTAN
Kegiatan Belajar 1: Sifat Koligatif Larutan. Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada kimia larutan.
 Kegiatan Belajar 1: Sifat Koligatif Larutan Capaian Pembelajaran Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada kimia larutan. Subcapaian pembelajaran: 1. Menentukan sifat koligatif
Kegiatan Belajar 1: Sifat Koligatif Larutan Capaian Pembelajaran Menguasai teori aplikasi materipelajaran yang diampu secara mendalam pada kimia larutan. Subcapaian pembelajaran: 1. Menentukan sifat koligatif
Sifat Koligatif Larutan
 BABI Sifat Koligatif Larutan Sumber: Tempo, 20 Agustus 2006 Kamu tentu pernah menjenguk orang sakit di rumah sakit. Pernahkah kamu melihat orang sakit yang diberi cairan infus. Apakah sebenarnya cairan
BABI Sifat Koligatif Larutan Sumber: Tempo, 20 Agustus 2006 Kamu tentu pernah menjenguk orang sakit di rumah sakit. Pernahkah kamu melihat orang sakit yang diberi cairan infus. Apakah sebenarnya cairan
BAB 1 SIFAT KOLIGATIF LARUTAN. STANDART KOMPETENSI Mendeskripsikan sifat-sifat larutan, metode pengukuran serta terapannya.
 BAB 1 SIFAT KOLIGATIF LARUTAN STANDART KOMPETENSI Mendeskripsikan sifat-sifat larutan, metode pengukuran serta terapannya. KOMPETENSI DASAR Mendeskripsikan penurunan tekanan uap, kenaikan titik didih,
BAB 1 SIFAT KOLIGATIF LARUTAN STANDART KOMPETENSI Mendeskripsikan sifat-sifat larutan, metode pengukuran serta terapannya. KOMPETENSI DASAR Mendeskripsikan penurunan tekanan uap, kenaikan titik didih,
Pilihan Ganda Soal dan Jawaban Sifat Koligatif Larutan 20 butir. 5 uraian Soal dan Jawaban Sifat Koligatif Larutan.
 1 Pilihan Ganda Soal dan Jawaban Sifat Koligatif Larutan 20 butir. 5 uraian Soal dan Jawaban Sifat Koligatif Larutan. Berilah tanda silang (X) pada huruf A, B, C, D atau E di depan jawaban yang benar!
1 Pilihan Ganda Soal dan Jawaban Sifat Koligatif Larutan 20 butir. 5 uraian Soal dan Jawaban Sifat Koligatif Larutan. Berilah tanda silang (X) pada huruf A, B, C, D atau E di depan jawaban yang benar!
Sulistyani M.Si
 Sulistyani M.Si Email:sulistyani@uny.ac.id + Larutan terdiri dari pelarut (solvent) dan zat terlarut (solute). Jumlah zat terlarut dalam suatu larutan dinyatakan dengan konsentrasi larutan. Secara kuantitatif,
Sulistyani M.Si Email:sulistyani@uny.ac.id + Larutan terdiri dari pelarut (solvent) dan zat terlarut (solute). Jumlah zat terlarut dalam suatu larutan dinyatakan dengan konsentrasi larutan. Secara kuantitatif,
Kelompok 2 JUWITA ARRAHMA W NOVIAN ARRADEX C SURI ANDAYANA 2 KI A TAHUN AKADEMIK 2016 POLITEKNIK NEGERI SRIWIJAYA
 Kelompok 2 JUWITA ARRAHMA W NOVIAN ARRADEX C SURI ANDAYANA 2 KI A TAHUN AKADEMIK 2016 POLITEKNIK NEGERI SRIWIJAYA KATA PENGANTAR Puji syukur kehadirat Allah SWT atas berkat dan rahmat-nya kami dapat menyelesaikan
Kelompok 2 JUWITA ARRAHMA W NOVIAN ARRADEX C SURI ANDAYANA 2 KI A TAHUN AKADEMIK 2016 POLITEKNIK NEGERI SRIWIJAYA KATA PENGANTAR Puji syukur kehadirat Allah SWT atas berkat dan rahmat-nya kami dapat menyelesaikan
Soal dan Pembahasan. Soal dan Pembahasan Fraksi Mol. 1.Tentukan kemolalan larutan dari 0,01 mol NaOH dalam 200 gram air!
 Soal dan Pembahasan Fraksi Mol Soal dan Pembahasan 1.Tentukan kemolalan larutan dari 0,01 mol NaOH dalam 200 gram air! Menentukan kemolalan Dimana m = kemolalan larutan p = massa pelarut n = jumlah mol
Soal dan Pembahasan Fraksi Mol Soal dan Pembahasan 1.Tentukan kemolalan larutan dari 0,01 mol NaOH dalam 200 gram air! Menentukan kemolalan Dimana m = kemolalan larutan p = massa pelarut n = jumlah mol
LAPORAN PRAKTIKUM KIMIA DASAR 1
 LAPORAN PRAKTIKUM KIMIA DASAR 1 Penentuan Titik Beku Oleh: Nama NIM : Eka Anzihory : M0211024 Hari/tgl praktek : Kamis / 10 November 2011 Kelompok : 6 LABORATORIUM KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
LAPORAN PRAKTIKUM KIMIA DASAR 1 Penentuan Titik Beku Oleh: Nama NIM : Eka Anzihory : M0211024 Hari/tgl praktek : Kamis / 10 November 2011 Kelompok : 6 LABORATORIUM KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
Perhatikan gambar diagram P-T berikut:
 SIFAT KOLIGATIF LARUTAN 1. Yang bukan merupakan sifat koligatif larutan adalah. A. Penurunan tekanan uap B. Penurunan titik beku C. Penurunan titik didih D. Kenaikan titik didih E. Tekanan osmosis 2. Adanya
SIFAT KOLIGATIF LARUTAN 1. Yang bukan merupakan sifat koligatif larutan adalah. A. Penurunan tekanan uap B. Penurunan titik beku C. Penurunan titik didih D. Kenaikan titik didih E. Tekanan osmosis 2. Adanya
20 % w/w = 100% 26.67% x =
 massa zat terlarut (g) %w/w = x100% massa larutan (g) Contoh : hitung %berat NaCl yang dibuat dengan melarutkan 20 g NaCl dalam 55 g air Jawab : 20 % w/w = 100% 26.67% 20 + 55 x = Contoh : 50 ml alkohol
massa zat terlarut (g) %w/w = x100% massa larutan (g) Contoh : hitung %berat NaCl yang dibuat dengan melarutkan 20 g NaCl dalam 55 g air Jawab : 20 % w/w = 100% 26.67% 20 + 55 x = Contoh : 50 ml alkohol
LAPORAN PRAKTIKUM KIMIA DASAR I
 LAPORAN PRAKTIKUM KIMIA DASAR I PENENTUAN TITIK BEKU Nama Mahasiswa NIM : Ita Permadani : M0311040 Hari/Tanggal Praktikum : Kamis, 10 November 2011 Kelompok : 13 Asisten Pembimbing : Dewi Nur Rita LABORATORIUM
LAPORAN PRAKTIKUM KIMIA DASAR I PENENTUAN TITIK BEKU Nama Mahasiswa NIM : Ita Permadani : M0311040 Hari/Tanggal Praktikum : Kamis, 10 November 2011 Kelompok : 13 Asisten Pembimbing : Dewi Nur Rita LABORATORIUM
SOAL REMEDIAL SIFAT KOLIGATIF LARUTAN
 SOAL REMEIAL SIFAT KOLIGATIF LARUTAN Nama : No induk : Kelas : Mata pelajaran: A. Pilihlah salah satu jawaban yang menurut kamu paling tepat! 1. Sifat koligatif adalah sifat lurutan yang tidak bergantung
SOAL REMEIAL SIFAT KOLIGATIF LARUTAN Nama : No induk : Kelas : Mata pelajaran: A. Pilihlah salah satu jawaban yang menurut kamu paling tepat! 1. Sifat koligatif adalah sifat lurutan yang tidak bergantung
BAB II TINJAUAN PUSTAKA. Belajar merupakan salah satu faktor yang berperan penting dalam
 BAB II TINJAUAN PUSTAKA 2.1 Belajar dan Hasil Belajar 2.1.1 Belajar Belajar merupakan salah satu faktor yang berperan penting dalam pembentukan pribadi dan perilaku individu. Sukmadinata (2003) menyebutkan
BAB II TINJAUAN PUSTAKA 2.1 Belajar dan Hasil Belajar 2.1.1 Belajar Belajar merupakan salah satu faktor yang berperan penting dalam pembentukan pribadi dan perilaku individu. Sukmadinata (2003) menyebutkan
SIFAT KOLIGATIF LARUTAN
 SIFAT KOLIGATIF LARUTAN 1. Yang bukan merupakan sifat koligatif larutan adalah. A. Penurunan tekanan uap B. Penurunan titik beku C. Penurunan titik didih D. Kenaikan titik didih E. Tekanan osmosis Sifat
SIFAT KOLIGATIF LARUTAN 1. Yang bukan merupakan sifat koligatif larutan adalah. A. Penurunan tekanan uap B. Penurunan titik beku C. Penurunan titik didih D. Kenaikan titik didih E. Tekanan osmosis Sifat
L A R U T A N d a n s i f a t k o l i gat if l a r u t a n. Putri Anjarsari, S.S.i., M.Pd
 L A R U T A N d a n s i f a t k o l i gat if l a r u t a n Putri Anjarsari, S.S.i., M.Pd putri_anjarsari@uny.ac.id LARUTAN Zat homogen yang merupakan campuran dari dua komponen atau lebih, yang dapat berupa
L A R U T A N d a n s i f a t k o l i gat if l a r u t a n Putri Anjarsari, S.S.i., M.Pd putri_anjarsari@uny.ac.id LARUTAN Zat homogen yang merupakan campuran dari dua komponen atau lebih, yang dapat berupa
Sifat Dasar Larutan Kelarutan Pengaruh Jenis Zat pada Kelarutan
 2. LARUTAN 1. Sifat Dasar Larutan Larutan adalah campuran yang bersifat homogen antara molekul, atom ataupun ion dari dua zat atau lebih. Disebut campuran karena susunannya atau komposisinya dapat berubah.
2. LARUTAN 1. Sifat Dasar Larutan Larutan adalah campuran yang bersifat homogen antara molekul, atom ataupun ion dari dua zat atau lebih. Disebut campuran karena susunannya atau komposisinya dapat berubah.
Kimia. Mari Belajar. untuk SMA-MA Kelas XII IPA
 Kimia Mari Belajar untuk SMA-MA Kelas XII IPA Hak Cipta pada Departemen Pendidikan Nasional Dilindungi Undang-undang Mari Belajar Kimia untuk SMA-MA Kelas XII IPA Penyusun Crys Faj:ar Partana Antuni Wiyarsi
Kimia Mari Belajar untuk SMA-MA Kelas XII IPA Hak Cipta pada Departemen Pendidikan Nasional Dilindungi Undang-undang Mari Belajar Kimia untuk SMA-MA Kelas XII IPA Penyusun Crys Faj:ar Partana Antuni Wiyarsi
Sifat koligatif larutan. Pak imam
 Sifat koligatif larutan Pak imam Sifat-sifat koligatif larutan Adalah sifat larutan yang hanya ditentukan oleh jumlah partikel dalam larutan dan tidak tergantung jenis partikelnya. Materi terbatas untuk
Sifat koligatif larutan Pak imam Sifat-sifat koligatif larutan Adalah sifat larutan yang hanya ditentukan oleh jumlah partikel dalam larutan dan tidak tergantung jenis partikelnya. Materi terbatas untuk
KIMIA TERAPAN LARUTAN
 KIMIA TERAPAN LARUTAN Pokok Bahasan A. Konsentrasi Larutan B. Masalah Konsentrasi C. Sifat Elektrolit Larutan D. Sifat Koligatif Larutan E. Larutan Ideal Pengantar Larutan adalah campuran homogen atau
KIMIA TERAPAN LARUTAN Pokok Bahasan A. Konsentrasi Larutan B. Masalah Konsentrasi C. Sifat Elektrolit Larutan D. Sifat Koligatif Larutan E. Larutan Ideal Pengantar Larutan adalah campuran homogen atau
RINGKASAN MATERI PETA KONSEP KIMIA
 RINGKASAN MATERI PETA KONSEP KIMIA Peta Konsep berikut : Dari Peta konsep yang terlukiskan diatas maka akan dibuat ringkasan materi sebagai LARUTAN adalah campuran homogen dua zat atau lebih yang saling
RINGKASAN MATERI PETA KONSEP KIMIA Peta Konsep berikut : Dari Peta konsep yang terlukiskan diatas maka akan dibuat ringkasan materi sebagai LARUTAN adalah campuran homogen dua zat atau lebih yang saling
BAB 4 TEMUAN DAN PEMBAHASAN. merumuskan indikator dan konsep pada submateri pokok kenaikan titik didih
 BAB 4 TEMUAN DAN PEMBAHASAN Secara garis besar, penelitian ini dibagi menjadi tiga tahap yaitu merumuskan indikator dan konsep pada submateri pokok kenaikan titik didih larutan setelah menganalisis standar
BAB 4 TEMUAN DAN PEMBAHASAN Secara garis besar, penelitian ini dibagi menjadi tiga tahap yaitu merumuskan indikator dan konsep pada submateri pokok kenaikan titik didih larutan setelah menganalisis standar
UH : SIFAT KOLIGATIF LARUTAN KODE SOAL : A
 UH : SIFAT KOLIGATIF LARUTAN KODE SOAL : A Catatan : Boleh menggunakan kalkulator, tetapi bukan kalkulator hp atau sejenisnya. 1.. Larutan 1 molal NaOH (Ar Na = 23 g/mol, Ar O = 16 g/mol, dan Ar H = 1
UH : SIFAT KOLIGATIF LARUTAN KODE SOAL : A Catatan : Boleh menggunakan kalkulator, tetapi bukan kalkulator hp atau sejenisnya. 1.. Larutan 1 molal NaOH (Ar Na = 23 g/mol, Ar O = 16 g/mol, dan Ar H = 1
OSMOSIS LATAR BELAKANG
 OSMOSIS LATAR BELAKANG Sifat koligatif adalah sifat yang hanya bergantung pada jumlah partikel zat terlarut dan tidak tergantung pada jenis partikelnya. Koligatif artinya bergantung pada kumpulan atau
OSMOSIS LATAR BELAKANG Sifat koligatif adalah sifat yang hanya bergantung pada jumlah partikel zat terlarut dan tidak tergantung pada jenis partikelnya. Koligatif artinya bergantung pada kumpulan atau
BAB I PENDAHULUAN A. KENAIKAN TITIK DIDIH DAN PENURUNAN TITIK BEKU
 BAB I PENDAHULUAN A. KENAIKAN TITIK DIDIH DAN PENURUNAN TITIK BEKU 1. Kenaikan Titik Didih Titik didih suatu zat cair adalah: suhu pada suatu tekanan uap jenuh zat cair tersebut sama dengan tekanan luar.
BAB I PENDAHULUAN A. KENAIKAN TITIK DIDIH DAN PENURUNAN TITIK BEKU 1. Kenaikan Titik Didih Titik didih suatu zat cair adalah: suhu pada suatu tekanan uap jenuh zat cair tersebut sama dengan tekanan luar.
TITIK DIDIH LARUTAN. Disusun Oleh. Kelompok B-4. Zulmijar
 Laporan khusus Laboratorium Kimia Fisika TITIK DIDIH LARUTAN Disusun Oleh Kelompok B-4 Zulmijar 1404103010044 JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS SYIAH KUALA DARUSSALAM, BANDA ACEH 2015 pes
Laporan khusus Laboratorium Kimia Fisika TITIK DIDIH LARUTAN Disusun Oleh Kelompok B-4 Zulmijar 1404103010044 JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS SYIAH KUALA DARUSSALAM, BANDA ACEH 2015 pes
RENCANA PELAKSANAAN PEMBELAJARAN (RPP)
 1 No. Dokumen : F/751/WKS1/P/5 No. Revisi : 1 Tanggal Berlaku : 1 Juli 2016 RENCANA PELAKSANAAN PEMBELAJARAN (RPP) Satuan Pendidikan : SMA Negeri 1 Godean Mata Pelajaran : Kimia Kelas/Semester : XII MIPA/Ganjil
1 No. Dokumen : F/751/WKS1/P/5 No. Revisi : 1 Tanggal Berlaku : 1 Juli 2016 RENCANA PELAKSANAAN PEMBELAJARAN (RPP) Satuan Pendidikan : SMA Negeri 1 Godean Mata Pelajaran : Kimia Kelas/Semester : XII MIPA/Ganjil
bemffums.blogspot.com
 bemffums.blogspot.com MATERI KIMIA DASAR SEMESTER 1 Tahun Akademik 2015/2016 No. 1 MAteri Pengantar Sifat dan Dasar Konsep Kimia Modern 2 3 4 5 6 7 8 9 10 11 12 Stoikiometri I Stoikiometri II Ikatan kimia
bemffums.blogspot.com MATERI KIMIA DASAR SEMESTER 1 Tahun Akademik 2015/2016 No. 1 MAteri Pengantar Sifat dan Dasar Konsep Kimia Modern 2 3 4 5 6 7 8 9 10 11 12 Stoikiometri I Stoikiometri II Ikatan kimia
Rima Puspa Aryani : A1C311010
 LAPORAN PRAKTIKUM KIMIA SMA (AKKC 351) PERCOBAAN VIII SIFAT KOLIGATIF LARUTAN Dosen: Dra. Hj. St. H. Nurdiniah, M.Si Drs. Rusmansyah, M.Pd Asisten Praktikum: Siti Meisyarah Trisda Mila Disusun Oleh: Kelompok
LAPORAN PRAKTIKUM KIMIA SMA (AKKC 351) PERCOBAAN VIII SIFAT KOLIGATIF LARUTAN Dosen: Dra. Hj. St. H. Nurdiniah, M.Si Drs. Rusmansyah, M.Pd Asisten Praktikum: Siti Meisyarah Trisda Mila Disusun Oleh: Kelompok
MAKALAH KIMIA FISIKA LARUTAN ELEKTROLIT DAN NON ELEKTROLIT
 MAKALAH KIMIA FISIKA LARUTAN ELEKTROLIT DAN NON ELEKTROLIT KELAS 3M - KELOMPOK 6 DISUSUN OLEH : FITRI FELINA HADIJAH JANEKE DWIRARA PUTRI KIKI KINANTI. D LUTFIKA MUNAZIAH DOSEN PEMBIMBING : FAHJAR PRISISKA,
MAKALAH KIMIA FISIKA LARUTAN ELEKTROLIT DAN NON ELEKTROLIT KELAS 3M - KELOMPOK 6 DISUSUN OLEH : FITRI FELINA HADIJAH JANEKE DWIRARA PUTRI KIKI KINANTI. D LUTFIKA MUNAZIAH DOSEN PEMBIMBING : FAHJAR PRISISKA,
Kata Pengantar. Surakarta, Juli Penyusun. Sains KIMIA SMA/MA Kelas X 3
 Kata Pengantar Puji syukur kita panjatkan pada Tuhan Yang Maha Esa yang telah melimpahkan rahmat dan karunia-nya sehingga penulis dapat menyelesaikan buku Kimia untuk SMA dan MA ini. Seiring dengan perkembangan
Kata Pengantar Puji syukur kita panjatkan pada Tuhan Yang Maha Esa yang telah melimpahkan rahmat dan karunia-nya sehingga penulis dapat menyelesaikan buku Kimia untuk SMA dan MA ini. Seiring dengan perkembangan
Larutan dan Konsentrasi
 Larutan dan Konsentrasi Tujuan Pembelajaran Mahasiswa memahami konsep larutan Mahasiswa memahami konsep perhitungan konsentrasi Pentingnya perhitungan konsentrasi Pentingnya memahami sifat larutan dan
Larutan dan Konsentrasi Tujuan Pembelajaran Mahasiswa memahami konsep larutan Mahasiswa memahami konsep perhitungan konsentrasi Pentingnya perhitungan konsentrasi Pentingnya memahami sifat larutan dan
PERTEMUAN VI DAN VII SIFAT KOLIGATIF LARUTAN
 PERTEMUAN VI DAN VII LARUTAN IDEAL SIFAT KOLIGATIF LARUTAN Larutan Ideal adalah larutan yang memnuhi kriteria sebagai berikut: 1.Homogenitas larutan Homogenitas larutan berlaku dari larutan yang sangat
PERTEMUAN VI DAN VII LARUTAN IDEAL SIFAT KOLIGATIF LARUTAN Larutan Ideal adalah larutan yang memnuhi kriteria sebagai berikut: 1.Homogenitas larutan Homogenitas larutan berlaku dari larutan yang sangat
Larutan. Modul 1 PENDAHULUAN
 Modul 1 Larutan Dra. Marheni M. Sc. PENDAHULUAN B anyak reaksi kimia yang penting berlangsung dalam lingkungan air. Karena itu kita perlu mengetahui dan mempelajari sifat larutan dalam air. Larutan adalah
Modul 1 Larutan Dra. Marheni M. Sc. PENDAHULUAN B anyak reaksi kimia yang penting berlangsung dalam lingkungan air. Karena itu kita perlu mengetahui dan mempelajari sifat larutan dalam air. Larutan adalah
Hak Cipta pada Departemen Pendidikan Nasional dilindungi Undang-undang
 ak Cipta pada Departemen Pendidikan Nasional dilindungi Undang-undang Praktis Belajar Kimia untuk Kelas XII Sekolah Menengah Atas/Madrasah Aliyah Program Ilmu Pengetahuan Alam Penulis : Iman Rahayu Penyunting
ak Cipta pada Departemen Pendidikan Nasional dilindungi Undang-undang Praktis Belajar Kimia untuk Kelas XII Sekolah Menengah Atas/Madrasah Aliyah Program Ilmu Pengetahuan Alam Penulis : Iman Rahayu Penyunting
TEGUH PANGAJUANTO TRI RAHMIDI KIMIA 3 UNTUK SMA/MA KELAS XII
 TEGU PANGAJUANT TRI RAMIDI KIMIA 3 UNTUK SMA/MA KELAS XII ak Cipta pada Departemen Pendidikan Nasional Dilindungi Undang-Undang Kimia 3 Untuk SMA/MA Kelas XII Teguh Pangajuanto Tri Rahmidi Editor materi
TEGU PANGAJUANT TRI RAMIDI KIMIA 3 UNTUK SMA/MA KELAS XII ak Cipta pada Departemen Pendidikan Nasional Dilindungi Undang-Undang Kimia 3 Untuk SMA/MA Kelas XII Teguh Pangajuanto Tri Rahmidi Editor materi
KESETIMBANGAN FASA. Sistem Satu Komponen. Aturan Fasa Gibbs
 KESETIMBANGAN FASA Fasa adalah bagian sistem dengan komposisi kimia dan sifat sifat fisik seragam, yang terpisah dari bagian sistem lain oleh suatu bidang batas. Pemahaman perilaku fasa mulai berkembang
KESETIMBANGAN FASA Fasa adalah bagian sistem dengan komposisi kimia dan sifat sifat fisik seragam, yang terpisah dari bagian sistem lain oleh suatu bidang batas. Pemahaman perilaku fasa mulai berkembang
Standar Kompetensi Kompetensi Dasar Nilai Indikator. Sifat Koligatif Larutan
 Model Pengintegrasian Nilai Pendidikan Karakter Standar Kompetensi Kompetensi Dasar Nilai Indikator 1. Menjelaskan sifat-sifat koligatif larutan nonelektrolit dan elektrolit. 1.1 Menjelaskan penurunan
Model Pengintegrasian Nilai Pendidikan Karakter Standar Kompetensi Kompetensi Dasar Nilai Indikator 1. Menjelaskan sifat-sifat koligatif larutan nonelektrolit dan elektrolit. 1.1 Menjelaskan penurunan
I. Judul : Membandingkan Kenaikan Titik Didih Larutan Elektrolit dan Non-Elektrolit.
 I. Judul : Membandingkan Kenaikan Titik Didih Larutan Elektrolit dan Non-Elektrolit. II. Tujuan : Membandingkan Kenaikan Titik Didih Larutan Elektrolit dan Non-Elektrolit pada konsentrasi larutan yang
I. Judul : Membandingkan Kenaikan Titik Didih Larutan Elektrolit dan Non-Elektrolit. II. Tujuan : Membandingkan Kenaikan Titik Didih Larutan Elektrolit dan Non-Elektrolit pada konsentrasi larutan yang
KESETIMBANGAN FASA. Komponen sistem
 KESETIMBANGAN FASA Kata fase berasal dari bahasa Yunani yang berarti pemunculan. Fasa adalah bagian sistem dengan komposisi kimia dan sifat sifat fisik seragam, yang terpisah dari bagian sistem lain oleh
KESETIMBANGAN FASA Kata fase berasal dari bahasa Yunani yang berarti pemunculan. Fasa adalah bagian sistem dengan komposisi kimia dan sifat sifat fisik seragam, yang terpisah dari bagian sistem lain oleh
HASIL ANALISIS KEBENARAN KONSEP PADA OBJEK PENELITIAN. Penjelasan Konsep
 LAMPIRAN 7 HASIL ANALISIS KEBENARAN KONSEP PADA OBJEK PENELITIAN Keterangan kriteria kebenaran konsep Benar (B) Salah (S) Indikator Pembelajaran : Jika penjelasan konsep subjek penelitian sesuai dengan
LAMPIRAN 7 HASIL ANALISIS KEBENARAN KONSEP PADA OBJEK PENELITIAN Keterangan kriteria kebenaran konsep Benar (B) Salah (S) Indikator Pembelajaran : Jika penjelasan konsep subjek penelitian sesuai dengan
Bab VI Larutan Elektrolit dan Nonelektrolit
 Bab VI Larutan Elektrolit dan Nonelektrolit Sumber: Dokumentasi Penerbit Air laut merupakan elektrolit karena di dalamnya terdapat ion-ion seperti Na, K, Ca 2, Cl, 2, dan CO 3 2. TUJUAN PEMBELAJARAN Setelah
Bab VI Larutan Elektrolit dan Nonelektrolit Sumber: Dokumentasi Penerbit Air laut merupakan elektrolit karena di dalamnya terdapat ion-ion seperti Na, K, Ca 2, Cl, 2, dan CO 3 2. TUJUAN PEMBELAJARAN Setelah
BAB II KAJIAN PUSTAKA. Kata media berasal dari bahasa latin yaitu medius yang secara harfiah berarti
 BAB II KAJIAN PUSTAKA A. Media Pembelajaran 1. Pengertian Media Pembelajaran Kata media berasal dari bahasa latin yaitu medius yang secara harfiah berarti tengah, perantara, atau pengantar. Secara lebih
BAB II KAJIAN PUSTAKA A. Media Pembelajaran 1. Pengertian Media Pembelajaran Kata media berasal dari bahasa latin yaitu medius yang secara harfiah berarti tengah, perantara, atau pengantar. Secara lebih
TINGKAT PERGURUAN TINGGI 2017 (ONMIPA-PT) SUB KIMIA FISIK. 16 Mei Waktu : 120menit
 OLIMPIADE NASIONAL MATEMATIKA DAN ILMU PENGETAHUAN ALAM TINGKAT PERGURUAN TINGGI 2017 (ONMIPA-PT) BIDANG KIMIA SUB KIMIA FISIK 16 Mei 2017 Waktu : 120menit Petunjuk Pengerjaan H 1. Tes ini terdiri atas
OLIMPIADE NASIONAL MATEMATIKA DAN ILMU PENGETAHUAN ALAM TINGKAT PERGURUAN TINGGI 2017 (ONMIPA-PT) BIDANG KIMIA SUB KIMIA FISIK 16 Mei 2017 Waktu : 120menit Petunjuk Pengerjaan H 1. Tes ini terdiri atas
MAKALAH KIMIA ORGANIK FISIK GEJALA SOLVASI
 MAKALAH KIMIA ORGANIK FISIK GEJALA SOLVASI Disusun Oleh: 1. Izzuddin Surya Nata (0621 14 028) 2. Elly Febriyanti (0621 16 707) 3. Fildzah Ahdiya (0621 16 701) 4. Faus Asyarafi Endyan (0621 16 703) 5. Karina
MAKALAH KIMIA ORGANIK FISIK GEJALA SOLVASI Disusun Oleh: 1. Izzuddin Surya Nata (0621 14 028) 2. Elly Febriyanti (0621 16 707) 3. Fildzah Ahdiya (0621 16 701) 4. Faus Asyarafi Endyan (0621 16 703) 5. Karina
KIMIA. Sesi. Sifat Koligatif (Bagian II) A. PENURUNAN TEKANAN UAP ( P)
 KIMIA KELAS XII IA - KURIKULUM GABUNGAN 02 Sesi NGAN Sifat Koligatif (Bagia II) Iteraksi atara pelarut da zat megakibatka perubaha fisik pada kompoekompoe peyusu laruta. Salah satu sifat yag diakibatka
KIMIA KELAS XII IA - KURIKULUM GABUNGAN 02 Sesi NGAN Sifat Koligatif (Bagia II) Iteraksi atara pelarut da zat megakibatka perubaha fisik pada kompoekompoe peyusu laruta. Salah satu sifat yag diakibatka
Review I. 1. Berikut ini adalah data titik didih beberapa larutan:
 KIMIA KELAS XII IPA KURIKULUM GABUNGAN 06 Sesi NGAN Review I Kita telah mempelajari sifat koligatif, reaksi redoks, dan sel volta pada sesi 5. Pada sesi keenam ini, kita akan mereview kelima sesi yang
KIMIA KELAS XII IPA KURIKULUM GABUNGAN 06 Sesi NGAN Review I Kita telah mempelajari sifat koligatif, reaksi redoks, dan sel volta pada sesi 5. Pada sesi keenam ini, kita akan mereview kelima sesi yang
BAB 4. WUJUD ZAT 1. WUJUD GAS 2. HUKUM GAS 3. HUKUM GAS IDEAL 4. GAS NYATA 5. CAIRAN DAN PADATAN 6. GAYA ANTARMOLEKUL 7. TRANSISI FASA 8.
 BAB 4. WUJUD ZAT 1. WUJUD GAS 2. HUKUM GAS 3. HUKUM GAS IDEAL 4. GAS NYATA 5. CAIRAN DAN PADATAN 6. GAYA ANTARMOLEKUL 7. TRANSISI FASA 8. DIAGRAM FASA WUJUD ZAT: GAS CAIRAN PADATAN PERMEN (sukrosa) C 12
BAB 4. WUJUD ZAT 1. WUJUD GAS 2. HUKUM GAS 3. HUKUM GAS IDEAL 4. GAS NYATA 5. CAIRAN DAN PADATAN 6. GAYA ANTARMOLEKUL 7. TRANSISI FASA 8. DIAGRAM FASA WUJUD ZAT: GAS CAIRAN PADATAN PERMEN (sukrosa) C 12
STOIKIOMETRI LARUTAN. Andian Ari Anggraeni, M.Sc
 STOIKIOMETRI LARUTAN Andian Ari Anggraeni, M.Sc A.1. MASSA ATOM RELATIF (A r ) DAN MASSA MOLEKUL RELATIF (M r ) Dari percobaan diketahui bahwa perbandingan massa hidrogen dan oksigen dalam air adalah 1
STOIKIOMETRI LARUTAN Andian Ari Anggraeni, M.Sc A.1. MASSA ATOM RELATIF (A r ) DAN MASSA MOLEKUL RELATIF (M r ) Dari percobaan diketahui bahwa perbandingan massa hidrogen dan oksigen dalam air adalah 1
DAFTAR LAMPIRAN...xi
 DAFTAR ISI ABSTRAK... i KATA PENGANTAR... ii DAFTAR ISI... v DAFTAR TABEL... viii DAFTAR GAMBAR... ix DAFTAR LAMPIRAN...xi BAB I PENDAHULUAN 1.1 Latar Belakang... 1 1.2 Rumusan Masalah... 3 1.3 Batasan
DAFTAR ISI ABSTRAK... i KATA PENGANTAR... ii DAFTAR ISI... v DAFTAR TABEL... viii DAFTAR GAMBAR... ix DAFTAR LAMPIRAN...xi BAB I PENDAHULUAN 1.1 Latar Belakang... 1 1.2 Rumusan Masalah... 3 1.3 Batasan
Ari Harnanto Ruminten. Kimia 3. Untuk SMA/MA Kelas XII
 Ari Harnanto Ruminten Kimia 3 Untuk SMA/MA Kelas XII Hak Cipta pada Departemen Pendidikan Nasional Dilindungi oleh Undang-undang Kimia 3 Untuk SMA/MA Kelas XII Disusun oleh: Ari Harnanto Ruminten Editor
Ari Harnanto Ruminten Kimia 3 Untuk SMA/MA Kelas XII Hak Cipta pada Departemen Pendidikan Nasional Dilindungi oleh Undang-undang Kimia 3 Untuk SMA/MA Kelas XII Disusun oleh: Ari Harnanto Ruminten Editor
PENENTUAN BERAT MOLEKUL MELALUI METODE PENURUNAN TITIK BEKU (CRYOSCOPIC)
 PENENTUAN BERAT MOLEKUL MELALUI METODE PENURUNAN TITIK BEKU (CRYOSCOPIC) A. TUJUAN PERCOBAAN Dapat menentukan berat molekul zat non-elektrolit melalui penurunan titik beku larutan, dan menentukan persentase
PENENTUAN BERAT MOLEKUL MELALUI METODE PENURUNAN TITIK BEKU (CRYOSCOPIC) A. TUJUAN PERCOBAAN Dapat menentukan berat molekul zat non-elektrolit melalui penurunan titik beku larutan, dan menentukan persentase
ARTIKEL ILMIAH PENGEMBANGAN MULTIMEDIA CROCODILLE CHEMISTRY MENGGUNAKAN CAMTASIA STUDIO 7 PADA MATERI SIFAT KOLIGATIF LARUTAN KELAS XII SMAN 2 JAMBI
 ARTIKEL ILMIAH PENGEMBANGAN MULTIMEDIA CROCODILLE CHEMISTRY MENGGUNAKAN CAMTASIA STUDIO 7 PADA MATERI SIFAT KOLIGATIF LARUTAN KELAS XII SMAN 2 JAMBI OLEH : UMI OKTAVIANI RRA1C109003 FAKULTAS KEGURUAN DAN
ARTIKEL ILMIAH PENGEMBANGAN MULTIMEDIA CROCODILLE CHEMISTRY MENGGUNAKAN CAMTASIA STUDIO 7 PADA MATERI SIFAT KOLIGATIF LARUTAN KELAS XII SMAN 2 JAMBI OLEH : UMI OKTAVIANI RRA1C109003 FAKULTAS KEGURUAN DAN
YAYASAN BINA SEJAHTERA SMK BINA SEJAHTERA 2 BOGOR Jl. Ledeng Sindangsari No. 05 Bogor Jl. Radar baru no. 08 Bogor ULANGAN SEMESTER GANJIL
 : XI (Semua Jurusan) Jawablah pertanyaan-pertanyaan di bawah ini dengan benar! 1. Apa yang dimaksud dengan pengertian istilah-istilah berikut : a. ikatan ionik b. reaksi basa c. reaksi reduksi d. reaksi
: XI (Semua Jurusan) Jawablah pertanyaan-pertanyaan di bawah ini dengan benar! 1. Apa yang dimaksud dengan pengertian istilah-istilah berikut : a. ikatan ionik b. reaksi basa c. reaksi reduksi d. reaksi
Soal ini terdiri dari 10 soal Essay (153 poin)
 Bidang Studi Kode Berkas : Kimia : KI-L01 (soal) Soal ini terdiri dari 10 soal Essay (153 poin) Tetapan Avogadro N A = 6,022 10 23 partikel.mol 1 Tetapan Gas Universal R = 8,3145 J.mol -1.K -1 = 0,08206
Bidang Studi Kode Berkas : Kimia : KI-L01 (soal) Soal ini terdiri dari 10 soal Essay (153 poin) Tetapan Avogadro N A = 6,022 10 23 partikel.mol 1 Tetapan Gas Universal R = 8,3145 J.mol -1.K -1 = 0,08206
MODUL I SIFAT KOLIGATIF LARUTAN Penurunan Titik Beku Larutan
 MODUL I SIFAT KOLIGATIF LARUTAN Penurunan Titik Beku Larutan - Siswa mampu membuktikan penurunan titik beku larutan akibat penambahan zat terlarut. - Siswa mampu membedakan titik beku larutan elektrolit
MODUL I SIFAT KOLIGATIF LARUTAN Penurunan Titik Beku Larutan - Siswa mampu membuktikan penurunan titik beku larutan akibat penambahan zat terlarut. - Siswa mampu membedakan titik beku larutan elektrolit
Sifat Koligatif Larutan (Bagian I)
 KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 01 Sesi NGAN Sifat Koligatif Larutan (Bagian I) Sebelum mempelajari sifat koligatif larutan, terlebih dahulu kita akan meninjau kembali sedikit pengetahuan mengenai
KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 01 Sesi NGAN Sifat Koligatif Larutan (Bagian I) Sebelum mempelajari sifat koligatif larutan, terlebih dahulu kita akan meninjau kembali sedikit pengetahuan mengenai
4. Sebanyak 3 gram glukosa dimasukkan ke dalam 36 gram air akan diperoleh fraksi mol urea sebesar.
 LATIHAN ULUM 1. Sebutkan kegunaan dari sifat koligarif larutan. 2. Sebanyak 27 gram urea ditimbang dan dimasukkan ke dalam 500 gram. Berapakah molalitas larutan yang terjadi?. 3. Apa definisi dari 4. Sebanyak
LATIHAN ULUM 1. Sebutkan kegunaan dari sifat koligarif larutan. 2. Sebanyak 27 gram urea ditimbang dan dimasukkan ke dalam 500 gram. Berapakah molalitas larutan yang terjadi?. 3. Apa definisi dari 4. Sebanyak
LAPORAN PRAKTIKUM KIMIA FISIK VOLUM MOLAL PARSIAL. Nama : Ardian Lubis NIM : Kelompok : 6 Asisten : Yuda Anggi
 LAPORAN PRAKTIKUM KIMIA FISIK VOLUM MOLAL PARSIAL Nama : Ardian Lubis NIM : 121810301028 Kelompok : 6 Asisten : Yuda Anggi LABORATORIUM KIMIA FISIK JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
LAPORAN PRAKTIKUM KIMIA FISIK VOLUM MOLAL PARSIAL Nama : Ardian Lubis NIM : 121810301028 Kelompok : 6 Asisten : Yuda Anggi LABORATORIUM KIMIA FISIK JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
Stoikiometri. Berasal dari kata Stoicheion (partikel) dan metron (pengukuran). Cara perhitungan dan pengukuran zat serta campuran kimia.
 Stoikiometri Berasal dari kata Stoicheion (partikel) dan metron (pengukuran). Cara perhitungan dan pengukuran zat serta campuran kimia. Bilangan Avogadro Stoikometri: pengukuran kuantitatif sehingga perlu
Stoikiometri Berasal dari kata Stoicheion (partikel) dan metron (pengukuran). Cara perhitungan dan pengukuran zat serta campuran kimia. Bilangan Avogadro Stoikometri: pengukuran kuantitatif sehingga perlu
SKL- 3: LARUTAN. Ringkasan Materi. 1. Konsep Asam basa menurut Arrhenius. 2. Konsep Asam-Basa Bronsted dan Lowry
 SKL- 3: LARUTAN 3 Menjelaskan sifat-sifat larutan, metode pengukuran dan terapannya. o Menganalisis data daya hantar listrik beberapa larutan o Mendeskripsikan konsep ph larutan o Menghitung konsentrasi
SKL- 3: LARUTAN 3 Menjelaskan sifat-sifat larutan, metode pengukuran dan terapannya. o Menganalisis data daya hantar listrik beberapa larutan o Mendeskripsikan konsep ph larutan o Menghitung konsentrasi
MODUL KIMIA SMA IPA Kelas 10
 SMA IPA Kelas 10 Perbedaan Larutan Elektrolit dan Nonelektrolit Larutan adalah campuran homogen dari dua zat atau lebih, larutan tersusun dari pelarut (solvent) dan zat terlarut (solute). Berdasarkan keelektrolitannya,
SMA IPA Kelas 10 Perbedaan Larutan Elektrolit dan Nonelektrolit Larutan adalah campuran homogen dari dua zat atau lebih, larutan tersusun dari pelarut (solvent) dan zat terlarut (solute). Berdasarkan keelektrolitannya,
Bibliografi : hlm. 297 Indeks ISBN (No. Jil Lengkap) ISBN
 PUSAT PERBUKUAN Departemen Pendidikan Nasional ak ipta Pada Departemen Pendidikan Nasional dilindungi oleh Undang-Undang Mudah dan Aktif Belajar Kimia untuk Kelas XII Sekolah Menengah Atas/Madrasah Aliyah
PUSAT PERBUKUAN Departemen Pendidikan Nasional ak ipta Pada Departemen Pendidikan Nasional dilindungi oleh Undang-Undang Mudah dan Aktif Belajar Kimia untuk Kelas XII Sekolah Menengah Atas/Madrasah Aliyah
BAB II TINJAUAN PUSTAKA. Dalam dunia pendidikan, strategi diartikan sebagai a plan, method, or
 BAB II TINJAUAN PUSTAKA 2.1 Strategi Pembelajaran Dalam dunia pendidikan, strategi diartikan sebagai a plan, method, or series of activities designed to achieves a particular educational goal (David, 1976
BAB II TINJAUAN PUSTAKA 2.1 Strategi Pembelajaran Dalam dunia pendidikan, strategi diartikan sebagai a plan, method, or series of activities designed to achieves a particular educational goal (David, 1976
TUGAS KIMIA DASAR LARUTAN
 TUGAS KIMIA DASAR LARUTAN OLEH ANDRE YULANDA MISWAR : 111 0913 049 DEONA ERION : 111 0913 047 EKO FIRMANTO : 111 0913 048 DOSEN INDRAWATI JURUSAN TEKNIK MESIN FAKULTAS TEKNIK UNIVERSITAS ANDALAS PADANG
TUGAS KIMIA DASAR LARUTAN OLEH ANDRE YULANDA MISWAR : 111 0913 049 DEONA ERION : 111 0913 047 EKO FIRMANTO : 111 0913 048 DOSEN INDRAWATI JURUSAN TEKNIK MESIN FAKULTAS TEKNIK UNIVERSITAS ANDALAS PADANG
BAB III HASIL PENELITIAN
 BAB III HASIL PENELITIAN A. Gambaran Umum Buku Teks Kimia SMA Kelas X 1. Identitas Buku Teks Kimia SMA Kelas X Buku yang menjadi obyek penelitian peneliti adalah buku teks kimia SMA kelas X jilid 1 materi
BAB III HASIL PENELITIAN A. Gambaran Umum Buku Teks Kimia SMA Kelas X 1. Identitas Buku Teks Kimia SMA Kelas X Buku yang menjadi obyek penelitian peneliti adalah buku teks kimia SMA kelas X jilid 1 materi
BAB 8. Jika Anda memasukkan satu sendok gula ke dalam segelas air, kemudian Anda. Kelarutan Garam Sukar Larut. Kata Kunci.
 Kimia XI SMA 205 BAB 8 Kelarutan Garam Sukar Larut Gambar Larutan Tujuan Pembelajaran: Setelah mempelajari bab ini, Anda diharapkan mampu: 1. Menjelaskan kesetimbangan dalam larutan jenuh atau larutan
Kimia XI SMA 205 BAB 8 Kelarutan Garam Sukar Larut Gambar Larutan Tujuan Pembelajaran: Setelah mempelajari bab ini, Anda diharapkan mampu: 1. Menjelaskan kesetimbangan dalam larutan jenuh atau larutan
Jurnal sains kimia Vol.II No.2,2010 PENURUNAN TITIK BEKU LARUTAN
 Jurnal sains kimia Vol.II No.2,200 PENURUNAN TITIK BEKU LARUTAN Rohayati, Nova Safitri Lab.Kimia Fisika Jurusan Kimia Universitas Negeri Semarang Kode Pos 50229 Gedung D8 Lt 2 Sekaran Gunungpati Semarang,
Jurnal sains kimia Vol.II No.2,200 PENURUNAN TITIK BEKU LARUTAN Rohayati, Nova Safitri Lab.Kimia Fisika Jurusan Kimia Universitas Negeri Semarang Kode Pos 50229 Gedung D8 Lt 2 Sekaran Gunungpati Semarang,
LAPORAN PRAKTIKUM KIMIA FISIK I PERCOBAAN IX ENTALPI DAN ENTROPI PELEBURAN
 LAPORAN PRAKTIKUM KIMIA FISIK I PERCOBAAN IX ENTALPI DAN ENTROPI PELEBURAN OLEH: NAMA : MUH. YAMIN A. STAMBUK : F1C1 08 049 KELOMPOK ASISTEN PEMBIMBING : III : IMA ISMAIL JURUSAN KIMIA FAKULTAS MATEMATIKA
LAPORAN PRAKTIKUM KIMIA FISIK I PERCOBAAN IX ENTALPI DAN ENTROPI PELEBURAN OLEH: NAMA : MUH. YAMIN A. STAMBUK : F1C1 08 049 KELOMPOK ASISTEN PEMBIMBING : III : IMA ISMAIL JURUSAN KIMIA FAKULTAS MATEMATIKA
BAB I STOIKHIOMETRI I - 1
 BAB I STOIKHIOMETRI 1.1 PENDAHULUAN Setiap zat, unsur, senyawa dalam kimia mempunyai nama dan rumus uniknya sendiri. Cara tersingkat untuk memerikan suatu reaksi kimia adalah dengan menuliskan rumus untuk
BAB I STOIKHIOMETRI 1.1 PENDAHULUAN Setiap zat, unsur, senyawa dalam kimia mempunyai nama dan rumus uniknya sendiri. Cara tersingkat untuk memerikan suatu reaksi kimia adalah dengan menuliskan rumus untuk
Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam
 Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam sistem pada kesetimbangan Uap mengembun dengan laju
Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam sistem pada kesetimbangan Uap mengembun dengan laju
STOIKIOMETRI Konsep mol
 STOIKIOMETRI Konsep mol Dalam hukum-hukum dasar materi ditegaskan bahwa senyawa terbentuk dari unsur bukan dengan perbandingan sembarang tetapi dalam jumlah yang spesifik, demikian juga reaksi kimia antara
STOIKIOMETRI Konsep mol Dalam hukum-hukum dasar materi ditegaskan bahwa senyawa terbentuk dari unsur bukan dengan perbandingan sembarang tetapi dalam jumlah yang spesifik, demikian juga reaksi kimia antara
Kelarutan & Gejala Distribusi
 PRINSIP UMUM Kelarutan & Gejala Distribusi Oleh : Lusia Oktora RKS, S.F.,M.Sc., Apt Larutan jenuh : suatu larutan dimana zat terlarut berada dalam kesetimbangan dengan fase padat (zat terlarut). Kelarutan
PRINSIP UMUM Kelarutan & Gejala Distribusi Oleh : Lusia Oktora RKS, S.F.,M.Sc., Apt Larutan jenuh : suatu larutan dimana zat terlarut berada dalam kesetimbangan dengan fase padat (zat terlarut). Kelarutan
BAB 2 TINJAUAN PUSTAKA. cara. Secara umum strategi ialah suatu garis besar haluan dalam bertindak
 BAB 2 TINJAUAN PUSTAKA A. Strategi Pembelajaran 1) Pengertian Strategi Pembelajaran Secara bahasa, strategi bisa diartikan sebagai siasat, kiat, trik atau cara. Secara umum strategi ialah suatu garis besar
BAB 2 TINJAUAN PUSTAKA A. Strategi Pembelajaran 1) Pengertian Strategi Pembelajaran Secara bahasa, strategi bisa diartikan sebagai siasat, kiat, trik atau cara. Secara umum strategi ialah suatu garis besar
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
MODUL 3 LARUTAN. A. Sifat Dasar Larutan. B. Konsentrasi Larutan
 MODUL 3 LARUTAN A. Sifat Dasar Larutan Larutan adalah campuran yang bersifat homogen antara molekul, atom ataupun ion dari dua zat atau lebih. Disebut campuran karena susunannya atau komposisinya dapat
MODUL 3 LARUTAN A. Sifat Dasar Larutan Larutan adalah campuran yang bersifat homogen antara molekul, atom ataupun ion dari dua zat atau lebih. Disebut campuran karena susunannya atau komposisinya dapat
A. Pengertian larutan B. Jenis-jenis larutan C. Sifat larutan
 A. Pengertian larutan Larutan didefinisikan sebagai campuran homogen antara dua atau lebih zat yang terdispersi baik sebagai molekul, atom maupun ion yang komposisinya dapat bervariasi. Larutan dapat berupa
A. Pengertian larutan Larutan didefinisikan sebagai campuran homogen antara dua atau lebih zat yang terdispersi baik sebagai molekul, atom maupun ion yang komposisinya dapat bervariasi. Larutan dapat berupa
D kj/mol E kj/mol
 1. Dari data : 2H 2 (g) + O 2 (g) 2H 2 O (l) H = -571 kj 2Ca (s) + O 2 (g) 2CaO(s) H = -1269 kj CaO (s) + H 2 O (l) Ca(OH)2(s) H = -64 kj Dapat dihitung entalpi pembentukan Ca(OH) 2 (s) sebesar... A. -984
1. Dari data : 2H 2 (g) + O 2 (g) 2H 2 O (l) H = -571 kj 2Ca (s) + O 2 (g) 2CaO(s) H = -1269 kj CaO (s) + H 2 O (l) Ca(OH)2(s) H = -64 kj Dapat dihitung entalpi pembentukan Ca(OH) 2 (s) sebesar... A. -984
LARUTAN. Zat terlarut merupakan komponen yang jumlahnya sedikit, sedangkan pelarut adalah komponen yang terdapat dalam jumlah banyak.
 LARUTAN Larutan merupakan campuran yang homogen,yaitu campuran yang memiliki komposisi merata atau serba sama di seluruh bagian volumenya. Suatu larutan mengandung dua komponen atau lebih yang disebut
LARUTAN Larutan merupakan campuran yang homogen,yaitu campuran yang memiliki komposisi merata atau serba sama di seluruh bagian volumenya. Suatu larutan mengandung dua komponen atau lebih yang disebut
Pemicu III : Larutan
 Pemicu III : Larutan Rizki Romadhon Akbar ( 0906635734) Rizqi Pandu S (0906557045) Ryan Januar Rusli (0906635753) Samhani Mahendra W. (0906635766) Zulfikar N. (0806456902) i MIND MAP ii Daftar Isi Kata
Pemicu III : Larutan Rizki Romadhon Akbar ( 0906635734) Rizqi Pandu S (0906557045) Ryan Januar Rusli (0906635753) Samhani Mahendra W. (0906635766) Zulfikar N. (0806456902) i MIND MAP ii Daftar Isi Kata
Fraksi mol adalah perbandingan antara jumiah mol suatu komponen dengan jumlah mol seluruh komponen yang terdapat dalam larutan.
 Konsentrasi Larutan Ditulis oleh Redaksi chem-is-try.org pada 02-05-2009 Konsentrasi merupakan cara untuk menyatakan hubungan kuantitatif antara zat terlarut dan pelarut. Menyatakan konsentrasi larutan
Konsentrasi Larutan Ditulis oleh Redaksi chem-is-try.org pada 02-05-2009 Konsentrasi merupakan cara untuk menyatakan hubungan kuantitatif antara zat terlarut dan pelarut. Menyatakan konsentrasi larutan
LARUTAN ELEKTROLIT DAN NON ELEKTROLIT
 BAB 6 LARUTAN ELEKTROLIT DAN NON ELEKTROLIT Standar Kompetensi Memahami sifat-sifat larutan non elektrolit dan elektrolit, serta reaksi oksidasi-reduksi Kompetensi Dasar Mengidentifikasi sifat larutan
BAB 6 LARUTAN ELEKTROLIT DAN NON ELEKTROLIT Standar Kompetensi Memahami sifat-sifat larutan non elektrolit dan elektrolit, serta reaksi oksidasi-reduksi Kompetensi Dasar Mengidentifikasi sifat larutan
UNIVERSITAS NEGERI YOGYAKARTA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM SILABUS
 UNIVERSITAS NEGERI YOGYAKARTA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM SILABUS I. Fakultas : Matematika Ilmu Pengetahuan Alam Program Studi : Kimia Mata Kuliah : Kimia I Semester : 1 Dosen : Dini
UNIVERSITAS NEGERI YOGYAKARTA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM SILABUS I. Fakultas : Matematika Ilmu Pengetahuan Alam Program Studi : Kimia Mata Kuliah : Kimia I Semester : 1 Dosen : Dini
PETA KONSEP LAJU REAKSI. Percobaan. Waktu perubahan. Hasil reaksi. Pereaksi. Katalis. Suhu pereaksi. Konsentrasi. Luas. permukaan.
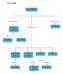 PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
K I M I A. UNTUK SMA dan MA KELAS XII Program Ilmu Alam
 K I M I A UNTUK SMA dan MA KELAS XII Program Ilmu Alam Penulis: Budi Utami, Agung Nugroho Catur Saputro, Lina Mahardiani, Sri Yamtinah, Bakti Mulyani. ii Kimia XII SMA Hak Cipta pada Departemen Pendidikan
K I M I A UNTUK SMA dan MA KELAS XII Program Ilmu Alam Penulis: Budi Utami, Agung Nugroho Catur Saputro, Lina Mahardiani, Sri Yamtinah, Bakti Mulyani. ii Kimia XII SMA Hak Cipta pada Departemen Pendidikan
LAMPIRAN C CCT pada Materi Ikatan Ion
 LAMPIRAN C CCT pada Materi Ikatan Ion 1 IKATAN ION A. KECENDERUNGAN ATOM UNTUK STABIL Gas mulia merupakan sebutan untuk unsur golongan VIIIA. Unsur unsur ini bersifat inert (stabil). Hal ini dikarenakan
LAMPIRAN C CCT pada Materi Ikatan Ion 1 IKATAN ION A. KECENDERUNGAN ATOM UNTUK STABIL Gas mulia merupakan sebutan untuk unsur golongan VIIIA. Unsur unsur ini bersifat inert (stabil). Hal ini dikarenakan
Hubungan koefisien dalam persamaan reaksi dengan hitungan
 STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
PERCOBAAN VII PEMBUATAN KALIUM NITRAT
 I. Tujuan Percobaan ini yaitu: PERCOBAAN VII PEMBUATAN KALIUM NITRAT Adapun tujuan yang ingin dicapai praktikan setelah melakukan percobaan 1. Memisahkan dua garam berdasarkan kelarutannya pada suhu tertentu
I. Tujuan Percobaan ini yaitu: PERCOBAAN VII PEMBUATAN KALIUM NITRAT Adapun tujuan yang ingin dicapai praktikan setelah melakukan percobaan 1. Memisahkan dua garam berdasarkan kelarutannya pada suhu tertentu
kimia Kelas X LARUTAN ELEKTROLIT DAN NONELEKTROLIT K-13 A. Pengertian Larutan dan Daya Hantar Listrik
 K-13 Kelas X kimia LARUTAN ELEKTROLIT DAN NONELEKTROLIT Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami perbedaan antara larutan elektrolit dan
K-13 Kelas X kimia LARUTAN ELEKTROLIT DAN NONELEKTROLIT Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami perbedaan antara larutan elektrolit dan
KISI KISI SOAL ULANGAN AKHIR SEMESTER GASAL MADRASAH ALIYAH TAHUN PELAJARAN 2015/2016
 KISI KISI SOAL ULANGAN AKHIR SEMESTER GASAL MADRASAH ALIYAH TAHUN PELAJARAN 205/206 MATA PELAJARAN KELAS : KIMIA : XII IPA No Stansar Materi Jumlah Bentuk No Kompetensi Dasar Inikator Silabus Indikator
KISI KISI SOAL ULANGAN AKHIR SEMESTER GASAL MADRASAH ALIYAH TAHUN PELAJARAN 205/206 MATA PELAJARAN KELAS : KIMIA : XII IPA No Stansar Materi Jumlah Bentuk No Kompetensi Dasar Inikator Silabus Indikator
KATA PENGANTAR. Wassalamualaikum Wr. Wb. Palembang, Oktober Penyusun
 KATA PENGANTAR Assalamualikum Wr.Wb Puji syukur senatiasa kami panjatkan kehadirat Allah SWT, karena atas segala limpahan rahmat dan hidayah-nya kami dapat menyelesaikan Makalah Kimia ini dengan baik dan
KATA PENGANTAR Assalamualikum Wr.Wb Puji syukur senatiasa kami panjatkan kehadirat Allah SWT, karena atas segala limpahan rahmat dan hidayah-nya kami dapat menyelesaikan Makalah Kimia ini dengan baik dan
