KOMPATIBILITAS Bacillus spp. DAN AKTINOMISET SEBAGAI AGENS HAYATI Xanthomonas oryzae pv. oryzae DAN PEMICU PERTUMBUHAN PADI M.
|
|
|
- Iwan Rachman
- 7 tahun lalu
- Tontonan:
Transkripsi
1 1 KOMPATIBILITAS Bacillus spp. DAN AKTINOMISET SEBAGAI AGENS HAYATI Xanthomonas oryzae pv. oryzae DAN PEMICU PERTUMBUHAN PADI M. CANDRA PUTRA DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN INSTITUT PERTANIAN BOGOR BOGOR 2011
2 i ABSTRAK M. CANDRA PUTRA. Kompatibilitas Bacillus spp. dan Aktinomiset sebagai Agens Hayati Xanthomonas oryzae pv. oryzae dan Pemicu Pertumbuhan Padi. Dibimbing oleh GIYANTO. Penyakit hawar daun bakteri adalah salah satu penyakit penting pada tanaman padi yang disebabkan oleh bakteri Xanthomonas oryzae pv. oryzae. Bakteri ini dapat terbawa benih dan bertahan dalam waktu yang lama. Beberapa mikroba diketahui berpotensi sebagai agens hayati patogen ini, seperti Bacillus spp. dan aktinomiset. Bacillus spp. dan aktinomiset telah diketahui menghasilkan antibiotik yang dapat menghambat perkembangan bakteri patogen dan menghasilkan spora yang dapat bertahan pada kondisi ekstrim. Penelitian ini bertujuan untuk mendapatkan isolat aktinomiset sebagai agens hayati patogen X. oryzae pv. oryzae dan kompatibel terhadap Bacillus spp.yang dapat diaplikasikan pada benih padi. Aktinomiset yang diisolasi tanah, diseleksi dengan metode pembiakkan ganda pada media agar dan media tumbuh berupa tanah dan pupuk kandang (1:1). Dari 16 isolat aktinomiset yang berhasil diisolasi, terdapat tiga isolat yang bersifat antagonis terhadap patogen X. oryzae pv. oryzae dan kompatibel terhadap Bacillus spp., yaitu APS7, APS9, dan APS12. Bacillus spp. dan aktinomiset diaplikasikan pada benih padi varietas Ciherang dengan metode pelapisan benih (seed coating) dan bahan pembawa yang digunakan ialah tepung dengan arang sekam sebagai komposisi utamanya. Aplikasi Bacillus spp. dan aktinomiset pada benih padi dapat menurunkan populasi patogen X. oryzae pv. oryzae pada bibit padi serta meningkatkan pertumbuhan bibit padi. Perlakuan aktinomiset dengan kode isolat APS9 dapat menekan populasi X. oryzae pv. oryzae sebesar 88,89%. Perlakuan B12+APS7 merupakan perlakuan dengan hasil persen kemunculan bibit paling tinggi di antara perlakuan lain, yaitu 83,33% pada 7 HST, diikuti dengan perlakuan APS9 dengan 79%. Perlakuan Bacillus spp. dan aktinomiset juga mampu memicu pertumbuhan tajuk tanaman sebesar 13,35-26,53% pada 7 HST. Kata kunci: Kompatibilitas, Bacillus spp., aktinomiset, agens hayati, padi.
3 ii KOMPATIBILITAS Bacillus spp. DAN AKTINOMISET SEBAGAI AGENS HAYATI Xanthomonas oryzae pv. oryzae DAN PEMICU PERTUMBUHAN PADI M. CANDRA PUTRA Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Departemen Proteksi Tanaman DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN INSTITUT PERTANIAN BOGOR BOGOR 2011
4 iii Judul : Kompatibilitas Bacillus spp. dan Aktinomiset sebagai Agens Hayati Xanthomonas oryzae pv. oryzae dan Pemicu Pertumbuhan Padi Nama : M. Candra Putra NRP : A Disetujui Dosen Pembimbing Dr. Ir. Giyanto, M.Si. NIP Diketahui Ketua Departemen Dr. Ir. Dadang, MSc. NIP Tanggal Lulus:
5 iv RIWAYAT HIDUP Penulis bernama lengkap M. Candra Putra, dilahirkan di Cirebon pada tanggal 30 November Penulis merupakan anak bungsu dari empat bersaudara dari pasangan Mumud Sunaryo dan Mumun Munarsih. Penulis menempuh pendidikan sekolah dasar di Indramayu dan sekolah menengah di Cirebon. Pendidikan sekolah dasar diselesaikan di SDN Kedokan Agung III pada tahun Pendidikan menengah penulis tempuh di SMP Negeri 1 Cirebon, lulus pada tahun Pendidikan kemudian dilanjutkan di SMA Negeri 1 Cirebon selama tiga tahun dan lulus pada tahun Penulis melanjutkan pendidikan di IPB melalui jalur SPMB (Seleksi Penerimaan Mahasiswa Baru) pada tahun 2006, dan pada tahun 2007, penulis diterima sebagai mahasiswa Departemen Proteksi Tanaman, Fakultas Pertanian. Selama menjalani pendidikan di perguruan tinggi, penulis aktif dalam beberapa organisasi. Pada tahun , penulis aktif di Ikatan Kekeluargaan Cirebon-IPB (IKC-IPB) sebagai anggota divisi Hubungan Masyarakat dan Forum Silaturahmi Alumni ESQ IPB (FOSMA IPB) sebagai anggota. Pada tahun 2008, penulis bergabung dalam Himpunan Mahasiswa Proteksi Tanaman (HIMASITA) sebagai anggota Divisi Administrasi Rumah Tangga. Penulis juga aktif dalam beberapa club mitra HIMASITA, yaitu sebagai editor Majalah Metamorfosa dan sebagai anggota di Organic Farming Club serta Entomology Club. Pada Januari 2009 penulis diamanahkan untuk menjadi ketua umum HIMASITA selama satu periode kepengurusan hingga Desember Penulis juga aktif dalam mengikuti Program Kreativitas Mahasiswa (PKM) pada tahun Penulis telah berhasil menghasilkan satu laporan hasil PKM-Pengabdian Masyarakat dan empat laporan PKM-Penelitian.
6 v PRAKATA Segala pujian dan ucapan syukur penulis panjatkan ke hadirat Allah SWT atas segala nikmat dan ridho-nya sehingga penulis dapat menyelesaikan skripsi dengan judul Kompatibilitas Bacillus spp. dan Aktinomiset sebagai Agens Hayati Xanthomonas oryzae pv. oryzae dan Pemicu Pertumbuhan Padi. Penyusunan ini dilakukan berdasarkan atas penelitian yang telah penulis lakukan pada bulan Febuari hingga September 2010 di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman IPB. Penulis ucapkan terima kasih kepada Dr. Ir. Giyanto, M.Si atas bimbingan, nasihat, dan motivasi yang telah diberikan kepada penulis selama pelaksanaan penelitian hingga penyusunan skripsi ini, Dr. Ir. I Wayan Winasa M.Si selaku dosen penguji tamu pada sidang skripsi yang berkenan memberikan saran dan kritik yang membangun, Ir. Titiek S. Yuliani, SU. selaku dosen pembimbing akademik yang telah memberikan bimbingan dan dorongan selama penulis menjadi mahasiswa di Departemen Proteksi Tanaman (DPT). Penulis juga ucapkan terima kasih dan apresiasi yang luar biasa kepada kedua orang tua tercinta atas segala perhatian, dukungan, motivasi, dan doa yang selalu tercurah kepada penulis. Ucapan terimakasih juga penulis ucapkan kepada kakak-kakak tercinta (Sukmawati, Suryanto, Agustina, Boy, dan Iwan) yang selalu memberikan semangat dan nasihat kepada penulis. Terima kasih kepada sahabat-sahabat mahasiswa Departemen Proteksi Tanaman IPB atas semangat dan inspirasi yang diberikan kepada penulis dalam menyelesaikan penyusunan skripsi ini, terutama untuk Redi, Faishol, Adde, Ibnu, Fitrah, Herlie, Lara, Sari, Ita, Dilah, Ana, Yeni serta rekan-rekan DPT lainnya (angkatan 42, 43, 44, dan 45) yang tidak dapat disebutkan satu persatu. Terima kasih kepada rekan-rekan di Laboratorium Bakteriologi Tumbuhan, Mbak Didi, Mbak Nilda, Pak Rustam, Pak Husda, dan Ibu Lia, atas semua bantuan dan nasihat yang diberikan selama penulis melakukan penelitian di Laboratorium Bakteriologi Tumbuhan. Tak lupa pula ucapan terima kasih penulis ucapkan kepada teman-teman kosan Fullhouse dan semua pihak yang telah membantu penulis dalam pelaksanaan penelitian hingga penyusunan skripsi ini. Penulis menyadari bahwa skripsi ini bukan merupakan suatu karya tulis ilmiah yang sempurna. Oleh sebab itu, penulis mengharapkan masukan berupa kritik dan saran yang bersifat membangun dari pembaca. Semoga skripsi ini dapat bermanfaat baik bagi penulis maupun para pembacanya. Bogor, Januari 2011 Penulis
7 vi DAFTAR ISI Halaman DAFTAR TABEL... DAFTAR GAMBAR... DAFTAR LAMPIRAN... viii ix x PENDAHULUAN... 1 Latar Belakang... 1 Tujuan... 4 Manfaat... 4 TINJAUAN PUSTAKA... 5 Pengandalian Hayati... 5 Bacillus spp Aktinomiset... 7 BAHAN DAN METODE... 9 Waktu dan Tempat... 9 Peremajaan Isolat Bacillus spp Isolasi dan Seleksi Aktinomiset sebagai Agens Hayati Uji Kompatibilitas Bacillus spp. dan Aktinomiset Pengujian Aplikasi Bacillus spp. dan Aktinomiset terhadap Penekanan X. oryzae pv. Oryzae dan Pertumbuhan Tanaman Padi Penyiapan Spora Bacillus spp. dan Aktinomiset Penyiapan Formulasi Spora Bacillus spp. dan Aktinomiset pada Bahan Pembawa Berbentuk Tepung Aplikasi Formulasi Bacillus sp. dan Aktinomiset pada Benih Padi... 13
8 vii Pengujian Formulasi Bacillus spp. dan Aktinomiset terhadap Penekanan Populasi X. oryzae pv. oryzae Pengujian Formulasi Spora Bacillus spp. dan Aktinomiset terhadap Pertumbuhan Bibit Padi Analisis Statistik HASIL DAN PEMBAHASAN Isolat Bacillus spp Isolasi dan Seleksi Aktinomiset sebagai Agens Hayati Uji Kompatibilitas Bacillus spp. dan Aktinomiset Pengujian Aplikasi Bacillus spp. dan Aktinomiset terhadap Penekanan X. oryzae pv. Oryzae dan Pertumbuhan Tanaman Padi Pengujian Formulasi Bacillus spp. dan Aktinomiset terhadap Penekanan Populasi X. oryzae pv. oryzae Pengujian Formulasi Spora Bacillus spp. dan Aktinomiset terhadap Pertumbuhan Bibit Padi PENUTUP Kesimpulan Saran DAFTAR PUSTAKA LAMPIRAN... 32
9 viii DAFTAR TABEL Nomor Halaman 1. Perlakuan terhadap benih padi pada pengujian formulasi spora Bacillus spp. dan aktinomiset Daftar isolat aktinomiset hasil isolasi berdasarkan media isolasi Pembentukan zona hambatan oleh aktinomiset terhadap koloni X. oryzae pv. oryzae pada media TSA Pembentukan zona hambatan oleh aktinomiset terhadap koloni Bacillus spp. pada media TSA Pengaruh perlakuan formulasi pada benih padi terhadap populasi X. oryzae pv. oryzae pada bibit padi berumur 7 HST Pengaruh perlakuan formulasi pada benih padi terhadap persen perkecambahan benih Pengaruh perlakuan formulasi pada benih padi terhadap tinggi tajuk rata-rata bibit padi berumur 7 HST... 26
10 ix DAFTAR GAMBAR Nomor Halaman 1 Koloni Bacillus spp. pada media TSA Koloni aktinomiset pada media agar padat dan penampakan mikroskopis Pengaruh uji kompatibilitas bakteri terhadap populasi Bacillus spp. dan aktinomiset pada media tanah dan pupuk kandang steril Pengaruh bibit padi yang tidak diberi perlakuan (kiri) dan yang diberi perlakua B12+APS 7 (kanan)... 26
11 x DAFTAR LAMPIRAN Nomor Halaman 1 Hasil analisis ragam pengujian formulasi spora Bacillus spp. dan Aktinomiset terhadap penekanan populasi X. oryzae pv. oryzaea pada 7 HST Hasil analisis ragam pengaruh perlakuan formulasi spora Bacillus spp. dan aktinomiset pada benih padi terhadap persen kemunculan bibit padi pada 4 HST Hasil analisis ragam pengaruh perlakuan formulasi spora Bacillus spp. dan aktinomiset pada benih padi terhadap persen kemunculan bibit padi pada 5 HST Hasil analisis ragam pengaruh perlakuan formulasi spora Bacillus spp. dan aktinomiset pada benih padi terhadap persen kemunculan bibit padi pada 6 HST Hasil analisis ragam pengaruh perlakuan formulasi spora Bacillus spp. dan aktinomiset pada benih padi terhadap persen kemunculan bibit padi pada 7 HST Hasil analisis ragam pengujian formulasi spora Bacillus spp. dan aktinomiset terhadap tinggi tajuk bibit padi pada 7 HST... 33
12 1 PENDAHULUAN Latar Belakang Permasalahan yang cukup dominan dalam dunia pertanian adalah masalah organisme pengganggu tanaman (OPT), termasuk di Indonesia yang memiliki iklim tropis yang cocok bagi perkembangan patogen penyebab penyakit tanaman. Penyebab penyakit adalah organisme hidup patogenik maupun faktor lingkungan fisik (Agrios, 1988). Kerugian yang sering kali ditimbulkan oleh penyakit tanaman ini antara lain adalah penurunan kualitas dan kuantitas hasil produksi pertanian. Penyakit hawar daun bakteri, atau dikenal juga dengan istilah penyakit kresek, merupakan salah satu penyakit penting pada tanaman padi. Penyakit ini dapat merusak tanaman mulai dari fase bibit hingga generatif. Kerugian yang ditimbulkan bekisar antara 20-30%, bergantung pada varietas yang ditanam dan musim tanam (CAB Internasional 2005, dalam Sulistiani 2009). Penyakit ini disebabkan oleh bakteri X. oryzae pv. oryzae yang bersifat fitopatogenik. Bakteri X. oryzae pv. oryzae ini dapat terbawa benih dan bertahan dalam waktu yang cukup lama. Hal ini dikarenakan bakteri berada pada fase dorman ketika berada pada benih (Singh dan Mathur 2004). Untuk mengamankan produksi akibat serangan OPT, petani seringkali menggunakan pestisida secara berlebihan, sehingga menimbulkan dampak negatif yang tidak diinginkan. Untuk mengurangi penggunaan pestisida, maka diperlukan alternatif pengendalian OPT yang ramah lingkungan. Saat ini, perhatian mulai beralih ke sumber daya biologi dalam meningkatkan kesehatan dan ketahanan tanaman terhadap penyakit, antara lain melalui peran mikroba tanah yang bermanfaat. Mikroba yang bersifat menguntungkan bagi tanaman, termasuk sebagai agens penginduksi ketahanan, hidup di daerah sekitar perakaran (rhizosphere), di mana terdapat eksudat yang dikeluarkan akar sebagai nutrisi bagi mikroba itu sendiri. Mikroba yang banyak diteliti adalah kelompok rizobakteria pemacu pertumbuhan tanaman atau dikenal dengan PGPR (Plant Growth Promoting Rhizocacteria). PGPR merupakan agens pengendali hayati yang menjanjikan dapat menekan OPT di lapang (Nelson 2004).
13 2 Salah satu PGPR yang telah dikembangkan dan dimanfaatkan sebagai agens pengendali biologi adalah Bacillus spp., yang merupakan bakteri Gram positif pendegradasi amilum yang umumnya ditemukan di tanah. Bacillus spp. mampu menghasilkan beberapa jenis antibiotik dan hormon pengatur tumbuh. Di luar negeri Bacillus spp. telah dikomersilkan secara luas sebagai agens antagonis atau sebagai bakteri pemicu pertumbuhan tanaman dalam berbagai merek dagang maupun formulasi. Menurut Fravel et al. (1998) produk-produk tersebut banyak digunakan dalam pengendalian berbagai macam penyakit pada tanaman. Bakteri ini memiliki kemampuan membentuk struktur bertahan berupa endospora, yang memungkinkan organisme ini tahan terhadap kondisi lingkungan yang ekstrim, seperti kadar air yang rendah. Selain Bacillus spp., aktinomiset juga merupakan mikroba yang berpotensi memiliki kemampuan dalam mengendalikan mikoroorganisme penyebab penyakit pada tanaman. Madigan et al (1996) menyatakan bahwa aktinomiset merupakan kelompok besar dari bakteri berbentuk filamen. Fakta mengindikasikan bahwa secara kuantitatif dan kualitatif aktinomiset memiliki peranan yang penting pada rizosfer, di mana aktinomiset berpengaruh terhadap pertumbuhan tanaman dan melindungi perakaran tanaman dari serangan fungi patogen akar. Hal ini menarik banyak ahli mikrobiologi untuk menggunakan aktinomiset sebagai agens hayati dalam mengendalikan patogen tanah. Beberapa hasil penelitian menunjukkan bahwa aktinomiset merupakan kelompok mikroba yang menjanjikan dalam pengendalian biologis (Crawford et al. 1993). Mikroba ini pun telah banyak diketahui dapat menghasilkan beragam antibiotik sebagai metabolit sekundernya (Sabaratnam dan Traquair 2001). Aktinomiset termasuk golongan bakteri Gram positif dan menghasilkan struktur bertahan berupa spora yang dapat bertahan dalam kondisi tidak menguntungkan, seperti rendahnya kadar air dan suhu tinggi serta dapat bertahan dalam waktu yang lama. Tidak seperti bakteri penghasil spora lainnya, aktinomiset memproduksi spora sebagai cara utama bakteri ini dalam melakukan pemencaran atau dispersal (Schaad et al. 2000). Aktinomiset dikenal sebagai bakteri yang bersifat saprofit dan sangat umum dijumpai di rhizosfer hingga lapisan tanah dalam. Menurut Schaad et al. (2000), dari sekitar 400 spesies
14 3 Streptomyces, sangat sedikit yang diketahui menjadi patogen pada tanaman. Isolasi aktinomiset dari jaringan tanaman dan lahan pertanian sering kali diperoleh aktinomiset yang bersifat saprofitik. Baik Bacillus spp. maupun aktinomiset, keduanya dapat menghasilkan spora yang dapat bertahan pada kondisi ekstrim, seperti rendahnya kadar air. Berdasarkan persamaan sifat ini, maka kedua mikroba ini berpotensi untuk dapat diaplikasikan pada bahan pembawa dalam bentuk kering berupa tepung. Hal ini dilakukan agar Bacillus spp. maupun aktinomiset dapat digunakan dalam pengendalian penyakit tanaman yang efektif dan aman bagi manusia serta lingkungan sekitarnya. Bahan pembawa dalam bentuk tepung juga dinilai lebih efisien dalam penggunaannya karena lebih mudah diaplikasikan. Selain itu, mikroba dalam bahan pembawa berbentuk tepung memiliki umur simpan yang relatif lebih panjang karena mikroba berada dalam fase dorman, yaitu dalam bentuk spora yang dapat bertahan dalam waktu yang cenderung lebih lama daripada bentuk sel vegetatifnya. Kondisi tersebut tentu didukung dengan terjaganya kadar air dalam tepung tersebut agar tetap rendah. Penggunaan bahan pembawa yang tepat dan murah pun akan menjadikan aplikasi mikroba dalam bentuk tepung menjadi dinilai lebih efektif dan efisien bagi penggunanya. Muis (2006) melaporkan bahwa penggunaan beberapa bahan, seperti talc, tepung beras, tepung singkong, abu pegunungan, dan arang, dengan konsentrasi tertentu dapat menjadi bahan pembawa bagi mikroba yang baik pada perlakuan benih dengan metode seed coating. Hasil penelitian Putra et al. (2009) aplikasi Bacillus spp. pada benih padi dengan bahan pembawa 70% tepung singkong, 1% tepung cangkang udang, 1% ragi, 10% dedak halus, dan 18% talc mampu menghambat pertumbuhan patogen X. oryzae pv. oryzae sebesar 96,6% serta meningkatkan tinggi tajuk tanaman padi sebesar 6,83% pada usia 3 minggu setelah tanam. Namun, untuk membuat suatu formulasi yang mengandung lebih dari satu jenis mikroba, terlebih dahulu diperlukan adanya kajian mengenai kompatibilitas mikroba tersebut. Hal ini diperlukan agar mikroba yang digunakan tidak saling meniadakan karena memiliki sifat antagonis antar keduanya. Oleh sebab itu, penelitian ini akan mengkaji kompatibilitas Bacillus spp. dan aktinomiset,
15 4 kemampuan keduanya dalam menekan patogen yang menyebabkan penyakit pada tanaman, serta peranannya dalam mendukung pertumbuhan tanaman. Tujuan Penelitian ini bertujuan untuk mendapatkan isolat aktinomiset sebagai agens hayati patogen X. oryzae pv. oryzae penyebab penyakit hawar daun bakteri dan mengetahui kompatibilitasnya terhadap Bacillus spp.yang dapat diaplikasikan pada benih padi. Manfaat Manfaat dari penelitian ini berupa informasi dan data isolat aktinomiset sebagai agens hayati patogen X. oryzae pv. oryzae penyebab penyakit hawar daun bakteri dan kompatibilitasnya terhadap Bacillus spp.yang dapat diaplikasikan pada benih padi dalam rangka penyediaan teknik pengendalian alternatif patogen X. oryzae pv. oryzae.
16 5 TINJAUAN PUSTAKA Pengendalian Hayati Pengendalian hayati adalah proses pengurangan kepadatan inokulum atau aktivitas patogen dalam menimbulkan penyakit yang berada dalam keadaan aktif maupun dorman oleh satu atau lebih oragisme baik secara aktif maupun manipulasi lingkungan dan inang, dengan menggunakan agens antagonis, atau dengan mengintroduksi secara massal satu atau lebih organisme antagonis (Baker dan Cook 1974). Pada dasarnya manusia telah melakukan pengendalian hayati sejak manusia mengenal budidaya pertanian dan munculnya OPT yang merugikan. Suwahyono (2010) mengemukakan bahwa pengendalian hayati yang dilakukan saat itu hanya bersifat percobaan berdasarkan pengalaman, dengan pendekatan ilmiah yang minim. Saat muncul Revolusi Hijau, kegiatan pengendalian hayati sempat jarang dilakukan karena penggunaan bahan kimia sintetik dinilai lebih efektif dan efisien dalam mengendalikan OPT. Namun beberapa dekade belakangan ini, seiring dengan perkembangan dunia pertanian dan merebaknya isu lingkungan, penggunaan bahan kimia sintetik mulai dikurangi secara bertahap. Pengendalian hayati pun mulai gencar dilakukan kembali karena dinilai lebih ramah lingkungan. Penggunaan organisme hidup sebagai agens antagonis dalam mengendalikan OPT mulai dilakukan dengan pendekatan ilmiah yang lebih jauh dan perkembangannya tampak semakin pesat. Agens antagonis dapat berupa mikroorganisme yang dapat mempengaruhhi kemampuan bertahan atau berpengaruh negatif terhadap aktivitas patogen dalam menimbulkan penyakit (Agrios 1997). Bacillus spp. Bacillus spp. ialah kelompok bakteri yang umum ditemukan di berbagai lingkungan ekologi, baik di tanah, air, maupun udara. Bakteri ini merupakan bakteri Gram positif yang dapat membentuk endospora yang berbentuk oval di bagian sentral sel. Spora berfungsi untuk bertahan hidup antara lain pada suhu dan kondisi lingkungan yang ekstrim. Sel Bacillus spp. berbentuk batang, berukuran
17 6 0,3-2,2 x 1,2-7,0 µm dan mempunyai flagel peritrikus. Bakteri ini dapat tumbuh pada suhu 45 C, ph 5-7, NaCl 7%, menghidrolisis pati, serta membentuk asam sitrat dari karbohidrat glukosa, arabinosa, manitol, dan silosa (Sonenshein et al. 2002). Pada umumnya Bacillus spp. dapat digunakan sebagai agens biokontrol terhadap patogen tanaman walaupun diketahui terdapat strain yang dapat membusukkan biji kedelai. Biji kedelai yang diinokulasikan B. subtilis strain virulen (isolat VS) pada suhu C dan kelembaban udara relatif 98% akan menunjukkan busuk berlendir 5 hari setelah inokulasi. (Sinclair dan Backman 1989, dalam Desmawati 2006). Bakteri Bacillus spp. yang bersifat antagonis mampu menekan pertumbuhan mikroorganisme lain karena memproduksi antibiotik berupa lipopeptida yang disebut basitrasin dengan mekanisme merusak membran sel bakteri (Leary dan Chan 1988, dalam Desmawati 2006). Jenis metabolit sekunder lain yang diproduksi Bacillus spp. adalah bio-surfaktan yang disebut surfaktin atau subtilisin. Surfaktin merupakan lipopeptida siklik yang berfungsi menurunkan tegangan permukaan air dan juga bersifat antibiotik (Hommel dan Ratledge 1933, Desai dan Desai 1933, dalam Dirmawati 2004). Sebagian besar anggota Bacillus spp. tidak dianggap sebagai bakteri patogen terhadap manusia, walaupun dapat mengkontaminasi makanan, namun jarang menimbulkan keracunan (Sonenshein,et al. 2002). Schaad et al. (2000) menyatakan bahwa hanya terdapat tiga kelompok Bacillus yang diketahui sebagai patogen tanaman, yaitu B. circulans, B. megaterium pv. cerealis, dan B. polymyxa. Bacillus spp. memiliki aktivitas antifungal yang tinggi (Jing dan Qian 2007) dan berperan dalam menekan beberapa fungi yang bersifat patogen, seperti Rhizoctonia, Fusarium (Zhang et al. 2009) dan Aspergilus (Muis 2006). Selain memiliki kemampuan dalam menekan perkembangan fitopatogen, Bacillus spp. pun diketahui dalam mendukung pertumbuhan tanaman. McQuilken et al. (1998) mengemukakan bahwa aplikasi Bacillus spp. pada benih kedelai mampu mengurangi kerusakan bibit karena kerusakan saat imbibisi. Selain itu, perlakuan benih dengan Bacillus spp. untuk merangsang pertumbuhan tanaman dan
18 7 membantu mengurangi patogen terbawa benih telah menjadi bahan penelitian yang menarik selama lebih dari 20 tahun terakhir. Aktinomiset Aktinomiset adalah kelompok besar dari bakteri berfilamen, umumnya bersifat Gram positif, dan membentuk filament yang bercabang. Pertumbuhan aktinomiset yang sukses mampu mengahasilkan jaringan berfilamen yang memiliki cabang-cabang yang rumit, disebut juga dengan miselium. Ada juga yang menyebutnya miselia aerial karena miselia dapat tumbuh pada lapisan udara. Ukuran miselium umumnya memiliki diameter 0,5-1,0 µm, dengan panjang yang tidak tentu, dan tidak memiliki sekat pada fase vegetatif (Madigan et al. 1993). Sebagian besar aktinomiset mampu menghasilkan spora dari ujung-ujung miselium yang terbentuk. Spora aktinomiset dikenal dengan eksospora, karena terbentuk tidak dari dalam sel serta memiliki dinding yang tidak terlalu tebal (Janse 2005). Aktinomiset dapat ditemukan di berbagai lingkungan ekologi, seperti air laut (Patil et al. 2001, air sungai (Rifaat 2003), dan tanah gua (Nakaew et al. 2009). Bahkan, Khan et al. (2008) berhasil mengisolasi aktinomiset dari floppy dan compact disc. Beberapa aktinomiset juga diketahui merupakan organisme endofit dan dapat diisolasi dari tanaman (Kunoh 2002). Salah satu anggota Aktinomiset yang memiliki kemampuan sebagai agens hayati adalah Streptomyces sp. Bakteri ini merupakan mikroorganisme yang banyak menghasilkan substansi antibiotik, salah satunya aktif menghambat pertumbuhan cendawan patogen pada tumbuhan. Hasil penelitian menunjukkan bahwa Streptomyces sp. berpengaruh terhadap penghambatan pertumbuhan cendawan, salah satunya adalah Fusarium sp. (Murdiyah 2008). Pada tahun 1944 Selman Waksman menemukan streptomisin yang merupakan salah satu antibiotik yang dihasilkan oleh Streptomyces sp. Perkembangan ini merangsang penelitian lebih lanjut terhadap genus Streptomyces dalam usaha mencari mikroorganisme penghasil antibiotik. Sejak saat itu penelitian aktinomiset, terutama Streptomyces sp., menjadi gudang utama untuk memperoleh antibiotik baru. Di berbagai lembaga penelitian dilakukan
19 8 pencarian antibiotik dari berbagai tipe mikroorganisme terutama dari kelas aktinomiset dan telah berhasil menemukan antibiotik baru seperti khlortetrasiklin, neomisin, oksitetrasiklin, dan eritromisin (Suwandi 1993). Dalam bidang fitopatologi, khususnya dalam hal pengendalian patogen pada tanaman, aktinomiset diketahui dapat mengendalikan beberapa patogen penting, seperti Rhizoctonia solani (Sabaratnam dan Traquair, 2001) dan Phytium ultimum (Crawford et al., 1993). Bahkan dari hasil penelitian Nakaew et al. (2009) melaporkan bahwa salah satu aktinomiset yang diisolasi dari gua di Thailand, Spirillospora albida, diketahui dapat menujukkan aktivitas antimoikrobial terhadap Bacillus cereus, Staphylococcus aureus, dan Paenibacillus larvae. Hasil penelitian Charoensopharat et al. (2007) menyatakan bahwa Streptomyces sp. menunjukkan aktivitas antibakteri yang signifikan terhadap perkembangan bakteri Gram negatif, seperti Xanthomonas sp.. Aktinomiset dapat menjadi objek penelitian yang sangat potensial untuk masa yang akan datang (Sabaratnam dan Traquair, 2001). Streptomyces sp. telah menunjukkan adanya produksi senyawa toksik antifungal, rhizostreptin, dalam kapasitas yang tinggi, baik pada media biakan maupun pada perakaran tomat. Bakteri ini pula menunjukkan produksi eksoenzim pendegradasi dinding sel cendawan seperti kitinase. Kajian mengenai kemampuan produksi aktinomiset akan senyawa metabolit lainnya, kemampuan metabolit tersebut menekan pertumbuhan patogen, hingga efikasi dan persistensinya di perakaran akan sangat penting untuk menghasilkan senyawa yang dapat diaplikasikan sebagai antimikroba untuk berbagai agroekosistem.
20 9 BAHAN DAN METODE Waktu dan Tempat Penelitian dilakukan pada bulan Maret hingga September 2010 di Laboratorium Bakteriologi Tumbuhan Departemen Proteksi Tanaman IPB, Fakultas Pertanian, Institut Pertanian Bogor. Peremajaan Isolat Bacillus spp. Isolat Bacillus spp. yang digunakan dalam penelitian ini diperoleh dari kultur stok koleksi Laboratorium Bakteriologi Tumbuhan Departemen Proteksi Tanaman IPB. Isolat tersebut berupa suspensi bakteri pada larutan Gliserol 20% dan disimpan dalam keadaan beku pada suhu -20 C. Sebanyak satu lup suspensi beku tersebut diambil dan digores pada media Tryptone Soy Agar (TSA) secara aseptik dengan menggunakan jarum oose. Selanjutnya, cawan diinkubasi pada suhu ruang selama dua hari. Koloni bakteri akan tumbuh pada media setelah masa inkubasi. Peremajaan isolat Bacillus spp. ini dilakukan secara aseptik di laminar air flow cabinet. Isolasi dan Seleksi Aktinomiset sebagai Agens Hayati Aktinomiset merupakan salah satu mikroba yang umum ditemukan di tanah. Penelitian ini menggunakan isolat aktinomiset asal tanah. Tanah sampel, yang diambil dari daerah Bogor, berasal dari tanah bagian top soil. Kemudian tanah tersebut dikeringanginkan pada suhu ruang selama 10 hari. Sebanyak 10 gr tanah sampel yang sudah kering disuspensikan pada 100 ml air steril kemudian diinkubasi pada inkubator bergoyang selama 15 menit. Pencawanan dilakukan terhadap suspensi ini dengan didahului teknik pengenceran berseri dengan konsentrasi 10-1 hingga Pencawanan dilakukan pada media semi selektif Water-yeast extract Agar (WYE) (0,25 g yeast extract, 0,5 g K 2 HPO 4, 18 g agar, dan 1 L aquades) dan Casamino Acids-yeast extract-glucose-agar (YCED) (0,3 g Casamino Acids, 0,3 g Yeast extract, 0,3 g D-Glucose, 2 g K 2 HPO 4, 18 g agar, dan 1 L aquades). Koloni Aktinomiset akan tumbuh dalam waktu 7-10 hari, kemudian dilakukan pemurnian terhadap koloni tunggal yang terbentuk dan ini
21 10 dijadikan sebagai isolat murni. Setelah diberi label kode, isolat murni ini yang akan dijadikan sebagai bahan pada pengujian selanjutnya. Seleksi Aktinomiset dilakukan dengan menggunakan metode biakkan ganda (dual culture). Sebanyak satu lup biakan X. oryzae pv. oryzae berusia 24 jam diambil dari media Yeast Dextrose Calcium carbonate Agar (YDCA) (15 gr Yeast Extract, 20 gr Dextrose, 20 gr CaCO 3, 15 gr Agar, dan 1 L aquades) dan diinokulasikan ke erlenmeyer berisi media 10 ml media LB serta diinkubasi pada inkubator bergoyang dengan kecepatan 100 rpm pada suhu ruang selama 18 jam. Pada waktu yang sama, sebanyak satu lup spora aktinomiset, yang diperoleh dari biakan berusia tujuh hari, diinokulasikan ke erlenmeyer berisi 10 ml media cair Luria Broth (LB) (1 gram Triptone, 0,5 gram NaCl, 0,5 gram Yeast Extract), dan diinkubasi pada inkubator bergoyang dengan kecepatan 100 rpm pada suhu ruang selama 18 jam. Setelah masa inkubasi, sebanyak 100 µl suspensi bakteri X. oryzae pv. oryzae disebar pada media TSA, kemudian dikeringanginkan selama 15 menit pada laminar air flow cabinet. Sebanyak empat buah kertas saring berdiameter 0,5 cm diletakkan pada media TSA yang telah disebar suspensi bakteri X. oryzae pv. oryzae. Pada masing-masing kertas saring diteteskan suspensi aktinomiset sebanyak 10 µl. Setelah itu, media diinkubasi pada suhu ruang selama beberapa hari. Pengamatan terhadap aktivitas antagonisme dilakukan setiap hari. Aktivitas antagonisme ditunjukkan dengan pembentukkan zona bening di sekitar kertas saring. Isolat aktinomiset yang menunjukkan sifat antagonis terhadap bakteri patogen X. oryzae pv. oryzae kemudian dijadikan isolat stok yang akan digunakan pada pengujian selanjutnya. Uji Kompatibilitas Bacillus spp. dan Aktinomiset Uji kompatibilitas pada media padat dilakukan dengan membiakkan Bacillus spp. dan aktinomiset secara dual culture. Sebanyak 10 μl suspensi biakan aktinomiset diteteskan pada kertas saring yang terdapat pada media agar yang telah disebar dengan 100 μl susupensi Bacillus spp. Media agar yang digunakan ialah media umum untuk membiakkan bakteri, yaitu TSA. Aktinomiset yang bersifat antagonis terhadap Bacillus spp. akan membentuk zona bening dan tidak akan digunakan sebagai bahan uji.
22 11 Isolat aktinomiset yang menunjukkan hasil positif terhadap uji kompatibilitas melalui dual culture kemudian dilakukan pengujian lebih lanjut. Bacillus spp. dan aktinomiset dibiakkan pada media tumbuh berupa tanah dan pupuk kandang yang sudah disterilisasi. Perbandingan antara tanah dan pupuk kandang ialah 1:1. Bacillus spp. dan aktinomiset yang diinokulasikan pada media tumbuh masing-masing sebanyak 10 5 cfu/gr media tumbuh. Setelah diinkubasi selama dua minggu pada suhu ruang, kemudian dilakukan penghintungan kepadatan populasi Bacillus spp. dan aktinomiset pada masing-masing media tumbuh dengan metode pengenceran berseri. Isolat aktinomiset yang diketahui tidak memiliki interaksi yang negatif terhadap Bacillus spp. akan dijadikan sebagai bahan pengujian selanjutnya. Pengujian Aplikasi Bacillus spp. dan Aktinomiset terhadap Penekanan X. oryzae pv. oryzae dan Pertumbuhan Tanaman Padi Penyiapan Spora Bacillus spp. dan Aktinomiset Bakteri Bacillus sp. adalah bakteri Gram positif yang dapat membentuk spora. Pembentukan spora oleh Bacillus sp. merupakan salah satu respon bakteri ini dalam bertahan pada kondisi tertentu (Muis 2006). Pada penelitian ini, produksi spora diawali dengan peremajaan biakan Bacillus spp. secara aseptik. Biakan Bacillus spp. hasil peremajaana berumur satu hari tersebut diinokulasi sebanyak satu lup ke dalam tabung reaksi berisi 5 ml media cair LB dan diinkubasi pada inkubator bergoyang dengan kecepatan 100 rpm selama 13 jam. Setelah itu sebanyak 5 ml suspensi Bacillus spp. diinokulasi ke dalam erlenmeyer 1000 ml berisi 300 ml media cair Dickinson (6 g Pancreatic Digest of Gelatin, 4 g Pancreatic Digest of Casein, 3 g Yeast Extract, 1 g Beef Extract, 0,3 g Manganolis Sulfat) dan diinkubasi pada inkubator bergoyang dengan kecepatan 100 rpm selama enam hari. Penghitungan spora Bacillus spp. dilakukan dengan memanaskan suspensi pada suhu 80 C selama 15 menit dengan tujuan untuk mematikan sel vegetatif Bacillus spp., tetapi tidak mematikan sporanya. Setelah itu, dilakukan pengenceran berseri dan dilanjutkan dengan pencawanan pada media TSA. Pengamatan dilakukan dengan menghitung jumlah koloni Bacillus
23 12 spp. yang tumbuh setelah diinkubasikan selama 48 jam. Jumlah koloni yang tumbuh selanjutnya dikonversikan ke dalam satuan cfu/ml dengan rumus: Populasi bakteri = Keterangan: x = jumlah koloni yang tumbuh pada cawan dengan faktor pengenceran ke- (cfu) p = faktor pengenceran kev = volume suspensi yang disebar pada cawan (ml) Isolat aktinomiset yang telah terseleksi kemudian dilakukan perbanyakan untuk keperluan pengujian selanjutnya. Perbanyakan aktinomiset dilakukan dengan menggoreskan kultur murni ke media WYE atau YCED, tergantung pada tiap isolat. Untuk persediaan, setiap isolat dengan sama yang berbeda diperbanyak hingga 10 cawan Kemudian cawan diinkubasi hingga 8-10 hari. Spora akan tumbuh pada permukaan media yang ditumbuhi koloni aktinomiset dengan penampakan kasar seperti beludru dan mengandung pigmen tertentu sehingga akan tampak memiliki beragam (Madigan et al. 1996). Selain itu, dilakukan juga perbanyakan isolat aktinomiset dengan penggunaan agar miring. Hal ini dilakukan untuk menyediakan kultur stok yang murni dan dapat diperbanyak sewaktuwaktu. Penyiapan Formulasi Spora Bacillus spp. dan Aktinomiset pada Bahan Pembawa Berbentuk Tepung Spora bakteri dipanen dengan sentrifugasi eppendorf pada rpm pada suhu ruang selama 6 menit dari media kultur yang telah berumur 7 hari. Pelet dari spora bakteri kemudian dicuci 2 kali dengan larutan 0,05M Phosphate Buffer Saline (PBS) (8 gr NaCl, 0,2 gr KH 2 PO 4, 1,15 gr Na 2 HPO 4, 0,2 gr KCl, 1 L aquades) ph 7,0. Spora bakteri yang telah dicuci dengan PBS selanjutnya diresuspensikan kembali pada larutan PBS dan kemudian kepadatan spora bakteri pada suspensi tersebut dihitung dengan teknik pengenceran berseri. Spora aktinomiset dipanen dari kultur aktinomiset yang telah berumur 10 hari pada cawan petri berisi media padat. Sebanyak 10 ml aquades steril dituang pada cawan tersebut. Kemudian dengan menggunakan spatula steril, koloni
24 13 aktinomiset digores dengan lembut hingga sporanya lepas dari permukaan agar dan tersuspensi pada aquades steril. Setelah itu, suspensi spora tersebut diteteskan pada cawan kultur lain dengan menggunakan pipet. Selanjutnya dilakukan metode yang sama hingga mencapai 5 cawan. Penghitungan terhadap kepadatan spora dilakukan dengan alat Haemacytometer. Setelah dipanen, kemudian spora diinokulasikan pada bahan pembawa yang akan digunakan. Setiap bahan pembawa yang digunakan, sebelumnya telah disaring dengan saringan 50 mess. Bahan pembawa yang akan diuji dalam penelitian ini adalah campuran tepung arang sekam, dedak halus, tepung jagung, dan tepung cangkang udang dengan perbandingan 86,5 : 3 : 10 : 0,5. Bahan pembawa yang sudah dicanpur kemudian dimasukkan ke dalam plastik tahan panas untuk dilakukan sterilisasi secara panas uap dengan menggunakan autoklaf selama 15 menit. Formulasi dibuat dengan cara menyebarkan susupensi spora secara merata pada bahan pembawa dengan perbandingan 5 ml untuk setiap 10 g bahan pembawa. Suspensi tersebut diteteskan ke dalam plastik berisi bahan pembawa dan diaduk secara merata. Adapun kepadatan spora Bacillus spp. dan aktinomiset yang diinokulasi ialah 10 8 cfu/gr bahan pembawa. Formulasi bahan pembawa spora Bacillus spp. dan aktinomiset selanjutnya diletakan pada aluminium foil steril dan dilakukan pengeringan dengan oven pada suhu 60 C selama 2 jam. Selanjutnya formulasi ini digunakan untuk pengujian pada bahan tanaman. Aplikasi Formulasi Bacillus sp. dan Aktinomiset pada Benih Padi Benih padi yang digunakan dalam pengujian ini ialah benih padi varietas Ciherang. Benih yang akan digunakan dalam pengujian ini, sebelum diberi perlakuan dan ditanam, dilakukan analisis terhadap populasi X. oryzae pv. oryzae dengan teknik pencawanan dengan pengenceran berseri. Sebanyak 20 benih dipilih dan disterilisasi permukaan lalu digerus serta disuspensikan pada 10 ml larutan PBS. Suspensi tersebut kemudian dilakukan pengenceran berseri hingga 10-8 kali dan disebar pada cawan berisi media YDCA. Selanjutnya media diinkubasi selama 2 hari dan dilakukan peghitungan koloni X. oryzae pv. oryzae yang tumbuh. Schaad et al. (2000) menyatakan bahwa pada media YDCA koloni
25 14 X. oryzae pv. oryzae akan tampak mukoid dan berwarna kuning dengan permukaan licin. Penanaman benih padi dilakukan pada nampan plastik yang berisi cocopeat steril sebagai media semainya. Sebelum diberi perlakuan dan ditumbuhkan pada media semai, benih padi direndam dalam tabung erlenmeyer steril berisi air steril selama semalam. Sebanyak 100 benih padi disebar pada formulasi spora bakteri yang diletakan di atas aluminium foil steril dan dicampurkan secara merata hingga seluruh benih tertutupi formulasi bakteri. Tahap ini dinamakan seed dressing atau seed coating. Kemudian benih yang sudah diberi perlakuan ditanam pada media yang telah disiapkan. Pengujian Formulasi Bacillus spp. dan Aktinomiset terhadap Penekanan Populasi X. oryzae pv. oryzae Analisis populasi X. oryzae pv. oryzae dilakukan pada bibit tanaman padi yang berumur 7 HST. Sebanyak 20 dari 100 sampel bibit pada setiap ulangan dari setiap perlakuan digerus pada plastik steril kemudian disuspensikan pada 50 ml air steril. Kemudian X. oryzae pv. oryzae diisolasi dari suspensi tersebut dengan metode pengenceran berseri dan pencawanan pada media YDCA. Pengamatan dilakukan dengan menghitung jumlah koloni X. oryzae pv. oryzae yang tumbuh setelah diinkubasikan selama 48 jam. Jumlah koloni yang tumbuh selanjutnya dikonversikan ke dalam satuan cfu/ml dengan rumus: Keterangan: Populasi bakteri = x = jumlah koloni yang tumbuh pada cawan dengan faktor pengenceran ke- (cfu) p = faktor pengenceran ke- v = volume suspensi yang disebar pada cawan (ml) Pengujian formulasi spora Bacillus spp. dan aktinomiset terhadap penekanan populasi X. oryzae pv. oryzae dilakukan dengan menggunakan rancangan acak lengkap. Perlakuan yang diuji dapat dilihat pada Tabel 1.
26 15 Tabel 1 Perlakuan terhadap benih padi pada pengujian formulasi spora Bacillus spp. dan aktinomiset Perlakuan Keterangan KONTROL Benih padi tanpa aplikasi Bacillus spp. dan aktinomiset B12 APS7 APS9 APS12 B12+APS7 B12+APS9 B12+APS12 Aplikasi benih padi dengan formulasi Bacillus spp. Aplikasi benih padi dengan formulasi aktinomiset isolat APS7 Aplikasi benih padi dengan formulasi aktinomiset isolat APS9 Aplikasi benih padi dengan formulasi aktinomiset isolat APS12 Aplikasi benih padi dengan formulasi Bacillus spp. dan aktinomiset isolat APS7 Aplikasi benih padi dengan formulasi Bacillus spp. dan aktinomiset isolat APS9 Aplikasi benih padi dengan formulasi Bacillus spp. dan aktinomiset isolat APS12 Parameter pengamatan yang diambil ialah jumlah koloni X. oryzae pv. oryzae yang tumbuh berdasarkan hasil pengenceran berseri dan pencawanan pada media YDCA. Pengujian dilakukan dengan tiga ulangan. Pada setiap ulangan diambil 20 unit sampel yang dipilih secara acak yang akan dijadikan sebagai sumber parameter pengamatan. Pengujian Formulasi Spora Bacillus spp. dan Aktinomiset terhadap Pertumbuhan Bibit Padi Pengujian formulasi spora Bacillus spp. dan aktinomiset terhadap pertumbuhan tanaman dilakukan dengan menggunakan rancangan acak lengkap. Perlakuan yang diuji dapat dilihat pada Tabel 1. Parameter pengamatan yang diambil ialah persen kemunculan bibit padi dan tinggi tajuk dari bibit yang tumbuh. Pengujian dilakukan dengan tiga ulangan. Pada setiap ulangan diambil 20 unit sampel yang dipilih secara acak yang akan dijadikan sebagai sumber parameter pengamatan.
27 16 Analisis Statistik Data pengujian formulasi spora Bacillus spp. dan aktinomiset terhadap populasi X. oryzae pv. oryzae dan pertumbuhan tajuk pada bibit padi diolah menggunakan Analisis Sidik Ragam (ANOVA) dengan program The Statistical Analysis System (SAS) for Windows 9.0. Pengaruh yang berbeda nyata akan dilakukan uji lanjut dengan uji selang berganda Duncan dengan taraf nyata (α) = 5%.
28 17 HASIL DAN PEMBAHASAN Isolat Bacillus spp. Pada media agar padat, Bacillus spp. berbentuk tidak beraturan dengan pinggiran bergerigi dan berwarna putih pucat kecoklatan (Gambar 1). Muis (2006) mengungkapkan bahwa Bacillus spp. berpotensi dalam mengendalikan penyakit yang disebabkan oleh X. oryzae.waites et al. (1970) mengemukakan bahwa Bacillus spp. tergolong ke dalam bakteri Gram positif yang dapat membentuk struktur berupa endospora yang dapat bertahan pada kondisi ekstrim dan dalam waktu yang lama hingga hitungan tahun. Gambar 1 Koloni Bacillus spp. pada media TSA Isolasi dan Seleksi Aktinomiset sebagai Agens Hayati Menurut Madigan et al. (1996), koloni aktinomset pada cawan agar mudah dibedakan dengan koloni bakteri lain, bahkan cendawan sekalipun. Koloni aktinomiset memiliki ciri khas berupa penampakan yang terlihat berdebu atau bertekstur seperti beludru (Gambar 2). Penampakan tersebut merupakan spora yang dihasilakan oleh hifa aerial yang hanya dimiliki oleh aktinomiset. Hal ini berbeda dengan bakteri yang memiliki koloni yang mukoid ataupun permukaan licin yang khas. Bakteri ini sudah dikenal selama bertahun-tahun sebagai bakteri yang dapat memproduksi antibiotik sebagai metabolit sekundernya (Stevenson 1956). Aktinomiset merupakan suatu kelompok bakteri berfilamen yang umum ditemukan di tanah. Aktinomiset termasuk ke dalam golongan bakteri Gram positif dan dapat menghasilkan struktur bertahan berupa spora.
29 18 Gambar 2 Koloni aktinomiset pada media agar padat (kiri) dan penampakan mikroskopis pada perbesaran 400 (kanan) Berdasarkan isolasi aktinomiset asal tanah yang dilakukan, diperoleh beberapa isolat aktinomiset yang dibiakkan pada media semi selektif WYE dan YCED. Tabel 2 Daftar isolat aktinomiset hasil isolasi berdasarkan media isolasi No. Kode isolat aktinomiset Media isolasi WYE YCED 1. APS 1-2. APS 2-3. APS 3-4. APS 4-5. APS 5-6. APS 6-7. APS 7-8. APS 8-9. APS APS APS APS APS APS APS APS 16 - Keterangan: Tumbuh - Tidak tumbuh Pengamatan mengenai perbedaan fenotipe koloni yang tumbuh pada media dilakukan terhadap isolat aktinomiset yang diperoleh. Pemberian kode isolat dilakukan berdasarkan perbedaan fenotipe yang diamati. Berdasarkan pengamatan yang dilakukan (Tabel 2), diperoleh 16 isolat aktinomiset dengan ciri fenotipe yang berbeda satu sama lain. Perbedaan ini meliputi penampakan koloni yang
30 19 terbentuk pada media agar, warna koloni, serta pertumbuhan isolat tersebut dalam menghasilkan spora. Keenambelas isolat ini tumbuh pada dua media isolasi yang berbeda, yaitu WYE dan YCED. Penggunaan media WYE dan YCED pernah dilakukan Crawford et al. (1993) dalam mengisolasi aktinomiset. Media dengan kandungan nutrisi yang rendah baik digunakan dalam melakukan isolasi aktinomiset karena media jenis ini dapat mengurangi kontaminasi yang dapat diakibatkan oleh fungi dan bakteri. Adapun isolat yang tumbuh pada media WYE adalah APS 1, APS 8, APS 9, APS 10, APS12, APS 13, dan APS 16. Sedangkan isolat yang tumbuh pada media YCED adalah APS 2, APS 3, APS4, APS 5, APS 6, APS 7, APS 11, APS 14, dan APS 16. Tabel 3 Pembentukan zona hambatan oleh aktinomiset terhadap koloni X. oryzae pv. oryzae pada media TSA No. Kode isolat aktinomiset Pembentukan zona bening 1. APS 1-2. APS 2-3. APS 3-4. APS APS 5-6. APS 6-7. APS APS 8-9. APS APS APS APS APS APS APS APS 16 - Keterangan: + Terbentuk zona bening - Tidak terbentuk zona bening Isolat aktinomiset yang diperoleh kemudian dilakukan pengujian terhadap daya antagonisme yang muncul terhadap bakteri X. oryzae pv. oryzae. Hasil pengujian menunjukkan bahwa tidak semua aktinomiset memiliki kemampuan dalam menghambat pertumbuhan X. oryzae pv. oryzae. Dari 16 isolat aktinomiset yang berhasil diisolasi, hanya empat isolat yang memiliki daya hambat terhadap
31 20 X. oryzae pv. oryzae, yaitu aktinomiset dengan kode isolat APS 4, APS 7, APS 9, dan APS 12 (Tabel 3). Ada tidaknya kemampuan daya hambat yang dimiliki aktinomiset dapat diketahui dengan terbentuknya zona hambatan pada media biakan cawan. Zona bening yang terbentuk ini merupakan suatu akibat dari adanya aktivitas antimikroba yang dimiliki oleh aktinomiset. Aktivitas antimikroba ini dapat dikarenakan oleh suatu senyawa antibiotik yang dihasilkan aktinomiset, seperti Amphotericin, Cyclohexamide, Nystatin, dan Streptomycin yang dikenal memiliki sifat antimikroba (Ainsworth 1971). Uji Kompatibilitas Bacillus spp. dan Aktinomiset Uji kompatibilitas dilakukan dalam dua tahap, yaitu dengan menggunakan metode dual culture pada media agar dan dengan menumbuhkan kedua bakteri ini di media tanah dan pupuk kandang steril. Pengujian dengan metode dual culture, yang dilakukan pada media TSA, menunjukkan hasil bahwa hampir seluruh isolat aktinomiset tidak menunjukkan aktivitas antagonisme terhadap Bacillus spp. Satusatunya isolat aktinomiset yang menunjukkan aktivitas antagonisme terhaap Bacillus spp. ialah aktinomiset dengan kode isolat APS 4. Hal ini diperoleh dari pembentukan zona bening pada media TSA yang dilakukan pengujian. Tabel 4 Pembentukan zona hambatan oleh aktinomiset terhadap koloni Bacillus spp. pada media TSA No. Kode Isolat Pembentukan zona Kompatibilitasnya bening terhadap Bacillus spp. 1. APS 4 + Tidak kompatibel 2. APS 7 - Kompatibel 3. APS 9 - Kompatibel 4. APS 12 - Kompatibel Keterangan: + Terbentuk zona bening - Tidak terbentuk zona bening
32 21 Aktinomiset Bacillus spp. Gambar 3 Pengaruh uji kompatibilitas bakteri terhadap populasi Bacillus spp. dan aktinomiset pada media tanah dan pupuk kandang steril Berdasarkan hasil pengujian (Tabel 4), sebanyak 3 isolat aktinomiset yang kompatibel terhadap Bacillus spp., yaitu isolat APS 7, APS 9, dan APS 12. Ketiga isolat ini kemudian dilakukan pengujian lebih lanjut dengan menumbuhkan Bacillus spp. dan ketiga isolat aktinomiset pada suatu media tumbuh, baik secara terpisah maupun dikombinasikan antara Bacillus spp. dan aktinomiset media tumbuh tersebut berupa tanah dan pupuk kandang (1:1) yang telah disterilisasi. Inkubasi dilakukan terhadap media yang telah diinokulasi bakteri selama tiga minggu. Setelah masa inkubasi selama tiga minggu, tanah yang telah diinokulasi bakteri dengan berbagai perlakuan kemudian dilakukan analisis penghitungan bakteri yang tumbuh dengan metode pengenceran berseri yang disertai dengan teknik pencawanan. Bedasarkan penghitungan yang telah dilakukan (Gambar 3), dapat diketahui bahwa terdapat perbedaan jumlah populasi antara bakteri yang ditumbuhkan secara tunggal dan ganda. Secara umum, baik Bacillus spp. maupun aktinomiset, keduanya memiliki nilai populasi yang lebih kecil saat keduanya ditumbuhkan secara bersamaan. Bacillus spp. yang ditumbuhkan secara tunggal memiliki nilai log populasi yang lebih tinggi, yaitu sebesar 6,15 (1, cfu/gr media). Namun ketika ditumbuhkan secara bersamaan dengan APS 7 dan APS 9 hanya memiliki nilai log populasi sebesar 5,30 ( cfu/gr media) dan 5,00 ( cfu/gr media). Hal yang sama terjadi pada aktinomiset, ketika ditumbuhkan secara tunggal, nilai log populasinya mencapai 3,78 ( cfu/gr media) untuk APS 7,
33 22 5,04 (1, cfu/gr media) untuk APS 9 dan 4,92 (8, cfu/gr media) APS 12. Namun pada kondisi dimana keduanya ditumbuhkan bersama dengan Bacillus spp., nilai populasinya menurun hingga 2,30 cfu/gr media untuk APS 7, 2,92 cfu/gr media untuk APS 9, dan 3,87 cfu/gr media untuk APS 12. Penyebab dari penurunan populasi yang terjadi, baik pada Bacillus spp. mapun aktinomiset, terjadi karena beberapa hal. Pada saat bakteri ini ditumbuhkan secara tunggal, tidak terjadi kompetisi dalam hal nutrisi maupun ruang tumbuh, sehingga bakteri dapat tumbuh dengan maksimal. Namun ketika ditumbuhkan secara bersamaan, baik Bacillus spp. bersama dengan APS 7 maupun APS 9, terjadi kompetisi dalam memperoleh nutrisi serta ruang hidup, sehingga pertumbuhan dan perkembangan bakteri ini lebih terbatas. Tetapi kompetisi ini tidak bersifat antagonis karena bakteri masih dapat tumbuh walaupun dalam kondisi yang terbatas sehingga hubungan antara Bacillus spp. dan aktinomiset ini dapat dikatakan kompatibel. Populasi Bacillus spp. ketika ditumbuhkan dengan APS 12 mengalami kenaikan yang sigifikan, yaitu mencapai 7,56 (3, cfu/gr media). Hal ini menunjukkan bahwa perbedaan isolat aktinomiset dapat mempengaruhi pertumbuhan Bacillus spp. Perbedaan kode isolat mengindikasikan perbedaan spesies aktinomiset. Kemungkinan terdapat suatu interaksi tertentu yang bersifat mendukung yang terjadi antara APS 12 dengan Bacillus spp. sehingga populasi Bacillus spp. yang ditumbuhkan bersama dengan APS 12 lebih tinggi dibandingkan Bacillus spp. yang ditumbuhkan secara tunggal. Crawford et al. (1993) menyatakan bahwa aktinomiset merupakan bakteri yang aktif dalam mendegradasi bahan-bahan organik, seperti lignoselulosa, kitin, dan pati dalam tanah. Schaad et al. (2000) pernah melaporkan bahwa Bacillus spp. juga memiliki hasil yang positif terhadap uji hidrolisis pati dan menghasilkan enzim amylase. Kemampuan keduanya dalam mendegradasi senyawa kompleks menjadi senyawa sederhana ini diduga mempengaruhi kompatibilitas keduanya dalam pengujian pada media tanah dan pupuk kandang.
34 23 Pengujian Aplikasi Bacillus spp. dan Aktinomiset terhadap Penekanan X. oryzae pv. oryzae dan Pertumbuhan Tanaman Padi Pengujian Formulasi Bacillus spp. dan Aktinomiset terhadap Penekanan Populasi X. oryzae pv. oryzae Perlakuan mikroba pada benih padi juga berpengaruh pada populasi bakteri patogen X. oryzae pv. oryzae pada bibit padi (Lampiran 1). Sebelum digunakan, sebanyak 20 benih padi diambil secara acak dari masing-masing sampel yang akan digunakan. Benih tersebut dilakukan analasis populasi X. oryzae pv. oryzae yang terbawa benih dengan cara teknik pencawanan dengan pengenceran berseri pada media YDCA. Hasil analisis menunjukkan bahwa benih yang digunakan sebagai bahan uji dalam penelitian ini rata-rata mengandung X. oryzae pv. oryzae sebanyak 2, cfu/gr benih padi. Tabel 5 Pengaruh perlakuan formulasi pada benih padi terhadap populasi X. oryzae pv. oryzae pada bibit padi berumur 7 HST Perlakuan Populasi X, oryzae pv, oryzae ( 10 5 cfu/gr bibit)* KONTROL 108,00a B12 45,33c APS 7 91,00b APS 9 12,00d APS 12 23,33d B12 + APS 7 53,00c B12 + APS 9 16,00d B12 + APS 12 48,00c * Angka yang diikuti huruf yang berbeda menunjukkan hasil yang berbeda nyata (uji selang berganda Duncan α = 0,05) Setelah benih padi ditanam pada media perkecambahan berupa cocopeat dengan perlakuan yang berbeda, kemudian dilakukan analisis terhadap populasi bakteri X. oryzae pv. oryzae yang terkandung dalam bibit padi. Pada Tabel 4 disajikan data populasi X oryzae pv. oryzae pada bibit padi yang berumur 7 HST. Hasil menunjukkan bahwa seluruh perlakuan mikroba dapat menekan populasi X. oryzae pv. oryzae dibandingkan dengan benih yang tidak diberi perlakuan (KONTROL). Perlakuan aktinomiset dengan kode isolat APS 9 dapat menekan populasi X. oryzae pv. oryzae sebesar 88,89%. Hal ini menunjukkan bahwa
35 24 adanya sifat antagonisme yang dimiliki oleh aktinomiset terhadap bakteri X. oryzae pv. oryzae yang terdapat pada bibit padi berumur 7 HST tersebut. Jika dibandingkan dengan populasi awal X. oryzae pv. oryzae pada benih padi sebelum ditanam, yaitu 2, cfu, data menunjukkan bahwa bakteri X. oryzae pv. oryzae mengalami perbanyakan. Namun dengan diberinya perlakuan, perkembangan X. oryzae pv. oryzae dapat ditekan hingga 12, cfu, dengan bibit yang tidak diberi perlakuan mencapai 108, cfu. Bakteri patogen X. oryzae pv. oryzae merupakan bakteri Gram negatif yang tidak dapat membentuk spora dalam siklus hidupnya. Madigan et al (1996) menyatakan bahwa beberapa spesies aktinomiset dapat menghasilkan antibiotik yang aktif dalam menekan perkembangan bakteri Gram negatif seperti X. oryzae pv. oryzae ini, seperti Streptomycin yang dihasilkan oleh Streptomyces griseus dan Tetracyline yang dihasilkan oleh S. aureofaciens. Pengujian Formulasi Bacillus spp. dan Aktinomiset terhadap Pertumbuhan Bibit Padi Adanya aktivitas mikroba pada benih padi menimbulkan keragaman dalam pertumbuhan bibit padi pada usia semai. Hasil analisis statistik dengan sidik ragam pengaruh perlakuan aktinomiset, Bacillus spp., maupun kombinasi keduanya dalam suatu bahan pembawa menunjukkan bahwa adanya pengaruh yang nyata terhadap persen perkecambahan benih padi selama masa pengamatan hingga 7 HST (Lampiran 2, 3, 4, dan 5). Tabel 6 Pengaruh perlakuan formulasi pada benih padi terhadap persen kemunculan bibit padi Perlakuan Persen kemunculan bibit padi* 4 HST 5 HST 6 HST 7 HST KONTROL 6,67b 23,67bc 40,00bc 56,67c B12 6,33b 16,67c 30,67c 56,33c APS 7 20,67a 35,33ab 44,33abc 73,33abc APS 9 12,67ab 29,33abc 58,33ab 79,00ab APS 12 7,67b 15,67c 35,67bc 63,00bc B12 + APS 7 20,67a 42,33a 64,67a 83,33a B12 + APS 9 7,67b 17,33c 30,33c 57,00c B12 + APS 12 16,00ab 27,00bc 46,33abc 77,00bc * Angka yang diikuti huruf yang berbeda pada kolom yang sama menunjukkan hasil yang berbeda nyata (uji selang berganda Duncan α = 0,05)
36 25 Pada tabel 6 disajikan data kemunculan bibit padi dengan berbagai perlakuan bakteri yang diberikan terhadap benih padi. Aplikasi bakteri pada benih padi menunjukkan hasil yang beragam terhadap kemunculan bibit padi. Perlakuan kombinasi bakteri Bacillus spp, dan aktinomiset dengan kode isolat APS 7 (B12+APS7) merupakan perlakuan dengan hasil paling tinggi di antara perlakuan lain. Pada 4 HST sebanyak 20,67% bibit yang muncul. Kemudian pada 5, 6, dan 7 MST masing-masing ialah 42,33%, 64,67%, dan 83,33%. Dapat dikatakan bahwa perlakuan Bacillus spp, dan aktinomiset dapat meningkatkan persen kemunculan bibit padi sebesar 47,04%. Hal ini menunjukkan adanya akivitas mikroba yang dapat memacu proses kemunculan bibit padi hingga menyebabkan jumlah benih dengan perlakuan bakteri memiliki tingkat kemunculan bibit yang lebih banyak dibandingkan dengan benih yang tidak diberi perlakuan. Bakteri X. oryzae pv. oryzae terdapat pada bagian bawah glume dan terkadang berada pada endosperma dari benih padi. Keberadaan bakteri pada bagian ini yang dapat mengganggu proses metabolisme dari benih tersebut (Singh dan Mathur 2004). Hal ini mengakibatkan benih yang tidak diberi perlakuan (KONTROL) memiliki tingkat kemunculan bibit yang paling rendah, karena bakteri X. oryzae pv. oryzae dapat berkembang dan mengganggu proses metabolisme benih padi. Adanya aktivitas antagonisme yang dimiliki Bacillus spp. maupun aktinomiset mengakibatkan terhambatnya perkembangan X. oryzae pv. oryzae. Hal ini yang menyebabkan benih dengan perlakuan memiliki tingkat kemunculan bibit yang lebih tinggi dibandingkan benih yang tidak diberi perlakuan (KONTROL). Bakteri Bacillus spp., telah diketahui mampu memacu pertumbuhan bagi tanaman karena diketahui dapat membantu menghasilkan hormon pertumbuhan seperti asam indoleasetat (IAA), asam giberelat, sitokinin, dan etilen pada tanaman (Sulistiani 2009). Dalam jumlah yang sesuai, hormon tersebut dapat memacu pertumbuhan tanaman menjadi lebih baik. Aktinomiset juga merupakan bakteri yang diketahui banyak menghasilkan antibiotik yang dapat dimanfaatkan dalam menekan populasi mikroba yang dapat mengganggu proses pertumbuhan tanaman.
37 26 Tabel 7 Pengaruh perlakuan formulasi pada benih padi terhadap tinggi tajuk ratarata bibit padi berumur 7 HST Perlakuan Tinggi tajuk rata-rata (cm)* KONTROL 7,64e B12 9,09cd APS 7 9,89abc APS 9 10,40a APS 12 8,66d B12 + APS 7 8,80d B12 + APS 9 9,21bcd B12 + APS 12 10,07ab * Angka yang diikuti huruf yang berbeda menunjukkan hasil yang berbeda nyata (uji selang berganda Duncan α = 0,05) Perlakuan aplikasi mikroba pada benih juga mengakibatkan perbedaan yang nyata pada tinggi tajuk bibit padi berumur 7 HST (Lampiran 6). Seluruh perlakuan mikroba yang diberikan pada benih mengakibatkan tinggi tajuk ratarata bibit padi menjadi lebih tinggi dibandingkan dengan unit uji tanpa perlakuan (kontrol). Benih padi dengan perlakuan APS12 dapat meningkatkan tinggitajuk padi sebesar 13,35% dan benih yang diberi perlakuan aktinomiset dengan kode isolat APS 9 dapat meningkatkan tinggi tajuk bibit padi sebesar 26,53%. Hal ini ditunjukkan dengan data tinggi tajuk rata-rata bibit yang dimiliki, yaitu 8,66 cm dengan perlakuan APS12 dan 10,40 cm untuk perlakuan APS9, jika dibandingkan dengan benih yang tidak diberi perlakuan (kontrol) yang hanya 7,64 cm (Tabel 7). Gambar 4 Bibit padi yang tidak diberi perlakuan (kiri) dan yang diberi perlakuan B12+APS12 (kanan)
BAHAN DAN METODE Tempat dan Waktu Bahan Peremajaan Aktinomiset dari Kultur Penyimpanan Perbanyakan Sclerotium rolfsii dari Kultur Penyimpanan
 BAHAN DAN METODE Tempat dan Waktu Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor (IPB) mulai Maret 2011 sampai
BAHAN DAN METODE Tempat dan Waktu Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor (IPB) mulai Maret 2011 sampai
BAHAN DAN METODE. Pembiakan P. fluorescens dari Kultur Penyimpanan
 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor mulai bulan Februari
BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor mulai bulan Februari
Gambar 1 Tanaman uji hasil meriklon (A) anggrek Phalaenopsis, (B) bunga Phalaenopsis yang berwarna putih
 BAHAN DAN METODE Tempat dan Waktu Penelitian Isolasi dan perbanyakan sumber inokulum E. carotovora dilakukan di Laboratorium Bakteriologi Departemen Proteksi Tanaman Fakultas Pertanian, Institut Pertanian
BAHAN DAN METODE Tempat dan Waktu Penelitian Isolasi dan perbanyakan sumber inokulum E. carotovora dilakukan di Laboratorium Bakteriologi Departemen Proteksi Tanaman Fakultas Pertanian, Institut Pertanian
BAHAN DAN METODE Tempat dan waktu penelitian Bahan dan Alat Isolasi dan Uji Reaksi Hipersensitif Bakteri Penghasil Siderofor
 BAHAN DAN METODE Tempat dan waktu penelitian Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, dari Oktober 2010
BAHAN DAN METODE Tempat dan waktu penelitian Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, dari Oktober 2010
BAHAN DAN METODE. Tabel 1 Kombinasi perlakuan yang dilakukan di lapangan
 13 BAHAN DAN METODE Tempat dan waktu Penelitian ini dilaksanakan di Desa Ciburuy, Kecamatan Cigombong, Kabupaten Bogor serta di Laboratorium Bakteriologi, Departemen Proteksi Tanaman, Fakultas Pertanian,
13 BAHAN DAN METODE Tempat dan waktu Penelitian ini dilaksanakan di Desa Ciburuy, Kecamatan Cigombong, Kabupaten Bogor serta di Laboratorium Bakteriologi, Departemen Proteksi Tanaman, Fakultas Pertanian,
BAHAN DAN METODE. Metode Penelitian
 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilakukan di Laboratorium Bakteriologi Tumbuhan dan Rumah Kaca University Farm, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian
BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilakukan di Laboratorium Bakteriologi Tumbuhan dan Rumah Kaca University Farm, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian
BAHAN DAN METODE Waktu dan Tempat Bahan dan Alat Metode Penelitian Penyediaan Isolat Fusarium sp. dan Bakteri Aktivator
 BAHAN DAN METODE Waktu dan Tempat Penelitian ini dilakukan di Laboratorium Mikologi, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, dan Laboratorium Mikrobiologi dan Kesehatan
BAHAN DAN METODE Waktu dan Tempat Penelitian ini dilakukan di Laboratorium Mikologi, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, dan Laboratorium Mikrobiologi dan Kesehatan
BAHAN DAN METODE Tempat dan Waktu Penelitian Bahan dan Alat Metode Penelitian Penyiapan tanaman uji
 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilakukan pada bulan Juli 2010 Maret 2011. Penelitian dilakukan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian,
BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilakukan pada bulan Juli 2010 Maret 2011. Penelitian dilakukan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian,
Kompatibilitas Bacillus spp. dan Aktinomiset sebagai Agens Hayati Xanthomonas oryzae pv. oryzae dan Pemacu Pertumbuhan Padi
 ISSN: 0215-7950 Volume 10, Nomor 5, Oktober 2014 Halaman 160 169 DOI: 10.14692/jfi.10.5.160 Kompatibilitas Bacillus spp. dan Aktinomiset sebagai Agens Hayati Xanthomonas oryzae pv. oryzae dan Pemacu Pertumbuhan
ISSN: 0215-7950 Volume 10, Nomor 5, Oktober 2014 Halaman 160 169 DOI: 10.14692/jfi.10.5.160 Kompatibilitas Bacillus spp. dan Aktinomiset sebagai Agens Hayati Xanthomonas oryzae pv. oryzae dan Pemacu Pertumbuhan
HASIL DAN PEMBAHASAN
 6 HASIL DAN PEMBAHASAN Pembiakan Streptomyces katrae pada Formulasi Media Beras, Jagung dan Limbah Baglog Jamur S. katrae merupakan aktinomiset dari golongan Streptomyces yang pertama diisolasi dari tanah
6 HASIL DAN PEMBAHASAN Pembiakan Streptomyces katrae pada Formulasi Media Beras, Jagung dan Limbah Baglog Jamur S. katrae merupakan aktinomiset dari golongan Streptomyces yang pertama diisolasi dari tanah
BAHAN DAN METODE. Metode Penelitian
 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilaksanakan di Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, dari bulan Februari sampai
BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilaksanakan di Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, dari bulan Februari sampai
BAHAN DAN METODE Tempat dan Waktu . Bahan dan Alat Metode Penelitian Survei Buah Pepaya Sakit
 5 BAHAN DAN METODE Tempat dan Waktu Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman dan Kebun Percobaan Leuwikopo, Fakultas Pertanian, Institut Pertanian Bogor.
5 BAHAN DAN METODE Tempat dan Waktu Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman dan Kebun Percobaan Leuwikopo, Fakultas Pertanian, Institut Pertanian Bogor.
BAHAN DAN METODE Tempat dan Waktu Bahan dan Alat Metode Penelitian Isolasi Aktinomiset
 BAHAN DAN METODE Tempat dan Waktu Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, dari bulan Februari sampai dengan
BAHAN DAN METODE Tempat dan Waktu Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, dari bulan Februari sampai dengan
BAB III METODE PENELITIAN. Penelitian ini dilakukan di Laboratorium Mikrobiologi Departemen Biologi
 BAB III METODE PENELITIAN 3.1 Waktu dan Lokasi Penelitian Penelitian ini dilakukan di Laboratorium Mikrobiologi Departemen Biologi Fakultas Sains dan Teknologi Universitas Airlangga pada bulan Januari-Mei
BAB III METODE PENELITIAN 3.1 Waktu dan Lokasi Penelitian Penelitian ini dilakukan di Laboratorium Mikrobiologi Departemen Biologi Fakultas Sains dan Teknologi Universitas Airlangga pada bulan Januari-Mei
BAHAN DAN METODE Tempat dan Waktu Penyiapan Tanaman Uji Pemeliharaan dan Penyiapan Suspensi Bakteri Endofit dan PGPR
 17 BAHAN DAN METODE Tempat dan Waktu Penelitian dilakukan di Laboratorium Bakteriologi Tumbuhan Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dan di Rumah Kaca, University Farm,
17 BAHAN DAN METODE Tempat dan Waktu Penelitian dilakukan di Laboratorium Bakteriologi Tumbuhan Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dan di Rumah Kaca, University Farm,
Haris Dianto Darwindra BAB VI PEMBAHASAN
 Haris Dianto Darwindra BAB VI PEMBAHASAN Berbagai jenis makanan dan minuman yang dibuat melalui proses fermentasi telah lama dikenal. Dalam prosesnya, inokulum atau starter berperan penting dalam fermentasi.
Haris Dianto Darwindra BAB VI PEMBAHASAN Berbagai jenis makanan dan minuman yang dibuat melalui proses fermentasi telah lama dikenal. Dalam prosesnya, inokulum atau starter berperan penting dalam fermentasi.
BAHAN DAN METODE Tempat dan Waktu Penelitian Bahan dan Alat Metode Penelitian Pra-pengamatan atau survei
 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilaksanakan di Kebun Percobaan Pusat Kajian Buah-Buahan Tropika IPB (PKBT-IPB) Pasir Kuda, Desa Ciomas, Bogor, dan Laboratorium Bakteriologi Tumbuhan,
BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilaksanakan di Kebun Percobaan Pusat Kajian Buah-Buahan Tropika IPB (PKBT-IPB) Pasir Kuda, Desa Ciomas, Bogor, dan Laboratorium Bakteriologi Tumbuhan,
BAB III METODE PENELITIAN. Biologi, Fakultas Sains dan Teknologi, Universitas Airlangga Surabaya dan
 BAB III METODE PENELITIAN 3.1 Tempat dan Waktu Penelitian Penelitian ini dilakukan di Laboratorium Mikrobiologi Departemen Biologi, Fakultas Sains dan Teknologi, Universitas Airlangga Surabaya dan kumbung
BAB III METODE PENELITIAN 3.1 Tempat dan Waktu Penelitian Penelitian ini dilakukan di Laboratorium Mikrobiologi Departemen Biologi, Fakultas Sains dan Teknologi, Universitas Airlangga Surabaya dan kumbung
BAHAN DAN METODE. Pertanian Universitas Sumatera Utara, Medan dengan ketinggian tempat + 25
 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Penyakit Tumbuhan Fakultas Pertanian, Medan dengan ketinggian tempat + 25 meter di atas permukaan laut pada bulan
BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Penyakit Tumbuhan Fakultas Pertanian, Medan dengan ketinggian tempat + 25 meter di atas permukaan laut pada bulan
BAHAN DAN METODE Tempat dan Waktu Metode Penelitian Perbanyakan Propagul Agens Antagonis Perbanyakan Massal Bahan Pembawa Biopestisida
 7 BAHAN DAN METODE Tempat dan Waktu Penelitian ini dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dan Balai Penelitian Tanaman
7 BAHAN DAN METODE Tempat dan Waktu Penelitian ini dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dan Balai Penelitian Tanaman
III. BAHAN DAN METODE. Penelitian ini dilaksanakan di Kebun Percobaan Tanaman Industri dan Penyegar
 25 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Kebun Percobaan Tanaman Industri dan Penyegar Cahaya Negeri, Abung Barat, Lampung Utara dan Laboratorium Penyakit
25 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Kebun Percobaan Tanaman Industri dan Penyegar Cahaya Negeri, Abung Barat, Lampung Utara dan Laboratorium Penyakit
BAHAN DAN METODE. Tempat dan Waktu
 15 BAHAN DAN METODE Tempat dan Waktu Penelitian dilaksanakan di laboratorium dan rumah kaca Hama dan Penyakit dan rumah kaca Balai penelitian Tanaman Obat dan Aromatik (BALITTRO), Bogor; pada bulan Oktober
15 BAHAN DAN METODE Tempat dan Waktu Penelitian dilaksanakan di laboratorium dan rumah kaca Hama dan Penyakit dan rumah kaca Balai penelitian Tanaman Obat dan Aromatik (BALITTRO), Bogor; pada bulan Oktober
FORMULASI AKTINOMISET MENGGUNAKAN BEBERAPA JENIS TANAH SEBAGAI AGENS HAYATI PENYAKIT KRESEK (Xanthomonas oryzae pv.
 FORMULASI AKTINOMISET MENGGUNAKAN BEBERAPA JENIS TANAH SEBAGAI AGENS HAYATI PENYAKIT KRESEK (Xanthomonas oryzae pv. oryzae) PADA PADI ARFIANI FITRI AMALIA DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN
FORMULASI AKTINOMISET MENGGUNAKAN BEBERAPA JENIS TANAH SEBAGAI AGENS HAYATI PENYAKIT KRESEK (Xanthomonas oryzae pv. oryzae) PADA PADI ARFIANI FITRI AMALIA DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN
METODE PENELITIAN. Penelitian dilaksanakan pada bulan Agustus sampai Februari 2014.
 10 METODE PENELITIAN Waktu dan Tempat Penelitian dilaksanakan pada bulan Agustus sampai Februari 2014. Pengambilan sampel tanah dilakukan di Hutan mangrove Percut Sei Tuan Kabupaten Deli Serdang. Analisis
10 METODE PENELITIAN Waktu dan Tempat Penelitian dilaksanakan pada bulan Agustus sampai Februari 2014. Pengambilan sampel tanah dilakukan di Hutan mangrove Percut Sei Tuan Kabupaten Deli Serdang. Analisis
BAB III METODE PENELITIAN. Mikrobiologi Tanah dan Rumah Kaca Balai Penelitian Tanaman Kacang- kacangan dan Umbiumbian
 BAB III METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian Penelitian dilaksanakan pada tanggal 01 Februari sampai 31 Mei 2011 di Laboratorium Mikrobiologi Tanah dan Rumah Kaca Balai Penelitian Tanaman
BAB III METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian Penelitian dilaksanakan pada tanggal 01 Februari sampai 31 Mei 2011 di Laboratorium Mikrobiologi Tanah dan Rumah Kaca Balai Penelitian Tanaman
Tabel 1 Persentase penghambatan koloni dan filtrat isolat Streptomyces terhadap pertumbuhan S. rolfsii Isolat Streptomyces spp.
 4 Tinggi tanaman kumulatif dikonversi menjadi LADKT (luasan area di bawah kurva perkembangan tinggi tanaman) menggunakan rumus sama seperti perhitungan LADKP. KB dihitung dengan rumus (Sutopo 2002): Perhitungan
4 Tinggi tanaman kumulatif dikonversi menjadi LADKT (luasan area di bawah kurva perkembangan tinggi tanaman) menggunakan rumus sama seperti perhitungan LADKP. KB dihitung dengan rumus (Sutopo 2002): Perhitungan
III. BAHAN DAN METODE. Penelitian ini dilaksanakan di Laboratorium Penyakit Tumbuhan dan Kebun
 17 III. BAHAN DAN MEODE 3.1 empat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Penyakit umbuhan dan ebun Percobaan di dalam kampus di Program Studi Agroteknologi Fakultas Pertanian,
17 III. BAHAN DAN MEODE 3.1 empat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Penyakit umbuhan dan ebun Percobaan di dalam kampus di Program Studi Agroteknologi Fakultas Pertanian,
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Jenis penelitian ini adalah penelitian eksplorasi dan eksperimental dengan menguji isolat bakteri endofit dari akar tanaman kentang (Solanum tuberosum
BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Jenis penelitian ini adalah penelitian eksplorasi dan eksperimental dengan menguji isolat bakteri endofit dari akar tanaman kentang (Solanum tuberosum
BAHAN DAN METODE. Hrp -, IAA +, BPF Hrp -, IAA + + , BPF Hrp. , BPF Hrp -, IAA +, BPF + Hrp. , BPF Hrp. , BPF Hrp. Penambat Nitrogen Penambat Nitrogen
 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB dan lahan pertanian Kampung Bongkor, Desa Situgede, Karang Pawitan-Wanaraja,
BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB dan lahan pertanian Kampung Bongkor, Desa Situgede, Karang Pawitan-Wanaraja,
PENGENDALIAN LAYU FUSARIUM PADA TANAMAN PISANG (Musa paradisiaca L.) SECARA KULTUR TEKNIS DAN HAYATI MIFTAHUL HUDA
 PENGENDALIAN LAYU FUSARIUM PADA TANAMAN PISANG (Musa paradisiaca L.) SECARA KULTUR TEKNIS DAN HAYATI MIFTAHUL HUDA DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN INSTITUT PERTANIAN BOGOR 2010 ABSTRAK MIFTAHUL
PENGENDALIAN LAYU FUSARIUM PADA TANAMAN PISANG (Musa paradisiaca L.) SECARA KULTUR TEKNIS DAN HAYATI MIFTAHUL HUDA DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN INSTITUT PERTANIAN BOGOR 2010 ABSTRAK MIFTAHUL
III. METODE PENELITIAN. Persiapan alat dan bahan yang akan digunakan. Pembuatan media PDA (Potato Dextrose Agar)
 III. METODE PENELITIAN A. Bagan Alir Penelitian Persiapan alat dan bahan yang akan digunakan Pembuatan media PDA (Potato Dextrose Agar) Pengambilan sampel tanah dekat perakaran tanaman Cabai merah (C.
III. METODE PENELITIAN A. Bagan Alir Penelitian Persiapan alat dan bahan yang akan digunakan Pembuatan media PDA (Potato Dextrose Agar) Pengambilan sampel tanah dekat perakaran tanaman Cabai merah (C.
BAB III METODE PENELITIAN. eksplorasi dengan cara menggunakan isolasi jamur endofit dari akar kentang
 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Jenis penelitian ini adalah penelitian eksplorasi dan eksperimen. Penelitian eksplorasi dengan cara menggunakan isolasi jamur endofit dari akar kentang
BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Jenis penelitian ini adalah penelitian eksplorasi dan eksperimen. Penelitian eksplorasi dengan cara menggunakan isolasi jamur endofit dari akar kentang
III. METODE PENELITIAN. Penelitian ini dilakukan di Laboratorium Mikrobiologi Jurusan Biologi
 17 III. METODE PENELITIAN A. Tempat dan Waktu Penelitian Penelitian ini dilakukan di Laboratorium Mikrobiologi Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung pada Januari
17 III. METODE PENELITIAN A. Tempat dan Waktu Penelitian Penelitian ini dilakukan di Laboratorium Mikrobiologi Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung pada Januari
III. BAHAN DAN METODE. Penelitian dilaksanakan di Laboratorium Ilmu Penyakit Tumbuhan, Bidang
 8 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian dilaksanakan di Laboratorium Ilmu Penyakit Tumbuhan, Bidang Proteksi Tanaman, Jurusan Agroteknologi, Fakultas Pertanian Universitas Lampung
8 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian dilaksanakan di Laboratorium Ilmu Penyakit Tumbuhan, Bidang Proteksi Tanaman, Jurusan Agroteknologi, Fakultas Pertanian Universitas Lampung
III. BAHAN DAN METODE
 10 III. BAHAN DAN METODE 3.1 Waktu dan Tempat Penelitian dilaksanakan dari bulan Oktober 2011 sampai Oktober 2012. Sampel gubal dan daun gaharu diambil di Desa Pulo Aro, Kecamatan Tabir Ulu, Kabupaten
10 III. BAHAN DAN METODE 3.1 Waktu dan Tempat Penelitian dilaksanakan dari bulan Oktober 2011 sampai Oktober 2012. Sampel gubal dan daun gaharu diambil di Desa Pulo Aro, Kecamatan Tabir Ulu, Kabupaten
BAB III METODE PENELITIAN. A. Waktu dan Tempat Penelitian. Penelitian dilaksanakan pada bulan Maret-November 2012 di
 digilib.uns.ac.id BAB III METODE PENELITIAN A. Waktu dan Tempat Penelitian Penelitian dilaksanakan pada bulan Maret-November 2012 di Laboratorium Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas
digilib.uns.ac.id BAB III METODE PENELITIAN A. Waktu dan Tempat Penelitian Penelitian dilaksanakan pada bulan Maret-November 2012 di Laboratorium Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas
BAB III METODE PENELITIAN. untuk mengisolasi Actinomycetes dan melihat kemampuannya dalam
 BAB III METODE PENELITIAN 3.1. Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Jurusan Biologi untuk mengisolasi Actinomycetes dan melihat kemampuannya dalam menghasilkan
BAB III METODE PENELITIAN 3.1. Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Jurusan Biologi untuk mengisolasi Actinomycetes dan melihat kemampuannya dalam menghasilkan
HASIL DAN PEMBAHASAN
 HASIL DAN PEMBAHASAN Pembiakan P. fluorescens pada Beberapa Formulasi Limbah Organik Populasi P. fluorescens pada beberapa limbah organik menunjukkan adanya peningkatan populasi. Pengaruh komposisi limbah
HASIL DAN PEMBAHASAN Pembiakan P. fluorescens pada Beberapa Formulasi Limbah Organik Populasi P. fluorescens pada beberapa limbah organik menunjukkan adanya peningkatan populasi. Pengaruh komposisi limbah
III BAHAN DAN METODE
 meliputi daerah Jawa, Kalimantan dan Sumatera. Tanaman Kilemo di daerah Jawa banyak ditemui pada daerah dengan ketinggian 230 700 meter di atas permukaan laut (mdpl). Tanaman ini terutama banyak ditemui
meliputi daerah Jawa, Kalimantan dan Sumatera. Tanaman Kilemo di daerah Jawa banyak ditemui pada daerah dengan ketinggian 230 700 meter di atas permukaan laut (mdpl). Tanaman ini terutama banyak ditemui
komersial, pupuk SP 36, pupuk KCl, NaCl, Mannitol, K 2 HPO 4, MgSO 4.7H 2 O,
 BAB III METODOLOGI PENELITIAN 3.1 Waktu dan tempat Penelitian ini dilakukan pada tanggal 01 Februari 31 Juni 2011 di Laboratorium Mikrobiologi, Bioteknologi, Kultur Jaringan dan Rumah Kaca Balai Penelitian
BAB III METODOLOGI PENELITIAN 3.1 Waktu dan tempat Penelitian ini dilakukan pada tanggal 01 Februari 31 Juni 2011 di Laboratorium Mikrobiologi, Bioteknologi, Kultur Jaringan dan Rumah Kaca Balai Penelitian
III. METODE PENELITIAN. dan Ilmu Pengetahuan Alam, Universitas Lampung dari bulan Januari sampai
 23 III. METODE PENELITIAN A. Tempat dan Waktu Penelitian Penelitian ini dilakukan di Laboratorium Mikrobiologi Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung dari bulan Januari sampai
23 III. METODE PENELITIAN A. Tempat dan Waktu Penelitian Penelitian ini dilakukan di Laboratorium Mikrobiologi Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung dari bulan Januari sampai
BAB III BAHAN DAN METODE
 BAB III BAHAN DAN METODE 3.1 Waktu dan Tempat Penelitian Penelitian dilaksanakan pada bulan September sampai Oktober 2009. Pengambilan sampel susu dilakukan di beberapa daerah di wilayah Jawa Barat yaitu
BAB III BAHAN DAN METODE 3.1 Waktu dan Tempat Penelitian Penelitian dilaksanakan pada bulan September sampai Oktober 2009. Pengambilan sampel susu dilakukan di beberapa daerah di wilayah Jawa Barat yaitu
III. METODE PENELITIAN. Penelitian ini dilakukan di Laboratorium Mikrobiologi Jurusan Biologi
 13 III. METODE PENELITIAN A. Tempat dan Waktu Penelitian Penelitian ini dilakukan di Laboratorium Mikrobiologi Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung. Penelitian
13 III. METODE PENELITIAN A. Tempat dan Waktu Penelitian Penelitian ini dilakukan di Laboratorium Mikrobiologi Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung. Penelitian
BAHAN DAN METODE. Kasa Fakultas Pertanian Universitas Sumatera Utara, Medan dengan ketinggian tempat
 BAHAN DAN METODE Tempat dan waktu penelitian Penelitian ini dilaksanakan di Laboratorium Penyakit Tumbuhan dan di Rumah Kasa Fakultas Pertanian, Medan dengan ketinggian tempat + 25 m dpl pada Bulan Mei
BAHAN DAN METODE Tempat dan waktu penelitian Penelitian ini dilaksanakan di Laboratorium Penyakit Tumbuhan dan di Rumah Kasa Fakultas Pertanian, Medan dengan ketinggian tempat + 25 m dpl pada Bulan Mei
BAB III METODE PENELITIAN. Jenis percobaan pada penelitian ini adalah penelitian eksperimental,
 35 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Jenis percobaan pada penelitian ini adalah penelitian eksperimental, dengan menggunakan Rancangan Acak Kelompok (RAL), yang dilakukan dengan 9 perlakuan
35 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Jenis percobaan pada penelitian ini adalah penelitian eksperimental, dengan menggunakan Rancangan Acak Kelompok (RAL), yang dilakukan dengan 9 perlakuan
II. MATERI DAN METODE
 II. MATERI DAN METODE 2.1 Materi, Lokasi, dan Waktu Penelitian 2.1.1 Materi Alat yang digunakan dalam penelitian adalah cawan petri, tabung reaksi, gelas ukur, pembakar spiritus, pipet, jarum ose, erlenmeyer,
II. MATERI DAN METODE 2.1 Materi, Lokasi, dan Waktu Penelitian 2.1.1 Materi Alat yang digunakan dalam penelitian adalah cawan petri, tabung reaksi, gelas ukur, pembakar spiritus, pipet, jarum ose, erlenmeyer,
POTENSI BAKTERISIDA SENYAWA METABOLIT Penicillium spp. TERHADAP Ralstonia solanacearum PENYEBAB PENYAKIT LAYU BAKTERI PADA CABAI KHOIRUNNISYA
 POTENSI BAKTERISIDA SENYAWA METABOLIT Penicillium spp. TERHADAP Ralstonia solanacearum PENYEBAB PENYAKIT LAYU BAKTERI PADA CABAI KHOIRUNNISYA DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN INSTITUT PERTANIAN
POTENSI BAKTERISIDA SENYAWA METABOLIT Penicillium spp. TERHADAP Ralstonia solanacearum PENYEBAB PENYAKIT LAYU BAKTERI PADA CABAI KHOIRUNNISYA DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN INSTITUT PERTANIAN
BAB III METODELOGI PENELITIAN
 BAB III METODELOGI PENELITIAN 3.1 Waktu dan Tempat Penelitian ini dilaksanakan pada Tanggal 01 Februari 31 Juni 2011 di Laboratorium Mikrobiologi dan Rumah Kaca Balai Penelitian Tanaman Kacangkacangan
BAB III METODELOGI PENELITIAN 3.1 Waktu dan Tempat Penelitian ini dilaksanakan pada Tanggal 01 Februari 31 Juni 2011 di Laboratorium Mikrobiologi dan Rumah Kaca Balai Penelitian Tanaman Kacangkacangan
MATERI DAN METODE. Pekanbaru. Penelitian ini telah dilaksanakan pada bulan Mei sampai September
 III. MATERI DAN METODE 3.1. Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di laboratorium Patologi, Entomologi, dan Mikrobiologi (PEM) Fakultas Pertanian dan Peternakan Universitas Islam Negeri
III. MATERI DAN METODE 3.1. Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di laboratorium Patologi, Entomologi, dan Mikrobiologi (PEM) Fakultas Pertanian dan Peternakan Universitas Islam Negeri
METODE PENELITIAN. Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
 III. METODE PENELITIAN A. Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung. Penelitian
III. METODE PENELITIAN A. Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung. Penelitian
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN 3.1. Rancangan Penelitian Penelitian ini merupakan penelitian eksperimental. Rancangan yang digunakan dalam penelitian ini adalah rancangan acak lengkap (RAL) tunggal, dengan
BAB III METODE PENELITIAN 3.1. Rancangan Penelitian Penelitian ini merupakan penelitian eksperimental. Rancangan yang digunakan dalam penelitian ini adalah rancangan acak lengkap (RAL) tunggal, dengan
Koloni bakteri endofit
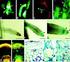 Lampiran : 1 Isolasi Bakteri Endofit pada tanaman V. varingaefolium Tanaman Vaccinium varingaefolium Diambil bagian akar tanaman Dicuci (menghilangkan kotoran) Dimasukkan ke dalam plastik Dimasukkan ke
Lampiran : 1 Isolasi Bakteri Endofit pada tanaman V. varingaefolium Tanaman Vaccinium varingaefolium Diambil bagian akar tanaman Dicuci (menghilangkan kotoran) Dimasukkan ke dalam plastik Dimasukkan ke
DEPARTEMEN BIOLOGI FMIPA USU LAMPIRAN
 LAMPIRAN Lampiran 1. Diagram Alir Penelitian Peremajaan Bacillus Isolasi Bakteri Oportunistik Produksi Antimikrob Penghitungan Sel Bakteri Oportunistik Pengambilan Supernatan Bebas Sel Pemurnian Bakteri
LAMPIRAN Lampiran 1. Diagram Alir Penelitian Peremajaan Bacillus Isolasi Bakteri Oportunistik Produksi Antimikrob Penghitungan Sel Bakteri Oportunistik Pengambilan Supernatan Bebas Sel Pemurnian Bakteri
LAMPIRAN. Lampiran 1. Alur Kerja Isolasi Bakteri Endofit dari Batang dan Akar Tanaman Dara metode Radu & Kqueen (2002) yang dimodifikasi
 LAMPIRAN Lampiran 1. Alur Kerja Isolasi Bakteri Endofit dari Batang dan Akar Tanaman Dara metode Radu & Kqueen (2002) yang dimodifikasi Bagian akar dan batang (3-5 cm) Dicuci dengan air mengalir selama
LAMPIRAN Lampiran 1. Alur Kerja Isolasi Bakteri Endofit dari Batang dan Akar Tanaman Dara metode Radu & Kqueen (2002) yang dimodifikasi Bagian akar dan batang (3-5 cm) Dicuci dengan air mengalir selama
III. METODE PENELITIAN. Penelitian ini dilakukan pada bulan Januari sampai bulan April 2014.
 14 III. METODE PENELITIAN A. Tempat Dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Mikrobiologi Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas
14 III. METODE PENELITIAN A. Tempat Dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Mikrobiologi Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas
BAB 2 TINJAUAN PUSTAKA
 BAB 2 TINJAUAN PUSTAKA 2.1 Kitin dan Bakteri Kitinolitik Kitin adalah polimer kedua terbanyak di alam setelah selulosa. Kitin merupakan komponen penyusun tubuh serangga, udang, kepiting, cumi-cumi, dan
BAB 2 TINJAUAN PUSTAKA 2.1 Kitin dan Bakteri Kitinolitik Kitin adalah polimer kedua terbanyak di alam setelah selulosa. Kitin merupakan komponen penyusun tubuh serangga, udang, kepiting, cumi-cumi, dan
BAHAN DAN METODE Waktu dan Tempat Penelitian Bahan Penelitian Metode Penelitian Isolasi dan Identifikasi Cendawan Patogen
 14 BAHAN DAN METODE Waktu dan Tempat Penelitian Percobaan dilaksanakan dari bulan Maret sampai bulan Juli 2012 di Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut
14 BAHAN DAN METODE Waktu dan Tempat Penelitian Percobaan dilaksanakan dari bulan Maret sampai bulan Juli 2012 di Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut
III. BAHAN DAN METODE. Penelitian ini dilaksanakan pada bulan Juli sampai dengan Desember 2014.
 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan pada bulan Juli sampai dengan Desember 2014. Isolasi dan karakterisasi penyebab penyakit dilakukan di Laboratorium Penyakit
III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan pada bulan Juli sampai dengan Desember 2014. Isolasi dan karakterisasi penyebab penyakit dilakukan di Laboratorium Penyakit
BAHAN. bulan Juli diremajakan. pertumbuhan. Gambar 4
 14 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilakukan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian serta di Rumah Kaca University Farm, Institut
14 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilakukan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian serta di Rumah Kaca University Farm, Institut
III. BAHAN DAN METODE
 III. BAHAN DAN METODE 3.1. Tempat dan Waktu Penelitian ini telah dilaksanakan di Laboratorium Penyakit Tumbuhan Fakultas Pertanian Universitas Riau, Pekanbaru yang berlangsung selama 4 bulan, dimulai dari
III. BAHAN DAN METODE 3.1. Tempat dan Waktu Penelitian ini telah dilaksanakan di Laboratorium Penyakit Tumbuhan Fakultas Pertanian Universitas Riau, Pekanbaru yang berlangsung selama 4 bulan, dimulai dari
EKSPLORASI Pseudomonad fluorescens DARI PERAKARAN GULMA PUTRI MALU (Mimosa invisa)
 EKSPLORASI Pseudomonad fluorescens DARI PERAKARAN GULMA PUTRI MALU (Mimosa invisa) A. Pendahuluan Pseudomonad fluorescens merupakan anggota kelompok Pseudomonas yang terdiri atas Pseudomonas aeruginosa,
EKSPLORASI Pseudomonad fluorescens DARI PERAKARAN GULMA PUTRI MALU (Mimosa invisa) A. Pendahuluan Pseudomonad fluorescens merupakan anggota kelompok Pseudomonas yang terdiri atas Pseudomonas aeruginosa,
METODE PENELITIAN. Penelitian ini dilakukan di Laboratorium Mikrobiologi Jurusan Biologi Fakultas
 III. METODE PENELITIAN A. Tempat dan Waktu Penelitian Penelitian ini dilakukan di Laboratorium Mikrobiologi Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung dari bulan
III. METODE PENELITIAN A. Tempat dan Waktu Penelitian Penelitian ini dilakukan di Laboratorium Mikrobiologi Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung dari bulan
3 Metode Penelitian 3.1 Alat-alat
 3 Metode Penelitian 3.1 Alat-alat Alat-alat gelas yang dibutuhkan: Cawan petri untuk wadah media padat dan tempat membiakkan organisme Gelas erlenmeyer untuk wadah membuat media sekaligus tempat membiakkan
3 Metode Penelitian 3.1 Alat-alat Alat-alat gelas yang dibutuhkan: Cawan petri untuk wadah media padat dan tempat membiakkan organisme Gelas erlenmeyer untuk wadah membuat media sekaligus tempat membiakkan
III. BAHAN DAN METODE. Penelitian ini dilaksanakan pada bulan Juli sampai bulan November 2009, di
 III. BAHAN DAN METODE A. Tempat dan Waktu Penelitian Penelitian ini dilaksanakan pada bulan Juli sampai bulan November 2009, di Laboratorium Kesuburan Tanah, dan Laboratorium Bioteknologi Pertanian Fakultas
III. BAHAN DAN METODE A. Tempat dan Waktu Penelitian Penelitian ini dilaksanakan pada bulan Juli sampai bulan November 2009, di Laboratorium Kesuburan Tanah, dan Laboratorium Bioteknologi Pertanian Fakultas
BAB III METODE PENELITIAN. lengkap (RAL) pola faktorial yang terdiri dari 2 faktor. Faktor pertama adalah variasi
 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Rancangan yang digunakan dalam penelitian ini adalah rancangan acak lengkap (RAL) pola faktorial yang terdiri dari 2 faktor. Faktor pertama adalah variasi
BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Rancangan yang digunakan dalam penelitian ini adalah rancangan acak lengkap (RAL) pola faktorial yang terdiri dari 2 faktor. Faktor pertama adalah variasi
BAHAN DAN METODE Bahan dan Alat
 23 III. BAHAN DAN METODE 3.1. Tempat dan Waktu Penelitian Penelitian dilakukan di Laboratorium Bioteknologi Tanah, Departemen Ilmu Tanah dan Sumberdaya Lahan, Fakultas Pertanian, Institut Pertanian Bogor
23 III. BAHAN DAN METODE 3.1. Tempat dan Waktu Penelitian Penelitian dilakukan di Laboratorium Bioteknologi Tanah, Departemen Ilmu Tanah dan Sumberdaya Lahan, Fakultas Pertanian, Institut Pertanian Bogor
BAB III METODE PENELITIAN. Rancangan Penelitian yang digunakan dalam penelitian ini adalah RAL
 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Rancangan Penelitian yang digunakan dalam penelitian ini adalah RAL faktorial dengan 15 perlakuan dan 3 kali ulangan. Desain perlakuan pada penelitian
BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Rancangan Penelitian yang digunakan dalam penelitian ini adalah RAL faktorial dengan 15 perlakuan dan 3 kali ulangan. Desain perlakuan pada penelitian
BAHAN DAN METODE. Penelitian ini dilaksanakan di Laboratorium Penyakit Tumbuhan dan di halaman
 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Penyakit Tumbuhan dan di halaman Jurusan Proteksi Tanaman Fakultas Pertanian Universitas Lampung dari bulan
III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Penyakit Tumbuhan dan di halaman Jurusan Proteksi Tanaman Fakultas Pertanian Universitas Lampung dari bulan
BAB III METODE PENELITIAN. Pangan dan Hortikultura Sidoarjo dan Laboratorium Mikrobiologi, Depertemen
 BAB III METODE PENELITIAN 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di UPT Pengembangan Agrobisnis Tanaman Pangan dan Hortikultura Sidoarjo dan Laboratorium Mikrobiologi, Depertemen Biologi,
BAB III METODE PENELITIAN 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di UPT Pengembangan Agrobisnis Tanaman Pangan dan Hortikultura Sidoarjo dan Laboratorium Mikrobiologi, Depertemen Biologi,
BAB III METODE PENELITIAN. konsentrasi limbah cair tapioka (10%, 20%, 30%, 40%, 50% dan 0% atau kontrol)
 34 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian disusun menggunakan metoda statistika rancangan acak lengkap (RAL) satu faktor, dimana faktor yang diujikan adalah pengaruh konsentrasi
34 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian disusun menggunakan metoda statistika rancangan acak lengkap (RAL) satu faktor, dimana faktor yang diujikan adalah pengaruh konsentrasi
III. METODOLOGI A. BAHAN DAN ALAT C. METODE PENELITIAN
 III. METODOLOGI A. BAHAN DAN ALAT Bahan baku utama yang digunakan pada penelitian ini adalah rimpang jahe segar yang diperoleh dari Balai Penelitian Tanaman Aromatik dan Obat (Balitro) Bogor berumur 8
III. METODOLOGI A. BAHAN DAN ALAT Bahan baku utama yang digunakan pada penelitian ini adalah rimpang jahe segar yang diperoleh dari Balai Penelitian Tanaman Aromatik dan Obat (Balitro) Bogor berumur 8
BAHAN DAN METODE. Penelitian dilaksanakan pada bulan Mei-Agustus Uji potensi
 BAHAN DAN METODE Waktu dan Tempat Penelitian dilaksanakan pada bulan Mei-Agustus 2016. Uji potensi mikroba pelarut fosfat dilakukan di Laboratorium Biologi Tanah, Program Studi Agroekoteknologi, Fakultas
BAHAN DAN METODE Waktu dan Tempat Penelitian dilaksanakan pada bulan Mei-Agustus 2016. Uji potensi mikroba pelarut fosfat dilakukan di Laboratorium Biologi Tanah, Program Studi Agroekoteknologi, Fakultas
Sampel air panas. Pengenceran 10-1
 Lampiran 1. Metode kerja Sampel air panas Diambil 10 ml Dicampur dengan media selektif 90ml Di inkubasi 24 jam, suhu 50 C Pengenceran 10-1 Di encerkan sampai 10-10 Tiap pengenceran di tanam di cawan petri
Lampiran 1. Metode kerja Sampel air panas Diambil 10 ml Dicampur dengan media selektif 90ml Di inkubasi 24 jam, suhu 50 C Pengenceran 10-1 Di encerkan sampai 10-10 Tiap pengenceran di tanam di cawan petri
III. METODE PENELITIAN. Penelitian dilaksanakan pada Oktober 2011 sampai Maret 2012 di Rumah Kaca
 III. METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian dilaksanakan pada Oktober 2011 sampai Maret 2012 di Rumah Kaca dan di Laboratorium Penyakit Tumbuhan Jurusan Proteksi Tanaman Fakultas Pertanian Universitas
III. METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian dilaksanakan pada Oktober 2011 sampai Maret 2012 di Rumah Kaca dan di Laboratorium Penyakit Tumbuhan Jurusan Proteksi Tanaman Fakultas Pertanian Universitas
III. BAHAN DAN METODE. Penelitian ini dilaksanakan di Laboratorium Penyakit Tanaman dan Laboratorium
 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Penyakit Tanaman dan Laboratorium Lapangan Terpadu Fakultas Pertanian Universitas Lampung pada bulan November
III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Penyakit Tanaman dan Laboratorium Lapangan Terpadu Fakultas Pertanian Universitas Lampung pada bulan November
HASIL DAN PEMBAHASAN
 HASIL DAN PEMBAHASAN Isolasi Bakteri Endofit Asal Bogor, Cipanas, dan Lembang Bakteri endofit yang digunakan dalam penelitian ini berasal dari tiga tempat yang berbeda dalam satu propinsi Jawa Barat. Bogor,
HASIL DAN PEMBAHASAN Isolasi Bakteri Endofit Asal Bogor, Cipanas, dan Lembang Bakteri endofit yang digunakan dalam penelitian ini berasal dari tiga tempat yang berbeda dalam satu propinsi Jawa Barat. Bogor,
III. BAHAN DAN METODE. Penelitian dilakukan di Laboratorium Penyakit Tanaman, Fakultas Pertanian,
 16 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian dilakukan di Laboratorium Penyakit Tanaman, Fakultas Pertanian, Universitas Lampung dan penelitian ini dilaksanakan pada bulan Juni 2014
16 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian dilakukan di Laboratorium Penyakit Tanaman, Fakultas Pertanian, Universitas Lampung dan penelitian ini dilaksanakan pada bulan Juni 2014
BAB III METODELOGI PENELITIAN
 BAB III METODELOGI PENELITIAN 3.1 JENIS PENELITIAN : Eksperimental Laboratoris 3.2 LOKASI PENELITIAN : Laboratorium Fatokimia Fakultas Farmasi UH & Laboratorium Mikrobiologi FK UH 3.3 WAKTU PENELITIAN
BAB III METODELOGI PENELITIAN 3.1 JENIS PENELITIAN : Eksperimental Laboratoris 3.2 LOKASI PENELITIAN : Laboratorium Fatokimia Fakultas Farmasi UH & Laboratorium Mikrobiologi FK UH 3.3 WAKTU PENELITIAN
BAB III METODE PENELITIAN. variasi suhu yang terdiri dari tiga taraf yaitu 40 C, 50 C, dan 60 C. Faktor kedua
 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Rancangan yang digunakan dalam penelitian ini adalah rancangan acak lengkap (RAL) pola faktorial yang terdiri dari 2 faktor. Faktor pertama adalah variasi
BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Rancangan yang digunakan dalam penelitian ini adalah rancangan acak lengkap (RAL) pola faktorial yang terdiri dari 2 faktor. Faktor pertama adalah variasi
BAB III METODOLOGI PENELITIAN. Penelitian dilaksanakan mulai bulan Juli sampai bulan November 2009
 BAB III METODOLOGI PENELITIAN 3.1 Waktu dan Lokasi Penelitian Penelitian dilaksanakan mulai bulan Juli sampai bulan November 2009 yang bertempat di Laboratorium Riset, Jurusan Pendidikan Kimia, Fakultas
BAB III METODOLOGI PENELITIAN 3.1 Waktu dan Lokasi Penelitian Penelitian dilaksanakan mulai bulan Juli sampai bulan November 2009 yang bertempat di Laboratorium Riset, Jurusan Pendidikan Kimia, Fakultas
III. BAHAN DAN METODE. Penelitian ini dilaksanakan di Laboratorium Ilmu Penyakit Tanaman Fakultas
 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Ilmu Penyakit Tanaman Fakultas Pertanian Universitas Lampung. Pelaksanaan penelitian dimulai dari September
III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Ilmu Penyakit Tanaman Fakultas Pertanian Universitas Lampung. Pelaksanaan penelitian dimulai dari September
BAB III METODE PENELITIAN. yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan 4 perlakuan dan
 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian ini merupakan penelitian eksperimental. Rancangan penelitian yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan 4 perlakuan dan 6 ulangan,
BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian ini merupakan penelitian eksperimental. Rancangan penelitian yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan 4 perlakuan dan 6 ulangan,
III. METODE PENELITIAN. Penelitian ini dilakukan pada bulan Januari hingga Maret 2015.
 13 III. METODE PENELITIAN A. Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung. Penelitian
13 III. METODE PENELITIAN A. Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung. Penelitian
BAB III BAHAN DAN METODE PENELITIAN
 BAB III BAHAN DAN METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian Penelitian dilaksanakan pada April 2013 sampai dengan Mei 2013 di laboratorium Nutrisi Fakultas Perikanan dan Ilmu Kelautan Universitas
BAB III BAHAN DAN METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian Penelitian dilaksanakan pada April 2013 sampai dengan Mei 2013 di laboratorium Nutrisi Fakultas Perikanan dan Ilmu Kelautan Universitas
MATERI DAN METODE. Kasim Riau yang beralamat di Jl. HR. Soebrantas KM 15 Panam, Pekanbaru.
 III. MATERI DAN METODE 3.1. Waktu Dan Tempat Penelitian Penelitian ini dilaksanakan di laboratorium Patologi, Entomologi, dan Mikrobiologi (PEM) dan lahan kampus Universitas Islam Negeri Sultan Syarif
III. MATERI DAN METODE 3.1. Waktu Dan Tempat Penelitian Penelitian ini dilaksanakan di laboratorium Patologi, Entomologi, dan Mikrobiologi (PEM) dan lahan kampus Universitas Islam Negeri Sultan Syarif
BAHAN DAN METODE. Penelitian dilaksanakan di Laboratorium Penyakit Tumbuhan Jurusan Proteksi
 11 III. BAHAN DAN METODE 3.1 Tempat Penelitian dan Waktu Penelitian dilaksanakan di Laboratorium Penyakit Tumbuhan Jurusan Proteksi Tanaman Fakultas Pertanian Universitas Lampung. Pelaksanaan penelitian
11 III. BAHAN DAN METODE 3.1 Tempat Penelitian dan Waktu Penelitian dilaksanakan di Laboratorium Penyakit Tumbuhan Jurusan Proteksi Tanaman Fakultas Pertanian Universitas Lampung. Pelaksanaan penelitian
BAB 2 TINJAUAN PUSTAKA
 BAB 2 TINJAUAN PUSTAKA 2.1 Kacang Tanah Kacang tanah berasal dari Amerika Selatan, namun saat ini telah menyebar ke seluruh dunia yang beriklim tropis atau subtropis. Cina dan India merupakan penghasil
BAB 2 TINJAUAN PUSTAKA 2.1 Kacang Tanah Kacang tanah berasal dari Amerika Selatan, namun saat ini telah menyebar ke seluruh dunia yang beriklim tropis atau subtropis. Cina dan India merupakan penghasil
III. METODOLOGI PENELITIAN. Penelitian ini akan dilakukan pada bulan Juli sampai September 2012,
 III. METODOLOGI PENELITIAN A. Waktu dan Tempat Penelitian Penelitian ini akan dilakukan pada bulan Juli sampai September 2012, bertempat di Laboratorium Biokimia Jurusan Kimia Fakultas MIPA Universitas
III. METODOLOGI PENELITIAN A. Waktu dan Tempat Penelitian Penelitian ini akan dilakukan pada bulan Juli sampai September 2012, bertempat di Laboratorium Biokimia Jurusan Kimia Fakultas MIPA Universitas
BAHAN DAN METODE. Pengambilan sampel tanaman nanas dilakukan di lahan perkebunan PT. Great
 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Pengambilan sampel tanaman nanas dilakukan di lahan perkebunan PT. Great Giant Pineapple (GGP) di Lampung Timur dan PT. Nusantara Tropical Farm, Lampung
III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Pengambilan sampel tanaman nanas dilakukan di lahan perkebunan PT. Great Giant Pineapple (GGP) di Lampung Timur dan PT. Nusantara Tropical Farm, Lampung
III. METODE PENELITIAN
 III. METODE PENELITIAN A. Materi, Lokasi dan Waktu Penelitian 1. Materi Penelitian a. Bahan Bahan yang digunakan dalam penelitian ini adalah jamur yang memiliki tubuh buah, serasah daun, ranting, kayu
III. METODE PENELITIAN A. Materi, Lokasi dan Waktu Penelitian 1. Materi Penelitian a. Bahan Bahan yang digunakan dalam penelitian ini adalah jamur yang memiliki tubuh buah, serasah daun, ranting, kayu
III. BAHAN DAN METODE. Sampel tanah diambil dari daerah di sekitar risosfer tanaman nanas di PT. Great
 9 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Sampel tanah diambil dari daerah di sekitar risosfer tanaman nanas di PT. Great Giant Pineapple (GGP) Terbanggi Besar, Lampung Tengah dan PT. Nusantara
9 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Sampel tanah diambil dari daerah di sekitar risosfer tanaman nanas di PT. Great Giant Pineapple (GGP) Terbanggi Besar, Lampung Tengah dan PT. Nusantara
BAHAN DAN METODE. Bahan
 9 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilaksanakan di Laboratorium Patologi Serangga, dan Laboratorium Fisiologi dan Toksikologi Serangga, Departemen Proteksi Tanaman, Fakultas Pertanian,
9 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilaksanakan di Laboratorium Patologi Serangga, dan Laboratorium Fisiologi dan Toksikologi Serangga, Departemen Proteksi Tanaman, Fakultas Pertanian,
BAHAN DAN METODE Waktu dan Tempat Penelitian Bahan Metode Penelitian Pembuatan Pupuk Hayati
 BAHAN DAN METODE Waktu dan Tempat Penelitian Penelitian dilaksanakan di Laboratorium Fisiologi Tumbuhan dan Laboratorium Mikrobiologi Departemen Biologi Institut Pertanian Bogor, serta di kebun percobaan
BAHAN DAN METODE Waktu dan Tempat Penelitian Penelitian dilaksanakan di Laboratorium Fisiologi Tumbuhan dan Laboratorium Mikrobiologi Departemen Biologi Institut Pertanian Bogor, serta di kebun percobaan
HASIL DAN PEMBAHASAN Isolasi dan Inokulasi Penyebab Busuk Lunak Karakterisasi Bakteri Penyebab Busuk Lunak Uji Gram
 HASIL DAN PEMBAHASAN Isolasi dan Inokulasi Penyebab Busuk Lunak Isolasi daun anggrek yang bergejala busuk lunak dihasilkan 9 isolat bakteri. Hasil uji Gram menunjukkan 4 isolat termasuk bakteri Gram positif
HASIL DAN PEMBAHASAN Isolasi dan Inokulasi Penyebab Busuk Lunak Isolasi daun anggrek yang bergejala busuk lunak dihasilkan 9 isolat bakteri. Hasil uji Gram menunjukkan 4 isolat termasuk bakteri Gram positif
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian ini dilaksanakan di Laboratorium dan Rumah Kaca Departemen Silvikultur, Fakultas Kehutanan, Institut Pertanian Bogor, mulai bulan Januari 2012
BAB III METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian ini dilaksanakan di Laboratorium dan Rumah Kaca Departemen Silvikultur, Fakultas Kehutanan, Institut Pertanian Bogor, mulai bulan Januari 2012
III. METODE PENELITIAN
 III. METODE PENELITIAN A. Tahap Laboratorium 1. Uji Kemampuan Isolat a. Tempat dan Waktu Penelitian Uji kemampuan 40 isolat bakteri dilaksanakan di laboratorium Biologi dan Bioteknologi Tanah, Fakultas
III. METODE PENELITIAN A. Tahap Laboratorium 1. Uji Kemampuan Isolat a. Tempat dan Waktu Penelitian Uji kemampuan 40 isolat bakteri dilaksanakan di laboratorium Biologi dan Bioteknologi Tanah, Fakultas
HIBAH KOMPETITIF PENELITIAN SESUAI PRIORITAS NASIONAL BATCH II
 HIBAH KOMPETITIF PENELITIAN SESUAI PRIORITAS NASIONAL BATCH II KAJIAN PEMBIAKAN BAKTERI KITINOLITIK Pseudomonas fluorescens dan Bacillus sp PADA LIMBAH ORGANIK DAN FORMULASINYA SEBAGAI PESTISIDA HAYATI
HIBAH KOMPETITIF PENELITIAN SESUAI PRIORITAS NASIONAL BATCH II KAJIAN PEMBIAKAN BAKTERI KITINOLITIK Pseudomonas fluorescens dan Bacillus sp PADA LIMBAH ORGANIK DAN FORMULASINYA SEBAGAI PESTISIDA HAYATI
bio.unsoed.ac.id III. METODE PENELITIAN
 III. METODE PENELITIAN A. Materi, Lokasi dan Waktu Penelitian 1. Materi Penelitian 1.1. Bahan Materi yang digunakan dalam penelitian ini adalah sampel tanah dari rizosfer tanaman Cabai merah (Capsicum
III. METODE PENELITIAN A. Materi, Lokasi dan Waktu Penelitian 1. Materi Penelitian 1.1. Bahan Materi yang digunakan dalam penelitian ini adalah sampel tanah dari rizosfer tanaman Cabai merah (Capsicum
METODE PENELITIAN. Kehutanan dan di Laboratorium Hama dan Penyakit Tanaman Program Studi
 23 METODE PENELITIAN Tempat dan Waktu Penelitian Penelitian dilakukan di Laboratorium Bioteknologi Program Studi Kehutanan dan di Laboratorium Hama dan Penyakit Tanaman Program Studi Agroekoteknologi,
23 METODE PENELITIAN Tempat dan Waktu Penelitian Penelitian dilakukan di Laboratorium Bioteknologi Program Studi Kehutanan dan di Laboratorium Hama dan Penyakit Tanaman Program Studi Agroekoteknologi,
III. BAHAN DAN METODE. Tanaman, serta Laboratorium Lapang Terpadu, Fakultas Pertanian, Universitas
 13 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Hama dan Penyakit Bidang Proteksi Tanaman, serta Laboratorium Lapang Terpadu, Fakultas Pertanian, Universitas
13 III. BAHAN DAN METODE 3.1 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Hama dan Penyakit Bidang Proteksi Tanaman, serta Laboratorium Lapang Terpadu, Fakultas Pertanian, Universitas
