STUDI OVER-EKSPRESI GEN PENYANDI HORMON PERTUMBUHAN MELALUI ELEKTROPORASI SPERMA UNTUK MEMBUAT IKAN PATIN SIAM TRANSGENIK CEPAT TUMBUH
|
|
|
- Vera Tan
- 7 tahun lalu
- Tontonan:
Transkripsi
1 STUDI OVER-EKSPRESI GEN PENYANDI HORMON PERTUMBUHAN MELALUI ELEKTROPORASI SPERMA UNTUK MEMBUAT IKAN PATIN SIAM TRANSGENIK CEPAT TUMBUH RADEN RORO SRI PUDJI SINARNI DEWI SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR BOGOR 2010
2 PERNYATAAN MENGENAI DISERTASI DAN SUMBER INFORMASI Dengan ini saya menyatakan bahwa disertasi Studi Over-Ekspresi Gen Penyandi Hormon Pertumbuhan Melalui Elektroporasi Sperma untuk Membuat Ikan Patin Siam Transgenik Cepat Tumbuh adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di disertasi ini. Bogor, Juli 2010 Raden Roro Sri Pudji Sinarni Dewi NIM C
3 ABSTRACT RADEN RORO SRI PUDJI SINARNI DEWI. Study on Over Expression of Gene Encoding Growth Hormone by Sperm Electroporation to Produce Transgenic Fast-Growing Stripped Catfish. Under direction of KOMAR SUMANTADINATA, AGUS OMAN SUDRAJAT, and ALIMUDDIN. Stripped catfish (Pangasionodon hypophthalmus) is one of freshwater fish species that has high economic value in Indonesia. Limited attention has been paid to increase the growth of stripped catfish towards enhancement of its aquaculture productivity. In this research, we developed transgenesis technology to produce stripped catfish transgenic F0 as a material to obtain stable line transgenic fish with an improved growth rate character. Research was conducted in some steps: cloning and characterization of gene encoding stripped catfish growth hormone (PhGH), making of all fish gene construction which consist of PhGH cdna (complementary DNA) directed by carp β-actin promoter (pccba), developing electroporation technique using sperm mediated gene transfer (SMGT) and screening stripped catfish juvenile which carrying PhGH exogenous gene by PCR and RT-PCR methods. Complementary DNA encoding PhGH was isolated from pituitary by RT-PCR method. The size of PhGH cdna was 1148 bp which consisted of 603 bp of ORF (open reading frame) and encoded 200 amino acid residues. PhGH gene has common characteristic like others teleost GH gene. To make all-fish gene construction of pccba-phgh, PhGH cdna was ligated with carp β-actin promoter (pccba). The size of pccba-phgh construction was 6.6 kb. Increasing in electric field strength on sperm electroporation caused a decrease in sperm motility and embryos hatchling. Higher sperm motility and embryos hatchling were obtained at the electric field strength of 125 V/cm. Increasing concentrations of plasmid DNA caused an increase in the number of individuals carrying the exogenous PhGH gene. Electroporation using plasmid DNA concentration of 90 μg/ml effectively produced transgenic F0. Further, ectopic expression of exogenous PhGH in transgenic fish F0 at 2 months old increased % of their body weight compared to non-transgenic. Average body weight of 4 months juvenile treated with 90 μg/ml of DNA plasmid was 53.38% heavier than control. Therefore, stripped catfish growth rate could be increased by over expression of gene encoding growth hormone. Then, followed by stable transgenic stripped catfish generation, their culture production suggested to be increased significantly. Keywords: Pangasionodon hypophthalmus, transgenesis, PhGH gene, electroporation, gene expression
4 RINGKASAN RADEN RORO SRI PUDJI SINARNI DEWI. Studi Over-Ekspresi Gen Penyandi Hormon Pertumbuhan Melalui elektroporasi Sperma untuk Membuat Ikan Patin Siam Transgenik Cepat Tumbuh. Dibimbing oleh KOMAR SUMANTADINATA, AGUS OMAN SUDRAJAT DAN ALIMUDDIN. Ikan patin siam (Pangasionodon hypophthalmus) merupakan salah satu spesies ikan air tawar yang memiliki nilai ekonomis tinggi di Indonesia. Dalam program peningkatan produksi perikanan budidaya tahun 2014, ikan patin menempati urutan ke-3 dengan target peningkatan produksi sebesar 70%/tahun. Berbagai penelitian yang bisa mendukung program Kementerian Kelautan dan Perikanan tersebut telah dilakukan pada bidang nutrisi, reproduksi dan lingkungan. Sementara itu, penelitian di bidang genetika dalam rangka memperoleh benih unggul masih dalam tahap permulaan. Penggunaan teknologi transgenesis terbukti mampu meningkatkan pertumbuhan spesies ikan budidaya sampai beberapa kali lipat. Pada penelitian ini, transgenesis digunakan untuk meningkatkan pertumbuhan ikan patin siam. Penelitian dilakukan melalui beberapa tahapan yaitu: kloning gen penyandi hormon pertumbuhan ikan patin siam (PhGH), optimalisasi kondisi elektroporasi dengan menggunakan sperma sebagai perantara transfer gen, pembuatan konstruksi gen dan transfer gen pccba-phgh dengan menggunakan metode elektroporasi melalui sperma, serta analisis ekspresi gen PhGH secara genotipe dan fenotipe. Gen PhGH diisolasi dari kelenjar pituitari menggunakan metode RT-PCR. Pembacaan sekuens nukleotida gen PhGH dilakukan dengan menggunakan mesin ABIPRISM Analisa homologi sekuens nukleotida dan deduksi asam amino ikan patin siam dengan ikan lainnya dilakukan dengan menggunakan program BLAST N/P dan Genetyx versi 7. Sekuens gen PhGH selanjutnya disambungkan dengan promoter β-aktin ikan mas (pccba). Konstruksi gen pccba-phgh dikembangkan dari konstruksi gen pccba-oggh. Hasil penelitian menunjukkan sekuens nukleotida gen PhGH ikan patin siam tersusun atas 1148 bp yang terdiri dari 603 bp daerah pengkodean (ORF, open reading frame), 18 bp daerah yang tidak dikodekan pada bagian ujung 5, dan 527 bp pada ujung 3. Gen PhGH memiliki beberapa ciri seperti halnya gen GH ikan umumnya yaitu: residu tryptophan (W) tunggal pada asam amino ke-104, 5 residu sistein (C) pada asam amino ke-71, 135, 173,190, dan 198, serta motif Asn-Xaa-Thr pada terminal C yang berpotensi sebagai lokasi N-linked glycosilation. Transfer gen dilakukan menggunakan teknik elektroporasi dengan menggunakan sperma yang berperan sebagai perantara. Pengujian berbagai kondisi elektroporasi dilakukan dengan menggunakan gen EGFP (enhanced green fluorescent protein), yang berperan sebagai reporter gene, yang dikendalikan oleh promoter β-aktin ikan mas. Elektroporasi dilakukan dengan menguji kombinasi berbagai tingkat kuat medan listrik (125; 187,5 dan 250 V/cm) dan jumlah kejutan (1 dan 3). Beberapa parameter yang diukur untuk menentukan keberhasilan elektroporasi adalah motilitas spermatozoa, kelangsungan hidup spermatozoa dan deteksi keberadaan gen EGFP pada sperma dan larva. Kemampuan promoter β-
5 aktin ikan mas diukur melalui analisis ekspresi gen EGFP dengan menggunakan teknik PCR semi kuantitatif. Pengujian berbagai kombinasi kuat medan listrik dan jumlah kejutan listrik dengan menggunakan gen EGFP menunjukkan sperma yang dielektroporasi dengan kuat medan listrik 125 V/cm memiliki nilai motilitas dan derajat penetasan telur yang tidak berbeda dengan sperma yang tidak dielektroporasi. Deteksi keberadaan gen EGFP pada larva yang berasal dari telur yang dibuahi sperma yang dielektroporasi menunjukkan bahwa transgen berhasil ditransfer ke dalam ikan resipien. Aktivitas promoter β-aktin ikan mas diukur berdasarkan ekspresi sementara (transient expression) gen EGFP pada embrio dan larva ikan patin siam. Promoter β-aktin ikan mas mampu mengaktifkan transkripsi gen EGFP. Percobaan uji aktivitas promoter β-aktin ikan mas pada embrio dan larva ikan patin siam menunjukkan bahwa ekspresi gen EGFP mencapai puncaknya pada fase neurula dan menurun pada fase larva. Kondisi elektroporasi yang optimal digunakan untuk mentransfer gen PhGH yang ada dalam konstruksi pccba-phgh ke dalam sperma ikan patin siam. Pengujian berbagai konsentrasi DNA plasmid (10, 50 dan 90 µg/ml) dilakukan untuk mendapatkan konsentrasi DNA optimal dengan tingkat keberhasilan transfer gen terbaik. Ekspresi gen PhGH eksogen diukur secara genotipe yaitu melalui ekspresi mrna PhGH dan secara fenotipe yaitu melalui pengukuran bobot tubuh ikan transgenik dan non-transgenik. Pengujian berbagai tingkat konsentrasi DNA plasmid menunjukkan bahwa konsentrasi DNA plasmid dalam larutan mempengaruhi keberhasilan transfer gen PhGH dan ekspresi gen PhGH eksogen secara fenotipe. Pada konsentrasi DNA plasmid 90 µg/ml, keberhasilan transfer gen PhGH eksogen 85,71% dengan bobot rata-rata juvenil ikan transgenik umur 2 bulan 19% lebih berat dibandingkan dengan yang non-transgenik. Adapun pada juvenil umur 4 bulan, rataan bobot populasi yang diberi perlakuan DNA plasmid dengan konsentrasi 90 µg/ml bobotnya lebih berat 53,38% dibandingkan kontrol. Dengan demikian laju pertumbuhan ikan patin siam dapat ditingkatkan melalui over-ekspresi gen penyandi hormon pertumbuhan, dan budidaya ikan patin siam dengan karakter tumbuh cepat diduga dapat meningkatkan produksinya secara signifikan.
6 Hak Cipta milik IPB, tahun 2010 Hak Cipta dilindungi Undang-Undang 1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah. b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB 2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB.
7 STUDI OVER-EKSPRESI GEN PENYANDI HORMON PERTUMBUHAN MELALUI ELEKTROPORASI SPERMA UNTUK MEMBUAT IKAN PATIN SIAM TRANSGENIK CEPAT TUMBUH RADEN RORO SRI PUDJI SINARNI DEWI Disertasi Sebagai salah satu syarat untuk memperoleh gelar Doktor pada Program Studi Ilmu Akuakultur SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR BOGOR 2010
8 Penguji pada Ujian Tertutup: Prof.Dr.Ir. Ronny Rachman Noor, M.Rur.Sc. Dr.Ir. Odang Carman, M.Sc. Penguji pada Ujian Terbuka: Dr.Ir. Endhay Kusnendar, M.S. Dr.Ir. Utut Widyastuti, M.Si.
9 Judul Disertasi Nama NIM : Studi Over-ekspresi Gen Penyandi Hormon Pertumbuhan Melalui Elektroporasi Sperma untuk Membuat Ikan Patin Siam Transgenik Cepat Tumbuh. : Raden Roro Sri Pudji Sinarni Dewi : C Disetujui Komisi Pembimbing Prof.Dr.Ir. Komar Sumantadinata, M.Sc. Ketua Dr.Ir. Agus Oman Sudrajat, M.Sc. Anggota Dr.Alimuddin, S.Pi., M.Sc. Anggota Mengetahui Ketua Program Studi Ilmu Akuakultur Dekan Sekolah Pascasarjana Prof.Dr.Ir. Enang Harris, M.S. Prof.Dr.Ir. Khairil A. Notodiputro,M.S. Tanggal Ujian: 10 Agustus 2010 Tanggal Lulus:.
10 PRAKATA Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia- Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian ini ialah produksi ikan patin siam transgenik, dengan judul Studi Over- Ekspresi Gen Penyandi Hormon Pertumbuhan melalui Elektroporasi Sperma untuk Membuat Ikan Patin Siam Cepat Tumbuh. Penelitian dilaksanakan mulai Bulan Juni 2008 sampai dengan Februari 2010 di Laboratorium Reproduksi dan Genetika Organisme Akuatik, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor (IPB) di Bogor dan Loka Riset Pemuliaan dan Teknologi Budidaya Perikanan Air Tawar di Sukamandi. Bab II dari disertasi ini telah dipublikasikan dalam Indonesian Aquaculture Journal 4(1): 9-17, tahun 2009 dengan judul Identification of Growth Hormone Gene of Pangasionodon hypophthalmus, dan dipresentasikan pada Forum Inovasi Akuakultur Indonesia (FITA) I pada tahun 2009 di Surabaya. Terima kasih penulis ucapkan kepada komisi pembimbing: Prof Dr Ir. Komar Sumantadinata, M.Sc., Dr.Ir. Agus Oman Sudrajat, M.Sc. dan Dr. Alimuddin, S.Pi., M.Sc., atas segala bimbingan dalam penyusunan proposal, pelaksanaan penelitian, dan penulisan disertasi. Penulis mengucapkan terima kasih kepada Prof.Dr.Ir. Enang Harris, M.Sc. dan Dr.Ir. Dinar Setyowati, M.Sc., selaku penguji luar komisi pada ujian prakualifikasi program Doktor. Ucapan terima kasih juga disampaikan kepada Prof.Dr.Ir. Ronny Rachman Noor, M.Rur.Sc., Dr.Ir. Odang Carman, M.Sc., Dr.Ir. Endhay Kusnendar, M.S. dan Dr.Ir. Utut Widyastuti, M.Si. sebagai penguji luar komisi pada ujian tertutup dan ujian terbuka. Ucapan terima kasih penulis sampaikan pula pada Ir. Retna Utami, M.Sc. selaku Kepala Bidang Monitoring dan Evaluasi PRPB dan Ir. Wayan Subamia, M.Si. selaku Kepala LRPTBPAT Sukamandi beserta seluruh rekan-rekan peneliti khususnya Drs. Sularto, M.Si. dan Ir. Evi Tahapari yang telah memberikan banyak dukungan selama penulis menjalankan studi, juga rekan-rekan akuakultur program Doktor angkatan 2007, serta rekan-rekan di Laboratorium Reproduksi dan Genetika Organisme Akuatik. Ungkapan terima kasih penulis sampaikan kepada ayahanda Raden Sulyadi (alm), Ibunda Suratmi, suami M. Ali Nurdin, S.Pi, kedua anak tercinta Adinda Nurazizah dan Sarah Alya Dewi serta seluruh keluarga atas segala doa dan dorongan semangatnya. Semoga disertasi ini dapat memberikan manfaat bagi perkembangan penelitian dan ilmu pengetahuan juga dapat dijadikan awal untuk meningkatkan produksi ikan budidaya di Indonesia. Bogor, Juli 2010 Raden Roro Sri Pudji Sinarni Dewi
11 DAFTAR ISI Halaman DAFTAR TABEL. DAFTAR GAMBAR 1 PENDAHULUAN.. 1 Latar Belakang. 1 Tujuan dan Manfaat. 7 Kebaharuan Penelitian. 7 Ruang Lingkup Penelitian KARAKTERISASI GEN PENYANDI HORMON PERTUMBUHAN IKAN PATIN SIAM (Pangasionodon hypophthalmus)... 9 Abstrak Abstract 10 Pendahuluan 10 Bahan dan Metode.. 12 Hasil dan Pembahasan. 17 Kesimpulan PENGEMBANGAN METODE ELEKTROPORASI PADA SPERMA SEBAGAI PERANTARA TRANSFER GEN PADA IKAN PATIN SIAM (Pangasionodon hypophthalmus) Abstrak 25 Abstract 26 Pendahuluan 26 Bahan dan Metode.. 29 Hasil dan Pembahasan. 35 Kesimpulan EFEKTIVITAS TRANSFER DAN EKSPRESI GEN PhGH PADA IKAN PATIN SIAM (Pangasionodon hypophthalmus) Abstrak 45 Abstract 46 Pendahuluan 46 Bahan dan Metode.. 48 Hasil dan Pambahasan. 51 Kesimpulan PEMBAHASAN UMUM KESIMPULAN UMUM 65 DAFTAR PUSTAKA 66
12 DAFTAR TABEL Halaman 1 Kriteria penilaian motilitas spermatozoa Motilitas spermatozoa ikan patin siam yang dielektroporasi pada beberapa tingkat kuat medan listrik Motilitas spermatozoa yang dielektroporasi pada beberapa tingkat kombinasi kuat medan listrik dan jumlah kejutan 36 4 Keberhasilan transfer gen PhGH eksogen pada juvenil ikan patin siam pada beberapa tingkat konsentrasi DNA plasmid Beberapa konstruksi gen all fish dalam pembuatan ikan transgenik GH SMGT pada berbagai spesies hewan 62
13 DAFTAR GAMBAR Halaman 1 Peta konstruksi gen dalam bentuk plasmid Roadmap penelitian untuk produksi ikan patin siam transgenik Deteksi gen penyandi hormon pertumbuhan pada beberapa jaringan tubuh ikan patin siam Cracking hasil transformasi pada plasmid pgem-t Easy yang diligasi gen PhGH Sekuens nukleotida dan deduksi asam amino penyusun gen PhGH Perbandingan sekuens asam amino gen PhGH dengan spesies-spesies ikan dari lima ordo yang berbeda Pohon filogenetik yang didasarkan pada sekuens asam amino gen PhGH dengan beberapa spesies ikan dari lima ordo yang berbeda Peta konstruksi gen pccba-egfp (6,0 kb) Spermatozoa ikan patin siam Kelangsungan hidup spermatozoa (%) yang dielektroporasi pada beberapa tingkat kuat medan listrik Kelangsungan hidup spermatozoa (%) yang dielektroporasi pada beberapa tingkat kombinasi kuat medan listrik dan jumlah kejutan Derajat pembuahan (%) telur ikan patin siam yang dibuahi oleh spermatozoa yang dielektroporasi pada beberapa tingkat kombinasi kuat medan listrik dan jumlah kejutan Derajat penetasan (%) telur ikan patin siam yang dibuahi oleh spermatozoa yang dielektroporasi pada beberapa tingkat kombinasi kuat medan listrik dan jumlah kejutan Keberadaan gen EGFP (tanda kepala panah) pada spermatozoa ikan patin siam setelah dielektroporasi dan pada kontrol (K) Keberadaan gen EGFP (tanda kepala panah) pada larva ikan patin siam setelah dielektroporasi dan pada kontrol (K) Fase perkembangan embrio ikan patin siam yang diamati setiap enam jam sekali
14 17 18 Pola ekspresi gen EGFP yang diamati selama perkembangan embrio sampai menetas.. Level ekspresi gen EGFP pada embrio dan larva ikan patin siam Peta konstrusi gen pccba-phgh (6,6 kb) Deteksi gen PhGH eksogen pada ikan patin siam Ekspresi mrna PhGH eksogen pada sirip individu ikan patin siam transgenik Distribusi bobot individu juvenil ikan patin siam hasil introduksi gen pccba-phgh dengan konsentrasi plasmid yang berbeda 55
15 1 1. PENDAHULUAN LATAR BELAKANG Ikan patin siam (Pangasionodon hypophthalmus) merupakan salah satu spesies ikan air tawar yang memiliki nilai ekonomis tinggi di Indonesia. Dalam program peningkatan produksi perikanan budidaya tahun 2014, ikan patin menempati urutan ke-3 dengan target peningkatan produksi sebesar 70%/tahun (Kementerian Kelautan dan Perikanan 2010). Berbagai penelitian yang bisa mendukung program Kementerian Kelautan dan Perikanan tersebut telah dilakukan pada bidang nutrisi (Ahmadi 2001; Mokoginta et al. 2000, Suwarsito 2007, Tahapari et al. 2008), reproduksi (Indriastuti 2000) dan lingkungan (Taufik et al. 2005; Taufik et al. 2007). Sementara itu, penelitian di bidang genetika dalam rangka memperoleh benih unggul masih dalam tahap permulaan. Program seleksi untuk mendapatkan induk unggul dengan karakter pertumbuhan yang cepat saat ini sedang dilakukan oleh Balai Budidaya Air Tawar Jambi, di bawah Kementerian Kelautan dan Perikanan. Program seleksi merupakan metode yang efektif untuk meningkatkan produktivitas dan meningkatkan karakter lainnya seperti meningkatkan resistensi penyakit (Gjedrem 1997). Program seleksi secara umum mampu meningkatkan pertumbuhan 6-7% per generasi pada sebagian besar ikan budidaya. Adapun pada beberapa spesies seperti salmon Atlantik, Salmo salar, salmon Coho, channel catfish, Labeo rohita dan nila, program seleksi dengan menggunakan seleksi massal maupun famili mampu meningkatkan pertumbuhan 11-14% per generasi (Dunham et al. 2001). Namun demikian metode seleksi memiliki beberapa kelemahan antara lain membutuhkan waktu yang relatif lama dan membutuhkan banyak generasi keturunan. Selain itu seleksi tidak dapat digunakan untuk meningkatkan karakteristik lain yang diinginkan seperti meningkatkan resistensi ikan terhadap suhu dingin (Fletcher et al. 2004). Perkembangan bioteknologi yang pesat pada saat ini memungkinkan untuk mendapatkan produk perikanan dengan karakteristik yang diinginkan. Transgenesis atau teknologi rekombinan DNA merupakan rekayasa genetik yang
16 2 memungkinkan kombinasi ulang (rekombinasi) atau penggabungan ulang gen dari sumber yang berbeda secara in vitro yang kemudian diintroduksikan pada suatu individu. Gen yang telah mengalami rekombinasi ini disebut dengan gen rekombinan atau gen asing. Gen yang diintroduksi atau biasa disebut dengan transgen merupakan pengkode protein tertentu yang mengontrol karakter yang diinginkan dan berguna bagi akuakultur. Keunggulan teknologi transgenesis dibandingkan teknologi lainnya antara lain yaitu karakter yang diinginkan dapat ditransfer dalam satu generasi dan keunggulan yang didapatkan diturunkan pada generasi selanjutnya (Yaskowiak et al. 2006). Pelopor transgenesis pada hewan dilakukan pada tikus (dikenal dengan super mice ) oleh Palmiter et al. (1982). Penelitian awal pada transgenesis ikan pada saat ini berkembang pada banyak jenis ikan. Pada dua dekade terakhir, paling sedikit 35 jenis ikan diteliti untuk menjadi subjek transgenik terutama melalui perbaikan pertumbuhan melalui transgenesis gen penyandi hormon pertumbuhan (GH, growth hormone). Devlin et al. (1994) melaporkan bahwa pertumbuhan dapat dipercepat dengan mengintroduksi gen yang mengkodekan GH yang mensintesa peptida GH dalam jumlah yang besar (Over-ekspresi). Transfer gen GH telah diaplikasikan pada beberapa spesies ikan budidaya dan terbukti mampu meningkatkan pertumbuhannya. Over-ekspresi gen GH pada ikan mud loach mampu meningkatkan pertumbuhan lebih dari 32 kali (Nam et al. 2001), pada ikan nila 2-7 kali (Kobayashi et al. 2007), salmon Coho 10 kali (Devlin et al. 1995), ikan mas 3 kali (Hinits & Moav 1999) dan salmon Atlantik 2-6 kali (Du et al. 1992) pada generasi kedua. Secara umum, proses produksi hewan transgenik terdiri dari beberapa tahapan yang dapat diringkas seperti berikut: (1) identifikasi gen yang diinginkan (gen target), (2) isolasi gen target, (3) amplifikasi gen target untuk memproduksi beberapa kopi, (4) penggabungan gen target dengan promoter yang tepat dan sekuens poliadenilasi serta insersi ke dalam plasmid, (5) multiplikasi plasmid dalam bakteri dan purifikasi konstruksi gen untuk injeksi, (6) transfer konstruksi gen ke dalam jaringan resipien, (7) screening keberhasilan integrasi gen eksogen
17 3 ke dalam genom resipien, (8) analisis tingkat ekspresi transgen, dan (9) analisis pewarisan transgen pada generasi selanjutnya (Beardmore & Porter 2003). Pada ikan, pertumbuhan dikontrol antara lain oleh keberadaan hormon pertumbuhan. Hormon pertumbuhan adalah polipeptida yang sangat penting untuk pengaturan pertumbuhan pada vertebrata (Meier et al. 2006). Hormon pertumbuhan pituitari yang juga dikenal sebagai somatotropin pada ikan, merupakan protein kunci yang berperan dalam pengaturan pertumbuhan somatik dan banyak aspek metabolisme lainnya yang terdeteksi pada semua vertebrata (Ryynanen & Primmer 2006). Pada ikan, hormon pertumbuhan terlibat dalam sejumlah proses fisiologi termasuk keseimbangan ionik, metabolisme lipid dan protein, pertumbuhan, reproduksi dan fungsi kekebalan, serta berbagai aspek tingkah laku (Perez-Sanchez 2000). Secara komersial hormon pertumbuhan berperan penting pada bidang obat-obatan, peternakan, akuakultur dan formulasi pakan hewan, sehingga studi mengenai gen yang mengkodekan hormon tersebut banyak dipelajari pada spesies mamalia dan ikan (Anathy et al. 2001). Dalam akuakultur terapi hormon pertumbuhan dilakukan antara lain melalui penggunaan/pemberian hormon secara langsung pada ikan budidaya atau dapat juga dilakukan dengan produksi ikan transgenik yang telah diintroduksi dengan gen hormon pertumbuhan. Dalam proses pembuatan ikan transgenik, agar gen yang diintroduksikan dapat aktif maka diperlukan adanya promoter. Promoter adalah sekuens DNA yang memfasilitasi transkripsi gen tertentu. Pemilihan promoter menentukan keberhasilan ekspresi transgen pada ikan transgenik. Promoter dapat bersifat spesifik pada jaringan tertentu. Spesifitas ini ditentukan oleh keberadaan faktor transkripsi yang mempengaruhi ekspresi transgen. Salah satu jenis promoter yang umum digunakan untuk membuat ikan transgenik adalah promoter β-aktin. Menurut Volckaert et al. (1994) promoter β-aktin merupakan promoter yang memiliki keaktifan tanpa adanya rangsangan dari luar sehingga disebut constitutive promoter. Selain itu promoter β-aktin bersifat ubiquitous artinya dapat aktif pada semua jaringan otot, serta bersifat house keeping yang dapat aktif kapan saja bila diperlukan.
18 4 Promoter β-aktin telah diisolasi dari beberapa jenis ikan dan dilaporkan sebagai regulator dengan aktivitas tinggi dalam mengatur ekpresi transgen pada ikan transgenik. Promoter β-aktin dari ikan medaka mampu mengatur gen penanda LacZ pada embrio ikan medaka (Takagi et al. 1994). Ekspresi gen GFP yang kuat dengan menggunakan promoter β-aktin juga telah ditunjukkan pada ikan medaka (Hamada et al. 1998) dan rainbow trout (Yoshizaki 2001). Selanjutnya promoter ini juga aktif mengatur ekspresi gen penyandi enzim Δ6- desaturase pada ikan zebra (Alimuddin et al. 2005) dan gen penyandi hormon pertumbuhan pada ikan nila (Kobayashi et al. 2007). Promoter β-aktin ikan mas mampu mengatur ekspresi beberapa gen penanda pada beberapa jenis ikan (Liu et al. 1990). Sementara itu, promoter β-aktin dari ikan zebra dilaporkan aktif mengatur ekspresi gen GFP pada ikan zebra (Higashijima et al. 1997). Begitu pula dengan promoter β-aktin dari ikan nila mampu mengatur ekspresi gen GFP pada ikan zebra (Alimuddin et al. 2008). Nam et al. (2001) melaporkan bahwa pada ikan mud loach (Misgurnus mizolepis) yang diintroduksi oleh konstruksi gen yang tersusun dari gen GH dan promoter β-aktin yang diisolasi dari spesies yang sama, menunjukkan pertumbuhan yang lebih tinggi dibandingkan non-transgenik. Sebelum gen target diintroduksikan ke sel inang, gen target dan promoter harus ditempatkan dalam sebuah konstruksi gen. Konstruksi gen berfungsi sebagai kendaraan atau vektor yang membawa gen target ke dalam organisme resipien. Konstruksi gen tersebut memiliki beberapa bagian yang berbeda seperti misalnya yang ditunjukkan pada Gambar 1. Bagian-bagian dalam konstruksi gen antara lain: (1) promoter (P) yang berperan untuk mengontrol aktivitas gen target, (2) gen (cdna) target, dan (3) sekuens perhentian/terminator (poliadenilasi). Gambar 1. Peta konstruksi gen dalam bentuk plasmid (P= promoter, RE= enzim restriksi, cdna= complementary DNA, polya= poliadenilasi).
19 5 Banyak teknik dikembangkan untuk mengintroduksi molekul DNA ke dalam embrio. Pada hewan akuatik, mikroinjeksi merupakan metode yang umum digunakan (Chourrout et al. 1986). Dibandingkan dengan mikroinjeksi, elektroporasi merupakan teknik yang lebih mudah dalam pengerjaannya (Inoue et al. 1990) karena elektroporasi pada telur hasil fertilisasi dapat memproduksi 10 sampai 100 kali lipat dibandingkan mikroinjeksi (Powers et al. 1992). Elektroporasi adalah proses modifikasi permeabilitas membran sel menggunakan medan listrik. Perubahan permeabilitas bersifat sementara, dengan syarat kejutan listrik tidak melebihi batas kritis bagi sel (Tsong 1983; Serpeusu et al. 1985). Brackett et al. (1971) pertama kali mendemonstrasikan bahwa sperma kelinci mampu membawa DNA eksogen dalam larutan, dan DNA ini terlokalisasi dalam kepala sperma. Hampir dua dekade berikutnya, Arezzo (1989) dan Lavitrano et al. (1989) membuktikan bahwa sel sperma bulu babi dan tikus dapat digunakan sebagai vektor untuk transfer gen. Sperm-mediated gene transfer (SMGT) merupakan metode yang ideal untuk transfer gen secara massal pada organisme yang fertilisasinya eksternal seperti ikan salmon (Sin et al. 2000). Keberhasilan transfer gen dengan menggunakan metode elektroporasi melalui sperma telah dibuktikan pada ikan budidaya, antara lain : ikan salmon, zebra, mas, dan nila (diacu dari Spadafora 1998). Penelitian Sin et al. (2000) menunjukkan bahwa kondisi elektroporasi optimal pada sperma salmon adalah pada medan listrik 800 sampai 1000 V/cm, panjang kejutan 27,4 milidetik, dan 2 kejutan. Motilitas sperma pasca elektroporasi bergantung pada medan listrik, panjang kejutan, jumlah kejutan dan kekuatan ionik buffer (Symonds et al. 1994). Berdasarkan penelitian Cheng et al. (2002), motilitas sperma ikan ayu menurun sampai 50% setelah 120 detik ketika dikejutkan dengan voltase 9 kv. Symonds et al. (1994) juga mendemonstrasikan bahwa aktivitas sperma chinook salmon menurun dari 82% menjadi 2% pada saat sperma dielektroporasi dengan voltase yang meningkat dari 625 V/cm menjadi 1000 V/cm. Konsentrasi DNA dalam larutan juga dapat mempengaruhi efisiensi keberhasilan transfer gen (Walker et al. 1995). Konsentrasi DNA bervariasi antara 10 dan 200 µg/ml telah diuji (Sin et al. 1993). Konsentrasi DNA yang tinggi meningkatkan efisiensi pengambilan DNA oleh sperma, dan meningkatkan
20 6 efisiensi transfer gen pada telur. Pada kondisi elektroporasi yang optimal, DNA eksogen terdeteksi pada lebih dari 90% embrio ikan salmon yang baru difertilisasi (Walker et al. 1995). Ekspresi dari gen asing dimulai setelah fase mid-blastula dan levelnya meningkat selama embriogenesis, dan selanjutnya menurun setelah menetas (Gong & Hew 1993; Liu et al. 1990). Kejadian ini disebut sebagai ekspresi sementara (transient expression), yang mungkin disebabkan oleh replikasi ekstrakromosomal DNA asing. Level ekspresi selanjutnya akan menurun yang diikuti dengan degradasi dari ekstrakromosomal DNA. Akibatnya, level ekspresi gen yang terintegrasi ke kromosom resipien tidak setinggi dengan ekspresi sementara. Meskipun hanya beberapa laporan yang menunjukkan integrasi gen dalam genom ikan resipien, teknik ini sangat diperlukan dalam akuakultur (Alimuddin et al. 2003). Pada beberapa laporan, ekspresi gen dianalisis dengan mengukur level mrna (messenger RNA) dan protein. mrna dari gen asing dapat dideteksi dengan menggunakan probe (fragmen DNA yang diberi label radioaktif, biasanya berupa 35 P) dan protein dengan cara immunodeteksi dengan menggunakan antibodi. Akan tetapi kedua metode ini membutuhkan banyak waktu dan relatif kompleks. Oleh karena itu, untuk mengembangkan promoter/enhanser yang baik diperlukan suatu metode yang sederhana dan cepat untuk mendeteksi ekspresi gen yang dikendalikannya (Alimuddin et al. 2003). Pada penelitian ini, peningkatan pertumbuhan ikan patin siam akan dilakukan melalui rekayasa genetika yaitu dengan mengintroduksikan gen GH. Konstruksi gen yang digunakan adalah all fish yang tersusun dari gen GH yang berasal dari ikan patin siam (PhGH) dan promoter β-aktin dari ikan mas (pccba). Transfer gen PhGH dilakukan dengan menggunakan metode elektroporasi pada sperma ikan patin siam yang berperan sebagai media pembawa transgen, sebelum digunakan untuk membuahi telur. Diharapkan gen PhGH yang ditransfer mampu terinsersi dan terekspresi pada ikan patin siam.
21 7 TUJUAN DAN MANFAAT Penelitian ini bertujuan untuk menghasilkan ikan patin siam (Pangasionodon hypophthalmus) transgenik F0 melalui over-ekspresi gen penyandi hormon pertumbuhan. Secara khusus penelitian ini bertujuan untuk: 1. Mendapatkan konstruksi gen hormon pertumbuhan all fish yang tersusun dari promoter β- aktin ikan mas dan gen GH dari ikan patin siam. 2. Mendapatkan kondisi elektroporasi yang optimal pada sperma ikan patin siam. 3. Mendapatkan informasi tingkat ekspresi gen PhGH pada juvenil ikan patin siam. 4. Mendapatkan individu transgenik F0 Manfaat penelitian ini antara lain yaitu untuk menyediakan kandidat ikan patin siam (Pangasionodon hypophthalmus) transgenik F0 sebagai bahan untuk menghasilkan ikan transgenik stabil yang tumbuh cepat. KEBAHARUAN PENELITIAN Kebaharuan (novelty) dalam penelitian ini adalah: (1) Konstruksi gen hormon pertumbuhan all fish yang tersusun dari promoter β- aktin ikan mas dan gen GH dari ikan patin siam, (2) Kondisi elektroporasi yang optimal untuk sperma ikan patin siam, (3) Tingkat ekspresi gen PhGH eksogen pada juvenil ikan patin siam dan (4) Individu transgenik F0. RUANG LINGKUP PENELITIAN Penelitian ini dilakukan berdasarkan roadmap produksi ikan patin siam transgenik (Gambar 2). Untuk mendapatkan induk transgenik dengan pertumbuhan cepat dan stabil dalam mentransmisikan transgen diperlukan waktu relatif lama sehingga disertasi ini difokuskan pada beberapa tahapan awal penelitian. Penelitian ini dilakukan dalam tiga tahap penelitian yaitu: kloning dan
22 8 karakterisasi gen hormon pertumbuhan ikan patin siam, pengembangan metode elektroporasi pada sperma ikan patin siam dan analisis ekspresi gen PhGH pada juvenil ikan patin siam, serta produksi ikan patin siam transgenik F0. Gambar 2. Roadmap penelitian untuk memproduksi ikan patin siam transgenik.
23 9 2. KARAKTERISASI GEN PENYANDI HORMON PERTUMBUHAN IKAN PATIN SIAM (Pangasionodon hypophthalmus) ABSTRAK Identifikasi gen penyandi hormon pertumbuhan pada ikan target merupakan langkah awal untuk pembuatan konstruksi all fish dan untuk membuat ikan transgenik. Penelitian dilakukan untuk mengidentifikasi dan mengkarakterisasi gen penyandi hormon pertumbuhan ikan patin siam (PhGH). Pelaksanaan penelitian dilakukan di Laboratorium Reproduksi dan Genetika Organisme Akuatik, Institut Pertanian Bogor. Identifikasi gen PhGH dilakukan melalui beberapa tahap yaitu ekstraksi RNA total, sintesis cdna, amplifikasi PCR, isolasi fragmen DNA target, kloning dan pembacaan sekuens nukleotida. Analisis sekuens nukleotida menggunakan mesin ABIPRISM 3100 dan hasilnya dianalisis menggunakan program BLASTN/P dan GENETYX version 7. Sekuens nukleotida gen PhGH tersusun atas 1148 bp yang terdiri dari 603 bp daerah penyandian (ORF, open reading frame) dengan 200 asam amino residu, 18 bp daerah yang tidak dikodekan pada bagian ujung 5, dan 527 bp pada ujung 3. Gen PhGH memiliki beberapa ciri seperti halnya gen GH ikan umumnya yaitu: residu tryptophan (W) tunggal pada asam amino ke-104, 5 residu sistein (C) pada asam amino ke-71, 135, 173,190, dan 198, serta motif Asn-Xaa-Thr pada terminal C yang berpotensi sebagai lokasi N-linked glycosilation. Sinyal poliadenilasi (aataaa) berada pada 14 bp di bagian hulu lokasi poliadenilasi. Kata kunci: identifikasi, karakterisasi, gen PhGH, Pangasionodon hypophthalmus *) Bab ini sebagian telah dipublikasi dengan judul: Identification of Growth Hormone Gene of Pangasionodon hypophthalmus, pada Indonesian Aquaculture Journal 2009; 4(1): 9-17
24 10 CHARACTERIZATION OF GENE ENCODING GROWTH HORMONE ON STRIPPED CATFISH (Pangasionodon hypophthalmus) ABSTRACT Identification of growth hormone (GH) gene on the target fish is the first step for the construction of "all fish gene transfer vector" and to generate transgenic fish. Research was done on the identification and characterization of stripped catfish (Pangasionodon hypophthalmus) GH gene (PhGH). This research was conducted at Reproduction and Genetic of Aquatic Organism Laboratory, Bogor Agricultural University. Steps of study performed to identify the PhGH gene were total RNA extraction, cdna synthesis, PCR amplification, DNA fragment isolation, cloning and sequencing. Analysis of nucleotide sequence were done using ABIPRISM 3100, the results were then analyzed using BLASTN/P and GENETYX version 7 program. The full-length PhGH gene is 1148 bp in length, coding for an open reading frame (ORF) of 603 bp with 200 amino acid residues. The 5 and 3 untranslated regions of the PhGH gene are 18 bp and 527 bp, respectively. PhGH gene has some common characteristics that are owned by GH genes, such as single tryptophan residue (W) on the 104th amino acid, 5 cysteine residues (C) on the amino acid 71, 135, 173, 190 and 198 and a motif Asn-Xaa-Thr on C terminus which is the potential location for N-linked glycosilation. Polyadenylation signal (aataaa) was on the 14 bp at the upstream of polyadenylation location. Keywords: identification, characterization, PhGH gene, Pangasionodon hypophthalmus PENDAHULUAN Hormon pertumbuhan adalah polipeptida yang sangat penting untuk pengaturan pertumbuhan pada vertebrata (Meier et al. 2006). Hormon pertumbuhan pituitari yang juga dikenal sebagai somatotropin pada ikan, merupakan protein kunci yang berperan dalam pengaturan pertumbuhan somatik dan banyak aspek metabolisme lainnya yang terdeteksi pada semua vertebrata (Ryynanen & Primmer 2006). Secara umum pada ikan, hormon pertumbuhan diproduksi di pituitari. Namun pada ikan salmon, hormon pertumbuhan selain diproduksi di pituitari, juga diproduksi di otot walaupun dalam jumlah yang relatif kecil (Devlin et al. 2009). Pada ikan, hormon pertumbuhan terlibat dalam sejumlah proses fisiologi termasuk keseimbangan ionik, metabolisme lipid dan
25 11 protein, pertumbuhan, reproduksi dan fungsi kekebalan, serta berbagai aspek tingkah laku (Perez-Sanchez 2000). Secara komersial hormon pertumbuhan diperlukan pada bidang obat-obatan, peternakan, akuakultur dan formulasi pakan hewan. Oleh sebab itu studi mengenai gen yang mengkodekan hormon tersebut dipelajari secara ekstensif pada beberapa spesies mamalia dan ikan (Anathy et al. 2001). Dalam dua puluh tahun terakhir ini dikembangkan teknologi transfer gen yang ditujukan untuk mendapatkan produk perikanan dengan karakteristik yang diinginkan. Pada saat ini, transgen yang paling berhasil dan tampaknya yang pertama digunakan di ikan budidaya untuk konsumsi manusia adalah yang mengandung konstruksi gen penyandi hormon pertumbuhan (growth hormone, GH). Alasannya adalah bahwa konstruksi gen GH terbukti dapat meningkatkan pertumbuhan secara drastis pada berbagai spesies ikan seperti ikan mas (Cyprinus carpio) dan koki (Carrasius auratus gibelio) (Zhu 1992), channel catfish (Ictalurus punctatus) (Dunham et al. 1987), nila (Oreochromis niloticus) (Martinez et al. 1996), salmon Atlantik (Salmo salar) (Du et al. 1992), salmon coho (Oncorhynchus kisutch) (Devlin et al. 1994), rainbow trout (Oncorhynchus mykiss) (Devlin et al. 2001), mud loach (Misgurnus mizolepis) (Nam et al. 2001) dan Arctic charr (Salvelinus alpinus) (Pitkanen et al. 1999). Penelitian pengembangan teknologi transgenesis untuk memacu pertumbuhan ikan budidaya di Indonesia belum banyak dilakukan. Indonesia memiliki banyak jenis ikan yang sudah berhasil dibudidayakan. Di antara berbagai spesies ikan air tawar yang potensial untuk dibudidayakan secara komersial adalah ikan patin siam (Pangasionodon hypophthalmus). Untuk meningkatkan efisiensi budidaya ikan patin siam di Indonesia, perlu kiranya dikembangkan teknologi transgenesis untuk memproduksi induk unggul dengan karakter pertumbuhan yang cepat dalam rangka efisiensi pakan, tenaga dan biaya. Sebagai langkah awal untuk memproduksi ikan patin siam transgenik, maka penelitian ini dilakukan dengan tujuan untuk mengkloning dan mengkarakterisasi gen penyandi hormon pertumbuhan pada ikan patin siam (PhGH).
26 12 BAHAN DAN METODE Isolasi RNA Total RNA total diisolasi dari jaringan hipofisa, hati, otot, otak, limfa dan testes ikan patin siam yang masih hidup berukuran sekitar 500 gram. Jaringan diambil secara aseptis dan disimpan dalam botol sampel yang telah berisi isogen sebanyak 200 µl. Jaringan dihancurkan oleh penggerus yang sebelumnya telah disterilkan dengan DEPC 1%. Ke dalam Eppendorf ditambahkan larutan isogen sampai mencapai volume akhir 800 µl. Chloroform p.a. sebanyak 200 µl ditambahkan ke dalam Eppendorf dan larutan disentrifugasi pada kecepatan rpm selama lima menit pada suhu ruang. Supernatan yang terbentuk dipindahkan ke dalam Eppendorf baru yang telah berisi 400 µl isopropanol. Larutan disentrifugasi pada kecepatan rpm selama 15 menit pada suhu 4 C. Pada Eppendorf akan terbentuk pelet RNA, dan cairan yang terdapat pada Eppendorf dibuang. Ke dalam Eppendorf berisi pelet RNA ditambahkan 1 ml etanol 70% (dingin) kemudian disentrifugasi dengan kecepatan rpm selama 15 menit. Pelet RNA dikeringkan dengan cara membuang larutan yang terdapat pada Eppendorf. Sampel RNA disimpan dengan cara menambahkan 30 µl DEPC 1%. Konsentrasi RNA total hasil isolasi diukur menggunakan alat pengukur konsentrasi RNA/DNA (GeneQuant). Absorbansi diukur pada panjang gelombang 260 dan 280 nm. Sintesis cdna Sintesis cdna hormon pertumbuhan (cdna GH) dilakukan menggunakan kit Ready-To-Go You-Prime First Strand Beads, FSRMB, (Amersham pharmacia biotech, USA). Konsentrasi RNA dibuat 3 μg dalam 30 μl DEPC. Larutan RNA diinkubasi pada suhu 65 C selama 10 menit dan kemudian disimpan di atas es (on ice). Sampel RNA dipindahkan ke dalam tube FSRMB dan ditambahkan 3 μl primer dt3 RACE-VECT (5 -GTA ATA CGA CTC ACT ATA GGG CAC GCG TGG TCG ACG GCC CGG GCT GGT TTT TTT TTT TTT TTT TTT-3 ) dengan konsentrasi 1 µg/3 µl. Larutan dihomogenkan dan
27 13 diinkubasi pada suhu 37 C selama 1 jam. cdna yang terbentuk ditambahkan 30 µl SDW steril dan disimpan dalam refrigerator. Identifikasi Gen PhGH Isolasi gen PhGH dilakukan dengan menggunakan cdna yang disintesis dari RNA hasil ekstraksi dari kelenjar hipofisa, hati, otak, otot, limfa dan testes. Satu mikroliter cdna digunakan sebagai cetakan untuk PCR, kemudian dicampur dengan 1 μl primer ghf (5 -TCA GAG AGA TTT GGC AAA ATG GCT-3 ), 1 μl primer AP-1r (5 -CCA TCC TAA TAC GAC TCA CTA TAG GGC-3 ), 1 μl dntp, 1 μl Ex Taq buffer, 0.05 μl Ex Taq polymerase (TAKARA) kemudian ditambahkan SDW sampai volume akhir menjadi 10 μl. PCR dilakukan dengan program: 94 C selama 3 menit; (94 C selama 30 detik; 59 C selama 30 detik; 72 C selama 1 menit) sebanyak 35 siklus; 72 C selama 3 menit; dan 4 C (tak hingga). Pengecekan hasil amplifikasi PCR dilakukan dengan elektroforesis menggunakan gel agarose 1%. Sebagai kontrol internal digunakan gen β-aktin. Deteksi gen β-aktin dilakukan dengan menggunakan metode PCR. Primer yang digunakan adalah bact-f (5 -TAT GAA GGT TAT GCT CTG CCC-3 ) dan bact- R (5 - CAT ACC CAG GAA AGA TGG CTG-3 ). PCR dilakukan dengan program: 94 C selama 3 menit; (94 C selama 30 detik; 58 C selama 30 detik; 72 C selama 30 detik) sebanyak 30 siklus; 72 C selama 3 menit; dan 4 C (tak hingga). Pengecekan hasil amplifikasi PCR dilakukan dengan elektroforesis menggunakan gel agarose 1%. Fragmen gen β-aktin ikan patin siam berada pada ukuran sekitar 300 bp. Purifikasi Gen PhGH Fragmen DNA hasil PCR diisolasi dari gel agarose menggunakan kit Mobio Ultra Clean TM 15 DNA Purification (MoBio Laboratories, CA, USA). Hasil PCR (40 μl) dielektoforesis dengan gel agarose 0,7%. Gel dipotong pada bagian yang terdapat band DNA, gel ditimbang dan dimasukkan ke dalam Eppendorf. TBE Gel Melt sebanyak ½ dari berat gel dan juga sodium iodida sebanyak 4,5 kali berat gel ditambahkan ke dalam Eppendorf. Selanjutnya diinkubasi pada suhu 55 C selama 5 menit, sementara itu Glass Blind divorteks
28 14 selama 30 detik. Glass blind sebanyak 6 μl ditambahkan ke dalam Eppendorf, dibolak-balik beberapa kali dan diinkubasi kembali pada suhu ruang selama 5 menit. Larutan disentrifugasi pada kecepatan rpm selama 5 detik dengan suhu 4 C. Supernatan yang terbentuk dibuang, lalu ke dalam tabung ditambahkan 1 ml wash buffer dan etanol, kemudian divorteks sampai pelet hancur. Selanjutnya disentrifugasi selama 5 detik dengan kecepatan rpm dan wash buffer dibuang sampai bersih. SDW sebanyak 9 μl ditambahkan dan diaduk sampai pelet hancur kemudian diinkubasi pada suhu ruang selama 5 menit. Larutan disentrifugasi dengan kecepatan rpm selama 1 menit pada suhu ruang, supernatan dipindahkan pada Eppendorf selanjutnya DNA dilarutkan dengan 12 μl SDW. Ligasi Gen PhGH ke Vektor pgem-t Easy Fragmen DNA hasil purifikasi dari gel diligasi dengan vektor kloning pgem-t Easy (Promega, WI, USA) dengan komponen reaksi ligasi meliputi 5 μl larutan DNA hasil purifikasi; 0,5 μl pgem-t Easy; 6,5μl 5x buffer ligasi, dan 1μl enzim T4 DNA ligase (Promega). Inkubasi dilakukan selama dua jam pada suhu ruang dan dilanjutkan semalam di dalam refrigerator (suhu sekitar 4 C). Transformasi ke Bakteri Escherichia coli DH5α Pembuatan Bakteri Kompeten. Sebuah koloni bakteri E. coli DH5α diambil dari biakan dan dikultur dalam 25 ml larutan LB. Proses inkubasi dilakukan pada suhu 37ºC selama jam di dalam shaker. Subkultur dilakukan dengan mengambil 1% dari volume biakan dan dikultur kembali pada suhu 37ºC selama 3 jam di dalam shaker. Biakan disimpan di atas es selama 30 menit. Biakan sebanyak 1,5 ml dipindahkan ke dalam Eppendorf dan disentrifugasi selama 2 menit dengan kecepatan rpm. Proses ini diulang sebanyak dua kali. Supernatan yang terbentuk dibuang. Endapan bakteri dicuci dengan menggunakan NaCl dingin kemudian disentrifugasi selama 2 menit dengan kecepatan 5000 rpm. Supernatan yang terbentuk dibuang. Endapan bakteri dicuci kembali menggunakan 1 ml CaCl 2 dan dibiarkan selama 20 menit. Larutan disentrifugasi dengan kecepatan 5000 rpm selama 2 menit. Supernatan yang
29 15 terbentuk dibuang. Endapan bakteri disuspensi menggunakan 200 µl CaCl 2 dan diinkubasi di atas es selama menit. Transformasi. Sebanyak 6,5 μl hasil reaksi ligasi dicampur ke dalam Eppendorf berisi sel kompeten E. coli DH5α. Transformasi dilakukan menggunakan kejutan panas pada suhu 42 C selama 45 detik. Sekitar 2-3 menit setelah diinkubasi dalam es. Ke dalam Eppendorf ditambahkan 900 μl larutan SOC (1,2 g polypeptone; 0,3 g yeast extract; 0,035 g NaCl; 0,011 g KCl; 600 μl MgCl 2 1M; 600 μl MgSO 4 1 M dan 60 μl glucose 2M dalam 60 ml SDW). Selanjutnya inkubasi dilakukan menggunakan shaker pada suhu 37 C selama 1 jam. Bakteri disebar di atas cawan agar 2xYT (1.6% polypeptone, 1% yeast extract, 0.5% NaCl dan 1.5% bacto agar dalam SDW) yang mengandung ampisilin, IPTG dan X-gal (disingkat menjadi 2xYT-A,I,X). Cawan agar berisi bakteri diinkubasi pada suhu 37 C selama sekitar 14 jam. Identifikasi Transforman Metode Cracking. Seleksi koloni bakteri yang membawa plasmid hasil ligasi dilakukan dengan metode cracking. Koloni bakteri berwarna putih yang tumbuh dalam cawan agarose diambil menggunakan tusuk gigi steril dan dioleskan ke dasar Eppendorf volume 1.5 ml untuk cracking, dan dilanjutkan dengan menggoreskan tusuk gigi tersebut ke dalam cawan agar 2xYT-A,I,X untuk membuat master plate. Master plate merupakan cawan agar yang mengandung setiap koloni bakteri yang dianalisa dengan cracking, yang merupakan sumber koloni bakteri untuk tahap penelitian berikutnya. Master plate diinkubasi pada suhu 37 C sekitar 8 jam. Ke dalam Eppendorf yang berisi bakteri ditambahkan 10 μl buffer cracking (0,2 g saccharosa, 40 μl NaOH 5 M, 50 μl SDS 10% dan sisanya SDW sehingga volume larutan menjadi 1 ml), 10 μl larutan EDTA 10 mm dan sekitar 2 μl 6x buffer loading DNA berisi KCl 4 M dengan perbandingan volume 1:1. Setelah diinkubasi sekitar 5 menit, dilakukan sentrifugasi pada kecepatan rpm selama 15 menit. Sebanyak 10 μl supernatan yang terbentuk digunakan untuk elektroforesis menggunakan gel agarose 0,7%. Untuk mengetahui koloni bakteri yang membawa DNA insersi dalam plasmid
30 16 digunakan koloni biru sebagai kontrol. Ukuran DNA plasmid koloni bakteri yang membawa insersi akan lebih besar daripada yang dari kontrol. Koloni bakteri yang membawa DNA insersi diambil dari master plate menggunakan tusuk gigi steril dan disentuhkan ke media cair 2xYT yang mengandung ampisilin dalam tabung kultur berbentuk L untuk diperbanyak. Inkubasi bakteri menggunakan shaker dilakukan pada suhu 37 C selama sekitar 14 jam. Metode PCR. Untuk mengetahui keberhasilan transformasi, maka dilakukan isolasi plasmid pada koloni bakteri yang positif membawa gen insersi. Proses PCR dilakukan dengan menggunakan primer ghf dan primer ghr. Pembacaan Sekuens Nukleotida Gen PhGH Isolasi Plasmid. Plasmid pgem-t Easy yang mengandung gen PhGH diisolasi dari bakteri E. coli. Satu koloni bakteri yang mengandung plasmid rekombinan ditumbuhkan di dalam 2 ml media Luria Bertani (LB) (10 g/l polypeptone, 5 g/l yeast extract, 10 g/l NaCl, ph 7,5) yang mengandung ampisilin 100 mg/l pada shaker dengan kecepatan 250 rpm, suhu 37ºC selama semalam. Bakteri diendapkan dengan sentrifugasi pada kecepatan rpm, suhu 4ºC, selama 10 menit. Pelet yang terbentuk digunakan sebagai sampel untuk isolasi plasmid dengan menggunakan kit GF-1 Plasmid DNA Extraction (Vivantis) sesuai dengan prosedur pada manualnya. Pelet diresuspensi dengan 250 µl buffer resuspensi (larutan S1) kemudian divorteks dan ditambahkan 250 µl buffer lisis (larutan S2) sampai tercampur. Ke dalam larutan ditambahkan 250 µl buffer netralisasi (buffer NB), kemudian Eppendorf dibolak balik. Sentrifugasi dilakukan pada kecepatan rpm, suhu 4ºC, selama 10 menit. Supernatan dipindahkan ke spin colomn kemudian disentrifugasi dengan kecepatan rpm selama 1 menit. Spin colomn dicuci menggunakan 700 µl wash buffer kemudian disentrifugasi dengan kecepatan rpm selama 1 menit dan hasil sentrifugasi dibuang. Colomn dikeringkan dengan sentrifugasi pada kecepatan rpm selama 1 menit. Colomn dipindahkan ke Eppendorf baru dan disuspensi dengan 50 µl elution buffer atau SDW kemudian diinkubasi pada suhu ruang selama 1 menit. Eppendorf yang
31 17 berisi colomn disentrifugasi dengan kecepatan rpm selama 1 menit untuk melarutkan DNA dan selanjutnya disimpan pada suhu -20ºC. Pembacaan Sekuens Nukleotida. Pembacaan sekuens cdna dilakukan terhadap klon-klon cdna GH terpilih yang didasarkan pada dideoxy-nucleotide chain-termination menggunakan mesin otomatis ABI PRISM Konsentrasi DNA diukur dengan menggunakan genequant. PCR untuk sekuensing menggunakan primer target dan reagen khusus untuk sekuens yaitu big dye. Volume PCR 10 µl terdiri dari 1µl ready reaction premix (2,5x), 1 µl big dye sequence buffer (5x), 3,2 µl primer (10 pmol), 0,5 µl plasmid (300 ng), dan 4,3 µl SDW. Analisis Sekuens Gen PhGH Sekuens nukleotida dianalisis dengan menggunakan program Genetyx 7 dan BLASTN/P. Analisis dengan menggunakan program Genetyx 7 akan menghasilkan deduksi asam amino, pensejajaran nukleotida hormon pertumbuhan beberapa spesies ikan, dan filogenetik gen hormon pertumbuhan pada beberapa ordo spesies ikan. Analisis dengan menggunakan program Blast P akan menghasilkan indeks similaritas antar sekuens asam amino pada beberapa spesies ikan. HASIL DAN PEMBAHASAN Identifikasi Gen PhGH Identifikasi gen PhGH dilakukan pada beberapa jaringan tubuh ikan antara lain hipofisa, hati, otot, otak, limfa, dan testes (Gambar 3). Berdasarkan hasil elektroforesis, gen PhGH hanya teridentifikasi pada jaringan hipofisa. Pita DNA dengan panjang sekitar 1200 bp merupakan kandidat fragmen gen PhGH. Sebagai kontrol internal digunakan gen β-aktin ikan patin siam. Fragmen gen β- aktin ikan patin siam berada pada ukuran sekitar 300 bp. Gen PhGH diisolasi dan dipurifikasi untuk kemudian diligasi dengan vektor pgem-t Easy. Proses kloning dilakukan dengan cara mentransformasi vektor pgem-t Easy ke dalam bakteri E. coli DH5α dan kemudian dikultur
32 18 dalam media agar. Keberhasilan proses kloning dideteksi dengan menggunakan metode cracking. Hasil cracking dapat dilihat pada Gambar 4. Plasmid yang mengandung gen PhGH berada pada ukuran yang lebih besar dibandingkan dengan kontrol (blue colony, B) yaitu plasmid yang tidak terinsersi gen PhGH. Berdasarkan hasil tersebut, maka dipilih klon nomor 3 dan 5 untuk selanjutnya dilakukan proses sekuensing. M hipofisa hati otot otak limfa testes 3 kb - 1 kb bp 0,5 kb - (A) 0,5 kb bp (B) Gambar 3 Deteksi gen penyandi hormon pertumbuhan pada beberapa jaringan tubuh ikan patin siam (A). Produk PCR dari beberapa jaringan menggunakan primer gen β-aktin dengan panjang fragmen sekitar 300 bp (B). M adalah marker DNA kb (BioLabs Inc., New England). Pembacaan sekuens nukleotida gen PhGH pada klon 3 dan 5 dilakukan dari arah forward dan reverse. Alignment dilakukan untuk mendapatkan urutan nukleotida yang sama. Sekuens nukleotida dan deduksi asam amino gen PhGH dapat dilihat pada Gambar 5. Hasil pembacaan sekuens nukleotida gen PhGH menunjukkan bahwa sekuens gen PhGH berukuran 1148 bp yang terdiri atas 18 bp pada daerah yang tidak diterjemahkan (UTR) pada ujung 5 dan 527 bp pada ujung 3 serta daerah penyandian (ORF) sepanjang 603 bp (Gambar 5). Translasi asam amino diawali
33 19 dengan sekuens ATG atau dikenal dengan kodon awal yang disandikan dalam bentuk methionin (M). Sedangkan kodon akhir ditandai dengan sekuens TAG yang walaupun tidak diterjemahkan ke dalam bentuk asam amino tetapi merupakan sekuens sinyal berakhirnya aktivitas translasi. B B B B Gambar 4. Cracking hasil transformasi pada plasmid pgem-t Easy yang diligasi gen PhGH. B = blue colony (kontrol). Angka di atas gambar menunjukkan nomor klon bakteri. Gen GH antar spesies ikan memiliki ukuran yang bervariasi. Gen GH pada Pangasionodon gigas berukuran 1176 bp (no aksesi L ; Lemaire et al. 1994), Cyprinus carpio berukuran 1164 bp (no aksesi M27000; Koren et al. 1989), Oncorhynchus keta berukuran 1120 bp (no aksesi K03050; Sekine et al. 1985), Oncorhynchus mykiss berukuran 1161 bp (no aksesi M24683; Rentier- Delrue et al. 1989a) dan Oreochromis niloticus berukuran 847 bp (no aksesi M26816; Rentier-Delrue et al. 1989b). Gen PhGH memiliki beberapa ciri khas yang umum dimiliki oleh gen GH antara lain: memiliki residu tryptophan (W) tunggal yaitu pada asam amino ke- 104, memiliki 5 residu sistein (C) yaitu pada asam amino ke-71, 135, 173, 190 dan 198 dan memiliki motif Asn-Xaa-Thr pada C terminus yang merupakan lokasi potensial untuk N-linked glycosilation. Sinyal poliadenilasi (aataaa) berada pada 14 bp di bagian hulu lokasi poliadenilasi.
34 20 tcagagagatttggcaaaatggctagagtgttggtggtgctctctgtggtggtggc 60 M A R V L V V L S V V V A gagtttgttctttagtcaaggcgcgacattcgagaaccagcggctcttcaacaacgcagt 120 S L F F S Q G A T F E N Q R L F N N A V catccgtgtgcaacaccttcatcagctggctgccaagatgatggatgactttgaggaagc 180 I R V Q H L H Q L A A K M M D D F E E A tctgttacctgaagaacgcaaacagctgagcaagattttccccctgtctttctgcaactc 240 L L P E E R K Q L S K I F P L S F C N S ggactccatcgaagctcctgcaggcaaggacgagacccagaaaagctctgtgctgaaatt 300 D S I E A P A G K D E T Q K S S V L K L gctgcacacctcctaccgtctgatcgagtcatgggagttccccagcaagaacctcggcaa 360 L H T S Y R L I E S W E F P S K N L G N ccccaaccacatctcagagaagctggctgacctgaaaatgggcatcggcgtgcttatcga 420 P N H I S E K L A D L K M G I G V L I E gggatgtttggatggacaaaccagcctggatgagaacgactctctggctccgcccttcga 480 G C L D G Q T S L D E N D S L A P P F E ggatttctaccagaccttgagcgagggaaacctgaggaagagcttccgtctgctgtcctg 540 D F Y Q T L S E G N L R K S F R L L S C cttcaagaaggacatgcacaaagtggagacctatctcagcgtggccaagtgcaggagatc 600 F K K D M H K V E T Y L S V A K C R R S cctggattccaactgcaccctgtagggggcgagagagcacaatttagccacagcctgtga 660 L D S N C T L * tctcagacagattttgtatttaaattaaaaaaaaaactctgtccaggcctggctaaatgt 720 atcagcctctttctctggtttcacttctgactttatgtatttattctgctcaccgaggag 780 aactcctccattcacatttttagcagatttctctgtcccggcaacttaaaggttgtaaaa 840 tgggaccaatttcacaatggtgctatgcaaattcagctttatatcaaataatgaccagaa 900 aaatgactaggtctatttcttttaacttattggctacaaattggataatctgatttaaca 960 atcgtgttaactttggaatggacgagttcgctcctggccagtgaatgttaaatattcaaa 1020 gtgtatattttcatatcaaagtctatacttattgttcagcattgactatttctgtgtgta 1080 aatctgtcattgttgttgtggatttccaataaagctaattcttgcattaaaaaaaaaaaa 1140 aaaaaaaaaaaa 1152 Gambar 5. Sekuens nukleotida dan deduksi asam amino penyusun gen PhGH. Lokasi N-glikosilasi ditandai dengan huruf yang digaris bawah. Sinyal poliadenilasi (aataaa) dan poliadenilasi ditandai dengan huruf miring yang digarisbawahi.
35 21 Homologi Sekuens Asam Amino Gen PhGH Analisa BlastP antara sekuens asam amino gen PhGH dengan beberapa spesies ikan dari lima ordo yang berbeda ditunjukkan pada Gambar 6. Sekuens asam amino penyusun gen GH jumlahnya berbeda antar ordo yang berbeda. Sekuens asam amino penyusun gen GH ordo siluriformes berjumlah 200 asam amino, ordo cypriniformes berjumlah 210 asam amino, ordo salmoniformes berjumlah 210 asam amino, ordo perciformes berjumlah 204 asam amino, sedangkan ordo anguilliformes berjumlah 209 asam amino. Gambar 6. Perbandingan sekuens asam amino gen PhGH dengan spesies-spesies ikan dari lima ordo yang berbeda. P. hypophthalmus (no aksesi ACW 82446; Sekar et al. 2009), Clarias gariepinus (no aksesi ACN 97175; Wang et al. 2009), Clarias batrachus (no aksesi AAL 84164; Das et al. 2001), Ctenopharyngodon idella (no aksesi AAA 58724; Ho et al. 1989), Cyprinus carpio (no aksesi AAA 49208; Koren et al. 1989), Oncorhynchus mykiss (no aksesi AAA 49556; Agellon et al. 1988), Oncorhynchus keta (no aksesi AAA 49406; Shen et al. 1993), Oreochromis niloticus (no aksesi AAA 49626; Ber & Daniel 1992), Oreochromis mossambicus (no aksesi AAC 77876; Chen et al. 1997), Anguilla japonica (no aksesi AAA 48535; Saito et al. 1988), Anguilla Anguilla (no aksesi AAN 61122; Goldberg et al. 2002).
36 22 Hasil penelitian Ryynanen & Primmer (2006) menunjukkan adanya dugaan daerah sinyal peptida yang diprediksikan pada 22 asam amino pertama di seluruh pre-gh teleost yang diteliti (salmoniformes, siluriformes dan cypriniformes) dengan kekecualian pada perciformes, dimana sinyal peptida terdiri dari 17 atau 18 residu asam amino pertama pada pre-gh. Pada ordo siluriformes, deduksi asam amino gen GH mengandung 200 asam amino yang terdiri dari 178 mature peptide dan 22 asam amino sinyal peptida. Secara umum pada ikan termasuk silurids, terdapat dua dugaan lokasi N-glikosilasi (Asn-Xaa- Thr atau Ser) yang secara normal berada pada asam amino ke-125 dan 175 pada mature peptide (Anathy et al. 2001). Domain N-glikosilasi mengandung empat asam amino yaitu asparagin, sistein, treonin dan leusin. N-glikosilasi terlibat di dalam regulasi aktivitas transport dan ekspresi permukaan dari transporter neurotransmitter (Bennet & Kanner 1997). Pensejajaran sekuens asam amino gen penyandi hormon pertumbuhan ikan patin siam yang berasal dari sampel dan yang ada di bank gen menunjukkan adanya kemiripan 100%. Adapun pensejajaran sekuens asam amino dari lima ordo spesies ikan yang berbeda menunjukkan bahwa spesies-spesies ikan dari ordo siluriformes dan cypriniformes memiliki lima residu sistein sedangkan pada ordo anguilliformes, salmoniformes dan perciformes memiliki empat residu sistein. Residu sistein berada pada posisi yang conserved. Menurut Anathy et al. (2001), daerah C-terminal memiliki kemiripan yang tinggi diantara seluruh ikan teleost yang mengandung 3 dari 4 residu sistein yang diketahui penting untuk pembentukan ikatan disulfida. Sistein pertama berada pada posisi yang conserved yaitu pada asam amino ke-71 (70 pada perciformes). Residu sistein bertanggung jawab untuk ikatan disulfida pada seluruh anggota famili GH/PRL. Keberadaan ikatan ini penting untuk integritas struktural dan aktivitas biologi hormon. Dugaan secara fungsional lokasi yang penting dari GH juga relatif conserved ketika sekuens GH teleost dibandingkan dengan sekuens GH mamalia lainnya (Liu et al dalam Ryynanen & Primmer 2006). Lebih dari 30% lokasi asam amino yang dilaporkan pada mamalia identik dengan asam amino ikan dan 54% lokasi asam amino pada teleost sama dengan paling sedikit satu spesies mamalia.
37 23 Kekerabatan gen PhGH ikan patin siam dengan kelompok ikan dari ordo lainnya dianalisa berdasarkan pohon filogenetik (Gambar 7). Perbandingan sekuens gen PhGH dengan beberapa spesies ikan dari lima kelompok ordo yang berbeda menunjukkan bahwa ikan patin siam memiliki kekerabatan terdekat dengan spesies-spesies ikan yang berada dalam ordo yang sama yaitu C. gariepinus dan C. batrachus yang berada dalam ordo siluriformes. Ordo siluriformes memiliki kekerabatan terdekat dengan spesies-spesies ikan dari ordo cypriniformes (Ctenopharyngodon idella & Cyprinus carpio). Ikan patin siam berada dalam cluster yang berbeda dengan spesies-spesies ikan dari ordo perciformes, salmoniformes dan anguilliformes. Gambar 7. Pohon filogenetik yang didasarkan pada sekuens asam amino gen PhGH dengan beberapa spesies ikan dari lima ordo yang berbeda. P. hypophthalmus (no aksesi ACW 82446; Sekar et al. 2009), Clarias gariepinus (no aksesi ACN 97175; Wang et al. 2009), Clarias batrachus (no aksesi AAL 84164; Das et al. 2001), Ctenopharyngodon idella (no aksesi AAA 58724; Ho et al. 1989), Cyprinus carpio (no aksesi AAA 49208; Koren et al. 1989), Oncorhynchus mykiss (no aksesi AAA 49556; Agellon et al. 1988), Oncorhynchus keta (no aksesi AAA 49406; Shen et al. 1993), Oreochromis niloticus (no aksesi AAA 49626; Ber & Daniel 1992), Oreochromis mossambicus (no aksesi AAC 77876; Chen et al. 1997), Anguilla japonica (no aksesi AAA 48535; Saito et al. 1988), Anguilla Anguilla (no aksesi AAN 61122; Goldberg et al. 2002).
38 24 GH bersama-sama dengan prolaktin dan somatolaktin merupakan famili dari hormon pituitari dengan struktur dan fungsi yang sama yang tampaknya berasal dari sumber gen yang sama sebelum ikan berevolusi (Meier et al. 2006). GH ditemukan pada semua kelompok taksonomi vertebrata yang berahang (gnathostomes) dan juga terdapat pada sea lamprey yang merupakan bagian dari kelompok vertebrata yang tertua (vertebrata yang tidak berahang) (Roussau & Dufour 2004). Data molekular dari gen inti seperti halnya gen GH pada saat ini digunakan sebagai sumber informasi untuk mengevaluasi hubungan kekerabatan ikan pada berbagai tingkat taksonomi dan menghasilkan filogeni (Meier et al. 2006). Analisis sekuens nukleotida berguna untuk mempelajari hubungan antara sekuens dari ordo-ordo yang berbeda. Adanya variasi genetik pada evolusi GH dapat disebabkan oleh sejumlah faktor termasuk (1) meningkatnya tekanan seleksi yang berkaitan dengan perubahan dalam fungsi biologis, (2) relaksasi dari seleksi pemurnian yang disebabkan hilangnya suatu fungsi, atau (3) perbandingan dari produk gen-gen nonorthologous, setelah duplikasi gen dan periode evolusi yang berbeda (Wallis 1996). KESIMPULAN Sekuens nukleotida gen PhGH berhasil dikloning dengan panjang 1148 bp menyandikan 200 asam amino residu. Sekuens gen PhGH memiliki elemenelemen conserved untuk gen GH.
39 25 3. PENGEMBANGAN METODE ELEKTROPORASI PADA SPERMA SEBAGAI PERANTARA TRANSFER GEN PADA IKAN PATIN SIAM (Pangasionodon hypophthalmus) ABSTRAK Penggunaan metode elektroporasi dengan menggunakan sperma sebagai perantara transfer gen asing untuk memproduksi ikan transgenik telah dibuktikan keberhasilannya. Tujuan penelitian yang dilakukan adalah mendapatkan kondisi elektroporasi yang optimal pada sperma ikan patin siam (Pangasionodon hypophthalmus). Penelitian dilakukan di Loka Riset Pemuliaan dan Teknologi Budidaya Perikanan Air Tawar di Sukamandi dan Laboratorium Reproduksi dan Genetika Organisme Akuatik di Institut Pertanian Bogor. Plasmid yang mengandung gen EGFP (enhanced green fluorescent protein) yang disambungkan dengan promoter β-aktin ikan mas ditransfer ke dalam sperma menggunakan metode elektroporasi untuk memproduksi ikan patin siam transgenik. Elektroporasi dilakukan menggunakan tipe kejutan square wave dengan lama kejutan (pulse length) 30 milidetik dan interval kejutan (pulse interval) 0,1 detik. Perlakuan berupa kombinasi antara kuat medan listrik (125, 187,5 dan 250 V/cm) dan jumlah kejutan listrik (1 dan 3). Konsentrasi DNA plasmid adalah 10 µg/ml TE. Hasil penelitian menunjukkan peningkatan kuat medan listrik dari 125 sampai 250 V/cm menurunkan motilitas sperma, adapun jumlah kejutan tidak mempengaruhi motilitas sperma. Motilitas sperma yang dikejut pada 125 V/cm lebih tinggi dibandingkan perlakuan lainnya walaupun kelangsungan hidup sperma relatif sama antar perlakuan dan kontrol kecuali pada sperma yang dilektroporasi pada 250 V/cm dengan jumlah kejutan 3 kali. Sperma yang dielektroporasi masih memiliki kemampuan untuk membuahi sel telur. Derajat penetasan tertinggi berasal dari telur yang dibuahi sperma yang dielektroporasi pada 125 V/cm dengan jumlah kejutan 1 dan 3 kali. Keberadaan gen EGFP dideteksi pada sperma yang dielektroporasi maupun pada sperma yang hanya diinkubasi (kontrol). Namun, pada fase larva gen EGFP hanya dapat dideteksi pada larva yang berasal dari telur yang difertilisasi sperma yang dielektroporasi. Oleh karena itu, elektroporasi dapat digunakan untuk memproduksi ikan patin transgenik. Ekspresi gen EGFP dimulai pada fase 2-8 sel dan mencapai puncaknya pada fase neurula. Kata kunci: elektroporasi, sperma, Pangasionodon hypophthalmus
40 26 OPTIMALIZATION ELECTROPORATION METHODS ON STRIPPED CATFISH (Pangasiondon hypohthalmus) SPERM AS A CARRIER FOR GENE TRANSFER ABSTRACT The success of transgenic fish production has been proven through eggs fertilization using the electroporated sperms carrying exogenous DNA. This study was conducted in order to obtain the optimal electroporation condition for stripped catfish (Pangasionodon hypophthalmus) sperm. The research was done at Research Institute for Freshwater Fish Breeding and Aquaculture, Sukamandi and Reproduction and Genetic of Aquatic Organism Laboratory, Bogor Agricultural University. Plasmid containing enhanced green fluorescent protein (EGFP) gene driven by carp β-actin promoter was transferred into sperm using electroporation method towards transgenic stripped catfish production. Electroporation was carried out using square wave shock with pulse length of 30 ms and pulse interval of 0.1 s. Treatments are combination between electric field strengths (125; 187,5 and 250 V/cm) and pulse number (1 and 3). Exogenous DNA concentration was 10 µg/ml of Tris-EDTA. Results showed that increasing of electric field strength from 125 to 250 V/cm decreased sperm motility, while pulse number did not affect sperm motility. Electric field strength of 125 V/cm gave the best motility of sperm, although sperm viability relatively similar between treatments and control except at 250 V/cm with 3 pulses number. Further, electroporation treated sperm were able to fertilize eggs. Higher hatching rate of eggs was obtained in electroporation treatment at 125 V/cm with pulse number of 1 and 3. The persistence of transferred EGFP was detected in electroporated and incubated sperms (control). However, EGFP was only detected in larvae from eggs that fertilized by electroporated sperm. Thus, electroporation could be applied to produce transgenic stripped catfish. EGFP expression was started at 2-8 cells stage, and peak expression was achieved at neurula stage. Keywords: electroporation, sperm, Pangasionodon hypophthalmus PENDAHULUAN Pada saat ini, tersedia beberapa teknik transfer gen untuk memproduksi ikan transgenik, termasuk mikroinjeksi DNA ke dalam nukleus telur yang telah dibuahi (Ozato et al. 1986), elektroporasi pada telur dan sperma (Inoue et al. 1990; Lu et al. 2002), lipofeksi gonad (Lu et al. 2002), retroviral vector (Lin et al. 1994) dan particle gun bombardment (Yazawa et al. 2005). Di antara teknikteknik ini, mikroinjeksi merupakan teknik yang paling banyak dipakai dan
41 27 memiliki tingkat keberhasilan yang tinggi untuk memproduksi ikan transgenik. Namun demikian, teknik mikroinjeksi membutuhkan keterampilan yang tinggi dan keberhasilannya ditentukan oleh karakteristik telur seperti ukurannya yang kecil, korion yang keras, mudah pecah, buram, dan sebagainya (Lanes et al. 2009). Produksi hewan transgenik melalui mikroinjeksi relatif mahal dengan tingkat keberhasilan 1-4% (Anzar & Buhr 2006). Spermatozoa dapat berperan sebagai carrier DNA eksogen, karena memiliki kemampuan alami untuk mentransfer DNA eksogen ke dalam oosit dan memproduksi benih transgenik (Anzar & Buhr 2006). Brackett et al. (1971) pertama kali mendemonstrasikan bahwa sperma kelinci mampu mengikat DNA eksogen yang ada dalam larutan, dan DNA ini terlokalisasi dalam kepala sperma. Hampir dua dekade berikutnya, Arezzo (1989) dan Lavitrano et al. (1989) membuktikan bahwa sel spermatozoa bulu babi dan tikus dapat digunakan sebagai vektor untuk transfer gen. Menurut Sin et al. (2000), sperm-mediated gene transfer (SMGT) merupakan metode yang ideal untuk transfer gen secara massal pada organisme yang fertilisasinya eksternal seperti pada ikan salmon. SMGT dapat berguna untuk transgenesis pada spesies yang memiliki fekunditas yang tinggi, ukuran telur yang kecil dan dapat diakses dengan mudah pada spermatozoa (Lanes et al. 2009). SMGT efisien dalam memproduksi babi transgenik yang mengandung human decay accelerating factor (hdaf) dengan tingkat transkripsi 64% pada jaringan yang diuji. Teknik ini lebih sederhana dibandingkan mikroinjeksi pada zigot dan membuka kesempatan untuk melakukan transgenesis pada skala massal. Beberapa laporan penelitian menyebutkan bahwa spermatozoa tikus, ayam, kerbau, dan manusia mampu mengikat DNA eksogen. Walaupun hewan transgenik dari berbagai spesies telah berhasil diproduksi, efisiensi transfer DNA dengan perantara sperma masih dipertanyakan, terutama disebabkan tingkat pengikatan DNA eksogen yang rendah oleh spermatozoa, sehingga menurunkan kesempatan fertilisasi oosit oleh spermatozoa yang tertransfeksi (disarikan dari Anzar & Buhr 2006). Berdasarkan beberapa hasil penelitian pada ikan, SMGT yang baik hanya ditemukan pada sperma yang dielektroporasi, seperti pada nila (Oreochromis
42 28 niloticus), zebra (Danio rerio), salmon (Oncorhynchus tshawytscha), koan (Ctenopharyngodon idellus) dan silver red sea bream (Sparus sarba) (disarikan dari Lanes et al. 2009). Menurut Inoue et al. (1990), dibandingkan dengan mikroinjeksi, elektroporasi merupakan teknik yang lebih mudah dalam pengerjaannya karena elektroporasi pada telur hasil fertilisasi dapat memproduksi 10 sampai 100 kali lipat dibandingkan mikroinjeksi (Powers et al. 1992). Namun demikian, efisiensi transfer gen masih belum cukup mampu untuk menangani sejumlah besar telur hasil pemijahan dalam waktu yang sangat singkat pada spesies akuakultur. Aplikasi elektroporasi dengan perantara sperma pada ikan memiliki beberapa keuntungan antara lain yaitu: (1) Teknik ini merupakan teknik transfer gen secara massal, (2) Teknik ini mampu mengatasi beberapa kekurangan sistem transfer gen konvensial yang disebabkan karakter telur seperti warna yang kabur/buram, menempel, melayang, pronuklei yang tidak tampak, dan korion yang keras, (3) DNA asing harus ditransfer ke dalam nukleus, jika telur hasil fertilisasi dielektroporasi dengan DNA asing, fragmen DNA memiliki kesempatan yang lebih besar untuk ditransfer ke dalam beberapa tempat selain blastodisk karena volumenya sangat kecil dalam telur hasil fertilisasi, (4) Sperma ikan mudah ditangani karena penambahan air secara sederhana mampu untuk mengaktifkan sperma, (5) Sperma dari hewan akuatik dapat di-kriopreservasi sehingga sperma dapat selalu tersedia untuk digunakan. Oleh karena itu, sperma ikan dapat digunakan sebagai vektor untuk mengintroduksi DNA asing untuk memproduksi ikan transgenik (Tsai 2000). Keberhasilan transfer gen ke dalam organisme akuatik telah dibuktikan melalui elektroporasi sperma menggunakan DNA eksogen sebelum fertilisasi. Efisiensi transfer DNA pada telur ikan ayu (Plecoglossus altivelis) melalui metode elektroporasi dengan perantara sperma adalah 55% ( Cheng et al. 2002), lebih baik dibandingkan loach sebesar 50% (Tsai et al. 1995), tetapi lebih rendah dibandingkan ikan zebra sebesar 80% (Powers et al. 1992). Pada penelitian ini akan dilakukan introduksi gen yang tersusun dari promoter β-aktin ikan mas (pccba) yang disambungkan dengan gen enhanced green fluorescent protein (EGFP) dengan menggunakan teknik elektroporasi pada sperma ikan patin siam
43 29 (Pangasionodon hypophthalmus). Untuk mendapatkan efisiensi transfer gen yang tinggi, pada penelitian ini diuji kombinasi tingkat kuat medan listrik (electric field strength) dan jumlah kejutan listrik (pulse number) pada sperma ikan patin siam. Diharapkan, gen EGFP yang ditransfer mampu terinsersi dan terekspresi pada ikan patin siam. BAHAN DAN METODE Koleksi Gamet Induk jantan dan betina yang digunakan adalah induk ikan patin siam berukuran 2-4 kg yang diperoleh dari Loka Riset Pemuliaan dan Teknologi Budidaya Perikanan Air Tawar Sukamandi. Induk diseleksi berdasarkan tingkat kematangan gonadnya. Induk yang telah mencapai TKG III dipilih untuk dipijahkan. Induk hasil seleksi dari kolam induk dipindahkan ke dalam bak pemijahan. Keseragaman kematangan telur dan ovulasi diinduksi melalui penyuntikan hormon. Induk betina diberi suntikan pertama berupa HCG dengan dosis 500 IU/kg bobot. Suntikan kedua diberikan dengan selang waktu 24 jam berupa ovaprim dengan dosis 0,6 ml/kg bobot. Striping untuk mendapatkan sel telur dilakukan 9-12 jam dari penyuntikan kedua. Induk jantan diinduksi melalui penyuntikan ovaprim dengan dosis 0,2 0,3 ml/kg bobot. Striping untuk mendapatkan sperma dilakukan 9-12 jam setelah penyuntikan. Konstruksi Plasmid Konstruksi gen pccba-egfp (Hidayani 2009) yang digunakan tersusun dari promoter β-aktin ikan mas (pccba) dan gen enhanced green fluorescent protein (EGFP) dimodifikasi dari vektor ekspresi pegfp-ni (Clontech). Vektor pegfp-n1 (panjang 4,7 kb) dipotong (digesti) menggunakan enzim restriksi Kpn I dan Apa I sebelum disambungkan (diligasi) dengan sekuens promoter pccba (panjang 1,9 kb). Proses digesti dilakukan dengan melarutkan 5 µl pegfp-n1, 2,5
44 30 µl 10xK buffer, 5µl BSA, 1 µl enzim Kpn I, 1 µl enzim Apa I dan 35,5 µl SDW. Reaksi digesti diinkubasi selama satu jam pada suhu 37ºC. Proses ligasi (penyambungan) dilakukan dengan mencampurkan 1 µl pccba, 6,5 µl 2x buffer ligasi, 1 µl enzim T4 DNA ligase dan 4,5 µl plasmid pegfp-ni yang telah dipotong. Inkubasi dilakukan selama dua jam pada suhu ruang dan dilanjutkan semalam di dalam refrigerator (suhu sekitar 4 C). Peta konstruksi gen pccba-egfp (6,0 kb) dapat dilihat pada Gambar 8. Kpn I Apa I Age I Not I pccba EGFP pccba-egfp (6,0 kb) Poly A Gambar 8 Peta konstruksi gen pccba-egfp (6,0 kb). pccba= promoter β- aktin ikan mas. EGFP= enhanced green fluorescent protein. PolyA= poliadenilasi. KpnI, ApaI, AgeI, NotI= enzim restriksi. Elektroporasi Sperma Elektroporasi sperma dilakukan dengan menggunakan mesin Gene Pulser II (Biorad, USA). Sperma diencerkan dengan menggunakan larutan fisiologis (1 : 7) sebelum dicampur dengan plasmid. Untuk mendapatkan kondisi elektroporasi yang optimal maka dilakukan penelitian pendahuluan untuk mendapatkan kisaran kuat medan listrik yang mendukung motilitas dan kelangsungan hidup spermatozoa yang tinggi sehingga tetap memiliki kemampuan untuk membuahi sel telur. Kisaran kuat medan listrik yang digunakan yaitu antara V/cm. Berdasarkan hasil pada penelitian pendahuluan tersebut, diketahui bahwa kejutan listrik dengan menggunakan 250 V/cm menunjukkan nilai motilitas dan kelangsungan hidup sperma yang terbaik (Tabel 2). Pengujian lebih lanjut dilakukan untuk mendapatkan kombinasi kuat medan listrik dan jumlah kejutan listrik yang optimal sehingga didapatkan nilai motilitas spermatozoa dan ketahanan hidup spermatozoa yang tinggi serta larva yang membawa DNA eksogen. Kuat medan listrik yang diujikan adalah 125; 187,5 dan 250 V/cm
45 31 dengan jumlah kejutan listrik 1 dan 3 kali. Elektroporasi dilakukan dengan tipe kejutan square wave dengan panjang kejutan (pulse length) 30 milidetik dan interval kejutan (pulse interval) 0,1 detik. Konsentrasi DNA plasmid yang digunakan adalah 10 µg/ml dalam TE. Motilitas dan Kelangsungan Hidup Spermatozoa Kualitas sperma hasil elektroporasi diukur dengan menentukan derajat motilitasnya. Satu tetes sperma diteteskan dengan menggunakan mikropipet di atas gelas objek kemudian ditutup dengan gelas penutup. Pada tepi gelas penutup diteteskan akuades lalu dilihat pergerakan spermatozoa setelah terkena air di bawah mikroskop dengan perbesaran 10x40. Penilaian motilitas didasarkan pada kriteria banyaknya sperma yang bergerak maju (progresif) dengan skor seperti ditunjukkan pada Tabel 1. Tabel 1. Kriteria penilaian motilitas spermatozoa Kriteria Skor >70% spermatozoa bergerak cepat dengan arah maju dengan 5,0 pergerakan ekor bervariasi 55-70% spermatozoa bergerak maju dan beberapa menunjukkan 4,0 gerakan cepat 40-55% spermatozoa bergerak maju dan beberapa menunjukkan 3,0 gerakan cepat 25-40% spermatozoa menunjukkan gerakan arah maju 2, % spermatozoa menunjukkan gerakan arah maju 1,0 1-10% spermatozoa bergerak maju, kebanyakan spermatozoa tidak 0,5 bergerak semua spermatozoa tidak bergerak 0,0 Kuantitas sperma yang hidup setelah elektroporasi diamati melalui pewarnaan eosin. Sperma diteteskan di atas gelas objek dan ditambahkan eosin 2%, kemudian dicampur secara merata dan dibuat preparat ulas yang tipis. Preparat ulas dibiarkan kering udara kemudian dibilas dengan akuades. Preparat diamati di bawah mikroskop dengan perbesaran 10x40 dengan 3 bidang pandang. Spermatozoa yang hidup ditandai dengan kepala sperma yang berwarna merah muda dan berbentuk bulat, sedangkan kepala sperma yang mati berwarna hitam dan berbentuk tidak beraturan (Gambar 9).
46 32 Gambar 9. Spermatozoa ikan patin siam. a = spermatozoa hidup, b = spermatozoa mati Deteksi Gen EGFP pada Sperma dan Larva Ikan Patin Siam Ekstraksi DNA. Pada sampel sperma, sebelum dilakukan ekstraksi DNA, sampel sperma dicuci untuk membuang sisa plasmid pada media elektroporasi. Adapun untuk larva, tidak perlu dilakukan pencucian terlebih dahulu. Sperma hasil elektroporasi dicuci dengan cara menambahkan larutan fisiologis dan disentrifugasi dengan kecepatan 3000 rpm selama 1 menit. Supernatan yang terbentuk dibuang, pelet sperma diresuspensi dengan menggunakan 20 µl larutan fisiologis. Proses pencucian pelet sperma diulang sebanyak tiga kali. Sampel sperma atau larva dimasukkan ke dalam tabung mikro, ditambahkan 200 μl cell lysis solution (Puregene, Minneapolis, USA), 2 μl Proteinase K (20 mg/ml) dan selanjutnya dihomogenasi menggunakan vorteks. Inkubasi dilakukan pada suhu 55 C selama semalam (overnight). RNase sebanyak 2 μl (4 mg/ml) ditambahkan ke dalam larutan dan diaduk dengan hati-hati dengan cara membolik-balik tabung mikro. Larutan diinkubasi pada suhu 37 C selama 60 menit dan disimpan dalam suhu 4 C selama 5 menit. Sebanyak 200 μl protein precipitation solution (Puregene, Minneapolis, USA) ditambahkan ke dalam larutan, diaduk perlahan, dan selanjutnya disentrifugasi pada kecepatan rpm selama 10 menit. Supernatan dipindahkan ke dalam tabung mikro berisi
47 33 isopropanol, lalu tabung mikro dibolak-balik sebanyak 50x dengan hati-hati dan disentrifugasi dengan kecepatan rpm selama menit. Supernatan dibuang dan ditambahkan 300 μl Etanol 70% dingin. Sentrifugasi dengan kecepatan rpm selama 10 menit, supernatan dibuang dan pelet DNA dikering-udarakan. Steril destillated water (SDW) sebanyak 50 μl digunakan untuk melarutkan DNA. Larutan DNA dapat disimpan dalam freezer (suhu -20 C) hingga akan digunakan dalam proses selanjutnya. Polymerase chain reaction. Keberadaan DNA eksogen (EGFP) di dalam sperma dan larva diamati dengan metode PCR. PCR dilakukan dengan menggunakan primer GFPr (5 -ACG AAC TCC AGC AGG ACC AT-3 ) dan GFPf (5 -GGT CGA GCT GGA CGG CGA CG-3 ). PCR dilakukan dengan program: 94 C selama 3 menit; (94 C selama 30 detik; 62 C selama 30 detik; 72 C selama 1 menit) sebanyak 35 siklus; 72 C selama 3 menit; dan 4 C (tak hingga). Pengecekan hasil amplifikasi PCR dilakukan dengan elektroforesis menggunakan gel agarosa 0,7%. Produk amplifikasi gen EGFP berada pada ukuran sekitar 600 bp. Ekspresi Gen EGFP pada Embrio dan Larva Ikan Patin Siam Ekstraksi RNA. RNA total diisolasi dari 50 butir embrio atau larva. Sampel disimpan dalam botol sampel yang telah berisi isogen sebanyak 200 µl. Sampel dihancurkan oleh penggerus yang sebelumnya telah disterilkan dengan DEPC 1%. Ke dalam Eppendorf ditambahkan larutan isogen sampai mencapai volume akhir 800 µl. Chloroform p.a. sebanyak 200 µl ditambahkan ke dalam Eppendorf dan larutan disentrifugasi pada kecepatan rpm selama lima menit pada suhu ruang. Supernatan yang terbentuk dipindahkan ke dalam Eppendorf baru yang telah berisi 400 µl isopropanol. Larutan disentrifugasi pada kecepatan rpm selama 15 menit pada suhu 4 C. Pada Eppendorf akan terbentuk pelet RNA, dan cairan yang terdapat pada Eppendorf dibuang. Ke dalam Eppendorf ditambahkan 1 ml alkohol 70% (dingin) kemudian sentrifugasi dengan kecepatan rpm selama 15 menit. Pelet RNA dikeringkan dengan cara membuang larutan yang terdapat pada Eppendorf. Sampel RNA disimpan dengan cara menambahkan 30 µl DEPC 1%. Konsentrasi RNA total hasil isolasi
48 34 diukur menggunakan alat pengukur konsentrasi RNA/DNA (GeneQuant). Absorbansi diukur pada panjang gelombang 260 dan 280 nm. Sintesis cdna. Sintesis complementary DNA (cdna) menggunakan kit Ready-To-Go You-Prime First Strand Beads (Amersham pharmacia biotech, USA). Konsentrasi RNA dibuat 3 μg dalam 30 μl DEPC. Larutan RNA diinkubasi pada suhu 65 C selama 10 menit dan kemudian disimpan di atas es. Sampel RNA dipindahkan ke dalam tube FSRMB (First strand reaction mix beads) dan ditambahkan 3 μl primer dt3 RACE-VECT (5 -GTA ATA CGA ATA ACT ATA GGG CAC GCG TGG TCG ACG GCC CGG GCT GGT TTT TTT TTT TTT TTT T-3 ) dengan konsentrasi 1 µg/3 µl. Larutan dihomogenkan dan diinkubasi pada suhu 37 C selama 1 jam. cdna yang terbentuk ditambahkan 30 µl SDW steril dan disimpan dalam refrigerator. Analisis Ekspresi EGFP. Ekspresi EGFP pada embrio dan larva diamati setiap enam jam dengan metode RT-PCR. PCR dilakukan dengan menggunakan primer GFPr (5 -ACG AAC TCC AGC AGG ACC AT-3 ) dan GFPf (5 -GGT CGA GCT GGA CGG CGA CG-3 ). PCR dilakukan dengan program: 94 C selama 3 menit; (94 C selama 30 detik; 62 C selama 30 detik; 72 C selama 1 menit) sebanyak 25 siklus; 72 C selama 3 menit; dan 4 C (tak hingga). Pengecekan hasil amplifikasi PCR dilakukan dengan elektroforesis menggunakan gel agarose 0,7%. Produk amplifikasi gen EGFP berada pada ukuran sekitar 600 bp. Sebagai kontrol internal digunakan gen β-aktin. Deteksi gen β-aktin dilakukan dengan menggunakan metode PCR. Primer yang digunakan adalah bact-f (5 - TAT GAA GGT TAT GCT CTG CCC-3 ) dan bact-r (5 - CAT ACC CAG GAA AGA TGG CTG-3 ). PCR dilakukan dengan program: 94 C selama 3 menit; (94 C selama 30 detik; 58 C selama 30 detik; 72 C selama 30 detik) sebanyak 30 siklus; 72 C selama 3 menit; dan 4 C (tak hingga). Pengecekan hasil amplifikasi PCR dilakukan dengan elektroforesis menggunakan gel agarose 1%. Gen β-aktin ikan patin siam berada pada ukuran sekitar 300 bp. Pengukuran level ekspresi gen EGFP dilakukan dengan mengukur ketebalan pita DNA hasil elektroforesis menggunakan software UN-SCAN-IT gel 6.1. Hasil pengukuran level ekspresi gen EGFP dibandingkan dengan gen β-aktin yang berfungsi sebagai kontrol loading RNA.
49 35 HASIL DAN PEMBAHASAN Motilitas dan Kelangsungan Hidup Spermatozoa Setelah Elektroporasi Uji pendahuluan untuk mendapatkan kondisi elektroporasi yang optimal pada sperma ikan patin siam dilakukan dengan menguji berbagai level kuat medan listrik. Hasil pengujian berbagai kondisi kuat medan listrik terhadap motilitas dan kelangsungan hidup spermatozoa dapat dilihat pada Tabel 2. Tabel 2. Motilitas spermatozoa ikan patin siam yang dielektroporasi pada beberapa tingkat kuat medan listrik Kuat medan listrik (V/cm) Indeks Motilitas (skor) Kontrol , Kelangsungan hidup spermatozoa menurun setelah dielektroporasi dari 250 sampai 1250 V/cm. Kelangsungan hidup spermatozoa yang dielektroporasi pada 250 V/cm tidak berbeda dengan 500 V/cm, tetapi berbeda dengan 750 V/cm, 1000 V/cm dan 1250 V/cm. Motilitas dan kelangsungan hidup spermatozoa yang dielektroporasi pada V/cm menunjukkan hasil terbaik dan tidak berbeda dibandingkan dengan spermatozoa yang tidak dielektroporasi (Gambar 10). Gambar 10. Kelangsungan hidup spermatozoa (%) yang dielektroporasi pada beberapa tingkat kuat medan listrik.
50 36 Selanjutnya, untuk mendapatkan kondisi elektroporasi yang optimal, sperma dielektroporasi dengan kombinasi kuat medan listrik (125; 187,5 dan 250 V/cm) dan jumlah kejutan listrik (1 dan 3). Peningkatan kuat medan listrik dari 125 sampai 250 V/cm menyebabkan menurunnya motilitas spermatozoa, tetapi jumlah kejutan tidak mempengaruhi motilitas spermatozoa. Spermatozoa yang dielektroporasi pada 125 V/cm menunjukkan nilai motilitas terbaik. Namun demikian, kelangsungan hidup spermatozoa relatif tidak berbeda antar perlakuan dan kontrol kecuali pada spermatozoa yang dielektroporasi pada 250 V/cm dengan jumlah kejutan 3 kali. Pengaruh elektroporasi pada motilitas dan kelangsungan hidup spermatozoa ditunjukkan pada Tabel 3 dan Gambar 11. Berdasarkan data tersebut, sperma yang dielektroporasi pada 125 V/cm dengan jumlah kejutan 1 dan 3 kali memberikan kondisi terbaik untuk elektroporasi pada sperma ikan patin siam. Tabel 3. Motilitas spermatozoa yang dielektroporasi pada beberapa tingkat kombinasi kuat medan listrik dan jumlah kejutan Perlakuan Jumlah kejutan listrik Kuat medan listrik (V/cm) 0 (Kontrol) , Gambar 11. Kelangsungan hidup spermatozoa (%) yang dielektroporasi pada beberapa tingkat kombinasi kuat medan listrik dan jumlah kejutan.
51 37 Aplikasi kejutan listrik pada suspensi sel menginduksi polarisasi komponen membran sel dan mengembangkan potensi tegangan di seluruh membran. Pada saat perbedaan potensial antara bagian dalam dan luar membran sel melewati titik kritis, komponen membran di-reorganisasi ke dalam pori dalam area terlokalisasi, dan kemudian sel menjadi permeabel terhadap masuknya makromolekul (Knight, 1981; Knight & Scrutton, 1986). Proses modifikasi permeabilitas membran sel melalui kuat medan listrik disebut elektroporasi. Perubahan permeabilitas bersifat sementara, dengan syarat kejutan listrik tidak melebihi batas kritis bagi sel (Tsong 1983). Ukuran pori dapat diubah melalui berbagai panjang kejutan (dalam milidetik), kuat medan listrik (dalam Volt/sentimeter), dan kekuatan ionik media (Tsong 1983). Pada ikan patin siam, kelangsungan hidup spermatozoa yang dielektroporasi pada 125 V/cm adalah 58,4-66,5%, tetapi ketika sperma dielektroporasi pada 1250 V/cm menyebabkan kematian pada spermatozoa. Berdasarkan penelitian Cheng et al. (2002), motilitas sperma ikan ayu menurun sampai 50% setelah 120 detik ketika dikejut dengan voltase 9 kv. Symonds et al. (1994) juga mendemonstrasikan bahwa aktivitas sperma chinook salmon menurun dari 82% menjadi 2% pada saat sperma dielektroporasi dengan kuat medan listrik yang meningkat dari 625 V/cm menjadi 1000 V/cm. Penelitian Sin et al. (2000) pada sperma salmon menunjukkan bahwa kondisi elektroporasi optimal pada sperma salmon adalah pada kuat medan listrik 800 sampai 1000 V/cm, panjang kejutan 27,4 milidetik, dan 2 kejutan. Motilitas sperma pasca elektroporasi bergantung pada voltase, panjang kejutan, jumlah kejutan dan kekuatan ionik buffer (Symonds et al. 1994). Ukuran pori dapat diubah melalui variasi panjang kejutan (milidetik), kuat medan listrik (Volt/cm), dan kekuatan ionik dari media (Tsong 1983). Sperma yang dielektroporasi pada 125; 187,5 dan 250 V/cm tetap memiliki kemampuan untuk membuahi telur. Berdasarkan data pada Gambar 12, telur yang dibuahi oleh sperma yang dielektroporasi pada 125 V/cm dan 187,5 V/cm dengan jumlah kejutan satu kali, menunjukkan derajat pembuahan yang lebih tinggi dibandingkan telur yang dibuahi oleh sperma yang dielektroporasi pada 250 V/cm. Namun demikian, derajat penetasan telur sangat dipengaruhi oleh motilitas dan kelangsungan hidup sperma. Telur yang dibuahi oleh sperma yang
52 38 dielektroporasi pada 125 V/cm dengan jumlah kejutan 1 dan 3 kali menunjukkan nilai derajat penetasan terbaik (Gambar 13). Gambar 12. Derajat pembuahan (%) telur ikan patin siam yang dibuahi oleh spermatozoa yang dilektroporasi pada beberapa tingkat kombinasi kuat medan listrik dan jumlah kejutan. Gambar 13. Derajat penetasan (%) telur ikan patin siam yang dibuahi oleh spermatozoa yang dilektroporasi pada beberapa tingkat kombinasi kuat medan listrik dan jumlah kejutan. Kondisi sperma ikan akan menentukan keberhasilan pembuahannya. Sperma yang baik dapat membuahi sel telur dengan baik. Terjadinya perubahan pada sperma akan mempengaruhi kerja sperma. Perubahan disini adalah dalam hal pergerakan (motilitas) dan ketahanan hidupnya. Semen yang memenuhi syarat
53 39 untuk proses pembuahan mengandung sperma yang hidup dan bergerak aktif ke depan (progresif). Persentase sperma yang motil tidak harus lebih dari 75%. Dalam penggunaan sehari-hari tidak kurang dari 50% meskipun beberapa peneliti menganjurkan 60% atau lebih tinggi (Hafez 1987). Derajat penetasan telur yang dibuahi oleh sperma yang dielektroporasi pada 125 V/cm tidak berbeda dengan kontrol. Derajat penetasan menurun pada telur yang dibuahi oleh sperma yang dielektroporasi dari 125 V/cm sampai 250 V/cm (Gambar 13). Hal ini menunjukkan bahwa sperma yang dielektroporasi pada 125 V/cm dengan jumlah kejutan 1 dan 3 kali memberikan kondisi terbaik untuk memproduksi ikan patin siam transgenik. Deteksi Gen EGFP pada Spermatozoa dan Larva Keberadaan gen EGFP pada spermatozoa ikan patin siam yang telah dielektroporasi dapat dilihat pada Gambar 14. Gen EGFP terdeteksi pada semua perlakuan, baik pada sperma yang hanya diinkubasi dalam larutan yang mengandung DNA plasmid (kontrol) tanpa elektroporasi maupun pada sperma yang dielektroporasi. Adapun deteksi gen EGFP pada larva ikan patin siam (Gambar 15) menunjukkan bahwa gen EGFP hanya ditemukan pada larva hasil pembuahan telur oleh sperma yang dielektroporasi. Larva yang berasal dari telur yang difertilisasi oleh sperma yang hanya diinkubasi dalam medium yang mengandung DNA plasmid (K), tidak menunjukkan adanya gen EGFP. 600 bp Gambar 14. Keberadaan gen EGFP (tanda kepala panah) pada spermatozoa ikan patin siam setelah dielektroporasi dan pada kontrol (K). M=marker panjang fragmen DNA (2 log-ladder); angka 1 dan 3 menunjukkan jumlah kejutaan listrik; 125, 187,5 dan 250 adalah kuat medan listrik. Angka di sebelah kiri gambar adalah ukuran panjang marka DNA.
54 bp Gambar 15. Keberadaan gen EGFP (tanda kepala panah) pada larva ikan patin siam setelah dielektroporasi dan pada kontrol (K). M=marker panjang fragmen DNA (2 log-ladder); angka 1 dan 3 menunjukkan jumlah kejutaan listrik; 125, 187,5 dan 250 adalah kuat medan listrik. Angka di sebelah kiri gambar adalah ukuran panjang marka DNA. Gen EGFP ditemukan pada sperma yang dielektroporasi maupun pada sperma yang hanya diinkubasi dalam media yang mengandung DNA plasmid. Namun pada larva, gen EGFP hanya ditemukan pada larva yang berasal dari telur yang dibuahi sel spermatozoa yang dielektroporasi. Menurut Lanes et al. (2009), jika semen diinkubasi oleh DNA eksogen tetapi tidak dielektroporasi, efisiensi SMGT untuk produksi ikan transgenik rendah atau bahkan tidak ada. Hasil penelitian Zhong et al. (2002) pada ikan koan menunjukkan bahwa sperma ikan koan yang dicampur dengan plasmid pcahlfc dan diinkubasi selama menit dan dicampurkan ke telur untuk fertilisasi buatan, memiliki efisiensi transfer gen antara 2,2 4,3%. Adapun tingkat keberhasilan transfer gen diantara benih yang diperoleh dari telur yang difertilisasi oleh sperma yang dielektroporasi yaitu antara 19,6 46,8%. Patil & Khoo (1996) melaporkan bahwa pada sel sperma ikan zebra (Danio rerio) yang diinkubasi dengan DNA asing memiliki kapasitas untuk mengambil DNA asing. Pengambilan/pemasukan DNA asing dapat ditingkatkan melalui elektroporasi. Pengikatan DNA asing oleh spermatozoa ikan zebra meningkat 1-2 kali lipat setelah dielektroporasi dengan kuat medan listrik 500, 1000, dan 1500 V/cm. Peningkatan kuat medan listrik menyebabkan penurunan motilitas sperma, bahkan pada kuat medan listrik yang tinggi menyebabkan sperma menggumpal.
55 41 Pola Ekspresi Gen EGFP pada Embrio dan Larva Ikan Patin Siam Pengamatan pola ekspresi gen EGFP dilakukan setiap enam jam sampai embrio menetas menjadi larva. Tahapan perkembangan embrio setiap enam jam dapat dilihat pada Gambar 16. Pada penelitian ini, gen EGFP yang ditransfer pada sperma ikan patin siam melalui metode elektroporasi terbukti mampu terinsersi pada embrio dan larva ikan patin siam. Selain mampu terinsersi, Gen EGFP juga diekspresikan baik pada fase embrio sampai menjadi larva (Gambar 17). Gen EGFP mulai terekspresi pada jam ke-0 (fase 2-8 sel) dan mencapai puncaknya pada jam ke-12 yaitu pada fase neurula. Ekspresi gen EGFP menurun pada jam ke-30 yaitu pada fase larva (Gambar 18). Jam ke-0 (fase 2-8 sel) Jam ke-6 (fase gastrula) Jam ke-12 (fase neurula) Jam ke-18 (fase organogenesis) Jam ke-30 (fase larva) Gambar 16. Fase perkembangan embrio ikan patin siam yang diamati setiap enam jam sekali.
56 42 kb 3,0 - M L M L kb 3,0-1,0-0,5-1,0-0,5 - EGFP BA Gambar 17. Pola ekspresi gen EGFP yang diamati selama perkembangan embrio sampai menetas. M = marker. Angka 0, 6, 12, 18 menunjukkan jam pengamatan sampel. L = larva. BA = β-aktin (kontrol internal). EGFP = enhanced green fluorescent protein. Tanda kepala panah menunjukkan keberadaan DNA target. Gambar 18. Level ekspresi gen EGFP pada embrio dan larva ikan patin siam. Gen asing yang diintroduksi ke ikan harus bisa ditranskripsi dan ditranslasi secara akurat dalam ikan resipien. Ekspresi dari gen asing dimulai setelah fase mid-blastula dan levelnya meningkat selama embriogenesis, dan selanjutnya menurun setelah menetas (Gong & Hew 1993; Liu et al. 1990). Pada ikan patin siam, puncak ekspresi gen EGFP terjadi pada jam ke-12 yaitu pada fase neurula. Puncak ekspresi DNA eksogen diduga lebih berkaitan dengan perkembangan embrio dibandingkan waktu. Pada ikan zebra (Danio rerio), puncak ekspresi DNA
57 43 eksogen terjadi pada awal gastrula (Stuart et al. 1988). Pada ikan medaka terjadi pada stadia gastrula/neurula (Chong & Vielkiend 1989). Pada loach (Misgurnus sp.) terjadi pada stadia akhir gastrula (Maclean et al. 1987), dan pada lele Afrika (Clarias gariepinus) terjadi pada awal gastrula (awal epiboli; Volckaert et al. 1994). Puncak replikasi DNA ini terjadi pada Xenopus pada akhir proses pembelahan yang cepat (midblastula terdiri dari 4000 sel, 7 jam setelah fertilisasi). Pada ikan medaka, awal transkripsi gen endogen terjadi pada stadia midblastula (Winkler et al. 1992). Ekspresi dari gen asing dimulai setelah fase mid-blastula dan levelnya meningkat selama embriogenesis, dan selanjutnya menurun setelah menetas (Gong & Hew 1993; Liu et al. 1990). Kejadian ini disebut sebagai ekspresi sementara (transient expression), yang mungkin disebabkan oleh replikasi ekstrakromosomal DNA asing. Level ekspresi selanjutnya akan menurun yang diikuti dengan degradasi dari ekstrakromosomal DNA. Akibatnya, level ekspresi gen yang terintegrasi ke kromosom resipien tidak setinggi dengan ekspresi sementara. Integrasi DNA asing pada ikan transgenik relatif rendah dan bervariasi, dan sebagian besar transgenik founder (F0) bersifat mosaic baik pada sel somatik maupun germ cell, yang menyebabkan frekuensi transmisi yang lebih rendah dibandingkan dengan yang diharapkan apabila mengikuti hukum segregasi Mendel (Iyengar et al. 1996). Walaupun banyak eksprerimen melaporkan keberhasilan ekspresi gen yang diintroduksikan pada ikan transgenik, ekspresi bersifat sementara (transient) pada sebagian besar eksperimen, dan hanya beberapa eksperimen yang menunjukkan adanya ekspresi yang ditransmisikan dari gen reporter yang terintegrasi (Lin et al. 1994, Kinoshita et al. 1996). Transfer gen EGFP melalui metode elektroporasi pada sperma ikan patin siam menunjukkan bahwa gen EGFP mampu terinsersi dan terekspresi pada larva ikan patin siam. Keberhasilan ini membuka kesempatan untuk memproduksi ikan patin siam transgenik dengan karakteristik yang diinginkan. Peningkatan produksi ikan patin siam dibutuhkan seiring dengan adanya isu meningkatnya populasi manusia, menurunnya kualitas lingkungan perairan, dan meningkatnya kepedulian masyarakat akan pentingnya makanan yang bernutrisi tinggi. Transfer berbagai jenis gen terbukti mampu meningkatkan karakteristik tertentu pada ikan seperti
58 44 transfer gen GH mampu meningkatkan pertumbuhan ikan mud loach (Nam et al. 2001), transfer gen cecropin mampu meningkatkan resistensi ikan medaka terhadap Pseudomonan fluorescents dan Vibrio anguillarum (Sarmasik et al. 2002), dan transfer gen AFP mampu meningkatkan toleransi ikan salmon terhadap temperatur dingin (Hew et al. 1992). KESIMPULAN Metode elektroporasi melalui sperma dapat digunakan untuk transfer gen pada ikan patin siam. Tingkat kuat medan listrik yang sesuai untuk elektroporasi sperma ikan patin siam adalah 125 V/cm. Promoter β-aktin ikan mas dapat digunakan untuk membuat ikan patin siam transgenik.
59 45 4. EFEKTIVITAS TRANSFER DAN EKSPRESI GEN PhGH PADA IKAN PATIN SIAM (Pangasionodon hypophthalmus) ABSTRAK Penggunaan konsentrasi DNA yang tinggi dalam elektroporasi sperma meningkatkan pengikatan DNA eksogen pada sperma, dan meningkatkan persentase ikan yang membawa gen asing. Pada penelitian ini, konstruksi gen pccba-phgh yang mengandung promoter β-aktin ikan mas (pccba) dan cdna GH ikan patin siam (PhGH) dibuat dan selanjutnya ditransfer menggunakan metode elektroporasi pada sperma yang berperan sebagai perantara. Penelitian dilaksanakan di Loka Riset Pemuliaan dan Teknologi Budidaya Perikanan Air Tawar di Sukamandi dan Laboratorium Reproduksi dan Genetika Organisme Akuatik di Institut Pertanian Bogor. Elektroporasi dilakukan dengan tipe kejutan square wave dengan panjang kejutan (pulse length) 30 milidetik, interval kejutan (pulse interval) 0,1 detik, kuat medan listrik (electric field strength) 125 V/cm dan jumlah kejutan (pulse number) 3 kali. Hasil penelitian menunjukkan bahwa keberhasilan transfer gen PhGH eksogen pada ikan patin siam (Pangasionodon hypophthalmus) meningkat dengan meningkatnya konsentrasi DNA yang digunakan. Persentase ikan yang membawa gen asing pada konsentrasi DNA 10 µg/ml, 50 µg/ml dan 90 µg/ml, secara berturut-turut adalah 28,57%, 78,57% dan 85,71%. Bobot rata-rata juvenil ikan patin siam transgenik F0 umur 2 bulan yang dihasilkan menggunakan konsentrasi DNA 50 μg/ml dan 90 μg/ml adalah 22.6% dan 19.0% lebih berat dibandingkan non-transgenik, tetapi pada konsentrasi 10 μg/ml lebih rendah (-8.45%). Adapun populasi juvenil ikan patin siam berumur 4 bulan yang diintroduksi DNA plasmid dengan konsentrasi 90 μg/ml memiliki bobot rataan 53,38% lebih berat dibandingkan kontrol. Dengan demikian, elektroporasi sperma menggunakan konsentrasi DNA 90 µg/ml efektif meningkatkan keberhasilan transfer gen, dan over-ekspresi gen PhGH eksogen meningkatkan pertumbuhan ikan patin siam. Kata kunci: transfer gen, ekspresi gen, pccba-phgh, Pangasionodon hypophthalmus
60 46 GENE TRANSFER EFFECTIVITY AND EXPRESSION OF PhGH GENE ON STRIPPED CATFISH (Pangasionodon hypophthalmus) ABSTRACT The used of high exogenous DNA concentration in electroporation of sperm enhances the binding of exogenous DNA into sperm, and increase number of fish carrying foreign gene. In this study, pccba-phgh gene construct consists of common carp β-actin promoter (pccba) and stripped catfish growth hormone cdna was designed and then transferred using electroporation method on sperm that acts as a vector. Electroporation was performed using square-wave type with pulse length 30 milliseconds, pulse interval 0.1 seconds, electric field strength 125 V/cm and pulse number 3 times. The results showed that the success transfer of the exogenous PhGH gene in stripped catfish (Pangasionodon hypophthalmus) increased by increasing DNA concentration used. Percentage of fish carrying foreign gene in DNA concentration of 10 µg/ml, 50 µg/ml and 90 µg/ml were 28.57%, 78.57%, and 85, 71%, respectively. Average body weight of 2 months old transgenic fish juvenile produced by using DNA concentration of 50 µg/ml and 90 µg/ml was 22.6% and 19% heavier than non-transgenic, but at concentration of 10 µg/ml was lower (-8.45%). The average weight of 4 months old juvenile produced by using DNA concentration of 90 µg/ml was 53.38% heavier than control. Thus, electroporation of sperm with DNA concentration of 90 µg/ml effectively increased gene transfer efficiency, and over-expression of PhGH exogenous gene enhanced growth of stripped catfish. Keywords: gene transfer, gene expression, pccba-phgh, Pangasionodon hypophthalmus PENDAHULUAN Hormon pertumbuhan (growth hormone, GH) merupakan bagian dari hormon yang disirkulasikan yang menstimulasi pertumbuhan tubuh. Selain itu GH juga berperan dalam adaptasi di air laut pada kelompok ikan-ikan salmonid (McLean & Donaldson 1993) dan menstimulasi steroidogenesis gonad (Rand- Weaver & Kawauchi 1993). Pada awal produksi ikan transgenik, digunakan gen GH dari manusia atau tikus yang disambungkan dengan promoter metallothionein-1 dari tikus (Zhu et al. 1985; Maclean et al. 1987). Pada saat ini berkembang produksi ikan transgenik dengan menggunakan gen GH yang berasal
61 47 dari ikan (Inoue et al. 1990; Du et al. 1992). Berdasarkan laporan sampai dengan tahun 1991 bahwa ikan mas, salmon, Northern pike, loach, trout, dan lele dapat ditransformasi dengan berbagai hormon pertumbuhan di bawah kontrol promoter yang berbeda untuk memproduksi ikan dengan peningkatan pertumbuhan lebih dari 100% dibandingkan kontrol (Hackett 1993). Peningkatan laju pertumbuhan ikan merupakan salah satu motivasi awal pada rekayasa genetika ikan yang didasarkan pada penelitian bahwa ukuran tikus secara signifikan dapat ditingkatkan setelah diintroduksi gen hormon pertumbuhan tikus tanah (sekuens heterolog) yang disambungkan dengan promoter metallothionein (MT) tikus ke dalam genom tikus (Palmiter et al. 1982). Berdasarkan penelitian ini maka diperoleh petunjuk untuk keberhasilan produksi ikan transgenik dengan pertumbuhan yang cepat, yaitu regulator transgen dari spesies yang kekerabatannya jauh sebaiknya dihindari, karena sekuens promoter dari spesies yang kekerabatannya jauh kemungkinan tidak dikenali oleh RNA polimerase inang untuk mengarahkan ekspresi gen asing. Namun demikian, hasil observasi selanjutnya menunjukkan bahwa transgen GH yang berasal dari spesies yang kekerabatannya dekat efektif meningkatkan pertumbuhan hewan inang, tetapi jika menggunakan sekuens gen GH homolog yang sama dari spesies yang sama kemungkinan tidak terlalu efektif karena adanya potensi pengaturan umpan balik negatif (Nam et al. 2008). Hasil penelitian Devlin et al. (1994) menunjukkan bahwa transfer gen dengan menggunakan konstruksi gen all-salmonid yang mengandung gen GH-1 dari sockeye salmon (Oncorhynchus nerka) yang disambungkan dengan promoter sockeye salmon metallothionein-b (MT-B) pada coho salmon (O.kisutch), yaitu spesies yang kekerabatannya dekat, menyebabkan peningkatan pertumbuhan yang drastis. Tingkat ekspresi transgen pada organisme transgenik yang stabil dipengaruhi oleh banyak faktor, terutama promoter yang mengendalikan transgen, jumlah kopi transgen dalam genom, dan interaksi antara transgen dan sekuens yang mengapit transgen (Rahman et al. 2000). Hasil penelitian Rahman et al. (2000) yang mengintroduksi gen reporter lacz dengan promoter β-aktin ikan mas pada ikan nila menunjukkan adanya pola mosaik dari ekspresi LacZ pada jaringan somatik berbeda antar garis keturunan tetapi konsisten dalam satu garis keturunan.
62 48 Ekspresi LacZ pada ikan transgenik homozigot sekitar 2 kali lebih besar dibandingkan ikan transgenik heterozigot. Analisis ekspresi gen reporter pada jaringan-jaringan yang didasarkan pada ekspresi LacZ pada ikan transgenik stabil menunjukkan intensitas yang bervariasi pada organ dan jaringan yang berbeda dan kadang-kadang bervariasi pada sel-sel yang berbeda dalam jaringan yang sama pada generasi transgenik generasi pertama dan kedua. Ekspresi gen GH eksogen dideteksi pada sejumlah penelitian seperti pada ikan Northern pike (Esox lucius; Gross et al. 1992) dan ikan mas (Cyprinus carpio; Chen et al. 1993). Berdasarkan hasil penelitian sebelumnya bahwa introduksi gen EGFP dengan menggunakan metode elektroporasi pada sperma efektif dalam memproduksi ikan patin siam (Pangasionodon hypophthalmus) transgenik. Gen EGFP terbukti mampu tertransfer dan terekspresi baik pada fase embrio maupun larva ikan patin siam. Pada penelitian ini dilakukan introduksi gen PhGH ikan patin siam (sekuens homolog) yang disambungkan dengan promoter β-aktin ikan mas (sekuens heterolog) pada ikan patin siam. Teknik transfer gen yang digunakan adalah elektroporasi dengan perantaraan sperma. Beberapa konsentrasi DNA plasmid diujikan untuk mengetahui efektivitas transfer gen ke dalam resipien dan ekspresinya pada ikan patin siam. Diharapkan gen PhGH eksogen yang diintroduksi selain mampu tertransfer ke dalam resipien juga dapat diekspresikan sehingga dapat mempercepat pertumbuhan ikan patin siam. BAHAN DAN METODE Penyiapan Sel Gamet Induk jantan dan betina yang digunakan adalah induk ikan patin siam berukuran 2-4 kg yang diperoleh dari Loka Riset Pemuliaan dan Teknologi Budidaya Perikanan Air Tawar Sukamandi. Induk diseleksi berdasarkan tingkat kematangan gonadnya. Induk yang telah mencapai TKG III dipilih untuk dipijahkan. Induk hasil seleksi dari kolam induk dipindahkan ke dalam bak pemijahan.
63 49 Keseragaman kematangan telur dan ovulasi diinduksi melalui penyuntikan hormon. Induk betina diberi suntikan pertama berupa HCG dengan dosis 500 IU/kg bobot. Suntikan kedua diberikan dengan selang waktu 24 jam berupa ovaprim dengan dosis 0,6 ml/kg bobot. Striping untuk mendapatkan sel telur dilakukan 9-12 jam dari penyuntikan kedua. Untuk mendapatkan sperma, induk jantan diinduksi melalui penyuntikan hormon ovaprim dengan dosis 0,2-0,3 ml/kg bobot. Striping untuk mendapatkan sperma dilakukan 9-12 jam setelah penyuntikan. Konstruksi Plasmid Konstruksi gen pccba-phgh dimodifikasi dari konstruksi gen pccba- OgGH yang tersusun atas gen GH ikan gurame (OgGH) dan promoter β-aktin ikan mas (pccba) (Alimuddin, tidak dipublikasi). Fragmen OgGH dibuang dan diganti dengan PhGH setelah pccba-oggh didigesti menggunakan enzim restriksi ApaI dan NotI. Ligasi fragmen PhGH dengan pccba dilakukan menggunakan enzim T4 DNA ligase (TAKARA). Peta konstruksi gen pccba- PhGH ditunjukkan pada Gambar 19. Kpn I Apa I Age I Not I pccba PhGH pccba -PhGH (6,6 kb) Poly A Gambar 19. Peta konstruksi gen pccba-phgh (6,6 kb). pccba= promoter β- aktin ikan mas. PhGH= gen hormon pertumbuhan ikan patin siam. PolyA= poliadenilasi pada vektor pegfp-n1. KpnI, ApaI, AgeI, NotI= enzim restriksi. Pengujian Konsentrasi DNA terhadap Keberhasilan Transfer Gen Pengujian beberapa level konsentrasi pccba-phgh dilakukan untuk mendapatkan konsentrasi terbaik menghasilkan ikan transgenik. Konsentrasi DNA plasmid yang diujikan adalah 10, 50 dan 90 µg/ml. Transfer gen dilakukan dengan
64 50 menggunakan metode elektroporasi dengan perantara sperma. Elektroporasi sperma dilakukan menggunakan mesin Gene Pulser II (Biorad, USA). Elektroporasi dilakukan dengan tipe kejutan square wave dengan panjang kejutan (pulse length) 30 milidetik, interval kejutan (pulse interval) 0,1 detik, kuat medan listrik (electric field strength) 125 V/cm dan jumlah kejutan (pulse number) 3 kali. Efektivitas Transfer Gen PhGH Eksogen Keberhasilan transfer gen PhGH eksogen diidentifikasi pada juvenil ikan patin siam berumur 2 bulan. Ikan sebanyak 14 ekor dari masing-masing perlakuan dipotong sebagian sirip ekornya untuk kemudian dilakukan ekstraksi DNA genom. Selanjutnya dilakukan proses PCR untuk mendeteksi keberadaan gen PhGH eksogen. Primer yang digunakan adalah F3phGH (5 -TCT TTA GTC AAG GCG CGA CAT TCG AGA- 3 ) dan R3phGH (5 - CGA TAA GCA CGC CGA TGC CCA TTT TCA-3 ). Panjang fragmen PhGH eksogen yang diapit oleh kedua primer tersebut adalah 336 bp. PCR dilakukan dengan program: 94 C selama 3 menit; (94 C selama 30 detik; 62 C selama 30 detik; 72 C selama 1 menit) sebanyak 35 siklus; 72 C selama 3 menit; dan 4 C (tak hingga). Pengecekan hasil amplifikasi PCR dilakukan dengan elektroforesis menggunakan gel agarose 1,5%. Ekspresi Gen PhGH Ekspresi gen PhGH eksogen diamati dari lima ekor ikan patin siam yang positif membawa gen PhGH eksogen pada sirip ekornya. Sebagian sirip ekor ikan patin siam yang positif membawa gen PhGH eksogen dipotong untuk selanjutnya dilakukan ekstraksi RNA total. Sintesis cdna dilakukan dengan menggunakan kit Ready-To-Go You-Prime First Strand Beads (GE Healthcare). Ekspresi gen PhGH eksogen dideteksi dengan menggunakan teknik RT-PCR menggunakan primer F3phGH dan R3phGH. Sebagai kontrol internal digunakan gen β-aktin. Deteksi gen β-aktin dilakukan dengan menggunakan metode RT-PCR dengan primer bact-f (5 -TAT GAA GGT TAT GCT CTG CCC-3 ) dan bact-r (5 - CAT ACC CAG GAA AGA TGG CTG-3 ). Panjang fragmen β-aktin ikan patin siam yang diapit oleh kedua primer tersebut sekitar 300 bp. PCR dilakukan dengan
65 51 program: 94 C selama 3 menit; (94 C selama 30 detik; 58 C selama 30 detik; 72 C selama 30 detik) sebanyak 30 siklus; 72 C selama 3 menit; dan 4 C (tak hingga). Pengecekan hasil amplifikasi PCR dilakukan dengan elektroforesis menggunakan gel agarose 1%. Selain dengan metode RT-PCR, ekspresi gen PhGH eksogen juga dilakukan dengan mengukur bobot ikan patin siam berumur 2 dan 4 bulan. Embrio ikan patin siam yang berasal dari telur yang dibuahi sperma yang dielektroporasi diinkubasi pada suhu 29 C. Telur yang menetas dipelihara selama satu bulan dalam akuarium berukuran 60 x 40 x 40 cm 3 dengan kepadatan 20 ekor per liter. Juvenil ikan patin siam umur 1 bulan dipindahkan ke kolam tanah berukuran 25 m 2 dengan kepadatan 50 ekor/m 2 dan dipelihara selama satu bulan. Juvenil umur 2 bulan selanjutnya dipindahkan ke dalam jaring berukuran 3 x 3 x 1,5 m 3 dengan kepadatan 40 ekor/m 2. Selama pemeliharaan ikan diberi pakan secara ad libitum dan pada wadah pemeliharaan diberi aerasi. Pengukuran bobot juvenil umur 2 bulan dilakukan pada 14 individu dari masing-masing perlakuan. Selanjutnya dibuat grafik distribusi bobot ikan patin siam yang positif membawa gen PhGH eksogen (transgenik) dan tidak membawa gen PhGH eksogen (non- transgenik) dari masing-masing perlakuan. Pengukuran bobot ikan patin siam dari masingmasing perlakuan diukur kembali pada juvenil berumur 4 bulan untuk melihat adanya pergeseran bobot ikan patin siam. Pengukuran dilakukan pada 200 ekor juvenil ikan patin siam dari masing-masing perlakuan. HASIL DAN PEMBAHASAN Efektivitas Transfer Gen PhGH Ikan Patin Siam Fragmen gen PhGH eksogen produk PCR dengan ukuran 336 bp terdeteksi pada ikan hasil elektroporasi, sedangkan pada ikan kontrol tidak ada (Gambar 20). Hasil analisis DNA menunjukkan bahwa semakin tinggi konsentrasi DNA plasmid yang digunakan dalam elektroporasi sperma, maka semakin banyak individu transgenik yang diperoleh (Tabel 4). Keberhasilan transfer gen PhGH
66 52 eksogen pada ikan patin siam yang diintroduksi dengan konsentrasi DNA plasmid 10 µg/ml, 50 µg/ml dan 90 µg/ml, secara berturut-turut adalah 28,57%, 78,57% dan 85,71%. Persentase keberhasilan elektroporasi relatif sama dengan penelitian ini telah dilaporan pada ikan salmon, 90% embrio membawa transgen (Walker et al. (1995). kb 3,0 - M NT T (+) 1,0-0,5-336 bp Gambar 20. Deteksi gen PhGH eksogen pada ikan patin siam. Panjang fragmen gen PhGH eksogen 336 bp. M adalah marker DNA 0,1-10,0 kb (BioLabs Inc., New England). NT = non-transgenik. T= transgenik. Tanda (+) adalah kontrol positif (plasmid). Tabel 4. Keberhasilan transfer gen PhGH eksogen pada juvenil ikan patin siam pada beberapa tingkat konsentrasi DNA plasmid. Konsentrasi DNA Plasmid (µg/ml) Jumlah Individu yang diperiksa (ekor) Jumlah Individu Membawa Transgen di Sirip (%) , , ,71 Efisiensi pengikatan DNA eksogen dengan menggunakan elektroporasi pada sperma ikan chinook salmon ditentukan oleh kekuatan medan listrik, jumlah kejutan listrik dan konsentrasi DNA (Symonds et al. 1994). Penelitian pada chinook salmon menunjukkan bahwa sperma yang dikejutkan 1 kali dengan konsentrasi DNA 200 μg/ml mampu meningkatkan DNA eksogen yang ditransfer (20,8±12,8), adapun bila dikejutkan 2 kali dengan konsentrasi DNA μg/ml tidak mempengaruhi efisiensi transfer gen (Sin et al. 2000).
67 53 Pada penelitian ini, transfer gen pccba-phgh dilakukan dengan menggunakan metode elektroporasi pada sperma yang berperan sebagai perantara. Menurut Spadafora (1998), pada proses transfer gen dengan perantara sperma, DNA eksogen terinternalisasi ke dalam nukleus sperma dan selanjutnya terintegrasi ke dalam genom sperma. Gen asing yang terintegrasi akan stabil di sel resipien, sementara dalam bentuk ekstrakromosomal akan terdegradasi oleh endogenous nuclease. Menurut Palmiter & Brinster 1986, setelah DNA eksogen mengalami proses degradasi, seringkali DNA eksogen ditemukan dalam kondisi terintegrasi pada kromosom DNA inang. Mekanisme integrasi diduga melibatkan proses penggabungan dan rekombinasi bergantung pada pemotongan kromosom yang bersifat acak. Ekspresi Gen pccba-phgh pada Juvenil Ikan Patin Siam Analisis ekspresi gen PhGH eksogen pada ikan patin dilakukan pada individu yang positif membawa gen PhGH eksogen pada sirip ekornya. Dari lima ekor ikan yang diamati, semuanya menunjukkan bahwa gen PhGH terekspresi pada ikan patin siam (Gambar 21). Hal ini menunjukkan bahwa promoter β-aktin ikan mas mampu mengendalikan ekspresi gen PhGH pada ikan patin siam dan telah terjadi over-ekspresi gen PhGH pada sirip ikan patin siam. Gen PhGH yang ditransfer selain mampu terinsersi di dalam tubuh ikan patin siam juga terekspresi dengan baik, hal ini membuka peluang ditemukannya ikan patin siam transgenik founder. Menurut Sarmasik (2003), jika konstruksi transgen membawa promoter fungsional, sejumlah individu transgenik dapat diharapkan untuk mengekspresikan aktivitas transgen. Introduksi gen pengkode karakter yang diharapkan ke ikan harus bisa diekspresikan secara akurat dalam ikan resipien. Ekspresi mrna PhGH pada individu transgenik (Gambar 21) menunjukkan bahwa promoter β-aktin ikan mas mampu mengendalikan transkripsi gen PhGH. Ekspresi transgen yang digabungkan dengan promoter β-aktin pada berbagai jaringan juga ditemukan pada individu transgenik lainnya seperti mud loach (Nam et al. 2001) dan nila (Kobayashi et al. 2007).
68 54 3,0-1,0-0,5 - M P NT M NT (-) 3,0-1,0-0,5 - (A) (B) Gambar 21. Ekspresi mrna PhGH eksogen pada sirip individu ikan patin siam transgenik (A) dan mrna β-aktin ikan patin siam (B) sebagai kontrol internal. M adalah marker DNA 0,1-10,0 kbp (BioLabs Inc., New England). Angka 1-5 adalah individu transgenik. P adalah plasmid yang membawa konstruksi gen pccba-phgh. NT adalah individu non transgenik. (-) adalah kontrol negatif. Tanda kepala panah menunjukkan keberadaan DNA target. Transfer gen pccba-phgh pada ikan patin siam mampu meningkatkan pertumbuhannya. Pada konsentrasi DNA plasmid 50 µg/ml dan 90 µg/ml, individu-individu transgenik cenderung memiliki bobot lebih besar dibandingkan yang non-transgenik. Adapun pada konsentrasi 10 µg/ml, bobot individu transgenik cenderung tidak berbeda dengan yang non-transgenik (Gambar 22). Transkripsi gen asing dapat mulai diamati pada stadia akhir gastrula dan berdasarkan pada analisa radioimmunoassay menunjukkan bahwa individu yang berbeda memiliki level ekspresi yang berbeda (Wu et al. 2003). Menurut Inoue et al. (1990), level ekspresi transgen bervariasi di antara individu transgenik. Hal ini dikarenakan antara lain karena bervariasinya jumlah transgen yang terintegrasi dan situs integrasi pada individu yang berbeda. Pada penelitian ini, bobot rata-rata juvenil ikan patin siam non-transgenik umur 2 bulan adalah 13,05±0,72 g, sedangkan bobot rataan juvenil ikan patin siam transgenik yang diintroduksi gen pccba-phgh dengan konsentrasi 10, 50 dan 90 µg/ml secara berturut-turut adalah 11,95±0,81 g; 16,00±0,97 g; dan 15,53±0,74 g. Bobot rata-rata ikan patin siam yang diintroduksi gen pccba-phgh dengan konsentrasi 50 μg/ml dan 90 μg/ml adalah 22,6% dan 19% lebih berat dibandingkan non-transgenik, tetapi pada dosis 10 μg/ml lebih rendah (-8,45%). Pada juvenil ikan patin siam umur 4
1. PENDAHULUAN LATAR BELAKANG
 1 1. PENDAHULUAN LATAR BELAKANG Ikan patin siam (Pangasionodon hypophthalmus) merupakan salah satu spesies ikan air tawar yang memiliki nilai ekonomis tinggi di Indonesia. Dalam program peningkatan produksi
1 1. PENDAHULUAN LATAR BELAKANG Ikan patin siam (Pangasionodon hypophthalmus) merupakan salah satu spesies ikan air tawar yang memiliki nilai ekonomis tinggi di Indonesia. Dalam program peningkatan produksi
5. PEMBAHASAN UMUM. Tabel 5. Beberapa konstruksi gen all fish dalam pembuatan ikan transgenik GH.
 58 5. PEMBAHASAN UMUM Tujuan umum introduksi gen asing ke dalam genom ikan adalah membuat ikan dengan karakteristik komersial yang lebih baik untuk meningkatkan produksi akuakultur. Sejak pertengahan tahun
58 5. PEMBAHASAN UMUM Tujuan umum introduksi gen asing ke dalam genom ikan adalah membuat ikan dengan karakteristik komersial yang lebih baik untuk meningkatkan produksi akuakultur. Sejak pertengahan tahun
III. METODE PENELITIAN
 III. METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian Penelitian ini dilaksanakan mulai bulan November 2007 hingga Juli 2009, bertempat di Laboratorium Reproduksi dan Genetika Organisme Akuatik Departemen
III. METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian Penelitian ini dilaksanakan mulai bulan November 2007 hingga Juli 2009, bertempat di Laboratorium Reproduksi dan Genetika Organisme Akuatik Departemen
BAHAN DAN METODE. Produksi Protein Rekombinan Hormon Pertumbuhan (rgh)
 11 BAHAN DAN METODE Penelitian ini terdiri atas 2 tahapan utama, yaitu produksi protein rekombinan hormon pertumbuhan (rgh) dari ikan kerapu kertang, ikan gurame, dan ikan mas, dan uji bioaktivitas protein
11 BAHAN DAN METODE Penelitian ini terdiri atas 2 tahapan utama, yaitu produksi protein rekombinan hormon pertumbuhan (rgh) dari ikan kerapu kertang, ikan gurame, dan ikan mas, dan uji bioaktivitas protein
4. EFEKTIVITAS TRANSFER DAN EKSPRESI GEN PhGH PADA IKAN PATIN SIAM (Pangasionodon hypophthalmus)
 45 4. EFEKTIVITAS TRANSFER DAN EKSPRESI GEN PhGH PADA IKAN PATIN SIAM (Pangasionodon hypophthalmus) ABSTRAK Penggunaan konsentrasi DNA yang tinggi dalam elektroporasi sperma meningkatkan pengikatan DNA
45 4. EFEKTIVITAS TRANSFER DAN EKSPRESI GEN PhGH PADA IKAN PATIN SIAM (Pangasionodon hypophthalmus) ABSTRAK Penggunaan konsentrasi DNA yang tinggi dalam elektroporasi sperma meningkatkan pengikatan DNA
adalah bagian dari DNA dimana RNA polymerase menempel. Fungsi dari promoter ini adalah untuk mengarahkan RNA polymerase sehingga transkripsi terjadi.
 66 VI. PEMBAHASAN UMUM Teknik rekayasa genetika merupakan salah satu alternatif yang menjanjikan dalam mengatasi masalah rendahnya produksi, karena dengan teknik ini kita dapat mengintroduksi gen unggul
66 VI. PEMBAHASAN UMUM Teknik rekayasa genetika merupakan salah satu alternatif yang menjanjikan dalam mengatasi masalah rendahnya produksi, karena dengan teknik ini kita dapat mengintroduksi gen unggul
IV. HASIL DAN PEMBAHASAN
 IV. HASIL DAN PEMBAHASAN 4.1. Isolasi Promoter -Aktin Ikan Mas Promoter -Aktin dari ikan mas diisolasi dengan menggunakan metode PCR dengan primer yang dibuat berdasarkan data yang ada di Bank Gen. Panjang
IV. HASIL DAN PEMBAHASAN 4.1. Isolasi Promoter -Aktin Ikan Mas Promoter -Aktin dari ikan mas diisolasi dengan menggunakan metode PCR dengan primer yang dibuat berdasarkan data yang ada di Bank Gen. Panjang
IV. HASIL DAN PEMBAHASAN
 IV. HASIL DAN PEMBAHASAN 4.1 Isolasi Fragmen DNA Penyandi CcGH Mature Plasmid pgem-t Easy yang mengandung cdna GH ikan mas telah berhasil diisolasi. Hal ini ditunjukkan dengan adanya pita DNA pada ukuran
IV. HASIL DAN PEMBAHASAN 4.1 Isolasi Fragmen DNA Penyandi CcGH Mature Plasmid pgem-t Easy yang mengandung cdna GH ikan mas telah berhasil diisolasi. Hal ini ditunjukkan dengan adanya pita DNA pada ukuran
Pembuatan Media Kultur Bakteri Pemanenan sel bakteri. Isolasi DNA kromosom bakteri. Kloning DNA
 LAMPIRAN 15 15 Lampiran 1 Tahapan penelitian Pembuatan Media Kultur Bakteri Pemanenan sel bakteri Isolasi DNA kromosom bakteri Pemotongan DNA dengan enzim restriksi Kloning DNA Isolasi DNA plasmid hasil
LAMPIRAN 15 15 Lampiran 1 Tahapan penelitian Pembuatan Media Kultur Bakteri Pemanenan sel bakteri Isolasi DNA kromosom bakteri Pemotongan DNA dengan enzim restriksi Kloning DNA Isolasi DNA plasmid hasil
III. BAHAN DAN METODE
 11 III. BAHAN DAN METODE 3.1 Ikan Uji Larva ikan gurame diperoleh dari pembenihan di Desa Ciherang Kec. Darmaga, Kab. Bogor. Larva dipelihara dalam akuarium berukuran 1,0x0,5x0,5 m 3 dengan kepadatan sekitar
11 III. BAHAN DAN METODE 3.1 Ikan Uji Larva ikan gurame diperoleh dari pembenihan di Desa Ciherang Kec. Darmaga, Kab. Bogor. Larva dipelihara dalam akuarium berukuran 1,0x0,5x0,5 m 3 dengan kepadatan sekitar
HASIL DAN PEMBAHASAN
 19 HASIL DAN PEMBAHASAN Vektor Kloning Protein rgh Isolasi Plasmid cdna GH. Plasmid pgem-t Easy yang mengandung cdna; El-mGH, Og-mGH dan Cc-mGH berhasil diisolasi dari bakteri konstruksi E. coli DH5α dengan
19 HASIL DAN PEMBAHASAN Vektor Kloning Protein rgh Isolasi Plasmid cdna GH. Plasmid pgem-t Easy yang mengandung cdna; El-mGH, Og-mGH dan Cc-mGH berhasil diisolasi dari bakteri konstruksi E. coli DH5α dengan
INTRODUKSI DAN PERSENTASE IKAN YANG MEMBAWA GEN GH Growth Hormone IKAN NILA Oreochromis niloticus PADA IKAN LELE DUMBO Clarias sp.
 INTRODUKSI DAN PERSENTASE IKAN YANG MEMBAWA GEN GH Growth Hormone IKAN NILA Oreochromis niloticus PADA IKAN LELE DUMBO Clarias sp. GENERASI F0 BAMBANG KUSMAYADI GUNAWAN SKRIPSI PROGRAM STUDI TEKNOLOGI
INTRODUKSI DAN PERSENTASE IKAN YANG MEMBAWA GEN GH Growth Hormone IKAN NILA Oreochromis niloticus PADA IKAN LELE DUMBO Clarias sp. GENERASI F0 BAMBANG KUSMAYADI GUNAWAN SKRIPSI PROGRAM STUDI TEKNOLOGI
3. PENGEMBANGAN METODE ELEKTROPORASI PADA SPERMA SEBAGAI PERANTARA TRANSFER GEN PADA IKAN PATIN SIAM (Pangasionodon hypophthalmus)
 25 3. PENGEMBANGAN METODE ELEKTROPORASI PADA SPERMA SEBAGAI PERANTARA TRANSFER GEN PADA IKAN PATIN SIAM (Pangasionodon hypophthalmus) ABSTRAK Penggunaan metode elektroporasi dengan menggunakan sperma sebagai
25 3. PENGEMBANGAN METODE ELEKTROPORASI PADA SPERMA SEBAGAI PERANTARA TRANSFER GEN PADA IKAN PATIN SIAM (Pangasionodon hypophthalmus) ABSTRAK Penggunaan metode elektroporasi dengan menggunakan sperma sebagai
PENDAHULUAN. sangat pokok dalam menunjang keberlanjutan kegiatan budidaya dan hasil
 1 PENDAHULUAN Latar Belakang Ketersediaan induk unggul dalam bidang akuakultur merupakan hal yang sangat pokok dalam menunjang keberlanjutan kegiatan budidaya dan hasil produksi untuk dapat memenuhi kebutuhan
1 PENDAHULUAN Latar Belakang Ketersediaan induk unggul dalam bidang akuakultur merupakan hal yang sangat pokok dalam menunjang keberlanjutan kegiatan budidaya dan hasil produksi untuk dapat memenuhi kebutuhan
DETEKSI DAN ANALISIS EKSPRESI TRANSGEN (PhGH) PADA IKAN LELE DUMBO (Clarias gariepinus) TRANSGENIK F3 FERY JAKSEN SIHOTANG
 DETEKSI DAN ANALISIS EKSPRESI TRANSGEN (PhGH) PADA IKAN LELE DUMBO (Clarias gariepinus) TRANSGENIK F3 FERY JAKSEN SIHOTANG 110302045 PROGRAM STUDI MANAJEMEN SUMBERDAYA PERAIRAN FAKULTAS PERTANIAN UNIVERSITAS
DETEKSI DAN ANALISIS EKSPRESI TRANSGEN (PhGH) PADA IKAN LELE DUMBO (Clarias gariepinus) TRANSGENIK F3 FERY JAKSEN SIHOTANG 110302045 PROGRAM STUDI MANAJEMEN SUMBERDAYA PERAIRAN FAKULTAS PERTANIAN UNIVERSITAS
VI. TRANSFER GEN PENYANDI HORMON PERTUMBUHAN IKAN NILA (tigh) PADA IKAN LELE (Clarias sp) DENGAN METODE ELEKTROPORASI ABSTRAK
 50 VI. TRANSFER GEN PENYANDI HORMON PERTUMBUHAN IKAN NILA (tigh) PADA IKAN LELE (Clarias sp) DENGAN METODE ELEKTROPORASI ABSTRAK Penelitian ini dilakukan untuk mengetahui keberhasilan introduksi gen penyandi
50 VI. TRANSFER GEN PENYANDI HORMON PERTUMBUHAN IKAN NILA (tigh) PADA IKAN LELE (Clarias sp) DENGAN METODE ELEKTROPORASI ABSTRAK Penelitian ini dilakukan untuk mengetahui keberhasilan introduksi gen penyandi
I. PENDAHULUAN UMUM Latar belakang
 1 I. PENDAHULUAN UMUM Latar belakang Produksi akuakultur setiap tahun meningkat seiring dengan meningkatnya pertambahan penduduk di Indonesia. Pada tahun 2005 jumlah penduduk Indonesia sebanyak 220 juta
1 I. PENDAHULUAN UMUM Latar belakang Produksi akuakultur setiap tahun meningkat seiring dengan meningkatnya pertambahan penduduk di Indonesia. Pada tahun 2005 jumlah penduduk Indonesia sebanyak 220 juta
PENGEMBANGAN MARKA MOLEKULER DNA DALAM IDENTIFIKASI SEL GONAD IKAN GURAME (Osphronemus gouramy) DAN IKAN NILA (Oreochromis niloticus) MENGGUNAKAN PCR
 PENGEMBANGAN MARKA MOLEKULER DNA DALAM IDENTIFIKASI SEL GONAD IKAN GURAME (Osphronemus gouramy) DAN IKAN NILA (Oreochromis niloticus) MENGGUNAKAN PCR MARLINA ACHMAD SEKOLAH PASCASARJANA INSTITUT PERTANIAN
PENGEMBANGAN MARKA MOLEKULER DNA DALAM IDENTIFIKASI SEL GONAD IKAN GURAME (Osphronemus gouramy) DAN IKAN NILA (Oreochromis niloticus) MENGGUNAKAN PCR MARLINA ACHMAD SEKOLAH PASCASARJANA INSTITUT PERTANIAN
BAB III METODE PENELITIAN. Jenis penelitian yang dilakukan termasuk dalam penelitian dasar yang. dilakukan dengan metode deskriptif (Nazir, 1998).
 BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian yang dilakukan termasuk dalam penelitian dasar yang dilakukan dengan metode deskriptif (Nazir, 1998). B. Populasi dan Sampel 1. Populasi yang
BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian yang dilakukan termasuk dalam penelitian dasar yang dilakukan dengan metode deskriptif (Nazir, 1998). B. Populasi dan Sampel 1. Populasi yang
BAB 4 HASIL PERCOBAAN DAN BAHASAN. Oligonukleotida sintetis daerah pengkode IFNα2b sintetis dirancang menggunakan
 BAB 4 HASIL PERCOBAAN DAN BAHASAN Oligonukleotida sintetis daerah pengkode IFNα2b sintetis dirancang menggunakan program komputer berdasarkan metode sintesis dua arah TBIO, dimana proses sintesis daerah
BAB 4 HASIL PERCOBAAN DAN BAHASAN Oligonukleotida sintetis daerah pengkode IFNα2b sintetis dirancang menggunakan program komputer berdasarkan metode sintesis dua arah TBIO, dimana proses sintesis daerah
Pengertian TEKNOLOGI DNA REKOMBINAN. Cloning DNA. Proses rekayasa genetik pada prokariot. Pemuliaan tanaman konvensional: TeknologiDNA rekombinan:
 Materi Kuliah Bioteknologi Pertanian Prodi Agroteknologi Pertemuan Ke 9-10 TEKNOLOGI DNA REKOMBINAN Ir. Sri Sumarsih, MP. Email: Sumarsih_03@yahoo.com Weblog: Sumarsih07.wordpress.com Website: agriculture.upnyk.ac.id
Materi Kuliah Bioteknologi Pertanian Prodi Agroteknologi Pertemuan Ke 9-10 TEKNOLOGI DNA REKOMBINAN Ir. Sri Sumarsih, MP. Email: Sumarsih_03@yahoo.com Weblog: Sumarsih07.wordpress.com Website: agriculture.upnyk.ac.id
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian yang digunakan adalah penelitian dasar dengan metode deskriptif (Nazir, 1983). B. Populasi dan Sampel Populasi dalam penelitian ini adalah
BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian yang digunakan adalah penelitian dasar dengan metode deskriptif (Nazir, 1983). B. Populasi dan Sampel Populasi dalam penelitian ini adalah
POLA EKSPRESI GEN ENHANCED GREEN FLUORESCENT PROTEIN PADA EMBRIO DAN LARVA IKAN PATIN SIAM (Pangasianodon hypophthalmus)
 Pola ekspresi gen enhanced green fluorescent... (Raden Roro Sri Pudji Sinarni Dewi) POLA EKSPRESI GEN ENHANCED GREEN FLUORESCENT PROTEIN PADA EMBRIO DAN LARVA IKAN PATIN SIAM (Pangasianodon hypophthalmus)
Pola ekspresi gen enhanced green fluorescent... (Raden Roro Sri Pudji Sinarni Dewi) POLA EKSPRESI GEN ENHANCED GREEN FLUORESCENT PROTEIN PADA EMBRIO DAN LARVA IKAN PATIN SIAM (Pangasianodon hypophthalmus)
HASIL DAN PEMBAHASAN. Derajat Kelangsungan Hidup Embrio dan Derajat Penetasan Berdasarkan hasil pengamatan terhadap derajat kelangsungan hidup
 HASIL DAN PEMBAHASAN Derajat Kelangsungan Hidup Embrio dan Derajat Penetasan Berdasarkan hasil pengamatan terhadap derajat kelangsungan hidup (DKH-e) dan derajat penetasan (DP) tiap promoter (perlakuan)
HASIL DAN PEMBAHASAN Derajat Kelangsungan Hidup Embrio dan Derajat Penetasan Berdasarkan hasil pengamatan terhadap derajat kelangsungan hidup (DKH-e) dan derajat penetasan (DP) tiap promoter (perlakuan)
METODE PENELITIAN Waktu dan Tempat Penelitian Bahan Metode penelitian Isolasi RNA total
 METODE PENELITIAN Waktu dan Tempat Penelitian Penelitian ini dilakukan mulai bulan Februari 2005 hingga bulan Maret 2008 di Laboratorium Biologi Molekuler dan Seluler Tanaman dan Laboratorium BIORIN (Biotechnology
METODE PENELITIAN Waktu dan Tempat Penelitian Penelitian ini dilakukan mulai bulan Februari 2005 hingga bulan Maret 2008 di Laboratorium Biologi Molekuler dan Seluler Tanaman dan Laboratorium BIORIN (Biotechnology
LAPORAN PRAKTIKUM REKAYASA GENETIKA
 LAPORAN PRAKTIKUM REKAYASA GENETIKA LAPORAN IV (ISOLASI RNA DARI TANAMAN) KHAIRUL ANAM P051090031/BTK BIOTEKNOLOGI SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2010 0 ISOLASI RNA DARI TANAMAN TUJUAN Tujuan
LAPORAN PRAKTIKUM REKAYASA GENETIKA LAPORAN IV (ISOLASI RNA DARI TANAMAN) KHAIRUL ANAM P051090031/BTK BIOTEKNOLOGI SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2010 0 ISOLASI RNA DARI TANAMAN TUJUAN Tujuan
EFEKTIVITAS PROMOTER KERATIN IKAN FLOUNDER JEPANG
 EFEKTIVITAS PROMOTER KERATIN IKAN FLOUNDER JEPANG Paralichthys olivaceus DAN PROMOTER HEATSHOCK IKAN RAINBOW TROUT Oncorhynchus mykiss PADA IKAN NILA Oreochromis niloticus ARIEF EKO PRASETIYO SKRIPSI PROGRAM
EFEKTIVITAS PROMOTER KERATIN IKAN FLOUNDER JEPANG Paralichthys olivaceus DAN PROMOTER HEATSHOCK IKAN RAINBOW TROUT Oncorhynchus mykiss PADA IKAN NILA Oreochromis niloticus ARIEF EKO PRASETIYO SKRIPSI PROGRAM
BAB 3 PERCOBAAN. Alat elektroforesis agarosa (Biorad), autoklaf, cawan Petri, GeneAid High Speed Plasmid
 BAB 3 PERCOBAAN 3.1 Alat Alat elektroforesis agarosa (Biorad), autoklaf, cawan Petri, GeneAid High Speed Plasmid Mini kit, inkubator goyang (GSL), jarum Ose bundar, kit GFX (GE Healthcare), kompor listrik
BAB 3 PERCOBAAN 3.1 Alat Alat elektroforesis agarosa (Biorad), autoklaf, cawan Petri, GeneAid High Speed Plasmid Mini kit, inkubator goyang (GSL), jarum Ose bundar, kit GFX (GE Healthcare), kompor listrik
BAB 4 HASIL PERCOBAAN DAN PEMBAHASAN
 BAB 4 HASIL PERCOBAAN DAN PEMBAHASAN Sebelum melakukan PCR, terlebih dahulu dilakukan perancangan primer menggunakan program DNA Star. Pemilihan primer dilakukan dengan mempertimbangkan parameter spesifisitas,
BAB 4 HASIL PERCOBAAN DAN PEMBAHASAN Sebelum melakukan PCR, terlebih dahulu dilakukan perancangan primer menggunakan program DNA Star. Pemilihan primer dilakukan dengan mempertimbangkan parameter spesifisitas,
FAKULTAS BIOLOGI LABORATORIUM GENETIKA & PEMULIAAN INSTRUKSI KERJA UJI
 ISOLASI TOTAL DNA TUMBUHAN DENGAN KIT EKSTRAKSI DNA PHYTOPURE Halaman : 1 dari 5 1. RUANG LINGKUP Metode ini digunakan untuk mengisolasi DNA dari sampel jaringan tumbuhan, dapat dari daun, akar, batang,
ISOLASI TOTAL DNA TUMBUHAN DENGAN KIT EKSTRAKSI DNA PHYTOPURE Halaman : 1 dari 5 1. RUANG LINGKUP Metode ini digunakan untuk mengisolasi DNA dari sampel jaringan tumbuhan, dapat dari daun, akar, batang,
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Jenis Penelitian deskriptif. Jenis penelitian yang digunakan adalah penelitian dasar dengan metode B. Objek Penelitian Objek penelitian ini adalah sampel DNA koleksi hasil
BAB III METODE PENELITIAN A. Jenis Penelitian deskriptif. Jenis penelitian yang digunakan adalah penelitian dasar dengan metode B. Objek Penelitian Objek penelitian ini adalah sampel DNA koleksi hasil
FAKULTAS BIOLOGI LABORATORIUM GENETIKA & PEMULIAAN INSTRUKSI KERJA UJI
 Halaman : 1 dari 5 ISOLASI TOTAL DNA HEWAN DENGAN KIT EKSTRAKSI DNA 1. RUANG LINGKUP Metode ini digunakan untuk mengisolasi DNA dari sampel jaringan hewan, dapat dari insang, otot, darah atau jaringan
Halaman : 1 dari 5 ISOLASI TOTAL DNA HEWAN DENGAN KIT EKSTRAKSI DNA 1. RUANG LINGKUP Metode ini digunakan untuk mengisolasi DNA dari sampel jaringan hewan, dapat dari insang, otot, darah atau jaringan
VISUALISASI HASIL PCR DENGAN METODE PCR LANGSUNG DAN TIDAK LANGSUNG PADA SAMPEL BAKTERI Pseudomonas fluorescens dan Ralstonia solanacearum
 VISUALISASI HASIL PCR DENGAN METODE PCR LANGSUNG DAN TIDAK LANGSUNG PADA SAMPEL BAKTERI Pseudomonas fluorescens dan Ralstonia solanacearum Pendahuluan Polymerase Chain Reaction (PCR) adalah suatu teknik
VISUALISASI HASIL PCR DENGAN METODE PCR LANGSUNG DAN TIDAK LANGSUNG PADA SAMPEL BAKTERI Pseudomonas fluorescens dan Ralstonia solanacearum Pendahuluan Polymerase Chain Reaction (PCR) adalah suatu teknik
ISOLASI DAN KARAKTERISASI cdna HORMON PERTUMBUHAN IKAN KERAPU BEBEK (Cromileptes altivelis) MOCHAMAD SYAlFUDlN
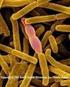 ISOLASI DAN KARAKTERISASI cdna HORMON PERTUMBUHAN IKAN KERAPU BEBEK (Cromileptes altivelis) MOCHAMAD SYAlFUDlN SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR BOGOR 2006 ABSTRAK MOCHAMAD SYAIFUDIN. Isolasi-
ISOLASI DAN KARAKTERISASI cdna HORMON PERTUMBUHAN IKAN KERAPU BEBEK (Cromileptes altivelis) MOCHAMAD SYAlFUDlN SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR BOGOR 2006 ABSTRAK MOCHAMAD SYAIFUDIN. Isolasi-
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian ini dilaksanakan pada bulan Januari 2012 sampai bulan Juli 2012, yang bertempat di Laboratorium Genetika dan Biologi Molekuler Jurusan Biologi
BAB III METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian ini dilaksanakan pada bulan Januari 2012 sampai bulan Juli 2012, yang bertempat di Laboratorium Genetika dan Biologi Molekuler Jurusan Biologi
BAB III METODE PENELITIAN
 39 BAB III METODE PENELITIAN A. Desain Penelitian Penelitian yang dilakukan merupakan penelitian deskriptif. Penelitian membuat deskripsi secara sistematis, faktual dan akurat mengenai fakta-fakta dan
39 BAB III METODE PENELITIAN A. Desain Penelitian Penelitian yang dilakukan merupakan penelitian deskriptif. Penelitian membuat deskripsi secara sistematis, faktual dan akurat mengenai fakta-fakta dan
III. BAHAN DAN METODE
 15 III. BAHAN DAN METODE 3.1 Waktu dan Tempat Penelitian Penelitian ini dilaksanakan pada bulan November 2009 hingga Februari 2010. Tempat penelitian adalah di Laboratorium Reproduksi dan Genetika Organisme
15 III. BAHAN DAN METODE 3.1 Waktu dan Tempat Penelitian Penelitian ini dilaksanakan pada bulan November 2009 hingga Februari 2010. Tempat penelitian adalah di Laboratorium Reproduksi dan Genetika Organisme
ANALISA HASIL TRANSFORMASI DENGAN MENGGUNAKAN PCR KOLONI DAN RESTRIKSI
 1 ANALISA HASIL TRANSFORMASI DENGAN MENGGUNAKAN PCR KOLONI DAN RESTRIKSI PENDAHULUAN Polimerase Chain Reaction (PCR) PCR adalah suatu reaksi invitro untuk menggandakan jumlah molekul DNA pada target tertentu
1 ANALISA HASIL TRANSFORMASI DENGAN MENGGUNAKAN PCR KOLONI DAN RESTRIKSI PENDAHULUAN Polimerase Chain Reaction (PCR) PCR adalah suatu reaksi invitro untuk menggandakan jumlah molekul DNA pada target tertentu
KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN DIREKTORAT JENDERAL PENDIDIKAN MENENGAH DIREKTORAT PEMBINAAN SEKOLAH MENENGAH ATAS
 KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN DIREKTORAT JENDERAL PENDIDIKAN MENENGAH DIREKTORAT PEMBINAAN SEKOLAH MENENGAH ATAS Test Seleksi Calon Peserta International Biology Olympiad (IBO) 2014 2 8 September
KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN DIREKTORAT JENDERAL PENDIDIKAN MENENGAH DIREKTORAT PEMBINAAN SEKOLAH MENENGAH ATAS Test Seleksi Calon Peserta International Biology Olympiad (IBO) 2014 2 8 September
TRANSMISI DAN EKSPRESI FENOTIPE GEN PENYANDI HORMON PERTUMBUHAN PADA IKAN PATIN SIAM
 TRANSMISI DAN EKSPRESI FENOTIPE GEN PENYANDI HORMON PERTUMBUHAN PADA IKAN PATIN SIAM Raden Roro Sri Pudji Sinarni Dewi, Jadmiko Darmawan, dan Ika Nurlaela Balai Penelitian Pemuliaan Ikan Jl. Raya 2 Sukamandi,
TRANSMISI DAN EKSPRESI FENOTIPE GEN PENYANDI HORMON PERTUMBUHAN PADA IKAN PATIN SIAM Raden Roro Sri Pudji Sinarni Dewi, Jadmiko Darmawan, dan Ika Nurlaela Balai Penelitian Pemuliaan Ikan Jl. Raya 2 Sukamandi,
BAB 4 HASIL PERCOBAAN DAN BAHASAN
 14 BAB 4 HASIL PERCOBAAN DAN BAHASAN Konfirmasi bakteri C. violaceum dan B. cereus dilakukan dengan pewarnaan Gram, identifikasi morfologi sel bakteri, sekuensing PCR 16s rdna dan uji kualitatif aktivitas
14 BAB 4 HASIL PERCOBAAN DAN BAHASAN Konfirmasi bakteri C. violaceum dan B. cereus dilakukan dengan pewarnaan Gram, identifikasi morfologi sel bakteri, sekuensing PCR 16s rdna dan uji kualitatif aktivitas
ABSTRAK. ISOLASI, OPTIMASI AMPLIFIKASI DAN KLONING GEN phoq PADA Salmonella typhi
 ABSTRAK ISOLASI, OPTIMASI AMPLIFIKASI DAN KLONING GEN phoq PADA Salmonella typhi Patrisia Puspapriyanti, 2008. Pembimbing I : Ernawati A.Girirachman, Ph.D. Pembimbing II : Johan Lucianus, dr., M.Si. Salmonella
ABSTRAK ISOLASI, OPTIMASI AMPLIFIKASI DAN KLONING GEN phoq PADA Salmonella typhi Patrisia Puspapriyanti, 2008. Pembimbing I : Ernawati A.Girirachman, Ph.D. Pembimbing II : Johan Lucianus, dr., M.Si. Salmonella
KLONING DAN OVEREKSPRESI GEN celd DARI Clostridium thermocellum ATCC DALAM pet-blue VECTOR 1
 PROPOSAL METODOLOGI PENELITIAN (BM-3001) KLONING DAN OVEREKSPRESI GEN celd DARI Clostridium thermocellum ATCC 27405 DALAM pet-blue VECTOR 1 Penyusun: Chandra 10406014 Dosen Narasumber: Dra. Maelita Ramdani
PROPOSAL METODOLOGI PENELITIAN (BM-3001) KLONING DAN OVEREKSPRESI GEN celd DARI Clostridium thermocellum ATCC 27405 DALAM pet-blue VECTOR 1 Penyusun: Chandra 10406014 Dosen Narasumber: Dra. Maelita Ramdani
EFEKTIVITAS TRANSFER DAN EKSPRESI GEN PhGH PADA IKAN PATIN SIAM (Pangasianodon hypophthalmus)
 Efektivitas transfer dan ekspresi gen PhGH pada... (Raden Roro Sri Pudji Sinarni Dewi) EFEKTIVITAS TRANSFER DAN EKSPRESI GEN PhGH PADA IKAN PATIN SIAM (Pangasianodon hypophthalmus) Raden Roro Sri Pudji
Efektivitas transfer dan ekspresi gen PhGH pada... (Raden Roro Sri Pudji Sinarni Dewi) EFEKTIVITAS TRANSFER DAN EKSPRESI GEN PhGH PADA IKAN PATIN SIAM (Pangasianodon hypophthalmus) Raden Roro Sri Pudji
MATERI DAN METODE. Kota Padang Sumatera Barat pada bulan Oktober Amplifikasi gen Growth
 III. MATERI DAN METODE 3.1 Waktu dan Tempat Pengambilan sampel darah domba dilakukan di Kecamatan Koto Tengah Kota Padang Sumatera Barat pada bulan Oktober 2012. Amplifikasi gen Growth Hormone menggunakan
III. MATERI DAN METODE 3.1 Waktu dan Tempat Pengambilan sampel darah domba dilakukan di Kecamatan Koto Tengah Kota Padang Sumatera Barat pada bulan Oktober 2012. Amplifikasi gen Growth Hormone menggunakan
V. EXPRESSION OF GROWTH HORMONE GENE OF TILAPIA (tigh) IN CATFISH (Clarias sp.) TRANSGENIC FIRST GENERATION ABSTRACT
 37 V. EXPRESSION OF GROWTH HORMONE GENE OF TILAPIA (tigh) IN CATFISH (Clarias sp.) TRANSGENIC FIRST GENERATION ABSTRACT The research intends to analyse expression of growth hormone gene of tilapia (tigh)
37 V. EXPRESSION OF GROWTH HORMONE GENE OF TILAPIA (tigh) IN CATFISH (Clarias sp.) TRANSGENIC FIRST GENERATION ABSTRACT The research intends to analyse expression of growth hormone gene of tilapia (tigh)
Gambar 1. Struktur organisasi promoter pada organisme prokariot [Sumber: University of Miami 2008: 1.]
![Gambar 1. Struktur organisasi promoter pada organisme prokariot [Sumber: University of Miami 2008: 1.] Gambar 1. Struktur organisasi promoter pada organisme prokariot [Sumber: University of Miami 2008: 1.]](/thumbs/63/49770631.jpg) Gambar 1. Struktur organisasi promoter pada organisme prokariot [Sumber: University of Miami 2008: 1.] Gambar 2. Struktur organisasi promoter pada organisme eukariot [Sumber: Gilbert 1997: 1.] Gambar 3.
Gambar 1. Struktur organisasi promoter pada organisme prokariot [Sumber: University of Miami 2008: 1.] Gambar 2. Struktur organisasi promoter pada organisme eukariot [Sumber: Gilbert 1997: 1.] Gambar 3.
HASIL DAN PEMBAHASAN bp bp bp
 HASIL DAN PEBAHASAN Purifikasi dan Pengujian Produk PCR (Stilbena Sintase) Purifikasi ini menggunakan high pure plasmid isolation kit dari Invitrogen. Percobaan dilakukan sesuai dengan prosedur yang terdapat
HASIL DAN PEBAHASAN Purifikasi dan Pengujian Produk PCR (Stilbena Sintase) Purifikasi ini menggunakan high pure plasmid isolation kit dari Invitrogen. Percobaan dilakukan sesuai dengan prosedur yang terdapat
BAHAN DAN METODE Tahap I: Pembuatan Konstruksi Vaksin DNA KHV dan Plasmid Disain Primer Isolasi Gen Penyandi Glicoprotein
 BAHAN DAN METODE Tahap I: Pembuatan Konstruksi Vaksin DNA KHV dan Plasmid DNA KHV yang digunakan sebagai sumber isolasi gen adalah DNA yang berasal dari virus tipe liar. DNA ini diperoleh dari Balai Riset
BAHAN DAN METODE Tahap I: Pembuatan Konstruksi Vaksin DNA KHV dan Plasmid DNA KHV yang digunakan sebagai sumber isolasi gen adalah DNA yang berasal dari virus tipe liar. DNA ini diperoleh dari Balai Riset
3. METODE PENELITIAN
 29 3. METODE PENELITIAN 3.1. Lokasi dan Waktu Penelitian Lokasi penelitian meliputi Laut Sulawesi, Selat Makassar, Teluk Bone, Laut Flores, Laut Banda, Teluk Tolo, Laut Maluku dan Teluk Tomini (Gambar
29 3. METODE PENELITIAN 3.1. Lokasi dan Waktu Penelitian Lokasi penelitian meliputi Laut Sulawesi, Selat Makassar, Teluk Bone, Laut Flores, Laut Banda, Teluk Tolo, Laut Maluku dan Teluk Tomini (Gambar
II. TINJAUAN PUSTAKA 2.1 Transgenik
 II. TINJAUAN PUSTAKA 2.1 Transgenik Salah satu pendekatan untuk perbaikan genetik organisme akuatik yang muncul sebagai suatu disiplin ilmu tersendiri baru-baru ini adalah transgenesis, yaitu proses transfer
II. TINJAUAN PUSTAKA 2.1 Transgenik Salah satu pendekatan untuk perbaikan genetik organisme akuatik yang muncul sebagai suatu disiplin ilmu tersendiri baru-baru ini adalah transgenesis, yaitu proses transfer
BAB III METODE PENELITIAN. Dalam penelitian ini dilakukan lima tahap utama yang meliputi tahap
 BAB III METODE PENELITIAN Dalam penelitian ini dilakukan lima tahap utama yang meliputi tahap penyiapan templat mtdna, amplifikasi fragmen mtdna pada daerah D-loop mtdna manusia dengan teknik PCR, deteksi
BAB III METODE PENELITIAN Dalam penelitian ini dilakukan lima tahap utama yang meliputi tahap penyiapan templat mtdna, amplifikasi fragmen mtdna pada daerah D-loop mtdna manusia dengan teknik PCR, deteksi
TINJAUAN PUSTAKA Hormon Pertumbuhan ( Growth Hormone Teknologi DNA Rekombinan
 4 TINJAUAN PUSTAKA Hormon Pertumbuhan (Growth Hormone) Hormon pertumbuhan (GH) merupakan hormon polipeptida penting dengan ukuran sekitar 22 kda yang diproduksi dari somatotropin di dalam kelenjar anterior
4 TINJAUAN PUSTAKA Hormon Pertumbuhan (Growth Hormone) Hormon pertumbuhan (GH) merupakan hormon polipeptida penting dengan ukuran sekitar 22 kda yang diproduksi dari somatotropin di dalam kelenjar anterior
BAB 3 METODOLOGI PENELITIAN
 BAB 3 METODOLOGI PENELITIAN 3.1 Desain Penelitian Bentuk desain penelitian yang akan digunakan adalah bentuk deskriptif molekuler potong lintang untuk mengetahui dan membandingkan kekerapan mikrodelesi
BAB 3 METODOLOGI PENELITIAN 3.1 Desain Penelitian Bentuk desain penelitian yang akan digunakan adalah bentuk deskriptif molekuler potong lintang untuk mengetahui dan membandingkan kekerapan mikrodelesi
Kloning Domain KS dan Domain A ke dalam Sel E. coli DH5α. Analisis Bioinformatika. HASIL Penapisan Bakteri Penghasil Senyawa Antibakteri
 3 selama 1 menit, dan elongasi pada suhu 72 0 C selama 1 menit. Tahap terakhir dilakukan pada suhu 72 0 C selama 10 menit. Produk PCR dielektroforesis pada gel agarosa 1 % (b/v) menggunakan tegangan 70
3 selama 1 menit, dan elongasi pada suhu 72 0 C selama 1 menit. Tahap terakhir dilakukan pada suhu 72 0 C selama 10 menit. Produk PCR dielektroforesis pada gel agarosa 1 % (b/v) menggunakan tegangan 70
TUGAS TERSTRUKTUR BIOTEKNOLOGI PERTANIAN VEKTOR DNA
 TUGAS TERSTRUKTUR BIOTEKNOLOGI PERTANIAN VEKTOR DNA Oleh: Gregorius Widodo Adhi Prasetyo A2A015009 KEMENTERIAN RISET TEKNOLOGI DAN PENDIDIKAN TINGGI UNIVERSITAS JENDERAL SOEDIRMAN FAKULTAS PERTANIAN PROGRAM
TUGAS TERSTRUKTUR BIOTEKNOLOGI PERTANIAN VEKTOR DNA Oleh: Gregorius Widodo Adhi Prasetyo A2A015009 KEMENTERIAN RISET TEKNOLOGI DAN PENDIDIKAN TINGGI UNIVERSITAS JENDERAL SOEDIRMAN FAKULTAS PERTANIAN PROGRAM
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Jenis penelitian Jenis penelitian yang dilakukan adalah penelitian dasar dengan metode deskriptif (Nazir, 1988). B. Populasi dan sampel Populasi pada penelitian ini adalah
BAB III METODE PENELITIAN A. Jenis penelitian Jenis penelitian yang dilakukan adalah penelitian dasar dengan metode deskriptif (Nazir, 1988). B. Populasi dan sampel Populasi pada penelitian ini adalah
LAPORAN II (ISOLASI DNA GENOM)
 LAPORAN PRAKTIKUM REKAYASA GENETIKA LAPORAN II (ISOLASI DNA GENOM) KHAIRUL ANAM P051090031/BTK BIOTEKNOLOGI SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2010 0 ISOLASI DNA GENOM TUJUAN 16s rrna. Praktikum
LAPORAN PRAKTIKUM REKAYASA GENETIKA LAPORAN II (ISOLASI DNA GENOM) KHAIRUL ANAM P051090031/BTK BIOTEKNOLOGI SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR 2010 0 ISOLASI DNA GENOM TUJUAN 16s rrna. Praktikum
BAHAN DAN METODE Tempat dan Waktu Penelitian Bahan dan Alat
 12 BAHAN DAN METODE Tempat dan Waktu Penelitian Survei penyakit klorosis dan koleksi sampel tanaman tomat sakit dilakukan di sentra produksi tomat di daerah Cianjur, Cipanas, Lembang, dan Garut. Deteksi
12 BAHAN DAN METODE Tempat dan Waktu Penelitian Survei penyakit klorosis dan koleksi sampel tanaman tomat sakit dilakukan di sentra produksi tomat di daerah Cianjur, Cipanas, Lembang, dan Garut. Deteksi
BAHAN DAN METODE. Tempat dan Waktu Penelitian
 BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilakukan di Laboratorium Kerjasama Bioteknologi Indonesia- Belanda (BIORIN) dan Laboratorium Biologi Molekuler dan Seluler Tanaman (BMST), Pusat
BAHAN DAN METODE Tempat dan Waktu Penelitian Penelitian dilakukan di Laboratorium Kerjasama Bioteknologi Indonesia- Belanda (BIORIN) dan Laboratorium Biologi Molekuler dan Seluler Tanaman (BMST), Pusat
Gambar 2 Vektor pengklonan pgem T Easy
 BAHAN DAN METODE Waktu dan Tempat Penelitian ini dilaksanakan dari bulan September 2007 sampai dengan bulan April 2008. Penelitian dilakukan di Laboratorium Biologi Molekuler Seluler Tanaman, dan Laboratorium
BAHAN DAN METODE Waktu dan Tempat Penelitian ini dilaksanakan dari bulan September 2007 sampai dengan bulan April 2008. Penelitian dilakukan di Laboratorium Biologi Molekuler Seluler Tanaman, dan Laboratorium
BAB III METODE PENELITIAN. Secara garis besar langkah-langkah yang dilakukan dalam penelitian ini
 BAB III METODE PENELITIAN Secara garis besar langkah-langkah yang dilakukan dalam penelitian ini adalah: pengumpulan sampel; lisis terhadap sampel mtdna yang telah diperoleh; amplifikasi daerah D-loop
BAB III METODE PENELITIAN Secara garis besar langkah-langkah yang dilakukan dalam penelitian ini adalah: pengumpulan sampel; lisis terhadap sampel mtdna yang telah diperoleh; amplifikasi daerah D-loop
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Jenis Penelitian Penelitian ini merupakan penelitian murni yang dilakukan dengan metode deskriptif, yaitu suatu metode penelitian untuk membuat deskripsi, gambaran atau lukisan
BAB III METODE PENELITIAN A. Jenis Penelitian Penelitian ini merupakan penelitian murni yang dilakukan dengan metode deskriptif, yaitu suatu metode penelitian untuk membuat deskripsi, gambaran atau lukisan
II. ISOLASI DAN KARAKTERISASI PROMOTER GEN ANTIVIRUS DARI UDANG WINDU Penaeus monodon *)
 II. ISOLASI DAN KARAKTERISASI PROMOTER GEN ANTIVIRUS DARI UDANG WINDU Penaeus monodon *) ABSTRAK Promoter adalah sekuen DNA spesifik yang berperan dalam mengendalikan transkripsi gen yang terletak di sebelah
II. ISOLASI DAN KARAKTERISASI PROMOTER GEN ANTIVIRUS DARI UDANG WINDU Penaeus monodon *) ABSTRAK Promoter adalah sekuen DNA spesifik yang berperan dalam mengendalikan transkripsi gen yang terletak di sebelah
Kolokium Departemen Biologi FMIPA IPB: Ria Maria
 Kolokium Departemen Biologi FMIPA IPB: Ria Maria Ria Maria (G34090088), Achmad Farajallah, Maria Ulfah. 2012. Karakterisasi Single Nucleotide Polymorphism Gen CAST pada Ras Ayam Lokal. Makalah Kolokium
Kolokium Departemen Biologi FMIPA IPB: Ria Maria Ria Maria (G34090088), Achmad Farajallah, Maria Ulfah. 2012. Karakterisasi Single Nucleotide Polymorphism Gen CAST pada Ras Ayam Lokal. Makalah Kolokium
MATERI DAN METODE. Materi. Tabel 1. Sampel Darah Sapi Perah dan Sapi Pedaging yang Digunakan No. Bangsa Sapi Jenis Kelamin
 MATERI DAN METODE Lokasi dan Waktu Penelitian ini dilaksanakan di Laboratorium Genetika Molekuler Ternak, Bagian Pemuliaan dan Genetika, Fakultas Peternakan, Institut Pertanian Bogor. Penelitian ini berlangsung
MATERI DAN METODE Lokasi dan Waktu Penelitian ini dilaksanakan di Laboratorium Genetika Molekuler Ternak, Bagian Pemuliaan dan Genetika, Fakultas Peternakan, Institut Pertanian Bogor. Penelitian ini berlangsung
BAB 3 PERCOBAAN Mikroba C. violaceum, Bacillus cereus dan E. coli JM 109
 9 BAB 3 PERCOBAAN 3.1 Alat, Bahan dan Miroba 3.1.1 Alat Bunsen, inkubator 37 o C, sentrifuga (Mikro 200R Hettich), Eppendorf 100 ul, 500 ul, 1,5 ml, tabung mikrosentrifuga (Eppendorf), neraca timbang (Mettler
9 BAB 3 PERCOBAAN 3.1 Alat, Bahan dan Miroba 3.1.1 Alat Bunsen, inkubator 37 o C, sentrifuga (Mikro 200R Hettich), Eppendorf 100 ul, 500 ul, 1,5 ml, tabung mikrosentrifuga (Eppendorf), neraca timbang (Mettler
II. BAHAN DAN METODE
 II. BAHAN DAN METODE 2.1 Rancangan Perlakuan Penelitian ini terdiri dari enam perlakuan yang masing-masing diberi 3 kali ulangan. Perlakuan yang diberikan berupa perendaman dengan dosis relhp berbeda yaitu
II. BAHAN DAN METODE 2.1 Rancangan Perlakuan Penelitian ini terdiri dari enam perlakuan yang masing-masing diberi 3 kali ulangan. Perlakuan yang diberikan berupa perendaman dengan dosis relhp berbeda yaitu
RATNA ANNISA UTAMI
 RATNA ANNISA UTAMI 10703022 AMPLIFIKASI DAN KLONING DNA PENGKODE PROTEIN CHAPERONIN 60.1 MYCOBACTERIUM TUBERCULOSIS KE DALAM VEKTOR pgem-t PADA ESCHERICHIA COLI PROGRAM STUDI SAINS DAN TEKNOLOGI FARMASI
RATNA ANNISA UTAMI 10703022 AMPLIFIKASI DAN KLONING DNA PENGKODE PROTEIN CHAPERONIN 60.1 MYCOBACTERIUM TUBERCULOSIS KE DALAM VEKTOR pgem-t PADA ESCHERICHIA COLI PROGRAM STUDI SAINS DAN TEKNOLOGI FARMASI
EVALUASI DAN OPTIMALISASI PROGRAM PCR DALAM DETERMINASI KELAMIN IKAN BARBIR EMAS Puntius conchonius SECARA MOLEKULAR RADI IHLAS ALBANI
 EVALUASI DAN OPTIMALISASI PROGRAM PCR DALAM DETERMINASI KELAMIN IKAN BARBIR EMAS Puntius conchonius SECARA MOLEKULAR RADI IHLAS ALBANI DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
EVALUASI DAN OPTIMALISASI PROGRAM PCR DALAM DETERMINASI KELAMIN IKAN BARBIR EMAS Puntius conchonius SECARA MOLEKULAR RADI IHLAS ALBANI DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
BAHAN DAN METODE. Waktu dan Tempat
 BAHAN DAN METODE Waktu dan Tempat Penelitian dilakukan terhadap sampel yang dikoleksi selama tujuh bulan mulai September 2009 hingga Maret 2010 di Kabupaten Indramayu. Penelitian dilaksanakan di Laboratorium
BAHAN DAN METODE Waktu dan Tempat Penelitian dilakukan terhadap sampel yang dikoleksi selama tujuh bulan mulai September 2009 hingga Maret 2010 di Kabupaten Indramayu. Penelitian dilaksanakan di Laboratorium
Teknologi manipulasi gen (genetic engineering) telah dikembangkan sebagai pelengkap program perbenihan untuk meningkatkan kualitas dan kuantitas dari
 VI. PEMBAHASAN UMUM Produksi udang windu tahan penyakit atau memiliki daya tahan tubuh yang kuat (resisten) terhadap patogen merupakan salah satu strategi yang perlu dilakukan dalam upaya mengendalian
VI. PEMBAHASAN UMUM Produksi udang windu tahan penyakit atau memiliki daya tahan tubuh yang kuat (resisten) terhadap patogen merupakan salah satu strategi yang perlu dilakukan dalam upaya mengendalian
BAB 3 PERCOBAAN 3.1 Bahan 3.2 Alat
 BAB 3 PERCOBAAN 3.1 Bahan Bahan yang digunakan memiliki kualitas pro analisis atau pro biologi molekular, yaitu : primer M. tuberculosis forward: 5 GGATCCGATGAGCAAGCTGATCGAA3 (Proligo) dan primer M. tuberculosis
BAB 3 PERCOBAAN 3.1 Bahan Bahan yang digunakan memiliki kualitas pro analisis atau pro biologi molekular, yaitu : primer M. tuberculosis forward: 5 GGATCCGATGAGCAAGCTGATCGAA3 (Proligo) dan primer M. tuberculosis
HASIL DAN PEMBAHASAN Isolasi DNA Genomik Sengon
 HASIL DAN PEMBAHASAN Isolasi DNA Genomik Sengon DNA genomik sengon diisolasi dari daun muda pohon sengon. Hasil uji integritas DNA metode 1, metode 2 dan metode 3 pada gel agarose dapat dilihat pada Gambar
HASIL DAN PEMBAHASAN Isolasi DNA Genomik Sengon DNA genomik sengon diisolasi dari daun muda pohon sengon. Hasil uji integritas DNA metode 1, metode 2 dan metode 3 pada gel agarose dapat dilihat pada Gambar
HASIL DAN PEMBAHASAN. Hasil
 11 secara perlahan beberapa kali kemudian segera ditambah dengan 400 μl larutan buffer netralisasi (1.32 M natrium asetat ph 4.8), divorteks dan disentrifugasi pada suhu 4 0 C dengan kecepatan 10 000 rpm
11 secara perlahan beberapa kali kemudian segera ditambah dengan 400 μl larutan buffer netralisasi (1.32 M natrium asetat ph 4.8), divorteks dan disentrifugasi pada suhu 4 0 C dengan kecepatan 10 000 rpm
GENETIKA DASAR Rekayasa Genetika Tanaman. Definisi. Definisi. Definisi. Rekayasa Genetika atau Teknik DNA Rekombinan atau Manipulasi genetik
 Definisi GENETIKA DASAR Rekayasa Genetika Tanaman Oleh: Dr. Ir. Dirvamena Boer, M.Sc.Agr. HP: 081 385 065 359 e-mail: dirvamenaboer@yahoo.com Fakultas Pertanian, Universitas Haluoleo, Kendari Dipublikasi
Definisi GENETIKA DASAR Rekayasa Genetika Tanaman Oleh: Dr. Ir. Dirvamena Boer, M.Sc.Agr. HP: 081 385 065 359 e-mail: dirvamenaboer@yahoo.com Fakultas Pertanian, Universitas Haluoleo, Kendari Dipublikasi
BAB 4. METODE PENELITIAN
 BAB 4. METODE PENELITIAN Penelitian penanda genetik spesifik dilakukan terhadap jenis-jenis ikan endemik sungai paparan banjir Riau yaitu dari Genus Kryptopterus dan Ompok. Penelitian ini bertujuan untuk
BAB 4. METODE PENELITIAN Penelitian penanda genetik spesifik dilakukan terhadap jenis-jenis ikan endemik sungai paparan banjir Riau yaitu dari Genus Kryptopterus dan Ompok. Penelitian ini bertujuan untuk
III. BAHAN DAN METODE
 III. BAHAN DAN METODE Tempat dan Waktu Penelitian dilakukan di Laboratorium BIORIN (Biotechnology Research Indonesian - The Netherlands) Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB. Penelitian
III. BAHAN DAN METODE Tempat dan Waktu Penelitian dilakukan di Laboratorium BIORIN (Biotechnology Research Indonesian - The Netherlands) Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB. Penelitian
HASIL DAN PEMBAHASAN
 HASIL DAN PEMBAHASAN Pemotongan Parsial dan Penyisipan Nukleotida pada Ujung Fragmen DNA Konstruksi pustaka genom membutuhkan potongan DNA yang besar. Untuk mendapatkan fragmen-fragmen dengan ukuran relatif
HASIL DAN PEMBAHASAN Pemotongan Parsial dan Penyisipan Nukleotida pada Ujung Fragmen DNA Konstruksi pustaka genom membutuhkan potongan DNA yang besar. Untuk mendapatkan fragmen-fragmen dengan ukuran relatif
PETUNJUK PRAKTIKUM BIOLOGI SEL DAN MOLEKULER Oleh: Ixora Sartika M ISOLASI DNA PLASMID
 PETUNJUK PRAKTIKUM BIOLOGI SEL DAN MOLEKULER Oleh: Ixora Sartika M ixomerc@uny.ac.id ISOLASI DNA PLASMID Plasmid adalah DNA ekstrakromosom yang berbentuk sirkuler dan berukuran kecil (1 200 kb). Sebagian
PETUNJUK PRAKTIKUM BIOLOGI SEL DAN MOLEKULER Oleh: Ixora Sartika M ixomerc@uny.ac.id ISOLASI DNA PLASMID Plasmid adalah DNA ekstrakromosom yang berbentuk sirkuler dan berukuran kecil (1 200 kb). Sebagian
BAHAN DAN METODE. ditranskipsi dan produk translasi yang dikode oleh gen (Nasution 1999).
 4 ditranskipsi dan produk translasi yang dikode oleh gen (Nasution 1999). Polymerase Chain Reaction (PCR) PCR merupakan suatu reaksi in vitro untuk menggandakan jumlah molekul DNA pada target tertentu
4 ditranskipsi dan produk translasi yang dikode oleh gen (Nasution 1999). Polymerase Chain Reaction (PCR) PCR merupakan suatu reaksi in vitro untuk menggandakan jumlah molekul DNA pada target tertentu
bio.unsoed.ac.id METODE PENELITIAN A. Materi, Lokasi, dan Waktu Penelitian 1. Materi Penelitian
 III. METODE PENELITIAN A. Materi, Lokasi, dan Waktu Penelitian 1. Materi Penelitian 1.1. Peralatan Penelitian Alat yang digunakan dalam penelitian ini adalah botol sampel, beaker glass, cool box, labu
III. METODE PENELITIAN A. Materi, Lokasi, dan Waktu Penelitian 1. Materi Penelitian 1.1. Peralatan Penelitian Alat yang digunakan dalam penelitian ini adalah botol sampel, beaker glass, cool box, labu
BAB III METODE PENELITIAN. amplifikasi daerah HVI mtdna sampel dengan menggunakan teknik PCR;
 BAB III METODE PENELITIAN Secara garis besar, langkah-langkah yang dilakukan dalam penelitian ini adalah: pengumpulan sampel; lisis terhadap sampel mtdna yang telah diperoleh; amplifikasi daerah HVI mtdna
BAB III METODE PENELITIAN Secara garis besar, langkah-langkah yang dilakukan dalam penelitian ini adalah: pengumpulan sampel; lisis terhadap sampel mtdna yang telah diperoleh; amplifikasi daerah HVI mtdna
II. BAHAN DAN METODE. Betina BEST BB NB RB. Nirwana BN NN RN. Red NIFI BR NR RR
 II. BAHAN DAN METODE Ikan Uji Ikan uji yang digunakan adalah ikan nila hibrida hasil persilangan resiprok 3 strain BEST, Nirwana dan Red NIFI koleksi Balai Riset Perikanan Budidaya Air Tawar Sempur, Bogor.
II. BAHAN DAN METODE Ikan Uji Ikan uji yang digunakan adalah ikan nila hibrida hasil persilangan resiprok 3 strain BEST, Nirwana dan Red NIFI koleksi Balai Riset Perikanan Budidaya Air Tawar Sempur, Bogor.
I. PENDAHULUAN. protein dalam jumlah besar (Reece dkk., 2011). kompeten biasanya dibuat dari inokulum awal dengan konsentrasi 2% ( v / v )
 I. PENDAHULUAN A. Latar Belakang Penelitian Plasmid merupakan molekul DNA berukuran relatif kecil, melingkar, dan beruntai ganda. Plasmid membawa gen-gen yang terpisah dari kromosom bakteri. Plasmid digunakan
I. PENDAHULUAN A. Latar Belakang Penelitian Plasmid merupakan molekul DNA berukuran relatif kecil, melingkar, dan beruntai ganda. Plasmid membawa gen-gen yang terpisah dari kromosom bakteri. Plasmid digunakan
BAB III METODOLOGI PENELITIAN. Penelitian akan diawali dengan preparasi alat dan bahan untuk sampling
 16 BAB III METODOLOGI PENELITIAN Penelitian akan diawali dengan preparasi alat dan bahan untuk sampling sel folikel akar rambut. Sampel kemudian dilisis, diamplifikasi dan disekuensing dengan metode dideoksi
16 BAB III METODOLOGI PENELITIAN Penelitian akan diawali dengan preparasi alat dan bahan untuk sampling sel folikel akar rambut. Sampel kemudian dilisis, diamplifikasi dan disekuensing dengan metode dideoksi
3 METODOLOGI 3.1 Waktu dan Tempat 3.2 Bahan dan Alat
 3 METODOLOGI 3.1 Waktu dan Tempat Penelitian Autentikasi Bahan Baku Ikan Tuna (Thunnus sp.) dalam Rangka Peningkatan Keamanan Pangan dengan Metode Berbasis DNA dilaksanakan pada bulan Januari sampai dengan
3 METODOLOGI 3.1 Waktu dan Tempat Penelitian Autentikasi Bahan Baku Ikan Tuna (Thunnus sp.) dalam Rangka Peningkatan Keamanan Pangan dengan Metode Berbasis DNA dilaksanakan pada bulan Januari sampai dengan
BAB III METODOLOGI PENELITIAN. Pada penelitian ini terdapat lima tahapan penelitian yang dilakukan yaitu
 BAB III METODOLOGI PENELITIAN Pada penelitian ini terdapat lima tahapan penelitian yang dilakukan yaitu pengumpulan sampel berupa akar rambut, ekstraksi mtdna melalui proses lisis akar rambut, amplifikasi
BAB III METODOLOGI PENELITIAN Pada penelitian ini terdapat lima tahapan penelitian yang dilakukan yaitu pengumpulan sampel berupa akar rambut, ekstraksi mtdna melalui proses lisis akar rambut, amplifikasi
REKAYASA GENETIKA. Genetika. Rekayasa. Sukarti Moeljopawiro. Laboratorium Biokimia Fakultas Biologi Universitas Gadjah Mada
 REKAYASA GENETIKA Sukarti Moeljopawiro Laboratorium Biokimia Fakultas Biologi Universitas Gadjah Mada Rekayasa Genetika REKAYASA GENETIKA Teknik untuk menghasilkan molekul DNA yang berisi gen baru yang
REKAYASA GENETIKA Sukarti Moeljopawiro Laboratorium Biokimia Fakultas Biologi Universitas Gadjah Mada Rekayasa Genetika REKAYASA GENETIKA Teknik untuk menghasilkan molekul DNA yang berisi gen baru yang
BAB III METODE PENELITIAN. Penelitian ini merupakan penelitian yang dilakukan dengan metode
 16 BAB III METODE PENELITIAN A. Jenis Penelitian Penelitian ini merupakan penelitian yang dilakukan dengan metode deskriptif. Penelitian deskriptif adalah suatu metode penelitian untuk membuat deskripsi,
16 BAB III METODE PENELITIAN A. Jenis Penelitian Penelitian ini merupakan penelitian yang dilakukan dengan metode deskriptif. Penelitian deskriptif adalah suatu metode penelitian untuk membuat deskripsi,
BAB III METODE PENELITIAN. Jenis penelitian yang digunakan dalam penelitian ini adalah deskriptif.
 BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian yang digunakan dalam penelitian ini adalah deskriptif. Penelitian deskriptif adalah metode penelitian yang bertujuan untuk membuat gambaran
BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian yang digunakan dalam penelitian ini adalah deskriptif. Penelitian deskriptif adalah metode penelitian yang bertujuan untuk membuat gambaran
METODOLOGI PENELITIAN. Tempat dan Waktu Penelitian. Bahan dan Alat Penelitian
 14 METODOLOGI PENELITIAN Tempat dan Waktu Penelitian Tempat penelitian dilakukan di Laboratorium Unit Pelayanan Mikrobiologi Terpadu, Bagian Mikrobiologi Kesehatan, Departemen Ilmu Penyakit Hewan dan Kesehatan
14 METODOLOGI PENELITIAN Tempat dan Waktu Penelitian Tempat penelitian dilakukan di Laboratorium Unit Pelayanan Mikrobiologi Terpadu, Bagian Mikrobiologi Kesehatan, Departemen Ilmu Penyakit Hewan dan Kesehatan
TINJAUAN PUSTAKA. transfer gen sejak penelitian pertama ikan transgenesis dimulai (Zhu dkk., 1985).
 TINJAUAN PUSTAKA Teknologi Transgenesis Telah lebih dari 35 spesies ikan berbeda telah telah diteliti untuk kegiatan transfer gen sejak penelitian pertama ikan transgenesis dimulai (Zhu dkk., 1985). Transgenesis
TINJAUAN PUSTAKA Teknologi Transgenesis Telah lebih dari 35 spesies ikan berbeda telah telah diteliti untuk kegiatan transfer gen sejak penelitian pertama ikan transgenesis dimulai (Zhu dkk., 1985). Transgenesis
BAB III METODE PENELITIAN. Penelitian ini merupakan penelitian eksperimental dengan 7 sampel dari 7
 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian ini merupakan penelitian eksperimental dengan 7 sampel dari 7 individu udang Jari yang diambil dari Segara Anakan Kabupaten Cilacap Jawa Tengah.
BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian ini merupakan penelitian eksperimental dengan 7 sampel dari 7 individu udang Jari yang diambil dari Segara Anakan Kabupaten Cilacap Jawa Tengah.
VII. UJI EKSPRESI GEN TcAP1 (APETALA1 KAKAO) PADA TANAMAN MODEL. Abstrak
 VII. UJI EKSPRESI GEN TcAP1 (APETALA1 KAKAO) PADA TANAMAN MODEL Abstrak Pada berbagai spesies termasuk kakao, gen AP1 (APETALA1) diketahui sebagai gen penanda pembungaan yang mengendalikan terbentuknya
VII. UJI EKSPRESI GEN TcAP1 (APETALA1 KAKAO) PADA TANAMAN MODEL Abstrak Pada berbagai spesies termasuk kakao, gen AP1 (APETALA1) diketahui sebagai gen penanda pembungaan yang mengendalikan terbentuknya
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian tentang Pengaruh Suhu Annealing pada Program PCR terhadap Keberhasilan Amplifikasi DNA Udang Jari (Metapenaeus elegans) Laguna Segara Anakan
BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian tentang Pengaruh Suhu Annealing pada Program PCR terhadap Keberhasilan Amplifikasi DNA Udang Jari (Metapenaeus elegans) Laguna Segara Anakan
YOHANES NOVI KURNIAWAN KONSTRUKSI DAERAH PENGKODE INTERFERON ALFA-2B (IFNα2B) DAN KLONINGNYA PADA Escherichia coli JM109
 YOHANES NOVI KURNIAWAN 10702026 KONSTRUKSI DAERAH PENGKODE INTERFERON ALFA-2B (IFNα2B) DAN KLONINGNYA PADA Escherichia coli JM109 Program Studi Sains dan Teknologi Farmasi INSTITUT TEKNOLOGI BANDUNG 2007
YOHANES NOVI KURNIAWAN 10702026 KONSTRUKSI DAERAH PENGKODE INTERFERON ALFA-2B (IFNα2B) DAN KLONINGNYA PADA Escherichia coli JM109 Program Studi Sains dan Teknologi Farmasi INSTITUT TEKNOLOGI BANDUNG 2007
BAB III METODE PENELITIAN
 25 BAB III METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian telah berlangsung sejak bulan Januari 2012 - Juli 2012 di Laboratorium Mikrobiologi, Lab. Optik, Lab. Genetika dan Lab. Biologi Molekuler Jurusan
25 BAB III METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian telah berlangsung sejak bulan Januari 2012 - Juli 2012 di Laboratorium Mikrobiologi, Lab. Optik, Lab. Genetika dan Lab. Biologi Molekuler Jurusan
TINJAUAN PUSTAKA. Ikan Lele Dumbo (Clarias gariepinus) Menurut Kottelat dkk., (1993), klasifikasi dari ikan lele dumbo adalah.
 TINJAUAN PUSTAKA Ikan Lele Dumbo (Clarias gariepinus) Menurut Kottelat dkk., (1993), klasifikasi dari ikan lele dumbo adalah sebagai berikut: Kingdom Filum Kelas Ordo Family Genus : Animalia : Chordata
TINJAUAN PUSTAKA Ikan Lele Dumbo (Clarias gariepinus) Menurut Kottelat dkk., (1993), klasifikasi dari ikan lele dumbo adalah sebagai berikut: Kingdom Filum Kelas Ordo Family Genus : Animalia : Chordata
DASAR REKAYASA GENETIKA
 DASAR REKAYASA GENETIKA Rekayasa = manipulasi = modifikasi = perubahan bahan genetik (perubahan & pemindahan gen) Cara: 1. Persilangan seksual (perkawinan) 2. Hibridisasi somatik 3. Mutasi 4. Teknologi
DASAR REKAYASA GENETIKA Rekayasa = manipulasi = modifikasi = perubahan bahan genetik (perubahan & pemindahan gen) Cara: 1. Persilangan seksual (perkawinan) 2. Hibridisasi somatik 3. Mutasi 4. Teknologi
