Prosiding Seminar Nasional Kimia Unesa 2012 ISBN : Surabaya, 25 Pebruari PEMBUATAN ELEKTRODA PEMBANDING Ag/AgCl
|
|
|
- Yuliani Sanjaya
- 7 tahun lalu
- Tontonan:
Transkripsi
1 PEMBUATAN ELEKTRODA PEMBANDING Ag/AgCl Pirim Setiarso Jurusan Kimia FMIPA Universitas Negeri Surabaya ABSTRAK Telah dibuat elektroda pembanding Ag/AgCl dari kawat Ag diameter 0.4 mm dan panjang 4 cm. Elektrodeposisi AgCl berlangsung dalam larutan NaCl 0.1 M pada kawat Ag sehingga terbentuk AgCl. Elektrolisis dilakukan dengan potensial konstan pada 2500 mv arus 100 A selama 10 menit menggunakan alat Voltammetri. Kawat Ag/AgCl yang terbentuk dimasukkan ke badan elektroda yang telah diisi dengan 3 ml larutan KCl 3 M. Elektroda Ag/AgCl hasil pembuatan dikarakterisasi mengenai presisi dan akurasi menggunakan larutan K 4 Fe(CN) dibandingkan dengan elektroda Ag/AgCl komersial. Pada karakterisasi elektroda Ag/AgCl digunakan elektrolit pendukung KClO 4 secara voltammetri siklis dan deferensial pulsa voltammetri. Berdasarkan voltamogram CV dan DPV larutan K 4 Fe(CN) relatif terhadap dan Ag/AgCl komersial terbukti memberikan respon lebih baik dari komersial hal itu dapat dilihat dari harga ratarata arus DPV yang dihasilkan 8,1 µa sedang elektroda Ag/AgCl komersial 5,43 µa. Standar deviasi arus DPV dengan pembanding 1,0 µa lebih kecil dari komersial 2,0 µa. Hal ini dapat diartikan pengukuran dengan elektroda pembanding Ag/AgCl buatan sendiri memiliki presisi dan akurasi lebih baik dari pada elektroda komersial. Kata kunci : Elektroda Ag/AgCl, Voltametri PENDAHULUAN Elektroda pembanding diperlukan dalam analisis secara elektrometri yang berbasis potensiometri atau amperometri. Potensial yang terukur pada elektrometri adalah beda potensial antara elektroda kerja dan elektroda pembanding. Elektroda pembanding yang umum digunakan dalam analisis diantaranya elektroda kalomel jenuh (EKJ) dan elektroda Ag/AgCl. Elektroda EKJ memberikan potensial 0,220 V relatif terhadap elektroda standar hidrogen, adapun elektroda Ag/AgCl memberikan potensial sebesar 0,019 V relatif terhadap EKJ. Potensial yang diberikan oleh elektroda Ag/AgCl dapat dijelaskan sebagai berikut: AgCl (s) + e Ag (s) + Cl E 0 Ag + /Ag = 0,222 V (I.1) C 179
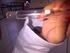
2 Adapun potensial yang diberikan oleh ion Ag + dalam larutan mengikuti persamaan Nernst E = E ln [Cl ] (I.2) Apabila persamaan (I.2) dikondisikan pada suhu 25 0 C dan konsentrasi Cl = 3 M maka persamaan (I.2) dapat diselesaikan E = 0,222,.. E = (0,222 0,028) V = 0,194 V ln[3] (I.3) Secara teori potensial yang diberikan oleh elektroda Ag/AgCl yang dipakai dalam penelitian ini V. Gambar 1 Elektroda Ag/AgCl. Elektroda Ag/AgCl yang telah dibuat dikarakterisasi menggunakan larutan K 4 Fe(CN) secara voltametri siklis dan diferensial pulsa voltametri dibandingkan dengan Elektroda Ag/AgCl buatan pabrik. Metodologi 1. Bahan Bahan yang diperlukan dalam penelitian ini di antaranya: Tabung kaca badan elektroda, kawat Ag diameter 0,4 mm, Larutan KCl 3 M, Larutan NaCl 0,1 M, Larutan K 4 Fe(CN), Larutan KClO 4, Aquades. 2. Alat Alat yang digunakan pada penelitian ini adalah seperangkat alat Voltammetri merk Epsilon. 3. Cara kerja C 180
3 Elektroda pembanding Ag/AgCl dalam penelitian ini dibuat dari kawat Ag diameter 0.4 mm dan panjang 4 cm. Elektrodeposisi AgCl berlangsung dalam larutan NaCl 0.1 M pada kawat Ag sehingga terbentuk AgCl dilakukan secara elektrolisis dengan potensial konstan pada 2500 mv arus 100 A selama 10 menit. Kawat Ag/AgCl dimasukkan ke badan elektroda yang telah diisi dengan 3mL larutan KCl 3 M selanjutnya ditutup dengan sumbat karet dan diisolasi dengan parafilm. Elektroda Ag/AgCl hasil pembuatan dikarakterisasi menggunakan larutan K 4 Fe(CN) dibandingkan dengan elektroda Ag/AgCl komersial. Karakterisasi elektroda Ag/AgCl digunakan elektrolit pendukung KCl secara voltametri siklis dan deferensial pulsa voltammetri. HASIL DAN PEMBAHASAN Elektroda Ag/AgCl yang telah dibuat dan dikarakterisasi menggunakan K 4 Fe(CN) 10 3 M dengan elektrolit pendukung KClO M dibandingkan dengan elektroda Ag/AgCl komersial secara voltametri. Pada pengukuran digunakan elektroda Pt sebagai elektroda kerja dan elektroda pembantu sedang elektroda pembanding adalah Ag/AgCl buatan sendiri dan komersial. Berikut adalah voltamogram voltametri siklis dan deferensial voltametri. CVfsSR 8 Arus A Arus A 4 Pengukuran E(V) relatif terhadap elektroda Ag/AgCl lokal E(V) relatif terhadap elektroda Ag/AgCl lokal Gambar 1 Voltamogram CV dan DPV fungsi laju pindai dari K 4 Fe(CN) 10 3 M relatif terhadap Cv K 4 Fe(CN) Ag/AgCl buatan pabrik Arus A Arus ( )A 4 Pe ngukuran E(V) relatif terhadap elektroda Ag/AgCl E (V ) relatif terhadap elektroda Ag /AgCl buatan pabrik Gambar 2 Voltamogram CV dan DPV fungsi laju pindai dari K 4 Fe(CN) 10 3 M relatif terhadap elektroda Ag/AgCl komersial C 181
4 Dari Gambar 1 dan 2 dapat diambil data Ipa dan Ipc seperti pada Tabel 1 berikut: Tabel 1 Data Ipa K 4 Fe(CN) 10 3 M terhadap laju pindai Ag/AgCl buatan sendiri dan komersial ν ν 1/2 Ipa µa Ipc µa Ipa/Ipc Ipa µa Ipc µa Ipa/Ipc Ag/AgCl buatan sendiri Ag/AgCl komersial 50 7,0711,984 3,3433 2,0897 3,5733 0,72 4, ,809 4,8747 2,0229 5,0549 0, , , ,9833 5,971 2,0052,0597 0,355 1, , ,1057,8224 2,075 7,458 0, , , ,7982 7,574 2,0857 8,4252 1,0814 7, , ,4101 8,2597 2, ,18 1,039 9, , ,728 8,9313 2, ,0324 1,5202 7,2572 Berdasarkan Tabel 1 dapat dibuat kurva ν 1/2 lawan Ipa relatif terhadap elektroda Ag/AgCl buatan sendiri dan komersial seperti berikut: ( Laju pindai) 1/2 Y = X R = Ipa (V/ menit) Gambar 3 Kurva ν 1/2 lawan arus Ipa K 4 Fe(CN) 10 3 M relatif terhadap (laju pindai) 1/2 Y = X R = Ipa V/menit) Gambar 4 Kurva ν 1/2 lawan arus Ipa K 4 Fe(CN) 10 3 M relatif terhadap elektroda Ag/AgCl komersial C 182
5 Tabel 2 Tabel persamaan regresi linier antara ν 1/2 lawan arus puncak DPV K 4 Fe(CN) 10 3 M relatif terhadap dan komersial Kurva Elektroda Ag/AgCl Elektroda Ag/AgCl komersil Ipa vs ν 1/2 Ipc vs ν 1/2 buatan sendiri Y = 0, ,0148 X R = 0, Y =0,073 0,4748 X R =0, Y =1, ,482 X R = 0,99 Y = 2,1243 0,1932 X R = 0, Dari Tabel (1) dapat dibuat pula kurva antara Ipa/Ipc lawan laju pindai untuk K 4 Fe(CN) 10 3 M dapat dilihat pada Gambar berikut: Ag/AgCl lokal Ag/AgCl komersial 5 Ipa/Ipc Laju pindai (V/menit) Gambar 5 Kurva antara laju pindai lawan Ipa/Ipc K 4 Fe(CN) 10 3 M relatif terhadap dan komersial Koefisien difusi dari K 4 Fe(CN) 10 3 M dihitung dengan menggunakan persamaan i = 2, n 2/3 A D 1/2 ν 1/2 Adapun hasinya dapat dilihat pada Tabel 3 berikut: Tabel 3 Koefisien difusi dari K 4 Fe(CN) 10 3 M Ipa relatif terhadap elektroda Ag/AgCl buatan sendiri dan Ag/AgCl komersial Elektroda Ag/AgCl buatan Elektroda Ag/AgCl komersial sendiri ν Ipa µa D D (10 4 ) cm 2 D D (10 4 ) /det Ipa µa cm 2 /det 7,0711,984 0,0192 3,84 3,5733 0,0102 1, ,809 0,0192 3,84 5,0549 0,0102 1, , ,9833 0,0192 3,84,0597 0,009 0,921 14, ,1057 0,0198 3,9204 7,458 0,0102 1, , ,7982 0,0198 3,9204 8,4252 0,0108 1,14 C 183
6 17, ,4101 0,0198 3, ,18 0,0114 1,299 18, ,728 0,0198 3, ,0324 0, Dari Tabel 3 dapat dibuat kurva antara ν 1/2 lawan koefisien difusi dari K 4 Fe(CN) 10 3 M relatif terhadap dan komersial berikut: Koef Difusi (D) (10 4 ) cm 2 /det Elektroda Ag/AgC l lokal Elektroda Ag/AgCl komersial Laju pindai ( V/m enit Gambar Kurva antara laju pindai lawan koefisien difusi relative terhadap dan komersial dari K 4 Fe(CN) 10 3 M Dengan cara yang sama dapat dihitung pula koefisien difusi dari Ipc K 4 Fe(CN) 10 3 M relative terhadap elektroda Ag/AgCl buatan sendiri dan komersial sedangkan hasilnya sebagai berikut: Tabel 4 Koefisien difusi dari K 4 Fe(CN) 10 3 M Ipc relatif terhadap elektroda Ag/AgCl buatan sendiri dan Ag/AgCl komersial Ag/AgCl buatan sendiri Ag/AgCl komersial ν Ipc (10 ) A D D(10 4 ) cm 2 /det Ipc (10 D D (10 5 ) ) A cm 2/ det 7,0711 3,3433 0,0093 0,849 0,72 0,0021 0, ,8747 0,009 0,921 0,2857 0,000 0,030 12,2475 5,971 0,009 0,921 0,355 0,000 0,030 14,1421,8224 0,0095 0,9025 0,5981 0,0008 0,040 15,8114 7,574 0,0094 0,883 1,0814 0,0013 0,190 17,3205 8,2597 0,0094 0,883 1,039 0,0011 0, ,7083 8,9313 0,0094 0,883 1,5202 0,001 0,250 Dari Tabel 4 dapat dialurkan kurva antara laju pindai (ν) 1/2 lawan koefisien difusi dari K 4 Fe(CN) 10 3 M relatif terhadap elektroda C 184
7 Ag/AgCl buatan sendiri dan komersial berikut: 1.0 Koef difusi (10 4 ) Ag/AgCl lokal Koef difusi (10 5 ) Ag/AgCl komersial Elektroda Ag/AgCl lokal Elektroda Ag/AgCl komersial La ju pind ai ( ) 1/2 V/m en it Gambar 7 Kurva laju pindai (ν) 1/2 lawan koefisien difusi dari K 4 Fe(CN) 10 3 M relative terhadap dan komersial Untuk menentukan jumlah electron yang terlibat dalam reaksi dari voltamogram CV Gambar 1 dan 2 dapat diambil data Epa dan Epc seperti pada Tabel 5 dan berikut: Tabel 5 Parameter elektrokimia voltamogram larutan K 4 Fe(CN) 10 3 M menggunakan Peng Epa (V) Epc (V) Ipa µa Ipc µa Epa Epc (V) Ipa/Ipc 1 0,4091 0,3329 9,727 4,473 0,072 2, ,4091 0,3329 9,727 4,473 0,072 2, ,4091 0,3329 9,727 4,473 0,072 2, ,4091 0,3329 9,727 4,90 0,072 2, ,4091 0,3329 9,727 4,90 0,072 2,0215 0,4091 0,3329 9,7591 4,90 0,072 2, ,4091 0,3329 9,7591 4,599 0,072 2,12297 Tabel Data pengulangan dan potensial redok relatif terhadap elektroda Ag/AgCl komersial Peng Epa (V) Epc (V) Ipa µa Ipc µa Epa Epc (V) Ipa/Ipc 1 0,3175 0,228 5,3172 0,1297 0, , ,3175 0,228 5,1012 0,1297 0, , ,3175 0,228 5,8998 0,173 0, , ,3175 0,228 5,125 0,0217 0, , ,3175 0,228 5,0398 0,0217 0, ,249 0,3175 0,228 5,0251 0,009 0, , ,3175 0,228 4,7919 0,1444 0, ,1849 Berdasarkan harga ratarata EpaEpc K 4 Fe(CN) 10 3 M 0,072 terhadap dan 0,0547 terhadap elektroda C 185
8 Ag/AgCl komersial, dapat dihitung jumlah elektron yang terlibat dalam reaksi pada suhu 25 0 C. Jumlah elektron yang terlibat untuk ( n = 0,059/0,072 = 0,7743) sedang untuk elektroda Ag/AgCl komersial (n = 0,059/ 0,0547 = 1,078), atau n 1. Sehingga jumlah elektron yang terlibat sesuai untuk reaksi reduksi K 4 Fe(CN) baik untuk elektroda Ag/AgCl komersial dan buatan sendiri. Fe(CN) e Fe(CN) Dari voltamogram DPV Gambar 1 dan 2 dapat diambil data arus puncak berikut: Tabel 7 Data tujuh pengulangan pengukuran arus DPV larutan K 4 Fe(CN) 10 3 M Peng Ag/AgCl buatan sendiri (10 5 ) A Ag/AgCl komersial (10 5 ) A 1 8,0175 5, ,027 5, ,1705 5, ,1948 5, ,1705 5,4032 8,2157 5, ,3234 5,8453 Dari Tabel 7 dapat dibuat kurva antara replikasi pengukuran lawan arus Arus 10 A Ag /AgC l lokal Ag /AgCl komersial P e ng u la n g a n Gambar 8 Kurva antara pengulangan dan arus DPV K 4 Fe(CN) 10 3 M dengan elektroda pembanding Ag/AgCl buatan sendiri dan komersial C 18
9 Ratarata arus DPV dengan elektroda pembanding Ag/AgCl buatan sendiri = (8,150 ± 0,1009) 10 5 A dan komersial ( 5,4378 ± 0,202417) 10 5 A. Untuk 8,150 5,4378 t 31,9507 0,0255(7 7) 49 t hitung = 31,95 > t tabel = 0,338. Sehingga dapat dikatakan arus DPV hasil pengukuran K 4 Fe(CN) 10 3 M dengan menggunakan elektroda Ag/AgCl buatan sendiri dan komersial menurut statistik terdapat pebedaan yang berarti. Untuk lebih mengetahui adakah perbedaan arus yang dihasilkan antara elektroda Ag/AgCl buatan sendiri dan komersial dilakukan uji t menggunakan persamaan. menguatkan hasil pengukuran akan dibandingkan potensial yang terukur. Adapun potensial yang terukur untuk 7 kali pengulangan pengukuran pada Tabel (5 dan ) dapat dibuat kurva antara pengulangan lawan EpaEpc A g /A gc l pabrik A g /A gc l sendiri E(V) P e n g u lan g a n Gambar 9 Potensial yang dihasilkan K 4 Fe(CN) 10 3 M dengan elekroda pembanding Ag/AgCl buatan sendiri dan komersial Dari tabel (4 dan 5) EpaEpc yang diberikan ratarata komersial (0,0547 ± 0 ) V dan buatan sendiri (0,072 ± 0) V. didapakan t hitung = ~ > t tabel = 0,338 sehingga secara statistik terdapat perbedaan yang berarti. Perbedaan tersebut disebabkan beberapa hal di antaranya 1. Sekat elektroda Ag/AgCl komersial berbeda dengan sekat Ag/AgCl buatan buatan sendiri yang terbuat dari silika gel. 2. Ketebalan sekat elektroda Ag/AgCl komersial berbeda dengan sekat Ag/AgCl buatan sendiri dengan ketebalan 2 mm. 3. Pengisi elektroda laruatan KCl 3 M boleh jadi sama namun ketebalan kawat 4. Ag dan gcl berbeda antara elektroda Ag/AgCl komersial dengan Ag/AgCl buatan sendiri. Walaupun terdapat perbedaan yang berarti menurut statistik akan tetapi memberikan respon lebih baik dari komersial hal itu dapat dilihat dari harga ratarata arus DPV yang dihasilkan 8, A sedang elektroda Ag/AgCl komersial 5, A. Standar deviasi arus DPV dengan pembanding 0, A lebih kecil dari komersial 0, A. Hal ini dapat diartikan pengukuran dengan elektroda pembanding Ag/AgCl buatan sendiri memiliki presisi C 187
10 dan akurasi lebih baik dari pada elektroda komersial. Dari uraian di atas maka peneliti menggunakan elektroda pembanding Ag/AgCl buatan sendiri untuk pengukuran dalam penelitian ini. KESIMPULAN Berdasarkan data voltamogram dan perhitungan dapat diambil kesimpulan secara umum elektroda Ag/AgCl buatan sendiri merespon secara elektrokimia dari larutan K 4 Fe(CN) 10 3 M lebih baik dari pada elektroda Ag/AgCl komersial. Berdasarkan perhitungan secara statistik potensial, arus puncak, koefisien difusi memberikan hasil yang lebih baik terbukti dari simpangan lebih kecil dibanding elektroda Ag/AgCl komersial. Sensitivitas, akurasi dan presisi lebih baik daripada elektroda Ag/AgCl komersial. DAFTAR PUSTAKA Dick,J.G., (1973): Analitical Chemistry, 1 st Ed, McGraw Hill Kogakusha LTD, Tokyo Ewing, G.W., (1975): Instrumental Methods of Chemical Analysis, 4 th Ed, McGraw Hill International Book Company 273, Harvey, D., (2000): Modern Analytical Chemistry, McGrawHill Higher Education, Boston, J.Widera, W.H. Steinecker, G.E. Pacey dan J.A. Cox (2003): Voltammetry in electrolytefree liquids using a threeelectrode probe with a sol gel Matrix, Journal of Applied Electrochemistry, 33, Skoog, D.A., dan West, D.M., (1980): Principles of Instrumental Analysis, 2 nd Ed, HoltSaunders Japan, Tokyo 031. Skoog, D.A.; West D.M., Holler F.J., dan Crouch S.R., (2004): Fundamentals of Analytical chemistry. Brooks/Cole Pub Co. C 188
SATUAN ACARA PERKULIAHAN
 SATUAN ACARA PERKULIAHAN Mata Kuliah : Metode Pemisahan dan Analisis Kimia (2 sks) Kode Mata Kuliah : SKM 205 Waktu Pertemuan : 2 50 menit Pertemuan ke : 1 A. Kompetensi Dasar : Memahami berbagai metode
SATUAN ACARA PERKULIAHAN Mata Kuliah : Metode Pemisahan dan Analisis Kimia (2 sks) Kode Mata Kuliah : SKM 205 Waktu Pertemuan : 2 50 menit Pertemuan ke : 1 A. Kompetensi Dasar : Memahami berbagai metode
BAB IV METODE PENELITIAN. karakterisasi elektroda pembanding Ag/AgCl. 2) Pembuatan EPK tanpa
 BAB IV METODE PENELITIAN 4.1. Rancangan Penelitian Penelitian ini dibagi empat tahap yang meliputi: 1) Pembuatan dan karakterisasi elektroda pembanding Ag/AgCl. 2) Pembuatan EPK tanpa modifikasi dan optimasi
BAB IV METODE PENELITIAN 4.1. Rancangan Penelitian Penelitian ini dibagi empat tahap yang meliputi: 1) Pembuatan dan karakterisasi elektroda pembanding Ag/AgCl. 2) Pembuatan EPK tanpa modifikasi dan optimasi
BAB IV HASIL DAN PEMBAHASAN
 33 BAB IV HASIL DAN PEMBAHASAN 4.1 PENDAHULUAN Pada bab ini akan dijelaskan mengenai hasil pengujian dari elektroda Ag/AgCl yang telah dibuat dengan memvariasikan konsentrasi larutan dan waktu pembuatan.
33 BAB IV HASIL DAN PEMBAHASAN 4.1 PENDAHULUAN Pada bab ini akan dijelaskan mengenai hasil pengujian dari elektroda Ag/AgCl yang telah dibuat dengan memvariasikan konsentrasi larutan dan waktu pembuatan.
2 TINJAUAN PUSTAKA. 2.1 Voltametri
 2 TINJAUAN PUSTAKA 2.1 Voltametri Voltametri merupakan salah satu teknik elektroanalitik dengan prinsip dasar elektrolisis. Elektroanalisis merupakan suatu teknik yang berfokus pada hubungan antara besaran
2 TINJAUAN PUSTAKA 2.1 Voltametri Voltametri merupakan salah satu teknik elektroanalitik dengan prinsip dasar elektrolisis. Elektroanalisis merupakan suatu teknik yang berfokus pada hubungan antara besaran
BAB 3 METODOLOGI PENELITIAN
 BAB 3 METODOLOGI PENELITIAN 3.1 Tahapan Penelitian 3.2 Alat dan Bahan 3.2.1 Alat Peralatan yang digunakan dalam penelitian ini meliputi peralatan gelas yang umum digunakan dalam analisis. Selain itu digunakan
BAB 3 METODOLOGI PENELITIAN 3.1 Tahapan Penelitian 3.2 Alat dan Bahan 3.2.1 Alat Peralatan yang digunakan dalam penelitian ini meliputi peralatan gelas yang umum digunakan dalam analisis. Selain itu digunakan
BAB V HASIL DAN PEMBAHASAN. dengan mengukur potensial campuran elektrolit K 3 Fe(CN) 6 dan K 4 Fe(CN) 6
 45 BAB V HASIL DAN PEMBAHASAN 5.1 Karakterisasi Elektroda Ag/AgCl Karakterisasi elektroda Ag/AgCl dilakukan untuk mengetahui apakah elektroda yang akan digunakan layak untuk pengukuran. Pengukuran dilakukan
45 BAB V HASIL DAN PEMBAHASAN 5.1 Karakterisasi Elektroda Ag/AgCl Karakterisasi elektroda Ag/AgCl dilakukan untuk mengetahui apakah elektroda yang akan digunakan layak untuk pengukuran. Pengukuran dilakukan
Metodologi Penelitian
 Bab III Metodologi Penelitian III.1. Tahapan Penelitian Penelitian ini dibagi menjadi 3 tahapan. Pertama adalah pembuatan elektroda pasta karbon termodifikasi diikuti dengan karakterisasi elektroda yang
Bab III Metodologi Penelitian III.1. Tahapan Penelitian Penelitian ini dibagi menjadi 3 tahapan. Pertama adalah pembuatan elektroda pasta karbon termodifikasi diikuti dengan karakterisasi elektroda yang
4 Hasil dan Pembahasan
 4 Hasil dan Pembahasan Hasil dan pembahasan dari penelitian ini terdiri dari tiga bagian, yaitu karakterisasi elektroda, tahap pengukuran, dan uji keakuratan analisis. Karakterisasi elektroda terdiri dari
4 Hasil dan Pembahasan Hasil dan pembahasan dari penelitian ini terdiri dari tiga bagian, yaitu karakterisasi elektroda, tahap pengukuran, dan uji keakuratan analisis. Karakterisasi elektroda terdiri dari
PEMBUATAN DAN KARAKTERISASI ELEKTRODA Ag/AgCl MENGGUNAKAN LARUTAN KCl
 PEMBUATAN DAN KARAKTERISASI ELEKTRODA Ag/AgCl MENGGUNAKAN LARUTAN KCl FAISAL RAHMAN NIM : 41312120083 PROGRAM STUDI TEKNIK MESIN FAKULTAS TEKNIK UNIVERSITAS MERCU BUANA JAKARTA 2017 LAPORAN TUGAS AKHIR
PEMBUATAN DAN KARAKTERISASI ELEKTRODA Ag/AgCl MENGGUNAKAN LARUTAN KCl FAISAL RAHMAN NIM : 41312120083 PROGRAM STUDI TEKNIK MESIN FAKULTAS TEKNIK UNIVERSITAS MERCU BUANA JAKARTA 2017 LAPORAN TUGAS AKHIR
BAB IV METODE PENELITIAN. Penelitian dilaksanakan di Laboratorium Penelitian Program Studi
 34 BAB IV METODE PENELITIAN 4.1 Lokasi dan Waktu Penelitian 4.1.1 Lokasi Penelitian dilaksanakan di Laboratorium Penelitian Program Studi Magister Kimia Terapan Universitas Udayana. 4.1.2 Waktu Penelitian
34 BAB IV METODE PENELITIAN 4.1 Lokasi dan Waktu Penelitian 4.1.1 Lokasi Penelitian dilaksanakan di Laboratorium Penelitian Program Studi Magister Kimia Terapan Universitas Udayana. 4.1.2 Waktu Penelitian
2 Tinjauan Pustaka. 2.1 Teknik Voltametri dan Modifikasi Elektroda
 2 Tinjauan Pustaka 2.1 Teknik Voltametri dan Modifikasi Elektroda Teknik elektrometri telah dikenal luas sebagai salah satu jenis teknik analisis. Jenis teknik elektrometri yang sering digunakan untuk
2 Tinjauan Pustaka 2.1 Teknik Voltametri dan Modifikasi Elektroda Teknik elektrometri telah dikenal luas sebagai salah satu jenis teknik analisis. Jenis teknik elektrometri yang sering digunakan untuk
3 Metodologi Penelitian
 3 Metodologi Penelitian 3.1 Tahapan Penelitian Penelitian ini bertujuan mengembangkan metoda analisis menggunaan elektroda pasta karbon untuk penentuan p-nitofenol Secara umum penelitian ini dibagi menjadi
3 Metodologi Penelitian 3.1 Tahapan Penelitian Penelitian ini bertujuan mengembangkan metoda analisis menggunaan elektroda pasta karbon untuk penentuan p-nitofenol Secara umum penelitian ini dibagi menjadi
IV. HASIL DAN PEMBAHASAN. A. Analisis Voltammogram Siklik Senyawa Klorambusil
 24 IV. HASIL DAN PEMBAHASAN A. Analisis Voltammogram Siklik Senyawa Klorambusil 1. Pembuatan voltammogram siklik senyawa klorambusil menggunakan perangkat lunak Polar 4.2 Voltammogram siklik senyawa klorambusil
24 IV. HASIL DAN PEMBAHASAN A. Analisis Voltammogram Siklik Senyawa Klorambusil 1. Pembuatan voltammogram siklik senyawa klorambusil menggunakan perangkat lunak Polar 4.2 Voltammogram siklik senyawa klorambusil
TINJAUAN PUSTAKA. uap yang rendah bersifat racun dengan rumus (C 6 H 5 ) 3 SnCl. Senyawa ini mudah
 II. TINJAUAN PUSTAKA A. Trifeniltimah(IV) Klorida Trifeniltimah(IV) klorida merupakan senyawa padatan berwarna dengan tekanan uap yang rendah bersifat racun dengan rumus (C 6 H 5 ) 3 SnCl. Senyawa ini
II. TINJAUAN PUSTAKA A. Trifeniltimah(IV) Klorida Trifeniltimah(IV) klorida merupakan senyawa padatan berwarna dengan tekanan uap yang rendah bersifat racun dengan rumus (C 6 H 5 ) 3 SnCl. Senyawa ini
BAB IV HASIL DAN PEMBAHASAN
 BAB IV HASIL DAN PEMBAHASAN 4.1 Karakterisasi Elektroda di Larutan Elektrolit Pendukung Elektroda pasta karbon yang dimodifikasi dengan silika dan lapis tipis raksa dikarakterisasi di larutan elektrolit
BAB IV HASIL DAN PEMBAHASAN 4.1 Karakterisasi Elektroda di Larutan Elektrolit Pendukung Elektroda pasta karbon yang dimodifikasi dengan silika dan lapis tipis raksa dikarakterisasi di larutan elektrolit
Senin, 26 Maret Anita Muji Rahayu Pembimbing : Dr. rer. nat. Fredy Kurniawan, M.Si
 Senin, 26 Maret 2012 Anita Muji Rahayu 1408100073 Pembimbing : Dr. rer. nat. Fredy Kurniawan, M.Si Sistematika Pendahuluan Metodologi Hasil dan Pembahasan Kesimpulan PENDAHULUAN Kromium Pencemaran Logam
Senin, 26 Maret 2012 Anita Muji Rahayu 1408100073 Pembimbing : Dr. rer. nat. Fredy Kurniawan, M.Si Sistematika Pendahuluan Metodologi Hasil dan Pembahasan Kesimpulan PENDAHULUAN Kromium Pencemaran Logam
PEMBUATAN ELEKTRODA PASTA KARBON TERMODIFIKASI ZEOLIT UNTUK ANALISIS LOGAM
 PEMBUATAN ELEKTRODA PASTA KARBON TERMODIFIKASI ZEOLIT UNTUK ANALISIS LOGAM Fe(II) DENGAN ION PENGGANGGU Zn(II) DAN Cd(II) SECARA CYCLIC STRIPPING VOLTAMMETRY MANUFACTURE OF ZEOLITE MODIFIED CARBON PASTE
PEMBUATAN ELEKTRODA PASTA KARBON TERMODIFIKASI ZEOLIT UNTUK ANALISIS LOGAM Fe(II) DENGAN ION PENGGANGGU Zn(II) DAN Cd(II) SECARA CYCLIC STRIPPING VOLTAMMETRY MANUFACTURE OF ZEOLITE MODIFIED CARBON PASTE
BAB V HASIL DAN PEMBAHASAN
 BAB V HASIL DAN PEMBAHASAN Penelitian studi voltametri siklik asam urat dengan menggunakan elektroda nikel sebagai elektroda kerja ini bertujuan untuk mengetahui berbagai pengaruh dari parameter yang ada
BAB V HASIL DAN PEMBAHASAN Penelitian studi voltametri siklik asam urat dengan menggunakan elektroda nikel sebagai elektroda kerja ini bertujuan untuk mengetahui berbagai pengaruh dari parameter yang ada
4 Hasil dan Pembahasan
 4 Hasil dan Pembahasan 4.1 Karakterisasi Elektroda Berdasarkan penelitian sebelumnya, komposisi optimum untuk elektroda pasta karbon yaitu grafit:parafin adalah 7:3 dan komposisi ini juga yang digunakan
4 Hasil dan Pembahasan 4.1 Karakterisasi Elektroda Berdasarkan penelitian sebelumnya, komposisi optimum untuk elektroda pasta karbon yaitu grafit:parafin adalah 7:3 dan komposisi ini juga yang digunakan
BAB V HASIL DAN PEMBAHASAN Karakterisasi Elektroda Pembanding Ag/AgCl
 BAB V HASIL DAN PEMBAHASAN 5.1. Karakterisasi Elektroda Pembanding Ag/AgCl Elektroda pembanding Ag/AgCl yang telah dibuat ditampilkan seperti pada Gambar 5.1. Gambar 5.1 Elektroda pembanding Ag/AgCl Voltamogram
BAB V HASIL DAN PEMBAHASAN 5.1. Karakterisasi Elektroda Pembanding Ag/AgCl Elektroda pembanding Ag/AgCl yang telah dibuat ditampilkan seperti pada Gambar 5.1. Gambar 5.1 Elektroda pembanding Ag/AgCl Voltamogram
BAB 4 HASIL DAN PEMBAHASAN
 BAB 4 HASIL DAN PEMBAHASAN 4.1 Karakterisasi Elektroda di Larutan Elektrolit Pendukung Elektroda pasta karbon lapis tipis bismut yang dimodifikasi dengan silika dikarakterisasi di larutan elektrolit pendukung
BAB 4 HASIL DAN PEMBAHASAN 4.1 Karakterisasi Elektroda di Larutan Elektrolit Pendukung Elektroda pasta karbon lapis tipis bismut yang dimodifikasi dengan silika dikarakterisasi di larutan elektrolit pendukung
ANALISIS LOGAM Fe(II) DALAM SAMPEL AIR SUNGAI X DENGAN ELEKTRODA PASTA KARBON TERMODIFIKASI ZEOLIT SECARA CYCLIC STRIPPING VOLTAMMETRY STANDAR ADISI
 ANALISIS LOGAM Fe(II) DALAM SAMPEL AIR SUNGAI X DENGAN ELEKTRODA PASTA KARBON TERMODIFIKASI ZEOLIT SECARA CYCLIC STRIPPING VOLTAMMETRY STANDAR ADISI ANALYSIS OF Fe(II) IN THE RIVER WATER SAMPLES X WITH
ANALISIS LOGAM Fe(II) DALAM SAMPEL AIR SUNGAI X DENGAN ELEKTRODA PASTA KARBON TERMODIFIKASI ZEOLIT SECARA CYCLIC STRIPPING VOLTAMMETRY STANDAR ADISI ANALYSIS OF Fe(II) IN THE RIVER WATER SAMPLES X WITH
III. METODOLOGI PENELITIAN. Penelitian ini dilaksanakan pada bulan Maret sampai Agustus 2014 di
 23 III. METODOLOGI PENELITIAN A. Waktu dan Tempat Penelitian Penelitian ini dilaksanakan pada bulan Maret sampai Agustus 2014 di Laboratorium Kimia Analitik FMIPA Universitas Lampung. B. Alat dan Bahan
23 III. METODOLOGI PENELITIAN A. Waktu dan Tempat Penelitian Penelitian ini dilaksanakan pada bulan Maret sampai Agustus 2014 di Laboratorium Kimia Analitik FMIPA Universitas Lampung. B. Alat dan Bahan
BAB III DASAR TEORI. mengalami pengkristalan dan dapat menimbulkan gout. Asam urat mempunyai peran
 9 BAB III DASAR TEORI 3.1 Asam Urat Asam urat (uric acid) adalah senyawa turunan purina dengan rumus kimia C5H4N4O3 dan rasio plasma antara 3,6 mg/dl (~214 µmol/l) dan 8,3 mg/dl (~494 µmol/l) (1 mg/dl
9 BAB III DASAR TEORI 3.1 Asam Urat Asam urat (uric acid) adalah senyawa turunan purina dengan rumus kimia C5H4N4O3 dan rasio plasma antara 3,6 mg/dl (~214 µmol/l) dan 8,3 mg/dl (~494 µmol/l) (1 mg/dl
PENENTUAN KADAR Cd(II) PADA LIMBAH PABRIK MENGGUNAKAN ELEKTRODA PASTA KARBON TERMODIFIKASI ZEOLIT SECARA CYCLIC STRIPPING VOLTAMETRY
 PENENTUAN KADAR Cd(II) PADA LIMBAH PABRIK MENGGUNAKAN ELEKTRODA PASTA KARBON TERMODIFIKASI ZEOLIT SECARA CYCLIC STRIPPING VOLTAMETRY DETERMINATION OF Cd(II) AT WASTE OF FACTORY USING CARBON ELECTRODE PASTA
PENENTUAN KADAR Cd(II) PADA LIMBAH PABRIK MENGGUNAKAN ELEKTRODA PASTA KARBON TERMODIFIKASI ZEOLIT SECARA CYCLIC STRIPPING VOLTAMETRY DETERMINATION OF Cd(II) AT WASTE OF FACTORY USING CARBON ELECTRODE PASTA
STUDI VOLTAMETRI SIKLIK SODIUM DEDOCYL BENZEN SULFONAT DALAM BERBAGAI ELEKTRODA DAN ELEKTROLIT PENDUKUNG
 Jurnal Teknologi Pengelolaan Limbah (Journal of Waste Management Technology), ISSN 1410-9565 Volume 15 Nomor 1, Juli 2012 (Volume 15, Number 1, July, 2012) Pusat Teknologi Limbah Radioaktif (Radioactive
Jurnal Teknologi Pengelolaan Limbah (Journal of Waste Management Technology), ISSN 1410-9565 Volume 15 Nomor 1, Juli 2012 (Volume 15, Number 1, July, 2012) Pusat Teknologi Limbah Radioaktif (Radioactive
BAB II TINJAUAN PUSTAKA
 BAB II TINJAUAN PUSTAKA 2.1 Teknik Voltametri Teknik voltametri digunakan untuk menganalisis analit berdasarkan pengukuran arus sebagai fungsi potensial. Hubungan antara arus terhadap potensial divisualisasikan
BAB II TINJAUAN PUSTAKA 2.1 Teknik Voltametri Teknik voltametri digunakan untuk menganalisis analit berdasarkan pengukuran arus sebagai fungsi potensial. Hubungan antara arus terhadap potensial divisualisasikan
BAB II TINJAUAN PUSTAKA
 5 BAB II TINJAUAN PUSTAKA 2.1 PENDAHULUAN Pada bab ini akan menjelaskan teori tentang analisis elektrokimia, sel elektrokimia, larutan elektrolit, jenis jenis elektroda, potensiometri, voltammetri, potentiostatic
5 BAB II TINJAUAN PUSTAKA 2.1 PENDAHULUAN Pada bab ini akan menjelaskan teori tentang analisis elektrokimia, sel elektrokimia, larutan elektrolit, jenis jenis elektroda, potensiometri, voltammetri, potentiostatic
STUDY OF LYSINE AND ALANINE DELIVERANCE THROUGH POLYPYRROLE MEMBRANE
 186 STUDY OF LYSINE AND ALANINE DELIVERANCE THROUGH POLYPYRROLE MEMBRANE Studi Penghantaran Lisin dan Alanin melalui Membran Polipirol Adhitasari Suratman Chemistry Department, Faculty of Mathematics and
186 STUDY OF LYSINE AND ALANINE DELIVERANCE THROUGH POLYPYRROLE MEMBRANE Studi Penghantaran Lisin dan Alanin melalui Membran Polipirol Adhitasari Suratman Chemistry Department, Faculty of Mathematics and
PENENTUAN KADAR FENOL PADA AIR SUNGAI SECARA CYCLIC STRIPPING VOLTAMMETRY DENGAN MENGGUNAKAN ELEKTRODA PASTA KARBON TERMODIFIKASI ZEOLIT
 PENENTUAN KADAR FENOL PADA AIR SUNGAI SECARA CYCLIC STRIPPING VOLTAMMETRY DENGAN MENGGUNAKAN ELEKTRODA PASTA KARBON TERMODIFIKASI ZEOLIT DETERMINATION OF PHENOL ON THE RIVER WATER BY CYCLIC STRIPPING VOLTAMMETRY
PENENTUAN KADAR FENOL PADA AIR SUNGAI SECARA CYCLIC STRIPPING VOLTAMMETRY DENGAN MENGGUNAKAN ELEKTRODA PASTA KARBON TERMODIFIKASI ZEOLIT DETERMINATION OF PHENOL ON THE RIVER WATER BY CYCLIC STRIPPING VOLTAMMETRY
VOLTAMETRI PULSA DIFERENSIAL UNTUK PENENTUAN METAMFETAMIN MENGGUNAKAN MEMBRAN POLIANILIN : PENGARUH ph DAN ELEKTROLIT PENDUKUNG
 VOLTAMETRI PULSA DIFERENSIAL UNTUK PENENTUAN METAMFETAMIN MENGGUNAKAN MEMBRAN POLIANILIN : PENGARUH ph DAN ELEKTROLIT PENDUKUNG Irdhawati 1, Indra Noviandri 2, Buchari 2 1. Laboratorium Kimia Analitik,
VOLTAMETRI PULSA DIFERENSIAL UNTUK PENENTUAN METAMFETAMIN MENGGUNAKAN MEMBRAN POLIANILIN : PENGARUH ph DAN ELEKTROLIT PENDUKUNG Irdhawati 1, Indra Noviandri 2, Buchari 2 1. Laboratorium Kimia Analitik,
PENENTUAN TETAPAN SELEKTIVITAS ELEKTRODA SELEKTIF ION SISTEM POTENSIOMETRI DENGAN METODE MPM**) Suyanta a, *
 1 PENENTUAN TETAPAN SELEKTIVITAS ELEKTRODA SELEKTIF ION SISTEM POTENSIOMETRI DENGAN METODE MPM**) Suyanta a, * Abstract Penentuan tetapan selektivitas elektroda selektif ion dengan menggunakan metode larutan
1 PENENTUAN TETAPAN SELEKTIVITAS ELEKTRODA SELEKTIF ION SISTEM POTENSIOMETRI DENGAN METODE MPM**) Suyanta a, * Abstract Penentuan tetapan selektivitas elektroda selektif ion dengan menggunakan metode larutan
Bab I Pendahuluan I.1 Deskripsi Topik Penelitian dan Latar Belakang
 Bab I Pendahuluan I.1 Deskripsi Topik Penelitian dan Latar Belakang Setiap tahun produksi dan penggunaan surfaktan di dunia mencapai beberapa juta ton, 70% di antaranya adalah surfaktan anionik yang digunakan
Bab I Pendahuluan I.1 Deskripsi Topik Penelitian dan Latar Belakang Setiap tahun produksi dan penggunaan surfaktan di dunia mencapai beberapa juta ton, 70% di antaranya adalah surfaktan anionik yang digunakan
3 METODOLOGI PENELITIAN
 3 METODOLOGI PENELITIAN Penelitian ini bertujuan untuk modifikasi elektroda pasta karbon menggunakan zeolit, serbuk kayu, serta mediator tertentu. Modifikasi tersebut diharapkan mampu menunjukkan sifat
3 METODOLOGI PENELITIAN Penelitian ini bertujuan untuk modifikasi elektroda pasta karbon menggunakan zeolit, serbuk kayu, serta mediator tertentu. Modifikasi tersebut diharapkan mampu menunjukkan sifat
BAB II KAJIAN PUSTAKA. Asam askorbat atau vitamin C memiliki nama sistematis IUPAC (5R)-
 BAB II KAJIAN PUSTAKA 2.1. Asam Askorbat Asam askorbat atau vitamin C memiliki nama sistematis IUPAC (5R)- [(1S)-1,2-dihidroksetil]-3,dihidroksifuran-2(5)-on. Rumus kimia vitamin C adalah C 6 8 6 dengan
BAB II KAJIAN PUSTAKA 2.1. Asam Askorbat Asam askorbat atau vitamin C memiliki nama sistematis IUPAC (5R)- [(1S)-1,2-dihidroksetil]-3,dihidroksifuran-2(5)-on. Rumus kimia vitamin C adalah C 6 8 6 dengan
Bab IV Hasil Penelitian dan Pembahasan
 Bab IV asil Penelitian dan Pembahasan IV.1 Pelapisan Elektrode dengan Polipirol Dalam penelitian ini dibuat elektrode kawat emas terlapis polipirol dengan tiga jenis ionofor untuk penentuan surfaktan ads,
Bab IV asil Penelitian dan Pembahasan IV.1 Pelapisan Elektrode dengan Polipirol Dalam penelitian ini dibuat elektrode kawat emas terlapis polipirol dengan tiga jenis ionofor untuk penentuan surfaktan ads,
PENYUSUN : 1. Eka Yuli Astuti ( ) 2. Lia Ariesta Ifron ( ) PEMBIMBING : Prof. Dr. Ir. Heru Setyawan, M.Eng
 PENYUSUN : 1. Eka Yuli Astuti (2307 100 078) 2. Lia Ariesta Ifron (2307 100 106) PEMBIMBING : Prof. Dr. Ir. Heru Setyawan, M.Eng LABORATORIUM ELEKTROKIMIA dan KOROSI JURUSAN TEKNIK KIMIA FAKULTAS TEKNOLOGI
PENYUSUN : 1. Eka Yuli Astuti (2307 100 078) 2. Lia Ariesta Ifron (2307 100 106) PEMBIMBING : Prof. Dr. Ir. Heru Setyawan, M.Eng LABORATORIUM ELEKTROKIMIA dan KOROSI JURUSAN TEKNIK KIMIA FAKULTAS TEKNOLOGI
III. METODOLOGI PENELITIAN. Penelitian ini dilaksanakan pada bulan Juli - September 2010, bertempat di
 17 III. METODOLOGI PENELITIAN A. Waktu dan Tempat Penelitian Penelitian ini dilaksanakan pada bulan Juli - September 2010, bertempat di Laboratorium Kimia Analitik Jurusan Kimia Fakultas MIPA Universitas
17 III. METODOLOGI PENELITIAN A. Waktu dan Tempat Penelitian Penelitian ini dilaksanakan pada bulan Juli - September 2010, bertempat di Laboratorium Kimia Analitik Jurusan Kimia Fakultas MIPA Universitas
PENGGUNAAN ZEOLIT SEBAGAI MODIFIER ELEKTRODA PASTA KARBON UNTUK ANALISIS Cd (II) SECARA CYCLIC STRIPPING VOLTAMETRY
 PENGGUNAAN ZEOLIT SEBAGAI MODIFIER ELEKTRODA PASTA KARBON UNTUK ANALISIS Cd (II) SECARA CYCLIC STRIPPING VOLTAMETRY USE ZEOLITE AS MODIFIER CARBON ELECTRODE PASTA FOR ANALYSIS Cd (II) IN CYCLIC STRIPPING
PENGGUNAAN ZEOLIT SEBAGAI MODIFIER ELEKTRODA PASTA KARBON UNTUK ANALISIS Cd (II) SECARA CYCLIC STRIPPING VOLTAMETRY USE ZEOLITE AS MODIFIER CARBON ELECTRODE PASTA FOR ANALYSIS Cd (II) IN CYCLIC STRIPPING
METODOLOGI PENELITIAN. Penelitian ini dilakukan pada bulan November 2011 sampai dengan Maret 2012 di
 23 III. METODOLOGI PENELITIAN A. Waktu dan Tempat Penelitian Penelitian ini dilakukan pada bulan November 2011 sampai dengan Maret 2012 di Laboratorium Kimia Analitik dan Laboratorium Kimia Anorganik Jurusan
23 III. METODOLOGI PENELITIAN A. Waktu dan Tempat Penelitian Penelitian ini dilakukan pada bulan November 2011 sampai dengan Maret 2012 di Laboratorium Kimia Analitik dan Laboratorium Kimia Anorganik Jurusan
HASIL DAN PEMBAHASAN. Gambar 2 Skema Pembuatan elektrode pasta karbon.
 3 Pasta dimasukkan ke ujung tabung hingga penuh dan padat. Permukaan elektrode dihaluskan menggunakan ampelas halus dan kertas minyak hingga licin dan berkilau (Gambar 2). Gambar 2 Skema Pembuatan elektrode
3 Pasta dimasukkan ke ujung tabung hingga penuh dan padat. Permukaan elektrode dihaluskan menggunakan ampelas halus dan kertas minyak hingga licin dan berkilau (Gambar 2). Gambar 2 Skema Pembuatan elektrode
3. Pada konsentrasi 6 ppm. 4.5 Pengukuran Senyawa Uji yang Berpotensi Aktif Antimalaria
 4.5 Pengukuran Senyawa Uji yang Berpotensi Aktif Antimalaria 4.1.1 Cinchona base Pengukuran senyawa antimalaria cinchona base menggunakan metode voltametri siklis dilakukan menggunakan elektroda kerja
4.5 Pengukuran Senyawa Uji yang Berpotensi Aktif Antimalaria 4.1.1 Cinchona base Pengukuran senyawa antimalaria cinchona base menggunakan metode voltametri siklis dilakukan menggunakan elektroda kerja
Prosiding Skripsi Semester Genap 2009/2010. PEMBUATAN ELEKTRODA PEMBANDING Ag/AgCl DENGAN MENGGUNAKAN MEMBRAN KOMPOSIT KARBON-ROTAN
 Prosiding Skripsi Semester Genap 2009/2010 SK-091304 PEMBUATAN ELEKTRODA PEMBANDING Ag/AgCl DENGAN MENGGUNAKAN MEMBRAN KOMPOSIT KARBON-ROTAN Miftachul Huda*, Fredy Kurniawan 1, Suprapto 1 Jurusan Kimia
Prosiding Skripsi Semester Genap 2009/2010 SK-091304 PEMBUATAN ELEKTRODA PEMBANDING Ag/AgCl DENGAN MENGGUNAKAN MEMBRAN KOMPOSIT KARBON-ROTAN Miftachul Huda*, Fredy Kurniawan 1, Suprapto 1 Jurusan Kimia
2 Tinjauan Pustaka. 2.1 Teknik Voltametri
 2 Tinjauan Pustaka 2.1 Teknik Voltametri Teknik voltametri adalah salah satu teknik analisis yang sering digunakan di bidang kimia analitik. Pada teknik ini, arus dari elektroda kerja diukur sebagai fungsi
2 Tinjauan Pustaka 2.1 Teknik Voltametri Teknik voltametri adalah salah satu teknik analisis yang sering digunakan di bidang kimia analitik. Pada teknik ini, arus dari elektroda kerja diukur sebagai fungsi
Bab III Metodologi Penelitian
 Bab III Metodologi Penelitian III.1 Deskripsi Cara Penelitian Penelitian ini dilakukan mulai dari tahap penelusuran literatur pendukung, perumusan topik, percobaan secara laboratorium dan penyusunan disertasi.
Bab III Metodologi Penelitian III.1 Deskripsi Cara Penelitian Penelitian ini dilakukan mulai dari tahap penelusuran literatur pendukung, perumusan topik, percobaan secara laboratorium dan penyusunan disertasi.
PEMBUATAN ELEKTRODA PASTA KARBON TERMODIFIKASI KITOSAN UNTUK ANALISIS Cr(VI) SECARA CYCLIC STRIPPING VOLTAMMETRY
 PEMBUATAN ELEKTRODA PASTA KARBON TERMODIFIKASI KITOSAN UNTUK ANALISIS Cr(VI) SECARA CYCLIC STRIPPING VOLTAMMETRY MANUFACTURE OF CHITOSAN MODIFIED CARBON PASTE ELECTRODE FOR THE ANALYSIS OF Cr(VI) IN CYCLIC
PEMBUATAN ELEKTRODA PASTA KARBON TERMODIFIKASI KITOSAN UNTUK ANALISIS Cr(VI) SECARA CYCLIC STRIPPING VOLTAMMETRY MANUFACTURE OF CHITOSAN MODIFIED CARBON PASTE ELECTRODE FOR THE ANALYSIS OF Cr(VI) IN CYCLIC
HASIL DAN PEMBAHASAN
 HASIL DAN PEMBAHASAN Penumbuhan sel D. radiodurans dan Ekstraksi SOD Bakteri D. radiodurans ditumbuhkan dalam media LB cair selama 48 jam dengan suhu 30 0 C. Setelah 48 jam bakteri dapat dipanen untuk
HASIL DAN PEMBAHASAN Penumbuhan sel D. radiodurans dan Ekstraksi SOD Bakteri D. radiodurans ditumbuhkan dalam media LB cair selama 48 jam dengan suhu 30 0 C. Setelah 48 jam bakteri dapat dipanen untuk
BAB II KAJIAN PUSTAKA. Voltametri adalah metode elektrokimia dimana arus diamati pada
 BAB II KAJIAN PUSTAKA 2.1 Voltametri 2.1.1 Analisis Voltametri Voltametri adalah metode elektrokimia dimana arus diamati pada pemberian potensial tertentu. Voltametri berasal dari kata volt ampero metry.
BAB II KAJIAN PUSTAKA 2.1 Voltametri 2.1.1 Analisis Voltametri Voltametri adalah metode elektrokimia dimana arus diamati pada pemberian potensial tertentu. Voltametri berasal dari kata volt ampero metry.
4 HASIL DAN PEMBAHASAN
 4 HASIL DAN PEMBAHASAN Secara garis besar, penelitian ini terdiri dari tiga tahapan. Tahap yang pertama adalah pembuatan elektroda dan karakterisasi elektroda. Karakterisasi elektroda ini meliputi penentuan
4 HASIL DAN PEMBAHASAN Secara garis besar, penelitian ini terdiri dari tiga tahapan. Tahap yang pertama adalah pembuatan elektroda dan karakterisasi elektroda. Karakterisasi elektroda ini meliputi penentuan
Mekanisme Pembentukan Lapisan ZnO
 Mekanisme Pembentukan Lapisan ZnO Grafik Chrono Amperometry pada berbagai pontensial (-0,5 V hingga -1,5V vs Ag/AgCl) Grafik Chrono Amperometry Elektrodeposisi ITO Glass pada pontensial -0,5 V hingga-1,5v
Mekanisme Pembentukan Lapisan ZnO Grafik Chrono Amperometry pada berbagai pontensial (-0,5 V hingga -1,5V vs Ag/AgCl) Grafik Chrono Amperometry Elektrodeposisi ITO Glass pada pontensial -0,5 V hingga-1,5v
3 Metodologi Penelitian
 3 Metodologi Penelitian Penelitian ini bertujuan untuk mengembangkan metoda analisis dengan menggunakan elektroda yang telah dimodifikasi dengan buah pisang dan buah alpukat untuk menentukan kadar parasetamol.
3 Metodologi Penelitian Penelitian ini bertujuan untuk mengembangkan metoda analisis dengan menggunakan elektroda yang telah dimodifikasi dengan buah pisang dan buah alpukat untuk menentukan kadar parasetamol.
ChOx. Cholesterol + O 2 3one. 4-cholesten- + H 2 O 2. H 2 O 2 O 2 + 2H + + 2e - Gambar 14 Mekanisme reaksi katalisis enzimtik pada kolesterol [37]
![ChOx. Cholesterol + O 2 3one. 4-cholesten- + H 2 O 2. H 2 O 2 O 2 + 2H + + 2e - Gambar 14 Mekanisme reaksi katalisis enzimtik pada kolesterol [37] ChOx. Cholesterol + O 2 3one. 4-cholesten- + H 2 O 2. H 2 O 2 O 2 + 2H + + 2e - Gambar 14 Mekanisme reaksi katalisis enzimtik pada kolesterol [37]](/thumbs/67/57703257.jpg) Cholesterol + O 2 3one ChOx H 2 O 2 O 2 + 2H + + 2e - + H 2 O 2 4-cholesten- Gambar 14 Mekanisme reaksi katalisis enzimtik pada kolesterol [37] Karakterisasi SEM Morfologi permukaan elektroda kerja diobservasi
Cholesterol + O 2 3one ChOx H 2 O 2 O 2 + 2H + + 2e - + H 2 O 2 4-cholesten- Gambar 14 Mekanisme reaksi katalisis enzimtik pada kolesterol [37] Karakterisasi SEM Morfologi permukaan elektroda kerja diobservasi
VOLTAMETRI. Disampaikan pada Kuliah Metode Pemisahan dan Analisis Kimia Pertemuan Ke 7.
 VOLTAMETRI Disampaikan pada Kuliah Metode Pemisahan dan Analisis Kimia Pertemuan Ke 7 siti_marwati@uny.ac.id Definisi Pengembangan metode Polarografi Pengukuran yang dilakukan adalah pengukuran arus sebagai
VOLTAMETRI Disampaikan pada Kuliah Metode Pemisahan dan Analisis Kimia Pertemuan Ke 7 siti_marwati@uny.ac.id Definisi Pengembangan metode Polarografi Pengukuran yang dilakukan adalah pengukuran arus sebagai
III. METODOLOGI PENELITIAN. Penelitian ini dilaksanakan pada bulan Oktober 2011 sampai Maret 2012 di laboratorium
 III. METODOLOGI PENELITIAN A. Waktu dan Tempat Penelitian Penelitian ini dilaksanakan pada bulan Oktober 2011 sampai Maret 2012 di laboratorium Kimia Analitik dan laboratorium Kimia Anorganik Fakultas
III. METODOLOGI PENELITIAN A. Waktu dan Tempat Penelitian Penelitian ini dilaksanakan pada bulan Oktober 2011 sampai Maret 2012 di laboratorium Kimia Analitik dan laboratorium Kimia Anorganik Fakultas
 1 PENDAHULUAN Perkembangan ilmu pengetahuan dan teknologi mulai abad 20, memberikan dampak positif dalam hal kemudahan akses disegala bidang serta dampak negatif berkaitan dengan menurunnya kualitas lingkungan
1 PENDAHULUAN Perkembangan ilmu pengetahuan dan teknologi mulai abad 20, memberikan dampak positif dalam hal kemudahan akses disegala bidang serta dampak negatif berkaitan dengan menurunnya kualitas lingkungan
PENGEMBANGAN SENSOR OKSIGEN TERLARUT MENGGUNAKAN ELEKTRODA KERJA KARBON-PALADIUM (C-Pd) SECARA VOLTAMMETRI SIKLIK SKRIPSI
 PENGEMBANGAN SENSOR OKSIGEN TERLARUT MENGGUNAKAN ELEKTRODA KERJA KARBON-PALADIUM (C-Pd) SECARA VOLTAMMETRI SIKLIK SKRIPSI Oleh Mohamad Bayu Setiawan NIM 101810301041 JURUSAN KIMIA FAKULTAS MATEMATIKA DAN
PENGEMBANGAN SENSOR OKSIGEN TERLARUT MENGGUNAKAN ELEKTRODA KERJA KARBON-PALADIUM (C-Pd) SECARA VOLTAMMETRI SIKLIK SKRIPSI Oleh Mohamad Bayu Setiawan NIM 101810301041 JURUSAN KIMIA FAKULTAS MATEMATIKA DAN
BAB I PENDAHULUAN A. Latar Belakang Masalah
 BAB I PENDAHULUAN A. Latar Belakang Masalah Voltametri adalah salah satu metode elektroanalitik dimana informasi mengenai analit diperoleh dari pengukuran arus sebagai fungsi dari potensial yang diterapkan.
BAB I PENDAHULUAN A. Latar Belakang Masalah Voltametri adalah salah satu metode elektroanalitik dimana informasi mengenai analit diperoleh dari pengukuran arus sebagai fungsi dari potensial yang diterapkan.
TITRASI POTENSIOMETRI
 TITRASI PTENSIMETRI TITRASI PTENSIMETRI I. TUJUAN PERCBAAN Menentukan titik ekivalen secara potensiometri. II. DASAR TERI Suatu eksperimen dapat diukur dengan menggunakan dua metode yaitu, pertama (potensiometri
TITRASI PTENSIMETRI TITRASI PTENSIMETRI I. TUJUAN PERCBAAN Menentukan titik ekivalen secara potensiometri. II. DASAR TERI Suatu eksperimen dapat diukur dengan menggunakan dua metode yaitu, pertama (potensiometri
Fabrikasi Elektroda Pembanding Ag/AgCl dengan Berbagai Membran
 AKTA KIMIA INDONESIA Akta Kimindo Vol. 2(1), 217: 7-78 Fabrikasi Elektroda Pembanding Ag/AgCl dengan Berbagai Membran Maryanto, A 1 ; Kurniawan, F 1* 1 Departemen Kimia, Institut Teknologi Sepuluh Nopember,
AKTA KIMIA INDONESIA Akta Kimindo Vol. 2(1), 217: 7-78 Fabrikasi Elektroda Pembanding Ag/AgCl dengan Berbagai Membran Maryanto, A 1 ; Kurniawan, F 1* 1 Departemen Kimia, Institut Teknologi Sepuluh Nopember,
SKRIPSI. Oleh : Vivi Andriani NIM Dosen Pembimbing Utama : Drs. SISWOYO, M.Sc., PhD. Dosen Pembimbing Anggota : Drs. ZULFIKAR, PhD.
 SKRIPSI PENGEMBANGAN SENSOR VOLTAMETRI N 2 O DENGAN Vivi Andriani NIM 031810301047 Dosen Pembimbing Utama : Drs. SISWOYO, M.Sc., PhD. Dosen Pembimbing Anggota : Drs. ZULFIKAR, PhD. PENGEMBANGAN SENSOR
SKRIPSI PENGEMBANGAN SENSOR VOLTAMETRI N 2 O DENGAN Vivi Andriani NIM 031810301047 Dosen Pembimbing Utama : Drs. SISWOYO, M.Sc., PhD. Dosen Pembimbing Anggota : Drs. ZULFIKAR, PhD. PENGEMBANGAN SENSOR
SILVER RECYCLING FROM PHOTO-PROCESSING WASTE USING ELECTRODEPOSITION METHOD
 12 SILVER RECYCLING FROM PHOTO-PROCESSING WASTE USING ELECTRODEPOSITION METHOD Pengambilan Perak dari Limbah Pencuci Film Melalui Pengendapan Elektrolitik Mochammad Feri Hadiyanto, Agus Kuncaka Chemistry
12 SILVER RECYCLING FROM PHOTO-PROCESSING WASTE USING ELECTRODEPOSITION METHOD Pengambilan Perak dari Limbah Pencuci Film Melalui Pengendapan Elektrolitik Mochammad Feri Hadiyanto, Agus Kuncaka Chemistry
BAB IV METODE PENELITIAN
 BAB IV METODE PENELITIAN 4.1 Alat-Alat yang Digunakan 1. Gelas beker 100 ml 2. Pipet ukur 10 ml 3. Pipet ukur 5 ml 4. Pipet tetes 5. Gelas arloji 6. Pengaduk kaca 7. Labu takar 100 ml 8. Labu takar 250
BAB IV METODE PENELITIAN 4.1 Alat-Alat yang Digunakan 1. Gelas beker 100 ml 2. Pipet ukur 10 ml 3. Pipet ukur 5 ml 4. Pipet tetes 5. Gelas arloji 6. Pengaduk kaca 7. Labu takar 100 ml 8. Labu takar 250
BAB 2 TINJAUAN PUSTAKA
 BAB 2 TINJAUAN PUSTAKA 2.1 Voltametri Voltametri merupakan salah satu teknik analisis yang didasarkan pada pengukuran arus sebagai fungsi dari potensial. Timbulnya arus disebabkan oleh adanya reaksi oksidasi
BAB 2 TINJAUAN PUSTAKA 2.1 Voltametri Voltametri merupakan salah satu teknik analisis yang didasarkan pada pengukuran arus sebagai fungsi dari potensial. Timbulnya arus disebabkan oleh adanya reaksi oksidasi
Kata Kunci: Elektroda pasta karbon termodifikasi kitosan, Cr(VI), Fe(II), Zn(II), Voltametri
 UNESA Journal of Chemistry Vol. 3, No. 3, September 214 PEMBUATAN ELEKTRODA PASTA KARBON TERMODIFIKASI KITOSAN UNTUK ANALISIS LOGAM Cr(VI) DENGAN ION PENGGANGGU Fe(II) DAN Zn(II) SECARA CYCLIC STRIPPING
UNESA Journal of Chemistry Vol. 3, No. 3, September 214 PEMBUATAN ELEKTRODA PASTA KARBON TERMODIFIKASI KITOSAN UNTUK ANALISIS LOGAM Cr(VI) DENGAN ION PENGGANGGU Fe(II) DAN Zn(II) SECARA CYCLIC STRIPPING
PENGARUH AMOBILISASI ENZIM GLUKOSA OKSIDASE (GOD) PADA ELEKTRODA KAWAT PLATINA
 J. Sains MIPA, Edisi Khusus Tahun 2007, Vol. 13, No. 2, Hal.: 169-174 ISSN 1978-1873 PENGARUH AMOBILISASI ENZIM GLUKOSA OKSIDASE (GOD) PADA ELEKTRODA KAWAT PLATINA Ratu Betta Rudibyani Jurusan P.MIPA,
J. Sains MIPA, Edisi Khusus Tahun 2007, Vol. 13, No. 2, Hal.: 169-174 ISSN 1978-1873 PENGARUH AMOBILISASI ENZIM GLUKOSA OKSIDASE (GOD) PADA ELEKTRODA KAWAT PLATINA Ratu Betta Rudibyani Jurusan P.MIPA,
BAB IV METODE PENELITIAN
 18 BAB IV METODE PENELITIAN 4.1 Alat-Alat yang Digunakan 1. Kaca arloji 2. Spatula 3. Sendok sungu 4. Gelas beker 250 ml 5. Gelas beker 100 ml 6. Labu takar 250 ml 7. Labu takar 100 ml 8. Labu takar 25
18 BAB IV METODE PENELITIAN 4.1 Alat-Alat yang Digunakan 1. Kaca arloji 2. Spatula 3. Sendok sungu 4. Gelas beker 250 ml 5. Gelas beker 100 ml 6. Labu takar 250 ml 7. Labu takar 100 ml 8. Labu takar 25
II. TINJAUAN PUSTAKA. memiliki sifat antikanker karena efek sitotoksiknya terhadap sel kanker. Zat
 II. TINJAUAN PUSTAKA A. Senyawa Klorambusil Klorambusil merupakan salah satu zat pengalkil, yaitu kelompok senyawa yang memiliki sifat antikanker karena efek sitotoksiknya terhadap sel kanker. Zat pengalkil
II. TINJAUAN PUSTAKA A. Senyawa Klorambusil Klorambusil merupakan salah satu zat pengalkil, yaitu kelompok senyawa yang memiliki sifat antikanker karena efek sitotoksiknya terhadap sel kanker. Zat pengalkil
Penggunaan Elektroda Pasta Karbon Termodifikasi Kurkumin untuk Analisis Timbal (Ii) Secara Stripping Voltammetry
 Termodifikasi Kurkumin untuk Analisis Timbal (Ii) Secara Stripping Voltammetry Sri Hastuti 1, Abu Masykur 2, Rini Apriliani 1 1 Jurusan Pendidikan Kimia FPMIPA, 2 Jurusan Kimia FMIPA Universitas Sebelas
Termodifikasi Kurkumin untuk Analisis Timbal (Ii) Secara Stripping Voltammetry Sri Hastuti 1, Abu Masykur 2, Rini Apriliani 1 1 Jurusan Pendidikan Kimia FPMIPA, 2 Jurusan Kimia FMIPA Universitas Sebelas
BAHAN DAN METODE Bahan dan alat Metode Penumbuhan sel Deinococcus radiodurans dan ekstraksi enzim SOD
 BAHAN DAN METODE Bahan dan alat Alat dan instrumen yang akan digunakan adalah edaq Potensiostat Galvanostat yang dilengkapi perangkat lunak Echem v2.1.0, laminar air flow, inkubator, High Speed Refrigated
BAHAN DAN METODE Bahan dan alat Alat dan instrumen yang akan digunakan adalah edaq Potensiostat Galvanostat yang dilengkapi perangkat lunak Echem v2.1.0, laminar air flow, inkubator, High Speed Refrigated
Irdhawati et al., ALCHEMY Jurnal Penelitian Kimia, Vol. 13 (2017), No. 1, Hal. 1-16
 Irdhawati et al., ALCHEMY Jurnal Penelitian Kimia, Vol. 13 (17), No. 1, Hal. 1-16 PENGGUNAAN ELEKTRODA PASTA KARBON TERMODIFIKASI ZEOLIT UNTUK ANALISIS LOGAM Cu SECARA VOLTAMETRI PELUCUTAN ANODIK ZEOLITE-MODIFIED
Irdhawati et al., ALCHEMY Jurnal Penelitian Kimia, Vol. 13 (17), No. 1, Hal. 1-16 PENGGUNAAN ELEKTRODA PASTA KARBON TERMODIFIKASI ZEOLIT UNTUK ANALISIS LOGAM Cu SECARA VOLTAMETRI PELUCUTAN ANODIK ZEOLITE-MODIFIED
LAPORAN KIMIA ANALITIK KI-2221
 LAPORAN KIMIA ANALITIK KI-2221 Percobaan 5 EKSTRAKSI PELARUT Nama : Nisrina Rizkia NIM : 10510002 Kelompok : 1 Tanggal Percobaan : 20 Maret 2012 Tanggal Laporan : 27 Maret 2012 Asisten Praktikum : Ka Elsi
LAPORAN KIMIA ANALITIK KI-2221 Percobaan 5 EKSTRAKSI PELARUT Nama : Nisrina Rizkia NIM : 10510002 Kelompok : 1 Tanggal Percobaan : 20 Maret 2012 Tanggal Laporan : 27 Maret 2012 Asisten Praktikum : Ka Elsi
PENGARUH VARIASI ph DAN ASAM ASETAT TERHADAP KARAKTERISTIK KOROSI CO 2 BAJA BS 970
 TUGAS AKHIR MM091381 PENGARUH VARIASI ph DAN ASAM ASETAT TERHADAP KARAKTERISTIK KOROSI CO 2 BAJA BS 970 Dosen Pembimbing : Budi Agung Kurniawan, ST., M.Sc Oleh : Inti Sari Puspita Dewi (2707 100 052) Latar
TUGAS AKHIR MM091381 PENGARUH VARIASI ph DAN ASAM ASETAT TERHADAP KARAKTERISTIK KOROSI CO 2 BAJA BS 970 Dosen Pembimbing : Budi Agung Kurniawan, ST., M.Sc Oleh : Inti Sari Puspita Dewi (2707 100 052) Latar
BAB I PENDAHULUAN. penting bagi tubuh (Campbell et al, 2000). Pada saat ini. kosmetik (Motlagh dan Noroozifar, 2003). Oleh karena itu metode analisis
 BAB I PENDAHULUAN 1.1. Latar Belakang Asam askorbat atau lebih dikenal dengan nama vitamin C merupakan nutrisi yang penting bagi tubuh (Campbell et al, 2000). Pada saat ini penggunaannya sangat luas terutama
BAB I PENDAHULUAN 1.1. Latar Belakang Asam askorbat atau lebih dikenal dengan nama vitamin C merupakan nutrisi yang penting bagi tubuh (Campbell et al, 2000). Pada saat ini penggunaannya sangat luas terutama
KIMIA ANALITIK (Kode : B-13)
 MAKALAH PENDAMPING KIMIA ANALITIK (Kode : B-13) ISBN : 978-979-1533-85-0 ELEKTRODA KARBON TERMODIFIKASI POLIPIROL/EKSTRAK Brassica chinensis L. UNTUK PENENTUAN RHODAMIN B MENGGUNAKAN TEKNIK VOLTAMETRI
MAKALAH PENDAMPING KIMIA ANALITIK (Kode : B-13) ISBN : 978-979-1533-85-0 ELEKTRODA KARBON TERMODIFIKASI POLIPIROL/EKSTRAK Brassica chinensis L. UNTUK PENENTUAN RHODAMIN B MENGGUNAKAN TEKNIK VOLTAMETRI
Studi Elektrokimia Sistem Fe(III)/Fe(II) dalam Lelehan KOH secara Voltametri Siklis
 Jurnal Matematika dan Sains Vol. 9 No. 1, Maret 2004, hal 193 197 Studi Elektrokimia Sistem Fe(III)/Fe(II) dalam Lelehan KOH secara Voltametri Siklis Buchari dan Suprapto Departemen Kimia, FMIPA ITB. Jalan
Jurnal Matematika dan Sains Vol. 9 No. 1, Maret 2004, hal 193 197 Studi Elektrokimia Sistem Fe(III)/Fe(II) dalam Lelehan KOH secara Voltametri Siklis Buchari dan Suprapto Departemen Kimia, FMIPA ITB. Jalan
Diperiksa Oleh : Dr. H. Wahyu Sopandi, M.A. (Ketua Program Studi Pend. Kimia)
 KIMIA ANALITIK II (KI332) Halaman : 1 dari 8 Dibuat Oleh : Diperiksa Oleh : Disetujui Oleh : Drs. Hokcu Suhanda, M.Si (Koordinator Mata Kuliah) Dr. H. Wahyu Sopandi, M.A. (Ketua Program Studi Pend. Kimia)
KIMIA ANALITIK II (KI332) Halaman : 1 dari 8 Dibuat Oleh : Diperiksa Oleh : Disetujui Oleh : Drs. Hokcu Suhanda, M.Si (Koordinator Mata Kuliah) Dr. H. Wahyu Sopandi, M.A. (Ketua Program Studi Pend. Kimia)
POLAROGRAFI. Pertemuan Ke 5 & 6 Kuliah Metode Pemisahan dan Analisis Kimia.
 POLAROGRAFI Pertemuan Ke 5 & 6 Kuliah Metode Pemisahan dan Analisis Kimia siti_marwati@uny.ac.id Definisi Polarografi Polarografi adalah metode analisis yang didasarkan pada kurva arus tegangan yang diperoleh
POLAROGRAFI Pertemuan Ke 5 & 6 Kuliah Metode Pemisahan dan Analisis Kimia siti_marwati@uny.ac.id Definisi Polarografi Polarografi adalah metode analisis yang didasarkan pada kurva arus tegangan yang diperoleh
DAFTAR TABEL. 2. Nilai Arus Puncak Oksidasi Senyawa Trifeniltimah(IV) Klorida menggunakan Voltammetri Siklik pada Variasi Elektroda Kerja...
 DAFTAR TABEL Tabel Halaman 1. Nilai ip dan Ep Pengukuran Blangko menggunakan Variasi Elektroda Kerja dengan Teknik Voltammetri Siklik dan Voltammetri Gelombang Persegi... 22 2. Nilai Arus Puncak Oksidasi
DAFTAR TABEL Tabel Halaman 1. Nilai ip dan Ep Pengukuran Blangko menggunakan Variasi Elektroda Kerja dengan Teknik Voltammetri Siklik dan Voltammetri Gelombang Persegi... 22 2. Nilai Arus Puncak Oksidasi
PERCOBAAN POTENSIOMETRI (PENGUKURAN ph)
 PERCOBAAN POTENSIOMETRI (PENGUKURAN ph) I. Tujuan. Membuat kurva hubungan ph - volume pentiter 2. Menentukan titik akhir titrasi 3. Menghitung kadar zat II. Prinsip Prinsip potensiometri didasarkan pada
PERCOBAAN POTENSIOMETRI (PENGUKURAN ph) I. Tujuan. Membuat kurva hubungan ph - volume pentiter 2. Menentukan titik akhir titrasi 3. Menghitung kadar zat II. Prinsip Prinsip potensiometri didasarkan pada
II. PRINSIP Elektroda gelas yang mempunyai kemampuan untuk mengukur konsentrasi H + dalam air secara potensio meter.
 ph I. TUJUAN Tujuan praktikum ini adalah mengetahui tingkat keasaman (nilai ph) suatu sampel air,konsetrasi H + yang terkandung dalam sampel air dengan menggunakan elektroda gelas yang melakukan pengukuran
ph I. TUJUAN Tujuan praktikum ini adalah mengetahui tingkat keasaman (nilai ph) suatu sampel air,konsetrasi H + yang terkandung dalam sampel air dengan menggunakan elektroda gelas yang melakukan pengukuran
PREPARASI DAN KARAKTERISASI POLIPIROL (PPy) PADA ELEKTRODA KERJA KASA BAJA 400 MESH SECARA VOLTAMMETRI SIKLIK (CV)
 PREPARASI DAN KARAKTERISASI POLIPIROL (PPy) PADA ELEKTRODA KERJA KASA BAJA MESH SECARA VOLTAMMETRI SIKLIK (CV) Anceu Murniati, Buchari, Suryo Gandasasmita, Zeily Nurachman. Jurusan Kimia Fakultas MIPA
PREPARASI DAN KARAKTERISASI POLIPIROL (PPy) PADA ELEKTRODA KERJA KASA BAJA MESH SECARA VOLTAMMETRI SIKLIK (CV) Anceu Murniati, Buchari, Suryo Gandasasmita, Zeily Nurachman. Jurusan Kimia Fakultas MIPA
BAB IV METODE PENELITIAN. sampel. Penentuan kadar optimal disinfektan. Penentuan efektivitas disinfektan. data. Skema 4.1 Rancangan Penelitian
 BAB IV METODE PENELITIAN 4.1 Rancangan Penelitian sampel Penentuan kadar optimal disinfektan Penentuan efektivitas disinfektan data Skema 4.1 Rancangan Penelitian 4.2 Lokasi dan Waktu Penelitian Penelitian
BAB IV METODE PENELITIAN 4.1 Rancangan Penelitian sampel Penentuan kadar optimal disinfektan Penentuan efektivitas disinfektan data Skema 4.1 Rancangan Penelitian 4.2 Lokasi dan Waktu Penelitian Penelitian
III. METODOLOGI PENELITIAN. Penelitian ini dilaksanakan pada bulan April 2012 sampai Januari 2013 di
 27 III. METODOLOGI PENELITIAN 3.1 Pelaksanaan Penelitian Penelitian ini dilaksanakan pada bulan April 2012 sampai Januari 2013 di Laboratorium Kimia Organik Jurusan Kimia Fakultas MIPA Universitas Lampung.
27 III. METODOLOGI PENELITIAN 3.1 Pelaksanaan Penelitian Penelitian ini dilaksanakan pada bulan April 2012 sampai Januari 2013 di Laboratorium Kimia Organik Jurusan Kimia Fakultas MIPA Universitas Lampung.
Bab III Metodologi Penelitian
 Bab III Metodologi Penelitian III.1 Metode Penelitian Adapun langkah-langkah pengerjaan dalam penelitian ini adalah pertama mengambil sampel baja karbon dari pabrik tekstil yang merupakan bagian dari pipa
Bab III Metodologi Penelitian III.1 Metode Penelitian Adapun langkah-langkah pengerjaan dalam penelitian ini adalah pertama mengambil sampel baja karbon dari pabrik tekstil yang merupakan bagian dari pipa
TEKNIK VOLTAMETRI PELUCUTAN ANODIK UNTUK PENENTUAN KADAR LOGAM Pb, Cd, DAN Cu PADA AIR LAUT PELABUHAN BENOA
 TEKNIK VOLTAMETRI PELUCUTAN ANODIK UNTUK PENENTUAN KADAR LOGAM Pb, Cd, DAN Cu PADA AIR LAUT PELABUHAN BENOA SKRIPSI Oleh : I Wayan Hermawan NIM. 1108105010 JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
TEKNIK VOLTAMETRI PELUCUTAN ANODIK UNTUK PENENTUAN KADAR LOGAM Pb, Cd, DAN Cu PADA AIR LAUT PELABUHAN BENOA SKRIPSI Oleh : I Wayan Hermawan NIM. 1108105010 JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
BAB 8. ELEKTROKIMIA 8.1 REAKSI REDUKSI OKSIDASI 8.2 SEL ELEKTROKIMIA 8.3 POTENSIAL SEL, ENERGI BEBAS, DAN KESETIMBANGAN 8.4 PERSAMAAN NERNST 8
 BAB 8 BAB 8. ELEKTROKIMIA 8.1 REAKSI REDUKSI OKSIDASI 8.2 SEL ELEKTROKIMIA 8.3 POTENSIAL SEL, ENERGI BEBAS, DAN KESETIMBANGAN 8.4 PERSAMAAN NERNST 8.5 SEL ACCU DAN BAHAN BAKAR 8.6 KOROSI DAN PENCEGAHANNYA
BAB 8 BAB 8. ELEKTROKIMIA 8.1 REAKSI REDUKSI OKSIDASI 8.2 SEL ELEKTROKIMIA 8.3 POTENSIAL SEL, ENERGI BEBAS, DAN KESETIMBANGAN 8.4 PERSAMAAN NERNST 8.5 SEL ACCU DAN BAHAN BAKAR 8.6 KOROSI DAN PENCEGAHANNYA
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A. D. Cu E. Zn
 1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
Laporan Kimia Fisik KI-3141
 Laporan Kimia Fisik KI-3141 PERCOBAAN M-2 PENENTUAN LAJU REAKSI DAN TETAPAN LAJU REAKSI Nama : Kartika Trianita NIM : 10510007 Kelompok : 2 Tanggal Percobaan : 2 November 2012 Tanggal Laporan : 9 November
Laporan Kimia Fisik KI-3141 PERCOBAAN M-2 PENENTUAN LAJU REAKSI DAN TETAPAN LAJU REAKSI Nama : Kartika Trianita NIM : 10510007 Kelompok : 2 Tanggal Percobaan : 2 November 2012 Tanggal Laporan : 9 November
KIMIA FISIKA I. Disusun oleh : Dr. Isana SYL, M.Si
 PETUNJUK PRAKTIKUM KIMIA FISIKA I Disusun oleh : Dr. Isana SYL, M.Si Isana_supiah@uny.ac.id LABORATORIUM KIMIA FISIKA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI YOGYAKARTA 2002 TERMODINAMIKA
PETUNJUK PRAKTIKUM KIMIA FISIKA I Disusun oleh : Dr. Isana SYL, M.Si Isana_supiah@uny.ac.id LABORATORIUM KIMIA FISIKA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI YOGYAKARTA 2002 TERMODINAMIKA
ADLN - PERPUSTAKAAN UNIVERSITAS AIRLANGGA
 LAMPIRAN Lampiran 1. Data Absorbansi Larutan Naphthol Blue Black pada Berbagai Konsentrasi No. Konsentrasi (ppm) Absorbansi 1. 3 0.224 2. 4 0,304 3. 5 0,391 4. 6 0,463 5. 7 0,547 6. 8 0,616 7. 9 0,701
LAMPIRAN Lampiran 1. Data Absorbansi Larutan Naphthol Blue Black pada Berbagai Konsentrasi No. Konsentrasi (ppm) Absorbansi 1. 3 0.224 2. 4 0,304 3. 5 0,391 4. 6 0,463 5. 7 0,547 6. 8 0,616 7. 9 0,701
PENGEMBANGAN SENSOR VOLTAMMETRI OKSIGEN TERLARUT DENGAN ELEKTRODA KERJA PLATINA DAN EMAS MENGGUNAKAN LARUTAN ELEKTROLIT ASAM SULFAT SKRIPSI.
 PENGEMBANGAN SENSOR VOLTAMMETRI OKSIGEN TERLARUT DENGAN ELEKTRODA KERJA PLATINA DAN EMAS MENGGUNAKAN LARUTAN ELEKTROLIT ASAM SULFAT SKRIPSI Oleh Fani Atrica Suwita NIM 101810301007 JURUSAN KIMIA FAKULTAS
PENGEMBANGAN SENSOR VOLTAMMETRI OKSIGEN TERLARUT DENGAN ELEKTRODA KERJA PLATINA DAN EMAS MENGGUNAKAN LARUTAN ELEKTROLIT ASAM SULFAT SKRIPSI Oleh Fani Atrica Suwita NIM 101810301007 JURUSAN KIMIA FAKULTAS
Respon Ganda Elektrode Kawat Emas Terlapis Polipirol Terhadap Kation Dan Anion Dari Surfaktan Nads
 Abdul Haris Watoni/J. Prog. Kim. Si. 2011, 1 (2): 110-119 Respon Ganda Elektrode Kawat Emas Terlapis Polipirol Terhadap Kation Dan Anion Dari Surfaktan Nads Abdul Haris Watoni 1) * 1) Jurusan Kimia, FMIPA,
Abdul Haris Watoni/J. Prog. Kim. Si. 2011, 1 (2): 110-119 Respon Ganda Elektrode Kawat Emas Terlapis Polipirol Terhadap Kation Dan Anion Dari Surfaktan Nads Abdul Haris Watoni 1) * 1) Jurusan Kimia, FMIPA,
Elektroda Cu (katoda): o 2. o 2
 Bab IV Pembahasan Atom seng (Zn) memiliki kemampuan memberi elektron lebih besar dibandingkan atom tembaga (Cu). Jika menempatkan lempeng tembaga dan lempeng seng pada larutan elektrolit kemudian dihubungkan
Bab IV Pembahasan Atom seng (Zn) memiliki kemampuan memberi elektron lebih besar dibandingkan atom tembaga (Cu). Jika menempatkan lempeng tembaga dan lempeng seng pada larutan elektrolit kemudian dihubungkan
CYCLIC STRIPPING VOLTAMMETRY MODIFIED CARBON PASTE ELECTRODE USING CHITOSAN FOR ANALYSIS
 MODIFIKASI ELEKTRODA PASTA KARBON MENGGUNAKAN KITOSAN UNTUK ANALISIS ION Cd 2+ SECARA CYCLIC STRIPPING VOLTAMMETRY MODIFIED CARBON PASTE ELECTRODE USING CHITOSAN FOR ANALYSIS Cd 2+ ION IN CYCLIC STRIPPING
MODIFIKASI ELEKTRODA PASTA KARBON MENGGUNAKAN KITOSAN UNTUK ANALISIS ION Cd 2+ SECARA CYCLIC STRIPPING VOLTAMMETRY MODIFIED CARBON PASTE ELECTRODE USING CHITOSAN FOR ANALYSIS Cd 2+ ION IN CYCLIC STRIPPING
Skripsi Sarjana Kimia NUR AFRIYANTI
 PENENTUAN Cu DAN Zn PADA BUAH APEL (Malus Sylvestris Mill) DAN BUAH MELON (Cucumis melo L) DENGAN METODA VOLTAMMETRI STRIPPING ADSORPTIF (AdSV) Skripsi Sarjana Kimia Oleh : NUR AFRIYANTI 0910412028 JURUSAN
PENENTUAN Cu DAN Zn PADA BUAH APEL (Malus Sylvestris Mill) DAN BUAH MELON (Cucumis melo L) DENGAN METODA VOLTAMMETRI STRIPPING ADSORPTIF (AdSV) Skripsi Sarjana Kimia Oleh : NUR AFRIYANTI 0910412028 JURUSAN
Spektrofotometri Serapan Atom
 Spektrofotometri Serapan Atom I. Tujuan Menentukan kepekaan dan daerah konsentrasi analisis logam Cu pada panjang gelombang 324.7 nm Menentukan pengaruh spesi lain, matriks, dan nyala api pada larutan
Spektrofotometri Serapan Atom I. Tujuan Menentukan kepekaan dan daerah konsentrasi analisis logam Cu pada panjang gelombang 324.7 nm Menentukan pengaruh spesi lain, matriks, dan nyala api pada larutan
SATUAN ACARA PERKULIAHAN
 SATUAN ACARA PERKULIAHAN Mata Kuliah : Metode Pemisahan dan Analisis Kimia (2 sks) Kode Mata Kuliah : SKM 205 Waktu Pertemuan : 2 50 menit Pertemuan ke : 2 A. Kompetensi Dasar : Menerapkan metode pemisahan
SATUAN ACARA PERKULIAHAN Mata Kuliah : Metode Pemisahan dan Analisis Kimia (2 sks) Kode Mata Kuliah : SKM 205 Waktu Pertemuan : 2 50 menit Pertemuan ke : 2 A. Kompetensi Dasar : Menerapkan metode pemisahan
3 Metodologi Penelitian
 3 Metodologi Penelitian Prosedur penelitian ini terdiri dari beberapa tahap, tahap pertama sintesis kitosan yang terdiri dari isolasi kitin dari kulit udang, konversi kitin menjadi kitosan. Tahap ke dua
3 Metodologi Penelitian Prosedur penelitian ini terdiri dari beberapa tahap, tahap pertama sintesis kitosan yang terdiri dari isolasi kitin dari kulit udang, konversi kitin menjadi kitosan. Tahap ke dua
Hasil Penelitian dan Pembahasan
 Bab IV Hasil Penelitian dan Pembahasan IV.1 Pengaruh Arus Listrik Terhadap Hasil Elektrolisis Elektrolisis merupakan reaksi yang tidak spontan. Untuk dapat berlangsungnya reaksi elektrolisis digunakan
Bab IV Hasil Penelitian dan Pembahasan IV.1 Pengaruh Arus Listrik Terhadap Hasil Elektrolisis Elektrolisis merupakan reaksi yang tidak spontan. Untuk dapat berlangsungnya reaksi elektrolisis digunakan
Elektropolimerisasi Film Polianilin dengan Metode Galvanostatik dan Pengukuran Laju Pertumbuhannya
 JURNAL FISIKA DAN APLIKASINYA VOLUME 8, NOMOR 1 JANUARI 2012 Elektropolimerisasi Film Polianilin dengan Metode Galvanostatik dan Pengukuran Laju Pertumbuhannya Rakhmat Hidayat Wibawanto dan Darminto Jurusan
JURNAL FISIKA DAN APLIKASINYA VOLUME 8, NOMOR 1 JANUARI 2012 Elektropolimerisasi Film Polianilin dengan Metode Galvanostatik dan Pengukuran Laju Pertumbuhannya Rakhmat Hidayat Wibawanto dan Darminto Jurusan
