PERSETUJUAN PEMBIMBING. Analisis Kesalahan Konsep Mahasiswa Pada Pokok Bahasan Reaksi Reduksi Oksidasi. Oleh. Sriningsih NIM.
|
|
|
- Liana Setiawan
- 7 tahun lalu
- Tontonan:
Transkripsi
1 Jurnal yang berjudul: PERSETUJUAN PEMBIMBING Analisis Kesalahan Konsep Mahasiswa Pada Pokok Bahasan Reaksi Reduksi Oksidasi Oleh Sriningsih NIM Telah diperiksa dan disetujui Pembimbing I Pembimbing II Prof. Dr. Astin Lukum, M.Si Erni Mohamad, S.Pd., M.Si NIP NIP Mengetahui: Ketua Jurusan Pendidikan Kimia Dr. Akram La Kilo, M.Si NIP
2 JURNAL PENELITIAN : 2015 ANALISIS KESALAHAN KONSEP MAHASISWA PADA POKOK BAHASAN REAKSI REDUKSI OKSIDASI Sriningsih 1, Astin Lukum 2, Erni Mohamad 3 Jurusan Kimia Fakultas MIPA Universitas Negeri Gorontalo kimia_sriningsih@yahoo.co.id ABSTRAK Penelitian ini bertujuan untuk mengetahui kesalahan konsep mahasiswa pada pokok bahasan reaksi reduksi oksidasi. Pendekatan yang digunakan dalam penelitian ini adalah pendekatan kualitatif dengan jenis penelitian deskriptif. Subyek dalam penelitian ini adalah Mahasiswa Kimia Angkatan Tahun 2013/2014 yang berjumlah 50 orang. Instrumen penelitian yang digunakan berupa tes pilihan ganda beralasan (Tes Multiple Choice dengan Reasoning Terbuka) yang berjumlah 20 nomor soal yang dibuat berdasarkan indikator. Hasil penelitian menunjukkan bahwa kesalahan konsep yang dialami mahasiswa pada pokok bahasan reaksi reduksi oksidasi yaitu pada indikator konsep reaksi redoks, mahasiswa tidak dapat menentukan bilangan oksidasi dari suatu senyawa dengan benar yaitu sebesar 19,60%; pada indikator oksidator dan reduktor, mahasiswa sulit menentukan senyawa yang mengalami oksidator dan reduktor sebesar 20%; pada indikator reaksi reduksi dan oksidasi, mahasiswa tidak dapat menentukan reaksi yang tergolong reaksi reduksi oksidasi berdasarkan persamaan reaksi yaitu sebesar 23,09%; pada indikator penyetaraan reaksi redoks, mahasiswa tidak memperhatikan masing-masing koefisien (kiri dan kanan) serta tidak dapat menentukan banyaknya mol dari suatu senyawa sebesar 22,57% dan pada indikator ekivalen redoks dan ekivalen asam basa, mahasiswa salah menggunakan rumus dalam menghitung ekivalen redoks dan ekivalen asam basa yaitu sebesar 22,70%. Kata Kunci : Kesalahan Konsep Mahasiswa, Reaksi Reduksi Oksidasi 1 Sriningsih. NIM: , Jurusan: Pendidikan Kimia, Fakultas MIPA 2 Pembimbing I : Prof. Dr. Astin Lukum, M.Si 3 Pembimbing II : Erni Mohamad, S.Pd, M.Si
3 PENDAHULUAN Pendidikan sains yang berkualitas dipengaruhi oleh empat ranah yaitu pemahaman konsep, keterampilan konsep, kreativitas dan pengembangan sikap. Dalam dunia pendidikan, mata kuliah kimia dianggap sulit oleh sebagian besar mahasiswa, sehingga banyak dari mahasiswa yang tidak berhasil dalam belajar kimia. Kimia adalah suatu disiplin ilmu dasar yang diperoleh dan dikembangkan melalui eksperimen yang dipelajari mahasiswa dengan cara mensintesis, mengidentifikasi, menghitung dan mengamati. Untuk mencari jawaban atas pertanyaan apa, mengapa, dan bagaimana gejala-gejala alam khususnya yang berkaitan dengan komposisi, struktur dan sifat, transformasi dinamika dan energitika zat (Agustina dan Novita, 2012:11). Menurut Tayubi (2005:5) miskonsepsi adalah suatu konsepsi atau struktur kognitif yang melekat dengan kuat dan stabil dibenak mahasiswa yang sebenarnya menyimpang dari konsepsi yang dikemukakan para ahli, yang dapat menyesatkan para mahasiswa dalam memahami fenomena ilmiah. Miskonsepsi dalam pelajaran kimia akan sangat fatal dikarenakan konsep-konsep kimia saling terkait antara satu dengan yang lainnya, sehingga kesalahan konsep diawal pelajaran akan berpengaruh kepada pelajaran lanjutan, hal ini akan bermuara pada rendahnya kemampuan mahasiswa dan tidak tercapainya ketuntasan belajar (Nazar, dkk. 2010:1). Sedangkan menurut Djihu (2013:9) Kesalahan konsep dalam belajar kimia dapat dibagi dalam beberapa jenis yaitu: (1) kesalahan yang terjadi secara acak tanpa sumber tertentu (misalnya salah menghitung atau salah dalam menuliskan rumus), (2) salah ingat/hafal, (3) kesalahan yang terjadi secara terus menerus serta menunjukkan kesalahan dengan sumber tertentu Salah satu konsep dasar yang dipelajari dalam kimia adalah konsep tentang reaksi reduksi oksidasi atau biasa disingkat dengan reaksi redoks. Pokok bahasan reaksi reduksi oksidasi merupakan materi yang dianggap sulit bagi mahasiswa kimia. Dimana, reaksi redoks merupakan salah satu materi kimia yang syarat dengan konsep-konsep yang abstrak di antaranya konsep reaksi redoks berdasarkan transfer elektron, proses pelepasan dan penerimaan elektron yang tidak bisa dilihat dengan mata, tetapi hanya bisa dibayangkan. Reaksi reduksi oksidasi merupakan materi yang dianggap sulit bagi mahasiswa kimia. Didalam reaksi reduksi oksidasi ini terdapat keterkaitan antar konsep, misalnya dalam menentukan reaksi reduksi oksidasi mahasiswa perlu memahami konsep penentuan bilangan oksidasi. Hasil belajar mahasiswa tergambar pada sebaran nilai kelulusan mahasiswa untuk mata kuliah Kimia Dasar 2 pada semester genap tahun akademik 2013/2014, khususnya pada materi reaksi reduksi oksidasi sekitar 50% mahasiswa yang tidak tuntas atau memperoleh nilai yang tidak memuaskan. Tujuan penelitian ini adalah untuk mengetahui kesalahan konsep mahasiswa Jurusan Pendidikan Kimia angkatan 2013 pada materi reaksi reduksi oksidasi. METODE PENELITIAN Penelitian ini dilakukan pada mahasiswa Jurusan Kimia Universitas Negeri Gorontalo semester IV tahun akademik 2013/2014, dengan jumlah mahasiswa 50 orang. Jenis penelitian yang digunakan yaitu penelitian deskriptif. Dimana yang menjadi data dalam penelitian ini adalah hasil tes mahasiswa pada pokok bahasan reaksi reduksi oksidasi. Untuk pengumpulan data dalam penelitian ini menggunakan tes pilihan ganda yang dilengkapi dengan alasan
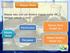
4 memilih jawaban (Tes Multiple Choice dengan Reasoning Terbuka). Setelah itu untuk mengetahui kemampuan pemahaman mahasiswa dianalisis dengan menggunakan rumus sebagai berikut. Skor yang diperoleh siswa % Kemampan x 100% Jumlah siswa keseluruhan Tingkat kesalahan konsep mahasiswa untuk tiap butir soal yang diujikan digunakan rumus sebagai berikut: % kesalahan = 100% % kemampuan Sedangkan untuk Jawaban-jawaban mahasiswa dapat dikategorikan dengan kategori yang terdapat pada tabel berikut ini: Tabel 1 Empat Kategori Jawaban Mahasiswa Tipe Jawaban Penjelasan Kategori Siswa B-B (benar-benar) Menjawab dengan benar kedua tingkatan pertanyaan Memahami B-S (benar-salah) S-B (salah-benar) S-S (salah-salah) Sumber: Tuyus (2009:198). HASIL PENELITIAN DAN PEMBAHASAN Deskripsi Hasil Penelitian Menjawab benar pada pertanyaan tingkat pertama dan salah pada pertanyaan tingkat kedua Menjawab salah pada pertanyaan tingkat pertama dan benar pada pertanyaan tingkat kedua Menjawab dengan salah kedua tingkat pertanyaan Miskonsepsi Menebak Tidak memahami Dari hasil analisis 20 soal konsep yang diujikan pada 50 mahasiswa semester IV angkatan 2013/2014 yang diukur dengan lima indikator yang disesuaikan dengan pokok bahasan reaksi reduksi dan reaksi oksidasi yang diperoleh persentase peserta uji yang menjawab salah (selanjutnya disebut tingkat kesalahan). Tingkat kesalahan cukup tinggi terjadi pada soal nomor 8 mencapai 92% yang menguji konsep tentang menuliskan reaksi reduksi dan oksidasi, selanjutnya soal nomor 18, 20 mencapai 92% dan 90% yang mewakili konsep tentang menghitung ekivalen redoks dan ekivalen asam basa. Sedangkan tingkat kesalahan terendah terdapat pada nomor 1 mencapai 30% yang menguji tentang menjelaskan konsep reaksi reduksi oksidasi (redoks). Berikut ini disajikan diagram presentase rata-rata kategori jawaban mahasiswa yang terdiri atas kategori memahami, miskonsepsi, menebak dan tidak paham. Persentase Rata-rata Kategori Jawaban Mahasiswa 58% 17% 2% 23% Memahami Miskonsepsi menebak tidak paham
5 Berdasarkan diagram terzebut dapat dilihat bahwa mahasiswa yang mengalami kesalahan konsep (miskonsepsi) mencapai 23,3%. Untuk kategori paham yaitu 17,4%, kategori menebak 1.3% sedangkan untuk kategori tidak paham mencapai 58%. Pembahasan Kesalahan Konsep Mahasiswa Pada Pokok Bahasan Reaksi reduksi dan Reaksi Oksidasi Pembahasan lebih difokuskan pada setiap item soal yang mengalami kesalahan konsep. Dimana pada indikator pertama yaitu tentang penjelasan konsep reaksi redoks diperoleh persentase mencapai 49.6% kategori sedang. Sedangkan untuk indikator 2, 3, 4 dan 5 persentase tingkat kesalahan secara umum mengalami peningkatan yang cukup tinggi yaitu dari 55,71%, 65,64%, 66,72% dan 72,40% sehingga kriteria kesalahan yang tinggi. Berikut ini akan diabahas kesalahan konsep berdasarkan lima indikator untuk per item soal. 1. Kesalahan konsep mahasiswa dalam memahami konsep reaksi reduksi oksidasi Berdasarkan hasil penelitian dijelaskan bahwa mahasiswa yang mengalami kesalahan konsep disebabkan karena alasan yang mahasiswa berikan lebih kepada menuliskan kembali pernyataan yang ada pada soal atau mengulang kembali apa yang ditanyakan soal. Tabel 2: Kutipan hasil pekerjaan mahasiswa dan kunci jawaban untuk soal nomor 1 1. A. Reduksi Karena berdasarkan perkembangan konsep redoks, reaksi reduksi merupakan reaksi yang ditandai dengan pelepasan oksigen oleh suatu zat 1. A. Reduksi reaksi yang ditandai dengan pelepasan oksigen oleh suatu zat disebut reaksi oksidasi. Berdasarkan hasil analisis, mahasiswa yang mengalami kesalahan konsep pada soal nomor satu hanya 2%, kesalahan konsep yang terjadi karena mereka memberikan jawaban yang tidak sesuai seperti: reaksi reduksi adalah reaksi yang mengalami penambahan oksigen oleh suatu zat. Pada soal nomor dua kesalahan konsep yang dialami mahasiswa mencapai 26%, disebabkan karena banyak dari mahasiswa yang tidak memahami konsep reaksi oksidasi, serta mereka masih bingung untuk membedakan antara reduksi dan oksidasi seperti halnya reaksi reduksi merupakan reaksi yang mengalami kenaikan bilangan oksidasi. Begitu juga sebaliknya reaksi oksidasi adalah reaksi yang mengalami penurunan bilangan oksidasi. Tabel 3: Kutipan hasil pekerjaan mahasiswa dan kunci jawaban untuk soal nomor 2 2. A. 1,3 dan 5 Dengan alasan karena berdasarkan perkembangan konsep reaksi reduksi oksidasi (redoks) yaitu: - Oksidasi adalah reaksi pengikatan atau penggabungan oksigen - Oksidasi adalah reaksi pelepasan elektron - Oksidasi adalah reaksi yang mengalami kenaikan bilangan oksidasi. 2. A. 1,3 dan 5 Mahasiswa beralasan bahwa itu adalah proses biloks
6 Berdasarkan hasil pekerjaan mahasiswa di atas bahwa jawaban yang mereka berikan tidak spesifik dalam menjelaskan konsep oksidasi. Konsep reaksi reduksi oksidasi berdasarkan pengikatan dan pelepasan oksigen ini kurang universal (luas) karena reaksi kimia tidak hanya melibatkan oksigen saja, tetapi melibatkan elektron dan bilangan oksidasi juga. Tabel 4: Kutipan hasil pekerjaan mahasiswa dan kunci jawaban untuk soal nomor 3 3. E. Karena dalam menentukan unsur yang berperan sebagai reduktor dan oksidator dalam suatu reaksi oksidasi reduksi, perlu dilihat adanya pengikatan dan pelepasan oksigen, pelepasan dan penerimaan elektron, serta kenaikan dan penurunan bilangan oksidasi. 3.. E karena menurut penentuan biloks, serta tidak disertai pelepasan elektron Untuk soal nomor tiga berdasarkan hasil analisis, kesalahan konsep yang dialami mahasiswa mencapai 18%. Hal ini disebabkan karena mereka beranggapan bahwa reaksi redoks berdasarkan penentuan biloks yang disertai dengan perubahan bilangan oksidasi dan tidak disertai dengan pelepasan elektron. Yang seharusnya dengan adanya pelepasan elektron muatan unsur akan menjadi naik karena elektron itu sendiri bermuatan negatif. Pada soal nomor 4 diperoleh persentase kesalahan konsep yang dialami mahasiswa mencapai 28%. Berikut ini disajikan tabel kutipan hasil pekerjaan mahasiswa. Tabel 5: Kutipan hasil pekerjaan mahasiswa dan kunci jawaban untuk soal nomor 4 4. C. b dan d b. AlO - 2 = +3, karena: Al + 2(-2) = -1 Al + (-4) = -1 Al -4 = -1 Al = +4 1 Al = +3 d. [CrCl 2(H 2O)] +, karena: Cr + 2 (-1) + 0 = +1 Cr + (-2) = +1 Cr -2 = +1 Cr = Cr = C. b dan d karena biloks Al + biloks O = +3 Jika dilihat dari hasil pekerjaan mahasiswa diatas, maka kesalahan yang terjadi disebabkan karena mahasiswa tidak paham terhadap aturan dalam penentuan bilangan oksidasi unsur dalam senyawa atau ion. Seperti halnya pada senyawa ion [CrCl2(H2O)4] +, untuk mencari biloks dari Cr perlu diuraikan terlebih dahulu senyawa ion dari [CrCl2(H2O)4] + ini. Sedangkan pada soal nomor lima kesalahan konsep yang dialami mahasiswa mencapai 26%.
7 Tabel 6: Kutipan hasil pekerjaan mahasiswa dan kunci jawaban untuk soal nomor 5 5. Jawaban: C - Cr 2O Jawaban: C Dengan alasan: yang memiliki bilangan oksidasi yang sama Cr 2 + 7(O) = dengan MnO 4 2- yaitu Cr 2O 7 jika dilihat dari muatannya Cr 2 + 7(-2) = -2 Cr 2 + (-14) = -2 Cr 2 14 = -2 Cr 2 = Cr 2 = +12 Cr = yaitu -2 Dari tabel di atas jika dilihat letak kesalahan disebabkan karena mahasiswa hanya melihat dari muatan, jika muatan sama, maka biloksnya pun sama dan kebanyakan dari mereka hanya mengahafal biloks dari Cr adalah +6 tanpa tahu dari mana +6 tersebut. 2. Kesalahan konsep mahasiswa dalam membedakan oksidator dan reduktor Kesalahan konsep yang terjadi pada soal nomor 6 ini mencapai 26%. Tabel 7: penyajian hasil pekerjaan mahasiswa dan kunci jawaban untuk soal nomor 6 6. A. 2,4 dan 5 6. A. 2,4 dan 5 Oksidator adalah zat yang mengalami karena proses oksidator = oksidasi reduksi. Jadi, oksidator adalah suatu zat yang = penurunan biloks = pelepasan elektron. mengalami penurunan biloks dan menarik elektron. Bentuk kesalahan konsep mahasiswa yang terjadi yaitu mereka belum bisa menentukan sifat oksidator secara benar. Pada soal nomor tujuh persentase kesalahan konsep sebesar 16%. Kesalahan konsep ini terjadi karena mahasiswa berpandangan bahwa pada reaksi Ag + Ag terjadi reaksi oksidasi, dimana biloks Ag turun dari +1 menjadi 0. Kemudian pada reaksi Zn Zn 2+ terjadi pula reaksi reduksi, dimana biloks Zn naik dari 0 menjadi +1. Hal inilah yang menyebabkan mahasiswa mengalami kesalahan konsep. Tabel 8: Kutipan hasil pekerjaan mahasiswa dan kunci jawaban untuk soal nomor 7 7. D 7. D 2Ag + + Zn 2Ag + Zn oksidator reduktor Zn adalah zat yang mengalami kenaikan biloks sehingga disebut reduktor. Sedangkan Ag + adalah zat yang mengalami penurunan biloks sehingga disebut oksidator. 2Ag + + Zn 2Ag + Zn 2+ oksidasi reduksi Pada reaksi 2Ag + + Zn 2Ag + Zn 2+ disini dapat dilihat bahwa Zn mengalami oksidasi (oksidator) sedangkan Ag mengalami reduksi (reduktor). Dari jawaban diatas dapat dilihat bahwa mahasiswa tidak memahami konsep dan jawaban yang diberikan tidak relevan. Dimana mereka menduga bahwa sifat oksidator
8 mengalami oksidasi dan melepaskan elektron, hal ini menunjukkan bahwa tidak ada keseriusan mahasiswa dalam mempelajari konsep ini. 3. Kesalahan konsep mahasiswa dalam menuliskan reaksi reduksi oksidasi Kesalahan konsep ini terjadi pada pada soal nomor delapan yaitu mencapai 32%. Tabel 9: Kutipan hasil pekerjaan mahasiswa dan kunci jawaban untuk soal nomor 8 8. A. H 2 + Cl 2 2HCl H 2 + Cl 2 2HCl A. H 2 + Cl 2 2HCl Karena berdasarkan reaksi yang terbentuk. Reduksi (+1) Oksidasi (-1) jadi reaksi tersebut tergolong reaksi reduksi oksidasi (redoks) Dari tabel di atas dapat dilihat bahwa pada bagian sub konsep tentang reaksi oksidasireduksi berdasarkan kenaikan dan penurunan bilangan oksidasi yaitu seperti pada reaksi H2 + Cl2 2HCl terjadi penurunan dan kenaikan bilangan oksidasi. Dimana H yang mulanya memiliki biloks dari 0 menjadi +1 atau mengalami kenaikan biloks (oksidasi) sedangkan Cl yang mulanya 0 menjadi -1 mengalami penurunan biloks (reduksi). Pada soal nomor sembilan kesalahan konsep yang terjadi mencapai 24%. Tabel 10: Kutipan hasil pekerjaan mahasiswa dan kunci jawaban untuk soal nomor 9 9. E. Cu 2O + 2HCl CuCl 2 + H 2O Tidak terjadi perubahan biloks, karena tidak ada kenaikan dan penurunan bilangan oksidasi. Cu 2 O + 2HCl CuCl 2 + H 2 O E. Cu 2O + 2HCl CuCl 2 + H 2O karena Cu mengalami reduksi. sedangkan Cl tidak mengalami kedua-duanya. Jadi bukan termasuk redoks. Berdasarkan tabel di atas kesalahan konsep yang dialami mahasiswa yaitu dikarenakan mahasiswa menduga bahwa Cu terjadi reaksi reduksi. Akan tetapi pada reaksi tersebut Cu2O mengikat HCl sedangkan CuCl2 melepaskan elektron. Berdasarkan biloksnya, bila diperhatikan biloks Cu, biloks Cu dalam Cu2O = +2, bilangan oksidasi Cu dalam CuCl2 = +2 maka biloks tidak mengalami perubahan, maka bukan termasuk reaksi redoks. Sedangkan untuk soal nomor sepuluh dianalisis mengalami kesalahan konsep mencapai 28%. Tabel 11: Kutipan hasil pekerjaan mahasiswa dan kunci jawaban untuk soal nomor B. 1 dan 3 Reaksi ini termasuk reaksi autoredoks, dimana terjadi kenaikan biloks S pada H 2S menjadi S yaitu dari -2 menjadi 0 dan dari SO 2 menjadi S yaitu dari +4 menjadi 0. Jadi H 2S bertindak sebagai reduktor. 10. B. 1 dan 3 karena 1 dan 3 termasuk reaksi reduksi.
9 Berdasarkan tabel diatas, mahasiswa mengalami kesalahan konsep, kesalahan konsep yang terjadi disebabkan karena sebagian besar mahasiswa belum paham dengan konsep autoredoks, yaitu reaksi yang bisa mengalami reduksi dan bisa sebagai oksidasi. Mereka beranggapan bahwa H2S dalam H2O bertindak sebagai reduksi, yang mana H2S tersebut bertindak sebagai reduktor atau oksidasi. Untuk soal nomor 11 kesalahan konsep mahasiswa mencapai 30%. Berikut disajikan kutipan hasil pekerjaan mahasiswa. Tabel 12: Kutipan hasil pekerjaan mahasiswa dan kunci jawaban untuk soal nomor C. Pelarutan gas NH 3 bukan termasuk reaksi redoks Reaksi tersebut tidak menunjukkan adanya kenaikan atau penurunan biloks. Jadi, reaksi tersebut bukan reaksi redoks. Karena jika dilihat berdasarkan kenaikan dan penurunan bilangan oksidasi, pelarutan gas NH 3 dalam air tidak mengalami kenaikan maupun penurunan bilangan oksidasi. 11. C. Pelarutan gas NH 3 bukan termasuk reaksi redoks. Karena pada pelarutan gas NH 3 terjadi reaksi reduksi. Dari tabel tersebut, mahasiswa menganggap bahwa pelarutan gas NH3 dalam air termasuk reaksi reduksi. Karena perubahan biloks N dari 0 menjadi +1. Akan tetapi reaksi pelarutan gas NH3 dalam air tersebut bukan termasuk reaksi redoks. Karena jika dilihat berdasarkan kenaikan dan penurunan bilangan oksidasi, pelarutan gas NH3 dalam air tidak mengalami kenaikan maupun penurunan bilangan oksidasi. 4. Kesalahan konsep mahasiswa dalam menyetarakan reaksi reduksi oksidasi Kesalahan konsep selanjutnya yakni pada indikator 4 terutama pada soal nomor 12, 13 dan 14. Tabel 13: Kutipan hasil pekerjaan mahasiswa dan kunci jawaban untuk soal nomor A. 3, 6, 1, 5, 3 Alasan : 3Br 2(aq) + 6 OH - (aq) - BrO 3 (aq) + 5Br A Alasan : Br 2(aq) + 6 OH - (aq) - 3BrO 3 (aq) + (aq) + 3 H 2O (l) 5Br - (aq) + 3 H 2O (l) Pada soal nomor 12 kesalahan konsep mencapai 12%, khususnya dalam penyetaraan reaksi a Br2(aq) + b OH - (aq) c BrO3 - (aq) + d Br - (aq) + e H2O(l) banyak yang mengalami kesalahan konsep. Kesalahan konsep ini terjadi karena mahasiswa tersebut tidak memperhatikan muatan antara ruas kanan dan ruas kiri persamaan reaksi tersebut, sehingga muatan yang ada disebelah kiri dengan sebelah kanan berbeda, dan hasil akhirnya pun menjadi salah.
10 Tabel 14: Kutipan hasil pekerjaan mahasiswa dan kunci jawaban untuk soal nomor E. 8 mol 13. E. 8 mol harus disamakan koefisien, karena H 2SO 4 + HI H 2S + I 2 + H 2O koefisien = mol Atom yang mengalami perubahan bilangan oksidasi yaitu S dan I Penyetaraan reaksi: H 2SO 4 + 8HI H 2S + 4I 2 + 4H 2O, Jadi Satu mol asam sulfat dapat mengoksidasi hidrogen iodida sebanyak 8 mol. Berdasarkan tabel diatas dan hasil persentase kesalahan konsep pada nomor 13 sebesar 26% dimana mereka tidak paham konsep, seperti halnya dalam penyetaran reaksi reduksi oksidasi (redoks). Agar reaksi tersebut setara terlebih dahulu harus menyamakan antara koefisien yang sebelah kiri dengan koefisien yang sebelah kanan, seperti H2SO4 + HI H2S + I2 + H2O (belum setara) setelah mengalami penyetaraan menjadi H2SO4 + 8HI H2S + 4I2 + 4H2O. Tabel 15: Kutipan hasil pekerjaan mahasiswa dan kunci jawaban untuk soal nomor D. 6 mol 14. D. 6 mol dilihat dari koefisien Fe 2+ + Cr 2 O 7 2- Fe Cr Oksidasi: Fe 2+ Fe 3+ Reduksi: Cr 2O 2-7 6Fe 2+ + Cr 2O H + Cr 3+ 6Fe Cr 3+ +7H 2O Berdasarkan tabel tersebut kesalahan konsep terjadi karena mahasiswa tidak bisa menyetarakan reaksi redoks dengan benar. Persentase kesalahan konsep sebesar 24%, dimana mereka tidak paham konsep, seperti halnya dalam penyetaran reaksi reduksi oksidasi (redoks). Dari uraian diatas dapat disimpulkan bahwa kesalahan konsep mahasiswa terjadi karena mahasiswa yang tidak memahami konsep tidak mampu menjelaskan kembali konsep yang telah dipelajarinya. 5. Kesalahan konsep mahasiswa dalam menghitung ekivalen redoks dan ekivalen asam basa Pada soal nomor 15 dalam menentukan ekivalen oksidator banyak dari mahasiswa yang mengalami miskonsepsi sebesar 36%, dimana mereka beranggapan bahwa sejumlah zat yang dapat menerima satu mol elektron (6,02 x elektron) adalah pengertian dari oksidator sebab oksidator yang mengalami reduksi dan akan terjadi penurunan biloks sehingga membutuhkan elektron dengan cara menerima satu mol elektron. Dari jawaban mahasiswa
11 tersebut sudah terlihat bahwa mengalami miskonsepsi. Seperti yang disajikan pada tabel dibawah ini: Tabel 16: Kutipan hasil pekerjaan mahasiswa dan kunci jawaban untuk soal nomor C. Ekivalen Oksidator Karena suatu ekivalen oksidator (zat pengoksidasi) adalah sejumlah zat tertentu yang dapat menerima satu mol elektron (6,02 x elektron). 15. C. Ekivalen Oksidator karena menerima satu mol elektron (6,02 x elektron). Pada soal nomor 16 tampak mahasiswa yang mengalami kesalahan konsep yaitu 22% dengan memilih jawaban A yang menyatakan banyaknya ekivalen dalam satu MnO4 - adalah 3 ekivalen akan tetapi alasan yang diberikan tidak sesuai dengan kunci jawaban yaitu dengan alasan bahwa 3 ekivalen merupakan biloks dari Mn. Tabel 17: Kutipan hasil pekerjaan mahasiswa dan kunci jawaban untuk soal nomor A. 3 ekivalen 16. A. 3 ekivalen - MnO 4 MnO 2 Karena biloks dari Mn = +3 - Bilangan oksidasi Mn berubah dari +7 menjadi +4 - Setiap mol MnO - 4 menerima 3 mol elektron - Jadi, 1 mol MnO 4 = 3 ekivalen Berdasarkan hasil pekerjaan mahasiswa diatas maka dapat dikatakan bahwa mahasiswa tersebut mengalami kesalahan konsep, disebabkan karena ketidaktahuan mahasiswa dalam menentukan ekivalen redoks dan kebanyakan mereka menganggap bahwa massa dari ekivalen Mn sama dengan banyaknya biloks Mn. Pada soal 17,18,19, 20 dengan masing-masing persentase kesalahan konsep mencapai 18%, 16%, 36% dan 10%. Ke-empat soal ini memerlukan pemahaman yang kuat, karena soal ini membutuhkan konsentrasi yang tinggi dalam berhitung seperti hasil pekerjaan mahasiswa dan kunci jawaban untuk soal nomor 17 dibawah ini. Tabel 18: Kutipan hasil pekerjaan mahasiswa dan kunci jawaban untuk soal nomor A. 27,923 gram Bilangan oksidasi Fe berubah dari 0 menjadi +2. Setiap mol Fe melepaskan 2 mol elektron, 1 mol Fe = 2 ekivalen, Massa 1 mol Fe = 2 ekivalen = 55,847 g, Massa 1 ekivalen Fe = 1/2 (55,847) = 27,923 gr 17. A materi lupa/tidak tahu (massa ekivaeln X Mr). yaitu 1 x 55,847 gr. Karena soal ini menghitung ekivalen redoks dan ekivalen asam basa. Seperti halnya dalam menyelesaikan soal nomor 17 ini, mahasiswa hanya menyelesaikannya sampai pada mencari massa 1 mol Fe. Sedangkan dalam mencari massa 1 ekivalen Fe mereka tidak selesaikan. Sedangkan untuk jawaban yang mereka berikan menunjukkan bahwa mahasiswa
12 tersebut belum memahami cara menghitung massa ekivalen redoks serta sudah lupa dengan materi tersebut. Tabel 19: Kutipan hasil pekerjaan mahasiswa dan kunci jawaban untuk soal nomor A. 212 Massa ekivalen M = 26,48 gram, Massa ekivalen M = 26.48/0.375 = Dari rumus M(OH) 3 menunjukkan bahwa valensi logam M adalah 3, jadi massa atom relatif M = 3 x = A. 212 atau Mr = gr/mol = 26,48/0,375 = 70,61. Jadi. Mr = 71 x 2 = 142 Berdasarkan tabel tersebut, mahasiswa masih keliru dalam penggunaan rumus serta belum memahami konsep perhitungan tentang menghitung massa atom relatif. Selain itu kurangnya keterampilan dalam menentukan massa atom relatif dan tingkat pemahaman mahasiswa yang heterogen menjadi penyebab melakukan kesalahan konsep. Pada soal nomor 19 kesalahan konsep diakibatkan karena penggunaan rumus yang salah serta penerapan rumusnya, seperti dalam pengerjaan soal ini mereka langsung menggunakan rumus molaritas (M = mol V ) tanpa mencari dulu ekivalen dari masing-masing senyawa. Sedangkan untuk soal nomor 20 yang sama halnya dengan soal sebelumnya, dalam pengerjaan soal ini mereka langsung menggunakan rumus molaritas (M= mol ) tanpa mencari dulu ekivalen dari masing-masing senyawa. Tabel 20: Kutipan hasil pekerjaan mahasiswa dan kunci jawaban untuk soal nomor B. 250 ml - Pada penetralan sempurna 1 mol H 3PO 4 = 3 ekivalen 1 mol Ca(OH) 2 = 2 ekivalen 5.55 g Ca(OH) 2 = 5.55 = mol mol Ca(OH) 2 = 0.15 ekivalen - H 3PO 4 yang diperlukan yaitu: 1 ekivalen H 3PO 4 = 1 3 mol 0,15 ekivalen H 3PO 4 = 1 x 0,15 = 0,05 mol 3 M = mol V 0.20 M = V= 0.05 mol V 0.05 mol 0.20 M = 0.25 L = 250 ml Jadi, 0.20 M H 3PO 4 yang diperlukan adalah 250 ml 19. B.250 M = mol/l = 0.005/0.20 = L = 250 ml V
13 Sedangkan untuk nomor 20 persentase kesalahan konsep sebesar 10%. Berikut ini disajikan tabel kutipan hasil hasil pekerjaan mahasiswa. Tabel 21: Kutipan hasil pekerjaan mahasiswa dan kunci jawaban untuk soal nomor B. 16 Ml Dik : 0,25 M KMnO 4 3,636 g FeSO 4 Mr: KMnO 4 = 158; FeSO 4 = 151,8 Dit: Vol. KMnO 4 =.? Jawab: - MnO 4 - berubah menjadi Mn 2+ Bilangan oksidasi Mn berubah dari +7 menjadi +2, jadi 1 mol KMnO 4 = 5 ekiv - Fe 2+ dioksidasi menjadi Fe 3+ Bilangan oksidasi Fe berubah dari +2 menjadi +3, jadi 1 mol FeSO 4 = 1 ekiv 3,636 g FeSO 4 = 3,636/151,8 = 0,02 mol = 0,02 ekiv - KMnO 4 yang diperlukan yaitu: 1 ekivalen KMnO 4 = 1 5 mol 0,02 ekivalen = 1 x 0,02 = 0,004 mol, jadi KMnO4 5 yang diperlukan adalah 0,02 ekivalen = 0,004 mol. M = mol V 0,25 M = 0,004 V V = 0,004 = 0,016 L atau 16 ml 0,25 Jadi volume KMnO 4 yang diperlukan yaitu 16 ml 20. B.16 ml mo = gr/mr = 3,636 / 158 = 0.02 M = mol/l = 0.02 / 0.25 = 0.08 L = 80 ml. Karena dioption tidak ada saya memilih B. Karena 80/0,2 = 16 ml. Dari tabel tersebut dapat disimpulkan bahwa tingkat kemampuan mahasiswa dalam menyelesaikan soal hitungan kimia masih kurang (rendah). Artinya mahasiswa tersebut tidak dapat menggunakan strategi untuk menyelesaikan masalah pada konsep hitungan kimia dengan benar sehingga mengalami kekeliruan dalam penggunaan rumus atau mengalami kesalahan konsep seperti halnya pada perhitungan ekivalen asam basa. Faktor penyebab kesalahan konsep yaitu dikarenakan adanya prakonsepsi yang salah. Prakonsepsi yang salah ini jika dibiarkan akan menjadi miskonsepi yang terus menumpuk hingga dewasa. Reasoning atau penalaran yang tidak lengkap atau salah juga menjadi penyebab miskonsepsi. Penalaran yang salah terjadi karena logika yang salah dalam mengambil kesimpulan. Sedangkan pengamatan yang tidak lengkap dapat menyebabkan kesimpulan yang salah. Selain itu kesalahan konsep ini juga disebabkan karena mahasiswa menganggap suatu konsep selalu sama dengan konsep yang lain seperti halnya asosiasi seseorang terhadap istilah yang ditemukan dalam pembelajaran dan kehidupan sehari-hari sering menimbulkan salah penafsiran.
14 KESIMPULAN DAN SARAN Kesimpulan Berdasarkan hasil penelitian dan hasil analisis ditemukan kesalahan konsep yang dialami mahasiswa pada pokok bahasan reaksi reduksi oksidasi yaitu pada indikator satu mahasiswa tidak dapat menentukan bilangan oksidasi dari suatu senyawa dengan benar yaitu sebesar 19,60%; pada indikator dua mahasiswa sulit menentukan senyawa yang mengalami oksidator dan reduktor sebesar 20%; pada tiga mahasiswa tidak dapat menentukan reaksi yang tergolong reaksi reduksi oksidasi berdasarkan persamaan reaksi yaitu sebesar 23,09%; pada indikator empat, mahasiswa tidak memperhatikan masing-masing koefisien (kiri dan kanan) serta tidak dapat menentukan banyaknya mol dari suatu senyawa sebesar 22,57% dan pada lima mahasiswa salah menggunakan rumus dalam menghitung ekivalen redoks dan ekivalen asam basa yaitu sebesar 22,70%. Saran Berdasarkan kesimpulan hasil penelitian peneliti mengharapkan agar perlunya dilakukan penelitian lanjutan untuk para pendidik agar dapat mengantisipasi terjadinya kesalahan konsep yang berkelanjutan dengan cara memberi penekanan pada konsep-konsep yang belum dipahami atau yang sulit untuk dimengerti oleh mahasiswa dan hendaknya perlu merancang suatu strategi dalam pembelajaran yang tepat sehingga dapat meningkatkan pengetahuan mahasiswa dalam memahami konsep kimia. DAFTAR PUSTAKA Agustina, Alviya dan Dian Novita pengembangan media pembelajaran video untuk melatih kemampuan memcahkan masalah pada materi larutan asam basa. Unesa Journal of Chemical Education Vol.1, No.1, tahun 2012, hal. 11 Djihu, Satria A Identifikasi Kesalahan Siswa Kelas X SMA Negeri 1 Kota Gorontalo dalam Memahami Konsep Ikatan Kimia Tahun Pelajaran 2011/2012. Skripsi. Jurusan Kimia, Universitas Negeri Gorontalo. Gorontalo Nazar, M., Sulastri, Sri W, dan Rakhmi F Identifikasi Miskonsepsi Siswa Pada Konsep Faktor-Faktor yang Mempengaruhi Laju Reaksi. Jurnal Kimia, Jurusan Pendidikan Kimia Unsyiah Banda Aceh Tayubi, R.Yuyu Identifikasi Miskonsepsi pada Konsep-Konsep Fisika menggunakan Certainty Of response Index (CRI). Mimbar Pendidikan No.3/XXIV/2001, hal.5 Tuysuz, C Development of Two-Tier Instrument and Assess Student Understanding in Chemistry. Scientific Research and Essay, 4 (6):
REAKSI REDOKS dan ELEKTROKIMIA
 REAKSI REDOKS dan ELEKTROKIMIA 1. Konsep Reduksi Oksidasi (Redoks) No Reaksi Oksidasi Reaksi Reduksi 1 reaksi penambahan oksigen reaksi pengurangan oksigen 2 peristiwa pelepasan elektron Contoh : Cu Cu
REAKSI REDOKS dan ELEKTROKIMIA 1. Konsep Reduksi Oksidasi (Redoks) No Reaksi Oksidasi Reaksi Reduksi 1 reaksi penambahan oksigen reaksi pengurangan oksigen 2 peristiwa pelepasan elektron Contoh : Cu Cu
Sulistyani, M.Si.
 Sulistyani, M.Si. sulistyani@uny.ac.id Reaksi oksidasi: perubahan kimia suatu spesies (atom, unsur, molekul) melepaskan elektron. Cu Cu 2+ + 2e Reaksi reduksi: perubahan kimia suatu spesies (atom, unsur,
Sulistyani, M.Si. sulistyani@uny.ac.id Reaksi oksidasi: perubahan kimia suatu spesies (atom, unsur, molekul) melepaskan elektron. Cu Cu 2+ + 2e Reaksi reduksi: perubahan kimia suatu spesies (atom, unsur,
Reaksi Redoks. Cu 2+ (aq) + 2e - Cu(s) Zn(s) Zn 2+ (aq) + 2e -
 KIMIA KELAS XII IPA KURIKULUM GABUNGAN 03 Sesi NGAN Reaksi Redoks Reaksi redoks (reduksioksidasi) adalah reaksi kimia yang melibatkan perubahan bilangan oksidasi. Pada dasarnya, reaksi redoks adalah gabungan
KIMIA KELAS XII IPA KURIKULUM GABUNGAN 03 Sesi NGAN Reaksi Redoks Reaksi redoks (reduksioksidasi) adalah reaksi kimia yang melibatkan perubahan bilangan oksidasi. Pada dasarnya, reaksi redoks adalah gabungan
b. Ruas yang kurang H maka ditambah H 2 O. untuk suasana basa: a. Ruas yang kurang O maka ditambah OH - ( tetapi koefisien OH - langsung dikali 2)
 Cara Perubahan Bilangan Oksidasi 1. Tentukan bilangan oksidasi dari atom yang mengalami kenaikan biloks (oksidasi) dan penurunan biloks (reduksi). 2. Setarakan (samakan) nilai kenaikan dan penurunan biloks
Cara Perubahan Bilangan Oksidasi 1. Tentukan bilangan oksidasi dari atom yang mengalami kenaikan biloks (oksidasi) dan penurunan biloks (reduksi). 2. Setarakan (samakan) nilai kenaikan dan penurunan biloks
Redoks dan Elektrokimia Tim Kimia FTP
 Redoks dan Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis
Redoks dan Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis
C. Reaksi oksidasi reduksi berdasarkan peningkatan dan penurunan bilangan oksidasi. Bilangan Oksidasi (biloks)
 97 Nama : Kelompok : Mata Pelajaran : Kimia Kelas/Semester : X 5 /2 Alokasi Waktu : 2 x 45 menit. Materi pokok : Konsep Redoks Standar Kompetensi : 3. Memahami sifat-sifat larutan elektrolit dan non elektrolit
97 Nama : Kelompok : Mata Pelajaran : Kimia Kelas/Semester : X 5 /2 Alokasi Waktu : 2 x 45 menit. Materi pokok : Konsep Redoks Standar Kompetensi : 3. Memahami sifat-sifat larutan elektrolit dan non elektrolit
LARUTAN ELEKTROLIT DAN NONELEKTROLIT (Diskusi Informasi) INFORMASI Larutan adalah campuran yang homogen antara zat terlarut dan zat pelarut.
 LARUTAN ELEKTROLIT DAN NONELEKTROLIT (Diskusi Informasi) INFORMASI Larutan adalah campuran yang homogen antara zat terlarut dan zat pelarut. Berdasarkan daya hantar listriknya, larutan dapat digolongkan
LARUTAN ELEKTROLIT DAN NONELEKTROLIT (Diskusi Informasi) INFORMASI Larutan adalah campuran yang homogen antara zat terlarut dan zat pelarut. Berdasarkan daya hantar listriknya, larutan dapat digolongkan
REDOKS dan ELEKTROKIMIA
 REDOKS dan ELEKTROKIMIA Overview Konsep termodinamika tidak hanya berhubungan dengan mesin uap, atau transfer energi berupa kalor dan kerja Dalam konteks kehidupan sehari-hari aplikasinya sangat luas mulai
REDOKS dan ELEKTROKIMIA Overview Konsep termodinamika tidak hanya berhubungan dengan mesin uap, atau transfer energi berupa kalor dan kerja Dalam konteks kehidupan sehari-hari aplikasinya sangat luas mulai
RENCANA PELAKSANAAN PEMBELAJARAN (RPP)
 No. Dokumen : F/751/WKS1/P/5 No. Revisi : 1 Tanggal Berlaku : 1 Juli 2016 RENCANA PELAKSANAAN PEMBELAJARAN (RPP) Satuan Pendidikan : SMA Negeri 1 Godean Mata Pelajaran : Kimia Kelas/Semester : XII/ Gasal
No. Dokumen : F/751/WKS1/P/5 No. Revisi : 1 Tanggal Berlaku : 1 Juli 2016 RENCANA PELAKSANAAN PEMBELAJARAN (RPP) Satuan Pendidikan : SMA Negeri 1 Godean Mata Pelajaran : Kimia Kelas/Semester : XII/ Gasal
TES PRESTASI BELAJAR
 TES PRESTASI BELAJAR Hari/tanggal : selasa/8 Mei 2012 Mata Pelajaran: Kimia Waktu : 90 menit Petunjuk : 1. Berdoalah sebelum mengerjakan soal 2. Bacalah petunjuk soal terlebih dahulu 3. Pilih salah satu
TES PRESTASI BELAJAR Hari/tanggal : selasa/8 Mei 2012 Mata Pelajaran: Kimia Waktu : 90 menit Petunjuk : 1. Berdoalah sebelum mengerjakan soal 2. Bacalah petunjuk soal terlebih dahulu 3. Pilih salah satu
Elektrokimia. Tim Kimia FTP
 Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis ini merupakan
Elektrokimia Tim Kimia FTP KONSEP ELEKTROKIMIA Dalam arti yang sempit elektrokimia adalah ilmu pengetahuan yang mempelajari peristiwa-peristiwa yang terjadi di dalam sel elektrokimia. Sel jenis ini merupakan
RENCANA PELAKSANAAN PEMBELAJARAN (RPP)
 1 No. Dokumen : F/751/WKS1/P/5 No. Revisi : 1 Tanggal Berlaku : 1 Juli 2016 RENCANA PELAKSANAAN PEMBELAJARAN (RPP) Satuan Pendidikan : SMA Negeri 1 Godean Mata Pelajaran : Kimia Kelas/Semester : XII/ Gasal
1 No. Dokumen : F/751/WKS1/P/5 No. Revisi : 1 Tanggal Berlaku : 1 Juli 2016 RENCANA PELAKSANAAN PEMBELAJARAN (RPP) Satuan Pendidikan : SMA Negeri 1 Godean Mata Pelajaran : Kimia Kelas/Semester : XII/ Gasal
TES PRESTASI BELAJAR. Hari/tanggal : Senin/7 Mei 2012 Mata Pelajaran: Kimia Waktu : 90 menit
 TES PRESTASI BELAJAR Hari/tanggal : Senin/7 Mei 2012 Mata Pelajaran: Kimia Waktu : 90 menit Petunjuk : 1. Berdoalah sebelum mengerjakan soal 2. Bacalah petunjuk soal terlebih dahulu 3. Pilih salah satu
TES PRESTASI BELAJAR Hari/tanggal : Senin/7 Mei 2012 Mata Pelajaran: Kimia Waktu : 90 menit Petunjuk : 1. Berdoalah sebelum mengerjakan soal 2. Bacalah petunjuk soal terlebih dahulu 3. Pilih salah satu
1. Bilangan Oksidasi (b.o)
 Reaksi Redoks dan Elektrokimia 1. Bilangan Oksidasi (b.o) 1.1 Pengertian Secara sederhana, bilangan oksidasi sering disebut sebagai tingkat muatan suatu atom dalam molekul atau ion. Bilangan oksidasi bukanlah
Reaksi Redoks dan Elektrokimia 1. Bilangan Oksidasi (b.o) 1.1 Pengertian Secara sederhana, bilangan oksidasi sering disebut sebagai tingkat muatan suatu atom dalam molekul atau ion. Bilangan oksidasi bukanlah
TITRASI REDUKSI OKSIDASI OXIDATION- REDUCTION TITRATION
 TITRASI REDUKSI OKSIDASI OXIDATION- REDUCTION TITRATION HERMAN, S.Pd., M.Si FARMASI UNMUL TITRASI REDUKSI OKSIDASI TITRASI REDUKSI OKSIDASI DEFINISI analisis titrimetri yang didasarkan pada reaksi reduksi
TITRASI REDUKSI OKSIDASI OXIDATION- REDUCTION TITRATION HERMAN, S.Pd., M.Si FARMASI UNMUL TITRASI REDUKSI OKSIDASI TITRASI REDUKSI OKSIDASI DEFINISI analisis titrimetri yang didasarkan pada reaksi reduksi
STUDI EVALUASI PEMAHAMAN KONSEP REAKSI REDOKS MENGGUNAKAN TES OBJEKTIF BERALASAN PADA SISWA KELAS X SMA NEGERI 10 MALANG
 STUDI EVALUASI PEMAHAMAN KONSEP REAKSI REDOKS MENGGUNAKAN TES OBJEKTIF BERALASAN PADA SISWA KELAS X SMA NEGERI 10 MALANG Binti Solikhatul Jannah, Ida Bagus Suryadharma, Fauziatul Fajaroh Universitas Negeri
STUDI EVALUASI PEMAHAMAN KONSEP REAKSI REDOKS MENGGUNAKAN TES OBJEKTIF BERALASAN PADA SISWA KELAS X SMA NEGERI 10 MALANG Binti Solikhatul Jannah, Ida Bagus Suryadharma, Fauziatul Fajaroh Universitas Negeri
3. Sebagian dari daur nitrogen di alam, adalah sebagai berikut Urutan bilangan oksidasi nitrogen dimulai dari N 2, adalah.
 Soal dan Pembahasan Reaksi Redok 20 butir Pilihan ganda 1. H 2 S dapat dioksidasi oleh KMnO 4 menghasilkan antara lain K 2 SO 4 dan MnO 2. Dalam reaksi tersebut setiap mol H 2 S melepaskan. A. 2 mol elektron
Soal dan Pembahasan Reaksi Redok 20 butir Pilihan ganda 1. H 2 S dapat dioksidasi oleh KMnO 4 menghasilkan antara lain K 2 SO 4 dan MnO 2. Dalam reaksi tersebut setiap mol H 2 S melepaskan. A. 2 mol elektron
REAKSI REDUKSI-OKSIDASI (REAKSI REDOKS)
 BAB VI REAKSI REDUKSIOKSIDASI (REAKSI REDOKS) Telah dipelajari bahwa persamaan reaksi kimia menyatakan perubahan materi dalam suatu reaksi kimia. Dalam reaksi kimia, jumlah atomatom sebelum reaksi sama
BAB VI REAKSI REDUKSIOKSIDASI (REAKSI REDOKS) Telah dipelajari bahwa persamaan reaksi kimia menyatakan perubahan materi dalam suatu reaksi kimia. Dalam reaksi kimia, jumlah atomatom sebelum reaksi sama
PEMBAHASAN KIMIA 2011(NGACAK)
 PEMBAHASAN KIMIA 2011(NGACAK) Berikut adalah 3 soal kimia pada UNSUR 2011 tentang senyawa karbon. Soal yang pertama adalah pengenalan jenis-jenis reaksi kimia pada senyawaan karbon. Reaksi adisi ~ reaksi
PEMBAHASAN KIMIA 2011(NGACAK) Berikut adalah 3 soal kimia pada UNSUR 2011 tentang senyawa karbon. Soal yang pertama adalah pengenalan jenis-jenis reaksi kimia pada senyawaan karbon. Reaksi adisi ~ reaksi
LARUTAN ELEKTROLIT DAN NON ELEKTROLIT. Perbandingan sifat-sifat larutan elektrolit dan larutan non elektrolit.
 KIMIA DASAR I PERTEMUAN 1 Tujuan Perkuliahan: Setelah proses pembelajaran ini selesai, diharapkan mahasiswa dapat: 1. Menjelaskan pengertian dari larutan beserta contohnya. 2. Menjelaskan perbedaan larutan
KIMIA DASAR I PERTEMUAN 1 Tujuan Perkuliahan: Setelah proses pembelajaran ini selesai, diharapkan mahasiswa dapat: 1. Menjelaskan pengertian dari larutan beserta contohnya. 2. Menjelaskan perbedaan larutan
BAB IV HASIL PENELITIAN DAN PEMBAHASAN. Data-data yang telah dikumpulkan dapat dikaji lebih lanjut untuk dilihat
 32 BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1. Hasil Penelitian Data-data yang telah dikumpulkan dapat dikaji lebih lanjut untuk dilihat bagaimana komposisi soal berdasarkan domain kognitif Taksonomi Bloom
32 BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1. Hasil Penelitian Data-data yang telah dikumpulkan dapat dikaji lebih lanjut untuk dilihat bagaimana komposisi soal berdasarkan domain kognitif Taksonomi Bloom
Persamaan Redoks. Cu(s) + 2Ag + (aq) -> Cu 2+ (aq) + 2Ag(s)
 Persamaan Redoks Dalam reaksi redoks, satu zat akan teroksidasi dan yang lainnya tereduksi. Proses ini terkadang mudah untuk dilihat; untuk contoh ketika balok logam tembaga ditempatkan dalam larutan perak
Persamaan Redoks Dalam reaksi redoks, satu zat akan teroksidasi dan yang lainnya tereduksi. Proses ini terkadang mudah untuk dilihat; untuk contoh ketika balok logam tembaga ditempatkan dalam larutan perak
RENCANA PELAKSANAAN PEMBELAJARAN. Kelas/Semester : X-1/ 2
 RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah Mata Pelajaran : SMA ISEN MULANG : Kimia Kelas/Semester : X-1/ Pertemuan Ke- Pokok Bahasan Sub Pokok Bahasan Alokasi Waktu : (dua) : Reaksi Oksidasi dan Reduksi
RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah Mata Pelajaran : SMA ISEN MULANG : Kimia Kelas/Semester : X-1/ Pertemuan Ke- Pokok Bahasan Sub Pokok Bahasan Alokasi Waktu : (dua) : Reaksi Oksidasi dan Reduksi
KATA PENGANTAR. Bangko, sepetember Penyusun
 KATA PENGANTAR Puji syukur kami ucapkan ke hadirat Tuhan Yang Maha Esa karena atas rahmat-nya lah sehingga kami dapat menyelesaikan makalah ini sebagai salah satu tugas dari mata kuliah Kimia Dasar. Makalah
KATA PENGANTAR Puji syukur kami ucapkan ke hadirat Tuhan Yang Maha Esa karena atas rahmat-nya lah sehingga kami dapat menyelesaikan makalah ini sebagai salah satu tugas dari mata kuliah Kimia Dasar. Makalah
Metode titrimetri dikenal juga sebagai metode volumetri
 Metode titrimetri dikenal juga sebagai metode volumetri? yaitu, merupakan metode analisis kuantitatif yang didasarkan pada prinsip pengukuran volume. 1 Macam Analisa Volumetri 1. Gasometri adalah volumetri
Metode titrimetri dikenal juga sebagai metode volumetri? yaitu, merupakan metode analisis kuantitatif yang didasarkan pada prinsip pengukuran volume. 1 Macam Analisa Volumetri 1. Gasometri adalah volumetri
Sifat Koligatif Larutan (Bagian I)
 KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 01 Sesi NGAN Sifat Koligatif Larutan (Bagian I) Sebelum mempelajari sifat koligatif larutan, terlebih dahulu kita akan meninjau kembali sedikit pengetahuan mengenai
KIMIA KELAS XII IPA - KURIKULUM GABUNGAN 01 Sesi NGAN Sifat Koligatif Larutan (Bagian I) Sebelum mempelajari sifat koligatif larutan, terlebih dahulu kita akan meninjau kembali sedikit pengetahuan mengenai
Ujian Akhir Semester Mata Pelajaran Kimia Kelas X Wacana berikut digunakan untuk menjawab soal no 1 dan 2. Ditentukan 5 unsur dengan konfigurasi
 Ujian Akhir Semester Mata Pelajaran Kimia Kelas X Wacana berikut digunakan untuk menjawab soal no 1 dan 2. Ditentukan 5 unsur dengan konfigurasi elektron sebagai berikut: P : 2 8 7 S : 2 8 8 Q : 2 8 8
Ujian Akhir Semester Mata Pelajaran Kimia Kelas X Wacana berikut digunakan untuk menjawab soal no 1 dan 2. Ditentukan 5 unsur dengan konfigurasi elektron sebagai berikut: P : 2 8 7 S : 2 8 8 Q : 2 8 8
L A R U T A N _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA
 L A R U T A N _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA 1. Larutan Elektrolit 2. Persamaan Ionik 3. Reaksi Asam Basa 4. Perlakuan Larutan
L A R U T A N _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA 1. Larutan Elektrolit 2. Persamaan Ionik 3. Reaksi Asam Basa 4. Perlakuan Larutan
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
Chapter 7 Larutan tirtawi (aqueous solution)
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi modif oleh Dr I Kartini Chapter 7 Larutan tirtawi (aqueous solution) Larutan adalah campuran yang homogen dari dua atau lebih
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi modif oleh Dr I Kartini Chapter 7 Larutan tirtawi (aqueous solution) Larutan adalah campuran yang homogen dari dua atau lebih
Soal-soal Redoks dan elektrokimia
 1. Reaksi redoks : MnO 4 (aq) + C 2 O 4 2- (aq) Mn 2+ (aq) + CO 2 (g), berlangsung dalam suasana asam. Setiap mol MnO 4 memerlukan H + sebanyak A. 4 mol B. 6 mol D. 10 mol C. 8 mol E. 12 mol 2. Reaksi
1. Reaksi redoks : MnO 4 (aq) + C 2 O 4 2- (aq) Mn 2+ (aq) + CO 2 (g), berlangsung dalam suasana asam. Setiap mol MnO 4 memerlukan H + sebanyak A. 4 mol B. 6 mol D. 10 mol C. 8 mol E. 12 mol 2. Reaksi
ELEKTROKIMIA Reaksi Reduksi - Oksidasi
 Jurusan Kimia - FMIPA Universitas Gadjah Mada (UGM) ELEKTROKIMIA Reaksi Reduksi - Oksidasi Drs. Iqmal Tahir, M.Si. Laboratorium Kimia Fisika,, Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam
Jurusan Kimia - FMIPA Universitas Gadjah Mada (UGM) ELEKTROKIMIA Reaksi Reduksi - Oksidasi Drs. Iqmal Tahir, M.Si. Laboratorium Kimia Fisika,, Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A. D. Cu E. Zn
 1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
1. Tragedi Minamata di Jepang disebabkan pencemaran logam berat... A. Hg B. Ag C. Pb Kunci : A D. Cu E. Zn 2. Nomor atom belerang adalah 16. Dalam anion sulfida, S 2-, konfigurasi elektronnya adalah...
3. ELEKTROKIMIA. Contoh elektrolisis: a. Elektrolisis larutan HCl dengan elektroda Pt, reaksinya: 2HCl (aq)
 3. ELEKTROKIMIA 1. Elektrolisis Elektrolisis adalah peristiwa penguraian elektrolit oleh arus listrik searah dengan menggunakan dua macam elektroda. Elektroda tersebut adalah katoda (elektroda yang dihubungkan
3. ELEKTROKIMIA 1. Elektrolisis Elektrolisis adalah peristiwa penguraian elektrolit oleh arus listrik searah dengan menggunakan dua macam elektroda. Elektroda tersebut adalah katoda (elektroda yang dihubungkan
REAKSI REDUKSI DAN OKSIDASI
 REAKSI REDUKSI DAN OKSIDASI Definisi Reduksi Oksidasi menerima elektron melepas elektron Contoh : Mg Mg 2+ + 2e - (Oksidasi ) O 2 + 4e - 2O 2- (Reduksi) Senyawa pengoksidasi adalah zat yang mengambil elektron
REAKSI REDUKSI DAN OKSIDASI Definisi Reduksi Oksidasi menerima elektron melepas elektron Contoh : Mg Mg 2+ + 2e - (Oksidasi ) O 2 + 4e - 2O 2- (Reduksi) Senyawa pengoksidasi adalah zat yang mengambil elektron
Fraksi mol adalah perbandingan antara jumiah mol suatu komponen dengan jumlah mol seluruh komponen yang terdapat dalam larutan.
 Konsentrasi Larutan Ditulis oleh Redaksi chem-is-try.org pada 02-05-2009 Konsentrasi merupakan cara untuk menyatakan hubungan kuantitatif antara zat terlarut dan pelarut. Menyatakan konsentrasi larutan
Konsentrasi Larutan Ditulis oleh Redaksi chem-is-try.org pada 02-05-2009 Konsentrasi merupakan cara untuk menyatakan hubungan kuantitatif antara zat terlarut dan pelarut. Menyatakan konsentrasi larutan
REDOKS DAN ELEKTROKIMIA
 REDOKS DAN ELEKTROKIMIA 1. Bilangan oksidasi dari unsur Mn pada senyawa KMnO4 adalah... A. +7 B. +6 C. +3 D. +2 E. +1 Jumlah bilangan oksidasi senyawa adalah nol, Kalium (K) mempunyai biloks +1 karena
REDOKS DAN ELEKTROKIMIA 1. Bilangan oksidasi dari unsur Mn pada senyawa KMnO4 adalah... A. +7 B. +6 C. +3 D. +2 E. +1 Jumlah bilangan oksidasi senyawa adalah nol, Kalium (K) mempunyai biloks +1 karena
OLEH Ni Nyoman Widiantari Telah diperiksa dan disetujui oleh NIP NIP
 LEMBAR PENGESAHAN JURNAL EFEKTIVITAS SAJIAN BAHAN AJAR MENGGUNAKAN ANALOGI DAN SUBMIKROSKOPIK DALAM MEREDUKSI MISKONSEPSI ASAM BASA PADA SISWA SMA KELAS XI DI GORONTALO OLEH Ni Nyoman Widiantari 441411048
LEMBAR PENGESAHAN JURNAL EFEKTIVITAS SAJIAN BAHAN AJAR MENGGUNAKAN ANALOGI DAN SUBMIKROSKOPIK DALAM MEREDUKSI MISKONSEPSI ASAM BASA PADA SISWA SMA KELAS XI DI GORONTALO OLEH Ni Nyoman Widiantari 441411048
BAB I STOIKHIOMETRI I - 1
 BAB I STOIKHIOMETRI 1.1 PENDAHULUAN Setiap zat, unsur, senyawa dalam kimia mempunyai nama dan rumus uniknya sendiri. Cara tersingkat untuk memerikan suatu reaksi kimia adalah dengan menuliskan rumus untuk
BAB I STOIKHIOMETRI 1.1 PENDAHULUAN Setiap zat, unsur, senyawa dalam kimia mempunyai nama dan rumus uniknya sendiri. Cara tersingkat untuk memerikan suatu reaksi kimia adalah dengan menuliskan rumus untuk
D. beta dan alfa E. alfa dan beta
 1. Pada peluruhan menjadi kemudian meluruh menjadi, partikel-partikel yang dipancarkan berturut-turut adalah... A. foton dan beta B. foton dan alfa C. beta dan foton Reaksi peluruhan : D. beta dan alfa
1. Pada peluruhan menjadi kemudian meluruh menjadi, partikel-partikel yang dipancarkan berturut-turut adalah... A. foton dan beta B. foton dan alfa C. beta dan foton Reaksi peluruhan : D. beta dan alfa
Oksidasi dan Reduksi
 Oksidasi dan Reduksi Reaksi kimia dapat diklasifikasikan dengan beberapa cara antara lain reduksi-oksidasi (redoks) Reaksi : selalu terjadi bersama-sama. Zat yang teroksidasi = reduktor Zat yang tereduksi
Oksidasi dan Reduksi Reaksi kimia dapat diklasifikasikan dengan beberapa cara antara lain reduksi-oksidasi (redoks) Reaksi : selalu terjadi bersama-sama. Zat yang teroksidasi = reduktor Zat yang tereduksi
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya.
 30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
YAYASAN PEMBINA UNIVERSITAS NEGERI JAKARTA SMA LABSCHOOL KEBAYORAN
 YAYASAN PEMBINA UNIVERSITAS NEGERI JAKARTA SMA LABSCHOOL KEBAYORAN ULANGAN HARIAN TERPROGRAM ( UHT ) Mata Pelajaran : KIMIA Kelas/Program : XII IPA / Reguler Hari,Tanggal : Kamis, 2 Oktober 2014 Waktu
YAYASAN PEMBINA UNIVERSITAS NEGERI JAKARTA SMA LABSCHOOL KEBAYORAN ULANGAN HARIAN TERPROGRAM ( UHT ) Mata Pelajaran : KIMIA Kelas/Program : XII IPA / Reguler Hari,Tanggal : Kamis, 2 Oktober 2014 Waktu
PEMBAHASAN UJIAN NASIONAL KIMIA TAHUN 2006
 UJIAN NASIONAL KIMIA TAHUN 2006 HTTP://GUDANGSOALPRO.BLOGSPOT.COM 1 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53 T yang terletak pada golongan yang sama dalam sistem periodik unsur adalah...
UJIAN NASIONAL KIMIA TAHUN 2006 HTTP://GUDANGSOALPRO.BLOGSPOT.COM 1 1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53 T yang terletak pada golongan yang sama dalam sistem periodik unsur adalah...
LEMBARAN SOAL 11. Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : X ( SEPULUH )
 LEMBARAN SOAL 11 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : X ( SEPULUH ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan
LEMBARAN SOAL 11 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : X ( SEPULUH ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan
Reaksi Oksidasi-Reduksi
 Reaksi ksidasireduksi Reaksi yang melibatkan transfer Elektron disebut ksidasireduksi atau Reaksi Redoks ksidasi adalah hilangnya Elektron suatu reaktan Reduksi adalah penangkapan Elektron oleh reaktan
Reaksi ksidasireduksi Reaksi yang melibatkan transfer Elektron disebut ksidasireduksi atau Reaksi Redoks ksidasi adalah hilangnya Elektron suatu reaktan Reduksi adalah penangkapan Elektron oleh reaktan
TES AWAL II KIMIA DASAR II (KI-112)
 TES AWAL II KIMIA DASAR II (KI112) NAMA : Tanda Tangan N I M : JURUSAN :... BERBAGAI DATA. Tetapan gas R = 0,082 L atm mol 1 K 1 = 1,987 kal mol 1 K 1 = 8,314 J mol 1 K 1 Tetapan Avogadro = 6,023 x 10
TES AWAL II KIMIA DASAR II (KI112) NAMA : Tanda Tangan N I M : JURUSAN :... BERBAGAI DATA. Tetapan gas R = 0,082 L atm mol 1 K 1 = 1,987 kal mol 1 K 1 = 8,314 J mol 1 K 1 Tetapan Avogadro = 6,023 x 10
MODUL SEL ELEKTROLISIS
 MODUL SEL ELEKTROLISIS Standar Kompetensi : 2. Menerapkan konsep reaksi oksidasi-reduksi dan elektrokimia dalam teknologi dan kehidupan sehari-hari. Kompetensi dasar : 2.2. Menjelaskan reaksi oksidasi-reduksi
MODUL SEL ELEKTROLISIS Standar Kompetensi : 2. Menerapkan konsep reaksi oksidasi-reduksi dan elektrokimia dalam teknologi dan kehidupan sehari-hari. Kompetensi dasar : 2.2. Menjelaskan reaksi oksidasi-reduksi
PRODUKSI GAS HIDROGEN MELALUI PROSES ELEKTROLISIS SEBAGAI SUMBER ENERGI
 PRODUKSI GAS HIDROGEN MELALUI PROSES ELEKTROLISIS SEBAGAI SUMBER ENERGI Oleh: Ni Made Ayu Yasmitha Andewi 3307.100.021 Dosen Pembimbing: Prof. Dr.Ir. Wahyono Hadi, M.Sc JURUSAN TEKNIK LINGKUNGAN FAKULTAS
PRODUKSI GAS HIDROGEN MELALUI PROSES ELEKTROLISIS SEBAGAI SUMBER ENERGI Oleh: Ni Made Ayu Yasmitha Andewi 3307.100.021 Dosen Pembimbing: Prof. Dr.Ir. Wahyono Hadi, M.Sc JURUSAN TEKNIK LINGKUNGAN FAKULTAS
REAKSI REDUKSI OKSIDASI (REDOKS)
 REAKSI REDUKSI OKSIDASI (REDOKS) I. Judul eksperimen : Reaksi reduksi oksidasi. II. Tujuan : Mengamati terjadinya reaksi reduksi oksidasi dalam berbagai situasi lingkungan serta penyetaraan persamaan koefisien
REAKSI REDUKSI OKSIDASI (REDOKS) I. Judul eksperimen : Reaksi reduksi oksidasi. II. Tujuan : Mengamati terjadinya reaksi reduksi oksidasi dalam berbagai situasi lingkungan serta penyetaraan persamaan koefisien
KIMIa ASAM-BASA II. K e l a s. A. Kesetimbangan Air. Kurikulum 2006/2013
 Kurikulum 2006/2013 KIMIa K e l a s XI ASAM-BASA II Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami kesetimbangan air. 2. Memahami pengaruh asam
Kurikulum 2006/2013 KIMIa K e l a s XI ASAM-BASA II Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami kesetimbangan air. 2. Memahami pengaruh asam
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
LEMBAR KERJA PESERTA DIDIK (LKPD) Reaksi Reduksi-Oksidasi
 LEMBAR KERJA PESERTA DIDIK (LKPD) Reaksi Reduksi-Oksidasi 1. Standar Komptensi 2. Kompetensi Dasar : 3. Memahami sifat-sifat larutan non-elektrolit dan elektrolit, serta reaksi oksidasi-reduksi : 3.2 Menjelaskan
LEMBAR KERJA PESERTA DIDIK (LKPD) Reaksi Reduksi-Oksidasi 1. Standar Komptensi 2. Kompetensi Dasar : 3. Memahami sifat-sifat larutan non-elektrolit dan elektrolit, serta reaksi oksidasi-reduksi : 3.2 Menjelaskan
BAB I PENDAHULUAN. menciptakan manusia yang dewasa, berkualitas dan berdaya saing, pendidikan
 A. Latar Belakang BAB I PENDAHULUAN Pendidikan merupakan sarana utama dalam membentuk dan menciptakan manusia yang dewasa, berkualitas dan memiliki daya saing di dalam masyarakat. Dalam upaya menciptakan
A. Latar Belakang BAB I PENDAHULUAN Pendidikan merupakan sarana utama dalam membentuk dan menciptakan manusia yang dewasa, berkualitas dan memiliki daya saing di dalam masyarakat. Dalam upaya menciptakan
BAB IV HASIL PENELITIAN DAN PEMBAHASAN
 BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1.Hasil Penelitian Pada dasarnya tujuan utama penelitian ini adalah untuk mengetahui kesulitan belajar siswa pada materi persamaan reaksi di Kelas X dan XI IPA
BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1.Hasil Penelitian Pada dasarnya tujuan utama penelitian ini adalah untuk mengetahui kesulitan belajar siswa pada materi persamaan reaksi di Kelas X dan XI IPA
Reaksi dan Stoikiometri Larutan
 Reaksi dan Stoikiometri Larutan A. PERSAMAAN REAKSI ION Persamaan reaksi ion adalah persamaan reaksi yang menjelaskan bagaimana reaksi antar-ion terjadi pada larutan elektrolit. Persamaan reaksi ion terdiri
Reaksi dan Stoikiometri Larutan A. PERSAMAAN REAKSI ION Persamaan reaksi ion adalah persamaan reaksi yang menjelaskan bagaimana reaksi antar-ion terjadi pada larutan elektrolit. Persamaan reaksi ion terdiri
Rumus Kimia. Mol unsur =
 Rumus Kimia Menentukan Rumus Kimia Zat Rumus kimia zat dapat dibedakan menjadi rumus empiris dan rumus molekul. Rumus empiris dapat ditentukan dengan menghitung mol komponen penyusun zat dengan menggunakan
Rumus Kimia Menentukan Rumus Kimia Zat Rumus kimia zat dapat dibedakan menjadi rumus empiris dan rumus molekul. Rumus empiris dapat ditentukan dengan menghitung mol komponen penyusun zat dengan menggunakan
2. Konfigurasi elektron dua buah unsur tidak sebenarnya:
 . Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
. Atom X memiliki elektron valensi dengan bilangan kuantum: n =, l =, m = 0, dan s =. Periode dan golongan yang mungkin untuk atom X adalah A. dan IIIB B. dan VA C. 4 dan III B D. 4 dan V B E. 5 dan III
D. 2 dan 3 E. 2 dan 5
 1. Pada suhu dan tekanan sama, 40 ml P 2 tepat habis bereaksi dengan 100 ml, Q 2 menghasilkan 40 ml gas PxOy. Harga x dan y adalah... A. 1 dan 2 B. 1 dan 3 C. 1 dan 5 Kunci : E D. 2 dan 3 E. 2 dan 5 Persamaan
1. Pada suhu dan tekanan sama, 40 ml P 2 tepat habis bereaksi dengan 100 ml, Q 2 menghasilkan 40 ml gas PxOy. Harga x dan y adalah... A. 1 dan 2 B. 1 dan 3 C. 1 dan 5 Kunci : E D. 2 dan 3 E. 2 dan 5 Persamaan
BAB I PENDAHULUAN 1.1 Latar Belakang
 BAB I PENDAHULUAN 1.1 Latar Belakang Tujuan pembelajaran sains (IPA) di SMP/MTs sesuai dengan peraturan Mentri Pendidikan Nasional No. 22 Tahun 2006, yaitu agar peserta didik memiliki kemampuan sebagai
BAB I PENDAHULUAN 1.1 Latar Belakang Tujuan pembelajaran sains (IPA) di SMP/MTs sesuai dengan peraturan Mentri Pendidikan Nasional No. 22 Tahun 2006, yaitu agar peserta didik memiliki kemampuan sebagai
BAB 8. ELEKTROKIMIA 8.1 REAKSI REDUKSI OKSIDASI 8.2 SEL ELEKTROKIMIA 8.3 POTENSIAL SEL, ENERGI BEBAS, DAN KESETIMBANGAN 8.4 PERSAMAAN NERNST 8
 BAB 8 BAB 8. ELEKTROKIMIA 8.1 REAKSI REDUKSI OKSIDASI 8.2 SEL ELEKTROKIMIA 8.3 POTENSIAL SEL, ENERGI BEBAS, DAN KESETIMBANGAN 8.4 PERSAMAAN NERNST 8.5 SEL ACCU DAN BAHAN BAKAR 8.6 KOROSI DAN PENCEGAHANNYA
BAB 8 BAB 8. ELEKTROKIMIA 8.1 REAKSI REDUKSI OKSIDASI 8.2 SEL ELEKTROKIMIA 8.3 POTENSIAL SEL, ENERGI BEBAS, DAN KESETIMBANGAN 8.4 PERSAMAAN NERNST 8.5 SEL ACCU DAN BAHAN BAKAR 8.6 KOROSI DAN PENCEGAHANNYA
RENCANA PELAKSANAAN PEMBELAJARAN (RPP)
 No. Dokumen : F/751/WKS1/P/5 No. Revisi : 1 Tanggal : 1 Juli 2016 Berlaku RENCANA PELAKSANAAN PEMBELAJARAN (RPP) Satuan Pendidikan : SMA Negeri 1 Godean Mata Pelajaran : Kimia Kelas/Semester : XII/ Gasal
No. Dokumen : F/751/WKS1/P/5 No. Revisi : 1 Tanggal : 1 Juli 2016 Berlaku RENCANA PELAKSANAAN PEMBELAJARAN (RPP) Satuan Pendidikan : SMA Negeri 1 Godean Mata Pelajaran : Kimia Kelas/Semester : XII/ Gasal
Penerapan Sistem Persamaan Lanjar dalam Penyetaraan Reaksi Kimia
 Penerapan Sistem Persamaan Lanjar dalam Penyetaraan Reaksi Kimia Nugroho Satriyanto 1351038 Program Studi Teknik Informatika Sekolah Teknik Elektro dan Informatika Institut Teknologi Bandung, Jl. Ganesha
Penerapan Sistem Persamaan Lanjar dalam Penyetaraan Reaksi Kimia Nugroho Satriyanto 1351038 Program Studi Teknik Informatika Sekolah Teknik Elektro dan Informatika Institut Teknologi Bandung, Jl. Ganesha
BAB III STOIKIOMETRI
 BAB III STOIKIOMETRI A. Standar Kompetensi: Memahami tentang ilmu kimia dan dasar-dasarnya serta mampu menerapkannya dalam kehidupan se-hari-hari terutama yang berhubungan langsung dengan kehidupan. B.
BAB III STOIKIOMETRI A. Standar Kompetensi: Memahami tentang ilmu kimia dan dasar-dasarnya serta mampu menerapkannya dalam kehidupan se-hari-hari terutama yang berhubungan langsung dengan kehidupan. B.
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H 2 SO 4 0.05 M dibutuhkan larutan H 2 SO 4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5 ml 2. Konsentrasi larutan yang
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI
 KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI KUMPULAN SOAL-SOAL KIMIA LAJU REAKSI 1. Untuk membuat 500 ml larutan H2SO4 0.05 M dibutuhkan larutan H2SO4 5 M sebanyak ml a. 5 ml b. 10 ml c. 2.5 ml d. 15 ml e. 5.5
Reaksi Dan Stoikiometri Larutan
 A. PERSAMAAN REAKSI ION Reaksi Dan Stoikiometri Larutan Persamaan reaksi ion adalah persamaan reaksi yang menjelaskan bagaimana reaksi antar-ion terjadi pada elektrolit. Persamaan reaksi ion terdiri dari:
A. PERSAMAAN REAKSI ION Reaksi Dan Stoikiometri Larutan Persamaan reaksi ion adalah persamaan reaksi yang menjelaskan bagaimana reaksi antar-ion terjadi pada elektrolit. Persamaan reaksi ion terdiri dari:
BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI
 BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI A. STANDAR KOMPETENSI Mendiskripsikan hukumhukum dasar kimia dan penerapannya dalam perhitungan kimia. B. Kompetensi Dasar : Menuliskan nama senyawa anorganik
BAB III TATA NAMA SENYAWA DAN PERSAMAAN REAKSI A. STANDAR KOMPETENSI Mendiskripsikan hukumhukum dasar kimia dan penerapannya dalam perhitungan kimia. B. Kompetensi Dasar : Menuliskan nama senyawa anorganik
PROFIL MISKONSEPSI SISWA SMA KELAS XI MENGGUNAKAN INSTRUMEN TES DIAGNOSTIK TWO TIER MULTIPLE CHOICE PADA MATERI ASAM-BASA
 BAB I PENDAHULUAN A. Latar Belakang Penelitian Penelitian yang dilakukan oleh Lestari (2014), telah dikembangkan instrumen tes diagnostik two tier multiple choice pada materi asam basa. Instrumen ini mencakup
BAB I PENDAHULUAN A. Latar Belakang Penelitian Penelitian yang dilakukan oleh Lestari (2014), telah dikembangkan instrumen tes diagnostik two tier multiple choice pada materi asam basa. Instrumen ini mencakup
Reaksi Oksidasi dan Reduksi
 Kode KIM.07 Reaksi Oksidasi dan Reduksi BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN NASIONAL 2004
Kode KIM.07 Reaksi Oksidasi dan Reduksi BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN NASIONAL 2004
Standar Kompetensi Kompetensi Dasar Nilai Indikator. Sifat Koligatif Larutan
 Model Pengintegrasian Nilai Pendidikan Karakter Standar Kompetensi Kompetensi Dasar Nilai Indikator 1. Menjelaskan sifat-sifat koligatif larutan nonelektrolit dan elektrolit. 1.1 Menjelaskan penurunan
Model Pengintegrasian Nilai Pendidikan Karakter Standar Kompetensi Kompetensi Dasar Nilai Indikator 1. Menjelaskan sifat-sifat koligatif larutan nonelektrolit dan elektrolit. 1.1 Menjelaskan penurunan
Stoikiometri. Berasal dari kata Stoicheion (partikel) dan metron (pengukuran). Cara perhitungan dan pengukuran zat serta campuran kimia.
 Stoikiometri Berasal dari kata Stoicheion (partikel) dan metron (pengukuran). Cara perhitungan dan pengukuran zat serta campuran kimia. Bilangan Avogadro Stoikometri: pengukuran kuantitatif sehingga perlu
Stoikiometri Berasal dari kata Stoicheion (partikel) dan metron (pengukuran). Cara perhitungan dan pengukuran zat serta campuran kimia. Bilangan Avogadro Stoikometri: pengukuran kuantitatif sehingga perlu
KISI KISI SOAL ULANGAN AKHIR SEMESTER GASAL MADRASAH ALIYAH TAHUN PELAJARAN 2015/2016
 KISI KISI SOAL ULANGAN AKHIR SEMESTER GASAL MADRASAH ALIYAH TAHUN PELAJARAN 205/206 MATA PELAJARAN KELAS : KIMIA : XII IPA No Stansar Materi Jumlah Bentuk No Kompetensi Dasar Inikator Silabus Indikator
KISI KISI SOAL ULANGAN AKHIR SEMESTER GASAL MADRASAH ALIYAH TAHUN PELAJARAN 205/206 MATA PELAJARAN KELAS : KIMIA : XII IPA No Stansar Materi Jumlah Bentuk No Kompetensi Dasar Inikator Silabus Indikator
BAB 1V HASIL DAN PEMBAHASAN
 4.1.1 HASIL PENELITIAN BAB 1V HASIL DAN PEMBAHASAN Berdasarkan data hasil penelitian, persentase kemampuan siswa kelas dalam menyelesaikan soal-soal persamaan reaksi kimia dapat dilihat pada tabel dibawah
4.1.1 HASIL PENELITIAN BAB 1V HASIL DAN PEMBAHASAN Berdasarkan data hasil penelitian, persentase kemampuan siswa kelas dalam menyelesaikan soal-soal persamaan reaksi kimia dapat dilihat pada tabel dibawah
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. 32. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
BAB 4 HASIL DAN PEMBAHASAN
 BAB 4 HASIL DAN PEMBAHASAN 4.1. Pemilihan Kelas Penentuan kelas yang akan digunakan sebagai kelas pengembangan butir soal didasarkan pada rata-rata kelas pada ujian semester 1 kelas X MAN 1 Model Kota
BAB 4 HASIL DAN PEMBAHASAN 4.1. Pemilihan Kelas Penentuan kelas yang akan digunakan sebagai kelas pengembangan butir soal didasarkan pada rata-rata kelas pada ujian semester 1 kelas X MAN 1 Model Kota
OKSIDASI-REDUKSI (REDOKS)
 LEMBAR KERJA SISWA OKSIDASI-REDUKSI (REDOKS) UNTUK KELAS X SMA SEMESTER GENAP OLEH DIANI RACHMANITA M DIBIMBING OLEH Dr I GUSTI MADE SANJAYA, M.Si. NAMA : NO ABS : KELAS : 1 Kompetensi dasar 1. Menjelaskan
LEMBAR KERJA SISWA OKSIDASI-REDUKSI (REDOKS) UNTUK KELAS X SMA SEMESTER GENAP OLEH DIANI RACHMANITA M DIBIMBING OLEH Dr I GUSTI MADE SANJAYA, M.Si. NAMA : NO ABS : KELAS : 1 Kompetensi dasar 1. Menjelaskan
BAB III METODOLOGI PENELITIAN
 BAB III METODOLOGI PENELITIAN A. Metode Penelitian Penelitian ini menggunakan metode Development and Validation, yaitu metode penelitian yang digunakan untuk mengembangkan Conceptual Change Text (CCT)
BAB III METODOLOGI PENELITIAN A. Metode Penelitian Penelitian ini menggunakan metode Development and Validation, yaitu metode penelitian yang digunakan untuk mengembangkan Conceptual Change Text (CCT)
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL. UjianTeori. Waktu: 100 menit
 OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
PEMBAHASAN SBMPTN KIMIA 2016
 PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
PEMBAHASAN SBMPTN KIMIA 2016 DISUSUN OLEH Amaldo Firjarahadi Tane 1 31. MATERI: SISTEM PERIODIK UNSUR Energi pengionan disebut juga energi ionisasi. Setiap unsur bisa mengalami energi ionisasi berkali-kali,
MODUL 9. Satuan Pendidikan : SMA SEDES SAPIENTIAE JAMBU Mata Pelajaran : Kimia Kelas/Semester : X/2
 MODUL 9 Satuan Pendidikan : SMA SEDES SAPIENTIAE JAMBU Mata Pelajaran : Kimia Kelas/Semester : X/2 I. Standar Kompetensi Memahami sifat-sifat larutan nonelektrolit dan elektrolit, serta oksidasi-reduksi.
MODUL 9 Satuan Pendidikan : SMA SEDES SAPIENTIAE JAMBU Mata Pelajaran : Kimia Kelas/Semester : X/2 I. Standar Kompetensi Memahami sifat-sifat larutan nonelektrolit dan elektrolit, serta oksidasi-reduksi.
Hubungan koefisien dalam persamaan reaksi dengan hitungan
 STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
STOIKIOMETRI Pengertian Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) Stoikiometri adalah hitungan kimia Hubungan
PENERAPAN MODEL PEMBELAJARAN CONCEPTUAL CHANGE UNTUK MEREDUKSI MISKONSEPSI SISWA PADA MATERI POKOK ASAM DAN BASA DI KELAS XI IA SMAN 2 BOJONEGORO
 PENERAPAN MODEL PEMBELAJARAN CONCEPTUAL CHANGE UNTUK MEREDUKSI MISKONSEPSI SISWA PADA MATERI POKOK ASAM DAN BASA DI KELAS XI IA SMAN 2 BOJONEGORO Laily Rohmawati, Suyono Jurusan Kimia FMIPA Universitas
PENERAPAN MODEL PEMBELAJARAN CONCEPTUAL CHANGE UNTUK MEREDUKSI MISKONSEPSI SISWA PADA MATERI POKOK ASAM DAN BASA DI KELAS XI IA SMAN 2 BOJONEGORO Laily Rohmawati, Suyono Jurusan Kimia FMIPA Universitas
Reaksi dalam larutan berair
 Reaksi dalam larutan berair Drs. Iqmal Tahir, M.Si. iqmal@gadjahmada.edu Larutan - Suatu campuran homogen dua atau lebih senyawa. Pelarut (solven) - komponen dalam larutan yang membuat penuh larutan (ditandai
Reaksi dalam larutan berair Drs. Iqmal Tahir, M.Si. iqmal@gadjahmada.edu Larutan - Suatu campuran homogen dua atau lebih senyawa. Pelarut (solven) - komponen dalam larutan yang membuat penuh larutan (ditandai
Mengubah energi kimia menjadi energi listrik Mengubah energi listrik menjadi energi kimia Katoda sebagi kutub positif, anoda sebagai kutub negatif
 TUGAS 1 ELEKTROKIMIA Di kelas X, anda telah mempelajari bilangan oksidasi dan reaksi redoks. Reaksi redoks adalah reaksi reduksi dan oksidasi. Reaksi reduksi adalah reaksi penangkapan elektron atau reaksi
TUGAS 1 ELEKTROKIMIA Di kelas X, anda telah mempelajari bilangan oksidasi dan reaksi redoks. Reaksi redoks adalah reaksi reduksi dan oksidasi. Reaksi reduksi adalah reaksi penangkapan elektron atau reaksi
Kimia Proyek Perintis I Tahun 1979
 Kimia Proyek Perintis I Tahun 979 PP I-79-5 Kalsium mempunyai nomor 0, susunan elektron pada kulit K, L, M, N adalah A., 8, 0, 0 B., 8, 9, C., 8, 8, D., 8, 6, 4 E., 8,, 8 PP I-79-5 Larutan molal NaOH (BM
Kimia Proyek Perintis I Tahun 979 PP I-79-5 Kalsium mempunyai nomor 0, susunan elektron pada kulit K, L, M, N adalah A., 8, 0, 0 B., 8, 9, C., 8, 8, D., 8, 6, 4 E., 8,, 8 PP I-79-5 Larutan molal NaOH (BM
Stoikiometri. OLEH Lie Miah
 Stoikiometri OLEH Lie Miah 1 STANDAR KOMPETENSI KOMPETENSI DASAR INDIKATOR KARAKTERISTIK MATERI KESULITAN BELAJAR SISWA STANDAR KOMPETENSI Memahami hukum-hukum dasar Kimia dan penerapannya dalam perhitungan
Stoikiometri OLEH Lie Miah 1 STANDAR KOMPETENSI KOMPETENSI DASAR INDIKATOR KARAKTERISTIK MATERI KESULITAN BELAJAR SISWA STANDAR KOMPETENSI Memahami hukum-hukum dasar Kimia dan penerapannya dalam perhitungan
Menuliskan nama senyawa kimia
 81 Bab 6. Stoikiometri Standar Kompetensi Memahami terjadinya ikatan kimia Memahami konsep mol Kompetensi Dasar Menuliskan nama senyawa kimia Menjelaskan konsep mol Menerapkan hukum Gay Lussac dan hukum
81 Bab 6. Stoikiometri Standar Kompetensi Memahami terjadinya ikatan kimia Memahami konsep mol Kompetensi Dasar Menuliskan nama senyawa kimia Menjelaskan konsep mol Menerapkan hukum Gay Lussac dan hukum
BAB I PENDAHULUAN A. Latar Belakang Penelitian
 BAB I PENDAHULUAN A. Latar Belakang Penelitian Kimia merupakan cabang ilmu yang paling penting dan dianggap sebagai pelajaran yang sulit untuk siswa oleh guru kimia, peneliti, dan pendidik pada umumnya.
BAB I PENDAHULUAN A. Latar Belakang Penelitian Kimia merupakan cabang ilmu yang paling penting dan dianggap sebagai pelajaran yang sulit untuk siswa oleh guru kimia, peneliti, dan pendidik pada umumnya.
LATIHAN ULANGAN TENGAH SEMESTER 2
 Pilihlah jawaban yang paling benar LATIHAN ULANGAN TENGAH SEMESTER 2 TATANAMA 1. Nama senyawa berikut ini sesuai dengan rumus kimianya, kecuali. A. NO = nitrogen oksida B. CO 2 = karbon dioksida C. PCl
Pilihlah jawaban yang paling benar LATIHAN ULANGAN TENGAH SEMESTER 2 TATANAMA 1. Nama senyawa berikut ini sesuai dengan rumus kimianya, kecuali. A. NO = nitrogen oksida B. CO 2 = karbon dioksida C. PCl
PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH
 PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH TAHUN 2016 Soal diketik ulang oleh urip rukim (www.urip.info)
PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH TAHUN 2016 Soal diketik ulang oleh urip rukim (www.urip.info)
PERSETUJUAN PEMBIMBING. Identifikasi Hirarki Pemahaman Siswa Kelas X SMA Negeri 1 Gorontalo pada Materi Ikatan Kimia. Oleh Bambang NIM.
 PERSETUJUAN PEMBIMBING Jurnal yang berjudul : Identifikasi Hirarki Pemahaman Siswa Kelas X SMA Negeri 1 Gorontalo pada Materi Ikatan Kimia Oleh Bambang NIM. 441410046 Telah diperiksa dan disetujui oleh
PERSETUJUAN PEMBIMBING Jurnal yang berjudul : Identifikasi Hirarki Pemahaman Siswa Kelas X SMA Negeri 1 Gorontalo pada Materi Ikatan Kimia Oleh Bambang NIM. 441410046 Telah diperiksa dan disetujui oleh
kimia ASAM-BASA III Tujuan Pembelajaran
 KTSP K-13 kimia K e l a s XI ASAM-BASA III Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami mekanisme reaksi asam-basa. 2. Memahami stoikiometri
KTSP K-13 kimia K e l a s XI ASAM-BASA III Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami mekanisme reaksi asam-basa. 2. Memahami stoikiometri
K13 Revisi Antiremed Kelas 11 Kimia
 K13 Revisi Antiremed Kelas 11 Kimia Stoikiometri Larutan - Soal Doc. Name: RK13AR11KIM0601 Doc. Version : 2016-12 01. Zat-zat berikut ini dapat bereaksi dengan larutan asam sulfat, kecuali... (A) kalsium
K13 Revisi Antiremed Kelas 11 Kimia Stoikiometri Larutan - Soal Doc. Name: RK13AR11KIM0601 Doc. Version : 2016-12 01. Zat-zat berikut ini dapat bereaksi dengan larutan asam sulfat, kecuali... (A) kalsium
PERSETUJUAN PEMBIMBING
 PERSETUJUAN PEMBIMBING Jurnal: Identifikasi Miskonsepsi Siswa Pada Materi Asam Basa Menggunakan Certainty Of Response Index (CRI) Pada Kelas XI IPA 2 Di SMA Negeri 1 Bonepantai Oleh Mindrianti Muksin NIM.
PERSETUJUAN PEMBIMBING Jurnal: Identifikasi Miskonsepsi Siswa Pada Materi Asam Basa Menggunakan Certainty Of Response Index (CRI) Pada Kelas XI IPA 2 Di SMA Negeri 1 Bonepantai Oleh Mindrianti Muksin NIM.
LOGO. Stoikiometri. Tim Dosen Pengampu MK. Kimia Dasar
 LOGO Stoikiometri Tim Dosen Pengampu MK. Kimia Dasar Konsep Mol Satuan jumlah zat dalam ilmu kimia disebut mol. 1 mol zat mengandung jumlah partikel yang sama dengan jumlah partikel dalam 12 gram C 12,
LOGO Stoikiometri Tim Dosen Pengampu MK. Kimia Dasar Konsep Mol Satuan jumlah zat dalam ilmu kimia disebut mol. 1 mol zat mengandung jumlah partikel yang sama dengan jumlah partikel dalam 12 gram C 12,
Profil Miskonsepsi Mahasiswa tentang Konsep Kepolaran Molekul dengan Menggunakan CRI (Certainty of Response Index)
 Profil Miskonsepsi Mahasiswa tentang Konsep Kepolaran Molekul dengan Menggunakan CRI (Certainty of Response Index) Lilik Sugiyanti, Lukman AR Laliyo dan Hendri Iyabu Pendidikan Kimia, FMIPA Universitas
Profil Miskonsepsi Mahasiswa tentang Konsep Kepolaran Molekul dengan Menggunakan CRI (Certainty of Response Index) Lilik Sugiyanti, Lukman AR Laliyo dan Hendri Iyabu Pendidikan Kimia, FMIPA Universitas
Soal ini terdiri dari 25 soal PG (50 poin) dan 6 soal essay (88 poin)
 Bidang Studi Kode Berkas : Kimia : KI-T01 (soal) Soal ini terdiri dari 25 soal PG (50 poin) dan 6 soal essay (88 poin) Tetapan Avogadro N A = 6,022 10 23 partikel.mol 1 Tetapan Gas Universal R = 8,3145
Bidang Studi Kode Berkas : Kimia : KI-T01 (soal) Soal ini terdiri dari 25 soal PG (50 poin) dan 6 soal essay (88 poin) Tetapan Avogadro N A = 6,022 10 23 partikel.mol 1 Tetapan Gas Universal R = 8,3145
LEMBAR PERSETUJUAN PEMBIMBING
 LEMBAR PERSETUJUAN PEMBIMBING Jurnal yang berjudul : Identifikasi Kemampuan Siswa Menyelesaikan Soal Persamaan Reaksi dan Perhitungan Kimia Menggunakan Three-Tier Multiple Choice Diagnostic Instrument
LEMBAR PERSETUJUAN PEMBIMBING Jurnal yang berjudul : Identifikasi Kemampuan Siswa Menyelesaikan Soal Persamaan Reaksi dan Perhitungan Kimia Menggunakan Three-Tier Multiple Choice Diagnostic Instrument
TINGKAT PERGURUAN TINGGI 2017 (ONMIPA-PT) SUB KIMIA FISIK. 16 Mei Waktu : 120menit
 OLIMPIADE NASIONAL MATEMATIKA DAN ILMU PENGETAHUAN ALAM TINGKAT PERGURUAN TINGGI 2017 (ONMIPA-PT) BIDANG KIMIA SUB KIMIA FISIK 16 Mei 2017 Waktu : 120menit Petunjuk Pengerjaan H 1. Tes ini terdiri atas
OLIMPIADE NASIONAL MATEMATIKA DAN ILMU PENGETAHUAN ALAM TINGKAT PERGURUAN TINGGI 2017 (ONMIPA-PT) BIDANG KIMIA SUB KIMIA FISIK 16 Mei 2017 Waktu : 120menit Petunjuk Pengerjaan H 1. Tes ini terdiri atas
