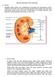
Derajat keasaman merupakan suatu sifat kimia yang penting dari darah dan cairan tubuh lainnya. Satuan derajat keasaman adalah ph :
|
|
|
- Johan Cahyadi
- 6 tahun lalu
- Tontonan:
Transkripsi
1 Larutan Buffer dalam Darah Buffer adalah zat yang dapat mempertahankan ph ketika ditambah sedikit asam/basa atau ketika diencerkan. Buffer terdiri dari asam lemah dan garamnya/basa konjugasinya atau basa lemah dan garamnya/asam konjugasinya. Salah satu contoh larutan buffer adalah darah. Buffer dalam darah terdiri dari H2CO3 ( asam lemah ) dan HCO3- ( basa konjugasinya ). Buffer tersebut dapat mempertahankan ph darah sekitar 7,35 â 7,45 dengan reaksi sebagai berikut ; * H2CO3 + OH- => HCO3- + H2O * HCO3- + H+ => H2CO3 Buffer dalam darah termasuk buffer asam. Buktinya, jika darah tidak memiliki buffer maka ketika minum jus jeruk yang kecut, tubuh kita dapat mengalami asidosis ( ph darah asam ). Derajat keasaman merupakan suatu sifat kimia yang penting dari darah dan cairan tubuh lainnya. Satuan derajat keasaman adalah ph : - ph 7,0 adalah netral - ph di atas 7,0 adalah basa (alkali) - ph di bawah 7,0 adalah asam. Suatu asam kuat memiliki ph sangat rendah (hampir 1,0) ; sedangkan suatu basa kuat memiliki ph yang sangat tinggi (di atas 14,0). Darah memiliki ph antara 7,35-7,45. Keseimbangan asam-basa darah dikendalikan secara seksama, karena perubahan ph yang sangat kecilpun dapat memberikan efek yang serius terhadap beberapa organ. Tubuh menggunakan 3 mekanisme untuk mengendalikan keseimbangan asam-basa darah: 1. Kelebihan asam akan dibuang oleh ginjal, sebagian besar dalam bentuk amonia. Ginjal memiliki kemampuan untuk merubah jumlah asam atau basa yang dibuang, yang biasanya berlangsung selama beberapa hari. 2. Tubuh menggunakan penyangga ph (buffer) dalam darah sebagai pelindung terhadap perubahan yang terjadi secara tiba-tiba dalam ph darah. Suatu penyangga ph bekerja secara kimiawi untuk meminimalkan perubahan ph suatu larutan, Penyangga ph yang paling penting dalam darah menggunakan bikarbonat. Bikarbonat (suatu komponen basa) berada dalam kesetimbangan dengan karbondioksida (suatu komponen asam). Jika lebih banyak asam yang masuk ke dalam aliran darah, maka akan dihasilkan lebih banyak bikarbonat dan lebih sedikit karbondioksida. Jika lebih banyak basa yang masuk ke dalam aliran darah, maka akan dihasilkan lebih banyak karbondioksida dan lebih sedikit bikarbonat. 3. Pembuangan karbondioksida.
2 Karbondioksida adalah hasil tambahan penting dari metabolisme oksigen dan terus menerus yang dihasilkan oleh sel. Darah membawa karbondioksida ke paru-paru dan di paru-paru karbondioksida tersebut dikeluarkan (dihembuskan). Pusat pernafasan di otak mengatur jumlah karbondioksida yang dihembuskan dengan mengendalikan kecepatan dan kedalaman pernafasan. Jika pernafasan meningkat, kadar karbondioksida darah menurun dan darah menjadi lebih basa. Jika pernafasan menurun, kadar karbondioksida darah meningkat dan darah menjadi lebih asam. Dengan mengatur kecepatan dan kedalaman pernafasan, maka pusat pernafasan dan paru-paru mampu mengatur ph darah menit demi menit. Adanya kelainan pada satu atau lebih mekanisme pengendalian ph tersebut, bisa menyebabkan salah satu dari 2 kelainan utama dalam keseimbangan asam basa, yaitu asidosis atau alkalosis. Asidosis adalah suatu keadaan dimana darah terlalu banyak mengandung asam (atau terlalu sedikit mengandung basa) dan sering menyebabkan menurunnya ph darah. Alkalosis adalah suatu keadaan dimana darah terlalu banyak mengandung basa (atau terlalu sedikit mengandung asam) dan kadang menyebabkan meningkatnya ph darah. Asidosis dan alkalosis bukan merupakan suatu penyakit tetapi lebih merupakan suatu akibat dari sejumlah penyakit. Terjadinya asidosis dan alkalosis merupakan petunjuk dari adanya masalah metabolisme yang serius. Asidosis dan alkalosis dikelompokkan menjadi metabolik atau respiratorik, tergantung kepada penyebab utamanya. Asidosis metabolik dan alkalosis metabolik disebabkan oleh ketidakseimbangan dalam pembentukan dan pembuangan asam atau basa oleh ginjal. Asidosis respiratorik atau alkakosis respiratorik terutama disebabkan oleh penyakit paru-paru atau kelainan pernafasan. No Komen : 33 M. Rezza Pahlawan/ XI-IA 8/ 18 :: :51:45 Kegunaan larutan buffer dalam kehidupan sehari-hari sangat banyak. misalnya dalam bidang farmasi, fotografi, industri kulit,reaksi-reaksi kimia dalam laboratorium, zat warna, pengawet makanan,dll. Bahkan dalam tubuh kita sendiri larutan buffer mempunyai peranan yang sangat penting dalam proses metabolisme. OLeh karena itu, cairan tubuh harus merupakan larutan buffer agar ph senantiasa konstan ketika metabolisme berlangsung. Cairan tubuh ini bisa dalam cairan intrasel maupun cairan ekstrasel. Dimana sistem penyangga utama dalam cairan intraselnya seperti H2PO4- dan HPO42- yang dapat bereaksi dengan suatu asam dan basa. Adapun sistem penyangga tersebut, dapat menjaga ph darah yang hampir konstan yaitu sekitar 7,4. Jika terjadi penurunan atau kenaikan ph sedikit saja menunjukkan kita dalam keadaan sakit. Dalam bidang farmasi contohnya pada obat tetes mata mempunyai ph yang sama dengan cairan tubuh kita (utamanya air mata), agar tidak menimbulkan efek samping. Berbeda lagi dengan infus, karena cairan infus masuk melalui pembuluh darah maka ph cairan infus harus sama dengan ph darah. Dalam mengawetkann makanan, larutan buffer juga mampu menjaga ph makanan agar tidak mudah dirusak oleh bakteri. Intinya jika kita akan menggunakan larutan buffer, kita harus menyesuaikan dengan ph objek yang akan kita tambahi larutan buffer tersebut. Daftar Pustaka :
3 Adom, A, Larutan Penyangga (Buffer), wikipedia.org, buku BSE. :: Reply :: Ok. Bagus. Bisakah memberikan contoh larutan buffer yang digunakan dalam mengawetkan makanan? No Komen : 32 Grand Ivennes H. M./13/XI-IA8 :: :28:35 FUNGSI LARUTAN BUFFER 1.) Fungsi Larutan Buffer yang paling relevan dalam kehidupan sehari-hari adalah kegiatan buffer dalam tubuh manusia. Contoh konkritnya adalah larutan buffer H2CO3 dan HCO3- yang bekerja sama untuk menjaga aliran ph darah tegtap netral pada ph 7,4. Contoh lainnya adalah hemogoblin kompleks yang mengikat proton berlebih (ion Hidrogen) selama otot tubuh bergerak sehingga tubuh dapat menggunakan oksigen yang mereka hasilkan bersama hydrogen 2.) Larutan Buffer juga berperan penting dalam beberapa produk rumah tangga komersial. Contohnya adalah sampo yang mengandung buffer asam nitrat dan natrium hidroksida yang nekerja untuk mengimbangu alkalinitas alami dari sabun, yang tidak akan membakar kulit kepala. 3.) Larutan buffer juga digunakan oleh industry alkohol dalam proses yang disebut fermentasi, mengkonversi gula dimana alkohol dalam ketiadaan oksigen. JIka tidak diatur, proses ini bias mengakibatkan pembusukan dari bahan yang difermentasi, sehingga pembuat bir, anggur dan minuman keras sering menambahkan larutan buffer untuk campuran mereka, yang mengatur tingkat PH sehingga hal ini tidak mungkin terjadi. 4.) Dalam proses industry larutan buffer juga dapat digunakan sebagai bahan perwarna. Sumber : dan :: Reply :: Ok, bagus. Bisakah memberikan contoh larutan buffer yang digunakan sebagai bahan perwarna? No Komen : 31 Afrilia Diana Fitri / XI-IA8 / 01 :: :25:14 Fungsi Larutan Penyangga : Fungsi larutan Buffer sistem penyangga digunakan dalam berbagai bidang seperti industri farmasi, kimia analisis, bakteriologi, industri kulit, dan zat warna yang menggunakan rentang ph cukup sempit untuk mendapatkan kerja yang optimum. Adapun lainnya yang biasa kita jumpai dalam kehidupan sehari-hari yaitu pada obat-obatan. Dalam bidang biokimia, kultur jaringan dan bakteri mengalami proses yang sangat sensitif terhadap perubahan ph. Darah dalam tubuh manusia mempunyai kisaran ph 7,35 sampai 7,45, dan apabila ph darah manusia di atas 7,8 akan menyebabkan organ tubuh manusia dapat rusak, sehingga harus dijaga kisaran phnya dengan larutan penyangga. 1.Darah Sebagai Larutan Penyangga Ada beberapa faktor yang terlibat dalam pengendalian ph darah, diantaranya yaitu : a)penyangga Karbonat Penyangga karbonat berasal dari campuran asam karbonat (H2CO3) dengan basa konjugasi bikarbonat (HCO3-). H2CO3 (aq) --> HCO3- (aq) + H+ (aq)
4 Penyangga karbonat sangat berperan penting dalam mengontrol ph darah. Seorang pelari maraton dapat mengalami kondisi asidosis, yaitu penurunan ph darah yang disebabkan oleh metabolisme yang tinggi sehingga meningkatkan produksi ion bikarbonat. Kondisi asidosis ini dapat mengakibatkan penyakit jantung, ginjal, diabetes miletus (penyakit gula) dan diare. Orang yang mendaki gunung tanpa oksigen tambahan dapat menderita alkalosis, yaitu peningkatan ph darah. Kadar oksigen yang sedikit di gunung dapat membuat para pendaki bernafas lebih cepat, sehingga gas CO2 yang dilepas terlalu banyak, padahal CO2 dapat larut dalam air menghasilkan H2CO3. Hal ini mengakibatkan ph darah akan naik. Kondisi alkalosis dapat mengakibatkan hiperventilasi (bernafas terlalu berlebihan, kadang-kadang karena cemas dan histeris). b)penyangga Karbonat Pada darah, terdapat hemoglobin yang dapat mengikat O2 untuk selanjutnya dibawa ke seluruh sel tubuh. Reaksi kesetimbangan dari larutan penyangga oksi hemoglobin adalah: HHb + O 2 (g) --> HbO2- + H+ Keberadaan oksigen pada reaksi di atas dapat memengaruhi konsentrasi ion H +, sehingga ph darah juga dipengaruhi olehnya. Pada reaksi di atas O2 bersifat basa. Hemoglobin yang telah melepaskan O2 dapat mengikat H+ dan membentuk asam hemoglobin. Sehingga ion H+ yang dilepaskan pada peruraian H2CO3 merupakan asam yang diproduksi oleh CO2 yang terlarut dalam air saat metabolisme. c)penyangga Fosfat Pada cairan intra sel, kehadiran penyangga fosfat sangat penting dalam mengatur ph darah. Penyangga ini berasal dari campuran dihidrogen fosfat (H2PO4- ) dengan monohidrogen fosfat (HPO32- ). H2PO4- (aq) + H+ (aq) --> H2PO4 (aq) H2PO4- (aq) + OH- (aq) --> HPO42- (aq) + H2O (aq) Penyangga fosfat dapat mempertahankan ph darah 7,4. Penyangga di luar sel hanya sedikit jumlahnya, tetapi sangat penting untuk larutan penyangga urin. 2.Air Ludah sebagai Larutan Penyangga Gigi dapat larut jika dimasukkan pada larutan asam yang kuat. gigi yang rusak dapat menyebabkan kuman masuk ke dalam gigi. Air ludah dapat mempertahankan ph pada mulut sekitar 6,8. Air liur mengandung larutan penyangga fosfat yang dapat menetralisir asam yang terbentuk dari fermentasi sisa-sisa makanan. 3.Menjaga keseimbangan ph tanaman. Suatu metode penanaman dengan media selain tanah, biasanya dikerjakan dalam kamar kaca dengan menggunakan medium air yang berisi zat hara disebut dengan hidroponik. Setiap tanaman memiliki ph tertentu agar dapat tumbuh dengan baik. Oleh karena itu dibutuhkan larutan penyangga agar ph dapat dijaga. 4.Larutan Penyangga pada Obat-Obatan Asam asetilsalisilat merupakan komponen utama dari tablet aspirin, merupakan obat penghilang rasa nyeri. Adanya asam pada aspirin dapat menyebabkan perubahan ph pada perut. Perubahan ph ini mengakibatkan pembentukan hormon, untuk merangsang penggumpalan darah,
5 terhambat; sehingga pendarahan tidak dapat dihindarkan. Oleh karena itu, pada aspirin ditambahkan MgO yang dapat mentransfer kelebihan asam. Selain itu system Buffer juga dapat digunakan untuk berbagai aplikasi seperti buffer standart untuk proses produksi dan metode bioanalitik, untuk preparasi media kultur, pada temperatur rendah untuk aplikasi biokimia dan sebagai eluen dalam kromatografi. Buffer dapat digunakan dalam setiap eksperimen. Yang memberikan manfaat pada pengontrolan kondisi reaksi dan hasil sintetis organik. Fungsi buffer adalah untuk menciptakan lingkungan bagi biomolekul sehingga dalam bentuk stabildan asli serta lebih aktif. Sebagai salah satu produsen buffer terbesar di Eropa, Merck mendistribusi buffer dalam kemasan yang bervariasi untuk keperluan analisis khusus. Mereka hanya menggunakan substansi yang sangat murni dengan spesifikasi yang terdefinisi sehingga memastikan proses yang reproduksibel di laboratorium atau skala produksi. Sumber : :: Reply :: Bagus. Tingkatkan terus belajarnya ya... No Komen : 30 Rr.Farahdiba Balqis / XI ia8/ 26 :: :05:08 Larutan penyangga (buffer) adalah larutan yang dapat menjaga (mempertahankan) phnya dari penambahan asam, basa, maupun pengenceran oleh air. ph larutan buffer tidak berubah (konstan) setelah penambahan sejumlah asam, basa, maupun air. Larutan buffer mampu menetralkan penambahan asam maupun basa dari luar. Di dalam kehidupan sehari-hari kita tidak pernah terlepas dari peristiwa kimia. Mulai dari makanan yang kita makan ada yang bersifat asam, basa, atau netral hingga proses pencernaannya yang melibatkan reaksi-reaksi kimia yang akan mempengaruhi ph dalam tubuh. Apabila ph dalam tubuh terlalu rendah atau tinggi maka akan mengakibatkan kematian. Oleh karena itu di dalam tubuh kita terdapat sistem buffer (penyangga) yang dapat mempertahankan ph larutan. >> Larutan penyangga dalam bidang Farmasi Dalam bidang farmasi (obat-obatan) banyak zat aktif yang harus berada dalam keadaan ph stabil. Perubahan ph akan menyebabkan khasiat zat aktif tersebut berkurang atau hilang sama sekali. 1. Pada obat suntik atau obat tetes mata, ph obat-obatan tersebut harus disesuaikan dengan ph cairan tubuh. ph untuk obat tetes mata harus disesuaikan dengan ph air mata agar tidak menimbulkan iritasi yang mengakibatkan rasa perih pada mata. Begitu juga obat suntik harus disesuaikan dengan ph darah agar tidak menimbulkan alkalosis atau asidosis pada darah. 2. Larutan Penyangga pada Obat-Obatan : asam asetilsalisilat merupakan komponen utama dari tablet aspirin, merupakan obat penghilang rasa nyeri. Adanya asam pada aspirin dapat menyebabkan perubahan ph pada perut. Perubahan ph ini mengakibakan pembentukan hormon, untuk merangsang penggumpalan darah, terhambat; sehingga pendarahan tidak dapat
6 dihindarkan. Oleh karena itu, pada aspirin ditambahkan MgO yang dapat mentransfer kelebihan asam. >> Pada Teknik pembuatan minuman penambah performa olahraga Campuran garam sitrat dengan asam sitrat dalam produk minuman biasanya digunakan sebagai pengatur keasaman yang juga dapat memperkaya rasa dari minuman. Namun dalam kaitannya dengan kegiatan olahraga, campuran garam sitrat dengan asam sitrat juga dapat berfungsi sebagai ergogenic aids yang dapat,membantu untuk meningkatkan performa olahraga. Hal ini salah satunya disebabkan karena molekul ini dapat bersifat sebagai buffer terhadap asam laktat yang terbentuk dalam proses metabolisme energi secara anaerobik. Oleh sebab itu maka sitrat-natrium sitrat dapat membantu meningkatkan performa olahraga terutama pada olahraga intensitas tinggi yang bergantung terhadap sistem metabolisme secara anaerobik untuk menghasilkan energi. Selain membantu memberikan peningkatan terhadap performa olahraga intensitas tinggi yang bergantung terhadap sistem metabolisme energi seara anaerobik. Konsumsi sitrat-natrium sitrat juga dapat memberikan peningkatan terhadap performa olahraga yang bersifat ketahanan (endurance) seperti lari jarak jauh atau juga road cycling. ( >> Teknik pengolahan limbah melalui proses anaerob Teknik pengolahan limbah melalui proses anaerob melibatkan proses bufferisasi (menggunakan larutan penyangga). Inti dari teknik pengolahan limbah ini yaitu adanya proses pengubahan senyawa organik menjadi metana dan karbon dioksida,tanpa kehadiran oksigen. Dekomposisi senyawa organik melalui proses anaerob ini terjadi melalui tiga tahapan: (1) reaksi hidrolisis, (2) reaksi pembentukan asam, (3) reaksi pembentukan metana. Reaksi hidrolisis merupakan proses pelarutan senyawa organik yang semula tidak larut dan proses penguraian senyawa tersebut menjadi senyawa dengan berat molekul yang cukup kecil dan dapat melewati membran sel. Proses pembentukan asam melibatkan dua golongan besar bakteri, yaitu bakteri asidogenik dan asetogenik. Proses pembentukan metana terutama berasal dari asam asetat, tetapi ada juga yang berasal dari hidrogen dan karbon dioksida. Ada dua kelompok bakteri yang berperan, yaitu bakteri metana asetoklastik dan bakteri metana pengkonsumsi hidrogen. Kedua bakteri penghasil metana ini sanagt sebsitif terhadap perubahan ph. Pada rentang ph 6-8,laju produksi gas metana berkisar antara 1-4 ml/hari. Penambahan larutan penyangga diperlukan untuk mempertahankan ph sekitar 7 agar pertumbuhan bakteri penghasil metana tidak terhambat. Larutan penyangga yang sering digunakan adalah Ca(OH)2, CaCO3, CaHCO3, Na2CO3. sistem penyangga dalam reaktor anaerob adalah H2CO3-CO2 dalam kesetimbangan: CO2 + H2O â H2CO3 â H+ + HCO3- ( :: Reply :: Bagus. Itulah kebesaran Alloh. Bayangkan apa yang akan terjadi jika dalam tubuh kita tidak terdapat larutan penyangga?
7 No Komen : 29 oessi salsabila/ 21/ XI IA8 :: :48:19 saya akan mencoba menjawab pertanyaan dari Bu. Utami Alkalosis adalah suatu keadaan pada saat darah terlalu banyak mengandung basa (atau terlalu sedikit mengandung asam) dan kadang menyebabkan meningkatnya ph darah. Penyebab : Alkalosis metabolik terjadi jika tubuh kehilangan terlalu banyak asam. Sebagai contoh adalah kehilangan sejumlah asam lambung selama periode muntah yang berkepanjangan atau bila asam lambung disedot dengan selang lambung (seperti yang kadangkadang dilakukan di rumah sakit, terutama setelah pembedahan perut). Pada kasus yang jarang, alkalosis metabolik terjadi pada seseorang yang mengkonsumsi terlalu banyak basa dari bahan-bahan seperti soda bikarbonat. Selain itu, alkalosis metabolik dapat terjadi bila kehilangan natrium atau kalium dalam jumlah yang banyak mempengaruhi kemampuan ginjal dalam mengendalikan keseimbangan asam basa darah. Pengobatan : Biasanya satu-satunya pengobatan yang dibutuhkan adalah memperlambat pernafasan. Jika penyebabnya adalah kecemasan, memperlambat pernafasan bisa meredakan penyakit ini. Jika penyebabnya adalah rasa nyeri, diberikan obat pereda nyeri. Menghembuskan nafas dalam kantung kertas (bukan kantung plastik) bisa membantu meningkatkan kadar karbondioksida setelah penderita menghirup kembali karbondioksida yang dihembuskannya. PENGOBATAN Biasanya alkalosis metabolik diatasi dengan pemberian cairan dan elektrolit (natrium dan kalium). Pada kasus yang berat, diberikan amonium klorida secara intravena. sumber: :: Reply :: Ok, bagus. Jangan lupa untuk menerapkannya dalam kehidupan sehari-hari. Belajar yang giat ya... No Komen : 28 Robiah Al Adawiyah/25/XI-IA 8 :: :35:06 Fungsi Larutan Penyangga Larutan penyangga sangat penting dalam kehidupan; misalnya dalam analisis kimia, biokimia, bakteriologi, zat warna, fotografi, dan industri kulit. Dalam bidang biokimia, kultur jaringan dan bakteri mengalami proses yang sangat sensitif terhadap perubahan ph. Darah dalam tubuh manusia mempunyai kisaran ph 7,35 sampai 7,45, dan apabila ph darah manusia di atas 7,8 akan menyebabkan organ tubuh manusia dapat rusak, sehingga harus dijaga kisaran phnya dengan larutan penyangga. 1. Darah Sebagai Larutan Penyangga Ada beberapa faktor yang terlibat dalam pengendalian ph darah, diantaranya penyangga
8 karbonat, penyangga hemoglobin dan penyangga fosfat. a. Penyangga Karbonat Penyangga karbonat berasal dari campuran asam karbonat (H2CO3) dengan basa konjugasi bikarbonat (HCO3). H2CO3 (aq) â > HCO3(aq) + H + (aq) Penyangga karbonat sangat berperan penting dalam mengontrol ph darah. Pelari maraton dapat mengalami kondisi asidosis, yaitu penurunan ph darah yang disebabkan oleh metabolisme yang tinggi sehingga meningkatkan produksi ion bikarbonat. Kondisi asidosis ini dapat mengakibatkan penyakit jantung, ginjal, diabetes miletus (penyakit gula) dan diare. Orang yang mendaki gunung tanpa oksigen tambahan dapat menderita alkalosis, yaitu peningkatan ph darah. Kadar oksigen yang sedikit di gunung dapat membuat para pendaki bernafas lebih cepat, sehingga gas karbondioksida yang dilepas terlalu banyak, padahal CO2 dapat larut dalam air menghasilkan H2CO3. Hal ini mengakibatkan ph darah akan naik. Kondisi alkalosis dapat mengakibatkan hiperventilasi (bernafas terlalu berlebihan, kadang-kadang karena cemas dan histeris). b. Penyangga Hemoglobin Pada darah, terdapat hemoglobin yang dapat mengikat oksigen untuk selanjutnya dibawa ke seluruh sel tubuh. Reaksi kesetimbangan dari larutan penyangga oksi hemoglobin adalah: HHb + O2 (g) «HbO2 - + H + Asam hemoglobin ion aksi hemoglobin Keberadaan oksigen pada reaksi di atas dapat memengaruhi konsentrasi ion H+, sehingga ph darah juga dipengaruhi olehnya. Pada reaksi di atas O2 bersifat basa. Hemoglobin yang telah melepaskan O2 dapat mengikat H+ dan membentuk asam hemoglobin. Sehingga ion H+ yang dilepaskan pada peruraian H2CO3 merupakan asam yang diproduksi oleh CO2 yang terlarut dalam air saat metabolisme. c. Penyangga Fosfat Pada cairan intra sel, kehadiran penyangga fosfat sangat penting dalam mengatur ph darah. Penyangga ini berasal dari campuran dihidrogen fosfat (H2PO4 - ) dengan monohidrogen fosfat (HPO32- ). H2PO4 - (aq) + H+ (aq) â > H2PO4(aq) H2PO4 - (aq) + OH - (aq) â > HPO42- (aq) ) + H2O (aq) Penyangga fosfat dapat mempertahankan ph darah 7,4. Penyangga di luar sel hanya sedikit jumlahnya, tetapi sangat penting untuk larutan penyangga urin. 2. Air Ludah sebagai Larutan Penyangga Gigi dapat larut jika dimasukkan pada larutan asam yang kuat. gigi yang rusak dapat menyebabkan kuman masuk ke dalam gigi. Air ludah dapat mempertahankan ph pada mulut sekitar 6,8. Air liur mengandung larutan penyangga fosfat yang dapat menetralisir asam yang
9 terbentuk dari fermentasi sisa-sisa makanan. 3. Menjaga keseimbangan ph tanaman. Suatu metode penanaman dengan media selain tanah, biasanya ikerjakan dalam kamar kaca dengan menggunakan mendium air yang berisi zat hara, disebut dengan hidroponik. Setiap tanaman memiliki ph tertentu agar dapat tumbuh dengan baik. Oleh karena itu dibutuhkan larutan penyangga agar ph dapat dijaga. 4. Larutan Penyangga pada Obat-Obatan Asam asetilsalisilat merupakan komponen utama dari tablet aspirin, merupakan obat penghilang rasa nyeri. Adanya asam pada aspirin dapat menyebabkan perubahan ph pada perut. Perubahan ph ini mengakibakan pembentukan hormon, untuk merangsang penggumpalan darah, terhambat; sehingga pendarahan tidak dapat dihindarkan. Oleh karena itu, pada aspirin ditambahkan MgO yang dapat mentransfer kelebihan asam. Sumber : :: Reply :: Ok, bagus. Tingkatkan terus belajarnya ya... No Komen : 27 Robiah Al Adawiyah/25/XI-IA 8 :: :25:39 ibu maaf ternyata kurang jelas karena spasinya dempet. saya kirim ulang bu No Komen : 26 Robiah Al Adawiyah/25/XI-IA 8 :: :23:24 Fungsi Larutan Penyangga Larutan penyangga sangat penting dalam kehidupan; misalnya dalam analisis kimia, biokimia, bakteriologi, zat warna, fotografi, dan industri kulit. Dalam bidang biokimia, kultur jaringan dan bakteri mengalami proses yang sangat sensitif terhadap perubahan ph. Darah dalam tubuh manusia mempunyai kisaran ph 7,35 sampai 7,45, dan apabila ph darah manusia di atas 7,8 akan menyebabkan organ tubuh manusia dapat rusak, sehingga harus dijaga kisaran phnya dengan larutan penyangga. Darah Sebagai Larutan Penyangga Ada beberapa faktor yang terlibat dalam pengendalian ph darah, diantaranya penyangga karbonat, penyangga hemoglobin dan penyangga fosfat. a. Penyangga Karbonat Penyangga karbonat berasal dari campuran asam karbonat (H2CO3) dengan basa konjugasi bikarbonat (HCO 3 ). H 2 CO 3 (aq) â > HCO 3(aq) + H + (aq) Penyangga karbonat sangat berperan penting dalam mengontrol ph darah. Pelari maraton dapat mengalami kondisi asidosis, yaitu penurunan ph darah yang disebabkan oleh metabolisme yang tinggi sehingga meningkatkan produksi ion bikarbonat. Kondisi asidosis ini dapat mengakibatkan penyakit jantung, ginjal, diabetes miletus (penyakit gula) dan diare. Orang yang mendaki gunung tanpa oksigen tambahan dapat menderita alkalosis, yaitu peningkatan ph darah. Kadar oksigen yang sedikit di gunung dapat membuat para pendaki bernafas lebih cepat, sehingga gas karbondioksida yang dilepas terlalu banyak, padahal CO 2 dapat larut dalam air
10 menghasilkan H 2 CO 3. Hal ini mengakibatkan ph darah akan naik. Kondisi alkalosis dapat mengakibatkan hiperventilasi (bernafas terlalu berlebihan, kadang-kadang karena cemas dan histeris). b. Penyangga Hemoglobin Pada darah, terdapat hemoglobin yang dapat mengikat oksigen untuk selanjutnya dibawa ke seluruh sel tubuh. Reaksi kesetimbangan dari larutan penyangga oksi hemoglobin adalah: HHb + O 2 (g) «HbO H + Asam hemoglobin ion aksi hemoglobin Keberadaan oksigen pada reaksi di atas dapat memengaruhi konsentrasi ion H +, sehingga ph darah juga dipengaruhi olehnya. Pada reaksi di atas O 2 bersifat basa. Hemoglobin yang telah melepaskan O 2 dapat mengikat H + dan membentuk asam hemoglobin. Sehingga ion H + yang dilepaskan pada peruraian H 2 CO 3 merupakan asam yang diproduksi oleh CO 2 yang terlarut dalam air saat metabolisme. c. Penyangga Fosfat Pada cairan intra sel, kehadiran penyangga fosfat sangat penting dalam mengatur ph darah. Penyangga ini berasal dari campuran dihidrogen fosfat (H 2 PO 4 - ) dengan monohidrogen fosfat (HPO 3 2- ). H 2 PO 4 - (aq) + H + (aq) â > H 2 PO 4(aq) H 2 PO 4 - (aq) + OH - (aq) â > HPO 4 2- (aq) ) + H 2 O (aq) Penyangga fosfat dapat mempertahankan ph darah 7,4. Penyangga di luar sel hanya sedikit jumlahnya, tetapi sangat penting untuk larutan penyangga urin. Air Ludah sebagai Larutan Penyangga Gigi dapat larut jika dimasukkan pada larutan asam yang kuat. gigi yang rusak dapat menyebabkan kuman masuk ke dalam gigi. Air ludah dapat mempertahankan ph pada mulut sekitar 6,8. Air liur mengandung larutan penyangga fosfat yang dapat menetralisir asam yang terbentuk dari fermentasi sisa-sisa makanan. Menjaga keseimbangan ph tanaman. Suatu metode penanaman dengan media selain tanah, biasanya ikerjakan dalam kamar kaca dengan menggunakan mendium air yang berisi zat hara, disebut dengan hidroponik. Setiap tanaman memiliki ph tertentu agar dapat tumbuh dengan baik. Oleh karena itu dibutuhkan larutan penyangga agar ph dapat dijaga. Larutan Penyangga pada Obat-Obatan Asam asetilsalisilat merupakan komponen utama dari tablet aspirin, merupakan obat penghilang rasa nyeri. Adanya asam pada aspirin dapat menyebabkan perubahan ph pada perut. Perubahan ph ini mengakibakan pembentukan hormon, untuk merangsang penggumpalan darah, terhambat; sehingga pendarahan tidak dapat dihindarkan. Oleh karena itu, pada aspirin ditambahkan MgO yang dapat mentransfer kelebihan asam. Sumber : No Komen : 25 Shinta Mey Linawati / XI-IA8 / 27 :: :33:25 Saya akan mencoba menjawab pertanyaan bu utami â adakah obat-obatan yang bukan merupakan larutan buffer?â Menurut saya TIDAK ADA obat-obatan yang bukan merupakan larutan buffer. Dalam bidang farmasi (obat-obatan), diperlukan keadaan ph yang stabil. Perubahan ph akan menyebabkan khasiat zat aktif dalam obat-obatan akan terus berkurang atau hilang sama sekali. Dan apabila
11 obat tersebut bukan buffer, obat tersebut tidak dapat diterima oleh tubuh. Sepeti contoh Obat tetes mata harus memiliki ph yang sama dengan ph air mata agar tidak menimbulkan iritasi yang mengakibatkan rasa perih pada mata. Begitu pula obat suntik harus disesuaikan dengan ph darah. ph Obat suntik harus disesuaikan dengan ph darah agar tidak terjadi asidosis atau alkalosis pada darah. Keterangan : Asidosis : suatu keadaan dimana adanya peningkatan asam didalam darah yang disebabkan oleh berbagai keadaan dan penyakit tertentu yang mana tubuh tidak bisa mengeluarkan asam dalam mengatur keseimbangan asam basa Alkalosis : suatu keadaan dimana darah dalam keadaan basa karena tingginya kadar bikarbonat pada darah :: Reply :: Bagaimana dengan obat maag/antasida dan obat diare? No Komen : 24 cindy asri n / XI IA8/ 08 :: :15:58 larutan penyangga memiliki banyak kegunaan 1.Larutan Penyangga Alami a.larutan penyangga dalam darah Pada orang sehat, ph darah tidak pernah berbeda lebih dari 0,2 satuan dari ph normal,yaitu 7,4. ph darah tidak boleh turun di bawah 7,0 ataupun naik di atas 7,8 karena akan berakibat fatal bagi tubuh. Untuk mempertahankannya, darah memiliki bebarapa larutan penyangga alami yaitu hemoglobin, H2CO3/ HCO3-danH2PO4- / HPO42-1)Penyangga hemoglobina gar sel-sel dalam tubuh kita dapat berfungsi, diperlukan O2 yang diperoleh melalui pernapasan dan dibawa ke seluruh tubuh. Transportasi O2 oleh darah di dalam tubuh di gambarkan dengan reaksi kesetimbangan berikut. HHb+ + O2 --> HbO2 + H+ Asam hemoglobin oksi hemoglobinion H+ akan diikat oleh ion HCO3- membentuk H2CO3yang oleh enzim karbonatanhidrase terurai menjadi H2 O dan CO2. Pelepasan CO2oleh paru-paru mengakibatkan pengurangan H+ dalam darah. Oleh karena itu CO2 yang dihasilkan dalam jaringan sel diubah oleh enzim karbonat hidrase dalam darah menjadi H2CO3 yang segera terurai menghasilkan ion H+dan HCO3-. Selanjutnya, ion H+ diikat oleh basa konjugasi HbO2 menghasilkan O2 yang masuk ke jaringan sel dan digunakan untuk reaksi metabolisme. 2)Penyangga karbonat H2CO3/ HCO3-
12 Penyangga ini terlibat untuk mengontrol ph darah agar perbandingan [H2CO3]:[HCO3-]adalah 1 : 20, agar dapat mempertahankan ph darah normal yaitu 7,4 3)Penyangga fosfat H2PO40 / HPO42- Penyangga ini mengontrol ph darah terutama dalam sel, seperti ginjal. Ion H+ juga dikeluarkan dari tubuh oleh ginjal melalui pembentukan ion HPO42- dan dibuang sebagaigaram dalam urine. Taukah anda bahwa penyakit diabetes mellitus adalah salah satu penyebab asidosis(kondisi dimana ph darah di bawah mormal)? Penderita diabetes memiliki kelebihan asam organic dalam darahnya, artinya [H+] dalam darah naik (ph darah turun). Oleh karena itu, HbO2 dipaksa melepas O2. Akibatnya, Hb tidak dapat mengedarkan O2 ke seluruh tubuh. Disamping itu, olahraga intensif yang dilakukan terlalu lama dapat mengakibatkanasidosis sementara karena meningkatkan produksi ion bikarbonat sehingga ph darahturun. Para pendaki gunung, dapat mengalami kondisi alkalosis sementara (kondisi dimana phdarah di atas ph normal). Kadar O2 yang rendah di gunung membuat pendaki bernapas lebih cepat. kibatnya, terlalu banyak CO 2 yang dilepassehingga ph darah akan naik. b. Larutan penyangga dalam air Ludah Larutan penyangga H2PO4- / HPO42- ternyata ditemukan dalam air ludah, yang berfungsiuntuk menjaga ph mulut sekitar 6,8 dengan cara menetralisir asam yang dihasilkan darifermentasi sisa-sisa makanan yang dapat merusak gigi 2.Larutan Penyangga Sintetis a.larutan penyangga dalam biologi Enzim bakteri memerlukan ph tertentu untuk aktivitasnya. ph tertentu ini dapat dibuatdalam bentuk campuran penyangga yang ph-nya sesuai b.larutan penyangga dalam industri Larutan penyangga juga digunakan pada electroplating (penyepuhan), penanganan limbah dan proses fotografi. c.larutan penyangga dalam farmasi Perubahan ph pada larutan obat dapat merusak komposisi, fungsi, dan efektivitas obattersebut. Oleh karena itu, obat-obatan dalam bentuk larutan sering kali bertindak sebagaisistem penyangga bagi obat itu sendiri untuk mempertahankan kadar larutan obat tetap berada dalam trayek ph tertentu
13 sumber : No Komen : 23 cindy asri n / XI IA8/ 08 :: :12:10 larutan penyangga memiliki banyak kegunaan 1.Larutan Penyangga Alami a.larutan penyangga dalam darah Pada orang sehat, ph darah tidak pernah berbeda lebih dari 0,2 satuan dari ph normal,yaitu 7,4. ph darah tidak boleh turun di bawah 7,0 ataupun naik di atas 7,8 karena akan berakibat fatal bagi tubuh. Untuk mempertahankannya, darah memiliki bebarapa larutan penyangga alami yaitu hemoglobin, H2CO3/ HCO3-danH2PO4- / HPO42-1)Penyangga hemoglobina gar sel-sel dalam tubuh kita dapat berfungsi, diperlukan O2 yang diperoleh melalui pernapasan dan dibawa ke seluruh tubuh. Transportasi O2 oleh darah di dalam tubuh di gambarkan dengan reaksi kesetimbangan berikut. HHb+ + O2 --> HbO2 + H+ Asam hemoglobin oksi hemoglobinion H+ akan diikat oleh ion HCO3- membentuk H2CO3yang oleh enzim karbonatanhidrase terurai menjadi H2 O dan CO2. Pelepasan CO2oleh paru-paru mengakibatkan pengurangan H+ dalam darah. Oleh karena itu CO2 yang dihasilkan dalam jaringan sel diubah oleh enzim karbonat hidrase dalam darah menjadi H2CO3 yang segera terurai menghasilkan ion H+dan HCO3-. Selanjutnya, ion H+ diikat oleh basa konjugasi HbO2 menghasilkan O2 yang masuk ke jaringan sel dan digunakan untuk reaksi metabolisme. 2)Penyangga karbonat H2CO3/ HCO3- Penyangga ini terlibat untuk mengontrol ph darah agar perbandingan [H2CO3]:[HCO3-]adalah 1 : 20, agar dapat mempertahankan ph darah normal yaitu 7,4 3)Penyangga fosfat H2PO40 / HPO42- Penyangga ini mengontrol ph darah terutama dalam sel, seperti ginjal. Ion H+ juga dikeluarkan dari tubuh oleh ginjal melalui pembentukan ion HPO42- dan dibuang sebagaigaram dalam urine. Taukah anda bahwa penyakit diabetes mellitus adalah salah satu penyebab asidosis(kondisi dimana ph darah di bawah mormal)? Penderita diabetes memiliki kelebihan asam organic dalam darahnya, artinya [H+] dalam darah naik (ph darah turun). Oleh karena itu, HbO2 dipaksa melepas O2. Akibatnya, Hb tidak dapat mengedarkan O2 ke seluruh tubuh.
14 Disamping itu, olahraga intensif yang dilakukan terlalu lama dapat mengakibatkanasidosis sementara karena meningkatkan produksi ion bikarbonat sehingga ph darahturun. Para pendaki gunung, dapat mengalami kondisi alkalosis sementara (kondisi dimana phdarah di atas ph normal). Kadar O2 yang rendah di gunung membuat pendaki bernapas lebih cepat. kibatnya, terlalu banyak CO 2 yang dilepassehingga ph darah akan naik. b. Larutan penyangga dalam air Ludah Larutan penyangga H2PO4- / HPO42- ternyata ditemukan dalam air ludah, yang berfungsiuntuk menjaga ph mulut sekitar 6,8 dengan cara menetralisir asam yang dihasilkan darifermentasi sisa-sisa makanan yang dapat merusak gigi 2.Larutan Penyangga Sintetis a.larutan penyangga dalam biologi Enzim bakteri memerlukan ph tertentu untuk aktivitasnya. ph tertentu ini dapat dibuatdalam bentuk campuran penyangga yang ph-nya sesuai b.larutan penyangga dalam industri Larutan penyangga juga digunakan pada electroplating (penyepuhan), penanganan limbah dan proses fotografi. c.larutan penyangga dalam farmasi Perubahan ph pada larutan obat dapat merusak komposisi, fungsi, dan efektivitas obattersebut. Oleh karena itu, obat-obatan dalam bentuk larutan sering kali bertindak sebagaisistem penyangga bagi obat itu sendiri untuk mempertahankan kadar larutan obat tetap berada dalam trayek ph tertentu :: Reply :: Ok, bagus. Jika mulut terasa pahit apa yang harus dilakukan? No Komen : 22 siti uswatun khasanah/xi IPA8/28 :: :04:53 menjawab balasan dari ibu utami :) Seandainya gigi dapat larut dengan larutan asam organik yang lemah, apa yang akan terjadi? Sumbernya koq tidak dicantumkan? asam organik yang lemah itu gimana buk? aku gak tau. sumbernya :: Reply :: Asam organik yang lemah itu adalah asam yang pada umumnya berasal dari buah-buahan. No Komen : 21 Imam Sasongko Jati / XI - IA 8 / 15 :: :18:23 Menjaga keseimbangan ph tanaman.
15 Suatu metode penanaman dengan media selain tanah, biasanya dikerjakan dalam kamar kaca dengan menggunakan mendium air yang berisi zat hara, disebut dengan hidroponik. Setiap tanaman memiliki ph tertentu agar dapat tumbuh dengan baik. Oleh karena itu dibutuhkan larutan penyangga agar ph dapat dijaga. Sumber : :: Reply :: Bagaimana cara menggunakan larutan penyangga dalam menjaga ph tanaman? No Komen : 20 ULFA FERNINDA P/XI-IA8/29 :: :03:26 Teknik pengolahan limbah melalui proses anaerob. Teknik pengolahan limbah melalui proses anaerob melibatkan proses bufferisasi (menggunakan larutan penyangga). Inti dari teknik pengolahan limbah ini yaitu adanya proses pengubahan senyawa organik menjadi metana dan karbon dioksida,tanpa kehadiran oksigen. Dekomposisi senyawa organik melalui proses anaerob ini terjadi melalui tiga tahapan: (1) reaksi hidrolisis (2) reaksi pembentukan asam (3) reaksi pembentukan metana. Reaksi hidrolisis merupakan proses pelarutan senyawa organik yang semula tidak larut dan proses penguraian senyawa tersebut menjadi senyawa dengan berat molekul yang cukup kecil dan dapat melewati membran sel. Proses pembentukan asam melibatkan dua golongan besar bakteri, yaitu bakteri asidogenik dan asetogenik. Proses pembentukan metana terutama berasal dari asam asetat, tetapi ada juga yang berasal dari hidrogen dan karbon dioksida. Ada dua kelompok bakteri yang berperan, yaitu bakteri metana asetoklastik dan bakteri metana pengkonsumsi hidrogen. Kedua bakteri penghasil metana ini sanagt sebsitif terhadap perubahan ph. Pada rentang ph 6-8,laju produksi gas metana berkisar antara 1-4 ml/hari. Penambahan larutan penyangga diperlukan untuk mempertahankan ph sekitar 7 agar pertumbuhan bakteri penghasil metana tidak terhambat. Larutan penyangga yang sering digunakan adalah Ca(OH)2, CaCO3, CaHCO3, Na2CO3. sistem penyangga dalam reaktor anaerob adalah H2CO3-CO2 dalam kesetimbangan: CO2 + H2O â H2CO3 â H+ + HCO3- sumber : ( :: Reply :: Bagus... Bagaimana perbandingan antara asam karbonat dan bikarbonat dalam darah? No Komen : 19 andika dayongki S /02 :: :41:56 sifat sifat : Larutan penyangga atau larutan buffer atau dapar merupakan suatu larutan yang dapat mempertahankan nilai ph tertentu. Adapun sifat yang paling menonjol dari larutan penyangga ini seperti ph larutan penyangga hanya berubah sedikit pada penambahan sedikit asam kuat.
16 Disamping itu larutan penyangga merupakan larutan yang dibentuk oleh reaksi suatu asam lemah dengan basa konjugatnya ataupun oleh basa lemah dengan asam konjugatnya. Reaksi ini disebut sebagai reaksi asam-basa konjugasi. Disamping itu mempunyai sifat berbeda dengan komponenkomponen pembentuknya. fungsi : Adanya larutan penyangga ini dapat kita lihat dalam kehidupan sehari-hari seperti pada obatobatan, fotografi, industri kulit dan zat warna. Selain aplikasi tersebut, terdapat fungsi penerapan konsep larutan penyangga ini dalam tubuh manusia seperti pada cairan tubuh. Cairan tubuh ini bisa dalam cairan intrasel maupun cairan ekstrasel. Dimana sistem penyangga utama dalam cairan intraselnya seperti H2PO4- dan HPO42- yang dapat bereaksi dengan suatu asam dan basa. Adapun sistem penyangga tersebut, dapat menjaga ph darah yang hampir konstan yaitu sekitar 7,4. Selain itu penerapan larutan penyangga ini dapat kita temui dalam kehidupan sehari-hari seperti pada obat tetes mata. :: Reply :: Bagus... Berapa ph larutan pada obat tetes mata? No Komen : 18 LILA ARIMURTI XI-IA8/16 :: :28:43 Buffer pada bidang farmasi banyak digunakan untuk menetralkan darah atau biasanya pada kasus keracunan. Contohnya pada keracunan asam jengkolat. Asam jengkolat yang terbentuk saat kita terlalu banyak mengonsumsi jengkol ini harus di kurangi karena akan membetk kristal kristal yang menyumbat saluran kecing. Caranya? dengan memasukan larutan bisa Natrium karbonat(biasanya) yang sifatnya basa yang nantinya akan membentuk garam ketika bereaksi dengan asam dan kemudian akan keluar melalui urin (karena garam sifatnya adalah mudah larut dalam air). Dalam bidang farmasi (obat-obatan) banyak zat aktif yang harus berada dalam keadaan ph stabil. Perubahan ph akan menyebabkan khasiat zat aktif tersebut berkurang atau hilang sama sekali. Untuk obat suntik atau obat tetes mata, ph obat-obatan tersebut harus disesuaikan dengan ph cairan tubuh. ph untuk obat tetes mata harus disesuaikan dengan ph air mata agar tidak menimbulkan iritasi yang mengakibatkan rasa perih pada mata. Begitu juga obat suntik harus disesuaikan dengan ph darah agar tidak menimbulkan alkalosis atau asidosis pada darah. Perubahan ph pada larutan obat dapat merusak komposisi, fungsi, dan efektivitas obat tersebut. Oleh karena itu, obat-obatan dalam bentuk larutan sering kali bertindak sebagai sistem penyangga bagi obat itu sendiri untuk mempertahankan kadar larutan obat tetap berada dalam trayek ph tertentu. Larutan Penyangga pada Obat-Obatan : asam asetilsalisilat merupakan komponen utama dari tablet aspirin, merupakan obat penghilang rasa nyeri. Adanya asam pada aspirin dapat menyebabkan perubahan ph pada perut. Perubahan ph ini mengakibakan pembentukan hormon, untuk merangsang penggumpalan darah, terhambat; sehingga pendarahan tidak dapat dihindarkan. Oleh karena itu, pada aspirin ditambahkan MgO yang dapat mentransfer kelebihan asam. sumber : google :: Reply ::
17 Ok. bagus. Jangan lupa menerapkan dalam kehidupan sehari-hari. Tetap semangat belajar ya... No Komen : 17 mahesti ayu L/xi-ia8/17 :: :12:27 Salah satu fungsi larutan buffer (penyangga) pada kehidupan sehari-hari adalah sebagai penyeimbang antara ph sampo bayi dengan ph rambut.. Ikatan tersebut stabil pada ph 4,6 â 6,0. ph shampo yang terlalu tinggi atau rendah akan memutuskan ikatan pada protein rambut, sehingga rambut menjadi rusak dan terlihat tidak lebat. Larutan penyangga dengan ph seimbang pada shampo berfungsi agar ph shampo sama dengan ph rambut.agar pada saat bayi di beri shampoo ph yang ada di kepala bayi tidak berubah dengan drastis karena akan mengganggu Kenyamanan bayi tersebut.bayi memiliki rambut yang lebih halus, daripada rambut orang dewasa. Selain itu, kelenjar minyak dan keringat pada kulit kepala bayi belum berfungsi sempurna. Oleh karena itu, shampo bayi harus mengandung sedikit bahan aktif dan memiliki ph seimbang. Alasan lain untuk memilih shampo bayi dengan ph seimbang adalah agar shampo tidak pedih jika terkena mata.jadi dalam shampoo bayi ini larutan penyangga berfungsi sebagai penyeibang ph karena berbagai saraf yang ada di kepala bayi belum berfungsi dengan sempurna sumber: :: Reply :: Ok bagus. Tetap semangat belajar ya... No Komen : 16 Bobby Dwinanda / 06 :: :52:31 Dalam indutri farmasi, larutan penyangga berperan untuk pembuatan obat-obatan agar zat aktif dari obat tersebut mempunya ph tertentu. Selain itu larutan penyangga juga digunakan unutk industri makanan dan minuman ringan seperti yang sering digunakan adalah Natrium asetat dan asam sitrat. Contohnya pada asam sitrat : Asam sitrat merupakan asam organik lemah yang ditemukan pada daun dan buah tumbuhan genus Citrus (jeruk-jerukan). Senyawa ini merupakan bahan pengawet yang baik dan alami, selain digunakan sebagai penambah rasa masam pada makanan dan minuman ringan. Dalam biokimia, asam sitrat dikenal sebagai senyawa antara dalam siklus asam sitrat, yang penting dalam metabolisme makhluk hidup, sehingga ditemukan pada hampir semua makhluk hidup. Zat ini juga dapat digunakan sebagai zat pembersih yang ramah lingkungan dan sebagai antioksidan. Asam sitrat terdapat pada berbagai jenis buah dan sayuran, namun ditemukan pada konsentrasi tinggi, yang dapat mencapai 8% bobot kering, pada jeruk lemon dan limau (misalnya jeruk nipis dan jeruk purut). Rumus kimia asam sitrat adalah C6H8O7 (strukturnya ditunjukkan pada tabel informasi di sebelah kanan). Struktur asam ini tercermin pada nama IUPAC-nya, asam 2-hidroksi-1,2,3- propanatrikarboksilat. Sifat-sifat fisis asam sitrat dirangkum pada tabel di sebelah kanan. Keasaman asam sitrat didapatkan dari tiga gugus karboksil COOH yang dapat melepas proton dalam larutan. Jika hal
18 ini terjadi, ion yang dihasilkan adalah ion sitrat. Sitrat sangat baik digunakan dalam larutan penyangga untuk mengendalikan ph larutan. Ion sitrat dapat bereaksi dengan banyak ion logam membentuk garam sitrat. Selain itu, sitrat dapat mengikat ion-ion logam dengan pengkelatan, sehingga digunakan sebagai pengawet dan penghilang kesadahan air. Adanya larutan penyangga ini dapat kita lihat dalam kehidupan sehari-hari seperti pada obatobatan, fotografi, industri kulit dan zat warna. Selain aplikasi tersebut, terdapat fungsi penerapan konsep larutan penyangga ini dalam tubuh manusia seperti pada cairan tubuh. Cairan tubuh ini bisa dalam cairan intrasel maupun cairan ekstrasel. Dimana sistem penyangga utama dalam cairan intraselnya seperti H2PO4- dan HPO42- yang dapat bereaksi dengan suatu asam dan basa. Adapun sistem penyangga tersebut, dapat menjaga ph darah yang hampir konstan yaitu sekitar 7,4. Selain itu penerapan larutan penyangga ini dapat kita temui dalam kehidupan sehari-hari seperti pada obat tetes mata. Pada obat tetes mata mempunyai ph yang sama dengan cairan tubuh kita, agar tidak menimbulkan efek samping. Sumber : Searching google dan dari penjelasan saat pelajaran biologi. :: Reply :: Bagaimana rumus bangun/struktur dari 2-hidroksi-1,2,3-propanatrikarboksilat? No Komen : 15 viqqi vadilla / 30 / xi ipa 8 :: :10:25 sumber : buku paket biologi sri ngatin, buku paket biologi erlangga, lks kimia, dan search di google No Komen : 14 paramita daniswari / 23 :: :25:19 --> sistem penyangga utama dalam cairan intrasel tubuh manusia seperti H2PO4- dan HPO42- yang dapat bereaksi dengan suatu asam dan basa. Adapun sistem penyangga tersebut, dapat menjaga ph darah yang hampir konstan yaitu sekitar 7,4.apabila PH manusia kurang dari 7,4 maka akan menimbulkan PENYAKIT ASIDOSIS yang biasanya disebabkan oleh penimbunan HCO3 dalam paru-paru. ( -->Selain itu penerapan larutan penyangga ini dapat kita temui dalam kehidupan sehari-hari seperti pada obat tetes mata. Pada obat tetes mata mempunyai ph yang sama dengan cairan tubuh kita, agar tidak menimbulkan efek samping. ( -->Sistem penyangga digunakan dalam berbagai bidang seperti industri farmasi, kimia analiik, Bakteriologi, Fotografi, industri Kulit, dan Zat Warna, yang menggunakan rentang ph yang cukup sempit untuk mendapatkan kerja yang optimum. ( --> Air Ludah sebagai Larutan Penyangga Gigi dapat larut jika dimasukkan pada larutan asam yang kuat. gigi yang rusak dapat menyebabkan kuman masuk ke dalam gigi. Air ludah dapat mempertahankan ph pada mulut sekitar 6,8. Air liur mengandung larutan penyangga fosfat yang dapat menetralisir asam yang terbentuk dari fermentasi sisa-sisa makanan.( -->Menjaga keseimbangan ph tanaman.
19 Suatu metode penanaman dengan media selain tanah, biasanya ikerjakan dalam kamar kaca dengan menggunakan mendium air yang berisi zat hara, disebut dengan hidroponik. Setiap tanaman memiliki ph tertentu agar dapat tumbuh dengan baik. Oleh karena itu dibutuhkan larutan penyangga agar ph dapat dijaga. (( -->Larutan Penyangga pada Obat-Obatan Asam asetilsalisilat merupakan komponen utama dari tablet aspirin, merupakan obat penghilang rasa nyeri. Adanya asam pada aspirin dapat menyebabkan perubahan ph pada perut. Perubahan ph ini mengakibakan pembentukan hormon, untuk merangsang penggumpalan darah, terhambat; sehingga pendarahan tidak dapat dihindarkan. Oleh karena itu, pada aspirin ditambahkan MgO yang dapat mentransfer kelebihan asam.( :: Reply :: Ok bagus. Yang terpenting adalah penerapan dalam kehidupan sehari-hari. Tetap semangat ya... No Komen : 13 arina pramudita abadi XI-IA8/04 :: :23:40 Buffer dalam darah adalah jenis buffer yang terdiri dariâ asam lemah dan garamnya.â Asam lemah nya adalah asam karbonat H2CO3 ( asam lemah ) dan garamnya adalah HCO3-. Buffer tersebut dapat mempertahankan ph darah sekitar 7,35 â 7,45 dengan reaksi sebagai berikut :H2CO3 + OH- => HCO3- + H2OHCO3- + H+ => H2CO3 Ketika masuk zat asam dalam tubuh maka yang menetralisir adalah asam lemah yaitu asam karbonat, jika masuk zat basa yang bertugas menetralisir adalah garamnya :: Reply :: Ok. Benarkah pengertian buffer seperti itu? No Komen : 12 Ratna Palupi N / XI-IA8 / 24 :: :56:20 Menjawab pertanyaan Bu.Utami : Apa yang terjadi jika dalam tubuh kita terlalu asam atau terlalu basa? Kondisi tubuh yang terlalu asam menyebabkan kelelahan, nyeri, kulit melepuh, sakit kepala, mengantuk, alergi, pilek dan flu, masalah sinus, serta daya tahan tubuh yang rendah. Kadar oksigen menurun akibat penumpukan karbondioksida dalam darah. Jika oksigen turun sel-sel tubuh akan mati. Orang yang memiliki tubuh terlalu asam lebih gampang terkena bakteri atau virus. Selain itu, sel kanker juga lebih mudah berkembang jika tubuh dalam kondisi asam yang berlebihan. Darah yang asam akan memblokir penyerapan vitamin, membuat racun tersumbat dalam sel, memperlambat fungsi organ, mengganggu sistem pencernaan yang baik, mengeluarkan banyak gas dan perut kembung, menyebabkan kenaikan berat badan tidak sehat dan mempercepat proses penuaan.
20 Sedangkan tubuh manusia cenderung basa dan jarang terjadi kondisi basa yang tinggi. Tapi tentu saja tubuh bisa menjadi terlalu basa jika kadar karbondioksida dalam darah menjadi rendah karena terlalu banyak karbondioksida yang dikeluarkan dari aliran darah. Orang-orang yang menderita basa berlebih pernafasannya menjadi lebih cepat dan sering terlihat cemas. Apabila kondisinya memburuk bisa terjadi kejang otot dan penurunan kesadaran. Jika bernapasnya terlalu cepat ajari si penderita untuk belajar menahan napas selama mungkin sehingga lebih sedikit karbondioksida yang keluar. :: Reply :: Ok, bagus. Tingkatkan terus belajarnya ya... No Komen : 11 oessi salsabila :: :02:35 1. Darah Sebagai Larutan Penyangga Ada beberapa faktor yang terlibat dalam pengendalian ph darah, diantaranya penyangga karbonat, penyangga hemoglobin dan penyangga fosfat. a. Penyangga Karbonat Penyangga karbonat berasal dari campuran asam karbonat (H 2 CO 3 ) dengan basa konjugasi bikarbonat (HCO 3 ). H 2 CO 3 (aq) --> HCO 3(aq) + H + (aq) Penyangga karbonat sangat berperan penting dalam mengontrol ph darah. Pelari maraton dapat mengalami kondisi asidosis, yaitu penurunan ph darah yang disebabkan oleh metabolisme yang tinggi sehingga meningkatkan produksi ion bikarbonat. Kondisi asidosis ini dapat mengakibatkan penyakit jantung, ginjal, diabetes miletus (penyakit gula) dan diare. Orang yang mendaki gunung tanpa oksigen tambahan dapat menderita alkalosis, yaitu peningkatan ph darah. Kadar oksigen yang sedikit di gunung dapat membuat para pendaki bernafas lebih cepat, sehingga gas karbondioksida yang dilepas terlalu banyak, padahal CO 2 dapat larut dalam air menghasilkan H 2 CO 3. Hal ini mengakibatkan ph darah akan naik. Kondisi alkalosis dapat mengakibatkan hiperventilasi (bernafas terlalu berlebihan, kadang-kadang karena cemas dan histeris). b. Penyangga Hemoglobin Pada darah, terdapat hemoglobin yang dapat mengikat oksigen untuk selanjutnya dibawa ke seluruh sel tubuh. Reaksi kesetimbangan dari larutan penyangga oksi hemoglobin adalah: HHb + O 2 (g) «HbO H + Asam hemoglobin ion aksi hemoglobin Keberadaan oksigen pada reaksi di atas dapat memengaruhi konsentrasi ion H +, sehingga ph darah juga dipengaruhi olehnya. Pada reaksi di atas O 2 bersifat basa. Hemoglobin yang telah melepaskan O 2 dapat mengikat H + dan membentuk asam hemoglobin. Sehingga ion H + yang
Artikel Kimia tentang Peranan Larutan Penyangga
 Artikel Kimia tentang Peranan Larutan Penyangga A. PENGERTIAN Larutan penyangga atau dikenal juga dengan nama larutan buffer adalah larutan yang dapat mempertahankan nilai ph apabila larutan tersebut ditambahkan
Artikel Kimia tentang Peranan Larutan Penyangga A. PENGERTIAN Larutan penyangga atau dikenal juga dengan nama larutan buffer adalah larutan yang dapat mempertahankan nilai ph apabila larutan tersebut ditambahkan
Aplikasi Larutan Buffer dalam Kehidupan Sehari-hari
 Aplikasi Larutan Buffer dalam Kehidupan Sehari-hari Buat apa sih belajar tapi gak dipake? Pertanyaan ini tuh selalu muncul di otak gue tiap ngadepin pelajaran yang bikin gue mabok 3 x 24 jam. Dan mungkin
Aplikasi Larutan Buffer dalam Kehidupan Sehari-hari Buat apa sih belajar tapi gak dipake? Pertanyaan ini tuh selalu muncul di otak gue tiap ngadepin pelajaran yang bikin gue mabok 3 x 24 jam. Dan mungkin
LARUTAN ASAM-BASA DAN LARUTAN PENYANGGA
 LARUTAN ASAM-BASA DAN LARUTAN PENYANGGA A. Pengertian Larutan Penyangga Larutan penyangga biasa disebut juga dengan larutan Buffer atau larutan Dapar. Dimana larutan penyangga merupakan larutan yang mampu
LARUTAN ASAM-BASA DAN LARUTAN PENYANGGA A. Pengertian Larutan Penyangga Larutan penyangga biasa disebut juga dengan larutan Buffer atau larutan Dapar. Dimana larutan penyangga merupakan larutan yang mampu
LARUTAN PENYANGGA (BUFFER) Disusun Oleh: Diah Tria Agustina ( ) JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
 HANDOUT klik di sini LARUTAN PENYANGGA (BUFFER) Disusun Oleh: Diah Tria Agustina (4301414032) JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI SEMARANG 2016 PENGERTIAN LARUTAN
HANDOUT klik di sini LARUTAN PENYANGGA (BUFFER) Disusun Oleh: Diah Tria Agustina (4301414032) JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI SEMARANG 2016 PENGERTIAN LARUTAN
PETA KONSEP. Larutan Penyangga. Larutan Penyangga Basa. Larutan Penyangga Asam. Asam konjugasi. Basa lemah. Asam lemah. Basa konjugasi.
 PETA KONSEP Larutan Penyangga mempertahankan berupa ph Larutan Penyangga Asam mengandung Larutan Penyangga Basa mengandung Asam lemah Basa konjugasi Asam konjugasi Basa lemah contoh contoh contoh contoh
PETA KONSEP Larutan Penyangga mempertahankan berupa ph Larutan Penyangga Asam mengandung Larutan Penyangga Basa mengandung Asam lemah Basa konjugasi Asam konjugasi Basa lemah contoh contoh contoh contoh
LARUTAN PENYANGGA (BUFFER)
 LARUTAN PENYANGGA (BUFFER) Larutan penyangga Larutan penyangga atau larutan buffer adalah larutan yang ph-nya praktis tidak berubah walaupun kepadanya ditambahkan sedikit asam, sedikit basa, atau bila
LARUTAN PENYANGGA (BUFFER) Larutan penyangga Larutan penyangga atau larutan buffer adalah larutan yang ph-nya praktis tidak berubah walaupun kepadanya ditambahkan sedikit asam, sedikit basa, atau bila
LARUTAN PENYANGGA Bahan Ajar Kelas XI IPA Semester Gasal 2012/2013
 LARUTAN PENYANGGA [Yea r] LARUTAN PENYANGGA Bahan Ajar Kelas XI IPA Semester Gasal 2012/2013 MARI BELAJAR Indikator Produk Menjelaskan komponen pembentuk larutan penyangga dengan berpikir kritis. Menjelaskan
LARUTAN PENYANGGA [Yea r] LARUTAN PENYANGGA Bahan Ajar Kelas XI IPA Semester Gasal 2012/2013 MARI BELAJAR Indikator Produk Menjelaskan komponen pembentuk larutan penyangga dengan berpikir kritis. Menjelaskan
BAB 6. Jika ke dalam air murni ditambahkan asam atau basa meskipun dalam jumlah. Larutan Penyangga. Kata Kunci. Pengantar
 Kimia XI SMA 179 BAB 6 Larutan Penyangga Tujuan Pembelajaran: Setelah mempelajari bab ini, Anda diharapkan mampu: 1. Menjelaskan pengertian larutan penyangga dan komponen penyusunnya. 2. Merumuskan persamaan
Kimia XI SMA 179 BAB 6 Larutan Penyangga Tujuan Pembelajaran: Setelah mempelajari bab ini, Anda diharapkan mampu: 1. Menjelaskan pengertian larutan penyangga dan komponen penyusunnya. 2. Merumuskan persamaan
Lampiran 2.2 (Analisis Rencana Pelaksanaan Pembelajaran)
 Lampiran 2.2 (Analisis Rencana Pelaksanaan Pembelajaran) I. Analisis Indikator 4. Memahami sifat-sifat larutan asambasa, metode pengukuran, dan terapannya SMAN 1 Dasar SMAN 4 Bandung SMAN 1 Cimahi SMAN
Lampiran 2.2 (Analisis Rencana Pelaksanaan Pembelajaran) I. Analisis Indikator 4. Memahami sifat-sifat larutan asambasa, metode pengukuran, dan terapannya SMAN 1 Dasar SMAN 4 Bandung SMAN 1 Cimahi SMAN
Larutan penyangga dapat terbentuk dari campuran asam lemah dan basa
 Larutan penyangga dapat terbentuk dari campuran asam lemah dan basa konjugasinya atau campuran basa lemah dan asam konjugasinya. Larutan penyangga disebut juga larutan penahan atau larutan dapar atau buffer.
Larutan penyangga dapat terbentuk dari campuran asam lemah dan basa konjugasinya atau campuran basa lemah dan asam konjugasinya. Larutan penyangga disebut juga larutan penahan atau larutan dapar atau buffer.
LARUTAN PENYANGGA (BUFFER)
 LARUTAN PENYANGGA (BUFFER) Larutan penyangga Larutan penyangga atau larutan buffer adalah larutan yang ph-nya praktis tidak berubah walaupun kepadanya ditambahkan sedikit asam, sedikit basa, atau bila
LARUTAN PENYANGGA (BUFFER) Larutan penyangga Larutan penyangga atau larutan buffer adalah larutan yang ph-nya praktis tidak berubah walaupun kepadanya ditambahkan sedikit asam, sedikit basa, atau bila
LARUTAN PENYANGGA (BUFFER)
 LARUTAN PENYANGGA (BUFFER) Larutan penyangga Larutan penyangga atau larutan buffer adalah larutan yang ph-nya praktis tidak berubah walaupun kepadanya ditambahkan sedikit asam, sedikit basa, atau bila
LARUTAN PENYANGGA (BUFFER) Larutan penyangga Larutan penyangga atau larutan buffer adalah larutan yang ph-nya praktis tidak berubah walaupun kepadanya ditambahkan sedikit asam, sedikit basa, atau bila
Larutan penyangga adalah larutan yang dapat mempertahankan harga ph terhadap pengaruh penambahan sedikit asam atau basa, atau terhadap pengenceran.
 Standar Kompetensi Kompetensi Dasar Memahami sifatsifat larutan asambasa, metode pengukuran, dan terapannya. Mendeskripsikan sifat larutan penyangga dan peranan larutan penyangga dalam tubuh makhluk hidup.
Standar Kompetensi Kompetensi Dasar Memahami sifatsifat larutan asambasa, metode pengukuran, dan terapannya. Mendeskripsikan sifat larutan penyangga dan peranan larutan penyangga dalam tubuh makhluk hidup.
REAKSI KIMIA DALAM KEHIDUPAN SEHARI-HARI
 REAKSI KIMIA DALAM KEHIDUPAN SEHARI-HARI Reaksi Kimia bisa terjadi di manapun di sekitar kita, bukan hanya di laboratorium. Materi berinteraksi untuk membentuk produk baru melalui proses yang disebut reaksi
REAKSI KIMIA DALAM KEHIDUPAN SEHARI-HARI Reaksi Kimia bisa terjadi di manapun di sekitar kita, bukan hanya di laboratorium. Materi berinteraksi untuk membentuk produk baru melalui proses yang disebut reaksi
LARUTAN PENYANGGA DAN HIDROLISIS
 6 LARUTAN PENYANGGA DAN HIDROLISIS A. LARUTAN PENYANGGA B. HIDROLISIS Pada bab sebelumnya, kita sudah mempelajari tentang reaksi asam-basa dan titrasi. Jika asam direaksikan dengan basa akan menghasilkan
6 LARUTAN PENYANGGA DAN HIDROLISIS A. LARUTAN PENYANGGA B. HIDROLISIS Pada bab sebelumnya, kita sudah mempelajari tentang reaksi asam-basa dan titrasi. Jika asam direaksikan dengan basa akan menghasilkan
b. Mengubah Warna Indikator Selain rasa asam yang kecut, sifat asam yang lain dapat mengubah warna beberapa zat alami ataupun buatan.
 ASAM DAN BASA A. Asam Apa yang kamu ketahui tentang asam? Asam berkaitan dengan salah satu tanggapan indra pengecap kita terhadap suatu rasa masam. Kata asam berasal dari bahasa Latin, yaitu acidus yang
ASAM DAN BASA A. Asam Apa yang kamu ketahui tentang asam? Asam berkaitan dengan salah satu tanggapan indra pengecap kita terhadap suatu rasa masam. Kata asam berasal dari bahasa Latin, yaitu acidus yang
Kesetimbangan asam basa tubuh
 Kesetimbangan asam basa tubuh dr. Syazili Mustofa, M.Biomed Departemen Biokimia, Biologi Molekuler dan Fisiologi Fakultas Kedokteran Universitas Lampung ph normal darah Dipertahankan oleh sistem pernafasan
Kesetimbangan asam basa tubuh dr. Syazili Mustofa, M.Biomed Departemen Biokimia, Biologi Molekuler dan Fisiologi Fakultas Kedokteran Universitas Lampung ph normal darah Dipertahankan oleh sistem pernafasan
Asam Basa dan Garam. Asam Basa dan Garam
 Asam Basa dan Garam Asam Basa dan Garam A Sifat Asam, Basa, dan Garam 1. Sifat asam Buah-buahan yang masih muda pada umumnya berasa masam. Sebenarnya rasa masam dalam buah-buahan tersebut disebabkan karena
Asam Basa dan Garam Asam Basa dan Garam A Sifat Asam, Basa, dan Garam 1. Sifat asam Buah-buahan yang masih muda pada umumnya berasa masam. Sebenarnya rasa masam dalam buah-buahan tersebut disebabkan karena
Bab II Tinjauan Pustaka. Asam basa Konjugasi Menurut Bronsted Lowry
 Bab II Tinjauan Pustaka II.1 Asam basa Konjugasi Menurut Bronsted Lowry Untuk memahami konsep larutan buffer perlu diketahui konsep asam basa. Konsep asam basa ada tiga yaitu menurut Arrhenius, Bronsted
Bab II Tinjauan Pustaka II.1 Asam basa Konjugasi Menurut Bronsted Lowry Untuk memahami konsep larutan buffer perlu diketahui konsep asam basa. Konsep asam basa ada tiga yaitu menurut Arrhenius, Bronsted
Bab IV Hasil dan Pembahasan
 Bab IV Hasil dan Pembahasan IV.1 Pembuatan Larutan Buffer Semua zat yang digunakan untuk membuat larutan buffer dapat larut dengan sempurna. Larutan yang diperoleh jernih, homogen, dan tidak berbau. Data
Bab IV Hasil dan Pembahasan IV.1 Pembuatan Larutan Buffer Semua zat yang digunakan untuk membuat larutan buffer dapat larut dengan sempurna. Larutan yang diperoleh jernih, homogen, dan tidak berbau. Data
I. LARUTAN BUFFER. 1. Membuat Larutan Buffer 2. Mempelajari Daya Sanggah Larutan Buffer TINJAUAN PUSTAKA
 I. LARUTAN BUFFER II. TUJUAN 1. Membuat Larutan Buffer 2. Mempelajari Daya Sanggah Larutan Buffer III. TINJAUAN PUSTAKA Larutan penyangga atau larutan buffer atau larutan dapar merupakan suatu larutan
I. LARUTAN BUFFER II. TUJUAN 1. Membuat Larutan Buffer 2. Mempelajari Daya Sanggah Larutan Buffer III. TINJAUAN PUSTAKA Larutan penyangga atau larutan buffer atau larutan dapar merupakan suatu larutan
BAB II TINJAUAN PUSTAKA. pakan. Biaya untuk memenuhi pakan mencapai 60-70% dari total biaya produksi
 4 BAB II TINJAUAN PUSTAKA 2. 1. Pakan Sapi Perah Faktor utama dalam keberhasilan usaha peternakan yaitu ketersediaan pakan. Biaya untuk memenuhi pakan mencapai 60-70% dari total biaya produksi (Firman,
4 BAB II TINJAUAN PUSTAKA 2. 1. Pakan Sapi Perah Faktor utama dalam keberhasilan usaha peternakan yaitu ketersediaan pakan. Biaya untuk memenuhi pakan mencapai 60-70% dari total biaya produksi (Firman,
Ensiklopedi: 27 dan 342. Asam, basa dan garam. dikelompokkan berdasarkan. Alat ukur
 BAB 2 ASAM, BASA DAN GARAM Ensiklopedi: 27 dan 342 Kompetensi Dasar: Mengelompokkan sifat larutan asam, larutan basa, dan larutan garam melalui alat dan indikator yang tepat. Melakukan percobaan sederhana
BAB 2 ASAM, BASA DAN GARAM Ensiklopedi: 27 dan 342 Kompetensi Dasar: Mengelompokkan sifat larutan asam, larutan basa, dan larutan garam melalui alat dan indikator yang tepat. Melakukan percobaan sederhana
ASAM, BASA, DAN GARAM
 ASAM, BASA, DAN GARAM Standar Kompetensi : Memahami klasifikasi zat Kompetensi Dasar : Mengelompokkan sifat larutan asam, larutan basa, dan larutan garam melalui alat dan indikator yang tepat A. Sifat
ASAM, BASA, DAN GARAM Standar Kompetensi : Memahami klasifikasi zat Kompetensi Dasar : Mengelompokkan sifat larutan asam, larutan basa, dan larutan garam melalui alat dan indikator yang tepat A. Sifat
Larutan Dapar Dapar adalah senyawa-senyawa atau campuran senyawa yang dapat meniadakan perubahan ph terhadap penambahan sedikit asam atau basa.
 Larutan Dapar Dapar adalah senyawa-senyawa atau campuran senyawa yang dapat meniadakan perubahan ph terhadap penambahan sedikit asam atau basa. Peniadaan perubahan ph tersebut dikenal sebagai aksi dapar.
Larutan Dapar Dapar adalah senyawa-senyawa atau campuran senyawa yang dapat meniadakan perubahan ph terhadap penambahan sedikit asam atau basa. Peniadaan perubahan ph tersebut dikenal sebagai aksi dapar.
LEMBARAN SOAL 4. Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA )
 LEMBARAN SOAL 4 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
LEMBARAN SOAL 4 Mata Pelajaran : KIMIA Sat. Pendidikan : SMA Kelas / Program : XI IPA ( SEBELAS IPA ) PETUNJUK UMUM 1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan 2. Periksa dan bacalah
kimia Kelas X LARUTAN ELEKTROLIT DAN NONELEKTROLIT K-13 A. Pengertian Larutan dan Daya Hantar Listrik
 K-13 Kelas X kimia LARUTAN ELEKTROLIT DAN NONELEKTROLIT Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami perbedaan antara larutan elektrolit dan
K-13 Kelas X kimia LARUTAN ELEKTROLIT DAN NONELEKTROLIT Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami perbedaan antara larutan elektrolit dan
KONTROL KEASAMAN LARUTAN PENYANGGA (BUFFER)
 KONTROL KEASAMAN LARUTAN PENYANGGA (BUFFER) TUJUAN: 1. Memahami manfaat mengontrol ph, terutama dalam sistem fisiologi. 2. Mempelajari tehnik mempertahankan nilai ph larutan dalam berbagai aplikasi. 3.
KONTROL KEASAMAN LARUTAN PENYANGGA (BUFFER) TUJUAN: 1. Memahami manfaat mengontrol ph, terutama dalam sistem fisiologi. 2. Mempelajari tehnik mempertahankan nilai ph larutan dalam berbagai aplikasi. 3.
BAB VI REAKSI KIMIA. Reaksi Kimia. Buku Pelajaran IPA SMP Kelas IX 67
 BAB VI REAKSI KIMIA Pada bab ini akan dipelajari tentang: 1. Ciri-ciri reaksi kimia dan faktor-faktor yang mempengaruhi kecepatan reaksi kimia. 2. Pengelompokan materi kimia berdasarkan sifat keasamannya.
BAB VI REAKSI KIMIA Pada bab ini akan dipelajari tentang: 1. Ciri-ciri reaksi kimia dan faktor-faktor yang mempengaruhi kecepatan reaksi kimia. 2. Pengelompokan materi kimia berdasarkan sifat keasamannya.
SMP kelas 7 - BIOLOGI BAB 3. MELAKUKAN PENGAMATANLatihan Soal 3.2
 1. Rhodamin-B termasuk bahan kimia yang bersifat... SMP kelas 7 - BIOLOGI BAB 3. MELAKUKAN PENGAMATANLatihan Soal 3.2 Korosif Beracun Karsingenik Radioaktif Rhodamin B termasuk bahan kimia yang bersifat
1. Rhodamin-B termasuk bahan kimia yang bersifat... SMP kelas 7 - BIOLOGI BAB 3. MELAKUKAN PENGAMATANLatihan Soal 3.2 Korosif Beracun Karsingenik Radioaktif Rhodamin B termasuk bahan kimia yang bersifat
BAB V PENUTUP. 5.1 Kesimpulan. Berdasarkan hasil analisis data dan pembahasan secara deskriptif dan statistik. dapat disimpulkan sebagai berikut :
 BAB V PENUTUP 5.1 Kesimpulan Berdasarkan hasil analisis data dan pembahasan secara deskriptif dan statistik dapat disimpulkan sebagai berikut : 1. Penerapan pendekatan saintifik efektif pada materi pokok
BAB V PENUTUP 5.1 Kesimpulan Berdasarkan hasil analisis data dan pembahasan secara deskriptif dan statistik dapat disimpulkan sebagai berikut : 1. Penerapan pendekatan saintifik efektif pada materi pokok
FAKULTAS TEKNIK UNIVERSITAS NEGERI YOGYAKARTA BAHAN AJAR KIMIA DASAR
 No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 11 BAB VIII LARUTAN ASAM DAN BASA Asam dan basa sudah dikenal sejak dahulu. Istilah asam (acid) berasal dari bahasa Latin acetum yang berarti
No. BAK/TBB/SBG201 Revisi : 00 Tgl. 01 Mei 2008 Hal 1 dari 11 BAB VIII LARUTAN ASAM DAN BASA Asam dan basa sudah dikenal sejak dahulu. Istilah asam (acid) berasal dari bahasa Latin acetum yang berarti
PERCOBAAN IV PEMBUATAN BUFFER Tujuan Menghitung dan pembuat larutan buffer atau dapar untuk aplikasi dalam bidang farmasi.
 A B PERCOBAAN IV PEMBUATAN BUFFER Tujuan Menghitung dan pembuat larutan buffer atau dapar untuk aplikasi dalam bidang farmasi. Dasar Teori Larutan penyangga atau larutan buffer atau larutan dapar merupakan
A B PERCOBAAN IV PEMBUATAN BUFFER Tujuan Menghitung dan pembuat larutan buffer atau dapar untuk aplikasi dalam bidang farmasi. Dasar Teori Larutan penyangga atau larutan buffer atau larutan dapar merupakan
ASAM, BASA DAN GARAM
 ASAM, BASA DAN GARAM Larutan terdiri dari zat terlarut (solute) dan pelarut (solvent). Dalam suatu larutan, jumlah pelarut lebih banyak dibandingkan jumlah zat terlarut. Penggolongan larutan dapat juga
ASAM, BASA DAN GARAM Larutan terdiri dari zat terlarut (solute) dan pelarut (solvent). Dalam suatu larutan, jumlah pelarut lebih banyak dibandingkan jumlah zat terlarut. Penggolongan larutan dapat juga
MAKALAH KIMIA ANALITIK
 MAKALAH KIMIA ANALITIK Aplikasi COD dalam Pengolahan Limbah Cair Industri Disusun oleh : Ulinnahiyatul Wachidah ( 412014003 ) Ayundhai Elantra ( 412014017 ) Rut Christine ( 4120140 ) Universitas Kristen
MAKALAH KIMIA ANALITIK Aplikasi COD dalam Pengolahan Limbah Cair Industri Disusun oleh : Ulinnahiyatul Wachidah ( 412014003 ) Ayundhai Elantra ( 412014017 ) Rut Christine ( 4120140 ) Universitas Kristen
UJIAN AKHIR SEMESTER 1 SEKOLAH MENENGAH TAHUN AJARAN 2014/2015 Mata Pelajaran : Kimia
 Nama : UJIAN AKHIR SEMESTER 1 SEKOLAH MENENGAH TAHUN AJARAN 2014/2015 Mata Pelajaran : Kimia Kelas : 7 Waktu : 09.30-11.00 No.Induk : Hari/Tanggal : Jumat, 05 Desember 2014 Petunjuk Umum: Nilai : 1. Isikan
Nama : UJIAN AKHIR SEMESTER 1 SEKOLAH MENENGAH TAHUN AJARAN 2014/2015 Mata Pelajaran : Kimia Kelas : 7 Waktu : 09.30-11.00 No.Induk : Hari/Tanggal : Jumat, 05 Desember 2014 Petunjuk Umum: Nilai : 1. Isikan
LAPORAN PRAKTIKUM. ph METER DAN PERSIAPAN LARUTAN PENYANGGA
 LAPORAN PRAKTIKUM ph METER DAN PERSIAPAN LARUTAN PENYANGGA Hari/Tanggal Praktikum : Kamis/ 17 Oktober 2013 Nama Mahasiswa : 1. Nita Andriani Lubis 2. Ade Sinaga Tujuan Praktikum : Teori 1. Mengetahui pembuatan
LAPORAN PRAKTIKUM ph METER DAN PERSIAPAN LARUTAN PENYANGGA Hari/Tanggal Praktikum : Kamis/ 17 Oktober 2013 Nama Mahasiswa : 1. Nita Andriani Lubis 2. Ade Sinaga Tujuan Praktikum : Teori 1. Mengetahui pembuatan
KESEIMBANGAN ASAM- BASA. dr.sudarno
 KESEIMBANGAN ASAM- BASA dr.sudarno KESEIMBANGAN ASAM BASA Afinitas Hb terhadap O 2 terutama dikendalikan oleh ph darah ph darah (arterial) : 7,4 (7,35-7,45) Sistem yang berperan mempertahankan ph darah:
KESEIMBANGAN ASAM- BASA dr.sudarno KESEIMBANGAN ASAM BASA Afinitas Hb terhadap O 2 terutama dikendalikan oleh ph darah ph darah (arterial) : 7,4 (7,35-7,45) Sistem yang berperan mempertahankan ph darah:
Membuat Sendiri Air Alkalin (Basa) dan Manfaatnya Bagi Kesehatan
 Membuat Sendiri Air Alkalin (Basa) dan Manfaatnya Bagi Kesehatan a Merupakan suatu yang hal sangat penting bagi kita untuk mengkonsumsi makanan dan minuman yang memenuhi kebutuhan tubuh. Sifat asam diperoleh
Membuat Sendiri Air Alkalin (Basa) dan Manfaatnya Bagi Kesehatan a Merupakan suatu yang hal sangat penting bagi kita untuk mengkonsumsi makanan dan minuman yang memenuhi kebutuhan tubuh. Sifat asam diperoleh
SEKOLAH TINGGI ILMU KESEHATAN NASIONAL TAHUN
 ASIDOSIS METABOLIK Disusun oleh: Desi (A101.19.006) Dewi Sekar (A101.19.007) Dina Fitri Astuti (A101.19.008) Ela Kusumawati (A101.19.009) Fatoni Aditya O (A101.19.010) Febriana Ramadhani (A101.19.011)
ASIDOSIS METABOLIK Disusun oleh: Desi (A101.19.006) Dewi Sekar (A101.19.007) Dina Fitri Astuti (A101.19.008) Ela Kusumawati (A101.19.009) Fatoni Aditya O (A101.19.010) Febriana Ramadhani (A101.19.011)
Ubah Plastik Jadi Bahan Bakar
 Ubah Plastik Jadi Bahan Bakar Sampah plastik sangat banyak dijumpai di Indonesia. Tempat Pembuangan Akhir (TPA) sampah sudah dijejali plastik, bahkan hingga ditimbun dalam tanah. Sampah plastik juga terbawa
Ubah Plastik Jadi Bahan Bakar Sampah plastik sangat banyak dijumpai di Indonesia. Tempat Pembuangan Akhir (TPA) sampah sudah dijejali plastik, bahkan hingga ditimbun dalam tanah. Sampah plastik juga terbawa
KLASIFIKASI ZAT. 1. Identifikasi Sifat Asam, Basa, dan Garam
 KLASIFIKASI ZAT Pola konsep 1. Identifikasi Sifat Asam, Basa, dan Garam Di antara berbagai zat yang ada di alam semesta ini, asam,basa, dan garam merupakan zat yang paling penting yang diamati oleh para
KLASIFIKASI ZAT Pola konsep 1. Identifikasi Sifat Asam, Basa, dan Garam Di antara berbagai zat yang ada di alam semesta ini, asam,basa, dan garam merupakan zat yang paling penting yang diamati oleh para
KATA PENGANTAR. Surabaya, 24 Februari Penulis. Asiditas dan Alkalinitas Page 1
 KATA PENGANTAR Segala puji dan syukur senantiasa kita panjatkan kehadiran allah SWT, atas limpahan rahmat dan hidayahnya kepada kita, sehingga kelompok kami dapat menyelesaikan makalah Asiditas dan Alkalinitas.
KATA PENGANTAR Segala puji dan syukur senantiasa kita panjatkan kehadiran allah SWT, atas limpahan rahmat dan hidayahnya kepada kita, sehingga kelompok kami dapat menyelesaikan makalah Asiditas dan Alkalinitas.
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi. Bab 16. Asam dan Basa
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Bab 16 Asam dan Basa Asam Memiliki rasa masam; misalnya cuka mempunyai rasa dari asam asetat, dan lemon serta buah-buahan sitrun
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Bab 16 Asam dan Basa Asam Memiliki rasa masam; misalnya cuka mempunyai rasa dari asam asetat, dan lemon serta buah-buahan sitrun
LAPORAN PRAKTIKUM KIMIA DASAR LARUTAN BUFFER
 LAPORAN PRAKTIKUM KIMIA DASAR LARUTAN BUFFER Nama : Fathul Muin NIM : 12/334686/PA/14919 LABORATORIUM KIMIA DASAR JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS GADJAH MADA DASAR
LAPORAN PRAKTIKUM KIMIA DASAR LARUTAN BUFFER Nama : Fathul Muin NIM : 12/334686/PA/14919 LABORATORIUM KIMIA DASAR JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS GADJAH MADA DASAR
SISTEM EKSKRESI PADA MANUSIA
 A. GINJAL SISTEM EKSKRESI PADA MANUSIA Sebagian besar produk sisa metabolisme sel berasal dari perombakan protein, misalnya amonia dan urea. Kedua senyawa tersebut beracun bagi tubuh dan harus dikeluarkan
A. GINJAL SISTEM EKSKRESI PADA MANUSIA Sebagian besar produk sisa metabolisme sel berasal dari perombakan protein, misalnya amonia dan urea. Kedua senyawa tersebut beracun bagi tubuh dan harus dikeluarkan
kimia ASAM-BASA I Tujuan Pembelajaran
 KTSP & K-13 kimia K e l a s XI ASAM-BASA I Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami definisi dan sifat asam serta basa. 2. Memahami teori
KTSP & K-13 kimia K e l a s XI ASAM-BASA I Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami definisi dan sifat asam serta basa. 2. Memahami teori
Macam macam mikroba pada biogas
 Pembuatan Biogas F I T R I A M I L A N D A ( 1 5 0 0 0 2 0 0 3 6 ) A N J U RORO N A I S Y A ( 1 5 0 0 0 2 0 0 3 7 ) D I N D A F E N I D W I P U T R I F E R I ( 1 5 0 0 0 2 0 0 3 9 ) S A L S A B I L L A
Pembuatan Biogas F I T R I A M I L A N D A ( 1 5 0 0 0 2 0 0 3 6 ) A N J U RORO N A I S Y A ( 1 5 0 0 0 2 0 0 3 7 ) D I N D A F E N I D W I P U T R I F E R I ( 1 5 0 0 0 2 0 0 3 9 ) S A L S A B I L L A
HASIL DA PEMBAHASA. Tabel 5. Analisis komposisi bahan baku kompos Bahan Baku Analisis
 IV. HASIL DA PEMBAHASA A. Penelitian Pendahuluan 1. Analisis Karakteristik Bahan Baku Kompos Nilai C/N bahan organik merupakan faktor yang penting dalam pengomposan. Aktivitas mikroorganisme dipertinggi
IV. HASIL DA PEMBAHASA A. Penelitian Pendahuluan 1. Analisis Karakteristik Bahan Baku Kompos Nilai C/N bahan organik merupakan faktor yang penting dalam pengomposan. Aktivitas mikroorganisme dipertinggi
L A R U T A N _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA
 L A R U T A N _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA 1. Larutan Elektrolit 2. Persamaan Ionik 3. Reaksi Asam Basa 4. Perlakuan Larutan
L A R U T A N _KIMIA INDUSTRI_ DEWI HARDININGTYAS, ST, MT, MBA WIDHA KUSUMA NINGDYAH, ST, MT AGUSTINA EUNIKE, ST, MT, MBA 1. Larutan Elektrolit 2. Persamaan Ionik 3. Reaksi Asam Basa 4. Perlakuan Larutan
Disusun Oleh: Anastasia Latif ( XI IPA 1 ) Christine ( XI IPA 1 ) Josephine Putri ( XI IPA 2 ) Kelvin Ricky (XI IPA 2 ) Patty Regina (XI IPA 1 )
 LAPORAN PRAKTIKUM KIMIA Asam dan Basa Disusun Oleh: Anastasia Latif ( XI IPA 1 ) Christine ( XI IPA 1 ) Josephine Putri ( XI IPA 2 ) Kelvin Ricky (XI IPA 2 ) Patty Regina (XI IPA 1 ) Windy Saputra ( XI
LAPORAN PRAKTIKUM KIMIA Asam dan Basa Disusun Oleh: Anastasia Latif ( XI IPA 1 ) Christine ( XI IPA 1 ) Josephine Putri ( XI IPA 2 ) Kelvin Ricky (XI IPA 2 ) Patty Regina (XI IPA 1 ) Windy Saputra ( XI
FUNGSI SISTEM GINJAL DALAM HOMEOSTASIS ph
 FUNGSI SISTEM GINJAL DALAM HOMEOSTASIS ph Dr. MUTIARA INDAH SARI NIP: 132 296 973 2007 DAFTAR ISI I. PENDAHULUAN.......... 1 II. ASAM BASA DEFINISI dan ARTINYA............ 2 III. PENGATURAN KESEIMBANGAN
FUNGSI SISTEM GINJAL DALAM HOMEOSTASIS ph Dr. MUTIARA INDAH SARI NIP: 132 296 973 2007 DAFTAR ISI I. PENDAHULUAN.......... 1 II. ASAM BASA DEFINISI dan ARTINYA............ 2 III. PENGATURAN KESEIMBANGAN
Metabolisme (Katabolisme) Radityo Heru Mahardiko XII IPA 2
 Metabolisme (Katabolisme) Radityo Heru Mahardiko XII IPA 2 Peta Konsep Kofaktor Enzim Apoenzim Reaksi Terang Metabolisme Anabolisme Fotosintesis Reaksi Gelap Katabolisme Polisakarida menjadi Monosakarida
Metabolisme (Katabolisme) Radityo Heru Mahardiko XII IPA 2 Peta Konsep Kofaktor Enzim Apoenzim Reaksi Terang Metabolisme Anabolisme Fotosintesis Reaksi Gelap Katabolisme Polisakarida menjadi Monosakarida
Rangkaian reaksi biokimia dalam sel hidup. Seluruh proses perubahan reaksi kimia beserta perubahan energi yg menyertai perubahan reaksi kimia tsb.
 Rangkaian reaksi biokimia dalam sel hidup. Seluruh proses perubahan reaksi kimia beserta perubahan energi yg menyertai perubahan reaksi kimia tsb. Anabolisme = (biosintesis) Proses pembentukan senyawa
Rangkaian reaksi biokimia dalam sel hidup. Seluruh proses perubahan reaksi kimia beserta perubahan energi yg menyertai perubahan reaksi kimia tsb. Anabolisme = (biosintesis) Proses pembentukan senyawa
BAB II TINJAUAN PUSTAKA. Belajar merupakan proses aktif siswa untuk mempelajari dan memahami
 10 BAB II TINJAUAN PUSTAKA 2.1 Belajar dan Pembelajaran Belajar merupakan proses aktif siswa untuk mempelajari dan memahami konsep-konsep yang dikembangkan dalam kegiatan belajar-mengajar, baik individual
10 BAB II TINJAUAN PUSTAKA 2.1 Belajar dan Pembelajaran Belajar merupakan proses aktif siswa untuk mempelajari dan memahami konsep-konsep yang dikembangkan dalam kegiatan belajar-mengajar, baik individual
KESEIMBANGAN ASAM BASA Pengertian ph Definisi ph -log (H + ) Untuk menghitung ph larutan : 1.Hitung konsentrasi ion Hidrogen (H + ) 2.Hitung logaritma
 Keseimbangan Asam Basa Dr. OK.M. Syahputra, M.kes Dr. Almaycano Ginting Departemen Biokimia FK USU KESEIMBANGAN ASAM BASA Pengertian ph Definisi ph -log (H + ) Untuk menghitung ph larutan : 1.Hitung konsentrasi
Keseimbangan Asam Basa Dr. OK.M. Syahputra, M.kes Dr. Almaycano Ginting Departemen Biokimia FK USU KESEIMBANGAN ASAM BASA Pengertian ph Definisi ph -log (H + ) Untuk menghitung ph larutan : 1.Hitung konsentrasi
PENENTUAN KUALITAS AIR
 PENENTUAN KUALITAS AIR Analisis air Mengetahui sifat fisik dan Kimia air Air minum Rumah tangga pertanian industri Jenis zat yang dianalisis berlainan (pemilihan parameter yang tepat) Kendala analisis
PENENTUAN KUALITAS AIR Analisis air Mengetahui sifat fisik dan Kimia air Air minum Rumah tangga pertanian industri Jenis zat yang dianalisis berlainan (pemilihan parameter yang tepat) Kendala analisis
Senyawa Kimia Paling Penting Dalam Kehidupan Manusia
 Senyawa Kimia Paling Penting Dalam Kehidupan Manusia Senyawa Kimia Paling Penting Dalam Kehidupan Manusia Dalam hidup ini, kita selalu dikelilingi oleh senyawa kimia. Baik makromolekul maupun mikromolekul.
Senyawa Kimia Paling Penting Dalam Kehidupan Manusia Senyawa Kimia Paling Penting Dalam Kehidupan Manusia Dalam hidup ini, kita selalu dikelilingi oleh senyawa kimia. Baik makromolekul maupun mikromolekul.
tujuh1asam - - ASAM BASA GARAM - - Asam Basa Garam 7202 Kimia Les Privat dirumah bimbelaqila.com - Download Format Word di belajar.bimbelaqila.
 - - ASAM BASA GARAM - - Modul ini singkron dengan Aplikasi Android, Download melalui Play Store di HP Kamu, ketik di pencarian tujuh1asam Jika Kamu kesulitan, Tanyakan ke tentor bagaimana cara downloadnya.
- - ASAM BASA GARAM - - Modul ini singkron dengan Aplikasi Android, Download melalui Play Store di HP Kamu, ketik di pencarian tujuh1asam Jika Kamu kesulitan, Tanyakan ke tentor bagaimana cara downloadnya.
KESEIMBANGAN ASAM BASA
 KESEIMBANGAN ASAM BASA Oleh: Putu Aksa Viswanatha dr. Kadek Agus Heryana Putra,SpAn BAGIAN/SMF ILMU ANESTESIA DAN TERAPI INTESIF FK UNUD/RSUP SANGLAH 2017 DAFTAR ISI Halaman HALAMAN JUDUL... KATA PENGANTAR...
KESEIMBANGAN ASAM BASA Oleh: Putu Aksa Viswanatha dr. Kadek Agus Heryana Putra,SpAn BAGIAN/SMF ILMU ANESTESIA DAN TERAPI INTESIF FK UNUD/RSUP SANGLAH 2017 DAFTAR ISI Halaman HALAMAN JUDUL... KATA PENGANTAR...
PRESENTASI POWERPOINT PENGAJAR OLEH PENERBIT ERLANGGA DIVISI PERGURUAN TINGGI. BAB 16. ASAM DAN BASA
 PRESENTASI POWERPOINT PENGAJAR OLEH PENERBIT ERLANGGA DIVISI PERGURUAN TINGGI. BAB 16. ASAM DAN BASA Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Bab 16 Asam dan Basa Asam
PRESENTASI POWERPOINT PENGAJAR OLEH PENERBIT ERLANGGA DIVISI PERGURUAN TINGGI. BAB 16. ASAM DAN BASA Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Bab 16 Asam dan Basa Asam
LAPORAN PRAKTIKUM KIMIA ORGANIK FARMASI PERCOBAAN I PERBEDAAN SENYAWA ORGANIK DAN ANORGANIK
 LAPORAN PRAKTIKUM KIMIA ORGANIK FARMASI PERCOBAAN I PERBEDAAN SENYAWA ORGANIK DAN ANORGANIK OLEH: NAMA : ISMAYANI STAMBUK : F1 F1 10 074 KELOMPOK : III KELAS : B ASISTEN : RIZA AULIA JURUSAN FARMASI FAKULTAS
LAPORAN PRAKTIKUM KIMIA ORGANIK FARMASI PERCOBAAN I PERBEDAAN SENYAWA ORGANIK DAN ANORGANIK OLEH: NAMA : ISMAYANI STAMBUK : F1 F1 10 074 KELOMPOK : III KELAS : B ASISTEN : RIZA AULIA JURUSAN FARMASI FAKULTAS
BAB II LANDASAN TEORI
 5 BAB II LANDASAN TEORI 2.1 Pengertian Biogas Biogas adalah gas yang terbentuk melalui proses fermentasi bahan-bahan limbah organik, seperti kotoran ternak dan sampah organik oleh bakteri anaerob ( bakteri
5 BAB II LANDASAN TEORI 2.1 Pengertian Biogas Biogas adalah gas yang terbentuk melalui proses fermentasi bahan-bahan limbah organik, seperti kotoran ternak dan sampah organik oleh bakteri anaerob ( bakteri
BAB II TINJAUAN PUSTAKA. Asam asetat dalam ilmu kimia disebut juga Acetid acid (Acidum aceticum), akan
 BAB II TINJAUAN PUSTAKA A. Asam Asetat 1. Definisi Asam asetat dalam ilmu kimia disebut juga Acetid acid (Acidum aceticum), akan tetapi di kalangan masyarakat asam asetat biasanya disebut cuka atau asam
BAB II TINJAUAN PUSTAKA A. Asam Asetat 1. Definisi Asam asetat dalam ilmu kimia disebut juga Acetid acid (Acidum aceticum), akan tetapi di kalangan masyarakat asam asetat biasanya disebut cuka atau asam
BAB I PENDAHULUAN. dikonsumsi, tetapi juga dari aktivitas atau latihan fisik yang dilakukan. Efek akut
 BAB I PENDAHULUAN 1.1 Latar Belakang Kesehatan tubuh manusia tidak hanya tergantung dari jenis makanan yang dikonsumsi, tetapi juga dari aktivitas atau latihan fisik yang dilakukan. Efek akut aktivitas
BAB I PENDAHULUAN 1.1 Latar Belakang Kesehatan tubuh manusia tidak hanya tergantung dari jenis makanan yang dikonsumsi, tetapi juga dari aktivitas atau latihan fisik yang dilakukan. Efek akut aktivitas
PERCOBAAN 3 REAKSI ASAM BASA
 PERCOBAAN 3 REAKSI ASAM BASA I. Teori Dasar Kita sering menjumpai asam dan basa dalam kehidupan sehari-hari. Buah-buahan, seperti jeruk, apel, dll., mengandung asam. Amonia rumah tangga, bahan pembersih,
PERCOBAAN 3 REAKSI ASAM BASA I. Teori Dasar Kita sering menjumpai asam dan basa dalam kehidupan sehari-hari. Buah-buahan, seperti jeruk, apel, dll., mengandung asam. Amonia rumah tangga, bahan pembersih,
AHMAD SULISTYONO ( ) MEGA BUNGA P. ( ) CHAYUN PIDA RENNI ( ) SINTA HERAWATI ( ) ISPONI UMAYAH ( ) YUNAN
 OKSIGEN (O2) AHMAD SULISTYONO (4311413082) MEGA BUNGA P. (4311413065) CHAYUN PIDA RENNI (4311413069) SINTA HERAWATI (4311413076) ISPONI UMAYAH (4311413066) YUNAN GUMARA Y. (4311413057) OKSIGEN?? Oksigen
OKSIGEN (O2) AHMAD SULISTYONO (4311413082) MEGA BUNGA P. (4311413065) CHAYUN PIDA RENNI (4311413069) SINTA HERAWATI (4311413076) ISPONI UMAYAH (4311413066) YUNAN GUMARA Y. (4311413057) OKSIGEN?? Oksigen
RUMAH BIRU (BIOETANOL URIN MANUSIA) Dari Masyarakat Untuk Masyarakat Oleh : Benny Chandra Monacho
 RUMAH BIRU (BIOETANOL URIN MANUSIA) Dari Masyarakat Untuk Masyarakat Oleh : Benny Chandra Monacho Latar Belakang Keberadaan minyak sebagai sumber bahan bakar utama memang masih dominan di dunia, namun
RUMAH BIRU (BIOETANOL URIN MANUSIA) Dari Masyarakat Untuk Masyarakat Oleh : Benny Chandra Monacho Latar Belakang Keberadaan minyak sebagai sumber bahan bakar utama memang masih dominan di dunia, namun
Manfaat Minum Air Putih
 Manfaat Minum Air Putih "Teman-teman, mungkin banyak dari kita yang malas minum air putih...padahal manfaatnya banyak banget...yuks kita kupas manfaatnya!" Sekitar 80% tubuh manusia terdiri dari air. Otak
Manfaat Minum Air Putih "Teman-teman, mungkin banyak dari kita yang malas minum air putih...padahal manfaatnya banyak banget...yuks kita kupas manfaatnya!" Sekitar 80% tubuh manusia terdiri dari air. Otak
INTRUKSI Kompetensi Dasar Indikator Sumber Belajar
 Lampiran 3 89 INTRUKSI 1. Setiap siswa harus membaca penuntun praktikum ini dengan seksama. 2. Setelah alat dan bahan siap tersedia, laksanakanlah percobaan menurut prosedur percobaan. 3. Setelah melakukan
Lampiran 3 89 INTRUKSI 1. Setiap siswa harus membaca penuntun praktikum ini dengan seksama. 2. Setelah alat dan bahan siap tersedia, laksanakanlah percobaan menurut prosedur percobaan. 3. Setelah melakukan
Metodologi Penelitian
 Bab III Metodologi Penelitian Pembuatan larutan buffer menggunakan metode pencampuran antara asam lemah dengan basa konjugasinya. Selanjutnya larutan buffer yang sudah dibuat diuji kemampuannya dalam mempertahankan
Bab III Metodologi Penelitian Pembuatan larutan buffer menggunakan metode pencampuran antara asam lemah dengan basa konjugasinya. Selanjutnya larutan buffer yang sudah dibuat diuji kemampuannya dalam mempertahankan
Reaksi keseluruhannya :
 LI 1. Memahami dan Mengetahui Tentang Asam-Basa LO 1.1 Definisi Asam-Basa Definisi asam-basa menurut Arrhenius Menurut Arrhenius pada tahun 1903, asam adalah zat yang dalam air dapat menghasilkan ion hidrogen
LI 1. Memahami dan Mengetahui Tentang Asam-Basa LO 1.1 Definisi Asam-Basa Definisi asam-basa menurut Arrhenius Menurut Arrhenius pada tahun 1903, asam adalah zat yang dalam air dapat menghasilkan ion hidrogen
2
 Keseimbangan Asam Basa Dr. OK.M. Syahputra, M.Kes Dr. Almaycano Ginting, M.Kes Departemen Biokimia FK USU KESEIMBANGAN ASAM BASA Pengertian ph Defanisi ph -log (H + ) Untuk menghitung ph larutan : 1.Hitung
Keseimbangan Asam Basa Dr. OK.M. Syahputra, M.Kes Dr. Almaycano Ginting, M.Kes Departemen Biokimia FK USU KESEIMBANGAN ASAM BASA Pengertian ph Defanisi ph -log (H + ) Untuk menghitung ph larutan : 1.Hitung
LAPORAN PRAKTIKUM 2. : Magister Ilmu Biolmedik : ph meter, persiapan larutan penyangga Tanggal pelaksanaan : 10 Maret 2015
 LAPORAN PRAKTIKUM NAMA PRAKTIKAN : Nini Chairani (14700801) Zakirullah Syafei (1470080) PRODI : Magister Ilmu Biolmedik JUDUL : ph meter, persiapan larutan penyangga Tanggal pelaksanaan : 10 Maret 015
LAPORAN PRAKTIKUM NAMA PRAKTIKAN : Nini Chairani (14700801) Zakirullah Syafei (1470080) PRODI : Magister Ilmu Biolmedik JUDUL : ph meter, persiapan larutan penyangga Tanggal pelaksanaan : 10 Maret 015
I. PENDAHULUAN. A. Latar Belakang Masalah. kelenjar ludah besar dan kecil yang ada pada mukosa oral. Saliva yang terbentuk
 I. PENDAHULUAN A. Latar Belakang Masalah Saliva adalah cairan oral kompleks yang terdiri atas campuran sekresi dari kelenjar ludah besar dan kecil yang ada pada mukosa oral. Saliva yang terbentuk di rongga
I. PENDAHULUAN A. Latar Belakang Masalah Saliva adalah cairan oral kompleks yang terdiri atas campuran sekresi dari kelenjar ludah besar dan kecil yang ada pada mukosa oral. Saliva yang terbentuk di rongga
1. Dari pengujian larutan dengan kertas lakmus diperoleh data berikut:
 SOAL-SOAL BAB 5 LARUTAN ASAM BASA/ Kimia Erlangga 2B 1. Dari pengujian larutan dengan kertas lakmus diperoleh data berikut: No Larutan yang diuji Warna lakmus Merah Biru 1 X Merah Biru 2 Y Merah Merah
SOAL-SOAL BAB 5 LARUTAN ASAM BASA/ Kimia Erlangga 2B 1. Dari pengujian larutan dengan kertas lakmus diperoleh data berikut: No Larutan yang diuji Warna lakmus Merah Biru 1 X Merah Biru 2 Y Merah Merah
SMA XII (DUA BELAS) BIOLOGI METABOLISME
 JENJANG KELAS MATA PELAJARAN TOPIK BAHASAN SMA XII (DUA BELAS) BIOLOGI METABOLISME Metabolisme adalah seluruh reaksi kimia yang dilakukan oleh organisme. Metabolisme juga dapat dikatakan sebagai proses
JENJANG KELAS MATA PELAJARAN TOPIK BAHASAN SMA XII (DUA BELAS) BIOLOGI METABOLISME Metabolisme adalah seluruh reaksi kimia yang dilakukan oleh organisme. Metabolisme juga dapat dikatakan sebagai proses
BAB I PENDAHULUAN. Teh sarang semut merupakan salah satu jenis teh herbal alami yang terbuat
 IX-xi BAB I PENDAHULUAN I.1. Latar Belakang Teh sarang semut merupakan salah satu jenis teh herbal alami yang terbuat dari bahan utama yaitu tumbuhan umbi yang digunakan oleh semut sebagai sarang sehingga
IX-xi BAB I PENDAHULUAN I.1. Latar Belakang Teh sarang semut merupakan salah satu jenis teh herbal alami yang terbuat dari bahan utama yaitu tumbuhan umbi yang digunakan oleh semut sebagai sarang sehingga
BAB LARUTAN PENYANGGA. Click to edit Master subtitle style 4/8/12
 BAB 8 7 LARUTAN Click to edit Master subtitle style PENYANGGA Oleh : Ariel Evansyah Herianto Arika Budi Yarti Arina Dyah Yuliarti Permata Rahmatul Hijjah Risma Eva Rizki Imansari Rizki Mamluatuz Zahro
BAB 8 7 LARUTAN Click to edit Master subtitle style PENYANGGA Oleh : Ariel Evansyah Herianto Arika Budi Yarti Arina Dyah Yuliarti Permata Rahmatul Hijjah Risma Eva Rizki Imansari Rizki Mamluatuz Zahro
BAB 2 TINJAUAN PUSTAKA. Pemberian cairan diperlukan karena gangguan dalam keseimbangan cairan dan
 BAB 2 TINJAUAN PUSTAKA 2.1. Terapi cairan Pemberian cairan bertujuan untuk memulihkan volume sirkulasi darah. 6,13 Pemberian cairan diperlukan karena gangguan dalam keseimbangan cairan dan elektrolit merupakan
BAB 2 TINJAUAN PUSTAKA 2.1. Terapi cairan Pemberian cairan bertujuan untuk memulihkan volume sirkulasi darah. 6,13 Pemberian cairan diperlukan karena gangguan dalam keseimbangan cairan dan elektrolit merupakan
BAB 7. ASAM DAN BASA
 BAB 7. ASAM DAN BASA 7. 1 TEORI ASAM BASA 7. 2 TETAPAN KESETIMBANGAN PENGIONAN ASAM DAN BASA 7. 3 KONSENTRASI ION H + DAN ph 7. 4 INDIKATOR ASAM-BASA (INDIKATOR ph) 7. 5 CAMPURAN PENAHAN 7. 6 APLIKASI
BAB 7. ASAM DAN BASA 7. 1 TEORI ASAM BASA 7. 2 TETAPAN KESETIMBANGAN PENGIONAN ASAM DAN BASA 7. 3 KONSENTRASI ION H + DAN ph 7. 4 INDIKATOR ASAM-BASA (INDIKATOR ph) 7. 5 CAMPURAN PENAHAN 7. 6 APLIKASI
1. Ciri-Ciri Reaksi Kimia
 Apakah yang dimaksud dengan reaksi kimia? Reaksi kimia adalah peristiwa perubahan kimia dari zat-zat yang bereaksi (reaktan) menjadi zat-zat hasil reaksi (produk). Pada reaksi kimia selalu dihasilkan zat-zat
Apakah yang dimaksud dengan reaksi kimia? Reaksi kimia adalah peristiwa perubahan kimia dari zat-zat yang bereaksi (reaktan) menjadi zat-zat hasil reaksi (produk). Pada reaksi kimia selalu dihasilkan zat-zat
BAB II TINJAUAN PUSTAKA. Belajar adalah proses aktif siswa untuk mempelajari dan memahami konsepkonsep
 BAB II TINJAUAN PUSTAKA A. Belajar dan Pembelajaran Belajar adalah proses aktif siswa untuk mempelajari dan memahami konsepkonsep yang dikembangkan dalam kegiatan belajar mengajar, baik individual maupun
BAB II TINJAUAN PUSTAKA A. Belajar dan Pembelajaran Belajar adalah proses aktif siswa untuk mempelajari dan memahami konsepkonsep yang dikembangkan dalam kegiatan belajar mengajar, baik individual maupun
CREATIVE THINKING. MANUSIA DAN ILMU PENGETAHUAN Panca Indra
 CREATIVE THINKING MANUSIA DAN ILMU PENGETAHUAN Panca Indra HIDUNG Hidung merupakan panca indera manusia yang sangat penting untuk mengenali bau dan juga untuk bernafas. Bagian-Bagian Hidung Dan Fungsinya
CREATIVE THINKING MANUSIA DAN ILMU PENGETAHUAN Panca Indra HIDUNG Hidung merupakan panca indera manusia yang sangat penting untuk mengenali bau dan juga untuk bernafas. Bagian-Bagian Hidung Dan Fungsinya
ASAM -BASA, STOIKIOMETRI LARUTAN DAN TITRASI ASAM-BASA
 ASAM -BASA, STOIKIOMETRI LARUTAN DAN TITRASI ASAM-BASA Asam merupakan zat yang yang mengion dalam air menghasilkan ion H + dan basa merupakan zat yang mengion dalam air menghasilkan ion OH -. ASAM Asam
ASAM -BASA, STOIKIOMETRI LARUTAN DAN TITRASI ASAM-BASA Asam merupakan zat yang yang mengion dalam air menghasilkan ion H + dan basa merupakan zat yang mengion dalam air menghasilkan ion OH -. ASAM Asam
SMP kelas 8 - BIOLOGI BAB 11. SISTEM EKSKRESI MANUSIAlatihan soal 11.3
 1. Kaitan antara hati dan eritrosit adalah??? SMP kelas 8 - BIOLOGI BAB 11. SISTEM EKSKRESI MANUSIAlatihan soal 11.3 Hati berperan dalam perombakan eritosit Hati menghasilkan eritrosit Eritrosit merupakan
1. Kaitan antara hati dan eritrosit adalah??? SMP kelas 8 - BIOLOGI BAB 11. SISTEM EKSKRESI MANUSIAlatihan soal 11.3 Hati berperan dalam perombakan eritosit Hati menghasilkan eritrosit Eritrosit merupakan
BAB II TINJAUAN PUSTAKA
 6 BAB II TINJAUAN PUSTAKA 2.1. Metabolisme Energi Otot Rangka Kreatin fosfat merupakan sumber energi pertama yang digunakan pada awal aktivitas kontraktil. Suatu karakteristik khusus dari energi yang dihantarkan
6 BAB II TINJAUAN PUSTAKA 2.1. Metabolisme Energi Otot Rangka Kreatin fosfat merupakan sumber energi pertama yang digunakan pada awal aktivitas kontraktil. Suatu karakteristik khusus dari energi yang dihantarkan
Sistem Ekskresi Manusia
 Sistem Ekskresi Manusia Sistem ekskresi merupakan sistem dalam tubuh kita yang berfungsi mengeluarkan zatzat yang tidak dibutuhkan lagi oleh tubuh dan zat yang keberadaannya dalam tubuh akan mengganggu
Sistem Ekskresi Manusia Sistem ekskresi merupakan sistem dalam tubuh kita yang berfungsi mengeluarkan zatzat yang tidak dibutuhkan lagi oleh tubuh dan zat yang keberadaannya dalam tubuh akan mengganggu
TINJAUAN PUSTAKA. Sifat dan Ciri Ultisol. merupakan tanah yang terkikis dan memperlihatkan pengaruh pencucian yang
 TINJAUAN PUSTAKA Sifat dan Ciri Ultisol Ultisol berasal dari bahasa Latin Ultimius, yang berarti terakhir yang merupakan tanah yang terkikis dan memperlihatkan pengaruh pencucian yang lanjut. Ultisol memiliki
TINJAUAN PUSTAKA Sifat dan Ciri Ultisol Ultisol berasal dari bahasa Latin Ultimius, yang berarti terakhir yang merupakan tanah yang terkikis dan memperlihatkan pengaruh pencucian yang lanjut. Ultisol memiliki
Pemisahan dengan Pengendapan
 Pemisahan dengan Pengendapan Reaksi Pengendapan Pemisahan dengan teknik pengendapan membutuhkan perbedaan kelarutan yang besar antara analit dan material pengganggunya. Pemisahan dengan pengendapan bisa
Pemisahan dengan Pengendapan Reaksi Pengendapan Pemisahan dengan teknik pengendapan membutuhkan perbedaan kelarutan yang besar antara analit dan material pengganggunya. Pemisahan dengan pengendapan bisa
Kesetimbangan Kimia. Chapter 9 P N2 O 4. Kesetimbangan akan. Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Kesetimbangan adalah suatu keadaan di mana tidak ada perubahan yang terlihat seiring berjalannya waktu. Kesetimbangan kimia
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Kesetimbangan adalah suatu keadaan di mana tidak ada perubahan yang terlihat seiring berjalannya waktu. Kesetimbangan kimia
Cara menggunakan ph meter digital
 Cara menggunakan ph meter digital ph meter adalah alat elektronik yang digunakan untuk mengukur ph (keasaman atau alkalinitas) dari cairan (meskipun probe khusus terkadang digunakan untuk mengukur ph zat
Cara menggunakan ph meter digital ph meter adalah alat elektronik yang digunakan untuk mengukur ph (keasaman atau alkalinitas) dari cairan (meskipun probe khusus terkadang digunakan untuk mengukur ph zat
HASIL DAN PEMBAHASAN
 HASIL DAN PEMBAHASAN Analisis Awal Bahan Baku Pembuatan Biogas Analisis bahan baku biogas dan analisis bahan campuran yang digunakan pada biogas meliputi P 90 A 10 (90% POME : 10% Aktivator), P 80 A 20
HASIL DAN PEMBAHASAN Analisis Awal Bahan Baku Pembuatan Biogas Analisis bahan baku biogas dan analisis bahan campuran yang digunakan pada biogas meliputi P 90 A 10 (90% POME : 10% Aktivator), P 80 A 20
ANALISISN AIR METODE TITRIMETRI TENTANG KESADAHAN AIR. Oleh : MARTINA : AK
 ANALISISN AIR METODE TITRIMETRI TENTANG KESADAHAN AIR Oleh : MARTINA : AK.011.046 A. PENGERTIAN AIR senyawa kimia yang sangat penting bagi kehidupan umat manusia dan makhluk hidup lainnya karena fungsinya
ANALISISN AIR METODE TITRIMETRI TENTANG KESADAHAN AIR Oleh : MARTINA : AK.011.046 A. PENGERTIAN AIR senyawa kimia yang sangat penting bagi kehidupan umat manusia dan makhluk hidup lainnya karena fungsinya
SMP kelas 7 - BIOLOGI BAB 11. Organisasi KehidupanLatihan Soal 11.4
 1. Perubahan energi yang trjadi didalam kloropas adalah.... SMP kelas 7 - BIOLOGI BAB 11. Organisasi KehidupanLatihan Soal 11.4 Energi cahaya menjadi energi potensial Energi kimia menjadi energi gerak
1. Perubahan energi yang trjadi didalam kloropas adalah.... SMP kelas 7 - BIOLOGI BAB 11. Organisasi KehidupanLatihan Soal 11.4 Energi cahaya menjadi energi potensial Energi kimia menjadi energi gerak
BAB I PENDAHULUAN. 1.1 Latar Belakang
 BAB I PENDAHULUAN 1.1 Latar Belakang Dewasa ini, masyarakat semakin sadar terhadap pentingnya olahraga bagi kesehatan tubuh. Di berbagai kota besar sudah mulai banyak bermunculan pusatpusat kebugaran tubuh
BAB I PENDAHULUAN 1.1 Latar Belakang Dewasa ini, masyarakat semakin sadar terhadap pentingnya olahraga bagi kesehatan tubuh. Di berbagai kota besar sudah mulai banyak bermunculan pusatpusat kebugaran tubuh
REAKSI SAPONIFIKASI PADA LEMAK
 REAKSI SAPONIFIKASI PADA LEMAK TUJUAN : Mempelajari proses saponifikasi suatu lemak dengan menggunakan kalium hidroksida dan natrium hidroksida Mempelajari perbedaan sifat sabun dan detergen A. Pre-lab
REAKSI SAPONIFIKASI PADA LEMAK TUJUAN : Mempelajari proses saponifikasi suatu lemak dengan menggunakan kalium hidroksida dan natrium hidroksida Mempelajari perbedaan sifat sabun dan detergen A. Pre-lab
HASIL DAN PEMBAHASAN
 21 HASIL DAN PEMBAHASAN Pada setiap sediaan otot gastrocnemius dilakukan tiga kali perekaman mekanomiogram. Perekaman yang pertama adalah ketika otot direndam dalam ringer laktat, kemudian dilanjutkan
21 HASIL DAN PEMBAHASAN Pada setiap sediaan otot gastrocnemius dilakukan tiga kali perekaman mekanomiogram. Perekaman yang pertama adalah ketika otot direndam dalam ringer laktat, kemudian dilanjutkan
Bab VIII Reaksi Penetralan dan Titrasi Asam-Basa
 Bab VIII Reaksi Penetralan dan Titrasi Asam-Basa Sumber: James Mapple, Chemistry an Enquiry-Based Approach Pengukuran ph selama titrasi akan lebih akurat dengan menggunakan alat ph-meter. TUJUAN PEMBELAJARAN
Bab VIII Reaksi Penetralan dan Titrasi Asam-Basa Sumber: James Mapple, Chemistry an Enquiry-Based Approach Pengukuran ph selama titrasi akan lebih akurat dengan menggunakan alat ph-meter. TUJUAN PEMBELAJARAN
TEORI ASAM BASA Secara Umum :
 TEORI ASAM BASA Secara Umum : Asam Basa : : Cairan berasa asam dan dapat memerahkan kertas lakmus biru Cairan berasa pahit dan dapat membirukan kertas lakmus merah Garam : Cairan yang berasa asin TEORI
TEORI ASAM BASA Secara Umum : Asam Basa : : Cairan berasa asam dan dapat memerahkan kertas lakmus biru Cairan berasa pahit dan dapat membirukan kertas lakmus merah Garam : Cairan yang berasa asin TEORI
