BAB II DASAR TEORI. 3Fe 2 O 3 +C 2 Fe 3 O 4 +CO. Fe 3 O 4 +CO 3FeO+CO2 Fe 3 O 4 + C 3FeO+CO FeO+C Fe+CO
|
|
|
- Handoko Tedja
- 7 tahun lalu
- Tontonan:
Transkripsi
1 BAB II DASAR TEORI Pembelajaran tentang proses pengolahan besi merupakan hal yang penting untuk dipelajari, mengingat logam tersebut digunakan pada berbagai macam aplikasi. Teknik yang paling umum digunakan secara komersial yaitu dengan menggunakan blast furnace dan juga converter. Pada blast furnace reaksi yang terjadi yaitu sebagai berikut [8] : 3Fe 2 O 3 +CO 2 Fe 3 O 4 +CO2 3Fe 2 O 3 +C 2 Fe 3 O 4 +CO Fe 3 O 4 +CO 3FeO+CO2 Fe 3 O 4 + C 3FeO+CO FeO+CO Fe+CO2 FeO+C Fe+CO Meskipun dapat terlihat bahwa bijih besi dapat direduksi secara langsung dengan menggunakan karbon padat, namun reduksi dengan menggunakan gas CO mengindikasikan reaksi utama yang terjadi pada beberapa percobaan reduksi bijih besi yang telah dilakukan [9-13]. Pemrosesan reduksi bijih besi dengan menggunakan blast furnace memiliki kelemahan utama, yaitu karena temperatur proses yang terlalu tinggi maka logam lain ( Si, Mn, dll.) akan banyak yang ikut melebur bersama dengan Fe sehingga akan sulit untuk dipisahkan. Oleh karena itu dikembangkan suatu metode baru untuk mengatasi hal tersebut dengan menggunakan proses reduksi langsung. Proses reduksi langsung adalah proses pengurangan oksigen dari besi oksida dimana besi oksida tersebut tidak mengalami perubahan fasa, yaitu fasa padat. Proses reduksi langsung menggunakan zat pereduksi yang afinitas terhadap
2 oksigen lebih besar daripada besi oksida. Proses ini dilakukan dengan menggunakan temperatur tinggi, namun lebih rendah dari temperatur yang digunakan pada pemrosesan dengan menggunakan blast furnace. Banyak studi yang dilakukan untuk mempelajari proses reduksi langsung, Usui et al. mempelajari tentang proses prereduksi pada besi oksida dengan menggunakan batu bara dan juga gas dengan reaksi utama yang terjadi antara besi oksida dan hydrogen [14]. Ishikawa et al. secara sukses mempelajari tentang reduksi pada wustit (Fe1)xO dengan menggunakan karbon padat [15]. Untuk lebih memahami proses reduksi langsung, dipaparkan pada dasar teori dibahan ini : 2.1 PRINSIP DASAR PROSES REDUKSI BESI OKSIDA Proses reduksi langsung merupakan reduksi bijih besi dengan menghindari fasa cair. Proses ini dilakukan dengan menggunakan pereduktor seperti karbon (coal), minyak bumi dan juga gas metana (CH 4 ). Prinsip dasar proses ini adalah mengurangi kadar oksigen dengan menggunakan unsur yang afinitas terhadap O (oksigen) lebih besar daripada Fe (besi). Proses ini dilakukan tanpa mengubah fasa, yaitu fasa padat. Hasil akhir proses ini menghasilkan bijih besi yang didalamnya masih terdapat oksida. Proses reduksi langsung digunakan dengan beberapa alasan sebagai berikut : a. Menggunakan batu bara/ gas bumi sebagai pengganti kokas b. Produk berkualitas tinggi c. Kapasitas produksi bisa rendah, sesuai dengan permintaan pasar d. Emisi CO 2 rendah sehingga lebih ramah terhadap lingkungan Termokimia Reaksi kimia selalu melibatkan pelepasan maupun penyerapan energi. Hal tersebut menunjukkan bahwa setiap material memiliki energi. Energi dilepaskan apabila dalam suatu reaksi produk memiliki energi yang lebih rendah daripada pereaktan, sedangkan suatu reaksi dikatakan menyerap energi apabila produk memiliki energi yang lebih tinggi daripada pereaktan [16].
3 Panas merupakan bentuk energi yang umum pada suatu reaksi. Derajat panas juga dapat diukur dengan suhu. Panas yang dimiliki oleh suatu material merupakan entalpi dari material tersebut yang diberi lambang H. Ketika suatu unsur bereaksi dengan unsur lain membentuk suatu senyawa, energi panas yang digunakan pada reaksi tersebut disebut sebagai energi panas pembentukan (entalpi pembentukan) yang diberi lambang H f. Contoh entalpi pembentukan adalah sebagai berikut : C + ½O 2 CO H f = cal/mol C + O 2 CO 2 H f = cal/mol Ketika suatu senyawa bereaksi dengan senyawa lain membentuk suatu senyawa baru maka H f berubah menjadi H penguraian, oleh karena itu besar H f harus dibalik. Contohnya sebagai berikut : Fe 3 O 4 + CO 3FeO + CO 2 H = x(-63500) Apabila H reaksi bernilai positif maka reaksi merupakan reaksi endotermik (menyerap panas). Apabila H bernilai negatif maka reaksi merupakan reaksi eksotermik ( melepaskan panas) Energi Bebas Energi bebas merupakan selisih antara total energi pada sistem dengan energi ikatan, TS. Energi bebas reaksi kimia pada temperatur konstan dirumuskan sebagai berikut [16]:..(2.1) Keterangan : F = Energi bebas cal/mol H = Entalpi cal/mol T = Temperatur K S = Perubahan entropi
4 Apabila F bernilai negatif maka reaksi tersebut dapat berjalan secara spontan, namun apabila suatu reaksi F bernilai positif maka reaksi tersebut tidak dapat berjalan secara spontan. Contoh energi bebas beberapa reaksi sebagai berikut [16] : 2Fe + O 2 2FeO F o T = T cal/molo 2 ( o K) 6FeO + O 2 2Fe 3 O 4 F o T = T cal/molo 2 ( o K) 4Fe 3 O 4 + O 2 6Fe 2 O 3 F o T = T cal/molo 2 ( o K) 2C + O 2 2CO F o T = T cal/molo 2 ( o K) C + O 2 CO 2 F o T = T cal/molo 2 ( o K) 2CO + O 2 2 CO 2 F o T = T cal/molo 2 ( o K) C + CO 2 2CO F o T = T cal/molo 2 ( o K) 2H 2 + O 2 2H 2 O F o T = T cal/molo 2 ( o K) Energi bebas suatu reaksi juga dapat ditentukan dengan menggunakan prinsip kesetimbangan kimia. Pada reaksi kimia : A + B C + D Kecepatan reaksi pereaktan sama dengan kecepatan pereaksi produk (Vpereaktan = Vproduk). Energi bebas dapat ditentukan dengan Persamaan 2.2. RTlnK RTln C D A B...(2.2) Keterangan : F o = Energi bebas cal/mol R = konstanta gas T = Temperatur K a = aktivitas Aktivitas pada gas sama dengan tekanan parsial yang dimiliki oleh gas tersebut. Untuk material padat dan cair, sama dengan konsentrasi yang dimiliki.
5 Energi bebas yang dimiliki oleh suatu reaksi dapat diplot kedalam suatu grafik bersama dengan temperatur. Grafik yang memuat energi bebas versus temperatur disebut sebagai Diagram Ellingham seperti ditunjukkan pada Gambar 2.1. Pada diagram Ellingham, logam yang aktif secara kimia memiliki energi bebas yang paling tinggi (negatif) dalam membentuk oksida terletak pada diagram dibagian paling bawah. Sedangkan untuk logam yang memiliki energi bebas terkecil (positif) dalam membentuk oksida terletak pada diagram dibagian paling atas. Nilai dari F o untuk reaksi oksidasi merupakan ukuran afinitas kimia suatu logam terhadap oksigen. Semakin negatif nilai F o suatu logam menunjukkan logam tersebut semakin stabil dalam bentuk oksida. Dari diagram Ellingham pada Gambar 2.1, kita dapat mengetahui temperatur minimal yang dibutuhkan agar reaksi tersebut dapat terjadi. Hal tersebut dapat ditunjukkan oleh perpotongan antara kurva oksidasi dan reduksi. Termodinamika hanya dapat digunakan untuk menentukan apakah suatu reaksi dapat berjalan spontan ataukah tidak pada temperatur tertentu berdasarkan energi bebas yang dimiliki. Namun tidak dapat digunakan untuk menentukan laju reaksi. Perpotongan antara garis reaksi oksidasi dan reduksi secara termodinamika menunjukkan bahwa reaksi tersebut dapat berjalan pada temperatur tertentu. Selain menggunakan diagram Ellingham, kita juga dapat menentukan termodinamika suatu reaksi melalui perhitungan energi bebas F dari reaksi tersebut dengan menggunakan F o referensi seperti yang telah tercantum diatas.
6 G Gambar 2.1 Diagram D Elliingham [16] Term modinamika a Reaksi Reeduksi Besi Oksida Reakksi reduksi dengan d mengggunaan karbbon monoksida (CO) meemiliki tiga tahap t antaraa lain [16] : I Fe2O3 Î (I) ( 3 Fe2O3 +CO Î (II) ( Fe3O4+CO (III) ( FeO+ +CO III II Fe3O4 Î F FeO Î Fe 2 Fe3O4+CO2 H = cal Î 3FeO+ +CO2 H = Î Fe+CO O2 H = cal 8664 cal
7 Secara termodinamika energi bebas dari ketiga reaksi tersebut dapat ditentukan sebagai berikut : Persamaan (I) 6Fe 2 O 3 4Fe 3 O 4 + O 2 F o T = T cal/molo 2 2CO + O 2 2 CO 2 F o T = T cal/molo 2 6Fe2O3 + 2CO 4Fe3O4+ 2CO 2 F o T = T cal/molo 2 Atau 3Fe2O3 + CO 2Fe3O4+ CO 2 F o T = T cal/molo 2 Persamaan (II) 2Fe 3 O 4 6FeO + O 2 F o T = T cal/molo 2 2CO + O 2 2 CO 2 F o T = T cal/molo 2 2Fe3O4+2CO 6FeO+2CO2 F o T = T cal/molo 2 Atau Fe3O4+CO 3FeO+CO2 F o T = T cal/molo 2 Persamaan (III) 2FeO 2Fe + O 2 F o T = T cal/molo 2 2CO + O 2 2 CO 2 F o T = T cal/molo 2 2FeO + 2CO 2Fe + 2CO2 F o T = T cal/molo 2 FeO + CO Fe + CO2 F o T = T cal/molo 2 Hasil perhitungan energi bebas diatas menunjukkan bahwa ketiga reaksi tersebut dapat berjalan spontan. Secara termodinamika menunjukkan ketiga reaksi tersebut feasible untuk dilakukan.
8 2.1.4 Reaksi Boudouard Proses reduksi langsung menggunakan kesetimbangan antara besi, hematite, magnetit, wustit, karbonmonoksida, karbondioksida, serta karbon padat pada tekanan 1 atm seperti ditunjukkan dalam diagram Bauer Glassner dan Boudouard pada Gambar 2.2. Kesetimbangan tersebut merupakan dasar dilakukannya proses reduksi langsung dengan menggunakan karbon padat. Gambar 2.2. Diagram Bauer Glassner dan Boudouard [16] Dalam diagram tersebut terdapat kesetimbangan besi oksida dengan campuran gas CO/ CO 2, antara lain : Garis kesetimbangan Boudouard : CO 2 + C = 2CO Garis kesetimbangan : 3Fe 2 O 3 + CO = 2Fe 3 O 4 + CO 2 Garis kesetimbangan : Fe 3 O 4 + CO = 3FeO + CO 2 Garis kesetimbangan : FeO + CO = Fe + CO 2
9 Dari garis kesetimbangan Boudouard, pada temperatur C terdapat 100 % gas CO. Apabila temperatur diturunkan maka kesetimbangan tersebut tidak tercapai sehingga terjadi penguraian dari gas CO menjadi CO 2 dan C. Sehingga jumlah gas CO (pereduktor) akan berkurang. Pada daerah disebelah kiri garis kesetimbangan boudouard maka gas CO 2 akan lebih stabil sehingga gas CO yang ada akan terurai menjadi CO 2. Pada daerah disebelah kanan garis kesetimbangan boudouard gas CO lebih stabil sehingga gas CO 2 akan mengalami reaksi boudouard membentuk gas CO.Hal tersebut merupakan contoh dari prinsip Le Chatelier, reaksi boudouard merupakan reaksi yang endotermik sehingga membutuhkan temperatur tinggi untuk dapat berjalan. Dari Diagram Bauer Glassner dan Boudouard pada Gambar 2.2, senyawa yang terbentuk sangat dipengaruhi oleh perbandingan antara CO/CO 2 dan juga temperatur operasi. Misal pada temperatur C dengan perbandingan CO/CO 2 adalah 60:40, maka senyawa yang paling stabil adalah wustit. Magnetit akan tereduksi menjadi wustit, sedangkan Fe akan mengalami oksidasi menjadi wustit. Hal penting yang dapat disimpulkan dari kesetimbangan Boudouard antara garis kesetimbangan wustit/fe dan garis kesetimbangan boudouard berpotongan pada temperatur C. Hal tersebut menunjukkan bahwa temperatur minimum yang dibutuhkan untuk mereduksi wustit menjadi Fe adalah C. Antara garis kesetimbangan Magnetit/wustit dan garis kesetimbangan boudouard berpotongan pada temperatur C. Hal tersebut menunjukkan bahwa temperatur minimum yang dibutuhkan untuk mereduksi magnetit menjadi wustit adalah C. Temperatur minimum diatas pada tekanam 1 atm. Sangat tidak mungkin reaksi dapat berjalan dibawah temperatur minimum karena karbonmonoksida terurai menjadi karbondioksida. 2.2 MEKANISME REDUKSI LANGSUNG Mekanisme reduksi langsung besi oksida dengan karbon padat terdiri dari : 1. Pembentukan gas reduktor 2. Adsorbsi gas pada besi oksida 3. Proses difusi dalam besi oksida
10 2.2.1 Pembentukan Gas Reduktor Bila karbon dengan adanya oksigen pada temperatur tertinggi akan terbentuk gas CO menurut reaksi : C + O 2 CO 2 CO 2 + C 2CO Karbondioksida yang dibentuk dapat bereaksi kembali dengan karbon sehingga terbentuk karbonmonoksida sesuai dengan reaksi boudouard. Karbon tersebut berasal dari karbon dan gas CO yang merupakan gas reduktor yang akan mereduksi besi oksida. Pada proses pembakaran karbon terjadi pembentukan lapisan film. Gas CO yang terbentuk konsentrasinya lebih rendah bila dibandingkan dengan konsentrasi gas CO pada fraksi padat. Selain gas CO sebagai reduktor yang terbentuk dari pembakaran tadi, dihasilkan juga abu yang mempengaruhi jumlah molekul gas reduktor tiap satuan volume. Gas-gas yang terjadi dipengaruhi oleh kecepatan molar transformasi karbon padat tiap satuan waktu dan satuan volume. Proses pembentukan gas CO berjalan dengan seiring waktu, seperti ditunjukkan pada Gambar 2.3. Semakin lama waktu reaksi maka semakin banyak karbon yang bereaksi dengan karbondioksida membentuk karbonmonoksida yang digunakan sebagai pereduktor.
11 Gambar 2.3 Gasifikasi Karbon Keterangan : Cag = konsentrasi gas reaktan pada fasa gas Cas = konsentrasi gas reaktan pada permukaan partikel padat Cac = konsentrasi gas reaktan pada permukaan padatan yang belum tereaksi Crc = konsentrasi gas produk pada permukaan padatan yang belum tereaksi Crs = konsentrasi gas produk pada permukaan partikel padat Crg = konsentrasi gas produk pada fasa gas R = jari-jari partikel padat r c = jari-jari padatan yang belum tereaksi
12 Secara empiris ditulis...(2.3) Keterangan : Vc = Kecepatan molar transformasi karbon ( mol C/ cm 3. det) kc = konstanta gasifikasi karbon (det -1 ) n 0 CO2 = konsentrasi gas CO 2 dalam fasa gas (mol/cm 3 ) n CO2 = konsentrasi gas CO 2 pada kesetimbangan permukaan reaksi karbon padat (mol/cm 3 ) Sedangkan.....(2.4). exp RT...(2.5) Keterangan : kr = konstantan reaktifitas (cm 3 /g. det) Mc = jumlah karbon( g/ cm 3 ) n = faktor Thiele s untuk pori-pori Hc = reaktifitas batu bara Pada temperatur diatas C, n = 1 Sehingga diperoleh :. Mc. exp RT...(2.6) Dari Persamaan 2.3 dan 2.6 didapatkan :. Mc. exp RT n0co2 n CO2...(2.7)
13 Dari Persamaan Persamaan diatas maka dapat disimpulkan bahwa gasifikasi karbon yang menghasilkan gas reduktor merupakan molar transformasi karbon didalam karbon yang tergantung pada reaktifitas karbon dan jumlah karbon. Reaksi gasifikasi karbon dengan CO 2 merupakan reaksi endotermik, oleh karena itu reaksi ini terjadi pada temperatur tinggi. Pada temperatur C akan dihasilkan 100% CO pada tekanan 1 atm. Laju reaksi secara keseluruhan dikendalikan oleh laju gasifikasi karbon [16]. Laju gasifikasi karbon ditentukan oleh beberapa faktor yaitu reaktivitas karbon, temperatur dan juga ketersediaan panas yang digunakan untuk mempertahankan reaksi hingga mencapai temperatur operasi [16]. Reaktivitas yang dimiliki oleh material yang mengandung karbon (carbonaceous material) sangat bervariasi. Luas permukaan karbon yang memungkinkan terjadinya reaksi antara karbon dengan CO 2 merupakan hal yang penting, yang ditentukan oleh ukuran partikel material dan juga porositas yang dimiliki oleh material. Charcoal, arang dan juga kokas memiliki porositas dan reaktivitas yang lebih tinggi daripada material karbon alami seperti kayu, karbon, dan grafit. Charcoal lebih reaktif daripada kokas pada temperatur rendah.kokas yang dibuat dengan tipe karbon yang berbeda-beda(lignit, bituminous, anthracite) juga akan memberikan reaktivitas yang berbeda-beda. Pada banyak kasus, laju reaksi serta produktivitas dari proses reduksi langsung ditentukan oleh beberapa faktor yang saling terhubung yaitu : Transfer panas (heat transfer) Reaktivitas karbon (carbon reactivity) Reducibility besi oksida (iron oxide reducibility) Ukuran partikel karbon, jumlah karbon yang tersedia, serta tipe karbon yang digunakan sangat berpengaruh terhadap laju gasifikasi. Ukuran partikel yang kecil dan ketersediaan dalam jumlah banyak akan meningkatkan luas permukaan yang mungkin untuk terjadi reaksi gasifikasi karbon sehingga dapat meningkatkan laju reaksi[16].
14 2.3.2 Adsorbsi Gas Pada Besi Oksida Adsorbsi adalah proses terikatnya gas reduktor pada permukaan besi oksida yang disebabkan oleh energi secara fisika dan kimia. Fisika adsorbsi merupakan daya yang terjadi oleh bergeraknya masing-masing molekul gas, yang dibatasi oleh jumlah molekul gas yang menumbuk luas permukaan besi oksida dalam satuan waktu. Kimia adsorbsi adalah daya kimia antara gas dengan padatan (besi oksida), dimana gas melingkupi dan berinteraksi dengan permukaan besi oksida. Kimia adsorbsi sangat bergantung pada kemampuan dan kecenderungan antar gas dan besi oksida dalam bertukar ion elektron atau memberi dari orbitnya. Dalam wustit ( Fe 1-y O), dimana y merupakan tempat kosong ion besi terhadap kisi-kisi besi atau mol fraksi dari tempat kosong ion besi. Dengan adanya gas CO maka akan menyebabkan pengurangan oksigen dan bersamaan dengan proses tersebut terjadi pembentukan ion bervalensi 2 dalam posisi kisi normal menurut reaksi [8] : keterangan : = tempat ion kosong dalam wustit = cacat elektron Fe 2+ Fe 2+ = divalen ion besi pada wustit dalam kondisi kisi normal Pada permukaan besi oksida akan terbentuk ikatan baru sebagai produk yaitu akan terbentuk Fe metalik dengan ikatan logam, dilain pihak akan terbentuk gas CO 2 sebagai hasil dari reaksi adsorbsi oksigen. Pengurangan oksigen dapat ditunjukkan dengan adanya perbedaan konsentrasi gas CO 2 antara fasa gas dengan fasa kesetimbangan pada permukaan besi oksida. Dengan demikian oksigen yang hilang tiap satuan waktu dan satuan volume secara empiris dapat ditulis sebagai berikut :
15 Vo = k Fe (n CO2 - n o CO2)...(2.8) Sedangkan : k Fe = H Fe (1-R) (T/1173) 2 (1/ n CO2)...(2.9) Dimana : Vo = jumlah oksigen yang dihilangkan ( mol O/ cm 3. det) Vc = kecepatan molar transformasi karbon ( mol C/ cm 3. det) k Fe = konstanta kecepatan reduksi (det -1 ) n CO2 = konsentrasi gas CO 2 pada permukaan reaksi besi oksida (mol/ cm 3 ) n CO2 = konsentrasi gas CO 2 pada kesetimbangan reaksi permukaan karbon padat (mol/ cm 3 ) n o CO2 = konsentrasi gas CO 2 dalam fasa gas (mol/ cm 3 ) k C = konstanta gasifikasi karbon (det -1 ) H Fe R T = karakterisasi besi oksida = derajat reduksi = jumlah oksigen yang hilang jumlah oksigen mula-mula = temperatur pengukuran proses (K) Pada keadaan setimbang maka kecepatan molar transformasi gasifikasi karbon sama dengan molar transformasi oksigen yang hilang (Vc=Vo). Oleh karena itu diperoleh konsentrasi CO 2 pada fasa gas sebagai fungsi dari konstanta Persamaan (2.10) sehingga kecepatan reduksi menjadi :...(2.11)
16 Dari Persamaan 2.11 dapat terlihat bahwa kecepatan reaksi reduksi tergantung dari konstanta gasifikasi karbon dan konstanta reduksi besi oksida. Apabila, Reaktifitas karbon lebih kecil dibandingkan dengan kemampuan reduksi besi oksida : kc < k Fe maka terjadi Vo ~ 0 Reaktifitas karbon lebih besar dibandingkan dengan kemampuan reduksi besi oksida : kc > k Fe maka terjadi Vo = Vo maks. Vo maks. = k Fe (n CO2 n CO2)...(2.12) Vo maks. merupakan kecepatan maksimum reduksi pada permukaan besi oksida pada temperatur reduksi. Untuk temperatur diatas C, didapatkan n CO2 << n CO2, maka didapatkan Persamaan kecepatan : Vo maks. = k Fe (n CO2 )...(2.13) Dari Persamaan 2.12 didapatkan kecepatan molar oksigen yang hilang pada temperatur diatas C adalah :...(2.14) Dengan demikian tampak bahwa pengurangan oksigen tiap satuan waktu dan volume merupakan fungsi dari karakteristik besi oksida, reaktifitas karbon, jumlah karbon dan temperatur Proses Difusi Dalam Besi Oksida Dasar Difusi Difusi didefinisikan sebagai pergerakan atom didalam suatu material dengan fasa padat, cair ataupun gas. Fokus pada pembahasan disini adalah pada material denga fasa padat, yaitu besi oksida pada temperatur tinggi.
17 Pada temperatur tinggi tempat atom kosong akan bergerak semakin cepat dengan meningkatnya temperatur. Diperlukan energi untuk menggerakkan sebuah tempat atom kosong dari suatu keadaan setimbang ke keadaan setimbang yang lain, sebesar Hm. Selain itu juga diperlukan juga energi untuk membentuk tempat atom kosong sebesar Hv. Sehingga difusi tidak hanya tergantung pada pergerakan tempat kosong termasuk pada pergerakan atom tetapi juga pada fraksi kedudukan tempat yang atomnya kosong. Konsekuensi dengan bertambahnya tempat atom kosong yaitu meningkatkan kecepatan difusi atau meningkatnya difusifitas dengan meningkatnya temperatur.. /...(2.15)...(2.16) Sehingga diperoleh. /...(2.17) Dimana : D = Difusifitas (koefisien difusi) (cm 2. det -1 ) Do = Koefisien difusi standard (cm 2. det -1 ) Q = energi aktivasi ( kal.mol -1 ) R = konstanta gas (1.987 kcal/mol) T = Temperatur (K) Mekanisme Reaksi Reduciability dari besi oksida sangat dipengaruhi oleh porositas yang dimiliki oleh besi oksida tersebut. Semakin tinggi porositas maka akan mempermudah difusi gas pereduktor CO pada besi oksida sehingga akan meningkatkan laju reduksi. Pellet hasil aglomerisasi memiliki porositas yang jauh lebih tinggi daripada pellet yang disinter, sehingga reduciability pellet hasil aglomerisasi jauh lebih tinggi daripada pellet hasil sinter.
18 Ukuran partikel pereaksi seperti karbon juga sangat berpengaruh. Semakin kecil partikel karbon maka semakin luas permukaan yang memungkinkan terjadi reaksi, sehingga laju pembentukan CO semakin tinggi. Mekanisme reaksi reduksi langsung pada pellet berpori sangat tergantung dari difusi CO untuk menyentuh permukaan besi oksida dan bereaksi. Semakin banyak pori-pori, semakin mudah CO berdifusi kedalam pellet sehingga laju reaksi reduksi akan berjalan semakin cepat. Semakin sedikit pori-pori, semakin sulit CO untuk bereduksi sehingga laju reaksi reduksi akan berjalan semakin lambat. Mekanisme reduksi langsung seperti ditunjukkan pada Gambar 2.4. Gas CO 2 Gas CO waktu waktu Fe 2 O 3 Fe 3 O 4 FeO FeO Gambar 2.4 Mekanisme reduksi langsung pada pellet berporos [16] Pada material yang bebas poros maka reaksi reduksi menggunakan mekanisme solid state difffusion of ferrous ion.
19 2.4 METODE KARAKTERISASI PRODUK Metode karakterisasi yang digunakan untuk mengidentifikasi pereaksi serta produk akhir dapat dilakukan dengan metode XRD maupun XRF X-Ray Fluorecence (XRF) Ketika x-ray primer tereksitasi dari x-ray tube atau radiaoaktif menabrak sampel, x-ray dapat diserap oleh atom atau disebarkan pada seluruh permukaan material. Proses dimana x-ray diserap oleh atom dengan mentransfer seluruh energinya ke elektron yang paling dalam dinamakan protoelectric effect. Prinsip kerja XRF dapat dijelaskan sebagai berikut : Selama proses jika x-ray mempunyai energi yang cukup maka elektron akan terlempar dari kulitnya yang lebih dalam (tereksitasi), menciptakan vacancy pada kulitnya, ditunjukkan pada Gambar 2.5. Gambar 2.5 Elektron tereksitasi keluar [17] Vacancy itu mengakibatkan kondisi yang tidak stabil pada atom. Untuk menstabilkan kondisi maka elektron dari luar ditransfer untuk menutupi vacancy tersebut, seperti ditunjukkan pada Gambar 2.6. Misalnya elektron dari kulit L dan M mengisi kekosongan yang ada. Pada proses perpindahan tersebut energy dibebaskan karena adanya perpindahan dari kulit yang memiliki energy lebih tinggi (L/M) kedalam kulit yang memiliki energy paling rendah (K). Emisi yang dikeluarkan oleh setiap material memiliki karakter khusus.
20 Gambar 2.6 Pengisian kekosongan elektron [17] Proses tersebut memberikan karakteristik dari x-ray, yang energinya berasal dari perbedaan energi ikatan antar kulit yang berhubungan. X-ray yang dihasilkan dari proses ini disebut X-Ray Flourecence atau XRF (Gambar 2.7). Gambar 2.7 Pelepasan energi [17] Proses untuk mendeteksi dan menganalisa X-Ray yang dihasilkan disebut X-ray Flourecence analysis. Karena spektrum X-ray maka pada saat penyinaran suatu material akan didapatkan multiple peak pada intensitas yang berbeda, seperti ditunjukkan pada gambar Gambar 2.8.
21 Contoh : Iceland Basalt Fluorescence Spectrum Cou nts Energi (kev) Gambar 2.8 Contoh hasil XRF Karakterisasi x-ray yang ditandai oleh K,L,M, atau N untuk menunjukkan kulit asalnya. Model yang lain yaitu alfa, beta, atau gamma dibuat untuk menandai x-ray yang berasal dari elektron transisi dari kulit yang lebih tinggi. Kα dihasilkan dari transisi elektron dari kulit L ke K dan x-ray K β dihasilkan dari transisi elektron dari M menuju kulit K, dll. Metoda x-ray banyak digunakan untuk menentukan komposisi elemen dari material. Karena metode ini cepat dan tidak merusak sampel metoda ini dipilih unutk penggunaan pada aplikasi lapangan dan proses produksi pada industri untuk mengontrol material. Berdasarkan penggunaanya, x-ray dapat dihasilkan tidak hanya dari x-ray primer tapi juga sumber eksitasi primer yang lain seperti partikel α, proton, atau eletron energi tinggi X-ray diffraction (XRD) XRD dilakukan dengan menembakkan sinar X-Ray pada material kemudian pantulannya akan ditangkap oleh detektor, ditunjukkan pada Gambar 2.9. Prinsip dari XRD dimana elektron yang berada pada bidang elektromagnetik akan bertolak dengan frekuensi yang sama, ditunjukkan pada Gambar Ketika berkas x-ray menumbuk atom, elektron disekitar atom akan mulai
22 terpantul kesegala arah dengan frekuensi yang sama sebagai berkas sinar datang, seperti ditunjukkan pada Gambar Hampir di semua arah mempunyai interferensi yang saling melemahkan, yaitu gelombang gabungan keluar dari fasa dan tidak ada resultan energi meninggalkan sampel padat. Walau bagaimanapun atom pada kristal tergabung pada pola umum dan pada beberapa arah akan menghasilkan inteferensi yang saling menguatkan. Oleh sebab itu berkas sinar diffraksi akan digambarkan sebagai berkas sinar dari sejumlah sinar tersebar yang saling menguatkan satu sama lain. Gambar 2.9 Mekanisme X-Ray Diffraction [18] Gambar 2.10 Geometri pemantulan X-Ray [18]
23 Gambar 2.11 Interaksi antara photon dengan atom [18] Pada Gambar 2.12 dapat terlihat contoh hasil XRD. Hasil dari XRD dapat digunakan untuk mendeteksi secara kualitatif senyawa yang terkandung dalam suatu material. Setiap senyawa pasti memiliki posisi 2θ yang berbeda. XRD juga dapat digunakan untuk menganalisa secara kuantitatif, berdasarkan pernyataan dari B.D.Culity dalam buku Element of X-Ray Diffraction menyatakan bahwa analisa kuantitafif dengan XRD dapat dilakukan dengan memanfaatkan intensitas hasil pengukuran. Faktanya intensitas tergantung dari konsentrasi pada campuran sampel. Gambar 2.12 Contoh hasil XRD
24 Hubungan antara intensitas dengan konsentrasi tidak selalu linear, karena intensitas difraksi tergantung dari koefisien absorbsi pada setiap campuran yang bervariasi berdasarkan konsentrasi. Aplikasi XRD biasanya digunakan adalah untuk analisa kimia, meliputi identifikasi fasa, investivigasi fasa temperatur tinggi ataupun rendah, solid solution dan menentukan parameter sel dari material baru.
BAB II DASAR TEORI. Universitas Indonesia. Studi pengaruh temperatur..., Sarah, FT UI, 2008
 BAB II DASAR TEORI Pembelajaran tentang proses pengolahan besi merupakan hal yang penting untuk dipelajari, mengingat logam tersebut digunakan pada berbagai macam aplikasi. Teknik yang paling umum digunakan
BAB II DASAR TEORI Pembelajaran tentang proses pengolahan besi merupakan hal yang penting untuk dipelajari, mengingat logam tersebut digunakan pada berbagai macam aplikasi. Teknik yang paling umum digunakan
BAB II DASAR TEORI 2.1. TERMODINAMIKA REAKSI REDUKSI Termokimia Reaksi
 BAB II DASAR TEORI Proses reduksi langsung merupakan proses pembuatan besi yang menghindari fasa cair. Proses ini merupakan pengembangan dari teknologi tanur tinggi. Sebagai teknologi pembuatan besi yang
BAB II DASAR TEORI Proses reduksi langsung merupakan proses pembuatan besi yang menghindari fasa cair. Proses ini merupakan pengembangan dari teknologi tanur tinggi. Sebagai teknologi pembuatan besi yang
BAB II DASAR TEORI. FeO. CO Fe CO 2. Fe 3 O 4. Fe 2 O 3. Gambar 2.1. Skema arah pergerakan gas CO dan reduksi
 BAB II DASAR TEORI Pengujian reduksi langsung ini didasari oleh beberapa teori yang mendukungnya. Berikut ini adalah dasar-dasar teori mengenai reduksi langsung yang mendasari penelitian ini. 2.1. ADSORPSI
BAB II DASAR TEORI Pengujian reduksi langsung ini didasari oleh beberapa teori yang mendukungnya. Berikut ini adalah dasar-dasar teori mengenai reduksi langsung yang mendasari penelitian ini. 2.1. ADSORPSI
BAB IV DATA HASIL PENELITIAN
 BAB IV DATA HASIL PENELITIAN 4.1. DATA KARAKTERISASI BAHAN BAKU Proses penelitian ini diawali dengan karakterisasi sampel batu besi yang berbentuk serbuk. Sampel ini berasal dari kalimantan selatan. Karakterisasi
BAB IV DATA HASIL PENELITIAN 4.1. DATA KARAKTERISASI BAHAN BAKU Proses penelitian ini diawali dengan karakterisasi sampel batu besi yang berbentuk serbuk. Sampel ini berasal dari kalimantan selatan. Karakterisasi
PENGARUH UKURAN PARTIKEL TERHADAP OPTIMASI DERAJAT REDUKSI Fe PADA BIJIH LATERIT LOW GRADE SKRIPSI
 UNIVERSITAS INDONESIA PENGARUH UKURAN PARTIKEL TERHADAP OPTIMASI DERAJAT REDUKSI Fe PADA BIJIH LATERIT LOW GRADE SKRIPSI EKO MULIA PUTRA 0806455692 FAKULTAS TEKNIK DEPARTEMEN METALURGI DAN MATERIAL DEPOK
UNIVERSITAS INDONESIA PENGARUH UKURAN PARTIKEL TERHADAP OPTIMASI DERAJAT REDUKSI Fe PADA BIJIH LATERIT LOW GRADE SKRIPSI EKO MULIA PUTRA 0806455692 FAKULTAS TEKNIK DEPARTEMEN METALURGI DAN MATERIAL DEPOK
UNIVERSITAS INDONESIA STUDI PENGARUH PENAMBAHAN KARBON PADA PROSES REDUKSI LANGSUNG BATU BESI SKRIPSI
 UNIVERSITAS INDONESIA STUDI PENGARUH PENAMBAHAN KARBON PADA PROSES REDUKSI LANGSUNG BATU BESI SKRIPSI KOMARUDIN 0405040414 FAKULTAS TEKNIK DEPARTEMEN METALURGI DAN MATERIAL DEPOK DESEMBER 2008 UNIVERSITAS
UNIVERSITAS INDONESIA STUDI PENGARUH PENAMBAHAN KARBON PADA PROSES REDUKSI LANGSUNG BATU BESI SKRIPSI KOMARUDIN 0405040414 FAKULTAS TEKNIK DEPARTEMEN METALURGI DAN MATERIAL DEPOK DESEMBER 2008 UNIVERSITAS
Material dengan Kandungan Karbon Tinggi dari Pirolisis Tempurung Kelapa untuk Reduksi Bijih Besi
 Material dengan Kandungan Karbon Tinggi dari Pirolisis Tempurung Kelapa untuk Reduksi Bijih Besi Anton Irawan, Ristina Puspa dan Riska Mekawati *) Jurusan Teknik Kimia, Fak. Teknik, Universitas Sultan
Material dengan Kandungan Karbon Tinggi dari Pirolisis Tempurung Kelapa untuk Reduksi Bijih Besi Anton Irawan, Ristina Puspa dan Riska Mekawati *) Jurusan Teknik Kimia, Fak. Teknik, Universitas Sultan
ANALISA KINETIKA REAKSI PROSES REDUKSI LANGSUNG BIJIH BESI LATERIT SKRIPSI. Oleh Rosoebaktian Simarmata
 ANALISA KINETIKA REAKSI PROSES REDUKSI LANGSUNG BIJIH BESI LATERIT SKRIPSI Oleh Rosoebaktian Simarmata 04 04 04 06 58 DEPARTEMEN TEKNIK METALURGI DAN MATERIAL FAKULTAS TEKNIK UNIVERSITAS INDONESIA GANJIL
ANALISA KINETIKA REAKSI PROSES REDUKSI LANGSUNG BIJIH BESI LATERIT SKRIPSI Oleh Rosoebaktian Simarmata 04 04 04 06 58 DEPARTEMEN TEKNIK METALURGI DAN MATERIAL FAKULTAS TEKNIK UNIVERSITAS INDONESIA GANJIL
BAB V DIAGRAM FASE ISTILAH-ISTILAH
 BAB V DIAGRAM FASE ISTILAH-ISTILAH Komponen : adalah logam murni atau senyawa yang menyusun suatu logam paduan. Contoh : Cu - Zn (perunggu), komponennya adalah Cu dan Zn Solid solution (larutan padat)
BAB V DIAGRAM FASE ISTILAH-ISTILAH Komponen : adalah logam murni atau senyawa yang menyusun suatu logam paduan. Contoh : Cu - Zn (perunggu), komponennya adalah Cu dan Zn Solid solution (larutan padat)
MODUL 1 TERMOKIMIA. A. Hukum Pertama Termodinamika. B. Kalor Reaksi
 MODUL 1 TERMOKIMIA Termokimia adalah ilmu yang mempelajari hubungan antara energi panas dan energi kimia. Sebagai prasyarat untuk mempelajari termokimia, kita harus mengetahui tentang perbedaan kalor (Q)
MODUL 1 TERMOKIMIA Termokimia adalah ilmu yang mempelajari hubungan antara energi panas dan energi kimia. Sebagai prasyarat untuk mempelajari termokimia, kita harus mengetahui tentang perbedaan kalor (Q)
Materi Pokok Bahasan :
 STOIKIOMETRI Kompetensi : Memiliki kemampuan untuk menginterpretasikan serta menerapkan dalam perhitungan kimia. Memiliki kemampuan untuk mengaplikasikan pengetahuan yang dimilikinya dan terbiasa menggunakan
STOIKIOMETRI Kompetensi : Memiliki kemampuan untuk menginterpretasikan serta menerapkan dalam perhitungan kimia. Memiliki kemampuan untuk mengaplikasikan pengetahuan yang dimilikinya dan terbiasa menggunakan
MAKALAH FABRIKASI DAN KARAKTERISASI XRD (X-RAY DIFRACTOMETER)
 MAKALAH FABRIKASI DAN KARAKTERISASI XRD (X-RAY DIFRACTOMETER) Oleh: Kusnanto Mukti / M0209031 Jurusan Fisika Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret Surakarta 2012 I. Pendahuluan
MAKALAH FABRIKASI DAN KARAKTERISASI XRD (X-RAY DIFRACTOMETER) Oleh: Kusnanto Mukti / M0209031 Jurusan Fisika Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret Surakarta 2012 I. Pendahuluan
LOGO STOIKIOMETRI. Marselinus Laga Nur
 LOGO STOIKIOMETRI Marselinus Laga Nur Materi Pokok Bahasan : A. Konsep Mol B. Penentuan Rumus Kimia C. Koefisien Reaksi D. Hukum-hukum Gas A. Konsep Mol Pengertian konsep mol Hubungan mol dengan jumlah
LOGO STOIKIOMETRI Marselinus Laga Nur Materi Pokok Bahasan : A. Konsep Mol B. Penentuan Rumus Kimia C. Koefisien Reaksi D. Hukum-hukum Gas A. Konsep Mol Pengertian konsep mol Hubungan mol dengan jumlah
BAB IV HASIL DAN PEMBAHASAN
 BAB IV HASIL DAN PEMBAHASAN 4.1 ANALISIS MINEROLOGI DAN KOMPOSISI KIMIA BIJIH LIMONITE Tabel 4.1. Komposisi Kimia Bijih Limonite Awal Sampel Ni Co Fe SiO 2 CaO MgO MnO Cr 2 O 3 Al 2 O 3 TiO 2 P 2 O 5 S
BAB IV HASIL DAN PEMBAHASAN 4.1 ANALISIS MINEROLOGI DAN KOMPOSISI KIMIA BIJIH LIMONITE Tabel 4.1. Komposisi Kimia Bijih Limonite Awal Sampel Ni Co Fe SiO 2 CaO MgO MnO Cr 2 O 3 Al 2 O 3 TiO 2 P 2 O 5 S
D. H 2 S 2 O E. H 2 S 2 O 7
 1. Jika gas belerang dioksida dialirkan ke dalam larutan hidrogen sulfida, maka zat terakhir ini akan teroksidasi menjadi... A. S B. H 2 SO 3 C. H 2 SO 4 D. H 2 S 2 O E. H 2 S 2 O 7 Reaksi yang terjadi
1. Jika gas belerang dioksida dialirkan ke dalam larutan hidrogen sulfida, maka zat terakhir ini akan teroksidasi menjadi... A. S B. H 2 SO 3 C. H 2 SO 4 D. H 2 S 2 O E. H 2 S 2 O 7 Reaksi yang terjadi
Kesetimbangan Kimia. Bab 4
 Kesetimbangan Kimia Bab 4 Standar Kompetensi 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang memengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri Kompetensi
Kesetimbangan Kimia Bab 4 Standar Kompetensi 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang memengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri Kompetensi
SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016)
 SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016) Bagian I: Pilihan Ganda 1) Suatu atom yang mempunyai energi ionisasi pertama bernilai besar, memiliki sifat/kecenderungan : A. Afinitas elektron rendah
SOAL LATIHAN CHEMISTRY OLYMPIAD CAMP 2016 (COC 2016) Bagian I: Pilihan Ganda 1) Suatu atom yang mempunyai energi ionisasi pertama bernilai besar, memiliki sifat/kecenderungan : A. Afinitas elektron rendah
STUDI RANCANG BANGUN MICROWAVE BATCH FURNACE UNTUK PROSES REDUKSI PASIR BESI DENGAN OPTIMASI LAMA RADIASI
 STUDI RANCANG BANGUN MICROWAVE BATCH FURNACE UNTUK PROSES REDUKSI PASIR BESI DENGAN OPTIMASI LAMA RADIASI Oleh : Yuhandika Yusuf (2709100083) Dosen Pembimbing : Dr. Sungging Pintowantoro S.T., M.T. JURUSAN
STUDI RANCANG BANGUN MICROWAVE BATCH FURNACE UNTUK PROSES REDUKSI PASIR BESI DENGAN OPTIMASI LAMA RADIASI Oleh : Yuhandika Yusuf (2709100083) Dosen Pembimbing : Dr. Sungging Pintowantoro S.T., M.T. JURUSAN
BAB VI KINETIKA REAKSI KIMIA
 BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
BANK SOAL SELEKSI MASUK PERGURUAN TINGGI BIDANG KIMIA 1 BAB VI 1. Padatan NH 4 NO 3 diaduk hingga larut selama 77 detik dalam akuades 100 ml sesuai persamaan reaksi berikut: NH 4 NO 2 (s) + H 2 O (l) NH
TINGKAT PERGURUAN TINGGI 2017 (ONMIPA-PT) SUB KIMIA FISIK. 16 Mei Waktu : 120menit
 OLIMPIADE NASIONAL MATEMATIKA DAN ILMU PENGETAHUAN ALAM TINGKAT PERGURUAN TINGGI 2017 (ONMIPA-PT) BIDANG KIMIA SUB KIMIA FISIK 16 Mei 2017 Waktu : 120menit Petunjuk Pengerjaan H 1. Tes ini terdiri atas
OLIMPIADE NASIONAL MATEMATIKA DAN ILMU PENGETAHUAN ALAM TINGKAT PERGURUAN TINGGI 2017 (ONMIPA-PT) BIDANG KIMIA SUB KIMIA FISIK 16 Mei 2017 Waktu : 120menit Petunjuk Pengerjaan H 1. Tes ini terdiri atas
Dengan mengalikan kedua sisi persamaan dengan T akan dihasilkan
 Hukum III termodinamika Hukum termodinamika terkait dengan temperature nol absolute. Hukum ini menyatakan bahwa pada saat suatu system mencapai temperature nol absolute, semua proses akan berhenti dan
Hukum III termodinamika Hukum termodinamika terkait dengan temperature nol absolute. Hukum ini menyatakan bahwa pada saat suatu system mencapai temperature nol absolute, semua proses akan berhenti dan
REAKSI REDUKSI DAN OKSIDASI
 REAKSI REDUKSI DAN OKSIDASI Definisi Reduksi Oksidasi menerima elektron melepas elektron Contoh : Mg Mg 2+ + 2e - (Oksidasi ) O 2 + 4e - 2O 2- (Reduksi) Senyawa pengoksidasi adalah zat yang mengambil elektron
REAKSI REDUKSI DAN OKSIDASI Definisi Reduksi Oksidasi menerima elektron melepas elektron Contoh : Mg Mg 2+ + 2e - (Oksidasi ) O 2 + 4e - 2O 2- (Reduksi) Senyawa pengoksidasi adalah zat yang mengambil elektron
Diagram Latimer (Diagram Potensial Reduksi)
 Diagram Latimer (Diagram Potensial Reduksi) Ini sangat mudah untuk menginterpresikan data ketika ditampilkan dalam bentuk diagram. Potensial reduksi standar untuk set sepsis yang berhubungan dapat ditampilkan
Diagram Latimer (Diagram Potensial Reduksi) Ini sangat mudah untuk menginterpresikan data ketika ditampilkan dalam bentuk diagram. Potensial reduksi standar untuk set sepsis yang berhubungan dapat ditampilkan
OXEA - Alat Analisis Unsur Online
 OXEA - Alat Analisis Unsur Online OXEA ( Online X-ray Elemental Analyzer) didasarkan pada teknologi fluoresens sinar X (XRF) yang terkenal di bidang laboratorium. Dengan bantuan dari sebuah prosedur yang
OXEA - Alat Analisis Unsur Online OXEA ( Online X-ray Elemental Analyzer) didasarkan pada teknologi fluoresens sinar X (XRF) yang terkenal di bidang laboratorium. Dengan bantuan dari sebuah prosedur yang
Komponen Materi. Kimia Dasar 1 Sukisman Purtadi
 Komponen Materi Kimia Dasar 1 Sukisman Purtadi Pengamatan ke Arah Pandangan Atomik Materi Konservasi Massa Komposisi Tetap Perbandingan Berganda Teori Atom Dalton Bagaimana Teori Dalton Menjelaskan Hukum
Komponen Materi Kimia Dasar 1 Sukisman Purtadi Pengamatan ke Arah Pandangan Atomik Materi Konservasi Massa Komposisi Tetap Perbandingan Berganda Teori Atom Dalton Bagaimana Teori Dalton Menjelaskan Hukum
III. METODOLOGI PENELITIAN. Penelitian ini dilaksanakan pada bulan Februari 2013 sampai dengan Juni 2013 di
 III. METODOLOGI PENELITIAN A. Waktu dan Tempat Penelitian Penelitian ini dilaksanakan pada bulan Februari 2013 sampai dengan Juni 2013 di Laboratorium Fisika Material FMIPA Unila, Laboratorium Kimia Instrumentasi
III. METODOLOGI PENELITIAN A. Waktu dan Tempat Penelitian Penelitian ini dilaksanakan pada bulan Februari 2013 sampai dengan Juni 2013 di Laboratorium Fisika Material FMIPA Unila, Laboratorium Kimia Instrumentasi
REDOKS dan ELEKTROKIMIA
 REDOKS dan ELEKTROKIMIA Overview Konsep termodinamika tidak hanya berhubungan dengan mesin uap, atau transfer energi berupa kalor dan kerja Dalam konteks kehidupan sehari-hari aplikasinya sangat luas mulai
REDOKS dan ELEKTROKIMIA Overview Konsep termodinamika tidak hanya berhubungan dengan mesin uap, atau transfer energi berupa kalor dan kerja Dalam konteks kehidupan sehari-hari aplikasinya sangat luas mulai
UJIAN NASIONAL TAHUN PELAJARAN 2007/2008
 UJIAN NASIONAL TAHUN PELAJARAN 2007/2008 PANDUAN MATERI SMA DAN MA K I M I A PROGRAM STUDI IPA PUSAT PENILAIAN PENDIDIKAN BALITBANG DEPDIKNAS KATA PENGANTAR Dalam rangka sosialisasi kebijakan dan persiapan
UJIAN NASIONAL TAHUN PELAJARAN 2007/2008 PANDUAN MATERI SMA DAN MA K I M I A PROGRAM STUDI IPA PUSAT PENILAIAN PENDIDIKAN BALITBANG DEPDIKNAS KATA PENGANTAR Dalam rangka sosialisasi kebijakan dan persiapan
BAB 1 PERKEMBANGAN TEORI ATOM
 BAB 1 PERKEMBANGAN TEORI ATOM 1.1 Teori Atom Perkembangan teori atom merupakan sumbangan pikiran dari banyak ilmuan. Konsep dari suatu atom bukanlah hal yang baru. Ahli-ahli filsafah Yunani pada tahun
BAB 1 PERKEMBANGAN TEORI ATOM 1.1 Teori Atom Perkembangan teori atom merupakan sumbangan pikiran dari banyak ilmuan. Konsep dari suatu atom bukanlah hal yang baru. Ahli-ahli filsafah Yunani pada tahun
HASIL DAN PEMBAHASAN
 HASIL DAN PEMBAHASAN BaTiO 3 merupakan senyawa oksida keramik yang dapat disintesis dari senyawaan titanium (IV) dan barium (II). Proses sintesis ini dipengaruhi oleh beberapa faktor seperti suhu, tekanan,
HASIL DAN PEMBAHASAN BaTiO 3 merupakan senyawa oksida keramik yang dapat disintesis dari senyawaan titanium (IV) dan barium (II). Proses sintesis ini dipengaruhi oleh beberapa faktor seperti suhu, tekanan,
kimia KTSP & K-13 TERMOKIMIA I K e l a s A. HUKUM KEKEKALAN ENERGI TUJUAN PEMBELAJARAN
 KTSP & K-13 kimia K e l a s XI TERMOKIMIA I TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Menjelaskan hukum kekekalan energi, membedakan sistem dan
KTSP & K-13 kimia K e l a s XI TERMOKIMIA I TUJUAN PEMBELAJARAN Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Menjelaskan hukum kekekalan energi, membedakan sistem dan
BAB IV HASIL DAN PEMBAHASAN. hal ini memiliki nilai konduktifitas yang memadai sebagai komponen sensor gas
 31 BAB IV HASIL DAN PEMBAHASAN Sintesis material konduktor ionik MZP, dilakukan pada kondisi optimum agar dihasilkan material konduktor ionik yang memiliki kinerja maksimal, dalam hal ini memiliki nilai
31 BAB IV HASIL DAN PEMBAHASAN Sintesis material konduktor ionik MZP, dilakukan pada kondisi optimum agar dihasilkan material konduktor ionik yang memiliki kinerja maksimal, dalam hal ini memiliki nilai
KARAKTERISASI DIFRAKSI SINAR X DAN APLIKASINYA PADA DEFECT KRISTAL OLEH: MARIA OKTAFIANI JURUSAN FISIKA
 KARAKTERISASI DIFRAKSI SINAR X DAN APLIKASINYA PADA DEFECT KRISTAL OLEH: MARIA OKTAFIANI 140310110018 JURUSAN FISIKA OUTLINES : Sinar X Difraksi sinar X pada suatu material Karakteristik Sinar-X Prinsip
KARAKTERISASI DIFRAKSI SINAR X DAN APLIKASINYA PADA DEFECT KRISTAL OLEH: MARIA OKTAFIANI 140310110018 JURUSAN FISIKA OUTLINES : Sinar X Difraksi sinar X pada suatu material Karakteristik Sinar-X Prinsip
pendinginan). Material Teknik Universitas Darma Persada - Jakarta
 BAB V DIAGRAM FASE Komponen : adalah logam murni atau senyawa yang menyusun suatu logam paduan. Contoh : Cu - Zn (perunggu) komponennya adalah Cu dan Zn Solid solution (larutan padat) : terdiri dari beberapa
BAB V DIAGRAM FASE Komponen : adalah logam murni atau senyawa yang menyusun suatu logam paduan. Contoh : Cu - Zn (perunggu) komponennya adalah Cu dan Zn Solid solution (larutan padat) : terdiri dari beberapa
BAB II TINJAUAN PUSTAKA. (C), serta unsur-unsur lain, seperti : Mn, Si, Ni, Cr, V dan lain sebagainya yang
 BAB II TINJAUAN PUSTAKA 2.1 Baja Baja merupakan paduan yang terdiri dari unsur utama besi (Fe) dan karbon (C), serta unsur-unsur lain, seperti : Mn, Si, Ni, Cr, V dan lain sebagainya yang tersusun dalam
BAB II TINJAUAN PUSTAKA 2.1 Baja Baja merupakan paduan yang terdiri dari unsur utama besi (Fe) dan karbon (C), serta unsur-unsur lain, seperti : Mn, Si, Ni, Cr, V dan lain sebagainya yang tersusun dalam
PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH
 PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH TAHUN 2016 Soal diketik ulang oleh urip rukim (www.urip.info)
PEMBAHASAN SOAL KIMIA KSM PROVINSI 2016 Oleh Urip Rukim (www.urip.info) JENJANG MADRASAH ALIYAH SELEKSI TINGKAT PROVINSI KOMPETISI SAINS MADRASAH TAHUN 2016 Soal diketik ulang oleh urip rukim (www.urip.info)
Gambar 4.2 Larutan magnesium klorida hasil reaksi antara bubuk hidromagnesit dengan larutan HCl
 BAB 4 HASIL PENELITIAN DAN PEMBAHASAN 4.1 Sintesa Garam Magnesium Klorida Garam magnesium klorida dipersiapkan melalui dua bahan awal berbeda yaitu bubuk magnesium oksida (MgO) puritas tinggi dan bubuk
BAB 4 HASIL PENELITIAN DAN PEMBAHASAN 4.1 Sintesa Garam Magnesium Klorida Garam magnesium klorida dipersiapkan melalui dua bahan awal berbeda yaitu bubuk magnesium oksida (MgO) puritas tinggi dan bubuk
Hukum-hukumdalam Termokimia
 Hukum-hukumdalam Termokimia N A M A K E L O M P O K : A N J A S F A J A R F A N D Y A H M A D K H A L I L M U H A M M A D R E S H A T A M A A B I M A N Y U R I D W A N N U R H A F I I D H Dalam mempelajari
Hukum-hukumdalam Termokimia N A M A K E L O M P O K : A N J A S F A J A R F A N D Y A H M A D K H A L I L M U H A M M A D R E S H A T A M A A B I M A N Y U R I D W A N N U R H A F I I D H Dalam mempelajari
Kesetimbangan Kimia KIM 2 A. PENDAHULUAN B. REAKSI KESETIMBANGAN. α = KESETIMBANGAN KIMIA. materi78.co.nr. setimbang
 konsentrasi laju reaksi materi78.co.nr Kesetimbangan Kimia A. PENDAHULUAN Reaksi satu arah (irreversible) atau reaksi tidak dapat balik adalah reaksi yang terjadi pada satu arah, dan produknya tidak dapat
konsentrasi laju reaksi materi78.co.nr Kesetimbangan Kimia A. PENDAHULUAN Reaksi satu arah (irreversible) atau reaksi tidak dapat balik adalah reaksi yang terjadi pada satu arah, dan produknya tidak dapat
BAB IV TERMOKIMIA A. PENGERTIAN KALOR REAKSI
 BAB IV TERMOKIMIA A. Standar Kompetensi: Memahami tentang ilmu kimia dan dasar-dasarnya serta mampu menerapkannya dalam kehidupan se-hari-hari terutama yang berhubungan langsung dengan kehidupan. B. Kompetensi
BAB IV TERMOKIMIA A. Standar Kompetensi: Memahami tentang ilmu kimia dan dasar-dasarnya serta mampu menerapkannya dalam kehidupan se-hari-hari terutama yang berhubungan langsung dengan kehidupan. B. Kompetensi
1 Energi. Energi kinetic; energy yang dihasilkan oleh benda bergerak. Energi radiasi : energy matahari.
 1 Energi Dapat diubah dari bentuk yang satu ke bentuk lainnya. Kemampuan untuk melakukan kerja. Kerja: perubahan energi yang langsung dihasilkan oleh suatu proses. Energi kinetic; energy yang dihasilkan
1 Energi Dapat diubah dari bentuk yang satu ke bentuk lainnya. Kemampuan untuk melakukan kerja. Kerja: perubahan energi yang langsung dihasilkan oleh suatu proses. Energi kinetic; energy yang dihasilkan
IV. HASIL DAN PEMBAHASAN. sol-gel, dan mempelajari aktivitas katalitik Fe 3 O 4 untuk reaksi konversi gas
 IV. HASIL DAN PEMBAHASAN A. Pengantar Penelitian ini pada intinya dilakukan dengan dua tujuan utama, yakni mempelajari pembuatan katalis Fe 3 O 4 dari substrat Fe 2 O 3 dengan metode solgel, dan mempelajari
IV. HASIL DAN PEMBAHASAN A. Pengantar Penelitian ini pada intinya dilakukan dengan dua tujuan utama, yakni mempelajari pembuatan katalis Fe 3 O 4 dari substrat Fe 2 O 3 dengan metode solgel, dan mempelajari
BAB 2 DASAR TEORI. Universitas Indonesia. Pemodelan dan..., Yosi Aditya Sembada, FT UI
 BAB 2 DASAR TEORI Biodiesel adalah bahan bakar alternatif yang diproduksi dari sumber nabati yang dapat diperbaharui untuk digunakan di mesin diesel. Biodiesel mempunyai beberapa kelebihan dibandingkan
BAB 2 DASAR TEORI Biodiesel adalah bahan bakar alternatif yang diproduksi dari sumber nabati yang dapat diperbaharui untuk digunakan di mesin diesel. Biodiesel mempunyai beberapa kelebihan dibandingkan
HASIL DAN PEMBAHASAN. dengan menggunakan kamera yang dihubungkan dengan komputer.
 10 dengan menggunakan kamera yang dihubungkan dengan komputer. HASIL DAN PEMBAHASAN Hasil sintesis paduan CoCrMo Pada proses preparasi telah dihasilkan empat sampel serbuk paduan CoCrMo dengan komposisi
10 dengan menggunakan kamera yang dihubungkan dengan komputer. HASIL DAN PEMBAHASAN Hasil sintesis paduan CoCrMo Pada proses preparasi telah dihasilkan empat sampel serbuk paduan CoCrMo dengan komposisi
4 Hasil dan Pembahasan
 4 Hasil dan Pembahasan 4.1 Sintesis Padatan TiO 2 Amorf Proses sintesis padatan TiO 2 amorf ini dimulai dengan melarutkan titanium isopropoksida (TTIP) ke dalam pelarut etanol. Pelarut etanol yang digunakan
4 Hasil dan Pembahasan 4.1 Sintesis Padatan TiO 2 Amorf Proses sintesis padatan TiO 2 amorf ini dimulai dengan melarutkan titanium isopropoksida (TTIP) ke dalam pelarut etanol. Pelarut etanol yang digunakan
IV. HASIL DAN PEMBAHASAN. 2, 50/50 (sampel 3), 70/30 (sampel 4), dan 0/100 (sampel 5) dilarutkan dalam
 IV. HASIL DAN PEMBAHASAN A. Hasil Oksidasi Spesimen baja AISI 4130 dilapisi alumunium dengan cara mencelupkan ke dalam bak alumunium cair pada temperatur 700 ºC selama 16 detik. NaCl/Na2SO4 dengan perbandingan
IV. HASIL DAN PEMBAHASAN A. Hasil Oksidasi Spesimen baja AISI 4130 dilapisi alumunium dengan cara mencelupkan ke dalam bak alumunium cair pada temperatur 700 ºC selama 16 detik. NaCl/Na2SO4 dengan perbandingan
kimia KESETIMBANGAN KIMIA 2 Tujuan Pembelajaran
 KTSP & K-13 kimia K e l a s XI KESETIMBANGAN KIMIA 2 Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami faktor-faktor yang memengaruhi kesetimbangan.
KTSP & K-13 kimia K e l a s XI KESETIMBANGAN KIMIA 2 Tujuan Pembelajaran Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut. 1. Memahami faktor-faktor yang memengaruhi kesetimbangan.
BAB I PENDAHULUAN 1.1. LATAR BELAKANG
 BAB I PENDAHULUAN 1.1. LATAR BELAKANG Industri besi baja merupakan basic industry yang merupakan penopang pembangunan suatu bangsa. Dari tahun ke tahun tingkat produksi baja dunia terus mengalami peningkatan
BAB I PENDAHULUAN 1.1. LATAR BELAKANG Industri besi baja merupakan basic industry yang merupakan penopang pembangunan suatu bangsa. Dari tahun ke tahun tingkat produksi baja dunia terus mengalami peningkatan
Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam
 Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam sistem pada kesetimbangan Uap mengembun dengan laju
Kesetimbangan dinamis adalah keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama, akibatnya tidak terjadi perubahan bersih dalam sistem pada kesetimbangan Uap mengembun dengan laju
KISI KISI SOAL ULANGAN AKHIR SEMESTER GASAL MADRASAH ALIYAH TAHUN PELAJARAN 2015/2016
 KISI KISI SOAL ULANGAN AKHIR SEMESTER GASAL MADRASAH ALIYAH TAHUN PELAJARAN 205/206 MATA PELAJARAN KELAS : KIMIA : XII IPA No Stansar Materi Jumlah Bentuk No Kompetensi Dasar Inikator Silabus Indikator
KISI KISI SOAL ULANGAN AKHIR SEMESTER GASAL MADRASAH ALIYAH TAHUN PELAJARAN 205/206 MATA PELAJARAN KELAS : KIMIA : XII IPA No Stansar Materi Jumlah Bentuk No Kompetensi Dasar Inikator Silabus Indikator
ANALISIS KANDUNGAN LOGAM OKSIDA MENGGUNAKAN METODE XRF (X-RAY FLOURESCENCE) SARI BACAAN
 ANALISIS KANDUNGAN LOGAM OKSIDA MENGGUNAKAN METODE XRF (X-RAY FLOURESCENCE) Jamaluddin 1,Muh.Altin Massinai 1, Dahlang Tahir 2 1 Program StudiGeofisika 2 Program Studi Fisika Fakultas MatematikadanIlmuPengetahuan
ANALISIS KANDUNGAN LOGAM OKSIDA MENGGUNAKAN METODE XRF (X-RAY FLOURESCENCE) Jamaluddin 1,Muh.Altin Massinai 1, Dahlang Tahir 2 1 Program StudiGeofisika 2 Program Studi Fisika Fakultas MatematikadanIlmuPengetahuan
SOAL KIMIA 2 KELAS : XI IPA
 SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
SOAL KIMIA KELAS : XI IPA PETUNJUK UMUM. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja. Kerjakanlah soal anda pada lembar jawaban
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya.
 30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
30 Soal Pilihan Berganda Olimpiade Kimia Tingkat Kabupaten/Kota 2011 Alternatif jawaban berwarna merah adalah kunci jawabannya. 1. Semua pernyataan berikut benar, kecuali: A. Energi kimia ialah energi
HASIL DAN PEMBAHASAN. Struktur Karbon Hasil Karbonisasi Hidrotermal (HTC)
 39 HASIL DAN PEMBAHASAN Struktur Karbon Hasil Karbonisasi Hidrotermal (HTC) Hasil karakterisasi dengan Difraksi Sinar-X (XRD) dilakukan untuk mengetahui jenis material yang dihasilkan disamping menentukan
39 HASIL DAN PEMBAHASAN Struktur Karbon Hasil Karbonisasi Hidrotermal (HTC) Hasil karakterisasi dengan Difraksi Sinar-X (XRD) dilakukan untuk mengetahui jenis material yang dihasilkan disamping menentukan
Gambar 3.1 Diagram alir penelitian
 BAB 3 METODE PENELITIAN 3.1 Bahan dan Peralatan Penelitian Bahan-bahan utama yang digunakan dalam penelitian ini antara lain bubuk magnesium oksida dari Merck, bubuk hidromagnesit hasil sintesis penelitian
BAB 3 METODE PENELITIAN 3.1 Bahan dan Peralatan Penelitian Bahan-bahan utama yang digunakan dalam penelitian ini antara lain bubuk magnesium oksida dari Merck, bubuk hidromagnesit hasil sintesis penelitian
BAB IV HASIL PENELITIAN dan PEMBAHASAN
 BAB IV HASIL PENELITIAN dan PEMBAHASAN 4.1. KARAKTERISTIK SERBUK 4.1.1. Serbuk Fe-50at.%Al Gambar 4.1. Hasil Uji XRD serbuk Fe-50at.%Al Berdasarkan gambar di atas, dapat diketahui bahwa secara keseluruhan
BAB IV HASIL PENELITIAN dan PEMBAHASAN 4.1. KARAKTERISTIK SERBUK 4.1.1. Serbuk Fe-50at.%Al Gambar 4.1. Hasil Uji XRD serbuk Fe-50at.%Al Berdasarkan gambar di atas, dapat diketahui bahwa secara keseluruhan
IV. HASIL DAN PEMBAHASAN
 IV. HASIL DAN PEMBAHASAN 4.1 Pengaruh Aliran Udara Kipas terhadap Penyerapan Etilen dan Oksigen Pada ruang penyerapan digunakan kipas yang dihubungkan dengan rangkaian sederhana seperti pada gambar 7.
IV. HASIL DAN PEMBAHASAN 4.1 Pengaruh Aliran Udara Kipas terhadap Penyerapan Etilen dan Oksigen Pada ruang penyerapan digunakan kipas yang dihubungkan dengan rangkaian sederhana seperti pada gambar 7.
BAB V PERHITUNGAN KIMIA
 BAB V PERHITUNGAN KIMIA KOMPETENSI DASAR 2.3 : Menerapkan hukum Gay Lussac dan hukum Avogadro serta konsep mol dalam menyelesaikan perhitungan kimia (stoikiometri ) Indikator : 1. Siswa dapat menghitung
BAB V PERHITUNGAN KIMIA KOMPETENSI DASAR 2.3 : Menerapkan hukum Gay Lussac dan hukum Avogadro serta konsep mol dalam menyelesaikan perhitungan kimia (stoikiometri ) Indikator : 1. Siswa dapat menghitung
Bab IV Hasil dan Pembahasan
 Bab IV Hasil dan Pembahasan IV. 1 Analisis Hasil Pengujian Metalografi dan Spektrometri Sampel Baja Karbon Dari hasil uji material pipa pengalir hard water (Lampiran A.1), pipa tersebut terbuat dari baja
Bab IV Hasil dan Pembahasan IV. 1 Analisis Hasil Pengujian Metalografi dan Spektrometri Sampel Baja Karbon Dari hasil uji material pipa pengalir hard water (Lampiran A.1), pipa tersebut terbuat dari baja
Bab IV Hasil dan Pembahasan
 Bab IV Hasil dan Pembahasan IV.1 Serbuk Awal Membran Keramik Material utama dalam penelitian ini adalah serbuk zirkonium silikat (ZrSiO 4 ) yang sudah ditapis dengan ayakan 400 mesh sehingga diharapkan
Bab IV Hasil dan Pembahasan IV.1 Serbuk Awal Membran Keramik Material utama dalam penelitian ini adalah serbuk zirkonium silikat (ZrSiO 4 ) yang sudah ditapis dengan ayakan 400 mesh sehingga diharapkan
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2015 Page 1 1. MATERI: STOIKIOMETRI Persen massa adalah persentase massa zat terlarut dalam 100 gram massa larutan (massa pelarut + massa
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2015 Page 1 1. MATERI: STOIKIOMETRI Persen massa adalah persentase massa zat terlarut dalam 100 gram massa larutan (massa pelarut + massa
Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
 Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Chapter 8 Kinetika Kimia Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Chapter 8 Kinetika Kimia Termodinamika apakah suatu reaksi dapat terjadi? Kinetika Seberapa cepat suatu reaksi berlangsung?
Bab 2 Tinjauan Pustaka
 Bab 2 Tinjauan Pustaka 2.1 Pengertian Biomassa Untuk memperoleh pengertian yang menyeluruh mengenai gasifikasi biomassa, diperlukan pengertian yang sesuai mengenai definisi biomassa. Biomassa didefinisikan
Bab 2 Tinjauan Pustaka 2.1 Pengertian Biomassa Untuk memperoleh pengertian yang menyeluruh mengenai gasifikasi biomassa, diperlukan pengertian yang sesuai mengenai definisi biomassa. Biomassa didefinisikan
OAL TES SEMESTER I. I. Pilihlah jawaban yang paling tepat! a. 2d d. 3p b. 2p e. 3s c. 3d 6. Unsur X dengan nomor atom
 KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
KIMIA XI SMA 3 S OAL TES SEMESTER I I. Pilihlah jawaban yang paling tepat!. Elektron dengan bilangan kuantum yang tidak diizinkan n = 3, l = 0, m = 0, s = - / n = 3, l =, m =, s = / c. n = 3, l =, m =
H 2 O (l) H 2 O (g) Kesetimbangan kimia. N 2 O 4 (g) 2NO 2 (g)
 Purwanti Widhy H Kesetimbangan adalah suatu keadaan di mana tidak ada perubahan yang terlihat seiring berjalannya waktu. Kesetimbangan kimia tercapai jika: Laju reaksi maju dan laju reaksi balik sama besar
Purwanti Widhy H Kesetimbangan adalah suatu keadaan di mana tidak ada perubahan yang terlihat seiring berjalannya waktu. Kesetimbangan kimia tercapai jika: Laju reaksi maju dan laju reaksi balik sama besar
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: HUKUM-HUKUM DASAR KIMIA Di soal diketahui dan ditanya: m (NH 2 ) 2 CO = 12.000 ton/tahun (pabrik) m N 2 = ton/tahun?
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: HUKUM-HUKUM DASAR KIMIA Di soal diketahui dan ditanya: m (NH 2 ) 2 CO = 12.000 ton/tahun (pabrik) m N 2 = ton/tahun?
AMALDO FIRJARAHADI TANE
 DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: TERMOKIMIA Pada soal diketahui dan ditanya: ΔH c C 2 H 5 OH = -1380 kj/mol ΔH d C 6 H 12 O 6 = -60 kj/mol ΔH c C
DISUSUN OLEH AMALDO FIRJARAHADI TANE PEMBAHASAN UTUL UGM KIMIA 2013 Page 1 1. 2. MATERI: TERMOKIMIA Pada soal diketahui dan ditanya: ΔH c C 2 H 5 OH = -1380 kj/mol ΔH d C 6 H 12 O 6 = -60 kj/mol ΔH c C
UNIVERSITAS NEGERI YOGYAKARTA F A K U L T A S M I P A
 RPP/KIC201/01 2. Mata Kuliah & Kode : Kimia Dasar 1 Kode : KIC 201 5 Kompetensi Dasar : Mampu menjelaskan sifat, jenis dan perubahan materi serta hukum hukum tentang materi 6. Indikator Ketercapaian :
RPP/KIC201/01 2. Mata Kuliah & Kode : Kimia Dasar 1 Kode : KIC 201 5 Kompetensi Dasar : Mampu menjelaskan sifat, jenis dan perubahan materi serta hukum hukum tentang materi 6. Indikator Ketercapaian :
Hubungan entalpi dengan energi yang dipindahkan sebagai kalor pada tekanan tetap kepada sistem yang tidak dapat melakukan kerja lain
 Hubungan entalpi dengan energi yang dipindahkan sebagai kalor pada tekanan tetap kepada sistem yang tidak dapat melakukan kerja lain Jika sistem mengalami perubahan, maka : ΔH = H 2 H 1 ΔH = ( U 2 + p
Hubungan entalpi dengan energi yang dipindahkan sebagai kalor pada tekanan tetap kepada sistem yang tidak dapat melakukan kerja lain Jika sistem mengalami perubahan, maka : ΔH = H 2 H 1 ΔH = ( U 2 + p
KIMIA TERAPAN STOIKIOMETRI DAN HUKUM-HUKUM KIMIA Haris Puspito Buwono
 KIMIA TERAPAN STOIKIOMETRI DAN HUKUM-HUKUM KIMIA Haris Puspito Buwono Semester Gasal 2012/2013 STOIKIOMETRI 2 STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi
KIMIA TERAPAN STOIKIOMETRI DAN HUKUM-HUKUM KIMIA Haris Puspito Buwono Semester Gasal 2012/2013 STOIKIOMETRI 2 STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi
KERAMIK Mimin Sukarmin, S.Si., M.Pd.
 KERAMIK Mimin Sukarmin, S.Si., M.Pd. m.sukar1982xx@gmail.com A. Keramik Bahan keramik merupakan senyawa antara logam dan bukan logam. Senyawa ini mempunyai ikatan ionik dan atau ikatan kovalen. Jadi sifat-sifatnya
KERAMIK Mimin Sukarmin, S.Si., M.Pd. m.sukar1982xx@gmail.com A. Keramik Bahan keramik merupakan senyawa antara logam dan bukan logam. Senyawa ini mempunyai ikatan ionik dan atau ikatan kovalen. Jadi sifat-sifatnya
Diagram Fasa. Latar Belakang Taufiqurrahman 1 LOGAM. Pemaduan logam
 Diagram Fasa Latar Belakang Umumnya logam tidak berdiri sendiri (tidak dalam keadaan murni Kemurnian Sifat Pemaduan logam akan memperbaiki sifat logam, a.l.: kekuatan, keuletan, kekerasan, ketahanan korosi,
Diagram Fasa Latar Belakang Umumnya logam tidak berdiri sendiri (tidak dalam keadaan murni Kemurnian Sifat Pemaduan logam akan memperbaiki sifat logam, a.l.: kekuatan, keuletan, kekerasan, ketahanan korosi,
Bab II Tinjauan Pustaka
 Bab II Tinjauan Pustaka 2.1 Produksi H 2 Sampai saat ini, bahan bakar minyak masih menjadi sumber energi yang utama. Karena kelangkaan serta harganya yang mahal, saat ini orang-orang berlomba untuk mencari
Bab II Tinjauan Pustaka 2.1 Produksi H 2 Sampai saat ini, bahan bakar minyak masih menjadi sumber energi yang utama. Karena kelangkaan serta harganya yang mahal, saat ini orang-orang berlomba untuk mencari
BAB I PENDAHULUAN. yang ada dibumi ini, hanya ada beberapa energi saja yang dapat digunakan. seperti energi surya dan energi angin.
 BAB I PENDAHULUAN 1.1 Latar Belakang Penggunaan energi pada saat ini dan pada masa kedepannya sangatlah besar. Apabila energi yang digunakan ini selalu berasal dari penggunaan bahan bakar fosil tentunya
BAB I PENDAHULUAN 1.1 Latar Belakang Penggunaan energi pada saat ini dan pada masa kedepannya sangatlah besar. Apabila energi yang digunakan ini selalu berasal dari penggunaan bahan bakar fosil tentunya
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL. UjianTeori. Waktu: 100 menit
 OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
OLIMPIADE SAINS NASIONAL 2012 SELEKSI KABUPATEN / KOTA SOAL UjianTeori Waktu: 100 menit Kementerian Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Menengah Direktorat Pembinaan Sekolah Menengah
PETA KONSEP LAJU REAKSI. Percobaan. Waktu perubahan. Hasil reaksi. Pereaksi. Katalis. Suhu pereaksi. Konsentrasi. Luas. permukaan.
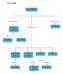 PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
PETA KONSEP LAJU REAKSI Berkaitan dengan ditentukan melalui Waktu perubahan Dipengaruhi oleh Percobaan dari Pereaksi Hasil reaksi Konsentrasi Luas Katalis Suhu pereaksi permukaan menentukan membentuk mengadakan
H = H hasil reaksi H pereaksi. Larutan HCl
 Standar Kompetensi Kompetensi Dasar Memahami perubahan energi dalam kimia, cara pengukuran dan sifat ketidakteraturan dalam alam semesta. Menjelaskan pengertian tentang entalpi suatu zat dan perubahannya.
Standar Kompetensi Kompetensi Dasar Memahami perubahan energi dalam kimia, cara pengukuran dan sifat ketidakteraturan dalam alam semesta. Menjelaskan pengertian tentang entalpi suatu zat dan perubahannya.
Disampaikan oleh : Dr. Sri Handayani 2013
 Disampaikan oleh : Dr. Sri Handayani 2013 PENGERTIAN Termokimia adalah cabang dari ilmu kimia yang mempelajari hubungan antara reaksi dengan panas. HAL-HAL YANG DIPELAJARI Perubahan energi yang menyertai
Disampaikan oleh : Dr. Sri Handayani 2013 PENGERTIAN Termokimia adalah cabang dari ilmu kimia yang mempelajari hubungan antara reaksi dengan panas. HAL-HAL YANG DIPELAJARI Perubahan energi yang menyertai
MODUL III KESETIMBANGAN KIMIA
 MODUL III KESETIMBANGAN KIMIA I. Petunjuk Umum 1. Kompetensi Dasar 1) Mahasiswa memahami Asas Le Chatelier 2) Mahasiswa mampu menjelaskan aplikasi reaksi kesetimbangan dalam dunia industry 3) Mahasiswa
MODUL III KESETIMBANGAN KIMIA I. Petunjuk Umum 1. Kompetensi Dasar 1) Mahasiswa memahami Asas Le Chatelier 2) Mahasiswa mampu menjelaskan aplikasi reaksi kesetimbangan dalam dunia industry 3) Mahasiswa
SMP kelas 8 - BIOLOGI BAB 8. FOTOSINTESISLatihan Soal ph (derajat keasaman) apabila tidak sesuai kondisi akan mempengaruhi kerja...
 SMP kelas 8 - BIOLOGI BAB 8. FOTOSINTESISLatihan Soal 8.4 1. ph (derajat keasaman) apabila tidak sesuai kondisi akan mempengaruhi kerja... Klorofil Kloroplas Hormon Enzim Salah satu faktor yang mempengaruhi
SMP kelas 8 - BIOLOGI BAB 8. FOTOSINTESISLatihan Soal 8.4 1. ph (derajat keasaman) apabila tidak sesuai kondisi akan mempengaruhi kerja... Klorofil Kloroplas Hormon Enzim Salah satu faktor yang mempengaruhi
Sudaryatno Sudirham ing Utari. Mengenal Sudaryatno S & Ning Utari, Mengenal Sifat-Sifat Material (1)
 Sudaryatno Sudirham ing Utari Mengenal Sifat-Sifat Material (1) 13-2 Sudaryatno S & Ning Utari, Mengenal Sifat-Sifat Material (1) A 13 Sistem Multifasa Pengertian tentang fasa telah kita singgung dalam
Sudaryatno Sudirham ing Utari Mengenal Sifat-Sifat Material (1) 13-2 Sudaryatno S & Ning Utari, Mengenal Sifat-Sifat Material (1) A 13 Sistem Multifasa Pengertian tentang fasa telah kita singgung dalam
Bab 10 Kinetika Kimia
 D e p a r t e m e n K i m i a F M I P A I P B Bab 0 Kinetika Kimia http://chem.fmipa.ipb.ac.id Ikhtisar 2 3 Laju Reaksi Teori dalam Kinetika Kimia 4 Mekanisme Reaksi 5 46 Faktor Penentu Laju Reaksi Enzim
D e p a r t e m e n K i m i a F M I P A I P B Bab 0 Kinetika Kimia http://chem.fmipa.ipb.ac.id Ikhtisar 2 3 Laju Reaksi Teori dalam Kinetika Kimia 4 Mekanisme Reaksi 5 46 Faktor Penentu Laju Reaksi Enzim
BAB II TINJAUAN PUSTAKA DAN LANDASAN TEORI
 BAB II TINJAUAN PUSTAKA DAN LANDASAN TEORI 2.1 Tinjauan Pustaka Bambang (2016) dalam perancangan tentang modifikasi sebuah prototipe kalorimeter bahan bakar untuk meningkatkan akurasi pengukuran nilai
BAB II TINJAUAN PUSTAKA DAN LANDASAN TEORI 2.1 Tinjauan Pustaka Bambang (2016) dalam perancangan tentang modifikasi sebuah prototipe kalorimeter bahan bakar untuk meningkatkan akurasi pengukuran nilai
Hasil Penelitian dan Pembahasan
 Bab IV Hasil Penelitian dan Pembahasan IV.1 Pengaruh Arus Listrik Terhadap Hasil Elektrolisis Elektrolisis merupakan reaksi yang tidak spontan. Untuk dapat berlangsungnya reaksi elektrolisis digunakan
Bab IV Hasil Penelitian dan Pembahasan IV.1 Pengaruh Arus Listrik Terhadap Hasil Elektrolisis Elektrolisis merupakan reaksi yang tidak spontan. Untuk dapat berlangsungnya reaksi elektrolisis digunakan
PENENTUAN RUMUS ION KOMPLEKS BESI DENGAN ASAM SALISILAT
 PENENTUAN RUMUS ION KOMPLEKS BESI DENGAN ASAM SALISILAT Desi Eka Martuti, Suci Amalsari, Siti Nurul Handini., Nurul Aini Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Jenderal
PENENTUAN RUMUS ION KOMPLEKS BESI DENGAN ASAM SALISILAT Desi Eka Martuti, Suci Amalsari, Siti Nurul Handini., Nurul Aini Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Jenderal
Struktur atom, dan Tabel periodik unsur,
 KISI-KISI PENULISAN USBN Jenis Sekolah : SMA/MA Mata Pelajaran : KIMIA Kurikulum : 2006 Alokasi Waktu : 120 menit Jumlah : Pilihan Ganda : 35 Essay : 5 1 2 3 1.1. Memahami struktur atom berdasarkan teori
KISI-KISI PENULISAN USBN Jenis Sekolah : SMA/MA Mata Pelajaran : KIMIA Kurikulum : 2006 Alokasi Waktu : 120 menit Jumlah : Pilihan Ganda : 35 Essay : 5 1 2 3 1.1. Memahami struktur atom berdasarkan teori
Bab IV. Hasil dan Pembahasan
 Bab IV. Hasil dan Pembahasan Bab ini memaparkan hasil sintesis, karakterisasi konduktivitas listrik dan struktur kirstal dari senyawa perovskit La 1-x Sr x FeO 3-δ (LSFO) dengan x = 0,2 ; 0,4 ; 0,5 ; 0,6
Bab IV. Hasil dan Pembahasan Bab ini memaparkan hasil sintesis, karakterisasi konduktivitas listrik dan struktur kirstal dari senyawa perovskit La 1-x Sr x FeO 3-δ (LSFO) dengan x = 0,2 ; 0,4 ; 0,5 ; 0,6
BAB II KOROSI dan MICHAELIS MENTEN
 BAB II : MEKANISME KOROSI dan MICHAELIS MENTEN 4 BAB II KOROSI dan MICHAELIS MENTEN Di alam bebas, kebanyakan logam ditemukan dalam keadaan tergabung secara kimia dan disebut bijih. Oleh karena keberadaan
BAB II : MEKANISME KOROSI dan MICHAELIS MENTEN 4 BAB II KOROSI dan MICHAELIS MENTEN Di alam bebas, kebanyakan logam ditemukan dalam keadaan tergabung secara kimia dan disebut bijih. Oleh karena keberadaan
besarnya polaritas zeolit alam agar dapat (CO) dan hidrokarbon (HC)?
 OPTIMALISASI SUHU AKTIVASI DAN POLARITAS ZEOLIT ALAM UNTUK MENGURANGI EMISI GAS BUANG SEPEDA MOTOR Drs. Noto Widodo, M.Pd. Bambang Sulistyo, S.Pd., M.Eng Amir Fatah, MPd M.Pd. JURUSAN PENDIDIKAN TEKNIK
OPTIMALISASI SUHU AKTIVASI DAN POLARITAS ZEOLIT ALAM UNTUK MENGURANGI EMISI GAS BUANG SEPEDA MOTOR Drs. Noto Widodo, M.Pd. Bambang Sulistyo, S.Pd., M.Eng Amir Fatah, MPd M.Pd. JURUSAN PENDIDIKAN TEKNIK
I. Pendahuluan II. Agen Penitrasi
 I. Pendahuluan Nitrasi merupakan reaksi terbentuknya senyawa nitro atau masuknya gugus nitro (-NO2) dalam suatu senyawa. Pada reaksi nitrasi, gugus nitro dapat berikatan dengan atom yang berbeda dan bisa
I. Pendahuluan Nitrasi merupakan reaksi terbentuknya senyawa nitro atau masuknya gugus nitro (-NO2) dalam suatu senyawa. Pada reaksi nitrasi, gugus nitro dapat berikatan dengan atom yang berbeda dan bisa
-Ibnu Fariz A -Akhmad Rivaldi C -Ghanang Samanata Y -Fadlan Izra -Raihan Aldo -Dimas Nur. Kelompok 6 Termokimia, Arah dan Proses
 -Ibnu Fariz A -Akhmad Rivaldi C -Ghanang Samanata Y -Fadlan Izra -Raihan Aldo -Dimas Nur Kelompok 6 Termokimia, Arah dan Proses Pendahuluan Termokimia mempelajari perubahan energi yang menyertai reaksi
-Ibnu Fariz A -Akhmad Rivaldi C -Ghanang Samanata Y -Fadlan Izra -Raihan Aldo -Dimas Nur Kelompok 6 Termokimia, Arah dan Proses Pendahuluan Termokimia mempelajari perubahan energi yang menyertai reaksi
BAB IV HASIL PENELITIAN DAN PEMBAHASAN
 BAB IV HASIL PENELITIAN DAN PEMBAHASAN Pada penelitian ini menggunakan 2 macam sampel paduan alumunium silikon dengan kadar penambahan Fe yang berbeda-beda. Yang pertama adalah sampel paduan alumunium
BAB IV HASIL PENELITIAN DAN PEMBAHASAN Pada penelitian ini menggunakan 2 macam sampel paduan alumunium silikon dengan kadar penambahan Fe yang berbeda-beda. Yang pertama adalah sampel paduan alumunium
BAB IV HASIL DAN PEMBAHASAN. Hasil preparasi bahan baku larutan MgO, larutan NH 4 H 2 PO 4, dan larutan
 BAB IV HASIL DAN PEMBAHASAN 4.1 Hasil Preparasi 4.1.1 Sol Hasil preparasi bahan baku larutan MgO, larutan NH 4 H 2 PO 4, dan larutan ZrOCl 2. 8H 2 O dengan perbandingan mol 1:4:6 (Ikeda, et al. 1986) dicampurkan
BAB IV HASIL DAN PEMBAHASAN 4.1 Hasil Preparasi 4.1.1 Sol Hasil preparasi bahan baku larutan MgO, larutan NH 4 H 2 PO 4, dan larutan ZrOCl 2. 8H 2 O dengan perbandingan mol 1:4:6 (Ikeda, et al. 1986) dicampurkan
Karakterisasi XRD. Pengukuran
 11 Karakterisasi XRD Pengukuran XRD menggunakan alat XRD7000, kemudian dihubungkan dengan program dikomputer. Puncakpuncak yang didapatkan dari data pengukuran ini kemudian dicocokkan dengan standar difraksi
11 Karakterisasi XRD Pengukuran XRD menggunakan alat XRD7000, kemudian dihubungkan dengan program dikomputer. Puncakpuncak yang didapatkan dari data pengukuran ini kemudian dicocokkan dengan standar difraksi
BAB V HASIL DAN PEMBAHASAN
 BAB V HASIL DAN PEMBAHASAN 5.1. Pemeriksaan Bahan Baku GMP Pada tahap awal penelitian dilakukan pemeriksaan bahan baku GMP. Hasil pemeriksaan sesuai dengan persyaratan pada monografi yang tertera pada
BAB V HASIL DAN PEMBAHASAN 5.1. Pemeriksaan Bahan Baku GMP Pada tahap awal penelitian dilakukan pemeriksaan bahan baku GMP. Hasil pemeriksaan sesuai dengan persyaratan pada monografi yang tertera pada
Bab III Metodologi Penelitian
 Bab III Metodologi Penelitian Penelitian ini dilaksanakan di Laboratorium Penelitian Kimia Analitik, Program Studi Kimia FMIPA ITB sejak September 2007 sampai Juni 2008. III.1 Alat dan Bahan Peralatan
Bab III Metodologi Penelitian Penelitian ini dilaksanakan di Laboratorium Penelitian Kimia Analitik, Program Studi Kimia FMIPA ITB sejak September 2007 sampai Juni 2008. III.1 Alat dan Bahan Peralatan
HUKUM TERMODINAMIKA I
 HUKUM TERMODINAMIKA I Pertemuan 3 Sistem Isotermal: Suhu-nya tetap Adiabatik: Tidak terjadi perpindahan panas antara sistem dan lingkungan Tertutup: Tidak terjadi pertukaran materi dengan lingkungan Terisolasi:
HUKUM TERMODINAMIKA I Pertemuan 3 Sistem Isotermal: Suhu-nya tetap Adiabatik: Tidak terjadi perpindahan panas antara sistem dan lingkungan Tertutup: Tidak terjadi pertukaran materi dengan lingkungan Terisolasi:
BAB IV HASIL DAN PEMBAHASAN Hasil Pengujian Densitas Abu Vulkanik Milling 2 jam. Sampel Milling 2 Jam. Suhu C
 38 BAB IV HASIL DAN PEMBAHASAN 4.1 KARAKTERISASI HASIL 4.1.1 Hasil Pengujian Densitas Abu Vulkanik Milling 2 jam Pengujian untuk mengetahui densitas sampel pellet Abu vulkanik 9,5gr dan Al 2 O 3 5 gr dilakukan
38 BAB IV HASIL DAN PEMBAHASAN 4.1 KARAKTERISASI HASIL 4.1.1 Hasil Pengujian Densitas Abu Vulkanik Milling 2 jam Pengujian untuk mengetahui densitas sampel pellet Abu vulkanik 9,5gr dan Al 2 O 3 5 gr dilakukan
BAB III METODOLOGI PENELITIAN
 BAB III METODOLOGI PENELITIAN 3.1 Diagram Alir Metode Penelitian Permasalahan industri Kandungan unsur Pb yang tinggi dalam tembaga blister Studi literatur Perilaku unsur timbal dalam tanur anoda Perilaku
BAB III METODOLOGI PENELITIAN 3.1 Diagram Alir Metode Penelitian Permasalahan industri Kandungan unsur Pb yang tinggi dalam tembaga blister Studi literatur Perilaku unsur timbal dalam tanur anoda Perilaku
TERMOKIMIA. Sistem terbagi atas: 1. Sistem tersekat: Antara sistem dan lingkungan tidak dapat terjadi pertukaran energi maupun materi
 TERMOKIMIA almair amrulloh 12:04:00 AM 11 IPAKimia 11 IPA Asas kekekalan energi menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan, tetapi energi dapat diubah dari satu bentuk kebentuk lain
TERMOKIMIA almair amrulloh 12:04:00 AM 11 IPAKimia 11 IPA Asas kekekalan energi menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan, tetapi energi dapat diubah dari satu bentuk kebentuk lain
