LAPORAN PRAKTIKUM ISOLASI DNA DAN TEKNIK PCR
|
|
|
- Fanny Hartono
- 8 tahun lalu
- Tontonan:
Transkripsi
1 LAPORAN PRAKTIKUM ISOLASI DNA DAN TEKNIK PCR Nama : Juwita ( ) Rika Nailuvar Sinaga ( ) Hari / Tanggal Praktikum : Kamis / 01 November 2012 Waktu Praktikum : WIB Tujuan : a. Memahami metode isolasi DNA b. Mampu mengerjakan isolasi DNA sesuai prosedur, dengan sampel DNA diambil dari sel epithelial mulut c. Memahami dan dapat melakukan teknik PCR menggunakan DNA manusia. Pendahuluan : DNA adalah asam nukleat yang mengandung materi genetik dan berfungsi untuk mengatur perkembangan biologis seluruh bentuk kehidupan. DNA terdapat di nukleus, mitokondria, dan kloroplas. Ada perbedaan di antara ketiga lokasi DNA ini, yaitu: DNA nukleus berbentuk linear dan berhubungan sangat erat dengan protein histon, sedangkan DNA mitokondria dan kloroplas berbentuk sirkular dan tidak berhubungan dengan protein histon. DNA memiliki struktur helix utas ganda, yang mengandung komponen-komponen gula pentosa (deoksiribosa), gugus fosfat, dan pasangan basa. Satu sel memiliki DNA yang merupakan materi genetik dan akan diturunkan pada keturunannya. DNA dapat diisolasi, baik pada manusia maupun tumbuhan. Isolasi DNA merupakan langkah tepat untuk mempelajari DNA. Prinsipnya ada dua, yaitu : a. Sentrifugasi Merupakan teknik untuk memisahkan campuran berdasarkan berat molekul komponennya. Molekul yang mempunyai berat molekul besar akan berada di bagian
2 bawah tabung dan molekul ringan akan berada pada bagian atas tabung. Tehnik sentrifugasi dilakukan oleh mesin yaitu mesin sentrifugasi dengan kecepatan yang bervariasi. Hasil sentrifugasi akan menunjukkan dua macam fraksi yang terpisah, yaitu supernatan di bagian atas dan pelet di bagian bawah. b. Presipitasi Merupakan langkah yang dilakukan untuk mengendapkan suatu komponen dari campuran. Langkah-langkah isolasi DNA: a. Pengumpulan sel-sel b. Pemecahan sel (lisis sel) dan pencernaan protein c. Pengendapan DNA Pada praktikum ini, DNA akan diisolasi dari sel epitelial mulut. Alat dan Bahan : Alat Batang kayu Timbangan digital Tabung mikrosentrifus Beaker Waterbath ph meter Kertas absorben Tabung reaksi Spidol Vortex Mikrosentrifus SDS Pipet Mohr Bahan Minuman isotonik Stok proteinase K (100 µg/ml) EDTA NaCl Tris 1 N HCl Akuades Etanol dingin Minuman isotonik Stok proteinase K (100 µg/ml) EDTA
3 Tahap isolasi DNA epitel a. Pengumpulan sel-sel 1. Gosok pipi bagian dalam menggunakan batang kayu selama ± 30 detik (penting: jangan ditelan). 2. Ambil minuman isotonik kumur-kumur dengan minuman isotonik sebanyak ± 10 ml, sekaligus menggosok pipi selama 1 menit hasil berkumur ini jangan ditelan, tetapi keluarkan ke dalam beaker ini yang menjadi larutan sel epitel yang akan diisolasi DNA nya. b. Pemecahan sel (lisis sel) dan pencernaan protein 3. Atur temperatur 56 0 C pada waterbath. 4. Ambil 1,5 ml larutan sel epitelial menggunakan pipet Mohr masukkan ke dalam tabung mikrosentrifus. 5. Masukkan tabung mikrosentrifus dalam mesin sentrifus selama 30 detik pada kecepatan rpm, dan gunakan sampel orang lain sebagai penyeimbang. Hasil sentrifus yang didapat supernatant dibuang, kemudian tambahkan larutan sel lagi. 6. Langkah 5 dan 6 diulang sebanyak dua kali agar endapan (pelet) yang terbentuk semakin banyak 7. Kemudian tambahkan 1 ml buffer Tris-EDTA ke dalam tabung mikrosentrifus. 8. Tabung mikrosentrifus di vortex selama 30 detik (sampai endapan hancur). 9. Selanjutnya tambahkan 50μL Proteinase K (enzim untuk mencerna protein) dan masukkan dalam waterbath (56 0 C) selama 10 menit. c. Pengendapan DNA 10. Masukkan 100μL NaCl, 2,5M ke dalam tabung mikrosentrifus aduk isi tabung agar tercampur baik, dengan cara membolak-balikkan tabungnya. 11. Pindahkan semua isi tabung mikrosentrifus ke tabung lain yang bersih dan kering (hati-hati, agar tidak banyak muncul busa).
4 12. Pelan-pelan tambahkan 1 ml etanol dingin (untuk mengendapkan atau menggumpalkan DNA) agar terlihat batas jelas biarkan selama 5 menit. 13. DNA akan menggumpal di antara batas buffer dan etanol (terlihat ada yang melayang seperti benang putih) 14. Ambil DNA menggunakan batang kaca atau besi taruh di tabung sentrifugasi kecil yang bersih. (Gunakan tisu bersih untuk menghisap sisa etanol). 19. Simpan tabung mikrosentrifus kecil di lemari pendingin, pada suhu di bawah 0 0 C. Isolasi DNA dari Darah Alat dan Bahan yang digunakan: Alat Waterbath Vorteks Tabung mikrosentrifus Kertas absorben Mikrosentrifus Pipet tetes Bahan Darah (1 cc) Isopropanol Larutan nuklei lisis Larutan RNAase Larutan sel lisis Larutan rehidrasi DNA Anti-koagulan 70% etanol Larutan protein precipitation Tahap Isolasi DNA Darah : 1. Gunakan tabung mikrosentrifus 1,5 ml yang steril isi dengan 1 mg anti-koagulan (EDTA, atau heparin) masukkan 1 ml darah kedalamnya. 2. Goyangkan tabung mikrosentrifus perlahan agar darah dan anti-koagulan bercampur dengan baik. 3. Gunakan satu tabung mikrosentrifus steril lagi masukkan 900 μl larutan sel lisis 4. Ambil 300 μ1 darah dari tabung mikrosentrifus pertama masukkan ke dalam tabung kedua bolak-balikkan tabung 5-6 kali supaya cairannya bercampur baik.
5 5. Inkubasikan tabung mikrosentrifus kedua selama 10 menit pada temperatur ruang bolak-balikkan tabung 2-3 kali selama masa inkubasi untuk melisis sel-sel darah merah. 6. Sentrifugasi tabung pada kecepatan rpm selama 2 menit pada temperatur ruang. 7. Supernatant dibuang sebanyak mungkin (hati-hati! Jangan sampai pellet putih ikut terbuang) sekitar μ1 cairan residu akan tertinggal dalam tabung tersebut 8. Tabung divortex dengan kuat (10-15 detik) agar sel-sel darah putih tersuspensi kembali. 9. Tambahkan 300 μ1 larutan nuklei lisis ke dalam tabung tersebut (di langkah ke-8). campurkan dengan menggunakan pipet sebanyak 5-6 kali untuk melisiskan sel-sel darah putih larutan menjadi viscous (kental) jika terlihat gumpalan, maka inkubasikan tabung pada 37 C sampai gumpalan tersebut larut dinginkan pada temperatur ruangan 10. Tambahkan larutan protein precipitation sebanyak 100 μ1 ke dalam larutan di langkah 9 vortex dengan kuat selama detik gumpalan protein yang kecil mungkin akan terlihat. 11. Sentrifugasi pada kecepatan rpm selama 3 menit (pada temperatur ruangan) pellet protein yang berwarna coklat tua akan terlihat. 12. Pindahkan supernatant ke dalam tabung Eppendorf steril (tabung mikrosentrifus 1,5 ml) yang diisi 300 μ1 isopropanol (temperatur ruangan). 13. Tabung dibalikkan perlahan-lahan supaya larutan bercampur akan terlihat massa seperti benang-benang putih (DNA). 14. Sentrifugasi pada kecepatan rpm selama 1 menit pada temperatur ruangan DNA akan terlihat sebagai pellet kecil yang putih. 15. Supernatant dibuang tambahkan 300 μ1 70% etanol (di suhu temperatur ruangan). bolak-balikkan tabung perlahan beberapa kali untuk mencuci pellet DNA sentrifugasi lagi seperti pada langkah 15 diatas. 16. Aspirasikan etanol menggunakan pipet (jangan sampai pelletnya terbuang!) letakkan tabung secara terbalik diatas kertas absorben dan keringkan di udara selama menit. 17. Tambahkan 100 μ1 larutan rehidrasi DNA DNA direhidrasi dengan menginkubasikan tabung pada 65 C selama menit secara periodik, campurkan larutan dengan cara menepuk tabung perlahan. 18. DNA disimpan pada temperatur 2-8 C atau untuk jangka panjang pada -20 C.
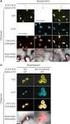
6 Observasi pada praktikum ini: Awalnya pelet yang terbentuk hanya sedikit, tetapi setelah ditambahkan larutan sel epitel dan disentrifus beberapa kali, terbentuk endapan atau pelet berwarna putih di dasar tabung yang semakin banyak. Supernatan seharusnya dibuang sebanyak mungkin dengan hati-hati, agar pelet atau endapan tidak ikut terbuang bila tidak banyak supernatan yang terbuang, maka saat proses selanjutnya, volume larutan dalam tabung akan semakin banyak (berbeda dengan batas volume larutan pada kelompok lain). Hasil akhir didapatkan endapan atau pelet coklat di dasar tabung kemudian sampel disimpan dalam lemari pendingin untuk diproses di waktu praktikum selanjutnya. HASIL PRAKTIKUM ISOLASI DNA EPITEL DAN DNA DARAH Gambar 1: Hasil Isolasi DNA Epitel dan Darah Dengan Teknik PCR.
7 Keterangan : 1 = standard 2 = darah 3 = epitel (juwita) 4 = epitel (rika) 5 = darah kelompok ayu/yulia 6 = epitel (ayu) 7 = epitel (yulia) Gambar 2: Hasil elektroforesis Pembahasan : Tabel 1. Marker Hasil pengamatan elektroforesis isolasi DNA X Y 2, , ,6 500
8 Axis Title Y Expon. (Y) Axis Title y = 14461e -2.18x Grafik 1. Hasil pengamatan elektroforesis isolasi DNA Tabel 2. Pita hasil PCR DNA Sampel Sumur 3 Sumur 4 Sumur 6 Jarak band (cm) 2,6 2,6 2,6 Panjang DNA (Base pair) Dari hasil praktikum diatas diperoleh : 1. Pada marker, batas-batas pitanya tidak terlihat jelas sehingga tidak terlalu dapat dibedakan batas pita yang satu dengan batas pita lainnya. Hal ini kemungkinan disebabkan karena waktu elektroforesis yang terlalu singkat ( ± 1,5 jam ). Seharusnya untuk mendapatkan hasil yang baik diperlukan waktu ± 4 jam pada proses elektroforesis. 2. Pada sampel, pita-pita tampak pada sumur 3,4 dan 6. Di masing-masing sumur hanya ada satu pita yang terlihat jelas. Hal ini disebabkan oleh kesalahan praktikan dalam memproses sampel baik saat pertama kali mengisolasi DNA atau pada saat menyiapkan sampel untuk masuk proses elektroforesis. Jarak yang diukur dari batas sumur sampai pada pita di sumur 3,4 dan 6 adalah sama yaitu sekitar 2,6 cm.
9 3. Dari grafik hasil PCR standar DNA didapat persamaan y = 14461e -2.18x rumus ini digunakan untuk menghitung panjang DNA sampel sehingga didapat panjang DNA sampel pada sumur 3,4 dan 6 adalah 494 bp. Saran : 1. Praktikan harus lebih berhati-hati dalam melakukan isolasi DNA dan mempersiapkan sampel agar hasil yang didapat baik. 2. Pada saat melakukan elektroforesis, diperlukan ketepatan pengukuran dan ketelitian praktikan serta waktu yang dipakai dalam menjalankan elektroforesa harus ± 4 jam agar marker dan sampel yang dihasilkan baik.
10 LAPORAN PRAKTIKUM ISOLASI PROTEIN DARI DARAH Nama : Juwita ( ) Rika Nailuvar Sinaga ( ) Hari / Tanggal Praktikum : Kamis / 8 November 2012 Waktu Praktikum : WIB Tujuan : Memahami cara pemisahan bagian sel dengan teknik sentrifugasi, dan memahami teknik lainnya untuk isolasi protein. Pendahuluan : Protein adalah makromolekul yang secara fisik dan fungsional kompleks yang melakukan beragam peran penting. Untuk meneliti sifat-sifat fisik dan fungsional suatu protein secara rinci, diperlukan protein yang sangat murni. Sel mengandung ribuan protein yang berlainan, masingmasing dengan jumlah yang sangat bervariasi. Untuk memisahkan masing-masing protein dari campuran kompleks sering digunakan pelarut atau elektrolit (atau keduanya) untuk mengeluarkan fraksi protein yang berbeda sesuai karakteristik kelarutannya. Hal ini adalah dasar dari sesuatu yang disebut sebagai metode saltingout, yang digunakan dalam penentuan fraksi protein di laboratorium klinik. Oleh karena itu, kita dapat memisahkan protein plasma menjadi tiga kelompok besar fibrinogen, albumin, dan globulin- berdasarkan pemakaian natrium atau amonium sulfat dengan berbagai konsentrasi. Metode tersering yang digunakan untuk menganalisis protein plasma adalah elektroforesis. Terdapat banyak jenis elektroforesis, yang masing-masing menggunakan medium penopang/penunjang yang berbeda. Akan dicoba pemisahan protein plasma dari protein intraselular dan protein membran, maupun dari bagian sel lain dengan teknik sentrifugasi serta pengendapan protein dengan larutan garam konsentrasi tinggi (salting out), dan pengendapan protein dengan etanol (alcohol
11 precipitation). Diharapkan didapat 6 sampel protein yaitu M, S, Gs, Gp, Es, Ep. Dan sampelsampel ini akan dianalisis menggunakan metode SDS-PAGE. sel Lisis sel Sentrifugasi Protein membran Protein sitoplasmik Sentrifugasi Darah Utuh pengendapan dengan larutan garam tinggi Protein dalam supernatan Sentrifugasi Plasma Protein dalam pengendapan pengendapan dengan larutan garam tinggi Protein dalam supernatan Sentrifugasi Protein dalam pengendapan
12 Alat dan Bahan: Alat Jarum steril Sentrifus klinik Mikrosentrifus ph meter Tabung reaksi dan rak Bahan Es NaCl Na2PO4 EDTA Larutan (NH 4 ) 2 SO 4 yang jenuh Pipet Mohr Larutan 50% (NH 4 ) 2 SO 4 Tabung steril Pipet otomatik Pipet tetes Vorteks Tabung sentrifus klinik 2 ml Tabung sentrifus klinik 1,5 ml Tempat membuang cairan biologis Tisu Spidol Etanol absolut, dingin Siapkan dahulu larutan-larutan: a. Buffer cuci : 100 ml buffer yang berisi 150 mm NaCl, 5 mm Na2HPO4, 0,1 mm EDTA atur sampai ph =7,4 b. Buffer hemolisis : 100ml buffer yang berisi 5 mm Na2HPO4, 0,1 mm EDTA atur sampai ph =8 Kedua buffer ini disimpan dalam lemari pendingin
13 Bagian A: Pemisahan Sel-sel Darah dari Plasma 1. Ambil 5 ml darah diharapkan akan didapat ± 1,5 ml plasma dari darah yang diambil (500 µl plasma untuk prosedur pengendapan dengan garam tinggi, 500 µl plasma untuk pengendapan dengan etanol, dan 500 µl plasma merupakan sampel protein plasma). 2. Pindahkan darah ke tabung sentrifus klinik masukkan ke dalam alat sentrifus klinik, dan gunakan tabung sentrifus klinik lain sebagai penyeimbang atur waktu sentrifus selama 5 menit. 3. Pindahkan semua plasma (yaitu supernatant) ke tabung mikrosentrifus 2 ml yang bersih dan kering tandai tabung dengan tulisan plasma dan simpan di dalam es sebagai sampel plasma. 4. Buang sisa supernatan ke dalam tempat buangan cairan biologis menggunakan pipet tetes. 5. Tambahkan 6 ml buffer cuci dingin ke dalam tabung sentrifus klinik tutup dan vorteks pelan. 6. Selanjutnya masukkan tabung ke dalam alat sentrifus klinik, dan gunakan tabung lain sebagai penyeimbang sentrifus selama 5 menit. 7. Buang supernatan ke dalam tempat buangan cairan biologis menggunakan pipet tetes dengan hati-hati. 8. Langkah 6-8 diulang sekali lagi nantinya akan didapat endapan yang merupakan selsel darah Bagian B: Isolasi Protein-protein dari Sel-sel 1. Masukkan 6 ml buffer hemolisis dingin ke dalam tabung sentrifus klinik yang berisi selsel darah. 2. Tutup tabung dan vorteks sampai isi tabung melarut. 3. Masukkan tabung ke mesin sentrifus, dan gunakan tabung lain sebagai penyeimbang atur waktu sentrifus selama 10 menit.
14 4. Ambil 1 ml supernatan dari atas tabung sentrifus klinik (hati-hati) masukkan ke dalam tabung reaksi mikrosentrifus yang 2 ml tandai tabung dan simpan di dalam es ini merupakan sampel protein sitoplasmik (S) langsung simpan di bagian atas kulkas. 5. Buang ± 5 ml supernatan ke tempat buangan cairan biologis menggunakan pipet tetes masukkan 7 ml buffer hemolisis dingin vortex dengan kuat. 6. Setelah di vortex masukkan tabung ke dalam mesin sentrifus klinik, gunakan tabung sentrifus klinik lain sebagai penyeimbang sentrifus selama 10 menit. 7. Buang supernatant ke tempat buangan cairan biologis (hati-hati) kira-kira 2 ml paling bawah (termasuk endapan, kalau ada) dipindahkan ke dalam tabung mikrosentrifus 2 ml lain yang sudah ditandai sampel ini sebagai protein membran (M). 8. Tabung mikrosentrifus ini dimasukkan dalam alat mikrosentrifus, dengan menyertakan tabung yang lain sebagai penyeimbang atur pada kecepatan rpm selama 30 menit. 9. Selesai proses sentrifus keluarkan tabung mikrosentrifus perhatikan apakah ada endapan yang agak halus selanjutnya buang supernatan ke tempat buangan cairan biologis. 10. Tambahkan 500 µl buffer hemolisis atau buffer cuci tutup tabung sampai rapat simpan di bagian atas lemari pendingin. Bagian C: Pengendapan Protein Plasma dengan Larutan Garam Berkonsentrasi Tinggi 1. Masukkan 250 µl larutan (NH 4 ) 2 SO 4 yang jenuh kedalam tabung mikrosentrifus 1,5 ml dan masukkan 500 µl sampel plasma. 2. Vortex kuat tabung tersebut dalam keadaan tertutup dan diamkan selama 5 menit pada temperatur ruangan. 3. Masukkan tabung tersebut ke dalam alat mikrosentrifus (pakai tabung dari kelompok lain untuk menyeimbangkan) lalu putar selama 3 menit dengan kecepatan tinggi. 4. Setelah di sentrifugasi ambil supernatan yang ada sebanyak 500 µl dan masukkan ke tabung reaksi mikrosentrifus yang lain, tandai dan letakkan di atas es (Gs).
15 5. Gunakan tisue dan keringkan bagian atas endapannya. Teteskan 1 ml larutan 50% (NH 4 ) 2 SO 4 yang tak jenuh, campur dengan baik. 6. Masukkan tabung tersebut ke dalam alat mikrosentrifus (pakai tabung dari kelompok lain untuk menyeimbangkan) lalu putar selama 3 menit dengan kecepatan tinggi. 7. Buang supernatannya dan keringkan bagian atas endapan dengan tisue lalu tandai dengan Gp. Tambah 500 µl buffer hemolisis dan simpan di dalam kulkas. Bagian D: Pengendapan Protein Plasma dengan Etanol 1. Masukkan 250 µl etanol absolute dingin dan 500 µl sampel plasma ke dalam tabung mikrosentrifus 1,5 ml. 2. Tutup tabung dan vortex kuat lalu diamkan selama 5 menit di atas es. 3. Masukkan tabung tersebut ke dalam alat mikrosentrifus (pakai tabung dari kelompok lain untuk menyeimbangkan) lalu putar selama 3 menit dengan kecepatan tinggi. 4. Supernatan yang dihasilkan pindahkan ke tabung mikrosentrifus lain, tandai dan letakkan di atas es (Es). 5. Keringkan bagian atas endapan dengan menggunakan tisue lalu tambahkan 1 ml etanol 50% dan campur dengan pipet otomatik, jaga agar tabung tetap dingin dan simpan di atas es. 6. Masukkan tabung tersebut ke dalam alat mikrosentrifus (pakai tabung dari kelompok lain untuk menyeimbangkan) lalu putar selama 3 menit dengan kecepatan tinggi. 7. Buang supernatant dan keringkan bagian atasnya dengan tisue. Ini merupakan sampel protein pengendapan etanol tinggi (Ep). 8. Tambahkan 500 µl buffer hemolisis dan simpan di dalam kulkas. Point penting dalam praktikum ini: Pada praktikum ini yang harus diperhatikan adalah pada saat mengambil supernatan harus dilakukan dengan hati-hati jangan sampai endapan yang ada ikut terambil karena akan mempengaruhi hasil.
16 LAPORAN PRAKTIKUM PCR, ELEKTROFORESIS AGAROSE DAN SDS-PAGE (SDS PolyAcrilamide Gel Elektroforesis) Nama : Juwita ( ) Rika Nailuvar Sinaga ( ) Hari / Tanggal Praktikum : Kamis / 22 November 2012 Kamis / 15 Desember 2012 Waktu Praktikum : WIB Tujuan : a. Praktikan memahami prinsip teknik PCR dan prinsip dasar elektroforesis. b. Praktikan mampu mengerjakan prosedur teknik elektroforesis agarose menggunakan sampel DNA yang diperoleh dari jaringan manusia. c. Praktikan mampu melakukan teknik SDS-PAGE. Pendahuluan : Protein adalah makromolekul yang secara fisik dan fungsional kompleks yang melakukan beragam peran penting. Untuk meneliti sifat-sifat fisik dan fungsional suatu protein secara rinci, diperlukan protein yang sangat murni. Sel mengandung ribuan protein yang berlainan, masingmasing dengan jumlah yang sangat bervariasi. Untuk memisahkan masing-masing protein dari campuran kompleks sering digunakan pelarut atau elektrolit (atau keduanya) untuk mengeluarkan fraksi protein yang berbeda sesuai karakteristik kelarutannya. Hal ini adalah dasar dari sesuatu yang disebut sebagai metode saltingout, yang digunakan dalam penentuan fraksi protein di laboratorium klinik. Oleh karena itu, kita dapat memisahkan protein plasma menjadi tiga kelompok besar fibrinogen, albumin, dan globulin- berdasarkan pemakaian natrium atau amonium sulfat dengan berbagai konsentrasi.
17 Metode yang paling sering digunakan untuk menentukan kemurnian suatu protein adalah SDS-PAGE- elektroforesis gel poliakrilamid (polyacrylamide gel electrophoresis, PAGE) dengan menggunakan deterjen anionik natrium dodesil sulfat (sodium dodecyl sulfate, SDS). Elektroforesis memisahkan biomolekul-biomolekul bermuatan berdasarkan laju migrasi biomolekul tersebut dalam medan listrik. Pada SDS-PAGE, akrilamid mengalami polimerisasi dan pengikatan silang untuk menghasilkan matriks berpori. SDS mendenaturasi dan mengikat protein dengan perbandingan satu molekul SDS per dua ikatan peptida. Jika digunakan bersama 2-merkaptoetanol atau ditiotreitol untuk mereduksi dan memutus ikatan disulfida, SDS memisahkan komponen polipeptida dari protein multimerik. Jumlah molekul SDS anionik yang besar, masing-masing bermuatan -1, di masing-masing polipeptida mengalahkan muatan yang ditimbulkan oleh gugus fungsional asam amino. Karena perbandingan muatan terhadap massa masing-masing kompleks SDS-polipeptida kira-kira sama, resistensi fisik yang dijumpai masing-masing peptida sewaktu bergerak melintasi matriks akrilamid menentukan laju migrasi. Karena kompleks besar menemui resistensi yang lebih besar, polipeptida-polipeptida akan terpisah berdasarkan massa molekul relatif polipeptida tersebut. Setiap polipeptida yang terperangkap dalam gel akrilamid divisualisasikan dengan pulasan zat pewarna, seperti Coomassie blue. Alat dan bahan yang dibutuhkan pada percobaan PCR 1. Forward Primer : konsentrasi 40 pmol 2. Reverse Primer : konsentrasi 40 pmol 3. dntp s : konsentrasi akhir adalah 0,2 mm untuk setiap nukleotida (A T,G,C) x Buffer (10 x Konsentrasi) dengan konsentrasi MgCl 2 25 mm 5. Aquabidest steril 6. Taq Polimerase 7. Sampel DNA
18 8. Mineral oil (untuk menghindari penguapan) 9. Therma Cycler PCR 10. UV reader Cara kerja PCR - Siapkan larutan Mix Solution - Penyimpanan larutan-larutan Primer, dntp s, Buffer, Taq dan larutan DNA ada yang harus disimpan pada temperature 20 0 C saat bekerja larutan-larutan ini harus diletakan dalam wadah berisi es - Selalu gunakan tabung dan tips yang telah disterilisasi, hindari risiko kontaminasi seminimal mungkin. Menyiapkan Mix Solution : No. Bahan 1 sampel 1 Forward Primer (40 pmol) 0,25 µl 2 Reverse Primer (40 pmol) 0,25 µl 3 dntp s 0,5 µl 4 10 x Buffer 5 µl 6 Taq Polimerase 0,2 µl 7 Aquabidest (17,8 2,5 = 15,3 µl) 15,3 µl 8 MgCl 2 25 mm 1 µl Jumlah 22,5 µl - Siapkan 12 tabung PCR (steril) pipetkan sebanyak 22,5 µl Mix Solution masukkan ke masing-masing tabung PCR - Tambahkan 2,5 µl larutan DNA sampel ke dalam tabung kemudian vortex - Tambahkan Mineral Oil sebanyak 50 µl - Tutup rapat tabung dan susun di dalam blok alat Thermal Cycler
19 - Sertakan kontrol negatif setiap menjalankan PCR - Atur program untuk menjalankan PCR Cara kerja elektroforesis agarose Alat dan bahan yang digunakan : a. Alat - Sarung tangan - Tempat buang cairan biologis - Waterbath - Mikrosentrifus - Alat elektroforesis agarose - Tabung mikrosentrifus (1,5 ml) - Pipet Mohr - Erlenmeyer flask - ph meter - Pipet otomatik - Pipet tetes - Alat elektroforesis - Power supply - Beaker - Hamilton syringe - Vorteks - Spidol - Tisu b. Bahan - 7 sampel protein darah dari minggu yang lalu - Sampel DNA sel epitelial - Pewarna DNA (crystal violet dalam 20% gliserol) - Akuades - Etanol absolut dingin - Gel poliakrilamide SDS 10% - Isobutanol - Protein standard SDS-PAGE - 1 N HCl - Bromfenol biru - β-merkaptoetanol - Tris - DTT - SDS - Agar 2% - Na 2 HPO 4 - Gliserol - EDTA - Asam borik - Larutan pewarna - Larutan pencuci - Agarose
20 Larutan-larutan yang perlu disiapkan: 1. 1X TBE - siapkan 1000 ml dengan komposisi: 10.8 g Tris, 5.5 g asam borik acid, 0.74 g EDTA dimasukkan ke dalam beaker 1000 ml tambahkan 900 ml akuades aduk dengan magnetic stirrer sampai larut Tambahkan akuades sampai volume larutan 1 liter. simpan di dalam botol bersih pada temperatur ruangan % Agarose - siapkan agarose secukupnya (diperlukan 40 ml/casting tray) dengan komposisi: 1 g agarose dimasukkan ke dalam beaker/flask 250 ml yang bersih Tambahkan 125 ml larutan 1X TBE buffer solution Tutup flask/beaker dengan foil aluminium untuk mengurangi penguapan dan sisakan celah sedikit Aduk panaskan sampai mendidih dan larutan jernih kemudian dinginkan sampai 60 tambahkan 12 μl larutan ethidium bromide/casting tray. 3. Larutan Dapar Sampel (50 mm Tris-HCl ph 6,8; 10%(v/v) gliserol; 1% (b/v) SDS; 0,01% (b/v) biru bromfenol). 4. Larutan Dapar Elektroda (250 mm Tris-HCl ph 6,8; 1,8 M glisin; 1% (b/v) SDS). 5. Larutan Pewarna (0,15% Coomassie Brilliant Blue R-250; 250 ml metanol; 50 ml asam asetat; akuades sampai 500 ml) 6. Larutan Pencuci (50 ml metanol; 75 ml asam asetat; akuades sampai 1000 ml) Tahap Pertama ELEKTROFORESIS GEL AGAROSE
21 1. Siapkan casting tray pasang satu comb (sisir) pada pertengahan tray (plat cetakan) dan satu sisir lagi pada ujungnya.. 2. Tuangkan ± 40 ml 0,8% agarose ke dalam casting tray. Cara kerja alat elektroforesis: a. Tunggu sampai gel beku lepaskan comb secara hati-hati. b. Letakkan gel di dalam elektroforesis tank yang sudah berisi larutan 1X TBE kemudian tambahkan larutan 1X TBE secukupnya sampai gel terbenam. c. Untuk mewarnai DNA epitel campurkan 10 μl DNA epitel dengan 10 μl perwarna DNA di atas parafilm kemudian masukkan semuanya (20 μl) ke dalam sumur gel. d. Kemudian dengan parafilm baru lagi campurkan 10 μl DNA sel darah dengan 10 μl pewarna DNA di atas parafilm masukkan semuanya (20 μl) ke sumur gel. (Jangan lupa mencatat posisi dan urutan sampel-sampel DNA). e. Hidupkan mesin elektroforesis selama 30 menit dengan tegangan 90 V. Sampelsampelnya akan mulai bergerak ke katode. (karena DNA bermuatan negatif) f. Matikan mesin elektroforesis secara sempurna g. Keluarkan gel dengan sangat hati-hati dan letakkan pada tray yang disediakan. h. Pindahkan ke alat UV reader supaya hasilnya jelas. SDS PAGE Persiapan Gel 1. Bersihkan dulu plat kaca menggunakan akuades dan etanol (70%) 2. Susun lempeng kaca beserta spacer tutup celah antara lempeng dengan spacer menggunakan agar 2% secukupnya. 3. Siapkan gel poliakrilamide - SDS 10% (Siapkan gel pemisah dulu).
22 Bahan Gel pemisah ± 5 ml/gel Gel penumpuk ± 1,5 ml/gel (tabung reaksi 1) (tabung reaksi 2) Akrilamide 30% 1,88 ml 0,36 ml 1,5 M Tris-HCl ph=8,6 1,28 ml - 1,5M Tris-HCl ph=6,8-0,24 ml Akuades 1,93 ml 0,70 ml SDS 10% 56 µl 10 µl Amonium persulfat 10% 38 µl 7,2 µl TEMED 3,8 µl 1 µl Perhitungan plate serta spacer elektroforesisnya adalah: Plate elektroforesis: 10 cm x 10 cm x 0,2 cm = 20 cm 3 Spacer elektroforesis : 1 cm x 10 cm x 0,1 cm = 1 cm 3 Volume aktifnya : 8 cm x 8,5 cm o Untuk membuat gel pemisah dibutuhkan akrilamid = 6,5 cm Volume gel pemisah = p x l x t 8 cm x 0,1 cm x 6,5 cm = 5,2 cm 3 = 5,2 ml o Untuk membuat gel penumpuk dibutuhkan 1,5 cm Volume gel penumpuk = p x l x t 8 cm x 0,1 cm x 1,5 cm = 1,2 cm 3 = 1,2 ml 4. Tuangkan dulu campuran gel pemisah ke dalam ruang di antara lempeng kaca sisakan ± 2,5 cm dari tepi atas lempeng kaca untuk gel penumpuk. 5. Teteskan isobutanol untuk menyingkirkan udara pada bagian atas gel dan agar batas antar gel dapat terbentuk dengan baik. 6. Biarkan gel pemisah selama ± 30 menit siapkan gel penumpuk. 7. Setelah ± 30 menit gel pemisah berpolimerisasi tuang campuran gel penumpuk di atasnya sisipkan sisir plastik untuk membentuk sumur sampel biarkan gel penumpuk berpolimerisasi.
23 8. Setelah gel penumpuk berpolimerisasi lepaskan sisir bagian atas dan klem serta spacer bagian bawah. 9. Letakkan lempeng kaca yang berisi gel secara vertikal pada alat elektroforesis dan kemudian klem isi tempat dapar dengan dapar elektroda, dan singkirkan gelembung udara pada bagian bawah gel. Tahap Kedua : Mempersiapkan sampel protein 1. Atur temperatur waterbath di C. 2. Siapkan 7 tabung mikrosentrifus yang bersih dan kering tandai dengan plasma, M, S, G S, G P, E S, E P. 3. Ambil ke-7 sampel protein darah (yaitu plasma, M, S, G S, G P, E S, E P ) dari lemari pendingin. 4. Masukkan 450 μl buffer sampel, dan 25 μl β-merkaptoetanol ke tiap tabung mikrosentrifus yang sudah ditandai tambahkan 50 μl sampel protein plasma, M, S, G S, G P, E S, E P ke tabung mikrosentrifus masing-masing. 5. Tutup rapat tabung vorteks pelan-pelan supaya endapan tercampur rata dengan buffer. 6. Masukkan semua tabung mikrosentrifus ke dalam waterbath yang mendidih selama 5 menit. 7. Masukkan tabung tabung ini ke dalam mesin sentrifus pastikan letak semua tabung seimbang atur pada kecepatan rpm selama 3 menit. Tahap Ketiga: Loading and running the gel 1. Masukkan 10 μl sampel protein (yaitu plasma, M, S, G S, G P, E S, E P ) ke dalam sumur masingmasing menggunakan Hamilton syringe pada sumur yang terakhir masukkan 10 μl marker. (jangan lupa catat nomor sumur dan sampel apa). 2. Hubungkan alat elektroforesis dengan power supply jalankan elektroforesis selama 4 jam atau lebih.
24 Tahap Keempat: Pewarnaan Gel 1. Selesai proses pemisahan protein matikan power supply dan lepaskan semua kabel dari alat elektroforesis. 2. Buka klem (gunakan sarang tangan) angkat spacer pada kedua sisi lempeng kaca, kemudian pisahkan satu lempeng kaca dari gel potong gel pada batas antara gel penumpuk dan gel pemisah tandai salah satu ujung gel. 3. Angkat gel dan rendam dalam larutan pewarna selama menit. 4. Pindahkan gel ke tempat larutan pencuci ganti larutan pencuci beberapa kali hingga warna latar belakang memudar dan pita-pita protein jelas terlihat. 5. Bandingkan mobilitas semua protein sampel dengan marker untuk menentukan berat molekulnya. Untuk menentukan berat molekul protein sampel, ukur jarak pita-pita protein sampel serta pita-pita marker dari batas atas gel pemisah. Hasil praktikum: Keterangan : 1 = Standar 2 = Ep2 3 = Es2 4 = Gp2 5 = Gs = M2 7 = P2 8 = S2 9 = Ep4 10 = Es4 Gambar 1. Gel hasil Isolasi Protein SDS-PAGE 11 = Gp4
25 Keterangan : 1 = S3 2 = P3 3 = Standar 4 = Gs4 5 = M4 6 = P4 7 = S4 8 = Ep3 9 = Es3 10 = Gp3 11 = Gs3 Gambar 2. gel hasil Isolasi Protein SDS-PAGE 12 = M3 Keterangan Kelompok : Kelompok 2 : Herviani Sari & Henny S. Ompusunggu Kelompok 3 : Rebecca Rumesty & Maria Lestari Kelompok 4 : Juwita & Rika Nailuvar
26 Tabel 1. Pita standar pada SDS-PAGE Jarak Pita (cm) Berat Molekul (Dalton) Protein Myosin 1, β-galaktosidase 1, Phosphorylase B 2, Albumin Ovalbumin 3, Carbonic anhydrase Trypsin inhibitor 5, Lysozime Berat Molekul Protein (Daltons) Hasil Elektroforesis dan PCR Protein Jarak pita DNA ke sumur (cm) y = 36660e -0.70x R² = Series1 Expon. (Series1) Gambar 3. Grafik Hasil Elektroforesis dan PCR Protein Darah
27 Tabel 2. Pita sampel hasil SDS-PAGE Sumur 10 Jarak band (cm) 1,1 1,8 Berat Molekul (Dalton) 30160, ,2 Pembahasan : 1. Dari grafik hasil elektroforesis dan PCR standar DNA didapat persamaan y = 36660e -0.70x digunakan untuk menghitung berat molekul protein sampel. 2. Pada sumur 10 didapatkan beberapa pita pita DNA setelah dicoba dimasukkan ke dalam rumus ternyata berat molekulnya tidak sesuai seperti seharusnya. Seharusnya berat molekul yang paling besar terletak pada pita yang paling atas. Tetapi pada hasil praktikum di dapati hasil yang sebaliknya yaitu berat molekul yang paling kecil ada di pita yang paling atas. 3. Kemungkinan kesalahan ini bisa disebabkan oleh praktikan yang kurang teliti dalam menjalankan prosedur pembuatan gel poliakrilamid, baik kesalahan dalam mengukur volume bahan atau kesalahan membuat gel pemisah dan gel penumpuk. Saran : 1. Sebaiknya sebelum praktikum dimulai perhatikan bahan-bahan untuk praktikum. 2. Sebaiknya praktikan membaca dan memahami prosedur pengerjaan.
Laporan Praktikum Isolasi DNA, Teknik PCR dan Elektroforesis Agarose
 Laporan Praktikum Isolasi DNA, Teknik PCR dan Elektroforesis Agarose Hari / Tanggal Praktikum : Kamis / 28 April - 09 Juni 2016 Nama Praktikan : Binayanti Nainggolan Yuliandriani Wannur Azah Pukul : 10.00
Laporan Praktikum Isolasi DNA, Teknik PCR dan Elektroforesis Agarose Hari / Tanggal Praktikum : Kamis / 28 April - 09 Juni 2016 Nama Praktikan : Binayanti Nainggolan Yuliandriani Wannur Azah Pukul : 10.00
Laporan Praktikum Isolasi DNA, Teknik PCR dan Elektroforesis Agarose
 Laporan Praktikum Isolasi DNA, Teknik PCR dan Elektroforesis Agarose Hari / Tanggal Praktikum : Kamis / 1 November dan 22 November 2012 Nama Praktikan : Rica Vera Br. Tarigan dan Jekson Martiar Siahaan
Laporan Praktikum Isolasi DNA, Teknik PCR dan Elektroforesis Agarose Hari / Tanggal Praktikum : Kamis / 1 November dan 22 November 2012 Nama Praktikan : Rica Vera Br. Tarigan dan Jekson Martiar Siahaan
LAPORAN PRAKTIKUM V, VI, VII. Isolasi DNA dan Tekhnik PCR
 LAPORAN PRAKTIKUM V, VI, VII Isolasi DNA dan Tekhnik PCR Oleh: Selly Oktaria : 127008001 Paska Situmorang : 127008011 Kamis, 18 Oktober 2012 Pukul: 08.00-11.00 Tujuan : 1. Mahasiswa dapat melakukan metode
LAPORAN PRAKTIKUM V, VI, VII Isolasi DNA dan Tekhnik PCR Oleh: Selly Oktaria : 127008001 Paska Situmorang : 127008011 Kamis, 18 Oktober 2012 Pukul: 08.00-11.00 Tujuan : 1. Mahasiswa dapat melakukan metode
PRAKTIKUM PCR, ELEKTROFORESIS AGAROSE DAN SDS-PAGE (SDS PolyAcrilamide Gel Elektroforesis)
 PRAKTIKUM PCR, ELEKTROFORESIS AGAROSE DAN SDS-PAGE (SDS PolyAcrilamide Gel Elektroforesis) Tujuan: i) Menerti dan memahami teknik PCR ii) Mengerti prinsip dasar elektroforesis iii) Melatih teknik elektroforesis
PRAKTIKUM PCR, ELEKTROFORESIS AGAROSE DAN SDS-PAGE (SDS PolyAcrilamide Gel Elektroforesis) Tujuan: i) Menerti dan memahami teknik PCR ii) Mengerti prinsip dasar elektroforesis iii) Melatih teknik elektroforesis
PRAKTIKUM ISOLASI DNA DAN TEKNIK PCR
 PRAKTIKUM ISOLASI DNA DAN TEKNIK PCR Tujuan: i) Mengerti metode umum mengisolasi DNA ii) Mengisolasi DNA dari buah dan sel-sel epithelial mulut iii) Mengerti dan mempraktek teknik PCR dengan sempel DNA
PRAKTIKUM ISOLASI DNA DAN TEKNIK PCR Tujuan: i) Mengerti metode umum mengisolasi DNA ii) Mengisolasi DNA dari buah dan sel-sel epithelial mulut iii) Mengerti dan mempraktek teknik PCR dengan sempel DNA
LAPORAN PRAKTIKUM ISOLASI DNA, TEKNIK PCR, DAN ELEKTROFORESIS AGAROSE
 LAPORAN PRAKTIKUM ISOLASI DNA, TEKNIK PCR, DAN ELEKTROFORESIS AGAROSE Nama : T.M. Reza Syahputra Irma Yanti Dinno Rilando Tgl Praktikum : Kamis, 2 Juni 2016 Tujuan Praktikum : 1. Mengerti metode umum mengisolasi
LAPORAN PRAKTIKUM ISOLASI DNA, TEKNIK PCR, DAN ELEKTROFORESIS AGAROSE Nama : T.M. Reza Syahputra Irma Yanti Dinno Rilando Tgl Praktikum : Kamis, 2 Juni 2016 Tujuan Praktikum : 1. Mengerti metode umum mengisolasi
LAPORAN PRAKTIKUM 5 ISOLASI DNA Oleh : Herviani Sari dan Henny E. S. Ompusunggu Hari/Tanggal/Jam Praktikum : Kamis/ 1 November 2012/
 LAPORAN PRAKTIKUM 5 ISOLASI DNA Oleh : Herviani Sari dan Henny E. S. Ompusunggu Hari/Tanggal/Jam Praktikum : Kamis/ 1 November 2012/ 12.00-15.00 WIB Tujuan : 1. Praktikan mengerti metode umum mengisolasi
LAPORAN PRAKTIKUM 5 ISOLASI DNA Oleh : Herviani Sari dan Henny E. S. Ompusunggu Hari/Tanggal/Jam Praktikum : Kamis/ 1 November 2012/ 12.00-15.00 WIB Tujuan : 1. Praktikan mengerti metode umum mengisolasi
ISOLASI DNA MANUSIA (EPITHELIAL MULUT DAN DARAH)
 Laporan Praktikum ISOLASI DNA MANUSIA (EPITHELIAL MULUT DAN DARAH) Oleh: Jenny Novina Sitepu Liza Mutia Waktu Praktikum: Kamis, 01 November 2012 Jam 08.00 12.00 WIB I. Tujuan Praktikum : 1. Mengerti metode
Laporan Praktikum ISOLASI DNA MANUSIA (EPITHELIAL MULUT DAN DARAH) Oleh: Jenny Novina Sitepu Liza Mutia Waktu Praktikum: Kamis, 01 November 2012 Jam 08.00 12.00 WIB I. Tujuan Praktikum : 1. Mengerti metode
LAPORAN PRAKTIKUM. Isolasi DNA dari Epitel dan Darah (5), Isolasi Protein Darah(6) dan PCR (Elektroforesis agarose dan Akrilamid)(7)
 LAPORAN PRAKTIKUM Isolasi DNA dari Epitel dan Darah (5), Isolasi Protein Darah(6) dan PCR (Elektroforesis agarose dan Akrilamid)(7) Nama : Maria Lestari ( 127008012) Rebecca Rumesty Lamtiar (127008016)
LAPORAN PRAKTIKUM Isolasi DNA dari Epitel dan Darah (5), Isolasi Protein Darah(6) dan PCR (Elektroforesis agarose dan Akrilamid)(7) Nama : Maria Lestari ( 127008012) Rebecca Rumesty Lamtiar (127008016)
PRAKTIKUM V ISOLASI DNA DAN TEKNIK PCR. Oleh: Ayu Elvana ( ) Yulia Fitri Ghazali ( ) Hari/Tanggal praktikum : Kamis/1 November 2012
 PRAKTIKUM V ISOLASI DNA DAN TEKNIK PCR Oleh: Ayu Elvana (127008013) Yulia Fitri Ghazali (127008007) Hari/Tanggal praktikum : Kamis/1 November 2012 Tujuan: i) Agar mahasiswa dapat mengerti metode umum mengisolasi
PRAKTIKUM V ISOLASI DNA DAN TEKNIK PCR Oleh: Ayu Elvana (127008013) Yulia Fitri Ghazali (127008007) Hari/Tanggal praktikum : Kamis/1 November 2012 Tujuan: i) Agar mahasiswa dapat mengerti metode umum mengisolasi
LAPORAN PRAKTIKUM 5 PRAKTIKUM ISOLASI DNA DAN TEKNIK PCR
 LAPORAN PRAKTIKUM 5 PRAKTIKUM ISOLASI DNA DAN TEKNIK PCR HARI/ TANGGAL PRAKTKUM : KAMIS/ 1 November 2012 JAM : 08.00 11.00 WIB Nama Praktikan : KAROLINA BR SURBAKTI (NIM: 20127008018) LUCIA AKTALINA (
LAPORAN PRAKTIKUM 5 PRAKTIKUM ISOLASI DNA DAN TEKNIK PCR HARI/ TANGGAL PRAKTKUM : KAMIS/ 1 November 2012 JAM : 08.00 11.00 WIB Nama Praktikan : KAROLINA BR SURBAKTI (NIM: 20127008018) LUCIA AKTALINA (
LAPORAN PRAKTIKUM 5 ISOLASI DNA, PCR, ELEKTROFORESIS
 LAPORAN PRAKTIKUM 5 ISOLASI DNA, PCR, ELEKTROFORESIS HARI/TANGGAL PRAKTIKUM : Kamis, 19 Mei, 2, 9 Juni 2016 LABORATORIUM BIOMEDIK DAN LABORATORIUM TERPADU UNIVERSITAS SUMATERA UTARA SISKA MULYANI NIM :
LAPORAN PRAKTIKUM 5 ISOLASI DNA, PCR, ELEKTROFORESIS HARI/TANGGAL PRAKTIKUM : Kamis, 19 Mei, 2, 9 Juni 2016 LABORATORIUM BIOMEDIK DAN LABORATORIUM TERPADU UNIVERSITAS SUMATERA UTARA SISKA MULYANI NIM :
SOAL LATIHAN UAS MATA KULIAH KETRAMPILAN DASAR LABORATORIUM BIOMEDIK. Bentuk UAS tahun ini: Ada 3 bagian:
 SOAL LATIHAN UAS MATA KULIAH KETRAMPILAN DASAR LABORATORIUM BIOMEDIK Bentuk UAS tahun ini: Ada 3 bagian: 1. CARA KERJA Soal praktek pada UAS lebih rumit dari pada UTS di mana Anda akan diuji atas sebagian
SOAL LATIHAN UAS MATA KULIAH KETRAMPILAN DASAR LABORATORIUM BIOMEDIK Bentuk UAS tahun ini: Ada 3 bagian: 1. CARA KERJA Soal praktek pada UAS lebih rumit dari pada UTS di mana Anda akan diuji atas sebagian
LAPORAN PRAKTIKUM 5, 6, 7, 8 ISOLASI DNA, ISOLASI PROTEIN DARAH, SERTA PEMERIKSAAN DENGAN TEKNIK PCR, ELEKTROFORESIS AGAROSE DAN SDS-PAGE
 LAPORAN PRAKTIKUM 5, 6, 7, 8 ISOLASI DNA, ISOLASI PROTEIN DARAH, SERTA PEMERIKSAAN DENGAN TEKNIK PCR, ELEKTROFORESIS AGAROSE DAN SDS-PAGE Nama (NIM) : Debby Mirani Lubis (137008010) dan Melviana (137008011)
LAPORAN PRAKTIKUM 5, 6, 7, 8 ISOLASI DNA, ISOLASI PROTEIN DARAH, SERTA PEMERIKSAAN DENGAN TEKNIK PCR, ELEKTROFORESIS AGAROSE DAN SDS-PAGE Nama (NIM) : Debby Mirani Lubis (137008010) dan Melviana (137008011)
LAPORAN PRAKTIKUM. Bagian B Supernatan Pengendapan Jumlah /warna 7 ml / berwarna kuning 1 ml Warna merah
 LAPORAN PRAKTIKUM PRAKTIKUM ISOLASI DNA MANUSIA (SEL EPITHEL MULUT DAN DARAH) PRAKTIKUM ISOLASI PROTEIN DARI DARAH PRAKTIKUM PCR,ELEKTROFORESIS AGAROSE DAN SDS-PAGE OLEH : Yuni Rahmayanti Ade Putra Sinaga
LAPORAN PRAKTIKUM PRAKTIKUM ISOLASI DNA MANUSIA (SEL EPITHEL MULUT DAN DARAH) PRAKTIKUM ISOLASI PROTEIN DARI DARAH PRAKTIKUM PCR,ELEKTROFORESIS AGAROSE DAN SDS-PAGE OLEH : Yuni Rahmayanti Ade Putra Sinaga
LAPORAN PRAKTIKUM Isolasi DNA, Teknik PCR dan Elektroforesis Agarose Isolasi Protein Darah dan Elektroforesis SDS-PAGE
 LAPORAN PRAKTIKUM Isolasi DNA, Teknik PCR dan Elektroforesis Agarose Isolasi Protein Darah dan Elektroforesis SDSPAGE Hari/Tanggal Praktikum : Kamis/ 07, 14, 21, dan 28 November 2013 Nama Mahasiswa : Maya
LAPORAN PRAKTIKUM Isolasi DNA, Teknik PCR dan Elektroforesis Agarose Isolasi Protein Darah dan Elektroforesis SDSPAGE Hari/Tanggal Praktikum : Kamis/ 07, 14, 21, dan 28 November 2013 Nama Mahasiswa : Maya
LAPORAN PRAKTIKUM ISOLASI DNA, ISOLASI PROTEIN DARAH, PCR, DAN ELEKTROFORESIS AGAROSE DAN SDS PAGE
 LAPORAN PRAKTIKUM ISOLASI DNA, ISOLASI PROTEIN DARAH, PCR, DAN ELEKTROFORESIS AGAROSE DAN SDS PAGE NAMA PRAKTIKAN : Aditya Chandra Ramadhan Bestari GRUP PRAKTIKAN : Grup Pagi KELOMPOK : 3 HARI/TGL. PRAKTIKUM
LAPORAN PRAKTIKUM ISOLASI DNA, ISOLASI PROTEIN DARAH, PCR, DAN ELEKTROFORESIS AGAROSE DAN SDS PAGE NAMA PRAKTIKAN : Aditya Chandra Ramadhan Bestari GRUP PRAKTIKAN : Grup Pagi KELOMPOK : 3 HARI/TGL. PRAKTIKUM
Praktikan : Sari Hutagaol, Yulia Fitri (A), Nunung Sri Mulyani
 Laporan 5. PRAKTIKUM ISOLASI DNA DAN TEKNIK PCR Hari / tanggal : Kamis, 01 november 2012 Pukul : 08.00 wib Praktikan : Sari Hutagaol, Yulia Fitri (A), Nunung Sri Mulyani I. Tujuan 1. Mampu memahami metode
Laporan 5. PRAKTIKUM ISOLASI DNA DAN TEKNIK PCR Hari / tanggal : Kamis, 01 november 2012 Pukul : 08.00 wib Praktikan : Sari Hutagaol, Yulia Fitri (A), Nunung Sri Mulyani I. Tujuan 1. Mampu memahami metode
LAPORAN PRAKTIKUM ISOLASI DNA, ISOLASI PROTEIN DARAH, PCR, DAN ELEKTROFORESIS AGAROSE DAN SDS PAGE
 LAPORAN PRAKTIKUM ISOLASI DNA, ISOLASI PROTEIN DARAH, PCR, DAN ELEKTROFORESIS AGAROSE DAN SDS PAGE NAMA PRAKTIKAN : Amirul Hadi Barlian GRUP PRAKTIKAN : Grup Pagi HARI/TGL. PRAKTIKUM : Kamis, 7 November
LAPORAN PRAKTIKUM ISOLASI DNA, ISOLASI PROTEIN DARAH, PCR, DAN ELEKTROFORESIS AGAROSE DAN SDS PAGE NAMA PRAKTIKAN : Amirul Hadi Barlian GRUP PRAKTIKAN : Grup Pagi HARI/TGL. PRAKTIKUM : Kamis, 7 November
LAPORAN PRAKTIKUM ISOLASI DNA MANUSIA (EPITELIAL MULUT DAN DARAH) DAN TEKNIK PCR DAN ISOLASI PROTEIN DARI DRAH, ELEKTROFORESIS AGAROSE DAN SDS-PAGE
 LAPORAN PRAKTIKUM ISOLASI DNA MANUSIA (EPITELIAL MULUT DAN DARAH) DAN TEKNIK PCR DAN ISOLASI PROTEIN DARI DRAH, ELEKTROFORESIS AGAROSE DAN SDSPAGE Oleh : Nita Andriani Lubis dan Fery Prawira Gurusinga
LAPORAN PRAKTIKUM ISOLASI DNA MANUSIA (EPITELIAL MULUT DAN DARAH) DAN TEKNIK PCR DAN ISOLASI PROTEIN DARI DRAH, ELEKTROFORESIS AGAROSE DAN SDSPAGE Oleh : Nita Andriani Lubis dan Fery Prawira Gurusinga
BAB III METODE PENELITIAN. Penelitian ini merupakan penelitian eksperimental dengan 7 sampel dari 7
 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian ini merupakan penelitian eksperimental dengan 7 sampel dari 7 individu udang Jari yang diambil dari Segara Anakan Kabupaten Cilacap Jawa Tengah.
BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian ini merupakan penelitian eksperimental dengan 7 sampel dari 7 individu udang Jari yang diambil dari Segara Anakan Kabupaten Cilacap Jawa Tengah.
LAPORAN PRAKTIKUM ISOLASI DNA, TEKNIK PCR, DAN ELEKTROFORESIS AGAROSE NAMA PRAKTIKAN : KARIN TIKA FITRIA ( )
 LAPORAN PRAKTIKUM ISOLASI DNA, TEKNIK PCR, DAN ELEKTROFORESIS AGAROSE NAMA PRAKTIKAN : KARIN TIKA FITRIA (157008003) HARI/ TANGGAL PRAKTIKUM : RAHMIWITA (157008005) 1. ISOLASI DNA DARI DARAH : KAMIS/ 28
LAPORAN PRAKTIKUM ISOLASI DNA, TEKNIK PCR, DAN ELEKTROFORESIS AGAROSE NAMA PRAKTIKAN : KARIN TIKA FITRIA (157008003) HARI/ TANGGAL PRAKTIKUM : RAHMIWITA (157008005) 1. ISOLASI DNA DARI DARAH : KAMIS/ 28
LAPORAN PRAKTIKUM 03 ph METER DAN PERSIAPAN LARUTAN PENYANGGA
 LAPORAN PRAKTIKUM 03 ph METER DAN PERSIAPAN LARUTAN PENYANGGA Nama : Juwita (127008003) Herviani Sari (127008008) Tanggal Praktikum: 4 Oktober 2012 Tujuan Praktikum: 1. Memahami prinsip dasar larutan buffer
LAPORAN PRAKTIKUM 03 ph METER DAN PERSIAPAN LARUTAN PENYANGGA Nama : Juwita (127008003) Herviani Sari (127008008) Tanggal Praktikum: 4 Oktober 2012 Tujuan Praktikum: 1. Memahami prinsip dasar larutan buffer
BAB 3 METODOLOGI PENELITIAN
 20 BAB 3 METODOLOGI PENELITIAN 3.1. Desain Penelitian Penelitian ini bersifat deskriptif cross sectional molekuler. Data yang diperoleh berasal dari pemeriksaan langsung yang dilakukan peneliti sebanyak
20 BAB 3 METODOLOGI PENELITIAN 3.1. Desain Penelitian Penelitian ini bersifat deskriptif cross sectional molekuler. Data yang diperoleh berasal dari pemeriksaan langsung yang dilakukan peneliti sebanyak
BAB III METODE PENELITIAN. Secara garis besar langkah-langkah yang dilakukan dalam penelitian ini
 BAB III METODE PENELITIAN Secara garis besar langkah-langkah yang dilakukan dalam penelitian ini adalah: pengumpulan sampel; lisis terhadap sampel mtdna yang telah diperoleh; amplifikasi daerah D-loop
BAB III METODE PENELITIAN Secara garis besar langkah-langkah yang dilakukan dalam penelitian ini adalah: pengumpulan sampel; lisis terhadap sampel mtdna yang telah diperoleh; amplifikasi daerah D-loop
BAB III. METODOLOGI PENELITIAN. Pengambilan sampel. Penyiapan templat mtdna dengan metode lisis sel
 16 BAB III. METODOLOGI PENELITIAN Bab ini menggambarkan tahapan penelitian yang terdiri dari pengambilan sampel, penyiapan templat mtdna dengan metode lisis sel, amplifikasi D-loop mtdna dengan teknik
16 BAB III. METODOLOGI PENELITIAN Bab ini menggambarkan tahapan penelitian yang terdiri dari pengambilan sampel, penyiapan templat mtdna dengan metode lisis sel, amplifikasi D-loop mtdna dengan teknik
Asam Asetat Glacial = 5,7 ml EDTA 0,5 M ph 8.0 = 10 ml Aquades ditambahkan hingga volume larutan 100 ml
 36 Lampiran 1. Pembuatan Larutan Stok dan Buffer A. Pembuatan Larutan Stok Tris HCL 1 M ph 8.0 (100 ml) : Timbang Tris sebanyak 12,114 g. Masukkan Tris ke dalam Erlenmeyer dan ditambahkan 80 ml aquades.
36 Lampiran 1. Pembuatan Larutan Stok dan Buffer A. Pembuatan Larutan Stok Tris HCL 1 M ph 8.0 (100 ml) : Timbang Tris sebanyak 12,114 g. Masukkan Tris ke dalam Erlenmeyer dan ditambahkan 80 ml aquades.
The Genetic Fingerprint (Sidikjari Genetik)
 The Genetic Fingerprint (Sidikjari Genetik) Penting: Jangan lupa selalu memberi label pada tabung Eppi dengan hati-hati. Untuk pipet: Pipet 1000 (biru): gunakan tips biru dan hanya untuk memipet 100-1000
The Genetic Fingerprint (Sidikjari Genetik) Penting: Jangan lupa selalu memberi label pada tabung Eppi dengan hati-hati. Untuk pipet: Pipet 1000 (biru): gunakan tips biru dan hanya untuk memipet 100-1000
Lampiran 1 Prosedur Rotofor
 Lampiran 1 Prosedur Rotofor Kalibrasi Membran Ion Membran ion terdiri dari membran kation yang berkorelasi dengan elektrolit H 3 PO 4 0,1 N terpasang pada elektroda anoda sebagai pembawa ion positif, sedangkan
Lampiran 1 Prosedur Rotofor Kalibrasi Membran Ion Membran ion terdiri dari membran kation yang berkorelasi dengan elektrolit H 3 PO 4 0,1 N terpasang pada elektroda anoda sebagai pembawa ion positif, sedangkan
III. Bahan dan Metode
 III. Bahan dan Metode A. Waktu dan Tempat Penelitian Penelitian ini dilaksanakan selama 3 bulan dari bulan Mei-Juli 2011 yang dilakukan di LPPT UGM Yogyakarta. B. Bahan Penelitian Sampel yang digunakan
III. Bahan dan Metode A. Waktu dan Tempat Penelitian Penelitian ini dilaksanakan selama 3 bulan dari bulan Mei-Juli 2011 yang dilakukan di LPPT UGM Yogyakarta. B. Bahan Penelitian Sampel yang digunakan
FAKULTAS BIOLOGI LABORATORIUM GENETIKA & PEMULIAAN INSTRUKSI KERJA UJI
 ISOLASI TOTAL DNA TUMBUHAN DENGAN KIT EKSTRAKSI DNA PHYTOPURE Halaman : 1 dari 5 1. RUANG LINGKUP Metode ini digunakan untuk mengisolasi DNA dari sampel jaringan tumbuhan, dapat dari daun, akar, batang,
ISOLASI TOTAL DNA TUMBUHAN DENGAN KIT EKSTRAKSI DNA PHYTOPURE Halaman : 1 dari 5 1. RUANG LINGKUP Metode ini digunakan untuk mengisolasi DNA dari sampel jaringan tumbuhan, dapat dari daun, akar, batang,
Pembuatan Media Kultur Bakteri Pemanenan sel bakteri. Isolasi DNA kromosom bakteri. Kloning DNA
 LAMPIRAN 15 15 Lampiran 1 Tahapan penelitian Pembuatan Media Kultur Bakteri Pemanenan sel bakteri Isolasi DNA kromosom bakteri Pemotongan DNA dengan enzim restriksi Kloning DNA Isolasi DNA plasmid hasil
LAMPIRAN 15 15 Lampiran 1 Tahapan penelitian Pembuatan Media Kultur Bakteri Pemanenan sel bakteri Isolasi DNA kromosom bakteri Pemotongan DNA dengan enzim restriksi Kloning DNA Isolasi DNA plasmid hasil
BAB III METODE PENELITIAN. amplifikasi daerah HVI mtdna sampel dengan menggunakan teknik PCR;
 BAB III METODE PENELITIAN Secara garis besar, langkah-langkah yang dilakukan dalam penelitian ini adalah: pengumpulan sampel; lisis terhadap sampel mtdna yang telah diperoleh; amplifikasi daerah HVI mtdna
BAB III METODE PENELITIAN Secara garis besar, langkah-langkah yang dilakukan dalam penelitian ini adalah: pengumpulan sampel; lisis terhadap sampel mtdna yang telah diperoleh; amplifikasi daerah HVI mtdna
4.1. Alat dan Bahan Penelitian a. Alat Penelitian. No. URAIAN ALAT. A. Pengambilan sampel
 7 IV. METODE PENELITIAN Ikan Lais diperoleh dari hasil penangkapan ikan oleh nelayan dari sungaisungai di Propinsi Riau yaitu S. Kampar dan S. Indragiri. Identifikasi jenis sampel dilakukan dengan menggunakan
7 IV. METODE PENELITIAN Ikan Lais diperoleh dari hasil penangkapan ikan oleh nelayan dari sungaisungai di Propinsi Riau yaitu S. Kampar dan S. Indragiri. Identifikasi jenis sampel dilakukan dengan menggunakan
BAB III METODE PENELITIAN Bagan Alir Penelitian ini secara umum dapat digambarkan pada skema berikut:
 BAB III METODE PENELITIAN Tahapan-tahapan yang dilakukan dalam penelitian ini adalah: pengumpulan sampel, lisis terhadap sampel mtdna yang telah diperoleh, amplifikasi daerah HVI mtdna sampel dengan menggunakan
BAB III METODE PENELITIAN Tahapan-tahapan yang dilakukan dalam penelitian ini adalah: pengumpulan sampel, lisis terhadap sampel mtdna yang telah diperoleh, amplifikasi daerah HVI mtdna sampel dengan menggunakan
III. METODOLOGI PENELITIAN
 III. METODOLOGI PENELITIAN 3.1 WAKTU DAN TEMPAT Penelitian dilaksanakan pada bulan Januari 2012 hingga September 2012. Penelitian dilaksanakan di Laboratorium Pengembangan Teknologi Industri Agro dan Biomedika
III. METODOLOGI PENELITIAN 3.1 WAKTU DAN TEMPAT Penelitian dilaksanakan pada bulan Januari 2012 hingga September 2012. Penelitian dilaksanakan di Laboratorium Pengembangan Teknologi Industri Agro dan Biomedika
LAPORAN PRAKTIKUM 2 PH METER, PERSIAPAN LARUTAN PENYANGGA
 LAPORAN PRAKTIKUM 2 PH METER, PERSIAPAN LARUTAN PENYANGGA Nama : T.M. Reza Syahputra Dinno Rilando Hari / Tgl: Kamis / 24 Maret 2016 Tujuan Praktikum: 1. Mahasiswa/i dapat memahami pengertian dan fungsi
LAPORAN PRAKTIKUM 2 PH METER, PERSIAPAN LARUTAN PENYANGGA Nama : T.M. Reza Syahputra Dinno Rilando Hari / Tgl: Kamis / 24 Maret 2016 Tujuan Praktikum: 1. Mahasiswa/i dapat memahami pengertian dan fungsi
LAMPIRAN. Lampiran 1. Pembuatan Larutan Stok dan Buffer
 LAMPIRAN Lampiran 1. Pembuatan Larutan Stok dan Buffer A. LARUTAN STOK CTAB 5 % (100 ml) - Ditimbang NaCl sebanyak 2.0 gram - Ditimbang CTAB sebanyak 5.0 gram. - Dimasukkan bahan kimia ke dalam erlenmeyer
LAMPIRAN Lampiran 1. Pembuatan Larutan Stok dan Buffer A. LARUTAN STOK CTAB 5 % (100 ml) - Ditimbang NaCl sebanyak 2.0 gram - Ditimbang CTAB sebanyak 5.0 gram. - Dimasukkan bahan kimia ke dalam erlenmeyer
LAPORAN PRAKTIKUM ph METER DAN PERSIAPAN LARUTAN PENYANGGA
 LAPORAN PRAKTIKUM ph METER DAN PERSIAPAN LARUTAN PENYANGGA Nama : 1. Irmayanti (157008011) 2. Binayanti Nainggolan (157008008) 3. Henny Gusvina Batubara (157008010) Tanggal Praktikum : 31 Maret 2016 Tujuan
LAPORAN PRAKTIKUM ph METER DAN PERSIAPAN LARUTAN PENYANGGA Nama : 1. Irmayanti (157008011) 2. Binayanti Nainggolan (157008008) 3. Henny Gusvina Batubara (157008010) Tanggal Praktikum : 31 Maret 2016 Tujuan
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Jenis Penelitian deskriptif. Jenis penelitian yang digunakan adalah penelitian dasar dengan metode B. Objek Penelitian Objek penelitian ini adalah sampel DNA koleksi hasil
BAB III METODE PENELITIAN A. Jenis Penelitian deskriptif. Jenis penelitian yang digunakan adalah penelitian dasar dengan metode B. Objek Penelitian Objek penelitian ini adalah sampel DNA koleksi hasil
LAMPIRAN. Lampiran 1. Deskripsi Pembuatan Larutan Stok dan Buffer
 LAMPIRAN Lampiran 1. Deskripsi Pembuatan Larutan Stok dan Buffer 1. Pembuatan Larutan Stok a. CTAB 5 % Larutan dibuat dengan melarutkan : - NaCl : 2.0 gr - CTAB : 5.0 gr - Aquades : 100 ml b. Tris HCl
LAMPIRAN Lampiran 1. Deskripsi Pembuatan Larutan Stok dan Buffer 1. Pembuatan Larutan Stok a. CTAB 5 % Larutan dibuat dengan melarutkan : - NaCl : 2.0 gr - CTAB : 5.0 gr - Aquades : 100 ml b. Tris HCl
LAPORAN PRAKTIKUM ph METER, PERSIAPAN LARUTAN PENYANGGA
 LAPORAN PRAKTIKUM ph METER, PERSIAPAN LARUTAN PENYANGGA Nama : Ayu Elvana (127008013) & Rika Nailuvar Sinaga ( Tanggal praktikum : 4 Oktober 2012 Kelompok : Siang (12.00-15.00) Tujuan : 1. Mampu menggunakan
LAPORAN PRAKTIKUM ph METER, PERSIAPAN LARUTAN PENYANGGA Nama : Ayu Elvana (127008013) & Rika Nailuvar Sinaga ( Tanggal praktikum : 4 Oktober 2012 Kelompok : Siang (12.00-15.00) Tujuan : 1. Mampu menggunakan
KESEIMBANGAN ASAM BASA
 LAPORAN PRAKTIKUM PRAKTIKUM PH METER, PERSIAPAN LARUTAN PENYANGGA NAMA PRAKTIKAN : Fani Nuryana Manihuruk (NIM 147008013) Mesrida Simarmata (NIM 147008011) HARI/TGL. PRAKTIKUM : Selasa, 10 Maret 2015 TUJUAN
LAPORAN PRAKTIKUM PRAKTIKUM PH METER, PERSIAPAN LARUTAN PENYANGGA NAMA PRAKTIKAN : Fani Nuryana Manihuruk (NIM 147008013) Mesrida Simarmata (NIM 147008011) HARI/TGL. PRAKTIKUM : Selasa, 10 Maret 2015 TUJUAN
FAKULTAS BIOLOGI LABORATORIUM GENETIKA & PEMULIAAN INSTRUKSI KERJA UJI
 Halaman : 1 dari 5 ISOLASI TOTAL DNA HEWAN DENGAN KIT EKSTRAKSI DNA 1. RUANG LINGKUP Metode ini digunakan untuk mengisolasi DNA dari sampel jaringan hewan, dapat dari insang, otot, darah atau jaringan
Halaman : 1 dari 5 ISOLASI TOTAL DNA HEWAN DENGAN KIT EKSTRAKSI DNA 1. RUANG LINGKUP Metode ini digunakan untuk mengisolasi DNA dari sampel jaringan hewan, dapat dari insang, otot, darah atau jaringan
BAB III METODE PENELITIAN. Dalam penelitian ini dilakukan lima tahap utama yang meliputi tahap
 BAB III METODE PENELITIAN Dalam penelitian ini dilakukan lima tahap utama yang meliputi tahap penyiapan templat mtdna, amplifikasi fragmen mtdna pada daerah D-loop mtdna manusia dengan teknik PCR, deteksi
BAB III METODE PENELITIAN Dalam penelitian ini dilakukan lima tahap utama yang meliputi tahap penyiapan templat mtdna, amplifikasi fragmen mtdna pada daerah D-loop mtdna manusia dengan teknik PCR, deteksi
II. BAHAN DAN METODE. Betina BEST BB NB RB. Nirwana BN NN RN. Red NIFI BR NR RR
 II. BAHAN DAN METODE Ikan Uji Ikan uji yang digunakan adalah ikan nila hibrida hasil persilangan resiprok 3 strain BEST, Nirwana dan Red NIFI koleksi Balai Riset Perikanan Budidaya Air Tawar Sempur, Bogor.
II. BAHAN DAN METODE Ikan Uji Ikan uji yang digunakan adalah ikan nila hibrida hasil persilangan resiprok 3 strain BEST, Nirwana dan Red NIFI koleksi Balai Riset Perikanan Budidaya Air Tawar Sempur, Bogor.
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian tentang Pengaruh Suhu Annealing pada Program PCR terhadap Keberhasilan Amplifikasi DNA Udang Jari (Metapenaeus elegans) Laguna Segara Anakan
BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian tentang Pengaruh Suhu Annealing pada Program PCR terhadap Keberhasilan Amplifikasi DNA Udang Jari (Metapenaeus elegans) Laguna Segara Anakan
LAPORAN PRAKTIKUM ph METER DAN PERSIAPAN LARUTAN PENYANGGA
 LAPORAN PRAKTIKUM ph METER DAN PERSIAPAN LARUTAN PENYANGGA Nama : Meutia Atika Faradilla (147008014) Sri Wulandari (147008005) Tanggal Praktikum : 10 Maret 2015 Tujuan Praktikum : 1. Memahami prinsip dasar
LAPORAN PRAKTIKUM ph METER DAN PERSIAPAN LARUTAN PENYANGGA Nama : Meutia Atika Faradilla (147008014) Sri Wulandari (147008005) Tanggal Praktikum : 10 Maret 2015 Tujuan Praktikum : 1. Memahami prinsip dasar
Lampiran 1. Pembuatan Larutan Buffer untuk Dialisa Larutan buffer yang digunakan pada proses dialisa adalah larutan buffer Asetat 10 mm ph 5,4 dan
 39 Lampiran 1. Pembuatan Larutan Buffer untuk Dialisa Larutan buffer yang digunakan pada proses dialisa adalah larutan buffer Asetat 10 mm ph 5,4 dan buffer Asetat 20 mm ph 5,4. Larutan buffer asetat 10
39 Lampiran 1. Pembuatan Larutan Buffer untuk Dialisa Larutan buffer yang digunakan pada proses dialisa adalah larutan buffer Asetat 10 mm ph 5,4 dan buffer Asetat 20 mm ph 5,4. Larutan buffer asetat 10
LAPORAN PRAKTIKUM BIOKIMIA PERCOBAAN KE 2 PEMISAHAN PROTEIN PUTIH TELUR DENGAN FRAKSINASI (NH 4 ) 2 SO 4
 LAPORAN PRAKTIKUM BIOKIMIA PERCOBAAN KE 2 PEMISAHAN PROTEIN PUTIH TELUR DENGAN FRAKSINASI (NH 4 ) 2 SO 4 Disusun oleh : Ulan Darulan - 10511046 Kelompok 1 Asisten Praktikum : R. Roro Rika Damayanti (10510065)
LAPORAN PRAKTIKUM BIOKIMIA PERCOBAAN KE 2 PEMISAHAN PROTEIN PUTIH TELUR DENGAN FRAKSINASI (NH 4 ) 2 SO 4 Disusun oleh : Ulan Darulan - 10511046 Kelompok 1 Asisten Praktikum : R. Roro Rika Damayanti (10510065)
BAB III BAHAN DAN CARA KERJA. Penelitian dilakukan di Laboratorium Institute of Human Virology and
 23 BAB III BAHAN DAN CARA KERJA A. LOKASI DAN WAKTU PENELITIAN Penelitian dilakukan di Laboratorium Institute of Human Virology and Cancer Biology of the University of Indonesia (IHVCB-UI), Jl. Salemba
23 BAB III BAHAN DAN CARA KERJA A. LOKASI DAN WAKTU PENELITIAN Penelitian dilakukan di Laboratorium Institute of Human Virology and Cancer Biology of the University of Indonesia (IHVCB-UI), Jl. Salemba
I. Tujuan Menentukan berat molekul protein dengan fraksinasi (NH 4 ) 2 SO 4 Teori Dasar
 I. Tujuan II. Menentukan berat molekul protein dengan fraksinasi (NH 4 ) 2 SO 4 Teori Dasar Penamabahan garam pada konsentrasi rendah dapat meningkatkan kelarutan protein (salting in). tetapi protein akan
I. Tujuan II. Menentukan berat molekul protein dengan fraksinasi (NH 4 ) 2 SO 4 Teori Dasar Penamabahan garam pada konsentrasi rendah dapat meningkatkan kelarutan protein (salting in). tetapi protein akan
BAB III METODOLOGI PENELITIAN. Penelitian akan diawali dengan preparasi alat dan bahan untuk sampling
 16 BAB III METODOLOGI PENELITIAN Penelitian akan diawali dengan preparasi alat dan bahan untuk sampling sel folikel akar rambut. Sampel kemudian dilisis, diamplifikasi dan disekuensing dengan metode dideoksi
16 BAB III METODOLOGI PENELITIAN Penelitian akan diawali dengan preparasi alat dan bahan untuk sampling sel folikel akar rambut. Sampel kemudian dilisis, diamplifikasi dan disekuensing dengan metode dideoksi
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Jenis penelitian Jenis penelitian ini adalah penelitian deskriptif yang mengangkat fenomena alam sebagai salah satu masalah dalam penelitian, sehingga dapat menerangkan arti
BAB III METODE PENELITIAN A. Jenis penelitian Jenis penelitian ini adalah penelitian deskriptif yang mengangkat fenomena alam sebagai salah satu masalah dalam penelitian, sehingga dapat menerangkan arti
3 METODOLOGI 3.1 Waktu dan Tempat 3.2 Bahan dan Alat
 3 METODOLOGI 3.1 Waktu dan Tempat Penelitian Autentikasi Bahan Baku Ikan Tuna (Thunnus sp.) dalam Rangka Peningkatan Keamanan Pangan dengan Metode Berbasis DNA dilaksanakan pada bulan Januari sampai dengan
3 METODOLOGI 3.1 Waktu dan Tempat Penelitian Autentikasi Bahan Baku Ikan Tuna (Thunnus sp.) dalam Rangka Peningkatan Keamanan Pangan dengan Metode Berbasis DNA dilaksanakan pada bulan Januari sampai dengan
LAPORAN PRAKTIKUM ph METER, PERSIAPAN LARUTAN PENYANGGA
 LAPORAN PRAKTIKUM ph METER, PERSIAPAN LARUTAN PENYANGGA Nama : Muhammad Yunus dan Yuni Rahmayanti Tanggal praktikum : 17 Oktober 2013 Kelompok : Siang (12.00-15.00) Tujuan : 1. Mampu menggunakan alat ukur
LAPORAN PRAKTIKUM ph METER, PERSIAPAN LARUTAN PENYANGGA Nama : Muhammad Yunus dan Yuni Rahmayanti Tanggal praktikum : 17 Oktober 2013 Kelompok : Siang (12.00-15.00) Tujuan : 1. Mampu menggunakan alat ukur
MATERI DAN METODE. Materi
 MATERI DAN METODE Lokasi dan Waktu Penelitian ini dilakukan di Laboratorium Genetika Molekuler Ternak, Bagian Pemuliaan dan Genetik Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan,
MATERI DAN METODE Lokasi dan Waktu Penelitian ini dilakukan di Laboratorium Genetika Molekuler Ternak, Bagian Pemuliaan dan Genetik Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan,
bio.unsoed.ac.id METODE PENELITIAN A. Materi, Lokasi, dan Waktu Penelitian 1. Materi Penelitian
 III. METODE PENELITIAN A. Materi, Lokasi, dan Waktu Penelitian 1. Materi Penelitian 1.1. Peralatan Penelitian Alat yang digunakan dalam penelitian ini adalah botol sampel, beaker glass, cool box, labu
III. METODE PENELITIAN A. Materi, Lokasi, dan Waktu Penelitian 1. Materi Penelitian 1.1. Peralatan Penelitian Alat yang digunakan dalam penelitian ini adalah botol sampel, beaker glass, cool box, labu
BAB 4. METODE PENELITIAN
 BAB 4. METODE PENELITIAN Penelitian penanda genetik spesifik dilakukan terhadap jenis-jenis ikan endemik sungai paparan banjir Riau yaitu dari Genus Kryptopterus dan Ompok. Penelitian ini bertujuan untuk
BAB 4. METODE PENELITIAN Penelitian penanda genetik spesifik dilakukan terhadap jenis-jenis ikan endemik sungai paparan banjir Riau yaitu dari Genus Kryptopterus dan Ompok. Penelitian ini bertujuan untuk
3 Metodologi Penelitian
 3 Metodologi Penelitian 3.1 Alat Penelitian ini dilakukan di Laboratorium Penelitian Biokimia, Program Studi Kimia, Institut Teknologi Bandung. Peralatan yang digunakan pada penelitian ini diantaranya
3 Metodologi Penelitian 3.1 Alat Penelitian ini dilakukan di Laboratorium Penelitian Biokimia, Program Studi Kimia, Institut Teknologi Bandung. Peralatan yang digunakan pada penelitian ini diantaranya
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian tentang Karakterisasi genetik Udang Jari (Metapenaeus elegans De Man, 1907) hasil tangkapan dari Laguna Segara Anakan berdasarkan haplotipe
BAB III METODE PENELITIAN 3.1 Rancangan Penelitian Penelitian tentang Karakterisasi genetik Udang Jari (Metapenaeus elegans De Man, 1907) hasil tangkapan dari Laguna Segara Anakan berdasarkan haplotipe
BAB III METODOLOGI PENELITIAN. Pada penelitian ini terdapat lima tahapan penelitian yang dilakukan yaitu
 BAB III METODOLOGI PENELITIAN Pada penelitian ini terdapat lima tahapan penelitian yang dilakukan yaitu pengumpulan sampel berupa akar rambut, ekstraksi mtdna melalui proses lisis akar rambut, amplifikasi
BAB III METODOLOGI PENELITIAN Pada penelitian ini terdapat lima tahapan penelitian yang dilakukan yaitu pengumpulan sampel berupa akar rambut, ekstraksi mtdna melalui proses lisis akar rambut, amplifikasi
MATERI DAN METODE. Materi
 MATERI DAN METODE Lokasi dan Waktu Penelitian ini dilaksanakan di Laboratorium Genetika dan Molekuler Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian
MATERI DAN METODE Lokasi dan Waktu Penelitian ini dilaksanakan di Laboratorium Genetika dan Molekuler Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian
BAB III METODE PENELITIAN. Penelitian ini dilaksanakan pada bulan Mei sampai September 2014 di Green
 BAB III METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian ini dilaksanakan pada bulan Mei sampai September 2014 di Green House dan Laboratorium Genetika dan Molekuler jurusan Biologi Fakultas Sains dan
BAB III METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian ini dilaksanakan pada bulan Mei sampai September 2014 di Green House dan Laboratorium Genetika dan Molekuler jurusan Biologi Fakultas Sains dan
PRAKTIKUM 3 : PH METER, PERSIAPAN LARUTAN PENYANGGA, PENGENCERAN STOK GLUKOSA. Oleh : Henny Erina Saurmauli Ompusunggu. Jekson Martiar Siahaan
 PRAKTIKUM 3 : PH METER, PERSIAPAN LARUTAN PENYANGGA, PENGENCERAN STOK GLUKOSA Oleh : Henny Erina Saurmauli Ompusunggu Jekson Martiar Siahaan I. Tujuan Praktikum 1. Memahami prinsip-prinsip dasar larutan
PRAKTIKUM 3 : PH METER, PERSIAPAN LARUTAN PENYANGGA, PENGENCERAN STOK GLUKOSA Oleh : Henny Erina Saurmauli Ompusunggu Jekson Martiar Siahaan I. Tujuan Praktikum 1. Memahami prinsip-prinsip dasar larutan
: Kirana patrolina sihombing
 Laporan Praktikum Biomedik BM 506 Tema : ph Meter, Buffer dan Pengenceran Hari/Tanggal Praktikum : Selasa/10 Maret 2015 Jam Nama Praktikan Tujuan Praktikum : 10.00 WIB 14.00 WIB : Melya Susanti : Kirana
Laporan Praktikum Biomedik BM 506 Tema : ph Meter, Buffer dan Pengenceran Hari/Tanggal Praktikum : Selasa/10 Maret 2015 Jam Nama Praktikan Tujuan Praktikum : 10.00 WIB 14.00 WIB : Melya Susanti : Kirana
: Kirana patrolina sihombing
 Laporan Praktikum Biomedik BM 506 Tema : ph Meter, Buffer dan Pengenceran Hari/Tanggal Praktikum : Selasa/10 Maret 2015 Jam Nama Praktikan Tujuan Praktikum : 10.00 WIB 14.00 WIB : Melya Susanti : Kirana
Laporan Praktikum Biomedik BM 506 Tema : ph Meter, Buffer dan Pengenceran Hari/Tanggal Praktikum : Selasa/10 Maret 2015 Jam Nama Praktikan Tujuan Praktikum : 10.00 WIB 14.00 WIB : Melya Susanti : Kirana
20,0 ml, dan H 2 O sampai 100ml. : Tris 9,15 gram; HCl 3ml, dan H 2 O sampai 100ml. : ammonium persulfat dan 0,2 gram H 2 O sampai 100ml.
 MATERI DAN METODE Lokasi dan Waktu Contoh darah diambil dari koleksi contoh yang tersedia di Laboratorium Pemuliaan dan Genetika Departemen Ilmu Produksi dan Teknologi Peternakan Ternak Fakultas Peternakan
MATERI DAN METODE Lokasi dan Waktu Contoh darah diambil dari koleksi contoh yang tersedia di Laboratorium Pemuliaan dan Genetika Departemen Ilmu Produksi dan Teknologi Peternakan Ternak Fakultas Peternakan
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian ini adalah penelitian deskriptif yang mengangkat fenomena alam sebagai salah satu masalah dalam penelitian. Penelitian ini dapat menerangkan
BAB III METODE PENELITIAN A. Jenis Penelitian Jenis penelitian ini adalah penelitian deskriptif yang mengangkat fenomena alam sebagai salah satu masalah dalam penelitian. Penelitian ini dapat menerangkan
PETUNJUK PRAKTIKUM BIOLOGI SEL DAN MOLEKULER Oleh: Ixora Sartika M ISOLASI DNA PLASMID
 PETUNJUK PRAKTIKUM BIOLOGI SEL DAN MOLEKULER Oleh: Ixora Sartika M ixomerc@uny.ac.id ISOLASI DNA PLASMID Plasmid adalah DNA ekstrakromosom yang berbentuk sirkuler dan berukuran kecil (1 200 kb). Sebagian
PETUNJUK PRAKTIKUM BIOLOGI SEL DAN MOLEKULER Oleh: Ixora Sartika M ixomerc@uny.ac.id ISOLASI DNA PLASMID Plasmid adalah DNA ekstrakromosom yang berbentuk sirkuler dan berukuran kecil (1 200 kb). Sebagian
BAB V KESIMPULAN DAN SARAN. Berdasarkan hasil penelitian yang telah dilakukan dari empat primer yang
 BAB V KESIMPULAN DAN SARAN A. KESIMPULAN Berdasarkan hasil penelitian yang telah dilakukan dari empat primer yang digunakan hanya primer GE 1.10 dengan suhu annealing sebesar 49,5 o C yang dapat dianalisis
BAB V KESIMPULAN DAN SARAN A. KESIMPULAN Berdasarkan hasil penelitian yang telah dilakukan dari empat primer yang digunakan hanya primer GE 1.10 dengan suhu annealing sebesar 49,5 o C yang dapat dianalisis
BAB III METODE PENELITIAN. mengekstraksi DNA dari dari beberapa spesimen herbarium Rafflesia arnoldii
 21 BAB III METODE PENELITIAN 3.1 Jenis Penelitian Penelitian ini merupakan penelitian deskriptif kuantitatif untuk mengekstraksi DNA dari dari beberapa spesimen herbarium Rafflesia arnoldii R.Br dan Rafflesia
21 BAB III METODE PENELITIAN 3.1 Jenis Penelitian Penelitian ini merupakan penelitian deskriptif kuantitatif untuk mengekstraksi DNA dari dari beberapa spesimen herbarium Rafflesia arnoldii R.Br dan Rafflesia
Lampiran 1 Pembuatan Medium Kultur DMEM Lampiran 2 Pembuatan Larutan PBS Lampiran 3 Prosedur Pewarnaan HE
 LAMPIRAN Lampiran 1 Pembuatan Medium Kultur DMEM Medium kultur DMEM merupakan medium Dulbecco s Modified Eagle s Medium (DMEM; Sigma) yang telah dimodifikasi dengan penambahan asam amino non-esensial (AANE;
LAMPIRAN Lampiran 1 Pembuatan Medium Kultur DMEM Medium kultur DMEM merupakan medium Dulbecco s Modified Eagle s Medium (DMEM; Sigma) yang telah dimodifikasi dengan penambahan asam amino non-esensial (AANE;
METODE. Materi. Tabel 1. Jumlah Sampel DNA yang Digunakan dan Asal Pengambilan Sampel Darah.
 METODE Lokasi dan Waktu Penelitian ini dilaksanakan di Laboratorium Pemuliaan dan Genetika Molekuler, Bagian Pemuliaan dan Genetik Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan,
METODE Lokasi dan Waktu Penelitian ini dilaksanakan di Laboratorium Pemuliaan dan Genetika Molekuler, Bagian Pemuliaan dan Genetik Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan,
ph = pk a + log ([A - ]/[HA])
![ph = pk a + log ([A - ]/[HA]) ph = pk a + log ([A - ]/[HA])](/thumbs/40/21552046.jpg) PH METER, PERSIAPAN LARUTAN PENYANGGA Tujuan: i) Memahami prinsip prinsip dasar larutan buffer ii) Latihan penggunaan ph meter iii) Latihan persiapan pembuatan buffer fosfat dengan teknik titrasi iv) Latihan
PH METER, PERSIAPAN LARUTAN PENYANGGA Tujuan: i) Memahami prinsip prinsip dasar larutan buffer ii) Latihan penggunaan ph meter iii) Latihan persiapan pembuatan buffer fosfat dengan teknik titrasi iv) Latihan
s - soluble fraction i - insoluble fraction p - post-ni 2+ column
 METODE SDS- PAGE Oleh: Susila Kristianingrum susila.k@uny.ac.id SDS-PAGE Trx-STS Trx-CHS s i p s i p 97 66 45 60 K 31 22 14 s - soluble fraction i - insoluble fraction p - post-ni 2+ column Langkah SDS-PAGE
METODE SDS- PAGE Oleh: Susila Kristianingrum susila.k@uny.ac.id SDS-PAGE Trx-STS Trx-CHS s i p s i p 97 66 45 60 K 31 22 14 s - soluble fraction i - insoluble fraction p - post-ni 2+ column Langkah SDS-PAGE
BAB 3 METODOLOGI PENELITIAN
 BAB 3 METODOLOGI PENELITIAN 3.1 Desain Penelitian Bentuk desain penelitian yang akan digunakan adalah bentuk deskriptif molekuler potong lintang untuk mengetahui dan membandingkan kekerapan mikrodelesi
BAB 3 METODOLOGI PENELITIAN 3.1 Desain Penelitian Bentuk desain penelitian yang akan digunakan adalah bentuk deskriptif molekuler potong lintang untuk mengetahui dan membandingkan kekerapan mikrodelesi
Lampiran 1 Ekstraksi dan isolasi DNA dengan metode GeneAid
 LAMPIRAN 9 Lampiran 1 Ekstraksi dan isolasi DNA dengan metode GeneAid Satu ruas tungkai udang mantis dalam etanol dipotong dan dimasukkan ke dalam tube 1,5 ml. Ruas tungkai yang telah dipotong (otot tungkai)
LAMPIRAN 9 Lampiran 1 Ekstraksi dan isolasi DNA dengan metode GeneAid Satu ruas tungkai udang mantis dalam etanol dipotong dan dimasukkan ke dalam tube 1,5 ml. Ruas tungkai yang telah dipotong (otot tungkai)
EKSTRAKSI DNA. 13 Juni 2016
 EKSTRAKSI DNA 13 Juni 2016 Pendahuluan DNA: polimer untai ganda yg tersusun dari deoksiribonukleotida (dari basa purin atau pirimidin, gula pentosa,dan fosfat). Basa purin: A,G Basa pirimidin: C,T DNA
EKSTRAKSI DNA 13 Juni 2016 Pendahuluan DNA: polimer untai ganda yg tersusun dari deoksiribonukleotida (dari basa purin atau pirimidin, gula pentosa,dan fosfat). Basa purin: A,G Basa pirimidin: C,T DNA
LEMBAR PENGESAHAN Laporan lengkap praktikum Genetika dan Biologi Molekuler dengan judul Isolasi DNA Bawang Bombay Dengan Cara Sederhana yang disusun o
 LAPORAN LENGKAP PRAKTIKUM GENETIKA DAN BIOLOGI MOLEKULER (ISOLASI DNA BAWANG BOMBAY DENGAN CARA SEDERHANA) Disusun oleh: NAMA : LASINRANG ADITIA NIM : 60300112034 KELAS : BIOLOGI A KELOMPOK : V (Lima)
LAPORAN LENGKAP PRAKTIKUM GENETIKA DAN BIOLOGI MOLEKULER (ISOLASI DNA BAWANG BOMBAY DENGAN CARA SEDERHANA) Disusun oleh: NAMA : LASINRANG ADITIA NIM : 60300112034 KELAS : BIOLOGI A KELOMPOK : V (Lima)
MATERI DAN METODE Lokasi dan Waktu Materi Sampel Pengambilan Sampel Ekstraksi DNA Primer
 MATERI DAN METODE Lokasi dan Waktu Penelitian ini dilaksanakan pada bulan Juni hingga Nopember 2010. Penelitian dilakukan di Laboratorium Pemuliaan dan Genetik Molekuler, Bagian Pemuliaan dan Genetik Ternak,
MATERI DAN METODE Lokasi dan Waktu Penelitian ini dilaksanakan pada bulan Juni hingga Nopember 2010. Penelitian dilakukan di Laboratorium Pemuliaan dan Genetik Molekuler, Bagian Pemuliaan dan Genetik Ternak,
MATERI DAN METODE. Materi
 MATERI DAN METODE Lokasi dan Waktu Penelitian dilaksanakan di Laboratorium Genetika Molekuler Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan IPB dan Laboratorium Terpadu,
MATERI DAN METODE Lokasi dan Waktu Penelitian dilaksanakan di Laboratorium Genetika Molekuler Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan IPB dan Laboratorium Terpadu,
LAPORAN PRAKTIKUM. ph Meter dan Persiapan Larutan Penyangga
 LAPORAN PRAKTIKUM ph Meter dan Persiapan Larutan Penyangga Oleh : Adenin Dian Musrifani (147008020) Islah Wahyuni (147008024) Tanggal Praktikum : Selasa, 10 Maret 2015 A. Tujuan: 1. Mampu menggunakan alat
LAPORAN PRAKTIKUM ph Meter dan Persiapan Larutan Penyangga Oleh : Adenin Dian Musrifani (147008020) Islah Wahyuni (147008024) Tanggal Praktikum : Selasa, 10 Maret 2015 A. Tujuan: 1. Mampu menggunakan alat
BAB III METODE PENELITIAN
 25 BAB III METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian telah berlangsung sejak bulan Januari 2012 - Juli 2012 di Laboratorium Mikrobiologi, Lab. Optik, Lab. Genetika dan Lab. Biologi Molekuler Jurusan
25 BAB III METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian telah berlangsung sejak bulan Januari 2012 - Juli 2012 di Laboratorium Mikrobiologi, Lab. Optik, Lab. Genetika dan Lab. Biologi Molekuler Jurusan
3. METODE PENELITIAN
 19 3. METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian ini dilaksanakan pada bulan Maret sampai Juni 2010 di Laboratorium Mikrobiologi, Biokimia dan Bioteknologi Hasil Perairan Departemen Teknologi Hasil
19 3. METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian ini dilaksanakan pada bulan Maret sampai Juni 2010 di Laboratorium Mikrobiologi, Biokimia dan Bioteknologi Hasil Perairan Departemen Teknologi Hasil
BAB 1 PENDAHULUAN. 1.1 Latar Belakang
 BAB 1 PENDAHULUAN 1.1 Latar Belakang Enzim merupakan unit fungsional dari metabolisme sel. Bekerja dengan uruturutan yang teratur, enzim mengkatalisis ratusan reaksi bertahap yang menguraikan molekul nutrien,
BAB 1 PENDAHULUAN 1.1 Latar Belakang Enzim merupakan unit fungsional dari metabolisme sel. Bekerja dengan uruturutan yang teratur, enzim mengkatalisis ratusan reaksi bertahap yang menguraikan molekul nutrien,
JADWAL PRAKTIKUM BIOKIMIA
 JADWAL PRAKTIKUM BIOKIMIA Waktu Kegiatan dan Judul Percobaan 2 Februari 2018 Penjelasan Awal Praktikum di Lab. Biokimia Dasar 9 Februari 2018 23 Februari 2018 2 Maret 2018 9 Maret 2018 16 Maret 2018 23
JADWAL PRAKTIKUM BIOKIMIA Waktu Kegiatan dan Judul Percobaan 2 Februari 2018 Penjelasan Awal Praktikum di Lab. Biokimia Dasar 9 Februari 2018 23 Februari 2018 2 Maret 2018 9 Maret 2018 16 Maret 2018 23
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian ini dilaksanakan pada bulan Januari 2012 sampai bulan Juli 2012, yang bertempat di Laboratorium Genetika dan Biologi Molekuler Jurusan Biologi
BAB III METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian ini dilaksanakan pada bulan Januari 2012 sampai bulan Juli 2012, yang bertempat di Laboratorium Genetika dan Biologi Molekuler Jurusan Biologi
BAHAN DAN METODE Tempat dan Waktu Penelitian Bahan dan Alat
 12 BAHAN DAN METODE Tempat dan Waktu Penelitian Survei penyakit klorosis dan koleksi sampel tanaman tomat sakit dilakukan di sentra produksi tomat di daerah Cianjur, Cipanas, Lembang, dan Garut. Deteksi
12 BAHAN DAN METODE Tempat dan Waktu Penelitian Survei penyakit klorosis dan koleksi sampel tanaman tomat sakit dilakukan di sentra produksi tomat di daerah Cianjur, Cipanas, Lembang, dan Garut. Deteksi
LAPORAN PRAKTIKUM 2. : Magister Ilmu Biolmedik : ph meter, persiapan larutan penyangga Tanggal pelaksanaan : 10 Maret 2015
 LAPORAN PRAKTIKUM NAMA PRAKTIKAN : Nini Chairani (14700801) Zakirullah Syafei (1470080) PRODI : Magister Ilmu Biolmedik JUDUL : ph meter, persiapan larutan penyangga Tanggal pelaksanaan : 10 Maret 015
LAPORAN PRAKTIKUM NAMA PRAKTIKAN : Nini Chairani (14700801) Zakirullah Syafei (1470080) PRODI : Magister Ilmu Biolmedik JUDUL : ph meter, persiapan larutan penyangga Tanggal pelaksanaan : 10 Maret 015
LAPORAN PRAKTIKUM PH METER, PERSIAPAN LARUTAN PENYANGGAN, DAN PENGENCERAN
 LAPORAN PRAKTIKUM PH METER, PERSIAPAN LARUTAN PENYANGGAN, DAN PENGENCERAN KELOMPOK PRAKTIKAN : Hadiyatur Rahma dan Yunita Wannur Azza GRUP PRAKTIKAN : Grup Pagi (10.00-13.00) HARI/TGL. PRAKTIKUM : Selasa,
LAPORAN PRAKTIKUM PH METER, PERSIAPAN LARUTAN PENYANGGAN, DAN PENGENCERAN KELOMPOK PRAKTIKAN : Hadiyatur Rahma dan Yunita Wannur Azza GRUP PRAKTIKAN : Grup Pagi (10.00-13.00) HARI/TGL. PRAKTIKUM : Selasa,
LAPORAN PRATIKUM II PRATIKUM PH METER DAN PERSIAPAN LARUTAN PENYANGGA
 LAPORAN PRATIKUM II PRATIKUM PH METER DAN PERSIAPAN LARUTAN PENYANGGA NAMA : ASTRID SISKA PRATIWI (147008007) IKA WARAZTUTY (147008019) PRODI : MAGISTER ILMU BIOMEDIK TGL PRATIKUM : 10 MARET 2015 TUJUAN
LAPORAN PRATIKUM II PRATIKUM PH METER DAN PERSIAPAN LARUTAN PENYANGGA NAMA : ASTRID SISKA PRATIWI (147008007) IKA WARAZTUTY (147008019) PRODI : MAGISTER ILMU BIOMEDIK TGL PRATIKUM : 10 MARET 2015 TUJUAN
Lampiran 1 Analisis fitokimia
 113 Lampiran 1 Analisis fitokimia a. Uji alkaloid Satu gram sampel daun digerus dan ditambahkan 1.5 ml kloroform dan tiga tetes amoniak. Fraksi kloroform dipisahkan dan diasamkan dengan lima tetes H 2
113 Lampiran 1 Analisis fitokimia a. Uji alkaloid Satu gram sampel daun digerus dan ditambahkan 1.5 ml kloroform dan tiga tetes amoniak. Fraksi kloroform dipisahkan dan diasamkan dengan lima tetes H 2
Bab III Bahan dan Metode III.1 Bahan III. 2 Alat
 Bab III Bahan dan Metode III.1 Bahan Pada penelitian ini, sampel yang digunakan dalam penelitian, adalah cacing tanah spesies L. rubellus yang berasal dari peternakan cacing tanah lokal di Sekeloa, Bandung.
Bab III Bahan dan Metode III.1 Bahan Pada penelitian ini, sampel yang digunakan dalam penelitian, adalah cacing tanah spesies L. rubellus yang berasal dari peternakan cacing tanah lokal di Sekeloa, Bandung.
METODE PENELITIAN. A. Tempat dan Waktu
 10 III. METODE PENELITIAN A. Tempat dan Waktu Penelitian dilaksanakan pada bulan September 2015 sampai Februari 2016. Isolasi dan visualisasi RNA Colletrotichum dilaksanakan di Laboratorium Hama Penyakit
10 III. METODE PENELITIAN A. Tempat dan Waktu Penelitian dilaksanakan pada bulan September 2015 sampai Februari 2016. Isolasi dan visualisasi RNA Colletrotichum dilaksanakan di Laboratorium Hama Penyakit
MATERI DAN METODE. Lokasi dan Waktu. Materi. Tabel 1. Jumah Sampel Darah Ternak Sapi Indonesia Ternak n Asal Sapi Bali 2 4
 MATERI DAN METODE Lokasi dan Waktu Penelitian dilaksanakan di Laboratorium Genetika Molekuler Ternak, Bagian Pemuliaan dan Genetika Ternak, Fakultas Peternakan, Institut Pertanian Bogor. penelitian ini
MATERI DAN METODE Lokasi dan Waktu Penelitian dilaksanakan di Laboratorium Genetika Molekuler Ternak, Bagian Pemuliaan dan Genetika Ternak, Fakultas Peternakan, Institut Pertanian Bogor. penelitian ini
METODOLOGI PENELITIAN
 III. METODOLOGI PENELITIAN D. BAHAN DAN ALAT Bahan utama yang digunakan adalah rendang iradiasi yang memiliki waktu penyinaran yang berbeda-beda (11 November 2006, DIPA 14 Juni 2007, dan no label 14 Juni
III. METODOLOGI PENELITIAN D. BAHAN DAN ALAT Bahan utama yang digunakan adalah rendang iradiasi yang memiliki waktu penyinaran yang berbeda-beda (11 November 2006, DIPA 14 Juni 2007, dan no label 14 Juni
Laporan Praktikum ph Meter, Persiapan Larutan Penyangga
 Laporan Praktikum ph Meter, Persiapan Larutan Penyangga Hari / Tanggal Praktikum : Kamis / 4 Oktober 2012 Nama Praktikan : Rica Vera Br. Tarigan dan Nunung Sri Mulyani Tujuan Praktikum: Agar Mahasiswa/i
Laporan Praktikum ph Meter, Persiapan Larutan Penyangga Hari / Tanggal Praktikum : Kamis / 4 Oktober 2012 Nama Praktikan : Rica Vera Br. Tarigan dan Nunung Sri Mulyani Tujuan Praktikum: Agar Mahasiswa/i
BAB III METODE PENELITIAN
 BAB III METODE PENELITIAN A. Jenis Penelitian Penelitian ini merupakan penelitian murni yang dilakukan dengan metode deskriptif, yaitu suatu metode penelitian untuk membuat deskripsi, gambaran atau lukisan
BAB III METODE PENELITIAN A. Jenis Penelitian Penelitian ini merupakan penelitian murni yang dilakukan dengan metode deskriptif, yaitu suatu metode penelitian untuk membuat deskripsi, gambaran atau lukisan
II. MATERI DAN METODE. Tempat pengambilan sampel daun jati (Tectona grandis Linn. f.) dilakukan di
 II. MATERI DAN METODE 2.1 Waktu dan Tempat Penelitian Tempat pengambilan sampel daun jati (Tectona grandis Linn. f.) dilakukan di enam desa yaitu tiga desa di Kecamatan Grokgak dan tiga desa di Kecamatan
II. MATERI DAN METODE 2.1 Waktu dan Tempat Penelitian Tempat pengambilan sampel daun jati (Tectona grandis Linn. f.) dilakukan di enam desa yaitu tiga desa di Kecamatan Grokgak dan tiga desa di Kecamatan
